Изобретение относится к медицине и медицинской промышленности и может быть использовано для получения Аурона-биологически активного вещества /БАВ/, обладающего противовоспалительным действием, обусловленным его противомикробной, митотической и антиоксидантной активностью.
Известен способ получения Аурона, заключающийся в приготовлении эфирного концентрата, состоящего из смеси эквивалентного количества мятного масла и/или кориандрового, бергамотного, лимонного, апельсинового, эквалиптового, санталового, иланг-илангового, мускатно-шалфейного, пихтового, розового, лавандового, гвоздичного масел и водного экстракта растительного сырья, содержащего следующие компоненты, взятые на 1 л дистиллированной воды в соотношении, г:
Травы полыни 10
Лист мяты перечной 10
Почки сосны обыкновенной 12
Корень солодки 1
Трава зверобоя 5
Трава чабреца 5
Цветки тысячелистника 5
Цветки календулы 5
Трава чистотела 5,
смешивание эфирного концентрата, водного экстракта растительного сырья, глицерина, нашатырного спирта, олеиновой кислоты /эмульгатор/ при следующем соотношении на 1 кг целевого продукта, г:
Эфирный концентрат не менее 3,0
Глицерин не более 3,0
Эмульгатор не более 3,0
Водный аммиак не менее 5,0
Водный экстракт до 1 кг целевого продукта
/см. патент РФ N 2008913, кл. A 61 K 35/78, 1993/.
Водный экстракт растительного сырья в данном способе получают путем погружения всех компонентов указанного выше состава сырья в воду /прямая экстракция/. Процесс проводят в течение 5 ч при температуре не ниже 30oC. Однако данный способ имеет ряд недостатков, а именно: невысокая степень извлечения биологически активных веществ из растительного сырья в воду, технологические трудности процесса тонкой фильтрации получаемого экстракта, обусловленные большим объемом фильтруемой массы, состоящей из множества компонентов, что может отразиться на свойствах препарата. Кроме того, одновременная экстракция всех компонентов растительного сырья, собираемых в разное время по мере их созревания, вынуждает хранить ряд компонентов в ожидании других длительное время, что приводит к потере их свойств.
Целью данного изобретения является улучшение технологичности процесса, повышение эффективности препарата и улучшение его потребительских свойств.
В способе получения биологически активного вещества, обладающего противовоспалительной, фагоцитарной, митотической и антиоксидантной активностью, включающем приготовление эфирного концентрата, путем смешивания мятного масла и/или кориандрового, бергамотного, лимонного, апельсинового, эквалиптового, санталового, иланг-илангового, мускатно-шалфейного, пихтового, розового, лавандового, гвоздичного масел и водного экстракта растительного сырья путем экстракции БАВ из растительного сырья, содержащего траву полыни, лист мяты перечной, почки сосны обыкновенной, корень солодки, траву зверобоя, траву чабреца, цветки тысячелистника, цветки календулы, траву чистотела, при соотношении смесь трав/вода не менее 50 г/кг, смешивание эфирного концентрата, водного экстракта растительного сырья, глицерина, водного аммиака, эмульгатора в соотношении на 1 кг целевого продукта, г:
Эфирный концентрат не менее 3,0
Глицерин не более 3,0
Эмульгатор не более 3,0
Водный аммиак не менее 5,0
Водный экстракт до 1 кг целевого продукта,
Приготовление водного экстракта растительного сырья осуществляется в два этапа, на первом из которых проводят экстракцию каждого компонента в отдельности или смесей компонентов растительного сырья в среде органического растворителя, например сжиженного газа, с последующим удалением экстрагента, фильтруют и объединяют экстракты, на втором объединенный экстракт растительного сырья разводят дистиллированной водой.
Особенность данного способа состоит в том, что экстракцию растительного сырья проводят в среде специальных органических растворителей с последующим удалением данной среды, т.е. экстрагента.
В качестве данной среды может быть использован, например, жидкий газ, а именно фреон или углекислый газ, являющийся химически инертным и имеющим достаточно высокую температуру сжижения, что облегчает условия проведения процесса экстракции. Кроме того, экстрагентом может быть петролейный эфир, гексан, хлороформ, хлористый метилен и другие органические растворители.
После проведения экстракции экстрагент либо удаляют отгонкой, либо, как в случае использования жидкого газа, при отсутствии повышенного давления происходит его самоудаление.
Процесс непрямой экстракции растительного сырья по сравнению с водной экстракцией происходит более интенсивно, что определяется свойствами экстрагента органического растворителя и составляет от одного до нескольких часов.
Подбор специальных органических растворителей, а также параметров экстракции /температура, давление, время/ позволяет извлекать более широкий спектр биологически активных веществ, а также повысить степень их извлечения.
Данное обстоятельство определяет большие по сравнению с известным способом спектр и концентрацию БАВ в препарате, что повышает его эффективность, а также уменьшение осадка и примесей, что позволяет получать препарат с улучшенными потребительскими свойствами: более светлый, с лучшей впитываемостью.
Экстракция каждого компонента растительного сырья в отдельности или смесей компонентов позволяет избежать выдерживание некоторых из них в ожидании созревания остальных, что сохраняет их целебные свойства, то есть повышает качество самого сырья.
Кроме того, раздельная экстракция сырья также способствует увеличению коэффициента извлечения биологически активных веществ.
Тонкая фильтрация при раздельной экстракции компонентов происходит более эффективно за счет уменьшения объема фильтруемой массы и повышения ее однородности, такая фильтрация требует меньших усилий, что влияет на улучшение технологичности процеса и чистоту экстракта.
Экстракты каждого компонента или смесей компонентов сырья после удаления экстрагента представляют собой вязкую жидкость темно-коричневого цвета, обладающую способностью долгое время хранить без потери свойства БАВ.
Примеры конкретного выполнения.
Пример 1. Растительное сырье вышеуказанного состава либо в смешанном виде, либо каждый компонент в отдельности, либо смеси компонентов помещают в камеру реактора и заливают сжиженным газом, например, углекислым в соотношении 1: 1 или 1:2, устанавливают в камере давление, равное 80 бар /50 100 бар/ и температуру 30oC /25 50oC/.
Экстракцию проводят в течение 1 2 ч, после чего содержимое камеры экстракции помещают в камеру фильтрации, после фильтрации газ при отсутствии давления улетучивается /его собирают в предназначенную для этого емкость/.
Вход экстракта в случае использования в качестве экстрагента фреона равен 6 8 мас. в случае использования углекислого газа 3 6 мас. по отношению к количеству загружаемого сырья. В случае экстракции отдельных компонентов или их смесей экстракты объединяют.
Полученный объединенный экстракт растительного сырья разводят дистиллированной водой из расчета: проэкстрагированное сырье/вода не менее 50 г/кг при следующем соотношении компонентов сырья на 1 л дистиллированной воды, г:
Трава полыни 10
Лист мяты перечной 10
Почки сосны обыкновенной 12
Корень солодки 1
Трава зверобоя 5
Трава чабреца 5
Цветки тысячелистника 5
Цветки календулы 5
Трава чистотела 5
Водный экстракт, полученный данным методом, имеет повышенное содержание эфирных компонентов, составляющее 0,3 0,4% тогда как водный экстракт, получаемый ранее известным способом, содержит не более 0,05% эфирных компонентов.
В качестве эфирного концентрата используют смесь масел: масло мяты перечной и/или масла пихтового, фенхелевого, тминного, анисового, укропного, кориандрового, бергамотного, лимонного, апельсинового, эвкалиптового, санталового, иланг-илангового, мускатно-шалфейного, розового, лавандового и гвоздичного.
Количество концентрата в готовом препарате составляет 5 г на 1 кг препарата.
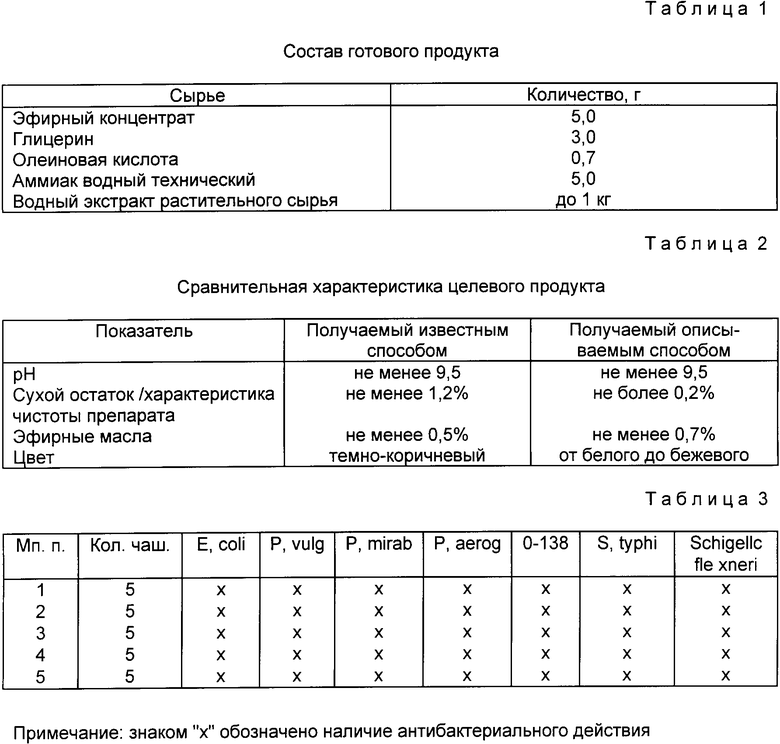
Эфирный концентрат смешивают с водным экстрактом растительного сырья, глицерином, олеиновой кислотой, аммиаком водным техническим (см. табл. 1, 2).
Пример 2. Растительное сырье указанного в материалах заявки состава либо в смешанном виде, либо каждый компонент в отдельности, либо смеси компонентов помещают в камеру реактора и заливают петролейным эфиром в соотношении сырье/экстракт 1/1,5, устанавливают в камере температуру 30 35oC. Экстракцию проводят в течение 3 4 ч, после чего содержимое камеры экстракции помещают в камеру фильтрации, после фильтрации экстракт подается в камеру приемника, где устанавливается температура 60 70oC, при которой экстрагент отгоняется и собирается в предназначенную для этого емкость.
Выход экстракта, в случае использования в качестве экстрагента петролейного эфира, равен 3 4 мас. по отношению к количеству загружаемого сырья.
В случае экстракции отдельных компонентов или их смесей экстракты объединяют.
Пример 3. Растительное сырье указанного в материалах заявки состава, либо в смешанном виде, либо каждый компонент в отдельности либо смеси компонентов помещают в камеру реактора и заливают хлороформом в соотношении сырье/экстракт 1/1,5, устанавливают в камере температуру 30 35oC. Экстракцию проводят в течение 4 5 ч, после чего содержимое камеры экстракции помещают в камеру фильтрации, после фильтрации экстракт подается в камеру приемника, где устанавливается температура 70 80oC, при которой экстракт отгоняется и собирается в предназначенную для этого емкость.
Выход экстракта в случае использования в качестве экстрагента хлороформа равен 3 5 мас. по отношению к количеству загружаемого сырья.
Полученный описываемым способом препарат содержит большее количество эфирных масел, что определяет его эффективность, меньшее количество сухого остатка, что определяет такие потребительские свойства, как чистоту, цвет препарата /более светлый/, впитываемость /полностью впитывается/.
Технологичность процесса улучшена за счет некоторого сокращения срока производства препарата на стадии получения водного экстракта, за счет возможности хранения экстрактов отдельных компонентов растительного сырья /что улучшает и свойства сырья по сравнению с вариантом хранения самого сырья/.
Упрощен процесс тонкой фильтрации экстрактов компонентов сырья, что отражается и на чистоте препарата.
Таким образом, описываемый способ получения препарата позволяет улучшить технологичность процесса, повысить эффективность препарата и улучшить его потребительские свойства.
Исследования активности биологически активного вещества, полученного предложенным способом.
I. Исследование противомикробной активности.
Исследования проводили на музейных культурах микроорганизмов: Stauvus, Esch. coli. Proleus vulgaris, Proteus mirabilis, Pseudomonal acruginosa, Salmonella typhinirium, Schigella flexneri, кишечная палочка 0-138. За трое суток до начала работы культуры пересевались на ЖСА, через 48 ч колонии откладывались на МПА и инкубировались в течение 24 ч при 37oC в термостате.
Для проведения исследования противомикробной активности препарата микроорганизмы пересевались на чашки Петри с питательной средой и инкубировались в течение ночи до появления на чашках большого числа микробных колоний.
Исследуемый препарат в количестве 0,02 наносился на чашку Петри поверх микробных колоний откалиброванной бактериологической петлей и чашки инкубировались в течение 2-х суток.
Результат учитывался по появившимся пятнам лизированных микроорганизмов. В качестве контроля использовались интактные чашки с музейной культурой микроорганизмов без воздействия препарата. Было проведено 5 серий исследований, в результате которых было установлено, что нативный препарат обладает выраженной антибактериальной активностью в отношении всех исследовавшихся микроорганизмов (см. табл. 3).
2. Исследование влияния растительного экстракта БАВ на фагоцитарную активность элементов крови.
Исследование проводилось на нейтрофилах крови /тест НСТ/. Суть теста состоит в том, что способные к фагоцитарной активности клетки крови захватывают частички красителя интротетразолиевого синего. Количество нейтрофилов, захвативших краситель, является показателем активности крови.
В качестве субстрата для получения нейтрофилов использовалась донорская кровь. Кровь в стерильных условиях забирались из локтевой вены, гепаринизировалась по общепринятой методике и затем в течение часа с момента ее получения проdодился тест НСТ.
В качестве стандартов сравнения активности исследуемого препарата использовались известные индукторы-фагоцитаза-лизоцим и продигиозан.
В иммунологический планшет помещали по 0,05 мл гепаринизированной крови. В контрольную лунку/для проверки спонтанной активности/ добавляли 0,225 мл раствора Хэнкса, в лунки для сравнения со стандартными препаратами по 0,025 мл раствора продигиозана и лизоцима, в остальные лунки добавлялся исследуемый препарат в концентрации 50% 10% 1% на солевом растворе Хенкса. Также в одну из лунок с кровью добавляли 0,025 мл среды 199 в качестве контроля растворителя.
Затем во все исследуемые лунки добавляли по 0,025 мл 0,02% раствора НСТ. Содержимое лунок в планшете пипетировали при помощи микропипеток и инкубировали при 37oC в течение 15 мин. После этого повторно пипетировали и инкубировали в термостате в течение 30 мин.
Затем готовили мазки крови на обезжиренных предметных стеклах, высушивали мазки на воздухе, фиксировали в течение 10 мин в смеси метилового и этилового спиртов, окрашивали кармином в течение 1 ч.
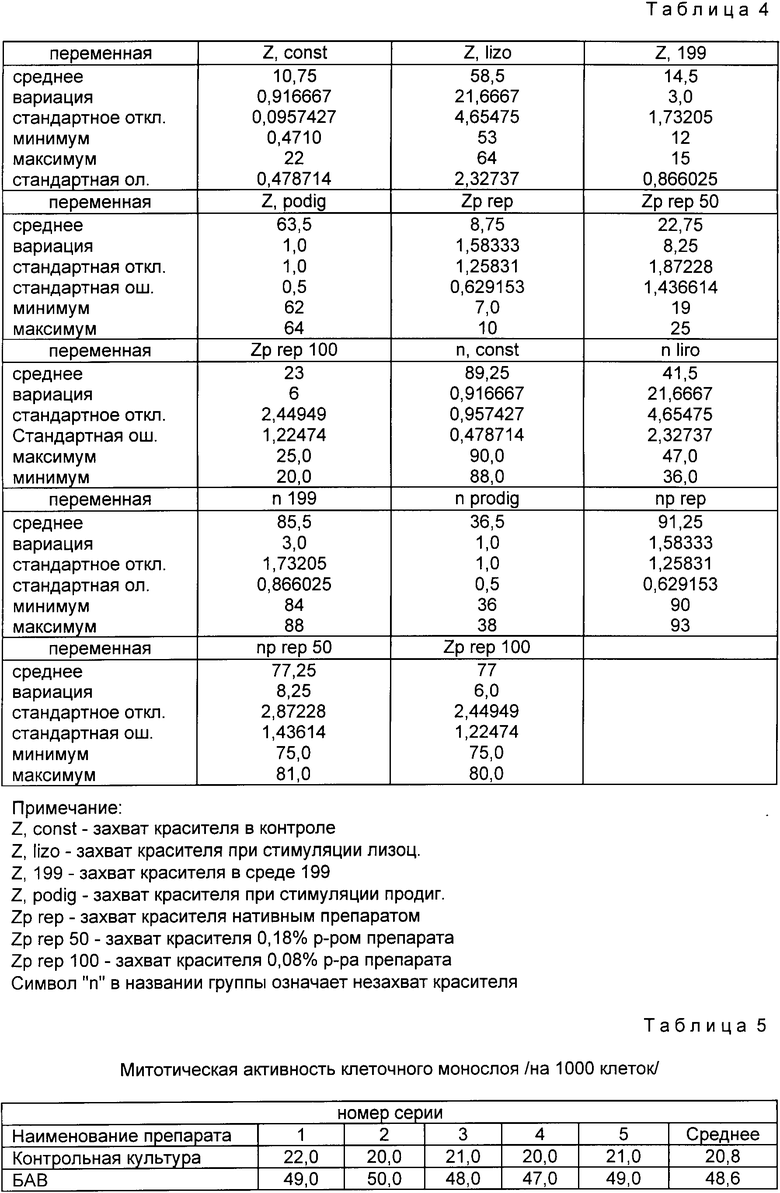
В полученных и окрашенных мазках подсчитывали отношение числа нейтрофилов, которые захватили краситель, к общему числу нейтрофилов в мазке /из 100 клеток/. Полученные результаты статистически обрабатывались. Данные приведены в табл. 4.
Исследуемый препарат во всех концентрациях /50% 10% 1%/ усиливая фагоцитарную, статистически достоверную активность нейтрофилов в 2,73 3,05 раза по сравнению со спонтанной, в зависимости от концентрации. БАВ является активным стимулятором процесса фагоцитоза, он может применяться при различных состояниях и заболеваниях, протекающих со снижением клеточного иммунитета.
3. Излучение антиоксидантной активности БАВ.
Исследование проводилось на нейтрофилах крови. Индуцировался зимозаном процесс кислородного взрыва и исследовался процесс его ингибирования исследуемым препаратом.
Препараты, ингибирущие индуцированный кислородный взрыв, по литературным данным обладают антиоксидантной и противовоспалительной активностью.
Исследование проводилось на цельной крови донора. Гепаринизированная кровь, полученная из локтевой вены, в количестве 0,1 мл добавлялась в анализатор хемолюминометра, затем добавлялось по 0,1 мл раствора люминола и зимозана /для индицированного кислородного взрыва в нейтрофилах крови/.
В клетках крови нарастал кислородный взрыв, что регистрировалось по увеличению хемолюминесценции. На пике кислородного взрыва в анализатор вводился препарат в конечной концентрации 0,5% и замерялось изменение люминесценции. Контролем служила кровь, к которой не добавлялся препарат.
Было установлено, что добавление в количестве 0,015 мл препарата к крови практически полностью ингибировало кислородный взрыв в клетках, что можно расценить как ингибирование АФК-активных форм кислорода, участвующих в механизме перекисного окисления липидов и развития окислительной реакции /см. табл. 3/.
В результате двух серий измерений было установлено, что БАВ достоверно ингибирует в клетках крови активные формы кислорода, участвующие в воспалительных реакциях в организме. Феновая люминесценция сыворотки крови и препарата ничтожно мала и не влияет на полученный результат. Так как растительный экстракт БАВ достоверно ингибирует индуцированный зимозаном кислородный взрыв, его можно отнести к группе препаратов, обладающих антиоксидантной, противовоспалительной активностью и он может быть использован в качестве профилактического средства при воздействии повышенных температур.
4. Изучение митотической активности БАВ.
Изучение митотической активности проводилось методом биоиндикации на перевиваемой клеточной линии РН.
Клеточная взвесь /концентрация клеток 80 тысяч в 1 мл культурной среды/ рассаживалась по пенициллиновым флаконам с кусочками покровных стекол на дне. В качестве культуральной среды использовалась среда 199 с добавлением 10% сыворотки крупного рогатого скота. После сформирования клеточного монослоя культуральная среда сливалась и заменялась на раствор препаратов в среде 199. Для исследования митотической активности были использованы нетоксичные концентрации препарата БАВ 0,5% раствор. Контролем служила клеточная культура без добавления препаратов, флаконы инкубировались в термостате при 37oC в течение 48 ч, каждые 24 ч готовились морфологические препараты по общепринятой методике и проводился подсчет числа митотических клеток в монослое методом случайных полей по морфологической сетке Стефанова С.Б.
Митотический индекс выражался в отношении числа митотических клеток к числу монослоя /на 1000 клеток/.
Было проведено 5 серий исследований. Митотический индекс контрольной клеточной линии РН составляет 20,5 митотических клеток на 1000 исследуемых (см. табл. 5).
Использование БАВ во всех 5 сериях сопровождалось достоверным в 2,34 раза увеличением митотической активности клеток по сравнению с контрольной культурой. Увеличивая митотическую активность клеток, БАВ улучшает репаративные процессы кожи.
Проведенные исследования позволили установить, что БАВ оказывает противомикробное действие, являясь активным стимулятором процесса фагоцитоза, и могут быть использованы при различных состояниях, связанных со снижением клеточного иммунитета.
Растительный экстракт БАВ может быть отнесен к группе веществ, обладающих антиоксидантной и противовоспалительной активностью. За счет митотической активности клеток улучшает репаративные процессы кожи.
II. Исследование безопасности накожного применения БАВ.
I. Изучение острой токсичности БАВ.
Изучение острой токсичности БАВ проводилось методом биоиндикации на клеточной линии Л-41-лейкоциты человека.
Клеточная суспензия рассаживалась в пенициллиновые флаконы с покрывным стеклом /концентрация клеток 80 тыс. в мл, культуральная среда 199 с добавлением сыворотки крупного рогатого скота/. Флаконы инкубировались в термостате при 37oC в течение 24 ч до формирования на стеклах клеточного монослоя. Затем культуральная среда сливалась и заменялась на поддерживающую среду 199 без сыворотки.
Разведение БАВ готовили в среде 199 в различных концентрациях от 0,1 до 10% и нативного.
Различные концентрации препарата добавлялись в культуральную среду и инкубировались в течение 72 ч в термостате, каждые 24 ч готовились морфологические препараты по общепринятой методике: фиксация жидкостью Карнуа, окраска гематоксилин-эезином.
Контролем служила клеточная культура, в которую не добавлялось БАВ, и культура, в которую добавлялось подсолнечное масло.
Исследования показали, что БАВ не токсично для клеточного монослоя в концентрациях от0,1 до 0,5% Клетки хорошо распластаны на стенке, цитоплазма мелкозернистая, ядра правильной формы, округлой с 1-3 ядрышками, имеется много митотических клеток.
В концентрациях от 1 до 3% проявляется слабая цитотоксичность: происходит разрежение монослоя, цитоплазма клеток вакуолизирована, встречаются отдельные пикнетизированные клетки.
В концентрации от 3 до 10% токсичность препарата для клеточного слоя значительно возрастает, появляется от 50 до 70% от общего числа погибших клеток.
2. Исследование хронической токсичности БАВ методом биоиндикации на клеточной линии Л-41-лейкоциты человека.
Для проведения исследования брали культуральный сосуд объемом 175 мл со сформированным клеточным монослоем. Монослой снимали со стекла раствором Версена, клетки суспендировали в культуральной среде 199 таким образом, чтобы концентрация в 1 мл среды составляла 100 тыс. клеток.
Полученная суспензия использовалась для проведения опыта в следующих вариантах:
а/ В 2-е чашки Карреля объемом 25 мл помещали 5 мл клеточной взвеси, затем в одну добавляли 5 мл среды 199 с 100 сыворотки крупного рогатого скота, а во вторую 5 мл среды 199, содержащей 0,16% исследуемого препарата и сыворотку.
Таким образом, препарат разводился до концентрации 0,08% Обе чашки Карреля динкубировали в термостате при 37oC без смены среды до полной дегенерации клеточного монослоя.
Время инкубации составило 16 суток как для контрольного, так и испытуемого монослоя.
б/ В 2-е чашки Карреля объемом 25 мл помещали 5 мл клеточной взвеси, затем в одну добавляли 5 мл среды 199, а в другую 5 мл 0,16% раствора препарата в среде 199. В обе чашки добавляли сыворотку крупного рогатого скота в количестве 5% Замену культуральной среды в обеих чашках проводили каждые 2 дня. Длительность выкипания монослоя составляла 21 день как в контрольной чашке, так и в опытной. Разница в длительности выживания клеточного монослоя между первым и вторым вариантами получена за счет введения во втором варианте питательной среды каждые два дня.
Проводилось ежедневное прижизненное наблюдение за состоянием монослоя, отклонений от морфологий монослоя не обнаружено.
в/ 1% взвеси помещали в культуральный сосуд емкостью 175 мл, добавляли 10 мл среды 199, содержащий 0,16% исследуемого препарата и 10% сыворотки крупного рогатого скота. Сосуд инкубировали в термостате при 37oC в течение 72 ч до формирования клеточного монослоя. В дальнейшем каждые двое суток проводили отсадку в пенициллиновые флаконы с покровными стеклами с целью приготовления морфологических препаратов /фиксация этиловым спиртом в течение 10 мин/, окраска гематоксилин-зозинем/. Длительность исследований составила 10 пассажей /в каждом пассаже 16 флаконов/.
г/ Клеточная взвесь инкубировалась в течение 72 ч до формирования монослоя. Затем клетки снимались со стекла раствором Версена и рассаживались в пенициллиновые флаконы. В 16 флаконах в качестве культуральной среды использовали среду 199 с 10% сыворотки /контрольная группа/ и в 16-ти флаконах 0,08% раствор исследуемого препарата в среде 1999 с сывороткой. Флаконы инкубировали в термостате, морфологические препараты готовились каждые 24 ч. Всего провели 5 серий исследований. Ни в одном варианте исследования не обнаружено отклонений в морфологии; отсутствуют патологические митозы, количество многоядерных /3,3/ и гигантскоядерных клеток /5,5 на 100/ не превышает нормы для данной клеточной линии, отсутствует неспецифическая дегенерация.
БАВ в используемой концентрации не нарушает жизненных функций клеточного монослоя при длительном введении в питательную среду ни в одном из вариантов исследования.
В результате приведенных исследований установлено, что БАВ нетоксичен и не оказывает цитопатического действия на клеточный монослой в концентрации 0,5% и ниже, так как исследование фармакологических препаратов на клеточном монослое приравнивается к модели внутривенного введения, то при пересчете на 1 кг биомассы человека доза БАВ составит около 17,2 л. Следовательно, БАВ можно отнести к нетоксичным веществам.
III. Исследование местораздражающих свойств БАВ.
Экспериментальные исследования проведены на 40 белых беспородных крысах /самцы, масса тела 180 200 г/ и 10 кроликах породы шиншилла /самки, масса тела 2,5 3,0 кг/.Исследуемый БАВ вводили животным различными способами в нативном виде.
I. Исследование местнораздражающего действия БАВ на крысах путем накожных аппликаций.
Исследования были проведены на 20 беспородных крысах /самцы, масса тела 180 200 г/, которые были разделены на две группы по 10 животных в каждой: 1-ая группа контроль /основа БАВ/, 2-я группа БАВ.
БАВ и его основу наносили на депиллированную кожу спины крыс размером 2,0х2,0 см по 1 мл ежедневно в течение 30 суток. По окончании эксперимента проведена эвтаназия животных и визуально была исследована кожа и подкожная клетчатка в месте нанесения БАВ и основы. При установлении выраженной реакции кожи и подкожной клетчатки в виде гиперемии или усилении сосудистого рисунка делался вывод о наличии раздражающего действия БАВ.
В результате проведенных исследований было установлено, что в условиях длительной аппликации БАВ кожи крыс не зарегистрировано гипермии или усиления сосудистого рисунка на коже и подкожной клетчатке, что свидетельствует об отсутствии раздражающего действия у БАВ.
2. Изучение местнораздражающих свойств БАВ при повторном подкожном введении крысам.
Исследования проведены на 20 белых беспородных крысах /самцы, масса тела 180 200 г/, которые были разделены на 2 группы по 10 животных в каждой: 1-я группа контроль /основа БАВ/, вторая группа БАВ.
Исследуемое БАВ и его основу вводили крысам 3-кратно подкожно в объеме 0,5 мл на животное. По окончании эксперимента была проведена эвтаназия животных. Оценка раздражающих свойств БАВ и его основы проведена аналогично описанной в разделе I.
В результате проведенных исследований установлено, что БАВ и его основа не вызывали видимых изменений кожи и подкожной клетчатки в месте введения препарата.
3. Оценка местнораздражающих свойств БАВ при субконьюктивальном введении кроликам.
Исследования выполнены на 10 кроликах породы шиншилла /самки, масса тела 2,5 3,0 кг/, которые были распределены на 2 группы по 5 животных в каждой: 1-я группа контроль /основа БАВ/, 2-я группа БАВ.
Исследуемый БАВ и его основу вводили кроликам 3-кратно в количестве 0,02 мл на каждое животное в левый глаз, правый глаз при этом был контрольным.
Проведенные исследования свидетельствуют об отсутствии раздражающего действия исследуемого БАВ и его основы на слизистую кроликов в условиях субконьюктивального введения.
Таким образом, изучение токсичности БАВ и его местораздражающего действия позволило установить, что:
1/ В условиях длительной аппликации БАВ, содержащем водный экстракт растительного сырья, на депиллерованную кожу крыс отсутствуют видимые изменения кожи и подкожной клетчатки экспериментальных животных.
2/ При 3-кратном введении крысам БАВ не зарегистрировано раздражающего препарата в месте иньекции.
3/. БАВ на основе водного экстракта растительного сырья не обладает раздражающим эффектом на слизистую оболочку глаз кроликов при повторном субконьюктивальном введении.
Проведенные исследования позволяют оценить БАВ как перспективное средство для противовоспалительной терапии, не имеющее побочного действия.
Препарат проходит клинические испытания.
Использование: улучшение технологичности процесса получения лекарственного препарата в медицине и медицинской промышленности, повышение эффективности и улучшение потребительских свойств препарата. Сущность: приготавливают эфирный концентрат, содержащий мятное масло и одно или несколько из ряда: фенхелевое, тминное, анисовое и т.п. Приготавливают водный экстракт растительного сырья, содержащего траву полыни горькой, лист мяты и т.д. Водный экстракт получают посредством экстракции каждого компонента растительного сырья или смесей компонентов в среде органического растворителя, например жидкого газа, с последующим удалением экстрагента. Получение экстракты объединяют и разводят дистиллированной водой. На последнем этапе смешивают эфирный концентрат, водный экстракт, глицерин, водный аммиак и эмульгатор при регламентированном соотношении компонентов. 5 табл.
Способ получения биологически активного вещества, обладающего противомикробной, фагоцитарной, митотической и антиоксидантной активностью, включающий приготовление эфирного концентрата путем смешивания мятного масла и/или фенхелевого, тминного, анисового, укропного, кориандрового, бергамотного, лимонного, апельсинового, эквалиптового, санталового, иланг-илангового, мускатно-шалфейного, пихтового, розового, лавандового, гвоздичного масел и водного экстракта растительного сырья путем экстракции биологически активных веществ из растительного сырья, содержащего траву полыни, лист мяты перечной, почки сосны обыкновенной, колень солодки, траву зверобоя, траву чабреца, цветки тысячелистника, цветки календулы, траву чистотела, при соотношении смесь трав / вода не менее 50 г/кг, смешивание эфирного концентрата, водного экстракта растительного сырья, глицерина, водного аммиака, эмульгатора в соотношении на 1 кг целевого продукта, г:
Эфирный концентрат Не менее 3,0
Глицерин Не менее 3,0
Эмульгатор Не более 3,0
Водный аммиак Не менее 5,0
Водный экстракт До 1 кг целевого продукта
отличающийся тем, что при приготовлении водного экстракта растительного сырья проводят экстракцию каждого компонента в отдельности или смесей компонентов в среде органического растворителя с последующим удалением экстрагента, фильтруют и объединяют экстракты в случае их раздельного приготовления, а затем разводят дистиллированной водой.
| SU, патент, 2008913, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
Авторы
Даты
1998-01-20—Публикация
1994-07-07—Подача