Изобретение относится к фармацевтическому препарату продленного действия, используемой в нем полимерной композици и способу получения этой композици.
В качестве основы для фармацевтических препаратов, например, в виде микрокапсул, могут быть использованы биологически разрушаемые полимеры. Подобный биологически разрушаемый полимер описывают в патенте Японии Kokai N 61-28521 (соответствующие патенты США NN 467719 и 4683288), показывающем, что реакция поликонденсации молочной кислоты и/или гликолевой кислоты в присутствии или в отсутствие катализатора приводит к получению подобного полимеру или сополимеру.
Патент Японии N 1-57087 (соответствующие патенты США NN 4652441, 4711782 и 4917893) описывает способ получения микрокапсул продленного действия, использующий подобные биологически разрушаемые полимеры.
Патент Японии Kokai N 62-54760 (соответствующие патенты США NN 4728721 и 4849228) указывает, что начальная картина выделения лекарства для микрокапсул может быть улучшена промыванием раствора биологически разрушаемого полимера водой для удаления водорастворимой низкомолекулярной фракции.
Патент Японии Kokai N 2-212436 описывает полимер, используемый в фармацевтических препаратах продленного действия и получаемый в результате непосредственной дегидратационной поликонденсации молочной кислоты и/или гликолевой кислоты с гидроксикарбоновой кислотой.
В препарате продленного действия, в котором лекарственное вещество диспергировано в биологически разрушаемом макромолекулярном соединении, предпочтительно, чтобы скорость выделения лекарства можно было регулировать. Обычно время выделения подобного биологически активного начала из препарата продленного действия регулируется подбором смеси мономеров и молекулярного веса биологически разрушаемого полимера, используемого для препарата. Скорость выделения лекарства, предпочтительно, постоянна на протяжении всего времени выделения. Как упомянуто ранее, для улучшения начальной картины выделения этого типа препаратов было выдвинуто много предложений. Однако, когда планируемое время выделения является сравнительно небольшим, часто сталкиваются с тем, что лекарство выделяется en musse во второй половине времени выделения. Кроме того, состав и молекулярный вес биологически разрушаемого полимера должен быть оптимизирован для каждого используемого лекарства и каждого планируемого времени выделения, а такая оптимизация требует много времени и усилий.
Кроме того, трудно получить постоянную картину выделения лекарства, используя препарат, смешивающий два вида микрокапсул, имеющих различные времена выделения, поскольку картина выделения лекарства смешанного препарата подвержена скачкообразным изменениям в ходе выделения лекарства.
Целью изобретения было преодоление вышеупомянутых недостатков. Обнаружено, что когда время выделения лекарства регулируют, используя простую смесь биологически разрушаемого полимера, имеющего сравнительно низкую скорость разрушения, и биологически разрушаемого полимера, имеющего сравнительно высокую скорость разрушения, характеристика выделения системы во второй половине времени выделения заметно улучшается по сравнению с характеристикой системы, использующей сополимер с тем же составом мономеров. Изобретение основано на вышеуказанном открытии.
Таким образом, объектами изобретения являются полимерная композиция для препарата продленного действия, включающая в себя полимолочную кислоту (А) и сополимер (В) гликолевой кислоты и гидроксикарбоновой кислоты формулы (I):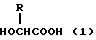 ,
,
где R означает алкильную группу, содержащую от 2 до 8 атомов углерода, смешанные в весовом отношении от 10/90 до 90/10 и препарат продленного действия, содержащий эффективное количество водорастворимого лекарственного вещества в указанной полимерной композиции.
В настоящем описании молекулярный вес означает эквивалентный молекулярный вес полистирола в соответствии с определенным посредством гельпроникающей хроматографии (ГПХ) с использованием полистирола в качестве эталона. При определении молекулярных весов использовали колонку для ГПХ KF8041 x 2 (showa Denko) и хлороформ в качестве подвижной фазы.
Используемая в изобретении полимолочная кислота может представлять собой любую из L-, D-, и D-, L - полимолочных кислот, но когда в технологии приготовления лекарственного средства используют растворитель, молярное соотношение D- и L-молочных кислот в D, L-полимолочной кислоте, с учетом растворимости, обычно составляет от 75/25 до 25/75, предпочтительно от 48/52 до 25/75, более предпочтительно, от 45/55 до 25/75. Также предпочтительно использовать полимолочную кислоту, имеющую максимальную величину молекулярного веса, равную от 5000 до З0000 и обеспечивающую при индивидуальном использовании время выделения, равное около 2 - 4 мес.
Известны два способа для синтеза указанной полимолочной кислоты, а именно, полимеризация с раскрытием кольца лактида, представляющего собой димер молочной кислоты, и дегидратационная поликонденсация молочной кислоты. Для получения полимера сравнительно низкого молекулярного веса для использования в настоящем изобретении, легче осуществить непосредственную дегидратационную поликонденсацию молочной кислоты (сравните патент Японии Kokai N 61-28521).
Что касается сополимера (В), используемая в нем гидроксикарбоновая кислота общей формулы (I) включает, в частности 2-гидрокси-масляную кислоту, 2-гидроксивалерьяновую кислоту, 2-гидрокси-З-метилмасляную кислоту, 2-гидроксика-проновую кислоту, 2-гидрокси-изокапроновую кислоту, 2-гидроксикаприловую кислоту и т.д. Особенно предпочтительна 2-гидроксимасляная кислота. Каждая из этих 2-гидроксикарбоновых кислот может представлять содой кислоту D-, L - или D, L - конфигурации, но предпочтительно используют D, L -соединение. Способ получения сополимера (В) может заключаться в неупорядоченной, блочной или привитой сополимеризации. Среди подобных сополимеров гликолевой кислоты предпочтительны сополимеры, разрушающиеся в теле сравнительно быстро и выделяющие, в случае индивидуального препарата, водорастворимое лекарство за время, не превышающее одного месяца.
Предпочтительное содержание гликолевой кислоты (1) в сополимере (В) находится в пределах 40 - 70 мол.% гликолевой кислоты, а содержание гидроксикарбоновой кислоты находится в пределах 60 - 30 мол.% соответственно. Если содержание гликолевой кислоты составляет менее 40 мол.%, картина выделения лекарства может не быть линейной, тогда как использование более 70 мол.% гликолевой кислоты приводит к малой растворимости сополимера в растворителе, затрудняя тем самым получение препаратов. Кроме того, сополимер гликолевой кислоты предпочтительно имеет максимальную величину молекулярного веса 5000 - 20000, определенную посредством ГПХ.
Способ синтеза указанного сополимера гликолевой кислоты (В) описан для сополимера гликолевой кислоты L-лейциновой кислоты в патенте Японии Kokai N 2-212436. Однако сополимер (В) можно легко синтезировать посредством обычных методов синтеза (например, патент Японии Kokai N 61-28521).
В фармацевтических препаратах в соответствии с изобретением можно использовать смесь полимолочной кислоты (А) и сополимера гликолевой кислоты (В) при весовом соотношении 10/90 - 90/10, предпочтительно 25/75 - 75/25 (по весу). Если содержание любого из двух компонентов является избыточным, получающаяся терапевтическая система будет иметь картину выделения, не очень отличающуюся от картины выделения для системы, состоящей исключительно из одного компонента, и не покажет желаемую линейную характеристику второй половины времени выделения. Способ смешивания произвольный.
Полученную таким образом смесь биологически разрушаемых полимеров можно использовать в фармацевтическом препарате продленного действия, например, в виде микрокапсул.
Водорастворимое лекарственное вещество, которое может быть выделено в вышеописанные препараты, включает вещества с высокой гидрофильностью, имеющие низкие коэффициенты распределения масло - вода. Низкий коэффициент распределения масло - вода означает, что коэффициент распределения между октанолом и водой, например, составляет не выше, чем около 0,1.
Поскольку разновидности подобных водорастворимых лекарственных веществ в действительности не ограничены, можно использовать ряд физиологически активных пептидов, антибиотиков, противоопухолевых средств, антигипертермических средств, болеутолящих средств, противовоспалительных средств противокашлевых отхаркивающих средств, успокоительных средств, миорелаксантов, антиэпилептических средств, противоязвенных средств, антидепрессантов, противоаллергических средств, средств, стимулирующих сердечную деятельность, антиаритмических средств, сосудорасширяющих средств, гипотензивных диуретических средств, антидиабетических средств, антикоагулянтов, кровосстанавливающих средств, противотуберкулезных средств, гормонов, автинаркотических средств, ингибиторов разрушения костей, ингибирующих англогенезис веществ и т.д.
Физиологически активный пептид, используемый в настоящем изобретении, представляет собой пептид, состоящий из двух или более аминокислотных остатков, и предпочтительно имеет молекулярный вес от около 200 до 80000.
В качестве примеров подобных пептидов можно упомянуть лютеинизирующий гормон - выделяющий гормон (LH- Rн) и его функциональные аналоги, например, полипептиды формулы
/Pyr/GIu-R1-Trp-Ser-R2-R3-Ru-Arg-Pro- R5 (II)
(Pyr = пиримидин, Glu = глутаминовая кислота, Тrp = триптофан, Ser = серин, Arg = аргинин, Pro = пролин)
где R1 означает His (гистидин), Tyr (тирозин), Trp, или пара-NH2-Phe (фенилаланин); R2 означает Tyr или Phе; R3 означает Gly (глицин) или остаток D-аминокислоты; R4 означает Leu (лейцин), ILе (интерлейцин) или Nie (норлейцин) R5 означает GIu-NН-R6 (R6 представляет собой H или низшую алкильную группу, которая может, необязательно, содержать гидроксильную группу) или NH-R6 (R6 соответствует вышеопределенному) и его соли (сравните патенты США NN 3853837, 4008209 и 3972859, патент Великобритании N 1.423. 083, Proceedins of the National Academy of Scisnces of the United States of America 78, 6509-6512, 1981).
Что касается вышеприведенной формулы (II), остаток D-аминокислоты R3 включает, в частности, остатки α-D-аминокислот, содержащие вплоть до 9 атомов углерода (например, D-Leu, ILе, Nle, Val (валин), Nval (норвалин), Аbu (аминомасляная кислота), Phe Fng (фенилглицин), Ser, Тhr (треовин), Met (метионин), Ala (аланин), Тrp, α-Аlbu (аминоизомасляная кислота) и т.д., которые могут необязательно иметь заместители (например, трет-бутил, трет-бутокси, трет-бутоксикарбонил и т.д.). Конечно, могут быть также использованы соли кислот и металлокомплексные соединения пептида (II).
В данном описании для обозначения аминокислот, пептидов, защитных групп и т.д. используются обозначения, согласованные с пептидом формулы (II), они также представляют собой сокращения, согласно Комиссии IИРАС- IИB по Биологической Номенклатуре или обычно используемые в этой области техники сокращения. Кроме того, в тех случаях, когда аминокислота может существовать в виде оптических изомеров, подразумевается L - изомер, если не оговорено особо.
Характерным представителем является полипептид формулы (III), в котором R1 = His; R2 = Tyr; R3 = D - Lеu; R4 = Lеu; R5 = NHCH2 - CH3.
Полипептид может также представлять собой любое из соединений, являющихся антагонистами LH-RH (сравните патенты США NN 4086219, 4214577, 4253997,4317815, 329526 и 368702).
Среди дополнительных примеров указанного пептида находятся инсулин, соматостатин, производные соматостатина (патенты США NN 4087390, 4093574, 4100117, 4253998) гормон роста, пролактин, адренокортикотропный гормон (АCТН), меланоцит стимулирующий гормон (MSH), тиреотропин-выделяющий гормон (ТРН), а также его соли и производные (патенты Японии KoKai NN 50-121273 и 52-116465), гормон, стимулирующий деятельность щитовидной железы (ТSН), лютеинизирующий гормон (LH), гормон, стимулирующий фолликулы (FSH), сосудосуживающий гормон, производные сосудосуживающего гормона (десмопрессин, "Folia Endocrinologica Japonica, 54,5, 676-691 (1978)), стимулятор родовой деятельности, кальцитонин, гормон паращитовидной железы, глюкагон, гастрин, секретин, пакреозимин, холецистокинин, ангиотензин, плацентарный лактоген человека, хорионический гонадотропин человека (НCG), энкефалин, производные энкефалина (патент США NN 4277394, Европейская выложенная Заявка N 31567), "эндорфин, киоторфин, интерфероны, (α,β и γ), интерлейкины (I, II, III), тафтсин, тимопойсетин, тимозин, тимостимулин, тимусный гуморальный фактор (THR), тимусный сывороточный фактор (FTS), а также его производные (патент США N 4229438) и другие тимусные факторы (Advances in Medicine, 125, 10, 835-843 (1983)), фактор омертвления опухолей (ТNF) колониестимулирующий фактор (CSF), стимулятор подвижности, динорфин, бомбезин, нейротензин, церулеин, брадикинин, урокиназа, аспарагиназа, калликреин, вещество Р фактор нервного роста, фактор коагуляции крови VIII, фактор коагуляции крови IX, лизоцим хлорид, полимиксин B, колистин, грамицидин, бацитрацин, эритропойетин (ЕРО) и т.д.
Среди указанных противоопухолевых средств могут находиться блеомицин гидрохлорид "метеотрексат, актиномидин D, митомицин С, винбластин сульфат, винкристин сульфат, цисплатин, даунорубицин гидрохлорид, адриамицин, неокарциностатин, цитозин, арабинозид, фтороурацил, тетрагидрофурил-5-фтороурацил, крестин, пицибанил, лентинан, левамизол, бестатин, азимексон, глициризин, поли I:С, поли А:U, поли ICLC и т.д.
Среди указанных антибиотиков находятся гентамицин, дибекацин, канендомицин, ливидомицин, тобрамицин, амикацин, фрадиомицин, сизомицин, тетрациклин, гидрохлорид, окситетциклин гидрохлорид, ролитетрациклин, доксициклин гидрохлорид, ампициллин, пиперациллин, тикарциллин, цефалотин, цефалородин, цефотиам, цефсулодин, цефменоксим, цефметазол, цефазолин, цефотаксим, цефоперазон, цефтизоксим, моксалактам, тиенамицин, сульфазецин, азтреонам и т.д.
Среди указанных антигипертермических, болеутоляющих и отхаркивающих средств могут находиться салицилат натрия, сульпирин, флафенамат натрия, натрий диклофенак, натрий индометацин, морфин сульфат, петидин гидрохлорид, лефорфанол тартрат, оксиморфон и т.д. Среди угаданных противокашлевых отхаркивающих средств могут находиться эфедрин гидрохлорид, метилэфедрин гидрохлорид, носкапин гидрохлорид, кодеин фосфат, дигидрокодеин фосфат, аллокламид гидрохлорид, клофеданол гидрохлорид, пикоперидамин гидрохлорид, сальбутамол сульфат, клоперастин, протокилол гидрохлорид, изопротенерол гидрохлорид, терубуталин сульфат и т.д. Успокоительные средства могут представлять собой хлорпромазин гидрохлорид, прохлорперазин, трифтороперазин, атропин сульфат, метилскополамин бромид и т.д. Миорелаксанты могут представлять собой пиридинол метансульфонат, тубокурарин хлорид, панкуроний бромид и т.д.
Антиэпилептические средства включают натрий фенитоин, этосуксимид, натрий ацетазоламид, хлордиазэпоксид гидрохлорид и т.д. Антиязвенные средства включают метоклопрамид, гистидин гидрохлорид и т.д. Антидепрессанты включают имипрамин, кломипрамин, ноксиптилин, фенелзин сульфат и т.д. Антиаллергические средства включают дифенгидрамин гидрохлорид, хлорфенирамин малеат, трипеленнамин гидрохлорид, метдилазин гидрохлорид, клемизол гидрохлорид, дифенилпиралин гидрохлорид, метоксифенамин гидрохлорид и т.д. Стимулирующие сердечную деятельность средства включают транс-п-оксокамфору, теофиллол, аминофиллин, этилефрин гидрохлорид и т.д. Антиаритмические средства включают пропранолол гидрохлорид, альпренолол гидрохлорид, буфетолол гидрохлорид, окспренолол гидрохлорид и т.д. Сосудорасширяющие средства включают оксифедрин гидрохлорид, дилтиазем гидрохлорид, толазолин гидрохлорид, гексобендин, баметан сульфат и т.д. Гипотензивные диуретические средства включают гексаметоний бромид, пентолиний, мекамиламин гидрохлорид, экаразин гидрохлорид, клонидин гидрохлорид и т.д. Антидиабетические средства включают натрий глимидин, глипизид, фенформин гидрохлорид, буформин гидрохлорид, метформин и т. д. Антикоагулянты включают натрий гепарин, натрий цитрат и т.д. Кровеостанавливающие средства включают тромбопластин, тромбин, менадион натрий бисульфит, ацетоменафтон, ∈-аминокапроновую кислоту, транэкзамовую кислоту, карбазохром натрий сульфонат, адренохром моноаминогуанидин метансульфонат и т. д. Противотурбекулезние средства включают изониазид, этамбутол, натрий пара-аминосалицилат и т. д. Гормоны включает преднизолон сукцинат, преднизолон натрий фосфат, дексаметазон натрий сульфат, бетаметазон натрий фосфат, гексестрол фосфат, гексестрол ацетат, метимазол и т. д. Антинаркотические средства включают леваллорфан тертрат, налофин, гидрохлорид, налоксазон гидрохлорид и т.д.
Ингибиторы разрушения костей включают (серусодержащий алкил)-алинометилен-бисфосфорная кислота и т.д. Вещества, ингибирующие ангиогенезис, включает ангиостатичный стероид (Sсi., 221, 719 (1983)), фумагиллин (например, ЕР-А-325119 и др.), производные фумагиллола (например, ЕР-А-357061, ЕР-А-359036, EP-A-3866687, ЕР-А-415294 и др.) и т.д.
Содержание указанного водорастворимого лекарства зависит от вида лекарства, ожидаемого фармакологического действия и его продолжительности и т. д. , но его концентрацию во внутренней водной фазе эмульсии вода в масле в ходе микрокапсуляции при помощи метода водной сушки выбирают из области от около 0.001 мас. % до около 90 мас. %, предпочтительно, от 0,01 до 80 мас.%.
Препарат продленного действия согласно настоящему изобретению можно получить посредством по существу известной технологии получения (например, смотрите патент США N 4652441) типичный способ получения включает приготовление эмульсии B/М (вода в масле) при использовании водного раствора водорастворимого лекарства, в качестве внутренней водной фазы, к которой необязательно добавляют вещество, удерживающее лекарство, например, желатин, альбумин, пектин или агар, и раствора препарата продленного действия настоящего изобретения, в качестве масляной фазы, диспергирование указанной В/М эмульсии в водной среде с образованием эмульсии В/М/В и подвергание последней высушиванию в воде с образованием длительно выделяющих микрокапсул, содержащих указанное водорастворимое лекарство.
Подобные микрокапсулы можно также получить высушиванием В/М эмульсии при помощи распыления.
Препарат продленного действия, помимо микрокапсул, можно также получить при помощи плавления подходящей дисперсии биологически разрушаемой смеси и формования расплава в шарики, стержни, иглы и другие формы.
Дозы назначения микрокапсул настоящего изобретения включают в себя инъекции, имплантации и средства, поглощаемые через слизистую оболочку прямой кишки или матки.
Микрокапсулы, полученные вышеуказанным способом, при необходимости после незначительного измельчения просеивают для того, чтобы удалить слишком большие микрокапсулы. Средний размер микрокапсулы находится в области от около 0,5 до 1000 мкм, желательно и предпочтительно, в области от около 2 до 500 мкм. Когда микрокапсулы используют для инъекции, в виде суспензий размер микрокапсул должен быть достаточен для того, чтобы удовлетворять требованиям диспергирумости и впрыскиваемости, например, желательно, в области от около 2 до 100 мкм.
Микрокапсулы, полученные в соответствии с настоящим изобретением, имеют много преимуществ. Например, они практически не подвергаются аггрегации или слипанию друг с другом во время стадии получения. Можно получить микрокапсулы, практически сферические по форме и имеющие произвольный размер. Стадию удаления растворителя из масляной фазы легко контролировать, посредством чего можно контролировать структуру поверхности микрокапсул, которая является определяющей для скорости выделения лекарства (включая, например, количество и размер пор, которые должны служить основными путями выделения лекарства).
Микрокапсулы, полученные посредством способа настоящего изобретения можно легко назначать в виде инъекций и имплантов, внутримускульно, подкожно или в орган, полость сустава или в патологическое изменение, например, опухоли. Их можно также назначать в различных дозах и, таким образом, можно использовать в качестве веществ для приготовления подобных доз.
Например, при получении микрокапсул для инъекций в соответствии с настоящим изобретением микрокапсулы, соответствующие настоящему изобретению, диспергируют в водной среде вместе с диспергирующим средством (например, Tween 80, HCO-60, карбоксиметилцеллюлозой, альгинатом натрия и т.д.), предохранительным средством (например, метилпарабеном, пропилпарабеном и т.д.), изотонирующим средством (например, хлоридом натрия, маннитом, сорбитом, глюкозой и т. д. ) или суспендируют в водной среде вместе с растительным маслом, например, кунжутным или кукурузным маслом. Подобную дисперсию или суспензию переводят в практически готовый препарат продленного действия для инъекций.
Кроме того, вышеупомянутый микрокапсулированный препарат продленного действия для инъекций можно превратить в более устойчивый препарат продленного действия для инъекций посредством добавления дополнительного наполнителя (например, маннита, сорбита, лактозы, глюкозы и т.д.), повторного диспергирования получающейся смеси и проведения отверждения посредством сушки замораживанием или сушки распылением с возможным добавлением дистиллированной водой для инъекции или некоторого количества подходящего диспегирующего средства.
Доза препарата продленного действия в соответствии с настоящим изобретением может изменяться в зависимости от вида и количества водорастворимого лекарства, которое является активным компонентом, дозирования, длительности выделения лекарства, животного-реципиента (например, теплокровных животных, таких как мышь, крыса, кролик, овца, свинья, корова, лошадь, человек) и цели назначения, но должно находиться в пределах эффективной дозы указанного активного компонента. Например, разовую дозу микрокапсул для указанного животного можно адекватно выбрать в области от около 0,1 до 100 мг/кг веса тела, предпочтительно, от около 0,2 мг до 50 мг/кг веса тела.
Следующие сравнительные и рабочие параметры предназначены для того, чтобы проиллюстрировать настоящее изобретение более подробно.
Сравнительный пример 1.
В четырехгорлую колбу на 1000 мл, снабженную подачей азота и трубками холодильника, загружали 247,7 г 90% водного раствора D, L-молочной кислоты, 95,1 г гликолевой кислоты и 130,1 г D, L- 2-гидроксимасляной кислоты и загрузку сырья нагревали в токе газообразного азота при 90oC и 400 Hg до 150oC и 30 мм Hg в течение 5 ч для удаления воды в виде дистиллата. Реакционную смесь далее нагревали при пониженном давлении при 160 - 175oC и 5 - 7 мм. Но в течение 72 ч, в конце этого времени смесь охлаждали, получая янтарно окрашенный сополимер молочной кислоты, гликолевой кислоты и 2-гидроксимасляной кислоты.
Этот сополимер растворяли в 1000 мл хлористого метилена и раствор при перемешивании выливали в теплую воду при 60oC. Тестообразный полимерный осадок собирали и сушили в вакууме при 30oC.
Максимальный молекулярный вес (ГПХ) получающегося сополимера молочной кислоты, гликолевой кислоты и 2-гидроксимасляной кислоты составлял 12000.
Сравнительный пример 2
В 0,25 мл дистиллированной воды растворяли 350 мг ТРН (тиротропин-выделяющего гормона) с последующим добавлением 4,65 г сополимера молочной кислоты, гликолевой кислоты и 2-гидроксимасляной кислоты, полученного в Сравнительном примере 1, в виде раствора в 5 мл хлористого метилена. Смесь перемешивали небольшим гомогенизатором в течение 60 с для получения эмульсии В/М. Эту эмульсию охлаждали до 18oC и выливали в 1250 мл 0,15% водного раствора поливинилового спирта (ПВС), предварительно доведенного до 19oC и смесь обрабатывали турбинным гомогенизатором для получения эмульсии В/М/В. Затем, эту эмульсию В/М/В перемешивали при комнатной температуре для испарения хлористого метилена и отверждения внутренней эмульсии В/М, которую собирали, центрифугировали, чтобы отмыть несвязанное лекарство и т.п. Собранные микрокапсулы сушили замораживанием с образованием порошка. Результат испытания на выделение in Vitro вышеуказанных микрокапсул в фосфатном буфере (pH 7.0) при 37oC представлен в табл. 1.
Сравнительный пример 3
В 0,8 мл дистиллированной воды растворяли 450 мг лейпропелин ацетата (ТАР-144) и 40 мг желатина и раствор добавляли к раствору 4,5 г сополимера молочной кислоты, гликолевой кислоты и 2-гидроксимасляной кислоты, полученного в Сравнительном примере 1, в 5 мл хлористого метилена. Смесь обрабатывали небольшим гомогенизатором в течение 60 с, для получения В/М эмульсии. Эту эмульсию охлаждали до 18oC и выливали в 1200 мл 0,15% водного раствора поливинилового спирта (ПВС), предварительно доведенного до 20oC, и смесь обрабатывали турбинным гомогенизатором для получения В/М/В эмульсии. Затем, эту В/М/В эмульсию перемешивали при комнатной температуре для испарения хлористого метилена и отверждения внутренней эмульсии В/М с последующим центрифугированием. Это вещество затем, повторно диспергировали в дистиллированной воде и снова центрифугировали для того, чтобы отмыть несвязанное лекарство и т.д.
Микрокапсулы, полученные таким образом, сушили замораживанием с образованием порошка. Результат испытания на выделение in Vitro вышеуказанных микрокапсул в фосфатном буфере (pH 7.0) при 37oC представлен в табл. 2.
Сравнительный пример 4
В четырехгорловую колбу на 1000 мл, снабженную подачей азота и средствами для охлаждения, загружали 247,7 г 90% водного раствора D,L -молочной кислоты и 190,2 г гликолевой кислоты и загрузку сырья нагревали в токе газообразного азота при пониженном давлении при 90oC/500 мм Hg до 150oC/130 мм Hg в течение 5 ч, причем вода постоянно отгонялась дистилляцией. Реакционную смесь далее нагревали при пониженном давлении при 5 - 7 мм Hg /150 - 180oC в течение 28 ч, после чего смесь охлаждали с получением янтарно окрашенного сополимера молочной кислоты и гликолевой кислоты.
Полученный таким образом сополимер растворяли в 1000 мл хлористого метилена, и раствор выливали при перемешивании в теплую воду при 60oC. Получающийся тестообразный тяжелый осадок полимера собирали и сушили в вакууме при 30oC.
Максимальный молекулярный вес получающегося сополимера молочной кислоты и гликолевой кислоты, в соответствии с определенным посредством ГПх, составлял 12000.
Сравнительный пример 5
В 0,8 мл дистиллированной воды растворяли 450 мг лейпропелин ацетата (ТАР-144) и 40 мг желатина, и раствор добавляли к раствору, полученному растворением 4,5 г смеси 1:1 сополимера молочной кислоты и гликолевой кислоты, из Сравнительного примера 4 и полимолочной кислоты из Контрольного примера 1 в 5 мл хлористого метилена. Смесь гомогенизировали небольшим гомогенизатором в течение 60 с для получения В/М эмульсии. Эту эмульсия имела склонность разделяться на два слоя. Эту эмульсию охлаждали до 18oC и выливали в 1200 мл 0,15% водного раствора поливинилового спирта (ПВС), предварительно доведенного до 20oC. Смесь гомогенизировали турбинным гомогенизатором для получения В/М/В эмульсии. Затем, по мере того как эту эмульсию В/М/В перемешивали при комнатной температуре, хлористый метилен испарялся с отверждением внутренней эмульсии В/М, которую затем собирали центрифугированием. Эту эмульсию повторно диспергировали в дистиллированной воде и еще раз центрифугировали для того, чтобы отмыть несвязанное лекарство и т.д.
Собранные микрокапсулы лиофилизировали с образованием порошка. Результат испытания на выделение in Vitro микрокапсул в фосфатном буфере (pH 7,0) при 37oC представлен в табл. 2.
Контрольный пример 1
В четырехгорловую колбу на 1000 мл, снабженную подачей азота и трубками холодильников, загружали 495,4 г 90% водного раствора D, L-молочной кислоты и загрузку сырья нагревали при пониженном давлении в токе газообразного азота при 90oC и 400 мм Hg ≈ 150oC и 30 мм Ho в течение 5 ч для удаления воды в виде дистиллата. Реакционную смесь далее нагревали при пониженном давлении при 5 - 7 мм Но и 150 - 175oC в течение 65 ч и затем охлаждали с образованием янтарно окрашенной полимолочной кислоты.
Этот полимер растворяли в 1000 мл хлористого метилена и добавляли при перемешивании к теплой воде при 60oC. Тестообразный полимерный осадок собирали и сушили в вакууме при 30oC.
Максимальный молекулярный вес получающейся полимолочной кислоты в соответствии с определенным посредством ГПХ составлял 16000.
Контрольный пример 2
В четырехгорловую колбу на 1000 мл, снабженную подачей азота и трубками холодильников, загружали 190,2 г гликолевой кислоты и 260,2 г D,L-2-гидроксимасляной кислоты, и загрузку сырья нагревали при пониженном давлении в токе газообразного азота при 90oC и 400 мм Hg ≈ 150oC и 30 мм Hg в течение 5 ч для удаления воды в виде дистиллата. Реакционную смесь далее нагревали при пониженном давлении при 5 - 7 мм Hg и 150 - 175oC в течение 72 ч и затем охлаждали с образованием янтарно окрашенного сополимера гликолевой кислоты и 2-гидроксимасляной кислоты.
Этот сополимер растворяли в 1000 мл хлористого метилена и добавляли при перемешивании в теплую воду при 60oC. Тестообразный осадок полимера собирали и сушили в вакууме при 30oC.
Максимальный молекулярный вес этого сополимера гликолевой кислоты и 2-гидроксимасляной кислоты, в соответствии с определенным посредством ГПХ, составлял 10000.
Контрольный пример 3
В четырехгорловую колбу на 1000 мл, снабженную подачей азота и холодильниками, загружали 300 г 90% водного раствора D, L -молочной кислоты и 100 г 90% L-молочной кислоты, и загрузку сырья нагревали в токе газообразного азота при пониженном давлении при 100oC/500 мм Hg до 150oC/30 мм Hg в течение 4 ч, причем вода постоянно отгонялась. Реакционную смесь нагревали при пониженном давлении при 5 - 7 мм Hg/150 - 180oC в течение 24 ч, после чего ее oxлаждали с образованием янтарно окрашенного полимера молочной кислоты.
Этот полимер растворяли в 1000 мл хлористого метилена, и раствор выливали при перемешивании в теплую воду при 60oC. Тестообразный осадок полимера собирали и сушили в вакууме при 30oC.
В соответствии с определенным посредством ГПХ, максимальная величина молекулярного веса данного полимера молочной кислоты составляла 7000.
Контрольный пример 4
В четырехгорловую колбу на 1000 мл, снабженную подачей азота и холодильниками, загружали 145,8 г D,L-2-гидроксимасляной кислоты и 177,7 г гликолевой кислоты и загрузку сырья нагревали в токе газообразного азота при пониженном давлении при 100oC/500 мм Hg до 150oC/30 мм Hg в течение 3,5 ч, причем вода постоянно отгонялась. Реакционную смесь далее нагревали при пониженном давлении при 5 - 7 мм Hg/150 - 180oC в течение 27 ч с последующим охлаждением, получая янтарно окрашенный сополимер гликолевой кислоты и 2-гидроксимасляной кислоты.
Этот сополимер растворяли в 1000 мл хлористого метилена, и раствор выливали при перемешивании в теплую воду при 60oC. Получающийся тестообразный осадок полимера собирали и сушили в вакууме при 25oC.
В соответствии с определенным посредством ГПХ, максимальная величина молекулярного веса данного сополимера, гликолевой кислоты и 2-гидроксимасляной кислоты составляла 14000.
Пример 1. Используя смесь полимолочной кислоты, полученной в Контрольном примере 1, и сополимера гликолевой кислоты и 2-гидроксимасляной кислоты, полученного в Контрольном примере 1, в весовом отношении 3:1, следовали методике Сравнительного примера 2 для получения микрокапсул. Результат испытания вышеуказанных микрокапсул на выделение in Vitro в фосфатном буфере (pH 7,0) при 37oC представлен в Таблице 1.
Пример 2.
Используя смесь полимолочной кислоты, полученной в Контрольном примере 1, и сополимера гликолевой кислоты и 2-гидроксимасляной кислоты, полученного в Контрольном примере 2, в весовом отношении 1:1, следовали методике Сравнительного примера 2 для получения микрокапсул. Результат испытания вышеуказанных микрокапсул на выделение in Vitro в фосфатном буфере (pH 7.0) при 37oC представлен в табл. 1.
Пример 3. Используя смесь полимолочной кислоты, полученной в Контрольном примере 1, и сополимера гликолевой кислоты и 2-гидроксимасляной кислоты, полученного в Контрольном примере 2 в весовом отношении 1:3, следовали методике Сравнительного примера 2 для получения микрокапсул. Результат испытания вышуказанных микрокапсул на выделение in Vitro в фосфатном буфере (pH 7.0) при 37oC представлен в табл. 1.
Из табл. 1 следует, что время выделения может быть доведено до 6, 4 и 3 нед соответственно при помощи изменения соотношения смешивания между полимолочной кислотой (А) и сополимером гликолевой кислоты и 2-гидроксимасляной кислоты (В). Кроме того, в то время, как микрокапсулы Сравнительного примера 2 не могут выделять лекарство с постоянной скоростью, все микрокапсулы изобретения могут выделять лекарство с, по существу, постоянной скоростью.
Пример 4. Используя смесь полимолочной кислоты, полученной в Контрольном примере 1, и сополимера гликолевой кислоты и 2-гидроксимасляной кислоты, полученного в Контрольном примере 2, в весовом отношении 3:1, следовали методике Сравнительного примера 3 для получения микрокапсул. Результат испытания данных микрокапсул на выделение in Vitro в фосфатном буфере (pH 7.0) при 37oC представлен в табл. 2.
Пример 5. Используя смесь полимолочной кислоты, полученной в Контрольном примере 1, и сополимера гликолевой кислоты и 2-гидроксимасляной кислоты, полученного в Контрольном примере 2, в весовом отношении 1:2, следовали методике Сравнительного примера 3 для получения микрокапсул. Результат испытания вышеуказанных микрокапсул на выделение in Vitro в фосфатном буфере (pH 7.0) при 37oC представлен в табл. 2.
Пример 6. Используя смесь полимолочной кислоты, полученной в Контрольном примере 1, и сополимера гликолевой кислоты и 2-гидроксимасляной кислоты, полученного в Контрольном примере 2, в весовом соотношении 1:3, следовали методике Сравнительного примера 3 для получения микрокапсул. Результат испытания данных микрокапсул на выделение in Vitro в фосфатном буфере (pH 7.0) при 37oC представлен в табл. 2.
Из табл. 2 следует, что время выделения может быть доведено до желательной продолжительности при помощи изменения соотношения смешивания полимолочной кислоты (А) и сополимера гликолевой кислоты и 2-гидроксимасляной кислоты (В). Тогда как скорость выделения лекарства из микрокапсул Сравнительного примера 3 не была постоянной, все микрокапсулы настоящего изобретения могут выделять лекарства с, по существу, постоянной скоростью на протяжении всего времени выделения. Как показано для Сравнительного примера 5, при смешивании полимолочной кислоты (А) и сополимера молочной кислоты и гликолевой кислоты (В) эффект настоящего изобретения не достигался.
Пример 7. В 0,4 мл дистиллированной воды растворяли 400 мг лейпропелин ацетата (ТАР-144), и раствор добавляли к раствору, полученному растворением 4,0 г смеси 1: 1 полимолочной кислоты Контрольного примера 3 и сополимера гликолевой кислоты и 2-гидроксимасляной кислоты Контрольного примера 4 в 5 мл хлористого метилена. Смесь гомогенизировали небольшим гомогенизатором в течение 60 с для получения В/M эмульсии. Эту эмульсию охлаждали до 18oC и выливали в 1000 мл 0,1% водного раствора поливинилового спирта /ПВС/, предварительно доведенного до 20oC. Смесь гомогенизировали турбинным гомогенизатором, получая В/М/В эмульсию. Затем, по мере того, как эту В/М/В эмульсию перемешивали при комнатной температуре, хлористый метилен испарялся, отверждая внутреннюю эмульсию В/M, которую затем собирали центрифугированием. Эту эмульсию повторно диспергировали в дистиллированной воде и дополнительно центрифугировали для того, чтобы отмыть несвязанное лекарство и т.д.
Собранные микрокапсулы лиофилизировали с образованием порошка. Результат испытания микрокапсул на выделение in Vitro в фосфатном буфере (pH 7,0), при 37oC представлен в табл. 3.
При получении терапевтической системы длительного выделения с использованием фармацевтической основы длительного выделения, включающей в себя смесь полимолочной кислоты и сополимера гликолевой кислоты, в соответствии с настоящим изобретением время выделения лекарства терапевтической системы можно легко регулировать, изменяя соотношение скоростью на протяжении всего времени выделения без значительного выброса на начальной стадии.
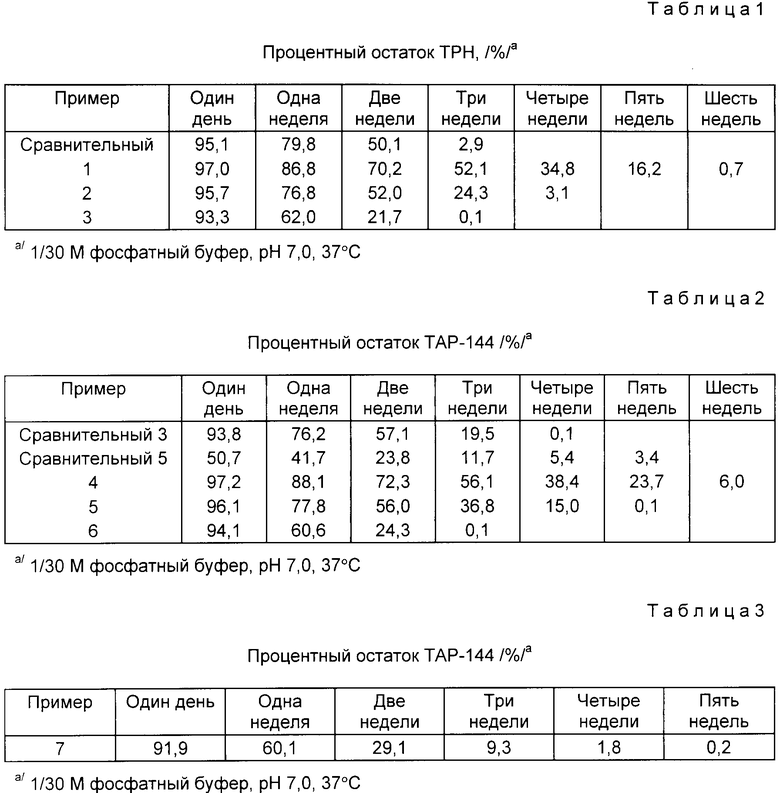
Изобретение относится к фармацевтическим композициям продленного действия. Представлена полимерная композиция для продленного действия, содержащая полимолочную кислоту и сополимер гликолевой кислоты и гидроксикарбоновой кислоты общей формулы , где R - алкильная группа с количеством углеродных атомов равном 2 - 8. Время выделения можно регулировать, изменяя соотношение компонентов композиции. 3 табл.
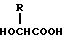
где R С2 С6-алкильная группа,
причем массовое соотношение полимолочной кислоты и сополимера гликолевой кислоты и гидроксикарбоновой кислоты находится в пределах 10 90 90 10.
(Ryr)-Glu-R1Trp-Ser-R2 -R3-R4-Arg-Pro-R5,
где R1 His, Tyr, Trp или пара-NH2-Phe;
R2 Tyr или Phe;
R3 Gly или остаток D-аминокислоты;
R4 Leu, Ile или NLe;
R5 Gly-NH-R6 (R6 H или низшая алкильная группа, которая может необязательно содержать гидроксильную группу) или NH-R6,
или их соли.
(Pyr)-Glu-His-Trp-Ser-Trp-D-Leu-Leu-Arg-Pro -NH-C2H5
или его ацетат.
где R С2 С6-алкильная группа,
в массовом соотношении 10 90 90 10.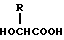
где R С2 С6-алкил,
при массовом соотношении полимолочной кислоты и сополимера гликолевой кислоты и гидроксикарбоновой кислоты 10 90 90 10.
Приоритет по пунктам:
16.10.90 по пп.1 и 3 10;
28.08.91 по п.2.
| ЕР, патент, 0058481, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
Авторы
Даты
1998-01-27—Публикация
1991-10-15—Подача