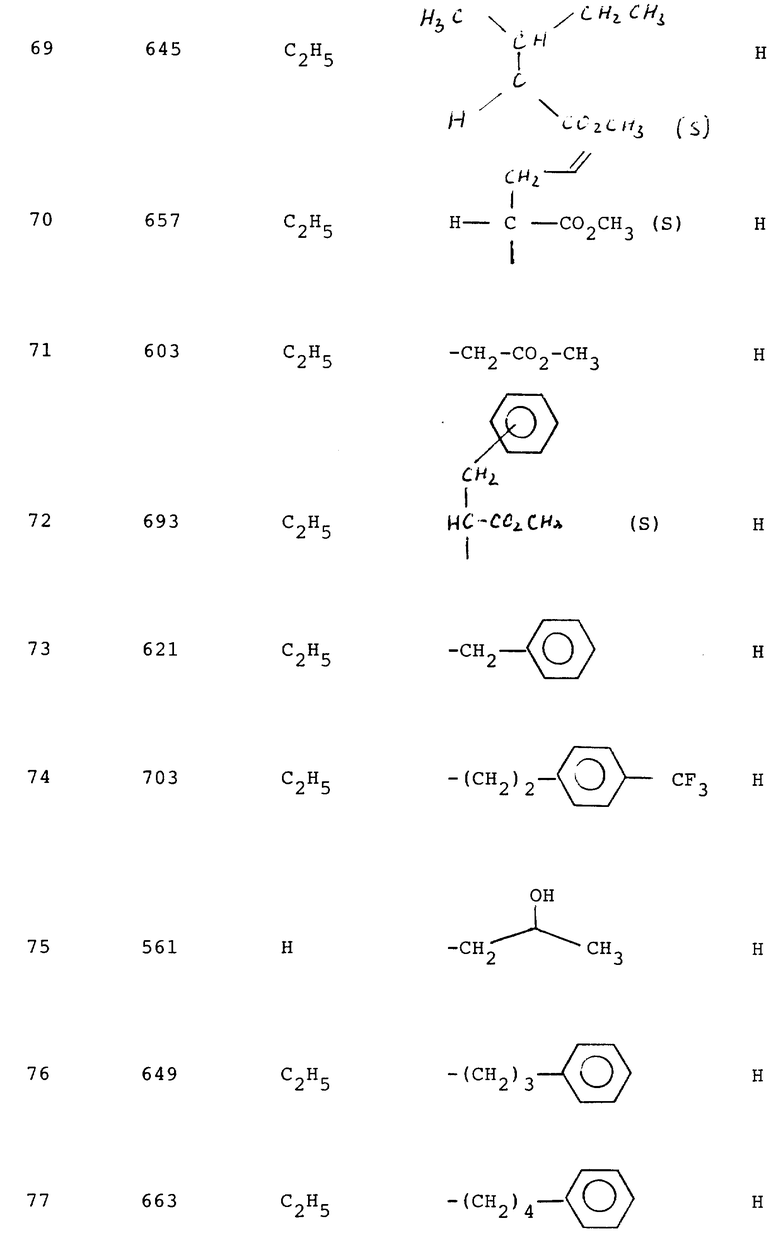
Изобретение относится к производным азола, к способу их получения и к фармацевтическим композициям на их основе. Из европейского патента A-28834 известно 1-бензил-замещенные производные имидазола, из европейского патента A-253310 и из европейского патента A-0401030 известны производные имидазола с функцией диарилкарбоновой кислоты, из европейского патента A-323841 известны производные пиразола и триазола и из европейского патента A-0409332 известны производные триазола соответственно с функцией диарилкарбоновой кислоты, а также из европейского патента A-324377 известны производные имидазола с группой диарил-тетразолила и их применение в качестве антагонистов ангиотензин-11-рецепторов.
Кроме того, в патенте ФРГ А 4010797 (соответствующем заявке патент США N 07/679,233) представлены замещенные азолы, которые содержат группу сульфонилмочевины.
Были найдены новые производные азола, которые имеют новую структуру сульфонилмочевины, сульфонилуретана или сульфонилсульфонамида и являются высокоэффективными антагонистами ангиотензин-11-рецепторов как в пробирке, так и на живом организме.
Изобретение относится к производным имидазола общей формулы 1: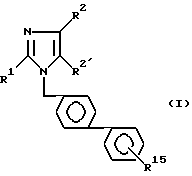 ,
,
или их физиологически переносимые соли.
где
R1 - означает (C2-C7)алкил;
R2 - означает галоген, (C1-C3)-алкилтио, (C1-C3)-алкокси;
R2′ - означает CHO, COOH, CH2OH, COO(C1-C3)алкил;
R15- означает группу: SO2NH-CO-NR6R9,
где
R6 и R9 различные и означают водород, (C1-C6)алкил, который может быть замещен 1-3 различными радикалами, выбранными из ряда: гидроксил, фенил, карбоксил, C3-C6-алкинил, (C3-C8)-циклоалкилен, (C1-C4)алкоксикарбонил, (C2-C4)-алкенил, который может быть замещен фенилом, (C1-C3)-алкоксикарбонилом; (C3-C8)циклоалкил, (C3-C6)-циклоалкил - (C1-C3)-алкил; фенил, фенил - (C1- C4)алкил, который может быть замещен 1-2 одинаковыми или различными радикалами, выбранными из ряда трифторметил, метокси-; (C1-C9)-гетероарил, который может быть частично или полностью гидрирован, причем в качестве гетероатома может быть 1-4 атома азота или один атом азота и один атом серы, или (C1-C9) - гетероарил - (C1-C3)алкил, который может быть частично или полностью гидрирован, в качестве гетероатома может содержать один атом азота или один атом азота и один атом кислорода, и который может быть замещен одним радикалом, выбранным из NO2, метила, оксо;
или R6 и R9 вместе с атомом азота образуют (C5-C6) - гетероарильное кольцо, которое может быть частично или полностью гидрировано и содержит в качестве гетероатома один атом азота и один атом кислорода или серы, или один атом азота, причем последний гетероарил может быть замещен (C1-C4)-алкокси- карбониламино-группой, или R15 представляет собой группу - SO2NH-CO-OR6′ , где R6′ означает (C1-C6) алкил, который может быть замещен (C1-C6)алкилом, тиенилом, (C3-C8) циклоалкиленом или бензилокси-группой, (C2-C5)-алкенил, который может быть замещен фенилом, (C3-C6)-алкинил, (C3-C8)-циклоалкил - (C1-C3)алкил, фенил - (C1-C4)алкил, или R15 представляет собой группу - SO2NH - SO2R6″ , где R6″ - означает - N - (C1-C4)-алкил 2, тиенил или нитрофенил.
Изобретение относится так же к производным имидазола, представляющим собой этил-1- [(2'-H-пропил- аминокабониламиносульфонилбифенил-4-ил) -метил] -2-H-бутил-4-метилтиоимидазол-5-карбоксилат или его физиологически переносимую соль или 1- [(2'-Н-пропиламинокарбониламиносульфонилбифенил-4-ил) метил] -2-n-бутил-4-метилтиоимидазол-5-карбоновой кислоты или его физиологически переносимую соль.
Предпочтительно, изобретение относится к производным имидазола общей формулы 1 по п. 1: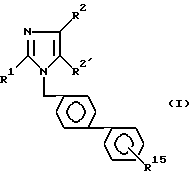 , или их физиологически переносимые соли,
, или их физиологически переносимые соли,
где
R1 - означает (C2-C7)алкил;
R2 - означает галоген, (C1-C3)-алкилтио, (C1-C3)- алкокси;
R2′ - означает CHO, COOH, CH2OH, COO(C1-C3)алкил;
R15 - означает группу: SO2NH-CO-NR6R9,
где
R6 и R9 различные и означают водород, (C1-C6)алкил, который может быть замещен 1-3 различными радикалами, выбранными из ряда: гидроксил, фенил, карбоксил, (C3-C8)-цикло-алкилен, (C1-C4)алкоксикарбонил, (C2-C4)-алкенил, который может быть замещен фенилом, (C1-C3)алкосикарбонилом; (C3-C6) алкинил; (C3-C8)циклоалкил, (C3-C6)-циклоалкил - (C1-C3)-алкил; фенил, фенил - (C1-C4)-алкил, который может быть замещен 1-2 одинаковыми или различными радикалами, выбранными из ряда трифторметил, метокси-; (C1-C9)-гетеоарил, который может быть частично или полностью гидрирован, причем в качестве гетероатома может быть 1-4 атома азота или один атом азота и один атом серы,
или
(C1-C9) - гетероарил - (C1-C3) алкил, который может быть частично или полностью гидрирован, в качестве гетероатома может содержать один атом азота или один атом азота и один атом кислорода, и который может быть замещен одним радикалом, выбранным из NO2, метила, оксо;
или
R6 и R9 вместе с атомом азота образуют (C5-C6)-гетероарильное кольцо, которое может частично или полностью гидрировано и содержит в качестве гетероатома один атом азота и один атом кислорода или серы, или один атом азота, причемпоследнийгетероарилможетбытьзамещен(C1-C4)-алкоксикарбониламино-группой.
Кроме того, изобретение относится к способу получения производных имидазола общей формулы I по п. 1, отличающемуся тем, что соединение формулы II: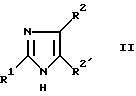 ,
,
алкилирует соединением формулы III: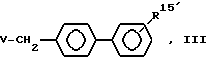
где
V - отщепляемая группа, с получением соединения формулы 1: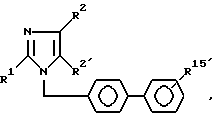 ,
,
где
R15 представляет защитную сульфамидную группу с последующим снятием защитной группы и полученный сульфонамид при необходимости превращают в сульфонилуретаны или сульфонилмочевины или сульфонилсульфонамиды формулы 1.
Изобретение так же относится к фармацевтической композиции, понижающей кровяное давление, включающей активное соединение и фармацевтически приемлемую добавку, отличающейся тем, что в качестве активного соединения она содержит соединение производные имидазола формулы 1 в эффективном количестве, описанные выше.
Соединения согласно изобретению формулы (1) имеют антагонистическое действие на ангиотензин-11-рецепторы и могут поэтому применяться для лечения зависимой от ангиотензина-11 гипертензии. Другие возможности применения существуют при недостаточности сердца, кардиозащите, инфаркте миокарда, гипертрофии сердца, артериосклерозе, нефропатии, почечной недостаточности, а также при сосудистых заболеваниях головного мозга, как транзисторные ишемические приступы и кровоизлияние в мозг.
Ренин представляет протеолитический фермент из класса аспертил-протеаз, который как результат различных стимулов (уменьшение объема, дефицит натрия, стимуляция β -рецепторов) смежноагломерированных клеток почек выделяют в кровообращение. Там он отщепляет от выделенного из печени ангиотензиногена декапептид ангиотензин 1. Последний через angiotenzin converting enzyme (ACE) переводят в ангиотензин 11. Ангиотензин 11 играет существенную роль при регуляции кровяного давления, так как он повышает непосредственно кровяное давление благодаря ангиоспазму. Дополнительно он стимулирует секрецию альдосторона из надпочечника и повышает таким образом через торможение выделения натрия внеклеточный объем жидкости, который, в свою очередь, способствует повышению кровяного давления.
Пострецепторными действиями являются, между прочим, стимуляция превращения фосфоинозита (освобождение Ca+2), активирование протеинкиназы C) и помощь зависящих от c-AMP гормональных рецепторов.
Сродство соединений формулы 1 с ангиотензин-11-рецептором может быть определено измерением 125J-ангиотензин-11- или 3H-ангиотензин-11-вытеснения рецепторов на мембранах зоны гломерулоза надпочечников крупного рогатого скота. Для этого препарирование мембраны суспендируют в буферном растворе при pH 7,4.
Чтобы препятствовать деградации радиолиганд во время инкубирования, добавляют апротинин, ингибитор пептидазы. Дополнительно применяют около 14000 ср изотопного индикатора с удельной активностью 74 TBq/ммол (продает фирма Амерсхам Бюхлер Брауншвейг, ФРГ) и количество рецепторного протеина, которое связывает 50% изотопного индикатора. Реакцию начинают добавкой 50 мл мембранной суспензии к смеси 100 мл буферного раствора + апротинина; 50 мл буферного раствора с ангиотензином-11 или антагонистом рецептора или без ангиотензина-11 или антагониста рецептора и 50 мл изотопного индикатора. По прошествии инкубационного периода 60 мин при температуре 25oC отделяют связанный и свободный радиолиганд опытами с фильтрованием при помощи Whatmann® GFIC фильтров на - собирателе клеток Скатрон® .
Неспецифические связи предотвращают обработкой фильтров при помощи 0,3% полиэтиленимина с pH=10 (Сигма, N 3143). Измерением радиоактивности в гамма-сцинтилляционном счетчике определяют интенсивность вытеснения радиолиганда рецептором. IC50-величины, которые обозначают концентрацию ингибитора, чтобы вытеснять 50% лиганда, определяют по J.Theor. Biol 59, 253 (1970). Они лежат в области от 1,10-4 до 1,10-9 М для соединений формулы (1).
В качестве альтернативы можно определять сродство соединений формулы 1 с ангиотензин-11-рецептором измерением 125J- ангиотензин-11- или 3H-ангиотензи-11-вытеснения рецепторными препаратами из различным органов (печень, легкое, надпочечник, головной мозг и т.д.).
Для этого препарированные мембраны суспендируют в инкубационном буферном растворе (20 ммол Трис, pH 7,4, содержащем 135 ммол NaCl, 10 ммол KCl, 10 ммол MgCl2, 5 ммол глюкозы, 0,2% сывороточного альбумина крупного рогатого скота и ингибиторы протеазы PMSF 0,3 ммол и бацитрация 0,1 ммол) и инкубируют с радиоактивно маркированным ангиотензином-11 и с различными концентрациями испытываемых соединений в течение 90 мин при 25oC. Затем связанный и свободный радиолиганд отделяют фильтрованием через фильтр с микростекловолокном (GF51, Schleicher - Shiill на собирателе клеток (СКАТРОН).
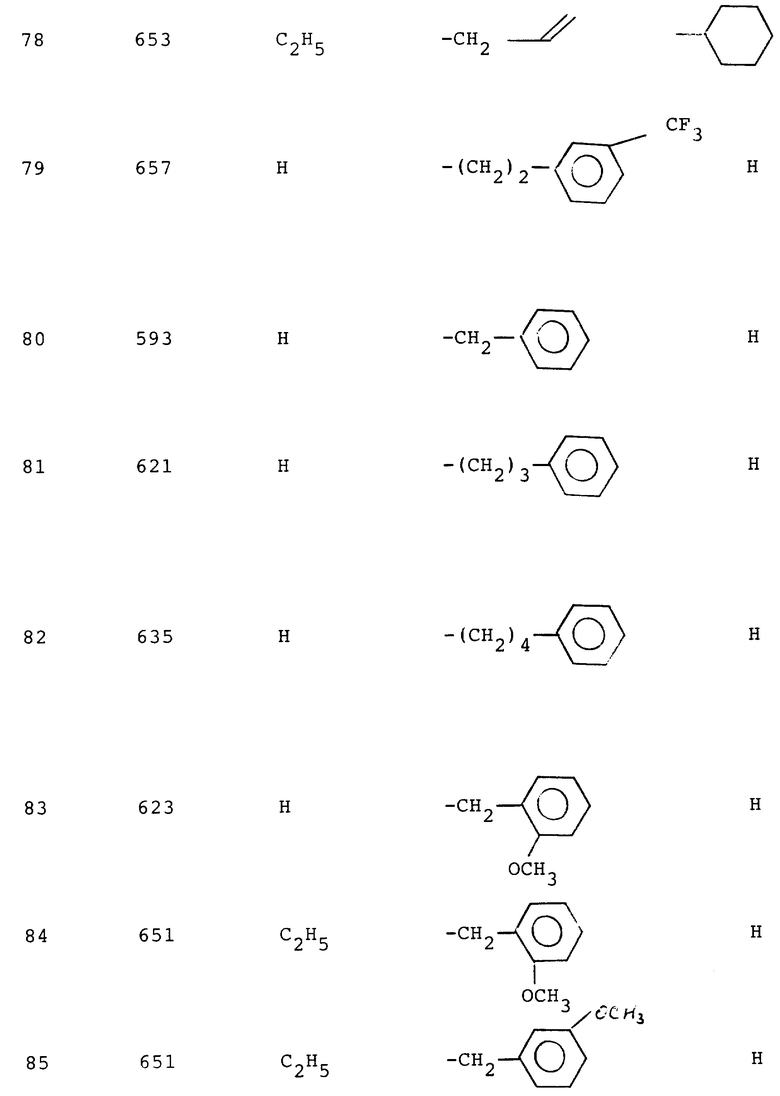
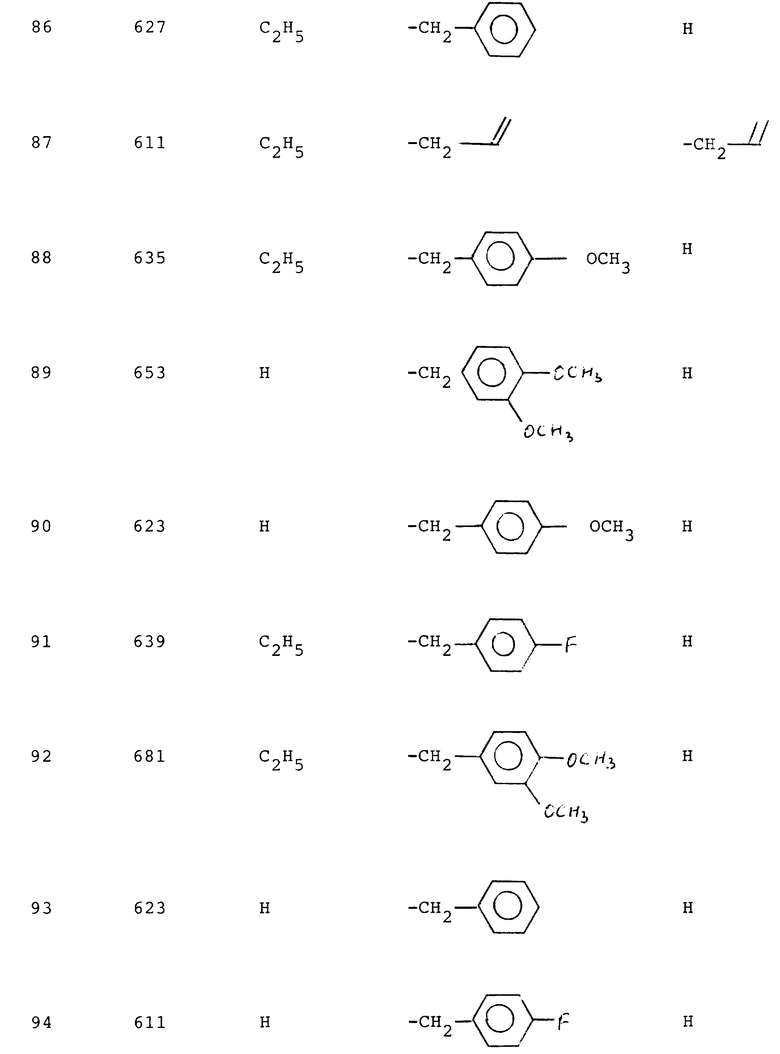
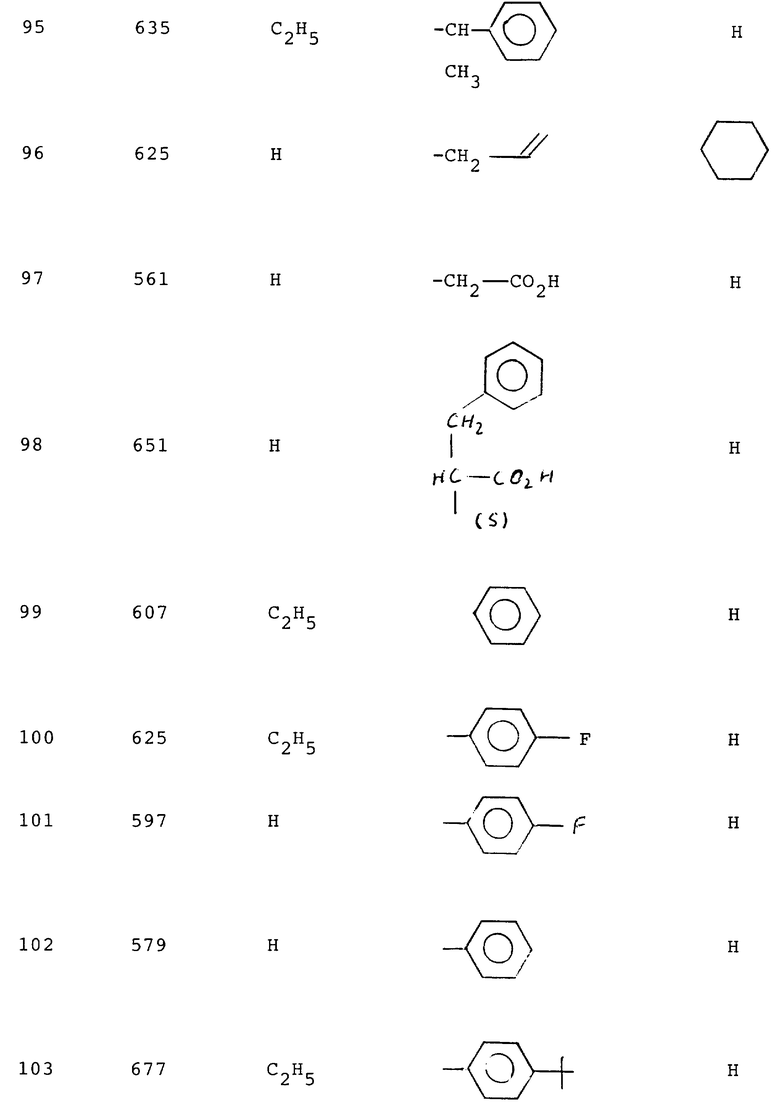
Измерением связанной рецептором радиоактивности на фильтрах при помощи бета- или гамма-спектрометра определяют степень вытеснения радиолиганда рецептором благодаря испытываемым соединениям. Интенсивность вытеснения радиолиганда рецептором благодаря испытываемым соединениям указывают величиной lC50, т.е. концентрация ингибитора, которая вытесняет 50% связанного радиолиганда рецептором. Вычисление величин lC50 производят при помощи PC-математического обеспечения (ЛИГАНД, C. A. Mepherson 1985, Elsivier-BIOSOFT, 68 Hills Road, Cambridge CB 2 ILA, UK). Измеренные для соединений формулы (I) lC50-величины лежат в области от 1•10-5 до 1•10-11 М (ср. нижеследующую табл. 1, в которой сопоставлены lC50-величины для соединений по изобретению).
Таблица 1.
Пример - lC50 нМ
1 - 5000
2 - 8000
3 - 1100
4 - 1100
5 - 16000
22 - 2000
24 - 800
25 - 1400
29 - 1,1
30 - 2030,0
31 - 153,0
32 - 3,5
33 - 34,0
34 - 1,0
35 - 50,0
36 - 16,0
37 - 1,1
55 - 8,8
56 - 4,6
57 - 1100
58 - 3,0
59 - 1,3
60 - 2,2
61 - 1,1
62 - 3,6
63 - 1,3
64 - 0,5
65 - 1,8
66 - 6,9
67 - 0,91
68 - 12,0
69 - 3,2
70 - 4,4
71 - 2,2
73 - 2,5
76 - 9,5
79 - 5,8
80 - 0,69
81 - 0,79
83 - 0,96
84 - 4,3
85 - 3,9
89 - 1,1
90 - 0,69
92 - 280,0
93 - 3,3
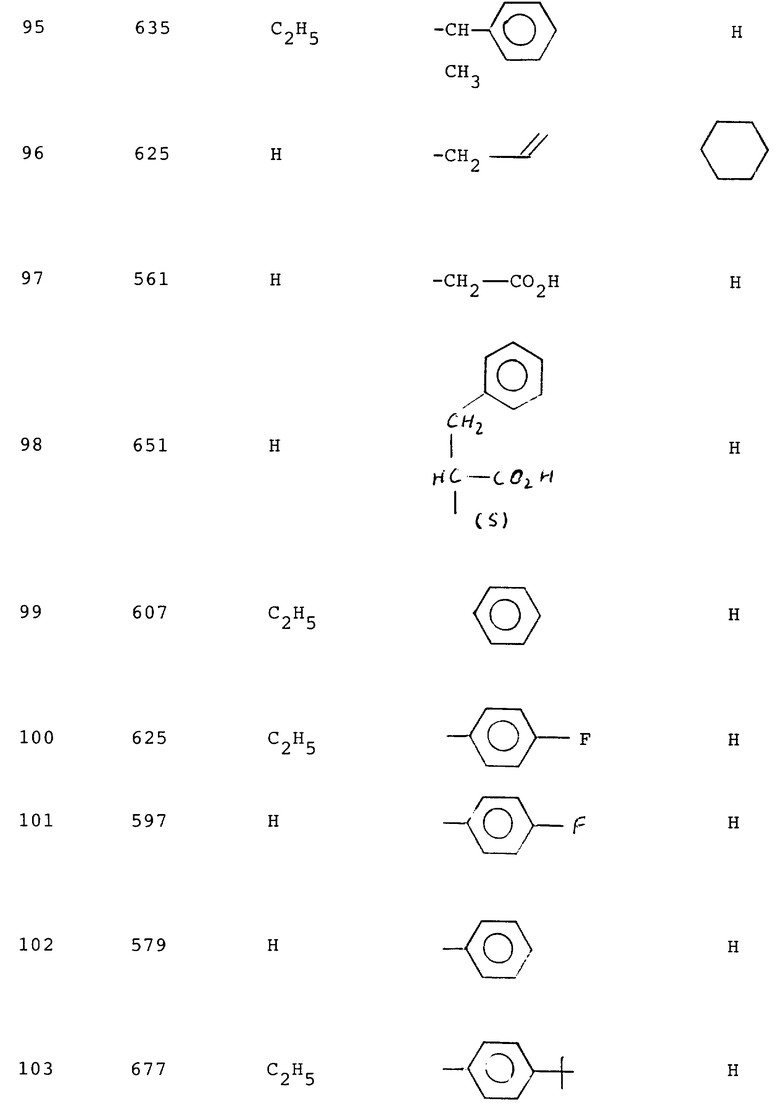
95 - 1,8
98 - 1,4
99 - 26,6
100 - 68,5
101 - 2,4
102 - 2,3
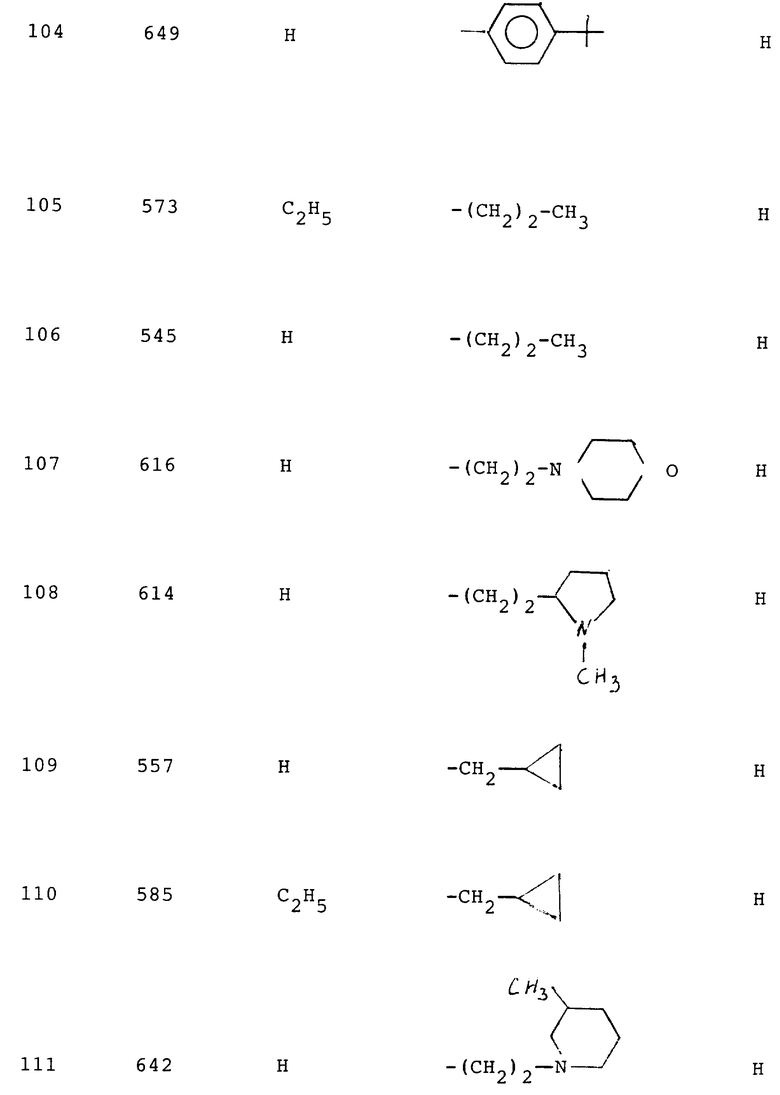
105 - 3,0
107 - 2,5
108 - 0,95
109 - 0,6
110 - 0,5
111 - 2,9
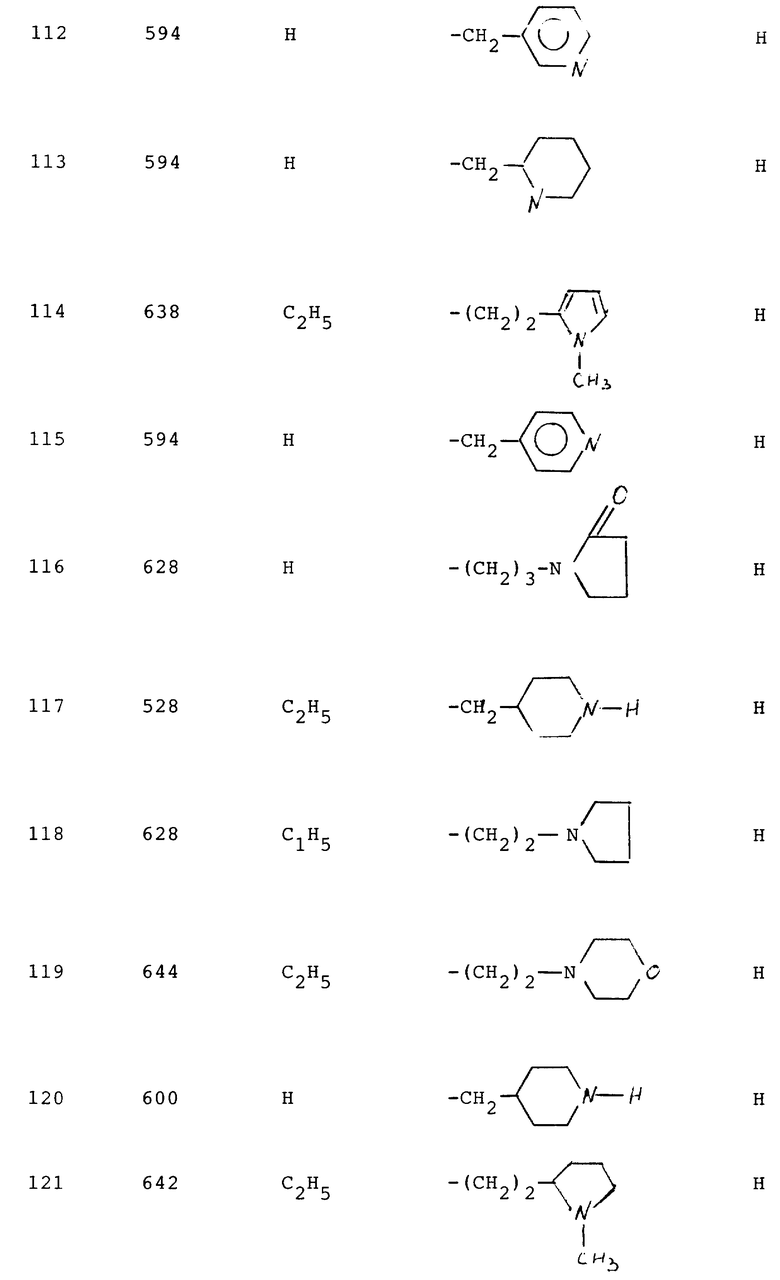
112 - 1,5
113 - 0,3
115 - 0,9
116 - 2,4
117 - 1,2
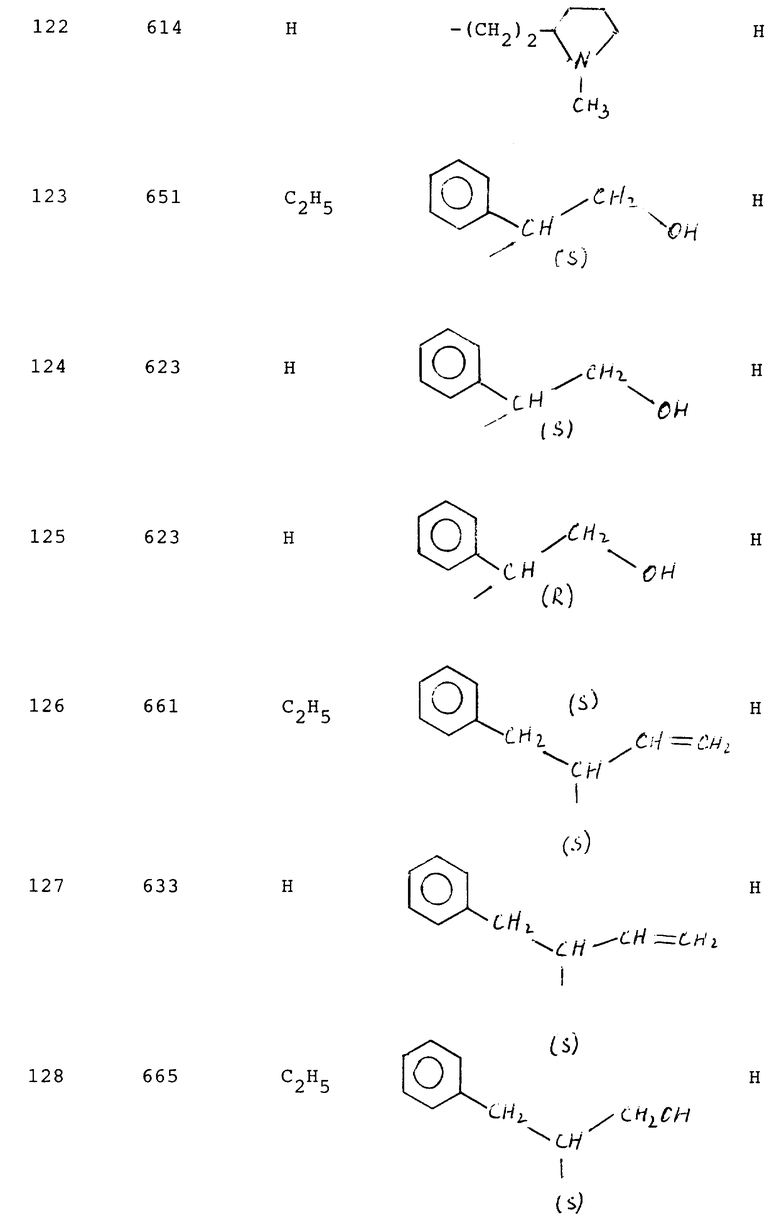
124 - 1,8
125 - 2,8
127 - 3,0
128 - 5,6
129 - 1,5
134 - 180,0
135 - 5,6
138 - 1,7
139 - 2,8
140 - 8,2
141 - 4,4
144 - 5,3
146 - 40,0
151 - 0,4
152 - 1,5
153 - 0,88
154 - 1,8
155 - 6,0
156 - 4,7
157 - 1,4
159 - 8,7
160 - 0,73
161 - 57,0
162 - 3,9
163 - 3,7
164 - 0,86
165 - 2,3
166 - 1,2
167 - 4,0
168 - 7,0
169 - 2,9
170 - 2,7
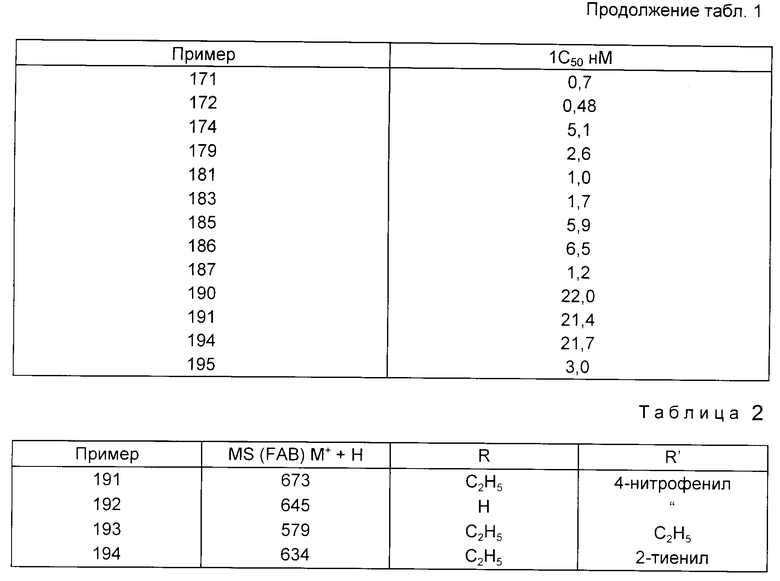
171 - 0,7
172 - 0,48
174 - 5,1
179 - 2,6
181 - 1,0
183 - 1,7
185 - 5,9
186 - 6,5
187 - 1,2
190 - 22,0
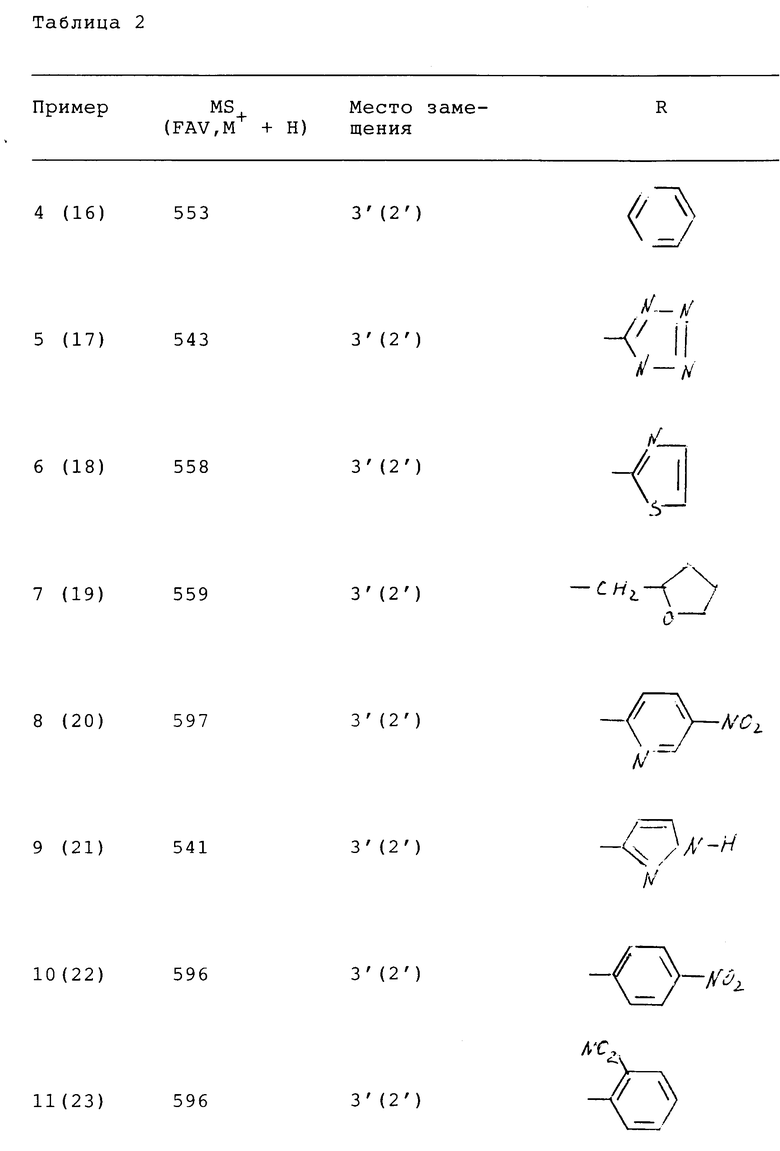
191 - 21,4
194 - 21,7
195 - 3,0
Для определения антагонистического действия соединений формулы (I) можно измерять их эффект на индуцированном ангиотензином-II повышении кровяного давления на наркотизированных Spragie-Dawley крысах. В качестве наркотического средства служит Na-тиобарбитал Трапанал® , товарный знак Бук Гулден, ФРГ) при дозе 100 мг/кг внутрибрюшинно. Внутривенное применение производят в яремную вену. Кровяное давление измеряют в сонной артерии. Сначала животных обрабатывают тартратом пентолина (10 мг/кг внутримышечно), так что достигают более низкого уровня кровяного давления (блокада ганглиев). ANGII (гипертензин ЦИБА) применяют в объеме 0,1 мл/ 100 г через 10-минутные интервалы внутривенно. Доза составляет 0,5 μ г/кг. Соединения формулы (1) растворяют в дистиллированной воде и применяют при дозах от 0,1 до 1,0 мк/кг внутривенно или 10 и 100 мг/кг интрадуоденально.
Соединения формулы (1) эффективны особенно в области 0,1-100 мг/кг, предпочтительно 0,1-3 мг/кг.
Изобретение относится также к фармацевтическим составам, состоящим из соединения формулы (1) и других активных веществ, как, например, мочегонные средства или нестероидальные противовоспалительные активные вещества. Соединения формулы (1) можно применять также как диагностические средства для системы ренин-ангиотензин.
Фармацевтические препараты содержат активное количество активного вещества формулы (1) и при случае другие активные вещества вместе с неорганическим или органическим фармацевтическим применяемым веществом-носителем. Применение может осуществляться через нос, внутривенно, подкожно или через рот. Дозировка активного вещества зависит от вида теплокровных, от веса тела, от возраста и от вида применения.
Фармацевтические препараты настоящего изобретения получают известными способами растворения, смешивания, гранулирования или дражирования.
Для оральной формы применения активные соединения смешивают с обычными для этой цели добавками, как вещества-носители, стабилизаторы или инертные растворители и обычными методами приводят в подходящие формы введения, как таблетки, драже, капсулы, водные, спиртовые или масляные суспензии или водные, спиртовые или масляные растворы. В качестве инертных носителей можно применять, например, гуммиарабик, магнезию, карбонат магния, фосфат калия, молочный сахар, глюкозу, стеарилфумарат магния или крахмал, особенно кукурузный крахмал. При этом лекарственную форму можно получать как сухой и влажный гранулят. В качестве маслянистых веществ-носителей или растворителей принимают во внимание, например, растительные и животные масла, как подсолнечное масло и рыбий жир.
Для подкожного или внутривенного применения активные соединения или их физиологически совместимые соли, в случае необходимости с обычными для этого веществами, как агенты растворения эмульгаторы или другие вспомогательные вещества, приводят в формы растворов, суспензий или эмульсий. В качестве растворителей принимают в расчет, например, воду, физиологический раствор хлористого натрия или спирты, как этанол, пропандиол или глицерин, а также растворы сахара, как растворы глюкозы или маннита, или смеси из названных растворителей.
Список сокращений:
DMF - N,N-диметилформамид
NBS - N-бромсукцинимид
AIBN - L,L-азобис-изобутиронитрил
EI - ударный электрон
DCI - десорбция-химическая ионизация
RT - комнатная температура
EE - этилацетат (EtOAc)
DIP - диизопропиловый эфир
MTB - метилтретбутиловый эфир
mp - точка плавления
HEP - n-гептан
DME - диметоксиэтан
FAB - бомбардировка прочными атомами
CH2Cl2 - дихлорметан
Изобретение поясняют нижеследующими примерами:
Пример 1. Синтез 1-[(2'-фениламинокарбониламиносульфонил-бифенил- 4-ил)-метил]-2 n-бутил-4-хлор-имидазол-5-карбоксальдегида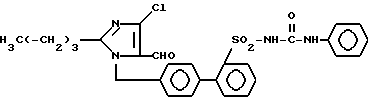 ,
,
a) получение 4'-метилбифенил-2-амина
К 23,9 г (0,112 мол) 4'-метил-2-нитробифенила (R.B. Muller и S.Dugar, Organometallics 1984, 3, 1261) в 50 мл метанола добавляют 3 г никеля Ренея и гидрируют при нормальном давлении при комнатной температуре до поглощения теоретического количества H2. После этого отделяют катализатор для фильтрования и сгущают фильтрат. Хроматография на SiO2 (500 г) с EE/HEP (1/6) в качестве растворителя дает 19 г соединения указанного в названии в виде масла (92,5%).
Коэффициент Rf (EE/HEP 1/4) = 0,3 MS (El) = 183 (M+)
b) 4' - метил-бифенил-2-аммонийгидрохлорид
10 г соединения 1a) растворяют в 50 мл 6 в HCl и 100 мл диоксана. Отгонка растворителя дает титульное соединение, которое применяют без дальнейшей очистки.
c) 4' - метилфенил-2-сульфонамид.
К суспензии 31 г (140 ммол) соединения 1b) в 200 мл 6 н HCl добавляют при -10oC 7,9 г (114 ммол) нитрита натрия, причем образуется прозрачный раствор. Последний при 0oC добавляют к раствору, состоящему из 200 мл ледяной уксусной кислоты, насыщенной SO2, 17 г C и Cl2 • H2O и 25 мл H2O. После этого доводят до комнатной температуры и перемешивают 2 ч при этой температуре. Затем добавляют 250 мл EE, отделяют фазы и сушат органическую фазу при помощи сульфата магния. Сгущение дает масло, которое растворяют в 300 мл ацетона. После этого добавляют 150 мл 25%-ного аммиака и перемешивают 2 ч. Потом сгущают и добавляют 500 мл EE. EE-фазу промывают 1•H2O, сушат на MgSO4 и сгущают. Хроматография на SiO2 с EE/HEP (1/1) дает титульное соединение (4,6 г).
Rf (EE/HEP 1/1)= 0,25 MS(DCI) = 248 (M+ + H).
Точка плавления: 122oC.
d) 4' - метилбифенил-2-N,N-диметиламиноформилсульфонамид
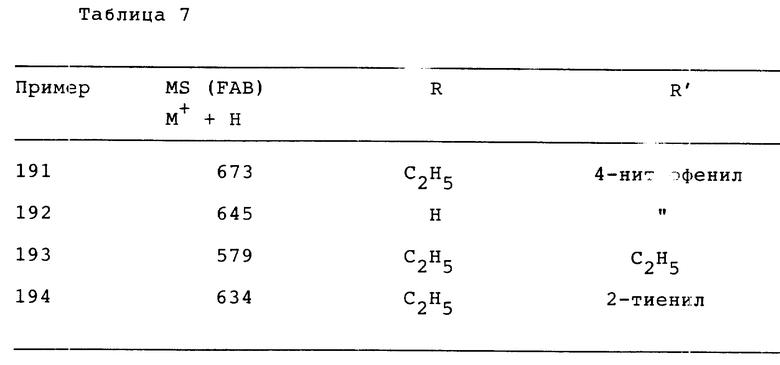
4,6 г (18,6 ммол) соединения 1c) и 2,5 г (19,3 ммол) N,N -диметилформамиддиметилацеталя в 30 мл DMF перемешивают 2 ч при комнатной температуре, затем добавляют 100 мл H2O и образованный осадок отсасывают на нутче и сушат на воздухе, причем получают 4,2 г титульное соединение.
Rf (EE/HEP 1/1) 00,2 MS (DCI) = 303 (M+ + H).
e) 4' -бромметилбифенил-2-N,N-диметиламино-формилсульфонамид.
К 2,76 г (13,5 ммол) соединения 1d) и 2,4 г NBS (13,5 ммол) в 50 мл хлорбензола добавляют 150 мг перекиси бензоила. Через 4 ч при флегме сгущают, добавляют 50 мл EE и промывают EE-фазу 1 х 10%-ным раствором Na2SO3 и 1 х H2O. После сушки с Na2SO4 сгущают и хроматографируют на SiO2- Получают 1,2 г титульного соединения.
Rf (EE/HEP 2/1) = 0,23 MS (DCl) = 381, 383 (M++ H)
f) 2 - n-бутил-4-хлор-5-формил-имидазол
К 20 г (0,106 мол) 2-n-бутил-4-хлор-5-гидроксиметилимидазола (полученного по европейскому патенту А 253 310) в 350 мл ледяной уксусной кислоты медленно добавляют при 10-15oC 305 мл 1-молярного раствора (NH4)2 Ce(NO3)6 в H2O. После 2,5 ч при комнатной температуре устанавливают величину pH при помощи 2 и KOH до 4 (20oC во время добавки основания). Затем экстрагируют 4 х с 500 мл CH2Cl2 и промывают соединенные органические экстракты 3 х по 300 мл насыщенного водного раствора NaHCO3, сушат при помощи Na2SO4 и сгущают, причем получается титульное соединение как бесцветное твердое вещество (18 г, 92%).
Точка плавления: = 90oC
Rf (DIP/MTV 1/1) = 0,5
g) 1- [(2'-N, N-диметиламиноформилсульфонамидобифенил-4-ил)- метил]-2 n-бутил-4-хлоро-имидазол-5-карбоксальдегид.
690 мг (1,98 ммол) соединения 1e), 370 мг (1,98 ммол) соединения 1f) и 270 мг (1,98 ммол) карбоната калия перемешивают в DMF (10 мл) при комнатной температуре 2 ч. После этого добавляют 50 мл EE и промывают 2 раза H2O. Органическую фазу сушат (a2 O4) и сгущают. Хроматография на SiO2 с EE/HEP (2/1) в качестве растворителя даеттитульное соединение (380 мг; 40%).
Rf (EE/HEP 2/1) = 0,15 MS (DCl) = 487 (M+ + H)
h) 1- [(2'-сульфонамидобифенил-4-ил)-метил] -2-n-бутил-4- хлороимидазол-5-карбоксальдегид, 280 мг (0,58 ммол) соединения 1g) в 7 мл метанола и 14 мл H2O смешивают с 110 мг (2,88 ммол) гидроокиси натрия и нагревают 4 ч до кипения. После охлаждения до комнатной температуры при помощи 4 и HCl устанавливают pH около 6 и экстрагируют 3 х с 30 мл EE, сушат EE-фазы (Na2SO4) и сгущают, причем получают 190 мг титульное соединение.
Rf (EE/HEP 3/1) = 0,45 MS (DCl) = 432 (M+ + H).
i) 1-[(2'-фениламинокарбониламиносульфонилбифенил-4-ил)- метил] -2'-бутил-4-хлоро-имидазол-5-карбоксальдегид.
730 мг (1,69 ммол) соединения 1) нагревают в 10 мл фенилизоцианата до 80oC. Через 4 ч сгущают и хроматографируют на SiO2 (растворитель EE/HEP (2/1), причем образуют 400 мг титульное соединение.
Rf (EE/HEP 2/1) = 0,15 MS (DCI) = 551 (М++H).
Альтернативное получение соединения id (4' -метил-2-N,N- диметиламиноформилсульфонамид).
К 11 г (37,9 ммол)
2-N, N-диметиламиноформилсульфонамидобромбензола (полученного из 2-броманилина аналогично 1b - 1d); 1 г трифенилфосфина, 8 г Na2CO3 в 150 мл толуола и 40 мл H2O добавляют в атмосфере аргона сначала 420 мг Pd (OAc)2 и затем 5,66 г (41,9 ммол) 4-толилбороновой кислоты в 100 мл этанола. Затем нагревают 4 ч до кипения. После этого сгущают и поглощают в 500 мл сложного этилового эфира уксусной кислоты и 500 мл H2O. Образующийся осадок отфильтровывают и характеризуют как титульное соединение. Фазу сложного эфира уксусной кислоты отделяют, сушат (Na2SO4) и сгущают. Хроматография на SiO2 с сложным этиловым эфиром уксусной кислоты дает другую часть титульного соединения (всего 7,6 - 66%).
Альтернативное получение 2-бромбензолсульфонамида (аналогичной промежуточной стадии к 1c).
В 4,7 г 2-бромтиофенила в 60 мл H2O вводят при 0-10oC в течение 30 мин газообразный Cl2. После этого перемешивают 30 мин при 0oC и затем без охлаждения в течение 30 мин продувают через раствор воздух. После добавки 60 мл ацетона и повторного охлаждения до 0oC медленно закапывают 10 мл насыщенного NH4 OH-раствора. Еще через 30 мин устанавливают величину pH раствора при помощи 4 н HCl до величины 3 и получают фильтрование продукта.
Выход 4,5 г (77%).
Точка плавления = 190-191oC.
Пример 3. Синтез 1- [(2' -n-пропиламинокарбониламиносульфонилбифенил-4-ил)- метил] -2 n-бутил-4-хлороимидазол-5-карбоксальдегида осуществляли аналогично примеру 1.
Rf (EE) = 0,6 MS (FAB) = 517 (M+ + H)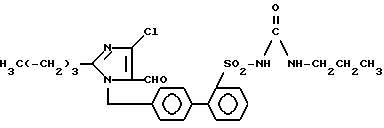 .
.
Пример 3. Синтез 1- (2'-пиридил-2-аминокарбониламиносульфонилбифенил-4-ил) метил -2-n-бутил-4-хлороимидазол-5-карбоксальдегида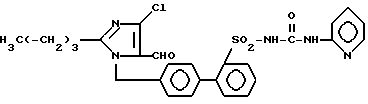 ,
,
a) 1- [(2'-этоксикарбониламиносульфонилбифенил-4-ил)-метил] -2- n-бутил-4-хлоро-имидазол-5-карбоксальдегид.
К 1,1 г (2,5 ммол) соединения Ih) и 0,78 г (5,6 ммол) карбоната калия в 20 мл сухого DME добавляют 0,48 мл (5,1 ммол) сложного этилового эфира хлормуравьиной кислоты. Через 1 ч охлаждают до комнатной температуры и смешивают с 50 мл 10%-ного раствора KH2PO4. После экстракции с EE сушат с Na2SO4 и сгущают. Хроматография на SiO2 с EE/HEP (2/1) в качестве растворителя дает 840 мг титульного соединения. Rf (EE/HEP 2/1 = 0,32 MS (DCI) = 504 (M+ + H).
b) 1- 1(2'-пиридил-2-аминокарбониламиносульфонилбифенил-4-ил)-метил -2-n-бутил-4-хлоро-имидазол-5-карбоксальдегид.
150 мг (0,3 ммол) соединения 3a) и 28,5 мг (0,3 ммол) 2-аминопиридина нагревают в 8 мл сухого толуола 2 ч до кипения. Затем сгущают и хроматографируют на SiO2 (растворитель EE), причем образуют 34 мг титульного соединения.
Rf (ЕЕ/метанол 10/1) = 0,4 MS (FAB) = 552 (M++1).
Соединения примеров 4 - 39 можно синтезировать аналогично примеру 3. (см. табл. 2)
Эти соединения имеют следующую общую формулу (A)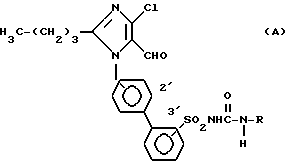 .
.
Пример 40. Синтез 1-[(2' -фениламинокарбониламиносульфонилбифенил-4-ил)-метил] -2-n-бутил-4-хлоро-5-гидроксиметилимидазола.
100 мг (0,18 ммол) соединения 1) растворяют в 5 мл этанола и смешивают при комнатной температуре с 10 мг (0,27 ммол) борогидрида натрия. Через 20 ч добавляют 10 мл 5%-ного раствора бисульфата натрия и экстрагируют 3 х с EE. Органическую фазу сушат при помощи Na3SO4 и сгущают. Хроматография на SiO2 с EE/HEP (3/1) дает 55 мг заглавного соединения.
Rf (EE/HEP 3/1) = 0,25 MS (DCI) = 553 (М++H).
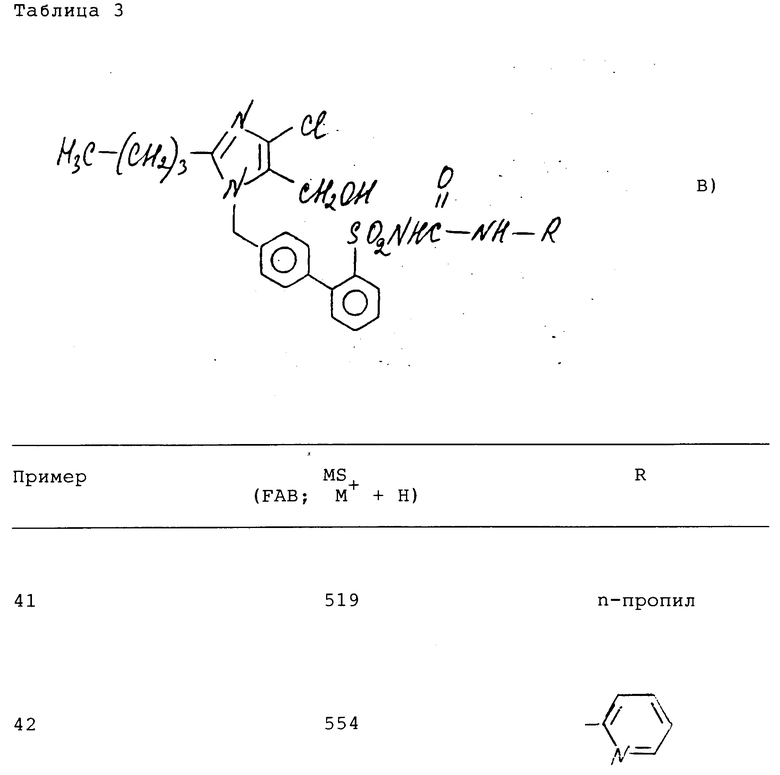
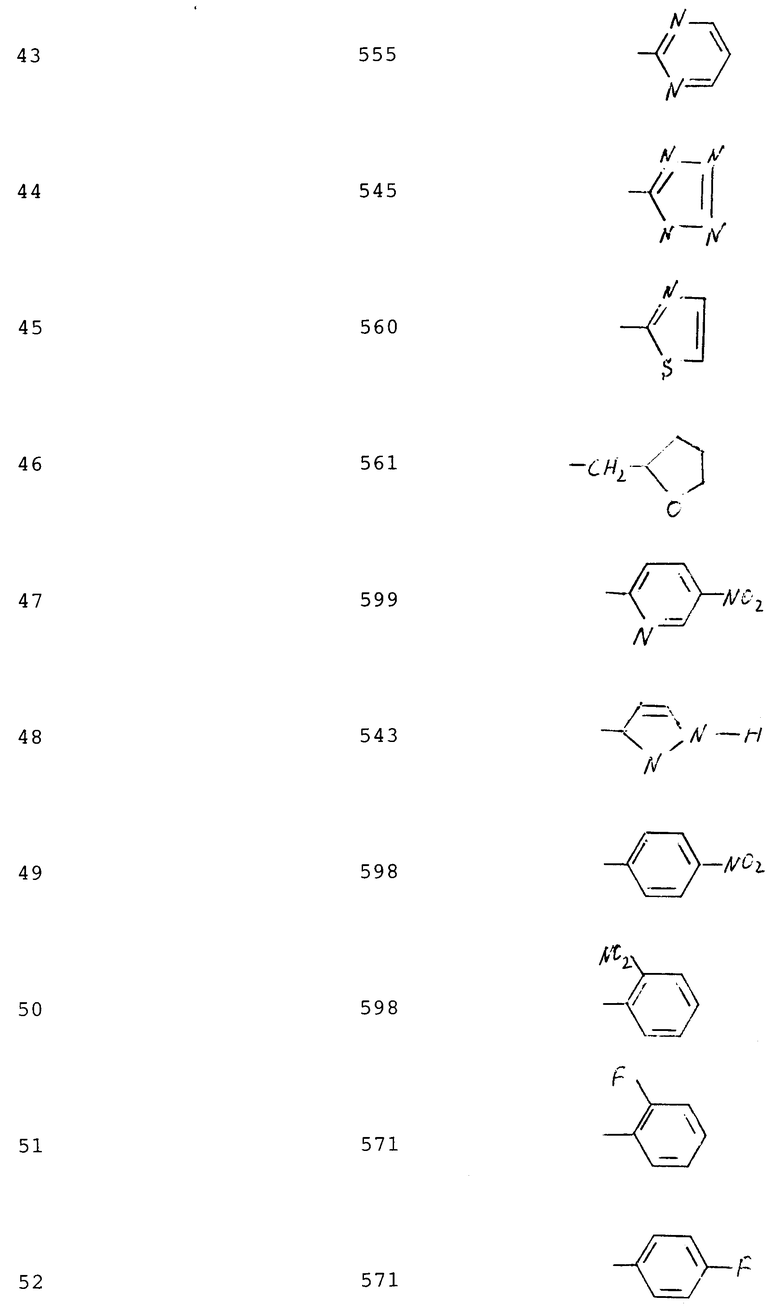
Соединения (см. формулу B) примеров 41-54 синтезируют аналогично примеру 40 из соединений примеров 2,3 и 16-27 (табл. 3).
Пример 55. Получение 1- [(2'-аллиламинокарбониламиносульфонилбифенил-4-ил)-метил] -2-n-бутил-4-хлоро-имидазол-5-карбоксальдегида .
.
730 мг (1,69 ммол) соединения Ih) нагревают в 10 мл аллилизоцианата до 80oC. Через 4 ч сгущают и хроматографируют на SiO2 (растворитель EE/HEP (2/1), причем получают 400 мг заглавного соединения.
Rf (EE/HEP 2/1) = 0,15 MS (FAB) = 515 (M+ + H)
Пример 56. Получение 1-[(2'-аллиламинокарбониламиносульфонилбифенил-4-ил)-метил] -2-n-бутил-4-метилтио-имидазол-5-карбоновой кислоты.
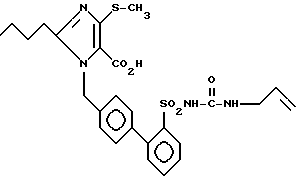 ,
,
a) Сложный этиловый эфир 2-амино-2-циано-уксусной кислоты.
К 35 г (0,246 мол) 2-оксима-сложного этилового эфира 2- цианоглиоксиловой кислоты в 350 мл H2O и 280 мл насыщенного раствора бикарбоната натрия при комнатной температуре добавляют частями (15 мин) 119 г дитионита натрия. Затем нагревают 1 ч до 35oC; потом насыщают NaCl и экстрагируют 5 х дихлорметаном. После сушки хлористым кальцием сгущают органическую фазу. Получают 11,8 г заглавного соединения как масло.
Rf (CH2Cl2/CH3OH 9/1) =0,6
b) Сложный этиловый эфир 2-циано-2-n-бутилкарбониламиноуксусной кислоты.
В 3,6 г (28,09 мол) соединения 56а) и 50 мл сухого CH2Cl2 и 2,3 мл (28,09 ммол) пиридина закапывают при от -5oC до 0oC 3,39 мл (28,09 ммол) хлористого валероила в 5 мл CH2Cl2. Затем перемешивают 1 ч при комнатной температуре. Потом промывают органическую фазу 3 х H2O и 1 х насыщенным раствором NaCl, сушат при помощи хлористого кальция и сгущают.
Кристаллизация из DIP дает 1,7 г заглавного соединения.
Rf (CH2Cl2/CH3OH 9/1) = 0,35.
Точка плавления: 87oC.
с) Сложный этиловый эфир З-амино-2-n-бутилкарбониламино-метилтиакриловой кислоты.
К 2,9 г (13,67 ммол) соединения 56 б) и 0,19 мл (1,36 ммол) триэтиламина и 60 мл абсолютного этанола добавляют при комнатной температуре 2 мл (27,26 ммол) конденсированного метилмеркаптана. Через 3 дня добавляют еще 0,5 мл метилмеркаптана. Через следующие 24 ч при комнатной температуре впрыскивают еще 0,5 мл метилмеркаптана и 0,19 мл триэтиламина и перемешивают еще 24 ч при комнатной температуре. Затем удаляют растворитель и кристаллизуют остаток из DIP, причем образуются 2,4 г заглавного соединения.
Rf (CH2Cl2/EE 4/1) = 0,3.
Точка плавления: 120oC.
d) Сложный этиловый эфир 2-n-бутил-4-метило-имидазол-5-карбоновой кислоты.
В 4,17 г (20,0 ммол) пентахлорида фосфора в 20 мл CH3Cl2 закапывают при -78oC 2,44 г (20,0 ммол) 4-диметиламинопиридина в 12 мл CH2Cl2. Через 5 мин закапывают 2,42 г (10,0 г ммол) соединения 56c в 25 мл CH2Cl2. Затем доводят до комнатной температуры и разбавляют 30 мл CH2Cl2. Через 2 ч при охлаждении льдом добавляют 300 мл 1 н раствора бикарбоната натрия и перемешивают 1 ч. Потом отделяют фазы, экстрагируют водную фазу 3 х с EE и сушат соединенные органические фазы при помощи хлористого кальция. Хроматография на SiO2 с CH2Cl2/EE 9/1).
Rf (CH2Cl2/EE 9/1) = 0,6 MS (DCI) = 243 (M+ + H)
e) Сложный этиловый эфир 1-[(2'-сульфонамидобифенил-4-ил)- метил] -2-n-бутил-4-метилтио-имидазол-5-карбоновой кислоты.
К 1,35 г (2,5 ммол) сложного этилового эфира 1- (2'- -диметиламиноформилсульфонамидобифенил-4-ил)-метил -2-n-бутил-4-метилтио-имидазол-5-карбоновой кислоты полученного из примера 56d) и примера 1e) аналогично примеру 1g) в 30 мл метанола добавляют 15 мл концентрированной HCl. Через 20 мин при флегме охлаждают до комнатной температуры и при помощи 2 н раствора NaOH устанавливают величину pH= 5-6. Затем экстрагируют 3 х по 100 мл EE, сушат органические экстракты при помощи Na2SO4 и сгущают, причем заглавное соединение получают как пену, которую без последующей очистки применяют для следующей стадии реакции.
Rf (EE/HEP 1/1) = 0,2 MS (FAB) = 488 (M+ + H)
f) Заглавное соединение 56 получают в результате того, что 120 мг сложного этилового эфира 1- [(2'-аллиламинокарбониламино-сульфонил-бифенил-4-ил)-метил] -2-n-бутил-4-метилтиоимидазол-5-карбоновой кислоты (полученного аналогично примеру 55) в 10 мл этанола и 1 мл 2 н раствора гидрокиси натрия перемешивают 4 для при комнатной температуре. После этого сгущают, добавляют H2O и при помощи 1 н HCl устанавливают величину pH=4, причем заглавное соединение осаждают и отделяют фильтрованием.
Rf (EE/MeOH 10/1) = 0,1 MS (FAB) = 543 (M+ + H)
Пример 57. Синтез 1-[(2'-пиридиэтил-2-аминокарбониламиносульфонилбифенил-4-ил)-метил] -2-n-бутил-4-метилтиоимидазол-4-карбоновой кислоты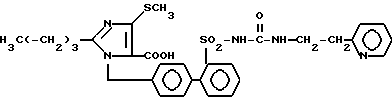 ,
,
a) Сложный этиловый эфир 1-[(2'-этоксикарбониламиносульфонилбифенил-4-ил)-метил] -2-n-бутил-4-метилтиоимидазол-5-карбоновой кислоты.
1,21 г (2,5 ммол) соединения 56e) и 0,78 г (5,6 ммол) карбоната калия в 20 мл сухого DME нагревают до кипения и добавляют 2,48 мл (5,1 ммол) сложного этилового эфира хлормуравьиной кислоты. Через 1 ч охлаждают до комнатной температуры и смешивают с 50 мл 10%-ного раствора KH2PO4. После экстракции с EE сушат при помощи Na2SO4 и сгущают. Хроматография на SiO2 с EE/MEP (2/1) в качестве растворителя дает 840 мг заглавного соединения.
Rf (EE/HEP 2/1) = 0,5 MS (DCI) = 559 (M+ + H)
b) Сложный этиловый эфир 1-[(2'-пиридилэтил-2-амминокарбонил-аминосульфонилбифенил-4-ил)-метил] - 2-n-бутил-4-метилтиоимидазоло-5-карбоновой кислоты 168 мг (0,3 ммол) соединения 57 a) и 37 мг (0,3 ммол) 2-(2-аминоэтил)-пиридина нагревают в 8 мл сухого толуола 2 ч до кипения. Затем сгущают и хроматографируют на SiO2 (растворитель EE), причем образуются 34 мг заглавного соединения.
Fr (EE) = 0,15 MS (FAB) = 636 (M+ + H)
c) Заглавное соединение 57 получают аналогично 56 f).
Rf (EE/MeON 5/1) = 0,1 MS (FAB) = 608 (M+ + H)
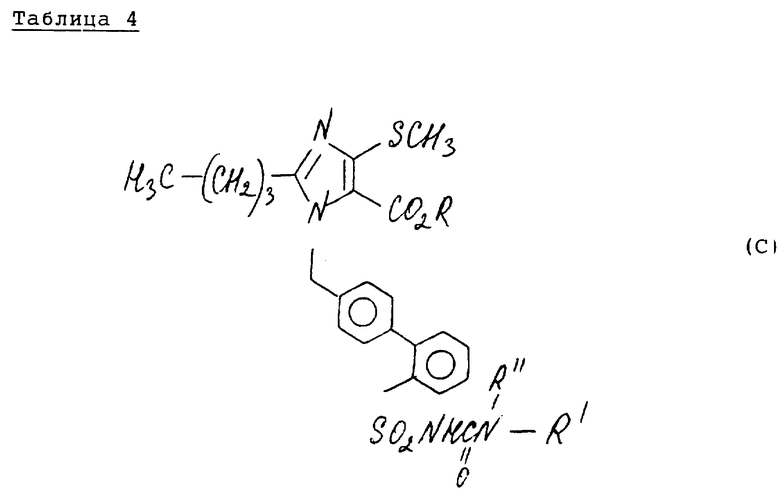
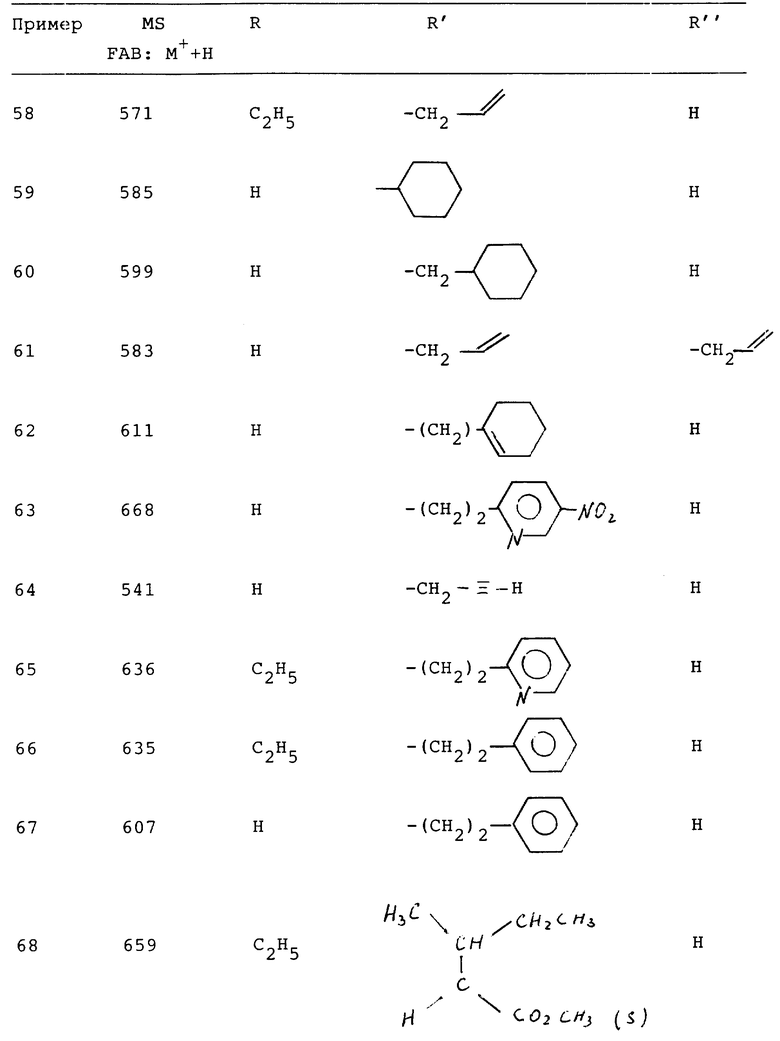
Аналогичным образом, как описано в примере 57, можно синтезировать соединения следующей табл. 4.
Эти соединения имеют формулу (C)
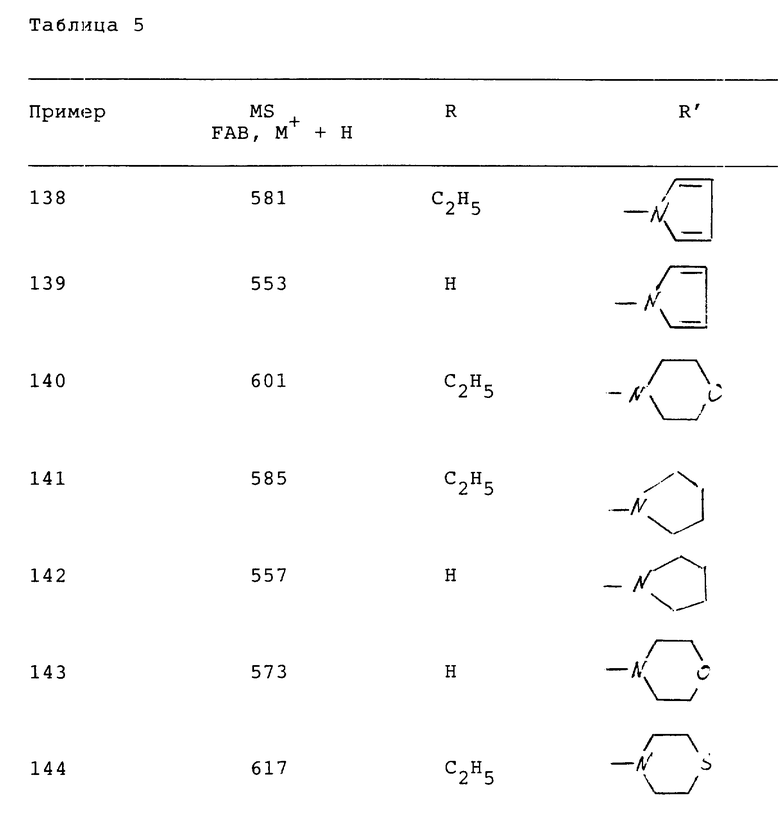
Соединения следующей табл. 5 можно синтезировать аналогично примеру 57.
Эти соединения имеют следующую формулу (D).
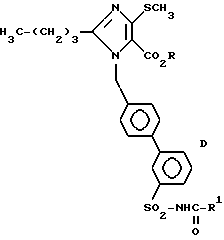
Пример 150. Получение 1-{[(2'-бензоилоксикарбониламиносульфонил)-бифенил-4-ил]-метил} -2-n-бутил-4-хлоро-имидазол-5-карбальдегида.
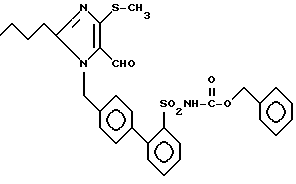 .
.
Заглавное соединение 150 получают нагреванием 215 мг (0,5 ммол) соединение lh), 71,3 мл (0,5 ммол) сложного бензилового эфира хлормуравьиной кислоты и 70 мг (0,5 ммол) K2CO3 в 10 мл DMF (безводного) 1,5 ч при флегме. Затем сгущают, добавляют 100 мл EE и промывают по 1 х 40 мл раствора NaHSO4 и раствора NCl. Органическую фазу сушат над Na2SO4 и вращают. Хроматография с MBT дает 120 мг (42%) заглавного соединения 150 T.пл. = 56oC.
Rf (MTC) = 0,20 MS (FAB) = 566 (М+ + H)
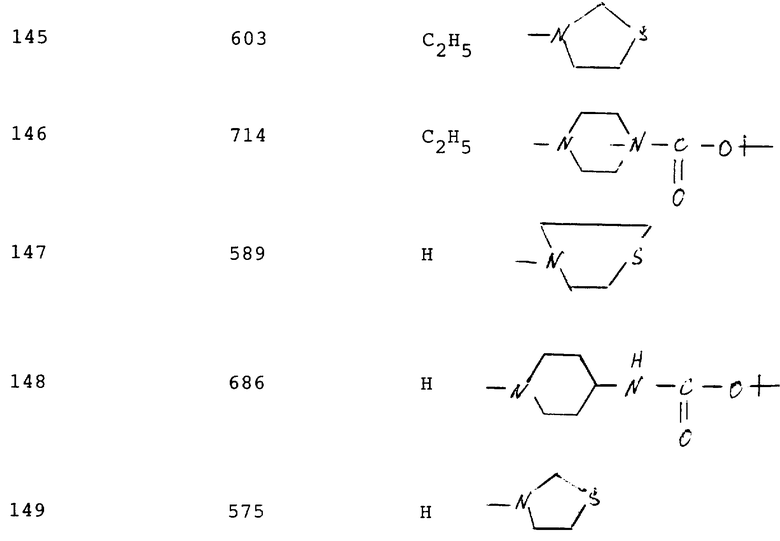
Соединения следующей табл. 6 можно синтезировать аналогично примеру 150 или 57a.
Эти соединения имеют следующую формулу (E).
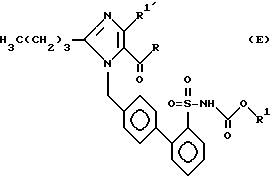 ,
,
Пример 178. Получение сложного этилового эфира 1-[(2'-диметилсульфамоиламиносульфонил-бифенил-4-ил)-метил-] 2-n-бутил-4-метилтио-имидазол-5-карбоновой кислоты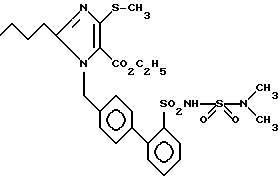 .
.
Заглавное соединение 178 получают нагреванием 244 мг (0,5 ммол) соединения 56 e), 108 мл (1,0 ммол) хлористого сульфамоила и 140 мг (1,0 ммол) K2CO3 в 10 мл DMF (безводного) 5 дней при флегме. Разбавляют 50 мл EE и промывают 50 мл KHSO4/H2SO4 (pH = 1,0). Органическую фазу сушат над Na2SO4 и вращают. Хроматография с EE дает 69 мг (23%) бесцветного масла.
Rf (EE) = 0,15 MS (FAB) = 617 (M+ + Na)
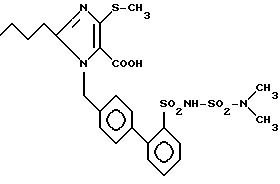
Пример 179. Получение 1-[1-(2'-диметилсульфамоиламиносульфонилбифeнил-4-ил)-метил] -2-n-бутил-4-метилтио-имидазол-5-карбоновой кислоты.
 .
.
50 мг (84 ммол) заглавного соединения примера 178 и 0,84 мл 1 н NaOH растворяют в 3 мл этанола и перемешивают 2 дня при комнатной температуре. Этанол отгоняют, добавляют 5 мл H2O и при помощи HCl устанавливают величину pH = 2. Осадок промывают 2 х с 1 мл воды и сушат в вакууме. Получают 33 мг (70%) бесцветного порошка.
Rf (EE/метанол 5:1) = 0,11 MS (FAB) = 567 (М+ + H).
Пример 180. Сложный этиловый эфир 1-[(2'-аллилоксикарбониламиносульфонилбифенил-4-ил)метил] -2-n-бутил-4-метило-имидазол-5-карбоновой кислоты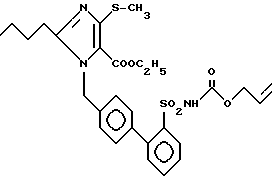 .
.
244 мг (0,5 ммол) соединения 56 e), 106 мл (1,0 ммол) сложного аллилового эфира хлормуравьиной кислоты и 140 мг (1,0 ммол) K2CO3 кипятят 1 ч при флегме. Затем добавляют 50 мл 10%-ного раствора KHSO4 и экстрагируют 3 х по 50 мл EE. Органическую фазу сушат над Na2SO4 и выпаривают. Хроматография с MTB/DIP 1:1 дает 115 мг (40%) бесцветного масла.
Rf (MTB/DIP 1:1) = 0,15 MS (FAB) : 572 (M+ + H).
Пример 181. Синтез 1-[(2'-аллилоксикарбониламиносульфонил-бифенил-4-ил)метил] -2-n-бутил-4-метилтио-имидазол-5-карбоновой кислоты.
95 мг (0,17 ммол) соединения 180 омыляют, как в примере 179. Получают 30 мг (33%) бесцветной пены.
Rf (EE/MeOH 10:1)=0,1 MS(FAB) =544
Пример 182. Сложный этиловый эфир 1-[(2'-бензилокарбониламиносульфонил-бифенил-4-ил)метил] -2-n-бутил-4-метилтио-имидазол-5-карбоновой кислоты.
 .
.
Заглавное соединение синтезируют аналогично примеру 180.
Rf (MTB-DIP 1:1) = 0,15 MS (FAB) = 622 (M+ + H).
Пример 183. 1-[(2' -бензилоксикарбониламиносульфонил-бифенил-4-ил)метил] -2-n-бутил-4-метилтио-имидазол-5-карбоновая кислота .
.
Заглавное соединение синтезируют аналогично примеру 181.
Rf (EE/MeOH 10:1) = 0,1 MS (FAB) - 594 (M+ + H)
Пример 184. 1-{ [2'-аллиаламинокарбониламиносульфонил]-бифенил- 4-ил-метил}-2-n-бутил-4-метокси-имидазол-5-карбальдегид ,
,
a) 1-[2'-сульфонамидобифенил-4-ил)-метил] -2-n-бутил-4-метоксиимидазол-5-карбальдегид.
215 мг (0,5 ммол) соединения lh) и 1,5 мол 1 н NaOH кипятят в 10 мл метанола 19 ч при флегме. Затем метанол вращают, при помощи раствора NaHSO4 устанавливают pH= 2 и экстрагируют 3 х по 50 мл EE. Органическую фазу сушат над Na2SO4 и вращают. Хроматография с MTB/DIP (1:1) дает 170 мг (80%) заглавного соединения, точка плавления: = 189oC.
Rf (MTB/DIP 1:1) = 0,19 MS (DCI)=426(M+ + H).
b) Заглавное соединение 184 получают в результате кипячения 150 мг (0,35 ммол) соединения 184 a) и 3 мл аллилизоцианата 5 ч при флегме. Затем вращают и хроматографируют с EE. Получают 60 мг (34%) бесцветной пены.
Rf (EE) = 0,34 MS (FAB) = 511 (M+ + H).
Пример 185. 1-{[(2'-этоксикарбониламиносульфон)-бифенил-4-ил]-метил} -2-n-бутил-4-метокси-имидазол-5-карбальдегид .
.
1,0 г (2,34 ммол) соединения 184 а) растворяют в 50 мл ацетона (безводного) и присоединяют 560 мг K2CO3. Нагревают до флегмы, затем при этой температуре медленно впрыскивают 0,45 мл сложного этилового эфира хлормуравьиной кислоты. Нагревают еще 4 ч при флегме, затем вращают. При помощи раствора NaHSO4 подкисляют до pH = 2, потом экстрагируют 3 х по 100 мл EE. Сушат над Na2SO4, затем вращают и хроматографируют с MTB /DIP/ HOAc (15:83: 2). Полученное масло можно кристаллизовать с простым диэтиловым эфиром. Получают 550 мг бесцветных кристаллов с точкой плавления 134oC.
Rf (MTB) = 0,24 MS (FAB) = 500 (M+ + H)
Пример 186. 1-{[(2'-бензилоксикарбониламиносульфонил)-бифенил-4-]-метил} -2-n-бутил-4-метокси-имидазол-5-карбальдегид.
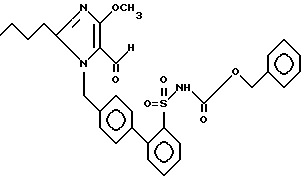 .
.
Пример 186 синтезируют аналогично примеру 185.
Rf (МТВ) = 0,16 MS (FAB) = 562 (M+ + H)
Пример 187. Сложный этиловый эфир 1-{[(2' -бензиламинокарбониламиносульфонил-бифенил-4-ил]-метил} -2-n -бутил-имидазол-5-карбоновой кислоты.
 .
.
К 150 мг (0,24 ммол) соединения примера 73, растворенного в 50 мл MeOH, и 5 мл HOAc присоединяют каталитическое количество Pd/C. Смесь перемешивают в H2-атмосфере 12 ч при комнатной температуре. Затем смесь вращают и хроматографируют с EE. Получают 30 мг (22%) бесцветной пены.
Rf (EE) = 0,42 MS (FAB) = 575 (M+ + H)
Пример 188. Сложный этиловый эфир 1-{[(2-этоксикарбониламиносульфонил)-бифенил-4-ил]-метил} -2-n-бутил-имидазол-5-карбоновой кислоты.
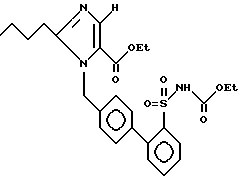 .
.
К 300 мг (0,5 ммол) соединения 57 a), растворенного в 10 мл E OH, добавляют около 200 мг никеля Ренея. Нагревают 10 ч и при флегме, добавляют остальные 200 мг на никель Ренея и снова нагреваю 5 ч при флегме. Катализатор отфильтровывают и растворитель вращают. Остаток хроматографируют с MTB и получают 50 мг (18%) бесцветной пены.
Rf (EE) = 0,27 MS (FAB) = 514 (М+ + H).
Пример 189. Сложный этиловый эфир 1- [(2'-{2-тиенилсульфониламино-сульфонил} -бифенил-4-ил)-метил] -2-n-бутил-4-метилтиодазол-5-карбоновой кислоты.
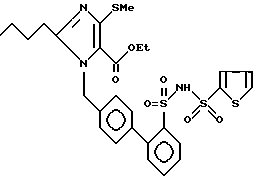 .
.
244 мг (0,5 ммол) сульфонамида примера 56 e) растворяют в 10 мл простого диэтиленгликольдиметилового эфира (безводного). Затем добавляют 346 мг (2,5 ммол) K2CO3 и 81 мг (0,5 ммол) хлористого 2-тиенилсульфонила. Нагревают 2 ч при флегме, затем выливают охлажденную реакционную смесь в 50 мл 50%-ного раствора NaHSO4 и экстрагируют 3 х по 50 мл EE. Сушат над Na2SO4, вращают и хроматографируют с EE. Получают 310 мг бледно-желтых кристаллов, точка плавления = 120 - 122oC.
Rf (EE) = 0,24 MS (FAB) = 634 (М+ + H)
Пример 190. 1-[2'{2-тиенилсульфониламиносульфонил}-бифенил-4-ил)метил] -2-n-бутил-4-метилтио-имидазол-5-карбоновая кислота.
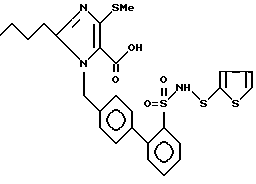 .
.
Омыление сложного этилового эфира из примера 189 происходит аналогично примеру 56 f).
Rf (EE/MeOH 5:1) = 0,13 MS (FAB) = 606 (М+ + H).
Соединения следующей табл. 7 можно синтезировать аналогично примеру 189 или аналогично примеру 190 (или 56 f).
Эти соединения имеют следующую формулу F).
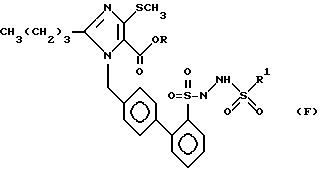 .
.
Пример 195. Сложный этиловый эфир 1-[(2'-метиламинокарбониламиносульфонил-бифенил-4-ил)-метил] -2-n-бутил-4-метилтио-имидазол-5-карбоновой кислоты.
В автоклаве к 1 г сульфонилкарбамата из примера 57 a) в 50 мл толуола при 80oC вводят в течение 5 мин меиламин. Затем нагревают 8 ч до 80oC. После этого сгущают в вакууме и остаток хроматографируют на силикагеле (EE/n-HEP 2/1), причем заглавное соединение получается как аморфный порошок.
Rf (EE/n-HEP 2/1) = 0,1 MS (PAB) = 545 (M+ + H).
Аналогичным образом, как в примере 195 или в примере 56f), можно синтезировать соединения следующей табл. 8 (приведено также соединение из примера 195).
Эти соединения имеют формулу C.
 .
.
Пример получения соли (дикалиевая соль соединения согласно примеру 106):
Дикалиевая соль 2-бутил-4-(метилтио)-1-((2'-((((пропиламино)- карбонил)амино)сульфонил)-(1,1'-бифенил)-4-ил)метил) -1H-имидазол-5-карбоновой кислоты
К охлажденной (3-5oC) суспензии соединения примера 105 (2 г, 3,5 ммолей) в этаноле (40 мл) прибавляют по каплям 6N KOH (2,3 мл, 13,8 ммолей). Реакционную смесь оставляют для нагревания до комнатной температуры и перемешивают 72 ч. Сырой осадок отфильтровывают, промывают 96% этанолом и получают 1,92 г (89%) 2-бутил-4-(метилтио)-1-((2'-((((пропиламино)-карбонил)амино) сульфонил)-(1,1'-бифенил)-4-ил)метил)-1H-имидазол-5-карбоновой кислоты в виде бесцветных кристаллов дикалиевой соли: т. пл. > 260oC; Элементный анализ (C26H30 K2N4O5S2), C, H, N, S;
1H ЯМР (Д2O) 0,77 (т, 2H), 1,31 (м, 4H), 1,58 (м, 2H), 2,47 (с, 3H), 2,72 (т, 2H), 2,80 (м, 2H), 5,63 (с, 2H), 7,05- 7,32 (AA'BB',4H), 7,25 (д, 1H), 7,56 (м, 2H), 9,04 (д, 1H); MS (FAB) m/e 621 (M + 1).
Действие дикалиевой соли 2-бутил-4-(метилтио)-1-((2'-((((пропиламино) карбонил)амино)сульфонил)-(1,1'-бифенил)-4-ил)метил)-1Н-имидазол-5- карбоновой кислоты (HR720) на систолическое артериальное кровяное давление у крыс-гипертоников с пониженным потреблением натрия.
Эксперимент выполняют на собаках-гипертониках (Beagle, 15 - 21 кг) каждого пола. За несколько месяцев до эксперимента и при анестезии две почки собак обертывают целлофаном (метод Page). Вторую операцию проводят для введения радиотелеметрического устройства (Data Sciences, Mn) для регистрации кровяного давления. За 17 ч до эксперимента вводят фуросемид (Hoechst) в дозе 10 мг/кг при подкожном введении и за 1 ч до препарата вводят внутривенно в дозе 10 мг/кг для того, чтобы повысить примерно в 6 раз активность ренита в плазме. При желудочном введении вводят пустые капсулы контрольной группе и HR720 в дозе 3 мг/кг опытной группе. Систолическое артериальное кровяное давление регистрируют в течение 30 ч после введения с интервалом в 2 ч.
Пример 1. Приготовление средства для орального применения:
1000 таблеток, содержащие каждая 20 мг 2-n-бутил-1-[(2' n-пропиламино-карбониламино-сульфонил-бифенил-4-ил)метил] - 4-метилтио-имидазол-5-карбоновой кислоты, приготавливаются с применением следующих вспомогательных средств:
2-n-бутил-1- [(2'n-пропиламинокарбониламиносульфонил-бифенил-4-ил)метил] - 4-метилтио-итидазол-5-карбоновой кислоты - 20,0 г
Кукурузный крахмал - 140,0 г
Желатина - 7,5 г
Микрокристаллическая целлюлоза - 2,5 г
Стеарат магния - 2,5 г
2-n-бутил-1- [2'n-пропиламинокарбониламиносульфонилбифенил-4-ил)метил] -4-метилтио-имидазол-5-карбоновой кислоты и кукурузный крахмал смешивают с водным раствором желатина. Смесь сушат и размалывают с получением гранулата. Смешивают с гранулатом микрокристаллическую целлюлозу и стеарат магния. Из полученного гранулата прессуют 1000 таблеток, причем в каждой такой таблетке содержатся 20 мг рецепторного антагониста ангиотензин II.
Пример 2. Аналогично примеру 1 приготавливают 1000 таблеток, каждая из которых содержит 3 мг 2-n-бутил-1- [(2'-n-пропиламинокарбониламиносульфонил-бифенил-4-ил)метил] -4-метилтиоимидазол-5-карбоновой кислоты, причем 3 г этого соединения применяют в приведенной в примере 1 композиции.
Пример 3. Желатиновые капсулы, каждая из которых содержит 20 г 2-n-бутил-1-[(2'-n-пропиламинокарбониламиносульфонил-бифенил-4-ил) метил]-4-метилтио-имидазол-5-карбоновой кислоты, начинаются следующей смесью:
2-n-бутил-1-[(2'-n-пропиламинокарбониламиносульфонил-бифенил-4-ил) метил]-4-метилтио-имидазол-5-карбоновой кислоты - 20 мг
Стеарат калия - 1 мг
Лактоза - 124 мг
Пример 4. Аналогично примеру 3 и с использованием 3 мг биологически активного вещества приготавливают желатиновые капсулы, каждая из которых содержит 3 мг 2-n-бутил-1-[(2'-n-пропиламинокарбониламиносульфонил-бифенил-4-ил) метил]-4- метилтио-имидазол-5-карбоновой кислоты.
Пример 5. Приготовление раствора для инъекций:
2-n-бутил-1-[(2'-n-пропиламинокарбониламиносульфонил-бифенил-4-ил) метил]-4-метилтио-имидазол-5-карбоновой кислоты 1 г
Метилпарабен - 5 г
Пропилпарабен - 1 г
Хлорид натрия - 25 г
Вода для инъекций - 5 л
2-n-бутил-1-[(2'-n-пропиламинокарбониламиносульфонилбифенил-4-ил) метил] -4-метилтио-имидазол-5-карбоновой кислоты, консерванты и хлорид натрия растворяют в 3 л воды для инъекций, добавляя затем воду для инъекций до 5 л. Производят стерильную фильтрацию раствора, разливают асептически по предварительно простерилизованным склянкам, закрываемым прошедшими стерилизацию резиновыми колпачками. В каждой склянке содержится 5 мл раствора.







Использование: в качестве фармацевтической композиции, понижающей кровяное давление. Сущность изобретения: продукт: производные имидазола: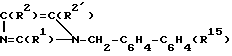 ,
,
где R' - C2-C7-алкил, R2 - галоген, C1-C3 - алкилтио, C1-C3алкокси; R2′ - CHO. COOH, CH2OH, COO(C1-C3)алкил; R15 означает группу SO2NHCONR6R9, R6 и R9 - различные и означают водород, C1-C6-алкил, который может иметь различные заместители, или R6 и R9 вместе с атомом азота образуют C5-C6-гетероарильное кольцо и др. 3 с. и 6 з. п., 8 табл.

или их физиологически переносимые соли,
где R1 C2 C7-алкил;
R2 галоген, C1 C3-алкилтио, C1 - C3-алкокси;
R2′- CНО, CООН, CН2ОН, CООC1 C3-алкил;
R1 5 группа SO2NH-CO-NR6R9, где R6 и R9 различные водород, C1 C6-алкил, который может быть замещен 1 3 различными радикалами, выбранными из ряда гидроксил, фенил, карбоксил, C3 C8-циклоалкилен, C1 - C4-алкоксикарбонил, C2 C4-алкенил, который может быть замещен фенилом, C1 C3-алкоксикарбонилом, C3
C6-алкинил, C3 C8-циклоалкил, C3 - C6-циклоалкил-C1 C3-алкил, фенил, фенил-C1 - C4-алкил, который может быть замещен 1 2 одинаковыми или различными радикалами, выбранными из ряда трифторметил, метокси-, C1 - C9-гетероарил, который может быть частично или полностью гидрирован, причем в качестве гетероатома может быть 1 4 атома азота или один атом азота и один атом серы, или C1 C9-гетероарил-C1 - C3-алкил, который может быть частично или полностью гидрирован, в качестве гетероатома может содержать один атом азота или один атом азота и один атом кислорода и который может быть замещен одним радикалом, выбранным из NO2, метила, оксо, или R6 и R9 вместе с атомом азота образуют C5 C6-гетероарильное кольцо, которое может быть частично или полностью гидрировано и содержит в качестве гетероатома один атом азота и один атом кислорода или серы, или один атом азота, причем последний гетероарил может быть замещен C1 - C4-алкоксикарбониламиногруппой, или R1 5 группа -SO2NH-CO-OR6′, где R6′- C1 С6-алкил, который может быть замещен C1 - C6-алкокси, тиенилом, C3 C8-циклоалкиленом или бензилоксигруппой, C2 C5-алкенил, который может быть замещен фенилом, C3 C6-алкинил, C3 - C8-циклоалкил-C1 C3-алкил, фенил-C1 - C4-алкил, или R1 5 группа -SO2NH-SO2-OR6″, где R6″ - N-(C1 C4)2-алкил, тиенил или нитрофенил.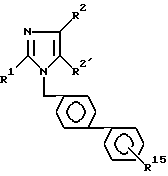
или их физиологически переносимые соли,
где R1 C2 C7-алкил;
R2 галоген, C1 C3-алкилтио, C1 - C3-алкокси;
R2′- CНО, CООН, CН2ОН, CООC1 C3алкил;
R1 5 группа SO2NH-CO-NR6R9, где R6 и R9 различные водород, C1 C6-алкил, который может быть замещен 1 3 различными радикалами, выбранными из ряда гидроксил, фенил, карбоксил, C3 C8-циклоалкилен, C1 - C4-алкоксикарбонил, C2 C4-алкенил, который может быть замещен фенилом, C1 C3-алкоксикарбонилом, C3
C6-алкинил, C3 C8-циклоалкил, C3 - C6-циклоалкил-C1 C3-алкил, фенил, фенил-C1 - C4-алкил, который может быть замещен 1 2 одинаковыми или различными радикалами, выбранными из ряда трифторметил, метокси-, C1 - C9-гетероарил, который может быть частично или полностью гидрирован, причем в качестве гетероатома могут быть 1 4 атома азота или один атом азота и один атом серы, или C1 C9-гетероарил-C1 - C3-алкил, который может быть частично или полностью гидрирован, в качестве гетероатома может содержать один атом азота или один атом азота и один атом кислорода и который может быть замещен одним радикалом, выбранным из NO2, метила, оксо, или R6 и R9 вместе с атомом азота образуют C5 C6-гетероарильное кольцо, которое может быть частично или полностью гидрировано и содержит в качестве гетероатома один атом азота и один атом кислорода или серы или один атом азота, причем последний гетероарил может быть замещен C1 - C4-алкоксикарбониламиногруппой.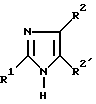
алкилируют соединением формулы III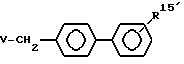
где V отщепляемая группа,
с получением соединения формулы I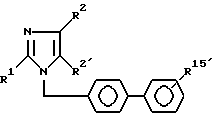
где R15′ защитная сульфамидная группа,
с последующим снятием защитной группы и полученный сульфонамид при необходимости превращают в сульфонилуретаны, или сульфонилмочевины, или сульфонилсульфонамиды формулы I.
Приоритет по пунктам:
04.01.91 по пп.5 и 6;
27.06.91 по п.1.
| EP, 324377, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1998-02-10—Публикация
1992-01-03—Подача