Изобретение относится к области исследования или анализа материалов особыми способами, а именно к способам исследования крови при действии ксенобиотиков, и может быть использовано для оценки микросомальной системы печени после воздействия малых доз иприта и люизита при реальных путях поступления ОВ (отравляющих веществ) в организм, а также при решении задач по уничтожению ХО (химического оружия) в районах военно-химических объектов, в частности по обследованию здоровья населения и обслуживающего персонала в местах по хранению и уничтожению ХО.
К настоящему времени в практике исследования биоматериалов особыми способами для контроля тех или иных органов, систем органов существуют различные способы оценки состояния здоровья организма. Разработанные способы отличаются по аналитическому принципу, последовательности анализа и имеют различные биохимические параметры, характеризующие определенные процессы в организме. В настоящем описании приведены основные способы исследования, связанные с обоснованием комплекса показателей, отражающих степень повреждения организма.
Ранее в экспериментальной практике проводили оценку состояния I и II фаз детоксикации ксенобиотиков после воздействия на организм токсичных соединений, например, таких как стирол, формальдегид, ацетон, фенол, СО, NO, SO2, Pb(NO3)2, NaNO3, FeSO4 с помощью определения цитохрома P450, цитохрома b5 печени, активности УДФ-глюкуронилтрансферазы и анализа скорости реакций N-деметилирования (амидопирина), гидроксилирования (анилина) (Muhambetova L.H. , Dolinskaya S.J., Nasonova A.A., Avaliani S.L. // Cytochrome P450 Biochem. and Biophys. : Proc. 7-th Int, Conf. Biotechnol. and Ecol. Aspects, Moscow, July 28-Aug, 2, 1991, Moscow, 1992, p. 580-582).
Однако данный подход имеет ряд недостатков. Во-первых, для анализа содержания ферментов печени необходим гомогенат ткани печени, то есть эксперименты проводятся "in vitro". Кроме того, метод дает ограниченную информацию, характеризуя I и II фазы детоксикации ксенобиотиков, не затрагивая вопросы содержания вещества в плазме крови, способности организма к элиминации, распределения ксенобиотика по органам и тканям, а также времени задержки соединения в организме.
Одним из информативных методов оценки функционирования метаболизирующих ферментных систем является фармакологическое зондирование. Но данный подход используется только в медицинской практике, в основном, для определения терапевтических доз лекарственных препаратов, в стационарных условиях лечения, при различной патологии печени (Бендиков Э.А., Логинов А.С., Петраков А.В. "Фармакокинетика и метаболизм антипирина у больных с хроническими поражениями печени". Методы индивидуализации и оптимизации применения лекарств на основе изучения их фармакокинетики. - М., 1982, ч. 2, с. 116-120).
Что касается отравляющих веществ кожно-нарывного действия, то на протяжении многих десятилетий, в основном, оценивалась их токсичность, тогда как изучение воздействия малых (пороговых) доз этих ОВ на организм с позиций оценки вредного воздействия практически не изучалась.
В медицинской практике также возможен прогноз развития хронического гепатита В при иммуноферментном анализе сыворотки крови, но в этом случае оценивается состояние организма при поражении вирусом, а не отравляющими веществами (G 01 N 33/535, А.Б. Жаляускас "Способ прогнозирования развития хронического гепатита В." Изобретения, 1992, N 28, с. 182).
Возможность определения кожно-резорбтивного действия химических веществ описана в способе-прототипе (G 01 N 33/48, В.И. Жуков, В.М. Кривоносов, Л.А. Бондаренко и др. "Способ определения кожно-резорбтивного действия химических веществ. " Изобретения, 1992, N 30, с. 181 - прототип), основанного на обработке сыворотки крови и мочи 0,5%-ным раствором перекиси водорода с последующим измерением интенсивности сверхслабого свечения биологической жидкости до и после обработки. По изменению интенсивности слабого свечения определяют кожно-резорбтивное действие химических веществ. Однако с помощью способа-прототипа невозможно выявить характер повреждающего действия внутри организма, происшедшего после нанесения вещества на кожу, а также провести прогноз происходящих адаптационно-компенсаторных процессов или процессов, приводящих к усилению интоксикации, а значит поражению организма. С этой точки зрения предлагаемый способ может быть успешно применен при установлении диагноза о глубине поражающего действия ОВ и необходимости проведения соответствующей терапии в стационарных условиях лечения.
Задачей настоящего изобретения является оценка микросомальной системы печени при действии на организм малых доз кожно-нарывных ОВ, повышение качества исследований за счет определения параметров, характеризующих адаптационно-компенсаторные процессы организма.
Поставленная задача достигается тем, что по динамике концентрации фармзонда в крови оценивают активность микросомальных ферментов печени, участвующих в его детоксикации до и после воздействия вещества на организм.
Отличие данного изобретения от способа-прототипа состоит в том, что в способе-прототипе биологическая жидкость обрабатывается 0,5%-ным раствором перекиси водорода и по измерению интенсивности сверхслабого свечения биоматериала определяется кожно-резорбтивное действие химических веществ. Использование же фармзонда позволяет характеризовать адаптационно-компенсаторные процессы, происходящие в печени по разнице в элиминации фармзонда до и после воздействия ОВ с привлечением жидкостной обращенно-фазовой хроматографии, предоставляет судить о характере повреждающего фактора (химического) на организм в целом, что приводит к улучшению качества анализа заявляемого способа, объективной оценки процессов, происходящих в организме уже в первые сутки при реальном действии малых доз вещества, а также дает возможность провести наблюдение за биообъектом до полного его выздоровления в течение всего периода интоксикации.
Эксперименты проведены на крысах в опытах in vivo. Кровь для анализа отбирали из подъязычной вены через 1, 2, 4, 7 ч после внутрибрюшинного введения фармзонда. В качестве фармзонда обоснован карбамазепин, лекарственный препарат, относящийся к противоэпилептическим средствам, детоксикация которого проходит по эпоксиддиольному пути.
Оптимизацию параметров хроматографического разделения карбамазепина проводили в условиях жидкостной обращенно-фазовой хроматографии с использованием колонок КАХ-2 с неполярной неподвижной фазой "Сепарон С18" на жидкостном хроматографе "Милихром-1" отечественного производства. В качестве элюента использовали водно-метаноловый раствор в соотношении 55/45 об.ед. Скорость потока составляла 30 мкл/мин. Детектирование производили с помощью ультрафиолетового детектора при λ = 290 нм. Чувствительность определения вещества составляет 5•10-4 мг/мл пробы.
Анализ биопроб по определению количественного содержания карбамазепина проводили по схеме
Последовательность операций приготовления биопроб для хроматографического анализа карбамазепина.
Расчет фармакокинетических параметров осуществляли с использованием модельно-независимого метода статистических моментов. Статистическая обработка полученных результатов осуществлялась стандартными методами. Различия считались достоверными при p < 0,05.
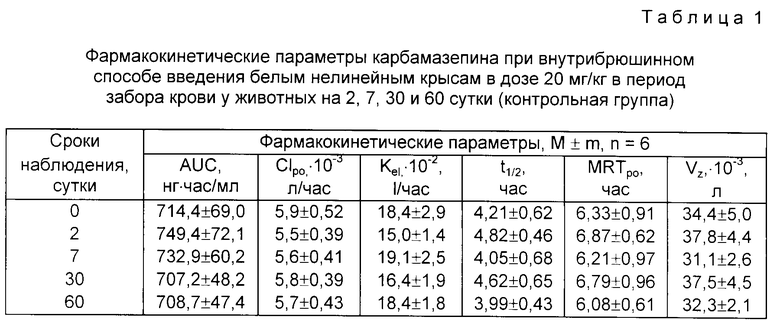
В норме у животных определяли фармакокинетические параметры карбамазепина при его внутрибрюшинном введении в дозе 20 мг/кг. По истечении двух недель этой же группе животных наносили различными способами кожно-нарывные ОВ в диапазонах малых доз и определяли фармакокинетические параметры фармзонда в разные сроки интоксикации в течение двух месяцев. Кроме того, на отдельной группе животных были определены в "норме" фармакокинетические параметры фармзонда в те же сроки взятия проб, что при обследовании животных, находившихся в опыте. Результаты по контрольной группу животных представлены в табл. 1.
Анализ данных табл. 1 показывает, что в течение всего периода наблюдений в контрольной группе животных достоверных изменений фармакокинетических параметров не наблюдается.
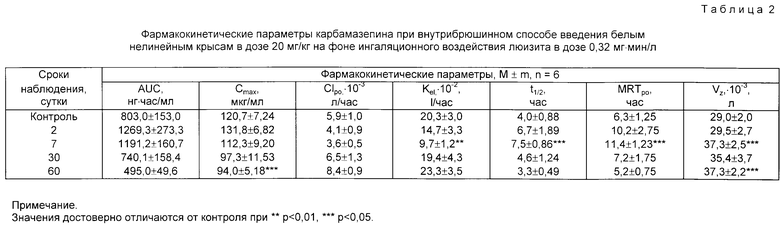
Результаты оценки процессов окислительного метаболизма с помощью карбамазепина после ингаляционного воздействия люизита представлены в табл. 2.
Приведенные в табл. 2 результаты исследований показывают, что содержание препарата в крови увеличивается после воздействия вещества на протяжении первых семи суток от начала эксперимента. Об этом свидетельствует величина AUC. Клиренс и константа элиминации фармзонда в сравнении с контролем уменьшаются в 1,6 и 2,1 раза, тогда как значения кинетического объема распределения ксенобиотика увеличиваются соответственно в 1,3 раза. На более длительное пребывание ксенобиотика в организме после воздействия вещества указывает достоверное увеличение параметра MRTpo на 7-ые сутки интоксикации по сравнению с контролем.
Таким образом, при ингаляционном воздействии малых доз люизита на организм животных наблюдается снижение процессов детоксикации, что косвенно указывает на ингибирование активности микросомальных ферментов печени.
При накожной аппликации люизита (табл. 3) максимальные различия в фармакокинетических параметрах карбамазепина выявляются на вторые сутки от начала эксперимента. При этом значения AUC и Сmax достоверно уменьшаются. Полученные данные свидетельствуют о том, что реакция организма на воздействие люизита в значительной степени зависит от путей поступления этого ОВ. Так, при ингаляционном воздействии люизит очень быстро попадает в кровь и за короткий период распределяется по органам и тканям, где создается его высокая концентрация. Воздействие этого яда при накожной аппликации, очевидно, приводит к связыванию его со структурными белками клеточных мембран, что вызывает нарушение клеточной проницаемости и, как следствие, более медленное проникновение вещества в организм по сравнению с ингаляционным путем. По-видимому, этим и объясняется разная направленность фармакокинетических параметров при различных путях поступления кожно-нарывного ОВ в организм.
Фармакокинетические параметры карбамазепина при его внутрибрюшинном способе введения белым нелинейным крысам на фоне накожной аппликации иприта в дозе 0,1 ЛД50 представлены в табл. 4.
Полученные данные показывают, что воздействие иприта не вызывает глубоких изменений в функционировании ферментов, участвующих в детоксикации ксенобиотиков. Возрастание значения Clpo и снижение Cmax концентрации фармзонда в плазме крови указывают на увеличение интенсивности биотрансформации препарата, иными словами, индукцию соответствующих монооксигеназ.
Результаты оценки процессов окислительного метаболизма с помощью карбамазепина после комбинированного воздействия иприта и люизита представлены в табл. 5.
Анализ экспериментальных данных показывает, что усиление воздействующей дозы при комбинированном применении люизита и иприта приводит к более выраженному изменению анализируемых показателей. Наблюдается существенное снижение процессов элиминации и увеличение препарата в плазме крови. Повышение концентрации фармзонда в плазме крови по сравнению с контролем указывает на снижение активности ферментов печени. При комбинированном воздействии иприта и люизита суммация воздействующих доз приводит к угнетению процессов метаболизма и нарушению гистогематических барьеров печени.
Применение карбамазепина в качестве фармакологического зонда для оценки микросомальной системы печени при реальном поступлении ОВ кожно-резорбтивного действия в организм в диапазоне малых доз имеет преимущество и может быть использовано в качестве диагностического метода при обследовании здоровья населения и обслуживающего персонала в районах расположения военно-химических объектов по хранению и уничтожению ХО.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ УНИЧТОЖЕНИЯ ИПРИТА | 2000 |
|
RU2191174C2 |
| СПОСОБ УНИЧТОЖЕНИЯ ИПРИТА ДЛИТЕЛЬНОГО ХРАНЕНИЯ | 2000 |
|
RU2191173C2 |
| СПОСОБ УНИЧТОЖЕНИЯ БОЕПРИПАСОВ С ИСТЕКШИМ СРОКОМ ХРАНЕНИЯ И ДЕГРАДИРОВАВШИМИ ЗАРЯДАМИ ОТРАВЛЯЮЩИХ ВЕЩЕСТВ КОЖНО-НАРЫВНОГО ДЕЙСТВИЯ | 1999 |
|
RU2169599C2 |
| СПОСОБ УТИЛИЗАЦИИ ОТРАВЛЯЮЩЕГО ВЕЩЕСТВА КОЖНО-НАРЫВНОГО ДЕЙСТВИЯ ТИПА ЛЮИЗИТ | 1999 |
|
RU2172196C2 |
| СПОСОБ ДИАГНОСТИКИ ОТРАВЛЕНИЙ МАЛЫМИ ДОЗАМИ ФОСФОРОРГАНИЧЕСКИХ ОТРАВЛЯЮЩИХ ВЕЩЕСТВ | 2012 |
|
RU2484469C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ВЕРОЯТНОЙ ТОКСИЧНОСТИ КСЕНОБИОТИКОВ ПРИМЕНИТЕЛЬНО К ЧЕЛОВЕКУ | 2002 |
|
RU2223493C2 |
| СОСТАВ ЭКСТРАГЕНТА ДЛЯ ИЗВЛЕЧЕНИЯ β-ХЛОРВИНИЛАРСИНОКСИДА ИЗ ПРОБ ПОЧВЫ | 1996 |
|
RU2129454C1 |
| ПРИМЕНЕНИЕ 1,2-ДИБУТИЛДИТИАЭТАНА В КАЧЕСТВЕ ИМИТАТОРА 2,2'-ДИХЛОРДИЭТИЛСУЛЬФИДА (ИПРИТА) ДЛЯ ОБУЧЕНИЯ ВОЙСК БОЕВЫМ ДЕЙСТВИЯМ В УСЛОВИЯХ ХИМИЧЕСКОГО ЗАРАЖЕНИЯ ИПРИТОМ | 2003 |
|
RU2260577C2 |
| ИСПЫТАТЕЛЬНЫЙ СТЕНД ДЛЯ СОЗДАНИЯ ПАРОГАЗОВЫХ И ПАРОАЭРОЗОЛЬНЫХ СМЕСЕЙ С ЗАДАННОЙ КОНЦЕНТРАЦИЕЙ | 2001 |
|
RU2219516C2 |
| ЭКСТРАГЕНТ ДЛЯ ИЗВЛЕЧЕНИЯ β,β′ -ДИХЛОРДИЭТИЛСУЛЬФИДА ИЗ ПРОБ ПОЧВЫ | 1996 |
|
RU2119160C1 |


Использование: в медицине для оценки микросомальной системы печени при действии ксенобиотиков алкилирующего типа. Сущность изобретения: на кожу животного наносят ксенобиотик алкилирующего типа, затем забирают у животного пробу крови с последующим ее исследованием, при этом перед нанесением ксенобиотика животному вводят фармзонд - карбамазепин, к полученной плазме крови добавляют кислоту при постоянном перемешивании, затем добавляют хлороформ и избыточное количество сульфата аммония, отделяют осадок с последующим упариванием экстракта до сухого остатка при температуре 42 ± 5oC, разделением остатка в условиях жидкостной обращенно-фазовой хроматографии с использованием в качестве элюэнта водно-метанолового раствора и ультрафиолетовым детектированием, и при увеличении содержания карбамазепина после воздействия ксенобиотика по сравнению с нормой оценивают активность микросомальных ферментов печени как нарушенную. Способ позволяет проводить оценку микросомальной системы печени при действии на организм малых доз кожно-нарывных отравляющих веществ, повысить качество исследований за счет определения параметров, характеризующих адаптационно-компенсаторные процессы организма. 5 табл.
Способ оценки микросомальной системы печени при действии ксенобиотиков алкилирующего типа, включающий нанесение ксенобиотика на кожу животного, забор и исследование пробы крови, отличающийся тем, что перед нанесением ксенобиотика животному вводят фармзонд карбамазепин, к полученной плазме крови добавляют кислоту при постоянном перемешивании, затем добавляют хлороформ и избыточное количество сульфата аммония, отделяют осадок с последующим упариванием экстракта до сухого остатка при (42 ± 5)oС, разделением остатка в условиях жидкостной обращенно-фазовой хроматографии с использованием в качестве элюэнта водно-метанолового раствора и ультрафиолетовым детектированием и при увеличении содержания карбамазепина после воздействия ксенобиотика по сравнению с нормой оценивают активность микросомальных ферментов печени как нарушенную.
| SU, авторское свидетельство, 1755199, кл | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
1998-02-10—Публикация
1995-06-23—Подача