Изобретение относится к методам получения трис-бета-дикетонатов редких платиновых металлов общей формулы (R'-CO-CH-CO-R'')3M, где M Rh(III), Ir(III), Ru(III), Os(III); R', R'' -CH3, -CF3, -CF3, -C6H5, -C(CH3)3, -C3F7 в различных комбинациях, касается области неорганической химии синтеза летучих кислородсвязанных комплексов с органическими лигандами. Изобретение может быть использовано в процессах, связанных с газофазным транспортом металлов посредством летучих металлсодержащих соединений, газовой и газо-жидкостной хроматографии, методах зонной сублимации, экстракции и т.д. Практически полезно для осуждения особо чистых металлов и их пленок газофазным термолизом данных соединений при получении защитных, антикоррозионных, отражающих покрытий и пр. Применение изобретения возможно для экспрессного приготовления стандартных образцов и растворов платиновых металлов, используемых при калибровке аналитического оборудования (спектроскопия, атомно-абсорбционная и электронная спектрофотометрия, объемный, гравиметрический анализ и т.д.)
Известны способы получения трис-бета-дикетонатов металлов платиновой группы, основанные на реакции взаимодействия бета-дикетонов со свежеосажденными гидроокисями соответствующих металлов при нагревании реагентов в диапазоне pH-5-6 с последующей перекристаллизацией целевых продуктов из растворов в хлороформе, бензоле, либо хроматографической очисткой на окиси алюминия [1]
Представлены методы синтеза, где в качестве исходных соединений в реакции с бета-дикетонами используются акватированные хлориды указанных металлов. Данные реакции проводятся при длительном нагревании (около 40 ч) в инертной атмосфере азота при постоянном pH среды [2] По данным [3] необходимым условием проведения реакции взаимодействия хлоридов родия (III) с ацетилацетоном является большой избыток лиганда и создание буферной среды с высокой емкостью.
Основными недостатками этих способов являются: необходимость предварительного получения очищенных реагентов (гидроокисей, акватированных форм в растворах и пр.), невозможность достижения высокого выхода целевых продуктов, который в случае бета-дикетонатов родия (III) составляет 50-70% а для комплексов иридия (III), рутения (III) и осмия (III) не превышает 5-20% длительность процесса, необходимость поддержания инертной атмосферы, постоянного значения pH среды, введение в синтез значительного избытка лиганда. Химическое объяснение малого выхода продуктов заключается в слабой координационной способности кислородных атомов ацетилацетона по сравнению с хлоридными лигандами или сильно полимеризованными гидроокисями благородных металлов. В [3] рассмотрено множество факторов, оказывающих влияние на протекание реакции взаимодействия хлоридов родия (III) с ацетилацетоном. Главным выводом авторов является заключение о необходимости увеличения количества ацетилацетона в десятки раз от стехиометрического для подавления конкурирующего влияния хлор-иона, что крайне нежелательно при использовании дорогих и дефицитных его фторированных производных. Помимо этого отмечается протекание побочных реакций при длительном нагревании реакционной смеси как с ацетилацетоном, разлагающимся на ацетон и уксусную кислоту, так с гидролизующимся (pH-9) хлоридом родия.
Таким образом, для проведения реакции комплексообразования с ацетилацетоном и его производными важнейшее значение приобретает исходная химическая форма, в которой находится благородный металл. С этих позиций наиболее предпочтительными являются координационно-"слабосвязанные" лиганды типа нитрат, фосфат, сульфат, ацетат-ионы. Однако малая доступность этих соединений, которые получаются сами с невысоким выходом и путем многоступенчатых реакций, заставляет искать другие методики синтеза.
По технической сущности наиболее близким является способ [2] основанный на длительном (около 2 суток) гидролитическом разложении гексахлоридиевой кислоты или гидратированного трихлорида иридия. В силу кинетической инерации и невысокой глубины протекания гидролиза хлорокомплексов иридия проявляются основные недостатки данного способа: малый выход кислородносвязанного бета-дикетона (18%), образование комплексов иридия с углеродсвязанной ацетилацетонатной группой, димерных соединений неизвестного состава и т.д. Это требует дополнительное проведение разделительных экстракционных процедур дихлорметаном. Высокая длительность процесса отражается на его производительности. Необходимость применения инертной атмосферы создает технические сложности его исполнения.
Вместе с тем, в литературе [4] представлены экспериментальные результаты, которые позволяют оценить термодинамические и кинетические характеристики реакций, идущих с участием фторсодержащих комплексов платиновых металлов. Из них следует, что фторокомплексы в водном растворе обладают наименьшей стабильностью по сравнению с другими галогенолигандами, а координированный фторид-ион слабым транс-влиянием. Эти предпосылки позволяют предполагать, что именно фторокомплексы соответствующих платиновых металлов могут быть перспективными исходными соединениями для данного целенаправленного синтеза.
Задачей настоящего изобретения является создание унифицированного способа синтеза трис-бета-дикетонатов редких платиновых металлов, позволяющего расширить круг используемых лигандов и повысить химический выход этих солей.
Поставленная задача решается тем, что в качестве реагента используют гексафторокомплекс платинового металла в высшей степени окисления, а реакцию с бета-дикетоном или его солью проводят в среде 0,1 N хлорной или 0,2 N плавиковой кислот в присутствии восстановителя с последующим подщелачиванием раствора. В зависимости от вида металлов восстановительными реагентами могут выступать как молекулы воды, так и растворы спиртов и гидрата-гидразина.
Отличительными признаками изобретения являются: использование в качестве исходных фторокомплексов данных металлов в нужных степенях окисления, их гидролитическое восстановление, предварительную акватацию. Другое отличие состоит в выборе кислот HClO4 или HF, кислотные остатки которых не являются координирующими лигандами. Кроме этого в качестве восстановителей используется вода или растворы спиртов и гидрата-гидразина.
В связи с вышесказанным возникает необходимость получить фторокомплексы иридия, родия, осмия и рутения в степени окисления 3+ для последующего синтеза трис-бета-дикетонатов металлов. Из-за высокого окислительного потенциала фтора и других фторирующих реагентов получаемые фторокосплексы реализуют высокие (IV, V) степени окисления центрального атома. Поэтому в дальнейшем требуется проведение реакций восстановления последних для получения степени окисления 3+. Для некоторых комплексных фторидов в качестве восстановителя могут выступать молекулы воды, что позволяет проводить реакции восстановительного гидролиза без применения загрязняющих систему восстановителей. В случае необходимости применения более активных восстановителей целесообразно использовать растворы гидрата-гидразина или спирты, продукты окисления которых газообразные вещества и вода.
Так, для родия этот переход завершается образованием гексааквакатиона вида Rh(H2O)
Наиболее важным следствием этого, определяющим существо предлагаемого метода, является факт дестабилизации внутренней сферы исходных фоторокомплексов и существенная лабилизация лигандов фтора при понижении степени окисления центрального атома. Целенаправленно это можно использовать для замены этих лабилизированной ионов фтора на молекулы воды или другие кислородсвязанные лиганды (в данном случае бета-дикетоны).
Главной предпосылкой использования в качестве исходных реагентов именно высших фторокомплексов является возможность их получения в одностадийной процедуре из наиболее доступного сырья черней или порошков рутения, родия, осмия или иридия по реакции: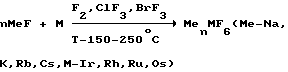
Фторокомплексы данных металлов в высших степенях окисления (Ir(V), Ru(V), Rh(IV), Os(V)) восстанавливаются при нагревании (T-80-90oC) в кислых растворах до образования фтор-акваформ металлов (IV), (III) с последующим дальнейшим восстановлением спиртами или гидратом гидразина до металлов (III) и взаимодействием продуктов восстановительного гидролиза с соответствующими бета-дикетонами или их солями. Другое отличие состоит в том, что лиганд вводят в кислый раствор и затем уже в присутствии бета-дикетона проводят изменение pH добавлением раствора щелочи. Проведение реакции бета-дикетонов именно с продуктами восстановительного гидролиза высших гексафторокомплексов позволяет весь процесс синтеза свести к двум стадиям:
1. Получению гексафторокомплексов металлов в высших степенях окисления с использованием выпускаемых промышленностью порошкообразных металлов или их хлоридов.
2. Собственно синтезу трис-бета-дикетонатов соответствующего металла.
Заявляемый способ является общим, применимым для получения трис-бета-дикетонатов всех платиновых металлов с разного типа бета-дикетонатнными лигандами, позволяет увеличить выход трис-ацетилацетонатов Ru, Rh, Ir, Os до 90-95% а также расширить номенклатуру получающихся с высоким выходом целевых продуктов.
Используемый интервал значений pH растворов (1-7) в заявляемом способе синтеза бета-дикетонатов металлов платиновой группы определяется природой металла и лиганда. Более кислые растворы (pH-1-2) применяются в синтезе соединений иридия с ацетилацетоном и фторированными бета-дикетонами. При больших значениях pH в данном случае, происходит выделение малорастворимых аквагидроксофторокомплексов иридия в твердую фазу и частичное образование соединений иридия полимерного характера, что уменьшает выход трис-бета-дикетонатов. В случае рутения, родия, осмия необходимость постепенного изменения pH от 1 до 6-7 объясняется, с одной стороны, более глубоким замещением фтор-ионов на молекулы воды, но не ионы гидроксида (pH-1) в восстановленной форме фторокомплексов металлов, а с другой большей степенью связывания бета-дикетонов с ионами металлов при pH-6-7, учитывая кислотные свойства енольной формы.
Пример 1. Получение ацетилацетоната Rh(III).
Навеску K2RhF6 массой 30,26 г (0,101 моль) помещают во фторопластовый стакан объемом 1 л, добавляют 500 мл плавиковой кислоты (разведение 1:10). Реакционную смесь нагревают до кипения при перемешивании и полного перехода родия в раствор с изменением цвета от фиолетового в желто-оранжевый. Затем раствор охлаждают и нейтрализуют избыточную кислоту 1 N раствором КОН до значения pH-2-3. Образовавшийся при этом осадок отфильтровывают на фторопластовой воронке через бумажный фильтр. После этого при перемешивании по частям вводят смесь 25 мл ацетилацетона в 40 мл 96%-ного этилового спирта. При этом сразу образуется рыхлый осадок желтого цвета, который увеличивает свой объем при постепенном подщелачивании раствора КОН до pH-6-7. Образовавшийся осадок отфильтровывают, в маточный раствор упаривают в два раза. Выделившиеся при этом кристаллы ацетилацетоната Rh(III) объединяют с предыдущим. Оставшуюся часть продукта экстрагируют бензолом, который после разделения водно-органического слоя упаривают. Полученный таким способом ацетилацетонат Rh(III) сублимируют в вакууме (P-5•10-2 Торр, T - 220oC). Выход очищенного целевого продукта составляет 94-96%
Пример 2. Получение трифторацетилацетоната Rh(III).
Навеску K2RhF6 массой 10,5 г (0,036 моль) помещают в кварцевый стакан объемом 0,5 л, добавляют 200 мл HCLO4 (разведение 1:1). Реакционную смесь нагревают до кипения при перемешивании и полного перехода родия в раствор с изменением цвета от фиолетового до желто-оранжевого. Затем при перемешивании по частям вводят смесь 33 г (0,214 моль) трифторацетилацетона в 40 мл метилового спирта. При этом образуется осадок желтого цвета, который увеличивает объем при постепенном подщелачивании раствора КОН до pH-5-6. Образовавшийся осадок отфильтровывают, а маточный раствор экстрагируют бензолом, который после разделения водно-органического слоя упаривают. Полученный таким образом трифторацетилацетонат Rh(III) объединяют с предыдущим, сублимируют в вакууме (P-5•10-2 Торр, T - 150oC). Выход очищенного целевого продукта составляет 80-85%
Пример 3. Получение гексафторацетилацетона Ir(III).
Навеску K3IrF6 (10 г; 0,024 моль), полученного при восстановлении K2Ir6 гидрат гидразина, растворяют при нагревании (90oC) в 50 мл 40% плавиковой кислоты, упаривают до влажных солей, разбавляют водой (50 мл, pH-1) и добавляют 3-х-кратный избыток соли гексафторацетилацетоната калия (44,3 г; 0,180 моль), растворенной в воде (30 мл). Реакцию ведут при нагревании (90oC) и перемешивании в течение 5 ч. Полученный оранжевый комплекс экстрагируют бензолом, упаривают и очищают вакуумной сублимацией при P-5•10-2 Topp и T 50oC. Выход очищенного гексафторацетилацетоната Ir(III) составляет 70-75%
Пример 4. Получение дипивалоилметаната Ir(III).
Навеску K3IrF6 (15 г; 0,035 моль), полученного при восстановлении K2IrF6 гидратом гидразина, растворяют при нагревании (90oC) в 40 мл 40% плавиковой кислоты и добавляют эквивалентное количество (19,6 г; 0,107 моль) дипивалоилментаната, растворенного в 40 мл этилового спирта. Реакцию проводят при нагревании (90oC) и перемешивании в течении 7 ч. Полученный желто-оранжевый комплекс экстрагируют хлороформом, упаривают и сублимируют в вакууме при P-5•10-2 Topp и T 180oC. Выход очищенного дипивалоилментаната Ir(III) составляет 50-55%
Пример 5. Получение бензоилацетоната Ru(III).
Навеску KRuF6 (12 г; 0,047 моль) растворяют при нагревании (90oC) в 50 мл 40% плавиковой кислоты. Для дальнейшего восстановления затем добавляют еще 30 мл изопропилового спирта, затем при нагревании и перемешивании 7,6 г (0,047 моля) бензоилацетона, растворенного в 20 мл этилового спирта. Реакцию проводят в течение 2 ч. Затем при добавлении концентрированного водного раствора КОН доводят pH среды до 6-7. Полученные ярко-красные кристаллы комплекса экстрагируют бензолом. Очистку соединения проводят методом перекристаллизации из системы хлороформ гексан. Выход очищенного соединения составляет 70%
Пример 6. Получение тензолитрифторацетоната Ru(III).
Навеску KRuF6 (15 г; 0,059 моль) растворяют при нагревании (90oC) в 50 мл 40% плавиковой кислоты, для дальнейшего восстановления затем добавляют еще 30 мл этилового спирта, затем при нагревании и перемешивании 12,7 г (0,059 моль) бензоилтрифторацетона, растворенного в 25 мл этилового спирта. Реакцию проводят в течение 3 ч. Добавлением концентрированного водного раствора КОН доводят pH среды до 6-7. Полученные красные кристаллы комплекса экстрагируют бензолом. Очистку соединения проводят методом перекристаллизации из системы хлороформ гексан. Выход очищенного соединения составляет 70%
Пример 7. Получение ацетилацетоната Os(III).
Навеску KOsF6 (8 г; 0,023 моль) растворяют при нагревании (90oC) в 45 мл 40% плавиковой кислоты, для дальнейшего восстановления затем добавляют еще 25 мл этилового спирта, через 15 мин при нагревании и перемешивании 11,5 г (0,115 моля) раствора ацетилацетона в 20 мл этилового спирта. Реакцию проводят в течение 30 мин, затем при добавлении коцентрированного водного раствора КОН доводят pH среды до 6-7. Полученные желтые кристаллы комплекса экстрагируют бензолом. Очистку соединения проводят методом зонной сублимации при P-5•10-2 Topp и T 180oC. Выход очищенного соединения составляет 90%
Пример 8. Получение пивалоилтрифторацетоната Os(III).
Навеску KOsF6 (5 г; 0,025 моль) растворяют при нагревании (90oC) в 25 мл 40% плавиковой кислоты, для дальнейшего восстановления затем добавляют еще 25 мл этилового спирта, через 15 мин при нагревании и перемешивании 2,9 г (0,015 моль) раствора пивалоилитрифторацетона в 15 мл этилового спирта. Реакцию проводят в течение 1 ч. затем при добавлении концентрированного водного раствора КОН доводят pH среды 6-7. Полученные желтые кристаллы комплекса экстрагируют бензолом. Очистку соединения проводят методом зонной сублимации при P-5•10-2 Topp и T 15oC. Выход очищенного соединения составляет 60%
Литература.
1. Dwjer F.P. Sargeson A.M. The preparation of Tris-acetylacetone-rhodium(III) and iridium (III). J. Am.Chem.Soc. 1953, v.75, N 4, p. 984-985.
Benett M. A. Carbon-Bonded 2,4-Pentanedionato Complexes of Trivalent iridium. Inorg.Chem. 1976. v. 15, N 11, p.2930.
3. Беляев А.В. Венедиктов А.Б. Федотов М.А. Храненко С.П. Исследование взаимодействия хлоридов родия (III) с ацетилацетоном. Координационная химия. т.11, вып. 6. 1985.
Шипачев В. А. Земсков С.В. Альт Л.Я. Изучение окислительно-восстановительных процессов с участием гексафтороплатинат- и гексафторапалладат-ионов в водных растворах. Координационная химия. т. 6, вып. 6. 1980.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ БЕТА-ДИКЕТОНАТОВ РОДИЯ (III) И ИРИДИЯ (III) | 1996 |
|
RU2105008C1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕТА-ДИКЕТОНАТА ПАЛЛАДИЯ (II) ИЛИ МЕДИ (II) | 2010 |
|
RU2433114C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЦЕТИЛАЦЕТОНАТОВ МЕТАЛЛОВ ПЛАТИНОВОЙ ГРУППЫ | 2012 |
|
RU2495880C1 |
| Способ получения бета-дикетонатов платины(II) | 2017 |
|
RU2659073C1 |
| Способ получения акваионов благородных металлов | 1990 |
|
SU1784034A3 |
| СПОСОБ РАЗДЕЛЕНИЯ МЕТАЛЛОВ ПЛАТИНОВОЙ ГРУППЫ | 1991 |
|
RU2033442C1 |
| СПОСОБ ИЗВЛЕЧЕНИЯ ПЛАТИНЫ И ПАЛЛАДИЯ ИЗ МАТЕРИАЛОВ С ПОРИСТОЙ ОСНОВОЙ | 2002 |
|
RU2221060C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2,3-БЕНЗО-5,7-ДИЗАМЕЩЕННЫХ -1,4-ЦИКЛОГЕПТАДИАЗИНОВ | 2008 |
|
RU2387645C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-(1-ПРОПЕНИЛ)АЦЕТАМИДА | 1998 |
|
RU2132326C1 |
| КАТАЛИЗАТОР ДЛЯ ПОЛУЧЕНИЯ ОРГАНИЧЕСКИХ КАРБОНАТОВ И СПОСОБ ПОЛУЧЕНИЯ ОРГАНИЧЕСКИХ КАРБОНАТОВ | 1997 |
|
RU2115471C1 |
Использование: неорганическая химия, синтез летучих комплексов трис-бета-дикетонатов редких платиновых металлов. Сущность способа: гексафторкомплекс платинового металла в высшей степени окисления контактирует с избытком бета-дикетона или его солью при нагревании. Реакцию ведут в присутствии восстановителя в среде 0,1 N хлорной или 0,2 N плавиковой кислоты. Затем реакционную смесь подщелачивают до pH 1 - 7 в зависимости от металла. В качестве восстановителя используют воду, или 0,1 N раствор HClO4 или 0,2 N раствор HF, или алифатические спирты с числом углеродных атомов C1 - C5, или гидрат гидразина. Технический результат изобретения - создание унифицированного способа синтеза, позволяющего расширить круг используемых лигандов и повысить выход солей, 1 н. и 2 з.п.ф-лы, 8 пр.
| Benett M.A | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Устройство для телеграфирования переменными токами | 1924 |
|
SU2930A1 |
Авторы
Даты
1998-02-27—Публикация
1996-08-14—Подача