Изобретение относится к области биотехнологии и касается микробиологического способа получения антибиотика окситетрациклина.
Окситетрациклин относится к антибиотикам широкого спектра действия и в настоящее время находит достаточно широкое применение как исходный продукт для получения химических производных окситетрациклина, используемых в медицине.
Описанные штаммы-продуценты окситетрациклина не отличаются высоким уровнем биосинтеза антибиотика, и поэтому изыскание более продуктивных штаммов представляет значительный практический интерес.
Указывается, например, что известные штаммы-продуценты окситетрациклина вида Streptomyces rimosus в условиях регулируемой ферментации с дробной подачей источника углерода могут образовывать до 14 г/л окситетрациклина [1] .
Наиболее близким к предложенному по физиологическим признакам является штамм-продуцент окситетрациклина Streptomyces rimosus R83, который в лабораторных условиях накапливает до 12 г/л антибиотика [2].
Этот штамм проявляет чувствительность к присутствию в среде L-серина и снижает уровень антибиотикообразования на 43-59% при концентрации L-серина 250-500 мг/л.
Существующие способы отбора высокопродуктивных штаммов- продуцентов антибиотиков основаны в основном на непосредственной оценке уровня антибиотикообразования у исследуемых штаммов, что является весьма трудоемкой задачей [3].
Описаны, однако, методы отбора перспективных продуцентов антибиотиков по иным, чем уровень антибиотикообразования, признакам, которые коррелируют с уровнем биосинтеза антибиотиков.
Известны, например, способы отбора продуктивных штаммов-продуцентов стрептомицина и олеандомицина, которые основаны на корреляции морфологических признаков (спорообразование, пигментация и т.п.) с продуктивностью [4,5] .
Однако эти способы оказались относительно малоэффективными для отбора высокопродуктивных штаммов [3].
Ближайшим аналогом способа отбора штаммов-продуцентов окситетрациклина является способ основанный на отборе антибиотикообразующих вариантов по признакам морфологии, пигментации и споруляции колоний и чувствительности их к окситетрациклину [6]. Однако данный способ пригоден лишь для отбора продуктивных клонов из популяции того или иного штамма, но не для селекции высокопродуктивных мутантов.
Цель изобретения - изыскать штамм-продуцент окситетрациклина, характеризующийся повышенным уровнем антибиотикообразования, и разработать более быстрый метод отбора высокопродуктивных штаммов.
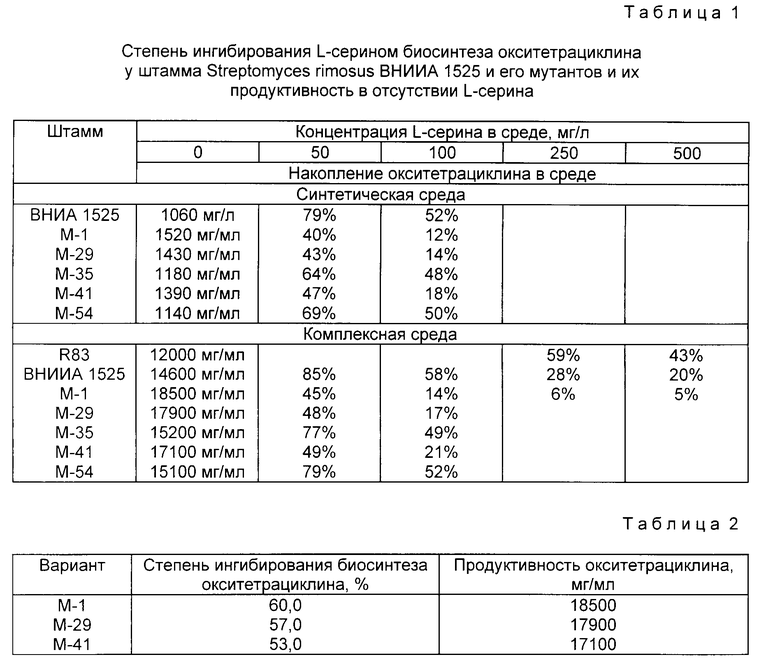
Экспериментальным путем было установлено, что существует явная зависимость между чувствительностью штаммов культуры Streptomyces rimosus к ингибирующему действию L-серина на биосинтез окситетрациклина и интенсивностью антибиотикообразования при отсутствии этой аминокислоты в питательной среде. Иными словами, чем сильнее L-серин подавляет биосинтез окситетрациклина у конкретного штамма Streptomyces rimosus, тем более высок уровень биосинтеза окситетрациклина у этого штамма на обычно используемых питательных средах, не содержащих этой аминокислоты, что подтверждается, в частности, данными табл.1.
Примечание к табл.1. Ферментацию проводили в условиях, описанных далее в примере 1. Накопление антибиотика в присутствии L-серина показано в процентах от уровня биосинтеза окситетрациклина каждым штаммом в отсутствии L-серина. Длительность ферментации в синтетической среде составляла 3 сут., в комплексной среде в присутствии L-серина - 3 сут., в отсутствии L-серина - 9 сут. Синтетическая среда имела следующий состав (г/л): глюкоза (40,0). сульфат аммония (4, 0), гидролизат казеина (1,0), дрожжевой экстракт (0,5), двузамещенный фосфат калия (0,5), сульфат магния (0,5), карбонат кальция (3,0), дистиллированная вода (остальное). Состав комплексной среды приведен в примере 2. Для штамма R83 приведены литературные данные [2].
Предложенный способ отбора высокопродуктивных штаммов-продуцентов окситетрациклина вида Streptomyces rimosus состоит в том, что исходный штамм высевают на плотную стандартную агаризованную среду и отбирают спонтанные устойчивые к канамицину мутанты, у которых модифицирована регуляция биосинтеза окситетрациклина.
Из выделенных устойчивых к канамицину мутантов в свою очередь отбирают варианты, у которых биосинтез окситетрациклина в жидкой среде в наибольшей степени подавляется L-серином.
В результате селекционируют штаммы-продуценты, обладающие высоким уровнем биосинтеза окситетрациклина.
При осуществлении предложенного способа был селекционирован штамм Streptomyces rimosus M-1, резистентный к канамицину в концентрации 30 мг/л, у которого уровень биосинтеза окситетрациклина подавлялся на 50- 60% в присутствии L-серина в концентрации 50 мг/л.
Продуктивность окситетрациклина у селекционированного штамма составляет в среднем 18,5 г/л при периодической ферментации на обычных питательных средах в течение 9 сут.
При последовательных пересевах через каждые 2 мес. на плотной среде СР-6 в течение 1 года селекционированный штамм сохранял основные морфологические и физиологические признаки, в частности устойчивость к канамицину, чувствительность к L-серину, а также уровень антибиотикообразования.
По основным признакам штамм Streptomyces rimosus M-1 не отличается от типичных представителей этого вида и имеет следующие характеристики.
Морфологические признаки
Спороносцы прямые, иногда изогнутые на конце, моноподиально ветвящиеся; споры овальные.
При росте на агаризованных средах при температуре 28-29oC в течение 12 сут имеет следующие морфологические признаки.
Среда с кукурузным экстрактом СР-6. Колонии округлые, плоские, радиально складчатые, диаметром 6-8 мм. Воздушный мицелий развит хорошо, в центре колонии темно-серого цвета, а по краям светло- серого. Субстратный мицелий коричневого цвета.
Гороховая среда. Колонии округлые, слегка выпуклые, радиально складчатые с небольшим кратером, диаметром 6-7 мм. Воздушный мицелий темно-коричневый. Центр колонии спорулирующий, край (ободок) неспорулирующий.
Овсяная среда. Колонии округлые, слегка приподнятые, с кратером диаметром 6-7 мм. Воздушный мицелий в центре колонии серого цвета, неспорулирующий по краям. Субстратный мицелий темно-коричневый со светло-коричневым ободком.
Среда Ваксмана. Колонии округлые, плоские, в центре небольшая выпуклость диаметром 2-3 мм. Воздушный мицелий отсутствует. Субстратный мицелий желтого цвета.
Среда Чапека. Колонии пленчатые, диаметром 4-5 мм. Воздушный мицелий темно-коричневый со светлым ободком. Субстратный мицелий светло-коричневый.
Среда Гаузе-1 (с глюкозой). Колонии пленчатые, в центре коричневого цвета, по краям бесцветные, диаметром 2-3 мм. Воздушный мицелий отсутствует. Субстратный мицелий светло-коричневый с желтым ободком.
Среда Гаузе-2 (с крахмалом). Колонии округлые, плоские, с точечным кратером, диаметром 2-3 мм. Воздушный мицелий развит слабо. Субстратный мицелий темно-коричневого цвета.
Среда Гаузе-2. Колонии округлые, слегка выпуклые, радиально- складчатые, с кратером диаметром 6-7 мм. Воздушный мицелий темно- серого цвета со светло-серым ободком. Субстратный мицелий темно- коричневый.
Физиолого-биохимические свойства
Сбраживает глюкозу, мальтозу, фруктозу, маннит, сорбит, инозит, арабинозу, слабо - ксилозу, не сбраживает сахарозу, лактозу, дульцит.
Реакция на инверсию сахарозы отрицательная.
Крахмал гидролизует интенсивно.
Желатину разжижает на 4 сут.
Молоко пептонизирует на 6 сут.
Нитраты не восстанавливает.
Накопление окситетрациклина при культивировании в обычных условиях составляет 18,0 - 19,0 г/л.
Штамм депонирован во Всероссийской коллекции промышленных микроорганизмов под регистрационным номером ВКПМ S-1512.
Пример 1. Исходный штамм Streptomyces rimosus ВНИИА 1525, высевают на плотную стандартную агаризованную среду, содержащую (г/л): крахмал (30,0), кукурузный экстракт (10,0), сульфат аммония (4,0), мел (5,0), хлористый натрий (5,0), воду водопроводную (до 1 л) и 30 мг/л канамицина, после чего отбирают спонтанные мутанты, устойчивые к канамицину.
Из выделенных 97 устойчивых к канамицину мутантов в свою очередь отбирают варианты, у которых биосинтез окситетрациклина в жидкой среде следующего состава (г/л): глюкоза (40,0), сульфат аммония (4,0), гидролизат казеина (1,0), дрожжевой экстракт (0,5), двузамещенный фосфат калия (0,5), сульфат магния (0,5), карбонат кальция (3,0), дистиллированная вода (остальное), дополненной L-серином в концентрации 50 мг/л, в наибольшей степени подавляется L-серином. Эффект ингибирования биосинтеза окситетрациклина констатируют на 3 сут. культивирования каждого штамма на среде, содержащей и не содержащей L-серин.
Было отобрано 3 варианта, степень ингибирования биосинтеза окситетрациклина у которых L-серином составляла 50-60%.
У отобранных вариантов была проверена способность к биосинтезу окситетрациклина в оптимальных условиях на ферментационной среде следующего состава (г/л): кукурузная мука (120,0), кукурузный экстракт (14,0 по сухому весу), сульфат аммония (14,0), мел (14,0), хлористый кобальт (0,0003), масло соевое (20,0), водопроводная вода (до 1 л).
Продуцирующая активность селекционированных вариантов культуры Streptomyces rimosus см. в табл.2.
Примечание к табл. 2. Степень ингибирования биосинтеза определяли в синтетической среде, а продуктивность - в комплексной.
Таким образом, были выделены 3 штамма Streptomyces rimosus, в том числе M-1, биосинтетическая активность которых заметно превышала таковую у исходного штамма.
При этом в результате предварительного отбора по признаку чувствительности к ингибированию биосинтеза окситетрациклина L-серином общий объем и длительность исследования значительно сократились: принятый способ выявления высокоактивных продуцентов окситетрациклина потребовал бы культивирования не 3, а 97 устойчивых к канамицину штаммов в течение 9 сут.
Пример 2. Суспензией культуры штамма Streptomyces rimosus M-1, выросшей на агаризованной среде СР-6, засевают посевную среду следующего состава (г/л): крахмал (30,0), кукурузный экстракт (10,0), сульфат аммония (4, 0), мел (5, 0), хлористый натрий (5, 0), вода водопроводная (до 1 л). Значение pH среды составляет 7,1. Инокулят выращивают при температуре 28-29oC в колбах емкостью 750 мл, заполненных 50 мл среды, на круговой качалке в течение 48 ч.
Инокулятом в количестве 5 об.% засевают ферментационную среду следующего состава (г/л): кукурузная мука (120,0), кукурузный экстракт (14,0 по сухому весу), сульфат аммония (14,0), мел (14,0), хлористый кобальт (0,0003), масло соевое (20,0), вода водопроводная (до 1 л). Значение pH среды составляет 7,1. Ферментацию проводят при температуре 28-29oC в колбах емкостью 750 мл, заполненных 50 мл среды, на круговой качалке (230-240 об/мин) в течение 9 сут.
Через 3 сут. ферментации в среду вносят соевое масло из расчета 2% от объема культуральной жидкости.
Содержание окситетрациклина в культуральной жидкости составляет 18,9 г/л.
Таким образом, приведенные примеры подтверждают практическую осуществимость изобретения и его преимущества перед известными техническими решениями.
В патентной и доступной научно-технической литературе не обнаружено сведений о том, что известна связь между уровнем биосинтеза окситетрациклина у штаммов Streptomyces rimosus и их чувствительностью к ингибирующему антибиотикообразование действию L-серина. Не обнаружено также и описание в доступных источниках информации штамма-продуцента окситетрациклина, идентичного предложенному.
Следовательно предложение соответствует всем требованиям, предъявляемым к изобретению.
Источники информации
1. Патент ГДР N 205.930, M. кл. C 12 P 15/20, 1982.
2. Parada l. L. Grown Inhibition of Streptomyces species by L-serine and Its effect on tetracycline biosynthesis.- "Appl. Environ. MIcrobiol", 1982, Vol. 41, N 3, р. 366-370,
3. Алиханян C. И. Селекция промышленных микроорганизмов".- М.: Наука, 1968.
4. Waksman S.A., Harris D.A. Streptomycin-producing capability of different strains of Str.griseus.- "Proc. Soc. Exp.Biol. a. Med.", 1949, Vol. 71, р. 232.
5. Жданова Н. И., Алиханян С. И. Действие стабилизирующего отбора в селекции продуцента олеандомицина. - "Известия АН СССР, серия биологическая", 1965, N 1, с. 138,
6. Gravius B. et al. Genetic instability and strain degeneration in Str. rimosus. - "Appl. Environ. Microbiol. ", 1993, vol.59, N 7, p.2220-2228. (прототип).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ АВЕРМЕКТИНОВ, ШТАММ STREPTOMYCES AVERMITILIS - ПРОДУЦЕНТ АВЕРМЕКТИНА | 1995 |
|
RU2098483C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФРАДИЗИНА | 1994 |
|
RU2109056C1 |
| СПОСОБ ПОЛУЧЕНИЯ КРИСТАЛЛИЧЕСКОГО ТИЛОЗИНА | 1997 |
|
RU2114173C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТИЛОЗИНА | 1993 |
|
RU2108392C1 |
| ШТАММ SACCHAROPOLYSPORA ERYTHRAEA 52 - ПРОДУЦЕНТ АНТИБИОТИКА ЭРИТРОМИЦИНА | 1999 |
|
RU2142509C1 |
| ШТАММ STREPTOMYCES FRADIAE НИЦБ 99-ПРОДУЦЕНТ ТИЛОЗИНА | 1999 |
|
RU2147319C1 |
| ШТАММ STREPTOMYCES RIMOSUS SOBIN, FINLAY AND KANE - ПРОДУЦЕНТ ОКСИТЕТРАЦИКЛИНА | 1993 |
|
RU2061044C1 |
| ШТАММ STREPTOMYCES AVERMITILIS НИЦБ 132-ПРОДУЦЕНТ АВЕРМЕКТИНОВ | 1999 |
|
RU2147320C1 |
| ШТАММ Saccharopolyspora erythraea C-77-ПРОДУЦЕНТ АНТИБИОТИКА ЭРИТРОМИЦИНА | 2004 |
|
RU2281332C2 |
| Штамм Streptomyces virginiae - продуцент вирджиниамицина и способ получения вирджиниамицина | 2016 |
|
RU2637857C1 |
Способ отбора высокопродуктивных штаммов-продуцентов окситетрациклина проводят культивированием штамма-продуцента вида Streptomyces rimosus, и в частности штамма Streptomyces rimosus М-1 (ВКПМ S-1512), продуцирующего окситетрациклин. Культивирование осуществляют на плотной питательной среде с канамицином. Отбирают канамицинустойчивые мутанты и после их культивирования на жидкой питательной среде с L-серином отбирают варианты штамма, биосинтез окситетрациклина у которых подавляется L-серином. 2 с.п. ф-лы, 2 табл.
| Appl | |||
| Environ.Microbid., 1993, v.59, N 7, p | |||
| Способ приготовления серо-угольноселитряного пороха | 1924 |
|
SU2220A1 |
Авторы
Даты
1998-05-10—Публикация
1995-12-05—Подача