Изобретение относится к биотехнологии и касается получения антибиотиков авермектинов, обладающих высокой антипаразитарной активностью и находящих применение в ветеринарии для профилактики и лечения домашних животных и птицы.
Авермектины суммарный препарат, продуцируемый культурой Streptomyces avermitilis и состоящий из структурно родственных соединений, называемых авермектином A и авермектином B, которые, в свою очередь, также подразделяются на несколько групп.
Наиболее активными являются авермектины B, на основе которых в основном и созданы коммерческие ветеринарные препараты.
Соотношение биосинтезируемых микробной культурой авермектинов A и авермектинов B зависит от особенностей штамма-продуцента и от условий, в которых проводят процесс культивирования.
Известен, например, способ получения авермектинов, предусматривающий выращивание штамма-продуцента Streptomyces avermitilis АТСС 31267 или АТСС 31271 или АТСС 31272 на питательной среде, содержащей в качестве источников углерода и азота простые и комплексные органические субстраты, в оптимальных для данной культуры условиях.
Суммарное содержание в культуральной жидкости авермектинов достигает 500 мг/л [1] из которых на долю авермектинов группы B приходится до 50 70% от общего количества биосинтезируемых авермектинов [2]
При использовании других штаммов-продуцентов соотношение продуцируемых авермектинов может быть иным.
В частности, запатентован способ получения авермектинов B, заключающийся в том, что в качестве продуцента используют мутантный штамм Streptomyces avermitilis АТСС 53692, который выращивают на питательной среде, содержащей ассимилируемые источники углерода, азота, неорганических солей и карбоновую кислоту-предшественник, в оптимальных условиях. В зависимости от используемой кислоты-предшественника могут быть получены как природные, так и неприродные авермектины группы B, в некоторых случаях совсем не содержащие примесей авермектинов группы F. Однако, абсолютное накопление авермектинов B ферментационной среде, как вытекает из приводимых примеров осуществления способа, не превышает 100 200 мг/л культуральной жидкости [3]
Описан способ получения авермектинов, предусматривающий выращивание мутантных штаммов Streptomyces avermitilis K475 или K655 на комплексной питательной среде, который обеспечивает накопление в культуральной жидкости до 1200 мг авермектина в 1 л среды после 7 суток культивирования. Максимальное накопление авермектина наблюдалось после 10 суток культивирования штамма Strepomyces avermitilis K655 при дополнительном введении в питательную среду 3% глюкозы к 5-суточной культуре и достигало при этом 2500 мг/л. Однако, каких-либо сведений об относительном содержании отдельных компонентов авермектинового комплекса в упоминаемой работе не приводится [4]
Существуют, однако, технологические приемы, позволяющие повысить общий выход авермектинов или долю авермектинов B в общем количестве биосинтезируемых авермектинов при использовании продуцентов, образующих и авермектины группы A и авермектины группы B.
Например, сообщалось, что дополнительное введение в ферментационную среду DL-триптофана в концентрации 0,5 мг/мл или DL-метионина в концентрации 2,5 мг/мл стимулирует образование авермектинов культурой Streptomyces avermitilis NRRL 8165, в то время, как другие из изученных 18 аминокислот подобного эффекта не проявляли.
Однако, степень влияния эффективных аминокислот на биосинтез авермектинов не приводится, равно как и соотношение отдельных компонентов авермектинового комплекса. Продуктивности культуры без дополнительного внесения аминокислот не превышает 500 мг/л [1]
Было установлено, что при внесении в ферментационную среду антиметаболита синефунгина, ингибирующего превращения авермектинов B в авермектины A, доля авермектинов B, продуцируемых культурой Streptomyces avermitilis NRRL 8165, достигает 77% от общей суммы авермектинов.
Однако, абсолютное содержание в культуральной жидкости авермектинов в этом случае остается лишь на уровне 88 105% от контроля, поскольку в присутствии синефунгина синтез авермектинов A снижается [5]
Наиболее близким к предложенному можно признать способ получения авермектина, заключающийся в том, что изолят MA 4990 штамма Streptomyces avermitilis ATCC 31271 выращивают на питательной среде, в состав которой включен L-изолейцин в концентрации 1 г/л, в оптимальных для данной культуры условиях.
Доля авермектинов B в этом случае составляет 69% от общей суммы биосинтезируемых авермектинов.
В то же время, общий уровень накопления авермектинов в культуральной жидкости под влиянием L-изолейцина не увеличивается и его абсолютная величина не приводится [6]
Цель изобретения повысить уровень накопления авермектинов в культуральной жидкости культуры Streptomyces avermitilis при высоком содержании авермектинов B в комплексе биосинтезируемых авермектинов.
Поставленная цель была достигнута в результате того, что посевной материал культуры Streptomyces avermitilis готовят путем выращивания споровой культуры этого штамма в присутствии L-лизина, а в оптимальном варианте осуществления изобретения в качестве продуцента используют штамм актиномицета Streptomyces avemitilis 103.
Сущность предложенного способа заключается в следующем.
В качестве продуцента авермектина используют штамм Sterptomyces avermitilis 103, полученный из исходного штамма Streptomyces avermitilis ATCC 31271 трехступенчатой селекцией.
Штамм Str. avermitilis 103 обладает всеми типичными для вида Str. avermitilis признаками, основные из которых указаны ниже.
Морфологические признаки
На среде с соевой мукой на 14 сутки образует колонии диаметром до 7 мм почти круглой формы. Контур края бахромчатый. Колонии плоские, в центре имеется небольшая складчатость. Поверхность колонии сухая, шероховатая, без опущения. Цвет колоний кремовый. Структура колоний однородная, консистенция плотная, кожистая. В среду выделяется коричневый пигмент.
На среде Хопвуда на 14 сутки образует колонии неправильной формы диаметром до 6 мм. Контур края лопастной. Колонии выпуклые. Поверхность колоний сухая, шероховатая, опущенная, складчатость бородавчатая. Колонии серого цвета с участками белого цвета. Структура колоний неоднородная, консистенция кожистая. Пигмент не образуется.
На среде Гаузе с глюкозой на 14 сутки образует колонии диаметром до 8 мм неправильной формы с волнистым краем. Рельеф колоний конусообразный. Часть колоний имеет радиальную складчатость. Поверхность колоний сухая, шероховатая, опущенная, но есть участки без опущения. Цвет колоний светло-серый и темно-серый. Структура колоний неоднородная, консистенция плотная. В среду выделяется светло-коричневый пигмент.
На среде YME на 5 сутки образует колонии двух морфологических типов: I - колонии белого цвета с кремовым оттенком, хорошо опущенные, II колонии выпуклые почти круглой формы с ровным краем и небольшой складчатостью. Цвет колоний серый, в центре более светлый участок. Диаметр колоний 2,0 2,5 мм. Поверхность колоний сухая, шероховатая, неопущенная. Оба типа колоний с обратной стороны коричневого цвета. Выделяют в среду коричневый пигмент. Колонии слегка заглублены в агар. На 14 сутки образует колонии неправильной формы с волнистым краем диаметром до 10 мм. Рельеф колоний конусообразный. Поверхность колоний сухая, шероховатая, хорошо опущенная. Складчатость гирозная. Цвет колоний серый с белыми вкраплениями. Структура неоднородная, консистенция плотная.
На среде CP-6 на 5 сутки образует колонии почти круглой формы серовато-коричневого цвета, диаметром 2 мм. Рельеф колоний куполообразный. Складчатость плохо выражена. В среду выделят темно-коричневый пигмент. Поверхность колоний сухая, шероховатая, опущение отсутствует. На 11 сутки колонии почти круглой формы со слегка волнистым краем, выпуклые с радиальной складчатостью серовато-коричневого цвета и с немного более темным центром. Поверхность сухая, шероховатая, без опущения. Выделяет темно-коричневый пигмент.
На среде YMS на 5 сутки образует светло-серые и почти белые колонии примерно в равном соотношении. Форма колоний кратерообразная, диаметр 3,0 - 3,5 мм. Поверхность хорошо опущенная, складчатая. Колонии слегка заглублены в агар, выделяют темно-коричневый пигмент. На 11 сутки колонии почти круглой формы, с волнистым краем, диаметром 5,5 6,0 мм, с выпуклым рельефом. Цвет колоний серый, поверхность сухая, шероховатая, с гирозной складчатостью. В среду выделяет коричневый пигмент.
Хорошая споруляция наблюдается на средах CP-6, минимальной Хопвуда и YMS. Спорофоры образуют спирали в виде разветвлений воздушного мицелия. Компактные вначале спирали раскрываются по мере старения культуры. Количество спор в цепочках не более 15, споры обычно сферической и овальной формы.
Физиологические признаки. В минимальной среде Хопвуда с 1% источника углерода растет, используя в качестве единственного источника углерода глюкозу, фруктозу, маннозу, маннит, инозит, рамнозу, сахарозу, лактозу, мальтозу, арабинозу и ксилозу.
Гидролизует желатину и казеин, свертывает молоко.
Хорошо растет и образует воздушный мицелий в интервале температур от 27 до 37 градусов, не растет при температуре 50 градусов.
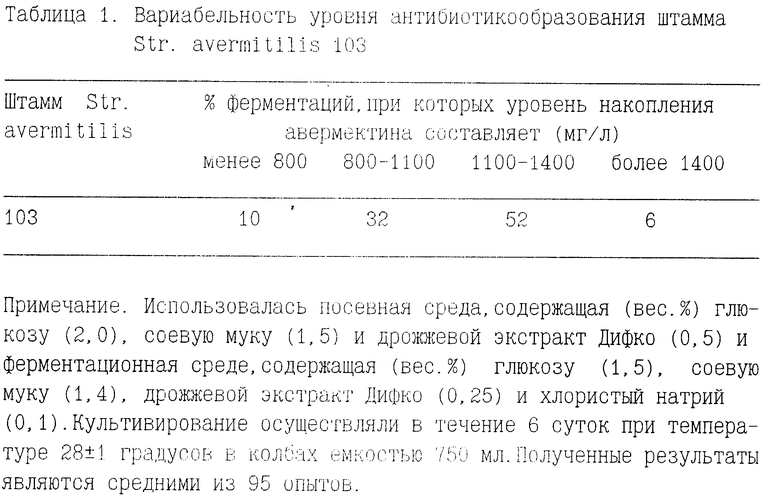
При культивировании на обычных средах штамм Str. avermitilis 103 характеризуется общей продуктивностью на уровне 1200 1400 мг авермектинов в 1 л культуральной жидкости. Этот уровень сохраняется после трех пассажей при пересеве культуры с косяка на среде YMS. При стандартных условиях культивирования доля авермектинов B в сумме синтезированных авермектинов составляет 40 50%
Выращенная в течение 8 10 суток при температуре 28+1 градусов на агаризованной среде YMS культура штамма хранится под слоем 40%-ного глицерина при температуре 20 градусов в течение 6 месяцев.
Для хранения штамма используют стандартную агаризованную среду, имеющую pH 7,5 и содержащую (г/100 мл дистиллированной воды): крахмал растворимый (0,5), дрожжевой экстракт Дифко (0,5), мальт-экстракт Дифко (1,5), мел (0,3) и агар-агар (2,0).
Штамм Streptomyces avermitilis 103 депонирован во Всероссийской коллекции промышленных микроорганизмов Государственного научно-исследовательского института генетики и селекции промышленных микроорганизмов под регистрационным номером ВКПМ-S1440.
По сравнению с исходным, штамм 103 морфологически более стабилен, образуя в основном лишь 2 типа колоний, в то время, как исходный штамм образует до 6 типов колоний.
Штамм Str. avermitilis 103 обладает стабильностью антибиотикообразования и обеспечивает высокий процент ферментаций с высоким уровнем накопления антибиотика, что показано в табл.1.
Для получения посевного материала штамма Streptomyces avermitilis 103 споровым материалом инокулируют жидкую среду, содержащую источники углерода, азота, ростовые факторы, минеральные соли и микроэлементы, дополненную L-лизином в количестве от 0,02 до 0,4% Предпочтительная концентрация L-лизина составляет от 0,1 до 0,2%
Выращивание посевного материала проводят при температуре 28±1 градусов в течение 48 72 ч.
Посевным материалом инокулируют ферментационную среду и ферментацию ведут при температуре 28±1 градусов в течение 6 суток.
Содержание авермектинов в культуральной жидкости после завершения ферментации достигает 2200 2500 мг/л, а доля авермектинов B составляют 50 - 56% от этого количества.
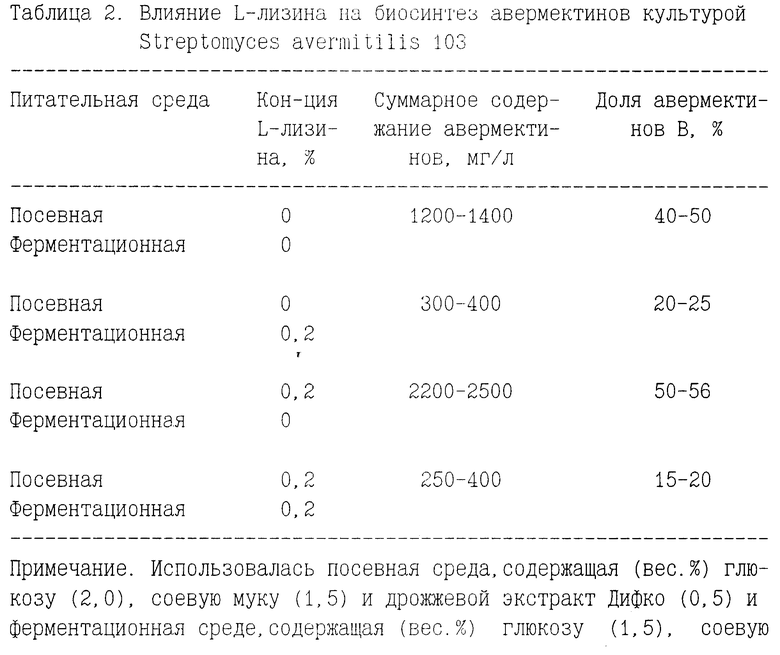
Уровень биосинтеза авермектинов в присутствии L- лизина, вводимого в посевную и в ферментационную среды, показан в табл. 2.
Обращает на себя внимание тот факт, что внесение L-лизина в ферментационную среду приводит к значительному снижению общего уровня антибиотикообразования и относительного содержания авермектинов B.
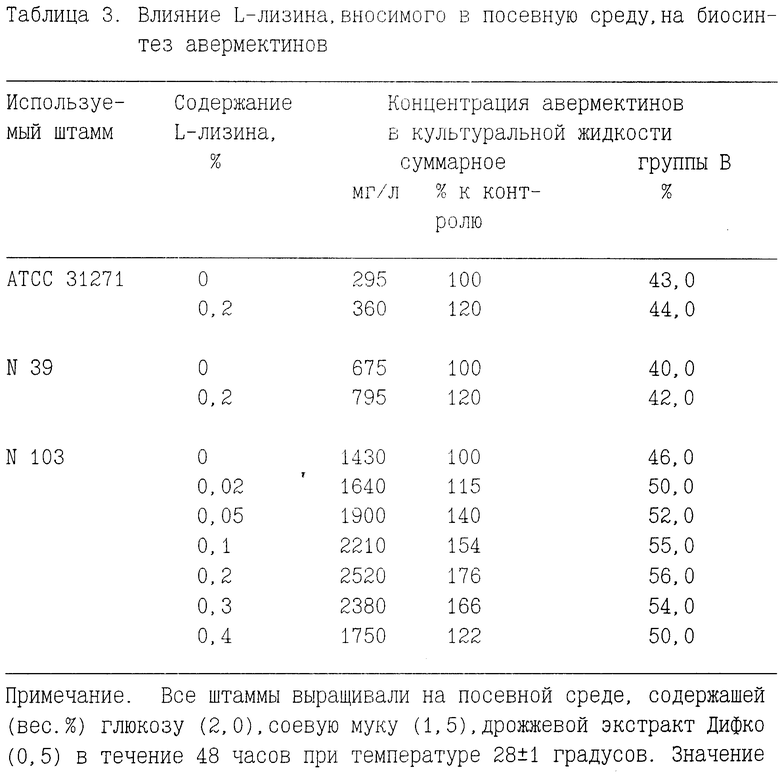
Сравнительные данные по влиянию L-лизина, дополнительно вносимого в посевную среду, на биосинтез авермектинов некоторыми штаммами Streptomyces avermitilis, представлены в табл. 3.
Представленные данные свидетельствуют о стимулирующем влиянии K-лизина, вносимого в посевную среду, на продуктивность исследованных культур, но наиболее благоприятный результат достигается при использовании штамма Streptomyces avermmitilis 103, дающего наивысший отклик: образование авермектинов превышает уровень накопления антибиотика в условиях контроля (при использовании посевного материала, выращенного без лизина) на 76% и одновременно повышение доли авермектинов группы B с 46% до 56%
Следующие Примеры более подробно поясняют сущность изобретения.
Пример 1. Споровой суспензией штамма Streptomyces avermitilis 103 засевают 5 колб емкостью 750 мл, заполненных 50 мл посевной среды, содержащей (мас.): глюкозу (2,0), соевую муку (1,5), дрожжевой экстракт (0,5), L-лизин (0,1) и водопроводную воду (до 100,0). Значение pH среды составляет 7,3.
Вегетативный инокулят выращивают при температуре 28±1 градусов на круговой качалке (230 250 об/мин) в течение 48 ч.
Инокулятом засевают 50 колб емкостью 750 мл, заполненных 50 мл ферментационной среды, содержащей (мас. ): глюкозу (4,5), соевую муку (1,4), дрожжевой экстракт (0,25), хлористый натрий (0,1) и водопроводную воду (до 100,0). Значение pH среды составляет 7,4.
Ферментацию осуществляют при температуре 28+1 градусов на круговой качалке (230-250 об/мин) в течение 6 суток.
После завершения ферментации содержание авермектинов в культуральной жидкости составляло 2520 мг/л, из которых на долю авермектинов B приходилось 56%
Пример 2. Споровой суспензией штамма Streptomyces avermitilis 103 засевают 5 колб емкостью 750 мл, заполненных 50 мл посевной среды содержащей (мас. ): глюкозу (1,0), лактозу (1,0), хлопковую муку (1,5), дрожжевой экстракт (0,5), L-лизин (0,1) и водопроводную воду. Значение pH среды составляет 7,2.
Вегетативный инокулят выращивают при температуре 28±1 градусов на круговой качалке (230 250 об/мин) в течение 48 ч.
Инокулятом засевают 50 колб емкостью 750 мл, заполненных 50 мл ферментационной среды, содержащей (мас.): глюкозу (4,5), хлопковую муку (1,4), дрожжевой экстракт (0,25), хлористый натрий (0,1) водопроводную воду (до 100,0). Значение pH составляет 7,4.
Ферментацию осуществляют при температуре 28±1 градусов на круговой качалке (230 250 об/мин в течение 5 суток.
После завершения ферментации содержание авермектинов в культуральной жидкости составляло 2350 мг/л, из которого на долю авермектинов B приходилось 55%
Существенные отличия предложенного способа от способа -прототипа состоят в том, что
в предложенном способе в качестве агента, способствующего увеличению биосинтеза авермектинов, используют L-лизин, а не L-изолейцин;
в предложенном способе стимулятор образования авермектинов вводят в состав посевной, а не ферментационной среды.
в оптимальном варианте осуществления предложенного способа в качестве продуцента авермектина используют штамм Streptomyces avermitilis 103, дающий наивысший отклик на введение L-лизина и обладающий высокой генетической стабильностью и высокой стабильностью антибиотикообразования.
Отличительные приемы предложенного способа с очевидностью не вытекает из известного уровня знаний, поскольку заявителю не известны источники информации, из которых можно было бы сделать вывод о стимулирующем эффекте L-лизина на биосинтез авермектинов и особенно на уровень биосинтеза авермектинов группы B.
Использование предложенного способа и предложенного нового штамма продуцента авермектинов позволяет без изменения технологической схемы производства повысить общий уровень антибиотикообразования до уровня максимальной продуктивности, известного по литературным данным, при высоком содержании авермектинов группы B, не увеличивая при этом продолжительности ферментации.
Источники информации, принятые во внимание
1. Burg R. W. Miller B.M. Baker E.E. et al. Avermectins, new family of potent anthelmitic agents: producing organism and fermentation. "Anntimicrobical Agents and Chemotherapy", 1979. Vol.15, N 3, p. 361 367
2. Патент США 4.310.519, М. кл. A 61 K 31/71, 1982
3. Патент СССР 1.806.198, М. кл. C 12 P 17/08, 1993
4. Ikeda H. Kotaki H. Tanaka H. Omura S. Involvent of glucose catabolism in avermectin production by Streptomyces avermitilis. "Antimicrobial Agents and Chemotherapy", 1988, Vol. 32, N 2, p. 282 284
5. Schulman M.D. Valentino D. Streicher S. Ruby C. Streptomyces avermitilis mutants defective in methylation of avermectins. "Antimicrobial Agents and Chemotherapy" 1987, Vol. 31, N 5, p. 744 749
6. McConn-McCormic P.A. Monaghan R.L. Baker E.E. Goegelman R.T. Stapley E. O. Studies of the avermectin fermentation. "Advances in Biotechnology", 1981, Vol. 1, p. 69 74 (прототип)и
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОТБОРА ВЫСОКОПРОДУКТИВНОГО ШТАММА - ПРОДУЦЕНТА ОКСИТЕТРАЦИКЛИНА И ШТАММ STREPTOMYCES RIMOSUS - ПРОДУЦЕНТ ОКСИТЕТРАЦИКЛИНА | 1995 |
|
RU2110576C1 |
| ШТАММ STREPTOMYCES AVERMITILIS НИЦБ 132-ПРОДУЦЕНТ АВЕРМЕКТИНОВ | 1999 |
|
RU2147320C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФРАДИЗИНА | 1994 |
|
RU2109056C1 |
| СПОСОБ ПОЛУЧЕНИЯ КРИСТАЛЛИЧЕСКОГО ТИЛОЗИНА | 1997 |
|
RU2114173C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТИЛОЗИНА | 1993 |
|
RU2108392C1 |
| ШТАММ SACCHAROPOLYSPORA ERYTHRAEA 52 - ПРОДУЦЕНТ АНТИБИОТИКА ЭРИТРОМИЦИНА | 1999 |
|
RU2142509C1 |
| ШТАММ АКТИНОМИЦЕТА STREPTOMYCES AVERMITILIS - ПРОДУЦЕНТ АВЕРМЕКТИНОВ | 1995 |
|
RU2087535C1 |
| ШТАММ STRENPTOMYCES AVERMITILIS - ПРОДУЦЕНТ АВЕРМЕКТИНОВ | 1992 |
|
RU2048520C1 |
| ШТАММ STREPTOMYCES FRADIAE НИЦБ 99-ПРОДУЦЕНТ ТИЛОЗИНА | 1999 |
|
RU2147319C1 |
| ШТАММ АКТИНОМИЦЕТА STREPTOMYCES AVERMITILIS - ПРОДУЦЕНТ АВЕРМЕКТИНОВ | 1993 |
|
RU2054483C1 |
Использование: биотехнология, микробиология, ветеринария. Сущность изобретения: в способе получения авермектинов осуществляют выращивание штамма Streptomyces arermitilis ВКПМS - 1440 в посевной среде, содержащей 0,02 - 0,4% l-лизина, затем инокулируют посевным материалом питательную среду с источниками углерода, азота и минеральных веществ, культивируют продуцент в оптимальных условиях и выделяют целевой продукт. 1 з.п., ф-лы., 3 табл.
2. Способ по п.1, отличающийся тем, что в качестве продуцента используют штамм Streptomyces avermitilis ВКПМ S-1440.
| Mc Conn - Mc Cormic P.A., Monaghan R.L., Baker E.E., Goegelman P.T., Stapley E.O | |||
| "Studies of the avermectin fermentation", Advances in Biotechhology", 1981, vol | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ приготовления пищевого продукта сливкообразной консистенции | 1917 |
|
SU69A1 |
Авторы
Даты
1997-12-10—Публикация
1995-08-21—Подача