Эта заявка является частным продолжением Сериала N 07/689.300, зарегистрированного 22 апреля 1991 г. и сериала N 07/676.102, зарегистрированного 27 марта 1991 г.
Настоящее изобретение относится к стереоизомерному обогащению 2-амино-3-гидрокси-3-фенилпропионовых кислот.
Биологическую активность многих химических соединений, имеющих хиральный центр, в частности фармацевтических и сельскохозяйственных препаратов, как было установлено, в основном обнаруживают у одной из хиральных форм. Поскольку большинство реакций синтеза не отличается стереоселективностью, то в результате возникают серьезные проблемы, связанные с химической переработкой. Поэтому обогащение преимущественно одной из хиральных форм следует проводить на какой-либо стадии процесса либо для конечных хиральных соединений, либо для их химических предшественников, которые обладают тем же хиральным центром, что и конечный продукт. Вне зависимости от выбора стадии, на которой проводится обогащение, и в отсутствие метода рециркуляции нежелательного одного или нескольких стереоизомеров, способ по существу ограничивается максимальным выходом, соответствующим 1/(2n)•100% нужного стереоизомера, где n - это общее число хиральных центров с молекуле.
2-амино-3-гидрокси-3-фенилпропионовые кислоты и их производные используются в качестве полупродуктов в синтезе ряда биологически полезных химических соединений. L-трео-2-амино-3-(4-метилсульфонилфенил)пропионовая кислота используется как полупродукт в синтезе антибиотиков D-трео-1-фторо-2-(дихлорацетамидо)-3-(4-метилсульфонил-фенил)пропан-1-ола (также известного под названием флорфеникол) и D-трео-2-(дихлорацетамидо)-3(4-метилсульфонилфенил)пропан-1,3-диола, известного под названием тиамфеникол. Кроме того, L-трео-2-амино-3-(4-метилтиофенил)-3-гидроксипропионовая кислота является полупродуктом синтеза антибиотиков. Аналогично как полупродукт синтеза 1-2-амино-2-метил-3-(3,4-дигидроксифенил)-пропионовой кислоты используется L-трео-2-амино-2-метил-3-гидрокси-3-фенилпропионовая кислота, также известная под названием L-метилдопа.
Поскольку 2-амино-3-гидрокси-3-фенилпропионовая кислота и ее производные обладают двумя хиральными центрами, то они существуют в виде четырех стереоизомеров. К ним относятся две пары энантиомеров - это D,L-эритро- и D,L-трео-энантиомеры. В тех случаях, когда конечный продукт содержит два хиральных центра, то, как правило, только один стереоизомер, обычно L-трео-стереоизомер, пригоден для получения биологически активных соединений. При получении L-метилдопы различие между "эритро" и "трео" не важно, поскольку гидрирование устраняет хиральный центр, связанный с 3-гидроксигруппой 2-амино-2-метил-3-гидрокси-3-фенилпропионовой кислоты, т. е. целевой продукт имеет только один хиральный центр. И в этом случае, однако, пригоден только один энантиомер, его L-форма. При наличии двух хиральных центров в молекуле нужный стереоизомер должен быть выделен из смеси или подвергнуться обогащению в смеси D,L-эритро- и D,L-трео-стереоизомеров для более эффективного получения конечного соединения оптической чистоты.
Британский патент N 1268867, Akiyama et al, на который ссылаются заявители, раскрывает процесс получения тиамфеникола, согласно которому спиртовой раствор соли щелочного металла глицина контактирует с двумя молями пара-метилсульфонилбензальдегида на моль глицина в присутствии карбоната щелочного металла. В результате образуются смеси, обогащенные именно D,L-трео-энантиомерными формами β-(4-метилсульфонилфенил)серина, а не D,L-эритро-формами. Отделение L-трео-энантиомера от D-трео-энантиомера затем можно провести, используя традиционное химическое разделение. Выходы, однако, бывают низкими, не более 50% нужного трео-изомера из трео-смеси.
Настоящее изобретение представляет собой значительное улучшение процесса получения L-трео-2-амино-3-гидрокси-3-фенилпропионовой кислоты, 2-амино-2-метил-3-гидрокси-3-фенилпропионовой кислоты и их производных, незамещенных или содержащих заместители в фенильном кольце. При обработке смеси D-трео- и L-трео-форм-2-амино-3-гидрокси-3-фенилпропионовой кислоты, которая, как правило, но необязательно является рацемической, с помощью D-треонин-альдолазы происходит селективное расщепление D- трео-2-амино-3-гидрокси-3-фенилпропионовой кислоты на глицин и соответствующий бензальдегид без значительного расщепления L-трео-2-амино-3-гидрокси-3-фенилпропионовой кислоты. Аналогично, при обработке смеси энантиомеров D,L-трео-2-амино-2-метил-3-гидрокси-3-фенилпропионовой кислоты D-треонин-альдолазой способом, предложенным в настоящем изобретении, происходит селективное расщепление D-трео-2-амино-2-метил-3-гидрокси-3-фенилпропионовой кислоты на аланин и соответствующий бензальдегид, и при этом не происходит в заметной степени расщепления L-трео-2-амино-2-метил-3-гидрокси-3-фенилпропионовой кислоты. В каждом случае соответствующий бензальдегид и соответствующая аминокислота могут быть легко выделены из смеси для их рециркуляции.
Основой настоящего изобретения послужил тот факт, что D-треонин-альдолаза селективно расщепляет связь между углеродным атомом в положении 2 (атом углерода, несущий аминогруппу) и тем, который находится в положении 3 (атом углерода, несущий гидроксигруппу) в D-трео-2-амино-3-гидрокси-3-фенилпропионовой кислоте или в D-трео-2-амино-2-метил-3-гидрокси-3-фенилпропионовой кислоте, оставляя соответствующий L-трео-изомер преимущественно незатронутым. Таким образом, настоящее изобретение в особенности пригодно для получения описанных выше биологически активных соединений, например флорфеникола, тиамфеникола и L-метилдопы.
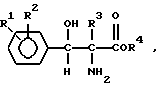
В более широком смысле настоящее изобретение включает энантиомерное обогащение смеси D,L-трео-2-амино-3-гидрокси-3-фенилпропионовых кислот или D,L-трео-2-амино-2-метил-3-гидрокси-3-фенилпропионовых кислот формулы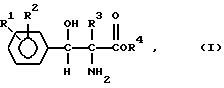
в которой каждый
R1 и R2, независимо друг от друга представляют собой водород, гидроксигруппу, галоген, нитрогруппу, трифторметил, низший алкил, низший алкоксил, низший алкилсульфонил, низший алкилсульфинил, или низшую алкилтиогруппу; R3 - водород или метил; R4 - водород или карбоксизащитная группа.
Также сюда относятся соответствующие соли вышеупомянутых 2-амино-2-метил-3-гидрокси-3-фенилпропионовых кислот.
Под термином низший алкил подразумевается моновалентный насыщенный разветвленный или неразветвленный углеводородный радикал, содержащий от 1 до 6 атомов углерода. К ним относятся такие алкильные группы, как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, трет-пентил, гексил, изогексил и т.п.
Под термином низший алкоксил подразумевается низший алкил, соединенный с оставшейся частью молекулы через простой эфирный кислород, например метокси, этокси, пропокси, изопропокси, бутокси, пентокси, гексокси и т.п. группы.
Галоген - это хлор, бром, фтор и иод.
Карбоксигруппа может быть защищена сложноэфирной группировкой R4, которая избирательно удаляется в мягких условиях без разрушения нужной структуры молекулы, в частности это может быть алкиловый эфир, содержащий в алкильной части от 1 до 12 атомов углерода, например метиловый или этиловый эфир, и в частности алкиловый эфир с разветвлением в положении 1, например трет-бутиловый эфир; низший алкиловый эфир, который замещен в положении 1 или 2: (1) низшей алкокси-группой, например это этометоксиметил, 1-метоксиэтил и этоксиэтил, (2) низшей алкилтиогруппой, например это метилтиометил и 1-этилтиоэтил; (3) галогеном, например это 2,2,2-трихлороэтил, 2-бромоэтил и 2-иодоэтоксикарбонил; (4) одной или двумя фенильными группами, каждая из которых может не иметь заместителей или быть моно-, ди- или тризамещенной, например, низшим алкилом, таким как трет-бутил, низшим алкоксилом, таким как метокси, гидрокси, галогеном, например хлором, и нитрогруппой, например такими как бензил, 4-нитробензил, дифенилметил, ди-(4-метокси)фенилметил; или (5) ароилом, таким как фенилацил. Карбоксигруппа может быть также защищена органосилильной группой, такой как три-низший алкилсилил, например триметилсилилоксикарбонилом.
Как указывалось, настоящее изобретение распространяется также на соли вышеперечисленных соединений, в частности соли щелочных металлов, щелочноземельных металлов, соли аммония и органических аминов, например такие соли, в которых катионами являются катионы натрия, калия, магния, кальция или катионы протонированных аминов, полученных из этиламина, тирэтиламина, этаноламина, диэтиламиноэтанола, этилендиамина, пиперидина, морфолина, 2-пиперидиноэтанола, бензиламина, прокаина и т.п. Поскольку соли используются в качестве полупродуктов химической реакции, нет необходимости предъявлять к ним требования физиологической приемлемости.
В частности, способ хорошо подходит для получения соединений формулы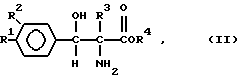
в которой каждый R1 и R2 независимо друг от друга представляет собой водород, гидрокси-, метокси-, метилсульфонил- или метилтио-группу; R3 - водород или метил; R4 - водород, C1-C3 алкил, или катион (т.е. их соли).
Термин "энантиомерное обогащение" в том смысле, как он используется в настоящем описании, относится к увеличению количества одного энантиомера по сравнению с другим. Удобный метод выражения достигнутого энантиомерного обогащения состоит в использовании понятия избыток энантиомера, "и.э.", выражаемого в виде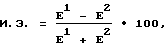
в которой
E1 - количество одной хиральной формы (такой, как L-трео-форма) и E2 - количество другой хиральной формы (такой, как D-трео-форма). Таким образом, если исходное отношение двух хиральных форм равно 50 : 50 (1 : 1), а достигается такое энантиомерное обогащение, при котором обеспечивается конечное отношение L-трео-формы к D-треоформе, равное 50 : 30 (5 : 3), то "и.э." по отношению к L-трео-форме составляет 25%. Если же конечное отношение L-трео-формы к D-трео-форме равно 70 : 30 (7 : 3), то "и.э." по отношению к L-трео-форме составляет 40%. Как правило, в соответствии с предлагаемым способом могут быть достигнуты значения "и.э.", равные 85% и выше.
Смеси стереоизомерных форм 2-амино-3-гидрокси-3-фенилпропионовой кислоты или 2-амино-2-метил-3-гидрокси-3-фенилпропионовой кислоты обычно получают путем простой конденсации соответственно глицина или аланина с подходящим бензальдегидом при использовании хорошо известных процедур. Поскольку такой синтез не является стереоспецифичным, то в результате получают рацемическую смесь D-трео и L-трео-изомеров соответствующих 2-амино-3-гидрокси-3-фенилпропионовой кислоты или 2-амино-2-метил-3-гидрокси-3-фенилпропионовой кислот.
Согласно предлагаемому способу смесь D,L-трео-2-амино-3-гидрокси-3-фенилпропионовой кислоты или D,L-трео-2-амино-2-метил-3-гидрокси-3-фенилпропионовой кислоты обрабатывают D-треонин-альдолазой. Ферментативный процесс оказывает воздействие только на одну хиральную форму (или оказывает воздействие на одну из хиральных форм в гораздо большей степени, чем на другую). D-треонин-альдолаза в результате не только расщепляет нежелательный D-изомер, тем самым способствуя процессу обогащения нужного энантиомера, но и воздействует на связь между 2-углеродным атомом и 3-углеродным атомом пропионовой кислоты, что в результате приводит к образованию соответствующего бензальдегида и аминокислоты - глицина или аланина. Бензальдегид и аминокислота, представляющие продукты ферментативной реакции, в тоже время являются исходными продуктами в синтезе D,L-трео-форм 2-амино-3-гидрокси-3-фенилпропионовой кислоты и 2-амино-2-метил-3-гидрокси-3-фенилпропионовой кислоты. Продукты реакции как таковые могут быть выделены и рециркулированы вновь в стадию конденсации для дальнейшего синтеза в 2-амино-3-гидрокси-3-фенилпропионовую кислоту или соответственно в 2-амино-2-метил-3-гидрокси-3-фенилпропионовую кислоту.
Например, D,L-трео-2-амино-3-гидрокси-3-фенилпропионовые кислоты формулы (I) обрабатывают D-треонин-альдолазой по следующей схеме: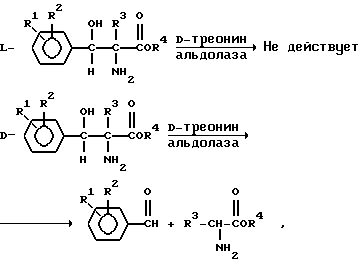
в которой
R1, R2, R3 и R4 - каждый имеет значение, определенное выше.
Ферменты D-треонин-альдолазы известны и могут быть получены, например, по методикам, описанным Kato et al. и Yamada et al., infra. Этот фермент может быть также выделен из микроорганизмов, способных приспосабливаться к различным экологическим условиям-убиквистам, обитающих в почве и не подвергавшихся действию треонина. В этом последнем способе микроорганизмы выращивают и инкубируют в подходящем питательном бульоне и D-треонине, а затем пересевают культуру и инкубируют в хемостате из питательного бульона и D-треонина. После дальнейшего инкубирования может быть выделена единственная колония, продуцирующая фермент D-треонин-альдолазу.
Фермент может быть выделен из клеток с использованием известных методик, например, связанных с разрушением клеток и выделением ферментсодержащего супернатанта. Целевой фермент может быть использован в несвязанном виде, либо в свободном от клеток экстракте или в виде цельного клеточного препарата, либо может быть иммобилизован на подходящей подложке или такой матрице, как сшитый декстран, агароза, силикагель, полиамид или целлюлоза. Фермент может быть также заключен в капсулы из полиакриламида, альгинатов, волокон и т.д. Способы подобного рода иммобилизации описаны в литературе (смотри, например, Methods of Enzymology, 44, 1976).
В практическом варианте осуществления способа фермент добавляют к смеси D- и L-трео-2-амино-3-гидрокси-3-фенилпропионовой кислоты или D- и L-трео-2-амино-2-метил-3-гидрокси-3-фенилпропионовой кислоты и реакционную смесь затем выдерживают при температуре активности фермента (примерно при 40oC) до тех пор, пока не будет достигнут требуемый избыток энантиомера L-формы. Эту точку можно легко определить при использовании, например, метода ВЭЖХ.
Част бывает удобно удалить один реагент из реакционной смеси для того, чтобы получить более высокий "и.э." согласно закону действующих масс. При этом нет необходимости удалять реагент физическим путем, что просто достаточно исключить (изолировать) из зоны ферментативной реакции. Например, использование сорастворителя, в котором один из продуктов реакции обладает предпочтительной растворимостью, способствует увеличению "и.э.". Бензальдегиды прекрасно растворимы в галогенированных алканах, таких как метиленхлорид и хлороформ, в низших алканонах, содержащих от 3 до 10 атомов углерода, таких как пентан-2-он или метилизобутилкетон, и ароматических углеводородах, например бензоле. Включение этих растворителей в реакционную смесь будет оказывать благоприятное воздействие. В другом случае добавление неионной смолы адсорбирующего типа, в частности Амберлита или Дауэкса (Amberlite, Dowex), на которой происходит адсорбция альдегида, также будет приводить к увеличению "и.э." в соответствии с теми же принципами.
Вслед за или в течение ферментативной реакции образующиеся бензальдегид и аминокислота могут быть рециркулированы в соответствии с процедурой, о которой шла речь выше. Нерасщепленную L-трео-форму 2-амино-3-гидрокси-3-фенилпропионовой кислоты выделяют и обрабатывают согласно известным методикам. Например, она может быть этерифицирована и затем восстановлена согласно ранее описанной методике с образованием соответствующего 2-амино-3-фенилпропан-1,3-диола. Если у фенильной группы в положении 4 имеется в качестве заместителя метилсульфонильная группа, то такой диол может быть просто подвергнут дихлорацетилированию с получением в результате тиамфеникола. Если фенильная группа в положении 4 замещена метилтиогруппой, то диол может быть дихлороацетилирован и затем окислен надуксусной кислотой, в результате чего тоже будет получен тиамфеникол.
Для получения флорфеникола подвергают прямому фторированию тиамфеникол, снова используя стандартные условия и в результате получают D-трео-2-(дихлороацетамидо)-3-(3-метилсульфонилфенил)-3- фторпропан-1-ол. Альтернативно, L-трео-2-амино-3-гидрокси-3-фенилпропионовую кислоту сначала этерифицируют и восстанавливают, как это описано выше, а аминогруппу затем защищают, например, посредством образования фталимидопроизводного, которое затем фторируют, и после удаления аминозащитной группы D-трео-2-амино-3-(3-метилсульфонилфенил)- 3-фторпропан-1-ол дихлорацетилируют, как описано выше.
Следующие примеры послужат иллюстративным материалом, который характерен для настоящего изобретения, но не ограничивает его рамки, при этом объем притязаний определяется исключительно приводимой формулой.
Пример 1
Рацемическую D,L-трео-2-амино-3-гидрокси-3-(4-метилтиофенил)пропионовую кислоту (0,7 г) добавляют к смеси, содержащей 20 мл 50 мМ бората натрия (pH 8,4), 1 мл 8 мМ пиридоксаль-5-фосфата и 4 мл экстракта D-треонин-альдолазы. Реакционную смесь выдерживают при 40oC до тех пор, пока не будет достигнут избыток энантиомера (определяют методом ВЭЖХ) в количестве не менее 98% L-трео-2-амино-3-гидрокси-3-(4-метилтиофенил)пропионовой кислоты; обычно в этих условиях процесс обогащения длится примерно 60 - 70 мин.
Пример 2.
Смесь из 2,5 г D-трео-2-амино-3-(4-метилтиофенил)пропан- 1,3-диола, полученного по способу, описанному в примере 1, и 3,6 мл этилдихлороацетата нагревают примерно при 100oC около 3 ч. Продукт реакции растворяют в этиленхлориде и отфильтровывают через активированный уголь. Фильтрат охлаждают и перекристаллизовывают из нитроэтана, в результате получают D-трео-2-дихлорацетамидо-3-(4-метилентиофенил)пропан-1,3-диол, т. пл. 111,6 - 112,6oC, [α]
Пример 3.
L-трео-2-амино-3-гидрокси-3-(4-метилсульфонилфенил)пропионовую кислоту получают из D,L-трео-2-амино-3-гидрокси-3- (4-метилсульфонилфенил)пропионовой кислоты, следуя процедуре, описанной в примере 1. Затем L-трео-2-амино-3-гидрокси-3- (4-метилсульфонилфенил)пропионовую кислоту этерифицируют и восстанавливают так, как описано выше, и в результате получают D-трео-2-амино-3-(4-метилсульфонилфенил)пропан-1,3-диол, т.пл. 201 - 202oC, [α]
D-трео-2-амино-3-(4-метилсульфонилфенил)пропан-1,3-диол подвергают затем дихлорацетилированию способом, аналогичным описанному в примере 2, и в результате получают тиамфеникол, т.пл. 164,3 - 166,3oC, [α]
Альтернативно тиамфеникол может быть получен из D-трео-2-дихлороацетамидо-3-(4-метилтиофенил)пропан-1,3-диола из примера 2 путем окисления надуксусной кислотой в традиционных условиях.
Пример 4.
6 г (150 ммоль) гидроокиси натрия и 8,9 г (100 ммоль) D,L-аланина растворяют в 25 мл воды и раствор охлаждают примерно до 5,5oC при перемешивании в атмосфере азота. К раствору добавляют 21,2 г (200 ммоль) бензальдегида и смесь перемешивают при 5,5oC около 1 ч. Затем смесь нагревают до комнатной температуры и выдерживают около 20 ч. Затем добавляют концентрированную соляную кислоту и доводят pH до 2. После перемешивания подкисленного раствора в течение 2 ч отделяют водную фазу, экстрагируют этилацетатом и упаривают в вакууме. Полученный материал дважды экстрагируют 80 мл абсолютного этилового спирта, а затем упаривают этанол. Полученный продукт вновь экстрагируют 40 мл абсолютного этанола с последующим удалением этанола. Экстракт затем растворяют в водно-метанольном растворе с соотношением по крайней мере 1 : 1 и абсорбируют на колонке, заполненной полиметилметакрилатом. Содержимое колонки затем элюируют там же метанольно-водным раствором (1 : 1), фракции объемом 30 мл объединяют и упаривают. Затем вновь повторили очистку, пропустив через колонку, заполненную полиметилметакрилатом, используя 90% этанол. В результате получают рацемическую 2-амино-2-метил-3-гидрокси-3-фенилпропионовую кислоту.
Пример 5.
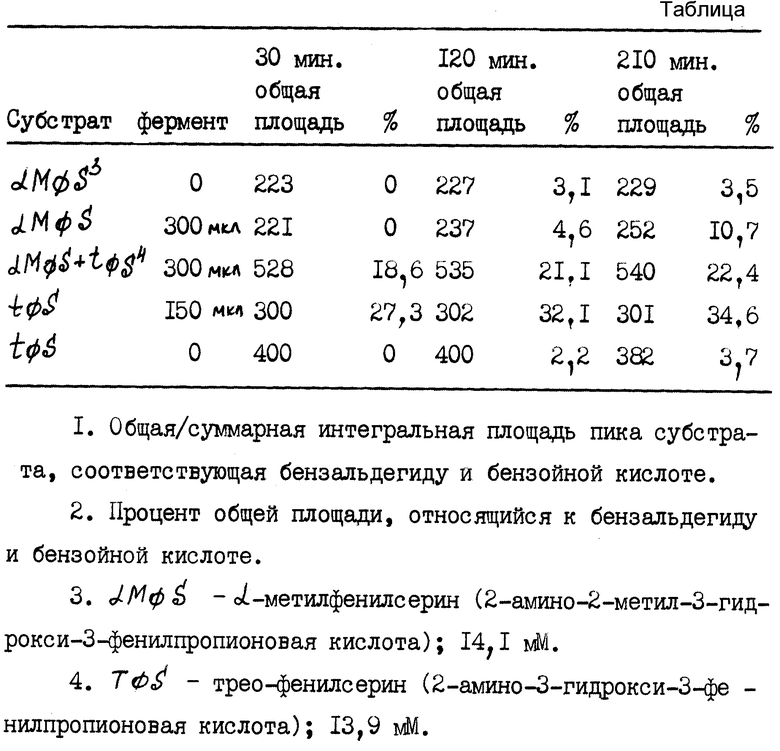
Следующая процедура подтверждается примером использования D-треонин-альдолазы в качестве средства, которое позволяет осуществить эффективное выделение L-изомера из рацемата D,L-трео-2-амино-2-метил-3-гидрокси-3-фенилпропионовой кислоты.
D, L-трео-2-амино-2-метил-3-гидрокси-3-фенилпропионовую кислоту (1,4 мМ) выдерживают при pH 8,75 в 50 мМ боратного буфера и 0,8 мМ пиридоксальфосфата в присутствии разрушенных клеток, содержащих около 300 мкл фермента.
Через определенные отрезки времени, составляющие около 30, 120 и 210 мин 200 мкл инкубационной смеси отбирают и разбавляют 800 мкл 1% хлорной кислоты. После центрифугирования смеси верхний слой анализируют методом ВЭЖХ. Данные, приведенные в таблице, демонстрируют эффективность действия фермента на процесс разделения рацемической смеси.
L-трео-2-амино-3-гидрокси-3-(4-метилтиофенил)пропионовая кислота, полученная таким способом, может быть этерифицирована и восстановлена борогидратом натрия согласно известным методикам; в результате получают D-трео-2-амино-3-(4-метилтиофенил)пропан-1,3-диол, т. пл. 151,9 - 152,9oC, [α]
Пример 6.
D-треонин-альдолазу продуцируют различными микроорганизмами, такими как Alcaligenes faecalis (депонированными в Институте Ферментов Осака, Япония, под номером IFO-12.669), Pseudomonas ДК-2 (депонированы в Институте исследования ферментов, Agency of Industrial Science and Technology, Ministry of Internacional Trade and Industry, Япония, под номером FERM-P N 6200) и Arthrobacter DK-19, FERM-P N 6201. Смотри, например, патент США N 4492757, Kato и др., и патент Япония 56 - 209983, Yamada и др. 1985.
Кроме того, микроорганизмы, продуцирующие D-треонин-альдолазу, могут быть выделены из образцов почвы следующим образом.
Образец почвы, ранее подвергавшийся обработке треонинами, инокулируют в колбе, встряхиваемой с 50 мл водной среды (называемой здесь далее "среда А"), которая, как правило, содержит следующие компоненты:
NH4Cl - 1 г/л
MgCl2 - 1 г/л
CaCl2 - 0,015 г/л
KH2PO4 - 2,7 г/л
NaOH - 0,5 г/л
и стандартные растворы микроэлементов - 1 мл/л
MgSO4 - 1 г/л
CaCl2 - 0,21 г/л
ZnSO4 • 7H2O - 0,2 мг/л
MnSO4 • 4H2O - 0,1 мг/л
H3BO3 - 0,02 мг/л
CuSO4 • 5H2O - 0,10 мг/л
CuCl2 • 6H2O - 0,05 мг/л
NiCl2 • 6H2O - 0,01 мг/л
FeSO4 - 1,5 мг/л
NaMoO4 - 2,0 мг/л
Fe ЭDTA - 5,0 мг/л
KH2PO4 - 20,0 мМ
NaOH - До pH 7
Состав стандартного раствора микроэлементов не является критическим параметром, определяющим протекание процесса, но во всех процедурах его стандартизируют для того, чтобы устранить его влияние как переменной величины.
Среду A и почву, содержащую микроорганизм, инокулируют с 3 г/л D-треонина и инкубируют при 30oC при встряхивании (200 об/мин) в течение 5 дней. 1 мл образца затем пересевают в такую же встряхиваемую колбу и снова инкубируют, как указано выше до помутнения. 5 мл помутневшей культуры затем инокулируют в хемостате со средой A и 3,0 г/л D-треонина и выдерживают при постоянном разбавлении со скоростью 0,03/мин в течение двух недель. Жидкую среду их хемостата высевают на пластинку или чашку Петри со средой A и 15 г/л благородного агара. После инкубационного периода, длящегося 5 дней при 30oC, выделяют одну колонию. Изолированный штамм - это грамм-отрицательные микроорганизмы палочкообразной формы, которые были идентифицированы как Alcaligenes dentrificans xylosoxydans методом анализа жирных кислот, входящих в состав стенки клетки.
50 мл среды A, содержащей 6,0 г/л D-треонина, инокулируют с Alcaligenes dentrificans xylosoxydans. После инкубирования смеси при 37oC в течение 48 ч 10 мл смеси пересевают в 250 мл среды A, содержащей 6,0 г/л D-треонина. Через 40 ч инкубирования при 37oC клетки путем центрифугирования при 10000 G концентрируют в пасту и промывают 50 мл фосфатного буфера с pH 7 и снова концентрируют в пасту путем центрифугирования с 10000 G. Промытую пасту помещают под French Press при давлении 17000 фунтов/дюйм2 (1195 кг/см2) для разрушения клеток и получения клеточного экстракта. Клеточный дебрис удаляют путем центрифугирования в течение 1 ч при 100000 G, собирая верхний слой, содержащий фермент.
Пример 7.
После обогащения рацемической смеси D, L-трео 2-амино-3-гидрокси-3-(4-метилтиофенил)пропионовой кислоты или D, L-трео-2-амино-3-гидрокси-3-(4-метилсульфонилфенил)-пропионовой кислоты в L-трео-форму проводят регенерацию соответствующего 4-метилтиобензальдегида или 4-метилсульфонилбензальдегида соответственно из водного раствора, снижая его pH до 0,5 добавлением соляной кислоты для того, чтобы расщепить основание Шиффа. Полученный таким образом бензальдегид отфильтровывают и рециркулируют снова в стадию конденсации.
Пример 8.
Смесь D- и L-трео-2-амино-3-гидрокси-3-(4-метилсульфонил)пропионовой кислоты (0,8 г) соединяют с 10 мл 50 мМ раствора фосфата натрия (pH 8,0), 0,5 мМ пиридоксальфосфата и 20 мл метиленхлорида. 10 мл неочищенной D-треонин-альдолазы добавляют для инициирования реакции. Через 90 мин "и. э." составил 94%.
Пример 9.
Смесь D- и L-трео-2-амино-3-гидрокси-3-(4-метилсульфонил)пропионовой кислоты (2,0 г) добавляют к 10 мл раствора 50 мМ фосфата натрия (pH 8,0), 0,8 мМ пиридоксаль-5-фосфата и 100 мМ хлорида натрия. Добавляют 20 г увлажненной смолы марки Amberlit XAD-16 вместе с 10 мл неочищенной D-треонин альдолазы. Реакционную смесь энергично перемешивают при 42oC в течение 120 мин и в результате получают L-трео-2-амино-3-гидрокси-3-(4-метилсульфонилфенил)пропионовую кислоту и с "и. э." 96%.
Смеси энантиомерных D,L-трео-2-амино-3-гидрокси-3-фенилпропионовых кислот, или их производных, или их солей стереоизомерно обогащают путем контактирования смеси с D-треонин-альдолазой, D- и L-трео-2-амино-3-гидрокси-3-(4-метилсульфонилфенил)пропионовую кислоту обрабатывают D-треонинальдолазой с образованием L-трео-2-амино-3-гидрокси-3-(4-метилсульфонилфенил)пропионовой кислоты с высоким значением выходов и достаточной селективностью. Бензальдегид и аминокислота, которые образуются из D-треоизомера, могут рециркулироваться на стадию конденсации. 9 з.п. ф-лы, 1 табл.
где R1 и R2 независимо друг от друга-водород, гидроксильная группа, галоген, трифторметил, низший алкил, низшая алкоксигруппа, низший алкилсульфонил, низший алкилсульфинил или низшая алкилтиогруппа;
R3 - водород или низший алкил;
R4 - водород или карбоксизащитная группа,
или их солей с основанием, когда R4 - водород, отличающийся тем, что проводят обработку указанной смеси в водной среде D-треонин-альдолазой, активной по отношению к D-трео-энантиомеру и практически не активной по отношению к L-трео-энантиомеру, до тех пор, пока значительное количество D-трео-энантиомера не превратится в бензальдегид и глицин или аланин.
Авторы
Даты
1998-06-10—Публикация
1992-03-26—Подача