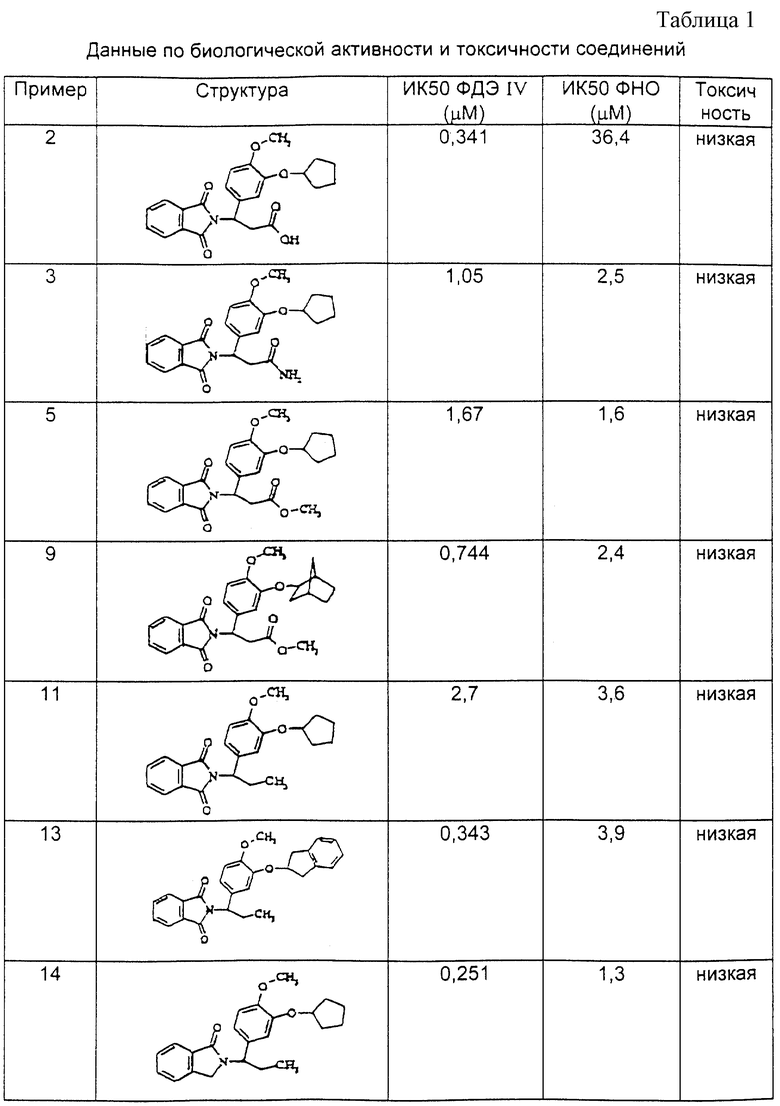
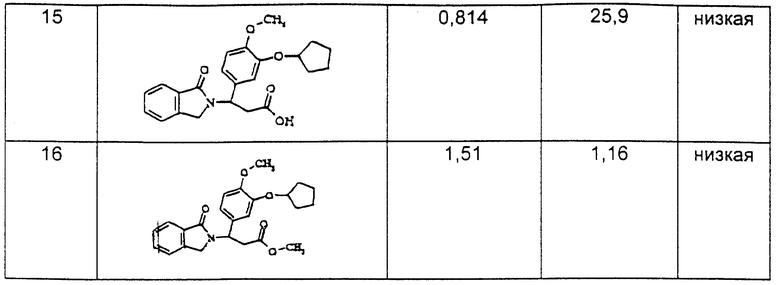
Изобретение относится к классу веществ, которые ингибируют действие фосфодиэстераз, в частности ФДЭ III и ФДЭ IV и образование фактора некроза опухоли А (или ФHOα, а также ядерного фактора кВ (или ЯФкВ). Схематически эти вещества могут быть представлены следующей формулой: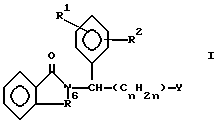
где один из R1 и R2 представляет собой структуру типа R3-X-, а другой это - водород, нитро, циано, трифторметил, карбо (низший) алкокси, ацетил, карбамоил, ацетокси, карбокси, гидрокси, амино, низший алкил, алкиламино, низший алкокси, гало, HF2CO, F3CO или R3-X-;
R3 - это моноциклоалкил, бициклоалкил или бензоциклоалкил с числом углеродных атомов до 18, тетрогидропиран или тетрогидрофуран;
X - это углерод-углеродная связь, -CH2-, -O- или -N=;
R5 - это: (1) o-фенилен, незамещенный или замещенный одним или более чем одним заместителями, которые каждый выбираются независимо из нитро, циано, трифторметила, карбо(низшего)алкокси, ацетила или карбамоила, незамещенного или замещенного низшим алкилом, ацетокси, карбокси, гидрокси, амино, низшим алкиламино, низшим ациламино, аминоалкилом или низшим алкокси; (2) вицинально двухвалентный остаток пиридина, пирролидина, имидазола, нафталина или тиофена, в которых двухвалентные связи располагаются при вицинальных кольцевых углеродных атомах; (3) вицинально двухвалентный циклоалкил или циклоалкенил с числом углеродных атомов от 4 до 10, незамещенные или замещенные одним или более заместителями, которые каждый выбираются независимо из группы, состоящей из нитро, циано, гало, трифторметила, карбо(низшего)алкокси, ацетила, карбамоила, ацетокси, карбокси, гидрокси, амино, низшего алкиламина, низшего алкила, низшего алкокси или фенила; (4) винилен двузамещенный низшим алкилом; или (5) этилен, незамещенный или однозамещенный или двузамещенный низшим алкилом;
R6 - это -CO-, -CH2-, или -CH2CO-;
Y - это -COZ, -CPN, -OR8, низший алкил или арил;
Z - это -MH2, -ОН, -NHR, -R9 или -OR9;
R8 - это водород или низший алкил;
R9 - это низший алкил или бензил; и
n - 0, 1, 2, или 3.
Используемый здесь термин "алкил" означает насыщенную разветвленную или неразветвленную одновалентную углеводородную цепь. Если специально не указано, такие цепи могут содержать от 1 до 18 углеродных атомов. Представителями таких алкильных групп являются метил, этил, пропил, изопропил, бутил, изобутил, вторичный бутил, третичный бутил, пентил, изопентил, неопентил, третичный пентил, гексил, изогексил, гептил, октил, нонил, децил, ундецил, додецил, тридецил, тетрадецил, пентадецил, гексадецил, гептадецил, октадецил и подобные. Когда вещества квалифицируются как "низшие", алкильная группа содержит от 1 до 6 углеродных атомов. Такое же содержание углеродных атомов подразумевается при использовании термина "алкан" как основного термина и при использовании производных терминов, таких как "алкокси".
Используемый здесь термин "циклоалкил" означает одновалентную насыщенную циклическую углеводородную цепь. Если специально не указано, такие цепи могут содержать до 18 углеродных атомов. Моноциклоалкил относится к группам, имеющим одно кольцо. Полициклоалкил означает углеводородные группы, имеющие две или более кольцевые системы, которые имеют два или более общих кольцевых атомов. Бензоциклоалкил означает моноциклическую или полициклическую группу, конденсированую с бензокольцом.
Представителями моноциклоалкильных групп являются циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклодецил, циклоундецил, циклододецил, циклотридецил, циклотетрадецил, циклопентадецил, циклогексадецил, циклогептадецил и циклооктадецил. Представителями полициклоалкильных групп являются бицикло[2.2.1] гептил, бицикло[3.2.1] октил и бицикло[2.2.2]октил. Типичными представителями бензоциклоалкила являются тетрагидронафтил, инданил и бензоциклогептанил.
Это изобретение также относится к способу уменьшения уровня цитокинов и их предшественников у млекопитающих и к используемым для этого композициям.
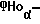 это цитокин, который высвобождается первоначально моноядерными фагоцитами в ответ на иммуностимуляторы. Введенный животным или людям ФНOα может вызывать воспаление, лихорадку, сердечно-сосудистые эффекты, геморрой, коагуляцию и острофазные ответы, подобные тем, которые наблюдаются в течение острых инфекций и шоковых состояний.
это цитокин, который высвобождается первоначально моноядерными фагоцитами в ответ на иммуностимуляторы. Введенный животным или людям ФНOα может вызывать воспаление, лихорадку, сердечно-сосудистые эффекты, геморрой, коагуляцию и острофазные ответы, подобные тем, которые наблюдаются в течение острых инфекций и шоковых состояний.
ЯФкВ - это плеотропный транскрипционный активатор (Lenardo, et al., Cell 1989, 58, 227-29), который вовлечен во многие заболевания и воспалительные состояния. Предполагается, что ЯФкВ регулирует уровни цитокинов, включая ФНOα, но не ограничиваясь им, и является активатором ВИЧ транскрипции (Dbaibo et al. , J. Biol. Chem. 1993, 17762-17766; Duh etaL, Proc. Natl. Acad. Sci. 1989, 86, 5974-5978; Bachelerie et. al., Nature 1991, 350, 709-712; Boswas et al., J. Acquired Immene Deficiency Syndrome 1993, 6, 778-786: Suzuki et al., Biochem, and Biophys. Res. Comm. 1992, 189, 1709-1715; Suzuki et al., Biochem. Mol. Bio. Int. 1993, 31(4), 693-700: Shakhov et al., 1990, 171, 35-47; Staal et al., Proc. Natl. Acad. Sci. USA 1990, 87, 9943-9947. Таким образом, ингибирование ЯФкВ связывания может регулировать транскрипцию цитокинного гена (генов), и через эту модуляцию и другие механизмы является пригодным в ингибировании множества болезней. Уровни ФНOα и ЯФкВ находятся во взаимной обратной связи.
Многие клеточные функции, которые вносят вклад в воспалительные процессы и болезни, включая астму, воспаления и другие процессы, опосредованы уровнями аденозин 3', 5'-циклического монофосфата (цАМР). Смотри, например, Lowe and Cheng, Drugs of the Future, 17(9), 799-807, 1992. Было показано, что повышение уровня цАМР в воспалительных лейкоцитах ингибирует их активацию и последующее высвобождение воспалительных медиаторов. Увеличенные уровни цАМР ведут также к релаксации гладких мышц дыхательных путей. Первичным клеточным механизмом для инактивации цАМР является разрыв цАМР с помощью семейства изоферментов (известно семь таких изоферментов), которые называются циклическими фосфодиэстеразами (ФДЭ). Считается, например, что ингибирование ФДЭ IV является особенно эффективным как при ингибировании высвобождения воспалительного медиатора, так и при релаксации гладких мышц дыхательных путей. Таким образом, соединения, которые ингибируют ФДЭ IV специфично ингибируют воспаление и уменьшают напряжение гладких мышц дыхательных путей, причем побочные эффекты, такие как сердечно-сосудистые или антитромбоцитные, минимальны. Сегодня известно, что ингибирование продуцирования ФНOα является следствием ингибирования ФДЭ IV.
Чрезмерное или нерегулируемое продуцирование ФНOα вовлечено в ряд болезней. Сюда относятся эндотоксимия и (или) синдром токсичного шока (Tracey et al. , Nature 330, 662-664 1987; Hinshaw et al., Circ. Shock 30, 279-292, 1990): кахексия (Dezube et al., Lancet, 335 (8690), 662 (1990)); и респираторный дистресс-синдром у взрослых (ARDS), когда концентрация ФНOα как было выявлено при помощи легочных аспираций у ARDS пациентов, превышала 12,000 пкг/мл (Millar et al., Lancet 2 (8665), 712-714, 1989). Системная инфузия рекомбинантного ФНOα, также приводила к типичным изменениям, наблюдаемым при респираторном дистресс-синдроме у взрослых (Ferrari-Baliviera et al., Arch. Surg. 124 (12), 1400 - 1405, 1989).
Видимо ФНOα также вовлечен в болезни костной резорбции, включая артриты, причем определено, что, будучи активированы, лейкоциты проявляют костно-резорбирующую активность и данные указывают на то, что ФНOα вносит вклад в эту активность (Bertolini et al., Nature 319, 516-518 1986; Johnson et al., Endocrinology 124 (3), 1424-1427 1989). Было установлено, что ФНOα стимулирует костную резорбцию и ингибирует образование кости in vitro и in vivo посредством стимуляции образования остеокластов и активации, сочетающейся с ингибированием функции остеобластов. Хотя ФНOα может быть вовлечен во многие болезни костной резорбции, включая артриты, наиболее характерным фактом его участия является связь между продуцированием ФНOα опухолью или тканями хозяина, и злокачественностью, связанной с гиперкальцемией (Calci. Tissue Int. (US) 46 (Suppl.), S3-S10 1990). При болезни Графта в противоположность болезни Хоста, увеличенный уровень ФНOα в сыворотке связан с основными осложнениями, которые сопровождают острые аллогенные транспланты костного мозга (Holler et al., Blood, 75 (4), 1011-1016, 1990).
Малярия мозга - это летальный сверхострый неврологический синдром, связанный с высокими уровнями ФНOα в крови, и наиболее тяжелыми осложнениями, встречающимися у больных малярией. Уровни ФНOα в сыворотке прямо коррелируют со сложностью заболевания и прогнозом у пациентов с острыми приступами малярии (Grau et al., N. Engl. J. Med. 320 (24), 1586-1591, 1989).
ФНOα также, очевидно, играет роль в болезнях, связанных с хроническим воспалением легких. Отложение частиц двуокиси кремния приводит к силикозу, болезни прогрессивной респираторной недостаточности, вызванной фиброзной реакцией. Антитела к ФНOα полностью блокировали кремнеиндуцированный фиброз легких у мышей (Pignet et al., Nature, 344, 245-247, 1990). Высокие уровни продуцирования ФНOα в плазме и выделенных макрофагах) были продемонстрированы на животных с фиброзом, вызванным двуокисью кремния и асбестом (Bissonnette et. al., Inflammation 13(3), 329-339, 1989). Также было обнаружено, что альвеолярные макрофаги пациентов с легочным саркоидозом высвобождают спонтанно большие количества ФНOα по сравнению с макрофагами от нормальных доноров (Baughman et al., J. Lab. Clin. Med. 115 (1), 36-42, 1990).
ФНOα также вовлечен в воспалительный ответ при реперфузии (реперфузионное повреждение) и является основной причиной повреждения ткани после потери кровотока (Vedder et al., Proc. Natl. Acad. Sci. 87, 2643-2646, 1990) ФНOα также изменяет свойства клеток эндотелия и имеет различные прокоагулянтные активности, такие как продуцирование увеличения в ткани фактора прокоагулянтной активности и подавление пути антикоагулянтного белка C, так же как и даун-регуляция экспрессии тромбомодулина (Sherry et al., J. Cell Biol. 107, 1269-1277, 1988). ФНOα имеет провоспалительные активности, которые вместе с его ранним продуцированием (в течение начальной стадии воспаления) делает его вероятным медиатором повреждения ткани в некоторых важных нарушениях, включая, но не ограничиваясь ими, инфаркт миокарда, инсульт и циркуляторный шок. Особенно важной может быть ФНOα-индуцированная экспрессия молекул адгезии, таких как внутриклеточные молекулы адгезии (ICAM) или эндотелиальные лейкоцитозные молекулы адгеэии (ELAM) на эндотелиальных клетках (Murno et al., Am. J. Path. 135 (1), 121- 132, 1989).
Более того, сейчас известно, что ФНOα , является сильным активатором репликации ретровируса, включая активацию ВИЧ-1 (Duh et al., Proc. Nat. Acad. Sci. 86, 5974-5978, 1989; Poll et al., Proc. Nat. Acad. Sci. 87, 782-785, 1990: Monto et al., Blood 79, 2670, 1990; Clouse etal., J. Immunol., 142, 431-438, 1989; Poll et al., AIDS Res. Hum. Retrovirus, 191-197, 1992). СПИД возникает в результате инфекции Т-лимфоцитов вирусом иммунодефицита человека (ВИЧ). По меньшей мере, три типа или штамма ВИЧ были идентифицированы, а именно ВИЧ-1, ВИЧ-2 и ВИЧ-3. Как следствие ВИЧ-инфекции, иммунитет, опосредованный Т-клетками, ослабляется и инфицированные индивидумы демонстрируют сильные оппортунистические инфекции и/или необычные новообразования. Вход ВИЧ в Т-лимфоцит требует активации Т-лимфоцита. Другие вирусы, такие как ВИЧ-1 и ВИЧ-2, инфицируют Т-лимфоциты после активации Т-клеток, и экспрессия (и/или) репликация белка такого вируса опосредуется или поддерживается такой активацией Т-клеток. Однажды активированный Т-лимфоцит, инфицированный вирусом иммунодефицита человека (ВИЧ), должен поддерживаться в активированном состоянии для того, чтобы происходила генная экспрессия и/или репликация вируса иммунодефицита человека (ВИЧ). Цитокины, особенно ФНОА, вовлечены в опосредованную активированными Т-клетками экспрессию белка ВИЧ, и/или вирусную репликацию в поддержании активации Т-лимфоцита. Поэтому препятствие цитокинной активности посредством предотвращения или ингибирования продуцирования цитокинов, а именно ФНOα у ВИЧ- инфицированных индивидумов помогает в ограничении поддержания активации Т-лимфоцитов, вызванной ВИЧ-инфекцией.
Моноциты, макрофаги и соответствующие клетки, такие как клетки Купфера и глиальные клетки, также вовлечены в поддержание ВИЧ-инфекции. Эти клетки, подобно Т-клеткам, являются мишенями для вирусной репликации, и уровень вирусной репликации зависит от состояния активации клеток (Rosenberg et al., The Immunopathogenesis of HIV Infection, Advance in Immunology, 57 1998). Было показано, что цитокины, такие как ФНOα, активизируют ВИЧ-репликацию в моноцитах и/или в макрофагах (Poli et al., Proc. Natl. Acad. Sci., 87, 782-784, 1990), поэтому предотвращение или ингибирование продуцирования или активности цитокинов помогает в ограничении развития вируса ВИЧ, как утверждалось выше для Т-клеток. Дополнительные изучения определили ФНOα как общий фактор в активации ВИЧ in vitro и дали ясный механизм действия через ядерный регуляторный белок, найденный в цитоплазме клеток (Osborn et al., Proc. Natl. Acad. Sci. 86. 2336-2340, 1989). Это доказательство предполагает, что уменьшение синтеза ФНOα возможно, имеет антивирусный эффект в ВИЧ-инфекциях посредством уменьшения транскрипции и за счет этого воспроизводства вируса.
СПИД вирусная репликация латентного ВИЧ в Т-клетках и линиях макрофагов может быть индуцирована при помощи ФНОА (Folks et al., Proc. Natl. Acad. Sci. 86, 2365-2368 1989). Предполагается, что молекулярный механизм активности индукции вирусов происходит за счет способности ФНOα/ активировать ген-регуляторный белок (ЯФkB), обнаруженный в цитоплазме клеток, который стимулирует репликацию ВИЧ посредством связывания с последовательностью вирусного регуляторного гена (LTR) (Osborn et al., Proc, Natl. Acad. Sci. 86, 2336-2340, 1989). Повышенное содержание сывороточного ФНOα и высокие уровни спонтанного ФНOα продуцирования в моноцитах периферийной крови пациентов говорит о присутствии ФНOα при СПИД-ассоциированной кохексии (Wright et al., J. Immunol. 141 (1), 99-104 1988).
ФНOα вовлечен в другие вирусные инфекции, такие как цитомегало вирус, вирус гриппа, аденовирусы и семейство вирусов герпеса по тем же причинам, которые уже были упомянуты.
Признано, что подавление эффектов ФНOα может быть выгодным в различных случаях, и в прошлом стероиды, такие как дексаметазон и преднизолон, так же как и поликлональные и моноклональные антитела (Beutler et al., Science 234, 470-474, 1985; WO 92/11383) использовались для этой цели. Случаи, в которых ингибирование ФНOα или ЯФкB является желательным, включают в себя септический шок, сепсис, эндотоксический шок, гемодинамический шок и синдром сепсиса, пост-ишемическое реперфузионное повреждение, малярию, микобактериальную инфекцию, менингит, псориаз, конгестивную сердечную недостаточность, фиброзную болезнь, кахексию, отторжение трансплантанта, рак, аутоиммунное заболевание, оппортунистические инфекции при СПИДе, ревматоидный артрит, ревматоидный спондилит, остеоартрит и другие случаи артритов, болезнь Крона, язвенный колит, рассеянный склероз, системную красную волчанку, узловатую эритему при проказе, радиационное повреждение, гипероксичное альвеолярное повреждение.
Эти соединения могут использоваться под наблюдением квалифицированных специалистов для ингибирования нежелательных эффектов ФНOα, ЯФkB или фосфодиэстеразы. Эти вещества могут быть введены млекопитающим, нуждающимся в лечении, орально, ректально или парентерально по одному или в комбинации с другими терапевтическими средствами, включая антибиотики, стероиды и т. д. Формы оральных доз включают в себя таблетки, капсулы, драже и подобные сформованные, спрессованные фармацевтические формы. Изотонические солевые растворы, содержащие 20-100 мг/мл, могут быть использованы для парентерального введения, которое включает внутримышечное, интратекальное, внутривенное и внутриартериальное. Ректальное введение может быть более эффективным посредством использования суппозиторий, сформированных с использованием обычных носителей, таких как масло какао.
Режимы дозирования должны быть указаны особо, учитывая возраст, вес и общее физическое состояние пациента и желаемый ответ, но обычно дозы будут от приблизительно 1 до приблизительно 1000 мг/день как требуется при разовом и множественном ежедневном введении. Обычно начальный режим лечения может быть скопирован с известного режима, эффективного в подавлении ФНOα активности соединениями настоящего изобретения в случаях других болезненных состояний, опосредованных ФНOα. Лечение индивидумов должно регулярно контролироваться по числу Т-клеток и Т4/Т8 отношению и/или по измерениям веремии, таким как уровни обратной транскриптазы или вирусных белков, и/или по развитию проблем, связанных с цитокин-опосредованными болезнями, такими как кахексия или мышечная дегенерация. Если не наблюдается никаких эффектов в результате нормального режима лечения, тогда количество агента, мешающего цитокинной активности, увеличивается, например, на 50% в неделю.
Соединения по данному изобретению также могут использоваться локально в лечении или профилактике локальных болезненных состояний, опосредованных или обостренных избыточным ФНOα продуцированием, таких как вирусные инфекции, например, вызванные вирусами герпеса или вирусный коньюктевит, псориаз, другие кожные нарушения и болезни и т.д.
Эти соединения также могут быть использованы при ветеринарном лечении млекопитающих помимо людей, когда необходимо предотвратить или ингибировать ФНOα продуцирование. К этим ФНOα опосредованным болезням у животных, которые лечатся терапевтически или профилактически, относятся болезненные состояния, такие как отмечались выше, но в особенности вирусные инфекции. В качестве примеров можно привести вирус кошачьего иммунодефицита, вирус инфекционной анемии лошади, артритный вирус козла, висна-вирус, медивирусы, так же как и другие медленно развивающиеся вирусы.
Соединения по изобретению обладают по меньшей мере одним хиральным центром, к которому присоединена отображенная фенильная группа и поэтому оптические изомеры будут существовать. Как рацематы этих изомеров, так и сами индивидуальные изомеры, а также диастереоизомеры, когда есть два или более хиральных центра, находятся в рамках настоящего изобретения. Рацематы могут быть использованы как таковые или могут быть разделены на их индивидуальные изомеры механически, как то хроматографией, используя хиральный абсорбент. Альтернативно, индивидуальные изомеры могут быть приготовлены в хиральной форме или выделены химически из смеси посредством образованием солей с хиральной кислотой, таких как индивидуальные энантиомеры 10-камфорсульфоновой кислоты, камфорной кислоты, альфа-бромкамфорной кислоты, метоксиуксусной кислоты, винной кислоты, диацетилвинной кислоты, яблочной кислоты, пирролидон-5-карбоновой кислоты и т.п., и затем высвобождая одно или оба растворенных основания, возможно повторяя процесс так, чтобы получить один из двух или оба изомера, существенно свободных друг от друга, например, в форме, имеющей оптическую чистоту > 95%.
Ингибирование продуцирования ФНOα этими соединениями может быть удобным образом проанализировано с использованием методов, известных из уровня техники. Например, ФНOα ингибиторный анализ может быть проведен посредством большого количества известных методов.
Мононуклеарные клетки периферической крови (РВМС) от нормальных доноров получают при помощи центрифугирования в градиенте плотности Ficoll-Hypaque. Клетки культивируются в RPMI, снабженной 10% АВ+сывороткой, 2 мМ L-глутамина, 100 U/мл пеницилина и 100 мг/мл стрептомицина. Активное соединение растворяется в DMSO (Sigma Chemical), и дальнейшие растворения делаются в обогащенной RPMI. Конечная концентрация DMSO в присутствии или отсутствии лекарственного препарата в суспензиях мононуклеарных клеток периферической крови составляет 0,25 весовых процента. Тестируемые кандидаты анализируются при полулогорифмических растворениях, начиная при 50 мг/мл, будучи добавленными к РВМС (106 клеток на мл) в 96 луночных планшетах за час перед добавлением LPS. Мононуклеарные клетки периферической крови (106 клеток на мл) в присутствии или отсутствии этого соединения стимулируется обработкой 1 мг/мл LPS из штамма Salmonella minnesota R595 (List Biological Labs, Campbell, CA). Клетки затем инкубируются при 37oC в течение 18-20 часов. Затем супернатанты собираются и анализируются немедленно на ФНOα уровни или замораживаются при -70oC (не более чем на 4 дня) до анализа. Концентрация ФНOα в супернатанте определяется при помощи наборов для ИФА человеческого ФНOα (ENDOGEN, Boston, МА) согласно инструкциям производителя.
Особенно предпочтительными являются соединения, в которых R5 является орто-незамещенным или замещенным финиленом, R1 является низшим алкокси, R3 является моноциклоалкилом с числом углеродных атомов до 10, R6 является -CO- или -CH2-, Y является низшим алкилом, - COZ или - CPN, Z является -NH2, -ОН, или -O (низший алкил), и n принимает значения 0 или 1.
Соединения данного изобретения могут быть приготовлены с использованием известных методов. Например, допускается, что ангидрид циклической кислоты или лактон реагируют с соответствующим двузамещенным соединением фенила: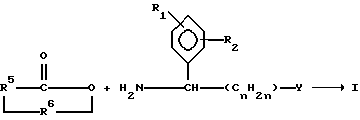
где, R1, R2, R5, R6, Y и n те, что определены выше. Реакция может быть осуществлена просто путем нагревания по аналогии со способом, изложенным в описании к патенту Великобритании N 1036694, который представлен здесь ссылкой. Возможно добавление уксусной кислоты с уксуснокислым натрием или без него.
Вместо кислого ангидрида или лактона может использоваться производное N-карбэтокси формулы: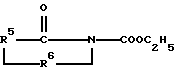
В дальнейшем воплощении, соединения, в которых R6 является -CH2-, формируются через конденсацию диальдегида с соединением двузамещенного фенила в присутствии кипящей в условиях обратного холодильника уксусной кислоты, используя метод Григгса (Griggs et al. , J. Chem. Soc., Chem. Comm., 1985, 1183-1184), который представлен здесь ссылкой.
Двузамещенный фенил, являющийся исходным материалом, может быть получен путем конденсации соответственно замещенного альдегида и малоновой кислоты, с промежуточным образованием фениламидина и последующим декарбоксилированием.
Двузамещенные альдегиды могут быть приготовлены с использованием классических методов получения эфиров, например реакция с соответствующим бромидом в присутствии карбоната калия. Многочисленные циклоалкилокси бензальдегиды и процедуры их получения описаны в литературе. См., например, Ashton et. al., J. Med. Chem., 1994, 37, 1696-1703; Saccomano et. al., J. Med. Chem., 1994, 34, 291-298; and Cheng et al. , Org. and Med. Chem. Lett., 1995, 5(7), 1969-1972, которые представлены здесь ссылками.
Представители исходных материалов включают 3-цикло-пентилокси-4-метоксибензальдегид, 3-цикло-пентилокси-4- этоксибензальдегид, 3-цикло-гексилокси-4-метоксибензальдегид, 3- (экзо-бицикло[2.2.1]гепт-2-илокси)-4-метоксибензальдегид, 3-(эндо- бицикло[2.2.1]гепт-2-илокси)-4- метоксибензальдегид, 3-(бицикло[2.2.2] окт-2-илокси)-4-метоксибензальдегид, 3-(бицикло[3.2.1] окт-2-илокси)-4-метоксибензальдегид, 3-индан-2-илокси-4- метоксибензальдегид, 3-(эндо-бензобицикло[2.2.1]гепт-2-илокси)-4- метоксибензальдегид.
Следующие примеры являются типичными, демонстрирующими сущность данного изобретения, однако, не следует истолковывать, что данное изобретение ограничивается ими.
Пример 1. 3-амино-3-(3-циклопентилокси-4-метоксифенил)пропионовая кислота.
Перемешанная суспензия 3-циклопентилокси-4-метоксибензальдегида (10,0 г, 45,4 мМоль) и уксуснокислого аммония (7,00 г, 90,8 мМоль) в этаноле (95%, 30 мл) нагревается в атмосфере азота до 45-50oC, и добавляется малоновая кислота (4,72 г, 45,4 мМоль). Данный раствор нагревают в колбе с обратным холодильником в течение 24 часов. Затем смеси дают охладиться до комнатной температуры и фильтруют. Твердую часть собирают и промывают этанолом, высушивают на воздухе, а затем в вакууме (60oC, < 1 мм) для получения 7,36 г (58%) продукта: точка плавления 225-226oC; 1H ЯМР (D2O/NaOH/TSP) д 7,05-6,88 (м, 3H), 4,91-4,78 (м, 1H), 4,21-4,14 (м, 1H), 3,79 (с, 3H), 2,59-2,46 (м, 2H), 2,05-1,48 (м, 8H). Пики следовых количеств примесей обнаруживались при 6,39 и 7,34 м. д. 13C ЯМР (D2O/NaOD/TSP/ д 182,9, 150,7, 149,1, 140,6, 121,6, 116,0, 114,9, 83,9, 58,5, 55,3, 49,8, 34,9, 26,3.
Подобным образом из 3-циклопентилокси-4-метоксибензальдегида, 3- циклопентилокси-4-этоксибензальдегида, и 3-циклогексилокси-4- метоксибензальдегида получают соответственно 3-амино-3-(3- циклопентилокси-4-метоксифенил)пропионовую кислоту, 3-амино-3-(3- циклопентилокси-4-этоксифенил)пропионовую кислоту и 3-амино-3-(3- циклогексилокси-4-метоксифенил)пропионовую кислоту.
Пример 2. 3-Фталимидо-3-(3-циклопентилокси-4-метоксифенил)пропионовая кислота.
К перемешанной смеси 3-амино-3-(3-циклопентилокси-4-метоксифенил)пропионовой кислоты (2,34 г, 8,40 мМоль) и углекислого натрия (0,96 г, 9,05 мМоль) в смеси воды (20 мл) и ацетонитрила (20 мл) в атмосфере азота добавляли N-карбетоксифталимид (1,9 г, 8,4 мМоль). После 3 часов ацетонитрил удаляли в вакууме. pH раствора был доведен до 1 водным раствором соляной кислоты (4 N). Затем добавляли эфир (5 мл) и смесь перемешивалась в течение 1 часа. Полученный сироп фильтровали, твердую часть промывали водой, высушивали на воздухе, а затем высушивали в вакууме (60oC, < 1 мм) до получения 2.92 г (85%) продукта в виде белого твердого вещества: точка плавления 159-162oC; 1H ЯМР (ДМСО-d6) д 12,40 (бр с, 1H), 7,96-7,80 (м, 4H), 7,02 (с, 1H), 6,90 (с, 2H), 5,71-5,52 (м, 1 Н), 4,81- 4,65 (м, 1H), 3,70 (с, 3H), 3,59-3,16 (м, 2H), 2,00-1,44 (м, 8H); 13C ЯМР(ДМСО-d6) д 171,7, 167,6, 149,1, 146,8, 134,6, 131,2, 131,1, 123,1, 119,4, 113,9, 112,1, 79,5, 55,5, 50,1, 36,1, 32,1, 32,1, 23,5. Аналитические вычисления для C23H23NO6. Теоретически: C, 67,47; H, 5,66; N, 3,42. Найдено: C, 67,34; H, 5,59; N, 3,14.
Подобным образом получали 3-фталимидо-3-(3-циклопентилокси-4- метоксифенил)пропионовую кислоту, 3-фталимидо-3-(3-циклопентилокси-4-этоксифенил)пропионовую кислоту, 3-фталимидо-3-(3- циклогексилокси-4- метоксифенил)пропионовую кислоту, 3-фталимидо-3-(3-(бицикло[3.2.1]окт-2- илокси)-4-метоксифенил)пропионовую кислоту, 3-фталимидо-3-(3-индан-2-илокси-4-метоксифенил)пропионовую кислоту и 3-фталимидо-3-{3-(эндо-бензобицикло[2.2.1]гепт-2-илокси)-4-метоксифенил}пропионовую кислоту.
Пример 3. 3-Фталимидо-3-(3-циклопентилокси-4-метоксифенил)пропионамид.
Смесь 3-фталимидо-3-(3-циклопентилокси-4-метоксифенил)пропионовой кислоты (2,05 г, 5,00 мМоль), 1,1'-карбонилдиимидазола (0,91 г, 5,5 мМоль) и 4-диметиламинопиридина (следовые количества) в тетрагидрофуране (20 мл) перемешивали 1,5 часа в атмосфере азота примерно при 25oC. К этому раствору добавляли гидроксид аммония (1,07 мл, 16,0 мМоль, 28-30%) и продолжали перемешивать в течение 1,5 часов. В течение этого времени образовывалось небольшое количество твердой части. Эта смесь концентрировалась до половины своего объема, и осаждался белый твердый осадок. Смесь отфильтровывалась, промывалась небольшим количеством тетрагидрофурана, высушивалась на воздухе и затем в вакууме (60oC, < 1 мм) до получения 1,27 г продукта. Этот продукт далее очищался колоночной флэш-хроматографией (силикагель, 5% метанол/метилен хлорид) и получившееся белое твердое вещество высушивалось в вакууме (60oC, < 1 мм) до получения 1 г (49%) продукта: точка плавления 165-166oC; 1H ЯМР (CDCl3) д 7,85-7,61 (м, 4H), 7,16-7,04 (м, 2H), 6,85-6,75 (м, 1H), 5,8 (дд, J=5,8, 10,4 Гц, 1H), 5,66 (бр с, 1H), 5,54 (бр с, 1H), 4,82-4,70 (м, 1H), 3,8 (с, 3H), 3,71 (дд, J=10,4, 15 Гц, 1H), 3,06 (дд, J=5,8, 15 Гц, 1H), 2,06-1,51 (м, 8H): 13C ЯМР (CDCl3) д 171,8, 168,3, 149,8, 147,7, 133,9, 131,8, 131,3, 123,3, 119,9, 114,6, 111,8, 80,4, 56,0, 51,6, 37,9, 32,7, 24,1. Аналитические вычисления для C23N24N2O5. Теоретически: C, 67,63; H, 5,92: N, 6,86. Найдено: C, 67,25; H, 5,76; N, 6,68.
Подобным образом получали 3-фталимидо-3-(3- циклопентилокси-4- метоксифенил)пропионамид, 3-фталимидо-3-(3-циклопентилокси-4-этоксифенил)пропионамид, 3-фталимидо-3-(3-циклогексилокси 4-метоксифенил)пропионамид, 3-фталимидо-3-{ 3-(эндо-бицикло[2.2.1]гепт-2-илокси)-4-метоксифенил} пропионамид, 3- фталимидо-3-{3-(бицикло[2.2.2]окт-2-илокси)-4- метоксифенил} пропионамид, 3-фталимидо-3-{3-(бицикло[3.2.1]окт-2- илокси)-4-метоксифенил}пропионамид, 3-фталимидо-3- {3-индан-2-илокси-4-метоксифенил} пропионамид, 3-фталимидо-3- {3-(эндо-бензобицикло[2.2.1]гепт-2-илокси)-4-метоксифенил}пропионамид.
Пример 4. Метил 3-амино-3-(3-циклопентилокси-4-метоксифенил)пропионат.
К охлажденной (до температуры ледяной бани) и перемешанной смеси 3-амино-3-(3-циклопентилокси-4-метоксифенил)пропионовой кислоты (3,00 г, 10,7 мМоль) в метаноле (20 мл) в атмосфере азота добавляли тионилхлорид (1,8 мл, 2,3 мМоль) по каплям при помощи шприца. Получившийся раствор перемешивали при 0oC в течение 1 часа, затем реакционную смесь снимали с ледяной бани и продолжали перемешивание при комнатной температуре в течение 1 часа и осаждали белое твердое вещество. Метанол удаляли и твердое вещество суспендировали в гексане. Смесь фильтровали и белое твердое вещество промывали гексаном, высушивали на воздухе и затем высушивали в вакууме (60oC, < 1 мм) до получения 2.69 г (76%) продукта в виде гидрохлоридной соли: точка плавления 183-184,5oC; 1H ЯМР (ДМСО-d6) д 8,76 (бр с, 3H), 7,25 (с, 1H), 7,06-6,89 (м, 2H), 4,85-4,75 (м, 1H), 4,58-4,44 (м, 1H), 3,74 (с, 3H), 3,55 (с, 3H), 3,31-2,86 (м, 2H), 2,06-1,44 (м, 8H); 13C ЯМР (ДМСО-d6)д 169,1, 149,3, 146,5, 128,4, 119,5, 113,5, 111,4, 79,0, 55,0, 51,2, 50,3, 38,2, 31,7, 31,6, 23,0. Аналитические вычисления для C16H24ClNO4. Теоретически: C, 58,27; H, 7,33; N, 4,25. Найдено: C, 58,44; H, 7,34; N, 4,13.
Подобным образом получали метил 3-амино-3-(3- циклопентилокси-4-метоксифенил)пропионат, метил 3-амино-3-(3- циклопентилокси-4-этоксифенил)пропионат, и метил 3-амино-3-(3- циклогексилокси-4-метоксифенил)пропионат, все в виде гидрохлоридов.
Пример 5. Метил 3-фталимидо-3-(3-циклопентилокси-4-метоксифенил)пропионат.
К перемешанному раствору метил 3-амино-3-(3-циклопентилокси- 4-метоксифенил)пропионата гидрохлорида (0,5 г, 1,52 мМоль) и карбоната натрия (0,16 г, 1,52 мМоль) в смеси воды (5 мл) и ацетонитрила (5 мл) в атмосфере азота добавляли N-карбетоксифталимид (0,34 г, 1,52 мМоль). Раствор перемешивался в течение 3 часов при комнатной температуре. Ацетонитрил удаляли под вакуумом, что приводило к образованию двуслойной смеси, которая затем экстрагировалась хлористым метиленом (3х15 мл). Объединенные экстракты органической фазы высушивались над сульфатом магния, фильтровались и затем концентрировались в вакууме до получения 0.77 г сырого продукта в виде масла. Этот сырой продукт очищался колоночной флэш-хроматографией, (силикагель 35/65, этил ацетат/гексан). Полученное стекловидное твердое вещество высушивалось в вакууме до получения 0,48 г (75%) продукта как белого твердого вещества: точка плавления 76-78oC; 1H ЯМР (CDCl3) д 7,86-7,60 (м, 4H), 7,19-7,00 (м, 2H), 6,88-6,72 (м, 1H), 5,84-5,67 (м, 1H), 4,85-4,70 (м, 1H), 3,80 (с, 3H), 3,80-3,69 (м, 1H), 3,63 (с, 3H), 3,34-3,15 (м, 1H), 2,10-1,48 (м, 8H); 13C ЯМР (CDCl3) д 171,0, 168,0, 149,8, 147,6, 133,9, 131,8, 130,9, 123,2, 120,1, 114,6, 111,7, 80,4, 55,9, 51,8, 50,7, 35,9, 32,7, 24,0. Аналитические вычисления для C24H25NO6. Теоретические данные: C, 68,03; H, 5,95; N, 3,31. Найдено: C, 67,77; H, 5,97; N, 3,20.
Подобным образом получали метил 3- фталимидо-3-(3-циклопентилокси-4-метоксифенил)пропионат, метил 3- фталимидо-3-(3-циклопентилокси-4-этоксифенил)пропионат и метил 3- фталимидо-3-(3-циклогексилокси-4-метоксифенил)пропионат.
Пример 6. 3-амино-3-(3-{экзо-бицикло[2.2.1]гепто-2-илокси}-4- метоксифенил)пропионовая кислота.
Перемешанная суспензия 3-(экзо-бицикло[2.2.1] гепт-2-илокси)- 4-метоксибензальдегида (6,00 г, 24,4 мМоль) и уксуснокислого аммония (3,76 г, 48,8 мМоль) в этаноле (95%, 20 мл) нагревали в атмосфере азота до 45-50oC и добавляли малоновую кислоту (2,53 г, 24,4 мМоль). Раствор нагревали в колбе с обратным холодильником в течение 24 часов, затем жидкость охлаждали до комнатной температуры и фильтровали. Твердую часть промывали этанолом, высушивали на воздухе, а затем в вакууме (60oC, < 1 мм) до получения 3,17 г (43%) продукта: точка плавления 225-226oC; 1H ЯМР (D2O/NaOD/TSP) д 7,09-6,90 (м, 3H), 4,41-4,28 (м, 1H), 4,27-4,15 (м, 1H), 3,82 (с, 3H), 2,64-2,48 (м, 2H), 2,44 (с, 1H), 2,31 (с, 1H), 1,92-1,76 (м, 1H), 1,69-1,38 (м, 4H), 1,30-1,05 (м, 3H).
Подобным образом из 3-(эндо-бицикло[2.2.1] гепт-2-илокси)-4- метоксибензальдегида, 3-(бицикло[2.2.2] окт-2-илокси)-4- метоксибензальдегида, 3-(бицикло[3.2.1] окт-2-илокси)-4- метоксибензальдегида, 3-индан -2-илокси-4-метоксибензальдегида и 3-(эндо-бензобицикло[2.2.1] гепт-2-илокси)-4-метоксибензальдегида получали соответственно 3-амино-3-{3-(эндо-бицикло[2.2.1] гепт-2- илокси)-4-метоксифенил пропионовую кислоту, 3-амино-3-{3- (бицикло[2.2.2]окт-2-илокси)-4-метоксифенил пропионовую кислоту, 3-амино-3-{ 3-(бицикло[3.2.1] окт-2-илокси)-4-метоксифенил пропионовую кислоту, 3-амино-3-{ 3-индан-2-илокси-4-метоксифенил} пропионовую кислоту, 3-амино-3-{3-(эндо-бензобицикло[2.2.1]гепт-2- илокси)-4-метоксифенил}пропионовую кислоту.
Пример 7. Метил 3-амино-3-(3-{экзо-бицикло-[2.2.1]гепт-2-илокси}- 4-метоксифенил)пропионат гидрохлорид.
К охлажденной до температуры ледяной бани и перемешиваемой суспензии 3-амино-3-(3-{ экзо-бицикло[2.2.1]гепт-2-илокси}-4- метоксифенил)пропионовой кислоты (2,00 r, 6,55 мМоль) в метаноле (15 мл) в атмосфере азота добавляли тионилхлорид (1,56 мл, 13,1 мМоль) по каплям при помощи шприца. Получившийся раствор перемешивали при 0oC в течение 30 минут, затем реакционную смесь снимали с ледяной бани и продолжали перемешивание при комнатной температуре в течение 2,5 часов. Метанол удаляли и твердое вещество суспендировали в гексане (15 мл). Смесь фильтровали и белое твердое вещество промывали гексаном, высушивали на воздухе и затем высушивали в вакууме (60oC, < 1 мм) до получения 1.97 г (85%) продукта: точка плавления 197,5-201,5oC: 1H ЯМР (ДМСО-d6) д 7,50 (бр с, 3H), 7,18 (с, 1H), 7,07-6,88 (м 2H), 4,56-4,42 (м, 1H), 4,30-4,19 (м, 1H), 3,74 (с, 3H), 3,54 (с, 3H), 3,41-2,85 (м, 3H), 2,37 (с, 1H), 2,27 (с, 1H), 1,92-1,75 (м, 1H), 1,64-1,03 (м, 6Н); 13C ЯМР (ДМСО-d6) д 169,4, 149,6, 146,4, 128,8, 120,0, 119,9, 113,8, 111,8, 80,1, 79,9, 55,5, 51,6, 50,7, 40,5, 39,2, 38,6, 34,8, 27,8, 23,7, 23,6.
Подобным образом получали метил 3-амино-3-{3-(эндо-бицикло- [2.2.1]гепт-2-илокси)-4-метоксифенил} пропионат, метил 3-амино-3-{3- (бицикло-[2.2.2] окт-2-илокси)-4-метоксифенил} пропионат, метил 3-амино-3-{3-(бицикло-[3.2.1] окт-2-илокси)-4-метоксифенил} пропионат, метил 3-амино-3-{3-индан-2-илокси-4-метоксифенил}пропионат и метил 3-амино-3-{3-(эндо-бензобицикло- [2.2.1]гепт-2-илокси)-4-метоксифенил}пропионат.
Пример 8. Следуя процедуре, описанной в примере 3, но заменив 3-фталимидо-3-{ 3-(экзо-бицикло-[2.2.1] гепт-2-илокси)-4-метоксифенил} пропионовую кислоту, получают 3-фталимидо-3-{3-(экзо-бицикло-[2.2.1]гепт-2- илокси)-4-метоксифенил}пропионамид.
Подобным образом получали 3-фталимидо-3-{3-(эндо-бицикло-[2.2.1]гепт-2- илокси)-4-метоксифенил} пропионамид, 3-фталимидо-3-{3-(бицикло-[2.2.2]окт-2- илокси)-4-метоксифенил} пропионамид, 3-фталимидо-3-{3-(бицикло-[3.2.1]окт-2- илокси)-4-метоксифенил} пропионамид, 3-фталимидо-3-{3-индан-2- илокси-4-метоксифенил} пропионамид и 3-фталимидо-3-{3-(эндо-бензобицикло- [2.2.1]гепт-2-илокси)-4-метоксифенил}пропионамид.
Пример 9. Метил 3-фталимидо-3-{3-(экзо-бицикло-[2.2.1]гепт-2-илокси)-4- метоксифенил}пропионат.
К перемешанному раствору метил 3-амино-3-{ 3-(экзо-бицикло- [2.2.1] гепт-2-илокси)-4-метоксифенил}пропионата гидрохлорида (1,00 г, 2,81 мМоль) и карбоната натрия (0,3 г, 2,8 мМоль) в смеси воды (10 мл) и ацетонитрила (10 мл) в атмосфере азота был добавлен N-карбетоксифталимид (0,64 г, 2,81 мМоль). Раствор перемешивали 3 часа при комнатной температуре. Ацетонитрил удаляли под вакуумом и остаток экстрагировали метиленхлоридом (3 х 30 мл). Объединенные органические экстракты высушивали над сульфатом магния, фильтровали и концентрировали в вакууме до получения 1,44 г продукта. Продукт затем очищали при помощи хроматографической флэш-колонки (силикагель, 20%, этилацетат/метиленхлорид) до получения белого твердого вещества, которое затем высушивали в вакууме до получения 0,23 г (18%) продукта: точка плавления 47- 48oC; 1H ЯМР (CDCl3) д 7,68-7,61 (м, 4H), 7,14-7,00 (м, 2H), 6,82- 6,74 (м, 1H), 5,75 (дд, J=5,9, 10 Гц, 1H), 4,25-4,14 (м, 1H), 3,84-3,69 (м, 1H), 3,79 (с, 3H), 3,63 (с,3H), 3,23 (дд, J=5,9, 16,5 Гц, 1H), 2,51-2,41 (м, 1H), 2,34-2,24 (м, 1H), 1,86-1,06 (м, 8H); 13C ЯМР (CDCl3) д 171,1, 168,1, 149,7, 147,2, 133,9, 131,8, 130.9, 123,3, 120,1, 120,0, 114,5, 114,4, 111,8, 81,1, 56,0, 51,9, 50,8, 41,1, 41,0, 39,9, 39,8, 35,9, 35,5, 35,3, 28,4, 24,3, ЖХВД 97%. Аналитически рассчитано для C26H27NO6. Теоретически: C, 69,47; H, 6.05; N, 3,12. Найдено: C, 69,22; H, 5,91; N, 2,95.
Аналогично получали метил 3-фталимидо-3-{3-(эндо-бицикло[2.2.1] гепт-2-илокси)-4-метоксифенил} пропионат, метил 3-фталимидо-3-{3-(бицикло[2.2.2] окт-2-илокси)- 4-метоксифенил}пропионат, метил 3-фталимидо-3-{3-(бицикло[3.2.1] окт-2-илокси)- 4-метоксифенил} пропионат, метил 3-фталимидо-3-{ 3-(индан- 2-илокси)- 4-метоксифенил}пропионат и метил 3-фталимидо-3-{ 3-эндо-бензобицикло[2.2.1]гепт-2-илокси)- 4- метоксифенил}пропионат.
Пример 10. 1-(3-Циклопентокси-4-метоксифенил)пропиламин.
К охлажденному на ледяной бане перемешанному раствору 1,1,1,3,3,3-гексаметилдисилазана (2,5 М, 4,1 мл, 19,5 мМоль) в тетрагидрофуране (5 мл) в атмосфере азота был добавлен раствор бутила лития в гексане (7,2 мл, 18 мМоль) через шприц, затем раствор вынимали из ледяной бани и перемешивали 30 минут при комнатной температуре. Затем этот раствор по каплям добавляли в охлажденный на ледяной бане раствор 3-циклопентокси-4- метоксибензальдегида (3,3 г, 15 мМоль) в тетрагидрофуране (5 мл) и смесь перемешивали 20 минут. Затем по каплям добавляли эфирный раствор этилмагний бромида (3 М, 10 мл, 30 мМоль). Реакционную смесь доводили до комнатной температуры и затем перемешивали при комнатной температуре. Развитие реакции наблюдали по ЖХВД (на колонке Waters Nova-Pak/EC 18, 3,9 x 150 мм, 4 микрона, 1 мл/мин, 240 нм, 35/65, CH3CN/0,1% H3PO4 (водный)) и через три часа не оставалось никаких исходных материалов. Реакционную смесь медленно вливали в насыщенный раствор хлорида аммония (100 мл). Полученную смесь экстрагировали метиленхлоридом (3 х 20 мл) и объединенные экстракты высушивали над сульфатом магния и концентрировали в вакууме до получения 5,6 г продукта, который затем очищали на хроматографической флэш-колонке (силикагель, 250/10/1 метиленхлорид/метанол/гидроксид аммония) до получения 2.5 г (67%) продукта в виде масла: 1H ЯМР (CDCl3) д 6,91-6,77 (м, 3H), 4,85-4,74 (м, 1H), 3,83 (с, 3H), 3,74 (т, J=6,8 Гц, 1H), 2,02-1,15 (м, 12H), 0,86 (т, J=7,4, Гц, 3H); 13C ЯМР (CDCl3) д 148,8, 147,5, 138,8, 118,4, 113,3, 111,8, 80,3, 57,40, 56,0, 32,7, 32,4, 10,9.
Пример 11. 3-Фталимидо-3-(3-циклопентокси-4-метоксифенил)пропан.
К перемешанному раствору 1-(3-циклопентокси-4-метоксифенил)пропиламина (1 г, 4 мМоль) и карбоната натрия (0,42 г, 4,0 мМоль) в смеси воды (5 мл) и ацетонитрила (5 мл) в атмосфере азота добавляли N-карбетоксифталимид (0,9 г, 4,0 мМоль). Раствор перемешивали 2,5 часа при комнатной температуре. Ацетонитрил удаляли в вакууме, что приводило к выпадению белого твердого вещества. Смесь фильтровали и твердую часть промывали водой, высушивали на воздухе, а затем в вакууме до получения 1,25 г (83%) продукта: точка плавления 100,0-102,5oC; 1H ЯМР (CDCl3) д 7,87-7,61 (м, 4H), 7,21-7,01 (м, 2H), 6,85-6,75 (м, 1H), 5,15 (дд, J=7, 9,3 Гц, 1H), 4,86-4,74 (м, 1H), 3,81 (с, 3H), 2,66-2,20 (м, 2H), 2,08-1,47 (м, 8H), 0,95 (т, J=7,3 Гц, 3H); 13C ЯМР (CDCl3) д 168,4, 149,4, 147,5, 133,8, 132,2, 131.9, 123,1, 120,5, 115,0, 111,5, 80,3, 55,6, 55,9, 32,7, 24,4, 11,6; ЖХВД (колонка Waters Nova-Pak/EC 18, 3,9 х 150 мм, 4 микрона, 1 мл/мин, 240 нм, 60/40, CH3CN/0,1% H3PO4 (водн.) 12 мин, 99%. Аналитически рассчитано для C23H25NO4. Теоретически: C, 72,80; H, 6,64; N, 3,69. Найдено: C, 72,72; H, 6,69; N, 3.65.
Пример 12. 1-(3-инданилокси-4-метоксифенил)пропиламин
К перемешанному на ледяной бане раствору 1,1,1,3,3,3- гексаметилдисилазана (2,7 мл, 13 мМоль) в тетрагидрофуране (5 мл) в атмосфере азота был добавлен раствор бутила лития в гексане (2,5 М, 4,8 мл, 12 мМоль) через шприц. Затем раствор снимали с ледяной бани и перемешивали 25 минут при комнатной температуре. Затем этот раствор по каплям добавляли в охлажденный на ледяной бане раствор 3-инданилокси-4-метоксибензальдегида (2,68 г, 10,0 мМоль) в тетрагидрофуране (4 мл) и смесь перемешивали в течение часа. Затем по каплям через шприц добавляли эфирный раствор этилмагний бромида (3 М, 6,7 мл, 20 мМоль). Реакционную смесь нагревали в колбе с обратным холодильником и наблюдали по ЖХВД (колонка Waters Nova- Pak/EC 18, 3,9 х 150 мм, 4 микрона, 1 мл/мин, 240 нм, 40/60, CH3CN/0,1% H3PO4 (водн.)). Через 48 часов реакция завершалась и смесь оставляли остывать до комнатной температуры. Реакционную смесь медленно вливали в насыщенный раствор хлорида аммония (80 мл). Полученную смесь экстрагировали метиленхлоридом (3 х 15 мл) и объединенные экстракты высушивали над сульфатом магния и концентрировали до получения продукта, который затем очищали на хроматографической флеш-колонке (силикагель, 250/10/1 метиленхлорид/метанол/ гидроксид аммония) до получения 0,27 г (9%) продукта в виде оранжевого твердого вещества.
Пример 13. 1-фталимидо-1-(3-инданилокси-4-метоксифенил)пропан.
К перемешанному раствору 1-(3-инданилокси-4-метоксифенил)пропиламина (0,25 г, 0,84 мМоль) и карбоната натрия (0,09 г, 0,84 мМоль) в смеси воды (2 мл) и ацетонитрила (2 мл) в атмосфере азота добавляли N-карбетоксифталимид (0,19 г, 0,84 мМоль). Раствор перемешивали 4 часа при комнатной температуре. Ацетонитрил удаляли в вакууме и полученную смесь экстрагировали метиленхлоридом (2 х 10 мл), высушивали над сульфатом магния и концентрировали в вакууме до получения 0,35 г продукта, который затем очищали на хроматографической флэш-колонке (силикагель, 25/75, этилацетат/гексан) до получения 0,19 г (48%) продукта в виде твердого вещества: точка плавления 62oC; 1H ЯМР (CDCl3) д 7,86-7,63 (м, 4H), 7,29-7,04 (м, 6H), 6,87-6,78 (м, 1H), 5,30-5,14 (м, 2H) 3,77 (с, 3H): 3,52-3,14 (м, 4H), 2,66-2,21 (м, 2H), 0,97 (т, J=7,3 Гц, 3H), 13C ЯМР (CDCl3) д 168,4, 149,6, 147,1 140,7, 140,6, 133,8, 132,2, 131,8, 126,5, 124,6, 123,1, 121,2, 115,3, 111,7, 79,0, 56,5, 55,9, 39,6, 39,6, 24,4, 11,6; ЖХВД (колонка Waters Nova-Pak/EC 18, 3,9х150 мм, 4 микрона, 1 мл/мин, 240 нм, 60/40, CH3CM/0,1% H3PO4 (водн.)) 12 мин, 98%. Аналитически рассчитано для C27H25NO4. Теоретические данные: C, 75,86; H, 5,89; N, 3,28. Найдено: C, 75,58: H, 5,90; N, 3.20.
Пример 14. 1-(1-оксоизоиндолин)-1-(3-циклопентокси-4- метоксифенил)пропан.
Перемешанный раствор фталиевого дикарбоксальдегида (0,4 г, 3 мМоль) и 1-(3-циклопентокси-4-метоксифенил)пропиламина (0,75 г, 3,0 мМоль) в ледяной уксусной кислоте (9 мл) в атмосфере азота нагревали в колбе с обратным холодильником 5 минут. Перемешанную смесь оставляли остывать до комнатной температуры и затем концентрировали в вакууме до получения продукта, который затем очищали на хроматографической флэш-колонке (силикагель, сначала с 40/60 этилацетат/гексан, а затем 15/85 этилацетат/метиленхлорид) до получения 0,48 г (44%) продукта в виде желтого масла: 1H ЯМР (CDCl3) д 7,97-7,76 (м, 1H), 7,61-7,31 (м, 3H), 7,06-6,74 (м, 3H), 5,54-5,39 (м, 1H), 4,87-4,66 (м, 1H), 4,28 (д, J=17 Гц, 1H) 4,00 (д, J=17 Гц, 1H), 3,82 (с, 3H), 2,25-1,45 (м, 10H), 0,99 (т, J= 7,3 Гц, 3H); 13C ЯМР (CDCl3) д 168,3, 149,4, 147,5, 141,1, 132,7, 132,2, 130,9, 127,7, 123,5, 122,6, 119,3, 114,9, 111,6, 80,3, 55,9, 55,8, 45,3, 32,6, 32,5, 24,2, 23,8, 10,9; ЖХВД (колонка Waters Nova-Pak/EC 18, 3,9 x 150 мм, 4 микрона, 1 мл/мин, 240 нм, 50/50, CH3CN/0,1% H3PO4) 8 мин, 100%.
Пример 15. 3-(1-оксоизоиндолин)-3-(3-циклопентилокси-4-метоксифенил)- пропионовая кислота.
Перемешанный раствор фталиевого дикарбоксальдегида (0,67 г, 5,00 мМоль) и 3-амино-3-(3-циклопентилокси-4-метоксифенил) пропановой кислоты (1,40 г, 5,01 мМоль) в ледяной уксусной кислоте (20 мл) в атмосфере азота нагревали в колбе с обратным холодильником 5 минут. Перемешанную смесь оставляли остывать до комнатной температуры на ночь. Полученный желто-коричневый раствор концентрировали в вакууме и образовавшееся твердое вещество суспендировали в этилацетате (25 мл). Суспензию фильтровали и твердое вещество высушивали в вакууме до получения 1,52 г (77%) продукта в виде белого порошка: точка плавления 161-163oC, 1H ЯМР (ДМСО-D6/TMS) д 12,33 (бр с, 1H, COOH), 7,75-7,4 (м, 4H, Ar), 7,05-6,8 (м, 3H, Ar), 5,66 (арр, т, J=7,9 Гц, 1H), 4,75 (м, 1H), 4,51 (д, J=17,7 Гц, 1H), 4,11 (д, J = 17,7 Гц, 1H), 3,71 (с, 3H), 3,12 (м, 2H), 1,95-1,45(м, 8H); 13C ЯМР (ДМСО-D6/TMS) д 171,8, 149,1, 146,8, 141,6, 132,1, 131,5, 131,3, 127,8, 123,4, 122,8, 119,2, 114,0, 112,2, 79,4, 55,5, 51,0 46,3, 36,7, 32,1, 32,0, 23,4. Аналитически рассчитано для C23H25NO5. Теоретически: C, 69,86: H, 6,37; N, 3,54. Найдено: C, 69,59; H, 6,35; N, 3,44.
Пример 16. Метил 3-(1-оксоизоиндолин)-3-(3-циклопентилокси-4- метоксифенил)пропионат.
К перемешанной суспензии 3-(1-оксоизоиндолин)-3-(3- циклопентилокси-4-метоксифенил)пропионовой кислоты (0,758 г, 1,92 мМоль) в 10 мл метанола охлажденной на ледяной бане в атмосфере азота добавляли 0,3 мл тионилхлорида. После перемешивания в течение 15 минут смесь оставляли подогреваться до комнатной температуры и перемешивали всю ночь. Растворитель выпаривали, остаток растворяли в метиленхлориде и промывали насыщенным водным раствором бикарбоната натрия и солевым раствором. Органический слой высушивали над сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью флэш-хроматографии (силикагель, 1/9 этилацетат/метиленхлорид) до получения 0,6 г продукта, который размешивали в гексане. Суспензию фильтровали до получения 0,32 г продукта в виде белого твердого вещества: точка плавления 94,5-95,5oC; 1H ЯМР (CDCl3/TMS) д 7,85 (д, J=6,7 Гц, 1H, Ar), 7,55-7,3 (м, 3H, Ar), 7,0-6,75 (м, 3H), 5,92 (дд, J=9,1, 7,0 Гц, 1H), 4,74 (м, 1H), 4,37 (д, J = 16,7 Гц, 1H), 4,07 (д, J=16,7 Гц, 1H), 3,82 (с, 3H), 3,64 (с, 3H), 3,23 (дд, J=9,1, 15,0 Гц, 1H), 3,10 (дд, J=9,1, 15,0 Гц, 1H), 2,05-1,45 (м, 8H): 13C ЯМР (CDCl3/TMS) д 170,9, 149,8, 147,8, 141,3, 132,6, 131,3, 131,0, 127,9, 123,8, 122,7, 119,0, 114,6, 111,8, 80,5, 56,0, 52,0, 51,7, 46,6, 40,0, 32,7, 32,7, 24,0. Аналитически рассчитано для C24H27NO5. Теоретически: C, 70,40; H, 6,65; N, 3,42. Найдено: C, 70,07; H, 6,63; N, 3,34.
Пример 17. Таблетки, каждая из которых содержит 50 мг активного ингредиента, могут быть приготовлены следующим образом.
Состав (на 1000 таблеток), г:
Активный ингредиент - 50,0
Лактоза - 50,7
Пшеничный крахмал - 7,5
Полиэтиленгликоль 6000 - 5,0
Тальк - 5,0
Стеарат магния - 1,8
Деминерализованная вода - Сколько требуется.
Твердые ингредиенты вначале продавливались через сито с диаметром пор 0,6 мм. Активное вещество, лактоза, тальк, стеарат магния и половина крахмала суспендировались в 40 мл воды и эту суспензию добавляли к кипящему раствору полиэтиленгликоля в 100 мл воды. Полученную пасту добавляли к порошкообразным веществам и смесь гранулировали, при необходимости добавляли воду. Гранулированное вещество высушивали в течение ночи при 35oC, продавливали сквозь сито с диаметром отверстий 1,2 мм и прессовали таблетки примерно 6 мм в диаметре с вогнутой поверхностью с обеих сторон.
Пример 18. Таблетки, каждая из которых содержит 100 мг активного ингредиента, были приготовлены следующим образом.
Состав (на 1000 таблеток), г:
Активный ингредиент - 100
Лактоза - 100
Пшеничный крахмал - 47
Стеарат магния - 3
Все твердые ингредиенты вначале продавливались через сито с диаметром пор 0,6 мм. Активное вещество, лактоза, стеарат магния и половина крахмала смешивали. Другую половину крахмала суспендировали в 40 мл воды и эту суспензию добавляли к 100 мл кипящей воды. Полученную пасту добавляли к порошкообразным веществам и смесь гранулировали, при необходимости добавляли воду. Гранулированное вещество высушивали в течение ночи при 35oC, продавливали сквозь сито с диаметром отверстий 1,2 мм и прессовали таблетки примерно 6 мм в диаметре с вогнутой поверхностью с обеих сторон.
Пример 19. Жевательные таблетки, каждая из которых содержит 75 мг активного ингредиента, могут быть приготовлены следующим образом.
Состав (на 1000 таблеток), г:
Активный ингредиент - 75,0
Маннит - 230,0
Лактоза - 150,0
Тальк - 21,0
Глицин - 12,5
Стеариновая кислота - 10,0
Сахарин - 1,5
5%-ный раствор желатина - Сколько требуется.
Все твердые ингредиенты вначале продавливали через сито с диаметром пор 0,25 мм. Маннит и лактозу смешивали, гранулировали с добавлением раствора желатина, пропускали через сито с диаметром пор 2 мм, высушивали при 50oC и вновь пропускали через сито с диаметром пор 1,7 мм. Активный ингредиент, глицин и сахарин осторожно смешивали, добавляли маннит, гранулированную лактозу, стеариновую кислоту и тальк. Полученную смесь тщательно перемешивали и прессовали таблетки диаметром примерно 10 мм, с вогнутой поверхностью с обеих сторон, которые имели делительный желобок на верхней стороне.
Пример 20. Таблетки, каждая из которых содержит 10 мг активного ингредиента, могут быть приготовлены следующим образом.
Состав (на 1000 таблеток), г:
Активный ингредиент - 10,0
Лактоза - 328,5
Кукурузный крахмал - 17,5
Полиэтиленгликоль 6000 - 5,0
Тальк - 25,0
Стеарат магния - 4,0
Минерализованная вода - Сколько требуется.
Твердые ингредиенты вначале продавливались через сито с диаметром пор 0,6 мм. Активный ингредиент, лактоза, тальк, стеарат магния и половину крахмала смешивали до однородного состояния. Другую половину крахмала суспендировали в 65 мл воды и эту суспензию добавляли к кипящему раствору полиэтиленгликоля в 260 мл воды. Полученную пасту добавляли к порошкообразным веществам и смесь гранулировали, при необходимости добавляли воду. Гранулированное вещество высушивали в течение ночи при 35oC, продавливали сквозь сито с диаметром отверстий 1,2 мм и прессовали таблетки примерно 10 мм в диаметре с вогнутой поверхностью с обеих сторон и имеющих делительный желобок на верхней стороне.
Пример 21. Желатиновые капсулы, заполненные сухим веществом, каждая из которых содержит 100 мг, активного ингредиента, могут быть приготовлены следующим образом.
Состав (на 1000 капсул), г:
Активный ингредиент - 100,0
Микрокристаллическая целлюлоза - 30.0
Лаурил сульфат натрия - 2,0
Стеарат магния - 8,0
Лаурил сульфат натрия просеивали в активный ингредиент через сито с диаметром пор 0,2 мм и оба компонента смешивали до однородного состояния в течение 10 минут. Затем добавляли микрокристаллическую целлюлозу через сито с диаметром пор 0,9 мм и все вновь перемешивали до однородного состояния в течение 10 минут. В конце добавляли стеарат магния через сито с диаметром пор 0,8 мм. После перемешивания в течение 3 минут смесь помещали порциями по 140 мг в каждую желатиновую капсулу (продолговатую) размера 0.
Пример 22. 0,2%-ный Инъекционный или инфузионный раствор может быть приготовлен следующим образом.
Активный ингредиент, г: - 5,0
Хлорид натрия, г - 22,5
Фосфатный буфер, pH 7,4 г - 300,0
Минерализованная вода, мл - До 2500,0
Активный ингредиент растворяли в 1000 мл воды, фильтровали через микрофильтр и разводили в 1000 мл воды. Добавляли буферный раствор и доводили объем водой до 2500 мл. Для приготовления единичной дозы порции по 1,0 или по 2,5 мл каждая помещали в стеклянные ампулы (каждая содержала соответственно 2,0 или 5,0 миллиграммов активного ингредиента).
Описываются новые соединения общей формулы I, где один из R1 и R2 = R3 - X, а другой представляет собой низший алкокси; R3 - моноциклоалкил, бициклоалкил, бензоциклоалкил с числом углеродных атомов до 10; X = -O-; R6 = CO, -CH2-; Y = -COZ, низший алкил; Z = NH2, -OH, -R9 или -OR9; R9 - низший алкил и n = 0, 1, 2 и 3. Новые амиды являются ингибиторами ФНOα и фосфодиэстеразы и могут использоваться для борьбы с кахексией, эндотоксическим шоком, репликацией ретровирусов, астмой и воспалительными состояниями. Типичным представителем является 3-фталимидо-3-(3-циклопентилокси-4-метоксифенил)пропионамид. Описывается также фармацевтическая композиция на их основе и способы ингибирования фосфодиэстеразы, ФНOα, ЯФкВ. 6 с. и 2 з.п. ф-лы, 1 табл.
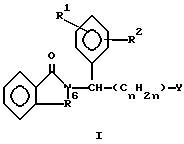
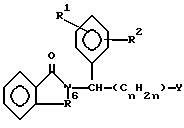
где один из R1 и R2 представляет собой R3 - Х, а другой - низший алкокси;
R3 - моноциклоалкил, бициклоалкил, бензоциклоалкил с числом углеродных атомов до 10;
Х - -О-;
R6 - -СО-, -СН2-;
Y - -COZ, низший алкил;
Z - -NH2, -OH, -R9 или -OR9;
R9 - низший алкил;
n = 0, 1, 2 и 3.
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Экономайзер | 0 |
|
SU94A1 |
| Способ получения изоиндолиновых производных или их основных или кислотных солей | 1973 |
|
SU592353A3 |
Авторы
Даты
2001-10-10—Публикация
1996-12-24—Подача