Изобретение относится к производным циклодекстрина и к их фармацевтическому применению в качестве клатрат-образующих агентов.
Циклодекстрины (ЦД) являются группой циклических гомологов олигосахаридов, которые получены при разложении крахмала под действием фермента циклодекстрин трансгликозилазы, вырабатываемого бактерией Bacillus macerans. Существуют опубликованные способы как для получения циклодекстрин трансгликозилазы, так и для получения и выделения циклодекстринов.
Циклодекстрины - это циклические молекулы, содержащие шесть или более α -D-глюкопиранозных единиц, связанных в положениях 1,4 путем α связывания, как в амилозе. Как следствие этого циклического строения молекула отличается тем, что не имеет ни восстанавливающей концевой группы, ни невосстанавливающей концевой группы.
Молекула представлена ниже схематической формулой (I), где гидроксильные группы показаны во 2, 3 и 6-положениях глюкопиранозных единиц.
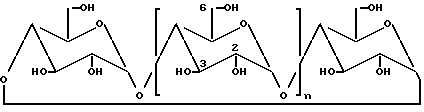 .
.
Переменная n может быть числом от 4 до 6 или выше.
Когда n = 4, молекула является обычно известной как α -циклодекстрин или циклогексаамилоза, когда n = 5, молекула обычно известна как β -циклодекстрин или циклогептаамилоза, и, когда n = 6, молекула обычно известна как γ -циклодекстрин или циклотаамилоза. Когда здесь делается отсылка к "циклодекстрину", это подразумевает включение вышеуказанных форм циклодекстрина, а также молекул, где n > 6.
Предлагают, что вследствие циклического строения конформации α -D-глюкопиранозных единиц ограничено свободное вращение вокруг глюкопиранозных связей, и циклодекстрины существуют в виде молекул конической формы с первичными гидроксилами, расположенными в маленьком конце конуса и вторичными гидроксилами, расположенными в большом открытом конце конуса. Полость наполнена водородными атомами у C3 и C5 вместе с глюкозидными кислородными атомами с получением относительно липофильной полости, но с гидрофильной внешней поверхностью.
В результате двух областей с различной полярностью и изменений в растворимой структуре, вызванных комплексообразованием, циклодекстрины обладают способностью образовывать комплексы с различными органическими и неорганическими молекулами. Образование циклодекстриновых комплексов включения с молекулами относится к явлению "хозяин-гость".
Результатом уникальных свойств циклодекстринов является их коммерческое использование в сельском хозяйстве при обработке водой в качестве поверхностно-активных веществ и в системах доставки лекарств. Результатом применения циклодекстринов в области фармации является микроинкапсулирование со своевременным высвобождением лекарства, улучшение стабильности и увеличение растворимости в воде различных лекарств.
Обычно циклодекстрины известны как улучшающие скорость растворения лекарств. Однако, кроме того, комплексы, образованные ими, устойчивы в водном растворе, поэтому улучшение растворимости сопровождается повышением концентрации насыщения лекарства. К сожалению, сам β -циклодекстрин, который образует наиболее устойчивые комплексы с большинством лекарств, имеет наименьшую растворимость в воде, поэтому лекарства, которые образуют с ним комплекс, не могут быть введены в раствор в терапевтических концентрациях. Причиной этого является кристаллическая структура β -циклодекстрина.
Известно, что химическая модификация циклодекстрина изменяет их свойства. Электронейтральные циклодекстрины были описаны Parmeter et al (патент США N 3453259) и Gramera et al (патент США N 3459731). Они получены реакцией конденсации циклодекстринов с различными эпоксидами или органическими галогенидами.
Другие производные включают циклодекстрины с катионными свойствами (Parmerter (I); патент США N 3453257), нерастворимые поперечносвязанные циклодекстрины (Solms; патент США N 3420788), и циклодекстрины с анионными свойствами (Parmerter (II); патент США N 3426011). К исходному циклодекстрину для получения производных циклодекстрина с анионными свойствами должны быть присоединены карбоновые кислоты, кислоты фосфора, фосфиновые кислоты, фосфоновые кислоты, фосфорные кислоты, тиофосфоновые кислоты, тиофосфоновые кислоты и сульфоновые кислоты (см. Parmerter (II), supra).
Циклодекстрины нашли применение в фармацевтических системах доставки. В качестве "хозяина" для "гостевых" лекарственных молекул эти комплексы включения (клатрат) показали повышение водной растворимости фармацевтических препаратов с существенно низкой водной растворимостью (Jones; патент США N 4555504).
Эта солюбилизация приводит к улучшению биологической доступности некоторых лекарств. В виде клатратных комплексов некоторые лекарства показывают улучшенную химическую стабильность в водных растворах (Harada et al; патент США N 4497803 и Hayash; et al; патент США N 3816394). Кроме того, циклодекстрины оказываются эффективными при регулировании высвобождения высокорастворимых в воде фармацевтических препаратов (Friedman; патент США N 4774329).
Несмотря на фармацевтическую полезность, циклодекстрины также имеют некоторые ограничения. Использование циклодекстринов в клинической практике ограничивается только оральными и формами для местного применения, так как циклодекстрины проявляют нефротоксичность, вызываемую введением неметаболизирующегося тела. Поскольку ферменты млекопитающих специфичны для разрушения линейных молекул крахмала циклодекстрины остаются в большой степени неметаболизированными и скапливаются из-за их рециркуляции и реадсорбции в ближайших трубчатых клетках.
Циклодекстрины и их производные являются, главным образом, кристаллическими твердыми продуктами, и концентрирование в почечной ткани сопровождается образованием кристалла, вызывающего некротическое повреждение клеток. Несмотря на образование водорастворимых клатратных комплексов кристаллические циклодекстриновые комплексы лекарств ограничивались при их использовании сублигвальным введением. Были предприняты попытки ингибирования образования кристалла в циклодекстриновых лекарственных комплексах путем преобразования исходных циклодекстринов неспецифическим методом с получением аморфных смесей, содержащих много компонентов циклодекстриновых производных (сравни: Pitha; патенты США NN 4596795 и 4727064). Эти смеси предотвращают процессы кристаллизации, наблюдаемые для единичных соединений, обеспечивая снижение токсичности.
Сущность изобретения.
Изобретение касается очищенных циклодекстриновых производных, представляющих как индивидуальные производные, так и смеси производных. Они получаются нагреванием циклодекстринового исходного материала с реагентом(ами), который(ые) вводит(ят) особый заместитель анионного типа, например, (C2-C6-алкилен)- SO
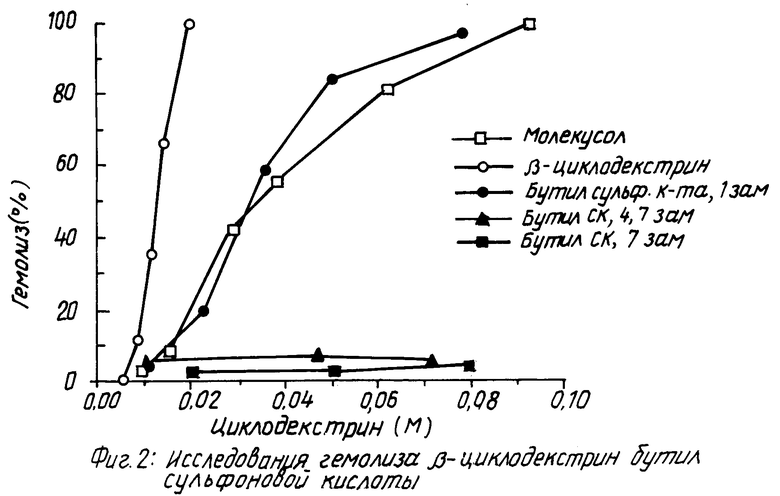
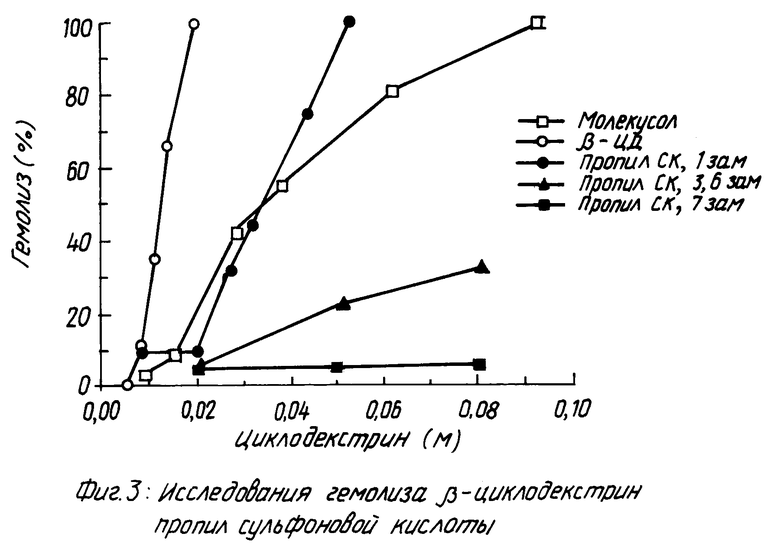
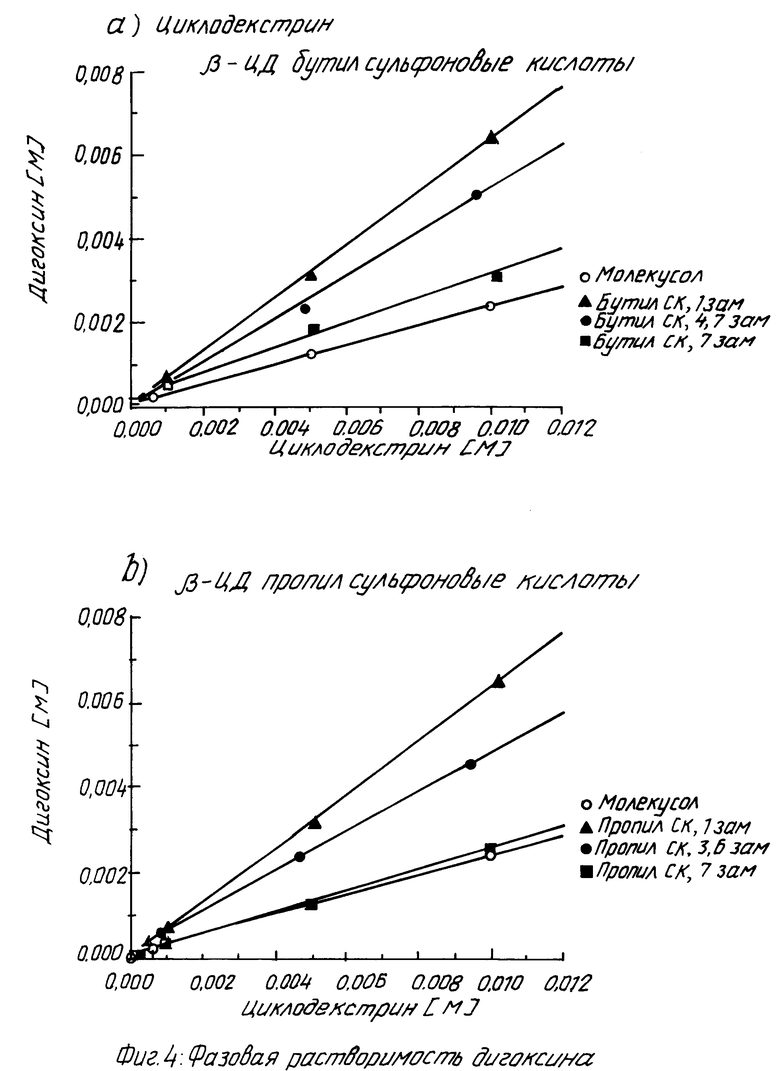
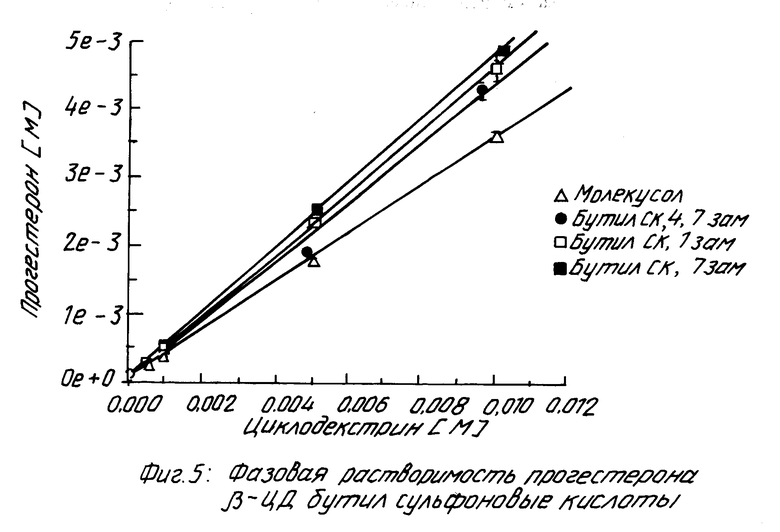
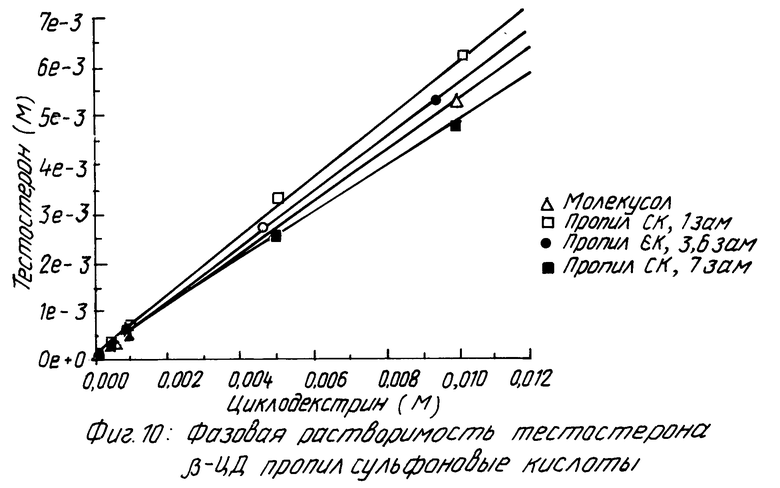
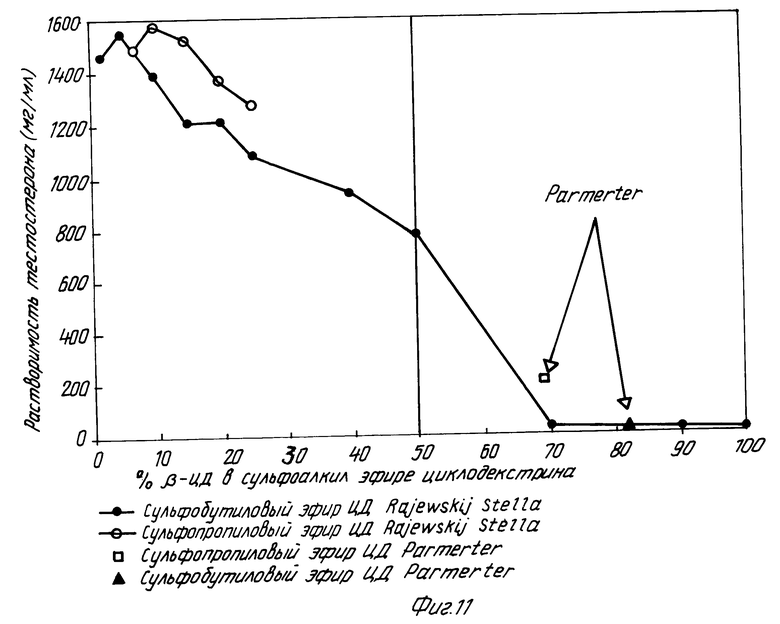
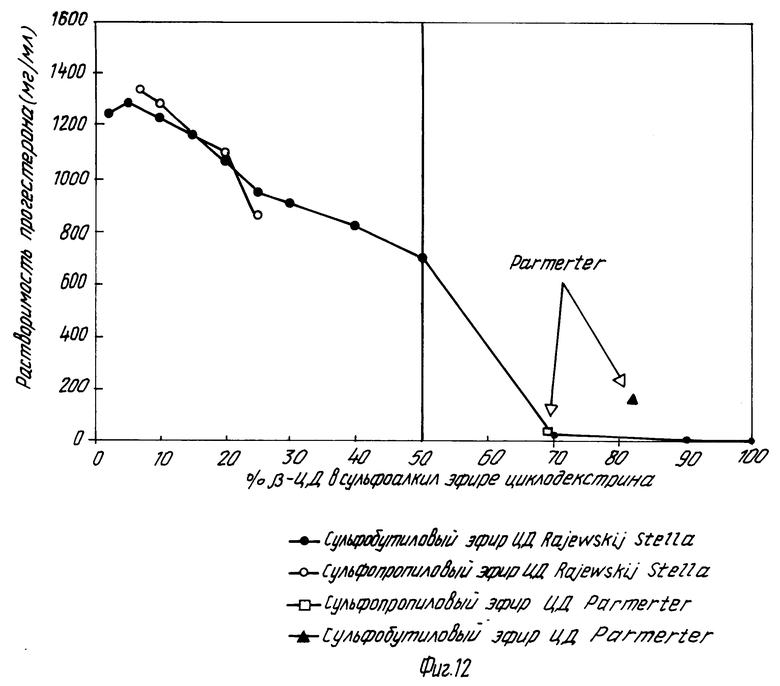
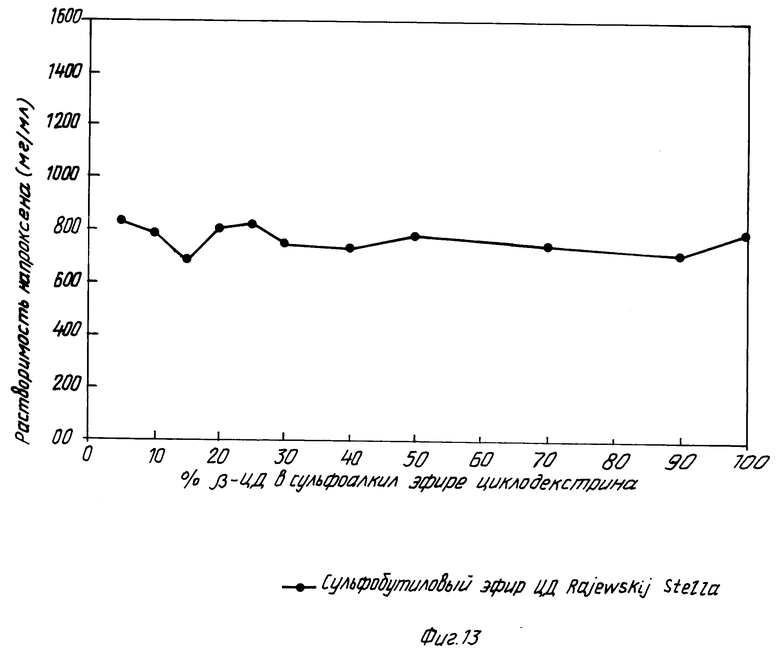
На фиг. 1 показано кумулятивное выделение циклодекстрина с мочой у мышей для случаев непреобразованного циклодекстрина, гидроксипропилпроизводного циклодекстрина и двух сульфоалкил циклодекстриновых производных по изобретению; на фиг. 2 и 3 - данные, показывающие, что более высокозамещенные алкилсульфоновые кислоты по настоящему изобретению вызывают меньший разрыв мембраны, что установлено исследованиями гемолиза красных кровяных клеток при сравнении монозамещенных производных алкилсульфоновой кислоты с непреобразованным циклодекстрином, вызывающим наибольший разрыв мембраны, и что монозамещенные производные алкилсульфоновой кислоты по настоящему изобретению вызывают такой же разрыв мембраны, что и гидроксипропил циклодекстриновое производное, что также установлено исследованием гемолиза красных кровяных клеток; на фиг. 4, 5 и 6 показано, что константы ассоциации для равновесия между сульфоалкил циклодекстриновыми производными по настоящему изобретению и дигоксином или прогестероном значительно больше, чем константа ассоциации для равновесия между гидроксипропил циклодекстриновым производным и дигоксином или прогестероном, соответственно; и на фиг. 7 - 10 также показано, что с фенитоином и тестостероном сульфоалкил циклодекстриновые производные по изобретению обладают значительно большими константами ассоциации по сравнению с гидроксипропил циклодекстриновым производным; на фиг. 11, 12 и 13 - результаты исследований растворимости тестостерона, прогестерона и напроксена с сульфоалкилэтиловыми циклодекстриновыми производными по настоящему изобретению.
Итак, данное изобретение касается циклодекстриновых производных, подходящих для фармацевтического использования. Эти производные являются подходящими для использования в качестве образующих с лекарствами агентов для получения клатратных комплексов, которые используются в парентеральных и других фармацевтических препаратах. Способы получения и выделения циклодекстриновых производных также предусмотрены.
Циклодектриновые производные по настоящему изобретению снабжены функциональными (C2-C6-алкилен)-SO3 группами и являются, таким образом, заряженными частицами. Тот факт, что было найдено, что эти соединения обладают очень низким уровнем токсичности, является неожиданным в свете предыдущего уровня техники, полагающего, что производные циклодекстрина должна сохранять электронейтральность для поддержания отсутствия токсичности (сравни: Pitha, "Amorphous Water-Soluble" "Third Int'l Symposium on Recent Advances in Drug Delivery Systems, Salt Lake City, Utah, Feb. 23-27, 1987).
Высокая растворимость в воде циклодекстриновых производных по настоящему изобретению и их результирующая низкая нефротоксичность являются дополнительными неочевидными результатами в свете патента США N 4727064, описывающего, что для поддержания высокого уровня растворимости циклодекстриновых производных должна быть использована смесь производных.
Растворимость в воде, проявляемая настоящими сульфоалкил циклодекстриновыми производными кажется полученной благодаря сольватации частей сульфоновой кислоты. Таким образом, не требуется гетерогенной смеси настоящих циклодекстриновых производных для того, чтобы имела место наблюдаемая повышенная сольватадия. Хотя смесь сульфоалкилэфирных производных может быть использована в соответствии с настоящим изобретением, такая смесь не требуется для повышения растворимости.
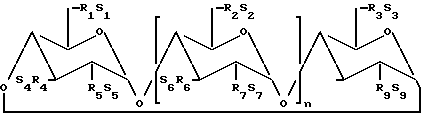
По предпочтительному осуществлению (I) циклодекстриновые производные по данному изобретению имеют структуры, представленные формулой (II):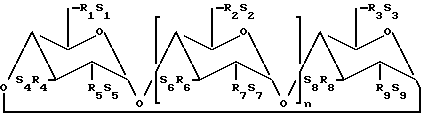 ,
,
где
n является 4, 5 или 6;
R1 - R9 являются каждый независимо O- или O-(C2-C6-алкилен)- SO
S1 - S9 каждый, независимо, фактически приемлемый катион, который включает, например, H+, щелочные металлы (например, Li+, Na+, K+), щелочноземельные металлы (например, Ca+2, Mg+2), ионы аммония и аминокатионы, также как катионы C1-C6-алкиламинов, пиперидина, пиразина, C1-C6-алканоламина и C4-C8-циклоалканоламина.
При другом предпочтительном осуществлении (2):
R1 является O-(C2-C6-алкилен)- SO
R2 - R9 являются O-;
S1 - S9 определены в осуществлении (1) выше.
При другом предпочтительном осуществлении (3):
R1, R2 и R3 является каждый независимо O-(C2-C6-алкилен)- SO
R4- R9 являются O-; и
S1 - S9 определены в осуществлении (1) выше.
При другом предпочтительном осуществлении (4):
R1 - R3 определены в осуществлениях (2) и (3); выше
по крайней мере один из R4, R6 и R8 являются O-(C2-C6-алкилен)- SO
R5, R6 и R7 являются O-; и
S1 - S9 определены в осуществлении (1) выше.
При другом предпочтительном осуществлении (6):
R1 - R6 и R8 каждый, независимо являются O-(C2-C6-алкилен)- O
R5, R7 и R9 являются O-; и
S1 - S9 определены в осуществлении (1) выше.
Термины "алкилен" и "алкил" в данном тексте (например, в O-(C2-C6-алкилен)- SO
Настоящее изобретение касается композиций, содержащих смесь производных циклодекстрина, имеющих структуру, представленную формулы (2), где композиция в целом содержит в среднем, по крайней мере, от 1 до 3 + 6 частей алкилсульфоновой кислоты на молекулу циклодекстрина. Настоящее изобретение также касается композиций, содержащих исключительно один или единственный тип производного циклодекстрина.
Настоящие производные циклодекстрина являются или замещенными, по крайней мере, по одной первичной гидроксильной группе (например, по крайней мере, у одного из R1-R3 имеется заместитель), или они замещены как по первичной гидроксильной группе в 3-м положении (например, как, по крайней мере, у одного из R1- R3, так и, по крайней мере, у одного из R4, R6 и R8 имеется заместитель). Замещение по гидроксильной группе во 2-м положении, хотя теоретически и возможное, на основании исследований заявителя не кажется в действительности проявляющимся в продуктах по изобретению.
Производные циклодекстрина по настоящему изобретению получены в виде очищенных композиций, предпочтительно в виде композиций, содержащих, по крайней мере, 95% по весу производного(ых) циклодекстрина с осуществленным замещением, по крайней мере, по первичной гидроксильной группе молекулы циклодекстрина (например, R1, R2 или R3 в формуле (2), как определено 1H ЯМР при 300 МГц). В предпочтительном осуществлении могут быть получены очищенные композиции, содержащие, по крайней мере, 98% производного(ых) циклодекстрина.
Это отличается от описания патента США N 3426011, в котором сообщается только о получении продуктов реакции взаимодействия циклодекстрина сультоновым реагентом. Эти продукты реакции значительное количество незамещенного исходного циклодекстринового материала.
В данных предпочтительных композициях по изобретению непрореагировавший циклодекстрин в существенной степени удален, при остаточных примесях (например, ≤ 5% по весу от веса композиции), не оказывающих влияния при получении содержащей циклодекстринпроизводное композиции.
Более высокозамещенные алкилсульфоновой кислотой производные циклодекстрина по настоящему изобретению, как было обнаружено, обладают, в дополнение к характеристикам повышенной растворимости и низкой токсичности, превосходным свойством вызывать меньший разрыв мембраны. При исследованиях гемолиза красных кровяных клеток более высокозамещенные циклодекстриновые производные демонстрируют незначительный разрыв мембраны. Монозамещенные циклодекстриновые производные вызывают почти такой же разрыв мембраны, как и гидроксипропил производное.
Данные улучшенные показатели достигаются очищенными композициями по изобретению, которые содержат < 5%, предпочтительно менее 2%, непрореагировавшегося β -циклодекстрина, и являются особенно важными для композиций, назначаемых пациенту для парентерального применения. Заявители, однако, обнаружили, что композиции, содержащие несколько большие количества непрореагировавшего β -циклодекстрина, при том, что они не подходят для парентерального назначения, остаются полезными для орального назначения.
При внутривенном пути введения лекарства, включенного в циклодекстриновый препарат, тот не должен содержать β -циклодекстрин ввиду присущей последнему нефротоксичности. Внутривенно введенная доза получает доступ к почкам посредством пути циркуляции крови. Стоит β -циклодекстрину быть отфильтрованным клетками почки, как он проявляет нефротоксичность, вызванную разрывом клеточных мембран из-за удаления холестерина из клеточных мембран. Следовательно, существует незначительная толерантность к преобразованному циклодекстрину содержащему остаточный β -циклодекстрин, если этот продукт используется в парентеральной форме.
В противоположность этому допущение остаточного β -циклодекстрина для препарата сульфоалкилэтерифицированного циклодекстрина, используемого в оральных формах, может быть большим. Оральная абсорбция β -циклодекстрина ограничена (если она вообще есть), и удаление β -циклодекстрина в "the feces" будет предотвращать какую-то ни было нефротоксичность. Однако уровень β -циклодекстрина, который может быть допустим в форме для орального применения будет зависеть от других характеристик материала, в частности, от присущей ему водной растворимости.
Таким образом, сульфоалкилэтерифицированные производные по настоящему изобретению могут быть использованы в форме для орального применения, даже если непрореагировавший β -циклодекстрин содержится в количестве до 50%, хотя предпочтительное количество ограничено менее 40%, а более предпочтительно менее 25%.
Получение производных циклодекстрина (ЦД).
Описанные производные циклодекcтрина могут быть получены, главным образом, растворением циклодекcтрина в водном основании при подходящей температуре, например, от 70o до 80oC, при максимально высокой концентрации. Например, для получения производных циклодекcтрина по осуществлению (4), количество происходящего алкил сультона, соответствующее числу молей присутствующих первичных гидроксильных групп ЦД, добавляются при энергичном перемешивании для достижения максимального контактирования в гетерогенной фазе.
Для получения производных циклодекстрина по осуществлению (2) берут мольное количество алкил сультона, соответствующее числу молей используемого ЦД. Как легко может определить специалист, для получения производных циклодекстрина по осуществлению (1), которые включают производные циклодекcтрина как по осуществлению (4), так и по (2), количество алкилсультона, при этом используемого, определено выше. Другие производные циклодекстрина, предусмотренные настоящим изобретение, получены Mutatis Mutandis.
Смесь подвергают взаимодействию до образования одной фазы, что указывает на израсходование алкилсультона. Реакционную смесь разбавляют равным количеством воды и нейтрализуют кислотой, такой как соляной кислотой. Раствор затем подвергают диализу для удаления примесей с последующим концентрированием ультрафильтрацией.
Концентрированный раствор затем подвергают ион-обменной хроматографии для удаления непрореагировавшего циклодекстрина и далее сушат вымораживанием (лиофильная сушка) с получением желаемого продукта.
ЦД, используемый в настоящем изобретении, может быть любом ЦД, полученным известным способом, например, действием циклодекстрин-глюканотрансферазы (CG Tase, E.C., 2.4.1.19.) на крахмал. Таким образом, ЦД здесь обозначает α -ЦД, в котором шесть глюкозных единиц связаны вместе по α -1,4-связи, β -ЦД, в котором семь глюкозных единиц связаны вместе, или γ -ЦД, в котором восемь глюкозных единиц связаны вместе, или их смесь. При этом использование β -ЦД наиболее предпочтительно для получения особенно преобразованных продуктов широкой полезности.
Как отмечается выше и в зависимости от требуемого производного циклодекстрина количество используемого в качестве агента преобразования сультона не может быть более одного мольного эквивалента относительно числа первичных гидроксильных групп, представленных в ЦД, хотя оптимальное количество может быть отчасти зависимым от концентрации реагента. В качестве ускорителя может быть использован гидроксид лития, гидроксид натрия и гидроксид калия. При этом, гидроксид натрия является предпочтительным ввиду его низкой цены. Его количество должно быть больше, чем около 30 мольных эквивалентов и будет предпочтительным при уровне от 80 до 200 мольных эквивалентов при концентрации реагента на уровне выше, чем 10% (в/в), предпочтительно уровня от 40 до 60% (в/в).
В качестве реакционной среды может быть использован любой растворитель, который является по существу инертным по отношению к частичному алкилированию. Типичными примерами является вода, ДМФА, ДМСО и их смеси, но использование одной воды предпочтительно для облегчения последующей обработки.
Тип и концентрация алкилсультона и щелочи не являются существенными для реакции. Однако, реакцию обычно проводят при перемешивании при температуре от 10 до 80oC в течение одного часа, предпочтительно от 20oC до 50oC в течение от 5 до 20 ч.
Для выделения и очистки целевых соединений из реакционных смесей могут быть применены широко известные в данной области методы. Они включают экстракцию органическими растворителями, диализ, адсорбционную хроматографию с активированным углем, силикагелем, оксидом алюминия и другими адсорбентами, хроматографию с использованием в качестве носителя поперечно связанного декстрина, стирол/дивинилбензол сополимеров и других поперечносвязанных полимеров и их сочетание.
Получение клатратных комплексов.
Клатратные комплексы по изобретению могут быть получены любым известным в данной области способом получения комплексов циклодекстринов.
Например, для получения клатратных комплексов производное циклодекстрина растворяют в воде или органический смешивающийся с водой растворитель может быть добавлен к физиологически активному соединению (лекарству), растворенному в органическом растворителе, который смешивается с водой. После нагревания смеси желаемый продукт получают концентрированием смеси при пониженном давлении или оставляют охлаждаться. В этом случае отношение смешиваемых органического растворителя и воды может соответствующим образом варьироваться в соответствии с растворимостью материала и продуктов.
Примеры лекарств, которые могут входить в комплексы с производными циклодекстрина включают дифенил гидантоин, адифенин, аллобарбитал, аминобензойную кислоту, амобарбитал, ампициллин, анетол, аспирин, азопропазон, азулен барбитуровую кислоту, беклометазон, беклометазон дипропронат, бензциклан, банзальдегид, бензокаин, бензодиазепин, бензотиазид, бетаметазон, бетаметазон 17-валерат, бромбензойную кислоту, бромизовалерилмочевину, бутил-п-аминобензоат, хлоральгидрат, хлорамбуцил, хлорамфеникол, хлорбензойную кислоту, хлорпромазин, коричную кислоту, хлорфибрат, коэнзим А, кортизон, кортизон ацетат, циклобарбитал, циклогексил антранилат, деоскихолевую кислоту, дексаметазон, дексаметазон ацетат, диазепам, дигитоксон, дигоксин, экстрадиол, фторфенамовую кислоту, фторхинолон ацетонид, 5-фторурацил, фторбипрофен, гризеофульфин, кваазулен, гидрокортизон, гидрокортизон ацетат, ибупрофен, индикан, индометацин, иод, кетопрофен, антибиотики группы ланкацидина, мефанамовую кислому, менадион, мефорбарбитал, метбарбитал, метициллин, метроиндазол, митомицин, нитразепам, нитроглицерин, нитрозомочевина, параметазон, фенециллин, фенобарбитал, фенобарбитон, пентобарбитал, фенилбутановую кислоту, фенилвалерианновую кислоту, фенитоин, преднизолон, преднизолон ацетат, прогестерон, пропилпарабен, просциллардин, серии простагландина A, серии простагландина B, серии простагландина E, серии простагландина F, хинолоновые антимикробные препараты, резерпин, спиронолактон, сульфацетамид натрия, сульфонамид, тестостерон, талимодин, тиамин дилаурилсульфат, тиамфениолпальмитат, тиопентал, триамцинолон, витамин A, витамин D3, витамин E, витамин K3 и варфарин.
Лекарство может быть растворено в воде или в органическом растворителе (как смешивающимся, так и не смешивающимся с водой). Подходящие растворители включают, например, диэтиловый эфир, тетрагидрофуран, диоксан, ацетон, диметилсульфоксид, диметилформамид и низшие алифатические спирты. Предпочтительно лекарство растворено либо в воде, либо в смеси воды и смешивающегося с водой растворителя, такого как метанол или этанол. Лекарство также может быть суспендировано в воде.
После достижения равновесия комплекс может быть выделен любым приемлемым способом, например, лиофилизацией, упариванием растворителя, отделением осадка (высаживанием - пер.), низкотемпературной кристаллизацией или разбрызгивательной сушкой. Циклодекстриновые комплексы включения могут быть также получены физическим размолом или замешиванием циклодектрина в гостевой молекулы с или без небольшого количества растворителя.
Соотношение производного циклодектрина и лекарства, используемого для приготовления клатратных комплексов по изобретению может быть любым приемлемым соотношением, но подходящим является, когда производное циклодекстрина берется в мольном избытке.
Положительный эффект от изобретения может быть получен при мольном соотношении производного циклодекстрина к лекарству порядка от 10:1 до 1:10, предпочтительно от 2:1 до 5:1, например 3:1, и при использовании методов и соотношений, указанных выше. Комплексы легко получаются с содержанием вплоть до 20% по весу лекарства. Однако, принимая во внимание низкие дозы обычно назначаемых лекарств и трудность приготовления гомогенных смесей активного ингредиента и наполнителей, возможно желательным является получение комплекса с избытком наличия производного циклодекстрина, например, комплексы, содержащие порядка от 0,1 до 10% по весу лекарства, в частности уровни от 0,5 до 0,2% по весу.
Клатратные комплексы по изобретению обеспечивают более приемлемый путь введения лекарств, поскольку циклодекстрин действует только как солюбилизирующий агент, без влияния на терапевтическое поведение лекарства любым способом.
Композиция, содержащая клатратные комплексы по изобретению.
Таким образом, изобретение, кроме того, касается комплекса включения, как указано выше, для использования его в медицине или ветеринарии. Комплекс для использования в виде лекарства может быть представлен в виде фармацевтического препарата.
Далее, изобретение касается, с другой стороны, фармацевтического препарата, содержащего комплекс включения лекарства с циклодекстриновым производным и фармацевтически приемлемый носитель и необязательно другие терапевтические и/или профилактические ингредиенты. Носители должны быть "приемлемыми" в смысле совместимости с другими ингредиентами препарата и не быть опасными для реципиента. Удобно, чтобы фармацевтический препарат был в единично дозированной форме. Каждая единичная доза будет подходящим образом содержать количество лекарства, обычно включенного в единичную дозу такого лекарства в отсутствие циклодекстрина. Фармацевтическими препаратами могут быть любые препараты, в виде которых могут использоваться для лечения комплексы включения, и содержат препараты, подходящие для орального, внутриносового, внутриглазного или парентерального (включая внутримышечное и внутривенное) применения. Препараты могут быть в зависимости от назначения представлены удобно в дробных дозированных единицах и могут быть получены любым из способов, хорошо известных специалистам в области фармации. Все способы включают стадию объединения активного соединения с жидкими носителями или тонко измельченными твердыми носителями или с обоими и затем, если необходимо, формирование продукта в желаемый препарат.
Фармацевтические препараты, подходящие для орального применения, в которых носитель - твердое вещество, в большинстве случаев представлены в виде единично дозированных препаратов, таких как пилюли, капсулы, каше или таблетки, каждый из которых содержит определенное количество активного ингредиента. Таблетки могут быть получены прессованием или формованием, необязательно с одним или более удобным ингредиентом. Прессованные таблетки могут быть получены прессованием на соответствующей машине активного соединения в свободнотекущем виде, таком как порошок или гранулы, необязательно смешанном со связующим, смазкой, инертным разбавителем, смазывающим, поверхностно-активным или диспергирующим агентом, формованные таблетки могут быть получены формованием инертного жидкого разбавителя. Таблетки могут быть необязательно покрыты и, если не покрыты, могут быть необязательно помечены. Капсулы могут быть получены наполнением активным соединением, либо один, либо в смеси с одним или более удобным ингредиентами, капсульных емкостей и затем запечатыванием из обычным методом. Каше и подобные наполняют активным ингредиентом вместе с любым удобным(ми) ингредиентом(ами) и запечатывают в оболочку из рисовой бумаги.
Таблетки содержат активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми наполнителями, которые подходят для приготовления таблеток. Этими добавками могут быть, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия: гранулирующие или разрыхляющие агенты, например, маисовый крахмал, или альгиновая кислота; связывающие агенты, например крахмал, желатин или acacia, или смазывающие агенты, например, стеарат магния, стеариновая кислота или тальк. Таблетки могут быть непокрыты, или они могут быть покрыты известными способами для задерживания разрушения и абсорбции в желудочнокишечном тракте и таким образом обеспечения поддержания действия в течение длительного периода. Например, может быть использован задерживающий во времени материал, такой, как глицерин моностеарат или глицерин дистеарат, индивидуально или с воском.
Настоящее изобретение также охватывает комплексы по настоящему изобретению в фармацевтических препаратах, проявляющих задерживаемое (пролонгированное) высвобождение лекарства. Фармацевтические препараты, проявляющие задерживание освобождения лекарства вообще известны. Такие препараты включают инертные полимеры или биоразрушающиеся поликислоты, в которых активный ингредиент (настоящий комплекс) либо диспергирован, ковалентно связанный по подвижным связям, либо помещен в полость между полимерными мембранами. Задерживаемое высвобождение достигается путем диффузии активного ингредиента через полимерную матрицу или гидролизом каких-то имеющихся ковалентных связей.
Замедленное освобождение может быть также представлено освобождением активного ингредиента с помощью осмотических насосов. Осмотические насосы содержат резервуар с раствором или суспензией активного ингредиента (например, настоящий комплекс), окруженный полупроницаемой мембраной, содержащий проход для лекарства. По мере того, как вода проникает сквозь полупроницаемую мембрану, раствор комплекса выталкивается через проход и высвобождается.
Производные циклодекстрина по изобретению действуют как лекарственные солюбилизирующие агенты в данной системе. Настоящие производные циклодекстрина могут также действовать как осмотические управляемые агенты, обеспечивающие возможность для наполнения водой такой системы.
Фармацевтические препараты, подходящие для орального применения, в которых носителем является жидкость, могут быть удобно представлены в виде раствора в водной или неводной жидкости или в виде масло-в-воде или вода-в-масле жидкой эмульсии. Фармацевтические препараты для парентерального применения удобно представлены в виде контейнеров с единичной дозой или с мульти-дозой, которые запечатаны после введения препаратной единицы, требуемой для применения.
Препараты для орального использования могут быть также представлены в виде твердых желатиновых капсул, где активный ингредиент смешан с инертным твердым разбавителем, например, карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, где активный ингредиент смешан с водой или масляной средой, например, арахисовым маслом, масло земляного ореха, жидким парафином или оливковым маслом.
Необходимо учесть, что в дополнение к вышеупомянутым несущим ингредиентам фармацевтические препараты, указанные выше, могут содержать, в количестве подходящего один или более дополнительных ингредиентов носителей, таких как разбавители, буферирующие агенты, ароматизирующие агенты, связующие, поверхностно-активные агенты, загустители, смазки, предохраняющие агенты (включая анти-оксиданты) и подобные, и вещества, включенные с целью поддержания изотоничности препарата в крови реципиента, которому они предназначены.
Для этих целей соединения по настоящему изобретению могут быть назначены орально, местно, интраназально, внутриглазным способом, парентерально, ингаляционным опрыскиванием или ректально в виде препаратов с дозированными единицами, содержащих нетоксичные фармацевтически приемлемые носители, добавки и растворители. Термин парентеральный, используемый здесь, включает подкожные инъекции, внутривенные, внутримышечные, внутрижелудочные инъекции или методы влияния. Помимо применения для лечения теплокровных животных, таких как мыши, крысы, лошади, собаки, коты и т.д., соединения по изобретению эффективны и на людях.
Водные суспензии содержат активные материалы в смеси с добавками, подходящими для приготовления водных суспензий. Такие добавки являются суспендирующими агентами, например, натрий карбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилцеллюлоза, альгинат натрия, поливинилпирролидон, смола трагаканта и смола акации диспергирующими или смачивающими агентами могут быть встречающиеся в природе фосфатиды, например, лецитин, или продукты конденсации алкиленоксида с жирными кислотами, например полиоксиэтиленстеарат, или продукты конденсации этиленоксида с длинноцепочечными алифатическими спиртами, например, гепта декаэтиленоксидэтанол, или продукты конденсации этиленоксида с частичными эфирами, производными жирных кислот и гекситола, такие как полиоксиэтиленсорбитол моно-олеат, или продукты конденсации этиленоксиды с частичными эфирами, производными жирных кислот и ангидридов гекситола, например, полиоксиэтилен сорбитан моно-олеат. Водные суспензии могут также содержать один или более защитных агентов, например, этил или н-пропил п-гидроксибензоат, один или более окрашивающих агентов, один или более ароматизирующих агентов и один или более подслащивающих агентов, таких как сукроза или сахарин.
Масляные суспензии могут быть получены суспендированием активного ингредиента в растительном масле, арахисовом масла, оливковом масле, кунжутном масле, кокосовом масле, или в минеральном масле, таком как жидкий парафин. Масляная суспензия может содержать сгущающий агент, например, пчелиный воск, тяжелый парафин или цетиловый спирт. Подслащивающие агенты, такие как указаны выше, и ароматизирующие агенты обеспечивают вкусные оральные препараты. Эти композиции могут быть защищены добавлением антиоксиданта, такого как аскорбиновая кислота.
Диспергирующиеся порошки и гранулы, подходящие для приготовления водой суспензии при добавлении воды, содержат активный ингредиент в смеси с диспергирующим или смачивающим агентом, суспендирующим агентом и одним или более защитным агентом. Подходящие диспергирующие или смачивающие агенты и суспендирующие агенты могут быть проиллюстрированы как уже указано выше. Дополнительные добавки, как например, подслащивающие, ароматизирующие или подкрашивающие агенты, также могут быть представлены.
Фармацевтические композиции по изобретению могут также быть в виде эмульсий масло-в-воде. Масляная фаза может быть растительным маслом, например, оливковым маслом или арахисовым маслом, или минеральным маслом, например жидким парафином, или их смесями. Подходящими эмульгирующими агентами могут быть встречающиеся в природе смолы, например, смола акации или смола трагаканта, встречающиеся в природе фосфатида, например, лецитин соевых бобов, и эфиры или частичные эфиры, производные жирных кислот и ангидридов гекситола, например, сорбитан моно-олеат, и продукты конденсации указанных эфиров с этиленоксидом, например, полиоксиэтилен сорбитан моно-олеат. Эмульсии могут также содержать подслащивающие и ароматизирующие агенты.
Сиропы и эликсиры могут быть составлены с подслащивающими агентами, например, глицеролом, сорбитолом или сукрозой. Такие препараты могут также содержать demulcent, защитные и ароматизирующие и подкрашивающие агенты, фармацевтические компоненты композиции могут быть в форме стерильных препаратов для инъекции, например, в виде стерильных водных или масляных суспензий для инъекций. Такая суспензия может быть составлена согласно известным методам с использованием таких подходящих диспергирующих или смачивающих агентов и суспендирующих агентов, которые были упомянуты выше. Стерильные препараты для инъекций могут быть также стерильным для инъекций раствором или суспензией в нетоксичном парентерально приемлемом разбавителе или растворителе. Среди приемлемых разбавителей и растворителей, которые могут быть использованы, вода, раствор Ринглера и изотонический раствор хлорида натрия. В дополнение стерильные определенные масла являются удобно применимыми в качестве растворителя или суспендирующей среды. Для этих целей любые мягкие определенные масла могут быть использованы, включая синтетические моно- или диглицериды. К тому же жирные кислоты, такие как олеиновая кислота, находит применение в применении в препаратах, пригодных для инъекции.
Соединения по данному изобретению могут быть также назначены в форме суппозиториев для ректального применения лекарства. Эти композиции могут быть получены смешиванием лекарства с подходящим нераздражающим носителем, который является твердым при обычной температуре, но жидким при ректальной температуре, и который поэтому будет плавиться в области ректума с высвобождением лекарства. Таким материалом является масло какао и полиэтиленгликоли.
Для местного применения используют кремы, растирки, желе, растворы или суспензии и т.д., содержащие активный ингредиент.
Количество активного ингредиента, которое может быть объединено с несущими материалами для получения единичной дозированной формы будет изменяется в зависимости от обработанной гостевой молекулы и особого способа введения. Например, препарат, предназначенный для орального применения на человеке может содержать от 1,0 до 750 мг активного агента, соединенным с подходящим и удобным количеством материала носителя, которое может варьироваться от 5 до 95 процентов от веса всей композиции. Единичные дозированные формы будут главным образом содержать между от 1 до 500 мг активного ингредиента.
Назначение клатратных комплексов пациенту.
Необходимо учесть, что специфичный уровень дозы для любого частного пациента будет зависеть от различных факторов, включая активность используемого специфичного соединения, возраста, веса тела, общего состояния здоровья, пола, питания, времени применения, пути введения, скорости выделения, комбинация лекарств и степень заболевания, которое подлежит лечению.
Фармацевтические препараты, содержащие комплексы включения, могут быть назначены на уровнях дозировки и при интервалах доз, требуемых для достижения требуемого фармакологического ответа, которые обычно такими же, что и для лекарства и состояния заболевания, как и в отсутствии циклодекстрина.
Другие особенности изобретения проявятся в последующем описании примеров осуществления, которые даны для иллюстрации изобретения и которые не предполагают его ограничение.
Примеры.
Гидроксипропилпроизводное циклодекстрина, используемое в экспериментах, представленных ниже, закуплено в Pharmatec, Inc., Alachua, Fl.
Получение производного циклодекстрина по изобретению.
Пример 1. Моносульфобутиловый эфир β -циклодекстрина.
В 100 мл круглодонной колбе 10 грамма β -циклодекстрина (8,81 • 10-3 моль) добавляют к водному раствору, состоящему из 30 мл воды и 5,0 г гидроксида натрия, при перемешивании и выдерживая при 70oC. К этому раствору медленно добавляют 1,8 мл (2,40 г, 1,76 • 10-2 моль) бутан сультона при энергичном перемешивании для достижения максимального контакта гетерогенных фаз.
После того, как наблюдается однородная фаза, что свидетельствует о полном израсходовании алкилсультона, раствор охлаждают до комнатной температуры и разбавляют 20 мл воды. Полученный раствор нейтрализуют 1 и соляной кислотой и диализуют 3 • 700 мл воды для удаления солей и гидроксиалкилсульфоновых кислот, образующихся как побочных продукты.
Диализат концентрируют ультрафильтрацией и помещают в ион-обменную колонку, содержащую 50 г A-25 DEAE-Sephadex, помещенного 1,25 дюймового диаметра стеклянную колонку. Непрореагировавший β -циклодекстрин удаляется элюированием с дистиллированной водой. Моно-замещенный сульфобутиловый эфир β -циклодекстрина выделяют элюированием с 0,1 и гидроксида натрия. Вытекающая фракция, содержащая моно-замещенное производное ультрафильтруется для удаления любых оставшихся солей. pH остатка устанавливают нейтральным и лиофилизуют с получением 2,17 г монозамещенного сульфобутилового эфира β -циклодекстрина в виде белого аморфного вещества. Элементный анализ продукта показывает соотношение углерода и серы равным 13,7, что соответствует Ca 1,2 замещению на молекулу.
Пример 2. Моно-сульфопропиловый эфир β -циклодекстрина.
Методы примера 1 повторяют, заменив 1,54 мл (2,15 г, 1,76 • 10-2 моль) пропансультоном бутансультон с получением 1,97 г моно-сульфопроиплового эфира β -циклодекстрина в виде белого аморфного твердого продукта. Элементный анализ показывает отношения углерода к сере составляет 12,1, что соответствует Ca. 1,4 замещениям на молекулу.
Пример 3. Сульфобутиловые эфиры β -циклодекстрина.
В 50 мл круглодонной колбе 5 грамм β -циклодекстрина (4,41 • 10-3 моль) добавляют при перемешивании к водному раствору, содержащему 10 мл воды и 2,0 г гидроксида натрия при 70oC. К этому раствору медленно добавляют 4,5 мл (6,0 г, 4,41 • 10-2 моль) бутансультона при энергичном перемешивании для обеспечения максимального контакта гетерогенных фаз. После образование единой фазы, свидетельствующего об израсходовании алкилсультона, раствор охлаждают до комнатной температуры и разбавляют 20 мл воды. Полученный раствор нейтрализуют 1 н соляной кислотой и диализуют 3 х 700 мл воды для удаления остатков солей и гидроксиалкил сульфоновых кислот, образующихся как побочные продукты. Диализат концентрируют ультрафильтрацией и устанавливают pH остатка нейтральным и лиофилизуют с получением сульфобутилового эфира циклодекстрина в виде белого аморфного твердого вещества. Элементный анализ продукта показывает, что отношение углерода к сере составляет 3,73, что соответствует Ca. 7 замещения на молекулу. Тонкослойная хроматография продукта (2-бутанон: метанол:вода, 4:4:2) показывает отсутствие непрореагировавшего β -циклодекстрина.
Пример 4. Дополнительные сульфоалкилэфиры циклодекстрина.
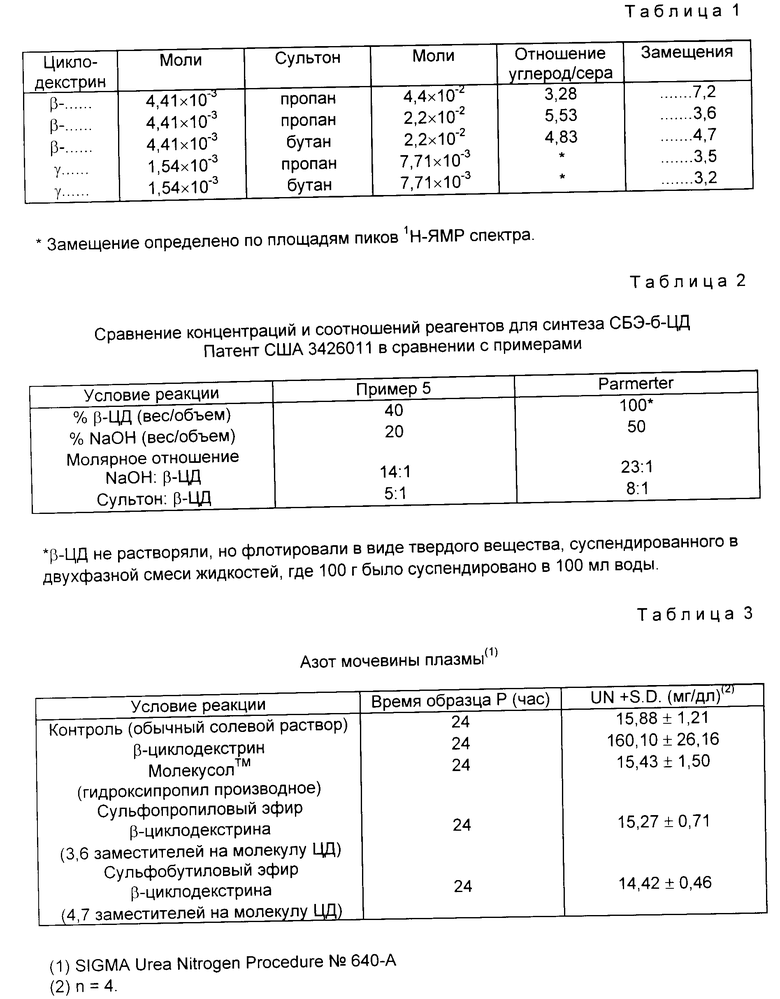
Методы примера 3 варьировали в зависимости от реагентов и мольных соотношений с получением производных циклодекстрина с различной степенью замещения. Представленные результаты следующие (см. табл. 1).
Пример 5. Комплекс прогестерона с производным СД (ЦД).
(220 мг, 0,10 ммоля) сульфобутилового эфира β -циклодекстрина из табл. 8, содержащего 25% дериватизированного β -циклодекстрина, (СБЭ7- β -ЦД/25%) растворяют в 1 мл воды с получением 0,1 молярного раствора циклодекстрина. К этому раствору добавляют (54 мг, 0,17 ммоля) тонкоизмельченного прогестерона, и полученную суспензию облучают ультразвуком в течение 24-48 ч. Водную суспензию отфильтровывают и фильтрат содержит комплекс прогестерон : циклодекстрин (пример 18 мг прогестерона/мл раствора), который используется как есть или после выделения в виде твердого вещества путем сушки посредством вакуумного выпаривания, распылительной сушки или лиофилизации.
Пример 6. Способ комплексообразования "твердая фаза в раствор".
(28 мг, 0,08 ммоля) гидрокортизона и (220 мг, 0,10 ммоля) СБЭ7- β -ЦД/25% измельчают в ступке пестиком для увеличения поверхности частиц и чтобы диспергировать гетерогенные частицы. Твердую смесь переносят в 1-миллилитровый "вольюметрический" контейнер с достаточным объемом, чтобы была возможность "встряхивания" твердого вещества в растворе. Добавляют каплю или две воды (или "водного растворителя"), чтобы создать очень концентрированный циклодекстриновый раствор с минимальными водными свойствами и максимальную возможность для гидрофобного лекарственного препарата найти полость ЦД. Раствор/суспензию нагревают и облучают ультразвуком до тех пор, пока гидрокортизон не растворится. Добавляют дополнительно воду (или "водный растворитель") до объема, в общем равного 1 мл.
"Водный растворитель". В идеале единственным добавлением растворителем должна быть вода, однако, в зависимости от свойств лекарственного вещества, может быть использован буфер. Для лекарственных веществ, которые чрезвычайно плохо растворимы в воде возможно нужно, чтобы первые одна или две капли были этанолом или ДМСО, но более предпочтительно, водным раствором этанола или раствором ДМСО с как можно меньшим количеством органического растворителя (т.е. 50,50 EtOH, вода).
Водный раствор фильтруют и фильтрат содержит комплекс гидрокортизон: циклодекстрин, который используется как есть, или его выделяют в виде твердого вещества путем сушки с помощью вакуумного выпаривания, распылительной сушки или лиофилизации.
Пример 7. Способ получения комплекса "твердое вещество - твердое вещество".
(7,8 г, 0,01 моля) диоксина и (220 г, 0,10 моля) СБЭ7- β -ЦД/25% перемешивали, используя вибрационную мельницу до тех пор, пока исследование с помощью твердофазного ЯМР не показывали, что образовался комплекс.
Пример 8. Получение дополнительных циклодекстриновых производных.
Реагенты.
Раствор β -ЦД. 1,38 г NaOH растворяли в 15 мл воды. К этому щелочному раствору добавляли 11,33 г β -ЦД (11,8% вода). Смесь нагревали до тех пор, пока весь β -ЦД растворится. β -ЦД оставался в растворе, когда смесь охлаждали до комнатной температуры.
Раствор сультона.
3,51 г NaOH растворили в 10 мл воды и в этот щелочной раствор добавляли 6,01 г бутансультона.
Реакция.
Водную смесь сультона: NaOH помещали в 100 мл 3-горлую колбу с круглым дном. Колбу снабжали конденсатором (холодильником), термометром и дополнительным отверстием для ввода. Реакционную систему помещали на водяную баню с комнатной температурой и температуру бани повышали до 70oC в течение 110 мин. Затем по каплям в течение 2 ч добавляли раствор β -ЦД и давали прореагировать в течение дополнительных 30 мин. В конце реакции pH реакционной смеси был равен 13,5. Раствор нейтрализовали до pH 7 с помощью 1н HCl.
Доработка.
Нейтрализованную реакционную смесь разбавляли водой и подвергали ультрафильтрации через мембрану, отделяющую компоненты с молекулярным весом 500, чтобы удалить NaCl и гидролизованные побочные продукты сультона. Оставшийся удержанный материал содержит смесь СБЭ-производных циклодекстринов и непрореагировавшего В-ЦД. Анализ с помощью капиллярного электрофореза показывает, что продукт содержит 40% В-ЦД и 60% СБЭ-ЦД производных, состоящих из СБЭ1- β -ЦД, СБЭ2- β -ЦД, СБЭ3- β -ЦД, СБЭ4- β -ЦД, СБЭ5- β -ЦД, СБЭ6- β -ЦД, СБЭ7- β -ЦД, СБЭ8- β -ЦД. Средняя степень замещения (DS) СБЭ-ЦД части продукта в виде смеси представляет DS примерно 4,1.
Условия реакции (когда все реагенты уже смешаны) заключаются в процентных концентрациях и молярных соотношениях, которые сравнимы с условиями, описанными в вышеприведенных примерах, но они отличаются от условий, описанных в патенте США 3453257 (принадлежащего Parmerter). DS конечного продукта СБЭ равна примерно 4,1, что сравнимо с таковой полученной для материала, полученного в вышеприведенных примерах, однако распределение по группам СБЭ-ЦД различно (см. табл. 2).
Пример 9. Способ комплексообразования путем равновесной растворимости.
(220 мг, 0,10 ммоля) сульфобутилового эфира В-циклодекстрина из примера 8, содержащего 40% непреобразованного В-циклодекстрина (СБЭ7- β -ЦД/40%) растворяют в 1 мл воды с получением 0,1 молярного раствора циклодекстрина. К этому раствору добавляют (54 мг, 0,17 ммоля) тонко измельченного прогестерона и полученную суспензию обрабатывали ультразвуком в течение 24-48 ч. Водную суспензию фильтруют, фильтрат содержит комплекс прогестерон : циклодекстрин (примерно 18 мг прогестерона/мл раствора), который используется как есть, или выделяется в виде твердого вещества путем высушивания с помощью вакуумного выпаривания, распылительной сушки или лиофилизации.
Пример 10. Способ комплексообразования "твердая фаза к раствору".
(28 мг, 0,08 ммоля) гидрокортизона и (220 мг, 0,10 ммоля) СБЭ7- β -ЦД/40% измельчают с помощью ступки и пестика для увеличения площади поверхности частиц и диспергирования гетерогенных частиц. Твердую смесь переносят в 1-миллилитровый "волюмометрический" контейнер с достаточным пространством для того, чтобы возможно "встряхивание" твердого вещества в растворе. Добавляют каплю или две воды (или "водного растворителя") для создания очень концентрированного циклодекстринового раствора с минимальными водными свойствами и максимальной возможностью для гидрофобного лекарственного средства найти полость ЦД. Раствор/суспензию нагревают и обрабатывают ультразвуком до тех пор, пока гидрокортизон растворится. Добавляют дополнительно воду (или "водный растворитель") до объема всего 1 мл.
Водный раствор фильтруют и фильтрат содержит комплекс гидрокортизона : циклодекстрина, который используется как есть выделяется в виде твердого вещества путем сушки с помощью вакуумного выпаривания, распылительной сушки или лиофилизации.
Пример 11. Способ комплексообразования "твердое вещество-твердое вещество".
(7,8 г, 0,01 моля) диоксина и (220 г, 0,10 моля) СБЭ7- β -ЦД/40% смешивают, используя вибрационную мельницу, до тех пор пока исследования с помощью твердофазного ЯМР не покажут, что образовался комплекс.
Кумулятивное выделение циклодекстрина с мочой.
Данные, касающиеся группы, представленные на фиг. 1, свидетельствуют, что, хотя производные сульфоалкил циклодекстрина по изобретению, также как и гидроксипропильное производное, выделяются у мышей быстрее и в большей степени, чем исходное соединение, настоящие производные выделяются наиболее быстро. Фиг. 1 касается данных для непреобразованного циклодекстринового соединения, гидроксипропил производного, сульфобутилпроизводного по изобретению и сульфопропил производного по изобретению.
Острая парентеральная токсичность.
Сульфоалкил производные циклодекстрина по изобретению не проявили наблюдаемое токсическое действие на самцах мышей в течение свыше 30 дней после внутрибрюшного введения 5,49 • 10-3 моль/кг.
Эта доза эквивалента 7,1 г/кг для моносульфоалкильных производных, 12,3 г/кг для сульфобутильного производного W/7 степеней замещения и 11,8 г/кг для сульфопропильного производного W/7 степеней замещения.
Азот мочевины плазмы.
Уровни азота мочевины плазмы являются индикаторами функционирования почек, при том, что повышение уровня свидетельствует о почечном заболевании. Данные табл. 3 свидетельствуют, что сульфоалкильные производные циклодекстрина по изобретению не вызывают повышения уровней азота мочевины плазмы у мышей по сравнению с непреобразованным исходным соединением (контроль). Однако отсутствует статистическое различие между нашими производными и гидроксипропильным производным.
Гемолиз красных кровяных клеток.
Как можно видеть из данных фиг. 2 и 3 более высокозамещенные производные алкилсульфоновой кислоты по изобретению вызывают меньший мембраны, как показывает процент гемолиза, чем монозамещенные производные. Монозамещенные производные вызывают почти такой же разрыв мембраны, что и гидроксипропил производное.
Проявление фазовой растворимости.
Как можно видеть из табл. 4 ниже и данных, представленных на фиг. 4a и 4b, контакты ассоциации для равновесия между сульфобутил производными по изобретению и дигоксином в пять раз больше, чем для гидроксипропил производного.
Необходимо отметить, что ось x на графиках фиг. 4a и 4b имеет максимум при примерно 1,8% по весу циклодекстрина. Если рассматривать относительную растворяющую способность настоящих производных по отношению к гидроксипропилпроизводному (при 50% растворах, как дано в патенте США N 4727064, табл. 1), то кажущаяся растворимость дигоксина составляет примерно 216 мг/мл для настоящего сульфобутил производных по сравнению с примерно 80 мг/мл для гидроксипропил производного. Значение 45,0 мг/мл, указанное в патенте США, дано для гидроксипропил производного с отличающейся степенью значения от гидроксилпроизводного, используемого здесь для сравнения.
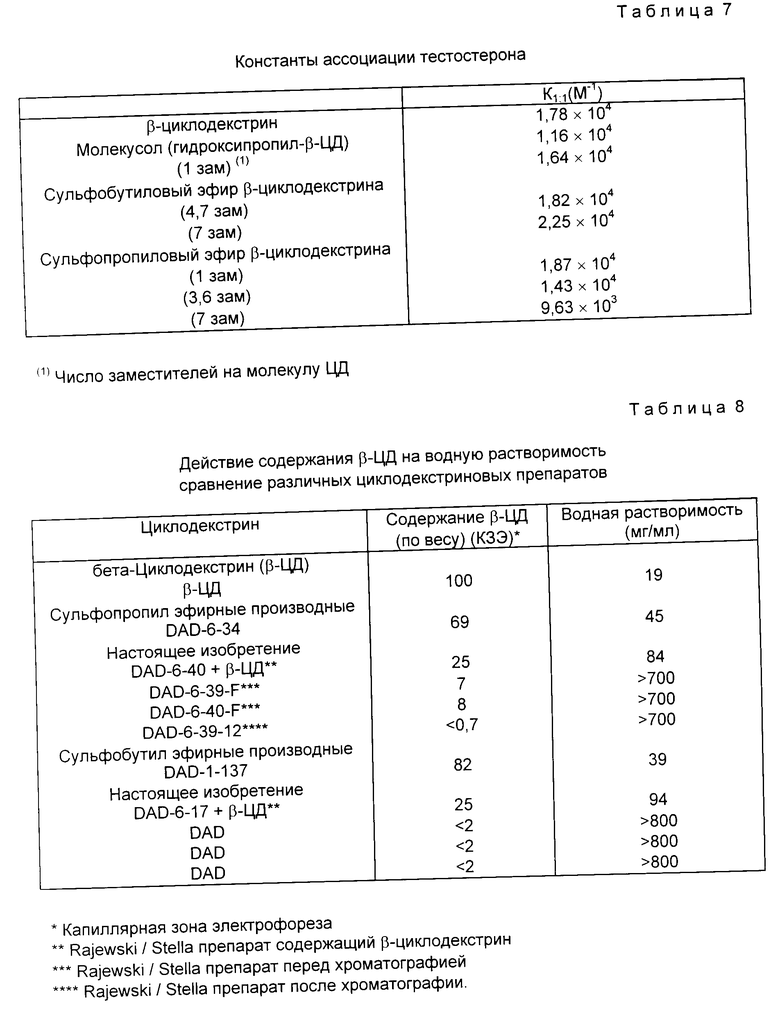
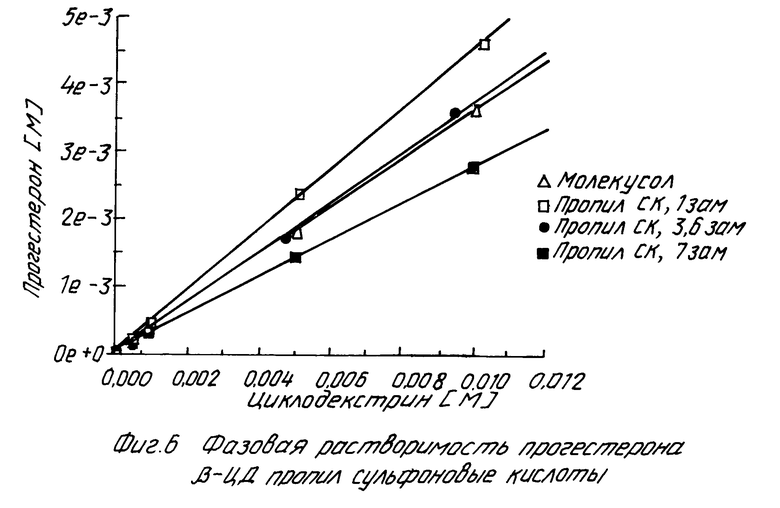
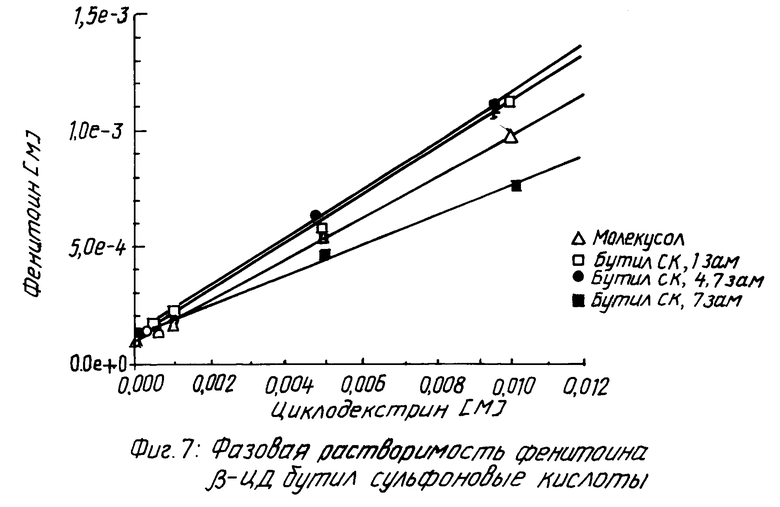
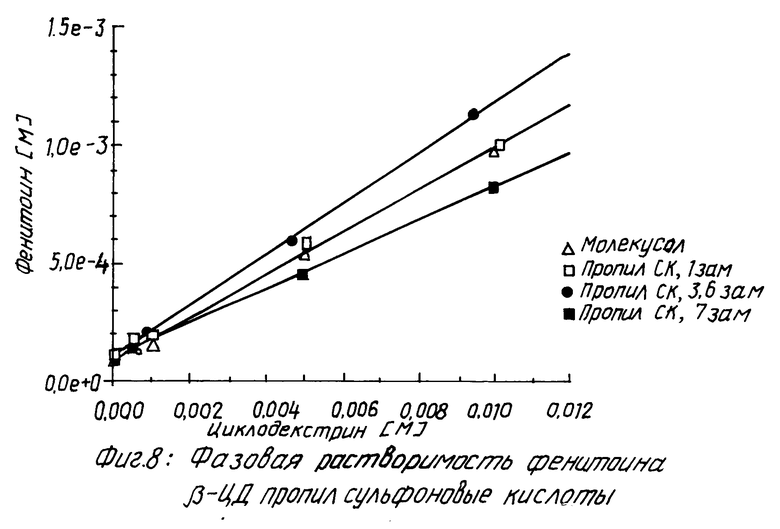
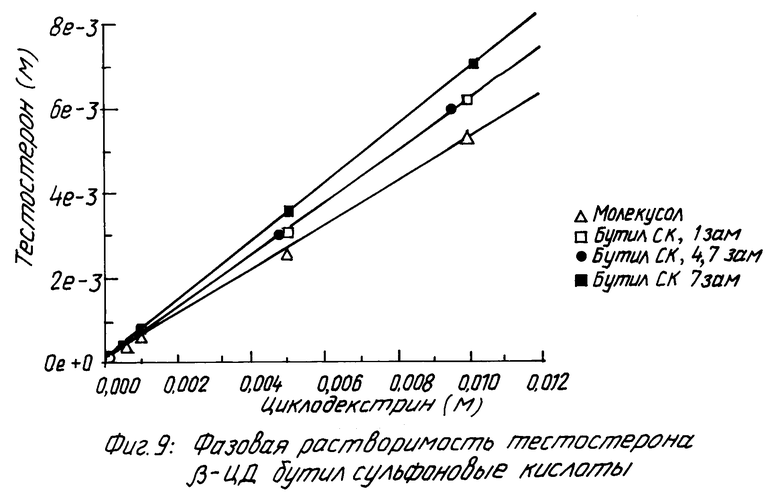
Похожие результаты можно видеть для прогестерона (смотри табл. 5 и фиг. 5 и 6), фенитоина (см. табл. 6 и фиг. 7 и 8) и тестостерона (см. табл. 7 и фиг. 9 и 10).
Исследования оральных препаратов
Как обсуждалось выше, оральные препараты могут допускать более высокое содержание β -циклодекстрина без ухудшения токсических показателей. Применяемые допустимые уровни β -циклодекстрина, однако, зависят от надлежащего баланса других характеристик, включая особенно присущую водную растворимость.
Максимум водной растворимости любого модифицированного циклодекстрина определяет границы его использования в растворяющих лекарство субстанциях. Чем выше водная растворимость, тем больше возможность применения циклодекстрина при достаточно высоких концентрациях для растворения всей лекарственной субстанции с образованием комплекса включения. Табл.6 показывает результаты сравнения водной растворимости различных сульфоалкил производных, полученных по настоящему изобретению, с установленным содержанием от < 0,7 до 25% по весу остаточного β -циклодекстрина с водной растворимостью производных, полученных по способу, описанному в патенте США N 3426011 Parmerter, которые содержат 62 - 82% по весу остаточного β -циклодекстрина.
Результаты табл. 6 показывают, что в то время, как концентрация остаточного содержания β -циклодекстрина увеличивается от < 1% по весу до 25% по весу, водная растворимость уменьшается. Однако, даже при содержании 25% по весу остаточного β -циклодекстрина смесь сульфоаклил эфирные производных проявляет растворимость в воде 84 и 94 мг/мл для сульфопропил и сульфобутил эфирных производных, соответственно. Это означает, что препарат по настоящему изобретению, содержащий даже так много, как 25% по весу β -циклодекcтрина, проявляет водную растворимость в 1,5 - 2 раза больше, чем соответствующие препараты Parmerter.
Фиг. 11 - 13 графически показаны характеристики растворимости некоторых лекарств с производными по настоящему изобретению, содержащие различное количество β -циклодекстрина. На фиг. 11 и 12 показаны результаты исследований растворимости двух различных лекарств, тестостерона и прогестерона, соответственно. На обоих рисунках характеристики растворимости представлены для сульфобутил и сульфопропил эфирных производных по настоящему изобретению, содержащих различное количество β -циклодекстрина и, кроме того, представлены сульфопропил эфирные сульфобутилэфирные производные по Parmeter. Результаты обоих исследований показывают, что производные по настоящему изобретению проявляют намного более высокую растворимость по сравнению с производными Parmeter. Даже композиция, содержащая сульфобутил эфирное производное по настоящему изобретению с 50% β -циклодекстрина, все еще показывает намного более высокую растворимость по сравнению по сравнению с композициями Parmeter. Результаты также показывают, однако, скорее существенное понижение растворимости после повышения количества β -циклодекстрины выше 50%.
Фиг. 13 представляет собой характеристики растворимости напроксена для композиций сульфобутил эфирных производных по изобретению с различными количествами β -циклодекстрина. Это исследование неожиданно показало, что растворимость напроксена была не такой высокой, как у тестостерона и прогестерона при низких уровнях β -циклодекстрина, но также растворимость лекарства не казалась значительно понижающейся при повышении количества β -циклодекстрина. Тем не менее, результаты фиг. 11 и 12 показывают, что растворимость некоторых лекарств не понижается с повышением количества β -циклодекстрина. Для таких лекарств композиции с сульфоалкил эфирными производными циклодекстрина обеспечивают прекрасную лекарственную растворимость даже при 40 - 50% β -циклодекстрина.
Очевидно, возможно множество модификаций и вариаций настоящего изобретения в свете вышеописанных методов. Необходимо далее отметить, что без ограничений прилагаемой формулы изобретения изобретение может найти более широкое практическое приложение, чем описано здесь.

Описаны очищенные производные сульфоалкильных эфиров циклодекстрина или их смесь, где производное циклодекстрина имеет формулу, приведенную в тексте описания, где n=4,5,6, R1-R9-каждый независимо означает O- или O-(C2-6 алкилен)-SO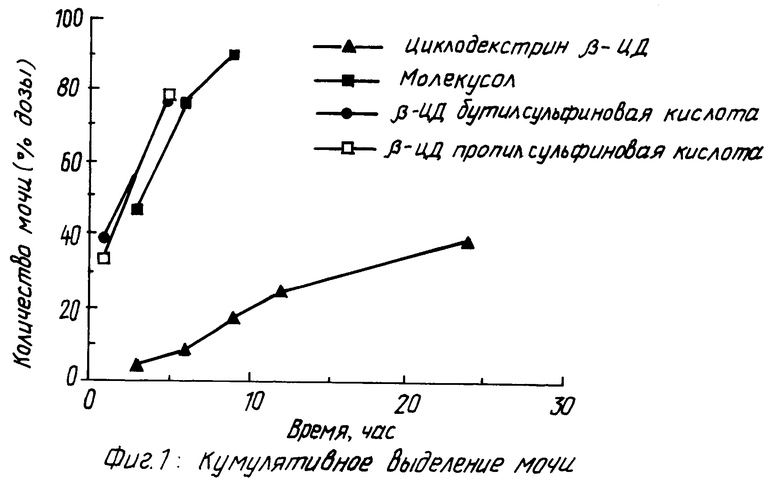
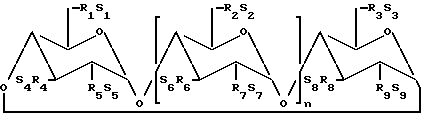
где n = 4, 5 или 6;
R1 - R9 каждый независимо - O- или O(C2 - C6-алкилен) - SO3 - группой и по меньшей мере один из R1 и R2 независимо - указанная O-(C2 - C6-алкилен)-SO3 --группа;
S1 - S9 - каждый независимо фармацевтически приемлемый катион,
указанные производные содержат в среднем примерно 1 - (3n + 6) C2 - C6-сульфоалкильных групп на 1 молекулу циклодекстрина, а содержание недериватизированного циклодекстрина в указанной смеси превышает 5 мас.%, но менее 50 мас.%.
11. Производные по п.9, где производные циклодекстрина в указанной смеси содержат в среднем около одной O-(C2 - C6-алкилен)-SO3 --группы на 1 молекулу циклодекстрина.
где n = 4, 5 или 6;
R1 - R9 каждый независимо - O- или O-(C2 - C6-алкилен)-SO3 -- группа и по крайней мере один из R1 и R2 независимо O-(C2 - C6-алкилен)-SO3 -- группа;
S1 - S9 каждый независимо - фармацевтически приемлемый катион,
причем указанные производные в среднем содержат примерно 1 - (3n + 6) C2 - C6-сульфоалкильных групп на 1 молекулу указанного циклодекстрина, причем содержание недериватизированного циклодекстрина в указанной смеси находится в интервале примерно от более 5 мас.%, но менее 50 мас.%, а молярное соотношение производного циклодекстрина лекарственного вещества находится в интервале от 10 : 1 до 1 : 10, предпочтительно от 2 : 1 до 5 : 1.
| US, патент, 4535152, кл | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| US, 4727064, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
Авторы
Даты
1998-06-20—Публикация
1993-07-26—Подача