Изобретение относится к производным таксола, которые обладают лучшей водорастворимостью по сравнению с таксолом и показывают хорошую противоопухолевую активность. Указанные соединения предназначены для их использования при лечении тех же видов рака, при котором используется и таксол, а именно опухолей легких, меланом, лейкемии, рака молочной железы и рака толстой кишки.
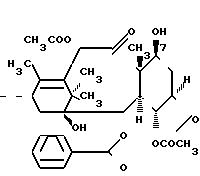
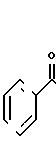
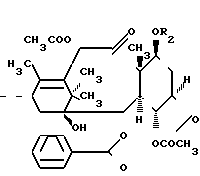
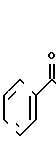
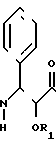
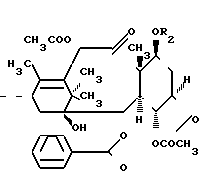
Таксол является известным дитерпеноидом, сесквитерпеном, который получают из коры дерева тиса коротколистного, Taxus brevi folia и который имеет следующую структуру:
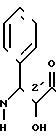


 (I)
(I)
Таксол также обладает сильной ингибирующей активностью против широкого ряда опухолей. Однако это соединение плохо растворяется в воде, что создает ряд значительных трудностей при изготовлении фармацевтических композиций, используемых для лечения опухолей у человека. Некоторые композиции таксола для инъекций или внутривенных вливаний изготавливаются в основном с использованием кремофора EL® в качестве наполнителя в целях устранения недостатка, связанного с низкой водорастворимостью таксола. Однако кремофор сам по себе является отчасти токсичным и вызывает идиосинкразическое высвобождение гистамина и анафиклатическиподобную реакцию, поэтому использование этого наполнителя, к сожалению, не является хорошим решением указанной выше проблемы разработки подходящих композиций таксола.
В соответствии с этим в результате исследований были получены производные таксола, которые, обладая лучшей водорастворимостью, чем таксол, показывают в то же время, такую же хорошую противоопухолевую и цитотоксичную активность, как и таксол.
Целью изобретения является получение производных таксола, обладающих хорошей противоопухолевой активностью и водорастворимостью, изготовление композиций, содержащих производные таксола и нетоксичные носители, что позволит отказаться от использования токсичных носителей, таких как кремофор, а также получение производных таксола, которые обладали бы достаточно хорошей стабильностью при уровнях рН, подходящих для изготовления фармацевтических композиций (рН 3-4), но при этом обладали бы способностью быстро разлагаться in vivo при физиологических значениях рН (рН 7,4), т.е. которые могли бы действовать, как предшественник таксола.
Эти цели изобретения могут быть осуществлены путем разработки получения производных таксола, обладающих хорошей противоопухолевой активностью и водорастворимостью.
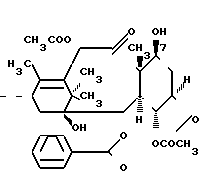
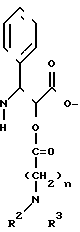
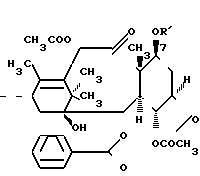
Новые производные таксола могут быть в основном представлены как 2'- и/или 7-сложные эфиры таксола, имеющие следующую формулу:
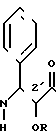


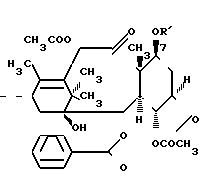 (II)
(II)
где R и R' каждый является Н или остатком аминокислоты, выбранной из группы, состоящей из аланина, лейцина, изолейцина, валина, фенилаланина, пролина, лизина или аргинина, или группой формулы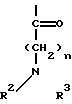 (III)
(III)
где n является целым числом от 1 до 3;
R2 и R3 - каждый является водородом или алкилом, имеющим от 1 до 3 атомов углерода, или R2 и R3 вместе с атомом азота, с которым они связаны, образуют насыщенное гетероциклическое ядро, имеющее 4-5 атомов углерода, при условии, что, по крайней мере, один из R и R' не является водородом.
Если в указанной формуле (III) R2 и/или R3 не являются водородом, то эти соединения могут рассматриваться как так называемые "алкилированные аминокислоты". Таким образом, соединения формулы (I), в более широком смысле, могут рассматриваться как 2'- и/или 7-сложные эфиры таксола с аминокислотами или алкилированными аминокислотами.
Таким образом, изобретение включает в себя:производные, этерифицированные при 2'-гидроксильной группе таксола, производные, этерифицированные при 7-гидроксильной группе таксола, и производные, этерифицированные при 2'- и 7-положениях гидроксильных групп.
Среди соединений, описываемых указанной общей формулой I, предпочтительными соединениями изобретения являются следующие соединения:
2' (N,N-диэтиламинопропионил) таксол (соединение 1)
2' (N,N-диметилглицил) таксол (соединение 2)
7(N,N-диметилглицил) таксол (соединение 3)
2', 7-ди-(N,N-диметилглицил) таксол (соединение 4)
7 (N,N-диэтиламинопропионил) таксол (соединение 5)
2',7-ди (N,N-диэтиламинопропионил) таксол (соединение 6)
2' -(L-глицил) таксол (соединение 7)
7-(L-глицил) таксол (соединение 8)
2' ,7-ди(L-глицил) таксол (соединение 9)
2 '-(L-аланил) таксол (соединение 10)
7-(L-аланил) таксол (соединение 11)
2',7-ди (L-аланил) таксол (соединение 12)
2 '-(L-лейцил) таксол (соединение 13)
7-(L-лейцил) таксол (соединение 14)
2',7-ди(L-лейцил) таксол (соединение 15)
2' -(L-изолейцил) таксол (соединение 16)
7-(L-изолейцил) таксол (соединение 17)
2',7-ди(L-изолейцил) таксол (соединение 18)
2 '-(L-валил) таксол (соединение 19)
7-(L-валил) таксол (соединение 20)
2' ,7-ди(L-валил) таксол (соединение 21)
2' -(L-фенилаланил) таксол (соединение 22)
7-(L-фенилаланил) таксол (соединение 23)
2',7-ди(L-фенилаланил) таксол (соединение 24)
2 '-(L-пропил) таксол (соединение 25)
7-(L-пропил) таксол (соединение 26)
2',7-ди(L-пропил) таксол (соединение 27)
2'-(L-лизил) таксол (соединение 28)
7-(L-лизил) таксол (соединение 29)
2 ',7-ди (L-лизил) таксол (соединение 30)
2' -(L-глутамил) таксол (соединение 31)
7-(L-глутамил) таксол (соединение 32)
2',7-ди(L-глутамил) таксол (соединение 33)
2 '-(L-аргинил) таксол (соединение 34)
7-(L-аргинил) таксол (соединение 35)
2',7-ди(L-аргинил) таксол (соединение 36)
Было обнаружено, что 2'- и 7-гидроксильные группы таксола, особенно 2'-гидроксильная группа, являются более химически активными, чем 7-гидроксильная группа. И этот факт лег в основу получения предлагаемых производных.
Получение производных 2'-сложный эфир-таксола
Производные 2'-сложного эфира могут быть получены одним или двумя способами в зависимости от того, является это производное образованным аминокислотой или алкилированной аминокислотой.
Для получения сложных эфиров алкилированных аминокислот использовалась следующая реакционная схема:
Cхема I
алкилированная аминокислота+таксол ->> 2'-сложный эфир (таксол)-производное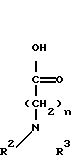


где n, R2 и R3 определены выше.
Для получения сложных эфиров аминокислот использовалась следующая реакционная схема:
Схема II  с
с т
т з
з
В обеих реакционных схемах (I и II) реакцию алкилированных или защитных аминокислот проводят в присутствии конденсирующего реагента и необязательно в присутствии катализатора, предпочтительно при комнатной температуре.
Подходящими конденсирующими реагентами являются карбодиимиды, такие как дициклогексилкарбодиимид (ДCC).
Подходящими катализаторами являются 4-диметиламинопиридин (ДМАП) и пиридин.
В реакционной схеме (II) в качестве исходных материалов могут быть использованы различные известные амино-защитные группы и коммерчески доступные защищенные аминокислоты. Для этой цели могут быть использованы аминокислоты, защищенные t-ВОС, FМОС или карбобензилокси-группой (CBZ). Предпочтительными являются аминокислоты, защищенные t-ВОС или FMOC-группами. Хотя разблокирование t-ВОС-группы на 2'-сложных эфирах с использованием водной муравьиной кислоты и других органических кислот и приводит к деградации продукта, а также к стереохимической модификации этого продукта, однако, использование 99% муравьиной кислоты дает лучшие результаты. В случае сложных эфиров FMOC-защищенных аминокислот, восстановление продукта зависит от рабочих условий реакции. Таким образом, в конечной стадии разблокирования, конкретные условия, используемые для удаления t-ВОС-защитной группы, могут вызвать нежелательные модификации у свободной гидроксильной группы в 7-положении молекул таксола. Эти нежелательные модификации, очевидно, являются следствием стереохимических модификаций молекул.
Примерами N-защищенных аланиновых соединений являются следующие соединения:
CH NH
NH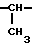 COOH t-ВОС-защищенные
COOH t-ВОС-защищенные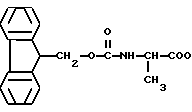 FMOC-защищенные
FMOC-защищенные
Как уже указывалось, было обнаружено, что 2'-гидроксильная группа таксола является более химически активной, чем 7-гидроксильная группа. Таким образом, в обеих указанных схемах I и II замещение или этирификации направлены на 2'-положение и осуществляются путем взаимодействия алкилированной или N-защищенной аминокислоты с таксолом при молярном соотношении 1: 1 или слегка превышающем 1:1. Указанная реакция, проводимая с использованием равных молярных количеств, приводит к получению значительного избыточного количества производного 2'-сложный эфир-таксола, хотя при этом могут образовываться небольшое количество 7-сложный эфир-таксол-производного, как побочного продукта.
Получение 7-позиционных сложных эфиров.
Схема III
Поскольку 2'-гидроксильная группа таксола является более активной, чем 7-гидроксильная группа, то указанная этерификация требует применения процедуры, отличной от той, что используется для получения 2'-производных. Таким образом, для получения 7-сложных эфиров использовалась процедура, с помощью которой 2-гидроксильная группа сначала блокировалась, затем 7-гидроксильная группа подвергалась этерификации и, наконец, 2'-защитная или блокирующая группа удалялась.
 д
д

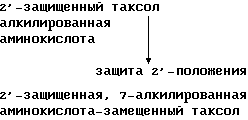
Для блокирования 2'-положения таксола могут быть использованы ряд известных защитных групп. В приведенной ниже схеме представлен пример использования защитной группы и алкилированной аминокислоты.

В приведенной выше реакционной схеме, реакцию 2'-troc-таксола и алкилированной аминокислоты проводят в присутствии конденсирующего реагента и катализатора. Подходящими конденсирующими реагентами и катализаторами являются те же реагенты и катализаторы, которые были указаны для схем I и II.
Разблокирование 2'-(troc)-таксола может быть осуществлено, например путем использования смеси цинка и уксусной кислоты.
Схема IV
В качестве альтернативного варианта производные 7-замещенного таксола могут быть получены при помощи процедуры, которая заключается в том, что сначала таксол подвергают взаимодействию с 2-3 эквивалентами N-защищенной аминокислоты в целях получения 2',7-двузамещенного таксола, затем подвергают разблокированию 2'- и 7-аминокислоты и отщепляют 2'-аминокислоту. Эта процедура схематически может быть представлена следующим образом с использованием t-ВОС защищенного аланила:
таксол +N-t
В этой процедуре, аналогичной процедуре схемы III, реакция таксола и защитной аминокислоты протекает в присутствии конденсирующего реагента и катализатора. Разблокирование аминокислот проводили методом, обычно используемoм для разблокирования аминокислот, например с помощью муравьиной кислоты.
Расщепление 2'-аминокислоты проводили путем доведения рН раствора 2', 7-(аминокислота) таксола до 7-7,4, например, с помощью смеси 2',7-ди(аминокислота) таксола в фосфатном буфере рН 7-7,4. Корректировка рН указанным способом приводит к расщеплению 2'-аминокислоты с образованием целевого 7-(аминокислота) таксола.
Расщепление 2'-аминокислоты проводили путем доведения рН раствора 2', 7-(аминокислота) таксола до 7-7,4, например с помощью смеси 2',7-ди(аминокислота) таксола в фосфатном буфере рН 7-7,4. Корректировка рН указанным способом приводит к расщеплению 2'-аминокислоты с образованием целевого 7-(аминокислота) таксола.
Таким образом, например, таксол подвергают реакции взаимодействия с 2-3 молярными эквивалентами N-защищенной аминокислоты (t-ВОС, CBZ или FMOC-защищенной) в метиленхлориде в присутствии ДCC и каталитического количества 4-диметиламинопиридина. В этом способе защищенную аминокислоту вводят в 2'- и 7-положение. Защитные группы удаляют с помощью соответствующего разблокирующего агента (например, кислоты, слабого основания, гидрогенолиза). Производное 2', 7-бис-аминокислота таксола выдерживают в течение 24-48 ч в фосфатном буфере при нейтральном рН, в результате чего происходит селективное разблокирование в 2'-положении с образованием 7-замещенного производного таксола.
Аналогичная реакционная схема может быть также использована для получения 7-замещенных производных таксола с помощью алкилированных аминокислот. Указанная реакция аналогична описанной выше, за исключением того, что проводили замещение N-защищенной аминокислоты нужной алкилированной аминокислотой, а стадию разблокирования не проводили. Эта схема может быть представлена следующим образом.
Схема V
таксол + алкилированная >>2
>>2
Получение производных 2',7-двузамещенного таксола.
Двузамещенные производные могут быть получены с помощью следующих процедур или части этих процедур.
Схема VI: Замещение алкилированными аминокислотами
таксол + алк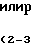 о
о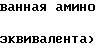 кисло
кисло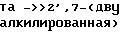 з
з
Схема VII: Замещение аминокислотами
таксол + N- щ
щ и
и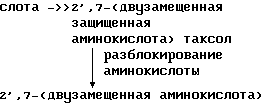

Схема VI, в основном, аналогична схеме I, за исключением того, что реакция протекает с 2 эквивалентами алкилированной аминокислоты. Кроме того реакция схемы I не требует обязательного присутствия катализатора, а реакция схемы VI должна протекать в присутствии катализатора вследствие меньшей химической активности 7-гидроксильной группы таксола.
Схема VII, в основном, аналогична схеме II. Однако, в связи с этим следует отметить, что в схеме VI предпочтительной защитной группой является FMOC-группа, которая позволяет избежать стеариновых модификаций в 7-положении во время стадии разблокирования. Такой проблемы, однако, не существует при реакции схемы VII, поскольку 7-гидроксильная группа является свободной. Таким образом, в указанной схеме могут быть использованы различные известные защитные группы, включая обе t-ВОС и FMOC-группы.
П р и м е р 1. 2'-(N,N-Диметилглицил)таксол или его соль.
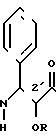


 .
.
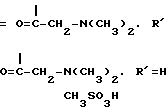 =H
=H
Соединение 1-2'-(N,N-диметилглицил) таксол.
К раствору таксола (0,21 г, 0,246 ммоль) и N,N -диметилглицина (0,0264 г, 0,246 ммоль) в безводном метиленхлориде (12 мл) добавляли 1,3-дициклогексилкарбодиимид (0,15 г, 0,72 ммоль) и 4-диметиламинопиридин (0,025 г, 0,2 ммоль). Реакционную смесь перемешивали в течение 1 дня в безводной среде. После чего добавляли еще 50 г ДCC и продолжали перемешивать еще 6 ч. Реакционную смесь отфильтровывали и фильтрат выпаривали в присутствии азота. Остаток хроматографировали на силанизированном силикагеле (35 г, 26 см) и последовательно элюировали смесью этилацетата и петролейного эфира (1:1) и этилацетатом. После чего фракции этилацетата:петролейного эфира медленно выпаривали и полученное твердое вещество фильтровали. Маточный раствор концентрировали, и добавляли петролейный эфир до тех пор, пока не появлялось помутнение, после чего его отбрасывали. В результате получали 0,14 г (61% ) соединения (т.пл. 168-171оС, разл.). В ЯМР-спектре соединения (300 МГц, CDCl3) резонансы 2'-протона давали сдвиг от 4,71 ppm в таксоле до 5,59 ppm, что соответствует этерификации в 2-положении. Все остальные резонансы спектра находятся в соответствии с предполагаемой структурой. ВЭЖХ-чистота составляла 98-99,5%. Масс-спектроскопия: (FAB)m/e 939 (М + Н)+.
Элементный анализ: C51H58N2O15
Вычислено,%: С 65,26; Н 6,22; N 2,98.
Найдено,%: С 65,16;Н 6,28; N 3,13.
Соединение 2-метансульфоновая кислая соль 2'-(N,N-диметилглицил) таксола.
2'-(N, N-Диметилглицил) таксол (0,06 г, 0,064 ммоль) растворяли в т-бутаноле (2 мл) и воде (1,5 мл). Смесь охлаждали до -5оС и по капле добавляли метансульфоновую кислоту (3,1 мл, 2 мг/мл, 0,0645 ммоль), после чего смесь перемешивали при 0-5оС в течение одной минуты и фильтровали через 20 мкм фильтр (миллипористый) и помещали в колбу, охлажденную в смеси льда и изопропанола. Раствор сушили вымораживанием и получали в результате 0,058 г продукта (88%), т.пл. 170-173оС.
Элементный анализ: C52H62N2SO18 x x2H2O
Вычислено,%: С 57,83; Н 6,27; N 2,6.
Найдено,%: С 57,49; Н 6,06; N 2,73.
Физические свойства. Мол.м. 1035 Т.пл. 170-173оС (разл.) Растворимость 15 мг/мл (слегка мутный)
2 мг/мл (светлый)
Исследования химической стабильности
Полученное соединение подвергали испытанию на стабильность в соответствии со следующими процедурами.
Исследовались производные при различных рН при 25оС и 37оС. Исследования плазмы проводили при 37оС с использованием плазмы человека и крысы. Человеческую плазму получали из госпиталя Watkins, а крысиную плазму получали из Канзасского университета (Animal Care Unit). Концентрация производного составляла около 20-25 мкг/мл. Маточный раствор соединения получали в количестве 0,8-1,0 мг/мл и добавляли к плазме до нужной концентрации (20-25 мкг/мл), 100 мкл образцов удаляли и резко охлаждали с помощью 250 мкл ацетонитрила и центрифугировали с целью осаждения плазменных белков. Кинетику деградации исследовали с помощью ВЭЖХ с построением графика зависимости площади пика от времени. Были рассчитаны t90 и t50. Исследования плазмы и химические исследования осуществляли с помощью жидкостной хроматографии высокого разрешения с использованием Р-8-колонки (15 см) и форколонки (5 см). Детектор устанавливали при 227 нм. Подвижная фаза состояла из 0,02 М ацетата (рН 5) и ацетонитрила при соотношении 50:50 или 35:65 и скорость потока варьировалась в пределах 1-1,5 мл/мин или эта фаза состояла из тех же растворителей, содержащих 0,001 М тетрабутиламмонийбисульфата, а скорость потока составляла 1 мл/мин.
При изучении стабильности, исчезновение пика соединения приводит к образованию пика, имеющего время удержания, соответствующее таксолу. Идентификация этого пика была, кроме того, подтверждена при помощи исследований деградации новых производных. Таким образом, 2' (ДМС) таксол инкубировали и очищали с помощью препаративной ТСХ. После очистки продукт анализировали путем ВЭЖХ и спектроскопических методов. Продукт показал пик молекулярного иона при m/e 860 (М + Li)+, что подтверждает тот факт, что полученный продукт является таксолом.
Рабочие условия ВЭЖХ. Колонка R-8, 150 мм длиной,
4,6 мм внут.д. Подвижная фаза 0,02 М ацетат (рН 5)
и ацетонитрил 50:50. Детектор Kratos Spectroflow 757 Скорость потока 1 мл/мин Время удержания 1 1,2 мл (соединение 2) 5,5 мл (таксол)
Результаты исследования химической стабильности Условия t 1/2 ч 0,02 М ацетат 0,1 мг/мл (рН 3,5, 25оС) 96,2 (рН 4,5, 25оС) 55,4 Вода 2 мг/мл (рН 3,8, 37оС) 89,8
Стабильность плазмы, 37оС Условия t 1/2 мин Плазма крысы 20 мкг/мл 3,05 Плазма собаки 20 мкг/мл 121,6 Плазма человека 20 мкг/мл 198,6
П р и м е р 2. Соли 2'(N,N-диэтиламинопропионил) таксола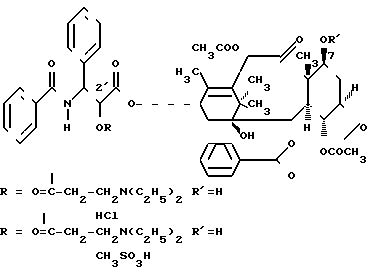
Соединение 3.
HCl-cоль 2'-(3-N,N-диэтиламинопропионил) таксола
К раствору таксола (0,12 г, 0,14 ммоль) в СН2Cl2 (12 мл), содержащему гидрохлорид N, N-диэтиламинопропионовой кислоты (0,025 г, 0,145 ммоль), добавляли 1,3-дициклогексилкарбодиимид (0,08 г, 0,38 мМ) и 4-диметиламинопиридин (0,01 г, 0,081 ммоль). Полученную смесь перемешивали в течение 24 ч при комнатной температуре. Затем реакционную смесь фильтровали и фильтрат выпаривали в присутствии азота. Неочищенный материал хроматографировали на колонках с силанизированным силикагелем (18 г, 22 см) и последовательно элюировали смесью этилацетата и петролейного эфира (1:2), смесью этилацетата и петролейного эфира (1:1) и этилацетатом. Фракции смеси этилацетата и петролейного эфира при медленном выпаривании образовывали твердый преципитат, который затем отфильтровывали. Маточные растворы, содержащие продукт, объединяли, концентрировали и добавляли до тех пор, пока раствор не становился мутным, после чего его отбрасывали. После фильтрования получали 0,068 г продукта (48%). Т.пл. 188-191оС, МС (FAB) m/e 981 (М + H)+.
ЯМР-спектр (300 Гц, CDCl3) показал, что 2'-протонные резонансы от 4,71 ppm в таксоле до 5,53 ppm-этильные группы показывали метиловый резонанс Ar 1,0 ppm и СН2-резонанс Ar 2,52 ppm. Все остальные характеристики резонансов соответствовали ожидаемому соединению.
Элементный анализ: C54H65ClN2O15
Вычислено,%: С 63,73; Н 6,43; N 2,75.
Найдено,%: С 64,84; Н 6,84; N 2,89.
Физические свойства соединения 3 Мол.м. 1017,56 Т.пл. 186-189оС (разл. ) Растворимость ≈0,8 мг/мл Условия ВЭЖХ Колонка R-8, 150 мм (длиной),
4,6 мм (внут.диам.). Подвижная фаза 0,02 М ацетат (рН 5)
и ацетонитрил 35: 65 Детектор Kratos Spectroflow 757 Скорость потока 1,5 мл/мин Время удержива- ния 16,71 мл (соединение 3) Химическая стабильность Условия t 1/2 ч 0,02 М ацетата (0,01 мг/мл рН 3,5, 25оС) 438,6 0,02 М фосфата (0,02 мг/мл рН 7,4, 25оС) 0,25 Стабильность плазмы, 37оС Условия t 1/2 мин Плазма человека 4,2
Соединение 4-метансульфоновая кислая соль 2'(N,N-диэтиламинопропионил) таксола
Для получения метансульфоновой кислой соли N,N-диметиламинопропионовой кислоты 10 г QAE-сефадекса (Pharmacia) cмачивали 0,1 М NaCl, 75% полученного материала вливали в колонку. Колонку промывали дистиллированной водой (700 мл). Затем колонку уравновешивали 500 мл CH3SO3Na (получали из 0,5 М метансульфоновой кислоты и 0,5 М гидроокиси натрия и титровали для рН 6). Полное исчезновение Cl- оценивали путем сбора элюата и тестирования на Cl-путем добавления нескольких капель 1%-ного нитрата серебра в нескольких каплях азотной кислоты. После чего колонку промывали дистиллированной водой до нейтрального рН.
2,5 г HCl-соли N,N-диэтиламинопропионовой кислоты в 15 мл воды выливали в колонку и элюировали водой. Собирали 4 фракции по 50 мл. Первые несколько фракций содержали продукт. Эти фракции объединяли, а растворитель удаляли. Остаток растворяли в смеси метиленхлорида и этанола и высушивали в присутствии сульфата магния, после чего растворитель удаляли и получали 3,1 г продукта. Этот продукт осаждали из этанола и эфира, в результате чего получали 2,6 г метансульфоновой кислой соли N,N-диэтиламинопропионовой кислоты.
К раствору таксола (0,05 г, 0,058 ммоль) и метансульфоновой кислой соли N, N-диэтиламинопропионовой кислоты (0,014 г, 0,058 ммоль) в метиленхлориде (10 мл) добавляли 1,3-дициклогексилкарбодиимид (0,061 г, 0,3 ммоль). Смесь перемешивали в течение 24 ч при комнатной температуре, затем реакционную смесь фильтровали, а фильтрат выпаривали в атмосфере азота. Остаток хроматографировали на колонке с силанизированным силикагелем и элюировали смесью этилацетата и петролейного эфира (1:1) и этилацетатом. После медленного выпаривания фракций этилацетата: петролейного эфира получали 0,048 г продукта (74%). Т.пл. 170-174оС.
Физические свойства. Мол.м. 1077,12 Т.пл. 170-174оС Растворимость >10 мг/мл ВЭЖХ-чистота >99% Химическая стабильность. Условия t 1/2 (час) 0,02 М ацетата (рН 4,5, 25оС) 305 0,02 М ацетата (рН 5,5, 25оС) 20,7
П р и м е р 3. Получение 7-(N,N-диметилглицил) таксола или его соли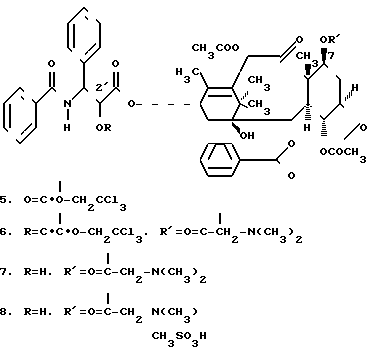
2'-(troc) таксол (соединение 5).
Таксол (0,27 г, 0,316 ммоль) растворяли в CH2Cl2 (10 мл) и пиридине (1,5 мл). Реакционную смесь охлаждали до -20-(-25о)С и добавляли 2,2,2-трихлорэтилхлороформат (80 мкл). Затем реакционную смесь перемешивали при этой температуре в течение 3 ч. После чего добавляли еще 25 мкл хлороформата и полученную смесь перемешивали в течение ночи. Затем реакционную смесь разбавляли CH2Cl2 (50 мл) и последовательно промывали 0,1 н. HCl (25 мл х 2), 0,05 М холодного NaHCO3 (25 мл х 1) и водой. Органический экстракт осушали безводным MgSO4 , а растворитель удаляли. Полученный материал осушали с помощью препаративной ТСХ на тарелках с силанизированным силикагелем, проявляли в смеси этилацетата и петролейного эфира (1:3), фракцию выше таксола отделяли, элюировали этилацетатом, а растворитель удаляли, в результате чего получали 0,32 г (97%) продукта, т.пл. 221-226 (разл., размяг. 160оС).
2'-(troc)-7-N,N-диметилглицил) таксол (соединение 6)
Смесь 2'-(troc) таксола (0,27 г, 0,262 ммоль) и N,N-диметилглицина (0,054 г, 0,524 ммоль) растворяли в CH2Cl2 (15 мл). К этому раствору добавляли 1,3-дициклогексилкарбодиимид (0,215 г, 1,04 ммоль) и 4-диметиламинопиридин (0,025 г, 0,2 ммоль), и полученную смесь перемешивали в течение двух дней при комнатной температуре. Затем смесь фильтровали, а растворитель удаляли. Полученный продукт очищали с помощью препаративной ТСХ на тарелках с силанизированным силикагелем и проявляли в смеси этилацетата и петролейного эфира (1:1). Фракцию ниже таксола (Rf 0,47, этилацетат и петролейный эфир (1:1) отделяли и элюировали этилацетатом, после чего растворитель удаляли и получали 0,26 г продукта (89%).
Т.пл. 176-180оС (разл.).
Элементный анализ: C54H60Cl3N2O17
Вычислено,%: С 58,16; Н 5,42; N 2,51.
Найдено,%: С 58,68; Н 6,00; N 3,18.
7-(N,N-Диметилглицил) таксол (соединение 7).
К раствору 2'-(troc)-7-(N,N-диметилглицил) таксола (0,335 г, 0,3 ммоль) в смеси метанола и уксусной кислоты (9:1) (12 мл) добавляли цинковую пыль (0,275 г) и полученную смесь перемешивали в течение 25 мин при комнатной температуре. Затем смесь фильтровали, фильтрат концентрировали до 1 мл и разбавляли CH2Cl2 (35 мл), а затем последовательно промывали 0,01 н. HCl (20 мл х 2), 0,01 М холодного NaHCO3 и водой. Органический экстракт осушали безводным NaSO4, растворитель удаляли и получали 0,24 г продукта. Это соединение очищали с помощью препаративной ТСХ на тарелках с силанизированным силикагелем (20 х 20, 3 Nos) и проявляли в смеси CH2Cl2 и этилацетата (7: 1). Фракцию, относящуюся к 7-(ДМС) таксолу (Rf 0,35) отделяли и элюировали этилацетатом и этанолом, затем растворитель удаляли и получали 0,19 г продукта (68%), МС (FАВ) m/е 939 (M+H)+.
В ЯМР-спектре (300 МГц, CDCl3) резонансы 7-Н при 4,33 ppm в таксоле появлялись в виде двойного дублета при 5,65 ppm N-(CH3)2-резонанс появлялся в виде синглета при 2,35 ppm. Метилановая группа глицината обнаруживалась при 3,16 ppm.
Метансульфоновая кислая соль 7-(диметилглицил) таксола (соединение 8)
7-(Диметилглицил) таксол (0,065 г, 0,069 ммоль) растворяли в т-бутаноле (2,5 мл) и воде (1 мл). Раствор охлаждали до 5-10оС и добавляли метансульфоновую кислоту (3,36 мл, 2 мг/мл, 0,0697 ммоль). Смесь перемешивали в течение 2 мин, фильтровали через миллипористый фильтр в пробирку, охлаждаемую льдом. Фильтрат осушали вымораживанием и получали 0,066 г продукта (94%). Т.пл. 164-168 (разл.)
Элементный анализ: C52H62N2O18 ˙ 2H2O
Вычислено,%: С 58,29; Н 6,19; N 2,6.
Найдено,%: С 58,05; H 6,00; N 1,72.
Физические свойства. Мол. м. 1035 Т.пл. 164-168оС Растворимость >2 мг/мл ВЭЖХ-условия. Колонка R-8, 150 мм(длиной),
4,6 мм (внут.диам.) Подвижная фаза 0,02 М ацетат (рН 5) и ацетонитрил 35:65 Детектор Kratos Spectroflow 757 Скорость потока 1,5 мл/мин Время удержания 15,07 мл (соедине-
ние 8)
Химическая стабильность Условия t 1/2 ч 0,02 М ацетата (рН 3,5, 25оС) 3397 0,02 М ацетата (рН 4,5, 25оС) 1719
0,02 М фосфата (рН 7,4, 25оС) 33,8
Стабильность плазмы, 37оС Условия t 1/2 ч Плазма крысы 20 мкг/мл 17,3 Плазма человека 20 мкг/мл 27,7 Плазма человека 10 мкг/мл 24,4
П р и м е р 4. Получение 2',7-(диметилглицил) таксола.

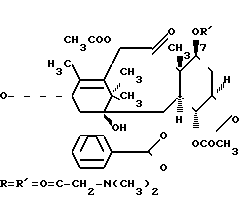
Таксол (0,06 г, 0,0702 ммоль) растворяли в безводном метиленхлориде (5 мл) и добавляли N, N-диметилглицин (0,015 г, 0,145 ммоль). К полученной смеси добавляли 1,3-дициклогексилкарбодиимид (0,08 г, 0,388 ммоль) и 4-диметиламинопиридин (0,008 г, 0,065 ммоль). Реакционную смесь перемешивали в течение 24 ч при комнатной температуре и фильтровали. Затем растворитель удаляли из фильтрата. Остаток очищали с помощью препаративной ТСХ на тарелках с силанизированным силикагелем и проявляли в смеси этилацетата и петролейного эфира (1:1). Фракцию (Rf 0,17) выше диметиламинопиридина отделяли и элюировали смесью этилацетата и этанола, а растворитель удаляли. Остаток перекристаллизовывали из смеси этилацетата и петролейного эфира, в результате чего получали 0,046 г продукта (64%). Т.пл. 194-198оС. МС: m/e 1024 (М+).
В ЯМР-спектре (300 МГц, С DСl3) С2-протон 4,71 ppm и С7-протон 4,33 ppm сдвинуты к 5,5 ppm и 5,6 ppm соответственно, что свидетельствует о этерификации в 2' - и 7-положении. Зафиксирован также -СН3-протон в виде синглета при 2,3 ppm.
Элементный анализ: C55H66ON3O16
Вычислено,%: С 63,39; Н 6,48; N 4,03.
Найдено,%: C 63,00; Н 6,98; N 3,98.
Синтез диметансульфоновой кислой соли 2 ',7-(N,N-диметилглицил) таксола
К раствору 2,7-диметилглицил таксола (60 мг, 0,0585 ммоль) в т-бутаноле (2 мл) и воде (1 мл), охлажденной до 0-5оС, добавляли метансульфоновую кислоту (11,37 мг, 3,79 мл, 0,117 ммоль). Смесь перемешивали при 0-5оС в течение 2 мин и фильтровали через миллипористый фильтр (0,2 мкМ), после чего фильтрат осушали вымораживанием и получали 62 г продукта. Т.пл. 160-163оС.
Физические свойства. Мол.м. 1217 Т.пл. 160-163оС (разл.) Растворимость >10 мг/мл ВЭЖХ-чистота ≈96% Рабочий режим ВЭЖХ Колонка RP8, 150 мм, 4,6 мм
(внут.диам.) Подвижная фаза 0,02 М смеси ацетата
рН 5 и ацетонитрила
(50:50), содержащей
0,005 М ТВА Детектор Kratos Spectroflow 757 Скорость потока 1 мл/мин Время удержания 6,64 мл
5,8 мл таксол
П р и м е р 5. Получение 7-(L-аланил) таксола или его соли.
2' ,7-ди(t-BOC-L-аланил) таксол
К раствору таксола (0,021 г, 0,246 ммоль) и t-BOC-L-аланина (0,14 г, 0,739 ммоль) в метиленхлориде (15 мл) добавляли 1,3-дициклогексилкарбодиимид (0,25 г, 1,21 ммоль) и диметиламинопиридин (0,025, 0,20 ммоль). Смесь перемешивали в течение 24 ч при комнатной температуре и фильтровали. Остаток хроматографировали на колонках с силанизированным силикагелем (20 г, 14 см) и элюировали этилацетатом и петролейным эфиром (1:1) и этилацетатом. Фракции этилацетата-петролейного эфира, содержащие распределенное производное, выливали, а растворитель удаляли, в результате чего получали 0,27 г соединения (92%). Т.пл. 158-161оС (разл.)
7-L-аланил таксол
2', 7-Ди-(t-BOC-L-аланил) таксол (0,29 г, 0,242 ммоль) и муравьиную кислоту (2 мл) смешивали при комнатной температуре в течение 40 мин и избыток муравьиной кислоты удаляли в присутствии азота. Остаток растворяли в этаноле и добавляли петролейный эфир. Твердое вещество отфильтровывали и получали 0,27 г, 2', 7-ди (аланил) таксола.
Полученное таким образом диаланиловое производное разводили в ацетонитриле (4 мл) и фосфатном буфере (0,02 М, рН 7,4, 50 мл) и смесь перемешивали при комнатной температуре в течение 12 ч. рН раствора повышали до 6,8, используя небольшое количество (мл) 5%-ного Na2HPO4. Мутный раствор перемешивали при комнатной температуре еще 8 ч. Затем реакционную смесь разбавляли метиленхлоридом (50 мл) и добавляли холодный NaHCO3 (0,05 М, 50 мл). Затем реакционную смесь экстрагировали метиленхлоридом (50 мл х 3), а полученный органический экстракт один раз промывали водой и высушивали безводным сульфатом натрия. После чего растворитель удаляли и получали 0,24 г продукта. Это соединение очищали с помощью хроматографии на колонках с силанизированным силикагелем и получали 0,135 г продукта (63%). Чистота 95%. Т.пл. 159-163оС.
Масс-спектр: (FAB) m/e 925 (М+Н). В ЯМР-спектре (300 МГц, CDCl3) 7-Н при 4,33 ppm в таксоле зафиксирован в виде двойного дублета при 5,65 ppm. СН3-группа на молекуле аланина зафиксирована в виде дублета при 1,27 ppm.
Элементный анализ: C50H58N2O16 х х 2,5H2O
Вычислено,%: С 61,91; Н 6,54; N 2,89.
Найдено,%: С 61,41; Н 6,59; N 2,78.
Метансульфоновая кислая соль 7-(аланин) таксола
К раствору 7-(аланил) таксола (62 мг, 0,0658 ммоль) в т-бутаноле (2 мл) и воде (1 мл), охлажденной до 0-5оС, добавляли метансульфоновую кислоту (6,39 мг, 2,13 мл, 3 мг/мл) и полученную смесь размешивали при этой температуре в течение 2 мин, после чего смесь фильтровали через миллипористый фильтр (0,2 мкМ). Фильтрат осушали вымораживанием и получали 66 мг продукта. Т.пл. 180-184оС.
Физические свойства. Мол.м. 1021 Т.пл. 180-184оС (разл.) Растворимость >2 мг/мл
Рабочие условия ВЭЖХ Колонка RP-8, 150 мм (длиной),
4,6 мм (внут.диам.) Подвижная фаза 0,02 М cмеси ацета-
та (рН 5)
и ацетонитрила (50:50),
содержащей 0,001 М
бисульфата тетрабутил-
аммония Детектор Kratos Spectroflow 757 Скорость потока 1 мл/мин Время удерживания 8,7 мл 7,3 мл таксол
Стабильность плазмы, 37оС Условия: t 1/2 ч Плазма человека 20 мкг/мл 11,9
П р и м е р 6. Получение 2'-(аланин) таксола
Синтез 2' (СВZ-L-аланил) таксола
К раствору таксола (30 мг, 0,0036 ммоль) и СВZ-L-аланина (8,5 мг, 0,036 ммоль) в метиленхлориде (5 мл) добавляли ДСС (45 мг) и 4-диметиламинопиридин (4 мг) и полученную смесь перемешивали в течение 3 дн при комнатной температуре. Реакционную смесь фильтровали, а растворитель удаляли из фильтрата. Остаток очищали с помощью препаративной ТСХ на тарелках с силанизированным силикагелем и проявляли в смеси этилацетата и петролейного эфира (1:1), слой выше таксола отделяли и элюировали этилацетатом, после чего растворитель удаляли и получали 28 г 2'-(СВZ-L-аланил) таксола.
Синтез 2' (аланил) таксола путем разблокирования 2' (СВZ-L-аланил) таксола
2' (СВZ-L-аланил) таксол растворяли в этаноле в присутствии органической кислоты, такой как муравьиная кислота, и перемешивали в течение 2 ч при комнатной температуре в присутствии 5%-ного палладированного угля. Реакционную смесь фильтровали с целью удаления катализатора, а затем удаляли растворитель. Сырой продукт растворяли в этаноле и добавляли петролейный эфир, в результате чего получали 2' (аланил) таксол в виде формата или ацетата с низким до умеренного выходом.
П р и м е р 7. Получение 2'-(лизил) таксола
Синтез 2' (N-ди-t-ВОС-лизил) таксола
К смеси таксола (30 мг, 0,035 ммоль) и N-ди-t-ВОС-L-лизина (19 мг, 0,0368 ммоль) в метиленхлориде (10 мл) добавляли ДСС (100 мг) и 4-диметиламинопириден (10 мг) и перемешивали в течение 2 дней при комнатной температуре. После чего смесь фильтровали, а растворитель удаляли. Остаток очищали с помощью препаративной ТСХ на тарелках с силанизированным силикагелем и проявляли в смеси ацетата и петролейного эфира (1:1), слой выше таксола отделяли и элюировали этилацетатом, затем растворитель удаляли и получили 20 мг продукта.
Синтез 2'-(лизил) таксола путем разблокирования t-ВОС-группы
Производное таксола N-t-ВОС-защищенной аминокислоты подвергали взаимодействию с муравьиной кислотой (99%, Sigma) в течение 30-40 мин при комнатной температуре, избыток муравьиной кислоты удаляли путем выпаривания в присутствии азота. Полученный продукт очищали путем кристаллизации или хроматографии, в результате чего получали производное таксола N-разблокированной аминокислоты, в виде формата (соли).
П р и м е р 8. Получение 2'-(L-аланил) таксола
Синтез 2'-(FMOC-L-аланил) таксола
К раствору таксола (60 мг, 0,072 ммоль) и N-FMOC-L-аланина (22,4 мг) в метиленхлориде (6 мл) добавляли ДCC (60 мг) и 4-диметиламинопириден (2 мг), после чего смесь перемешивали в течение двух дней при комнатной температуре и фильтровали. Растворитель удаляли из фильтрата. Полученный продукт очищали с помощью препаративной ТCХ на тарелках с силанизированным силикагелем и проявляли в смеси этилацетата и петролейного эфира (1:2). Слой выше таксола отделяли, растворитель удаляли и получали 48 мг продукта, содержащего 2' (FMOC-L-аланил) таксол. Т.пл. 162-164оС (разл.).
Разблокирование FМOC-группы защищенного аминокислотного производного таксола
N-FMOМ-защищенное аминокислотное производное таксола подвергали реакции взаимодействия с пиперидином в метиленхлориде в течение 2 ч, после чего растворитель удаляли. Остаток очищали с помощью хроматографии, в результате чего получали разблокированное аминокислотное производное таксола.
Фармацевтические композиции.
Соединения предлагаемого способа могут входить в состав фармацевтических композиций в чистом виде или в виде их фармацевтически приемлемых солей, в частности в виде нетоксичных фармацевтически приемлемых кислых аддитивных солей или приемлемых основных солей. Эти соли могут быть получены из соединений данного изобретения в соответствии со стандартной химической технологией.
Как правило, соли получают при помощи реакции свободного основания или кислоты стехиометрическими количествами или с избыточными количествами нужных солей, образующих органическую или неорганическую кислоту в соответствующем растворителе или в комбинации растворителей. Например, свободное основание можно растворить в водном растворе соответствующей кислоты и выделить соль с помощью стандартной технологии, такой как выпаривание раствора. Альтернативно, свободное основание можно растворять в органическом растворителе, таком как низший алканоил, простой эфир, алкиловый сложный эфир, или их смеси, например в метаноле, этаноле, простом эфире, этилацетате, растворе этилацетата и эфира и т.п., после чего раствор обрабатывают соответствующей кислотой с образованием соответствующей соли. Полученную соль выделяют с помощью стандартной техники, например путем фильтрации целевой соли после самовыделения из раствора, или путем преципитации посредством добавления растворителя, в котором данная соль не растворяется, и ее последующего выделения.
Производные таксола данного изобретения могут быть использованы при лечении раковых заболеваний, благодаря их цитотоксичности и противоопухолевой активности. Новые соединения могут быть введены в виде таблеток, пилюль, порошковых смесей, капсул, инъецируемых растворов, суппозиториев, эмульсий, дисперсий, добавок в пищу, и других подходящих форм. Фармацевтический препарат, содержащий предлагаемое соединение, обычно смешивают с нетоксичным фармацевтическим органическим наполнителем или нетоксичным фармацевтическим неорганическим наполнителем в количестве приблизительно 0,01 мг - 2500 мг, или выше, для разовой лекарственной формы, а предпочтительно, приблизительно 50-500 мг. Примерами фармацевтически приемлемых носителей могут служить манит, мочевина, декстран, лактоза, картофельный или кукурузный крахмалы, стеарат магния, тальк, растительные масла, полиалкиленгликоли, этилцеллюлоза, поли(винилпирролидон), карбонат кальция, этилолеат, изопропилмиристат, бензилбензоат, карбонат натрия, желатин, карбонат калия, силиконовая кислота, и другие обычно используемые приемлемые носители. Фармацевтические препараты могут также содержать нетоксичные добавки, такие как эмульгирующие, предохраняющие, смачивающие агенты и другие, например, монолаурат сорбитана, триэтаноламинолеат, полиоксиэтиленмоностеарат, глицеринтриналмитат, сульфокцинат диоцилнатрия и т.п.
Стандартный способ получения препарата в виде таблетки, содержащей активный ингредиент, заключается в том, что сначала активные агенты смешивают с нетоксичным связующим, таким как желатин, смола акации, этилцеллюлоза и т. п. Смешивание, как правило, осуществляют в стандартном V-смесителе и при условии безводной среды. Затем только что полученную смесь подвергают прессованию с помощью машины для таблетирования в таблетки. Свежеприготовленные таблетки могут быть покрыты оболочкой или оставлены непокрытыми. Характерными подходящими покрытиями являются нетоксичные покрытия, содержащие шеллак, воск карнаубы, сополимеры стирола и малеиновой кислоты и т.п. Для перорального введения спрессованные таблетки, содержащие 0,01 мг, 5 мг, 25 мг, 50 мг, 500 мг и т.д. вплоть до 2500 мг, изготавливают в соответствии с представленным описанием изобретения и при помощи стандартной техники.
Для изготовления таблеток активное соединение, кукурузный крахмал, лактозу, дикальцийфосфат, карбонат кальция обычно смешивают в условиях безводной среды и с помощью V-смесителя до тех пор, пока не получат однородную смесь. Затем приготавливают пасту из кукурузного крахмала в виде 10%-ной пасты, и только что полученную смесь смешивают с этой пастой до тех пор, пока не получат однородную смесь. Затем эту смесь пропускают через стандартное мелкое сито, высушивают в безводной атмосфере и затем смешивают со стеаратом кальция, после чего смесь спрессовывают в таблетки, и по желанию покрывают оболочкой. Аналогичным способом изготавливают таблетки, содержащие 10, 50, 100 и 150 мг активного вещества.
Ниже приводится пример изготовления препаратов, содержащих соединение настоящего изобретения в виде таблеток.
Препарат I содержит следующие ингредиенты, мг на таблетку: активное соединение 50,0; кукурузный крахмал 15,0; паста из кукурузного крахмала 4,0; карбонат кальция 15,0; лактоза 67,0; стеарат кальция 2,0; дикальцийфосфат 50,0.
Изготовление капсул, содержащих 10 мг - 2500 мг соединения настоящего изобретения для перорального введения, заключается в том, что указанное активное соединение смешивают с нетоксичным носителем и полученную смесь вводят в полимерную оболочку, обычно, желатиновую или подобную ей. Как известно, капсулы могут иметь мягкую форму, которые изготавливаются путем включения соединения в тщательно размешанные дисперсионные смеси вместе с пищевыми совместимыми носителями, или указанные капсулы могут иметь жесткую форму, которые в основном содержат соединение настоящего изобретения, смешанное с нетоксичными твердыми носителями, такими как тальк, стеарат кальция, карбонат кальция и т.п. Примером капсул, содержащих 25 мг, 75 мг, 125 мг и т. д. нового соединения в чистом виде или в виде смесей одного или нескольких новых соединений, может служить препарат II.
Препарат II содержит следующие ингредиенты, мг на капсулу: активный ингредиент 50,0; карбонат кальция 100,0; лактоза, U.S.P. 200,0; крахмал 130,0; стеарат магния 4,5.
Указанные ингредиенты смешивают в стандартном смесителе и полученной смесью наполняют коммерчески доступные капсулы. Чем выше концентрация активного компонента, тем меньшее количество лактозы должно использоваться в данном составе.
Соединения данного изобретения могут быть осушены вымораживанием, и если необходимо могут быть объединены с другими фармацевтически приемлемыми наполнителями, обычно используемыми при составлении композиций, предназначенных для парентерального введения путем инъекции. Для такого введения композиции могут быть разведены в воде (нормальной или соленой) или в смеси воды и органического растворителя, такого как пропиленгликоль, этанол и т. п.
Вводимая доза может быть в виде одноразовой или разделенной дозы и варьироваться в зависимости от конкретного соединения, используемого в каждом конкретном случае, способа введения, веса пациента и его физического состояния. Вводимая доза не является строго определенным параметром, однако, как правило, указанная доза представляет собой эффективное количество или эквивалентное (на молярной основе) количество фармакологически активной свободной формы, продуцируемой из лекарственного препарата в результате метаболического высвобождения активного лекарственного средства в целях достижения желаемого фармакологического или физиологического эффекта. Обычно, вводимая доза составляет порядка 0,8-8 мг/кг веса тела или около 50-275 мг/м2поверхности тела пациента, а предпочтительно, около 230-275 мг/м2.
Биологическая активность.
Предлагаемые производные таксола являются ценными лекарственными средствами вследствие их противоопухолевой активности, в частности указанные соединения могут быть использованы при лечении некоторых видов рака, например опухолей легких, меланомы, лейкемии, опухолей молочной железы и рака прямой кишки.
Биологическую активность указанных производных таксола испытывали посредством in vitro исследований и измерения кинетики скопления микротрубок; in vitro исследований кинетики на культуре клеток меланомы В16; in vivo исследований трансплантата МХ-1, привитого на подпочечную капсулу SRC.
Исследование кинетики скопления микротрубочек in vitro
Микротрубочки являются неотделимой частью эукариотических клеток, а комплексы микротрубочек играют важную роль в делении и размножении клеток. Известно, что полимеризация микротрубочек весьма восприимчива к кальцию, который обладает способностью к ингибированию скопления тубулина и деполимеризации уже скопившихся микротрубочек. Известные противоопухолевые соединения были исследованы на их влияние на скопления микротрубочек.
Винкаалкалоиды, такие как винбластин и винкристин, способствовали разрушению клеточных микротрубочек, т.е. in vitro они показали способность к ингибированию скопления микротрубочек и к деполимеризации микротрубочек в устойчивом состоянии.
Аналогично, колхицин также показал способность к деполимеризации микротрубочек в клетках.
С другой стороны, обнаружилось, что таксол имеет совершенно уникальный механизм воздействия, который заключается в том, что он стимулирует скопление микротрубочек, но ингибирует их разъединение, препятствуя тем самым G2 и М-фазам клеточных циклов и делению клеток. Исследования in vitro показали, что микротрубочки, уже полимеризованные, в присутствии таксола становятся устойчивыми к деполимеризации, вызываемой другими агентами, такими как CaCl2 или низкими температурами, которые обычно способствуют деполимеризации микротрубочек.
Были проведены исследование влияния производных таксола на скопление микротрубочек. Это исследование проводилось с использованием 2'- и 7-производных в соответствии с известными процедурами in vitro. Способность указанных соединений к стимулированию скопления микротрубочек можно проследить следующим образом: таксол> 7-(N,N-диметилглицил) таксол (11) > 2'-(N,N-диэтиламинопропионил) таксол (8) >2'(N,N-диметилглицил) таксол (2). Указанное исследование показало, что свободная 2'-гидроксильная группа играет главную роль в скоплении микротрубочек, 2'-производные были активными только в том случае, если 2'-гидроксильная группа оставалась свободной на протяжении всей процедуры эксперимента. 7-производные имеют свободную 2'-гидроксильную группу и, следовательно, являются активными. Полученный результат находится в соответствии с результатами активностей 2'- и 7-ацетил таксола.
In vitro-исследование культуры клеток В16.
Для подтверждения активности производных таксола настоящего изобретения были поведены исследования in vitro культуры клеток меланомы В-16. Указанные исследования проводили в соответствии со стандартными процедурами.
При исследовании пролиферации клеток меланомы В-16 были установлены эффективности в следующем порядке возрастания: таксол >2'-(N,N-диметилглицил) таксол> 2-(N,N-диэтиламинопропионил) таксол >7-(N,N-диметилглицил) таксол. Эти исследования и исследования другой кинетики показали, что активность 2'-производных обусловлена таксолом. По всей вероятности 2'-производные действуют в качестве пролекарственного средства. Однако, 7-производные обладают своей собственной активностью и, очевидно, не являются пролекарственным средством.
Исследования in vivo.
Третий тип эксперимента, проведенный для подтверждения биологической активности производных таксола, заключался в исследовании in vivo, которое осуществляли путем введения в подпочечную капсулу мыши трансплантата человеческой карциномы молочной железы МХ-1. Испытания проводили с помощью известной методики.
Процедура.
В описываемой процедуpе использовали тестируемые группы животных (6 мышей в каждой группе) и контрольные группы (12 мышей в каждой группе). Фрагмент опухоли (трансплантат человеческой карциномы молочной железы МХ-1) имплантировали в мембранную оболочку почки каждой мыши.
Исследование проводили по следующей схеме.
День 0. Животных анестезировали. Фиксировали массу тела (масса дня 1). Имплантируемую опухоль измеряли и результаты фиксировали. После выхода из наркоза животных рандомизировали. Готовили серию бактериальных культур. Определяли растворимости агентов теста. Ежедневно регистрировали смертность.
День 1. Контролировали культуры. В случае контаминации, культуры отбрасывали. Готовили материалы для теста. Начальные инъекции тестируемого агента (в загривок) определяли на основании веса тела. Обработка - Q,4D в день 1, 5 и 9. Для каждого дня готовили свежую инъекцию тестируемого агента и вводили в соответствии с весом тела мыши на этот день.
День 2. Снова проверяли культуры. В случае контаминации, тест прекращали и в соответствии с этим делали запись.
Дни 5 и 9. Для каждого дня готовили свежий тестируемый агент для инъекций, который вводили в соответствии с весом тела на этот день.
День 11. Эксперимент завершали и оценивали результаты. Массу тела регистрировали (масса дня 2). Опухоль измеряли в ОМед. (Окуляр-микрометр-единица - 10 ОМе = 1 мм) и измерения регистрировали.
Фиксировали изменение массы опухоли (дельта) на основании измерений длины и ширины (мм). Среднюю массу животных подсчитывали для дня 1 и для дня 11, а также подсчитывали T/C для всех тестируемых групп с более 65% выживания на день 11. Динамика изменения излишнего веса тела (тестируемый минус контрольный) может быть также использована при оценке токсичности. Размеры измеряли в ОМед. Компьютер использовали при следующих расчетах:
1) При переводе в ОМед в миллиметры (мм);
2) При подсчете массы опухоли (мг) на основании размеров опухоли мм х мм по формуле для объема вытянутого эллипсоида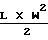 , где L представляет более 2-х измерений;
, где L представляет более 2-х измерений;
3) При расчете изменения (дельта) средней массы опухоли для каждой группы мышей. Изменение среднего веса опухоли = средняя масса опухоли конечная - средняя масса опухоли;
4) При расчете изменения начальной (дельта) средней массы опухоли для тестируемых (Т) и контрольных (С) групп;
5) При расчете Т/C (%) для всех тестируемых групп с процентом выживания более 65% на последний день эксперимента:
Т/С(% ) = T/C% =  × 100 - если Δ массы Т положительно x 100 - если Δ массы Т положительно.
× 100 - если Δ массы Т положительно x 100 - если Δ массы Т положительно.
Т/С(% ) =T/C% =  × 100 - если Δ массы Т отрицательно 100 - если Δ массы Т отрицательно.
× 100 - если Δ массы Т отрицательно 100 - если Δ массы Т отрицательно.
Критерии активности.
Значение начального Т/C ≅ 20% свидетельствует об умеренной активности. Репродуцируемое Т/C ≅ 10% свидетельствует о значительной активности.
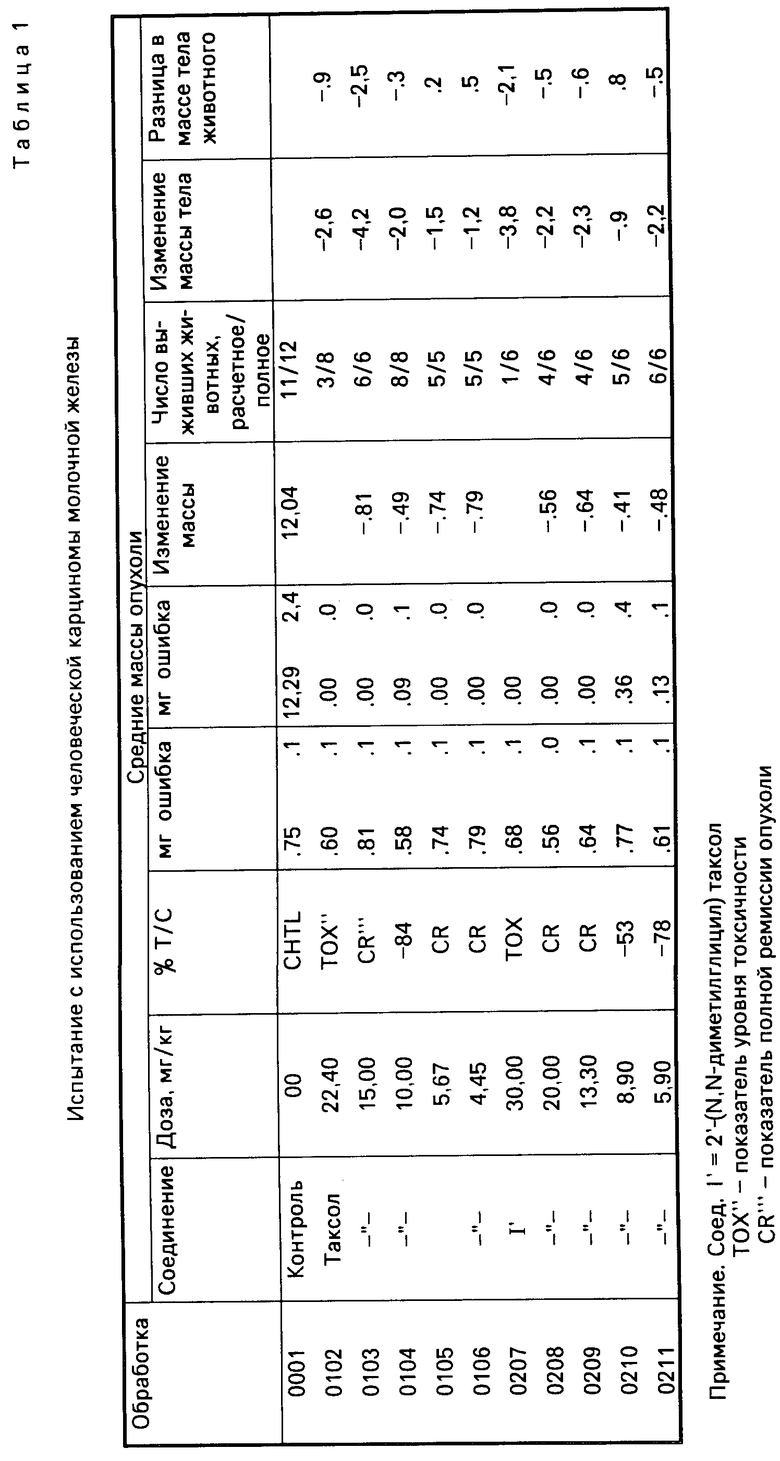
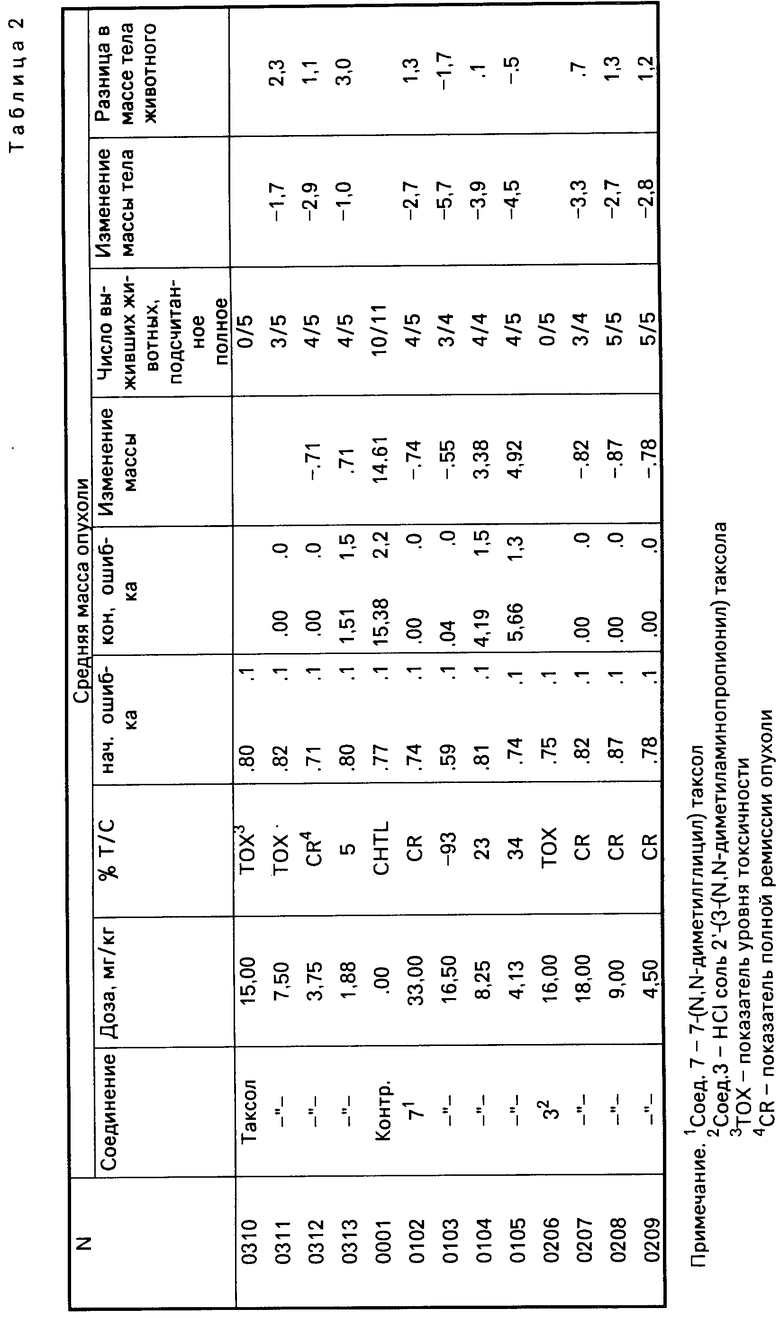
Результаты испытаний, проведенных для нескольких производных таксола, представлены в табл.1 и 2.
Из этих результатов видно, что предлагаемые производные таксола показывают прекрасную противоопухолевую активность. Поэтому указанные соединения могут быть использованы в качестве противоопухолевого средства, благодаря их хорошей биологической активности и лучшей по сравнению с таксолом водорастворимостью.
1. СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ТАКСОЛА общей формулы I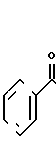


где R1 и R2 - каждый водород или группа общей формулы II
где n = 1 - 3 - целое число,
R3 и R4-C1-C3-алкил,
при условии, что по крайней мере один из R1 и R2 не является водородом,
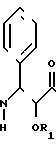
отличающийся тем, что таксол подвергают реакции взаимодействия с соединением общей формулы III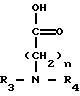
где n, R3 и R4 имеют указанные значения.
2. Способ по п.1, отличающийся тем, что таксол и соединение формулы III подвергают взаимодействию в эквивалентном соотношении 1 : 1 и получают 2-замещенное соединение общей формулы 1, где R1 - группа формулы II, а R2 - водород.
3. Способ по п. 1, отличающийся тем, что таксол подвергают взаимодействию с соединением общей формулы III и получают 2,7-ди(замещенное) соединение формулы 1, где R1 и R2 - группа формулы II.
4. Способ по п.3, отличающийся тем, что 2,7-ди(замещенное) соединение общей формулы 1 подвергают реакции расщепления с образованием 7-замещенного соединения общей формулы 1, где R1 - водород, R2 - группа формулы II.
5. Способ по п.1, отличающийся тем, что процесс проводят в присутствии конденсирующего реагента и не обязательно в присутствии катализатора.
6. Способ по п.4, отличающийся тем, что 2,7-ди(замещенное) соединение общей формулы 1 подвергают реакции расщепления при рн 7 - 7,4.
Использование: в медицине, в качестве опухолеингибирующего средства. Сущность изобретения: продукт- производные таксола ф-лы I, где R1 и R2 -Н или группа ф-лы 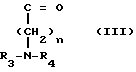 , где n 1 - 3; R1 и R4 C1-C3 -алкил, при условии, что по крайней мере один из R1и R2 не является атомом водорода. Реагент 1: таксол. Реагент 2: соединение ф-лы
, где n 1 - 3; R1 и R4 C1-C3 -алкил, при условии, что по крайней мере один из R1и R2 не является атомом водорода. Реагент 1: таксол. Реагент 2: соединение ф-лы 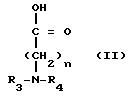 , где n, R3 и R4 указаны выше. Условия процесса: в присутствии конденсирующего реагента и необязательно в присутствии катализатора, причем при соотношении 1:1 соединение ф-лы II и таксола получают 2-замещенное соединение ф-лы I, где R1 - группа ф-лы III и R2 - Н. В случае получения 2,7-ди(замещенного) соединения ф-лы I, подвергают взаимодействию с соединением ф-лы II. При необходимости 2,7-ди (замещенное) соединение ф-лы I подвергают расщеплению при рН 7-7,4 и получают 7-замещенное соединение ф-лы I, где R1 -Н, а R2 группа ф-лы III. Соединение ф-лы I обладает высокой противоопухолевой активностью и водорастворимостью в дозе 1,88 - 7,50 мг/кг. 5 з.п. ф-лы, 2 табл.
, где n, R3 и R4 указаны выше. Условия процесса: в присутствии конденсирующего реагента и необязательно в присутствии катализатора, причем при соотношении 1:1 соединение ф-лы II и таксола получают 2-замещенное соединение ф-лы I, где R1 - группа ф-лы III и R2 - Н. В случае получения 2,7-ди(замещенного) соединения ф-лы I, подвергают взаимодействию с соединением ф-лы II. При необходимости 2,7-ди (замещенное) соединение ф-лы I подвергают расщеплению при рН 7-7,4 и получают 7-замещенное соединение ф-лы I, где R1 -Н, а R2 группа ф-лы III. Соединение ф-лы I обладает высокой противоопухолевой активностью и водорастворимостью в дозе 1,88 - 7,50 мг/кг. 5 з.п. ф-лы, 2 табл.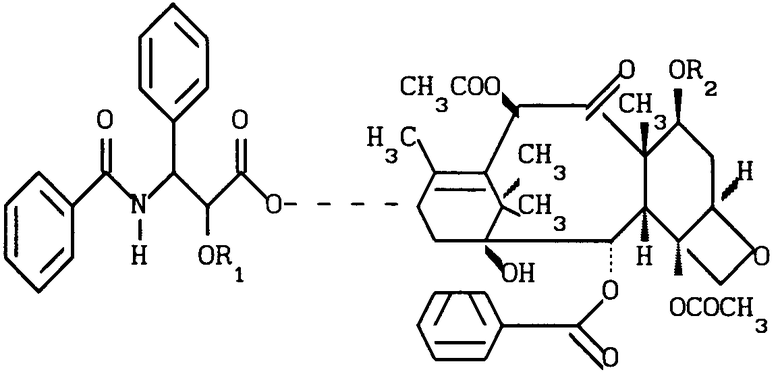


где R1 и R2 - каждый водород или группа общей формулы II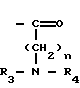
где n = 1 - 3 - целое число,
R3 и R4-C1-C3-алкил,
при условии, что по крайней мере один из R1 и R2 не является водородом,
отличающийся тем, что таксол подвергают реакции взаимодействия с соединением общей формулы III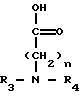
где n, R3 и R4 имеют указанные значения.
| Mellado et al "Biochemical and Biophysical Research Communication", 1984, т.124, с.324-336. |
Авторы
Даты
1994-08-15—Публикация
1990-07-12—Подача