Изобретение относится к новым производным 4-гетероароилизоксазола, к содержащим их композициям и к их использованию в качестве гербицидов.
Гербицидные 4-бензоилизоксазолы раскрыты в Европейских патентных публикациях NN 0418175 и 0487357. Этил-5-метил-4/пиридил-4-оил/ и оксазол-3-карбоксилат описан как промежуточное соединение в синтезе фармакологически активных соединений в J. Pharm. Sci. Vol. 80, p. 341-348 /1991/.
Настоящее изобретение предлагает 4-гетероароилизоксазолы формулы I
где
Ar представляет собой группу Het, которая необязательно замещена одной или более из групп R2, где Het представляет первое гетероциклическое кольцо, выбранное из кислорода, азота и серы, которое необязательно слито с бензолом или карбоциклическим или вторым гетероциклическим кольцом /которое необязательно является насыщенным или частично насыщенным/ до образования бициклической системы, где первое гетероциклическое кольцо группы Het присоединено к карбонильной группе в 4-положении изоксазольного кольца;
R представляет атом водорода или группу -CO2R3;
R1 представляет:
разветвленную или неразветвленную алкильную группу, содержащую от одного до шести атомов углерода, которые необязательно замещены одним или более атомов галоида; или
циклоалкильную группу, содержащую от трех до шести атомов углерода, необязательно замещенных одной или более из групп R4;
R2 представляет:
атом галоида, разветвленную или неразветвленную алкильную группу, содержащую от одного до шести атомов углерода, которые замещены группой OR4; или
группу, выбранную из -OH, R4, -SR5, -SOR5, -SO2R5, -O-SO2R5, -CO2R4, -COR4, -OR5, -NR6R7, -N/R8/SO2R5, нитро, циано, -O/CH2/m-OR4 и -/-CR9R10-/t-SO2R5;
или, если R2 представляет гетероциклическое или карбоциклическое кольцо группы Het, R2 может также представлять =O, =S, циклический кеталь или циклический тиокеталь;
R3 и R4, которые могут быть одинаковыми или различными, каждый представляет разветвленную или неразветвленную алкильную группу, содержащую от одного до шести атомов углерода, которые необязательно замещены одним или более из атомов галоида;
R5 представляет:
группу R4, или
фенил необязательно замещенную одной или пятью группами, выбранными из галоида, R4, -CO2R4, -COR4, OR4, нитро, циано и группу -O/CH2/m-OR4;
R6 и R7, которые могут быть одинаковы или различны, каждый представляет атом водорода или разветвленную или неразветвленную алкильную группу, содержащую от одного до шести атомов углерода, которая необязательно замещена одним или более из атомов галоида;
R8 представляет:
атом водорода;
разветвленный или неразветвленный алкил, алкенил или алкинил, содержащий вплоть до десяти атомов углерода, которые необязательно замещены одним или более из атомов галоида;
R9 и R10, которые могут быть одинаковы или различны, и каждый представляет:
атом водорода;
разветвленную или неразветвленную алкильную группу, содержащую вплоть до 6 атомов углерода, которая необязательно замещена одним или более из атомов галоида; или
фенил, необязательно замещенный одной-пятью группами R21, которые могут быть одинаковы или различны;
m представляет целое число от одного до трех;
t представляет 1, 2 или 3;
R21 представляет:
атом галоида, разветвленную или неразветвленную алкильную группу, содержащую вплоть до трех атомов углерода, которые могут быть необязательно замещены одним или более из атомов галоида; или группу, выбранную из нитро, циано, -OR4, и -S/O/pR4, где p равен 0, 1 или 2;
при условии, что если R представляет -CO2Et, а R1 представляет метильную группу, Ar не является незамещенным пиридин-4-оилом, и их сельскохозяйственной приемлемые соли, обладающие ценными гербицидными свойствами.
В некоторых случаях заместители R, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10 и R21 приводят к образованию оптических и/или стереоизомеров. Все такие формы также включены в объем изобретения.
Под термином "сельскохозяйственно приемлемая соль" подразумевают соли, катионы которых известны и приемлемы в сельском хозяйстве для получения солей для использования в сельском хозяйстве и садоводстве. Предпочтительными солями являются водорастворимые соли.
Подходящие соли присоединения кислот, образуемые соединениями формулы I, включают соли c неорганическими кислотами, например, гидрохлориды, сульфаты, фосфаты, и нитраты, и соли с такими органическими кислотами, как например, уксусной кислотой.
В группе Het предпочтительно, чтобы первое гетероциклическое кольцо содержало от 4 до 7 атомов в кольце, а карбоциклическое или второе гетероциклическое кольцо содержало от 4 до 7 атомов в кольце.
Het может быть ароматическим или неароматическим. Примеры кольцевых систем Het включают:
тиенил, фурил, пирролил и их бензо-конденсированные аналоги;
оксазинил, тиазинил, пиразинил, пиримидинил, пиридазинил и их бензо-конденсированные аналоги;
тиазолил, оксазолил, имидазолил и их бензо-конденсированные аналоги;
пиразолил, и оксазолил, и тиазолил и их бензо-конденсированные аналоги; оксадиазолил, тиадиазолил, триазолил и, в соответствующих случаях из бензо-конденсированные аналоги;
пиридинил, пиранил, тиинил и их бензо-конденсированные аналоги;
оксадиазинил, тиадиазинил, триазинил и, в соответствующих случаях их бензо-конденсированные аналоги;
тетразолил, пиперидинил, морфолинил и пиперазинил.
Предпочтительным классом соединений формулы I являются соединения, в которых R2 представляет:
атом галоида, или
разветвленную или неразветвленную алкильную группу, содержащую от одного до шести атомов углерода, которая замещена группой -OR4;
группу, выбранную из R4, -SR5, -SOR5, -SO2R5, -O-SO2R5, -CO2R4, -COR4, -OR5, -NR6R7, -NHSO2R5, нитро, циано и -O/CH2/m -OR4 .
Другим предпочтительным классом соединений формулы I являются соединения, в которых Ar выбирают из группы, состоящей из пиридинила, необязательно замещенного от одной до четырех групп R2, которые могут быть одинаковы или различны; пиримидинила, необязательно замещенного от одной до трех групп R2, которые могут быть одинаковы или различны; тиенила, необязательно замещенного от одной до трех групп R2, которые могут быть одинаковы или различны; имидазолила, необязательно замещенного одной или двумя группами R2, которые могут быть одинаковы или различны; пиразолина, необязательно замещенного от одной до трех групп R2, которые могут быть одинаковы или различны; тиазолила, необязательно замещенного одной или двумя группами R2, которые могут быть одинаковы или различны; оксазолила, необязательно замещенного от одной до четырех групп R2, которые могут быть одинаковы или различны;
где R2 имеет указанные ранее значения.
Следующим предпочтительным классом соединений формулы I являются соединения, в которых Ar является пиразолилом, необязательно замещенным одной-тремя группами R2, которые могут быть одинаковы или различны; или более предпочтительно, Ar выбирают из группы, состоящей из пиридинила, необязательно замещенного одной-четырьмя группами R2, которые могут быть одинаковы или различны, или тиенилом, необязательно замещенным одной или двумя группами R2, которые могут быть одинаковы или различны, где R2 имеет указанные ранее значения.
Особенно предпочтительными соединениями формулы I являются те, в которых Ar представляет группу пиридинила, необязательно замещенную одной-четырьмя группами R2, которые могут быть одинаковы или различны.
Соединения формулы I, в которых R1 представляет циклоалкильную группу, содержащую от трех до шести атомов углерода, необязательно замещенную одной или более из групп R4, также является предпочтительными, и наиболее предпочтителен циклопропил.
Другим предпочтительным классом соединений формулы I из-за их гербицидных свойств являются соединения, которые содержат один или более из следующих заместителей, где
R1 представляет:
разветвленную или неразветвленную алкильную группу, содержащую от одного до четырех атомов углерода;
циклопропильную группу, необязательно замещенную группой R4;
R2 представляет атом галоида или группу, выбранную из -SR5, -SOR5, -SO2R5, R4 и -OR5,
причем первое гетероциклическое кольцо группы Het замещено одной или двумя группами R2, которые могут быть одинаковы или различны.
Наиболее важные соединения включают:
1. 5-циклопропил-4-/3,5-дихлорпиридин-2-оил/изоксазол;
2. 5-циклопропил-4-/5-метилсульфенилпиридин-2-оил/изоксазол;
3. 5-циклопропил-4-/5-трифторметилпиридин-2-оил/изоксазол;
4. 5-циклопропил-4-/5-метоксипиридин-2-оил/изоксазол;
5. 5-циклопропил-4-/5-метилсульфонилпиридин-2-оил/изоксазол;
6. 5-циклопропил-4-/2-метилсульфонилпиридин-3-оил/изоксазол;
7. 5-циклопропил-4-/2-метилсульфонилпиридин-3-оил/изоксазол;
8. 5-циклопропил-4-/2-метилсульфонилпиридин-3-оил/изоксазол;
9. 5-циклопропил-4-/2-метоксиамиридин-3-оил/изоксазол;
10. 5-циклопропил-4-/3-метилтиен-2-оил/изоксазол;
11. 4-/3-бромпиридин-4-оил/-5-циклопропилизоксазол;
12. 4-/3-хлор-5-трифторметилпиридин-2-оил/-5-циклопропилизоксазол;
13. 5-циклопропил-4-/2-этоксипиридин-3-оил/изоксазол;
14. 4-/3-хлортиен-2-оил/-5-циклопропилизоксакзол;
15. 5-циклопропил-4-/5-этокси-1-метил-3-трифторметилпиразол -4-оил/изоксазол;
16. 5-циклопропил-4-/5-/4-фторфенилтио/-1-метил-3- трифторметилпиразол-4-оил/изоксазол; и
17. 5-циклопропил-4-/1-этил-3-трифторметилпиразол-4-оил/изоксазол.
Номера 1 - 17 присвоены этим соединениям для удобства дальнейших ссылок на них.
Соединения формулы I можно получить известными способами или их адаптациями /например, способами, которые были использованы ранее, или описаны в литературе/, например, описанными далее. Следует учитывать, что в описаниях последующих способов последовательности реакций могут быть изменены, могут понадобиться подходящие защитные группы для получения целевых соединений.
По способу настоящего изобретения соединения формулы I, в которых R является водородом, можно получить, осуществляя взаимодействие соединения формулы /II/: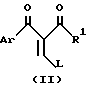
где
L является отщепляемой группой, а Ar и R1 имеют указанные ранее значения, с солью гидроксиламина. Предпочтителен гидрохлорид гидроксиламина. Обычно L является O-алкилом, например, этокси или N, N-диалкиламино, например, диметиламино. Реакцию обычно ведут в таком растворителе, как этанол или ацетонитрил, необязательно в присутствии основания, или такого кислотного акцептора, как триэтиламин или ацетат натрия.
В соответствии с другим способом настоящего изобретения соединения формулы I, в которых R представляет водород, можно получить при взаимодействии соединения формулы /III/:
где
R1 имеет указанные ранее значения, а Y представляет карбоксильную группу или ее реакционноспособное производное /например, хлорид карбоновой кислоты или сложный карбоновый эфир/, или цианогруппу, с металлорганическим реагентом формулы /IV/:
Ar-M
где
Ar имеет указанные ранее значения, а M представляет щелочной металл, металл, связанный с одним или более из лигандов, или группу Гриньяра. Предпочтительный M представляет литий или магний-содержащую группу Гриньяра. Реакцию обычно ведут в таком инертном растворителе, как диэтиловый эфир или тетрагидрофуран при температуре от -78oC до температуры кипения смеси с обратным холодильником.
В соответствии со следующим способом настоящего изобретения соединения формулы I, в которых R представляет группу -CO2R3, можно получить при взаимодействии соединения формулы /V/:
где
Ar и R1 имеют указанные ранее значения, а R является отщепляемой группой, с соединением формулы R3O2CC /X/ = NOH; где R3 имеет указанные ранее значения; а X является атомом галоида. Обычно Z является атомом хрома или брома, а R представляет N, N-диалкиламино. Реакцию обычно ведут в таком инертном растворителе, как толуол или дихлорметан, либо в присутствии такого основания, как триэтиламин, или такого катализатора, как молекулярные сита  или ионы фторида.
или ионы фторида.
В соответствии со следующим способом настоящего изобретения соединения формулы I, в которых R представляют группу -CO2R3, можно получить при взаимодействии соединения формулы /VI/:
где
Ar и R1 имеют указанные ранее значения, с соединением формулы R3O2CC /X/ = NOH, где R3 и X имеют указанные ранее значения. Реакцию обычно ведут в таком инертном растворителе, как толуол или дихлорметан, необязательно в присутствии такого основания как триэтиламин, или такого катализатора, как молекулярные сита  или ион фторида. Реакцию можно вести при температуре от комнатной до температуры кипения смеси с обратным холодильником.
или ион фторида. Реакцию можно вести при температуре от комнатной до температуры кипения смеси с обратным холодильником.
В соответствии со следующим способом настоящего изобретения соединения формулы I, в которых R представляет -CO2R3 можно получить при взаимодействии соли соединения формулы /VII/.
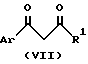
где
Ar и R1 имеют указанные ранее значения, с соединением формулы R3O2CC /X/ = NOH, где R3 и X имеют указанные ранее значения. Предпочтительные соли включают соли натрия и магния. Реакцию можно вести в таком инертном растворителе, как дихлорметан или ацетонитрил, при температуре от комнатной до температуры кипения с обратным холодильником для этой смеси.
В соответствии со следующим аспектом настоящего изобретения соединения формулы I, в которых R представляет водород, в Ar является необязательно замещенным пиридилом, можно получить при взаимодействии соединения формулы /VIII/:
где
R1 имеет указанные ранее значения, с соединением формулы Ar-H, где Ar имеет указанные ранее значения, исключая необязательно замещенный пиридил. Реакцию обычно ведут в присутствии кислоты Льюиса в качестве катализатора, например, трихлорида алюминия, в инертном растворителе при температуре от 0oC до температуры кипения смеси с обратным холодильником.
Промежуточные соединения при получении соединений формулы I можно получить, используя известные способы и их адаптации, например, такие, которые описаны ранее.
Соединения формулы /II/, в которых L представляет O-алкил или N,N-диалкиламино, можно получить при взаимодействии соответствующего соединения формулы /VII/ либо с триалкилортоформатом, например, триэтилортоформатом, или диметилформамидодиалкилацеталем, например, N,N-диметилформамиддиметилацеталем. Реакции с триэтилортоформатом обычно ведут в присутствии уксусного ангидрида при температуре кипения с обратным холодильником этой смеси, а реакцию с N, N-диметилформамиддиалкилацеталем ведут необязательно в присутствии инертного растворителя при температуре от комнатной температуры кипения с обратным холодильником этой смеси.
Соединения формулы /V/ можно получить при взаимодействии соединения формулы /IX/ с хлорангидридом формулы /X/:
где
Ar, R1 и R имеют указанные ранее значения. Реакцию обычно ведут в присутствии органического основания, например, триэтиламина в таком инертном растворителе, как толуол или дихлорметан при температуре от -20oC до комнатной температуры.
Соединения формулы (VI) можно получить металлированием соответствующего ацетилена формулы /XI/:
RI-C≡CH
где
R1 имеет указанные ранее значения, с последующим взаимодействием полученной при этом соли металла с хлорангидридом формулы (X). Металлирование обычно ведут, используя н-бутиллитий в таком инертном растворителе, как эфир или тетрагидрофуран, при температуре от -78oC до 0oC. Последующую реакцию с хлорангидридом ведут в таком же растворителе при температуре от -78oC до комнатной температуры.
Соединения формулы /VII/ можно получить при взаимодействии сложного эфира формулы /XII/:
ArCO2Z
где
Ar имеет указанные ранее значения, а Z представляет алкильную группу, с кетоном формулы R1C/O/CH3, где R1 имеет указанные ранее значения в присутствии основания. Обычно в качестве основания используют гидрид натрия, а реакцию ведут в инертном растворителе при температуре от 0oC до кипения с обратным холодильником. Соединения формулы /VII/можно получить при взаимодействии соединения формулы /XIII/:
ArCOCH3
где
Ar имеет указанные ранее значения, со сложным эфиром формулы R1CO2Z, где R1 и Z имеют указанные ранее значения, в присутствии основания. Предпочтительно, Z представляет метильную, этильную или трет.- бутильную группу. Обычно в качестве основания используют гидрид натрия, и реакцию ведут в инертном растворителе при температуре от 0oC до кипения с обратным холодильником.
Соединения формулы /VII/ можно также получить при взаимодействии хлорангидрида формулы /Х/ с солью металла соединения формулы /XIV/: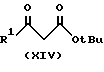
где
R1 имеет указанные ранее значения до получения соединения формулы /XV/: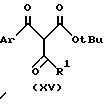
где
Ar имеет указанные ранее значения, которые декарбоксилируют до получения соединения формулы /VII/. Обычно реакцию для получения соединения формулы /XIV/ ведут в таком растворителе, как низший спирт, предпочтительно, метанол, в присутствии металла, предпочтительно магния. Декарбоксилирование ведут обычно при кипячении с обратным холодильником соединения формулы /XV/ в присутствии такого катализатора как пара-толуолсульфокислота, в таком инертном растворителе, как толуол.
Промежуточные соединения формулы /III/, /IV/, /VIII/, /IX/, /X/, /XI/, /XII/, /XIII/ и /XIV/ известны, или могут быть получены с использованием известных способов или их адаптации.
Синтез соединений формул /XII/ и /XIII/, в которых Ar представляет необязательно замещенную группу пиридина, описан, например, в Химии Гетероциклических Соединений, т. 14, часть I, Глава II. Синтез соединений формулы /XII/ и /XIII/, в которых Ar представляет необязательно замещенную группу тиофена, описан, например, в Химии Гетероциклических Соединений том 44, часть II и III, глава IV. Синтез соединений формулы /XII/ и /XIII/, в которых Ar представляет необязательно замещенную группу тиазола, описан, например, в Химии Гетероциклических Соединений т.34, часть I, глава IV. Синтез соединений формул /XII/ и /XIII/, в которых Ar представляет необязательно замещенную группу пиримидина, описан, например, в Химии Гетероциклических Соединений, том 16 и Nakamoto and Yamanaka, Heterocycles, 1981, т.15, стр.58. Синтез соединений формулы /XII/ и /XIII/, в которых Ar представляет необязательно замещенную группу оксазола, описанную, например, в Химии Гетероциклических Соединений, т. 45, глава 1. Синтез соединений формулы /XII/ и /XIII/, в которых Ar представляет необязательно замещенную имидазольную группу, описан, например, Oliver and Sonnet, J.Organic Chem., 1973, том 38, 1437 и M.K.Grimmet, Advances in Heterocyclic Chem. Vol.27, p.241 и Vol.12, p.103 /те же авторы/. Синтез соединений формулы /XII/ и /XIII/, в которых Ar представляет необязательно замещенную группу пиразола, описан, например, Kost and Granbberg, Advaces in Heterocyclic Chemistry, 1966, Vol.6.p.347, и в "The Chemistry of Heterocyclic Compounds - "Pyrazoles, Pyrazolines, Pyrazolidines, Indazoles and Coudeu sed Rings" edited by A.Weissberser.
Специалистам следует учитывать, что некоторые соединения формулы I можно получить в результате взаимопревращений других соединений формулы I, и такие взаимопревращения также составляют особенность настоящего изобретения. Примеры таких взаимопревращений описаны далее.
В соответствии с дальнейшим способом настоящего изобретения соединения, в которых R2 представляет - SOR5 или - SO2R5 можно получить в результате окисления атома серы соответствующего соединения, в которых R2 представляет - SR5 или -SOR5. Окисление атома серы обычно ведут, используя, например, 3-хлорпероксибензойную кислоту в таком инертном растворителе, как дихлорметан, при температуре от -40oC до комнатной температуры.
Следующие примеры иллюстрируют получение соединений формулы I, и следующие ссылочные примеры иллюстрируют получение промежуточных соединений настоящего изобретения. В настоящем изобретении /в описании/ о.р. означает температуру кипения; м.р. - температуру плавления. Под названием ЯМР приводятся характеристики спектров протонного ядерного магнитного резонанса.
Пример 1. Смесь гидрохлорида гидроксиламина /0,4 г/ и 3-циклопропил-1-/3,5-дихлорпиридин-2-ил/-2-/диметиламино/метиленпропан -1,3-диона/1,68 г/ в этаноле перемешивают при комнатной температуре в течение ночи. Растворитель удаляют выпариванием, а остаток растворяют в дихлорметане. Полученный раствор промывают водой, сушат /над безводным сульфатом магния/, фильтруют и выпаривают. Остаток очищают хроматографически на силикагеле, элюируя смесью этилацетата и гексана до получения 5-циклопропил-4-/3,5-дихлорпиридин-2-оил/ и оксазола /соединение 1, 0,38 г/ в виде твердого белого вещества; т.пл. 81,9-83,1oC.
Аналогичным способом получают следующие соединения формулы I, которые получают из соответствующих замещенных исходных материалов:
Соединение 3: 5-циклопропил-4-/5-трифторметилпиридин- 2-оил/изоксазол, т.плавления 74-75;
Соединение 6: 5-циклопропил-4-/2-метилсульфенилпиридин- 3-оил/изоксазол, т.пл.95,4-96,2;
Соединение 9: 5-циклопропил-4-/2-метоксипиридин-3-оил/-изоксазол, т.пл. 112,5-114;
Соединение 11: 4-/3-бромпиридин-4-оил/-5-циклопропил-изоксазол, т.пл. 92-100;
Соединение 12: 4-/3-хлор-5-трифторметилпиридин-2-оил/- 5-циклопропилизоксазол, т.пл. 84-86;
Соединение 13: 5-циклопропил-4-/2-этоксипиридин-3-ил/-изоксазол, ЯМР /CDCl3/ δ , 1,2-1,4 /м, 7H/, 2,8/с.1H/, 4,4 /кв.,2H/, 7,0 /м, 1H/, 7,8-7,9 /дд, 1H/, 8,25 /с, 1H/, 8,3/д, 1H/;
Соединение 14: 4-/3-хлортиен-2-оил/5-циклопропилизоксазол, т.плавления 72-74;
Соединение 15: 5-циклопропил-4-/5-этокси-1-метил-3- трифторметилпиразол-4-оил/изоксазол, т. пл. 121 - 12, исходя из 1-/5-хлор-1-метил-3-трифторметилпиразол-4-ил/3-циклопропил-2- этоксиметиленпропан-1,3-диона и вводя 5-этоксипиразолильную группу in situ;
Соединение 16: 5-циклопропил-4-/5-фторфенилтио/-1-метил-3- трифторметилпиразол-4-оил/изоксазол, т.пл. 118 - 120;
Соединение 17: 5-циклопропил-4-/1-этил-3-трифторметилпиразол-4 -оил/изоксазол, т.пл. 98 - 100;
Соединение 14 - 17 получают, используя в качестве основания безводный ацетат натрия.
Тем же способом, но используя безводный ацетат натрия /эквимолярное количество с используемым гидрохлоридом гидроксиламина в качестве основания, получают следующие соединения из соответствующих замещенных исходных материалов:
Соединение 2: 5-циклопропил-4-/5-метилсульфенилпиридин-2- -оил/изоксазол, т.пл. 85 - 86oC;
Соединение 4: 5-циклопропил-4-/5-метоксипиридин-2-оил/изоксазол, т.пл. 82 - 84oC;
Соединение 10: 5-циклопропил-4-/3-метилтиен-2-оил/изоксазол, ЯМР /CDCl3/ δ , 1,1 - 1,32 /м, 4H/, 2,53 /c, 3H/, 2,65 - 2,8 /м, 1H/, 6,97 /д, 1H/, 7,45 /д, 1H/, 8,5 /с, 1H/.
Пример 2. 3-Хлорпероксибензойную кислоту, оксидант /2,85 г/ добавляют к перемешиваемому раствору 5-циклопропил-4-/2-метилсульфенилпиридин-3-оил/изоксазола /2,36 г/ в дихлорметане при -20oC. Спустя 5 мин добавляют дополнительное количество оксиданта /0,14 г/. Реакционную смесь перемешивают при -20oC до тех пор, пока по данным тонкослойной хроматографии реакция не завершается. Полученную смесь фильтруют, и полученный фильтрат промывают последовательно водным раствором бикарбоната натрия и водным раствором метабисульфата натрия, сушат /над безводным сульфатом магния/, фильтруют и выпаривают. Неочищенный продукт суспендируют при кипячении с обратным холодильником с ацетонитрилом. Суспензию охлаждают до комнатной температуры и фильтруют. Полученный продукт сушат до получения 5-цилкопропил-4-/2-метилсульфинилпиридин-3-оил/-изоксазола /соединение 7: 2,0 г/ в виде бесцветных кристаллов, т. плавления 148 - 152,4oC.
Аналогичным образом, и увеличивая количество эквивалентов оксиданта при необходимости, получают следующие соединения из соответствующих замещенных исходных материалов:
Соединение 5: 5-циклопропил-4-/5-метилсульфонилпиридин- 2-оил/изоксазол, т. плавления 142 - 144oC, и
соединение 8: 5-циклопропил-4-/2-метилсульфонилпиридин- 3-оил/изоксазол, т. плавления 111,2 - 112oC.
Сравнительный 1. Смесь 3-циклопропил-1-/3,5-дихлорпиридин- 2-ил/пропан-1,3-диона /1,3 г/ и N,N-диметилформамиддиметилацателя /1,1 мл/ в 1,4-диоксане перемешивают при комнатной температуре в течение 4 дней, и растворитель выпаривают до получения 3-циклопропил-1-/3,5-дихлорпиридин-2-ил/-2-диметиламинометиленпропан- 1,3-диона /1,73 г/.
Аналогичным способом получают соединения формулы II из соответствующим образом замещенных материалов, приведенных в табл. 1.
Сравнительный пример 2. Смесь 1-циклопропил-3-/3-метилтиен- 2-ил/пропан-1,3-диона /7,5 г/ и триэтилортоформата /13,2 г/ в уксусном ангидриде перемешивают при температуре кипения с обратным холодильником в течение 7 ч, и растворитель выпаривают. Остаток растворителя удаляют азеотропной перегонкой с толуолом до получения 1-циклопропил-3-/3-метилтиен-2-ил/-пропан-1,3-диона /11,32 г/ в виде масла оранжевого цвета, которое не подвергается дальнейшей очистке.
Аналогичным способом получают следующие соединения из соответствующим образом замещенных исходных материалов:
1-/3-хлортиен-2-ил/-3-циклопропил-2-этоксиметиленпропан-1,3- дион;
1-/5-хлор-1-метил-3-трифторметилпиразол-4-ил/-3-циклопропил-2- этоксиметиленпропан-1,3-дион; и
1-циклопропил-2-этоксиметилен-3-/5-/4-фторфенилтио/-1-метил-3- трифторметилпиразол-4-ил/пропан-1,3-дион.
Сравнительный пример 3. Метилциклопропилкетон /1,65 г/ добавляют к перемешиваемой суспензии гидрида натрия /80% дисперсия в масле; 0,6 г/ в сухом диэтиловом эфире при 0oC в инертной атмосфере. Полученную смесь перемешивают при 0oC в течение одного часа. Добавляют 3,5-дихлорпиридин-е-2-карбоксилат /2,16 г/ добавляют, и полученную смесь перемешивают при 0oC в течение 1 ч, а затем при комнатной температуре в течение ночи. Добавляют соляную кислоту /2 н/, и полученную смесь экстрагируют диэтиловым эфиром. Органические экстракты промывают водой, сушат /над безводным сульфатом магния/, фильтруют и выпаривают до получения коричневой смолы, которую очищают на хроматографической колонке на силикагеле, элюируя смесью этилацетата и гексана до получения 3-циклопропил-1-/3,5-дихлорпиридин-2-ил/пропан-1,3-диона /1,35 г/ в виде бесцветного твердого продукта, т. плавления 50,2 - 52,7oC.
Аналогичным способом из соответствующих замещенных исходных материалов получают соединения формулы /VII/, приведенные в табл. 2.
/1/ ЯМР /CDCl3SOCD3/ δ 1,3 /д, 2H/, 1,4 /д, 2H/, 1,7 /т, 3H/, 2,75 /с, 1H/, 4,75 /кв, 2H/, 6,95 /м, 1H/, 7,2 - 7,3 /кв, 1H/, 8,25 /м, 1H/, 8,4 /м, 1H/. Исходным материалом для этой реакции служил этил-2-хлорпиридин-3-карбоксилат, а во время реакции группа хлора была замещена на этоксигруппу.
/2/ ЯМР /CDCl3/ δ 0,9 /м, 2H/, 1,05 /м, 2H/, 1,65 /м, 2H/, 3,8 /с, 3H/, 5,9 /с, 1H/, 15,7 /шир.с, 1H/. Этот продукт получают, используя в качестве растворителя сухой тетрагидрофуран, а полученный продукт используют непосредственно на следующей стадии.
Сравнительный анализ 4. Смесь трет.-бутил-2-циклопропанкарбонил-3-/2-метилсульфенилпиридин-3-ил/- 3-оксопропаноата /9,44 г/ и 4-толуолсульфоновой кислоты /0,4 г/ в сухом толуоле перемешивают при кипении с обратным холодильником в течение 5 ч, а затем оставляют выстаиваться на ночь при комнатной температуре. Полученную смесь перемешивают при кипении с обратным холодильником в течение еще 5 ч, охлаждают до комнатной температуры, и помещают в этилацетат и воду. Фазы разделяются, и водную фазу экстрагируют далее этилацетатом. Объединенные органические экстракты сушат /над безводным сульфатом магния/, фильтруют и выпаривают до получения 1-циклопропил-3-/2-метилсульфенилпиридин-3-ил/пропан-1,3-диона /7,64 г/ в виде масла коричневого цвета, которое используют без дальнейшей очистки.
Аналогичным способом получают следующие соединения из соответствующих исходных материалов:
1-циклопропил-3-/5-/4-фторфенилтио/-1-метил-3- трифторметилпиразол-4-ил/пропан-1,3-дион, т. пл. 87 - 89oC;
1-циклопропил-3-/1-этил-3-трифторметилпиразол-4-ил/пропан- 1,3-дион, ЯМР /CDCl3/ δ 0,9 /м, 2H/, 1,1 /м, 2H/, 1,45 /т, 3H/, 1,65 /м, 1H/, 4,15 /кв., 2H/, 6,0 /с, 1H/, 7,9 /с, 1H/, 16,0 /шир.с, 1H/;
1-/3-хлор-5-трифторметилпиридин-2-ил/-3-циклопропилпропан-1,3- дион, т. пл. 48 - 51oC; и
1-/3-бромпиридин-4-ил/-3-циклопропилпропан-1,3-диод, т. плавления 54 - 55oC.
Сравнительный пример 5. Суспензию магния /0,79 г/ и иода /1 кристалл/ в метаноле нагревают при кипячении с обратным холодильником в течение приблизительно 1 ч. Трет.-бутил-3-циклопропил-3-оксопропаноата /5,53 г/ добавляют к кипящей с обратным холодильником суспензии, которую поддерживают при этом кипении в течение еще 50 мин. После охлаждения до комнатной температуры растворитель выпаривают, а оставшиеся следы метанола азеотропно удаляют с толуолом. После выпаривания остаток снова растворяют в толуоле, и добавляют 2-метилсульфенил-3-пиридинилхлорид /5,63 г/ в виде суспензии в толуоле. Полученную суспензию перемешивают при комнатной температуре в течение ночи. Добавляют 2 н. соляную кислоту и полученную смесь перемешивают в течение 45 мин. Органическую фазу выделяют, промывают водой и рассолом, сушат /над безводным сульфатом натрия/, фильтруют и выпаривают до получения трет.-бутил-3-циклопропил-2-/2-метилсульфенил-3-пиридинилкарбонил/- 3-оксопропаноата /9,5 г/ в виде масла желтого цвета, которое используют без дальнейшей очистки.
Аналогичным образом получают следующие соединения:
трет. -бутил-3-циклопропил-2-/5-/4-фторфенил/-1-метил-3- трифторметил-4-пиразолкарбонил/-3-оксопропаноат;
трет. -бутил-3-циклопропил-2-/1-этил-3-трифторметил-4- пиразолилкарбонил/-3-оксопропаноат;
трет. -бутил-3-циклопропил-2-/3-хлор-5-трифторметил-2- пиридинилкарбонил/-3-оксопропаноат, и
трет. -бутил-2-/3-бром-4-пиридинилкарбонил/-3-циклопропил-3- оксопропаноат.
Сравнительный пример 6. Газообразный метантиол /7,9 г/ продувают через перемешиваемую суспензию гидрида натрия /60% дисперсия в масле, 6,0 г/ в сухом диметилформамиде, причем наблюдается приблизительно 20oC экзотерма. К полученной суспензии добавляют 23,8 г раствора метил-5-нитро-2-пиридинкарбоксилата, и полученную суспензию перемешивают при 100oC в течение пяти часов, а затем оставляют выстаиваться при комнатной температуре в течение ночи. Растворитель выпаривают. Осторожно добавляют воду к полученному остатку, и полученный раствор нейтрализуют, добавляя соляную кислоту /2 н./ и экстрагируют этилацетатом. Объединенные экстракты промывают водой, сушат /над безводным сульфатом натрия/, фильтруют и выпаривают. Остаток очищают на хроматографической колонке с силикагелем, элюируя смесью этилацетата и гексана до получения двух неочищенных продуктов. Первый продукт тщательно растирают в смеси циклогексана и диэтилового эфира до получения метил-5-метилсульфенил-2-пиридинкарбоксилата /5,78 г/ в виде твердого вещества кремового цвета. Т. пл. 71 - 73oC. Второй продукт представляет собой 5-метокси-2-пиридинкарбоксилат /2,67 г/, полученный в виде твердого продукта кремового цвета. Т.пл. 73 - 74oC.
Сравнительный пример 7. Смесь 6-нитропиридин-2-карбоновой кислоты /33,91 г/ и концентрированной серной кислоты /5 мл/ в безводном метаноле нагревают при кипячении с обратным холодильником в течение 20 ч. Растворитель выпаривают, а остаток помещают в дихлорметан и воду. Органический слой сушат /безводный сульфат натрия/, фильтруют и растворитель выпаривают до получения метил-5-нитропиридин-2-карбоксилата /23,82 г/ в виде твердого продукта оранжевого цвета. Т. плавления 156 - 159oC.
Аналогичным способом получают следующие соединения из соответствующим образом замещенных материалов:
Соединение.
Метил-5-трифторметилпиридин-2-карбоксилат, т. пл. - 85 - 88oC
Метил-2-метоксипиридин-3-карбоксилат - Желтое масло
Этил-3-метилтиофен-2-карбоксилат - Желтое масло
Этил-5-хлор-1-метил-3-трифторметил-пиразол-4-карбоксилат - Желтое масло /1/
Примечание /1/: ЯМР /CDCl3/ 1,3 /т, 3H/, 3,85 /с, 3H/, 4,25 /кв., 2H/ из 5-хлор-1-метил-3-трифторметилпиразол-4-карбоновой кислоты /L. F. Lee, F.M. Schleppnik, R. W. Salineider and D. H. Campbell b J. Het, Chem. 27, 243 /1990//. Концентрированную соляную кислоту заменяют серной кислотой в этом получении.
Сравнительный пример 8. Диэтил-2-/5-нитропиридин-2-ил/малонат /67,47 г/ перемешивают в воде, и добавляют водный раствор гидроксида натрия /2 н/, а затем перманганат калия /42 г/, что приводит к повышению температуры реакции до 60oC. Затем добавляют дополнительные порции водного раствора гидроксида натрия и перпанганата калия, поддерживая температуру реакции 60 - 70oC. После окончательного добавления суспензию перемешивают при 60oC в течение 1,5 ч. Затем горячую суспензию фильтруют через "Hyflo Supercel". Фильтровальную лепешку промывают водным раствором гидроксида натрия /2 н./. При охлаждении до комнатной температуры, фильтрат осторожно подкисляют до pH 1 - 2 концентрированной соляной кислотой. Полученный осадок собирают фильтрованием и сушат до получения 5-нитропиридин-2-карбоновой кислоты /26,17 г/ желтовато-коричневого твердого продукта. Т. пл. 210 - 211oC.
Аналогичным способом получены следующие соединения:
5-трифторметилпиридин-2-карбоновая кислота /соль гидрохлорид/, т.пл. более 300oC, и
3-хлор-5-трифторметилпиридин-2-карбоновая кислота /гидрохлоридная соль/, т. пл. более 139oC.
Сравнительный пример 9. К перемешиваемой суспензии гидрида натрия /60% дисперсии в масле, 18 г/ в сухом тетрагидрофуране в инертной атмосфере добавляют диэтилмалонат /75 г/. Полученную суспензию перемешивают при температуре кипения с обратным холодильником в течение одного часа. Полученную смесь охлаждают до 60oC, и добавляют раствор 2-хлор-5-нитропиридина /50 г/ в сухом тетрагидрофуране. Полученный раствор красного цвета перемешивают при температуре кипения с обратным холодильником в течение 3 ч, затем оставляют выстаиваться при комнатной температуре в течение ночи. Объем растворителя снижают испарением, добавляют воду к остатку, и полученную смесь подкисляют до pH 1 концентрированной соляной кислотой. Полученную смесь экстрагируют этилацетатом, промывают водой, сушат /над безводным сульфатом магния/, фильтруют и выпаривают. Неочищенный продукт тщательно растирают в смеси циклогексана и диэтилового эфира до получения диэтил-2-/5-нитропиридин-2-ил/малоната /56,5 г/ в виде твердого продукта желтого цвета. Т. плавления 91,5 - 93,5oC.
Аналогичным способом получают следующие соединения:
диэтил-2-/5-трифторметил-пиридин-2-ил/малонат, получаемый в виде масла желтого цвета;
диэтил-2-/3-хлор-5-трифторметилпиридин-2-ил/малонат. Т. кипения 120 - 122oC /0,6 - 0,8 мбар/.
Сравнительный пример 10. Этил-1-этил-3-трифторметилпиразол-4- карбоксилат /2,17 г/ растворяют в этаноле, и добавляют этанол и гидроксид калия /1,06 г/ в воде. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Этанол удаляют при пониженном давлении, а полученный остаток разделяют между водой и эфиром. Выделяют водный слой, подкисляют соляной кислотой /2М/, и экстрагируют эфиром. Объединенные органические экстракты сушат над безводным сульфатом магния и выпаривают в вакууме до получения 1-этил-3-трифторметилпиразол-4-карбоновой кислоты в виде белого твердого продукта /1,86 г/. ЯМР /CDCl3/ δ 1,45 /т, 3H/, 4,20 /кв., 2H/, 7,95 /c, 1H/.
Сравнительный пример 11. Этил-3-трифторметилпиразол-4-карбоксилат /5 г/, карбонат калия /3,48 г/ и этилиодид /2,3 мл/ в ацетонитриле нагревают при температуре кипения с обратным холодильником в течение ночи. После охлаждения добавляют этилацетат и воду, и органические фазы разделяют. Водный слой экстрагируют этилацетатом и объединенные органические экстракты сушат /над сульфатом магния/, и выпаривают при пониженном давлении до получения масла желтого цвета, которое очищают за счет кристаллизации в гексане до получения 4-этоксикарбонил-1-этил-3-трифторметилпиразола в виде кристаллов белого цвета /3,65 г/. 1H ЯМР /CDCl3/ δ 1,25 /3H, т/, 1,45 /3H, т/, 4,10 /2H, кв/, 4,20 /2H, кв/, 7,90 /1H, с/, мд.
Сравнительный пример 12. Смесь 5-хлор-1-метил-3-трифторметилпиразол-4-карбоновой кислоты /2,0 г/, 4-фтортиофенола /1,66 г/ и безводного карбоната калия /3,26 г/ нагревают при кипячении с обратным холодильником в ацетонитриле при перемешивании в течение 4 ч. После фильтрования полученный фильтрат выпаривают, подкисляют разбавленной соляной кислотой, и экстрагируют этилацетатом. Объединенный экстракт сушат /над безводным сульфатом магния/, фильтруют и выпаривают в вакууме. После перекристаллизации из смеси эфир/гексан получают 5-/4-фторфенилтио/-1-метил-3- трифторметилпиразол-4-карбоновую кислоту /0,98 г/ в виде твердого белого продукта при т. плавления 190 - 193,7oC.
Сравнительный пример 13. 3-Бромпиридин-4-карбоновую кислоту /5,0 г/ растворяют в 50 мл тионилхлорида, и полученный раствор нагревают при температуре кипения с обратным холодильником в течение 4 ч. Охлаждают и выпаривают в вакууме. Повторное испарение добавленного толуола дает 3-бромпиридин-4-карбонилхлорид, т. плавления 151-154oC, /с разложением/ /5,45 г/ в виде зеленого твердого продукта.
Аналогично получают следующие соединения:
3-хлор-5-трифторметилпиридин-2-карбонилхлорид в виде желтого полутвердого вещества желтого цвета;
5-/4-фторфенилтио/-1-метил-3-трифторметилпиразол-4- карбонилхлорид в виде полутвердого вещества коричневого цвета, и
1-этил-3-трифторметилпиразол-4-карбонилхлорид в виде масла.
Последние два упомянутых соединения получают, заменяя тионилхлорид раствором оксалилхлорида /1,2 эквивалента/ в 1,2-дихлорметане, содержащем несколько капель N,N-диметилформамида.
По способу настоящего изобретения представлен способ борьбы с сорняком /то есть, с нежелательными растениями/ на участке, который включает нанесение на этот участок гербицидно эффективного количества, по крайней мере, одного производного 4-гетероароилизоксазола формулы I или его сельскохозяйственно приемлемой соли. Для этой цели обычно используют производное 4-гетероароилизоксазола в форме гербицидных композиций /например, вместе с совместимыми разбавителями или носителями и/или поверхностно-активными агентами, пригодными для использования в гербицидных композициях/, например, таких, которые описаны далее.
Соединения формулы I демонстрируют гербицидную активность против двудольных /то есть, широколиственных/ и однодольных /то есть, трав/ сорняков при нанесении как до, так и после прорастания.
Под термином "нанесение для прорастания" подразумевают нанесение на почву, в которой имеются семена сорняков или их сеянцы, до прорастания сорняков над поверхностью почвы. Под термином "нанесение после прорастания" подразумевают нанесение в ореал или эпоксидирование части сорняков, которые уже выросли над поверхностью почвы. Так, например, соединения формулы I могут быть использованы для регулирования роста: широколиственных сорняков, например, Abutilon theophrasti, Amaranthus retroflexus, Bidens pilosa, Chenopodium album, Calium aparine, Ipomola Spp. e.g.Ipomola purpurea, Sesbania exaltata, Sinapis arvensis, Solanum nigrum и Xanthium Strumarium, и травянистых сорняков, например, Alopecurus myosuroides, Avena fatua, Digitaria sanguinalis, Echinochloa crus-galli, Eleusine indica и Setaria spp, e.g. Setaria faberii or Setariav viridis, и камышей, например, Cyperus esculentus.
Количества вносимых соединений формулы I меняются в зависимости от природы сорняков, используемых композиций, времени нанесения, климата и edaphie условий /если их используют для борьбы с растущими сорняками на участках выращивания сельскохозяйственных культур/, природы культурных растений. При внесении на участки с растущими культурными растениями, дозы внесения должны быть достаточны для борьбы с ростом сорняков, но не должны причинять постоянного повреждения культурным растениям. Вообще, учитывая эти факторы, дозы внесения, которые находятся между 0,01 кг и 5 кг активного материала на гектар дают хорошие результаты. Однако, следует учитывать, что могут быть использованы и более высокие и более низкие дозы внесения, в зависимости от конкретной проблемы охватывающей борьбу с сорняками.
Соединение формулы I можно использовать для селективной борьбы с ростом сорняков, например, для борьбы с ростом таких видов, которые были указаны, за счет внесения до и после прорастания, направленным или ненаправленным способом, например, за счет направленного или ненаправленного распыления в месте прорастания сорняков, которое расположено в области, используемой или предназначенной для использования для выращивания культурных растений, например, злаков, например, пшеницы, ячменя, овса, кукурузы и риса, сои, фасоли, горошка, люцерны, хлопка, земляных орехов, огурцов, моркови, капусты, рапса, подсолнечника, сахарной свеклы и постоянных или засеваемых пастбищ или после посева культур или перед и после прорастания культур. Для селективного контроля сорняков в местах зараженных сорняками, которые расположены на участках, которые использованы или должны быть использованы для выращивания культурных растений, например, указанных ранее культур, дозы внесения от 0,01 до 2,0 кг активного материала на гектар, являются наиболее подходящими.
Соединения формулы I можно также использовать для борьбы с ростом сорняков, особенно тех, которые указаны ранее, путем обработки до или после прорастания в садах и на других участках произрастания, например, в лесах, рощах и парках, и на плантациях, например, сахарного тростника, масличных пальм и каучуковых плантациях. Для этой цели их можно вносить направленным или ненаправленным образом /например, направленным или ненаправленным распылением/ на сорняки или на почву, в которой ожидается их появление, перед или после посадки деревьев или плантаций при дозах нанесения от 0,25 кг до 5,0 кг, и предпочтительно, от 0,5 кг до 4,0 кг активного материала на гектар.
Соединения формулы I можно также использовать для борьбы с ростом сорняков, особенно указанных ранее, в тех местах, которые не засеяны культурными растениями, но в которых, тем не менее желательна борьба с сорняками.
Примеры таких участков, на которых не выращивают культурные растения, включают аэродромы, промышленные площади, железные дороги, обочины шоссе, берега рек, ирригационные и другие водные пути, кустарники и участки под паром, особенно такие, на которых желателен контроль за ростом сорняков для снижения риска пожаров. В случае использования для таких целей, в которых часто желательно полное действие гербицидов, активные соединения обычно наносят в дозах более высоких нежели те, которые используют на участках с культурными растениями, как было указано ранее. Точные дозы зависят от природы обрабатываемой растительности и желательного эффекта.
Нанесение до или после прорастания, и предпочтительно, нанесения до прорастания, направленным или ненаправленным способом /например, направленным или ненаправленным распылением/ в дозах нанесения от 1,0 кг до 20,0 кг, и, предпочтительно, от 5,0 до 10,0 кг активного материала на гектар, особенно подходят для этих целей.
При использовании для борьбы с ростом сорняков при нанесении до прорастания соединения формулы 1 можно вносить в почву, в которой ожидается прорастание этих сорняков. Следует учитывать, что если используют соединения формулы I для борьбы с ростом сорняков за счет нанесения после прорастания, например, за счет нанесения на воздушную или экспонируемую часть прорастающих сорняков, соединения формулы I также могут приходить в контакт с почвой, и могут затем осуществить контроль до прорастания на более поздно прорастающих сорняках в почве.
Если необходим особенно пролонгированный контроль за сорняками, внесение соединений формулы I можно при необходимости повторить.
В соответствии со следующим аспектом настоящего изобретения предложены композиции, пригодные для гербицидного использования, содержащие одно или более из производных 4-гетероароилизоксазола формулы I, или их сельскохозяйственно приемлемые соли, вместе с, и предпочтительно, гомогенно диспергированные в одном или более из сельскохозяйственно приемлемых разбавителей или носителей и/или поверхностно-активных агентов /то есть, разбавителях или носителях и/или поверхностно-активных агентах такого типа, который обычно приемлем для специалистов, как подходящий для использования в гербицидных композициях, и которые совместимы с соединениями формулы I/. Термин "гомогенно диспергированный" используют для композиций, в которых соединения формулы I, растворены в других компонентах. Термин "гербицидная композиция" используется в широком смысле, и включает не только композиции, которые легко использовать в качестве гербицидов, но также концентраты, которые следует разбавлять перед употреблением. Предпочтительны композиции, которые содержат от 0,05 до 90% по весу одного или более соединений формулы I.
Гербицидные композиции могут содержать как разбавитель или носитель, так и поверхностно-активный агент /например, смачивающий, диспергирующий или эмульгирующий/. Поверхностно-активные агенты, которые могут присутствовать в гербицидных композициях настоящего изобретения, могут быть ионного или неионного типа, и включают, например, сульфорицинолеаты, производные четвертичного аммония, продукты конденсации этиленоксида с алкил- или полиарил-фенолами, например, нонил- или октил-фенолами, как сложные эфиры карбоновых кислот безводных сорбитолов, которым была придана растворимость за счет этерификации свободных гидроксильных групп за счет конденсации с этиленоксидом, соли щелочных или щелочноземельных металлов сложных эфиров серной кислоты, например, динонил- и диоктил-натрийсульфоносукцинаты и соли щелочных или щелочноземельных металлов высокомолекулярных производных сульфоновых кислот, например, натрий- и кальцийлигносульфонатов и натрий и кальций алкилбензолсульфонатов.
Удобно, если гербицидные композиции по способу настоящего изобретения могут содержать вплоть до 10 мас.%, например, от 0,05% до 10 мас.%, поверхностно-активного агента, но, при желании, гербицидные композиции по способу настоящего изобретения могут содержать большую долю поверхностно-активного агента, например, вплоть до 15% по весу жидких эмульгируемых концентратов суспензий и вплоть до 25 мас.% по весу жидких водорастворимых концентратов.
Примеры подходящих твердых разбавителей или носителей включают силикат алюминия, тальк, кальцинированную магнезию, кизельгур, трикальцийфосфат, порошок корки, адсорбентную сажу и такие глины, как каолин и бентонит. Твердые композиции, которые могут быть в форме дустов, гранул или смачиваемых порошков, предпочтительно получают, измельчая соединения формулы 1 с твердыми разбавителями, или пропитывая твердым разбавители или носители растворами соединений формулы I в летучих растворителях, выпаривая растворители, и, при необходимости, измельчая полученные таким образом продукты в порошки. Гранулированные композиции можно получать, абсорбируя соединения формулы I /растворенные в подходящих растворителях, которые при желании могут быть летучими/ на твердых разбавителях или носителях в гранулированной форме, и, при желании, испаряя растворитель или гранулируя композицию в порошковой форме, полученную как описано ранее. Твердые гербицидные композиции, особенно смачиваемые порошки и гранулы, могут содержать смачивающие порошки или диспергирующие агенты/ например, описанных выше типов/, которые могут также, будучи твердыми, служить разбавителями или носителями.
Жидкие композиции по способу настоящего изобретения могут принимать форму водных, органических или водно-органических растворов, суспензий и эмульсий, которые могут содержать поверхностно-активный агент. Подходящие жидкие разбавители для включения в жидкие композиции включают воду, гликоли, тетрагидрофуриловый спирт, ацетофенон, циклогексанон, изофорон, толуол, ксилол, минеральное, животное и растительное масла и легкие ароматические и нафтеновые фракции нефти /а также смеси этих растворителей/. Поверхностно-активные агенты, которые могут присутствовать в жидких композициях, могут быть ионными или неионными /например, описанного выше типа/ и могут, если они представляют жидкости, также служить разбавителями или носителями.
Порошки, диспергируемые гранулы и жидкие композиции в форме концентратов можно разбавлять водой или другими подходящими разбавителями, например, минеральными или растительными маслами особенно в случае жидких концентратов, в которых разбавитель или носитель существуют в виде масла, до получения готовых к использованию композиций.
При желании, жидкие композиции соединений формулы I можно использовать в форме самоэмульгирующихся концентратов, содержащих активные вещества, растворенные в эмульгирующих агентах или в растворителях, содержащих эмульгирующие агенты, совместимые с активными веществами, причем простое добавление воды к таким концентратам приводит к получению готовых к использованию композиций.
Жидкие концентраты, в которых разбавитель или носитель является маслом, можно использовать без дальнейшего разбавления, используя способ электростатического распыления.
Гербицидные композиции по способу настоящего изобретения могут также содержать, при желании, такие обычные адъюванты, как адгезивы, защитные коллоиды, загустители, агенты способствующие проницаемости, стабилизаторы, секвестирующие агенты, агенты, препятствующие спеканию, красители и ингибиторы коррозии. Такие адъюванты могут также служить носителями или разбавителями.
Если нет других указаний, все проценты даны по весу. Предпочтительным гербицидными композициями по способу настоящего изобретения являются:
концентраты водных суспензий, которые содержат от 10 до 70% одного или более из соединений формулы I, от 2 до 10% поверхностно-активного агента, от 0,1 до 5% загустителя и от 15 до 87,9% воды;
смачивающие порошки, которые содержат от 10 до 90% одного или более из соединений формулы I, от 2 до 10% поверхностно-активного агента, и от 8 до 88% твердого разбавителя или носителя;
водорастворимые или вододиспергируемые порошки, которые содержат от 10 до 90% одного или более из соединений формулы I, от 2 до 40% карбоната натрия от 0 до 88% твердого разбавителя;
жидкие водорастворимые концентраты, которые содержат от 5 до 50%, например, от 10 до 30% одного или более из соединений формулы I, от 5 до 25% поверхностно-активного агента, и от 25 до 90%, например, от 45 до 85% смешивающегося с водой растворителя, например, диметилформамида или смеси сшивающего с водой растворителя и воды;
концентраты жидкой эмульгируемой суспензии, которые содержат от 10 до 70% одного или более из соединений формулы I, от 5 до 15% поверхностно-активного агента, от 0,1 до 5% загустителя и от 10 до 84,9% органического растворителя;
гранулы, которые содержат от 1 до 90%, например, от 2 до 10% одного или более из соединений формулы I, от 0,5 до 7%, например, от 0,5 до 2% поверхностно-активного агента, и от 3 до 98,5%, например, от 88 до 97,5% гранул носителя; и
эмульгируемые концентраты, которые содержат от 0,05 до 90% и предпочтительно, от 1 до 60% одного или более из соединений формулы I, от 0,01 до 10%, и предпочтительно, от 1 до 10% поверхностно-активного агента, и от 99,9 до 99,94%, и предпочтительно, от 39 до 98,99% органического растворителя.
Гербицидные композиции по способу настоящего изобретения могут также содержать формулы I в связи с, и предпочтительно, гомогенно диспергированные в одном или более из других пестицидно активных соединений, и, при желании, одно или более из совместимых пестицидно приемлемых разбавителей или носителей, поверхностно-активных агентов и обычных адъювантов, описанных ранее. Примеры других пестицидно активных соединений, которые могут быть включены в, или использованы вместе с, гербицидными композициями настоящего изобретения, включают гербициды, например, для расширения круга видов сорняков, с которыми ведется борьба, например, алахор/2-хлор-2,6'-диэтил-N- /метокси-метил/-ацетанилид/, атразин/2-хлор-4-этиламино-6-изопропиламино-1,3,5-триазин/, бромоксинил/-3,5-дибром-4-гидроксибензонитрил/, хлортолурон/ N, N' /3-хлор-4-метилфенил/-N, N-диметилмочевина/, цианазин/2-хлор-4-/1-циано-1-метилэтиламино/-6-этиламино-1,3,5-триазин/, 2,4-D-/2,4-дихлорфенокси-уксусная кислота/, дикамба/3,6-дихлор-2-метоксибензойная кислота/, дифензокват/1,2-диметил-3,5-дифенилпиразолиевые соли/, флампропметил/метил-N-2-/N-бензоил-3-хлор-4-фторанилино/-пропионат/, флуометурон/N'-/3-трифторметилфенил/-N, N-диметилмочевина/, и опротурон/N'-/4-изопропилфенил/-N, N-диметилмочевина/, инсектициды, например, синтетические пиретроиды, например, перметрин и циперметрин, и фунгициды, например, карбаматы, например, метил-N-/1-бутил-карбамоил-бензимидазол-2-ил/карбамат и триазолы, например, 1-/4-хлорфенокси/-3,3-диметил-1-/1,2,4-триазол-1-ил/бутан-2-он.
Пестицидно активные соединения и другие биологически активные материалы, которые могут быть включены в, или использованы вместе с, гербицидными композициями настоящего изобретения, например, теми, которые указаны ранее, и которые являются кислотами, могут, при желании, быть использованы в форме обычных производных, например, солей и сложных эфиров щелочных металлов и аминов.
В соответствии со следующей отличительной особенностью настоящего изобретения предложены изделия, содержащие, по крайней мере, одно из производных 4-гетероароилизоксазола формулы I, или, что предпочтительно, описанные ранее гербицидные композиции и, предпочтительно, гербицидные концентраты, которые следует разбавлять перед использованием, содержащие, по крайней мере, одно из производных 4-гетероароилизоксазола формулы I, в контейнере для вышеуказанного производного или производных формулы I, или указанная гербицидная композиция и инструкции, физически прикрепленные к указанному контейнеру, устанавливающие способ, которым следует использовать вышеуказанное производное или производные формулы I, или содержащие их гербицидные композиции, для борьбы с ростом сорняков. Эти контейнеры могут быть типа обычно используемого для хранения химических соединений, которые при комнатной температуре являются твердыми веществами, и гербицидных композиций, особенно в форме концентратов, например, металлических банок и цилиндров, которые могут быть изнутри покрыты лаком, или пластических материалов, бутылок, из стеклянных или пластиковых материалов, и, в случае твердых форм содержимого контейнеров, например, гранул, гербицидных композиций, коробок, например, из картона, пластика и металла, или мешков. Такие контейнеры обычно имеют достаточную емкость для вмещения количеств производных 4-гетероароилизоксазола или гербицидных композиций, достаточных для обработки, по крайней мере, одного акра земли для контроля за ростом сорняков на этой площадки, но не превышают обычных размеров, удобных для обычных манипуляций. Инструкции должны быть физически прикреплены к контейнерам, например, непосредственно напечатаны на них, или на ярлыках или этикетках, прикрепленных к ним. В указаниях обычно должно быть названо содержимое контейнера, которое после разбавления необходимо наносить для контроля роста сорняков в дозах нанесения от 0,01 кг до 20 кг активного материала на гектар, способом, указанным для описанных целей.
Нижеследующие примеры иллюстрируют гербицидные композиции по способу настоящего изобретения.
Пример C1. Растворимый концентрат приготавливают из:
Активного ингредиента /соединение 1/ - 20% вес/об
Раствора гидроксида калия 33% мас./объем - 10% объем/об
Тетрагидрофурфурилового спирта /THFA/ - 10% об/об
Воды - До 100 объемов
За счет перемешивания THFA, активного ингредиента /соединение 1/ и 90% объема воды, и медленного добавления раствора гидроксида калия до достижения pH 7 - 8, и доведения объема до нужного значения водой.
Аналогичные растворимые концентраты можно получить как описано ранее, заменяя 4-гетероароилизоксазол /соединение 1/ другими соединениями формулы I.
Пример C2. Смачиваемый порошок приготовляют из:
активного ингредиента /соединение 1/ - 50% вес/вес
натрийдодецилбензолсульфоната - 3% вес/вес
натрийлигносульфоната - 5% вес/вес
натрий формальдегидалкилнафталинсульфоната - 2% вес/вес
микрочастиц диоксида кремния - 3% вес/вес и
каолина - 37% вес/вес.
путем смешивания вышеуказанных ингредиентов вместе и измельчения полученной смеси в воздухоструйном измельчителе.
Аналогичные смачиваемые порошки можно получить описанным выше способом, заменяя 4-гетероароилизоксазол /соединение I/ другими соединениями формулы I.
Пример С3. Водорастворимый порошок приготавливают из:
активного ингредиента /соединение I/ - 50% вес/вес
натрийдодецинбензолсульфоната - 1% вес/вес
микрочастиц диоксида натрия - 2% вес/вес
натрийбикарбоната - 47% вес/вес
путем перемешивания вышеуказанных ингредиентов и измельчения вышеуказанной смеси в молотковой мельнице.
Аналогичные водорастворимые порошки можно получить описанным выше способом, заменяя 4-гетероароилизоксазол /соединение I/ другими соединениями формулы I.
Представительные соединения формулы I были использованы в наносимых гербицидных композициях следующим способом.
Способ использования гербицидных соединений:
а/ Общий. Соответствующие количества соединений, используемых для обработки растений, растворяют в ацетоне до получения растворов, эквивалентных дозам нанесения, вплоть до 4000 г тестового соединения на гектар /г/га/ Эти растворы наносят из стандартной лабораторной установки для распыления гербицидов, подающей эквивалент 290 л распыляемой жидкости на гектар.
b/ Борьба с сорняками: до прорастания.
Семена посеяли в пластиковые горшки с нестерильной почвой размерами 70 мм2, 75 мм глубиной. Количества семян в каждом горшке были следующие:
Сорняки - Прибл.количество семян/горшок
1 /Широколиств. сорняки
Abutilon theophrasti - 10
Amaranthus retroflexus - 20
Calium aparine - 10
Ipomola purpurea - 10
Sinapis arvensis - 15
Xanthium strumarium - 2
2/ Травянистые сорняки
Alopecurus myosuroides - 15
Avena satua - 10
Echinochloa crus-galli - 15
Setaria viridis - 20
3/ Камыши
Cyperus esculentus - 3
Культурные растения - прибл. количество семян/горшок
I/ Широколиственные
Хлопок - 3
Соя - 3
2/ Травянистые
Кукуруза - 2
Рис - 6
Пшеница - 6
Соединения настоящего изобретения наносили на поверхность почвы, в которой были семена, по способу раздела a/. По одному горшку каждого вида растений оставляли необработанным, обработанным одним ацетоном для сравнения, и обработанным каждым соединением.
После обработки горшки помещали в застекленную теплицу на капиллярные маты и поливали сверху. Визуальную оценку повреждения растений проводили спусти 20 - 24 дня после распыления. Полученные результаты выражены как процент снижения роста или повреждения культурных растений или сорняков, по сравнению с растениями в контрольных горшках.
c/ Борьба с сорняками; после прорастания.
Сорняки и культурные растения сеяли непосредственно в горшки с компостом John Innes размерами 75 мм глубиной и 70 мм2, за исключением амарантуса, который пикировали на стадии сеянца, и перенесли в горшки за неделю до опрыскивания. Затем растения выращивали в оранжерее до тех пор, пока они не были готовы к опрыскиванию соединениями, которые использовали для обработки растений. Количество растений в каждом горшке:
Соединения, используемые для обработки растений, наносят на растения по способу, описанному в пункте /a/. По одному горшку каждого культурного растения и видов сорняков вводят в систему обработки, при этом остаются необработанные контрольные и контрольные растения, которые опрыснуты только ацетоном.
После обработки горшков их помещают в теплицы на капиллярные маты и поливают сверху один раз за 24 ч, а затем за счет контролируемой субирригации. Визуальная оценка повреждений культур с сорняков проводилась спустя 20 - 24 дня после распыления. Полученные результаты выражают как процент снижения роста или повреждения культурных растений или сорняков, по сравнению с растениями, в контрольных горшках.
При нанесении либо до либо после прорастания в дозах 4 кг/га или менее, соединения 1 - 17 дают, по крайней мере, 80% контроля одного или более из видов сорняков.

Использование: в химии гетероциклических соединений, обладающих гербицидной активностью. Раскрыты производные 4-гетероароилизоксазола формулы 1, где R представляет атом водорода; R1 представляет циклоалкил, содержащий 3-6 атомов С; Ar представляет группу Het, необязательно замещенную, а также способ получения этих соединений, гербицидная композиция и способ борьбы с сорняками на их основе.

Предложенный способ прост, удобен в работе, позволяет получить широкий круг необходимых в сельском хозяйстве гербицидов, эффективных для борьбы с сорняками. 4 с. и 9 з.п. ф-лы, 3 табл.

где R - атом водорода;
R1 - C3 - C6-циклоалкил;
Ar - группа Het, которая необязательно замещена от одной до трех групп R2, где Het - гетероциклическое кольцо, содержащее от 5 до 6 атомов в кольце, причем кольцо содержит 1 или 2 гетероатома, выбранное из азота и серы;
R2 - атом галогена или группа, выбранная из R4, - SR5, - SOR5, - SO2R5, - OR5;
R4 - представляет C1 - C4-алкил, необязательно замещенный 3 атомами галогена;
R5 - R4 или фенил, необязательно замещенный атомом галогена.
Соединение по п.1, отличающееся тем, что R1 - циклопропил.

| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| EP, 0418175, кл | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| EP, 0487357, кл | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
Авторы
Даты
1998-07-10—Публикация
1993-09-17—Подача