Изобретение относится к новым производным 2-циано-1,3-диона, к способам их получения, к композициям, содержащим указанные соединения, и к их использованию в качестве гербицидов. В EP A 0496630 описаны в качестве гербицидов некоторые 2-циано-1,3-дионы, содержащие в положении 4 бензоильного фрагмента серосодержащий заместитель.
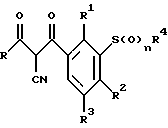
Настоящее изобретение относится к 2-циано-1,3-дионам формулы I:
где R представляет собой циклоалкильную группу, содержащую от 3 до 6 атомов углерода;
R1 представляет собой водород или прямую или разветвленную алкильную группу, содержащую до 6 атомов углерода, которая может быть замещена -OR5;
где R5 представляет собой прямую или разветвленную алкильную группу, содержащую до 6 атомов углерода, которая может быть замещена одним или несколькими атомами галогена, которые могут быть одинаковыми или различными;
или R1 представляет группу, выбранную из R5, нитро, -S(O)pR5 -OR5;
R2 представляет атом галогена или водорода; или группу выбранную из R5, -OR5, - S(O)qR5;
R3 представляет атом водорода;
R4 представляет прямую или разветвленную алкильную группу, содержащую до 6 атомов углерода;
n=0, 1 или 2; p=0; q=0, и их сельскохозяйственно-приемлемым солям.
Соединения формулы I могут существовать в енольных таутомерных формах, в результате чего могут образовываться геометрические изомеры относительно енольной двойной связи.
Кроме того, в некоторых случаях, заместители R, R1, R2, R3 R4 и R5 могут способствовать образованию оптических изомеров и/или стереоизомеров. Все указанные изомеры входят в объем настоящего изобретения.
Термин "сельскохозяйственно-приемлемые соли" означает соли, катионы которых являются известными и приемлемыми для получения солей в целях их использования в земледелии и садоводстве. Предпочтительно, если соли являются водорастворимыми.
Подходящими солями, которые образуют соединения формулы I, являющиеся кислотными, т.е. соединения в енольной таутомерной форме, с основаниями, могут служить соли щелочных металлов (например, соли натрия и калия), соли щелочноземельных металлов (напр., соли кальция и магния), соли аммония (напр., соли диоктилметиламина и морфолина).
Термин "комплексы металла" означают соединения, в которых один или оба атома кислорода 1,3-диона действуют как хелатирующие агенты по отношению к катиону металла. Примеры таких катионов включают цинк, марганец, медь (1), медь (2), железо (3), железо (2), титан и алюминий.
В некоторых аспектах своей активности против таких важных сорняков, как Setaria viridis, Setaria faberii, Echinochloa crus-galli, Avena fatua и Alopecurus myosuroides, соединения по настоящему изобретению являются более эффективными, чем известные соединения.
Предпочтительным классом соединений формулы I являются соединения, в которых заместители имеют следующие предпочтительные значения:
(a) - R представляет циклопропил;
и/или
(b) R1 представляет: атом водорода
или группу, выбранную из -OR5, например, метокси, этокси или трифторметокси, R5, например, метил или трифторметил, r нитро, или -SR5; и/или
(c) R2 представляет атом галогена или атом водорода;
или группу, выбранную из R5, например, метил или трифторметил, -OR5 например, метокси, этокси или изопропокси, или -S(O)qR5; и/или
(d) R3 представляет водород; и/или
(e) R4 представляет: прямую или разветвленную алкильную группу, содержащую до 4 атомов углерода;
(f) R5 представляет: прямую или разветвленную алкильную группу, содержащую до 4 атомов углерода; и/или
(g) галоген представляет собой хлор, бром или фтор.
Другим предпочтительным классом соединений формулы I являются соединения, в которых R представляет собой циклопропил.
Еще одним предпочтительным классом соединений формулы I являются соединения, в которых:
R представляет циклопропил,
R1 представляет трифторметил, -SR5, метокси или метил;
R2 представляет хлор, трифторметил, -S(O)qR5 или метил;
R3 представляет водород;
R4 представляет метил, этил или пропил;
R5 представляет собой метил, этил или пропил; и
n=0, 1 или 2.
Другим предпочтительным классом соединений формулы I являются соединения, в которых
R представляет циклопропил;
R1 представляет водород или, более предпочтительно, метил, трифторметил, -SMe или метокси;
R2 представляет метил или метокси, или, наиболее предпочтительно, хлор или -SMe;
R3 представляет водород;
R4 представляет метил, этил или пропил; и
n=0, 1 или 2.
Особенно важными соединениями формулы 1 являются следующие соединения:
1. 2-циано-3-циклопропил-1-(4-метил-3-метилсульфенилфенил)пропан- 1,3-дион;
2. 2-циано-3-циклопропил-1-(4-метил-3-метилсульфонилфенил)пропан- 1,3-дион;
3. 2-циано-3-циклопропил-1-(4-метил-3-метилсульфинилфенил)пропан- 1,3-дион;
4. 2-циано-3-циклопропил-1-(4-хлор-3-этилсульфенил-2- метилсульфенилфенил)пропан-1,3-дион;
5. 2-циано-3-циклопропил-1-(4-метокси-3-метилсульфонилфенил) пропан-1,3-дион;
6. 2-циано-3-циклопропил-1-(4-хлор-3-метилсульфонилфенил)пропан- 1,3-дион;
7. 2-циано-3-циклопропил-1-(4-хлор-2-метил-3-метилсульфенил-фенил) пропан-1,3-дион;
8. 2-циано-3-циклопропил-1-(3,4-бисметилсульфенил-2-трифторметилфенил) пропан-1,3-дион;
9. 2-циано-3-циклопропил-1-(4-хлор-2-метокси-3-метилсульфонилфенил) пропан-1,3-дион; и
10. 2-циано-3-циклопропил-1-(4-хлор-2-метилсульфенил-3- пропилсульфенилфенил)пропан-1,3-дион.
Соединения 1-10 далее обозначаются цифрами для идентификации.
Другим предпочтительным классом соединений формулы I являются соединения, в которых R представляет собой циклопропил.
Другим предпочтительным классом соединений формулы являются соединения, в которых R3 представляет собой атом водорода.
Еще одним предпочтительным классом соединений формулы I являются соединения, в которых:
R представляет собой изопропил, циклопропил, или 1-метилциклопропил;
R1 представляет собой хлор, бром, трифторметил, -SR5, метокси, или метил;
R2 представляет собой фтор, хлор, бром, трифторметил, -S(O)qR5 или метил;
R3 представляет собой водород;
R4 представляет собой метил, этил или изопропил;
R5 представляет собой, этил или н-пропил; и
n = 0, 1 или 2.
Другим предпочтительным классом соединений формулы I являются соединения, в которых
R представляет собой циклопропил;
R1 представляет собой водород или более предпочтительно метил, трифторметил, -SMe или метокси;
R2 представляет собой метил или метокси, а наиболее предпочтительно хлор или -SMe;
R3 представляет собой водород;
R4 представляет собой метил, этил, или пропил; и
n = 0, 1 или 2.
Особенно ценными соединениями формулы I являются следующие соединения:
1. 2-циано-3-циклопропил-1-(4-метил-3-метил-сульфенилфенил) пропан-1,3-дион;
2. 2-циано-3-циклопропил-1-(4-метил-3-метилсульфенилфенил) пропан-1,3-дион;
3. 2-циано-3-циклопропил-1-(4-метил-3-метилсульфинилфенил) пропан-1,3-дион;
4. 2-циано-3-циклопропил-1-(4-хлоро-3-этил-сульфенил-2- метилсульфенилфенил)пропан-1,3-дион;
5. 2-циано-3-циклопропил-1-(4-метокси-3-метилсульфонилфенил) пропан-1,3-дион;
6. 2-циано-3-циклопропил-1-(4-хлоро-3-метилсульфенилфенил) пропан-1,3-дион;
7. 2-циано-3-циклопропил-1-(4-хлоро-2-метил-3-метилсульфенилфенил) пропан-1,3-дион;
8. 2-циано-3-циклопропил-1-(3,4-бисметилсульфенил-2- трифторметилфенил)пропан-1,3-дион;
9. 2-циано-3-циклопропил-1-(4-хлоро-2-метокси-3-метилсульфонилфенил) пропан-1,3-дион; и
10. 2-циано-3-циклопропил-1-(4-хлоро-2-метилсульфенил-3- пропилсульфенилфенил)пропан-1,3-дион;
Соединения 1-10 будут далее обозначаться просто цифрами 1-10.
Соединения формулы I могут быть получены способами, описанными ниже.
При этом следует отметить, что если в нижеприведенных формулах буквенные обозначения не определяются конкретно, то это означает, что они является такими, как они были определены ранее, то есть в соответствии с первым определением этого символа в данном описании.
Следует также отметить, что последовательность описываемых ниже процедур может быть осуществлена в другом порядке и для получения целевых соединений могут потребоваться соответствующие защитные группы.
В соответствии с настоящим изобретением, соединения формулы (I) могут быть получены из соединения формулы (II):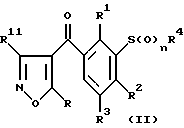
где R, R1, R2, R3, R4 и n определены выше, a R11 представляет собой атом водорода или группу, выбранную из сложного эфира карбоновой кислоты, амида, нитрила и ацила.
Если R11 является водородом или ацильной группой, то реакцию осуществляют путем обработки основанием. Примерами подходящих оснований являются гидроксиды или алкоксиды щелочных или щелочноземельных металлов, такие как этоксид натрия; или органические основания, такие как триэтиламин.
Если R11 представляет собой такую группу, как сложный эфир, амид или нитрил, то целевое соединение получают с помощью гидролитической реакции. Такая гидролитическая реакция может быть проведена в присутствии кислоты или основания. Кислотный гидролиз может быть осуществлен, например, с использованием водного раствора соляной кислоты. Основный гидролиз может быть осуществлен, например, с использованием гидроксида натрия в смеси спирта и воды. Указанные реакции проводят при температуре от комнатной до температуры перегонки указанной смеси.
В соответствии с другим признаком настоящего изобретения, соединения формулы (I) могут быть получены из соединения формулы (III):
где R, R1, R2, R3, R4 n и R11 определены выше.
Если R11 является водородом или ацильной группой, то реакцию проводят путем обработки основанием. Примерами подходящих оснований являются гидроксиды или алкоксиды щелочных или щелочноземельных металлов, например, этоксид натрия; или органические основания, например, триэтиламин.
Если R11 представляет собой такую группу, как сложный эфир, амид или нитрил, то нужное соединение получают посредством гидролитической реакции. Эта реакция может быть осуществлена в присутствии кислоты или основания. Кислотный гидролиз может быть проведен с использованием водного раствора соляной кислоты. Основный гидролиз может быть проведен, например, с использованием гидроксида натрия в смеси спирта и воды. Эти реакции осуществляют при температуре от комнатной до температуры перегонки указанной смеси.
В соответствии с другим отличительным признаком настоящего изобретения, соединения формулы (I), в которых n, p и q равны нулю или двум, могут быть также получены посредством реакции бензоилхлорида формулы (IV):
(где R1, R2, R3 и R4 определены выше, а n, p и q = 0 или 2)
с бета-кетонитрилом формулы (V):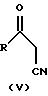
где R определен выше.
Эту реакцию осуществляют, в основном, в присутствии основания в растворителе или смеси растворителей. Подходящими основаниями являются гидриды, гидроксиды, или алкоксиды металлов (например, гидрид натрия или лития, гидроксид натрия, гидроксид калия, этоксид магния или метоксид магния).
Подходящими растворителями являются, например, тетрагидрофуран; углеводороды, такие как толуол; или галогенированные углеводороды, такие как дихлорметан. В основном, реакцию осуществляют при температуре от 0oC до температуры перегонки.
В соответствии со следующим признаком настоящего изобретения, соединения формулы (I), в которых n, p и q равны нулю или двум, могут быть также получены с помощью реакции хлорангидрида формулы (VI)
где R определен выше,
с бета-кетонитрилом формулы (VII)
где R1, R2, R3, R4 определены выше и n, p и q = 0 или 2.
Эту реакцию осуществляют, в основном, в условиях, аналогичных описанным выше условиям проведения реакции соединений формулы (IV) с соединениями формулы (V).
В соответствии со следующим отличительным признаком настоящего изобретения, соединения формулы (I), в которых n, p и q равны нулю или двум, могут быть получены с помощью реакции бензоилхлорида формулы (IV) (где R1, R2, R3 и R4 определены выше, a n, p и q = 0 или 2) с бета-кетонитрилом формулы (V) (где P определен выше) посредством промежуточного соединения формулы (VIII):
где R, R1, R2, R3, R4 определены выше, a n, p и q = 0 или 2.
Промежуточное соединение формулы (VIII) может быть получено в присутствии слабого основания, такого как органическое основание, например, триэтиламин, в инертном растворителе, таком как ацетонитрил или дихлорметан, при температуре в диапазоне от комнатной температуры до температуры перегонки смеси. Реакция перегруппировки промежуточного соединения формулы (VIII) с образованием соединения формулы (I) может быть осуществлена (но необязательно) in situ в инертном растворителе, таком как ацетонитрил или дихлорметан, в присутствии катализатора, такого как источник цианида.
Примерами таких источников цианида могут служить ацетонцианогидрин или цианид щелочного металла, например, цианид калия, необязательно в присутствии краун-фира, такого, как 18-краун-6.
В соответствии с другим отличительным признаком настоящего изобретения, соединения формулы (I), в которых n, p и q = 0 или 2, могут быть получены с помощью реакции хлорангидрида формулы (VI) (где R определен выше) с бета-катонитрилом формулы (VII) (где R1, R2, R3 и R4 определены выше, a n, p и q = 0 или 2) посредством промежуточного соединения формулы (IX):
где R, R1, R2, R3 и R4 определены выше, а n, p и q = 0 или 2.
Получение и перегруппировка промежуточного соединения формулы (IX) могут быть осуществлены в условиях, аналогичных описанным выше условиям получения и перегруппировки соединений формулы (VIII).
Промежуточные соединения при получении соединений формулы (I) могут быть получены с использованием или модификацией известных методов.
Соединения формул (II) или (III), в которых R11 является водородом, могут быть получены с помощью реакции соединения формулы (X):
(где R1, R2, R3, R4 и n определены выше, a L представляет собой -OR72 или -N(R72)2, где R72 является алкильной группой)
с солью гидроксиламина в присутствии основания или акцептора кислоты. Эту реакцию, в основном, осуществляют с использованием гидрохлорида гидроксиламина в присутствии ацетата натрия или органического основания, такого как триэтиламина.
Предпочтительно, если реакция протекает в растворителе. Подходящими растворителями являются спирты, такие как этанол, или инертные растворители, такие как ацетонитрил. Эту реакцию осуществляют, в основном, при температуре в диапазоне от комнатной температуры до температуры кипения растворителя.
Соединения формулы (X), в которых L представляет собой -OR72, могут быть получены с помощью реакции дикетона формулы (XI):
где R, R1, R2, R3, R4 и n определены выше, с ортоэфиром HC(OR72)3, где R72 определен выше.
Эту реакцию проводят, в основном, с использованием триэтилортоформата в присутствии кислотного катализатора, такого как ангидрида уксусной кислоты. Реакция протекает при температуре в диапазоне от комнатной температуры до температуры кипения смеси.
Соединения формулы (X), в которых L представляет собой -N(R72)2, могут быть получены с помощью реакции дикетона формулы (XI) (где R, R1, R2, R3, R4 и n определены выше) с амидоацеталем формулы (R72)2N-CH(OR72)2, где R72 определен выше.
Эта реакция протекает (но необязательно) в инертном растворителе, таком как толуол, при температуре в диапазоне от комнатной температуры до температуры кипения смеси.
Соединения формулы (II), где R11 представляет собой сложный эфир, нитрил или ацил, могут быть получены с помощью реакции соединения формулы (XII):
(где R, R1, R2, R3 R4 и n определены выше, а P является уходящей группой, такой как N,N-диалкиламино)
с соединением формулы R11-C(Z) = NOH, где R11 представляет собой сложноэфирную, нитрильную или ацильную группу, a Z является атомом галогена. В основном, Z является атомом хлора или брома. Эту реакцию осуществляют, в основном, в инертном растворителе, таком как толуол или дихлорметан, в присутствии основания, такого, как триэтиламин, или катализатора, такого как молекулярное сито в 4 ангстрем или ион фторида.
Соединения формулы (XII) могут быть получены с помощью реакции соединения формулы CH2 = C(R11)(P), где R11 и P определены выше, с бензоилхлоридом формулы (IV). Эту реакцию, в основном, осуществляют в присутствии органического основания, такого как триэтиламин, в инертном растворителе, таком как толуол или дихлорметан, при температуре от -20oC до комнатной температуры.
Соединения формулы (II) или (III), где R11 представляет собой сложноэфирную, нитрильную или ацильную группу, могут быть получены с помощью реакции соединения формулы (XI) с соединением формулы R11-C(Z) = NOH, где R11 представляет собой сложноэфирную, нитрильную или ацильную группу, a Z определен выше.
Обычно эту реакцию осуществляют в инертном растворителе, таком как дихлорметан или ацетонитрил, в присутствии основания.
Примерами подходящих оснований являются алкоксиды щелочноземельных металлов, такие как метоксид магния.
В основном, реакцию проводят при температуре в диапазоне от комнатной температуры до температуры перегонки смеси.
Соединения формулы (II) или (III), где R11 представляет собой амидную группу, могут быть получены с помощью реакции соответствующего соединения формулы (II) или (III), где R11 является сложноэфирной группой, с аммиаком или амином.
Эту реакцию осуществляют в растворителе или в смеси растворителей, такой как водный этанол, при температуре от комнатной до температуры перегонки смеси.
Соединения формулы (III), где R11 является водородом, могут быть получены с помощью реакции соединения формулы (XIII):
где R11 является водородом, а Y является карбоксильной группой,
или ее реактивным производным (таким как хлорангидрид карбоновой кислоты или сложный эфир карбоновой кислоты), или цианогруппой, с соответствующим металлоорганическим реагентом, таким как реагент Гриньяра или литийорганический реагент.
В результате этой реакции вводят группу -COR в 4-положение изоксазольного кольца. В основном, реакцию осуществляют в инертном растворителе, таком как простой эфир или тетрагидрофуран, при температуре от 0oC до температуры перегонки растворителя.
Соединения формулы (III), где R11 представляет собой сложноэфирную, нитрильную или ацильную группу, могут быть получены с помощью реакции соединения формулы (XIV):
где R1, R2, R3, R4 и n определены выше, a P является уходящей группой, такой как N,N-диалкиламин,
с соединением формулы R11C(Z) = N-OH, где Z определен выше, a R11 представляет собой сложноэфирную группу, нитрильную или ацильную группу.
В основном, Z является хлором или бромом. Эту реакцию, в основном, осуществляют в инертном растворителе, таком как толуол или дихлорметан, в присутствии основания, такого как триэтиламин, или катализатора, такого, как молекулярное сито 4  или ион фторида.
или ион фторида.
Соединения формулы (XIII), где R11 является водородом, a Y является -CO2-алкилом или -CN, могут быть получены с помощью реакции соединения формулы (XV):
где R1, R2, R3, R4 и n определены выше. Y1 является CO2-алкилом или -CN, a L определена выше,
с солью гидроксиламина, такой как гидрохлорид гидроксиламина, в растворителе, таком как этанол или ацетонитрил, необязательно в присутствии основания или акцептора кислоты, такого, как триэтиламин или ацетат натрия.
Соединения формулы (XIII), в которых R11 является водородом, a Y является карбоновой кислотой или хлорангидридом карбоновой кислоты, могут быть получены из соответствующего соединения формулы (XIII), в котором R11 является водородом, а Y представляет собой сложноэфирную группу карбоновой кислоты, посредством гидролиза указанной сложноэфирной группы, с последующим превращением, если это необходимо, полученной таким образом кислоты в хлорангидрид, например, путем нагревания с тионилхлоридом.
Соединения формулы (XV) могут быть получены с помощью реакции соединения формулы (VII) или сложного кетоэфира формулы (XVI):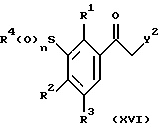
где R1, R2, R3, R4 и n определены выше, a Y2 представляет собой -CO2-алкил,
либо с триалкилортоформатом (например, триэтилортоформатом) в присутствии ангидрида уксусной кислоты при температуре перегонки смеси, либо с диалкилацеталем диалкилформамида (например, диметилацеталем диметилформамида) необязательно в инертном растворителе, таком как толуол при температуре от комнатной температуры до температуры перегонки смеси.
Соединения формулы (XIV) могут быть получены с помощью реакции соединения формулы (XVII):
где R1, R2, R3, R4, n и P определены выше,
с хлорангидридом формулы (VI), где R определен выше, в инертном растворителе, таком как дихлорметан или толуол, в присутствии основания, такого как триэтиламин.
Хлорангидриды формулы (IV) или (VI) обычно являются известными соединениями, либо они могут быть получены традиционными способами из соответствующей карбоновой кислоты, например, с использованием тионилхлорида в хлороформе в условиях нагревания с обратным холодильником.
Бета-кетонитрилы формулы (V) могут быть получены из хлорангидридов формулы (VI) стандартными методами, хорошо описанными в литературе (например, см. Krauss et al., Synthesis, 1983, 308 или Muth et al., J. Org. Chem. 1960, 25, 736). Альтернативно, бета-кетонитрилы формулы (V) могут быть получены с помощью реакции сложного эфира формулы R-CO2Et, где R определен выше, с ацетонитрилом. Эта реакция описана в литературе, см., например, статью Abramovitch и Hauser, J. Am. Chem. Soc., 1942, 64, 2720.
Бета-кетонитрилы формулы (VII) могут быть получены из бензоилхлоридов формулы (IV) или из этилбензоатов формулы (XVIII):
где R1, R2, R3, R4 и n определены выше) способом, аналогичным способу, описанному выше для получения бета-кетонитрилов формулы (V).
Соединения формулы (V), (XI), (XIV), (XVI), (XVII) и (XVIII) являются известными, либо они могут быть получены с использованием известных способов или путем адаптации известных способов.
Взаимопревращение соединений формулы (I) или промежуточных соединений может быть осуществлено известными методами либо путем модификации известных методов. Соединения, в которых n, p и q = 1 или 2, могут быть получены путем окисления соответствующих соединений, в которых n, p и q = 0 или 1, например, с использованием 3-хлоропероксибензойной кислоты в инертном растворителе, таком, как дихлорметан, при температуре от -30oC до температуры кипения растворителя.
Соединения, в которых R1, R2 или R3 являются атомом галогена, могут быть получены из соответствующих соединений, в которых R1, R2 или R3 являются замещенными незамещенной аминогруппой с помощью реакции Зандмейера. Эту реакцию осуществляют в присутствии кислоты, такой как хлористоводородная или бромистоводородная кислота, с последующей обработкой, например, хлоридом меди (I) или бромидом меди (I) при температуре от комнатной до 80oC. Альтернативно, диазотирование может быть осуществлено с использованием алкилнитрита, такого как т-бутилнитрит, в присутствии галогенирующего агента, такого как хлорид меди (II) или бромоформ, в инертном растворителе, таком как ацетонитрил.
Соединения, в которых R1, R2 или R3 заменены на незамещенную аминогруппу, могут быть получены с помощью реакции соединений, в которых R1, R2 или R3 являются нитрогруппой, например, с хлоридом олова (II) и соляной кислотой.
Соединения, в которых R1, R2 или R3 является цианогруппой, могут быть получены из соединений, в которых R1, R2 или R3 являются группой -CO2R5, посредством гидролиза с получением соответствующей карбоновой кислоты, в которой R5 заменяется водородом, с последующей конверсией в соответствующий галоидангидрид, например, путем обработки тионилхлоридом, а затем аммиаком, с образованием амида, и наконец, с последующей дегидратацией, например, в присутствии оксихлорида фосфора. Соединения, в которых R1, R2 или R3 являются нитрогруппой, могут быть получены путем окисления соединений, в которых R1, R2 или R3 заменены на незамещенную аминогруппу, например, при помощи реакции с трифторуксусной кислотой.
Агрономически приемлемые соли и металлокомплексы соединений формулы (I) могут быть получены известными методами.
Нижеприведенные примеры иллюстрируют получение соединений формулы (I). В настоящем описании т. кип. - точка кипения; т.пл. - точка плавления; cPr - циклопропил, ЯМР - спектр протонного (ядерного) магнитного резонанса. Если это не указано особо, то все процентные содержания даны в массовых процентах.
Пример 1. К раствору 5-циклопропил-4-(4-метил-3-метил-сульфенилбензоил) изоксазола (0,66 г) в дихлорметане добавляли 0,5 г триэтиламина. Полученную смесь перемешивали при комнатной температуре в течение ночи. После этого добавляли еще 0,2 г триэтиламина и полученную смесь перемешивали в течение 24 ч. К смеси добавляли соляную кислоту (2 М), и слои отделяли. Органический слой промывали водным раствором хлорида натрия, осушали сульфатом натрия и фильтровали. Полученный фильтрат выпаривали досуха и получали 2-циано-3-циклопропил- 1-(4-метил-3-метилсульфенилфенил)пропан-1,3-дион (соединение 1, 0,12 г) в виде камеди оранжевого цвета, которая отверждается, т.пл. 64,7-67,9oC.
Пример 2. К раствору 0,05 г натрия в этаноле (10 мл) добавляли 0,43 г 5-циклопропил-4-(4-хлоро-3-этилсульфенил-2- метилсульфенил-2-бензоил)изоксазола. Полученную смесь перемешивали при комнатной температуре в течение 2 ч. Затем добавляли соляную кислоту (2 М) и смесь экстрагировали эфиром, а слои отделяли. Органический слой промывали водой, осушали безводным сульфатом натрия и фильтровали. Фильтрат выпаривали досуха, и получали кремообразное твердое вещество. Это вещество растирали с эфиром и получали 2-циано-3-циклопропил-1-(4-хлоро-3-этилсульфенил-2- метилсульфенилфенил)пропан-1,3-дион (соединение 4, 0,15 г) в виде белого твердого вещества, т.пл. 63-65oC.
С использованием аналогичной процедуры и соответствующим образом замещенных исходных материалов, были получены следующие соединения формулы I (см. табл. A).
Пример 3. К раствору 5-(4-метил-3-метилсульфонилфенил)- 4-циклопропилкарбонилизоксазола (0,74 г) в дихлорметане, добавляли 0,5 г триэтиламина. Полученную смесь перемешивали в течение ночи. К смеси добавляли соляную кислоту (2 М) и слои разделяли. Органический слой промывали водным раствором хлорида натрия, осушали безводным сульфатом магния и фильтровали. Фильтрат выпаривали досуха и получали 2-циано-3-циклопропил-1-(4-метил-3- метилсульфонилфенил) пропан-1,3-дион (соединение 2, 0,55 г) в виде твердого вещества с т.пл. 133,6-135,6oC.
С использованием аналогичной процедуры и соответствующим образом замещенных исходных материалов были получены следующие соединения формулы I.
Соединение 3.
2-Циано-3-циклопропил-1-(4-метил-3-метилсульфинилфенил)-пропан-1, 3-дион (т. пл. 104,3oC) - из исходного 5-(4-метил-3-метилсульфинилфенил)-4-циклопропилкарбонилизоксазола.
Соединение 6.
2-Циано-3-циклопропил-1-(4-хлоро-3-метилсульфонилфенил)-пропан-1, 3-дион (т. пл. 115,8-116,7oC) - из исходного 5-(4-хлор-3- метилсульфонилфенил)-4-циклопропилкарбонилизоксазола.
Пример 4. К раствору смеси (1:1) 5-циклопропил-4-(4-метокси-3- метилсульфонилбензоил)изоксазола и 5-(4-метокси-3-метилсульфонилфенил)- 4-циклопропилкарбонилизоксазола (0,65 г) в дихлорметане, добавляли 0,5 мл триэтиламина. Полученную смесь перемешивали при комнатной температуре в течение 2 ч. После этого к смеси добавляли соляную кислоту (2 М) и слои отделяли.
В соответствии с вышеуказанными методиками, приведенными в примерах, были получены следующие соединения (см. табл. B).
Органический слой промывали водным раствором хлорида натрия, осушали безводным сульфатом натрия и фильтровали. Фильтрат выпаривали досуха и получали 2-циано-3-циклопропил-1-(4- метокси-3-метилсульфонилфенил)пропан-1,3-дион (соединение 5, 0,5 г) в виде твердого вещества бежевого цвета с т.пл. 151-153,1oC.
Ссылочный пример 1. Смесь 3-циклопропил-2-(N,N-диметиламинометилен)- 1-(4-метил-3-метилсульфенилфенил)пропан-1,3-диона (10,6 г) и гидрохлорида гидроксиламина (2,92 г) в этаноле перемешивали в течение ночи при комнатной температуре. Затем добавляли воду и полученную смесь выпаривали для удаления этанола.
После этого смесь экстрагировали этилацетатом, промывали водным раствором хлорида натрия, осушали сульфатом натрия и фильтровали. Фильтрат выпаривали досуха и образовавшийся остаток очищали с помощью хроматографии на двуокиси кремния (элюент: смесь эфира и циклогексана). В результате этой процедуры получали 2,77 г 5-циклопропил-4-(4-метил-3-метилсульфенилбензоил)изоксазола в виде белого твердого вещества, т.пл. 85,5-86,1oC.
С использованием аналогичной процедуры, из соответствующим образом замещенных исходных материалов, были получены следующие соединения.
5-(4-Метил-3-метилсульфенилфенил)-4-циклопропилкарбонилизоксазол (т.пл. 78,9-79,9oC) - из 3-циклопропил-2-(N,N-диметиламинометилен)- 1-(4-метил-3-метилсульфенилфенил)пропан-1,3-диона.
Смесь (1: 1) 4-(4-метокси-3-метилсульфонилбензоил)-5- циклопропилизоксазола и 5-(4-метокси-3-метилсульфонилизоксазола)фенил)- 4-циклопропилкарбонилизоксазола - из 3-циклoпpoпил-2-(N, N- диметиламинометилен)-1-(4-метокси-3-метилмульфонилфенил)пропан-1,3-диона.
Ссылочный пример 2. К смеси 1-[4-хлоро-3-(этилсульфенил)-2- (метилсульфенил)-фенил] -3-циклопропил-2-этоксиметиленпропан-1,3-диона (3,4 г) и гидрохлорида гидроксиламина (0,83 г) в этаноле добавляли 0,98 г ацетата натрия и полученную смесь перемешивали при комнатной температуре в течение ночи.
Твердое вещество отделяли, фильтровали, тщательно промывали водой и осушали. В результате этой процедуры получали 4-[4-хлоро- 3-(этилсульфенил)-2-(метилсульфенил)бензоил)-5-циклопропилизоксазола (1,45 г) в виде желтого твердого вещества, т.пл. 105-106oC.
С использованием аналогичной процедуры, из соответствующим образом замещенных исходных материалов, были получены следующие соединения формулы II, в которых R11 является водородом (см. табл. C).
Ссылочный пример 3. К перемешанному охлажденному раствору 4-(4-хлоро- 2-метокси-3-метилсульфонилбензоил)-5-циклопропилизоксазола (2,66 г) в дихлорметане при 2oC добавляли 3,55 г 3-хлоро-пероксибензойной кислоты. Полученную смесь перемешивали 1 ч. Затем эту смесь фильтровали, промывали водой, водным раствором метабисульфита натрия, затем снова водой, а после этого осушали безводным сульфатом магния и фильтровали. Фильтрат выпарывали досуха и остаток очищали с помощью колоночной хроматографии на двуокиси кремния (элюент: смесь гексана и этилацетата) (7:3).
В результате этой процедуры получали белое твердое вещество. Это твердое вещество растворяли в этилацетате и промывали насыщенным бикарбонатом натрия и водой, а затем осушали безводным сульфатом магния и фильтровали. Фильтрат выпаривали досуха и получали 1,3 г 4-(4-хлоро-2-метокси-3-метилсульфонилбензоил)-5-циклопропилизоксазола в виде белого твердого вещества, т.пл. 133,2oC.
С использованием аналогичной процедуры, из соответствующим образом замещенных исходных материалов, были получены следующие соединения:
5-(4-метил-3-метилсульфонилфенил)-4-циклопропилкарбонилизоксазол (т.пл. 110,8-112,2oC) - из исходного 5-(4-метил-3- метилсульфенилфенил)-4-циклопропилкарбонилизоксазола;
5-(4-метил-3-метилсульфинилфенил)-4-циклопропилкарбонилизоксазол (т.пл. 169,2-172,6oC) - из 5-(4-хлоро-3-метилсульфенилфенил)-4- циклопропилкарбонилизоксазола.
Ссылочный пример 4. К смеси 3-циклопропил-2-этоксиметилен-1-(4- хлоро-3-метилсульфенилфенил)пропан-1,3-диона (12,3 г) и гидрохлорида гидроксиламина (3,0 г) в этаноле добавляли 3,0 г ацетата натрия. Полученную смесь перемешивали в течение ночи при комнатной температуре. Эту смесь фильтровали и образовавшееся твердое вещество промывали этанолом, а затем водой. После осушки получали 3,3 г 5-(4-хлоро-3-метилсульфенил)-4- циклопропилкарбонилизоксазола в виде белого твердого вещества, т.пл. 114,8-115,3oC.
Ссылочный пример 5. К раствору 3-циклопропил-1-(4-метил-3- метилсульфенилфенил)пропан-1,3-диона (8,71 г) в толуоле добавляли 6,0 мл диметилацеталя диметилформамида. Полученную смесь перемешивали при комнатной температуре в течение ночи. После этого добавляли 2,0 мл диметилацеталя диметилформамида и смесь перемешивали и нагревали при 50oC в течение 24 ч. Эту смесь охлаждали и выпаривали досуха, в результате чего получали 10,6 г 3-циклопропил-2-(N, N-диметиламинометилен)-1-(4- метил-3-метилсульфенилфенил)пропан-1,3-диона в виде коричневого маслообразного вещества.
С использованием аналогичной процедуры был получен 3-циклопропил- 2-(N-метиламинометилен)-1-(4-метокси-3-метилсульфонилфенил)пропан- 1,3-дион.
Ссылочный пример 6. Смесь 1-[4-хлоро-2-(метилсульфенил)-3- (пропилсульфенилфенил] - 3-циклопропилпропан-1,3-диона (3,4 г), триэтилортоформата (2,96 г) и уксусного ангидрида (3,06 г) перемешивали и нагревали с обратным холодильником в течение 3 ч. Полученную смесь охлаждали и выпаривали досуха.
Образовавшийся остаток растворяли в толуоле и снова выпаривали, в результате чего получали 4,4 г 1-[4-хлоро-2-метилсульфенил-3- пропилсульфенилфенил] -2-этоксиметилен-3-циклопропилпропан-1,3- диона в виде красного маслообразного вещества, которое использовали без очистки.
С использованием аналогичной процедуры и соответствующим образом замещенных исходных материалов были получены следующие соединения формулы (X), в которых L представляет собой этоксигруппу (см. табл. D).
Ссылочный пример 7. Суспензию магния (2,4 г) в метаноле слегка нагревали для инициации реакции и добавляли т-бутил-3-циклопропил- 3-оксопропионат (18,4 г). Полученную смесь перемешивали в течение 0,75 ч, после чего метанол выпаривали. Затем добавляли толуол и смесь снова выпаривали для удаления последних следовых количеств метанола. Остаток суспендировали в ацетонитриле и добавляли раствор 4-метил-3-метилсульфенилбензоил-хлорида (20,0 г) в ацетонитриле. Полученную смесь перемешивали при комнатной температуре в течение ночи.
Затем добавляли соляную кислоту (2М) и смесь перемешивали в течение часа. Эту смесь экстрагировали этилацетатом, промывали водным раствором хлорида натрия, осушали сульфатом магния и фильтровали. Фильтрат выпаривали досуха и получали оранжевое маслообразное вещество. Затем это вещество растворяли в толуоле и добавляли 1,5 г 4-толуол-сульфоновой кислоты. Полученную смесь нагревали с обратным холодильником в течение 4 ч, охлаждали до комнатной температуры и выпаривали досуха.
Образовавшийся остаток растворяли в этилацетате и промывали водой и водным раствором хлорида натрия, а затем осушали сульфатом магния и фильтровали. Фильтрат выпаривали досуха. Остаток очищали с помощью хроматографии (элюент: смесь этилацетата и циклогексана), в результате чего получали 3-циклопропил-1-(4-метил-3-метилсульфенилфенил) пропан-1,3-диона (9,99 г) в виде коричневого маслообразного вещества.
1H-ЯМР (CDCl3): δ 0,9-1,05 (м, 2H), 1,15-1,25 (м, 2H), 1,75-1,85 (м, 1H), 2,4 (с, 3H), 2,5 (с, 3H), 6,25 (с, 1H), 7,2 (д, 1H), 7,5 (д, 1H), 7,65 (с, 1H), 16,2-16,4 (шир. с, 1H).
С использованием аналогичной процедуры и соответствующим образом замещенных исходных материалов, был получен 3- циклопропил-1-(4-метокси-3-метилсульфонилфенил)-пропан-1,3- дион.
ЯМР (CDCl3): 0,95 (м, 2H), 1,2 (м, 2H), 1,8 (м, 2H), 3,7 (с, 3H), 4,05 (с, 3H), 6,3 (с, 1H), 7,1 (д, 1H), 8,15 (д, 1H), 8,45 (д, 1H), 16,3 (шир. с. , 1H).
Бензоилхлориды были получены из соответствующим образом замещенных бензойных кислот путем нагревания этих кислот с обратным холодильником в тионилхлориде. Избыточное количество тионилхлорида удаляли путем выпаривания и остаточные продукты (бензоилхлориды) использовали без дополнительной очистки.
Ссылочный пример 8. Смесь магния (0,33 г) и метанола, содержащего тетрахлорметан (0,1 г) нагревали с обратным холодильником в течение получаса. После этого по капле добавляли 2,4 г т-бутил-3-циклопропил-3-оксопропионата и полученную суспензию нагревали с обратным холодильником в течение 1 часа.
Эту суспензию охлаждали и выпаривали досуха. Остаток растворяли в толуоле и добавляли 3,24 г 4-хлоро-2-(метил-сульфенил)-3- (пропилсульфенил)бензоилхлорида. Полученную смесь перемешивали в течение ночи при комнатной температуре. После этого добавляли соляную кислоту (2М) и смесь перемешивали в течение получаса.
Слои отделяли, а органический слой промывали водой и осушали путем азеотропного удаления воды с использованием аппарата Дина-Старка. К смеси добавляли 0,1 г 4-толуолсульфоновой кислоты и смесь нагревали с обратным холодильником в течение 2 ч. Смесь охлаждали, промывали водой, осушали безводным сульфатом натрия и фильтровали. Фильтрат обрабатывали углем и фильтровали через двуокись кремния (Hyflo), а затем выпаривали. В результате этой процедуры получали 1-[4-хлоро-2-метилсульфенил-3-пропилсульфенил- фенил]-3-циклопропилпропан-1,3-дион в виде маслообразного вещества коричневого цвета.
ЯМР (CDCl3): 1,0 (м, 5H), 1,2 (м, 2H), 1,6 (м, 2H), 1,7 (м, 1H), 2,45 (с, 3H), 2,9 (т, 2H), 6,05 (с, 1H), 7,25 (д, 1H), 7,55 (д, 1H), 16 (шир. с, 1H).
С использованием аналогичной процедуры и соответствующим образом замещенных исходных материалов были получены следующие соединения формулы (XI) (см. табл. E).
Ссылочный пример 9. К перемешанному раствору гидрида натрия (80%-ная дисперсия в масле) (4,20 г) в тетрагидрофуране, по капле в течение 2,5 ч, добавляли раствор циклопропилметилкетона (10,86 г) и метил (3-метилсульфенил-4-хлоро)бензоата (14,0 г) в третрагидрофуране.
Полученную смесь перемешивали при нагревании с обратным холодильником еще в течение 1,5 ч, а затем оставляли для охлаждения в течение ночи. После этого добавляли соляную кислоту (2М). Полученную смесь экстрагировали этилацетатом. Органический экстракт промывали водой, осушали безводным сульфатом магния и фильтровали. Фильтрат выпаривали досуха. Остаток очищали с помощью колоночной хроматографии на двуокиси кремния (элюент: циклогексан и этилацетат, 10: 1) и получали 11,3 г 3-циклопропил-1-(4- хлоро-3-метилсульфенилфенил)пропан-1,3-диона в виде твердого вещества, т.пл. 76,5-79,4oC.
Ссылочный пример 10. При температуре 0 - 5oC к перемешанной и охлажденной суспензии 3-амино-4-метилбензойной кислоты (30,23 г) в смеси уксусной кислоты и концентрированной соляной кислоты, добавляли 14,5 г раствора нитрита натрия в воде. Полученную смесь перемешивали при 0-5oC в течение часа, а затем добавляли к перемешанной смеси диметилдисульфида и медного порошка (0,25 г) в уксусной кислоте, поддерживая при этом температуру около 35oC.
Затем, на всем протяжении реакции, к смеси добавляли 3 г медного порошка для того, чтобы продолжалось выделение газа. После этого смесь перемешивали еще 1 ч, после чего ее выливали в воду, а твердый осадок отфильтровывали. После обработки этилацетатом и гексаном, смесь нагревали, а нерастворимые вещества отфильтровывали. В результате этой процедуры получали 19,5 г 4- метил-3-метилсульфенилбензойной кислоты в виде белого твердого вещества, т. пл. 174,6-175,2oC.
С использованием аналогичной процедуры, из соответствующим образом замещенных исходных материалов, были получены следующие соединения:
4-хлоро-3-метилсульфенилбензойная кислота (белое твердое вещество, т.пл. 208,0-209,3oC) - из 3-амино-4-хлоробензойной кислоты;
4-метокси-3-метилсульфенилбензойная кислота - из 3-амино-4- метоксибензойной кислоты.
Ссылочный пример 11. К перемешанному раствору 4-хлоро-3-фторо-2- метилсульфенилбензойной кислоты (4,4 г) и этилмеркаптана (3,73 г) в N,N-диметилформамиде, добавляли гидроксид лития (3,35 г). Полученную смесь перемешивали и нагревали при 80oC в течение ночи. После этого добавляли дополнительную порцию этилмеркаптана (0,6 г) и гидроксида лития (1,26 г). Смесь нагревали при 80oC в течение ночи, а затем охлаждали и выливали в воду. Затем эту смесь подкисляли до pH 1, путем добавления соляной кислоты (2 М) и экстрагировали эфиром.
Органический экстракт промывали водой, осушали безводным сульфатом натрия и фильтровали. Фильтрат выпаривали досуха, а после этого перетирали с гексан-4-хлоро-3-этилсульфенил-3-метилсульфенилбензойной кислотой (2,57 г), в результате чего получали белое твердое вещество.
ЯМР (CDCl3): 1,25 (т, 3H), 2,55 (с, 3H), 3,0 (кв., 2H), 7,5 (д, 1H), 7,85 (д, 1H).
С использованием аналогичной процедуры 4-хлоро-2-метилсульфенил- 3-пропилсульфенилбензойную кислоту (т.пл. 92-93oC) получали из 4-хлоро-3-фторо-2-метилсульфенилбензойной кислоты.
Ссылочный пример 12. К перемешанному раствору 3-фторо-4- метилсульфенил-2-трифторометилбензойной кислоты (2,5 г) в N,N-диметилформамиде добавляли 3,5 г тиометоксида натрия. Полученную смесь нагревали в течение 5 ч при 70oC, а затем в течение 4 ч при 110oC. После охлаждения смесь разбавляли водой и экстрагировали эфиром.
Органический экстракт промывали водой, осушали безводным сульфатом магния и фильтровали. Фильтрат выпаривали досуха и полученный остаток очищали с помощью колоночной хроматографии на двуокиси кремния (элюент: этилацетат).
В результате этой процедуры получали 0,8 г 3,4-бисметилсульфенил-2-трифторометилбензойной кислоты в виде твердого вещества бежевого цвета.
ЯМР (d6-ацетон): 1,3 (с, 3H), 1,4 (с, 3H), 7,5 (д, 1H), 8,1 (д, 1H).
Ссылочный пример 13. При температуре ниже -70oC к перемешанному, охлажденному раствору 6-бромо-2-фторо-3-(метилсульфенил) бензотрифторида (30,6 г) в эфире добавляли n-бутиллитий (2,5 М в гексане, 51 мл). После этого смесь перемешивали при -78oC в течение 4 ч, а затем выливали на гранулированную двуокись углерода. Смесь перемешивали 2 часа и разбавляли водой. После промывки смеси эфиром, водный слой подкисляли, экстрагировали эфиром, промывали водой, осушали сульфатом магния и фильтровали.
Фильтрат выпаривали досуха и получали 23,4 г 3-фторо-4- (металсульфенил)-2-трифторометилбензойной кислоты в виде твердого вещества бежевого цвета.
ЯМР (ДМСО-d6): 3,14 (с, 3H), 7,99 (д, 1H), 8,19 (т, 1H).
Ссылочный пример 14. При температуре ниже 5oC к перемешанной и охлажденной суспензии 4-бромо-2-фторо-3-трифторометиланилина (40 г) в ледяной уксусной кислоте добавляли раствор нитрита натрия (11,2 г) в концентрированной серной кислоте. Полученную смесь перемешивали при 5oC в течение 1,5 ч. После этого смесь постепенно добавляли к смеси диметилдисульфида (20 мл) и медного порошка (0,224 г) в ледяной уксусной кислоте при 45oC.
Полученную таким образом смесь перемешивали и нагревали при 70oC в течение 3 ч, а затем охлаждали, выливали в воду, экстрагировали эфиром, промывали водой, осушали сульфатом магния и фильтровали. Фильтрат выпаривали досуха и очищали с помощью колоночной хроматографии (элюент: петролейный эфир (т.кип. 60-80oC)).
В результате этой процедуры получали 30,6 г 6-бромо-2-фторо-3- (метилсульфенил)бензотрифторида в виде оранжевого маслообразного вещества.
ЯМР (CDCl3): 2,45 (с, 3H), 7,25 (т, 1H), 7,5 (д, 1H).
Ссылочный пример 15. Раствор N-бромосукцинимида (24,9 г) в N,N-диметилформамиде добавляли к раствору 2-фторо-3- трифторометиланилина (25 г) в диметилформамиде. Полученную смесь перемешивали 4,5 ч, выливали в воду и образовавшееся маслообразное вещество отделяли. Водные слои экстрагировали эфиром, а объединенные органические слои промывали водой, осушали сульфатом магния и фильтровали. Фильтрат выпаривали досуха, а остаток подвергали дистилляции, в результате чего получали 27,44 г 4-бромо-2-фторо-3-трифторометиланилина в виде оранжевого маслообразного вещества, т.кип. 88-94oC/4 мБар.
Ссылочный пример 16. В атмосфере инертного газа к перемешанному раствору 1-хлоро-3-фторобензола (10 г) в тетрагидрофуране (при - 78oC) добавляли n-бутиллитий (37 мл, 2,5 М в гексане).
После этого смесь перемешивали при -78oC в течение 3 ч, а затем добавляли 17,1 г диметилдисульфида.
Полученную смесь нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь гасили водой и экстрагировали эфиром. Органический экстракт промывали водой, осушали безводным сульфатом магния и фильтровали. Фильтрат выпаривали досуха, в результате чего получали 13,4 г 2-хлоро-6-фторотианизола в виде прозрачного маслоообразного вещества.
ЯМР (CDCl3): 2,5 (с, 3H), 7,0 (м, 1H), 7,25 (м, 2H).
Ссылочный пример 17. В атмосфере инертного газа (при -78oC) к перемешанному раствору 2-хлоро-6-фторотиоанизола (13,4 г) в тетрагидрофуране добавляли 36 мл n-бутиллития (2,5 М в гексане). Смесь перемешивали при -78oC в течение 3 ч, а затем выливали в 40 г твердой двуокиси углерода. Полученную смесь нагревали до комнатной температуры и выпаривали. Образовавшийся остаток суспендировали в эфире и промывали водой.
Водный экстракт промывали, подкисляли до pH 1 путем добавления соляной кислоты и экстрагировали эфиром. Органический экстракт промывали водой, осушали безводным сульфатом магния и фильтровали. Фильтрат выпаривали досуха, а остаток перетирали с гексаном, в результате чего получали 4-хлоро-2-фторо-3- метилсульфенилбензойную кислоту в виде белого твердого вещества, т. пл. 183-185oC.
Ссылочный пример 18. Суспензию 4-хлоро-2-фторо-3- метилсульфенилбензойной кислоты (21,1 г) в тионилхлориде (200 мл) нагревали с обратным холодильником в течение 5 ч. После охлаждения смесь выпаривали досуха. Полученный остаток суспендировали в толуоле и снова выпаривали досуха. В результате этой процедуры получали 22,9 г 4-хлоро-2-фторо-3-метилсульфенил- бензоилхлорида в виде прозрачного маслообразного вещества.
Ссылочный пример 19. При 0oC к раствору 2-амино-3-метилпропанола (17 г) в дихлорметане добавляли 22,9 г раствора 4-хлоро-2-фторо-3- метилсульфенилбензоилхлорида в дихлорметане. Смесь перемешивали в течение ночи при комнатной температуре. Полученную суспензию фильтровали, а фильтрат выпаривали досуха, в результате чего получали 27,8 г N-(2,2-диметил-1- гидроксиэтил)-4-хлоро-2-фторо-3-метилсульфенилбензамида в виде камеди коричневого цвета.
ЯМР (CDCl3): 1,45 (с, 6H), 2,4 (с, 3H), 3,7 (с, 2H), 6,7 (шир. д., 1H), 7,25 (дд, 1H), 7,9 (т, 1H).
Ссылочный пример 20. При перемешивании к N-(2,2-диметил-1- гидроксиэтил)-4-хлоро-2-фторо-3-метилсульфенилбензамиду (27,8 г) добавляли 40 г тионилхлорида. После этого смесь перемешивали в течение часа, медленно добавляли к воде и экстрагировали эфиром. Водный слой подщелачивали двумя молями гидроксида натрия и экстрагировали дихлорметаном.
Органический экстракт промывали водой, осушали безводным сульфатом магния и фильтровали. Фильтрат выпаривали досуха, а остаток очищали с помощью колоночной хроматографии на двуокиси кремния (элюент: смесь эфира и гексана, 1: 9), в результате чего получали 12,8 г 2-(4-хлоро-2-фторо-3-метилсульфенилфенил)-4,4- диметил-2-оксазолина в виде желтого твердого вещества с т.пл. 41,4-42,1oC.
Ссылочный пример 21. При нагревании с обратным холодильником, по капле, к суспензии магния (4,3 г) и кристалла йода в эфире добавляли метилиодид (25,1 г). Полученную смесь нагревали с обратным холодильником в течение часа, а затем добавляли к раствору 2-(4-хлоро-3-фторо-3-метилсульфенилфенил)-4,4-диметил-2-оксазолина (13,5 г) в эфире. После этого смесь перемешивали в течение ночи, а затем медленно выливали в смесь льда и соляной кислоты (2 М).
Полученную таким образом смесь нейтрализовали путем добавления гидроксида натрия (2 М) и экстрагировали эфиром. Органический экстракт осушали безводным сульфатом магния и фильтровали. Фильтрат выпаривали досуха и получали 12,4 г 2-(4-хлоро-2-метил-3- метилсульфенилфенил)-4,4-диметил-2-оксазолина в виде желтого маслообразного вещества.
ЯМР (CDCl3): 1,3 (с, 6H), 2,2 (с, 3H), 2,7 (с, 3H), 3,95 (с, 2H), 7,2 (д, 1H), 7,4 (д, 1H).
Ссылочный пример 22. 2-(4-Хлоро-2-метил-3-метилсульфенилфенил)- 4,4-диметил-2-оксазолин (12,4 г) и раствор соляной кислоты (364 мл, 5 М) нагревали с обратным холодильником в течение ночи. После охлаждения, смесь экстрагировали этилацетатом, осушали безводным сульфатом магния и фильтровали. Фильтрат выпаривали досуха и получали 4-хлоро-2-метил-3-метилсульфенилбензойную кислоту (10,0 г) в виде коричневого твердого вещества, т.пл. 131,5oC.
Ссылочный пример 23. 4-Хлоро-2-фторо-3-метилсульфенилбензоилхлорид (19,9 г) и метанол перемешивали в течение ночи при комнатной температуре. Полученную смесь выпаривали досуха, а остаток растворяли в эфире, промывали насыщенным бикарбонатом натрия, водой, осушали безводным сульфатом магния и фильтровали. Фильтрат выпаривали досуха и получали метил-4-хлоро-2-фторо-3-метилсульфенилбензоат (19,2 г) в виде желтого маслообразного вещества.
ЯМР (CDCl3): 2,5 (с, 3H), 4,0 (с, 3H), 7,3 (дд, 1H), 7,8 (т, 1H).
Ссылочный пример 24. К раствору метил-4-хлоро-2-фторо-3- метилсульфенилбензоата в тетрагидрофуране добавляли метоксид натрия (5,6 г). Полученную смесь перемешивали в течение ночи при комнатной температуре, разбавляли водой и экстрагировали эфиром. Органический экстракт осушали безводным сульфатом магния и фильтровали. Фильтрат выпаривали досуха и получали 4-хлоро-2-метокси-3-метилсульфенилбензоат (17,1 г) в виде желтого маслообразного вещества.
ЯМР (CDCl3): 2,5 (с, 3H), 3,9 (с, 3H), 4,0 (с, 3H), 7,2 (д, 1H), 7,65 (д, 1H).
Ссылочный пример 25. Раствор метил-4-хлоро-2-метокси-3- метилсульфенилбензоата (6 г) и гидроксида натрия (12 г) в метаноле и воде перемешивали при комнатной температуре в течение 2 ч. Полученную смесь выпаривали, а остаток суспендировали в воде и подкисляли путем добавления соляной кислоты (2 М) до pH 1. Образовавшееся твердое вещество фильтровали, промывали водой и осушали в вакуумной печи, в результате чего получали 4,95 г 4-хлоро-2-метокси-3-метилсульфенилбензойной кислоты в виде белого твердого вещества, т. пл. 131-132oC.
Ссылочный пример 26. Раствор 4-метокси-3-метилсульфенилбензойной кислоты (27,3 г) и серной кислоты (10 мл) в метаноле нагревали с обратным холодильником в течение ночи. После охлаждения смесь выпаривали, разбавляли водой и экстрагировали этилацетатом. Органический экстракт промывали раствором бикарбоната натрия, водой и солевым раствором, а затем осушали безводным сульфатом магния и фильтровали. После выпаривания получали 26,39 г метил 4-метокси-3-метилсульфенилбензоата.
К раствору метил-4-метокси-3-метилсульфенилбензоата (13,7 г) в дихлорметане, добавляли 36 г 3-хлоропероксибензойной кислоты (55% чистого материала). После этого смесь перемешивали при комнатной температуре в течение ночи, а затем промывали насыщенным бикарбонатом натрия и солевым раствором. Затем эту смесь осушали безводным сульфатом магния и фильтровали. Фильтрат выпаривали досуха и получали метил 4-метокси-3-метилсульфонилбензоат (11,62 г) в виде белого твердого вещества с т.пл. 125,7-127,4oC.
Настоящее изобретение относится к способу борьбы с сорняками (т.е. нежелательной растительности), заключающемуся в том, что места произростания указанных сорняков обрабатывают гербицидно эффективным количеством, по крайней мере, одного 2-циано-1,3-дионового производного формулы (I) или его агрономически приемлемой соли, металлокомплекса или енольной таутомерной формы. Для этих целей 2-циано-1,3-дионовые производные обычно используют в виде гербицидных композиций (т. е. в сочетании с приемлемыми разбавителями и/или носителями и/или поверхностно-активными веществами, обычно применяемыми в гербицидных композициях), например, таких как композиции, описанные ниже.
Соединения формулы (I) обладает гербицидной активностью против двудольных (т.е. широколистных) и однодольных (т.е. травянистых) сорных растений при довсходовом и/или послевсходовом их применении.
Под термином "довсходовое применение" подразумевается внесение соединений в почву, в которой имеются семена сорняков или их подростки, до того как эти сорняки появятся над поверхностью почвы. Под термином "послевсходовое применение" подразумевается внесение указанных соединений с самолета или обработка отдельных участков уже появившихся на поверхности земли всходов сорных растений. Например, соединения формулы (I) могут быть использованы для борьбы против следующих сорняков:
широколистных сорняков, например, Abutilon theophrasti,
Amaranthus retroflexus, Bidens pilosa, Chenopodium album, Galium aparine, lpomoea spp. , например, lpomoea purpurea, Sesbania exaltata, Sinapis arvensis, Solanum nigrum и Xanthium strumarium, и
травянистых сорняков, например, Alopecurus myosuroides,
Avena fatua, Digitaria sanguinalis, Echinochloa crus-galli, Eleusine indica и Setaria spp., например, Setaria feberii или Setaria viridis;
осоки, например, Cyperus esculentus.
Количество вносимых соединений формулы (I) может варьироваться в зависимости от природы сорняка, используемой композиции, времени применения, климатических и эдафических (т.е. почвенных) условий и природы культурных растений (если борьбу с сорняками проводят в районах возделывания сельскохозяйственных культур). При применении указанных соединений на сельскохозяйственных угодьях необходимо следить, чтобы норма внесения этих соединений была достаточной для уничтожения сорняков, но при этом не оказывала значительного и длительного неблагоприятного воздействия на культурное растение. В основном, с учетом вышеуказанных факторов, норма внесения активного материала в пределах от 0,01 кг до 5 кг на гектар дает хорошие результаты.
Однако при этом следует отметить, что в зависимости от конкретных целей и условий могут быть использованы более высокие или более низкие нормы внесения активных соединений.
Соединения формулы (I) могут быть использованы для селективного подавления роста сорняков, например, для подавления роста вышеуказанных видов сорняков, путем направленного или ненаправленного опрыскивания участков зарастания сорняками, имеющихся на используемых площадях как при довсходовой, так и при послевсходовой обработке; либо они могут быть использованы для защиты культуры на корню, например, злаковых культур, таких как пшеница, ячмень, овес, кукуруза и рис; кормовых бобов и карликовой фасоли, гороха, люцерны, хлопка, арахиса, льна, лука, моркови, капусты, масличного рапса, подсолнечника, сахарной свеклы, долголетних пастбищ и сеяных лугов, как перед, так и после посева культурных растений, либо перед или после появления их всходов.
Для селективного уничтожения сорняков на участках их произрастания, которыми являются площади, используемые под сельскохозяйственные культуры, либо для защиты культурных растений на корню (например, вышеупомянутых культурных растений) могут быть применены дозы внесения активного материала, составляющие 0,01 - 4,0 кг, а предпочтительно 0,01 - 2 кг на гектар.
Соединения формулы (I) могут быть также использованы для подавления роста сорняков, в частности сорняков, упомянутых выше, посредством довсходовой или послевсходовой обработки площадей, занятых под плодовые деревья или лесные посадки, например, лесных массивов, зеленых зон и парков, а также плантаций, например, сахарного тростника, масличных пальм и каучуковых плантаций. Для этих целей соединения формулы (I) могут быть нанесены направленным или ненаправленным способом (например, путем направленного или ненаправленного опрыскивания) на деревья или почву, где, как предполагается, могут появиться сорняки как перед, так и после посадки деревьев или засева плантаций, при норме внесения активного материала 0,25 - 5 кг, а предпочтительно 0,5 - 4 кг на гектар.
Соединения формулы (I) могут быть также использованы для подавления роста сорняков, например, таких как были указаны выше, на участках, которые не являются сельскохозяйственными угодьями, но на которых тем не менее желательно проводить борьбу с сорняками.
Примерами таких не занятых под сельскохозяйственные культуры площадей являются взлетные полосы на аэродромах, промышленные площади, железнодорожные пути, обочины автотрасс, берега рек, ирригационные и другие водные сооружения, лесные массивы, земли под паром или неокультуренные земли, в частности площади, которые желательно защитить от зарастания сорными растениями во избежание пожаров.
При использовании активных соединений в указанных целях, то есть в тех случаях, когда желательно получить общий гербицидный эффект, норма внесения этих соединений может быть выше, чем норма, используемая для обработки сельскохозяйственных площадей (см. выше). В этих случаях точная доза будет зависеть от вида обрабатываемых сорняков и желаемого эффекта обработки.
Указанные цели могут быть с успехом достигнуты при довсходовой или послевсходовой обработке, а предпочтительно довсходовой обработке направленным или ненаправленным способом (например, путем направленного или ненаправленного опрыскивания) при дозах внесения 1 - 20 кг, а предпочтительно 5 - 10 кг активного материала на гектар.
При подавлении роста сорняков путем довсходовой обработки соединения формулы (I) могут быть внесены в почву, в которой, как предполагается, могут произрастать сорняки. При этом следует отметить, что при использовании соединений формулы (I) для борьбы с сорняками путем послевсходовой обработки, то есть путем внесения с самолета или путем обработки участков произрастания сорняков, эти соединения будут также контактировать с почвой, в результате чего они могут к тому же оказывать довсходовое ингибирующее действие на сорняки, прорастающие в более позднее время.
Если требуется воздействовать на более поздние виды сорняков, то соединения формулы (I) могут быть внесены повторно.
В соответствии с другим своим признаком, настоящее изобретение относится к композициям, которые могут быть использованы в качестве гербицидов и содержат одно или несколько 2-циано-1,3-дионовых производных формулы (I), либо их агрономически приемлемых солей, металлокомплексов или енольных таутомерных форм в сочетании с одним или несколькими совместимыми гербицидно приемлемыми разбавителями или носителями и/или поверхностно-активными веществами (т. е. разбавителями или носителями и/или поверхностно-активными веществами, обычно используемыми в гербицидных композициях и совместимыми с соединениями формулы (I)); при этом предпочтительно, чтобы вышеуказанные соединения были гомогенно диспергированы в упомянутых разбавителях, носителях и/или поверхностно-активных веществах.
Термин "гомогенно диспергированный", используемый по отношению к композициям, означает, что в этих композициях соединения формулы (I) растворены в других компонентах.
Термин "гербицидные композиции" используется в настоящем описании в широком смысле и означает не только композиции, уже готовые к использованию в качестве гербицидов, но и также концентраты, которые перед их использованием необходимо разводить. Указанные композиции содержат предпочтительно от 0,05 до 90 мас.% одного или нескольких соединений формулы (I).
Гербицидные композиции могут содержать разбавитель или носитель и поверхностно-активное вещество (ПАВ) (например, смачивающий, диспергирующий или эмульгирующий агент). Примерами ПАВ, которые могут быть использованы в гербицидных композициях настоящего изобретения, являются ионогенные или неионогенные ПАВ (такие как сульфорициноолеаты; производные четвертичного аммония; продукты, образованные в результате конденсации этиленоксида с алкил- и полиарилфенолами, например, нонил- или октил-фенолами; или карбоновые сложные эфиры ангидросорбитов, которые делаются растворимыми благодаря этерификации свободных гидроксильных групп посредством конденсации с этиленоксидом; щелочные или щелочноземельные металлические соли сложных эфиров серной кислоты и сульфоновых кислот, такие как сульфоносукцинаты динонил- и диокстил-натрия, и щелочные и щелочноземельные металлические соли высокомолекулярных производных сульфоновой кислоты, такие как лигносульфонаты натрия и кальция и алкилбензолсульфонаты натрия и кальция).
В соответствии с этим, гербицидные композиции настоящего изобретения могут содержать до 10 мас.%, например, от 0,05 до 10 мас.% поверхностно-активного агента, однако если это необходимо, то гербицидные композиции настоящего изобретения могут содержать и более высокие количества ПАВ, например, до 15 мас.% в концентратах в виде жидкой эмульгируемой суспензии и до 25 мас.% в водорастворимых концентратах.
Примерами подходящих твердых разбавителей или носителей могут служить силикат алюминия, тальк, оксид магния, кизельгур, трикальцийфосфат, измельченная в порошок пробка, адсорбент в виде углеродной сажи, и глины, такие как каолин и бентонит.
Твердые композиции (которые могут быть изготовлены в виде дустов, гранул или смачиваемых порошков) получают предпочтительно путем измельчения соединений формулы (I) с твердыми разбавителями либо путем пропитывания твердых разбавителей или носителей растворами соединений формулы (I) в летучих растворителях с последующим выпариванием растворителей и, если необходимо, измельчением полученных таким образом продуктов в порошок.
Гранулированные композиции могут быть получены путем адсорбирования соединений формулы (I) (растворенных в соответствующих растворителях, которые могут быть, если это необходимо, летучими) на твердых разбавителях или носителях в форме гранул и, если это необходимо, с последующим выпариванием растворителей либо путем гранулирования порошковых композиций, полученных как описано выше. Твердые гербицидные композиции, например, смачиваемые порошки и гранулы, могут содержать смачивающие или диспергирующие агенты (например, такие как указано выше), которые, если они используются в твердом виде, могут также служить в качестве разбавителей или носителей.
Жидкие композиции настоящего изобретения могут быть изготовлены в виде водных, органических или водоорганических растворов, суспензий и эмульсий, которые могут содержать поверхностно-активное вещество. Подходящими для использования в жидких композициях являются такие жидкие разбавители, как вода, гликоли, тетрагидрофуриловый спирт, ацетофенон, циклогексанон, изофорон, толуол, ксилол, минеральное, животное и растительное масло, легкие ароматические и нафталиновые фракции нефти (и смеси указанных разбавителей).
Поверхностно-активные вещества, используемые в жидких композициях настоящего изобретения, могут быть ионогенными или неионогенными (например, такими, как указано выше), а если они являются жидкими, то они также могут служить в качестве разбавителей или носителей.
Порошки, диспергируемые гранулы и жидкие композиции, изготовленные в виде концентратов, могут быть разведены водой или другими подходящими разбавителями, например, минеральными или растительными маслами, особенно в случае жидких концентратов, в которых разбавителем или носителем является масло, в результате чего могут быть получены уже готовые к использованию композиции.
Если необходимо, жидкие композиции соединений формулы (I) могут быть изготовлены в виде самоэмульгируемых концентратов, содержащих активные вещества, растворенные в эмульгаторах или в растворителях, содержащих эмульгаторы, совместимые с активными веществами; и после простого добавления к этим концентратам воды могут быть получены готовые для использования композиции.
Жидкие концентраты, в которых разбавителем или носителем является масло, могут быть использованы без дополнительного разведения с применением техники электростатического опрыскивания.
Гербицидные композиции настоящего изобретения могут также содержать, если необходимо, стандартные адъюванты, такие как адгезивы, защитные коллоиды, загустители, агенты для повышения проницаемости, стабилизаторы, пассиваторы, средство против слеживания, красители и ингибиторы коррозии. Указанные адъюванты могут также служить в качестве носителей или разбавителей.
Предпочтительными гербицидными композициями настоящего изобретения являются следующие композиции (если это не указано особо, то все нижеприведенные процентные содержания даны по массе):
водные суспензионные концентраты, которые содержат 10 - 70% одного или нескольких соединений формулы (I); 2 - 10% поверхностно-активного вещества; 0,1 - 5% загустителя и 15 - 87,9% воды;
смачиваемые порошки, которые содержат 10 - 90% одного или нескольких соединений формулы (I); 2 - 10% поверхностно-активного вещества и 8 - 88% твердого разбавителя или носителя;
растворимые порошки, которые содержат 10 - 90% одного или нескольких соединений формулы (I); 2 - 40% карбоната натрия и 0 - 88% твердого наполнителя;
жидкие водорастворимые концентраты, которые содержат 5 - 50%, например 10 - 30%, одного или нескольких соединений формулы (I); 5 - 25% поверхностно-активного вещества и 25 - 90%, например 45 - 85%, смешиваемого с водой растворителя, например диметилформамида, или смеси смешиваемого с водой растворителя и воды;
жидкие эмульгируемые суспензионные концентраты, которые содержат 10 - 70% одного или нескольких соединений формулы (I); 5 - 15% поверхностно-активного вещества; 0,1 - 5% загустителя и 10 - 84,9% органического растворителя;
гранулы, которые содержат 1 - 90%, например 2 - 10%, одного или нескольких соединений формулы (I); 0,5 - 7%, например 0,5 - 2%, поверхностно-активного вещества; и 3 - 98,5%, например 88 - 97,5%, гранулированного носителя; и
эмульгируемые концентраты, которые содержат 0,05 - 90%, а предпочтительно 1 - 60% одного или нескольких соединений формулы (I); 0,01 - 10%, a предпочтительно 1 - 10% поверхностно-активного веществам и 9,99 - 99,94%, а предпочтительно 39 - 98,99% органического растворителя.
Гербицидные композиции настоящего изобретения могут также содержать соединения формулы (I) в сочетании с одним или несколькими другими пестицидно активными соединениями и, если необходимо, с одним или несколькими совместимыми пестицидно приемлемыми разбавителями или носителями, поверхностно-активными веществами, и стандартными адъювантами, указанными выше; при этом, предпочтительно, чтобы вышеупомянутое соединение формулы (I) было гомогенно диспергировано в смеси перечисленных ингредиентов.
Примерами других пестицидно активных соединений, которые могут быть использованы в гербицидных композициях настоящего изобретения или в сочетании с ними в целях расширения диапазона уничтожаемых видов сорняков, являются следующие гербициды:
алахлор, [2-хлоро-2,6'-диэтил-N-(метокси-метил)-ацетанилид];
атразил, [2-хлоро-4-этиламино-6-изопропиламино-1,3,5-триазин];
бромоксинил, [3,5-дибромо-4-гидроксибензонитрил];
хлортолурон, [N'-(3-хлоро-4-метилфенил)-N,N-диметилмочевина];
цианазин, [2-хлоро-4-(1-циано-1-метилэтиламино)-этиламино-1,3,5- триазин];
2,4-D, [2,4-дихлорофенокси-уксусная кислота];
дикамба, [3,6-дихлоро-2-метоксибензойная кислота];
дифензокват, [1,2-диметил-3,5-дифенил-пиразолиевые соли];
флампрометил, [метил N-2-(N-бензоил-3-хлоро-4-фтороанилино)- пропионат];
флуометурон, [N'-(3-трифторометилфенил)-N,N-диметилмочевина];
изопротурон, [N'-(4-изопропилфенил)-N,N-диметилмочевина];
никосульфурон, [2-(4,6-диметоксипиримидин-2-ил- карбамоилсульфамоил)-N, N-диметилникотинамид];
инсектициды, например, синтетические пиретроиды, такие как перметрин и циперметрин; фунгициды, например, карбаматы, такие как метил N-(1-бутил-карбамоил-бензимидазол-2-ил)карбамат; и триазолы, такие как 1-(4-хлорофенокси)-3,3-диметил-1-(1,2,4-триазол-1-ил)- бутан-2-он.
Пестицидно активные соединения и другие биологически активные материалы, которые могут быть включены в состав гербицидных композиций настоящего изобретения или использованы в сочетании с ними (например, такие как указано выше) и которые являются кислотами, могут быть, если это необходимо, получены в виде соответствующих производных, например солей щелочных металлов и амина, и сложных эфиров.
В соответствии с другим признаком настоящее изобретение относится к промышленному продукту, содержащему, по крайней мере, одно из 2-циано-1,3-дионовых производных формулы (I) или его агрономически приемлемую соль, металлокомплекс или енольную таутомерную форму либо, что предпочтительно, гербицидную композицию, описанную выше, а предпочтительно гербицидный концентрат, который перед использованием необходимо разводить и который содержит, по крайней мере, одно из 2-циано-1,3-дионовых производных формулы (I), находящееся внутри контейнера, предназначенного для вышеуказанного производного или
производных формулы (I), либо указанную гербицидную композицию; а также инструкции, непосредственно прилагаемые к этому контейнеру, составляющему вместе с этими инструкциями и содержащимся в нем вышеуказанным производным (или производными) формулы (I) или гербицидной композицией комплект, предназначенный для использования в целях борьбы с сорняками.
Указанными контейнерами могут служить емкости, обычно используемые для хранения химических веществ (которые являются твердыми при нормальной температуре окружающей среды) и гербицидных композиций (в основном, в виде концентратов), например, такие как жестяные ящики и металлические канистры, которые изнутри могут быть покрыты лаком, пластиковые материалы, бутыли или стеклянные и пластиковые упаковки, и если содержимое контейнера является твердым (например, в случае гранулированных гербицидных композиций), то могут быть использованы коробки, например, из картона, пластмассы и металла, или мешки.
Указанные контейнеры должны иметь емкость, достаточную для содержания определенного количества 2-циано-1,3-дионового производного или гербицидных композиций, необходимого для обработки, по крайней мере, одного акра земли в целях уничтожения сорняков; однако эта емкость не должна превышать размеры, соответствующие стандартным требованиям транспортировки.
Указанные инструкции обычно непосредственно прилагаются к контейнеру. Они могут быть, например, напечатаны на самом контейнере, либо на ярлыке или на бирке, прикрепленных к контейнеру.
В этих инструкциях обычно указывается, какое содержимое контейнера (после разведения, если оно необходимо) требуется для обработки в целях борьбы с сорняками при норме расхода 0,01 - 20 кг активного материала на гектар в соответствии с вышеописанными процедурами и целями.
Композиции настоящего изобретения иллюстрируются в нижеприведенных примерах:
Пример 5. Смачиваемый порошок получали из следующих ингредиентов, мас.%:
Активный ингредиент (соединение 1) - 50
Конденсат нонифенола/этиленоксида, содержащий 9 М этиленоксида на 1 М фенола, тонкоизмельченный (микрочастицы) - 5
Диоксид кремния - 5
Синтетический силикат магния (носитель) - 40
путем абсорбирования конденсата на диоксиде кремния, с по следующим смешиванием с другими ингредиентами, а затем путем размалывания на молотковой мельнице с образованием смачиваемого порошка.
Повторяя процедуру, описанную выше, и используя вместо 2-циано-1,3-диона (соединение 1) другие соединения формулы (I), получали аналогичные смачиваемые порошки.
Пример 6. Концентрат в виде водной суспензии получали из следующих компонентов:
Активный ингредиент (соединение 1), мас.% - 50
Конденсат нонилфенола/этиленоксида, содержащий 9 М этиленоксида на 1 М фенола, мас./об.% - 1
Натриевая соль поликарбоновой кислоты, мас./об.% - 0,2
Этиленгликоль, мас./об.% - 5
Ксантановая камедь, полисахарид (загуститель), мас./об.% - 0,15
Вода, об.% - до 100
путем тщательного размешивания ингредиентов и измельчения в течение 24 ч в шаровой мельнице.
Повторяя процедуру, описанную выше, и используя вместо 2-циано-1,3- диона (соединение 1) другие соединения формулы (I), получали аналогичные водные концентраты.
Пример 7. Водорастворимый концентрат получали из следующих компонентов:
Активный ингредиент (соединение 1), мас./об.% - 20
Раствор гидроксида калия, мас./об.% - 33
Тетрагидрофурфуриловый спирт (ТГФС), об./об.% - 10
Вода, об.% - до 100
При перемешивании ТГФС, активного ингредиента (соединение 1) и 90% по объему воды, медленно добавляли раствор гидроокиси калия до достижения pH 7-8, а затем доводили водой до 100% объема.
Подобные растворимые концентраты могут быть получены по вышеописанной методике из других соединений общей формулы I.
Пример 8. Эмульсионный концентрат готовили из следующих компонентов:
Соединение 1, вес./об.% - 10
Синпероник N РЕ 1800(ПАВ), вес./об.% - 4,9
Эрилан СА (ПАВ), % - 5,0
Циклогексанон (растворитель), % - 9,8
н-Метилпирролидин (растворитель), % - 9,8
Solvesso 150, % - 5,0
Вода, об.% - до 100
Подобные эмульсионные концентраты получали и из других соединений формулы I.
Пример 9. Диспергируемые смачиваемые гранулы получали из следующих компонентов, мас.%:
Активный ингредиент (соединение 1) - 75
REAX 88A (ПАВ) - 10
Sellogen HR (ПАВ) - 3
Barden AG 1 (Глина) - 11
Аэросил R 972 (кремниевый наполнитель) - 1,0
Пример 10. Водорастворимый порошок получают из следующих компонентов, мас.%:
Активный ингредиент (соединение 1) - 50
Натрия додецил бензолсульфонат - 1
Мелкодисперсный диоксид кремния - 2
Бикарбонат натрия - 47
Смешением ингредиентов и перемалыванием вышеуказанной смеси в молотковой мельнице.
Подобные водорастворимые порошки могут быть получены как описано выше из любого из соединений формулы I.
Характерное соединение формулы (I) было использовано для гербицидной обработки в соответствии со следующими процедурами.
Метод использования гербицидных соединений
Гербицидная активность
Соответствующие количества соединения, используемого для обработки растения, растворяли в ацетоне и получали растворы, эквивалентные норме применения до 1000 г соединений, используемых для обработки растения, на гектар (г/га). Эти растворы использовали в количестве 260 л жидкости для опрыскивания на гектар.
(a) Довсходовая обработка в целях борьбы с сорняками
Семена (сорняков или культурных растений) высевали в горшки с суглинистой почвой. Соединения настоящего изобретения наносили на поверхность почвы, как описано выше.
(b) Послевсходовая обработка в целях борьбы с сорняками
Несколько видов сорняков выращивали до тех пор, пока они не достигали стадии, подходящей для опрыскивания соединением настоящего изобретения. Это опрыскивание проводили на следующих стадиях роста растений:
(1) Широколистные сорняки:
Abutilon theophrasti - 1 - 2 листа
Amaranthus retroflexus - 1 - 2 листа
Galium aparine - 1 - 2 мутовки
Sinapis arvensis - 2 листа
Ipomoea purpurea - 1 - 2 листа
Xanthium strumarium - 2 листа
(2) Травянистые сорняки:
Alopecurus myosuroides - 2 листа
Avena fatua - 1 - 2 листа
Echinochloa crus-galli - 2 - 3 листа
Setaria viridis - 2 - 3 листа
(3) Осокообразные:
Cyperus esculentus - 3 листа
c) Толерантность культурных растений
Соединения настоящего изобретения использовали для довсходовой обработки (как описано в п. (a)) или послевсходовой обработки (на стадии 3 листа), следующих культурных растений: пшеницы, кукурузы, риса, сои и хлопчатника.
Один горшок с каждым видом растения был предназначен для контрольной обработки без опрыскивания и один горшок для контрольной обработки с опрыскиванием лишь одним ацетоном.
После обработки горшки помещали в теплицу и поливали с помощью дождевальной установки.
Через 17-20 дней после опрыскивания проводили визуальные оценки фитотоксичности. Результаты эксперимента по борьбе с сорняками выражали как процент снижения роста или уничтожения сорняков по отношению к контрольным растениям. Толерантность культурных растений выражали как процент повреждения, ведущего к снижению урожая.
При использовании нормы внесения 1 кг/га или менее соединения 1-10 дали, по меньшей мере, 90% уничтожения одного или нескольких из перечисленных выше видов сорняков; при этом указанные соединения показали также селективность в отношении одного или нескольких из перечисленных выше культурных растений.
Результаты испытаний активности против Echinochloa Crus-galli в дозе 50 г/га, выраженные в % подавления или уничтожения, относительно контрольных растений, для ряда соединений 1 приведены в табл. G.






Описываются новые производные 2-циано-1,3-диона формулы I, где R представляет циклоалкильную группу, содержащую 3 - 6 атомов углерода; R1 - атом водорода или прямую или разветвленную алкильную группу, содержащую до 6 атомов углерода, которая замещена группой -ОR5, где R5 представляет прямую или разветвленную алкильную группу, содержащую до 6 атомов углерода, которая необязательно замещена одним или несколькими атомами галогена, которые могут быть одинаковыми или различными, или R1 представляет группу, выбранную из R5, нитро, -S(O)pR5, -ОR5; R2 представляет атом галогена или водорода или группу, выбранную из R5, -ОR5, -S(O)qR5; R3 - атом водорода; R4 представляет прямую или разветвленную алкильную группу, содержащую до 6 атомов углерода; n = 0, 1 или 2; p = 0; q = 0, или его сельскохозяйственно-приемлемая соль, проявляющие гербицидную активность. Описывается также способ их получения, гербицидная композиция и способ подавления сорняков. Технический результат - повышение эффективности гербицидной композиции по сравнению с известным. 5 с. и 6 з.п. ф-лы, 6 табл.

где R представляет циклоалкильную группу, содержащую 3 - 6 атомов углерода;
R1 - атом водорода или прямая или разветвленная алкильная группа, содержащая до 6 атомов углерода, которая замещена группой -OR5, где R5 представляет прямую или разветвленную алкильную группу, содержащую до 6 атомов углерода, которая необязательно замещена одним или несколькими атомами галогена, которые могут быть одинаковыми или различными, или R1 представляет группу, выбранную из R5, нитро, -S(O)qR5, -OR5;
R2 представляет собой атом галогена или водорода или группу, выбранную из R5, -OR5; -S(O)cR5;
R3 - атом водорода;
R4 - прямая или разветвленная алкильная группа, содержащая до 6 атомов углерода;
n = 0, 1 или 2;
p = 0,
q = 0,
или его сельскохозяйственно-приемлемая соль.
или его сельскохозяйственно-приемлемая соль.
где R, R1 - R4 и n определены в п.1;
R11 является атомом водорода,
с основанием и необязательное преобразование полученного соединения в сельскохозяйственно-приемлемую соль.
где R, R1 - R4 и n определены в п.1;
R11 определен в п.6,
с основанием и необязательное преобразование полученного соединения в сельскохозяйственно-приемлемую соль.
| Способ усиления оптических сигналов | 1971 |
|
SU496630A1 |
| УСТРОЙСТВО для ОЦЕНКИ ДОСТОВЕРНОСТИ БИНАРНЫХ СИГНАЛОВ ЧАСТОТНОЙ ТЕЛЕГРАФИИ | 0 |
|
SU351332A1 |
| Гербицидный состав | 1977 |
|
SU638235A3 |
| SU 1292658 A2, 23.02.87 | |||
| US 4681621 A, 21.07.87 | |||
| СОСТАВ ТЕСТА ДЛЯ ПРОИЗВОДСТВА МАКАРОННЫХ ИЗДЕЛИЙ | 2004 |
|
RU2265371C1 |
| US 5097068 A, 17.03.92. | |||
Авторы
Даты
2000-05-27—Публикация
1994-05-16—Подача