Изобретение относится к генной инженерии и медицине и может быть использовано для создания лекарств.
Инсулин - гормон поджелудочной железы, недостаток которого приводит к тяжелому заболеванию - сахарному диабету. Поэтому на протяжении многих лет предпринимаются попытки разработать высокоэффективные технологии получения инсулина. Поскольку использование инсулина животного происхождения дает целый ряд побочных эффектов, уже более 20 лет проводятся работы в области генной инженерии с целью биотехнологического получения человеческого гормона.
Известно, что инсулин синтезируется в виде так называемого препроинсулина и включает в себя лидерную последовательность и три участка, названные как A, B и C-цепи. Собственно инсулин, как биологически активное соединение, - это небольшой глобулярный белок, в котором A и B цепи связаны дисульфидными связями. В процессе созревания происходит "вырезание" C-цепи, расположенной между A и B цепями (Биохимия человека. Под редакцией Р.Марри, M., Мир, том 2, стр. 249-250, 1993).
Все усилия последних 25-30 лет направлены на решение двух задач: в чем экспрессировать белок и какая конструкция препроинсулина оптимальна для биотехнологического использования.
Дилемма при решении первой задачи заключается в том, чтобы выбрать либо интра-, либо экстрацеллюлярный путь продукции инсулина. Был испытан каждый из путей, однако принципиальной разницы, дающей неоспоримое преимущество тому или иному подходу дано не было. Так, и тот и другой вариант не давал преимуществ в устойчивости к протеолизу (Shen S.-H., Proc.Nat.Acad.Sci.USA 81,4627-4631, 1984; Murby M. et al. Biotechnol.AppI. Biochem. 14,336-346, 1991). И хотя путь получения секретируемого белка сокращал число технологических стадий получения препроинсулина, путь через тельца включения при использовании в качестве микроорганизма продуцента E.coli, давал больший выход. Кроме того, надо отметить, что основной недостаток при использовании последнего подхода - денатурации белка при его гиперпродукции, успешно решается для инсулина.
Вторая проблема - проблема конструкции препроинсулина. Попытки получить мини-C-проинсулин, где C-цепь была редуцирована до нескольких аминокислот, являющихся местом атаки для трипсина, не принесли удовлетворительных результатов (Wetzel R. Gene 16,63-71,1981). Это, видимо, связано с тем, что C-участок полипептидной цепи необходим для правильного замыкания дисульфидных связей между цепями А и В. Поэтому в качестве основной конструкции во всех последующих работах был взят целый препроинсулин человека. Полный препроинсулин был получен двумя путями: через синтез к ДНК (Bell G.I. et al.. Nature 284, 26-32, 1980) и путем химико-ферментативного синтеза (Brousseau R. et al. . Gene 17, 279-289, 1982;, Овчинников Ю.А. и др. Докл. АН СССР 270, 743- 747, 1983).
Следующая проблема заключалась в том, какую технологию выбрать для получения конечного продукта - инсулина из его предшественника. И если в процедуре расщепления комплекса A, B и C цепей сомнений не было - это обработка трипсином и карбоксипептидазой B, то в отношении отщепления лидерной последовательности можно идти двумя путями. Первый - ничего не изменяя воспользоваться уникальностью первичной структуры препроинсулина - наличием метионина только между лидерной частью и проинсулином, с помощью бромциана расщепить полипептидную цепь (McGregor W.C. Ann.N.Y.Acad.Sci. 413,231,1983).
Основной недостаток такого подхода - использование высокотоксичного соединения.
Другое направление - создание искусственного линкера между лидерной последовательностью и проинсулином, который можно было бы легко "разрезать" например, трипсином.
Наиболее близким по технической сущности и достигаемому результату к предложенному изобретению является рекомбинантная плазмидная ДНК, содержащая трипсин-чувствительный участок -аргинин между IgG-связывающим доменом и проинсулином (Jonasson Р. et al.. Single-step trypsin cleavage of a fusion potein to obtain human insulin and its C peptide. Eur.J.Biochem. 236, 656-661, 1996). Необходимость введения IgG-связывающего домена продиктована основной задачей, поставленной авторами - усовершенствование выделения инсулина и пептида C, который по их мнению также имеет выраженную биологическую активность.
Однако однозначного ответа о целесообразности такого усложнения конструкции гибридного белка пока дать нельзя.
Задачей настоящего изобретения является создание плазмиды, с помощью которой синтезируется гибридный белок, лидерный пептид которого связан с проинсулином через остаток аргинина, что позволит отказаться от использования высокотоксичного соединения при получении инсулина, сократить число стадий и упростить процедуру его получения.
Поставленная задача решается путем создания плазмиды, названной нами pInsR, полученной на основе плазмиды pKK223-3, в которой проинсулин связан через аргинин с естественной лидерной последовательностью и имеющую нуклеотидную последовательность, приведенную на фиг. l.
Способ конструирования плазмиды заключается в том, что в плазмиду pKK223-3 между сайтами рестрикции EcoRI и HindIII была помещена кДНК, кодирующая препроинсулин человека. Далее была проведена замена триплета, кодирующего метионин на триплет, кодирующий аргинин. С этой целью на первом этапе по сайтам рестрикции BamHI и HpaI, входящим в последовательность, кодирующую гибридный белок, проводили ферментативный гидролиз. Точечную замену метионина на аргинин проводили с использованием следующих олигонуклеотидов:
5'-gatcccgtgcgctttgtt-3'
5'-aacaaagcgcacgg-3'.
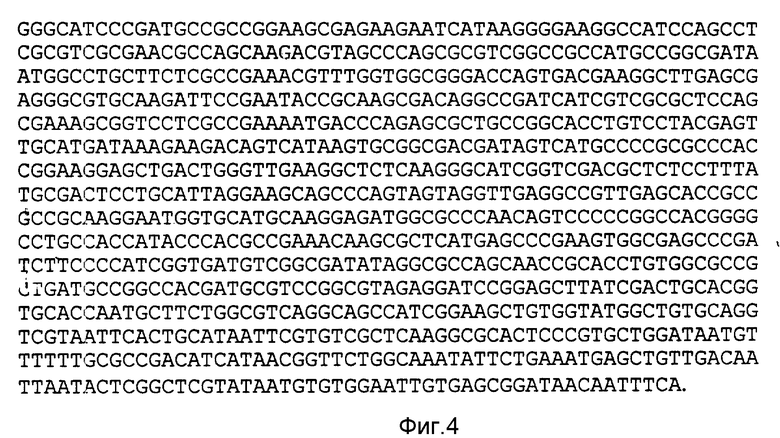
После лигирования по сайтам рестрикции BamHI и Hpal был проведен отбор плазмид, содержащих точечные мутанты. Полная нуклеотидная последовательность плазмиды, кодирующей гибридный белок, приведена на фиг. 2-4.
Таким образом, предлагаемое изобретение имеет следующие преимущества: во-первых в том, что плазмида pInsR кодирует синтез гибридного белка, в котором лидерный пептид и проинсулин соединены через остаток аргинина. Во-вторых, последовательность гибридного белка находится под сильным промотором, что обеспечивает ей высокий уровень экспрессии в штамме-продуценте. В третьих, исключение стадии бромцианового гидролиза при получении инсулина позволит не только отказаться от использования токсичного соединения, но и сократить технологическую цепочку, что, в свою очередь, приведет к снижению себестоимости конечного продукта. В четвертых, предлагаемая конструкция не содержит в отличие от прототипа дополнительной IgG-связывающей последовательности.
Пример конструирования рекомбинантной плазмиды pInsR, кодирующей препроинсулин человека.
1. В плазмиду pKK223-3 (Pharmacia Biotech) между сайтами рестрикции EcoRI и HindIII была помещена кДНК, кодирующая естественный препроинсулин человека.
2. Далее была проведена замена триплета, кодирующего метионин на триплет, кодирующий аргинин. С этой целью: а) по сайтам рестрикции BamHI и HpaI, входящим в последовательность, кодирующую естественный гибридный белок, проводили ферментативный гидролиз; б) точечную замену метионина на аргинин проводили с использованием следующих олигонуклеотидов:
5'-gatcccgtgcgctttgtt-3' и 5'-aacaaagcgcacgg-3'.
3. Полученная плазмида подвергалась рестрикции по тем же сайтам, а выделенная ДНК, кодирующая модифицированную последовательность препроинсулина, секвенировалась.
4. Для того, чтобы проверить функциональную активность сконструированной плазмиды и проанализировать получаемый продукт, плазмиду переносили в штамм E.coli XL1-blue. Контроль за трансфекцией штамма-продуцента E.coli XL 1-blue полученной плазмидой проводили путем отбора колоний нечувствительных к ампициллину, поскольку именно этот вид лекарственной устойчивости содержала вносимая плазмида.
5. Контроль за выработкой препроинсулина проводили методами электрофореза клеточного лизата с использованием соответствующего маркера и иммуно-блоттинга.
Предлагаемая генно-инженерная конструкция позволяет получать инсулин эффективным и нетоксичным способом.


Сконструированная рекомбинантная плазмидная ДНК может быть использована в биотехнологии для получения инсулина человека. Рекомбинантная ДНК получена на основе плазмиды рКК223-3. ДНК, кодирующая препроинсулин, встроена между сайтами рестрикции EcoRI и Hinol III. Триплет, кодирующий метионин, заменен на триплет, кодирующий аргинин, что позволяет получать проинсулин путем ферментативного расщепления. 2 ил.
Рекомбинантная плазмидная ДНК pInsR, кодирующая препроинсулин человека, имеющая следующие свойства: сконструирована на основе плазмиды рКК 223-3, между сайтами рестрикции EcoRI и Hind III встроена к ДНК препроинсулина человека с нуклеотидной последовательностью, представленной на с., где между нуклеотидной последовательностью, кодирующей лидерную последовательность, и последовательностью, кодирующей проинсулин, триплет, кодирующий метионин, заменен на триплет, кодирующий аргинин.
| Jonasson P.et al., Eur | |||
| J.Biochem., 1996, v.236, p.656-661. |
Авторы
Даты
1998-07-20—Публикация
1997-08-28—Подача