Изобретение касается производных оксазолидона, имеющих прекрасный медицинский эффект.
Можно сказать, что в настоящее время на 20 - 30 человек в обычном состоянии приходится один, страдающий депрессией. Кроме того, большинство больных обладают депрессивным состоянием, которое является последствием повреждения головного мозга и т.д. Таким образом депрессия и депрессивное состояние могут считаться современными болезнями.
Для ослабления депрессии и депрессивного состояния до этого применяли трициклические антидепрессанты, такие как имипрамин и амитриптилин. Однако антидепрессанты не так уж предпочтительны, так как они не эффективны для ~ 40% пациентов и обладают побочным действием, особенно для больных в возрасте, таким как тахикардия, пониженное кровяное давление, головная боль, тремор пальцев рук, запоры, расстройство мочеиспускания.
С другой стороны давно известно, что ингибиторы моноаминооксидазы (далее обозначается как МАО) имеют антидепрессивный эффект и показано, что их действие шире, чем у трициклических антидепрессантов. Однако гидразидные ингибиторы МАО сейчас не применяются, так как обнаружено, что они вызывают расстройства печени. Негидразидные ингибиторы МАО также едва используются, так как их ингибирующий эффект МАО необратим.
Дополнительные исследования показали, что МАО классифицируется по двум типам, тип A и тип B, и что неприятное побочное действие, такое как пониженное кровяное давление, головная боль и головокружение, а также так называемый "сырный эффект", когда взаимодействие препарата с пищей, имеющей высокое содержание тирамина, вызывает приступы гипертонии, обусловлено, главным образом ингибирующим эффектом МАО-B.
Авторами изобретения проведены широкие исследования с целью найти способ, обеспечивающий обратимый ингибирующий эффект, и в то же время свободный от серьезного побочного действия или взаимодействия с пищей, а также эффективный для больных в широких пределах. Для этого изучены ингибирующий эффект МАО-A и соединения, обладающие подобным действием.
В результате таких исследований авторами изобретения найдено, что объектом изобретения могут быть производные оксазолидона, которые описаны ниже. Настоящее изобретение выполнено на основе этого открытия.
Несмотря на то, что производные оксазолидона, применяющиеся в качестве медицинских препаратов описаны, например, в патентах - в Японии N 40428/1985, 5391/1988, 54710/1988, 63671/1988, 56071/1989, 37354/1990, 61465/1990 и 9106/1991 и патенте Японии N 63671/1988, они отличаются по структуре от соединений настоящего изобретения.
В патенте US 5011849 раскрыты оксазолкарбоксамидные производные, обладающие ингибирующей моноаминооксидазу активностью, а также фармацевтические композиции, содержащие данные производные или их фармацевтически приемлемые соли в качестве активного агента и фармацевтически приемлемый наполнитель.
Однако структура описанных в патенте US 5011849 значительно отличается от структуры соединений настоящего изобретения.
Настоящее изобретение касается производных оксазолидона, соответствующих общей формуле (1) или их фармакологически приемлемых солей: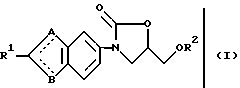
где
A и B каждый представляет собой атом азота, атом серы или атом кислорода, с условием, что по крайней мере один из A и B должен быть азотом;
R1 представляет собой атом водорода, атом галогена, цианогруппу, низший алкил, циклоалкил, гидроксиалкил, алкоксиалкил, цианоалкенил группы, группу, соответствующую формуле: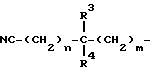
(в которой
n и m каждый представляет собой 0 или целое число от 1 до 4 и R3 и R4 могут быть одинаковыми или разными и каждый представляет собой атом водорода, гидроксил, низший алкил, низший алкоксил группы или группу, соответствующую формуле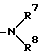
(в которой
R7 и R8 могут быть одинаковыми или разными и каждый представляет собой атом водорода или низший алкил или R7 и R8 могут вместе с атомом азота образовывать кольцо и кольцо может быть замещенным), группу, соответствующую формуле: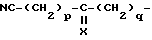
(в которой
p и g каждый представляет собой 0 или целое число от 1 до 4 и X является атомом кислорода, атомом серы или группой, соответствующей формуле: =N-OR9 (R9 - атом водорода или низший алкил), группу, соответствующую формуле: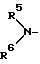
(в которой
R5 и R6 могут быть одинаковыми или разными и каждый представляет собой атом водорода, низший алкил или цианоалкил группу или R5 и R6 могут образовывать вместе с атомом азота, с которым они связаны, кольцо и кольцо может быть замещенным), группу, соответствующую формуле:
NC-(CH2)r-Y-(CH2)s-
(в которой
r и s каждый представляет собой 0 или целое число от 1 до 4 и Y является атомом кислорода, атомом серы, группой формулы: -NH-), арил группу, которая может быть замещенной, арилалкил группу, которая может быть замещенной, гетероарил группу, которая может быть замещенной, гетероарилалкил группу, которая может быть замещенной, карбамоилалкил группу или цианоалкилкарбамоил группу;
R2 представляет собой атом азота или низший алкил и связь, представленная 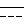 , соответствует простой или двойной связи).
, соответствует простой или двойной связи).
Настоящее изобретение также предлагает препарат для профилактики и лечения болезней, против которых эффективны ингибиторы моноаминоксидазы, включающий в качестве активного ингредиента производное оксазолидона общей формулы (I), представленной выше, и/или его фармакологически приемлемую соль.
Далее настоящее изобретение предлагает: лекарственный препарат, включающий в свой составу эффективную дозу производного оксазолидона общей формулы (I) и/или его фармакологически приемлемую соль и фармакологически приемлемый эксципиент; применение производного оксазолидона общей формулы (I) или его фармакологически приемлемой соли для получения лекарственного препарата против болезней, против которых эффективны ингибиторы моноаминооксидазы; метод лечения, согласно которому больному, страдающему болезнями, против которых эффективны ингибиторы моноаминооксидазы, вводят эффективную дозу производного оксазолидона общей формулы (I) и/или его фармакологически приемлемой соли.
Настоящее изобретение пригодно для лечения болезней, против которых эффективны ингибиторы моноаминооксидазы A, особенно тех, против которых эффективно введение антидепрессантов.
Низшие алкил группы в R1, R2, R3, R4, R5, R6, R7, R8 и R9 в приведенной выше общей формуле (I) представляют собой прямые цепочки или разветвленные алкил группы, имеющие 1 - 8 атомов углерода, такие как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил(амил), изопентил, неопентил, 1-метилбутил, 2-метилбутил, 1,1-диметилпропил, 1,2-диметилпропил; гексил, изогексил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 2,2-диметилбутил, 1,3-диметилбутил, 2,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил, 1-этил-2-метилпропил, гептил и октил группы. Наиболее предпочтительными среди них являются метил, этил, пропил и изопропил группы.
Низшие алкокси группы в R3 и R4 являются прямыми или разветвленными алкокси группами, содержащими от 1 до 8 атомов углерода, такие как метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, 1-метилбутокси, 2-метилбутокси, 1,2-диметилпропокси и гексилокси группы. Среди них наиболее предпочтительными являются метокси и этокси группы.
Алкоксиалкил группы R1 представляют собой вышеперечисленные группы низшего алкила.
Арил группы арил групп, которые по определению R1 могут быть замещенными, включают фенил, нафтил, толил и ксилил группы.
Арилалкил группы арилалкил групп, которые по определению R1 могут быть замещенными, представляют собой группы, полученные из описанных выше арил групп.
Гетероарил группы гетероарил групп, которые по определению R1 могут быть замещенными, представляют собой насыщенные или ненасыщенные 5- - 7-членные кольца, содержащие 1 или 2 атома азота, серы или кислорода.
Гетероарилалкил группы гетероарилалкил групп, которые по определению R1 могут быть замещенными, представляют собой группы, полученные из описанных выше гетероарил групп.
Заместители в "арил группах, которые могут быть замещенными", "арилалкил группах, которые могут быть замещенными", "гетероарил группах, которые могут быть замещенными", и "гетероарилалкил группах, которые могут быть замещенными", включают гидроксил, низший алкил, циано, низший алкокси, амино, нитро, карбоксил, гидроксиалкил, алкоксиалкил, цианоалкил и цианоалкенил группы.
Гидроксиалкил группы в R1 являются описанными выше низшими алкил группами, которые кроме того имеют одну или две гидроксильные группы, связанные с любым их атомом углерода.
Алкенил группы цианоалкенил групп в определении R1 соответствует представленным выше низшим алкильным группам, которые имеют одну или более двойных связей между их двумя атомами углерода. Циано группа может быть связана с любым атомом углерода алкенильной группы.
Карбамоилалкил группы в R1 представляют собой группы, которые получают из описанных выше низших алкил групп.
Цианоалкилкарбамоил группы в определении R1 представляют собой группы, полученные из описанных выше цианоалкил групп.
Атомы галогена в R1 включают фтор, хлор, бром и иод.
Циклоалкил группы в R1 включают группы, содержащие от 3 до 10 атомов углерода, такие как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил и циклодецил группы.
Понятие "могут образовывать кольцо вместе с атомом азота, с которым они связаны" в определениях R5 и R6 или R7 и R8 относится, в частности, к пиперидино и пирролидино группам и к пиперидино и морфолино группам, которые дополнительно содержат атомы азота, кислорода или серы.
В качестве их заместителей используются гидроксил, циано, карбоксил, амино, нитро, низший алкил, низший алкоксил, гидроксиалкил, цианоалкил и цианоалкенил группы.
Фармакологически приемлемые соли в настоящем изобретении включают соли неорганических кислот, такие как гидроксихлорид, гидробромид, сульфат и фосфат; соли органических кислот, такие как ацетат, малеат, тартрат, метансульфонат, бензолсульфонат и толуолсульфонат; соли аминокислот, такие как аспартат и глутамат.
Некоторые из этих соединений могут образовывать соли с металлами, такими как Na, K, Ca и Mg, которые также включаются в фармакологически приемлемые соли настоящего изобретения.
Соединения настоящего изобретения могут образовывать геометрические и оптические изомеры в зависимости от заместителей, и эти изомеры включаются в настоящее изобретение.
Предпочтительные примеры соединений настоящего изобретения будут даны ниже, в частности, для облегчения разъяснения настоящего изобретения, которые никоим образом не ограничивают изобретения.
Примерами наиболее подходящих соединений являются соединения, соответствующие основной формуле (A) и их фармакологически приемлемые соли: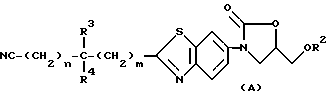
(где
R2, R3, R4 n и m являются группами, определенными выше). R2 является желательно атомом водорода или метил, этил или пропил группой, среди которых более желательны атом водорода и метил группа, причем из них более предпочтительна метил группа.
R3 и R4 могут быть одинаковыми или разными и каждый представляет собой желательно атом водорода или гидроксил или низший алкил группы, среди которых более желательны атом водорода или гидроксил, метил, этил, пропил, бутил или трет-бутил группа, причем более предпочтительны атом водорода или гидроксил, или метил группа.
Наиболее желательно сочетание значений R3 и R4, заключающее в себе атом водорода и гидроксил группу. Следующая желательная их комбинация включает гидроксил группу и низшую алкил группу. Следующее желательное их сочетание включает два атома водорода.
n и m представляют собой независимо друг от друга 0 или целое число от 1 до 4. Желательные комбинации n и m включают n=3 и m=0; n=2 и m=1; n=1 и m=2; n= 0 и m=3; n=2 и m=0; n=1 и m=1; n=0 и m=2, среди которых более желательно сочетание - n= 3 и m=0; и n=2 и m=0, наиболее предпочтительная комбинация включает n=2 и m=0.
Примерами следующих наиболее предпочтительных соединений являются соединения, соответствующие общей формуле (B) и их фармакологически приемлемые соли: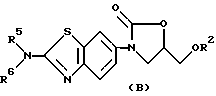
(где
R2, R5 и R6 имеют значения, представленные выше). R2 является желательно атомом водорода или метил, этил или пропил группой, среди которых более желательны - атом водорода и метил группа, причем наиболее предпочтительна метил группа.
R5 и R6 могут быть предпочтительно одинаковыми или разными и каждая представляет собой атом водорода или цианоалкил группу, или случай, когда R5 и R6 образуют кольцо вместе с атомом азота, с которым они связаны, однако предпочтительно, когда R5 и R6 образуют кольцо вместе с атомом азота, с которым они связаны, кольцо, в частности, представляет собой пиперидино или пирролидино группу. Кольцо может иметь желательно один или два заместителя, более желательно - один заместитель. Предпочтительными примерами заместителей являются циано, гидроксил и карбоксил группы.
Примерами следующих наиболее предпочтительных соединений являются соединения, соответствующие общей формуле (C) и их фармакологически приемлемые соли: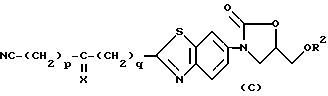
(где
R2, X, p и q имеют значения, представленные выше).
R2 является желательно атомом водорода или метил, этил или пропил группой, среди которых более желательны - атом водорода и метил группа, причем наиболее предпочтительна метил группа.
X является желательно атомом серы или кислорода, более желателен - атом кислорода.
p и q независимо друг от друга представляют собой 0 или целое число от 1 до 4. Желательные комбинации p и q включают p=3 и q=0; p=2 и q=1; p=1 и q=2; p=0 и q=3; p=2 и q=0; p=1 и q=1; p=0 и q=2, среди которых более желательны - p-3 и q=0; p=2 и q=0 и наиболее предпочтительно сочетание p=2 и q=0.
Среди соединений настоящего изобретения соединениями, имеющими особенно прекрасную ингибирующую активность к моноаминооксидазе, являются следующие соединения или их фармакологически приемлемые соли:
1) 3-[2-(1-гидрокси-3-цианопропил)бензтиазолол-6-ил] - 5-метоксиметил-2-оксазолидинон,
2) 3-[2-(3-цианопропил)бензтиазол-6-ил]-5- метоксиметил-2-оксазолидинон,
3) 3-[2-(1-гидрокси-4-цианобутил)бензтиазол-6-ил] -5- метоксиметил-2-оксазолидинон и
4) 3-[2-(4-цианобутил)бензтиазол-6-ил]-5- метоксиметил-2-оксазолидинон.
Типичные способы получения соединений настоящего изобретения представлены ниже.
Способ получения 1
(первая стадия)
(где
A и B имеют значения, описанные выше, Ra 1 представляет собой группу, выбранную из тех же групп, которые описаны для R1, исключая атомы галогена и группу формулы: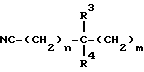
(где
R3, R4, m и n имеют значения, представленные выше) и Hal представляет собой атом галогена).
А именно, соединение общей формулы (II) реагируют с соединением общей формулы (III) в присутствии или отсутствии основания с образованием соединения общей формулы (IV). В качестве основания может быть использован любой тип. Примерами предпочтительных оснований являются соли щелочных металлов, такие как карбонат калия и гидрокарбонат натрия; гидриды щелочных металлов, такие как гидрид натрия и гидрид калия; амины, такие как триэтиламин.
Растворителем для проведения реакции является любой органический растворитель, который не участвует в реакции. Предпочтительно применение в качестве растворителей спиртов, таких как этанол; эфиров, таких как тетрагидрофуран и диоксан; и диметилформамида.
Температура реакции изменяется в пределах от 0oC до температуры кипения растворителя.
(вторая стадия)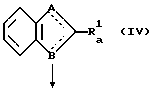
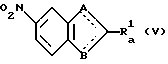
(где
A, B и Ra 1 имеют значения, указанные выше).
А именно, соединение общей формулы (IV), полученное на первой ступени, нитруют обычным методом с образованием соединения общей формулы (V).
(третья ступень)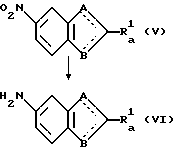
(где
A, B и Ra 1 имеют значения, указанные выше).
А именно, соединение общей формулы (V), полученное на второй стадии, восстанавливают обычным каталитическим гидрированием с образованием соединения общей формулы (VI).
Предпочтительны катализаторы включают, например, палладий на углероде, оксид платины, никель Ренея и родий-окись алюминия.
В качестве растворителя для реакции используют любой органический растворитель. Предпочтительными растворителями являются спирты, такие как метанол; углеводороды, такие как толуол; эфиры, такие как тетрагидрофуран; N, N-диметилформамид; и этилацетат.
Температура реакции варьирует от приблизительно 0oC до температуры кипения растворителя.
(Четвертая стадия)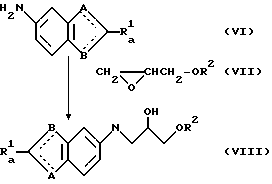
(где
Ra 1, R2, A и B имеют значения, описанные выше).
А именно, соединение общей формулы (VI), полученное на третьей ступени превращают с производными глицидола общей формулы (VII) обычным способом с образованием соединения общей формулы (VIII).
Соединение (VIII) может быть получено с высоким выходом с использованием перхлората магния, перхлората натрия или перхлората лития по методике, описанной в "Tetrahedron Letters" Vol. 31, N 32, стр. 4661-4664 (1990).
Растворителем реакции может быть любой органический растворитель, обычно используемый для органического синтеза и не участвующий в реакции. Для реакций с не-перхлоратными соединениями предпочтительно используют в качестве растворителей спирты, такие как метанол этанол, пропанол, изопропанол и бутанол, для реакций с перхлоратами предпочтительно применяют ацетонитрил.
Температура реакции изменяется в пределах от приблизительно 0oC до температуры кипения растворителя.
Эта стадия, в зависимости от обстоятельств, может проводиться в герметичном сосуде.
(Пятая стадия)
(где
Ra 1, R2, A и B имеют значения, описанные выше).
А именно, соединение общей формулы (VIII), полученное на четвертой стадии, реагирует с симметричным карбонильным соединением, таким как N,N-карбонилдиимидазол или диэтилкарбонат, с образованием требуемого соединения (IX), содержащего циклический уретановый остаток.
В качестве растворителя реакции используют любой органический растворитель, не участвующий в реакции. Предпочтительными растворителями являются эфиры, такие как тетрагидрофураны.
Температура реакции варьирует от приблизительно 0oC до температуры кипения растворителя.
Если R1 является атомом галогена, то требуемое соединение (1) может быть получено с помощью исходных со второй стадии.
Способ получения 2
Если требуемое соединение является соединением следующей общей формулы (X):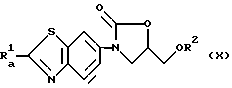
(где
Ra 1 и R2 имеют значения, указанные выше), то оно может быть получено также следующим способом:
Первая стадия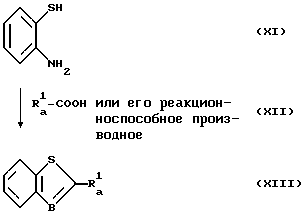
(где
Ra 1 имеет значения, описанные выше).
А именно, о-аминотиофенол (XI) реагирует с карбоновой кислотой или ее реакционноспособным производным (XII) по обычному методу с образованием бензтиазольного производного общей формулы (XIII).
Примеры реакционноспособных производных карбоновых кислот включают хлорангидриды кислот, эфиры и нитрилы.
Реакцию проводят в любом органическом растворителе, который не участвует в реакции. Предпочтительными растворителями являются бензол, тетрагидрофуран, пиридин и хлороформ.
Температура реакции изменяется приблизительно от -20oС до температуры кипения растворителя.
Образовавшееся бензтиазольное соединение (XIII) может превращаться по методам, приведенным для второй - пятой стадий в способе получения 1 с образованием требуемого соединения (X).
Способ получения 3
Если требуемое соединение является соединением соответствующим общей формуле (XIV):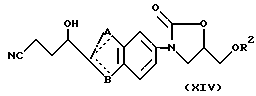
(где
A, B и R2 имеют значения, представленные выше), то оно может быть получено синтезом соединения общей формулы (XV):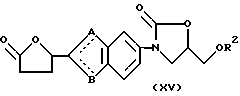
по способу получения 2 с последующей обработкой по методам 1 или 2:
(Метод 1)
Соединение (XV) восстанавливают с комплексом гидрида металла, таким как три-трет-бутоксиалюмогидрид лития или триэтоксиалюмогидрид лития для восстановления только кетогруппы в лактонной группе до образования лактольного соединения (XVI). Хотя температура реакции может изменяться от температуры при охлаждении льдом до температуры кипения растворителя, наиболее предпочтительна комнатная температура. В реакции используют любой органический растворитель, пригодный для органического синтеза и инертный к реакции. Примеры особенно предпочтительных растворителей включают тетрагидрофуран, диэтиловый эфир и 1,2-диметоксиэтан.
Лактольное соединение (XVI) реагирует с гидрохлоридом гидроксиламина в растворителе с образованием оксима (XVII). Хотя температура реакции может изменяться от температуры при охлаждении льдом до температуры кипения растворителя, наиболее предпочтительна комнатная температура. В реакции используют растворитель, пригодный для органического синтеза и инертный к реакции. Примеры особенно предпочтительных растворителей включают пиридин, воду, метанол и этанол. Растворители могут использоваться как по одному, так и в смеси двух или более растворителей.
Оксим (XVII) реагирует с 1-(трифторацетил)имидазолом в растворителе с образованием требуемого соединения (XIV). Хотя температура реакции может изменяться от температуры охлаждения льдом до температуры кипения растворителя, предпочтительна температура охлаждения льдом. В реакции используют любой растворитель, пригодный для органического синтеза и инертный к реакции. Примеры особенно предпочтительных растворителей включают жидкий аммиак, метанол, этанол, пропанол и изопропанол.
(Метод 2)
Соединение (XV) реагирует с аммиаком с образованием амида (XVIII). Хотя температура реакции может изменяться от температуры охлаждения льдом до температуры кипения растворителя, предпочтительна комнатная температура. Используют любой растворитель, пригодный для органического синтеза и инертный к реакции. Примеры особенно предпочтительных растворителей включают тетрагидрофуран, диэтиловый эфир и 1,2-диметоксиэтан.
Амид (XVIII) реагирует с ангидридом трифторуксусной кислоты в растворителе и затем обрабатывается гидрокарбонатом натрия до образования требуемого соединения (XIV). Хотя температура реакции может изменяться от температуры охлаждения льдом до температуры кипения растворителя, наиболее предпочтительна комнатная температура. В реакции используют любой растворитель, пригодный для органического синтеза и инертный к реакции. Примеры особенно предпочтительных растворителей включают 1,4-диоксан, тетрагидрофуран и пиридин. Растворитель может использоваться один, может использоваться смесь растворителей, двух или более.
Хотя основные способы получения соединений настоящего изобретения описаны выше, соединения настоящего изобретения могут быть также получены с помощью различных модификаций рассмотренных выше способов получения, где нитрогруппа вводится в бензольное кольцо и затем заместитель вводится во второе положение.
Заместитель во 2-положении может быть заменен с помощью обычных методов, таких как окисление, восстановление или конденсация.
Следующие экспериментальные примеры иллюстрируют результаты настоящего изобретения.
Примеры.
Определение ингибирующей активности МАО с использованием переднего мозга крыс:
Ингибирующую активность МАО определяли методом Prada et al. (J.Pharmacol. Exp. Ther., 248, 400-414 (1989)).
Ферментативная реакция выполнялась в 300 мкл раствора, имеющего следующий состав:
источник ферментов - 20 мкл
14C-меченный ферментативный субстрат - 80 мкл
тестируемое соединение - 200 мкл
в сумме - 300 мкл
В качестве источника ферментов использовали суспензию 1 части объема переднего мозга самцов крыс линии Wistar с 5 частями объема 0.1M буфера фосфата калия (pH 7.4). Источник ферментов смешивали с тестируемым соединением и смесь выдерживали 10 минут при 37oC, затем добавляли ферментативный субстрат для начала реакции, через 10 минут добавили 200 мкл 2N соляной кислоты для окончания реакции.
В качестве субстратов использовали меченные 14C МАО-А, и МАО-В, 5-НТ(серотонин) и PEA ( β -фенилэтиламин), Специфическую радиоактивность 5-НТ и PEA регулировали до 11.1 MBq/ммоль и 29.6 MBq/ммоль, соответственно, а их концентрации в реакции - 200 мкМ и 20 мкМ, соответственно.
Тестируемое соединение растворяли в дистиллированной воде до получения необходимой в реакции концентрации. Если тестируемое соединение не растворимо в воде, то его растворяли в диметилсульфоксиде до получения концентрации 10%.
Диэтиловый эфир и н-гептан использовали как радиоактивные метаболиты, образованные МАО-A и МАО-B, соответственно. После окончания ферментативной реакции, в реакционную смесь добавляли 3 мл растворителя, встряхивали 10 минут. После центрифугирования в течение 10 минут при 3000 оборотах/минуту нижний водный слой вымораживали смесью сухой лед/ацетон. Верхний органический слой отделяли декантированием и определяли его радиоактивность с помощью жидкого сцинтилляционного счетчика.
Результаты приведены в табл. 1 и 2. Ингибирующая активность тестируемых соединений к МАО-А и МАО-В приведена при концентрациях 10-7 М и 10-6 M или с помощью IC50 величин (см. табл. 1,2).
Из приведенных выше примеров эксперимента видно, что соединения настоящего изобретения способны селективно ингибировать МАО-А. Таким образом производные оксазолидона, являющиеся соединениями настоящего изобретения, эффективны при лечении болезней, требующего ингибирования МАО, особенно ингибирования МАО-А. Примеры таких болезней включают депрессию, депрессивный невроз, депрессивное состояние, обусловленное последствиями повреждения головного мозга. Кроме того, соединения настоящего изобретения имеют превосходный антирезерпиновый эффект, который улучшает терапевтический эффект при лечении описанных выше болезней.
Дополнительно соединения настоящего изобретения имеют уменьшенную токсичность и высокую безопасность, так что с этой точки зрения данное изобретение очень ценно.
Соединения настоящего изобретения применяют в форме таблеток, порошка, гранул, капсул, сиропа или ингаляций при лечении или профилактике этих болезней. Доза варьирует в зависимости от симптомов, возраста, типа болезни и т. д. и обычно составляет от 0,1 до 1000 мг, желательно 1 - 500 мг, более желательно 1 - 100 мг и наиболее предпочтительно 5 - 50 мг в день для взрослого, причем при разовом введении или при введении в несколько порций за день.
Препаративные формы, содержащие соединения получают обычными методами с обычными фармацевтическими наполнителями.
А именно, твердые препаративные формы для орального применения получают добавлением эксципиента и, если необходимо, связывающего агента, дезинтегратора, смазочного материала, цветовой добавки, модификатора лекарственных веществ и т.д., к активному ингредиенту и формованием полученной смеси в таблетки, таблетки с покрытием, гранулы, порошок или капсулы.
Полимеры эксципиента включают лактозу, кукурузный крахмал, белый сахар, глюкозу, сорбитол, кристаллическую целлюлозу и двуокись кремния. Примерами связывающих агентов являются поливиниловый спирт, поливиниловый эфир, этилцеллюлоза, метилцеллюлоза, аравийская камедь, трагакант, желатин, шеллак, гидроксипропилцеллюлоза, гидроксиметилцеллюлоза, цитрат кальция, декстрин и пектин. Примеры смазочного материала включают стеарат магния, тальк, полиэтиленгликоль, двуокись кремния и консистентная растительная смазка. В качестве цветовых добавок используют добавки, разрешенные для применения в медицине. В качестве модификаторов лекарственных веществ включают порошок какао, метанол, ароматический порошок, ментоловое масло, борнеол и порошок корицы. Такие таблетки и гранулы могут быть покрыты сахаром, желатином или другими подобными материалами.
Инъекции для подкожного, внутримышечного или внутривенного введения получают обычными методами, при добавлении к активному ингредиенту, если это необходимо, регулятора pH, буфера, стабилизатора и т.д.
Примеры
Следующие примеры далее иллюстрируют настоящее изобретение, но изобретение не ограничивается ими.
Примеры получения исходных соединений, применяющихся для синтеза требуемых соединений также приведены далее.
В примерах обозначения "Me" и "Et" представляют собой метил группу и этил группу, соответственно.
Примеры получения исходных соединений
Пример 1
2-Гидроксиметилбензотиазол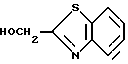
60 г 2-аминотиофенола и 36,6 г гликолевой кислоты нагревают в течение 12 часов при 130oC в герметичном сосуде. Продукт реакции растворяют в этилацетате, сушат над сульфатом натрия, растворитель упаривают в вакууме, остаток перекристаллизовывают из диизопропилового эфира и получают 55 г названного соединения в форме белых кристаллов.
1H-ЯМР (CDCl3) δ :
3.54 (1H, т), 5.08 (2H, д), 7.38 (1H, т), 7.47 (1H, т), 7.88 (1H, д), 7,97 (1H, д).
Пример 2
6-Нитро-2-гидроксиметилбензотиазол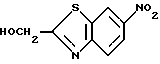
К 41 г 2-гидроксиметилбензотиазола, полученного в Примере 1, в 55 мл концентрированной серной кислоты, прибавляют по каплям 24 мл концентрированной азотной кислоты (удельный вес: 1.42), поддерживая температуру реакции при 40oC или ниже, перемешивают 1 час, выливают в смесь лед-вода и экстрагируют этилацетатом. Экстракт сушат над сульфатом натрия, упаривают в вакууме и получают твердый осадок, который перекристаллизовывают из этилацетата и получают 15 г названного соединения.
1H-ЯМР (CDCl3) δ :
2.37 (1H, c), 5.07 (2H, с), 8.05 (1H, д), 8.35 (1H, дд), 8.86 (1H, д).
Пример 3
6-Нитро-2-бензоилоксиметилбензотиазол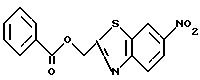
К раствору 15 г 6-нитро-2-гидроксиметилбензотиазола, полученного в Примере 2, и 11 мл триэтиламина в тетрагидрофуране при 10oC прибавляют по каплям 9 мл бензоилхлорида, перемешивают 1 час при комнатной температуре, прибавляют воду и экстрагируют этилацетатом. Экстракт сушат над сульфатом натрия, упаривают в вакууме. Остаток хроматографируют на колонке с силикагелем (растворитель: дихлорметанол/метанол) и получают 10 г названного соединения.
Пример 4
6-Амино-2-бензоилоксиметилбензотиазол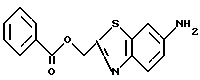
10 г 6-нитро-2-бензоилоксиметилбензотиазола, полученного в Примере 3, в растворе смеси этилацетата и этанола (1 : 1) гидрируют в течение 10 часов в присутствии 1 г катализатора (палладия на углероде). После окончания реакции катализатор отфильтровывают через целит, фильтрат упаривают в вакууме и получают 8,7 г названного соединения.
Пример 5
N-(2-Бензоилоксиметилбензотиазол-6-ил)-2-гидрокси- 3-метоксипропиламин
Смесь 8.7 г 6-амино-2-бензоилоксиметилбензотиазола, полученного в Примере 4, и 3 г метилового эфира глицидной кислоты кипятят 3 часа в этаноле, упаривают в вакууме, хроматографируют на колонке с силикагелем (растворитель: дихлорметан/метанол) и получают 6.2 г названного соединения.
Пример 6
2-(5-Оксотетрагидрофуран-2-ил)бензотиазол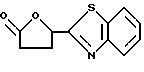
Хлорангидрид, полученный при обработке (S)-(+)-5-оксо-2-тетрагидрофуранкарбоновой кислоты тионилхлоридом, прибавляют по каплям при охлаждении льдом к раствору 600 г 2-аминотиофенола в 1500 мл пиридина, перемешивают 3 часа при комнатной температуре, выливают в лед/воду, образовавшийся осадок отфильтровывают, промывают водой, затем эфиром, перекристаллизовывают из ацетона и диизопропилового эфира и получают 504 г названного соединения.
1H-ЯМР (CDCl3) δ :
2.6 ~ 2.9 (4H, м), 5.8 ~ 5.9 (1H, м), 7,45 (1H, т), 7.52 (1H, т), 7.95 (1H, д), 8.04 (1H, д).
Пример 7
6-Нитро-2-(5-оксотетрагидрофуран-2-ил)бензотиазол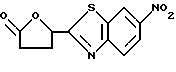
К раствору 504 г 2-(5-оксотетрагирдофуран-2-ил)бензотиазола, полученного в Примере 6, в 2000 мл концентрированной серной кислоты прибавляют по каплям при -5 - 0oC 188 мл концентрированной азотной кислоты, перемешивают 30 минут в этих условиях, 2 часа при 0oC, реакционную смесь выливают в приблизительно 30 л лед/вода. Образовавшийся осадок отфильтровывают, промывают водой, затем этанолом, сушат и получают 488 г названного соединения.
1H-ЯМР (CDCl3) δ :
2.6 ~ 3.0 (4H, м), 5.8 ~ 6.0 (1H, м), 8.13 (1H, д), 8.40 (1H, дд), 8.88 (1H, д).
Пример 8
6-Амино-2-(5-оксотетрагидрофуран-2-ил)бензотиазол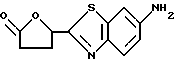
Суспензию 388 г 6-нитро-2-(5-оксотетрагирдофуран-2-ил)бензотиазола, полученного в Примере 7, в 6000 мл диоксана гидрируют в течение 48 часов в присутствии 30 г 10% палладия на углероде при комнатной температуре при атмосферном давлении. Катализатор отфильтровывают, растворитель упаривают, полученный твердый остаток перекристаллизовывают из ацетона и диизопропилового эфира и получают 300 г названного соединения.
1H-ЯМР (CDCl3) δ :
2.6 ~ 2.9 (4H, м), 5.8 ~ 5.9 (1H, м), 7.08 (1H, дд), 7.58 (1H, д), 7.85 (1H, д).
Пример 9
2-Хлор-6-нитробензотиазол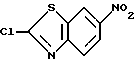
К 300 г 2-хлорбензотиазола в 1500 мл концентрированной серной кислоте прибавляют по каплям при 0o - 10oC 134 мл концентрированной азотной кислоты, перемешивают 1 час, выливают в лед/воду. Образовавшийся осадок отфильтровывают, промывают водой, затем ацетоном, сушат и получают 380 г названного соединения.
1H-ЯМР (CDCl3) δ :
8.07 (1H, д), 8.39 (1H, дд), 8.76 (1H, д).
Пример 10
Этил N-(6-нитробензотиазол-2-ил)изонипекотат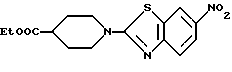
К смеси 68 г 2-хлор-6-нитробензотиазола, полученного в Примере 9, 50 г этил изонипекотата в 300 мл этанола и 300 мл тетрагидрофурана прибавляют 50 г бикарбоната натрия, кипятят 3 часа, выливают в лед/воду и экстрагируют этилацетатом. Экстракт промывают водным солевым раствором, упаривают в вакууме, остаток хроматографируют на колонке и получают 106 г названного соединения.
1H-ЯМР (CDCl3) δ :
1.27 (3H, т), 1.8 ~ 2.0 (2H, м), 2.0 ~ 2.1 (2H, м), 2.6 ~ 2.7 (1H, м), 3.3 ~ 3.4 (2H, м), 4.1 ~ 4.2 (2H, м), 4.18 (2H, кв), 7.50 (1H, д), 8.20 (1H, дд), 8.50 (1H, д).
Пример 11
N-(6-нитробензотиазол-2-ил)изонипекотиновая кислота
К 106 г этил N-(6-нитробензотиазол-2-ил)изонипекотата, полученного в Примере 10, в 300 мл этанола прибавляют 150 мл 5 М водного раствора гидроокиси натрия, нагревают 3 часа, выливают в разбавленную соляную кислоту. Образовавшийся осадок отфильтровывают, промывают водой, затем эфиром, сушат и получают 96 г названного соединения.
1H-ЯМР (CDCl3)  :
:
1.6 ~ 1.8 (2H, м), 1.9 ~ 2.1 (2H, м), 2.5 ~ 2.7 (1H, м), 3.2 ~ 3.5 (2H, м), 4.0 ~ 4.2 (2H, м), 7.47 (1H, м), 8.13 (1H, дд), 8.70 (1H, д).
Пример 12
N-(6-Нитробензотиазол-2-ил)изонипекотамид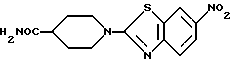
К суспензии 90 г N-(6-нитробензотиазол-2-ил)изонипекотиновой кислоты, полученной в Примере 11, в 500 мл тетрагидрофурана и 1000 мл диметилформамида добавляют 100 мл триэтиламина и прибавляют по каплям при -20oC 45 мл изобутилхлоркарбоната, перемешивают 20 минут, вносят 100 мл концентрированного водного аммиака при -40oC, перемешивают 20 минут. Реакционную смесь выливают в лед/воду, образовавшийся осадок фильтруют, промывают водой, затем эфиром, сушат и получают 75 г названного соединения.
1H-ЯМР (d6-DMCO) δ :
1.5 ~ 1.7 (2H, м), 1.9 ~ 2.0 (2H, м), 2.5 ~ 2.7 (1H, м), 3.2 ~ 3.4 (2H, м), 3.9 ~ 4.1 (2H, м), 7.47 (1H, д), 8.13 (1H, дд), 8.78 (1H, д).
Пример 13
N-(6-Нитробензотиазол-2-ил)-4-цианопиперидин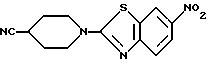
К 75 г N-(6-нитробензотиазол-2-ил)изонипекотамида, полученного в Примере 12, в 700 мл диметилформамида прибавляют 50 г п-толуолсульфонилхлорида, нагревают 20 минут при 110oC, выливают в лед/воду, нейтрализуют гидроокисью натрия. Образовавшийся осадок отфильтровывают, промывают водой и затем эфиром, сушат и получают 60 г названного соединения.
1H-ЯМР (CDCl3) δ :
2.0 ~ 2.2 (4H, м), 3.0 ~ 3.1 (1H, м), 3.7 ~ 3.8 (2H, м), 3.9 ~ 4.0 (2H, м), 7.52 (1H, д), 8.20 (1H, дд), 8.50 (1H, д).
Пример 14
N-(6-Аминобензотиазол-2-ил)-4-цианопиперидин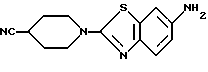
Смесь 60 г N-(6-нитробензотиазол-2-ил)-4-цианопиперидина, полученного в Примере 13, и 2000 мл диоксана гидрируют 2 часа в присутствии 3 г 10% палладия на углероде при комнатной температуре и атмосферном давлении. Катализатор отфильтровывают, раствор упаривают в вакууме и получают 51 г названного соединения.
1H-ЯМР (CDCl3) δ :
1.9 ~ 2.1 (4H, м), 2.8 ~ 3.0 (1H, м), 3.5 ~ 3.6 (2H, м), 3.70 (2H, м), 3.7 ~ 3.9 (2H, м), 6.70 (1H, дд), 6.95 (1H, д), 7.37 (1H, д).
Пример 1
3-(2-Бензоилоксиметилбензотиазол-6-ил)-5-метоксиметил-2- оксазолидинон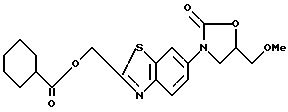
Смесь 6.2 г N-(2-бензоилоксиметилбензотиазол-6-ил)-2-гидрокси- 3-метоксипропиламина, полученного в Примере 5, и 4 г карбонилдиимидазола кипятят 3 часа в тетрагидрофуране, прибавляют по каплям 0.5 мл воды, раствор кипятят дополнительно 1 час, выливают в лед/воду, экстрагируют этилацетатом. Экстракт сушат над сульфатом натрия, раствор упаривают в вакууме, остаток хроматографируют на колонке с силикагелем (растворитель: н-гексан/этилацетат) и получают 4 г названного соединения.
1H-ЯМР (CDCl3) δ :
3.45 (3H, с), 3.68 (2H, д), 4.03 (1H, дд), 4.14 (1H, т), 4.80 (1H, м), 5.73 (2H, с), 7.49 (2H, м), 7.62 (2H, м), 8.08 (1H, д), 8.13 (2H, м), 8.28 (1H, д).
Пример 2
3-(2-Гидроксиметилбензотиазол-6-ил)-5-метоксиметил-2- оксазолидинон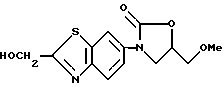
К раствору 4.7 г 3-(2-бензоилоксиметилбензотиазол-6-ил)-5- метоксиметил-2-оксазолидинона, полученного в примере 1, в метанола/диоксане (1:1) прибавляют 7.5 мл 2 N NaOH водного раствора, перемешивают 2 часа, метанол упаривают в вакууме и экстрагируют этилацетатом. Экстракт сушат, раствор упаривают в вакууме и получают 3.25 г названного соединения.
1H-ЯМР (CDCl3) δ :
3.44 (3H, с), 3.68 (2H, д), 4.02 (1H, дд), 4.14 (1H, т), 4.80 (1H, м), 5.06 (2H, д), 7.52 (1H, дд), 7.90 (1H, д), 8.21 (1H, д).
Пример 3
3-[(2-Цианометилоксиметилбензотиазол)-6-ил]-5-метоксиметил-2- оксазолидинон
Смесь 0.6 г 3-(2-гидроксиметилбензотиазол)-6-ил)-5- метоксиметил-2-оксазолидинона, полученного в Примере 2, 0.15 мл бромацетонитрила и 1.5 мл 2 N водного раствора гидроокиси натрия перемешивают 3 часа при комнатной температуре, добавляют воду и экстрагируют этилацетатом. Экстракт сушат над сульфатом натрия, раствор упаривают в вакууме, хроматографируют на колонке с силикагелем (растворитель: гексан/этилацетат) и получают 0.35 г названного соединения.
1H-ЯМР (CDCl3) δ :
3.45 (3H, с), 3.68 (2H, д), 4.02 (1H, дд), 4.14 (1H, т), 4.46 (2H, с), 4.80 (1H, м), 5.03 (2H, с), 7.60 (1H, дд), 8.00 (1H, д), 8.28 (1H, д).
Пример 4
3-[(2-Цианометиламинометилбензотиазол)-6-ил] -5- метоксиметил-2-оксазолидинон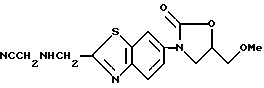
Смесь 0.6 г 3-(2-гидроксиметилбензотиазол-6-ил)-5-метоксиметил- 2-оксазолидинона, полученного в примере 2, и 0.47 г пятиокиси фосфора перемешивают 1 час при охлаждении льдом, выливают в лед/воду и экстрагируют этилацетатом. Органический слой промывают водой, сушат над сульфатом натрия, упаривают в вакууме и получают маслообразный остаток, который растворяют в диметилформамиде. К раствору добавляют 0.21 г цианометиламина гидрохлорида и 0.61 мл триэтиламина, нагревают 24 часа при 60oC, охлаждают, вносят воду и экстрагируют этилацетатом. Органический слой упаривают, хроматографируют на колонке с силикагелем (растворитель: дихлорметан/метанол) и получают 0.2 г названного соединения.
1H-ЯМР (CDCl3) δ :
3.45 (3H, с), 3.68 (2H, д), 3.78 (2H, д), 4.03 (1H, дд), 4.16 (1H, т), 4.37 (2H, д), 4.81 (1H, м), 7.56 (1H, дд), 7.97 (1H, д), 8.28 (1H, д).
Пример 5
3-[2-(5-Оксотетрагидрофуран-2-ил)бензотиазол-6-ил] - 5-метоксиметил-2-оксазолидинон
Смесь 300 г 6-амино-2-(5-оксотетрагидрофуран-2-ил)бензотиазола, полученного в Исходные. Пример 8 в 200 мл этанола и 146 г метилового эфира (S)-(-)-глицидной кислоты кипятят 10 часов, растворитель упаривают в вакууме, к остатку добавляют 8 л этилацетата. Полученный раствор пропускают через колонку с силикагелем, элюат упаривают в вакууме и получают маслообразный остаток, который растворяют в 2500 мл тетрагидрофурана, прибавляют 166 г 1,1'-карбонилдиимидазола, кипятят 2 часа, осторожно добавляют воду, кипятят 1 час, упаривают в вакууме до 1/3 первоначального объема, выливают в лед/воду и экстрагируют этилацетатом. Экстракт промывают разбавленной соляной кислотой, водным раствором бикарбоната натрия, водным солевым раствором, сушат над сульфатом магния, упаривают, остаток хроматографируют на колонке с силикагелем (хлористый метилен/этанол) и получают 166 г названного соединения.
1ЯМР (CDCl3) δ :
2.6 ~ 2.9 (4H, м), 3.43 (3H, с), 3.68 (2H, д), 4.0 ~ 4.2 (2H, м), 4.7 ~ 4.9 (1H, м), 5.8 ~ 5.9 (1H, м), 7.88 (1H, м), 8.00 (1H, д), 8.24 (1H, м).
Пример 5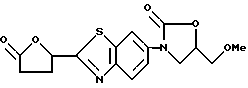
Пример 6
3-[2-(5-Оксотетрагидрофуран-2(S)-ил)бензотиазол-6-ил] - 5(R)-метоксиметил-2-оксазолидинон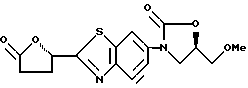
К 2.1 мл метилового эфира (S)-(-)-глицидной кислоты в 25 мл ацетонитрила прибавляют 5.2 г перхлората магния, перемешивают 10 минут при комнатной температуре, добавляют 5 г 6-амино-2-(5-оксотетрагидрофуран-2-ил)-бензотиазола, полученного в Исходные. Примере 8, перемешивают 30 минут при комнатной температуре, выливают в воду и экстрагируют этилацетатом. Органический слой промывают насыщенным водным солевым раствором, сушат, растворитель упаривают и получают 6.5 г маслообразного остатка. Остаток растворяют в 30 мл тетрагидрофурана, прибавляют 4.3 г 1,1'-карбонилдиимидазола, кипятят 1 час, охлаждают, упаривают в вакууме. Остаток обрабатывают метиленхлоридом, промывают водой, сушат, растворитель упаривают в вакууме, остаток хроматографируют на колонке с силикагелем, перекристаллизовывают из ацетона/изопропилового эфира и получают 3.8 г названного соединения.
1H-ЯМР (CDCl3) δ :
2.6 ~ 2.9 (4H, м), 3.43 (3H, с), 3.68 (2H, д), 4.0 ~ 4.2 (2H, м), 4.7 ~ 4.9 (1H, м), 5.8 ~ 5.9 (1H, м), 8.00 (1H, д), 8.24 (1H, м).
Пример 7
3-[2-(5-Гидрокситетрагидрофуран-2-ил)бензотиазол-6-ил] - 5-метоксиметил-2-оксазолидинон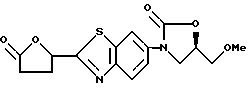
К раствору 160 г 3-[2-(5-оксотетрагидрофуран-2-ил)бензотиазол- 6-ил]-5-метоксиметил-2-оксазолидинона, полученного в примере 5, в 3000 мл тетрагидрофурана прибавляют по каплям 900 мл 1 M раствора три-трет-бутоксиалюмогидрида лития в тетрагидрофуране, перемешивают 2 часа при комнатной температуре, выливают в лед/воду, нейтрализуют разбавленной соляной кислотой и экстрагируют этилацетатом. Экстракт промывают водным бикарбонатом натрия, затем водным солевым раствором, сушат над сульфатом магния и упаривают в вакууме. Остаток хроматографируют на колонке с силикагелем (метиленхлорид/этанол) и получают 72 г названного соединения.
1H-ЯМР (CDCl3) δ :
2.0 ~ 2.8 (4H, м), 3.44 (3H, с), 3.68 (2H, д), 4.0 ~ 4.2 (2H, м) 4.7 ~ 4.9 (1H, м), 5.42 (1/2H, т), 5.60 (1/2H, кв), 5.73 (1/2H шир. с), 5.85 (1/2H, шир. с), 7.5. ~ 7.6 (1H, м), 7.9 ~ 8.0 (1H, м), 8.2 ~ 8.3 (1H, м).
Пример 8
3-[2-(1-Гидрокси-4-гидроксииминобутил)бензотиазол-6-ил] - 5-метоксиметил-2-оксазолидинон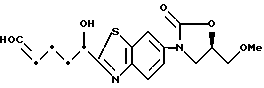
К раствору 72 г 3-[2-(5-гидрокситетрагидрофуран-2-ил)бензотиазол- 6-ил] -5-метоксиметил-2-оксазолидинона, полученного в примере 7, в 150 мл пиридина прибавляют 18.6 г гидрохлорида гидроксиламина, перемешивают 10 минут при комнатной температуре, выливают в лед/воду, экстрагируют этилацетатом. Экстракт промывают разбавленной соляной кислотой, водным раствором бикарбоната натрия, водным солевым раствором, сушат над сульфатом натрия и упаривают в вакууме. Остаток перекристаллизовывают из ацетона/диизопропилового эфира и получают 73 г названного соединения.
1H-ЯМР (CDCl3) δ :
2.0 ~ 2.3 (2H, м), 3.42 (3H, с), 3.6 ~ 3.8 (2H, м), 4.0 ~ 4.2 (2H, м), 4.8 ~ 4.9 (1H, м), 5.0 ~ 5.1 (1H, м), 5.85 (1/4H, д), 6.00 (3/4H, д), 7.5 ~ 7.7 (1H, м), 7.90 (1H, д), 8.20 (1H, д), 10.05 (3/4, с), 10.40 (1/4, м).
Пример 9
3-[2-(1(S)-Гидрокси-3-цианопропил)бензотиазол-6-ил] - 5(R)-метоксиметил-2-оксазолидинон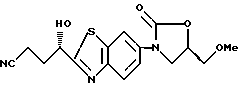
К раствору 73 г 3-[2-(1-гидрокси-3-гидроксииминопропил)бензотиазол- 6-ил] -5-метоксиметил-2-оксазолидинона, полученного в примере 8, в 800 мл тетрагидрофурана прибавляют по каплям при охлаждении льдом 90 г трифторацетилимидазола, перемешивают 4 часа при комнатной температуре, выливают в водный раствор бикарбоната натрия и экстрагируют этилацетатом. Экстракт промывают водным солевым раствором, сушат над сульфатом магния, упаривают в вакууме, полученный остаток перекристаллизовывают из ацетона/воды и получают 51 г названного соединения.
1H-ЯМР (CDCl3) δ :
2.1 ~ 2.4 (2H, м), 2.5 ~ 2.7 (2H, м), 3.42 (3H, с), 3.6 ~ 3.7 (2H. м), 3.9 ~ 4.1 (2H, м), 3.60 (1H, д), 4.7 ~ 4.9 (1H, м), 5.1 ~ 5.2 (1H, м), 7.50 (1H, дд), 7.83 (1H, д), 8.15 (1H, д). т.пл. 74 - 75oC.
Пример 10
3-[2-(1(S)-Гидрокси-3-карбамоилпропил)бензотиазол-6-ил] - 5(R)-метоксиметил-2-оксазолидинон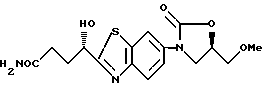
К 50 мл жидкого аммиака в герметичном сосуде при -78oC прибавляют 2.9 г 3-[2-(5-гидрокситетрагидрофуран-2-ил)бензотиазол- 6-ил] -5-метоксиметил-2-оксазолидинона, герметизируют, перемешивают 3 часа при комнатной температуре, аммиак медленно упаривают. К остатку добавляют ацетон, выпавшие кристаллы отфильтровывают, сушат и получают 2,6 г названного соединения.
1H-ЯМР (CDCl3) δ :
1.90 (1H, м), 2.20 (3H, м), 3.35 (3H, с), 3.60 (2H, м), 3.85 (1H, т), 4.20 (1H, т), 4.80 ~ 4.90 (2H, м), 6.25 (1H, д), 6.80 (1H, шир с), 7.30 (1H, шир с), 7.75 (1H, д), 7.90 (1H, д), 8.20 (1H, с).
т.пл. 170 - 171oC.
Пример 11
3-[2-(1(S)-Гидрокси-3-цианопропил)бензотиазол-6-ил] - 5(R)-метоксиметил-2-оксазолидинон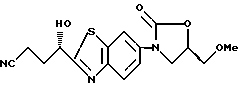
К суспензии 2.0 г 3-[2-(1(S)-гидрокси-3-карбамоилпропил)- бензотиазол-6-ил]-5(R)-метоксиметил-2-оксазолидинона в смеси 20 мл 1.4-диоксана и 3.6 мл пиридина прибавляют по каплям в течение 20 минут при охлаждении льдом 2.0 мл ангидрида трифторуксусной кислоты, перемешивают 2 часа при комнатной температуре, реакционную смесь прибавляют к насыщенному водному раствору бикарбоната натрия и экстрагируют этилацетатом. Органический слой промывают разбавленной соляной кислотой, затем насыщенным солевым водным раствором и сушат. Растворитель упаривают, остаток кристаллизуют из ацетона/воды и получают 1.6 г названного соединения.
Пример 12
3-[2-(1-гидрокси-4-цианобутил)бензотиазол-6-ил] -5- метоксиметил-2-оксазолидинон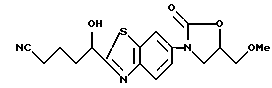
К раствору 3,48 г 3-[2-(5-оксотетрагидрофуран-2- ил)бензотиазол-6-ил]-5-метоксиметил-2-оксазолидинона, полученного в примере 5 в 20 мл безводного тетрагидрофурана при -50oC прибавляют по каплям 30 мл 1.0 М раствора диизобутилалюмогидрида в тетрагидрофуране, перемешивают 30 минут, обрабатывают по обычной методике и после перекристаллизации получают 2.8 г 3-[2-(1.4-дигидроксибутил)бензотиазол-6-ил)-5-метоксиметил-2- оксазолидинона.
1H-ЯМР (CDCl3) δ :
1.80 (2H, м), 2.00 (2H, м), 3.40 (3H, с), 3.60 ~ 3.80 (4H, м), 3.95 (1H, т), 4.10 (1H, т), 4.80 (1H, м), 5.10 (1H, м), 7.50 (1H, дд), 7.80 (1H, д), 8.05 (1H, д).
т.пл. 137 - 138oC
К 2.8 г 3-[2-(1.4-дигидроксибутил)-бензотиазол-6-ил]-5- метоксиметил-2-оксазолидинона, полученного таким образом, в 20 мл безводного метиленхлорида прибавляют 1 мл безводного триэтиламина, медленно при охлаждении льдом добавляют 0.6 мл метансульфонилхлорида, перемешивают 30 минут, вносят 100 мл эфира, фильтруют и упаривают. Остаток растворяют в 15 мл диметилсульфоксида, вносят 1.5 г цианида калия, нагревают 3 часа при 80oC, охлаждают, обрабатывают по обычной методике, очищают и получают 1,5 г названного соединения.
1H-ЯМР (CDCl3) δ :
1.90 (2H, м), 2.0 ~ 2.2 (2H, м), 2.40 (2H, т), 3.40 (3H, с), 3.65 (2H, м), 4.00 (1H, т), 4.15 (1H, т), 4.80 (1H, м), 5.10 (1H, м), 7.50 (1H, м), 7.90 (1H, т), 8.20 (1H, м).
Пример 13
(R)-3-[2-(4-Цианопиперидино)бензотиазол-6-ил]-5-метоксиметил-2- оксазолидинон гидрохлорид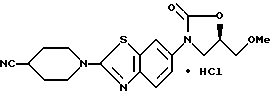
Смесь 22 г N-(6-аминобензотиазол-2-ил)-4-цианопиперидина, полученного в Исходные. Примере 14, и 11.2 мл (R)-(-)-глициновой кислоты метилового эфиров 400 мл этанола, кипятят 10 часов, этанол упаривают в вакууме, вносят 300 мл тетрагидрофурана, затем 17 г 1,1'-карбонилдиимидазола кипятят 30 минут, добавляют 50 мл воды, кипятят 30 минут, упаривают до 1/3 начального объема, выливают в лед/воду и экстрагируют этилацетатом. Экстракт промывают водой, сушат над сульфатом магния, растворитель упаривают в вакууме и очищают хроматографией на колонке с силикагелем (растворитель метиленхлорид/этанол) и получают 6.2 г названного соединения (свободного).
Продукт обрабатывают метанолом, содержащим хлористый водород, и получают названное соединение (гидрохлорид).
1H-ЯМР (свободное, CDCl3) δ :
1.9 ~ 2.1 (4H, м), 2.9 ~ 3.0 (1H, м), 3.42 (3H, с), 3.6 ~ 3.7 (4H, м), 3.8 ~ 4.1 (4H, м), 4.7 ~ 4.8 (1H, м), 7.25 (1H, дд), 7.50 (1H, д), 8.08 (1H, д).
Примеры 14 - 52
Соединения, перечисленные в таблицах 3 - 9, получают теми же способами, что и в примерах 1 - 13.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ТИОФОРМАМИДА ИЛИ ИХ ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1992 |
|
RU2125055C1 |
| ПРОИЗВОДНЫЕ ДИАЗАБИЦИКЛОАЛКЕНОВ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2126008C1 |
| 1,2,3,4-ТЕТРАГИДРОПИРАЗОЛО [5,1-c](1,2,4)ТРИАЗИН ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИНГИБИРУЮЩАЯ ВЫРАБОТКУ ИНТЕРЛЕЙКИНА-1 И ФАКТОРА НЕКРОЗА ОПУХОЛИ, СПОСОБ ПРОФИЛАКТИЧЕСКОГО ИЛИ ТЕРАПЕВТИЧЕСКОГО ЛЕЧЕНИЯ БОЛЕЗНЕЙ, ОПОСРЕДОВАННЫХ ИНТЕРЛЕЙКИНОМ-1 И ФАКТОРОМ НЕКРОЗА ОПУХОЛИ | 1994 |
|
RU2124517C1 |
| ПРОИЗВОДНЫЕ АМИНОКИСЛОТЫ | 1994 |
|
RU2127261C1 |
| ПРОИЗВОДНЫЕ ИНДОЛИЗИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ИНГИБИРОВАНИЯ ТЕСТОСТЕРОН 5α-РЕДУКТАЗЫ | 1992 |
|
RU2120942C1 |
| ПРОИЗВОДНОЕ (АЗА)ИНДОЛА И ЕГО ПРИМЕНЕНИЕ В ЛЕЧЕБНЫХ ЦЕЛЯХ | 2008 |
|
RU2477274C2 |
| ПОЛИПЕПТИДНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ПРОФИЛАКТИКИ ИЛИ/И ТЕРАПЕВТИЧЕСКОГО ЛЕЧЕНИЯ | 1994 |
|
RU2164230C2 |
| СОЕДИНЕНИЯ АЗОЛА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ПРОТИВОГРИБКОВОЙ АКТИВНОСТЬЮ | 1995 |
|
RU2142947C1 |
| ПРОИЗВОДНОЕ СУЛЬФОНАМИДА И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2014 |
|
RU2667520C9 |
| ПРОИЗВОДНЫЕ ГЕТЕРОАРИЛКАРБАМОИЛБЕНЗОЛА | 2004 |
|
RU2330030C2 |

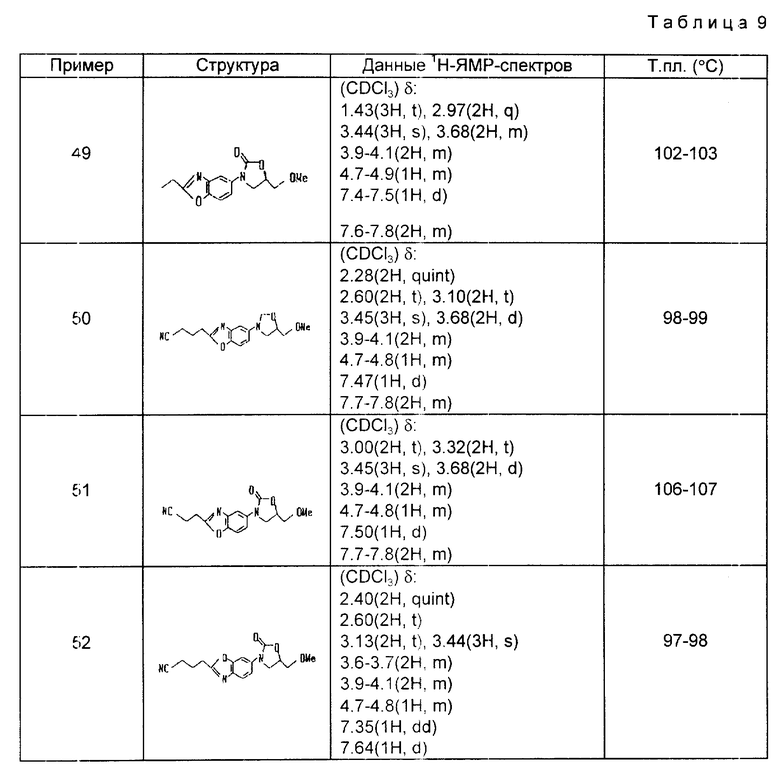
Использование: в химии гетероциклических соединений, обладающих ингибирующей моноаминооксидазу активностью. Раскрыты производные оксазолидона формулы I, 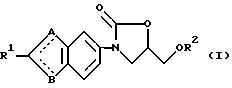 где A и B каждый представляет собой атом азота, серы или кислорода, при условии, что по крайней мере, один из них должен быть атомом азота, R1 и R2 имеют различные значения, указанные в описании, а также фармацевтическая композиция и способ лечения на их основе. 3 с. и 14 з.п. ф-лы, 9 табл.
где A и B каждый представляет собой атом азота, серы или кислорода, при условии, что по крайней мере, один из них должен быть атомом азота, R1 и R2 имеют различные значения, указанные в описании, а также фармацевтическая композиция и способ лечения на их основе. 3 с. и 14 з.п. ф-лы, 9 табл.

где A и B каждый - азот, сера или кислород, при условии, что по крайней мере один из A и B должен быть азотом;
R1 - водород, низшая алкильная, циклоалкильная, гидроксиалкильная, цианоалкенильная группы, группа общей формулы;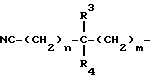
в которой n и m = 0 - 4, целое число;
R3 и R4, одинаковые или различные и каждый - водород, гидроксильная, низшая алкильная группы или группа общей формулы
в которой R7 и R8, одинаковые или различные и каждый - водород, низшая алкильная группа, или R7 и R8 могут вместе с атомом азота, с которым они связаны, образовывать кольцо, которое может быть замещено,
группа общей формулы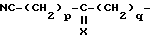
в которой p и q = 0 - 4, целое число;
Х - кислород или группа общей формулы
= N - OR9,
где R9 - водород или низший алкил,
или группа общей формулы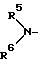
в которой R5 и R6, одинаковые или различные и каждый - водород, низшая алкильная или цианоалкильная группа, или R5 и R6 могут вместе с атомом азота, с которым они связаны, образовывать кольцо, которое может быть замещено,
или группа общей формулы
NC - (CH2)r - Y - (CH2)s-
в которой r и s = 0 - 4, целое число;
Y - кислород или группа формулы - NH- , арильная группа, цианоалкилкарбамоильную группу, альфа-бензоилоксиметил, 5-оксотетрагидрофуран-2-ил, 5-оксотетрагидрофуран-2-(S)-ил, 5-гидрокситетрагидрофуран-2-ил, 1-гидрокси-4-гидроксибутил, 4-гидрокси-4-гидроксииминобутил, 1-гидрокси-3-карбамоилпропил, 1-оксо-3-цианопропил;
R2 - водород или низшая алкильная группа;
связь 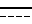 - простая или двойная связь,
- простая или двойная связь,
или его фармакологически приемлемые соли.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| US, патент, 4517197, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| US, патент, 5011849, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Машковский М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1982, т.1, с.93 и 94. | |||
Авторы
Даты
1998-08-20—Публикация
1992-09-30—Подача