Предпосылки изобретения.
а) Область изобретения
Настоящее изобретение относится к противогрибковому агенту. В частности, настоящее изобретение относится к противогрибковому агенту, используемому для лечения дерматомикоза, висцеромикоза и тому подобное. Более конкретно, настоящее изобретение относится к производному, содержащему 5-членное гетероциклическое кольцо или его конденсированное кольцо, и к его соли прибавления кислоты, которые используются в качестве противогрибковых агентов. Далее, настоящее изобретение относится к способу получения такого производного и соли прибавления кислоты и к фармацевтической композиции, содержащей производное и его фармацевтически приемлемую соль.
Кроме того, настоящее изобретение относится к промежуточным продуктам синтеза соединения азола, используемого в качестве противогрибкового агента, и к способу его получения. В частности, настоящее изобретение относится к промежуточному продукту синтеза противогрибкового агента, эффективного при лечении дерматомикоза, грибковой инфекции внутренних органов и тому подобное, и к способу его получения.
b) Описание уровня техники
В области противогрибковых агентов амфотерин В или тому подобные используются, например, при лечении mycosis profundus. Однако недавно были открыты синтетические противогрибковые агенты азольного типа. Даже в этих агентах азольного типа, однако, имеется настоятельная потребность для развития более эффективного противогрибкового агента с точки зрения их действия на пациентов с подавленной иммунной функцией.
Например, японская открытая патентная публикация (KOKAI) N 70885/1982 описывает триазольное соединение в качестве противогрибкового агента азольного типа. Кроме того, японская открытая патентная публикация (KOKAI) N 224689/1985 описывает производное (1,2,4-триазол-1-ил)метилкарбинола.
Настоящее изобретение предлагает противогрибковый агент, более эффективный, чем известные противогрибковые агенты, и его промежуточные продукты.
Сущность изобретения.
Авторы настоящего изобретения провели глубокие исследования. Результатом являются следующие изобретения:
I. Соединение, представленное общей формулой: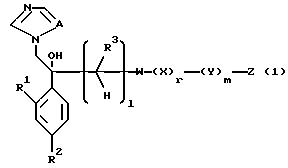
где R1 и R2 - одинаковы или отличаются друг от друга и обозначают каждый атом галогена или атом водорода;
R3 означает атом водорода или низшую алкильную группу;
l, r и m могут быть одинаковы или отличаться друг от друга и представляют каждый 0 или 1;
A представляет N или CH;
W обозначает ароматическое кольцо или его конденсированное кольцо, которое может иметь один или более гетероатомов и может иметь один или более заместителей; либо обозначает ароматическое кольцо или его конденсированное кольцо, где часть или все ароматическое кольцо или его конденсированное кольцо, которые могут иметь один или более гетероатомов, и может иметь один или более заместителей, являются насыщенными;
X означает ароматическое кольцо, которое может иметь один или более заместителей и может содержать один или более гетероатомов, выбранных из N, S и O, алкандиильной группы, которая может иметь один или более заместителей, алкендиильной группы, которая может иметь один или более заместителей, или алкиндиильной группы, которая может иметь один или более заместителей;
Y представляет группу, представленную -S-, 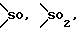
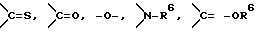 или -(CH2)j-, в которых R6 означает атом водорода или низшую алкильную группу и j представляет целое число 1-4; и
или -(CH2)j-, в которых R6 означает атом водорода или низшую алкильную группу и j представляет целое число 1-4; и
Z обозначает атом водорода, атом галогена, низшую алкильную группу, галогенированную низшую алкильную группу, низшую алкоксильную группу, галогенированную низшую алкоксильную группу, гидроксильную группу, тиоловую группу, нитрогруппу, цианогруппу, низшую алканоильную группу, фенильную группу, которая может иметь один или более заместителей, феноксильную группу, которая может иметь один или более заместителей, имидазолильную группу, которая может иметь один или более заместителей, триазолильную группу, которая может иметь одни или более заместителей, тетразолильную группу, которая может иметь один или более заместителей, или аминогруппу, которая может иметь один или более заместителей, за исключением случая, когда W является тиазольным кольцом, R3 является метильной группой и Z является атомом водорода, когда l = 1 и r = m = 0,
или его соль.
II. Способ получения оптически активного (2S,3R)-3-(2,4- дифторфенил)-3-гидрокси-2-метил-4-(1H-1,2,4-триазол-1- ил)бутиронитрила, который включает взаимодействие оптически активного (2R,3S)-2-(2,4-дифторфенил)-3-метил-2-(1H-1,2,4-триазол- 1-ил)метилоксирана с цианидом диэтилалюминия.
III. Способ получения оптически активного (2S,3R)-3-(2,4- дифторфенил)-3-гидрокси-2-метил-4-(1H-1,2,4-триазол-1- ил)бутиронитрила, который включает взаимодействие оптически активного (2R,3S)-3-(2,4-дифторфенил)-3-метил-2-(1H-1,2,4-триазол- 1-ил)метилоксирана с цианидом иттербия.
IV. Способ стереоселективного получения оптически активного (2S,3R)-3-(2,4-дифторфенил)-3-гидрокси-2-метил-4-(1H-1,2,4- триазол-1-ил)бутиронитрила, который включает взаимодействие оптически активного (2R, 3S)-3-(2,4-дифторфенил)-3-метил-2- (1H-1,2,4-триазол-1-ил)метилоксирана с ацетонцианогидрином.
V. Способ получения соединения, представленного формулой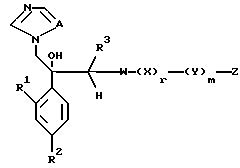
где W означает замещенное триазольное кольцо, и
A, R1, R2, R3, X, Y, Z, r и m определены выше,
или его соли прибавления кислоты, который включает взаимодействие соединения, представленного формулой:
где A, R1, R2 и R3 определены выше, с соединением, представленным формулой: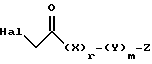
где Hal обозначает Br или Cl, и X, Y, Z, r и m определены выше.
VI. Способ получения соединения, представленного формулой: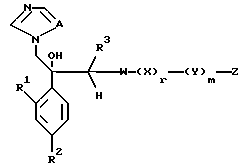
где A, R1, R2, R3, X, Y, Z, r и m определены выше, и означает замещенное или незамещенное азотсодержащее 5-членное гетероциклическое кольцо или его конденсированное кольцо;
или его соли прибавления кислоты, который включает взаимодействие соединения, представленного формулой: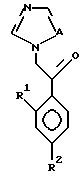
где A, R1 и R2 определены выше,
с соединением, представленным формулой:
где D является группой, содержащей замещенное или незамещенное азотсодержащее 5-членное гетероциклическое кольцо или его конденсированное кольцо, и
Z является водородом или CH3.
VII. Способ получения соединения, представленного формулой: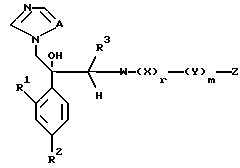
где W означает замещенное или незамещенное 5-членное гетероциклическое или его конденсированное кольцо,
A, R1, R2, R3, X, Y, Z, r и m определены выше,
или его соли прибавления кислоты, который включает взаимодействие соединения, представленного формулой: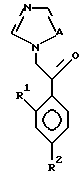
с соединением, представленным формулой: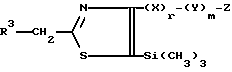
где R3, X, Y, Z, r и m определены выше.
VIII. Способ получения соединения, представленного формулой: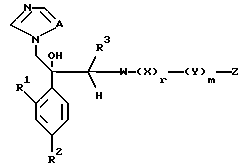
где A, R1, R2, R3, W, X, Y, Z, r и m определены выше,
или его соли прибавления кислоты, который включает взаимодействие соединения, представленного формулой: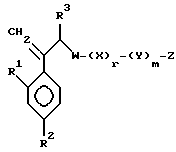
где A, R1, R2, R3, W, X, Y, Z, r и m определены выше,
с мета-хлорпербензойной кислотой и затем с натрий 1,2,4-триазолом или натрий 1,3-имидазолом.
IX. Фармацевтическая композиция, содержащая соединение, представленное общей формулой: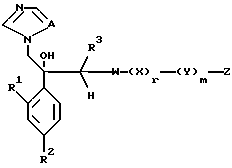
где R1 и R2 - одинаковы или отличаются друг от друга и обозначают каждый атом галогена или атом водорода;
R3 обозначает атом водорода или низшую алкильную группу;
r и m могут быть одинаковыми или отличаться друг от друга и представляют каждый 0 или 1;
A является N или CH;
W обозначает ароматическое кольцо, которое может иметь один или более заместителей и может содержать один или более гетероатомов, выбранных из N, S и O, или его конденсированное кольцо;
X означает ароматическое кольцо, которое может иметь один или более заместителей и может содержать один или более гетероатомов, выбранных из N, S и O, алкандиильной группы, которая может иметь один или более заместителей, алкендиильной группы, которая может иметь один или более заместителей, или алкиндиильной группы, которая может иметь один или более заместителей;
Y представляет группу, представленную -S-, 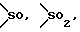
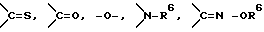 или -(CH2)j-, в которых R6 означает атом водорода или низшую алкильную группу и j представляет целое число 1-4;
или -(CH2)j-, в которых R6 означает атом водорода или низшую алкильную группу и j представляет целое число 1-4;
Z обозначает атом водорода, атом галогена, низшую алкильную группу, галогенированную низшую алкильную группу, низшую алкоксильную группу, галогенированную низшую алкоксильную группу, гидроксильную группу, тиоловую группу, нитрогруппу, цианогруппу, низшую алканоильную группу, фенильную группу, которая может иметь один или более заместителей, феноксильную группу, которая может иметь один или более заместителей, имидазолильную группу, которая может иметь один или более заместителей, триазолильную группу, которая может иметь один или более заместителей, тетразолильную группу, которая может иметь один или более заместителей, или аминогруппу, которая может иметь один или более заместителей, за исключением случая, когда W является тиазольным кольцом, R3 является метильной группой и Z обозначает атом водорода, когда r = m = 0,
или его соль прибавления кислоты и фармацевтически приемлемую соль.
X. Способ получения производного, представленного общей формулой: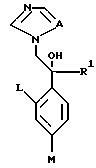
где A является =CH- или =N-;
L и M одинаковы или отличаются друг от друга и обозначают каждый атом галогена или атом водорода;
R1 означает 5-членное гетероциклическое кольцо, которое может содержать один или более других гетероатомов в дополнение к атому серы и имеет заместитель; или конденсированное кольцо 5-членного гетероциклического кольца, которое может содержать один или более других гетероатомов в дополнение к атому серы и имеет заместитель, с ароматическим кольцом, которое может содержать один или более гетероатомов и может иметь заместитель; или его частично или полностью насыщенное конденсированное кольцо;
или его соли прибавления кислоты, который включает получение производного или его соли прибавления кислоты путем добавления 2-галогенацетофенона, представленного общей формулой: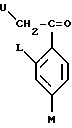
где U обозначает атом галогена,
L и M определены выше;
к соединению, содержащему 5-членное гетероциклическое кольцо, или его конденсированное кольцо, или его частично или полностью насыщенное конденсированное кольцо, в присутствии н-алкиллития, для их взаимодействия и затем добавление 1,2,4-триазола и гидрида натрия к полученному продукту реакции для их взаимодействия.
XI. Способ получения производного, представленного общей формулой: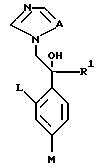
где A является =CH- или =N-;
L и M - одинаковы или отличаются друг от друга и обозначают каждый атом галогена или атом водорода;
R1 обозначает 5-членное гетероциклическое кольцо, которое может содержать один или более другие гетероатомы в дополнение к атому серы и имеет заместитель; или конденсированное кольцо 5-членного гетероциклического кольца, которое может содержать один или более другие гетероатомы в дополнение к атому серы и имеет заместитель, с ароматическим кольцом, которое может содержать один или более гетероатомов и может иметь заместитель; или его частично или полностью насыщенное конденсированное кольцо;
или его соли прибавления кислоты, который включает получение производного или его соли прибавления кислоты взаимодействием его соответствующего производного, содержащего цианофенилзамещенное 5-членное гетероциклическое кольцо, с азидом натрия и гидрохлоридом триэтиламина.
XII. Способ получения производного, представленного общей формулой: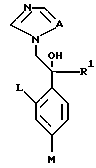
где A является =CH- или =N-;
L и M - одинаковы или отличаются друг от друга и обозначают каждый атом галогена или атом водорода;
R1 означает 5-членное гетероциклическое кольцо, которое может содержать один или более других гетероатомов в дополнение к атому серы и имеет заместитель; или конденсированное кольцо 5-членного гетероциклического кольца, которое может содержать один или более других гетероатомов в дополнение к атому серы и имеет заместитель, с ароматическим кольцом, которое может содержать один или более гетероатомов и может иметь заместитель; или его частично или полностью насыщенное конденсированное кольцо;
причем указанные производные замещены алкильной группой в 3- или 4-положении тетразольного кольца, или его соли прибавления кислоты, который включает получение производного или его соли прибавления кислоты взаимодействием его соответствующего производного, содержащего тетразолфенилзамещенное 5-членное гетероциклическое кольцо, с алкилгалогенидом.
XIII. Способ получения производного, представленного общей формулой: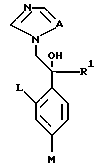
где A является =CH- или =N-;
L и M - одинаковы или отличаются друг от друга и обозначают каждый атом галогена или атом водорода;
R1 означает 5-членное гетероциклическое кольцо, которое может содержать один или более других гетероатомов в дополнение к атому серы и имеет заместитель; или конденсированное кольцо 5-членного гетероциклического кольца, которое может содержать один или более других гетероатомов в дополнение к атому серы и имеет заместитель, с ароматическим кольцом, которое может содержать один или более гетероатомов и может иметь заместитель; или его частично или полностью насыщенное конденсированное кольцо;
причем указанные производные замещены алкильной группой в 3- или 4-положении тетразольного кольца, или его соли прибавления кислоты, который включает получение производного или его соли прибавления кислоты взаимодействием его соответствующего производного, содержащего галогенфенилзамещенное 5-членное гетероциклическое кольцо, с 1,2,4-тетразолом и гидридом натрия.
XIV. Способ получения производного, представленного общей формулой: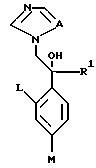
где A является =CH- или =N-;
L и M - одинаковы или отличаются друг от друга и обозначают каждый атом галогена или атом водорода;
R1 означает 5-членное гетероциклическое кольцо, которое может содержать один или более других гетероатомов в дополнение к атому серы и имеет заместитель; или конденсированное кольцо 5-членного гетероциклического кольца, которое может содержать один или более других гетероатомов в дополнение к атому серы и имеет заместитель, с ароматическим кольцом, которое может содержать один или более гетероатомов и может иметь заместитель; или его частично или полностью насыщенное конденсированное кольцо;
причем указанные производные замещены алкильной группой в 3- или 4-положении тетразольного кольца, или его соли прибавления кислоты, который включает получение производного или его соли прибавления кислоты взаимодействием его соответствующего производного, содержащего (1,2,4-тетразол-1-ил)этанол.
XV. Способ получения соединения, представленного общей формулой: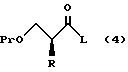
где R означает низшую алкильную группу; обозначает защитную группу для гидроксильной группы; и представляет уходящую группу;
или его соли, который включает введение защиты для гидроксильной группы соединения, представленного общей формулой:
где R означает ту же группу, что определена выше, и
R1 обозначает атом водорода или защитную группу для карбоксильной группы путем введения защитной группы с получением соединения, представленного общей формулой: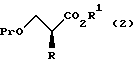
где R, R1 и Pr, каждый, означают те же группы, что определены выше,
с последующим снятием защитной группы у карбоксильной группы соединения, представленного общей формулой (2) с получением соединения, представленного общей формулой: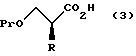
где R и Pr, каждый, означает те же группы, что определены выше,
и далее взаимодействие соединения, представленного общей формулой (3), с соединением, представленным формулой: LH, в котором L означает ту же группу, что указана выше.
XVI. Способ получения соединения, представленного общей формулой: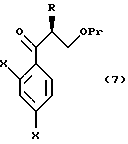
где R означает низшую алкильную группу;
X являются одинаковыми или отличаются друг от друга и обозначают каждый атом водорода или галогена;
Pr представляет защитную группу для гидроксильной группы,
или его соли, который включает взаимодействие соединения, представленного общей формулой: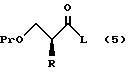
где R и Pr, каждый, означают те же группы, что определены выше,
L обозначает уходящую группу,
с соединением, представленным общей формулой: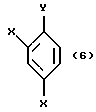
где X, каждый, означают те же группы, что определены выше, и
Y означает атом хлора, брома или иода,
или его реакционноспособным производным.
XVII. Способ получения соединения, представленного общей формулой: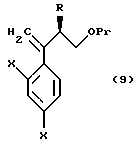
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают каждый атом водорода или галогена,
Pr представляет защитную группу для гидроксильной группы,
или его соли, который включает взаимодействие соединения, представленного общей формулой: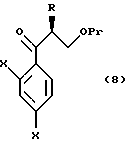
где R, X и Pr, каждый, означают те же группы, что определены выше, с трифенилфосфоний метилидом, полученным из метилтрифенилфосфонийхлорида, метилтрифенилфосфонийбромида или метилтрифенилфосфонийиодида, или с триметилсилилметилмагний хлоридом, триметилсилилметилмагний бромидом или триметилсилилметиллитием.
XVIII. Способ получения соединения, представленного общей формулой:
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают каждый атом водорода или галогена,
Pr представляет защитную группу для гидроксильной группы,
или его соли, который включает взаимодействие соединения, представленного общей формулой: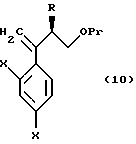
где R, X и Pr, каждый, означают те же группы, что определены выше,
с пероксикислотой.
XIX. Способ получения соединения, представленного общей формулой: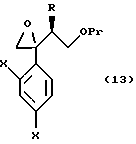
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают каждый атом водорода или галогена,
Pr представляет защитную группу для гидроксильной группы,
или его соли, который включает взаимодействие соединения, представленного общей формулой: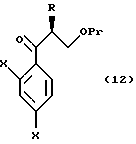
где R, X и Pr, каждый, означают те же группы, что определены выше,
с хлорметиллитием, полученным из хлориодметана или бромхлорметана, или с диметилсульфоксонийметилидом, диметилсульфонийметилидом, диэтилсульфоксонийметилидом или диэтилсульфонийметилидом.
XX. Способ получения соединения, представленного общей формулой:
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают каждый атом водорода или галогена,
Pr представляет защитную группу для гидроксильной группы,
или его соли, который включает взаимодействие соединения, представленного общей формулой: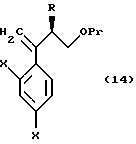
где R, X и Pr, каждый, означают те же группы, что определены выше,
с окислительным агентом.
XXI. Способ получения соединения, представленного общей формулой: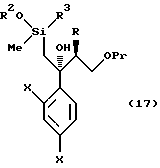
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают каждый атом водорода или галогена,
Pr представляет защитную группу для гидроксильной группы,
R2 означает низшую алкильную группу,
R3 обозначает метил или низшую алкоксильную группу,
или его соли, который включает взаимодействие соединения, представленного общей формулой: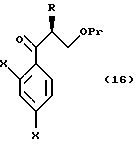
где R, X и Pr, каждый, означают те же группы, что определены выше,
с алкоксидиметилсилилметилмагний галогеном или диалкоксиметилсилилметилмагний галогеном.
XXII. Способ получения соединения, представленного общей формулой: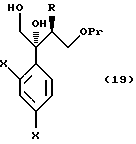
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают каждый атом водорода или галогена,
Pr представляет защитную группу для гидроксильной группы,
или его соли, который включает взаимодействие соединения, представленного общей формулой: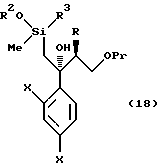
где R, X и Pr каждый, означают те же группы, что определены выше,
R2 означает низшую алкильную группу,
R3 обозначает метил или низшую алкоксильную группу,
с пероксикислотой в присутствии основания.
XXIII. Способ получения соединения, представленного общей формулой: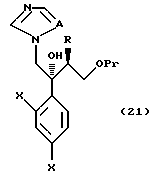
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают каждый атом водорода или галогена,
Pr представляет защитную группу для гидроксильной группы,
A означает CH или атом азота,
или его соли, который включает взаимодействие соединения, представленного общей формулой: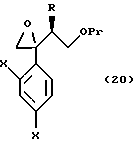
где R, X и Pr, каждый, означают те же группы, что определены выше,
с 1,2,4-триазолом или имидазолом или его солью.
XXIV. Способ получения соединения, представленного общей формулой: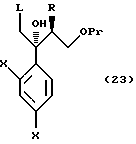
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают каждый атом водорода или галогена и
Pr представляет защитную группу для гидроксильной группы и означает уходящую группу,
или его соли, который включает галогенирование, алкилсульфонирование или арилсульфонирование соединения, представленного общей формулой: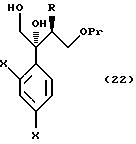
где R, X и Pr, каждый, означают те же группы, что определены выше.
XXV. Способ получения соединения, представленного общей формулой: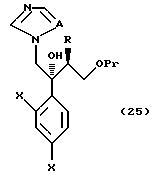
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают каждый атом водорода или галогена,
Pr представляет защитную группу для гидроксильной группы,
A означает CH или атом азота,
или его соли, который включает взаимодействие соединения, представленного общей формулой: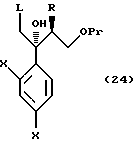
где R, X и Pr, каждый, означают те же группы, что определены выше,
L означает уходящую группу,
с 1,2,4-триазолом или имидазолом или его солью.
XXVI. Способ получения соединения, представленного общей формулой: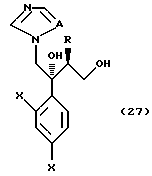
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают каждый атом водорода или галогена,
A означает CH или атом азота,
или его соли, который включает снятие Pr, который является защитной группой для гидроксильной группы соединения, представленного общей формулой: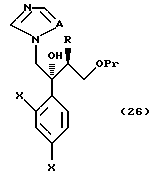
где R, X и A, каждый, означают те же группы, что определены выше,
Pr является защитной группой для гидроксильной группы.
XXVII. Способ получения соединения, представленного общей формулой: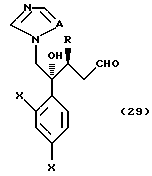
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают каждый атом водорода или галогена,
A означает CH или атом азота,
или его соли, который включает взаимодействие соединения, представленного общей формулой: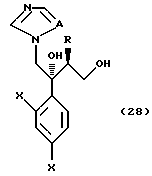
где R, X и A, каждый, означают те же группы, что определены выше,
с окислительным агентом.
XXVIII. Способ получения соединения, представленного общей формулой:
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают каждый атом водорода или галогена,
A означает CH или атом азота,
или его соли, который включает взаимодействие соединения, представленного общей формулой: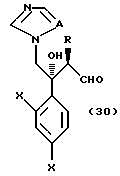
где R, X и A, каждый, означает те же группы, что определены выше,
с производными гидроксиламина.
XXIX. Фармацевтическая композиция, содержащая соединение, представленное общей формулой: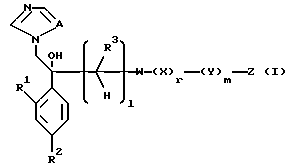
где R1 и R2 - одинаковы или отличаются друг от друга и обозначают каждый атом галогена или атом водорода;
R3 означает атом водорода или низшую алкильную группу;
l, r и m могут быть одинаковы или отличаться друг от друга и представляют каждый 0 или 1;
A является N или CH;
W обозначает ароматическое кольцо или его конденсированное кольцо, которое может иметь один или более гетероатомов и может иметь один или более заместителей, либо
W обозначает ароматическое кольцо или его конденсированное кольцо, где часть или все ароматическое кольцо или его конденсированное кольцо, которые могут иметь один или более гетероатомов и может иметь один или более заместителей, являются насыщенными,
X означает ароматическое кольцо, которое может иметь один или более заместителей и может содержать один или более гетероатомов, выбранных из N, S и O, алкандиильной группы, которая может иметь один или более заместителей, алкендиильной группы, которая может иметь один или более заместителей, или алкиндиильной группы, которая может иметь один или более заместителей; представляет группу, представленную -S-, 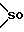 или
или 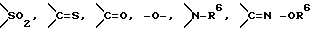 -(CH2)j-, в которых R6 означает атом водорода или низшую алкильную группу и j представляет целое число 1-4; и
-(CH2)j-, в которых R6 означает атом водорода или низшую алкильную группу и j представляет целое число 1-4; и
Z обозначает атом водорода, атом галогена, низшую алкильную группу, галогенированную низшую алкильную группу, низшую алкоксильную группу, галогенированную низшую алкоксильную группу, гидроксильную группу, тиоловую группу, нитрогруппу, цианогруппу, низшую алканоильную группу, фенильную группу, которая может иметь один или более заместителей, феноксильную группу, которая может иметь один или более заместителей, имидазолильную группу, которая может иметь один или более заместителей, триазолильную группу, которая может иметь один или более заместителей, тетразолильную группу, которая может иметь один или более заместителей, или аминогруппу, которая может иметь один или более заместителей, за исключением случая, когда W является триазольным кольцом, R3 является метильной группой и Z является атомом водорода, когда l = 1 и r = m = 0,
или его соль прибавления кислоты и фармацевтически приемлемую соль.
Подробное описание изобретения и предпочтительные варианты осуществления.
Настоящее изобретение относится к производному, представленному общей формулой (I)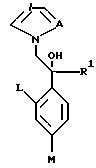
где A является =CH- или =N-,
L и М - одинаковы или отличаются друг от друга и обозначают каждый атом галогена или атом водорода, и
R1 означает 5-членное гетероциклическое кольцо, которое может содержать один или более других гетероатомов в дополнение к атому серы и имеет заместитель; или конденсированное кольцо 5-членного гетероциклического кольца, которое может содержать один или более других гетероатомов в дополнение к атому серы и имеет заместитель, с ароматическим кольцом, которое может содержать один или более гетероатомов и может иметь заместитель; или его частично или полностью насыщенное конденсированное кольцо,
или его соли прибавления кислоты, обладающие превосходными противогрибковыми свойствами.
Производные согласно настоящему изобретению могут быть получены различными путями синтеза. Некоторые из них показаны в примерах далее.
Процесс A:
2-Хлор-2',4'-дифторацетофенон прибавляют к 4-(2,4-дифторфенил)триазолу в присутствии н-бутиллития. После обработки продукта реакции добавляют 1,2,4-триазол и гидрид натрия и получают 1-(2,4-дифторфенил)-1-(4-(2,4-дифторфенил)тиазол-2-ил)- 2-(1H-1,2,4-триазол-1-ил)этанол.
Процесс B:
(1) 2-Хлор-2', 4'-дифторацетофенон прибавляют к 6-цианобензотиазолу в присутствии н-бутиллития с получением 1-(2,4-дифторфенил)-1- (6-цианобензотиазол-2-ил)-2-хлорэтанола.
(2) 1,2,4-Триазол прибавляют к суспензии гидрида натрия в диметилформамиде. К этой суспензии прибавляют 1-(2,4-дифторфенил)- 1-(6-цианобензотиазол-2-ил)-2-хлорэтанол, полученный на стадии (1), с получением 1-(2,4-дифторфенил)-1-(6-цианобензотиазол-2-ил)-2- (1H-1,2,4,триазол-1-ил)этанола.
Процесс C:
1-(2,4-Дифторфенил)-1-(4-(4-цианофенил)тиазол-2-ил)-2- (1H-1,2,4-триазол-1-ил)этанол взаимодействует с азидом натрия и гидрохлоридом триэтиламина с получением 1-(2,4-дифторфенил)-1- [4-[(4-(5-тетразол)фенил)тиазол]-2-ил] -2-(1H-1,2,4-триазол-1- ил)этанола.
Процесс D:
Метилиодид взаимодействует с 1-(2,4-дифторфенил)-1-[4-[(4- (5-тетразол)фенил)тиазол] -2-ил] -2-(1H-1,2,4-триазол-1- ил)этанолом, полученным по вышеописанному процессу C, с получением двух изомеров, в которых метильная группа замещена в 3- и 4-положениях тетразольного кольца.
Процесс E:
1-(2,4-Дифторфенил)-1-(2-(4-фторфенил)тиазол-5-ил)-2- (1H-1,2,4-триазол-1-ил)этанол взаимодействует с 1,2,4-триазолом и гидридом натрия с получением 1-(2,4-дифторфенил)-1-[2-[(4-(1-1H- 1,2,4-триазол)фенил)тиазол]-5-ил)-2-(1H-1,2,4-триазол-1- ил)этанола.
Процесс F:
1-(2,4-Дифторфенил)-1-(6-тиокарбамоилбензотиазол-2-ил)-2- (2-(1H-1,2,4-триазол-1-ил)этанол взаимодействует с гидрокарбонатом натрия и бромацетоном с получением 1-(2,4- дифторфенил)-1-(6-(3-метилтиазол-1-ил)бензотиазол-2-ил)-2-(2-(1H-1,2,4- триазол-1-ил)этанола.
Процесс G:
1-(2,4-Дифторфенил)-1-(6-цианобензотиазол-2-ил)-2-(2- (1H-1,2,4-триазол-1-ил)этанол и триэтиламин растворяют в диметилформамиде. В полученный раствор пропускают сероводород для реакции с ним, получая таким образом 1-(2,4-дифторфенил)-1-(6- тиокарбамоилбензотиазол-2-ил)-2-(2-(1H-1,2,4-триазол-1-ил)этанол.
Процесс H:
1-(2,4-Дифторфенил)-1-(6-тиокарбамоилбензотиазол-2-ил)-2- (1H-1,2,4-триазол-1-ил)этанол подвергают взаимодействию с диметилацеталем бромацетальдегида с получением 1-(2,4- дифторфенил)-1-(6-тиазол-1-ил)бензотиазол-2-ил-2-(1H-1,2,4-триазол-1- ил)этанола.
Процесс I:
(1) 1-(2,4-Дифторфенил)-1-(4-тиокарбамоилтиофен-2-ил)-2- (1H-1,2,4-триазол-1-ил)этанол подвергают взаимодействию с α -бромэтилпировиноградной кислотой с получением 1-(2,4- дифторфенил)-1-(4-этоксикарбонилтиазол-2-ил)тиофен-2-ил)-2- (1H-1,2,4-триазол-1-ил)этанола (A).
(2) Полученное таким образом соединение (A) растворяют в насыщенном аммиаком метанольном растворе и полученный раствор оставляют стоять для прохождения взаимодействия между соединением (1) и аммиаком с получением 1-(2,4-дифторфенил)-1-(4-(4- карбамоилтиазол-2-ил)тиофен-2-ил)-2-(1H-1,2,4-триазол-1-ил)этанола (В).
Процесс J:
Соединение (В), полученное на стадии (2) вышеописанного процесса 1, растворяют в пиридине и подвергают взаимодействию с оксихлоридом фосфора с получением 1-(2,4-дифторфенил)-1-(4-(4- цианотиазол-2-ил)тиофен-2-ил)-2-(1H-1,2,4-триазол-1- ил)этанола.
В качестве примеров растворителей, используемых по настоящему изобретению, можно отметить низшие спирты, такие как метанол, этанол, пропанол и бутанол, полигидроспирты, такие как этиленгликоль; кетоны, такие как ацетон, метилэтилкетон, диэтилкетон и циклогексанон, простые эфиры, такие как диэтиловый эфир, изопропиловый эфир, тетрагидрофуран, диоксан, 2-метоксиэтанол и 1,2-диметоксиэтан; нитрилы, такие как ацетонитрил и пропионитрил; сложные эфиры, такие как метилацетат, этилацетат, бутилацетат и диэтилфталат; галогенированные углеводороды, такие как дихлорметан, хлороформ, четыреххлористый углерод, 1,2-дихлорэтан, трихлорэтилен и тетрахлорэтилен; ароматические соединения, такие как бензол, толуол, ксилол, монохлорбензол, нитробензол, индол, пиридин, хинолин, коллидин и фенол; углеводороды, такие как пентан, циклогексан, гексан, гептан, октан, изооктан, петролейный эфир и петролейный бензин; амины, такие как этаноламин, диэтиламин, триэтиламин, пирролидин, пиперидин, пиперазин, морфолин, анилин, диметиланилин, бензиламин и толуидин; амиды, такие как формамид, N-метилпирролидон, N,N-диметилимидазолон, N, N-диметилацетамид и N,N-диметилформамид; амиды фосфорной кислоты, такие как триамид гексаметилфосфорной кислоты и триамид гексаметилфосфорной кислоты; органические кислоты, такие как муравьиная кислота, уксусная кислота, дифторуксусная кислота, трифторуксусная кислота и хлоруксусная кислота; сульфоксиды, такие как диметилсульфоксид; сульфиды углерода, такие как дисульфид углерода; вода и другие обычно используемые растворители. Эти растворители могут быть простыми растворителями или смесями двух или трех растворителей. Нет особых ограничений, накладываемых на соотношение между смешиваемыми растворителями.
В качестве фармацевтически приемлемых солей производных солей прибавления кислоты согласно настоящему изобретению можно указать следующие соли.
A именно, в качестве примеров неорганических солей можно указать соли щелочных металлов, таких как соли натрия и соли калия; соли аммония, соли тетраэтиламмония, четвертичные аммониевые соли, такие как соли бетаина; соли щелочноземельных металлов, таких как соли кальция и соли магния; и соли неорганических кислот, такие как гидрохлориды, гидробромиды, сульфаты, карбонаты и гидрокарбонаты.
С другой стороны, в качестве примеров органических солей можно указать органические карбоксилаты, такие как ацетаты, малеаты, лактаты и тартраты; органические сульфонаты, такие как метансульфонаты, гидроксиметансульфонаты, гидроксиэтансульфонаты, соли тауриновых кислот, бензолсульфонаты и толуолсульфонаты; соли аминокислот, такие как соли аргинина, лизина, серина, аспартаты, глутаматы и глицинаты; соли амина, такие как соли триэтиламина, соли триметиламина, соли пиридина, соли прокаина, соли пиколина, соли дициклогексиламина, соли N,N-дибензилэтилендиамина, соли N-метилглюкамина, соли диэтаноламина, соли триэтаноламина, соли трис(гидроксиметиламино)метана и соли фенетилбензиламина.
Далее настоящее изобретение относится к соединению, представленному общей формулой (I)
где R1 и R2 - одинаковы или отличаются друг от друга и обозначают каждый атом галогена или атом водорода;
R3 означает атом водорода или низшую алкильную группу;
r и m могут быть одинаковы или отличаться друг от друга и представляют каждый 0 или 1;
A является N или CH;
W - обозначает ароматическое кольцо, которое может иметь один или более заместителей и может содержать один или более гетероатомов, выбранных из N, S и O, или его конденсированное кольцо;
X означает ароматическое кольцо, которое может иметь один или более заместителей и может содержать один или более гетероатомов, выбранных из N, S и O, алкандиильной группы, которая может иметь один или более заместителей, алкендиильной группы, которая может иметь один или более заместителей, или алкиндиильной группы, которая может иметь один или более заместителей;
Y представляет группу, представленную -S-, 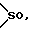
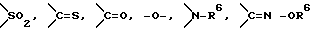 или -(CH2)j-, в которых R6 означает атом водорода или низшую алкильную группу и j представляет целое число 1-4; и
или -(CH2)j-, в которых R6 означает атом водорода или низшую алкильную группу и j представляет целое число 1-4; и
Z обозначает атом водорода, атом галогена, низшую алкильную группу, галогенированную низшую алкильную группу, низшую алкоксильную группу, галогенированную низшую алкоксильную группу, гидроксильную группу, тиоловую группу, нитрогруппу, цианогруппу, низшую алканоильную группу, фенильную группу, которая может иметь один или более заместителей, феноксильную группу, которая может иметь один или более заместителей, имидазолильную группу, которая может иметь один или более заместителей, триазолильную группу, которая может иметь один или более заместителей, тетразолильную группу, которая может иметь один или более заместителей, или аминогруппу, которая может иметь один или более заместителей, за исключением случая, когда W является триазольным кольцом, R3 является метильной группой и Z обозначает атом водорода, когда l = 1 и r = m = 0,
или его соль прибавления кислоты, обладающая превосходными противогрибковыми свойствами.
Соединения согласно настоящему изобретению могут быть получены различными путями синтеза. Некоторые из них показаны в примерах далее.
I путь:
Соединение формулы: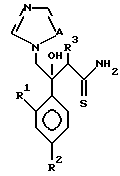
где A, R1, R2 и R3 определены выше
подвергают взаимодействию с соединением формулы: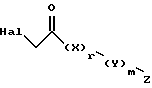
где Hal является Br или Cl, и
X, Y, Z, r и m, определены выше,
с получением посредством этого соединения, представленного формулой: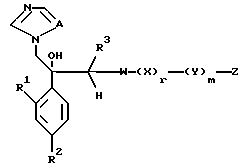
где W является группой, содержащей замещенный азол, и
A, R1, R2, R3, X, Y, Z, r и m определены выше.
II путь:
Соединение формулы: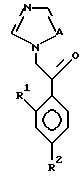
где A, R1 и R2 определены выше,
подвергают взаимодействию с соединением формулы:
где D является группой, содержащей замещенное или незамещенное, азотсодержащее 5-членное гетероциклическое кольцо или конденсированное кольцо, и
Z является водородом или CH3,
с получением посредством этого соединения, представленного формулой: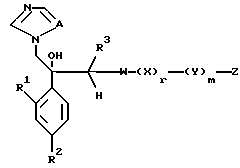
где W является замещенным или незамещенным, азотсодержащим 5-членным гетероциклическим кольцом или конденсированным кольцом, и
A, R1, R2, R3, X, Y, Z, r и m определены выше.
III путь:
Соединение формулы: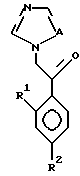
где A, R1 и R2 определены выше,
подвергают взаимодействию с соединением формулы: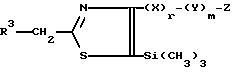
где R3, X, Y, Z, r и m определены выше,
с получением посредством этого соединения, представленного формулой: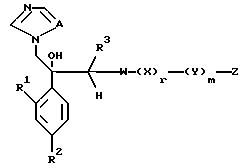
где W является группой, содержащей замещенное или незамещенное 5-членное гетероциклическое кольцо или конденсированное кольцо, и
A, R1, R2, R3, X, Y, Z, r и m определены выше.
IV путь:
Соединение формулы: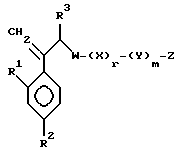
где R1, R2, R3, W, X, Y, Z, r и m определены выше,
подвергают взаимодействию с мета-хлорпербензойной кислотой и затем с натрий 1,2,4-триазолом или натрий 1,3-имидазолом с получением посредством этого соединения, представленного формулой: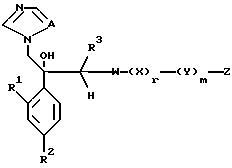
где A, R1, R2, R3, W, X, Y, Z, r и m определены выше.
В качестве кислоты, образующей соль прибавления кислоты соединения в соответствии с настоящим изобретением, могут быть использованы обычные неорганические кислоты, такие как соляная кислота и серная кислота, органические кислоты, такие как уксусная кислота и лимонная кислота. Предпочтительными кислотами являются соляная и уксусная кислоты.
В качестве примеров растворителей, применяемых по настоящему изобретению, могут быть указаны низшие спирты, такие как метанол, этанол, пропанол и бутанол; полигидроспирты, такие как этиленгликоль; кетоны, такие как ацетон, метилэтилкетон, диэтилкетон и циклогексанон; простые эфиры, такие как диэтиловый эфир, изопропиловый эфир, тетрагидрофуран, диоксан, 2-метоксиэтанол и 1,2-диметоксиэтан; нитрилы, такие как ацетонитрил и пропионитрил; сложные эфиры, такие как метилацетат, этилацетат, изопропилацетат, бутилацетат и диэтилфталат; галогенированные углеводороды, такие как дихлорметан, хлороформ, четыреххлористый углерод, 1,2-дихлорэтан, трихлорэтилен и тетрахлорэтилен; ароматические соединения, такие как бензол, толуол, ксилол, монохлорбензол, нитробензол, индол, пиридин, хинолин, коллидин и фенол; углеводороды, такие как пентан, циклогексан, гексан, гептан, октан, изооктан, петролейный бензин и петролейный эфир; амины, такие как этаноламин, диэтиламин, триэтиламин, пирролидин, пиперидин, пиперазин, морфолин, анилин, диметиланилин, бензиламин и толуидин; амиды, такие как формамид, N-метилпирролидон, N, N-диметилимидазолон, N, N-диметилацетамид и N,N-диметилформамид; амиды фосфорной кислоты, такие как триамид гексаметилфосфорной кислоты и триамид гексаметилфосфористой кислоты; органические кислоты, такие как муравьиная кислота, уксусная кислота, дифторуксусная кислота, трифторуксусная кислота и хлоруксусная кислота; сульфоксиды, такие как диметилсульфоксид; сульфиды углерода, такие как дисульфид углерода; вода и другие обычно используемые растворители. Эти растворители могут быть простыми растворителями или смесями двух или трех растворителей. Нет особых ограничений, накладываемых на соотношение смешивания смешанных растворителей.
В качестве фармацевтически приемлемых солей производных солей прибавления кислоты согласно настоящему изобретению можно указать следующие соли.
А именно, в качестве примеров неорганических солей можно указать соли щелочных металлов, такие как соли натрия и соли калия; соли аммония; соли тетраэтиламмония; четвертичные аммониевые соли, такие как соли бетаина; соли щелочноземельных металлов, такие как соли кальция и соли магния; и соли неорганических кислот, такие как гидрохлориды, гидробромиды, сульфаты, карбонаты и гидрокарбонаты.
С другой стороны, в качестве примеров органических солей можно указать органические карбоксилаты, такие как ацетаты, малеаты, лактаты и тартраты; органические сульфонаты, такие как метансульфонаты, гидроксиметансульфонаты, гидроксиэтансульфонаты, соли тауриновых кислот, бензолсульфонаты и толуолсульфонаты; соли аминокислот, такие как соли аргинина, соли лизина, соли серина, аспартаты, глутаматы и глицинаты; соли амина, такие как соли триэтиламина, соли триметиламина, соли пиридина, соли прокаина, соли пиколина, соли дициклогексиламина, соли N,N-дибензилэтилендиамина, соли N-метилглюкамина, соли диэтаноламина, соли триэтаноламина, соли трис(гидроксиметиламино)метана и соли фенетилбензиламина.
Далее, настоящее изобретение относится к способу получения соединения, представленного общей формулой: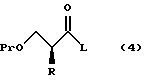
где R означает низшую алкильную группу,
Pr обозначает защитную группу для гидроксильной группы, и
L представляет уходящую группу,
или его соли, который включает введение защиты для гидроксильной группы соединения, представленного общей формулой: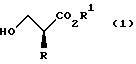
где R означает ту же группу, что определена выше, и
R1 обозначает атом водорода или защитную группу для карбоксильной группы,
путем введения защитной группы с получением соединения, представленного общей формулой: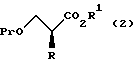
где R, R1, и Pr, каждый, означают те же группы, что определены выше, соответственно,
снятия защитной группы у карбоксильной группы в формуле (2) с получением соединения, представленного формулой: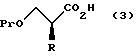
где R и Pr имеют те же группы, что определены выше, соответственно,
и взаимодействие этого соединения формулы (3) с соединением, представленным формулой: LH, в котором L представляет уходящую группу;
к способу получения соединений, представленных общей формулой: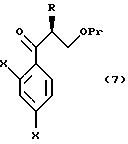
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают каждый атом водорода или галогена, и
Pr представляет защитную группу для гидроксильной группы,
или их солей, который включает взаимодействие соединения, представленного общей формулой:
где R и Pr имеют те же значения, что определены выше, и представляет уходящую группу,
с соединением, представленным общей формулой: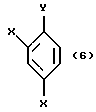
где X имеют те же группы, что определены выше, и
Y представляет атом хлора, брома или иода соответственно.
или его реакционноспособным производным;
к способу получения соединения, представленного общей формулой: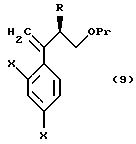
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают атом водорода или атом галогена, и
Pr представляет защитную группу для гидроксильной группы соответственно,
или его соли, который включает взаимодействие соединения, представленного общей формулой: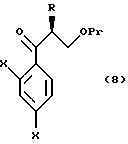
где R, X и Pr имеют те же группы, что определены выше,
с трифенилфосфонийметилидом, полученным из метилтрифенилфосфонийхлорида, метилтрифенилфосфонийбромида или метилтрифенилфосфонийиодида, или с триметилсилилметилмагнийхлоридом, триметилсилилметилмагнийбромидом или триметилсилилметиллитием;
к способу получения соединения, представленного общей формулой: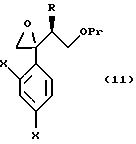
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают атом водорода или атом галогена, и
Pr представляет защитную группу для гидроксильной группы соответственно,
или его соли, который включает взаимодействие соединения, представленного общей формулой: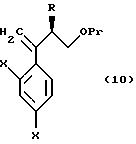
где R, X и Pr имеют то же группы, что определены выше,
с пероксикислотой;
к способу получения соединения, представленного общей формулой: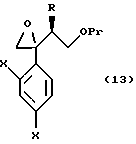
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают атом водорода или атом галогена, и
Pr представляет защитную группу для гидроксильной группы соответственно,
или его соли, который включает взаимодействие соединения, представленного общей формулой: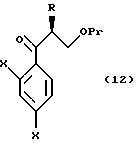
где R, X в Pr имеют то же группы, что определены выше,
с хлорметиллитием, полученным из хлородиметана или бромхлорметана, или с диметилсульфоний метилидом или диметилсульфоксоний метилидом;
к способу получения соединения, представленного общей формулой: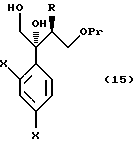
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают каждый атом водорода или атом галогена, и
Pr представляет защитную группу для гидроксильной группы,
или его соли, который включает взаимодействие соединения, представленного общей формулой: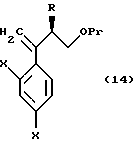
где R, X и Pr имеют те же группы, что определены выше,
с окислительным агентом;
к способу получения соединения, представленного общей формулой:
где Pr означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают атом водорода или атом галогена,
Pr представляет защитную группу для гидроксильной группы,
R2 представляет низшую алкильную группу, и
R3 представляет метильную группу или низшую алкоксильную группу соответственно,
или его соли, который включает взаимодействие соединения, представленного общей формулой: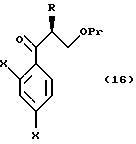
где R, X и Pr имеют те же группы, что определены выше,
с алкоксидиметилсилилметилмагний галогеном или диалкоксиметилсилилметилмагний галогеном;
к способу получения соединения, представленного общей формулой: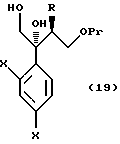
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают атом водорода или атом галогена,
Pr представляет защитную группу для гидроксильной группы,
или его соли, который включает взаимодействие соединения, представленного общей формулой: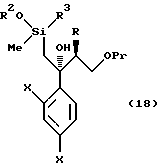
где R, X и Pr имеют те же группы, что определены выше,
R2 представляет низшую алкильную группу, и
R3 представляет метильную группу или низшую алкоксильную группу,
с пероксикислотой в присутствии основания;
к способу получения соединения, представленного общей формулой: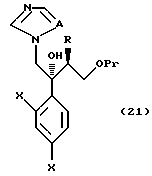
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают атом водорода или атом галогена,
Pr представляет защитную группу для гидроксильной группы и
A означает CH или атом азота, соответственно,
или его соли, который включает взаимодействие соединения, представленного общей формулой: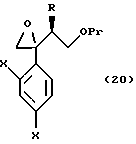
где R, X и Pr имеют те же группы, что определены выше,
с 1,2,4-триазолом или имидазолом или его солью;
к способу получения соединения, представленного общей формулой: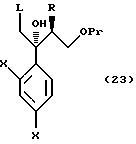
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают атом водорода или атом галогена,
Pr представляет защитную группу для гидроксильной группы, и
L означает уходящую группу соответственно,
или его соли, который включает галогенирование, алкилсульфонирование или арилсульфонирование соединения, представленного общей формулой: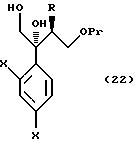
где R, X и Pr имеют те же группы, что определены выше;
к способу получения соединения, представленного общей формулой: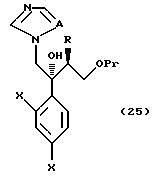
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают атом водорода или атом галогена,
Pr представляет защитную группу для гидроксильной группы и
A означает CH или атом азота соответственно,
или его соли, который включает взаимодействие соединения, представленного формулой: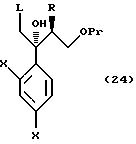
где R, X и Pr имеют те же группы, что определено выше, и
L означает уходящую группу,
с 1,2,4-триазолом или имидазолом или его солью;
к способу получения соединения, представленного общей формулой: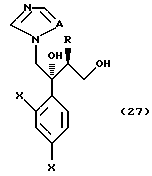
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают атом водорода или атом галогена,
Pr представляет защитную группу для гидроксильной группы и
A означает CH или атом азота соответственно,
или его соли, который включает снятие Pr, который является защитной группой для гидроксильной группы соединения, представленного общей формулой: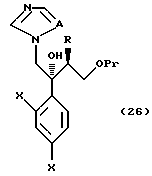
где R, X, Pr и A имеют те же группы, что определены выше, соответственно,
или его соли;
к способу получения соединения, представленного общей формулой: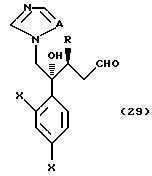
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают атом водорода или атом галогена, и
A означает CH или атом азота соответственно,
или его соли, который включает взаимодействие соединения, представленного общей формулой: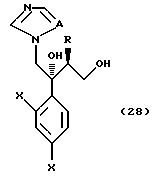
где R, X и A имеют те же группы, что определены выше, соответственно,
с окислительным агентом; и
к способу получения соединения, представленного общей формулой: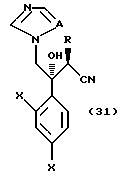
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают атом водорода или атом галогена, и
A означает CH или атом азота соответственно,
или его соли, который включает взаимодействие соединения, представленного общей формулой: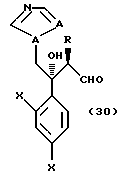
где R, X и A имеют те же группы, что определены выше, соответственно,
с гидроксиламин-О-сульфоновой кислотой.
Эти способы относятся в способам получения промежуточных продуктов синтеза для получения противогрибкового агента.
Данное изобретение далее касается следующих соединений или их солей, которые используются в качестве промежуточных продуктов синтеза. Так, настоящее изобретение относится к соединениям, представленным общей формулой: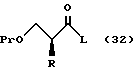
где R означает низшую алкильную группу,
Pr означает защитную группу для гидроксильной группы, и
L представляет уходящую группу соответственно,
или их солям;
соединениям, представленным общей формулой: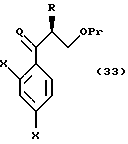
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают атом водорода или атом галогена,
Pr представляет защитную группу для гидроксильной группы, и
Q представляет атом кислорода или CH2 соответственно,
или их солям;
соединениям, представленным общей формулой: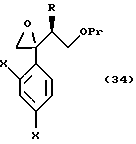
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают атом водорода или атом галогена, и
Pr представляет защитную группу для гидроксильной группы, соответственно,
или их солям;
соединениям, представленным общей формулой: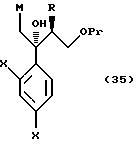
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают атом водорода или атом галогена, и
Pr представляет защитную группу для гидроксильной группы, и
M представляет гидроксильную группу или уходящую группу соответственно,
или их солям; и
соединениям, представленным общей формулой: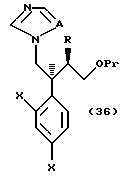
где R означает низшую алкильную группу,
X являются одинаковыми или отличаются друг от друга и обозначают атом водорода или атом галогена, и
Pr представляет защитную группу для гидроксильной группы, и
A представляет CH или атом азота соответственно,
или их солям.
Далее дано подробное разъяснение данного изобретения и используемых терминов.
R означает низшую алкильную группу. Низшая алкильная группа представляет алкильную группу с прямой или разветвленной цепью, содержащую 1-6 атомов углерода, например метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу, изопентильную группу, трет-пентильную группу, неопентильную группу, 1-метилбутильную группу, 2-метилбутильную группу, 1,1-диметилпропильную группу, 1,2-диметилпропильную группу, н-гексильную группу, изогексильную группу, 1-метилпентильную группу, 2-метилпентильную группу, 3-метилпентильную группу, 1,1-диметилбутильную группу, 1,2-диметилбутильную группу, 2,2-диметилбутильную группу, 1,3-диметилбутильную группу, 2,3-диметилбутильную группу, 3,3-диметилбутильную группу, 1-этилбутильную группу, 2-этилбутильную группу, 1,1,2-триметилпропильную группу, 1,2,2-триметилпропильную группу, 1-этил-1-метилпропильную группу, 1-этил-2-метилпропильную группу и тому подобное. Предпочтительная группа включает метильную группу, этильную группу, пропильную группу и т.п.
R1 обозначает атом галогена или защитную группу для карбоксильной группы.
Используемая здесь защитная группа для карбоксильной группы может быть любой группой, обычно используемой в органическом синтезе в качестве защитной группы для карбоксильной группы, и особенно не ограничена. Примеры защитной группы для карбоксильной группы включают, например, низшие алкильные группы с прямой цепью или разветвленной цепью, содержащие 1-6 атомов углерода, такие как метильную группу, этильную группу, изопропильную группу и трет-бутильную группу; галогенированные низшие алкильные группы, такие как 2-иодэтильную группу и 2,2,2-трихлорэтильную группу; низшие алкоксиалкильные группы, такие как метоксиметильную группу, этоксиметильную группу и изобутоксиметильную группу; низшие алифатические ацилоксиалкильные группы, такие как ацетоксиметильную группу, пропионилоксиметильную группу, бутирилоксиметильную группу и пивалоилоксиметильную группу; низшие алкоксикарбонилоксиалкильные группы, такие как метоксикарбонилоксиметильная группа, 1-метоксикарбонилоксиэтильная группа, этоксикарбонилоксиметильная группа, 1-этоксикарбонилоксиэтильная группа и 2-метоксикарбонилоксиэтильная группа; аралкильные группы, такие как бензильная группа, п-метоксибензильная группа, о-нитробензильная группа и п-нитробензильная группа; бензгидрильная группа и фталидильная группа; (5-метил-2-оксо-1,3-диоксо-4-ил)-метильная группа и тому подобное.
Снятие защитной группы у карбоксильной группы может осуществляться обычным способом, таким как гидролиз, восстановление и т.п., в зависимости от типа используемой защитной группы.
Pr обозначает защитную группу для гидроксильной группы.
Используемая здесь защитная группа для гидроксильной группы может быть любой группой, применяемой в органическом синтезе в качестве защитной группы для гидроксильной группы, и особо не ограничена. Примеры защитной группы для гидроксильной группы включают, например, низшие алкилсилильные группы, такие как триметилсилильная группа, трет-бутилдиметилсилильная группа и т.п.; низшие алкиларилсилильные группы, такие как трет-бутилдифенилсилильная группа и т. п.; низшие алкоксиметильные группы, такие как метоксиметильная группа, 2-метоксиэтоксиметильная группа и т.п., например тетрагидропиранильная группа; аралкильные группы, такие как бензильная группа, п-метоксибензильная группа, 2,4-диметоксибензильная группа, о-нитробензильная группа, п-нитробензильная группа, тритильная группа, метокситритильная группа, диметокситритильная группа и т.п.; ацильные группы, такие как формильная группа, ацетильная группа и т.п.; низшие алкоксикарбонильные группы, такие как трет-бутоксикарбонильная группа, 2-иодэтоксикарбонильная группа, 2,2,2-трихлорэтоксикарбонильная группа и т.п.; алкенилоксикарбонильные группы, такие как 2-пропенилоксикарбонильная группа, 2-хлор-2-пропенилоксикарбонильная группа, 3-метоксикарбонил-2-пропенилоксикарбонильная группа, 2-метил-2-пропенилоксикарбонильная группа, 2-бутенилоксикарбонильная группа, циннамоилоксикарбонильная группа и т.п.; аралкилоксикарбонильные группы, такие как бензилоксикарбонильная группа, п-метоксибензилоксикарбонильная группа, о-нитробензилоксикарбонильная группа, п-нитробензилоксикарбонильная группа и т.п.
Снятие защитной группы у гидроксильной группы может осуществляться обычным способом, таким как гидролиз, восстановление или тому подобное, в зависимости от типа используемой защитной группы.
L представляет уходящую группу.
Используемая здесь уходящая группа может быть любой группой, применяемой в органическом синтезе в качестве уходящей группы, и особо не ограничена. Примеры уходящей группы включают, например, атомы галогена, такие как атом хлора, атом брома, атом иода и т.п., алкилтиогруппы, такие как метилтиогруппа, этилтиогруппа, пропилтиогруппа и т.п.; арилтиогруппы, такие как фенилтиогруппа, толилтиогруппа, 2-пиридилтиогруппа и т.п., алкилсульфонилоксигруппы, такие как мезилоксигруппа, трифторметансульфонилоксигруппа, этансульфонилоксигруппа, пропансульфонилоксигруппа и т.п.; арилсульфонилоксигруппы, такие как бензолсульфонилоксигруппа, тозилоксигруппа и т.п.; алканоилоксигруппы, такие как ацетоксигруппа, трифторацетоксигруппа и т.п.; алкоксигруппы, такие как метоксигруппа, этоксигруппа, пропоксигруппа и т.п.; алкиламиногруппы, такие как метиламиногруппа, этиламиногруппа, пропиламиногруппа, бутиламиногруппа и т.п.; диалкиламиногруппы, такие как диметиламиногруппа, диэтиламиногруппа, дипропиламиногруппа, метилэтиламиногруппа, этилпропиламиногруппа, метилпропиламиногруппа и т.п.; и замещенная фосфорилоксигруппа, такая как дифеноксифосфорилоксигруппа и т.п. Соответственно активирующий реагент, используемый в реакциях данного изобретения, включает, например, ангидриды кислот, такие как трифторуксусный ангидрид, метансульфоновый ангидрид, трифторметансульфоновый ангидрид, п-толуолсульфоновый ангидрид и т.п.; хлорангидриды кислот, такие как метансульфонилхлорид, п-толуолсульфонилхлорид, дифенилхлорфосфат и т.п., и сверх того включает 2-меркаптопиридин, оксалилхлорид, тионилхлорид, тионилбромид и тому подобное.
X являются одинаковыми или отличаются друг от друга и обозначают атом водорода или атом галогена. Представленные примеры атома галогена включают атом фтора, атом хлора, атом брома, атом иода и тому подобное.
Y означает атом хлора, атом брома или атом иода.
Реакционноспособное производное соединения, представленное общей формулой: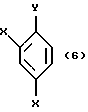
где X являются одинаковыми или отличаются друг от друга и обозначают атом водорода или атом галогена, и
Y означает атом хлора, атом брома или атом иода соответственно,
может быть получено, например, активированием Y металлом, таким как Mg, с образованием галогенида магния (-MgY), таким образом получая реактив Гриньяра.
Используемая здесь пероксикислота может быть любой, обычно применяемой в органическом синтезе, и особо не ограничена. Примеры уходящей группы включают, например, органические пероксикислоты, такие как мета-хлорпербензойная кислота (м-ХПБК), перуксусная кислота и т.п., и водная перекись водорода. Метахлорпербензойная кислота является предпочтительной.
Используемый здесь окислительный агент может быть любым, обычно применяемым в качестве окислительного агента в органическом синтезе, и особо не ограничен. Примеры окислительного агента включают, например, тетраоксид осмия, перманганат калия и тому подобное.
Алкоксидиметилсилилметилмагний галогенид означает диметилсилилметилмагний галогенид, замещенный алкоксигруппой, соответствующей низшей алкильной группе, описанной выше, и, в частности, включает метоксидиметилсилилметилмагний хлорид,
метоксидиметилсилилметилмагний бромид,
этоксидиметилсилилметилмагний хлорид,
этоксидиметилсилилметилмагний бромид,
пропоксидиметилсилилметилмагний хлорид,
изопропоксидиметилсилилметилмагний хлорид,
пропоксидиметилсилилметилмагний бромид,
изопропоксидиметилсилилметилмагний бромид и т.п.
Диалкоксиметилсилилметилмагний галогенид означает метилсилилметилмагний галогенид, замещенный алкоксигруппой, соответствующей низшей алкильной группе, описанной выше, и на практике включает диметоксиметилсилилметилмагний хлорид,
диметоксиметилсилилметилмагний бромид,
диэтоксиметилсилилметилмагний хлорид,
диэтоксиметилсилилметилмагний бромид,
дипропоксиметилсилилметилмагний хлорид,
дипропоксиметилсилилметилмагний бромид,
дибутоксиметилсилилметилмагний хлорид,
дибутоксиметилсилилметилмагний бромид и т.п.
Используемое здесь основание может быть любым, обычно известным в качестве основания в органическом синтезе, и особо не ограничено. Примеры основания включают, например, карбонат натрия, гидрокарбонат натрия, карбонат калия, гидрид натрия, гидрид калия, трет-бутоксикалий, пиридин, диметиламинопиридин, триметиламин, триэтиламин, N,N-диизопропилэтиламин, N-метилморфолин, N-метилпирролидин, N,N-диметиланилин, 1,8-диазабицикло[5,4,0] ундека-7-ен (ДБУ), пиридин, 4-диметиламинопиридин, пиколин, лутидин, хинолин, изохинолин, гидроксид натрия, гидроксид калия, гидроксид лития, бутил лития и т.п.
A означает CH или атом азота.
R2 представляет низшую алкильную группу. Низшая алкильная группа имеет те же значения, что описаны выше.
R3 представляет метильную или низшую алкоксильную группу.
Низшая алкоксильная группа соответствует вышеописанной низшей алкильной группе и является, в частности, алкоксильной группой с прямой или разветвленной цепью, содержащей 1-6 атомов углерода, и включает, например, метоксильную группу, этоксильную группу, н-пропоксильную группу, изопропоксильную группу, н-бутоксильную группу, изобутоксильную группу, втор-бутоксильную группу, трет-бутоксильную группу, н-пентоксильную группу, изопентоксильную группу, втор-пентоксильную группу, 1-метилбутоксильную группу, 2-метилбутоксильную группу, 1,1-диметилпропоксильную группу, 1,2-диметилпропоксильную группу, н-гексилоксильную группу, изогексилоксильную группу, 1-метилпентоксильную группу, 2-метилпентоксильную группу, 3-метилпентоксильную группу, 1,1-диметилбутоксильную группу, 1,2-диметилбутоксильную группу, 2,2-диметилбутоксильную группу, 1,3-диметилбутоксильную группу, 2,3-диметилбутоксильную группу, 3,3-диметилбутоксильную группу, 1-этилбутоксильную группу, 2-этилбутоксильную группу, 1,1,2-триметилпропоксильную группу, 1,2,2-триметилпропоксильную группу, 1-этил-1-метилпропоксильную группу, 1-этил-2-метилпропоксильную группу, и т.п.
Q представляет атом кислорода или CH2.
М представляет гидроксильную группу или уходящую группу.
Уходящая группа имеет те же значения, что указаны выше.
Используемые соли не ограничены по их типу и включают, например, соли прибавления кислоты, такие как гидрофторид, гидрохлорид, сульфат, нитрат, перхлорат, фосфат, карбонат, гидрокарбонат, гидробромат, гидроиодид и т.п.; соли прибавления органокарбоновых кислот, такие как ацетат, малеат, фумарат, оксалат, лактат, цитрат, трифторацетат и т.п.; соли прибавления органосульфоновых кислот, такие как метансульфонат, трифторметансульфонат, этансульфонат, гидроксиметансульфонат, гидроксиэтансульфонат, бензолсульфонат, толуолсульфонат, соль таурина и т.п.; соли прибавления амина, такие как соль триэтиламина, соль триметиламина, соль пиридина, соль прокаина, соль пиколина, соль дициклогексиламина, соль N, N-дибензилэтилендиамина, соль N-метилглюкамина, соль диэтаноламина, соль триэтаноламина, соль трис(гидроксиметиламино)метана и соль фенетилбензиламина; соли прибавления щелочного металла, такие как соль натрия, соль калия и т.п.; соли прибавления щелочноземельного металла, такие как соль магния, соль кальция и т.п.; соли прибавления аминокислот, такие как соль аргинина, соль лизина, соль серина, соль глицина, соль аспартамовой кислоты, соль глутаминовой кислоты и тому подобное.
Фармацевтически приемлемая соль означает соль, обычно применяемую для получения лекарств.
Используемые здесь производные гидроксиламина могут являться любым соединением, которое обычно применимо в органическом синтезе для преобразования в цианогруппу формильной группы и особо не ограничено, и включает, например, гидроксиламин-О-сульфоновую кислоту и т.п.
Способы получения в соответствии с настоящим изобретением, которые представлены следующей схемой общей, описаны далее (схему см. в конце описания).
Путь A-1 является путем, по которому гидроксильная группа соединения, представленного формулой (101) [в котором R и R1, каждый, означают те же группы, что указаны выше. Они же будут использоваться далее], является защищенной. Соединение, представленное формулой (102) [в котором Pr означает ту же группу, что указана выше. Она же будет использоваться далее], гидроксильная группа которого защищена таким методом, может быть получено путем защиты гидроксильной группы в соответствии со способом, известным специалистам. Гидроксильные группы, защищенные различными защитными группами, могут быть получены в соответствии с, например, методом, описанным у Green, "Protective Groups in Organic Synthesis (A Wily-Interscience Publication Co. ,)".
Путь A-2 является путем, по которому защитная группа для карбоксильной группы соединения, представленного формулой (102), подвергается снятию. Как и при пути A-1, при этом пути соединение, представленное формулой (103), может быть получено по способу снятия защитной группы для карбоксильной группы в соответствии с общепринятым способом, например гидролизом или каталитическим восстановлением с кислотой или основанием. Более конкретно, снятие защиты может быть осуществлено взаимодействием соединения формулы (102) с соляной кислотой, трифторуксусной кислотой, уксусной кислотой, бромистым водородом, муравьиной кислотой, tosic кислотой, перекисью водорода, триметилсилилхлоридом, трет-бутоксидом калия, гидроксидом лития, гидроксидом натрия, гидроксидом калия, гидразином, карбонатом калия, карбонатом натрия, трифторидом бора, галогенидом алюминия, тетрабутиламмоний фторидом и т.п., в растворителе, который не ингибирует реакцию.
Путь A-3 является путем, по которому уходящая группа (L) присоединяется к соединению, представленному формулой (103). Соединение, представленное формулой (104), может быть получено взаимодействием соединения, представленного формулой (103), с активирующим реагентом, например ангидридом кислоты, таким как трифторуксусный ангидрид, метансульфоновый ангидрид, трифторметансульфоновый ангидрид или п-толуолсульфоновый ангидрид; хлорангидриды кислот, например метансульфонилхлорид, п-толуолсульфонилхлорид, дифенилхлорфосфат, оксалилхлорид или тионилхлорид; или 2-меркаптопиридин. Если желательно, может быть использован конденсирующий агент, такой как дициклокарбодиимид (ДЦК), в соответствии с реакционной способностью используемого реагента.
По пути B-1 соединение формулы (105), в котором уходящая группа L в формуле (104) заменена на дизамещенную фенильную группу, может быть получено взаимодействием соединения, представленного формулой (104), с соединением, представленным формулой
[в котором X и Y, каждый, означают те же группы, что указаны выше. Они же будут использоваться далее] , или его реакционноспособным производным, например реагентом Гриньяра, в котором Y обозначает -MgCl, -MgBr или -MgI, активированный металлическим магнием.
По пути C-1 олефиновое соединение, представленное формулой (106), может быть получено взаимодействием (так называемая реакция Виттига) соединения, представленного формулой (105), с трифенилфосфоний метилидом, который получен обработкой метилтрифенилфосфоний хлорида, метилтрифенилфосфоний бромида или метилтрифенилфосфоний иодида основанием, таким как бутиллитий, или взаимодействием его с триметилсилилметилмагний хлоридом, триметилсилилметилмагний бромидом или триметилсилилметиллитием с получением промежуточного силилового спирта, и подвергая промежуточный силиловый спирт удалению группы силилового спирта с помощью комплекса трифторида бора или тому подобное.
Путь D-1 является путем, по которому олефиновое соединение, представленное формулой (106), эпоксидируют. Нет конкретных ограничений, накладываемых на реагент для эпоксидирования, поскольку он является реагентом, способным к эпоксидированию двойной связи. Однако в качестве примеров можно указать органические пероксикислоты, такие как метахлорпербензойная кислота (мХПБК), и перуксусная кислота, и водная перекись водорода. Эпоксисоединение, представленное формулой (107), было получено, предпочтительно, путем взаимодействия с метахлорпербензойной кислотой.
Эпоксисоединение, представленное формулой (107), может быть также получено следующим путем Е-1. А именно, эпоксисоединение может быть получено взаимодействием соединения формулы (105) с хлорметиллитием, полученным из хлориодметана или бромиодметана с помощью основания, такого как бутиллитий, или с диметилсульфоксоний метилидом, диэтилсульфоксоний метилидом или диэтилсульфоний метилидом.
Путь F-1 относится к реакции, по которой эпоксисоединение, представленное формулой (107), сразу подвергается раскрытию цикла с присоединением имидазольного кольца или 1,2,4-триазольного кольца. Соединение, представленное формулой (108) [в котором A означает атом азота или CH. Оно же будет использовано далее] , может быть получено взаимодействием эпоксисоединения, представленного формулой (107), с солью щелочного металла имидазола или 1,2,4-триазола, которая получена смешиванием гидрида щелочного металла, такого как гидрид натрия, гидрид лития или гидрид калия, с имидазолом или 1,2,4-триазолом в растворителе.
Путь G-1 является путем, по которому защитная группа для гидроксильной группы подвергается снятию. Эта защитная группа для гидроксильной группы может быть снята способом, известным специалистам. Например, он может быть осуществлен способом, описанным Green в литературе, указанной выше.
Путь H-1 является путем, по которому олефиновое соединение окисляют в 1,2-дигликоль с помощью окислительного агента. Соединение, представленное формулой (110), может быть получено обработкой соединения, представленного формулой (106), окислительным агентом, таким как тетраоксид осмия или перманганат калия.
Путь I-1 является путем, по которому соединение, представленное формулой (105), преобразуют в соединение, представленное формулой (110). По этому пути соединение, представленное формулой (110), может быть получено взаимодействием соединения, представленного формулой (105), с алкоксидиметилсилилметилмагний галогенидом или диалкоксиметилсилилметилмагний галогенидом с получением соединения, представленного общей формулой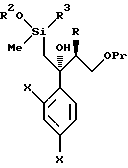
[в котором R2 означает низшую алкильную группу и R3 обозначает метил или низшую алкильную группу. Они же будут использоваться далее], и затем взаимодействием полученного таким образом соединения с пероксикислотой в присутствии основания.
Путь J-1 является путем, по которому первичная гидроксильная группа соединения, представленного формулой (110), заменяется уходящей группой L. Этот процесс может быть осуществлен в соответствии с путем А-3. Соединение, представленное формулой (111), может быть получено взаимодействием соединения, представленного формулой (110), с предпочтительно хлорангидридом кислоты, таким как метансульфонилхлорид, п-толуолсульфонилхлорид, дифенилхлорфосфат, оксалилхлорид или тионилхлорид.
По пути J-2 уходящая группа L соединения, представленного формулой (111), может быть заменена имидазолильной или 1,2,4-триазолильной группой проведением взаимодействия в соответствии с путем F-1.
Путь K-1 является путем, по которому первичная гидроксильная группа соединения, представленного формулой (109), окисляется в формильную группу. Окисление этой первичной гидроксильной группы может быть осуществлено известным специалистам способом. Его легко осуществлять, используя, например, соль или оксид металла, такого как хром, марганец или серебро, или органический окислительный агент, типичный для диметилсульфоксида. В качестве реагентов могут быть использованы, например, комплекс хромовая кислота - пиридин, пиридиний хлорхромат или пиридиний дихромат. Альтернативно обычно используют способ окисления с ДМСО, используя оксалилхлорид.
Путь L-1 является путем, по которому первичная гидроксильная группа соединения, представленного формулой (112), заменяется цианогруппой. Соединение, представленное формулой (113), может быть получено взаимодействием соединения, представленного формулой (112), с производным гидроксиламина, таким как гидроксиламиносульфоновая кислота.
Пути M-1 и N-1 являются способами получения противогрибкового агента, который является конечным соединением и представлен формулой (115). Этими путями может быть получено соединение, обладающее превосходной противогрибковой активностью и представленное формулой (115), путем прибавления сероводорода к соединению, представленному формулой (113), с образованием соединения, представленного формулой (114), и затем взаимодействием полученного таким образом соединения с 2-бром-4'-метилтиоацетофеноном.
Реакции по вышеуказанным путям можно проводить, главным образом, при температуре в области от -78oC до 150oC, предпочтительно от -40oC до 50oC, более предпочтительно от -20oC до 25oC.
Никакие конкретные ограничения не накладываются на растворители, используемые по настоящему изобретению, поэтому они не должны препятствовать реакциям и обычно используются в органических синтезах. Однако, как показано в примерах, можно указать низшие спирты, такие как метанол, этанол, пропанол и бутанол; полигидроспирты, такие как этиленгликоль и глицерин; кетоны, такие как ацетон, метилэтилкетон, диэтилкетон и циклогексанон; простые эфиры, такие как диэтиловый эфир, изопропиловый эфир, тетрагидрофуран, диоксан, 2-метоксиэтанол и 1,2-диметоксиэтан; нитрилы, такие как ацетонитрил и пропионитрил; сложные эфиры, такие как метилацетат, этилацетат, изопропилацетат, бутилацетат и диэтилфталат; галогенированные углеводороды, такие как дихлорметан, хлороформ, четыреххлористый углерод, 1,2-дихлорэтан, трихлорэтилен и тетрахлорэтилен; ароматические соединения, такие как бензол, толуол, ксилол, монохлорбензол, нитробензол, индол, пиридин, хинолин, коллидин и фенол; углеводороды, такие как пентан, циклогексан, гексан, гептан, октан, изооктан, петролейный бензин и петролейный эфир; амины, такие как этаноламин, диэтиламин, триэтиламин, пирролидин, пиперидин, пиперазин, морфолин, анилин, диметиланилин, бензиламин и толуидин; амиды, такие как формамид, N-метилпирролидон, N,N-диметилимидазолон, N,N-диметилацетамид и N,N-диметилформамид; амиды фосфорной кислоты, такие как триамид гексаметилфосфорной кислоты и триамид гексаметилфосфористой кислоты; органические кислоты, такие как муравьиная кислота, уксусная кислота, дифторуксусная кислота, трифторуксусная кислота и хлоруксусная кислота; сульфоксиды, такие как диметилсульфоксид; сульфиды углерода, такие как дисульфид углерода; вода и другие обычно используемые растворители. Эти растворители могут быть простыми растворителями или смесями двух или трех растворителей. Нет особых ограничений, накладываемых на соотношение между смешиваемыми растворителями.
По пути, указанному выше, полученные продукты могут быть очищены известным специалистам способом, таким как колоночная хроматография на силикагеле или тому подобное, если необходимо, и они могут быть подвергнуты реакциям по снятию их защитных групп, если желательно. Снятие защитных групп можно проводить, подвергая продукты восстановлению, такому как каталитическое восстановление или сольволиз.
Кроме того, соединения, представленные следующей формулой
или их соли, соединения, представленные общей формулой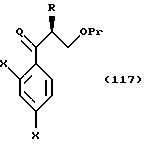
или их соли, соединения, представленные общей формулой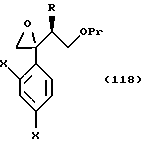
или их соли, соединения, представленные общей формулой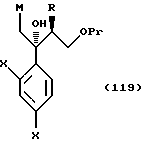
или их соли, и соединения, представленные общей формулой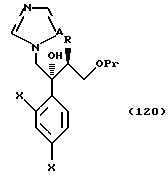
или их соли [в формулах (116) - (120) R, Pr, L, X, Q, M и A, каждый, означают те же группы, что указанные выше] используются в способах получения по настоящему изобретению и синтезах соединений, обладающих превосходной противогрибковой активностью.
Для соединений и способов получения в соответствии с настоящим изобретением существуют стереомеры, имеющие асимметрический атом углерода в молекулах и обладающие S-конфигурацией или R-конфигурацией. Кроме того, что касается тех соединений, которые обладают двойной связью, то существуют геометрические изомеры типа E или Z. Для подтверждения в описании описана одна конфигурация. Однако настоящим изобретением охватываются как соединения, так и их смеси. Соединения согласно настоящему изобретению не ограничены представленными в формуле, описанной для иллюстрации. Оптические изомеры могут быть отделены обычными методами по оптическому разделению, в то время как диастереомеры могут быть разделены с использованием метода разделения, такого как хроматография.
Когда предполагается получение индивидуальных изомеров, они могут быть получены стереоизбирательно или энантиоизбирательно в соответствии с их соответствующими способами получения по настоящему изобретению.
С точки зрения противогрибковой активности стерически предпочтительно использовать способ получения, где оптически активный (S)-метилгидрокси-2-метилпропионат используют в качестве соединения общей формулы (101) или исходного продукта при осуществлении вышеописанного способа получения для образования соединения общей формулы (113), поддерживая стереоструктуру, с получением посредством этого оптически активного (2S,3R)-3-(2,4- дифторфенил)-3-гидрокси-2-метил-4-(1H-1,2,4-триазол-1-ил)- бутиронитрила в качестве соединения общей формулы (113) и промежуточных продуктов, имеющих такую стереоструктуру.
Согласно настоящему изобретению, например, могут быть получены соединения, представленные общей формулой: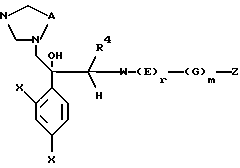
где X являются одинаковыми или отличаются друг от друга и обозначают каждый атом водорода или галогена;
R4 означает атом водорода или низшую алкильную группу;
r и m могут быть одинаковы или отличаться друг от друга и представляют каждый 0 или 1;
A является N или CH;
W обозначает ароматическое кольцо, которое может иметь один или более заместителей и может содержать один или более гетероатомов, выбранных из N, S и O, или его конденсированное кольцо;
E означает ароматическое кольцо, которое может иметь один или более заместителей и может содержать один или более гетероатомов, выбранных из N, S и О, алкандиильной группы, которая может иметь один или более заместителей, алкендиильной группы, которая может иметь один или более заместителей, или алкиндиильной группы, которая может иметь один или более заместителей;
G представляет группу, представленную -S-, 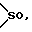
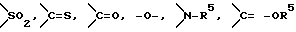 или -(CH2)j-, в которых R5 означает атом водорода или низшую алкильную группу и j представляет целое число 1-4; и
или -(CH2)j-, в которых R5 означает атом водорода или низшую алкильную группу и j представляет целое число 1-4; и
Z обозначает атом водорода, атом галогена, низшую алкильную группу, галогенированную низшую алкильную группу, низшую алкоксильную группу, галогенированную низшую алкоксильную группу, гидроксильную группу, тиоловую группу, нитрогруппу, цианогруппу, низшую алканоильную группу, феноксильную группу, которая может иметь один или более заместителей, имидазолильную группу, которая может иметь один или более заместителей, триазолильную группу, которая может иметь один или более заместителей, тетразолильную группу, которая может иметь один или более заместителей, или аминогруппу, которая может иметь один или более заместителей,
или их соли.
Некоторые примеры будут даны далее для описания изобретения более подробно. Однако настоящее изобретение но ограничивается только этими примерами. В следующих примерах 1H ЯМР спектр измеряют с помощью FT ЯМР (400 МГц), изготовленного Varian Company.
Кроме прочего, Tr, Ms, MOM, TBDPS и Bn обозначают далее группы тритил, мезил, метоксиметил, трет-бутилдифенилсилил и бензил соответственно.
Примеры.
Настоящее изобретение далее описано в примерах, экспериментальных примерах и препаративных примерах более конкретно. Однако настоящее изобретение не ограничивается только этими примерами, экспериментальными примерами и препаративными примерами
Пример 1:
Синтез 1-(2,4-дифторфенил)-1-(4-(2,4-дифторфенил)тиазол-2-ил)- 2-(1H-1,2,4-триазол-1-ил)этанола
После растворения 4-(2,4-дифторфенил)тиазола (330 мг) в диэтиловом эфире (3 мл) и охлаждения полученного раствора до -78oC в атмосфере азота прибавляют 1,6 М раствор (1,06 мл) н-бутиллития в гексане и полученную смесь перемешивают в течение около 10 минут. После прибавления к этой смеси по каплям раствора 2-хлор-2',4'- дифторацетофенона (306 мг) в тетрагидрофуране жидкую реакционную смесь нагревают до -20oC для прибавления водного раствора хлорида аммония. Реакционную смесь экстрагируют этилацетатом. После высушивания органического слоя над сульфатом магния растворитель отгоняют при пониженном давлении. Остаток растворяют в диметилформамиде (3 мл) с получением раствора (A). С другой стороны готовят раствор диметилформамида (3 мл) (В), содержащий 1,2,4-триазол (350 мл) и 60% гидрида натрия (135 мг). Раствор (B) прибавляют к раствору (A) и смесь нагревают при 60oC в течение 6 часов. Затем к жидкой реакционной смеси добавляют этилацетат и воду и органический слой промывают некоторое время водой, растворитель отгоняют. Остаток подвергают колоночной хроматографии на силикагеле для перекристаллизации фракции, содержащей желаемое соединение, из диэтилового эфира с получением посредством этого указанного в заголовке соединения (390 мг). Его физические свойства показаны в таблице 1.
Пример 2.
(1) Синтез 1-(2,4-дифторфенил)-1-(6-цианобензотиазол-2-ил)-2- хлорэтанола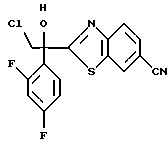
После растворения 6-цианобензотиазола (1,60 г) в тетрагидрофуране (80 мл) и охлаждения раствора до -98oC в атмосфере азота прибавляют по каплям в течение 10 минут 1,6 М раствор (5,9 мл) н-бутиллития в гексане и полученную смесь перемешивают в течение 5 минут. К этой смеси по каплям прибавляют раствор 2-хлор-2',4'-дифторацетофенона (2,85 г) в тетрагидрофуране (20 мл). После нагревания жидкой реакционной смеси до -10oC к ней прибавляют водный раствор хлорида аммония. После нагревания реакционной смеси до комнатной температуры органический слой отделяют, растворитель отгоняют при пониженном давлении. Водный слой экстрагируют этилацетатом и экстракт затем объединяют вместе с оставшимся органическим слоем. Этот органический слой промывают водой и затем насыщенным раствором соли, сушат над сульфатом магния и затем отгоняют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле (растворитель: гексан/этилацетат = 20/1, затем гексан/этилацетат = 5/1) с получением посредством этого желаемого соединения (1,49 г).
(2) Синтез 1-(2,4-дифторфенил)-1-(6-цианобензотиазол-2-ил)-2- (1H-1,2,4-триазол-1-ил)этанола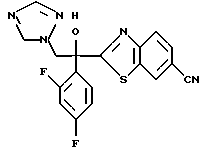
Гидрид натрия (440 мг) суспендируют в диметилформамиде (10 мл) и прибавляют 1,2,4-триазол (948 мг) к суспензии, к которой прибавляют 1-(2,4-дифторфенил)-1-(6-цианобензотиазол-2-ил)-2- хлорэтанол (1,49 г) в диметилформамиде (10 мл). Смесь нагревают при 60oC в течение 4 часов. После охлаждения жидкой реакционной смеси до комнатной температуры к ней прибавляют этилацетат и воду. Отделенный органический слой промывают три раза водой и затем сушат над сульфатом магния и растворитель отгоняют. Остаток перекристаллизовывают из дихлорметандиизопропилового эфира с получением желаемого соединения (1,17 г). Точка плавления: 170-172oC.
Пример 3.
Синтез 1-(2,4-дифторфенил)-1-[4-[(4-(5- тетразол)фенил)тиазол]-2-ил]-2-(1H-1,2,4-триазол-1-ил)этанола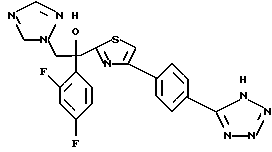
1-(2,4-Дифторфенил)-1-(4-(4-цианофенил)тиазол-2-ил)-2-(1H- 1,2,4-триазол-1-ил)этанол (точка плавления 195-198oC) (400 мг) растворяют в диметилформамиде (1,2 мл). К раствору добавляют азид натрия (191 мг) и гидрохлорид триэтиламина (404 мг). Полученную смесь нагревают в течение ночи (12 часов) при 100oC. После удаления нерастворимого материала фильтрацией и отгонки растворителя остаток растворяют в небольшом количестве (каждого около 2 мл) ацетона и этилацетата. К раствору прибавляют воду и pH раствора устанавливают около 4 с помощью концентрированной соляной кислоты. Полученный осадок собирают фильтрацией, промывают водой и затем сушат, получая таким образом указанное в заголовке соединение (380 мг). Точка плавления: 252-254oC. Его физические свойства показаны в таблице 2.
Пример 4.
Синтез 1-(2,4-дифторфенил)-1-[4-[(4-(5-(3-метил)тетразол)- фенил]тиазол] -2-ил-2-(1H-1,2,4-триазол-1-ил)этанола [структурная формула A] и 1-(2,4-дифторфенил)-1-[4-[(4-(5-(4- метил)тетразол)фенил)тиазол] -2-ил-2-(1H-1,2,4-триазол-1-ил)этанола [структурная формула B]
Структурная формула A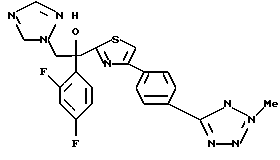
Структурная формула B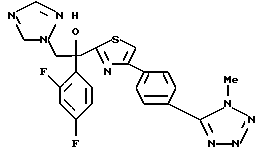
1-(2,4-Дифторфенил)-1-[4-[(4-(5-тетразол)фенил)тиазол] -2- ил] -2-(1H-1,2,4-триазол-1-ил)этанол (320 мг), полученный по примеру 3, растворяют в диметилформамиде (3 мл). К раствору добавляют карбонат цезия (231 мг) и смесь перемешивают при 60oC в течение 30 минут и затем охлаждают до комнатной температуры. Добавляют метилиодид (0,048 мл) и полученную смесь перемешивают в течение ночи при комнатной температуре. К смеси добавляют воду и экстрагируют этилацетатом. После удаления растворителя при пониженном давлении из экстракта остаток подвергают колоночной хроматографии на силикагеле с получением посредством этого соединения [точка плавления: 188-191oC] структурной формулы A элюированием 1% метанол-хлороформом и затем получением соединения [двойная точка плавления: 110-115oC и 185-187oC] (60 мг) структурной формулы В элюированием 2% метанол-хлороформом. Его физические свойства показаны в таблице 2.
Пример 5.
Синтез 1-(2,4-дифторфенил)-1-[2-(4-1-1H-1,2,4- триазол)фенил)тиазол-5-ил)]-2-(1H-1,2,4-триазол-1-ил)этанола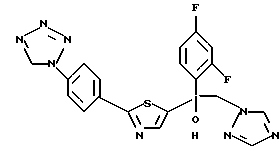
Раствор 1-(2,4-дифторфенил)-1-(2-(4-фторфенил)-1-(2-(4- фторфенил)тиазол-5-ил)-2-(1H-1,2,4-триазол-1-ил)этанола в диметилформамиде (3 мл) добавляют по каплям к раствору в диметилформамиде (3 мл), полученному из 1H-1,2,4-триазола (168 мг) и 60% гидрида натрия (81 мг). Полученную смесь нагревают при 100oC в течение 30 часов. После охлаждения жидкой реакционной смеси до комнатной температуры к ней добавляют воду и экстрагируют этилацетатом. Растворитель отгоняют из экстракта и полученный остаток подвергают колоночной хроматографии на силикагеле (элюирование 3% метанол-этилацетатом) с получением посредством этого указанного в заголовке соединения (60 мг). Его физические свойства показаны в таблице 2.
Пример 6.
Синтез 1-(2,4-дифторфенил)-1-(6-тиокарбамоилбензотиазол-2-ил)- 2-(1H-1,2,4-триазол-1-ил)этанола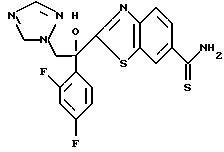
1-(2,4-Дифторфенил)-1-(6-цианобензотиазол-2-ил)-2-(1H-1,2,4- триазол-1-ил)этанол (418 мг) и триэтиламин (500 мг) растворяют в диметилформамиде (4 мл). После охлаждения ледяной водой в полученный раствор вводят сероводород в течение 5 минут. После выдерживания в течение более 6 часов при комнатной температуре к раствору добавляют воду и этилацетат для разделения жидких слоев. Органический слой промывают два раза водой и затем насыщенным раствором соли и сушат над сульфатом магния. Растворитель отгоняют с получением желаемого соединения (437 мг). Его физические свойства показаны в таблице 2.
Пример 7.
Синтез 1-(2,4-дифторфенил)-1-(6-(3-метилтиазол-1-ил) бензотиазол-2-ил)-2-(1H-1,2,4-триазол-1-ил)этанола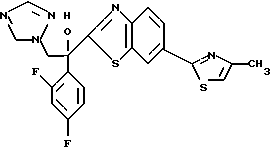
1-(2,4-Дифторфенил)-1-(6-тиокарбамоилбензотиазол-2-ил)-2- (1H-1,2,4-триазол-1-ил)этанол (219 мг) растворяют в этаноле (2 мл) и к раствору прибавляют гидрокарбонат натрия (42 мг) и бромацетон (46 л). Полученную смесь нагревают при 60oC в течение 3 часов. Этилацетат и воду добавляют к жидкой реакционной смеси для разделения жидких слоев. Органический слой промывают насыщенным раствором соли и затем сушат и растворитель отгоняют. Остаток подвергают колоночной хроматографии на силикагеле (элюирующий растворитель: хлороформ: метанол = 100:1) с получением посредством этого желаемого соединения (114 мг). Точка плавления: 213-215oC.
Пример 8.
Синтез 1-(2,4-дифторфенил)-1-(6-тиазол-1-ил)бензотиазол-2-ил)- 2-(1H-1,2,4-триазол-1-ил)этанола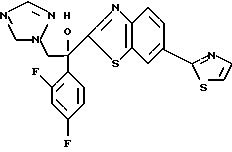
1-(2,4-Дифторфенил)-1-(6-тиокарбамоилбензотиазол-2-ил)-2-(1H- 1,2,4-триазол-1-ил)этанол (181 мг) и диметилацеталь бромацетальдегида (256 μ г) растворяют в этаноле (2 мл). К раствору прибавляют три капли концентрированной серной кислоты с кипячением с обратным холодильником в течение 2,5 часов. После охлаждения жидкой реакционной смеси к ней добавляют воду и насыщенный водный раствор гидрокарбоната натрия и полученную смесь экстрагируют этилацетатом. Органический слой промывают водой и затем насыщенным раствором соли и затем сушат над сульфатом магния. Растворитель отгоняют. К остатку прибавляют гексан для высаживания реакционного продукта, который затем собирают фильтрацией и промывают гексаном с получением посредством этого желаемого соединения (168 мг). Точка плавления: 162-166oC.
Пример 9.
(1) Синтез 1-(2,4-дифторфенил)-1-(4-(4-этоксикарбонилтиазол-2- ил)тиофен-2-ил)-2-(1H-1,2,4-триазол-1-ил)этанола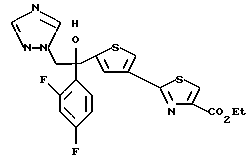
1-(2,4-Дифторфенил)-1-(4-тиокарбамоилтиофен-2-ил)-2-(1H-1,2,4- триазол-1-ил)этанол (1,6 г) растворяют в диметилформамиде (10 мл) и к раствору прибавляют α -бромэтилпировиноградную кислоту (0,67 мл). Полученную смесь перемешивают при 60oC в течение 4 часов. После взаимодействия добавляют воду и реакционную смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли. Остаток подвергают колоночной хроматографии на силикагеле (хлороформ: метанол = 80:1) с получением посредством этого маслянистого продукта (1,78 г).
(2) Синтез 1-(2,4-дифторфенил)-1-(4-(4-карбамоилтиазол-2- ил)тиофен-2-ил)-2-(1H-1,2,4-триазол-1-ил)этанола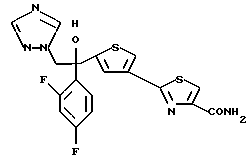
1-(2,4-Дифторфенил)-1-(4-(4-этоксикарбамоилтиазол-2-ил)- тиофен-2-ил)-2-(1H-1,2,4-триазол-1-ил)этанол (1,7 г), полученный на стадии (1), растворяют в насыщенном метанольном растворе (35 мл) аммиака и полученный раствор оставляют на 23 часа при комнатной температуре. После отгонки растворителя при пониженном давлении получают кристаллы (1,2 г) из дихлорэтан-эфира Точка плавления: 112-115oC.
Пример 10:
Синтез 1-(2,4-дифторфенил)-1-(4-(4-цианотиазол-2-ил)тиофен-2- ил)-2-(1H-1,2,4-триазол-1-ил)этанола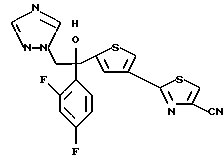
1-(2,4-Дифторфенил)-1-(4-(4-карбамоилтиазол-2-ил)тиофен-2- ил)-2-(1H-1,2,4-триазол-1-ил)этанол (1,2 г) растворяют в пиридине (7,1 мл). Раствор охлаждают на ледяной бане и к нему добавляют оксихлорид фосфора (0,29 мл). Полученную смесь перемешивают в течение 30 минут. После взаимодействия к реакционной смеси добавляют насыщенный раствор соли и экстрагируют этилацетатом. Органический слой промывают один раз 6 Н соляной кислотой (20 мл) и затем по одному разу водой, насыщенным раствором гидрокарбоната натрия и насыщенным раствором соли. После высушивания полученного таким образом органического слоя над сульфатом магния растворитель отгоняют и остаток очищают колоночной хроматографией на силикагеле. Перекристаллизация из раствора дихлорметана в эфире далее приводит к получению твердого продукта (800 мг). Точка плавления: 172-173oC.
Примеры 11-17.
Соединения, представленные общей формулой (II):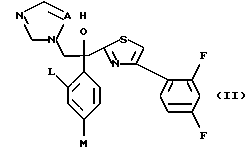
в которых A, M и L замещены, как показано в таблице 1, получают тем же способом, что и по примеру 1.
В таблицах, приведенных далее, даны следующие обозначения:
mp. - Т. пл.
1Н.M.R. - 1H ЯМР
Hz - Гц
brd - ушир. д. (уширенный дублет)
brs - ушир. с. (уширенный синглет)
d - д (дублет)
dd - дд (двойной дублет)
m - м (мультиплет)
s - с (синглет)
td - тд (тройной дублет)
Примеры 18-87.
Целевые соединения, полученные тем же способом, что и по примерам 1-10, суммарно показаны в таблице 2.
Экспериментальный пример 1.
Группы по пять мышей ICR инфицируют через их хвостовые вены штаммом Candida albicans MCY 8622 (2 х 106 СОЕ/мышь) (SFU - СОЕ, синтицийобразующая единица). Через 1 час соединения [представленные общей формулой (III)], показанные в таблице 3, вводят орально в дозе 2,5 или 10 мг на кг веса мыши соответствующим группам мышей. Наблюдения проводят в течение 7 дней для расчета среднего числа дней выживания для каждой группы. Это среднее число используют в качестве показателя, указывающего на противогрибковую активность in vivo.
Общая формула (III) следующая: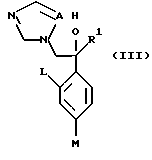
Препаративный пример 1:
Получение сырого продукта 1: (2S,3R)-3-(2,4-дифторфенил)-3- гидрокси-2-метил-4-(1H-1,2,4-триазол-1-ил)бутиронитрил
Структурная формула: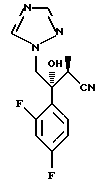
К раствору 5 г (20,0 ммоль) оптически активного (2R,3S)-2-(2,4-дифторфенил)-3-метил-2-(1H-1,2,4-триазол-1- ил)метилоксирана, растворенного в 40 мл толуола, добавляют 80 мл диэтиламмонийцианида (1,0 М толуольного раствора) в атмосфере азота. Смесь нагревают при 50oC в течение 12 часов и по каплям последовательно прибавляют 10 мл воды и 120 мл 1 HCl. Полученную смесь перемешивают в течение 2 часов при комнатной температуре, фильтруют сквозь фильтр Florisil и затем подвергают экстракции этилацетатом. Полученный органический слой промывают 4 раза жидкостью, полученной при смешивании воды и насыщенного раствора соли при соотношении 1:1, и в заключение насыщенным раствором соли. После отгонки растворителя при пониженном давлении остаток промывают диизопропиловым эфиром с получением 3,15 г (56,6%) оптически активного (2S,3R)-3-(2,4-дифторфенил)-3- гидрокси-2-метил-4-(1H-1,2,4-триазол-1-ил)бутиронитрила. Физические свойства этого продукта описаны далее.
Т. пл. 181-182oC.
ЯМР: δ растворитель (CDCl3) 1,17 (3H, д, J=7,2 Гц), 3,29 (1H, кв, J=7,2 Гц), 4,82 (1H, д, J=14,0 Гц), 4,97 (1H, д, J=14,0 Гц), 5,44 (1H, д, J=0,8 Гц), 6,74-6,82 (2H, м), 7,39-7,46 (1H, м), 7,83 (1H, с), 7,84 (1H, с).
МС: MH+ = 279.
Препаративный пример 2:
Получение сырого продукта 1 другим методом:
Гексагидрат хлорида иттербия в количестве 388 мг (1 ммоль) оставляют на 6 часов при 120oC при пониженном давлении. Это соединение суспендируют в 10 мл тетрагидрофурана в атмосфере азота и суспензию охлаждают до -78oC. К этой суспензии прибавляют по каплям 1,9 мл п-нитробутиллития (1,63 М раствор в гексане) и полученную смесь перемешивают в течение 5 минут при комнатной температуре и затем охлаждают до -78oC. К этой смеси осторожно прибавляют по каплям 0,8 мл триметилсилилцианида. Полученную смесь перемешивают в течение 10 минут при -78oC и затем в течение 5 минут при комнатной температуре охлаждают до -78oC. К этой смеси прибавляют по каплям раствор 128 мг (0,5 ммоль) оптически активного (2R,3S)-2-(2,4-дифторфенил)-3-метил-2-(1H-1,2,4-триазол- 1-ил)метилоксирана, растворенного в 1 мл тетрагидрофурана, и температуру полученной смеси сразу повышают до комнатной температуры. К этой смеси прибавляют насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом. Полученный органический слой промывают водой и насыщенным водным раствором соли. После отгонки растворителя при пониженном давлении остаток перекристаллизовывают из диэтилового эфира с получением посредством этого 81 мг (58,2%) оптически активного (2S,3R)-3-(2,4-дифторфенил)-3-гидрокси-2-метил-4-(1H- 1,2,4-триазол-1-ил)бутиронитрила.
Препаративный пример 3:
Получение сырого продукта 1 другим методом:
Гидрид лития в количестве 48 мг (60,0 ммоль) добавляют к охлаждаемому льдом раствору (50 мл) тетрагидрофурана до полного суспендирования. Через 10 минут к суспензии добавляют по каплям 5,4 г (63,5 ммоль) ацетонциангидрина [(CH3)2C(OH)CN] с последующим продолжением перемешивания дополнительно 1,5 часа при комнатной температуре. К этой смеси прибавляют 5 г (20,0 ммоль) оптически активного (2R,3S)-2-(2,4-дифторфенил)-3-метил-2- (1H-1,2,4-триазол-1-ил)метилоксирана. К полученному реакционному раствору прибавляют 100 мл этилацетата и затем последовательно промывают 100 мл воды и 50 мл раствора хлорида натрия. Далее сушат над сульфатом магния. Полученный раствор затем фильтруют. Фильтрат концентрируют при пониженном давлении. К концентрату добавляют 50 мл диизопропилового эфира. Полученный раствор подвергают фильтрации с получением 4,2 г (76,0%) оптически активного (2S,3R)-3-(2,4-дифторфенил)-3-гидрокси-2-метил-4-(1H- 1,2,4-триазол-1-ил)бутиронитрила.
Препаративный пример 4:
Получение сырого продукта 2:
Получение 2-(2,4-дифторфенил)-3-тиоамид-1-(1H-1,2,4-триазол-1- ил)-2-бутанола
Структурная формула:
К рацемической модификации сырого материала 1, полученного по препаративному примеру 1 или 2, т.е. 3-(2,4-дифторфенил)-3- гидрокси-2-метил-4-(1H-1,2,4-триазол-1-ил)бутиронитрила (14 г), прибавляют 14 мл воды в O,O-диэтилдитиофосфат (73 мл) и полученную смесь нагревают и кипятят с обратным холодильником в течение 30 минут. Жидкую реакционную смесь опять охлаждают до комнатной температуры, добавляют воды и подвергают экстракции AcOEt. Полученный AcOEt слой промывают водой и насыщенным водным раствором NaCl и сушат над сульфатом магния. Затем растворитель отгоняют. Полученный остаток очищают хроматографией на силикагеле (SiO2: 300 г, элюирование 1% раствором MeOH в CH2Cl2, 2% раствор MeOH в CH2Cl2 и 3% раствор MeOH в CH2Cl2 последовательно) и затем перекристаллизовывают из хлористого метилен-изопропилового эфира с получением посредством этого желаемого продукта (8,1 г). Кроме того, когда оптически активное вещество сырого продукта 1 используют вместо рацемической модификации сырого материала 1 может быть получен подобным образом оптически активный сырой продукт 2.
Физические свойства этого продукта описаны далее.
Т. пл. 164-167oC.
ЯМР: δ растворитель (CDCl3) 1,11 (3H, д, J=7,1 Гц), 3,69-3,72 (1H, м), 4,55 (1H, д, J=14,3 Гц), 5,08 (1H, д, J=14,3 Гц), 6,71-6,80 (2H, м), 7,42-7,48 (1H, м), 7,80 (1H, ушир. с), 7,94 (1H, с), 8,41 (1H, ушир. с).
МС: MH+ = 313.
Препаративный пример 5:
Получение сырого продукта 3:
Получение 2-бром-4'-цианоацетофенона
Структурная формула: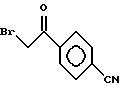
4'-Цианоацетофенон (10 г) растворяют в 100 мл хлороформа и к полученному раствору прибавляют по каплям 48% HBr (3,7 мл) в хлороформе при комнатной температуре. После перемешивания в течение 2 часов при комнатной температуре к жидкой реакционной смеси прибавляют насыщенный водный раствор NaHCO3 для ее нейтрализации. Хлороформный слой промывают водой и насыщенным водным раствором NaCl и сушат над сульфатом магния. Затем хлороформ отгоняют. Полученный твердый продукт перекристаллизовывают из AcOEt-н-гексана с получением посредством этого целевого соединения (3,49 г). Физические свойства этого продукта описаны далее.
Т. пл. 82-84oC.
ЯМР: δ растворитель (CDCl3) 4,44 (2H, с), 7,81-7,84 (2H, м), 8,09 (1H, д, J=8 Гц), 8,23 (1H, д, J=8 Гц).
Препаративный пример 6:
Получение сырого продукта 4:
Получение 2-этил-4-хлорбензотиазола
Структурная формула:
2-Амино-5-хлортиофенол (2,618 г) растворяют в N-метилпирролидоне (6 мл) и к раствору прибавляют пропионилхлорид (1,57 мл) с последующим нагреванием при 130oC в течение 1,5 часов. К жидкой реакционной смеси прибавляют этилацетат и водный раствор гидрокарбоната натрия для разделения смеси на слои. Полученный органический слой промывают водой, сушат и концентрируют. Полученный остаток очищают хроматографированием на колонке с силикагелем (гексан: этилацетат = 20: 1) с получением посредством этого 2-этил-6-хлорбензотиазола (2,3 г). Физические свойства этого продукта описаны далее.
Состояние: твердый продукт.
ЯМР: δ растворитель (CDCl3) 1,47 (3H, т, J=7,4 Гц), 3,14 (2H, кв, J=7,4 Гц), 7,40 (1H, дд, J=2,0 Гц, 8,8 Гц), 7,81 (1H, д, J=2,0 Гц), 7,86 (1H, д, J=8,8 Гц).
Препаративный пример 7:
Получение сырого продукта 5:
Получение 2-этил-6-(1,2,3-триазол-2-ил)бензотиазола
Структурная формула:
1H-1,2,3-Триазол (10,0 г) растворяют в диметилформамиде (280 мл) и к раствору прибавляют 60% дисперсию гидрида натрия (5,79 г) в минеральном масле в течение более 10 минут. К этой смеси прибавляют по каплям раствор 4-фторнитробензола (18,6 г) при комнатной температуре и полученную смесь нагревают и перемешивают при 50oC в течение 9 часов. Реакционную смесь выливают в 400 мл насыщенного водного раствора хлористого аммония и туда приливают 200 мл воды. Эту смесь подвергают экстракции этилацетатом (400 млх1, 200 млх2) и этилацетатный слой промывают водой и затем насыщенным раствором соли и сушат над безводным сульфатом магния. Органический слой концентрируют при пониженном давлении и очищают хроматографированием на колонке с силикагелем (гексан: этилацетат = 2:1 _→ 1:1) с получением посредством этого 4-(1,2,3-триазол-2-ил)нитробензола (11,5 г).
4-(1,2,3-Триазол-2-ил)нитробензол (5,75 г) растворяют в 300 мл этанола и к раствору прибавляют 10% палладий-на-угле (0,58 г) и гидразингидрат (15,0 г) с последующим нагреванием и кипячением с обратным холодильником в течение 5 часов. Реакционную смесь охлаждают до комнатной температуры и фильтруют через Целит. Фильтрат концентрируют при пониженном давлении, добавляют 500 мл воды и подвергают экстракции этилацетатом (200 мл, 100 мл х 2). Полученный таким образом органический слой промывают водой и затем насыщенным раствором соли, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении с получением посредством этого 4-(1,2,3-триазол-2-ил)анилина (5,0 г). Этот продукт используют в последующей реакции без его очистки.
4-(1,2,3-Триазол-2-ил)анилин (5,0 г), полученный по предшествующей реакции, растворяют в 55 мл уксусной кислоты и к раствору прибавляют тиоцианат аммония (6,0 г). Полученную смесь перемешивают при охлаждении ледяной водой. К этой смеси прибавляют по каплям раствор брома (1,62 мл) в 20 мл уксусной кислоты в течение более 30 минут. Затем смесь нагревают до комнатной температуры, перемешивают при этой температуре в течение 4 часов.
Реакционную смесь охлаждают ледяной водой и прибавляют по каплям концентрированный раствор аммиака с достижением таким образом pH 6. Образующийся осадок выделяют фильтрацией, промывают водой и затем холодным этанолом и сушат при пониженном давлении с получением 2-амино-6-(1,2,3-триазол-2-ил)бензотиазола (5,6 г).
2-Амино-6-(1,2,3-триазол-2-ил)бензотиазол (2,8 г) растворяют в N,N-диметилформамиде (60 мл) и к раствору прибавляют изоамилнитрит (8,66 мл) с последующим перемешиванием в течение 20 минут при 65oC. Реакционную смесь выливают в 100 мл воды и подвергают экстракции этилацетатом (100 мл х 3). Полученный органический слой промывают водой и затем насыщенным раствором соли, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Полученный маслянистый продукт очищают хроматографированием на колонке с силикагелем (дихлорметан) с получением 6-(1,2,3-триазол-2-ил)бензтиазола (1,1 г).
6-(1,2,3-Триазол-2-ил)бензтиазол (1,1 г) суспендируют в этаноле (90 мл) и к суспензии прибавляют 12 мл гидразинмоногидрата. Полученную смесь нагревают и кипятят с обратным холодильником в течение 2 часов. После концентрирования реакционной смеси при пониженном давлении добавляют 20 мл воды и устанавливают pH 7 с помощью уксусной кислоты. Полученную таким образом смесь 3 раза подвергают экстракции этилацетатом и полученный органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении с получением 2-амино-5-(1,2,3-триазол-2-ил)тиофенола (2,3 г). Этот продукт используют в последующей реакции без очистки.
2-Амино-5-(1,2,3-триазол-2-ил)тиофенол (2,3 г) растворяют в N-метилпирролидоне (8 мл) и к раствору прибавляют пропионилхлорид (0,472 мл) с последующим нагреванием и перемешиванием при 70oC в течение 5 часов. Реакционную смесь выливают в насыщенный водный раствор гидрокарбоната натрия и подвергают экстракции дихлорметаном. Полученный органический слой сушат над безводным сульфатом магния, концентрируют при пониженном давлении и затем очищают на колонке с силикагелем (гексан-этилацетат = 4:1 _→ 1:1) с получением целевого соединения, 2-этил-6-(1,2,3-триазол-2- ил)бензотиазола (940 мг). Физические свойства этого продукта описаны далее.
Состояние: твердый продукт.
ЯМР; δ растворитель (CDCl3) 1,49 (3H, т, J=7,7 Гц), 3,17 (2H, кв, J=7,7 Гц), 7,83 (2H, с), 8,03 (1H, д, J=8,8 Гц), 8,20 (1H, дд, J=8,8 Гц, 3,2 Гц), 8,55 (1H, д, J=8,8 Гц).
Пример 88.
Получение соединения структурной формулы: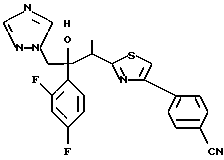
2-(2,4-Дифторфенил)-3-тиоамид-1-(1H-1,2,4-триазол-1-ил)-2- бутанол (сырой продукт 2) (156 мг) растворяют в EtOH (2 мл) и к раствору прибавляют 2-бром-4'-цианоацетофенон (сырой продукт 3) (224 мг) с последующим нагреванием и кипячением с обратным холодильником в течение 1 часа. Жидкую реакционную смесь нейтрализуют насыщенным раствором водным карбоната натрия и подвергают экстракции AcOEt. После промывки экстракта водой и затем насыщенным раствором NaCl и сушки над безводным сульфатом магния отгоняют AcOEt. Полученный остаток очищают хроматографией на силикагеле (SiO2: 20 г, элюирование хлористым метиленом и затем 1% раствором MeOH в хлористом метилене), и затем кристаллизуют из ИПЭ с получением посредством этого целевого соединения (109 мг). Физические свойства этого соединения описаны далее.
Т. пл. 196-197oC.
ЯMP: δ растворитель (CDCl3) 1,23 (3H, д, J=8,0 Гц), 4,09 (1H, кв, J=8,0 Гц), 4,26 (1H, д, J=14,3 Гц), 4,92 (1H, д, J=14,3 Гц), 5,74 (1H, с), 6,78-6,85 (2H, м), 7,48-7,54 (1H, м), 7,64 (1H, с), 7,69 (1H, с), 7,75 (1H, д, J= 8,1 Гц), 7,85 (1H, с), 8,03 (1H, д, J=8,1 Гц).
МС: MH+ = 483.
Пример 89.
Получение соединения, представленного структурной формулой:
Целевое соединение получают в соответствии с тем же способом, что описан в примере 88, за исключением того, что вместо 2-бром-4'-цианоацетофенона используют 2-бром-4'-метилцианоацетофенон. Физические свойства этого соединения описаны далее. Состояние: твердый продукт.
ЯМР: 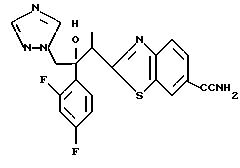 растворитель (CDCl3) 1,23 (3H, д, J = 7,2 Гц), 2,54 (3H, с), 4,05 (1H, кв, J = 7,2 Гц), 4,28 (1H, д, J = 14,4 Гц), 4,88 (1H, д, J = 14,4 Гц), 6,13 (1H, с), 6,75 - 6,85 (2H, м), 7,33 (2H, ушир. д, J = 8,4 Гц), 7,42 (1H, с), 7,46 - 7,54 (1H, м), 7,66 (1H, с), 7,82 (2H, ушир. д, J = 8,4 Гц), 7,92 (1H, с).
растворитель (CDCl3) 1,23 (3H, д, J = 7,2 Гц), 2,54 (3H, с), 4,05 (1H, кв, J = 7,2 Гц), 4,28 (1H, д, J = 14,4 Гц), 4,88 (1H, д, J = 14,4 Гц), 6,13 (1H, с), 6,75 - 6,85 (2H, м), 7,33 (2H, ушир. д, J = 8,4 Гц), 7,42 (1H, с), 7,46 - 7,54 (1H, м), 7,66 (1H, с), 7,82 (2H, ушир. д, J = 8,4 Гц), 7,92 (1H, с).
МС: MH+ = 459.
Пример 90.
Получение соединения, представленного структурной формулой:
_→
Целевое соединение получают в соответствии с тем же способом, что описан в примере 88, за исключением того, что вместо 2-бром-4'-цианоацетофенона используют 2-бром-2', 4'-дифторацетофенон. Физические свойства этого соединения описаны далее.
Состояние: твердый продукт.
ЯМР: δ растворитель (CDCl3) 1,23 (3H, д, J = 7,1 Гц), 4,07 (1H, кв, J = 7,1 Гц), 4,26 (1H, д, J = 14,4 Гц), 4,89 (1H, д, J = 14,4 Гц), 5,93 (1H, с), 6,92 - 6,98 (1H, м), 7,00 - 7,05 (1H, м), 7,47 - 7,54 (1H, м), 7,67 (1H, с), 7,68 (1H, с), 7,88 (1H, с), 8,13 - 8,19 (1H, м).
МС: MH+ = 449.
Пример 91.
Получение соединения, представленного структурной формулой: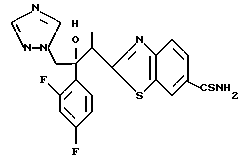
Целевое соединение получают в соответствии с тем же способом, что описан в примере 88, за исключением того, что вместо 2-бром-4'-цианоацетофенона используют 2-бром-4'-метилацетофенон. Физические свойства этого соединения описаны далее.
Состояние: твердый продукт.
ЯМР: δ растворитель (CDCl3) 1,23 (3H, д, J = 7,1 Гц), 2,41 (3H, с), 4,04 (1H, д, J = 7,1 Гц), 4,28 (1H, д, J = 14,3 Гц), 4,88 (1H, д, J = 14,3 Гц), 6,24 (1H, с), 6,76 - 6,84 (1H, с), 7,27 (2H, д, J = 8,3 Гц), 7,40 (1H, с), 7,47 - 7,53 (1H, м), 7,65 (1H, с), 7,80 (2H, д, J = 8,3 Гц), 7,94 (1H, с).
МС: MH+ = 427.
Пример 92.
Получение соединения, представленного структурной формулой: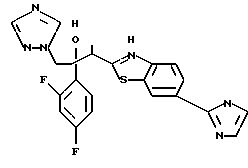
Целевое соединение получают в соответствии с тем же способом, что описан в примере 88, за исключением того, что вместо 2-бром-4'-цианоацетофенона используют 2-бром-4'-метоксиацетофенон. Физические свойства этого соединения описаны далее.
Состояние: твердый продукт.
ЯМР: 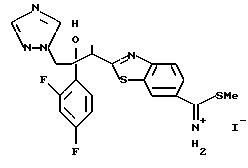 растворитель (CDCl3) 1,23 (3H, д, J = 7,1 Гц), 3,88 (3H, с), 4,04 (1H, кв, J = 7,1 Гц), 4,28 (1H, д, J = 14,3 Гц), 4,87 (1H, д, J = 14,3 Гц), 6,24 (1H, с), 6,76 - 6,84 (2H, м), 7,00 (2H, д, J = 8,2 Гц), 7,32 (1H, с), 7,47 - 7,53 (1H, м), 7,65 (1H, с), 7,84 (2H, д, J = 8,2 Гц), 7,94 (1H, с).
растворитель (CDCl3) 1,23 (3H, д, J = 7,1 Гц), 3,88 (3H, с), 4,04 (1H, кв, J = 7,1 Гц), 4,28 (1H, д, J = 14,3 Гц), 4,87 (1H, д, J = 14,3 Гц), 6,24 (1H, с), 6,76 - 6,84 (2H, м), 7,00 (2H, д, J = 8,2 Гц), 7,32 (1H, с), 7,47 - 7,53 (1H, м), 7,65 (1H, с), 7,84 (2H, д, J = 8,2 Гц), 7,94 (1H, с).
МС: MH+ = 443.
Пример 93.
Получение соединения, представленного структурной формулой:
μ
Целевое соединение получают в соответствии с тем же способом, что описан в примере 88, за исключением того, что вместо 2-бром-4'-цианоацетофенона используют 2-бром-4'-нитроацетофенон. Физические свойства этого соединения описаны далее.
Т. пл. 180 - 182oC.
ЯМР: δ растворитель (CDCl3) 1,25 (3H, д, J = 7,1 Гц), 4,11 (1H, д, J = 7,1 Гц), 4,27 (1H, д, J = 14,2 Гц), 4,94 (1H, д, J = 14,2 Гц), 5,70 (1H, с), 6,79 - 6,85 (2H, м), 7,43 - 7,55 (1H, м), 7,70 (1H, с), 7,71 (1H, с), 7,85 (1H, с), 8,08 (2H, д, J = 9,0 Гц), 8,32 (2H, д, J = 9,0 Гц).
МС: MH+ = 458.
Пример 94.
Получение соединения, представленного структурной формулой: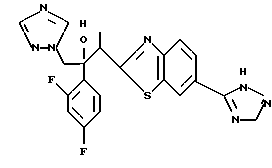
К суспензии 1,570 г 60%-ного гидрида натрия в 30 мл ДМД прибавляют 5 г 4-фтортиофенола и полученную смесь перемешивают при комнатной температуре в течение 5 минут. К этой смеси прибавляют 4,9 г 4-фторацетофенона с последующим перемешиванием в течение 3,5 часов при 80oC. К этой смеси приливают воду и экстрагируют этилацетатом. Экстракт промывают водой и затем насыщенным раствором соли и растворитель отгоняют при пониженном давлении с получением посредством этого 10,008 г 4-фтор-4'-ацетилфенилсульфида.
После этого промежуточное соединение, представленное структурной формулой:
μ
получают в соответствии с тем же способом, что описан в препаративном примере 4. Целевое соединение затем получают в соответствии с тем же способом, что описан в примере 88, за исключением того, что это соединение используют вместо 2-бром-4'-цианоацетофенона. Физические свойства этого соединения описаны далее.
Состояние: твердый продукт.
ЯМР: δ растворитель (CDCl3) 1,22 (3H, д, J = 7,0 Гц), 4,05 (1H, кв, J = 7,0 Гц), 4,26 (1H, д, J = 14,6 Гц), 4,88 (1H, д, J = 14,6 Гц), 6,04 (1H, с), 6,76 - 6,85 (2H, м), 7,07 (2H, ушир. дд, J = 8,4, 8,4 Гц), 7,32 (2H, ушир. д, J = 8,4 Гц), 7,44 (1H, ушир. с), 7,44 (2H, ушир. дд, J = 8,4, 8,4 Гц), 7,45 - 7,54 (1H, м), 7,66 (1H, с), 7,82 (2H, ушир. д, J = 8,4 Гц), 7,89 (1H, с).
МС: MH+ = 539.
Пример 95.
Получение соединения, представленного структурной формулой:
В 4 мл N-метилпирролидона растворяют 400 мг соединения, полученного по примеру 88, и к раствору добавляют 123 мг NaN3 и 260 мг Et3N • HCl. Полученную смесь нагревают в течение 6,5 часов при внешней температуре 100oC на масляной бане и к раствору далее добавляют 31 мг NaN3 и 65 мг Et3N • HCl для проведения реакции в течение 20 часов при 90oC. К полученной смеси добавляют хлористый метилен и полученную смесь удаляют фильтрацией с последующим упариванием жидкой реакционной смеси. К остатку прибавляют EtOH, ацетон, воду и 1 H HCl и полученную смесь оставляют стоять для высаживания твердого вещества. Этот твердый продукт отделяют фильтрацией с получением 390 мг целевого соединения. Физические свойства этого соединения описаны далее.
Т. пл. 166 - 169oC.
ЯМР: μ растворитель (CDCl3) 1,14 (3H, д, J = 7,3 Гц), 4,11 (1H, кв, J = 7,3 Гц), 4,37 (1H, д, J = 14,6 Гц), 4,87 (1H, д, J = 14,6 Гц), 6,08 (1H, с), 6,91 - 6,96 (1H, м), 7,18 - 7,25 (1H, м), 7,27 - 7,34 (1H, м), 7,62 (1H, с), 8,11 (2H, д, J = 8,5 Гц), 8,20 (2H, д, J = 8,5 Гц), 8,22 (1H, с), 8,29 (1H, с).
МС: MH+ = 481.
Пример 96.
Получение соединения, представленного структурной формулой:
μ
В воде (4 мл) суспендируют 800 мг соединения, полученного по примеру 88, и к суспензии прибавляют 2,6 мл (16,479 ммоль) соединения, представленного структурной формулой:
δ
с последующим нагреванием и кипячением с обратным холодильником в течение 30 минут. К жидкой реакционной смеси прибавляют воду и смесь подвергают экстракции AcOEt. После промывки экстракта водой и затем насыщенным водным раствором NaCl и сушки над сульфатом магния отгоняют AcOEt. Полученный остаток без его очистки растворяют в 10 мл ацетона и к раствору добавляют 0,45 мл CH3I с последующим перемешиванием при 40oC в течение 40 минут. К полученной жидкой реакционной смеси прибавляют воду и смесь подвергают экстракции AcOEt. После промывки экстракта водой и затем насыщенным водным раствором NaCl и сушки над сульфатом магния отгоняют AcOEt. Полученный остаток без его очистки растворяют в 10 мл EtOH и к раствору прибавляют 220 мг NH2NHCHO, 0,26 мл Et3N и одну каплю серной кислоты с последующим нагреванием и кипячением с обратным холодильником в течение 1 часа. К полученной жидкой реакционной смеси прибавляют воду и подвергают экстракции AcOEt. После промывки экстракта водой и затем насыщенным водным раствором NaCl и сушки над сульфатом магния отгоняют AcOEt. Полученный остаток очищают хроматографией на колонке с силикагелем (SiO2: 50 г, элюирование хлористым метиленом и затем 1% раствором MeOH в хлористом метилене и затем 2% раствором MeOH в хлористом метилене) с получением посредством этого 369 мг целевого соединения. Физические свойства этого соединения описаны далее.
Состояние: твердый продукт.
ЯМР: 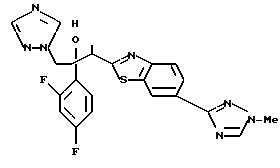 растворитель (CDCl3) 1,24 (3H, д, J = 7,1 Гц), 4,08 (1H, кв, J = 7,1 Гц), 4,34 (1H, д, J = 14,4 Гц), 4,91 (1H, д, J = 14,4 Гц), 6,15 (1H, с), 6,79 - 6,85 (1H, с), 7,52 - 7,56 (2H, м), 7,69 (1H, с), 7,97 - 7,99 (3H, м), 8,14 (2H, д, J = 8,2 Гц), 8,25 (1H, с).
растворитель (CDCl3) 1,24 (3H, д, J = 7,1 Гц), 4,08 (1H, кв, J = 7,1 Гц), 4,34 (1H, д, J = 14,4 Гц), 4,91 (1H, д, J = 14,4 Гц), 6,15 (1H, с), 6,79 - 6,85 (1H, с), 7,52 - 7,56 (2H, м), 7,69 (1H, с), 7,97 - 7,99 (3H, м), 8,14 (2H, д, J = 8,2 Гц), 8,25 (1H, с).
МС: MH+ = 480.
Пример 97.
Получение соединения, представленного структурной формулой: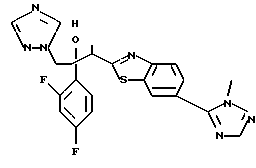
В 3 мл диметилформамида растворяют 250 мг соединения, полученного по примеру 95, и к раствору прибавляют 174 мг CsCO3. Полученную смесь нагревают в течение 30 минут при внешней температуре в 60oC на масляной бане и добавляют 0,05 мл CH3I с последующим перемешиванием в течение 30 минут при комнатной температуре. К жидкой реакционной смеси прибавляют воду и подвергают экстракции AcOEt. После промывки экстракта водой и затем насыщенным водным раствором NaCl и сушки над сульфатом магния отгоняют AcOEt. Полученный остаток очищают хроматографией на колонке с силикагелем (SiO2: 30 г, элюирование хлористым метиленом и затем 1% раствором MeOH в хлористом метилене и затем 2% раствором MeOH в хлористом метилене) с получением посредством этого 125 мг целевого соединения. Физические свойства этого соединения описаны далее.
Т.пл. 191 - 193oC.
ЯМР: μ растворитель (CDCl3) 1,25 (3H, д, J = 7,0 Гц), 4,09 (1H, кв, J = 7,0 Гц), 4,29 (1H, д, J = 14 Гц), 4,33 (3H, с), 4,92 (1H, д, J = 14 Гц), 6,01 (1H, с), 6,77 - 6,85 (2H, м), 7,49 - 7,55 (1H, м), 7,58 (1H, с), 7,67 (1H, с), 7,91 (1H, с), 8,04 (2H, д, J = 8,2 Гц), 8,24 (2H, д, J = 8,2 Гц).
МС: MH+ = 495.
Пример 98.
Получение соединения, представленного структурной формулой:
_→
В 5 мл ацетона растворяют 200 мг соединения, полученного по примеру 96, и к раствору прибавляют 60,6 мг карбоната калия и 0,03 мл хлористого метила. Полученную смесь перемешивают в течение 19 часов при комнатной температуре. К жидкой реакционной смеси прибавляют воду и подвергают экстракции AcOEt. После промывки экстракта водой и затем насыщенным водным раствором NaCl и сушки над сульфатом магния отгоняют AcOEt. Полученный остаток очищают хроматографией на колонке (SiO2: 40 г, элюирование хлористым метиленом и затем 0,5% раствором MeOH в хлористом метилене и затем 1% раствором MeOH в хлористом метилене) с получением 142 мг целевого соединения. Физические свойства этого соединения описаны далее.
Состояние: твердый продукт.
ЯМР: _→ растворитель (CDCl3) 1,13 (1H, д, J = 6,0 Гц), 1,25 (2H, д, J = 7,1 Гц), 4,01 - 4,13 (4H, м), 4,27 (2/3H, д, J = 14 Гц), 4,29 (1/3H, д, J = 14 Гц), 4,91 (1H, д, J = 14 Гц), 5,45 (1/3H, с), 6,08 (2/3H, с), 6,70 - 6,84 (2H, м), 7,50 - 7,55 (2H, м), 7,67 - 7,68 (4/3H, м), 7,79 - 7,81 (2/3H, м), 7,93 (1H, с), 7,96 (1H, с), 7,98 (1H, с), 8,10 (1H, с), 8,19 (2H, д, J = 8,4 Гц).
Пример 99.
Получение соединения, представленного структурной формулой:
δ
К раствору 138 мг соединения, полученного по примеру 89, растворенного в 3 мл хлороформа, прибавляют 215 мг мета-хлорпербензойной кислоты с последующим перемешиванием при комнатной температуре. После исчезновения сырого материала к жидкой реакционной смеси прибавляют воду с последующей экстракцией этилацетатом. Полученный органический слой промывают 50% насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным раствором соли. После удаления растворителя при пониженном давлении остаток очищают хроматографией на колонке с силикагелем и кристаллизуют из дихлорэтана-диизопропилового эфира с получением посредством этого 98,5 мг целевого соединения. Физические свойства этого соединения описаны далее.
Состояние: твердый продукт.
ЯМР: δ растворитель (CDCl3) 1,24 (3H, д, J = 7,2 Гц), 3,09 (3H, с), 4,09 (1H, кв, J = 7,2 Гц), 4,27 (1H, д, J = 14,4 Гц), 4,91 (1H, д, J = 14,4 Гц), 5,78 (1H, с), 6,78 - 6,85 (2H, м), 7,47 - 7,55 (1H, м), 7,67 (1H, с), 7,69 (1H, с), 7,87 (1H, с), 8,02 (2H, ушир. д, J = 8,4 Гц), 8,10 (2H, ушир. д, J = 8,4 Гц).
МС: MH+ = 491.
Пример 100.
Получение соединения, представленного структурной формулой: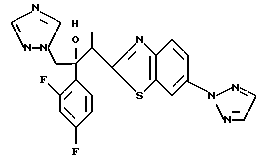
Целевое соединение получают из соединения, полученного по примеру 7, в соответствии с тем же способом, что и в примере 99. Физические свойства этого соединения описаны далее.
Состояние: твердый продукт.
ЯМР: δ растворитель (CDCl3) 1,22 (3H, д, J = 7,2 Гц), 4,07 (1H, кв, J = 7,2 Гц), 4,23 (1H, д, J = 14,4 Гц), 4,90 (1H, д, J = 14,4 Гц), 5,73 (1H, с), 6,77 - 6,84 (2H, м), 7,20 (2H, ушир. дд, J = 8,4, 8,4 Гц), 7,46 - 7,53 (1H, м), 7,63 (1H, с), 7,68 (1H, с), 7,83 (1H, с), 7,97 - 8,07 (6H, м).
МС: MH+ = 571.
Пример 101.
Получение производных, представленных структурными формулами: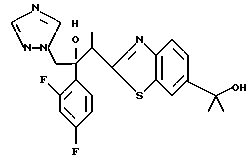
δ
и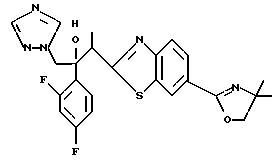
Соединения I, II и III в соответствии с этим примером получают согласно тому же способу, что и в примере 88, за исключением того, что 4-цианофенильная часть сырого продукта 3 была заменена на соответствующие пиридильные группы, которые отличались друг от друга местом присоединения. Физические свойства этих соединений описаны далее.
(I)
Т.пл. 149 - 151oC.
ЯМР: 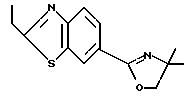 растворитель (ДМСО-d6) 1,13 (3H, д, J = 7,1 Гц), 4,07 (1H, кв, J = 7,1 Гц), 4,36 (1H, д, J = 14,3 Гц), 4,86 (1H, д, J = 14,3 Гц), 6,07 (1H, с), 6,91 - 6,96 (1H, м), 7,18 - 7,24 (1H, м), 7,27 - 7,36 (2H, м), 7,61 (1H, с), 7,88 (1H, т, J = 8 Гц), 8,11 (1H, д, J = 8 Гц), 8,22 (1H, с), 8,28 (1H, с), 8,60 - 8,62 (1H, м).
растворитель (ДМСО-d6) 1,13 (3H, д, J = 7,1 Гц), 4,07 (1H, кв, J = 7,1 Гц), 4,36 (1H, д, J = 14,3 Гц), 4,86 (1H, д, J = 14,3 Гц), 6,07 (1H, с), 6,91 - 6,96 (1H, м), 7,18 - 7,24 (1H, м), 7,27 - 7,36 (2H, м), 7,61 (1H, с), 7,88 (1H, т, J = 8 Гц), 8,11 (1H, д, J = 8 Гц), 8,22 (1H, с), 8,28 (1H, с), 8,60 - 8,62 (1H, м).
МС: MH+ = 414.
(II)
Т.пл. 148 - 149oC.
ЯМР: δ растворитель (CDCl3) 1,24 (3H, д, J = 7,1 Гц), 4,09 (1H, кв, J = 7,1 Гц), 4,27 (1H, д, J = 14,3 Гц), 4,92 (1H, д, J = 14,3 Гц), 5,84 (1H, ушир. с), 6,77 - 6,85 (2H, м), 7,40 (1H, ддд, J = 7,8, 4,8, 0,92 Гц), 7,48 - 7,56 (1H, м), 7,58 (1H, с), 7,68 (1H, с), 7,88 (1H, с), 8,21 (1H, ддд, J = 7,8, 2,2, 1,6 Гц), 8,61 (1H, дд, J = 4,8, 1,6 Гц), 9,15 (1H, дд, J = 2,2, 0,92 Гц).
МС: MH+ = 414.
(III)
Состояние: Твердый продукт.
ЯМР: 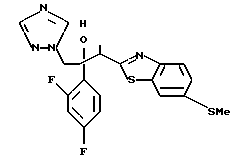 растворитель (CDCl3) 1,24 (3Hx4/5, д, J = 7,1 Гц), 1,68 (3Hx1/5, д, J = 6,2 Гц), 4,08 - 4,15 (1H, м), 4,25 (4/5H, кв, J = 14,5 Гц), 4,73 (1/5H, д, J = 13,9 Гц), 4,92 (1/5H, д, J = 13,9 Гц), 4,95 (4/5H, д, J = 14,5 Гц), 5,77 (4/5H, ушир. с), 5,88 (1/5H, ушир. с), 6,49 - 6,55 (1/5H, м), 6,66 - 6,72 (1/5H, м), 6,76 - 6,85 (1H, м), 7,07 - 7,14 (4/5H, м), 7,26 (1/5H, с), 7,44 (1/5H, с), 7,47 - 7,55 (4/5H, м), 7,61 - 7,64 (1/5H, м), 7,69 (4/5H, с), 7,73 (4/5H, с), 7,78 - 7,81 (4/5H, м), 7,87 (4/5H, с), 8,03 (1/5H, с), 8,64 - 8,66 (4/5H, м), 8,69 - 8,72 (1/5H, м).
растворитель (CDCl3) 1,24 (3Hx4/5, д, J = 7,1 Гц), 1,68 (3Hx1/5, д, J = 6,2 Гц), 4,08 - 4,15 (1H, м), 4,25 (4/5H, кв, J = 14,5 Гц), 4,73 (1/5H, д, J = 13,9 Гц), 4,92 (1/5H, д, J = 13,9 Гц), 4,95 (4/5H, д, J = 14,5 Гц), 5,77 (4/5H, ушир. с), 5,88 (1/5H, ушир. с), 6,49 - 6,55 (1/5H, м), 6,66 - 6,72 (1/5H, м), 6,76 - 6,85 (1H, м), 7,07 - 7,14 (4/5H, м), 7,26 (1/5H, с), 7,44 (1/5H, с), 7,47 - 7,55 (4/5H, м), 7,61 - 7,64 (1/5H, м), 7,69 (4/5H, с), 7,73 (4/5H, с), 7,78 - 7,81 (4/5H, м), 7,87 (4/5H, с), 8,03 (1/5H, с), 8,64 - 8,66 (4/5H, м), 8,69 - 8,72 (1/5H, м).
МС: MH+ = 414.
Пример 102.
Получение соединения, представленного структурной формулой:
δ
В 7 мл AcOEt и 5 мл тетрагидрофурана растворяют 700 мг соединения (I), полученного по примеру 101, и к раствору прибавляют 500 мг мета-хлорпербензойной кислоты с последующим перемешиванием в течение 1 часа при комнатной температуре и далее прибавлением 227 мг (0,882 ммоль) мХПБК. Полученную смесь перемешивают в течение 1 часа. К жидкой реакционной смеси прибавляют водный раствор сульфита натрия, перемешивают 5 минут и подвергают экстракции AcOEt. После промывания экстракта водным раствором сульфита натрия, водным раствором гидрокарбоната натрия, водой и затем водным раствором NaCl и сушки над сульфатом магния растворитель отгоняют. Остаток кристаллизуют из CH2Cl2-ИПЭ с получением посредством этого промежуточного N-оксида. Соединение растворяют в 5 мл CH2Cl2 и к раствору прибавляют 0,49 мл TMS-CN при комнатной температуре. Через 5 минут прибавляют 0,34 мл Me2NCOCl и смесь нагревают и кипятят с обратным холодильником в течение 1,5 часов. Затем добавляют 0,25 мл TMS-CN и 0,17 мл Me2NCOCl и полученную смесь нагревают и кипятят с обратным холодильником в течение 2,5 часов. К жидкой реакционной смеси прибавляют водный раствор гидрокарбоната натрия и смесь подвергают экстракции AcOEt. После промывания экстракта водой и насыщенным водным раствором NaCl и сушки над сульфатом магния растворитель отгоняют. Остаток очищают хроматографией на силикагеле (SiO2: 40 г, элюирование хлористым метиленом и затем 1% раствором MeOH в хлористом метилене и затем 2% раствором MeOH в хлористом метилене) с получением посредством этого 198 мг целевого соединения. Физические свойства этого соединения описаны далее.
Т.пл. 197 - 200oC.
ЯМР: δ растворитель (ДМСО-d6) 1,14 (3H, д, J = 7,0 Гц), 4,07 - 4,11 (1H, м), 4,47 (1H, кв, J = 14,3 Гц), 4,84 (1H, д, J = 14,3 Гц), 6,10 (1H, с), 6,91 - 6,96 (1H, м), 7,18 - 7,22 (1H, м), 7,23 - 7,33 (2H, м), 7,61 (1H, с), 7,98 (1H, д, J = 7,7 Гц), 8,14 (1H, т, J = 7,7 Гц), 8,21 (1H, с), 8,40 (1H, д, J = 7,7 Гц), 8,44 (1H, с).
МС: MH+ = 439.
Пример 103.
Получение соединения (I), представленного структурной формулой: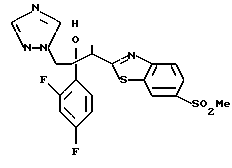
и другого соединения (II), представленного структурной формулой:
δ
В 16 мл EtOH растворяют 1,6 г 2-(2,4-дифторфенил)-3-тиоамид-1- (1H-1,2,4-триазол-1-ил)бутан-2-ол (156 мг) и к раствору добавляют 0,71 мл этилбромпирувата (этиловый эфир бромпировиноградной кислоты). Полученную смесь нагревают и кипятят с обратным холодильником в течение 5 часов. Жидкую реакционную смесь опять охлаждают до комнатной температуры, нейтрализуют насыщенным водным раствором гидрокарбоната натрия и подвергают экстракции AcOEt. После промывания экстракта водой и затем водным раствором NaCl и сушки над сульфатом магния растворитель отгоняют. Остаток очищают хроматографией (SiO2: 150 г, элюирование CH2Cl2 и затем 1% раствором MeOH в CH2Cl2 и затем 2% раствором MeOH в CH2Cl2) с получением посредством этого 435 мг 2-(2,4-дифторфенил)-3-(4-этоксикарбонилтиазол-2-ил)-1-(1H-1,2,4- триазол-1-ил)бутан-2-ола. В 20 мл ТГФ растворяют 1,9 мл этого соединения и к раствору медленно прибавляют 5,1 мл 1 М толуольного раствора DIBAL при -78oC. Через 40 минут далее прибавляют 2,3 мл 1 М толуольного раствора DIBAL при той же температуре. Через 1 час к жидкой реакционной смеси прибавляют водный раствор MH4Cl при -78oC. Реакционную смесь вновь подогревают до комнатной температуры, прибавляют воду и подвергают экстракции AcOEt. Затем экстракт промывают водой и сушат над сульфатом магния, растворитель отгоняют с получением посредством этого 989 мг 2-(2,4-дифторфенил)-3- (4-формилтиазол-2-ил)-1-(1H-1,2,4-триазол-1-ил)бутан-2-ола в виде сырого продукта.
К 5 мл ТГФ прибавляют 60% NaH (109 мг) при охлаждении ледяной водой и к смеси прибавляют по каплям раствор (Et2O)2P(=O)CH2CN (0,44 мл) в 5 мл ТГФ. После перемешивания смеси в течение 1 часа к смеси медленно прибавляют раствор с 989 мг вышеполученного продукта, растворенного в 10 мл ТГФ. После перемешивания полученной смеси в течение 30 минут при комнатной температуре к жидкой реакционной смеси прибавляют воду с последующей экстракцией AcOEt. После промывки экстракта водой и затем насыщенным водным раствором NaCl и сушки над сульфатом магния отгоняют AcOEt. Полученный остаток очищают хроматографией на силикагеле (SiO2: 60 г, элюирование CHCl3 и затем 1% раствором MeOH в CHCl3 и 2% раствором MeOH в CHCl3) с получением посредством этого 115 мг соединения I в виде первого элюата и 220 мг соединения II геометрического изомера в виде второго элюата. Физические свойства этих соединений описаны далее.
1,19 (3H, д, J = 7,1 Гц), 4,02 (1H, кв, J = 7,1 Гц), 4,16 (1H, д, J = 14,3 Гц), 4,91 (1H, д, J = 14,3 Гц), 5,47 (1H, с), 6,33 (1H, д, J = 16,0 Гц), 6,77 - 6,84 (2H, м), 7,33 (1H, д, J = 16,0 Гц), 7,46 (1H, с), 7,47 - 7,51 (1H, м), 7,72 (1H, с), 7,82 (1H, с).
МС: MH+ = 388.
1,20 (3H, д, J = 7,0 Гц), 4,05 (1H, кв, J = 7,0 Гц), 4,45 (1H, д, J = 14,0 Гц), 4,89 (1H, д, J = 14,0 Гц), 5,56 (1H, д, J = 11,9 Гц), 5,78 (1H, с), 6,75 - 6,82 (2H, м), 7,17 (1H, д, J = 11,9 Гц), 7,50 - 7,59 (1H, м), 7,60 (1H, с), 7,75 (1H, с), 8,10 (1H, с).
МС: MH+ = 388.
Пример 104.
Получение соединения, представленного структурной формулой:
δ
Целевое соединение получают в соответствии с тем же способом, что описан в примере 88, за исключением того, что вместо 2-(2,4-дифторфенил)-3-тиоамид-1-(1H-1,2,4-триазол-1-ил)бутан-2-ола используют 2-(2,4-дифторфенил)-3-тиоамид-1-(1H-1,2,4-триазол-1-ил) пропан-2-ол. Физические свойства этого соединения описаны далее.
Т.пл. 148 - 149oC.
ЯМР:  растворитель (CDCl3) 3,38 (1H, д, J = 15,2 Гц), 3,87 (1H, д, J = 15,2 Гц), 4,65 (1H, д, J = 14,0 Гц), 4,71 (1H, д, J = 14,0 Гц), 5,97 (1H, с), 6,70 - 6,76 (1H, м), 6,77 - 6,83 (1H, м), 7,42 (1H, м), 7,47 - 7,41 (1H, м), 7,69 - 7,72 (2H, м), 7,86 (1H, с), 7,86 - 7,90 (2H, м), 8,18 (1H, с).
растворитель (CDCl3) 3,38 (1H, д, J = 15,2 Гц), 3,87 (1H, д, J = 15,2 Гц), 4,65 (1H, д, J = 14,0 Гц), 4,71 (1H, д, J = 14,0 Гц), 5,97 (1H, с), 6,70 - 6,76 (1H, м), 6,77 - 6,83 (1H, м), 7,42 (1H, м), 7,47 - 7,41 (1H, м), 7,69 - 7,72 (2H, м), 7,86 (1H, с), 7,86 - 7,90 (2H, м), 8,18 (1H, с).
МС: MH+ = 424.
Пример 105.
Получение соединения, представленного структурной формулой:
δ
Целевое соединение получают в соответствии с тем же способом, что описан в примере 104, за исключением того, что вместо 2-бром-4'-цианоацетофенона используют 2-бром-4'-фторацетофенон. Физические свойства этого соединения описаны далее.
Состояние: твердый продукт.
ЯМР: 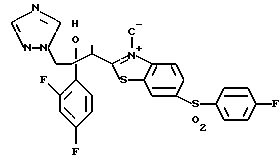 растворитель (CDCl3) 3,34 (1H, д, J = 15,4 Гц), 3,84 (1H, д, J = 15,4 Гц), 4,62 (1H, д, J = 14,0 Гц), 4,71 (1H, д, J = 14,0 Гц), 6,25 (1H, с), 6,82 - 6,69 (2H, м), 7,13 - 7,08 (2H, м), 7,17 (1H, с), 7,47 - 7,40 (1H, м), 7,76 - 7,72 (2H, м), 7,85 (1H, с), 8,21 (1H, с).
растворитель (CDCl3) 3,34 (1H, д, J = 15,4 Гц), 3,84 (1H, д, J = 15,4 Гц), 4,62 (1H, д, J = 14,0 Гц), 4,71 (1H, д, J = 14,0 Гц), 6,25 (1H, с), 6,82 - 6,69 (2H, м), 7,13 - 7,08 (2H, м), 7,17 (1H, с), 7,47 - 7,40 (1H, м), 7,76 - 7,72 (2H, м), 7,85 (1H, с), 8,21 (1H, с).
МС: MH+ = 417.
Пример 106.
Получение соединения I, представленного структурной формулой: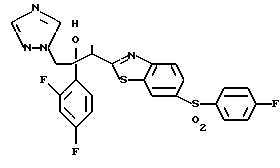
и другого соединения II, которое является диастереомером соединения I.
После прибавления по каплям н-бутиллития (1,6 М гексанового раствора; 313 мл) к диизопропиламину (840 δ л) в 15 мл тетрагидрофурана при -65oC смесь охлаждают до 4oC с проведением таким образом реакции в течение 15 минут с получением раствора диизопропиламида лития. После охлаждения раствора до -63oC к амидному раствору последовательно прибавляют тетрагидрофурановый раствор (10 мл) 2-этил-6-хлорбензотиазола (988 мл), полученный в препаративном примере 5, и тетрагидрофурановый раствор (12 мл) 1-(1H-1,2,4-триазол-1-ил)-2,4-дифторацетофенона (1,227 г) при внутренней температуре не выше чем -60oC. После проведения реакции в течение 15 минут реакционную смесь нагревают до 0oC и прибавляют к водному раствору хлорида аммония. Полученную смесь подвергают экстракции этилацетатом. Полученный органический слой промывают водой и затем насыщенным раствором соли, сушат и упаривают досуха при пониженном давлении. Остаток очищают на колонке с силикагелем (дихлорметан : метанол = 100:1). Полученную таким образом смесь диастереомеров пропускают через колонку с силикагелем (дихлорметан : этилацетат = 10:1 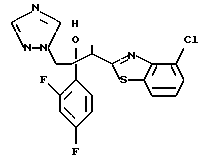 5:1) с получением посредством этого 442 мг соединения I в виде низкополярной фракции и 66 мг соединения II, которое является его диастереомером в виде высокополярной фракции. Физические свойства этого соединения описаны далее.
5:1) с получением посредством этого 442 мг соединения I в виде низкополярной фракции и 66 мг соединения II, которое является его диастереомером в виде высокополярной фракции. Физические свойства этого соединения описаны далее.
I
Т.пл. 187oC
ЯМР: δ растворитель (CDCl3) 1,25 (3H, д, J = 7,0 Гц), 4,09 (1H, кв, J = 7,0 Гц), 4,27 (1H, д, J = 14,4 Гц), 4,93 (1H, д, J = 14,4 Гц), 5,80 (1H, с), 6,85 - 6,78 (2H, м), 7,48 (1H, дд, J = 8,8 Гц, 2,4 Гц), 7,49 - 7,55 (1H, м), 7,67 (1H, с), 7,87 (1H, с), 7,90 (1H, д, J = 2,4 Гц), 7,94 (1H, д, J = 8,8 Гц).
МС: MH+ = 421.
II
Т.пл. 127 - 130oC
ЯМР: 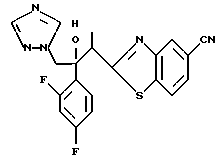 растворитель (CDCl3) 1,68 (3H, д, J = 6,8 Гц), 4,13 (1H, кв, J = 6,8 Гц), 4,71 (1H, д, J = 14 Гц), 4,94 (1H, д, J = 14 Гц), 5,87 (1H, с), 6,46 - 6,50 (1H, м), 6,43 - 6,69 (1H, м), 7,09 - 7,16 (1H, м), 7,38 (1H, дд, J = 2,0 Гц, 8,8 Гц), 7,69 (1H, с), 7,72 (1H, д, J = 2,0 Гц), 7,80 (1H, д, J = 8,8 Гц), 8,04 (1H, с).
растворитель (CDCl3) 1,68 (3H, д, J = 6,8 Гц), 4,13 (1H, кв, J = 6,8 Гц), 4,71 (1H, д, J = 14 Гц), 4,94 (1H, д, J = 14 Гц), 5,87 (1H, с), 6,46 - 6,50 (1H, м), 6,43 - 6,69 (1H, м), 7,09 - 7,16 (1H, м), 7,38 (1H, дд, J = 2,0 Гц, 8,8 Гц), 7,69 (1H, с), 7,72 (1H, д, J = 2,0 Гц), 7,80 (1H, д, J = 8,8 Гц), 8,04 (1H, с).
МС: MH+ = 421.
Пример 107.
Получение соединения, представленного структурной формулой:
δ
Смесь 2-этил-6-цианобензтиазола (1,78 г), азида натрия (1622 г) и триэтиламина гидрохлорида (2,59 г) нагревают при 100oC в течение 3 часов в 300 мл N-метилпирролидона. После охлаждения смеси до комнатной температуры к ней прибавляют 150 мл воды, устанавливают pH 3 с помощью концентрированной соляной кислоты и дважды подвергают экстракции этилацетатом. Полученный органический слой промывают насыщенным раствором соли и сушат. Растворитель отгоняют и оставшийся растворитель далее отгоняют азеотропной отгонкой с толуолом с получением посредством этого 2-этил-6-(тетразол-5-ил)бензотиазола (1,86 г). Это соединение растворяют в диметилформамиде (20 мл) и к раствору добавляют карбонат цезия (3,06 г) с последующим нагреванием при 80oC в течение 1,5 часов. Затем к реакционной смеси добавляют 1,17 мл иодметана при охлаждении льдом. Смеси дают достичь комнатной температуры и перемешивают в течение 7 часов. Добавляют воду и этилацетат для разделения смеси на слои и полученный органический слой промывают водой и сушат. Остаток очищают через колонку с силикагелем (гексан : этилацетат = 4:1) с получением посредством этого 2-этил-6-(2-метилтетразол-5-ил)бензтиазола (930 мг). Используя полученное таким образом соединение, получают тем же способом, что и по примеру 106, целевое соединение. Физические свойства этого соединения описаны далее.
Т.пл. 184 - 185oC
ЯМР:  растворитель (CDCl3) 1,28 (3H, д, J = 7,2 Гц), 4,13 (1H, кв, J = 7,2 Гц), 4,31 (1H, д, J = 14,2 Гц), 4,44 (3H, с), 4,96 (1H, д, J = 14,2 Гц), 5,89 (1H, с), 6,78 - 6,86 (2H, м), 7,50 - 7,58 (1H, м), 7,67 (1H, с), 7,89 (1H, с), 8,13 (1H, дд, J = 0,4 Гц, 8,8 Гц), 8,30 (1H, дд, J = 1,6 Гц, 8,8 Гц), 8,74 (1H, дд, J = 0,4 Гц, 1,6 Гц).
растворитель (CDCl3) 1,28 (3H, д, J = 7,2 Гц), 4,13 (1H, кв, J = 7,2 Гц), 4,31 (1H, д, J = 14,2 Гц), 4,44 (3H, с), 4,96 (1H, д, J = 14,2 Гц), 5,89 (1H, с), 6,78 - 6,86 (2H, м), 7,50 - 7,58 (1H, м), 7,67 (1H, с), 7,89 (1H, с), 8,13 (1H, дд, J = 0,4 Гц, 8,8 Гц), 8,30 (1H, дд, J = 1,6 Гц, 8,8 Гц), 8,74 (1H, дд, J = 0,4 Гц, 1,6 Гц).
Пример 108.
Получение соединения, представленного структурной формулой:
δ
Целевое соединение получают тем же способом, что и по примеру 106, за исключением того, что вместо 2-бром-6-хлорбензотиазола используют 2-этил-6-фторбензотиазол. Физические свойства этого соединения описаны далее.
Т.пл. 151 - 153oC.
ЯМР: 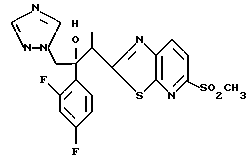 растворитель (CDCl3) 1,25 (3H, д, J = 7,1 Гц), 4,08 (1H, кв, J = 7,1 Гц), 4,28 (1H, д, J = 14,4 Гц), 4,93 (1H, д, J = 14,4 Гц), 5,83 (1H, с), 6,77 - 6,85 (2H, м), 7,23 - 7,29 (1H, м), 7,49 - 7,56 (1H, м), 7,58 - 7,62 (1H, м), 7,67 (1H, с), 7,87 (1H, с), 7,96 - 8,00 (1H, м).
растворитель (CDCl3) 1,25 (3H, д, J = 7,1 Гц), 4,08 (1H, кв, J = 7,1 Гц), 4,28 (1H, д, J = 14,4 Гц), 4,93 (1H, д, J = 14,4 Гц), 5,83 (1H, с), 6,77 - 6,85 (2H, м), 7,23 - 7,29 (1H, м), 7,49 - 7,56 (1H, м), 7,58 - 7,62 (1H, м), 7,67 (1H, с), 7,87 (1H, с), 7,96 - 8,00 (1H, м).
МС: MH+ = 405.
Пример 109.
Получение соединения, представленного структурной формулой:
δ
Целевое соединение получают тем же способом, что и по примеру 106, за исключением того, что вместо 2-бром-6-хлорбензотиазола используют 2-этил-6-цианобензотиазол. Физические свойства этого соединения описаны далее.
Т.пл. 186 - 188oC.
ЯМР: 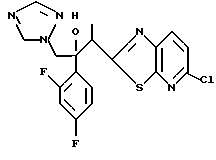 растворитель (CDCl3) 1,27 (3H, д, J = 7,2 Гц), 4,16 (1H, кв, J = 7,2 Гц), 4,24 (1H, д, J = 14,0 Гц), 4,96 (1H, д, J = 14,0 Гц), 5,67 (1H, с), 6,79 - 6,86 (2H, м), 7,49 - 7,56 (1H, м), 7,69 (1H, с), 7,77 (1H, дд, J = 1,6 Гц, 8,4 Гц), 7,83 (1H, с), 8,11 (1H, д, J = 8,4 Гц), 8,27 (1H, д, J = 1,6 Гц).
растворитель (CDCl3) 1,27 (3H, д, J = 7,2 Гц), 4,16 (1H, кв, J = 7,2 Гц), 4,24 (1H, д, J = 14,0 Гц), 4,96 (1H, д, J = 14,0 Гц), 5,67 (1H, с), 6,79 - 6,86 (2H, м), 7,49 - 7,56 (1H, м), 7,69 (1H, с), 7,77 (1H, дд, J = 1,6 Гц, 8,4 Гц), 7,83 (1H, с), 8,11 (1H, д, J = 8,4 Гц), 8,27 (1H, д, J = 1,6 Гц).
МС: MH+ = 412.
Пример 110.
Получение соединения, представленного структурной формулой:
δ
Соединение (506 мг), полученное по примеру 109, суспендируют в метаноле (10 мл) и к суспензии последовательно прибавляют 0,37 мл 1н водного раствора гидроксида натрия и 30% перекись водорода (0,42 мл). Полученную смесь перемешивают в течение 2 часов при комнатной температуре и для проведения экстракции прибавляют воду и этилацетат. Полученный органический слой промывают водой, сушат с последующей отгонкой. Остаток очищают на колонке с силикагелем (дихлорметан : метанол = 50:1 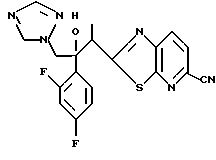 20:1) с получением посредством этого желаемого соединения (311 мг). Физические свойства этого соединения описаны далее.
20:1) с получением посредством этого желаемого соединения (311 мг). Физические свойства этого соединения описаны далее.
Т.пл. 112 - 117oC.
ЯМР: δ растворитель (CDCl3) 1,25 (3H, д, J = 7,0 Гц), 4,13 (1H, кв, J = 7,0 Гц), 4,29 (1H, д, J = 14,4 Гц), 4,94 (1H, д, J = 14,4 Гц), 5,82 (1H, с), 5,60 - 6,25 (2H, ушир.), 6,78 - 6,86 (2H, м), 7,50 - 7,56 (1H, м), 7,67 (1H, с), 7,87 (1H, с), 7,90 (1H, дд, J = 1,6 Гц, 8,4 Гц), 8,08 (1H, дд, J = 1,6 Гц, 8,4 Гц), 8,48 (1H, дд, J = 0,6 Гц, 1,6 Гц).
МС: MH+ = 430.
Пример 111.
Получение соединения, представленного структурной формулой: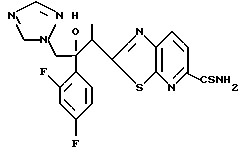
Соединение (507 мг), полученное по примеру 109, и одну каплю триэтиламина растворяют в диметилформамиде (5 мл) и раствор насыщают газообразным сероводородом при комнатной температуре и оставляют на более 6 часов при комнатной температуре. К жидкой реакционной смеси прибавляют водный раствор гидрокарбоната натрия и этилацетат для разделения на слои. Полученный органический слой промывают водой, сушат и концентрируют. Остаток очищают на колонке с силикагелем (растворитель для элюирования: дихлорметан : метанол = 50: 1) с получением целевого соединения (538 мг). Физические свойства этого соединения описаны далее.
Т.пл. 157 - 160oC.
ЯМР: δ растворитель (CDCl3) 1,23 (3H, д, J = 7,2 Гц), 4,13 (1H, кв, J = 7,2 Гц), 4,27 (1H, д, J = 14,0 Гц), 4,94 (1H, д, J = 14,0 Гц), 5,81 (1H, с), 6,78 - 6,85 (2H, м), 7,24 - 7,30 (1H, ушир. c), 7,39 - 7,56 (1H, м), 7,67 (1H, с), 7,66 - 7,72 (1H, ушир. c), 7,86 (1H, с), 7,95 (1H, дд, J = 2,0 Гц, 8,8 Гц), 8,02 (1H, д, J = 8,8 Гц), 8,59 (1H, д, J = 2,0 Гц).
МС: MH+ = 446.
Пример 112.
Получение соединения (смесь 1: 1 диастереомеров), представленного структурной формулой:
Соединение (2,67 г), полученное по примеру 111, суспендируют в 130 мл ацетона и к суспензии прибавляют 1,12 мл иодметана с нагреванием и кипячением с обратным холодильником полученной смеси при 40oC в течение 8 часов. Растворитель отгоняют с получением промежуточного соединения, представленного структурной формулой:
δ
Это промежуточное соединение (548 мг) растворяют в этаноле (5,8 мл) и к раствору прибавляют аминодиэтилацеталь (174  л) с нагреванием и кипячением с обратным холодильником полученной смеси в течение 5 часов. Затем к смеси прибавляют 6 Н соляную кислоту (5 мл) с последующим нагреванием и кипячением с обратным холодильником в течение 1 часа. К жидкой реакционной смеси прибавляют водный раствор гидрокарбоната натрия и этилацетат для разделения на слои. Полученный органический слой промывают водой, сушат и упаривают досуха. Остаток очищают на колонке с силикагелем (дихлорметан : метанол = 100:1 - 10:1) с получением посредством этого целевого соединения в виде смеси 1:1 диастереомеров.
л) с нагреванием и кипячением с обратным холодильником полученной смеси в течение 5 часов. Затем к смеси прибавляют 6 Н соляную кислоту (5 мл) с последующим нагреванием и кипячением с обратным холодильником в течение 1 часа. К жидкой реакционной смеси прибавляют водный раствор гидрокарбоната натрия и этилацетат для разделения на слои. Полученный органический слой промывают водой, сушат и упаривают досуха. Остаток очищают на колонке с силикагелем (дихлорметан : метанол = 100:1 - 10:1) с получением посредством этого целевого соединения в виде смеси 1:1 диастереомеров.
Состояние: твердый продукт.
ЯМР: δ растворитель (CDCl3) 1,27 (3H, д, J = 7,2 Гц), 1,73 (3H, д, J = 7,2 Гц), 4,10 (1H, кв, J = 7,2 Гц), 4,15 (1H, кв, J = 7,2 Гц), 4,32 (1H, д, J = 14,0 Гц), 4,73 (1H, д, J = 14,0 Гц), 4,94 (1H, д, J = 14,0 Гц), 4,95 (1H, д, J = 14,0 Гц), 5,92 (1H, с), 5,98 (1H, с), 6,44 - 6,50 (1H, м), 6,63 - 6,70 (1H, м), 6,77 - 6,84 (2H, м), 7,12 - 7,17 (1H, м), 7,17 (1H, ушир. с), 7,22 (1H, ушир. с), 7,50 - 7,57 (1H, м), 7,66 (1H, с), 7,69 (1H, с), 7,84 (1H, дд, J = 1,6 Гц, 8,4 Гц), 7,89 (1H, с), 7,91 (1H, д, J = 8,4 Гц), 7,93 (H, дд, J = 1,6 Гц, 8,4 Гц), 8,05 (1H, д, J = 8,4 Гц), 8,06 (1H, с), 8,27 (1H, д, J = 1,6 Гц), 8,46 (1H, д, J = 1,6 Гц).
Пример 113.
Получение соединения, представленного структурной формулой:
Промежуточное соединение (1,17 г) по примеру 112 растворяют в этаноле (12 мл) и к раствору последовательно прибавляют формилгидразин (240 мг), триэтиламин (250 δ л) и одну каплю концентрированной серной кислоты при проведении взаимодействия в течение 40 минут при комнатной температуре и затем в течение 1,5 часа при нагревании и кипячении реакционной смеси с обратным холодильником. После охлаждения реакционной смеси прибавляют этилацетат и воду для проведения экстракции. Полученный органический слой промывают водой, сушат и концентрируют. Остаток очищают на колонке с силикагелем (дихлорметан : метанол = 20:1) с получением целевого соединения (742 мг). Физические свойства этого соединения описаны далее.
Т.пл. 138 - 140oC.
ЯМР: 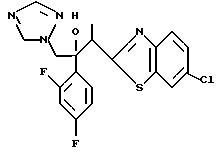 растворитель (CDCl3) 1,27 (3H, д, J = 7,2 Гц), 4,13 (1H, кв, J = 7,2 Гц), 4,33 (1H, д, J = 14,2 Гц), 4,95 (1H, д, J = 14,2 Гц), 5,96 (1H, с), 6,78 - 6,86 (2H, м), 7,51 - 7,57 (1H, м), 7,67 (1H, с), 7,91 (1H, с), 8,10 (1H, д, J = 8,4 Гц), 8,25 (1H, д, J = 8,4 Гц), 8,32 (1H, с), 8,69 (1H, с).
растворитель (CDCl3) 1,27 (3H, д, J = 7,2 Гц), 4,13 (1H, кв, J = 7,2 Гц), 4,33 (1H, д, J = 14,2 Гц), 4,95 (1H, д, J = 14,2 Гц), 5,96 (1H, с), 6,78 - 6,86 (2H, м), 7,51 - 7,57 (1H, м), 7,67 (1H, с), 7,91 (1H, с), 8,10 (1H, д, J = 8,4 Гц), 8,25 (1H, д, J = 8,4 Гц), 8,32 (1H, с), 8,69 (1H, с).
МС: MH+ = 472.
Пример 114.
Получение соединения, представленного структурной формулой:
δ
Соединение (264 мг), полученное по примеру 111, диметилацеталь бромацетоальдегида (390  л) и одну каплю концентрированной серной кислоты нагревают и кипятят с обратным холодильником в течение 1 часа в этаноле. Затем добавляют диметилацеталь бромацетоальдегида (390 δ л) с нагреванием и кипячением с обратным холодильником в течение 1 часа, к жидкой реакционной смеси прибавляют этилацетат и воду для разделения смеси на слои. Полученный органический слой промывают водой и сушат и растворитель отгоняют. К остатку прибавляют гексан и полученный осадок собирают фильтрацией с получением целевого соединения (180 мг). Физические свойства этого соединения описаны далее.
л) и одну каплю концентрированной серной кислоты нагревают и кипятят с обратным холодильником в течение 1 часа в этаноле. Затем добавляют диметилацеталь бромацетоальдегида (390 δ л) с нагреванием и кипячением с обратным холодильником в течение 1 часа, к жидкой реакционной смеси прибавляют этилацетат и воду для разделения смеси на слои. Полученный органический слой промывают водой и сушат и растворитель отгоняют. К остатку прибавляют гексан и полученный осадок собирают фильтрацией с получением целевого соединения (180 мг). Физические свойства этого соединения описаны далее.
Т.пл. 153 - 158oC.
ЯМР: 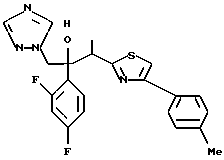 растворитель (CDCl3) 1,28 (3H, д, J = 7,2 Гц), 4,12 (1H, кв, J = 7,2 Гц), 4,31 (1H, д, J = 14,2 Гц), 4,96 (1H, д, J = 14,2 Гц), 5,89 (1H, с), 6,78 - 6,25 (2H, м), 7,40 (1H, д, J = 3,4 Гц), 7,66 (1H, с), 7,89 (1H, с), 7,92 (1H, д, J = 3,4 Гц), 8,09 (1H, д, J = 0,4 Гц), 8,10 (1H, д, J = 1,6 Гц), 8,75 (1H, дд, J = 0,4 Гц, 1,6 Гц).
растворитель (CDCl3) 1,28 (3H, д, J = 7,2 Гц), 4,12 (1H, кв, J = 7,2 Гц), 4,31 (1H, д, J = 14,2 Гц), 4,96 (1H, д, J = 14,2 Гц), 5,89 (1H, с), 6,78 - 6,25 (2H, м), 7,40 (1H, д, J = 3,4 Гц), 7,66 (1H, с), 7,89 (1H, с), 7,92 (1H, д, J = 3,4 Гц), 8,09 (1H, д, J = 0,4 Гц), 8,10 (1H, д, J = 1,6 Гц), 8,75 (1H, дд, J = 0,4 Гц, 1,6 Гц).
МС: MH+ = 470.
Пример 115.
Получение соединения, представленного структурной формулой A:
δ
и структурной формулой B: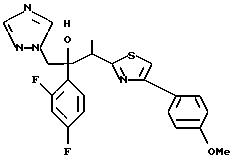
Соединение (453 мг), полученное по примеру 113, растворяют в ацетоне (4,5 мл) и к раствору прибавляют порошок карбоната калия (138 мг) и иодметан (62 δ л). Полученную смесь перемешивают всю ночь при комнатной температуре. Смесь подвергают экстракции этилацетатом-водой. Полученный органический слой промывают водой и сушат, растворитель отгоняют. Остаток очищают на колонке с силикагелем (дихлорметан : метанол = 50:1 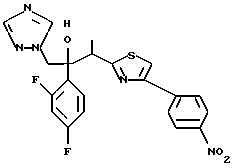 30: 1) и затем выделяют и очищают на колонке с ODS (метанол : вода = 60:40 δ 65: 35) с получением соединения структурной формулы A (192 мг) и соединения структурной формулы B (52 мг). Физические свойства этих соединений описаны далее.
30: 1) и затем выделяют и очищают на колонке с ODS (метанол : вода = 60:40 δ 65: 35) с получением соединения структурной формулы A (192 мг) и соединения структурной формулы B (52 мг). Физические свойства этих соединений описаны далее.
A
Т.пл. 180 - 190oC.
ЯМР: 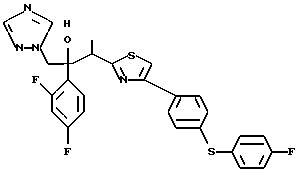 растворитель (CDCl3) 1,27 (3H, д, J = 7,0 Гц), 4,01 (3H, с), 4,11 (1H, кв, J = 7,0 Гц), 4,32 (1H, д, J = 14,0 Гц), 4,94 (1H, д, J = 14,0 Гц), 5,99 (1H, с), 6,77-6,86 (2H, м), 7,50 - 7,57 (1H, с), 7,65 (1H, с), 7,91 (1H, с), 8,08 (1H, д, J = 8,4 Гц), 8,10 (1H, с), 8,27 (1H, дд, J = 8,4 Гц, 1,6 Гц), 8,67 (1H, д, J = 1,6 Гц).
растворитель (CDCl3) 1,27 (3H, д, J = 7,0 Гц), 4,01 (3H, с), 4,11 (1H, кв, J = 7,0 Гц), 4,32 (1H, д, J = 14,0 Гц), 4,94 (1H, д, J = 14,0 Гц), 5,99 (1H, с), 6,77-6,86 (2H, м), 7,50 - 7,57 (1H, с), 7,65 (1H, с), 7,91 (1H, с), 8,08 (1H, д, J = 8,4 Гц), 8,10 (1H, с), 8,27 (1H, дд, J = 8,4 Гц, 1,6 Гц), 8,67 (1H, д, J = 1,6 Гц).
МС: MH+ = 454.
B
Т.пл. 196 - 197oC.
ЯМР: 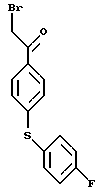 растворитель (CDCl3) 1,29 (3H, д, J = 7,2 Гц), 4,07 (3H, с), 4,15 (1H, кв, J = 7,2 Гц), 4,30 (1H, д, J = 14,2 Гц), 4,97 (1H, д, J = 14,2 Гц), 5,82 (1H, с), 6,79 - 6,86 (2H, м), 7,50 - 7,58 (1H, м), 7,68 (1H, с), 7,82 (1H, дд, J = 1,8 Гц, 8,4 Гц), 7,87 (1H, с), 7,99 (1H, с), 8,16 (1H, д, J = 8,4 Гц), 8,28 (1H, д, J = 1,8 Гц).
растворитель (CDCl3) 1,29 (3H, д, J = 7,2 Гц), 4,07 (3H, с), 4,15 (1H, кв, J = 7,2 Гц), 4,30 (1H, д, J = 14,2 Гц), 4,97 (1H, д, J = 14,2 Гц), 5,82 (1H, с), 6,79 - 6,86 (2H, м), 7,50 - 7,58 (1H, м), 7,68 (1H, с), 7,82 (1H, дд, J = 1,8 Гц, 8,4 Гц), 7,87 (1H, с), 7,99 (1H, с), 8,16 (1H, д, J = 8,4 Гц), 8,28 (1H, д, J = 1,8 Гц).
Пример 116.
Получение соединения, представленного структурной формулой:
δ
Целевое соединение (120 мг) получают тем же способом, что описан в примере 106, за исключением того, что вместо 2-бром-6-хлорбензотиазола используют 2-этил-6-(1,2,3-триазол-2-ил)бензотиазол (529 мг), который является сырым продуктом 5, полученным по препаративному примеру 7. Физические свойства этого соединения описаны далее.
Состояние: маслянистый продукт.
ЯМР: 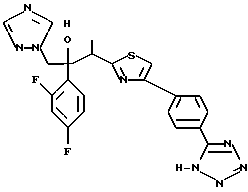 растворитель (CDCl3) 1,29 (3H, д, J = 7,1 Гц), 4,12 (1H, кв, J = 7,1 Гц), 4,32 (1H, д, J = 14,2 Гц), 4,97 (1H, д, J = 14,2 Гц), 5,87 (1H, ушир. с), 6,79 - 6,83 (2H, м), 7,50 - 7,58 (1H, м), 7,67 (1H, с), 7,87 (2H, с), 7,89 (1H, с), 8,12 (1H, д, J = 9,0 Гц), 8,30 (1H, дд, J = 8,8, 2,2 Гц), 8,65 (1H, д, J = 2,2 Гц).
растворитель (CDCl3) 1,29 (3H, д, J = 7,1 Гц), 4,12 (1H, кв, J = 7,1 Гц), 4,32 (1H, д, J = 14,2 Гц), 4,97 (1H, д, J = 14,2 Гц), 5,87 (1H, ушир. с), 6,79 - 6,83 (2H, м), 7,50 - 7,58 (1H, м), 7,67 (1H, с), 7,87 (2H, с), 7,89 (1H, с), 8,12 (1H, д, J = 9,0 Гц), 8,30 (1H, дд, J = 8,8, 2,2 Гц), 8,65 (1H, д, J = 2,2 Гц).
Пример 117.
Получение соединения (смесь 1: 1 диастереомеров), представленного структурной формулой:
δ
2-Этил-6-метоксикарбонилбензотиазол получают в соответствии с тем же способом, что описан в препаративном примере 7. Это соединение растворяют в 1 мл диэтилового эфира и к раствору при 0oC прибавляют метилмагнийиодид (2,0 М раствор в диэтиловом эфире, 1,2 мл). После перемешивания смеси при комнатной температуре прибавляют насыщенный водный раствор хлорида аммония и подвергают экстракции этилацетатом. Полученный органический слой промывают водой и затем насыщенным раствором соли и растворитель отгоняют при пониженном давлении. Полученный таким образом сырой продукт очищают на колонке с силикагелем с получением (2 метил-2-(2-этилбензотиазол-6-ил)этанол) (138 мг). Целевое соединение (смесь 1:1 диастереомеров) получают в соответствии с тем же способом, что описан в примере 99, за исключением того, что этот продукт в двойном количестве по сравнению с примером 116 вместо 2-этил-6-хлорбензотиазола используют 2-этил-6-хлорбензотиазол и н-бутиллитий. Физические свойства этого соединения описаны далее.
Состояние: твердый продукт.
ЯМР: 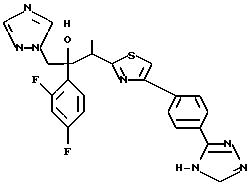 растворитель (CDCl3) 1,25 (1,5H, д, J = 7,2 Гц), 1,60 (3H, с), 1,67 (3H, с), 1,80 (1,5H, д, J = 8,4 Гц), 4,05 - 4,17 (1H, м), 4,27 (0,5H, д, J = 14,4 Гц), 4,71 (0,5H, д, J = 14,0 Гц), 4,90 - 4,95 (1H, м), 6,02 (0,5H, с), 6,13 (0,5H, д, J = 1,6 Гц), 6,44 - 6,51 (0,5H, м), 6,63-6,70 (0,5H, м), 6,63 - 6,70 (0,5H, м), 6,76 - 6,85 (1H, м), 7,10 - 7,17 (0,5H, м), 7,50 - 7,56 (1H, м), 7,61 - 7,65 (0,5H, м), 7,64 (0,5H, с), 7,66 (0,5H, с), 7,84 (0,5H, д, J = 8,8 Гц), 7,89 (0,5H, с), 7,91 (0,5H, д, J = 1,6 Гц), 8,00 (0,5 H, д, J = 8,8 Гц), 8,06 (0,5H, с), 8,10 (0,5H, д, J = 1,6 Гц).
растворитель (CDCl3) 1,25 (1,5H, д, J = 7,2 Гц), 1,60 (3H, с), 1,67 (3H, с), 1,80 (1,5H, д, J = 8,4 Гц), 4,05 - 4,17 (1H, м), 4,27 (0,5H, д, J = 14,4 Гц), 4,71 (0,5H, д, J = 14,0 Гц), 4,90 - 4,95 (1H, м), 6,02 (0,5H, с), 6,13 (0,5H, д, J = 1,6 Гц), 6,44 - 6,51 (0,5H, м), 6,63-6,70 (0,5H, м), 6,63 - 6,70 (0,5H, м), 6,76 - 6,85 (1H, м), 7,10 - 7,17 (0,5H, м), 7,50 - 7,56 (1H, м), 7,61 - 7,65 (0,5H, м), 7,64 (0,5H, с), 7,66 (0,5H, с), 7,84 (0,5H, д, J = 8,8 Гц), 7,89 (0,5H, с), 7,91 (0,5H, д, J = 1,6 Гц), 8,00 (0,5 H, д, J = 8,8 Гц), 8,06 (0,5H, с), 8,10 (0,5H, д, J = 1,6 Гц).
МС: MH+ = 445.
Пример 118.
Получение соединения (смесь 1: 1 диастереомеров), представленного структурной формулой:
Тот же 2-этил-6-метоксикарбонилбензотиазол (699 мг), что используется по примеру 117, растворяют в смеси 1:1 (20 мл) растворителей воды и метанола и к раствору прибавляют 1н водный NaOH (8 мл) с последующим нагреванием и кипячением с обратным холодильником в течение 4,5 часов. К реакционной смеси прибавляют 8 мл 1н HCl и затем обычную соль подвергают экстракции этилацетатом. Затем экстракт промывают насыщенным раствором соли, растворитель отгоняют при пониженном давлении с получением посредством этого 6-карбокси-2-этилбензотиазола (642 мг). Этот продукт (1,957 г) растворяют в ксилоле (50 мл) без очистки и к раствору прибавляют 2-амино-2-метил-1-пропанол (6 мл). Полученную смесь нагревают и кипятят с обратным холодильником в течение 3 дней с использованием насадки Дина-Старка. Растворитель отгоняют из жидкой реакционной смеси при пониженном давлении и полученный остаток очищают хроматографией на колонке с силикагелем с получением промежуточного соединения, представленного структурной формулой:
δ
С использованием промежуточного соединения получают целевое соединение в соответствии с тем же способом, что и по примеру 106. Физические свойств этого соединения описаны далее.
Состояние: твердый продукт.
ЯМР: 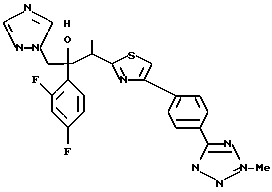 растворитель (CDCl3) 1,27 (1,5H, д, J = 6,8 Гц), 1,38 (3H, с), 1,42 (3H, с), 1,70 (1,5H, д, J = 6,8 Гц), 4,08 - 4,18 (1H, м), 4,12 (1H, с), 4,18 (1H, с), 4,29 (0,5H, д, J = 14,4 Гц), 4,74 (0,5H, д, J = 14 Гц), 4,94 (0,5H, д, J = 14,4 Гц), 4,95 (0,5H, д, J = 14 Гц), 5,90 (0,5H, с), 5,94 (0,5H, д, J = 1,6 Гц), 6,43 - 6,49 (0,5H, м), 6,62 - 6,69 (0,5H, м), 6,77 - 6,85 (1H, м), 7,07 - 7,14 (0,5H, м), 7,49 - 7,57 (0,5H, м), 7,66 (0,5H, с), 7,68 (0,5H, с), 7,89 (0,5H, д, J = 8,4 Гц), 7,89 (0,5H, с), 8,00 (0,5H, дд, J = 1,6, 8,4 Гц), 8,03 (0,5H, д, J = 8,4 Гц), 8,05 (0,5H, с), 8,10 (0,5H, дд, J = 1,6, 8,4 Гц), 8,35 (0,5H, д, J = 1,6 Гц), 8,53 (0,5H, д, J = 1,6 Гц).
растворитель (CDCl3) 1,27 (1,5H, д, J = 6,8 Гц), 1,38 (3H, с), 1,42 (3H, с), 1,70 (1,5H, д, J = 6,8 Гц), 4,08 - 4,18 (1H, м), 4,12 (1H, с), 4,18 (1H, с), 4,29 (0,5H, д, J = 14,4 Гц), 4,74 (0,5H, д, J = 14 Гц), 4,94 (0,5H, д, J = 14,4 Гц), 4,95 (0,5H, д, J = 14 Гц), 5,90 (0,5H, с), 5,94 (0,5H, д, J = 1,6 Гц), 6,43 - 6,49 (0,5H, м), 6,62 - 6,69 (0,5H, м), 6,77 - 6,85 (1H, м), 7,07 - 7,14 (0,5H, м), 7,49 - 7,57 (0,5H, м), 7,66 (0,5H, с), 7,68 (0,5H, с), 7,89 (0,5H, д, J = 8,4 Гц), 7,89 (0,5H, с), 8,00 (0,5H, дд, J = 1,6, 8,4 Гц), 8,03 (0,5H, д, J = 8,4 Гц), 8,05 (0,5H, с), 8,10 (0,5H, дд, J = 1,6, 8,4 Гц), 8,35 (0,5H, д, J = 1,6 Гц), 8,53 (0,5H, д, J = 1,6 Гц).
МС: MH+ = 484.
Пример 119.
Получение соединения (I), представленного структурной формулой:
δ
и другого соединения (II), которое является его диастереомером.
2-Этил-6-метилтиобензотиазол получают в соответствии с тем же способом, что описан в препаративном примере 7, и смесь диастереомеров, которая является целевыми соединениями, получают в соответствии с тем же способом, что описан в примере 106, за исключением того, что используют этот продукт. Смесь подвергают хроматографии на силикагеле с разделением соединения (I) и соединения (II), которое является его диастереомером.
(I)
Состояние: твердый продукт.
ЯМР: 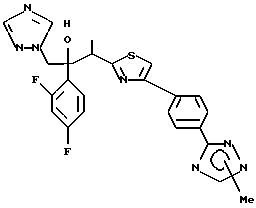 растворитель (CDCl3) 1,24 (3H, д, J = 7,0 Гц), 2,57 (3H, с), 4,06 (1H, кв, J = 7,0 Гц), 4,27 (1H, д, J = 14,2 Гц), 4,92 (1H, д, J = 14,2 Гц), 5,93 (1H, с), 6,76 - 6,84 (2H, м), 7,42 (1H, дд, J = 2,0, 8,4 Гц), 7,47 - 7,55 (1H, м), 7,65 (1H, с), 7,76 (1H, д, J = 2,0 Гц), 7,88 (1H, с), 7,92 (1H, д, J = 8,4 Гц).
растворитель (CDCl3) 1,24 (3H, д, J = 7,0 Гц), 2,57 (3H, с), 4,06 (1H, кв, J = 7,0 Гц), 4,27 (1H, д, J = 14,2 Гц), 4,92 (1H, д, J = 14,2 Гц), 5,93 (1H, с), 6,76 - 6,84 (2H, м), 7,42 (1H, дд, J = 2,0, 8,4 Гц), 7,47 - 7,55 (1H, м), 7,65 (1H, с), 7,76 (1H, д, J = 2,0 Гц), 7,88 (1H, с), 7,92 (1H, д, J = 8,4 Гц).
МС: MH+ = 433.
(II)
Состояние: твердый продукт.
ЯМР: δ растворитель (CDCl3) 1,24 (3H, д, J = 7,0 Гц), 2,57 (3H, с), 4,06 (1H, кв, J = 7,0 Гц), 4,27 (1H, д, J = 14,2 Гц), 4,92 (1H, д, J = 14,2 Гц), 5,93 (1H, с), 6,76 - 6,84 (2H, м), 7,42 (1H, дд, J = 2,0, 8,4 Гц), 7,47 - 7,55 (1H, м), 7,65 (1H, с), 7,76 (1H, д, J = 2,0 Гц), 7,88 (1H, с), 7,92 (1H, д, J = 8,4 Гц).
МС: MH+ = 433.
Пример 120.
Получение соединения (I), представленного структурной формулой:
и другого соединения (II), которое является его диастереомером.
Вышеуказанное соединение (I) и соединение (II), которое является его диастереомером, получают из соединения, полученного по примеру 119 и его диастереомера соответственно согласно тому же способу, что описан в примере 99. Физические свойства этих соединений описаны далее.
(I)
Состояние: твердый продукт.
ЯМР: δ растворитель (CDCl3) 1,29 (3H, д, J = 7,2 Гц), 3,13 (3H, с), 4,18 (1H, кв, J = 7,2 Гц), 4,24 (1H, д, J = 14,12 Гц), 4,98 (1H, д, J = 14,2 Гц), 5,68 (1H, с), 6,79 - 6,86 (2H, м), 7,49 - 7,56 (1H, м), 7,70 (1H, с), 7,84 (1H, с), 8,06 (1H, дд, J = 2,0, 8,8 Гц), 8,19 (1H, д, J = 8,8 Гц), 8,58 (1H, д, J = 2,0 Гц).
МС: MH+ = 465.
(II)
Состояние: твердый продукт.
ЯМР:  растворитель (CDCl3) 1,71 (3H, д, J = 6,8 Гц), 3,08 (3H, с), 4,22 (1H, кв, J = 6,8 Гц), 4,73 (1H, д, J = 14,0 Гц), 4,98 (1H, д, J = 14,0 Гц), 5,72 (1H, с), 6,47 - 6,54 (1H, м), 6,64 - 6,71 (1H, м), 7,12 - 7,19 (1H, м), 7,72 (1H, с), 7,96 (1H, дд, J = 1,7, 8,8 Гц), 8,02 (1H, с), 8,04 (1H, д, J = 8,8 Гц), 8,41 (1H, ушир. д, J = 1,7 Гц).
растворитель (CDCl3) 1,71 (3H, д, J = 6,8 Гц), 3,08 (3H, с), 4,22 (1H, кв, J = 6,8 Гц), 4,73 (1H, д, J = 14,0 Гц), 4,98 (1H, д, J = 14,0 Гц), 5,72 (1H, с), 6,47 - 6,54 (1H, м), 6,64 - 6,71 (1H, м), 7,12 - 7,19 (1H, м), 7,72 (1H, с), 7,96 (1H, дд, J = 1,7, 8,8 Гц), 8,02 (1H, с), 8,04 (1H, д, J = 8,8 Гц), 8,41 (1H, ушир. д, J = 1,7 Гц).
МС: MH+ = 465.
Пример 121.
Получение соединения, представленного структурной формулой:
δ
Целевое соединение получают в соответствии с тем же способом, что описан в примере 106, за исключением того, что вместо 2-этил-6-хлорбензотиазола используют 2-этил-6-(4-фторфенилтио)бензотиазол, полученный по тому же способу, что описан в препаративном примере 6. Физические свойства этого соединения описаны далее.
Состояние: твердый продукт.
ЯМР: 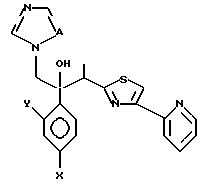 растворитель (CDCl3) 1,24 (3H, д, J = 7,2 Гц), 4,07 (1H, кв, J = 7,2 Гц), 4,26 (1H, д, J = 14,4 Гц), 4,92 (1H, д, J = 14,4 Гц), 5,84 (1H, с), 6,76 - 6,84 (2H, м), 7,06 (2H, ушир. дд, J = 8,6, 8,6 Гц), 7,39 - 7,44 (3H, м), 7,47 -7,55 (1H, м), 7,66 (1H, c), 7,77 (1H, д, J = 1,6 Гц), 7,86 (1H, c), 7,93 (1H, д, J = 8,8 Гц).
растворитель (CDCl3) 1,24 (3H, д, J = 7,2 Гц), 4,07 (1H, кв, J = 7,2 Гц), 4,26 (1H, д, J = 14,4 Гц), 4,92 (1H, д, J = 14,4 Гц), 5,84 (1H, с), 6,76 - 6,84 (2H, м), 7,06 (2H, ушир. дд, J = 8,6, 8,6 Гц), 7,39 - 7,44 (3H, м), 7,47 -7,55 (1H, м), 7,66 (1H, c), 7,77 (1H, д, J = 1,6 Гц), 7,86 (1H, c), 7,93 (1H, д, J = 8,8 Гц).
MC: MH+ = 513.
Пример 122.
Получение соединения (I), представленного структурной формулой: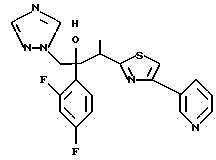 и другого соединения (II), представленного структурной формулой:
и другого соединения (II), представленного структурной формулой: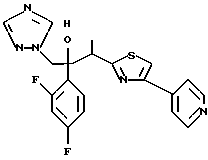
Смесь вышеуказанных соединений получают из соединения, полученного по примеру 121 согласно тому же способу, что описан в примере 99. Смесь подвергают хроматографии на силикагеле с разделением соединений и получением посредством этого индивидуальных соединений. Физические свойства этих соединений описаны далее.
(I)
Состояние: твердый продукт.
ЯМР: δ растворитель (CDCl3) 1,27 (3H, д, J = 7,2 Гц), 4,22 (1H, д, J = 14,4 Гц), 4,63 (1H, кв, J = 7,2 Гц), 5,11 (1H, д, J = 14,4 Гц), 6,56 (1H, ушир. с), 6,76 - 6,87 (2H, м), 7,23 (2H, ушир. дд, J = 8,4, 8,4 Гц), 7,46 - 7,54 (1H, м), 7,68 (1H, с), 7,92 (1H, с), 7,99 - 8,04 (2H, м), 8,12 (1H, дд, J = 1,6, 8,4 Гц), 8,32 (1H, д, J = 8,4 Гц), 8,51 (1H, ушир. д, J = 1,6 Гц).
МС: MH+ = 561.
1,26 (3H, д, J = 7,2 Гц), 4,14 (1H, кв, J = 7,2 Гц), 4,19 (1H, д, J = 14,4 Гц), 4,94 (1H, д, J = 14,4 Гц), 5,64 (1H, с), 6,78 - 6,85 (2H, м), 7,20 (2H, ушир. дд, J = 8,6, 8,6 Гц), 7,47 - 7,54 (1H, м), 7,68 (1H, с), 7,81 (1H, с), 7,98 - 8,03 (1H, м), 8,12 (1H, д, J = 8,8 Гц), 8,58 (1H, д, J = 2,0 Гц).
MC: MH+ = 545.
Пример 123.
Получение соединения, представленного структурной формулой:
δ
Целевое соединение получают в соответствии с тем же способом, что описан в примере 106, за исключением того, что вместо 2-этил-6-хлорбензотиазола используют 2-этил-4-хлорбензотиазол. Физические свойства этого соединения описаны далее.
Состояние: маслянистый продукт.
ЯМР: δ растворитель (CDCl3) 1,26 (3H, д, J = 8,0 Гц), 4,19 (1H, кв, J = 8,0 Гц), 4,34 (1H, д, J = 15,2 Гц), 4,96 (1H, д, J = 15,2 Гц), 5,92 (1H, ушир. с), 6,78 - 6,84 (2H, м), 7,34 - 7,40 (1H, м), 7,50 - 7,58 (2H, м), 7,68 (1H, с), 7,78 - 7,58 (2H, м), 7,68 (1H, с), 7,78 - 7,85 (1H, м), 7,92 (1H, с).
Пример 124.
Получение соединения, представленного структурной формулой: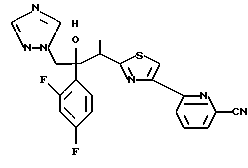
Целевое соединение получают в соответствии с тем же способом, что описан в примере 109, за исключением того, что вместо 2-этил-6-цианобензотиазола используют 2-этил-4-цианобензотиазол. Физические свойства этого соединения описаны далее.
Состояние: маслянистый продукт.
ЯМР: δ растворитель (CDCl3) 1,26 (3H, д, J = 7,1 Гц), 4,15 (1H, кв, J = 7,1 Гц), 4,22 (1H, д, J = 14,2 Гц), 4,98 (1H, д, J = 14,2 Гц), 5,63 (1H, ушир. с), 6,78 - 6,86 (2H, м), 7,48 - 7,56 (1H, м), 7,67 (1H, дд, J = 8,2, 1,5 Гц), 7,70 (1H, с), 7,84 (1H, с), 8,03 (1H, д, J = 8,2 Гц), 8,33 (1H, д, J = 1,5 Гц).
Пример 125.
Получение соединения, представленного структурной формулой: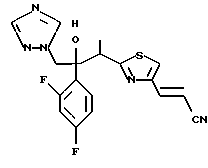
2-Этил-6-хлор-7-азобензтиазол (3,16 г) и тиометоксид натрия (1,67 г) взаимодействуют в течение 1 часа при 90oC в N-метилпирролидоне (9 мл). После охлаждения реакционной смеси к ней прибавляют воду и этилацетат для разделения смеси на слои. Полученный органический слой промывают водой и сушат и растворитель отгоняют. Остаток очищают на колонке с силикагелем (гексан : этилацетат = 10:1) с получением посредством этого промежуточного соединения, 2-этил-6-тиометокси-7-азабензтиазола (2,25 мг). Используя это промежуточное соединение, целевое соединение получают согласно тому же способу, что и по примеру 106. Физические свойства этого соединения описаны далее.
Т.пл. 185 - 186oC.
ЯМР: 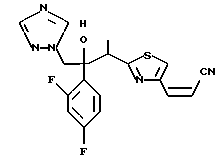 растворитель (CDCl3) 1,25 (3H, д, J = 7,2 Гц), 2,65 (3H, с), 4,03 (1H, кв, J = 7,2 Гц), 4,30 (1H, д, J = 14,2 Гц), 4,94 (1H, д, J = 14,2 Гц), 5,75 (1H, с), 6,77 - 6,85 (2H, м), 7,31 (1H, д, J = 8,4 Гц), 7,48 - 7,55 (1H, м), 7,68 (1H, с), 7,86 (1H, с), 8,02 (1H, д, J = 8,4 Гц).
растворитель (CDCl3) 1,25 (3H, д, J = 7,2 Гц), 2,65 (3H, с), 4,03 (1H, кв, J = 7,2 Гц), 4,30 (1H, д, J = 14,2 Гц), 4,94 (1H, д, J = 14,2 Гц), 5,75 (1H, с), 6,77 - 6,85 (2H, м), 7,31 (1H, д, J = 8,4 Гц), 7,48 - 7,55 (1H, м), 7,68 (1H, с), 7,86 (1H, с), 8,02 (1H, д, J = 8,4 Гц).
Пример 126.
Получение соединения, представленного структурной формулой: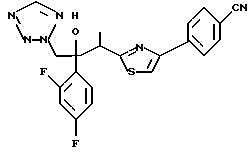
Соединение (400 мг), полученное по примеру 125, растворяют в дихлорметане (4 мл) и к раствору прибавляют мета-хлорпербензойную кислоту (476 мг) с последующим перемешиванием в течение 1,5 часа при комнатной температуре. Реакционную смесь промывают последовательно водным раствором гидрокарбоната натрия, к которому прибавлен дихлорметан, и водой и сушат. Растворитель отгоняют с получением целевого продукта (452 мг). Физические свойства этого соединения описаны далее.
Т.пл. 211 - 214oC.
ЯМР: δ растворитель (CDCl3) 1,30 (3H, д, J = 7,0 Гц), 3,32 (3H, с), 4,14 (1H, кв, J = 7,0 Гц), 4,23 (1H, д, J = 14,4 Гц), 5,01 (1H, д, J = 14,4 Гц), 5,59 (1H, с), 6,80 - 6,86 (2H, м), 7,48 - 7,56 (1H, м), 7,72 (1H, с), 7,82 (1H, с), 8,25 (1H, д, J = 8,4 Гц), 8,47 (1H, д, J = 8,4 Гц).
МС: MH+ = 466
Пример 127.
Получение соединения, представленного структурной формулой: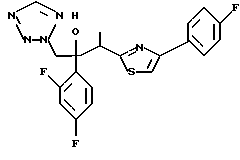
Целевое соединение получают в соответствии с тем же способом, что описан в примере 125, за исключением того, что в качестве промежуточного соединения используют 2-этил-6-хлор-7-азабензотиазол. Физические свойства этого соединения описаны далее.
Т.пл. 177 - 178oC.
ЯМР: δ растворитель (CDCl3) 1,27 (3H, д, J = 7,2 Гц), 4,07 (1H, д, J = 7,2 Гц), 4,27 (1H, д, J = 14,0 Гц), 4,96 (1H, д, J = 14,0 Гц), 5,63 (1H, с), 6,78 - 6,85 (2H, м), 7,47 (1H, д, J = 8,4 Гц), 7,48 - 7,55 (1H, м), 7,70 (1H, с), 7,83 (1H, с), 8,19 (1H, д, J = 8,4 Гц).
Пример 128.
Получение соединения, представленного структурной формулой: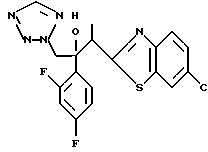
2-Этил-7-азабензотиазол (2,95 г) растворяют в дихлорметане (30 мл) и к раствору при комнатной температуре прибавляют мета-хлорпербензойную кислоту (4,7 г). Через 3,5 часа прибавляют мета-хлорпербензойную кислоту (2,3 г). После завершения реакции реакционную смесь обрабатывают водным раствором сульфита натрия при охлаждении ледяной водой. Полученную таким образом реакционную смесь разбавляют дихлорметаном и полученный органический слой промывают водным раствором гидрокарбоната натрия, водой и насыщенным раствором соли, в этом порядке и сушат. Растворитель отгоняют с получением 2-этил-7-азабензотиазол-7-оксида (2,69 г). Это соединение прибавляют к дихлорметану (27 мл) и последовательно прибавляют диметиламинокарбамоилхлорид (4,16 г), триметилсилил цианид (5,69 мл) и триэтиламин (6,3 мл) для проведения реакции в течение 8 часов при комнатной температуре. Далее прибавляют триметилсилил цианид (2,5 мл) и диметиламинокарбамоилхлорид (2,5 мл). После проведения реакции в течение 2 дней при комнатной температуре к реакционной смеси прибавляют водный гидрокарбонат натрия с последующим перемешиванием в течение 1 часа. Реакционную смесь подвергают экстракции этилацетатом и полученный органический слой промывают водой, сушат и упаривают. После очистки осадка на колонке с силикагелем (элюирование дихлорметаном : метанолом = 200: 1), перекристаллизации из дихлорметана-изопропилового эфира приводит к образованию 2-этил-6-циано-7-азабензтиазола (1,37 г). Целевое соединение получают согласно тому же способу, что и по примеру 106, за исключением того, что вместо 2-этил-6-хлорбензотиазола используют вышеописанное соединение. Физические свойства этого соединения описаны далее.
Т.пл. 170 - 173oC.
ЯМР: μ растворитель (CDCl3) 1,30 (3H, д, J = 7,0 Гц), 4,13 (1H, кв д, J = 7,0 Гц, 0,8 Гц), 4,25 (1H, д, J = 14,0 Гц), 4,98 (1H, д, J = 14,0 Гц), 5,59 (1H, д, J = 0,8 Гц), 5,59 (1H, д, J = 0,8 Гц), 6,79 - 6,86 (2H, м), 7,49 - 7,56 (1H, м), 7,72 (1H, с), 7,81 (1H, с), 7,84 (1H, д, J = 8,4 Гц), 8,35 (1H, д, J = 8,4 Гц).
МС: MH+ = 413
Пример 129.
Получение соединения, представленного структурной формулой:
_→
Целевое соединение получают из соединения, которое получено согласно примеру 128, в соответствии с тем же способом, что описан в примере 111. Физические свойства этого соединения описаны далее.
Состояние: твердый продукт.
ЯМР: δ растворитель (CDCl3) 1,30 (3H, д, J = 7,2 Гц), 4,12 (1H, кв, J = 7,2 Гц), 4,28 (1H, д, J = 14,4 Гц), 5,00 (1H, д, J = 14,4 Гц), 5,65 (1H, с), 6,80 - 6,87 (2H, м), 7,49 - 7,56 (1H, м), 7,70 (1H, с), 7,70 - 7,76 (1H, ушир. с), 7,80 (1H, с), 8,33 (1H, д, J = 8,8 Гц), 8,91 (1H, д, J = 8,8 Гц), 9,32 - 8,38 (1H, ушир. с).
Пример 130.
Получение соединения, представленного структурной формулой:
δ
Целевое соединение получают в соответствии с тем же способом, что описан в примере 127, за исключением того, что вместо 1-(1H-1,2,4-триазол-1-ил)-2', 4'-дифторацетофенона используют 1-(1H-1,2,4-триазол-1-ил)-2'-хлорацетофенон. Физические свойства этого соединения описаны далее.
Состояние: твердый продукт.
ЯМР: 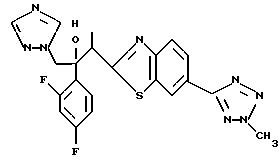 растворитель (CDCl3) 1,22 (3H, д, J = 7,2 Гц), 4,22 (1H, д, J = 14,4 Гц), 4,67 (1H, кв, J = 7,2 Гц), 5,55 (1H, с), 5,60 (1H, д, J = 14,4 Гц), 7,18 - 7,22 (2H, м), 7,34 - 7,38 (1H, м), 7,46 (1H, д, J = 8,8 Гц), 7,68 (1H, с), 7,69 - 7,73 (1H, с), 7,81 (1H, с), 8,20 (1H, д, J = 8,8 Гц).
растворитель (CDCl3) 1,22 (3H, д, J = 7,2 Гц), 4,22 (1H, д, J = 14,4 Гц), 4,67 (1H, кв, J = 7,2 Гц), 5,55 (1H, с), 5,60 (1H, д, J = 14,4 Гц), 7,18 - 7,22 (2H, м), 7,34 - 7,38 (1H, м), 7,46 (1H, д, J = 8,8 Гц), 7,68 (1H, с), 7,69 - 7,73 (1H, с), 7,81 (1H, с), 8,20 (1H, д, J = 8,8 Гц).
Пример 131.
Получение соединения, представленного структурной формулой:
δ
Целевое соединение получают в соответствии с тем же способом, что описан в примере 106, за исключением того, что вместо 2-этил-6-хлорбензотиазола используют 2-метил-6-хлорбензотиазол. Физические свойства этого соединения описаны далее.
Состояние: твердый продукт.
ЯМР 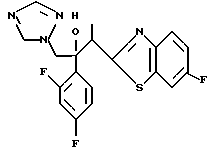 растворитель (CDCl3) 3,43 (1H, д, J = 15,2 Гц), 3,88 (1H, д, J = 15,2 Гц), 4,65 (1H, д, J = 14,2 Гц), 4,70 (1H, д, J= 14,2 Гц), 6,03 (1H, с), 6,69 - 6,74 (1H, м), 6,76 - 6,81 (1H, м), 7,40 (1H, дд, J = 8,8 Гц, 2,0 Гц), 7,42 - 7,50 (1H, м), 7,75 (1H, дд, J = 2,0 Гц), 7,82 (1H, д, J = 8,8 Гц), 7,85 (1H, с), 8,18 (1H, с).
растворитель (CDCl3) 3,43 (1H, д, J = 15,2 Гц), 3,88 (1H, д, J = 15,2 Гц), 4,65 (1H, д, J = 14,2 Гц), 4,70 (1H, д, J= 14,2 Гц), 6,03 (1H, с), 6,69 - 6,74 (1H, м), 6,76 - 6,81 (1H, м), 7,40 (1H, дд, J = 8,8 Гц, 2,0 Гц), 7,42 - 7,50 (1H, м), 7,75 (1H, дд, J = 2,0 Гц), 7,82 (1H, д, J = 8,8 Гц), 7,85 (1H, с), 8,18 (1H, с).
Пример 132.
Получение соединения, представленного структурной формулой:
δ
Целевое соединение получают в соответствии с тем же способом, что описан в примере 131, за исключением того, что вместо 2-метил-6-хлорбензотиазола используют 2-метил-6-цианобензотиазол. Физические свойства этого соединения описаны далее.
Т.пл. 176 - 178oC.
ЯМР: 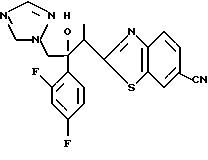 растворитель (CDCl3) 3,52 (1H, д, J = 15,4 Гц), 3,95 (1H, д, J = 15,4 Гц), 4,69 (2H, с), 5,87 (1H, с), 6,71 - 6,82 (1H, м), 7,51 - 7,45 (1H, м), 7,69 (1H, дд, J = 1,6 Гц, 8,6 Гц), 7,86 (1H, с), 7,99 (1H, дд, J = 0,4 Гц, 8,6 Гц), 8,13 (1H, дд, J = 0,4 Гц, 1,6 Гц), 8,15 (1H, с).
растворитель (CDCl3) 3,52 (1H, д, J = 15,4 Гц), 3,95 (1H, д, J = 15,4 Гц), 4,69 (2H, с), 5,87 (1H, с), 6,71 - 6,82 (1H, м), 7,51 - 7,45 (1H, м), 7,69 (1H, дд, J = 1,6 Гц, 8,6 Гц), 7,86 (1H, с), 7,99 (1H, дд, J = 0,4 Гц, 8,6 Гц), 8,13 (1H, дд, J = 0,4 Гц, 1,6 Гц), 8,15 (1H, с).
Пример 133.
Получение соединения, представленного структурной формулой:
δ
Целевое соединение получают в соответствии с тем же способом, что описан в примере 127, за исключением того, что вместо 2-этил-6-хлор-7-азабензотиазола используют 2-метил-6-хлор-7-азабензотиазол. Физические свойства этого соединения описаны далее.
Т.пл. 145 - 147oC.
ЯМР: δ растворитель (CDCl3) 3,47 (1H, д, J = 15,2 Гц), 3,90 (1H, д, J = 15,2 Гц), 4,69 (2H, с), 5,76 (1H, с), 6,70 - 6,83 (2H, м), 7,39 (1H, д, J = 8,4 Гц), 7,42 - 7,49 (1H, м), 7,86 (1H, с), 8,08 (1H, д, J = 8,4 Гц), 8,13 (1H, с).
Пример 134.
Получение соединения, представленного структурной формулой: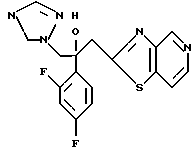
Гидрохлорид 3-нитро-4-хлорпиридина (2038 мг) растворяют в этаноле (42 мл) и к раствору прибавляют гидросульфид натрия (2148 мг) с последующим перемешиванием в течение 40 минут при комнатной температуре. К этой реакционной смеси прибавляют водный раствор гидросульфида натрия (6,67 г) и полученную смесь нагревают и перемешивают при 80oC в течение 12 часов. После отделения нерастворившегося материала фильтрацией раствор концентрируют. Концентрат растворяют в метаноле-воде и раствор смешивают с силикагелем и сушат при пониженном давлении. Далее проводят элюирование с 5:1 хлороформ : метанолом и затем с 1:1 хлороформ : метанолом с получением посредством этого 3-амино-4-меркаптопиридина (892 мг). К этому продукту прибавляют 7 мл этилацетата и молекулярное сито 4A и полученную смесь нагревают и кипятят с обратным холодильником в течение 20 минут в атмосфере азота. Реакционную смесь сушат при пониженном давлении и растворяют в метаноле. Раствор подвергают адсорбции при силикагеле. Этот раствор элюируют 50:1 хлороформ-метанолом с получением посредством этого 590 мг 2-метил-5-азабензотиазола. Целевое соединение получают в соответствии с тем же способом, что описан в примере 131, за исключением того, что вместо 2-метил-6-хлорбензотиазола используют вышеописанный 2-метил-5-азабензотиазол. Физические свойства этого соединения описаны далее.
Т.пл. 137 - 148oC.
ЯМР: δ растворитель (CD3OD) 3,69 (1H, д, J = 14,8 Гц), 4,08 (1H, д, J = 14,8 Гц), 4,77 (1H, д, J = 14,4 Гц), 4,87 (1H, д, J = 14,4 Гц), 6,71 - 6,84 (1H, м), 6,92 - 7,04 (1H, м), 7,32 - 7,46 (1H, м), 7,83 (1H, с), 7,97 (1H, д, J = 5,2 Гц), 8,37 (1H, д, J = 5,8 Гц), 8,37 (1H, с), 9,06 (1H, с).
Пример 135.
Получение соединения, представленного структурной формулой:
Азид натрия (2301 мг) растворяют в диметилсульфоксиде (60 мл) и к этому раствору прибавляют 2-бром-4'-тиометилацетофенон (3000 мг) с последующим перемешиванием в течение 20 минут при комнатной температуре. Реакционную смесь выливают в 200 мл ледяной воды и затем подвергают экстракции этилацетатом (200 мл х 5). Экстракт сушат над безводным сульфатом магния, концентрируют при пониженном давлении и затем очищают на хроматографической колонке с силикагелем (гексан _→ гексан-этилацетат = 8:1) с получением посредством этого 2-азид-4'-тиометилацетофенона (2155 мг). После охлаждения до -78oC раствора диизопропиламина лития в 47 мл тетрагидрофурана, полученного из диизопропиламина (1,75 мл) и 1,6 М гексанового раствора (7,8 мл) бутиллития, прибавляют по каплям тетрагидрофурановый раствор (19 мл) 2-азид-4'-тиометилацетофенона (2155 мг) в течение более 5 минут с последующим перемешиванием при -78oC в течение 1 часа. Затем прибавляют по каплям пропионилхлорид (1,81 мл) и полученную смесь оставляют стоять при -78oC в течение 10 минут, нагревают до комнатной температуры и перемешивают в течение 10 минут при комнатной температуре. Реакционную смесь выливают в ледяную воду и подвергают экстракции эфиром (300 мл х 3). Экстракт сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Полученное маслянистое вещество очищают хроматографией на колонке с силикагелем (гексан _→ гексан : этилацетат = 10:1) с получением посредством этого 2-азид-1-(4'-тиометилфенил)винилпропионата (1,98 г). Этот продукт растворяют в циклогексане (38 мл) и к раствору прибавляют эфир фосфорной кислоты. Полученную смесь перемешивают в течение 1 часа при комнатной температуре в атмосфере азота и затем 20 часов при 90oC при нагревании. Реакционную смесь очищают хроматографией на колонке с силикагелем (гексан _→ гексан : этилацетат = 30: 1) с получением посредством этого 2-этил-5-(4-тиометилфенил)оксазола (630 мг). Используя это соединение вместо 2-этил-6-хлорбензотиазола, получают целевое соединение в соответствии с тем же способом, что описан в примере 106. Физические свойства этого соединения описаны далее.
Состояние: маслянистый продукт.
ЯМР: δ растворитель (CDCl3) 1,55 (3H, д, J = 8,0 Гц), 2,50 (3H, с), 3,88 (1H, кв, J = 8,0 Гц), 4,69 (1H, д, J = 13,3 Гц), 4,98 (1H, д, J = 13,3 Гц), 5,56 (1H, ушир. с), 6,60 - 6,72 (2H, м), 7,20 - 7,26 (2H, м), 7,22 - 7,34 (1H, м), 7,27 (2H, с), 7,33 - 7,38 (2H, м), 7,70 (1H, с), 8,30 (1H, с).
Пример 136.
Получение соединения, представленного структурной формулой: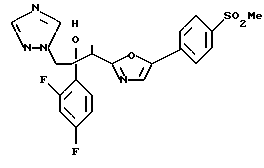
Продукт (77 мг) примера 135 растворяют в дихлорметане (6,0 мл) и при охлаждении ледяной водой к раствору прибавляют мета-хлорпербензойную кислоту (156 мг). После нагревания смеси до комнатной температуры ее перемешивают в течение 1 часа. К реакционной смеси прибавляют насыщенный водный раствор тиосульфата натрия и насыщенный водный раствор гидрокарбоната натрия. К полученной смеси прибавляют дихлорметан (10 мл) для разделения смеси на слои. Полученный водный слой подвергают далее экстракции дихлорметаном (10 мл х 2). Органические слои объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Полученное таким образом маслянистое вещество очищают хроматографией на колонке с силикагелем (гексан-этилацетат = 4:1 _→ дихлорметан-метанол = 10:1) с получением посредством этого целевого соединения. Физические свойства этого соединения описаны далее.
Состояние: маслянистый продукт.
ЯМР: δ растворитель (CDCl3) 1,60 (3H, д, J = 7,2 Гц), 3,07 (3H, с), 3,91 (1H, кв, J = 7,1 Гц), 4,71 (1H, д, J = 14,1 Гц), 5,00 (1H, д, J = 14,1 Гц), 5,40 - 5,50 (1H, ушир. с), 6,62 - 6,72 (2H, м), 7,26 - 7,33 (1H, м), 7,31 (1H, с), 7,60 - 7,64 (2H, м), 7,73 (1H, с), 7,92 - 7,97 (2H, м), 8,05 (1H, с).
MC: m/e FAB 475 (MH+).
Пример 137.
Получение соединения, представленного структурной формулой: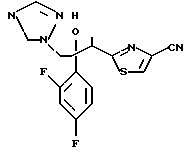
и его диастереомера;
Раствор 2-этил-4-циано-5-триметилсилилтиазол (1,58 г) в 10 мл тетрагидрофурана прибавляют по каплям к 20 мл тетрагидрофуранового раствора диизопропиламина лития (полученного из 1,40 мл диизопропиламина и 3,2 мл бутиллития (1,6 М гексановый раствор) при -65oC. Затем прибавляют по каплям 10 мл тетрагидрофуранового раствора (1H-1,2,4-триазол-1-ил)-2,4-дифторфенилацетофенона при -65oC. После перемешивания смеси в течение 1,5 часов прибавляют водный раствор хлорида аммония и полученную смесь разделяют с помощью этилацетата и воды на жидкости. Полученный органический слой промывают водой и сушат и растворитель отгоняют. Остаток растворяют в 20 мл тетрагидрофурана и к раствору прибавляют 20 мл тетрагидрофуранового раствора (1,0 М) тетрабутиламмонийфторида с последующим перемешиванием при комнатной температуре в течение 1 часа. После того, как реакционную смесь разделяют этилацетатом и водой на слои, полученный органический слой промывают водой, сушат и концентрируют досуха. Остаток очищают хроматографией на колонке с силикагелем (дихлорметан : метанол = 200:1) с получением посредством этого одного диастереомерного соединения (I) (464 мг). Фракцию, содержащую другой диастереомер и (1H-1,2,4-триазол-1-ил)-2,4-дифторацетофенона, обрабатывают боргидридом натрия в метаноле и подвергают разделению на колонке с силикагелем с получением посредством этого 564 мг другого диастереомерного соединения (II). Физические свойства этого соединения описаны далее.
(I)
Т.пл. 198 - 205oC.
ЯМР: δ растворитель (CDCl3) 1,20 (3H, д, J = 7,1 Гц), 4,06 (1H, кв, J = 14,4 Гц), 4,08 (1H, кв, J = 7,1 Гц), 4,96 (1H, д, J = 14,4 Гц), 5,41 (1H, с), 6,77 - 6,83 (2H, м), 7,42 - 7,49 (1H, м), 7,75 (1H, с), 7,80 (1H, с), 8,05 (1H, с).
МС: MH+ = 362
(II)
Т.пл. 191 - 194oC.
ЯМР: δ растворитель (CDCl3) 1,61 (3H, д, J = 7,1 Гц), 4,08 (1H, кв, J = 7,1 Гц), 4,66 (1H, д, J = 14,0 Гц), 4,98 (1H, д, J = 14,0 Гц), 5,37 (1H, с), 6,58 - 6,70 (2H, м), 7,12 - 7,18 (1H, м), 7,75 (1H, с), 7,79 (1H, с), 7,97 (1H, с).
MC: MH+ = 362
Пример 138.
Получение соединения, представленного структурной формулой: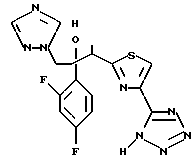
В 2 мл N-метилпирролидона растворяют 150 мг соединения, полученного по примеру 137, и к раствору добавляют 54 мг NaN3 и 115 мг Et3N • HCl с последующим нагреванием в течение 5 часов при внешней температуре 100oC на масляной бане. К жидкой реакционной смеси добавляют воду и подвергают 3 раза экстракции AcOEt. После экстракции промывают водой и затем насыщенным водным раствором NaCl и сушат над сульфатом магния. AcOEt отгоняют. К остатку прибавляют 2 мл ацетона, 4 мл EtOH и 10 мл воды. Полученную смесь доводят до pH 3 с помощью 1н водного раствора HCl и оставляют стоять. В результате образуется твердый продукт. Твердый продукт отделяют фильтрацией с получением 82 мг целевого соединения. Физические свойства этого соединения описаны далее.
Состояние: твердый продукт.
ЯМР: δ растворитель (DMSO - d6) 1,13 (3H, д, J = 7,0 Гц), 4,11 - 4,14 (1H, м), 4,34 (1H, д, J = 14,2 Гц), 4,80 (1H, д, J = 14,2 Гц), 6,16 (1H, с), 6,93 - 6,98 (1H, м), 7,18 - 7,24 (1H, м), 7,28 - 7,33 (1H, м), 7,61 (1H, с), 8,22 (1H, с), 8,45 (1H, ушир. с).
MC: MH+ = 405.
Пример 139.
Получение соединения, представленного структурной формулой:
В 1 мл диметилформамида растворяют 80 мг соединения, полученного по примеру 138, и к раствору прибавляют 65 мг Cs2CO3 с последующим нагреванием в течение 30 минут при внешней температуре в 60oC на масляной бане. Далее к реакционной смеси добавляют 0,02 мл CH3I с последующим перемешиванием в течение 30 минут при комнатной температуре. К жидкой реакционной смеси прибавляют воду и подвергают экстракции AcOEt. После промывки экстракта водой и затем насыщенным водным раствором NaCl и сушки над сульфатом магния отгоняют AcOEt. Полученный остаток очищают хроматографией на колонке с силикагелем (SiO2: 20 г, элюирование CH2Cl2 и затем 1% раствором MeOH в CH2Cl2, и затем 2% раствором MeOH в CH2Cl2) с получением 58 мг целевого соединения. Физические свойства этого соединения описаны далее.
Состояние: твердый продукт.
ЯМР: δ растворитель (CDCl3) 1,22 (0,9H, д, J = 7,1 Гц), 1,25 (2,1H, д, J = 7,1 Гц), 4,08 - 4,21 (2H, м), 4,45 (0,9H, с), 4,49 (2,1H, с), 4,95 (0,7H, д, J = 14,2 Гц), 5,00 (0,3H, д, J = 14,8 Гц), 5,40 (0,7H, c), 5,53 (0,3H, с), 6,76 - 6,84 (2H, м), 7,45 - 7,52 (1H, м), 7,72 (0,3H, с), 7,75 (0,7H, с), 7,78 (0,7H, с), 7,81 (0,3H, с), 8,14 (0,3H, с), 8,35 (0,7H, с).
MC: MH+ = 419
Пример 140.
Получение соединения (I), представленного структурной формулой: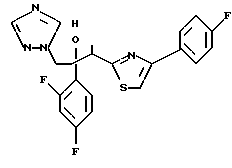
и его диастереомерного соединения (II):
Соответствующие целевые соединения получают в соответствии с тем же способом, что описан в примере 137, за исключением того, что вместо 2-этил-4-циано-5-триметилсилилтиазола используют 2-этил-4-(4'-фторфенил)-5-триметилсилилтиазол. Физические свойства этого соединения описаны далее.
(I)
Т.пл. 122 - 124oC.
ЯМР: δ растворитель (CDCl3) 1,67 (3H, д, J = 7,0 Гц), 4,08 (1H, кв, J = 7,0 Гц), 4,73 (1H, д, J = 13,8 Гц), 4,93 (1H, д, J = 13,8 Гц), 6,14 (1H, д, J = 1,7 Гц), 6,48 - 6,54 (1H, м), 6,66 - 6,73 (1H, м), 7,06 - 7,12 (3H, м), 7,67 (1H, с), 7,71 - 7,24 (2H, м), 8,05 (1H, с).
(II)
Т.пл. 87 - 89oC.
ЯМР: δ растворитель (CDCl3) 1,23 (3H, д, J = 7,1 Гц), 4,06 (1H, кв, J = 7,1 Гц), 4,28 (1H, д, J = 14,4 Гц), 4,89 (1H, д, J = 14,4 Гц), 6,04 (1H, с), 6,77 - 6,85 (2H, м), 7,13 - 7,17 (1H, м), 7,41 (1H, с), 7,47 - 7,55 (1H, м), 7,67 (1H, с), 7,85 - 7,92 (2H, м), 7,90 (1H, с).
Пример 141.
Получение соединения (I), представленного структурной формулой: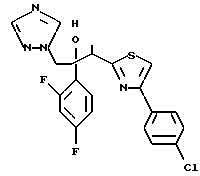
и его диастереомерного соединения (II).
Соответствующие целевые соединения получают в соответствии с тем же способом, что описан в примере 137, за исключением того, что вместо 2-этил-4-циано-5-триметилсилилтиазола используют 2-этил-4-(4'-хлорфенил)-5-триметилсилилтиазол. Физические свойства этого соединения описаны далее.
(I)
Т.пл.: 132 - 133oC.
ЯМР: δ растворитель (CDCl3) 1,67 (3H, д, J = 7,0 Гц), 4,10 (1H, кв, J = 7,0 Гц), 4,73 (1H, д, J = 13,9 Гц), 4,93 (1H, д, J = 13,9 Гц), 6,09 (1H, с), 6,46 - 6,55 (2H, м), 7,65 - 6,73 (1H, м) 7,05 - 7,13 (1H, м), 7,17 (1H, с), 7,35 - 7,40 (2H, м), 7,65 - 7,70 (2H, м), 8,04 (1H, с).
(II)
Т.пл.: 162 - 164oC.
ЯМР: δ растворитель (CDCl3) 1,23 (3H, д, J = 7,1 Гц), 4,06 (1H, кв, J = 7,1 Гц), 4,27 (1H, д, J = 14,4 Гц), 4,89 (1H, д, J = 14,4 Гц), 5,97 (1H, с), 6,76 - 6,85 (2H, м), 7,40 - 7,55 (4H, м), 7,67 (1H, с), 7,72 - 7,77 (2H, м), 7,89 (1H, с).
Пример 142.
Получение соединения, представленного структурной формулой: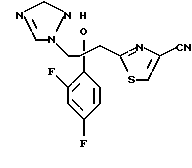
Целевое соединение получают в соответствии с тем же способом, что описан в примере 137, за исключением того, что вместо 2-этил-4-циано-5-триметилсилилтиазола используют 2-метил-4-циано-5-триметилсилилтиазол. Физические свойства этого соединения описаны далее.
Состояние: твердый продукт.
ЯМР: δ растворитель (CDCl3) 3,44 (1H, д, J = 15,0 Гц), 3,81 (1H, д, J = 15,0 Гц), 4,58 (1H, д, J = 14,2 Гц), 4,74 (1H, д, J = 14,2 Гц), 5,48 (1H, с), 6,74 - 6,82 (2H, м), 7,40 - 7,46 (1H, м), 7,85 (1H, с), 7,87 (1H, с), 8,07 (1H, с).
MC: MH+ = 348.
Пример 143.
Получение соединения, представленного структурной формулой: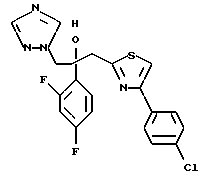
Целевое соединение получают в соответствии с тем же способом, что описан в примере 137, за исключением того, что вместо 2-этил-3-циано-5-триметилсилилтиазола используют 2-метил-4-(4'-хлорфенил)-5-триметилсилилтиазол. Физические свойства этого соединения описаны далее.
Состояние: твердый продукт.
ЯМР: δ растворитель (CDCl3) 3,34 (1H, д, J = 15,3 Гц), 3,85 (1H, д, J = 15,3 Гц), 4,62 (1H, д, J = 14,2 Гц), 4,71 (1H, д, J = 14,2 Гц), 6,21 (1H, с), 6,69 - 6,83 (2H, м), 7,27 (1H, с), 7,36 - 7,46 (3H, м), 7,68 - 7,73 (2H, м), 7,85 (1H, с), 8,20 (1H, с).
Пример 144.
Получение соединения, представленного структурной формулой: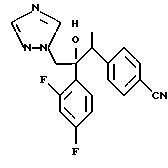
К суспензии AlCl3 (5,88 г) в CH2Cl2 (50 мл) прибавляют дифторбензол (5,77 г) и затем к полученной смеси прибавляют по каплям раствор 2-(4-цианофенил)ацетилхлорид (5,28 г) в CH2Cl2 (30 мл). Затем смесь нагревают и кипятят с обратным холодильником в течение 6 часов, добавляют ледяную воду. Продукт экстрагируют CHCl3 и подвергают колоночной хроматографии (SiO2) с проведением элюирования CH2Cl2-гексаном (1:1) с получением посредством этого 4-(2-(2,4-дифторфенил)-2-оксо)-этилбензонитрила (2,45 г).
К раствору этого соединения в EtOH (12 мл) прибавляют 50% NaOH (0,67 г) и затем по каплям прибавляют MeI (0,46 мл). Полученную смесь перемешивают в течение 4 часов при комнатной температуре. Затем к смеси прибавляют этилацетат и промывают водой, остаток, полученный упариванием органического слоя, очищают хроматографией на колонке (SiO2; гексан-CH2Cl2 = 3:1 _→ 1:1) с получением посредством этого 0,5 г соединения, 4-(2-(2,4-дифторфенил)-1-метил-2-оксо)этилбензонитрила.
1,0 М эфирного раствора (3,9 мл) TMSCH2MgCl охлаждают до -78oC и прибавляют по каплям эфирный раствор (5 мл) вышеописанного соединения (0,5 г). После этого смесь нагревают до 0oC и перемешивают в течение 10 минут. К смеси прибавляют насыщенный водный раствор хлорида аммония с последующей экстракцией AcOEt. Полученный органический слой упаривают досуха и добавляют CH2Cl2 (10 мл) и BF3-OEt2 (0,24 мл) при 0oC с последующим перемешиванием в течение 1,5 часов при той же температуре. Затем к смеси прибавляют AcOEt и промывают водным раствором гидрокарбоната натрия и затем насыщенным раствором соли, растворитель отгоняют. Полученный осадок очищают хроматографией на колонке (SiO2; гексан-CH2Cl2 = 3:1 _→ 1:1) с получением посредством этого соединения, 4-(2-(2,4-дифторфенил)-1-метил-2-пропенилбензонитрила (0,2 г).
К раствору этого соединения (200 мг) в хлороформе (4 мл) прибавляют мета-хлорпербензойную кислоту (490 мг) при охлаждении ледяной водой и полученную смесь оставляют стоять всю ночь. После промывания жидкой реакционной смеси разбавленным карбонатом натрия и затем водой к остатку, полученному упариванием полученного органического слоя, прибавляют 5 мл диметилформамида. Полученную таким образом смесь прибавляют к раствору натрий 1,2,4-триазола в диметилформамиде (3 мл), который получают из 1,2,4-триазола (272 мг) и 60% NaH (141 мг). После проведения реакции в течение 2 часов при 90oC к реакционной смеси прибавляют этилацетат с последующим промыванием водой. Растворитель отгоняют и полученный остаток подвергают хроматографии на колонке (SiO2; гексан-CH2Cl2 = 1:1 _→ 1:2) с получением посредством этого 50 мг целевого соединения. Физические свойства этого соединения описаны далее.
Т.пл. 208 - 209oC.
ЯМР: δ растворитель (CDCl3) 1,13 (3H, т, J = 7,1 Гц), 3,38 (1H, кв, J = 7,1 Гц), 3,79 (1H, д, J = 14,5 Гц), 4,79 (1H, д, J = 14,5 Гц), 4,98 (1H, д, J = 1,5 Гц), 6,74 - 7,81 (2H, м), 7,44 - 7,51 (1H, м), 7,64 (2H, д, J = 8,4 Гц), 7,67 (2H, д, J = 8,4 Гц), 7,72 (1H, с), 7,75 (1H, с).
Пример 145.
Получение соединения, представленного структурной формулой A: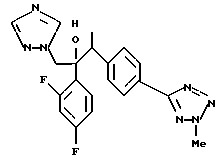
и соединения, представленного структурной формулой B: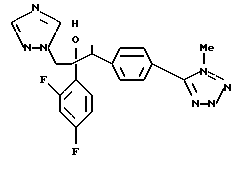
i) Соединение (625 мг), полученное по примеру 144, растворяют в N,N-диметилформамиде (2 мл) и раствор нагревают вместе с NaN3 (345 мг) и Et3N • HCl (731 мг) в течение 7 часов при 100oC. После удаления нерастворенного продукта фильтрацией растворитель отгоняют при пониженном давлении и к полученному остатку прибавляют небольшое количество этанола и воды. Затем полученную смесь доводят до pH 2 с помощью HCl. Выпавший твердый продукт выделяют фильтрацией, промывают водой и затем сушат. Выход: 539 мг.
ii) Вышеуказанный твердый продукт (514 мг) растворяют в N,N-диметилформамиде (5 мл) и к этому раствору прибавляют Cs2CO3 (422 мг) и MeI (0,089 мл) с последующим нагреванием в течение 4 часов при комнатной температуре. Добавляют этилацетат и полученный органический слой промывают 3 раза водой. После этого растворитель отгоняют и остаток очищают хроматографией на колонке (SiO2; CH2Cl2:EtOA = 4:1) с получением посредством этого соединения (333 мг) структурной формулы A и соединения (93 мг) структурной формулы B. Физические свойства этих соединений описаны далее.
A
Т.пл. 216 - 218oC.
ЯМР: δ растворитель (CDCl3) 1,17 (3H, т, J = 7,0 Гц), 3,39 (1H, кв, J = 7,0 Гц), 3,89 (1H, д, J = 14,3 Гц), 4,41 (3H, с), 4,83 (1H, д, J = 14,3 Гц), 4,83 (1H, д, J = 1,5 Гц), 6,74 - 6,81 (2H, м), 7,44 - 7,54 (1H, м), 7,64 (2H, д, J = 8,4 Гц), 7,71 (1H, с), 7,75 (1H, с), 8,14 (2H, д, J = 8,4 Гц).
B
Т.пл. 169 - 171oC.
ЯМР: δ растворитель (CDCl3) 1,17 (3H, д, J = 7,1 Гц), 3,42 (1H, кв, J = 7,1 Гц), 3,88 (1H, д, J = 14,1 Гц), 4,22 (3H, с), 4,83 (1H, д, J = 14,1 Гц), 4,95 (1H, д, J = 1,5 Гц), 6,75 - 6,82 (2H, м), 7,44 - 7,55 (1H, м), 7,70 - 7,78 (6H, м).
Пример 146.
Получение соединения A, представленного структурной формулой: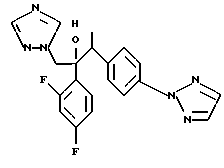
и его диастереомерного соединения B.
Целевое соединение получают в соответствии с тем же способом, что описан в примере 144, за исключением того, что вместо 2-(4-цианофенил)ацетилхлорида используют 2-(4-(1,2,3-триазол-2-ил)фенил)ацетилхлорид. Физические свойства этого соединения описаны далее.
A
Т.пл. 198 - 199oC.
ЯМР: δ растворитель (CDCl3) 1,16 (3H, д, J = 7,1 Гц), 3,39 (1H, кв, J = 7,1 Гц), 3,89 (1H, д, J = 14,1 Гц), 4,83 (1H, д, J = 14,1 Гц), 4,85 (1H, с), 6,72 - 6,80 (2H, м), 7,44 - 7,55 (1H, м), 7,64 (2H, д, J = 8,6 Гц), 7,72 (1H, с), 7,76 (1H, с), 7,83 (2H, с), 8,08 (2H, д, J = 8,6 Гц).
B
Состояние: твердый продукт.
ЯМР: δ растворитель (CDCl3) 1,58 (3H, д, J = 7,0 Гц), 3,46 (1H, кв, J = 7,0 Гц), 4,67 (1H, д, J = 13,9 Гц), 4,85 (1H, д, J = 1,3 Гц), 5,03 (1H, д, J = 13,9 Гц), 6,42 - 6,48 (1H, м), 6,61 - 6,67 (1H, м), 6,93 - 6,99 (1H, м), 7,14 (2H, ушир. д, J = 8,6 Гц), 7,75 (2H, с), 7,76 (1H, с), 7,80 (2H, ушир. д, J = 8,6 Гц), 7,86 (1H, с).
Экспериментальный пример 2.
Группы по пять мышей ICR инфицируют через их хвостовые вены штаммом Candida albicans MCY 8622 (2 х 106 СОЕ/мышь) (SFU - СОЕ, синцитийобразующая единица). Через 1 час соединения, показанные в таблице 4, вводят орально в дозе 2,5 или 10 мг на кг веса тела мыши соответствующим группам мышей. Наблюдения проводят в течение 7 дней для расчета среднего числа дней выживания для каждой группы. Это среднее число используют в качестве показателя, указывающего на противогрибковую активность in vivo (см. табл. 4).
Пример 147.
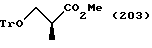
В 33 мл пиридина растворяют 6,6 мл (60 ммоль) (S)-метил гидрокси-2-метилпропионата. К полученному раствору прибавляют 18,1 г (1,5 эквивалента) трифенилхлорметана с последующим нагреванием в течение 1 часа при 80oC. Реакционную смесь охлаждают до комнатной температуры и затем понемногу прибавляют к 350 мл воды. Выпавшие кристаллы собирают фильтрацией, промывают водой и сушат. Полученный таким образом продукт перекристаллизовывают из этанола с получением 18,3 г (выход: 85%) целевого соединения (203).
C24H24O3 MH+ = 360
Рассчитано,%: H = 6,71, C = 79,97, N = 0
Найдено,%: H = 6,76, C = 79,77, N = 0,05
Точка плавления кристаллов: 84 - 85oC.
1H-ЯМР ( δ , CDCl3): 1,15 (3H, д, J = 7,1 Гц), 2,69 - 2,77 (1H, м), 3,17 (1H, дд, J = 5,6 Гц, 8,8 Гц), 3,29 (1H, дд, J = 5,6 Гц, 8,8 Гц), 3,70 (3H, с), 7,20 - 7,44 (15H, м).
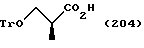
В жидкой смеси из 108 мл тетрагидрофурана и 54 мл метанола растворяют 10,8 г (30,0 ммоль) соединения (203). При охлаждении ледяной водой к полученному раствору прибавляют по каплям в течение более 15 минут при перемешивании 54 мл водного раствора 2,52 г (2 эквивалента) моногидрата гидроксида лития. После нагревания полученной смеси до комнатной температуры и перемешивания в течение 4 часов добавляют 3,6 мл ледяной уксусной кислоты и органический растворитель отгоняют при пониженном давлении. После экстракции этилацетатом экстракт промывают водой, сушат и концентрируют с получением 10,4 г целевого соединения (204). Перекристаллизацией из дихлорметана-гексана получают образец для (количественного) анализа.
C23H22O3 MH+ = 347
Рассчитано,%: C = 79,74 H = 6,47 N = 0
Найдено,%: C = 79,59 H 6,47 N = 0,07
Точка плавления кристаллов: 99 - 102oC.
1H-ЯМР ( δ , CDCl3): 1,18 (3H, д, J = 7,2 Гц), 2,69 - 2,78 (1H, м), 3,25 (1H, дд, J = 5,6 Гц, 8,8 Гц), 3,32 (1H, дд, J = 5,6 Гц, 8,8 Гц), 7,15 - 7,45 (15H, м).
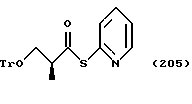
В 50 мл дихлорметана растворяют 10,3 г (29,8 ммоль) соединения (204). При охлаждении ледяной водой к полученному раствору прибавляют последовательно 3,64 г (1,1 эквивалента) 2-меркаптопиридина, 3,64 г (0,1 эквивалента) 4-диметиламинопиридина и 6,76 г (1,1 эквивалента) дициклогексилкарбодиимида. Полученную смесь перемешивают в течение 3,5 часов при охлаждении ледяной водой и в течение 2 часов при комнатной температуре, образовавшийся осадок отделяют фильтрацией. Затем фильтрат разбавляют этилацетатом, дважды промывают водой и насыщенным раствором соли и сушат над сульфатом магния и растворитель отгоняют при пониженном давлении.
Остаток очищают на колонке с силикагелем (элюирование гексаном : этилацетатом = 9:1) с получением посредством этого 11,9 г (выход 91%) целевого соединения (205) в виде желтого масла.
1H-ЯМР ( δ , CDCl3): 1,21 (3H, д, J = 7,2 Гц), 2,99 - 3,09 (1H, м), 3,21 (1H, дд, J = 5,6 Гц, 9,2 Гц), 3,44 (1H, дд, J = 7,6 Гц, 9,2 Гц), 7,21 - 7,33 (10H, м), 7,43 - 7,47 (6H, м), 7,63 (1H, д, J = 8,0 Гц), 7,73 (1H, т, J = 8,0 Гц), 8,63 (1H, д, J = 4,8 Гц).
Пример 148.
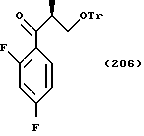
В 7,8 мл тетрагидрофурана суспендируют 780 мг [1,2 эквивалента по отношению к соединению (205)] порошка магния, активированного перемешиванием в течение ночи при 120oC в атмосфере азота. К этой суспензии прибавляют одну каплю 2,4-дифторбромбензола и один кусочек кристалла иода и перемешивают полученную смесь, к которой прибавляют по каплям 3,67 мл [1,2 эквивалента по отношению к соединению (205)] 2,4-дифторбромбензола, растворенного в 17 мл тетрагидрофурана при поддержании внутренней температуры при 40 - 60oC. Затем прибавляют 20 мл тетрагидрофурана, полученную смесь охлаждают до внутренней температуры -30oC. Раствор 11,9 г (27,1 ммоль) соединения (205), растворенного в 90 мл тетрагидрофурана, добавляют по каплям к смеси при поддержании внутренней температуры при -25 - -30oC. Затем полученную смесь перемешивают в течение 15 минут при -30oC и 2 часа при комнатной температуре, к реакционной смеси прибавляют насыщенный водный раствор хлорида аммония с последующим перемешиванием в течение 15 минут. К смеси прибавляют этилацетат и воду для отделения органического слоя. Органический слой дважды промывают водой и один раз насыщенным раствором соли и сушат над сульфатом магния, и растворитель отгоняют при пониженном давлении. Остаток очищают на колонке с силикагелем (элюирование гексаном : этилацетатом = 9:1) и потом перекристаллизовывают из метанола с получением посредством этого 7,46 г (выход 62%) целевого соединения (206).
C29H24F2O2 MH+ = 442
Рассчитано,%: H = 5,47 C = 78,7 N = 0
Найдено,%: H = 5,48 C = 78,73 N = 0
Точка плавления кристаллов: 94 - 97oC.
1H-ЯМР ( δ , CDCl3): 1,21 (3H, д, J = 6,8 Гц), 3,21 (1H, дд, J = 5,2 Гц, 8,8 Гц), 3,42 (1H, дд, J = 6,4 Гц, 8,8 Гц), 3,56 (1H, м), 6,80 (1H, м), 6,94 (1H, м), 7,17 - 7,31 (15H, м), 7,77 - 7,83 (6H, м).
Пример 149.
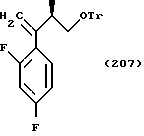
В 64 мл тетрагидрофурана суспендируют 6,43 г [1,2 эквивалента по отношению к соединению (206)] метилтрифенилфосфоний бромида в токе азота. К этой суспензии прибавляют по каплям 11,2 мл [1,2 эквивалента по отношению к соединению (206)] бутиллития (1,6 моль гексанового раствора) при охлаждении ледяной водой. После нагревания полученной смеси опять до комнатной температуры и затем перемешивания в течение 2 часов прибавляют по каплям раствор 6,63 г (15,0 ммоль) соединения (206) в 30 мл тетрагидрофурана. К жидкой реакционной смеси прибавляют 500 мл гексана и 300 мл воды и нерастворившийся продукт удаляют фильтрацией.
Органический слой отделяют и промывают 3 раза водой и один раз насыщенным раствором соли и сушат над сульфатом магния, и растворитель отгоняют при пониженном давлении. Остаток очищают на колонке с силикагелем (элюирование гексан : этилацетатом = 50:1) с получением посредством этого 5,4 г (выход 85%) маслянистого продукта (207).
1H-ЯМР ( δ , CDCl3):
1,16 (3H, д, J = 7,0 Гц), 2,81 - 2,89 (1H, м), 2,97 - 3,01 (1H, дд, J = 6,0 Гц, 9,2 Гц), 3,04 - 3,08 (1H, дд, J = 6,0 Гц, 9,2 Гц), 5,11 (1H, с), 5,21 (1H, с), 6,68 - 6,75 (2H, м), 7,00 - 7,06 (1H, м), 7,18 - 7,28 (9H, м), 7,35 - 7,39 (6H, м).
Пример 150.
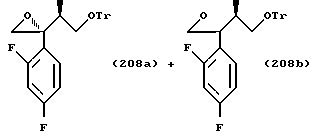
В 25 мл дихлорметана растворяют 2,70 г (6,14 ммоль) соединения (207). При охлаждении ледяной водой к раствору прибавляют 1,46 г (1,1 эквивалент) мета-хлорпенбензойной кислоты (чистота 80%) с последующим перемешиванием в течение 12 часов при 4oC. К реакционной смеси прибавляют мета-хлорбензойную кислоту в количестве 290 мг (0,34 эквивалента) с последующим перемешиванием в течение 5 часов при комнатной температуре. К смеси прибавляют 10%-ный водный раствор гидросульфита натрия с последующей экстракцией этилацетатом. Полученный органический слой промывают последовательно водой, насыщенным раствором гидрокарбоната натрия, водой и насыщенным раствором соли и затем сушат над сульфатом магния и растворитель отгоняют при пониженном давлении с получением посредством этого 2,813 г маслянистого продукта (208). По данным протонного ЯМР-анализа найдено, что это соединение является смесью 2:1 желаемого изомера (208а) и его диастереомера (208).
1H-ЯМР ( δ , CDCl3) 0,93 (3H, д, J = 8,8 Гц) <a>, 0,98 (3H, д, J = 8,8 Гц)<b>, 2,04 - 2,12 (1H, м)<b>, 2,20 - 2,28 (1H, м)<a>,
2,76 (1H, д, J = 5,2 Гц)<a>, 2,76 (1H, д, J = 5,2 Гц)<b>, 2,88 (1H, дд, J = 7,2 Гц, 9,2 Гц)<a>, 2,96 (1H, дд, J = 7,2 Гц, 9,2 Гц)<b>, 3,00 - 3,06 (1H, м)<a+b>, 3,02 (1H, д, J = 5,2 Гц)<a>, 3,11 (1H, д, J = 5,2 Гц)<b>, 6,61 - 6,73 (2H, м)<a+b>, 7,12 - 7,50 (16H, м)<a+b>.
Пример 151.
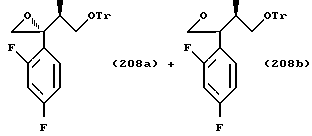
(Альтернативный способ)
1,6 М гексановый раствор бутиллития добавляют по каплям к 221 мг соединения (206) и 44 μ л (1,2 эквивалента) хлориодметана в тетрагидрофурана (2,2 мл) при -70oC при продувании азотом. Полученную смесь перемешивают в течение 5 минут при этой температуре и затем нагревают до достижения внутренней температуры в виде комнатной и перемешивании в течение 1 часа. К смеси последовательно прибавляют водный раствор хлорида аммония и этилацетат для разделения на жидкие слои. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над сульфатом магния и растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюирование гексаном : этилацетатом = 9:1) с получением посредством этого 219 мг (выход 96%) соединения (208). По данным протонного ЯМР-анализа найдено, что это соединение является диастереомерной смесью, содержащей соединение (208a) и (208b) в соотношении 1:2,5.
Пример 152.
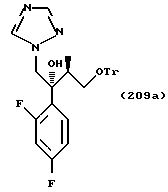
В 8,5 мл диметилформамида суспендируют 370 мг [1,5 эквивалента по отношению к соединению (208)] гидрида натрия (60% дисперсии в минеральном масле) и к суспензии прибавляют 851 мг [2 эквивалентов по отношению к соединению (208)] 1,2,4-триазола. После перемешивания в течение 15 минут при комнатной температуре к суспензии прибавляют раствор 2,813 г (6,17 ммоль) соединения (208) (диастереомерная смесь <a> : <b> = 2:1), растворенного в 22 мл диметилформамида и полученную смесь перемешивают в течение 8,5 часов при 80oC. После охлаждения до комнатной температуры к смеси прибавляют воду и этилацетат для разделения на слои. Полученный органический слой промывают насыщенным раствором соли и затем сушат над сульфатом магния и растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюирование дихлорметаном : метанолом = 200:1) с получением посредством этого 860 мг целевого соединения (209a), 99 мг его диастереомера (209b), обладающего высокой полярностью, и 867 мг смеси обоих соединений в виде белых твердых продуктов.
1ЯМР ( δ , CDCl3) 0,87 (3H, д, J = 7,6 Гц), 2,37 - 2,45 (1H, м), 3,40 (1H, дд, J = 3,2 Гц, 10,0 Гц), 3,55 (1H, дд, J = 5,6 Гц, 10,0 Гц), 4,19 (1H, д, J = 14,4 Гц), 4,65 (1H, д, J = 14,4 Гц), 4,88 (1H, с), 6,64 - 6,72 (2H, м), 7,22 - 7,30 (6H, м), 7,32 - 7,37 (6H, м), 7,46 - 7,50 (6H, м), 7,64 (1H, с), 7,84 (1H, с)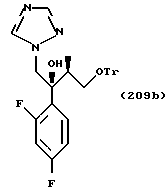
См. описание соединения (209a). Твердый продукт.
1H-ЯМР ( δ , CDCl3): 1,48 (3H, д, J = 7,6 Гц), 2,47 - 2,56 (1H, м), 2,92 (1H, дд, J = 3,2 Гц, 9,6 Гц), 3,19 (1H, дд, J = 3,2 Гц, 9,6 Гц), 4,56 (1H, д, J = 14,0 Гц), 4,69 (1H, дд, J = 14,0 Гц), 4,78 (1H, с), 6,49 - 6,61 (2H, м), 7,01 - 7,09 (1H, м), 7,16 - 7,37 (15H, м), 7,63 (1H, с), 7,88 (1H, с).
Пример 153.
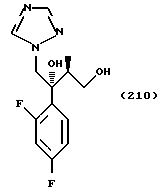
В 7,4 мл метанола растворяют 740 мг (1,41 ммоль) соединения (209a) и к полученному раствору прибавляют 295 мг (1,1 эквивалента) моногидрата толуолсульфокислоты с последующим перемешиванием в течение 1 часа при комнатной температуре. К полученной смеси прибавляют 295 мг (1,1 эквивалента) моногидрата толуолсульфокислоты с последующим перемешиванием в течение 3 часов при комнатной температуре. К смеси прибавляют воду и насыщенный раствор гидрокарбоната натрия и этилацетат для разделения на слои. Полученный органический слой промывают водой и затем насыщенным раствором соли и сушат над сульфатом магния и растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюирование последовательно смесями дихлорметана и метанола в соотношениях 100:1, 50:1 и 25:1) с получением посредством этого 246 мг сырого продукта. Продукт перекристаллизовывают из смешанного растворителя из дихлорметана и изопропилового эфира с получением 190 мг (выход 48%) целевого соединения (210) в виде чистого продукта.
C13H15F2N3O2 MH+ = 284
Рассчитано,%: H = 5,34 C = 55,12 N = 14,83
Найдено,%: H = 5,33 C = 55,09 N = 14,93
Точка плавления кристаллов: 134 - 135oC.
1H-ЯМР ( δ , CDCl3): 0,84 (3H, д, J = 7,2 Гц), 2,30 - 2,39 (1H, м), 2,67 - 2,77 (1H, ушир. с), 3,83 (1H, дд, J = 5,4 Гц, 11,2 Гц), 3,99 (1H, дд, J = 3,2 Гц, 11,2 Гц), 4,76 (1H, д, J = 14,0 Гц), 4,97 (1H, д, J = 14,0 Гц), 5,28 (1H, с), 6,69 - 6,78 (2H, м), 7,36 - 7,43 (1H, м), 7,75 (1H, с), 7,91 (1H, с).
Пример 154.
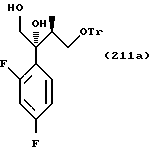
В смешанном растворе 5 мл воды и 2,5 мл ацетона растворяют 144 мг N-метилморфолин оксида (50% водный раствор) и к полученному раствору последовательно прибавляют 36 μ л тетраоксида осмия (4% водный раствор) и раствор 247 мг соединения (207) в 2,54 мл ацетона. После перемешивания в течение ночи при комнатной температуре к смеси прибавляют 100 μ л тетраоксида осмия (4% водный раствор) с последующим перемешиванием в течение 24 часов при комнатной температуре. К смеси прибавляют 10%-ный водный раствор гидросульфита натрия с последующей экстракцией этилацетатом. Полученный органический слой промывают насыщенным раствором соли и сушат над сульфатом магния и растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюирование последовательно смесями гексана и этилацетата в соотношениях 10:1 и 4:1) с получением посредством этого 153 мг основного продукта (211a) в твердом виде и 23 мг его диастереомера (211b), обладающего высокой полярностью.
1H-ЯМР ( δ ,CDCl3): 0,75 (3H, д, J = 8,8 Гц), 1,80 (1H, дд, J = 5,2 Гц, 8,4 Гц), 2,44 - 2,53 (1H, м), 2,77 (1H, дд, J = 5,6 Гц, 8,4 Гц), 3,21 (1H, дд, J = 8,4, 14,0 Гц), 3,32 (1H, дд, J = 2,8 Гц, 14,0 Гц), 3,63 (1H, дд, J = 8,4 Гц, 11,2 Гц), 3,96 (1H, ддд, 2,8 Гц, 5,6 Гц, 11,2 Гц), 4,39 (1H, с), 6,69 - 6,76 (1H, м), 6,79 - 6,84 (1H, м), 7,22 - 7,30 (3H, м), 7,32 - 7,37 (6H, м), 7,43 - 7,47 (6H, м), 7,52 - 7,58 (1H, м).
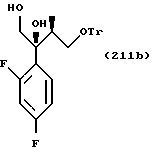
Смотри описание соединения (211a). Твердый продукт.
1H-ЯМР ( δ , CDCl3) 1,35 (3H, д, J = 7,2 Гц), 2,34 - 2,44 (1H, м), 2,93 (1H, дд, J = 3,6 Гц, 9,6 Гц), 3,19 (1H, дд, J = 3,6 Гц, 9,6 Гц), 3,82 (1H, дд, J = 6,8 Гц, 10,6 Гц), 3,96 (1H, дд, J = 5,2 Гц, 10,6 Гц), 4,50 (1H, с), 6,57 - 6,64 (1H, м), 6,70 - 6,75 (1H, м), 7,18 - 7,31 (15H, м), 7,39 - 7,45 (1H, м).
Пример 155.
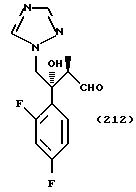
В 3,3 мл дихлорметана растворяют 96 μ г (2,2 эквивалента по отношению к веществу) оксалилхлорида и к полученному раствору при -60oC в токе азота прибавляют 185 μ г (4,8 эквивалента по отношению к веществу) диметилсульфоксида в дихлорметане (0,9 мл). После перемешивания в течение 5 минут прибавляют по каплям раствор 142 мг (0,005 ммоль) соединения (210a) в дихлорметане (4,2 мл). После перемешивания в течение 30 минут прибавляют 350 μ г (5 эквивалентов по отношению к веществу) триэтиламина. Полученную смесь нагревают до комнатной температуры. К смеси прибавляют воду с последующей экстракцией дважды дихлорметаном. Полученный органический слой промывают дважды водой и один раз насыщенным раствором соли и затем над сульфатом магния, и растворитель затем отгоняют при пониженном давлении. Остаток очищают на колонке с силикагелем (элюирование дихлорметаном-метанолом = 50:1) с получением посредством этого 106 мг (выход 75%) целевого продукта (212).
C13H13F2N3O2 MH+ = 262
Рассчитано,%: H = 4,66 C = 55,52 N = 14,94
Найдено,%: H = 4,68 C = 55,44 N = 14,96
Точка плавления кристаллов: 140 - 144oC.
1H-ЯМР ( δ , CDCl3) 1,01 (3H, д, J = 7,2 Гц), 2,96 - 3,03 (1H, м), 4,62 (1H, д, J = 14,0 Гц), 4,90 (1H, д, J = 14,0 Гц), 5,16 (1H, с), 6,73 - 6,81 (2H, м), 7,37 - 7,44 (1H, м), 7,79 (1H, с), 7,86 (1H, с), 9,85 (1H, д, J = 3,2 Гц).
Пример 156.

В 0,36 мл воды суспендируют 36 мг (0,128 ммоль) соединения (212) и к суспензии прибавляют 17 мг (1,2 эквивалента) гидроксиаминосульфоновой кислоты с последующим нагреванием в течение 1,5 часов при 50oC. К полученной смеси прибавляют 21 мг гидроксиаминосульфоновой кислоты с последующим нагреванием в течение 40 минут. К жидкой реакционной смеси прибавляют этилацетат и водный раствор гидрокарбоната натрия для разделения слоев. Полученный органический слой промывают водой и насыщенным раствором соли и затем сушат над сульфатом магния и растворитель затем отгоняют при пониженном давлении. Остаток очищают на колонке с силикагелем (элюирование дихлорметаном : метанолом = 100:1) с получением посредством этого 12 мг целевого продукта (202).
C13H12F2N4O MH+ = 279
Точка плавления: 181 - 182oC.
1H-ЯМР ( δ , CDCl3): 1,17 (3H, д, J = 7,2 Гц), 3,29 (1H, кв, J = 7,2 Гц), 4,82 (1H, д, J = 14,0 Гц), 4,97 (1H, д, J = 14,0 Гц), 5,44 (1H, д, J = 0,8 Гц), 6,74 - 6,82 (1H, м), 7,39 - 7,46 (1H, м), 7,83 (1H, с), 7,84 (1H, с).
Пример 157.
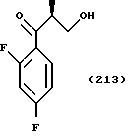
В 1,1 мл метанола растворяют 110 мг соединения (206) и к раствору прибавляют 53 мг (1,1 эквивалент) моногидрата п-толуолсульфокислоты с последующим перемешиванием в течение 20 минут при 40oC. К смеси прибавляют воду и этилацетат для осуществления экстракции. Полученный органический слой промывают насыщенным раствором соли и сушат над сульфатом магния и растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем с получением 32 мг (выход 58%) целевого соединения (213) в виде масла. Оптическую чистоту этого соединения оценивают жидкостной хроматографией высокого разрешения с использованием хиральной колонки. Оптическая чистота составляет 99,0% ее. Условия анализа описаны далее.
Колонка: Chiral Cell OB (внутренний диаметр 4 мм, длина 250 мм)
Подвижная фаза: Гексан : изопропанол = 9:1
Скорость потока: 0,5 мл/мин
1H-ЯМР ( δ , CDCl3): 1,18 (3H, д, J = 6,8 Гц), 2,50 (1H, т, J = 6,0 Гц), 3,45 - 3,54 (1H, м), 3,72 - 3,79 (1H, м), 3,84 - 3,92 (1H, м), 6,82 - 6,88 (1H, м), 6,92 - 6,98 (1H, м), 7,83 - 7,90 (1H, м).
Пример 158.
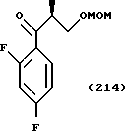
В 5 мл дихлорметана растворяют 472 мг (2,36 ммоль) соединения (213) и к раствору прибавляют 448 μ г (2,5 эквивалента) хлорметил метилового эфира, 822 μ г (2 эквивалента) диэтилизопропиламина и каталитическое количество 4-диметиламинопиридина с последующим перемешиванием в течение ночи при комнатной температуре. К смеси прибавляют дихлорметан и воду для осуществления экстракции. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над сульфатом магния и растворитель отгоняют при пониженном давлении. Остаток очищают на колонке с силикагелем (элюирование гексаном : этилацетатом = 10:1) с получением посредством этого 485 мг (выход 84%) целевого продукта (214) в виде маслянистого продукта.
1H-ЯМР ( δ , CDCl3): 1,22 (3H, д, J = 6,8 Гц), 3,29 (3H, с), 3,85 - 3,68 (2H, м), 3,87 - 3,94 (1H, м), 4,56 (1H, д, J = 8,4 Гц), 4,59 (1H, д, J = 9,4 Гц), 6,84 - 6,91 (1H, м), 6,94 - 6,99 (1H, м), 7,85 - 7,92 (1H, м).
Пример 159.
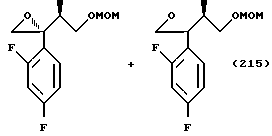
Целевое соединение (215) в виде масла получают как диастереомерную смесь 1:1 в соответствии с альтернативным способом соединения (208).
1H-ЯМР ( δ , CDCl3): 0,99 (3H, д, J = 6,8 Гц)<a>, 1,20 (3H, д, J = 6,8 Гц)<b>, 2,08 - 2,22 (1H, м)<a+b>, 2,78 (1H, д, J = 5,2 Гц)<a+b>, 3,09 (1H, д, J = 5,2 Гц), 3,33 (1H, с)<a>, 3,36 (1H, с)<b>, 3,19 - 3,38 (1H, м)<a+b>, 3,45 - 3,54 (1H, м)<a+b>, 4,57 (2H, с)<a>, 4,61 (1H, с)<b>, 6,75 - 6,88 (2H, м)<a+b>, 7,32 - 7,45 (1H, м)<a+b>.
Пример 160.
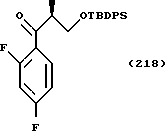
В 2,5 мл диметилформамида растворяют 500 мг соединения (213) и к раствору последовательно прибавляют 715 мг имидазола и 715 μ л трет-бутилдифенилсилилхлорида с последующим перемешиванием в течение 2,5 часов при комнатной температуре. К реакционной смеси прибавляют этилацетат и воду для осуществления экстракции. Полученный органический слой промывают водой и насыщенным раствором соли и сушат над сульфатом магния. Продукт очищают на колонке с силикагелем (элюирование гексаном : этилацетатом = 9:1) с получением посредством этого 939 мг целевого продукта (216) в твердом виде.
1H-ЯМР ( δ , CDCl3): 0,94 (9H, с), 1,19 (3H, д, J = 10,0 Гц), 3,58 (1H, м), 3,75 (1H, ддд, J = 10,0 Гц, 5,2 Гц, 0,8 Гц), 3,94 (1H, ддд, J = 10,0 Гц, 6,8 Гц, 1,6 Гц), 6,82 - 6,87 (1H, м), 6,92 - 6,98 (1H, м), 7,29 - 7,44 (6H, м), 7,49 - 7,52 (2H, м), 7,57 - 7,61 (2H, м), 7,79 - 7,85 (1H, м).
Пример 161.

Раствор 438 мг (1,00 ммоль) соединения (216) в 4,4 мл диэтилового эфира прибавляют по каплям к 3,0 мл 1,0 М раствора триметилмагний хлорида в диэтиловом эфире при комнатной температуре в токе азота с последующим перемешиванием в течение 2,5 часов при комнатной температуре. После прибавления водного раствора хлорида аммония к полученной смеси ее подвергают экстракции этилацетатом. Экстракт промывают водой и насыщенным раствором соли и затем сушат над сульфатом магния. Азеотропная перегонка с толуолом дает 524 мг твердого продукта.
Продукт в количестве 262 мг растворяют в 2,5 мл дихлорметана и к раствору прибавляют по каплям 69 μ л комплекса трифторидбора-диэтилового эфира при охлаждении ледяной водой. После перемешивания в течение 10 минут к реакционной смеси прибавляют насыщенный раствор гидрокарбоната натрия с последующей экстракцией дихлорметаном. Экстракт промывают водой и насыщенным раствором соли и сушат над сульфатом магния и растворитель затем отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюирование гексаном : этилацетатом = 20:1) с получением посредством этого 174 мг целевого продукта (217) в виде маслянистого продукта.
1H-ЯМР ( δ , CDCl3): 1,02 (9H, c), 1,17 (3H, д, J = 6,8 Гц), 2,72 - 2,80 (1H, м), 3,50 (1H, дд, J = 6,4 Гц, 10,0 Гц), 3,64 (1H, дд, J = 5,2 Гц, 10,0 Гц), 5,13 (1H, с), 5,23 (1H, с), 6,71 - 6,78 (2H, м), 7,04 - 7,11 (1H, м), 7,31 - 7,43 (6H, м), 7,58 - 7,63 (4H, м).
Пример 162.
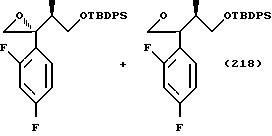
Проводят синтез соединения (208). По данным протонного ЯМР-анализа найдено, что соотношение диастереомеров в маслянистом продукте (218) составляет 1:2.
1H-ЯМР ( δ , CDCl3): 0,92 (3H, д, J = 8,8 Гц)<a>, 0,97 (3H, д, J = 8,8 Гц)<b>, 1,03 (9H, с)<b>, 1,06 (3H, с)<a>, 1,96 - 2,05 (1H, м)<b>, 2,14 - 2,22 (1H, м)<a>, 2,78 (1H, д, J = 5,2 Гц)<b>, 2,79 (1H, д, J = 5,2 Гц)<a>, 3,08 (1H, д, J = 5,2 Гц)<b>, 3,17 (1H, д, J = 5,2 Гц)<a>, 3,45 - 3,66 (2H, м)<a+b>, 6,70 - 6,82 (2H, м)<a+b>, 7,30 - 7,45 (6H, м)<a+b>, 7,59 - 7,68 (4H, м)<a+b>.
Пример 163.

(Альтернативный способ)
В 2 мл тетрагидрофурана растворяют 72 мг (0,16 ммоль) соединения (216) и 3,2 μ л (0,18 ммоль) хлоридометана. Полученный раствор охлаждают до -78oC в токе азота. К этому раствору прибавляют по каплям 0,12 мл (0,17 ммоль) 1,5 М раствора в диэтиловом эфире комплекса метиллитий-литий бромида. Полученную смесь перемешивают в течение 1 часа при нагревании до комнатной температуры. К реакционной смеси прибавляют насыщенный раствор водный хлорида аммония с последующей экстракцией этилацетатом. Полученный органический слой промывают насыщенным раствором соли, сушат и затем концентрируют при пониженном давлении с получением посредством этого 86 мг маслянистого соединения (218). По данным протонного ЯМР-анализа найдено, что соотношение диастереомеров в продукте составляет 1:1.
Пример 164.
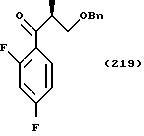
Соединение (213) (233 мг, 0,507 ммоль) растворяют в 5,0 мл толуола и к раствору прибавляют 141 мг (0,609 ммоль) оксида серебра и 84 μ л (0,710 ммоль) бензилбромида с последующим перемешиванием в течение 7 дней при комнатной температуре. Реакционную смесь фильтруют через Целит и полученный фильтрат промывают эфиром. Фильтрат концентрируют и затем очищают на хроматографической колонке с силикагелем (элюирование гексаном и затем гексаном : этилацетатом = 12:1) с получением 66 мг (выход 44%) соединения (219) в виде бесцветного маслянистого продукта.
1H-ЯМР ( δ , CDCl3): 1,21 (3H, д, J = 7,0 Гц), 3,54 (1H, дд, J = 8,8 Гц, 5,5 Гц), 3,60 - 3,70 (1H, м), 3,82 (1H, дд, J = 8,8 Гц, 3,6 Гц), 4,47 (1H, д, J = 11,9 Гц), 4,54 (1H, д, J = 11,9 Гц), 6,80 - 6,98 (2H, м), 7,20 - 7,40 (5H, м), 7,82 - 7,88 (1H, м).
Пример 165.
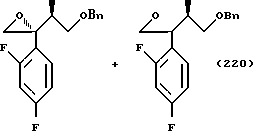
В 2 мл безводного тетрагидрофурана растворяют 66 мг (0,23 ммоль) соединения (219) и 18 μ л (0,25 ммоль) хлоридометана. Полученный раствор охлаждают до -78oC. К этому раствору прибавляют по каплям 0,16 мл (0,24 ммоль) 1,5 М раствора в диэтиловом эфире комплекса метиллитий-литий бромида. Полученную смесь нагревают до комнатной температуры и перемешивают в течение 2,5 часов. К реакционной смеси прибавляют насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом. Полученный органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении с получением посредством этого 60 мг (выход 86%) соединения (220) в виде маслянистого продукта.
Неожиданно, соединение (220) является смесью 1:1 диастереомеров.
1H-ЯМР ( δ , CDCl3): 0,97 (3H, д, J = 7,8 Гц)<a>, 1,01 (3H, д, J = 7,5 Гц)<b>, 2,14 - 2,18 (1H, м)<a>, 2,20 - 2,28 (1H, м)<b>, 2,77 - 2,80 (2H, м)<a+b>, 3,07 - 3,10 (2H, м)<a+b>, 3,24 - 3,32 (2H, м)<a+b>, 3,38 - 3,46 (2H, м)<a+b>, 4,40 - 4,52 (4H, м)<a+b>, 6,75 - 6,84 (4H, м)<a+b>, 7,26 - 7,40 (12H, м)<a+b>.
Препаративные примеры.
Препаративные примеры от соединения (202) до конечного соединения описаны далее.
Препаративный пример 8.
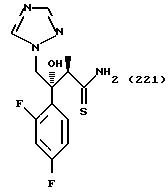
К 33 г соединения (202) прибавляют 33 мл воды и 172 мл O,O-диэтилдитиофосфата и смесь нагревают и кипятят с обратным холодильником в течение 30 минут. Реакционную смесь опять охлаждают до комнатной температуры и прибавляют воду с последующей экстракцией этилацетатом. Полученный этилацетатный слой промывают водой и насыщенным раствором соли, сушат над безводным сульфатом магния и растворитель отгоняют. К полученному остатку прибавляют 70 мл диэтилового эфира для образования кристаллов. Полученные таким образом кристаллы собирают фильтрацией с получением целевого соединения (35 г) в виде сырого продукта. Сырой продукт (13,9 г) растворяют в этилацетате и раствор промывают 5% водным раствором карбоната натрия и растворитель затем отгоняют. Полученный остаток перекристаллизовывают из диэтилового эфира и диизопропилового эфира с получением посредством этого 7,8 г целевого соединения (221).
MH+ = 313
Точка плавления: 132 - 134oC.
1H-ЯМР ( δ , CDCl3): 1,11 (3H, д, J = 7,1 Гц), 3,71 (1H, кв, J = 7,1 Гц), 4,55 (1H, д, J = 14,3 Гц), 5,08 (1H, д, J = 14,3 Гц), 6,71 - 6,80 (2H, м), 7,42 - 7,48 (1H, м), 7,80 (1H, ушир. с), 7,94 (1H, с), 8,41 (1H, ушир. с).
Препаративный пример 9.
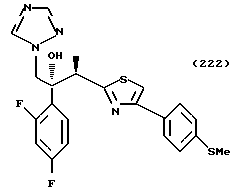
Соединение (221) (15,02 г) растворяют в эталоне (150 мл) и прибавляют 2-бром-4'-метилтиоацетофенон (14,97 мг) с последующим нагреванием и кипячением с обратным холодильником в течение 4 часов. Жидкую реакционную смесь охлаждают до 0oC и затем нейтрализуют водным раствором гидрокарбоната с последующей экстракцией этилацетатом. Экстракт промывают водой и затем насыщенным раствором соли и сушат над безводным сульфатом магния и этилацетат отгоняют. Остаток очищают хроматографией на силикагеле (SiO2, элюирование дихлорметаном и затем 1% раствором метанола в дихлорметане) с получением посредством этого целевого соединения (222) (10,19 г) в виде твердого продукта.
MH+ = 459
1H-ЯМР ( δ , CDCl3): 1,23 (3H, д, J = 7,2 Гц), 2,54 (3H, с), 4,05 (1H, кв, J = 7,2 Гц), 4,28 (1H, д, J = 14,4 Гц), 4,88 (1H, д, J = 14,4 Гц), 6,13 (1H, с), 6,75 - 6,85 (2H, м), 7,33 (2H, ушир. д, J = 8,4 Гц), 7,42 (1H, с), 7,46 - 7,54 (1H, м), 7,66 (1H, с), 7,82 (2H, ушир. д, J = 8,4 Гц), 7,92 (1H, с).
Препаративный пример 10.
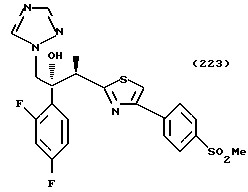
К раствору соединения (222) (10,19 г), растворенного в 150 мл хлороформа, прибавляют 18,35 г мета-хлорпербензойной кислоты с последующим перемещением при комнатной температуре. После расходования сырого продукта к жидкой реакционной смеси прибавляют воду с последующей экстракцией хлороформом. Полученный органический слой промывают 50%-ным водным раствором гидрокарбоната натрия, водой и затем насыщенным раствором соли и сушат над безводным сульфатом магния. После отгонки растворителя при пониженном давлении остаток очищают хроматографией на колонке с силикагелем с получением посредством этого целевого соединения (223) (8,2 г) в виде твердого продукта.
MH+ = 491
1H-ЯМР ( δ , CDCl3): 1,24 (3H, д, J = 7,2 Гц), 3,09 (3H, с), 4,09 (1H, кв, J = 7,2 Гц), 4,27 (1H, д, J = 14,4 Гц), 4,91 (1H, д, J = 14,4 Гц), 5,78 (1H, с), 6,78 - 6,85 (2H, м), 7,47 - 7,55 (1H, с), 7,67 (1H, с), 7,69 (1H, с), 7,87 (1H, с), 8,02 (2H, ушир. д, J = 8,4 Гц), 8,10 (2H, ушир. д, J = 8,4 Гц).
Экспериментальный пример 3.
Группы по пять мышей ICR инфицируют через их хвостовые вены штаммом Candida albicans MCY 8622 (2 x 106 COE/мышь) (SFU - COE, синцитийобразующая единица). Через 1 час соединения по данному описанию вводят орально в дозе 2,5 или 10 мг на кг веса мыши соответствующим группам мышей. Наблюдения проводят в течение 7 дней для расчета среднего числа дней выживания для каждой группы. Это среднее число используют в качестве показателя, указывающего на противогрибковую активность in vivo.
Результаты
Результат эксперимента показан в табл. 5.
Как ясно из этих данных, соединение, полученное из промежуточных продуктов для синтеза способами получения согласно настоящему изобретению, обладает превосходной противогрибковой активностью и поэтому является полезным для профилактики и лечения различных грибковых инфекционных заболеваний.
Примеры препаративных форм фармацевтической композиции
Пример I
Два грамма соединения примера 99 настоящего изобретения растворяют в этиловом спирте в 500 мл колбе, затем добавляют 6 г поливинилпирролидона и растворяют. Растворитель выпаривают и остаток собирают, размалывают в мельнице и затем просеивают через сита с размером отверстий 32 меш с получением гранулированной композиции.
Пример II
Два грамма соединения примера 49 настоящего изобретения растворяют в этиловом спирте в 500 мл колбе, затем добавляют воду для получения 85% этанольного раствора. Добавляют к раствору 6 г гидроксипропилметилцеллюлозы, затем растворитель выпаривают. Остаток собирают, размалывают в мельнице и затем просеивают через сита с размером отверстий 32 меш с получением гранулированной композиции.
Использование фталата гидроксипропилметилцеллюлозы или гидроксипропилцеллюлозы также дает гранулированную композицию.
Пример III
Пять граммов соединения примера 99 настоящего изобретения растворяют в этиловом спирте в 1000 мл колбе, затем добавляют воду для получения 85% этанольного раствора. К раствору добавляют 15 г гидроксипропилметилцеллюлозы и 100 г кристаллической целлюлозы (торговое наименование XXX, производится Asahi Chemical Industry Co., размер частиц от 200 до 300 мкм) для получения суспензии, затем растворитель выпаривают. Остаток собирают, размалывают в мельнице и затем просеивают для отделения гранул, которые проходят через сито с размером отверстий 32 меш и не проходят через сита с размером отверстий 48 меш. Таким образом получают гранулированную композицию.
Данные по биологической активности
1. Определение минимальной концентрации антибиотика (МКА)
Минимальную концентрацию антибиотика определяют с помощью метода на основе двукратно разведенного агара с агаром Сабуро с декстрозой (SDA: Difco Laboratories, Detroit, Mich.). Дрожжи выращивают на SDA при 30oC в течение 24 часов и разбавляют до конечной концентрации 105 клеток/мл стерилизованным физиологическим раствором.
Нитевидные грибки выращивают на картофельном агаре с декстрозой (PDA: Eiken Chemical Co., Tokyo, Japan) при 30oC в течение 1 недели и разбавляют до конечной концентрации 105 клеток/мл стерилизованным физиологическим раствором, содержащим 0,05% Tween 80. Пять микролитров каждой суспензии грибков наносят с помощью мультиинокулярного репликатора (Microplanar: Sakuma Seisakusho, Tokyo, Japan) на пластину агара, который содержит двукратные серийные разведения антифунгицидных соединений. Наблюдают рост грибков в течение 48 часов после инкубации при 30oC. МКА определяют как наименьшую концентрацию лекарственного средства, при которой наблюдают некоторое ингибирование роста грибков по сравнению с контрольным ростом грибков.
Полученные результаты представлены в табл. 6.
Исследовали активность против C. albicans MYC 8622.
2. Данные по токсичности заявляемых соединений
Соединение примера 104 (200 мг/кг) вводят перорально 4 крысам ежедневно в течение 7 дней. Все крысы были живы на 8 день и не наблюдалось какого-либо токсического действия.
Такой же результат наблюдали при испытании соединения примера 127.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ АНТРАНИЛОВОЙ КИСЛОТЫ ИЛИ ИХ ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ ДЛЯ ИХ ПОЛУЧЕНИЯ И ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ НА ИХ ОСНОВЕ | 1994 |
|
RU2128644C1 |
| ПРОИЗВОДНЫЕ ТРИАЗОЛО[1,4]ДИАЗЕПИНА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1989 |
|
RU2117670C1 |
| ПРОИЗВОДНОЕ ДИ- И ТРИАЗОЛИЛПРОПАНА, СПОСОБЫ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 1996 |
|
RU2145605C1 |
| АЗОТСОДЕРЖАЩИЕ КОНДЕНСИРОВАННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОДУКЦИИ БЕТА-АМИЛОИДА | 2010 |
|
RU2515976C2 |
| ГЕТЕРОЦИКЛО-ЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ АМИНОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ИНГИБИРОВАНИЯ ХОЛИНЭСТЕРАЗЫ, СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ | 1992 |
|
RU2119920C1 |
| ПРОИЗВОДНЫЕ КОНДЕНСИРОВАННЫХ ПОЛИЦИКЛИЧЕСКИХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1996 |
|
RU2167877C2 |
| ЦИКЛОПРОПАНОВЫЕ СОЕДИНЕНИЯ | 2011 |
|
RU2571414C2 |
| ЦИННАМИДНОЕ СОЕДИНЕНИЕ | 2005 |
|
RU2361872C2 |
| ТРИАЗОЛОВЫЕ СОЕДИНЕНИЯ ИЛИ ИХ ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И ПРОТИВОГРИБКОВАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2146250C1 |
| 1,2,3,4-ТЕТРАГИДРОПИРАЗОЛО [5,1-c](1,2,4)ТРИАЗИН ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИНГИБИРУЮЩАЯ ВЫРАБОТКУ ИНТЕРЛЕЙКИНА-1 И ФАКТОРА НЕКРОЗА ОПУХОЛИ, СПОСОБ ПРОФИЛАКТИЧЕСКОГО ИЛИ ТЕРАПЕВТИЧЕСКОГО ЛЕЧЕНИЯ БОЛЕЗНЕЙ, ОПОСРЕДОВАННЫХ ИНТЕРЛЕЙКИНОМ-1 И ФАКТОРОМ НЕКРОЗА ОПУХОЛИ | 1994 |
|
RU2124517C1 |
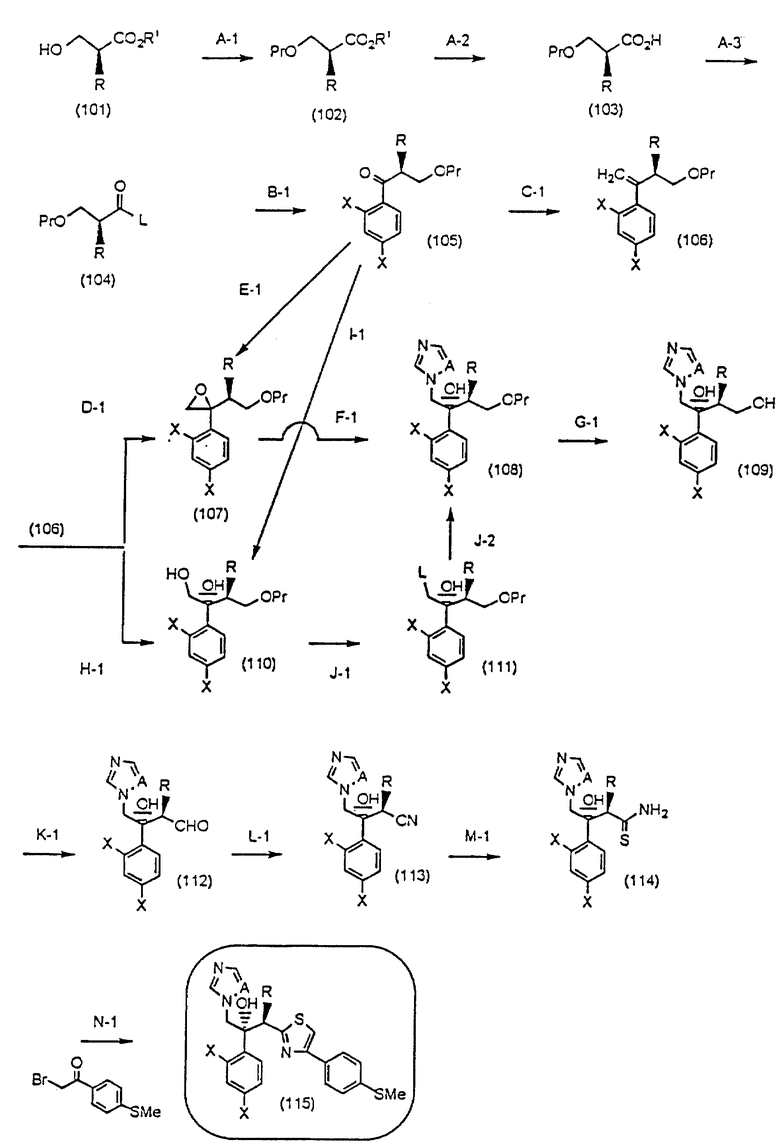

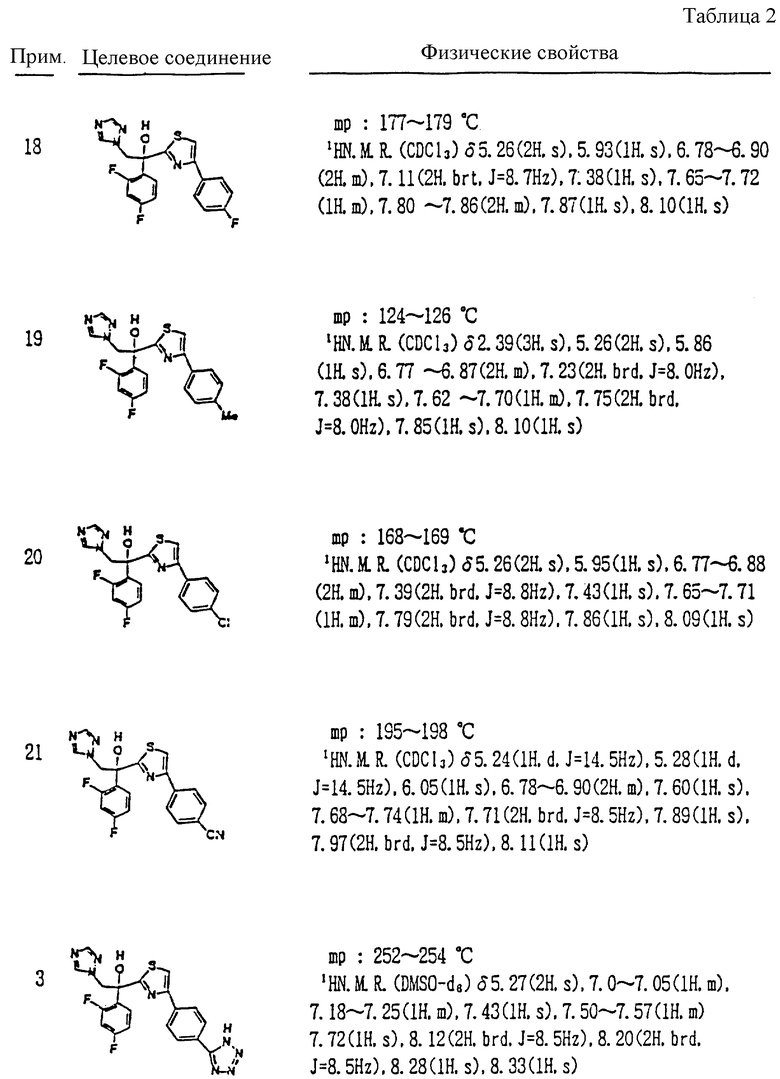
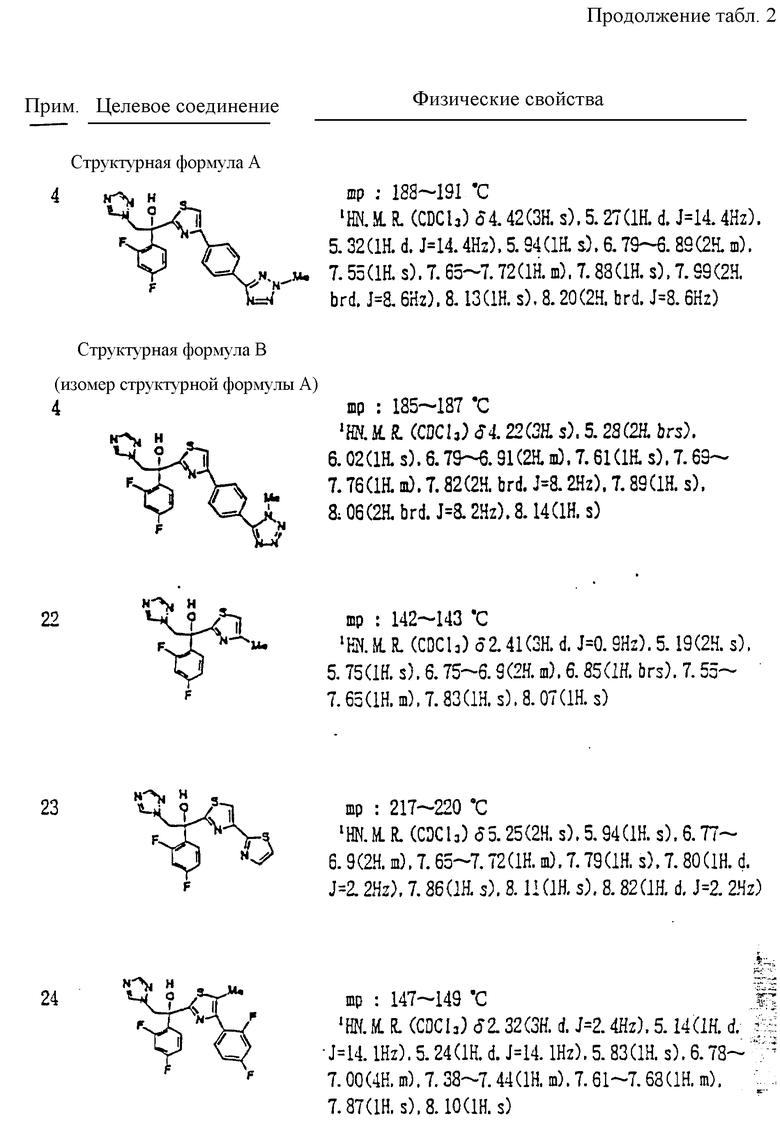
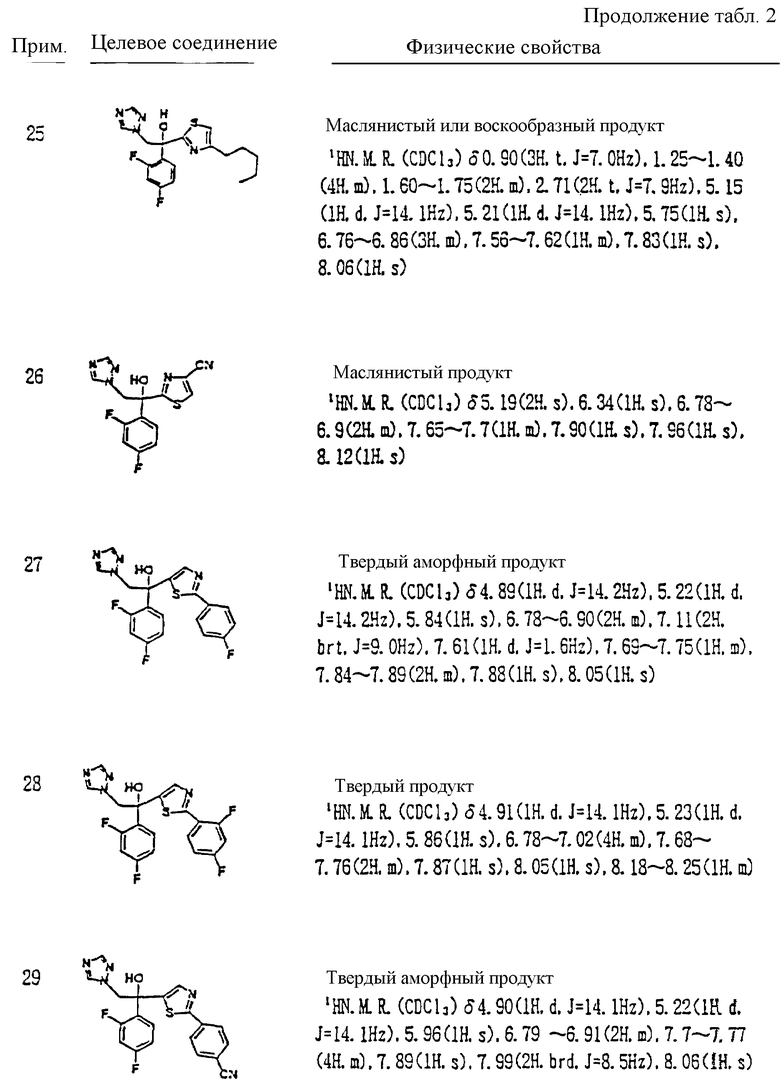
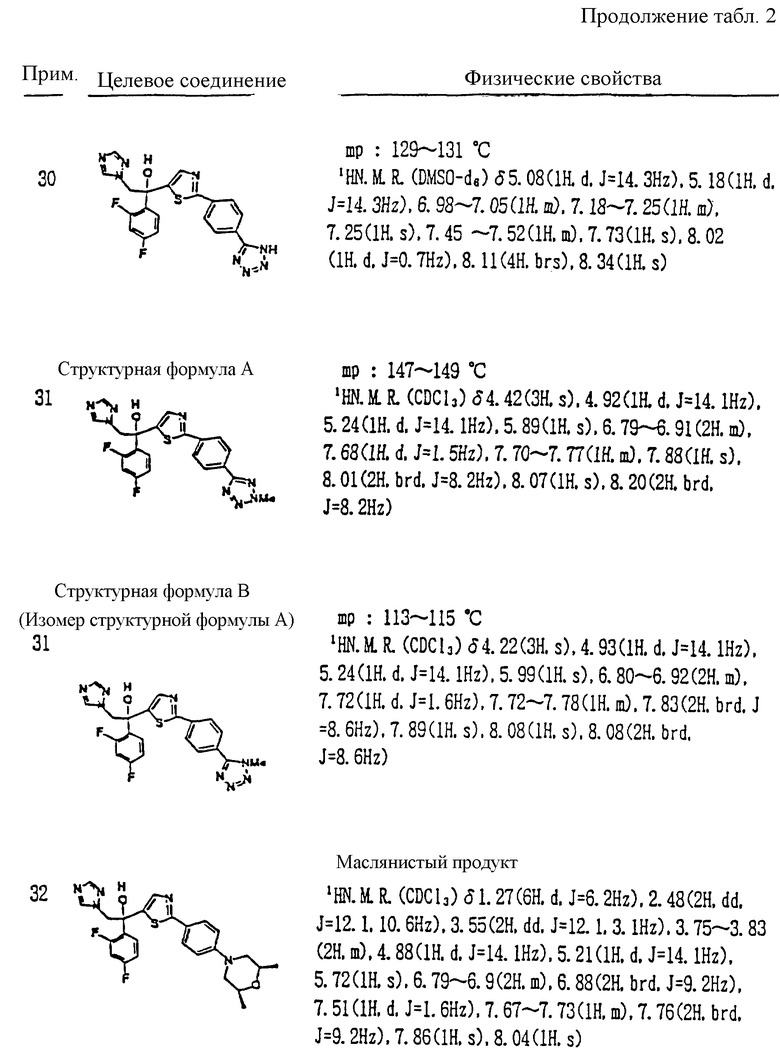
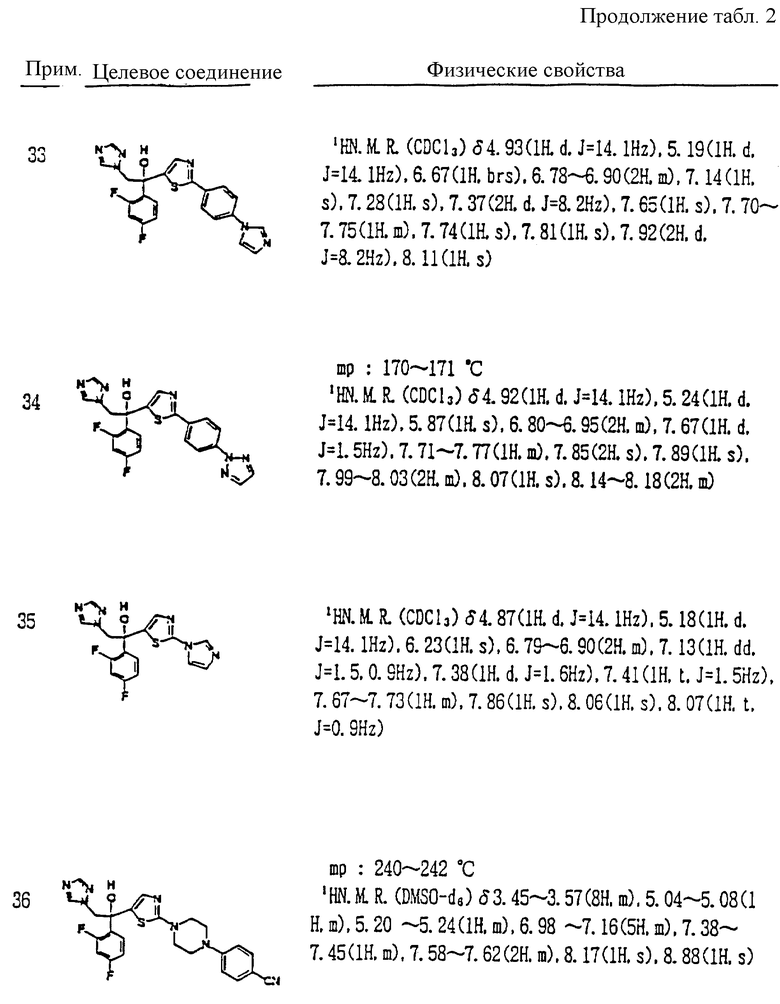

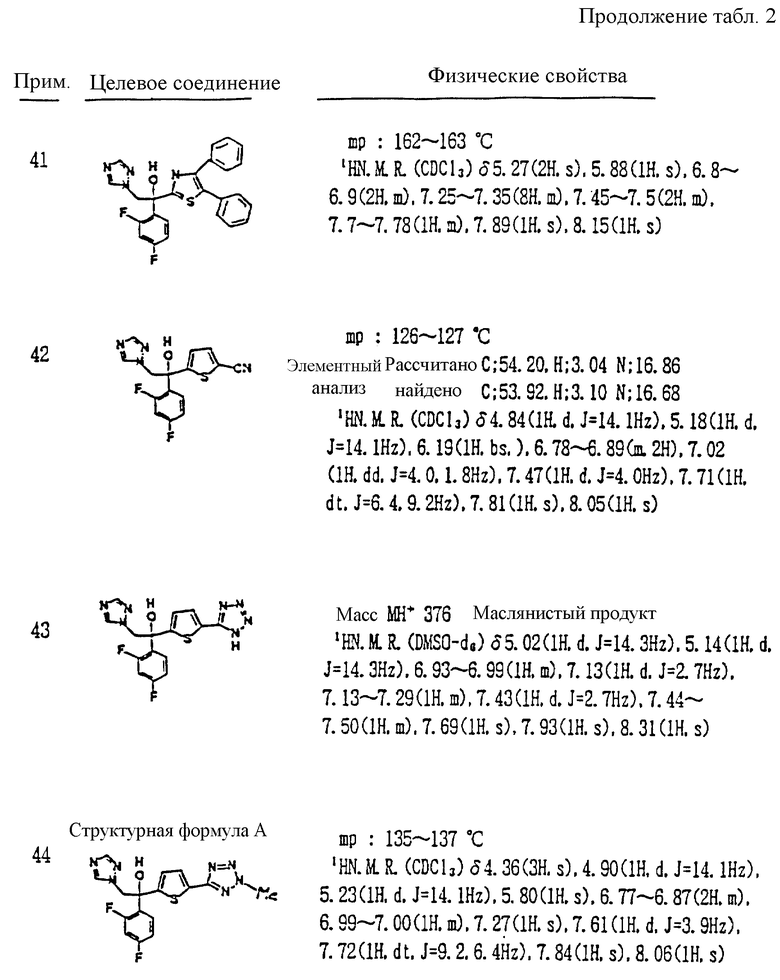
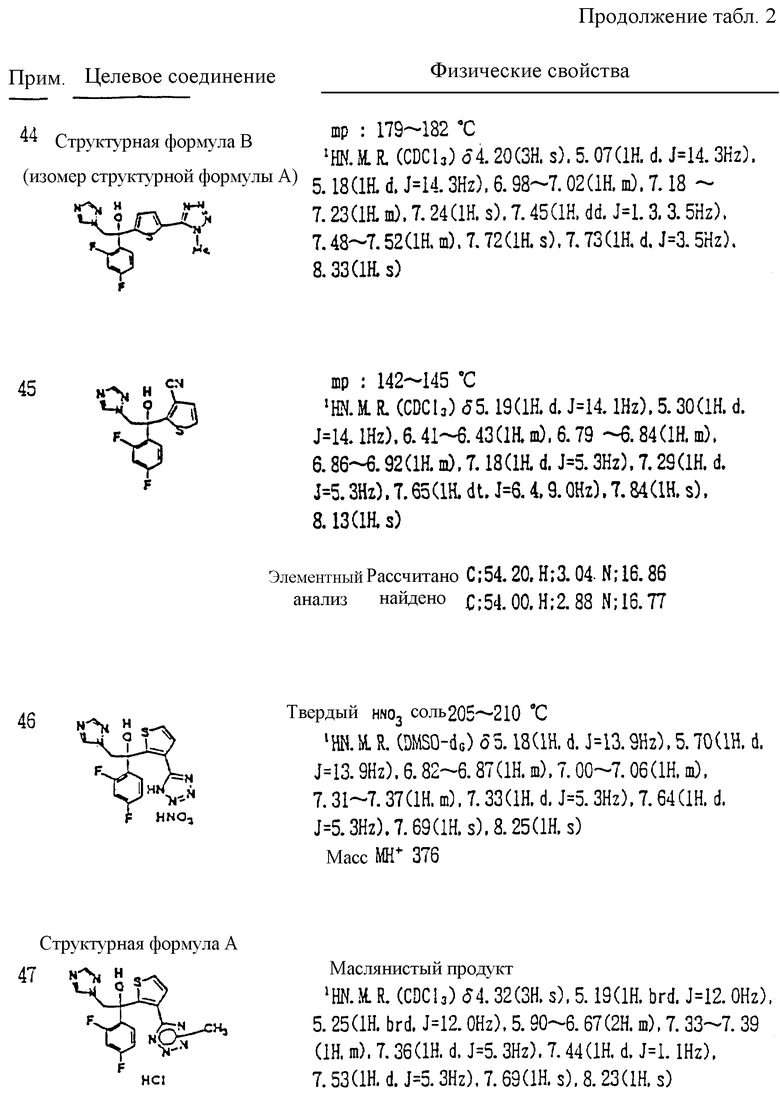
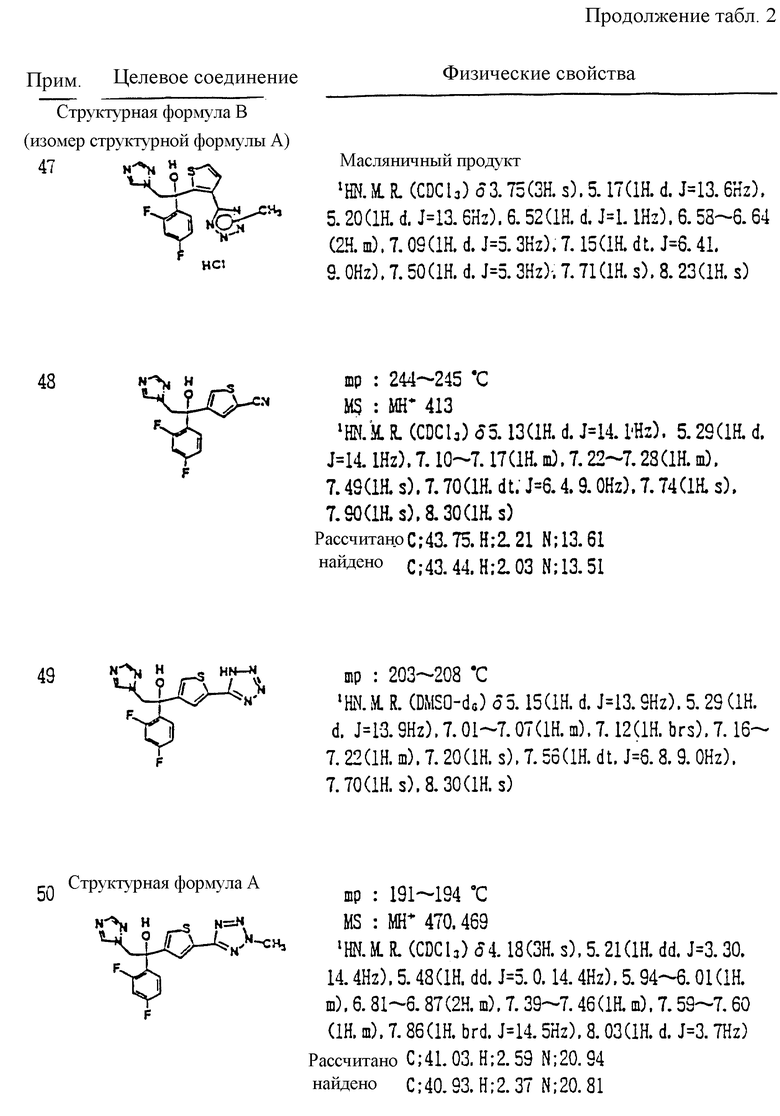
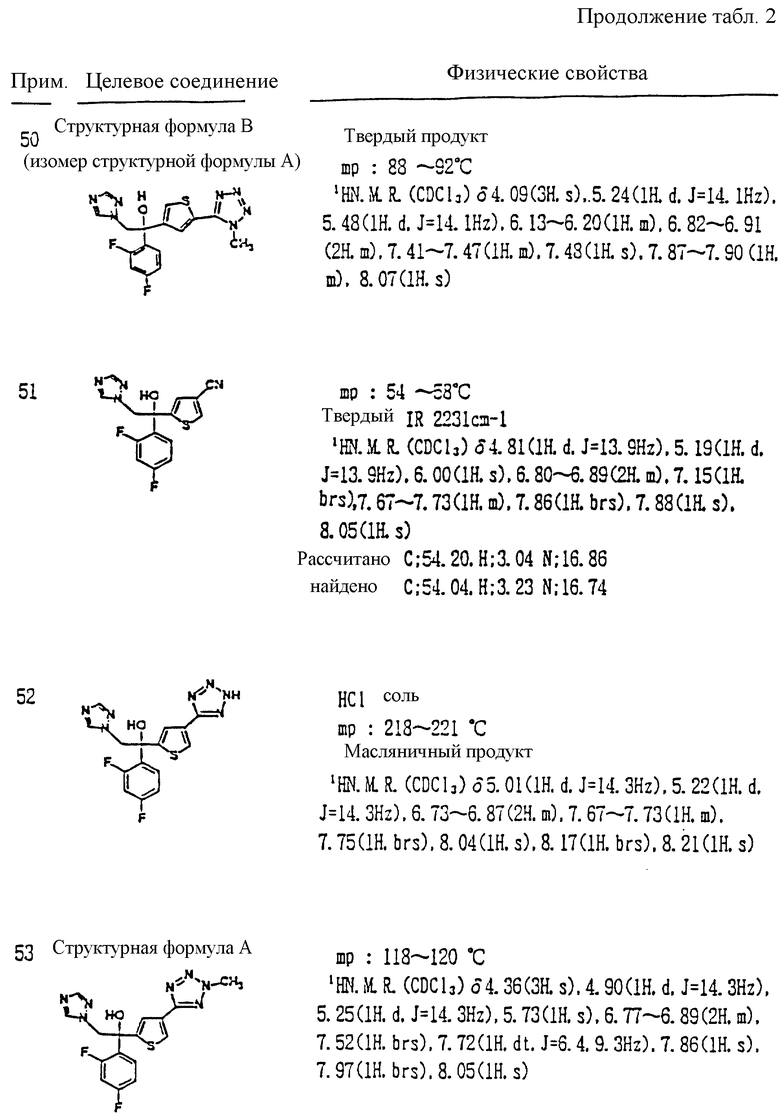
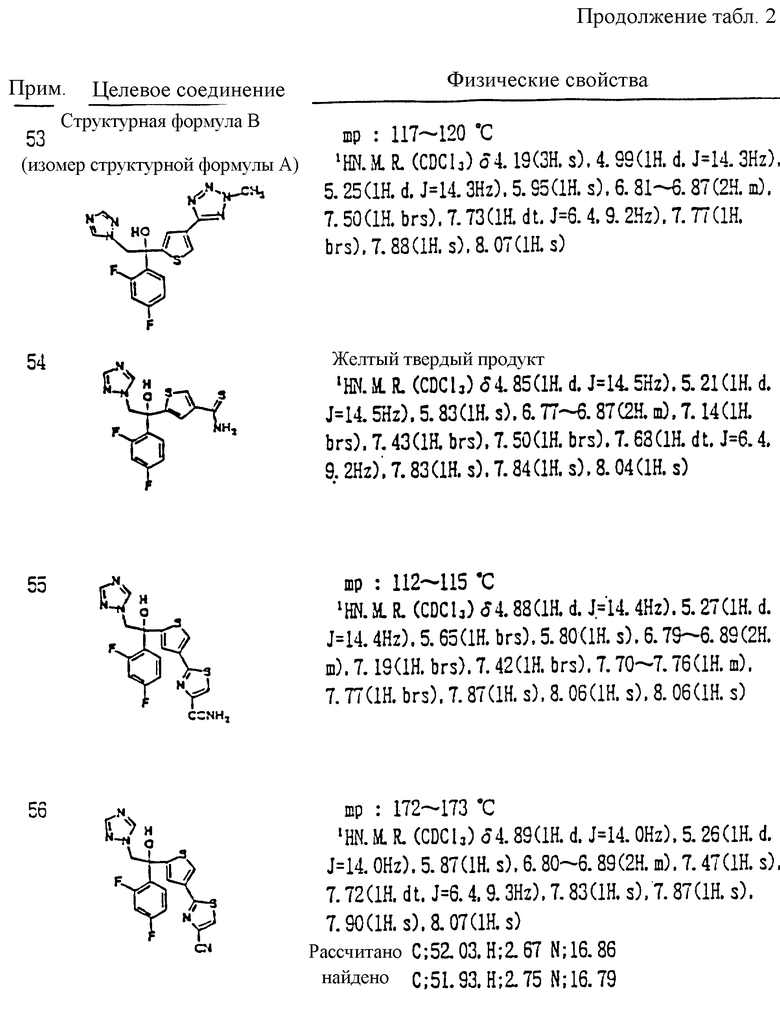
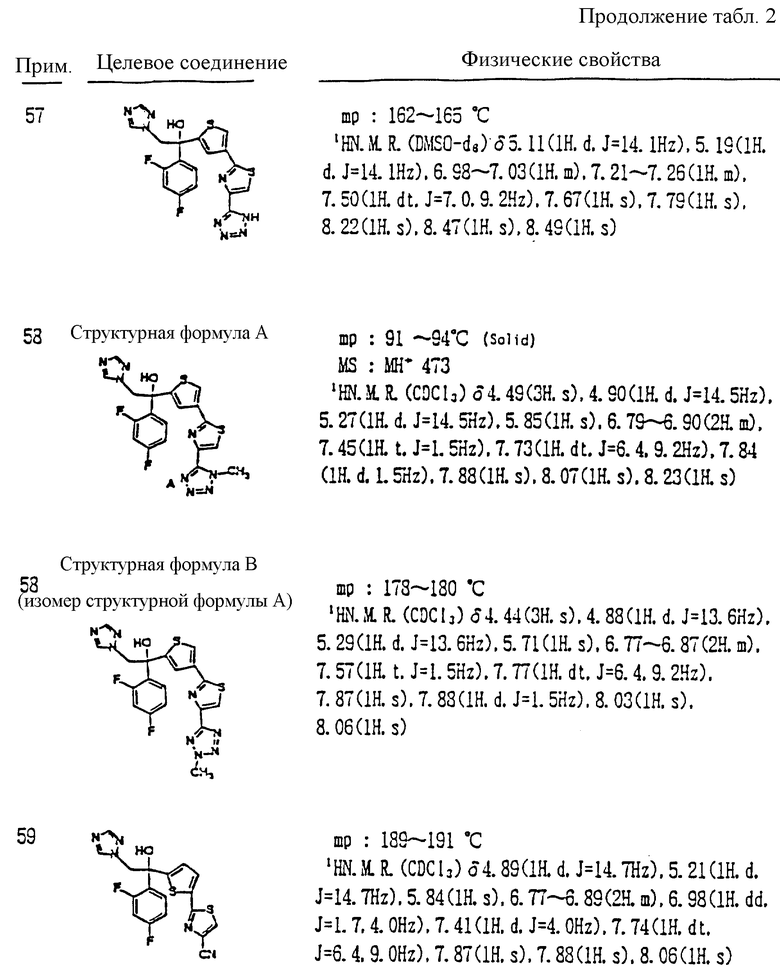
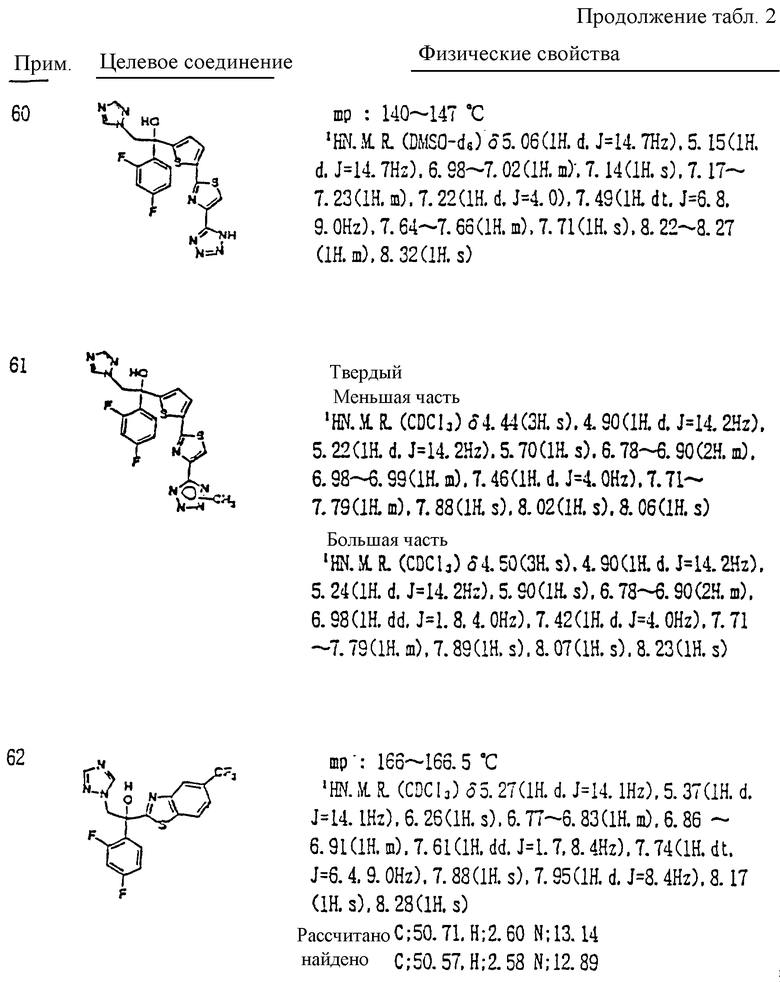
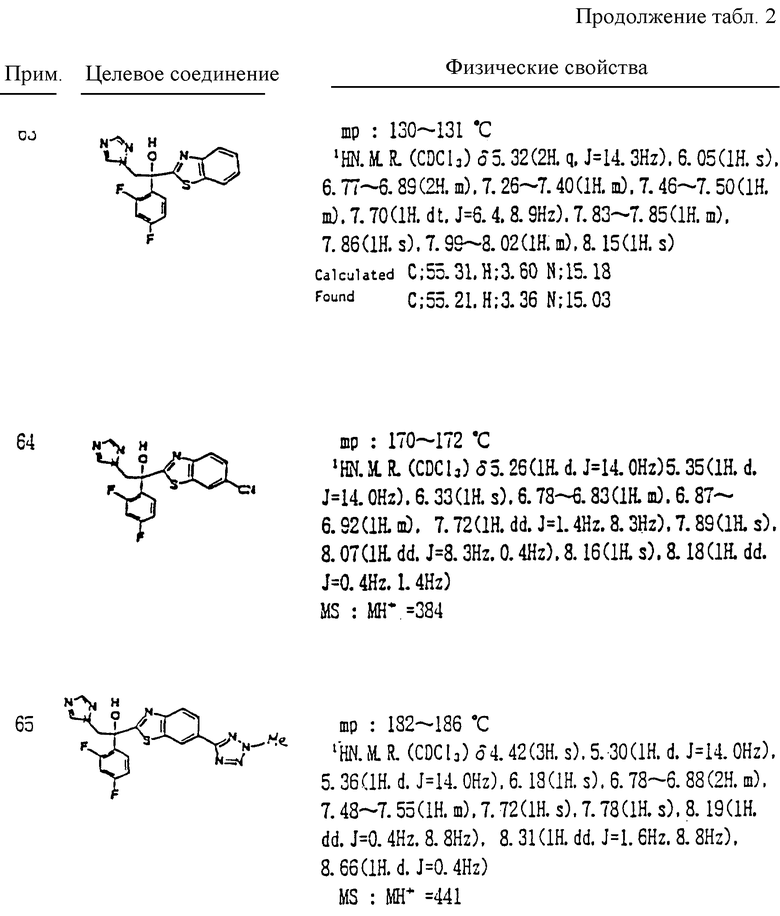
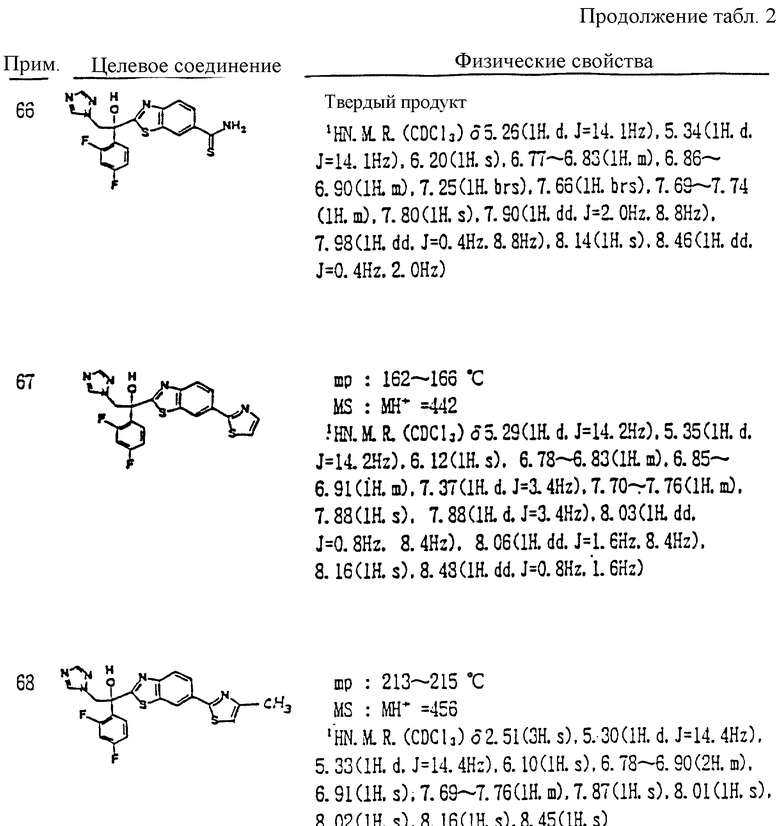
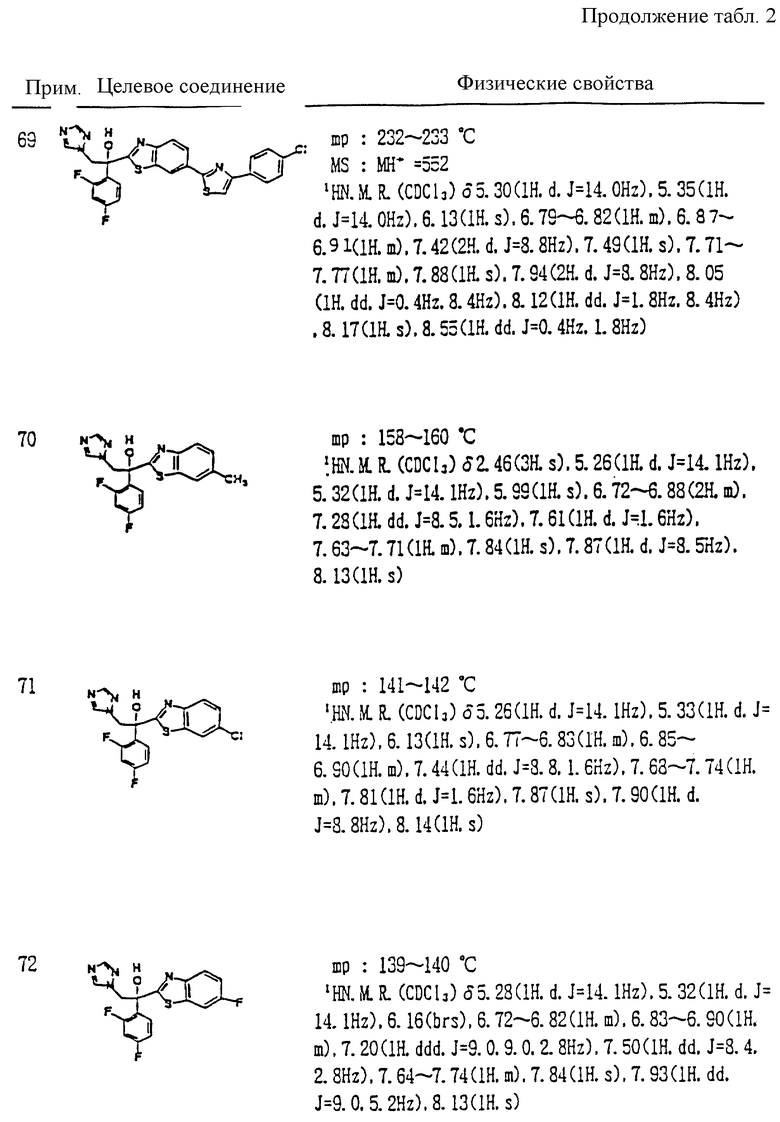
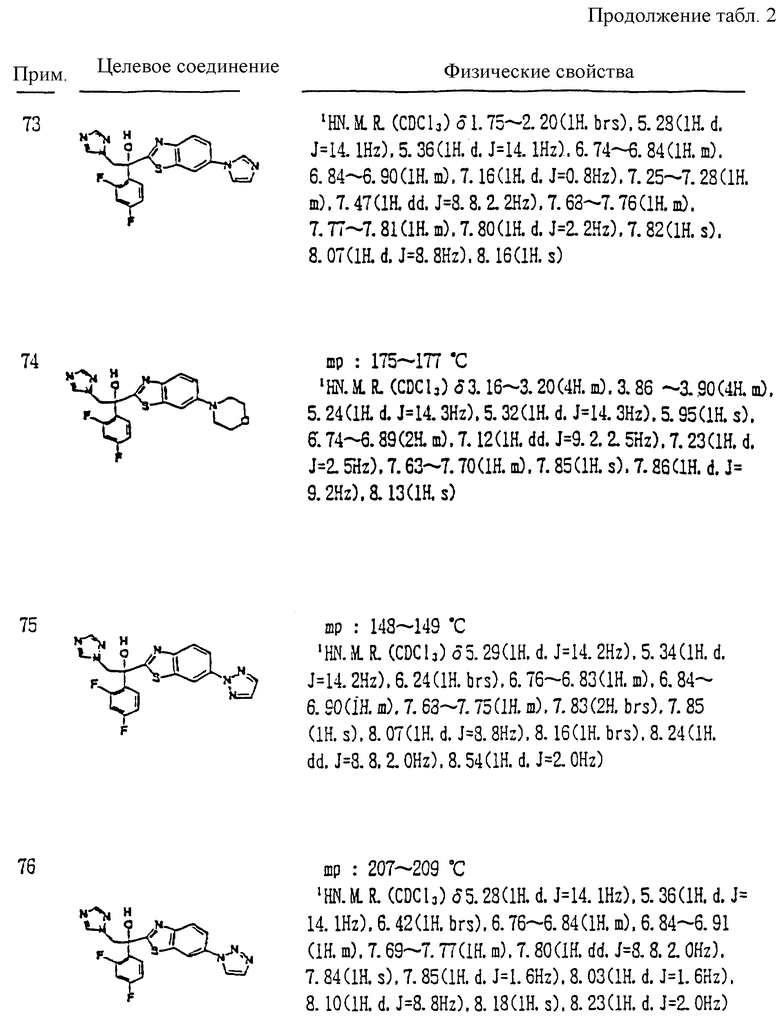
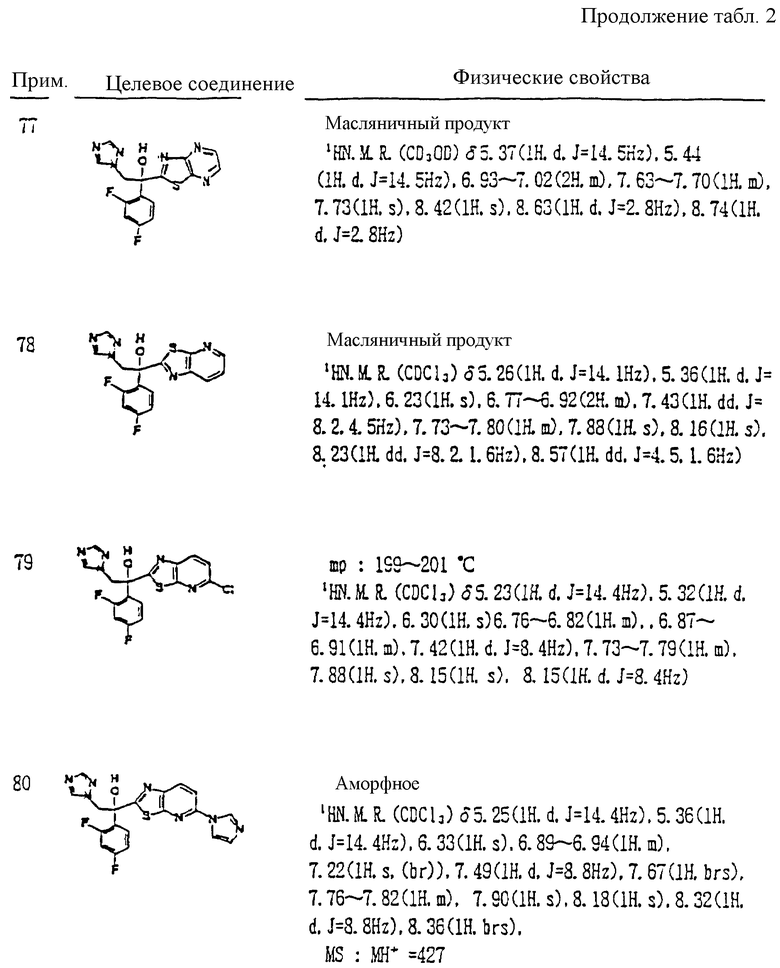
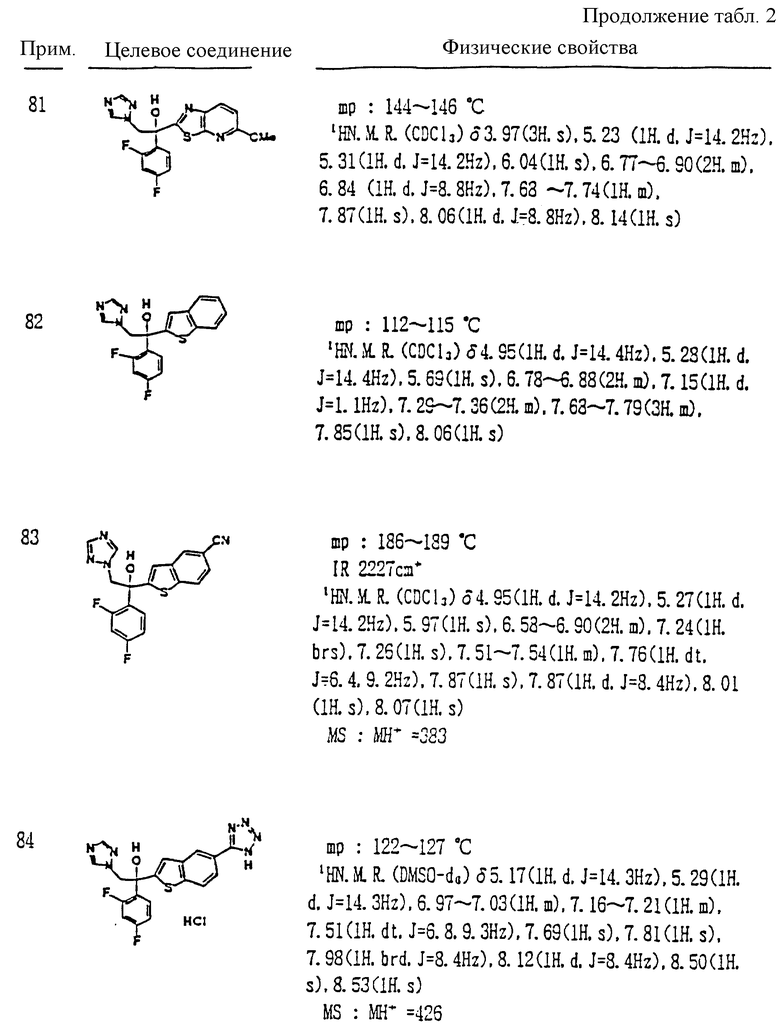
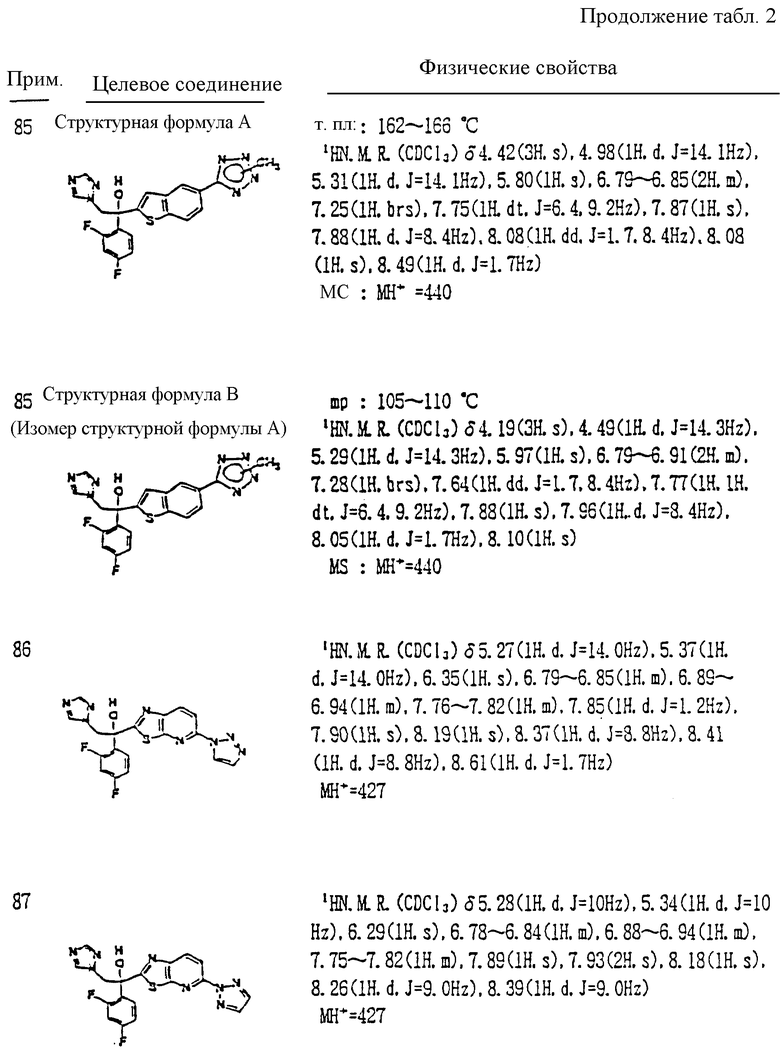
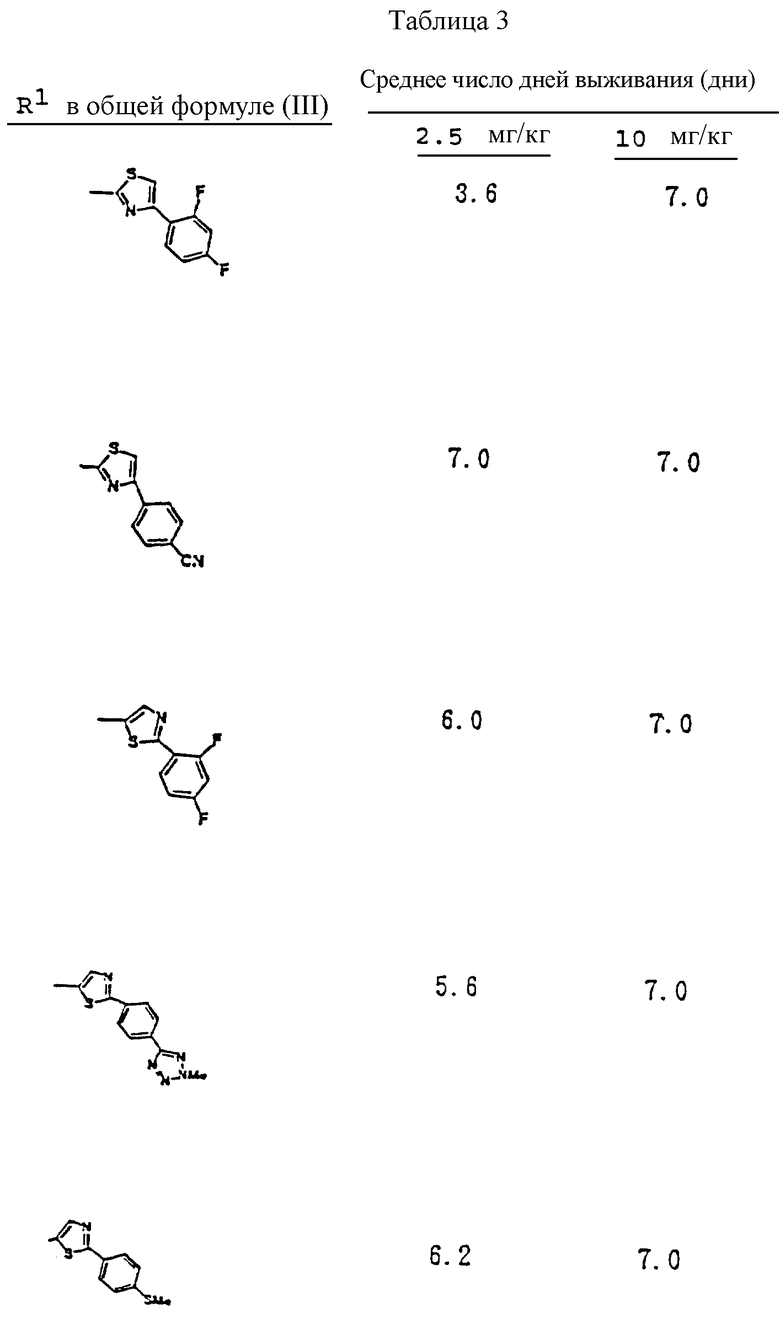
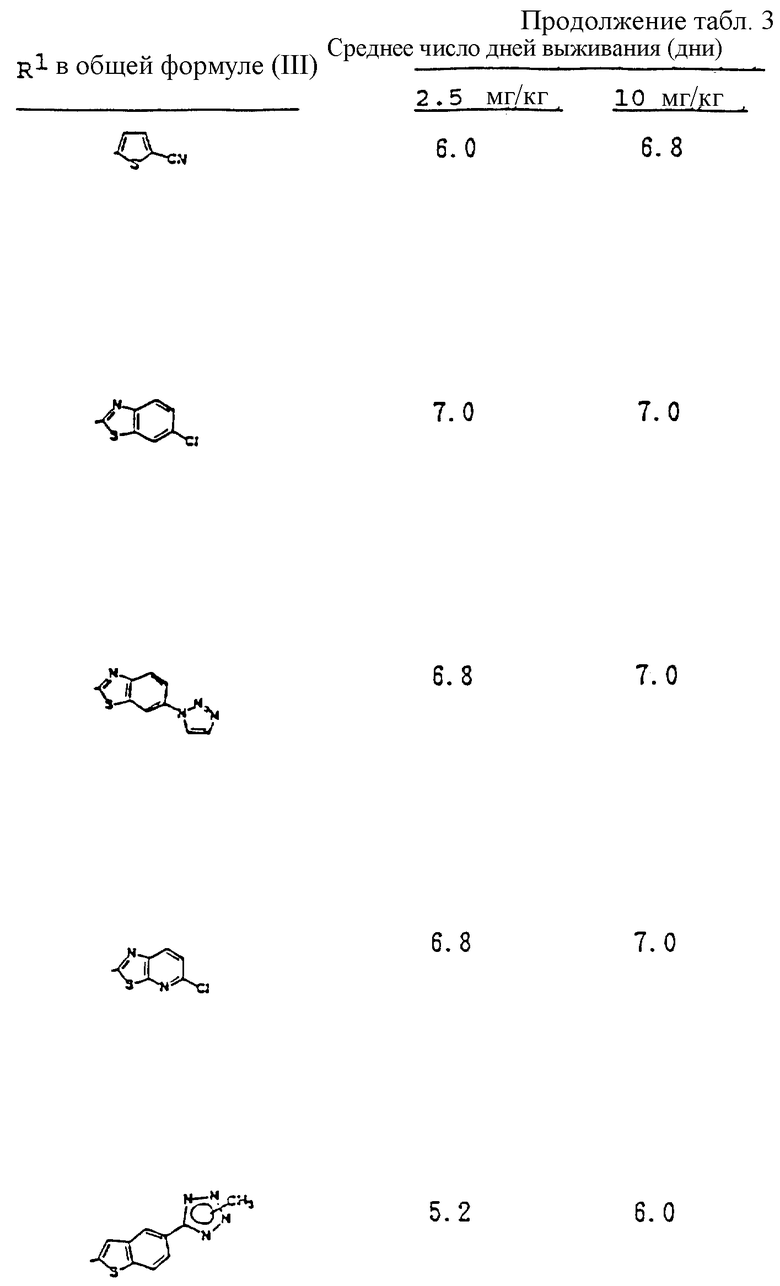
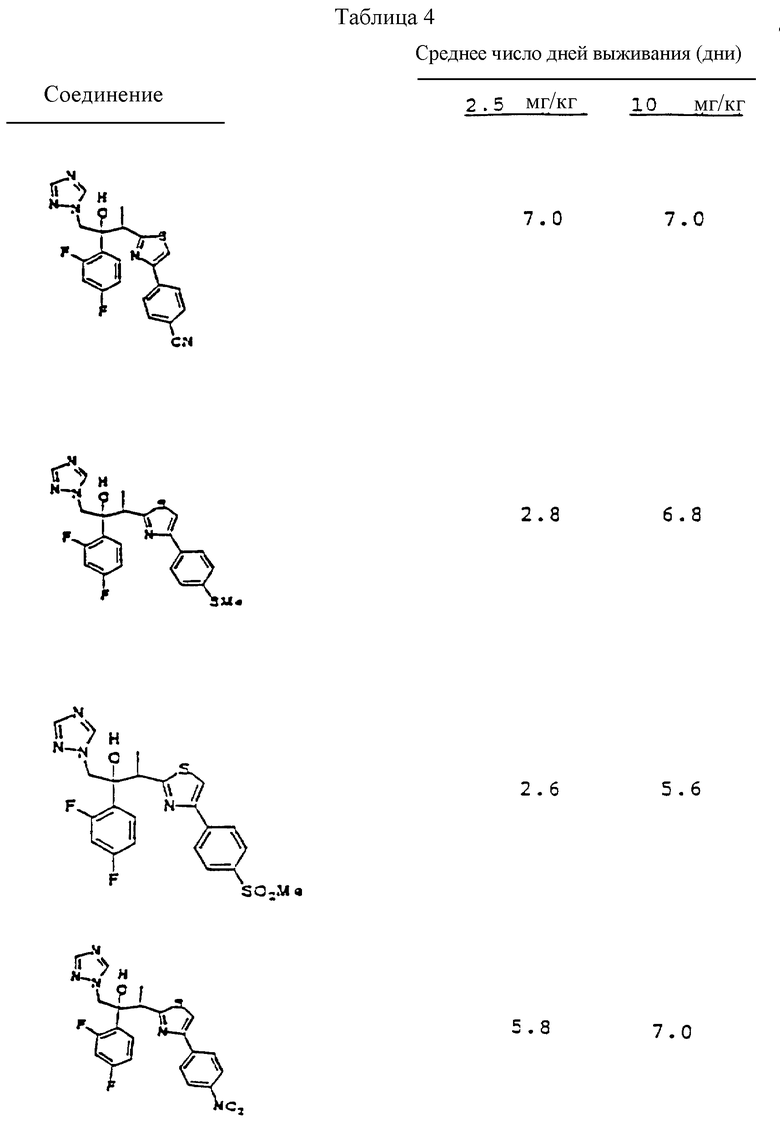
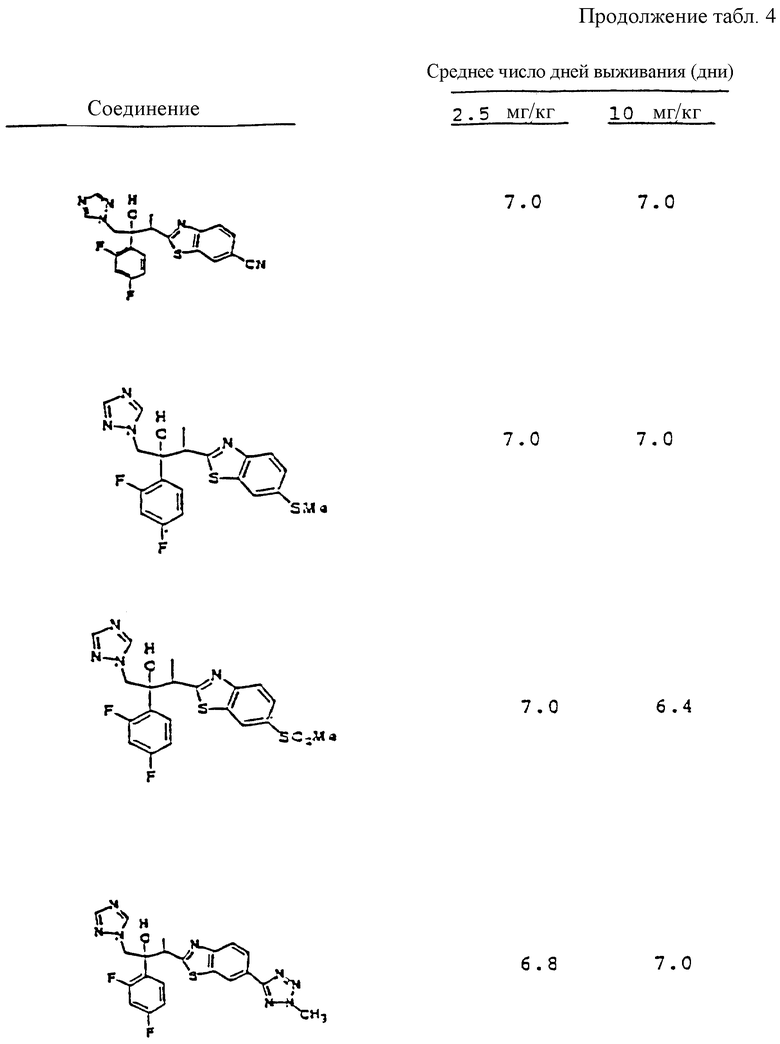
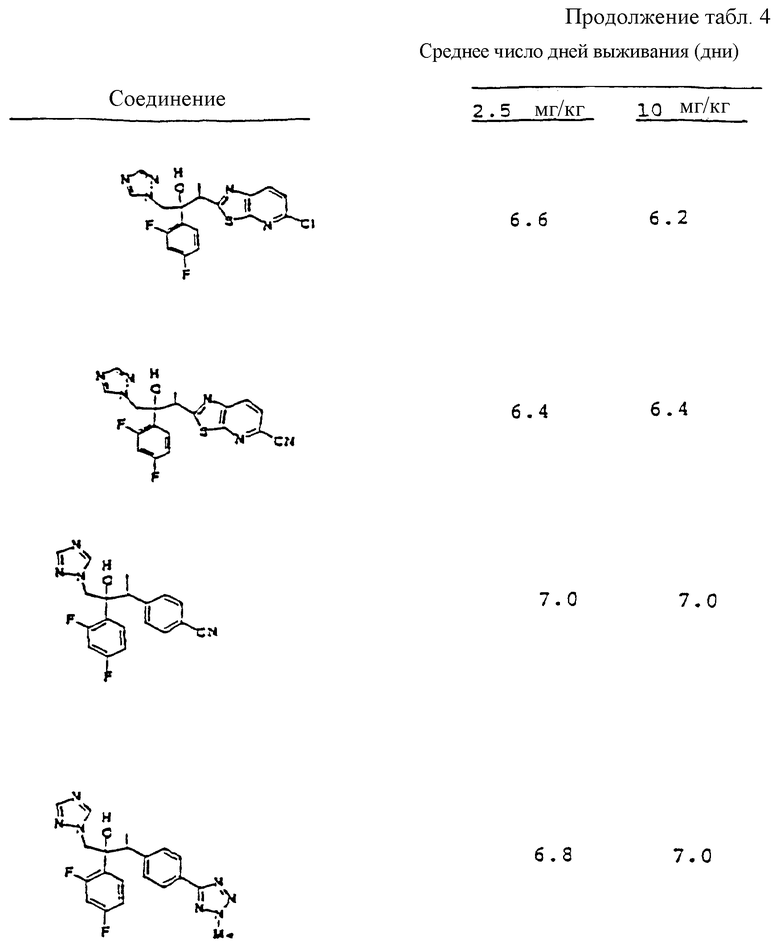
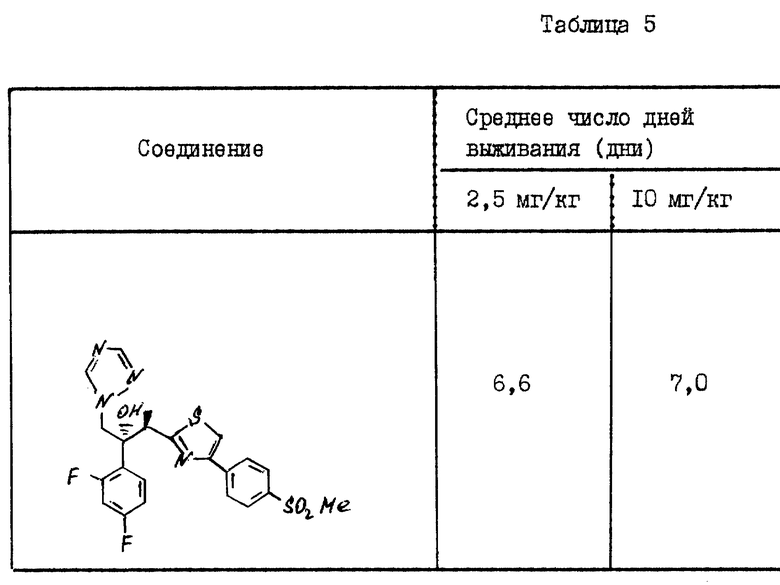
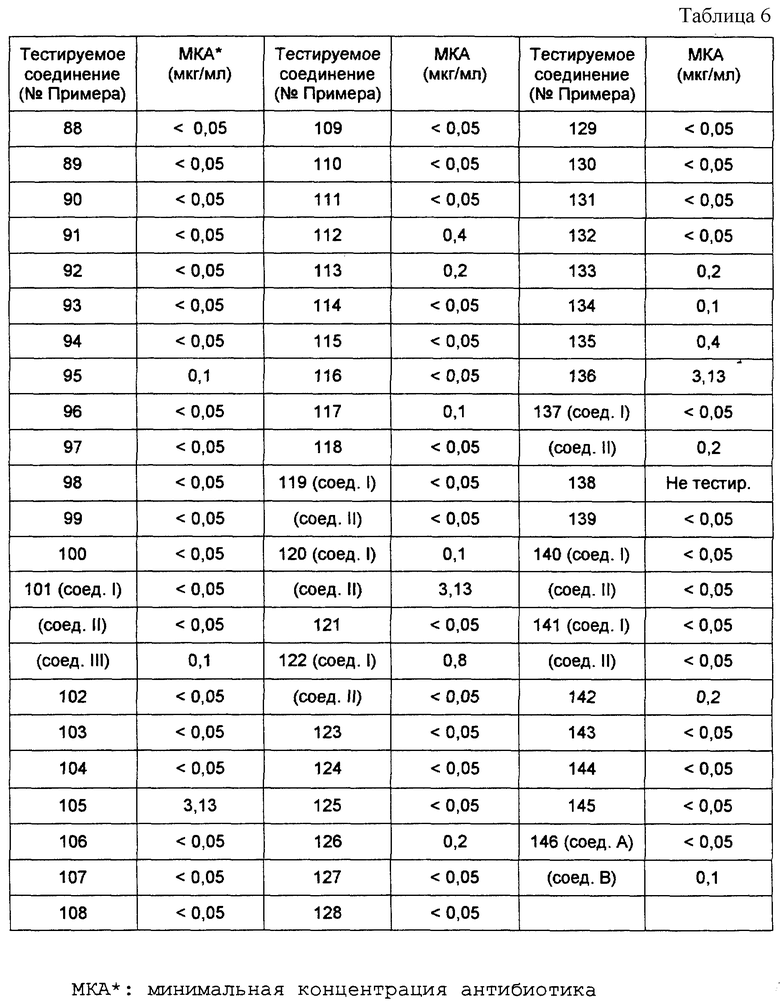
Описываются новые соединения азола общей формулы I, где значения А, R1 - R3, W, X, Y, Z, m указаны в п.1 формулы, которые проявляют противогрибковую активность и могут быть использованы при лечении дерматомикоза, висцеромикоза. Описывается также способ их получения, промежуточные соединения, а также фармацевтическая композиция, обладающая противогрибковой активностью. 26 с. и 5 з.п.ф-лы, 6 табл. 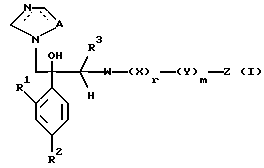
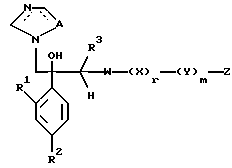
где R1 и R2 являются одинаковыми или различными и каждый представляет атом галогена или атом водорода;
R3 представляет атом водорода или низшую алкильную группу;
r и m могут быть одинаковыми или различными, каждый представляет 0 или 1;
A представляет N или CH;
W представляет фенил, оксазол, тиазол, или тиенил, или группу, представленную формулой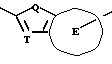
где Q представляет S или O;
T представляет =CH-, =N- или =N+O-;
кольцо E представляет 6-членное ароматическое кольцо, которое может содержать 1 или 2 атома азота;
где W может иметь один или более заместителей, выбранных из фенила, морфолинила или метила;
X представляет фенил, который может быть замещен фтором, тиазол или пиридин, алкандиильную группу, которая может быть замещена метилом, или алкендиильную группу;
Y представляет группу, выбранную из -S-,  ,
,  -O- или -(CH2)j-, где j равно целому числу от 1 до 4;
-O- или -(CH2)j-, где j равно целому числу от 1 до 4;
Z представляет атом водорода, атом галогена, галогенированную низшую алкильную группу, низшую алкоксильную группу, гидроксильную группу, нитрогруппу, цианогруппу, низшую алканоильную группу, фенильную группу, которая может иметь один или более заместителей, выбранных из фтора, хлора или 2,6-диметилморфолинила, имидазолильную группу, триазолильную группу, которая может быть замещена тиазолом, тетразолильную группу, которая может быть замещена метилом или аминогруппой, оксазолин, который может быть замещен метилом, за исключением случаев, когда W является тиазольным кольцом, R3 является метильной группой и Z является атомом водорода, когда r = m = 0, и когда W представляет фенил, R3 представляет водород; Z представляет водород, галоген, галогенированный низший алкил или низшую алкоксигруппу, когда r = m = 0,
или его соль.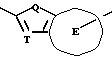
где Q представляет S или O;
T представляет =CH-, =N- или =N+-O-;
кольцо E представляет 6-членное ароматическое кольцо, которое может содержать 1 или 2 атома азота.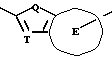
является группой, представленной следующими формулами:
4. Соединения азола, имеющие структурные формулы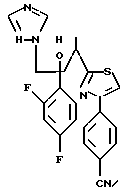
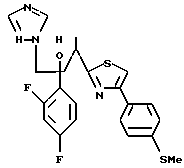
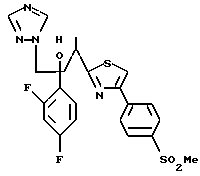
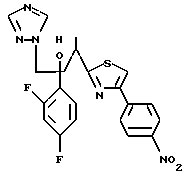
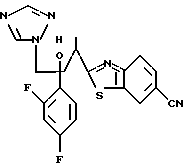
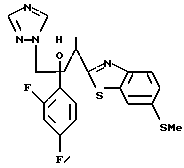

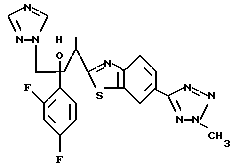
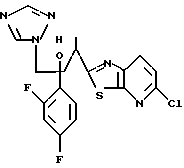
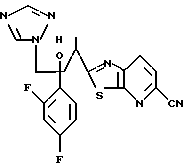
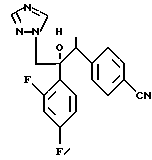
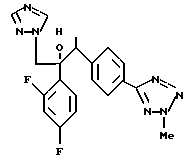
и их соли присоединения кислот.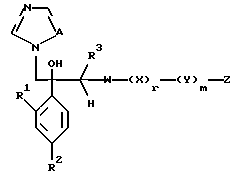
где W, A, R1, R2, R3, X, Y, Z, r и m определены в п.1,
или его соли присоединения кислоты, который включает взаимодействие соединения, представленного формулой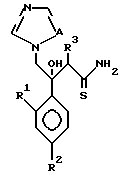
где A, R1, R2 и R3 определены выше,
с соединением, представленным формулой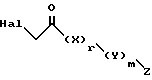
где Hal обозначает Br или Cl;
X, Y, Z, r и m определены выше.
где A, R1, R2, R3, X, Y, Z, r и m определены в п.1,
W представляет тиазол,
или его соли присоединения кислоты, который включает взаимодействие соединения, представленного формулой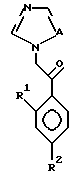
где A, R1 и R2 определены в п.1,
с соединением, представленным формулой
где D является группой формулы -W-(X)r-(Y)m-Z;
Z' является водородом или CH3.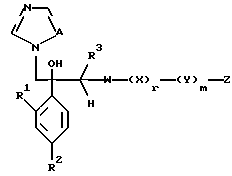
где W представляет тиазол;
A, R1, R2, R3, X, Y, Z, r и m определены в п.1,
или его соли присоединения кислоты, который включает взаимодействие соединения, представленного формулой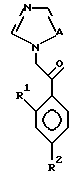
с соединением, представленным формулой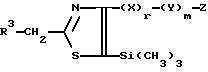
где R3, X, Y, Z, r и m определены выше.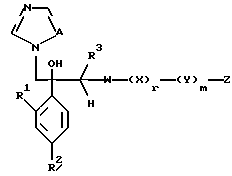
где A, R1, R2, R3, W, X, Y, Z, r и m определены в п.1,
или его соли присоединения кислоты, который включает взаимодействие соединения, представленного формулой
где A, R1, R2, R3, W, X, Y, Z, r и m определены выше,
с метахлорпербензойной кислотой и затем с натрий-1,2,4-триазолом или натрий-1,3-имидазолом.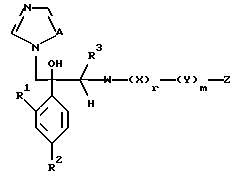
где R1 и R2 являются одинаковыми или различными и каждый представляет атом водорода или атом галогена;
R3 представляет атом водорода или низшую алкильную группу;
r и m могут быть одинаковыми или различными и каждый представляет 0 или 1;
A является N или CH;
W представляет фенил, оксазол, тиазол, или тиенил, или группу, представленную формулой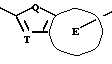
где Q представляет S или O;
T представляет =CH-, =N- или =N+O-;
кольцо E представляет 6-членное ароматическое кольцо, которое может содержать 1 или 2 атома азота;
W может иметь один или более заместителей, выбранных из фенила, морфолинила или метила;
X представляет фенил, который может быть замещен фтором, или тиазол, или пиридин, алкандиильную группу, которая может быть замещена метилом, или алкендиильную группу;
Y представляет группу, выбранную из -S-,  ,
,  -O-, или -(CH2)j-, где j равно целому числу от 1 до 4;
-O-, или -(CH2)j-, где j равно целому числу от 1 до 4;
Z представляет атом водорода, атом галогена, галогенированную низшую алкильную группу, низшую алкоксильную группу, гидроксильную группу, нитрогруппу, цианогруппу, низшую алканоильную группу, фенильную группу, которая может иметь один или более заместителей, выбранных из фтора, хлора или 2,6-диметилморфолинила, имидазолильную группу, триазолильную группу, которая может быть замещена тиазолом, тетразолильную группу, которая может быть замещена метилом или аминогруппой, оксазолин, который может быть замещен метилом, за исключением случаев, когда W является тиазольным кольцом, R3 является метильной группой и Z обозначает атом водорода, когда r = m = 0, когда W представляет фенил, R3 представляет атом водорода и Z представляет водород, галоген, галогенированную низшую алкильную группу или низшую алкоксигруппу, когда r = m = 0,
или его соль.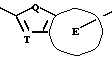
где Q представляет S или O;
T представляет =CH-, =N- или =N+O-;
кольцо E представляет 6-членное ароматическое кольцо, которое может содержать 1 или 2 атома азота;
W может иметь один или более заместителей, выбранных из фенила, морфолинила или метила.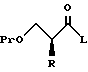
где R представляет низшую алкильную группу;
Pr представляет защитную группу для гидроксильной группы;
L представляет уходящую группу,
или его соли, который включает введение защиты для гидроксильной группы соединения, представленного общей формулой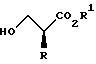
где R представляет группу, определенную выше;
R1 представляет атом водорода или защитную группу для карбоксильной группы,
путем введения защитной группы с получением соединения, представленного общей формулой 2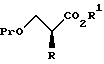
где R, R1 и Pr каждый представляют группы, определенные выше,
с последующим снятием защитной группы у карбоксильной группы соединения, представленного общей формулой 2, с получением соединения, представленного общей формулой 3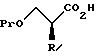
где R и Pr каждый представляет группы, определенные выше,
и, далее, взаимодействие соединения, представленного общей формулой 3 с соединением, представленным формулой
LH,
в котором L представляет группу, указанную выше.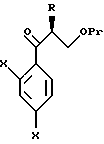
где R представляет низшую алкильную группу;
X являются одинаковыми или различными и каждый представляет атом водорода или галогена;
Pr представляет защитную группу для гидроксильной группы,
или его соли, который включает взаимодействие соединения, представленного общей формулой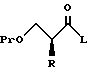
где R и Pr каждый представляют группы, определенные выше;
L представляет уходящую группу,
с соединением, представленным общей формулой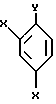
где X каждый представляет группы, определенные выше;
Y представляет хлор, бром или иод,
или его реакционноспособным производным.
где R представляет низшую алкильную группу;
X являются одинаковыми или различными и каждый представляет атом водорода или галоген;
Pr представляет защитную группу для гидроксильной группы,
или его соли, который включает взаимодействие соединения, представленного общей формулой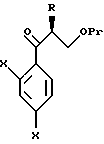
где R, X и Pr каждый представляют группы, определенные выше,
с трифенилфосфонийметилидом, производным от метилтрифенилфосфонийхлорида, метилтрифенилфосфонийбромида или метилтрифенилфосфонийиодида, или с триметилсилилметилмагнийхлоридом, триметилсилилметилмагнийбромидом или триметилсилилметиллитием.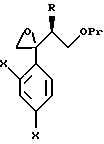
где R представляет низшую алкильную группу;
X являются одинаковыми или различными и каждый представляет атом водорода или галогена;
Pr представляет защитную группу для гидроксильной группы,
или его соли, который включает взаимодействие соединения, представленного общей формулой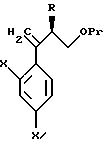
где R, X и Pr каждый представляют группы, определенные выше,
с пероксикислотой.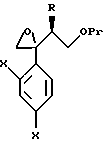
где R представляет низшую алкильную группу;
X являются одинаковыми или различными и каждый представляет атом водорода или галогена;
Pr представляет защитную группу для гидроксильной группы,
или его соли, который включает взаимодействие соединения, представленного общей формулой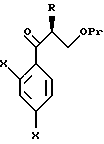
где R, X и Pr каждый представляет группы, определенные выше,
с хлорметиллитием, полученным из хлориодметана или бромхлорметана, или с диметилсульфоксоний метилидом, диметилсульфоний метилидом, диэтилсульфоксоний метилидом или диэтилсульфоний метилидом.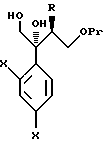
где R представляет низшую алкильную группу;
X являются одинаковыми или различными и каждый представляет атом водорода или галогена;
Pr представляет защитную группу для гидроксильной группы,
или его соли, который включает взаимодействие соединения, представленного общей формулой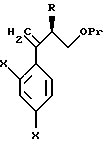
где R, X и Pr каждый представляет группы, определенные выше,
с окисляющим агентом.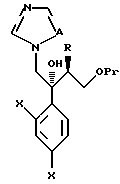
где R представляет низшую алкильную группу;
X являются одинаковыми или различными и каждый представляет атом водорода или галогена;
Pr представляет защитную группу для гидроксильной группы,
A представляет CH или атом азота,
или его соли, который включает взаимодействие соединения, представленного общей формулой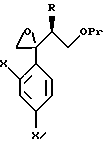
где R, X и Pr каждый представляет группы, определенные выше,
с 1,2,4-триазолом, или имидазолом, или его солью.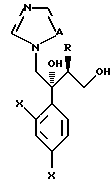
где R представляет низшую алкильную группу;
X являются одинаковыми или различными и каждый представляет атом водорода или галогена;
A представляет CH или атом азота,
или его соли, который включает снятие Pr, который является защитной группой для гидроксильной группы у соединения, представленного общей формулой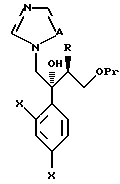
где R, X и A каждый представляет группы, определенные выше;
Pr является защитной группой для гидроксильной группы.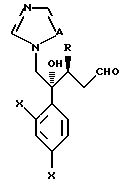
где R представляет низшую алкильную группу;
X являются одинаковыми или различными и каждый представляет атом водорода или галогена;
A представляет CH или атом азота,
или его соли, который включает взаимодействие соединения, представленного общей формулой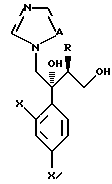
где R, X и A каждый представляет группы, определенные выше;
с окисляющим агентом.
где R представляет низшую алкильную группу;
X являются одинаковыми или различными и каждый представляет атом водорода или галогена;
A представляет атом азота или CH,
или его соли, который включает взаимодействие соединения, представленного общей формулой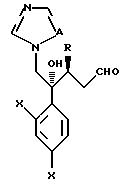
где R, X и A каждый представляет группы, определенные выше;
с производным гидроксиламина.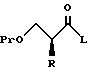
где R представляет низшую алкильную группу;
Pr представляет защитную группу для гидроксильной группы;
L представляет уходящую группу,
или его соль.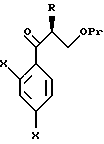
где R представляет низшую алкильную группу;
X являются одинаковыми или различными и каждый представляет атом водорода или галогена;
Pr представляет защитную группу для гидроксильной группы;
Q представляет атом кислорода или CH2,
или его соль.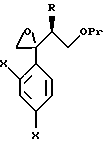
где R представляет низшую алкильную группу;
X являются одинаковыми или различными и каждый представляет атом водорода или галогена;
Pr представляет защитную группу для гидроксильной группы,
или его соль.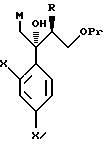
где R представляет низшую алкильную группу;
X являются одинаковыми или различными и каждый представляет атом водорода или галогена;
Pr представляет защитную группу для гидроксильной группы;
M представляет гидроксильную группу,
или его соль.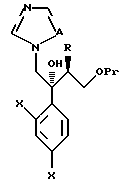
где R представляет низшую алкильную группу;
X являются одинаковыми или различными и каждый представляет атом водорода или галогена;
Pr представляет защитную группу для гидроксильной группы;
A представляет CH или атом азота,
или его соль.
Приоритеты по пунктам:
07.02.94 по пп.1 - 3;
05.07.94 по пп.4 - 6;
10.08.94 по п.7;
09.12.94 по пп.16 - 31.
| Способ получения производных триазола | 1984 |
|
SU1251802A3 |
| ИОННОЕ РЕЛЕ | 1935 |
|
SU44605A1 |
| DE 2920374 OS, 1984 | |||
| Подшипник для червячного транспортера | 1935 |
|
SU47594A1 |
Авторы
Даты
1999-12-20—Публикация
1995-02-06—Подача