Настоящее изобретение касается биологического материала, обладающего мужской стерильностью, который используется для разработки гибридных разновидностей культур сельскохозяйственного значения.
Она касается, в частности, растения, принадлежащего семейству крестоцветных, в которых цитоплазма клеток содержит органеллы, имеющие такую нуклеотидную последовательность, которая сообщает мужскую стерильность и высокие агрономические характеристики.
Разработка гибридных разновидностей может быть ускорена или возможна в результате использования цитоплазмовой системы мужской стерильности. Гибриды получаются путем перекрестного оплодотворения двух родственных популяций, одна из которых выполняет мужскую роль, а другая - женскую. Одним из препятствий, которые имеют место, когда желательно получить гибридные разновидности одинакового качества при половом скрещивании самооплодотворяющихся видов, является способность растения к самоопылению. Системы мужской стерильности обеспечивают возможность получения женских растений, которые не способны к самооплодотворению и от которых после опыления могут быть непосредственно взяты семена, которые все являются гидридами, без применения трудоемких приемов, таких как кастрация цветов.
Генетические детерминанты мужской стерильности включают такие, которые несет цитоплазма. В каждой продуцируемой половым путем генерации они переносятся исключительно матерью. Таким образом, в каждом гене генерации получается 100% потомства мужской стерильности и системой цитоплазмовой мужской стерильности (CMS). Эти генетические детерминанты переносятся геномом митохондрии.
Подходящая цитоплазмовая система мужской стерильности в крестоцветных определяется следующими характеристиками:
1. Мужская стерильность должна быть полной, то есть не должно быть опыленного продукта независимо от условий культивации независимо от линии, которая желательна для использования в качестве женского родителя. Когда этого условия нет, семена, собранные с этих женских растений, будут происходить частично от самооплодотворения и, следовательно, они не будут семенами гибридного типа F1.
2) Получение этих семян следует осуществлять, используя преимущество естественных опыленных векторов, то есть в случае данных видов, опыляемых с помощью перепончатокрылых, двукрылых и оплодотворяемых пыльцой, переносимой ветром. Пыльца должна переноситься от опыляющих растений к стерильным мужским (женским) растениям. Практически в семействе крестоцветных такой перенос могут осуществлять лишь насекомые.
Женские растения, таким образом, должны быть достаточно привлекательны для насекомых, которые прилетают к ним и собирают нектар. Морфология цветов должна быть такой, чтобы насекомые выполняли эту задачу через верхушку цветка так, чтобы их грудка контактировала с рыльцем пестика. Практически это приводит к такой ситуации, при которой основание лепестков должно образовывать определенный тип трубочки вокруг основания пестика.
3) Морфология женских органов (пестик) должна быть идентична морфологии фертильного растения, особенно растения с одним лепестком в цветке, и быть прямолинейной по форме. Мужские стерильности очень часто приводят также к феминизации пыльника, которые трансформируются в псевдопестики, и даже к трансформации нектаринов в полные цветки. Иногда образуемые таким путем пестик или пестики также деформируются. Все эти отклонения от нормы не позволяют получать хорошие семена и это может рассматриваться как эkbивалент некоторой степени женской стерильности.
4) Для получения гибридных разновидностей F1 в тех видах, от которых собираются семена, таких как рапс или горчица, важно, чтобы мужской родитель гибрида полностью исключал эффект мужской стерильной цитоплазмы, так чтобы гибридные растения легко опылялись.
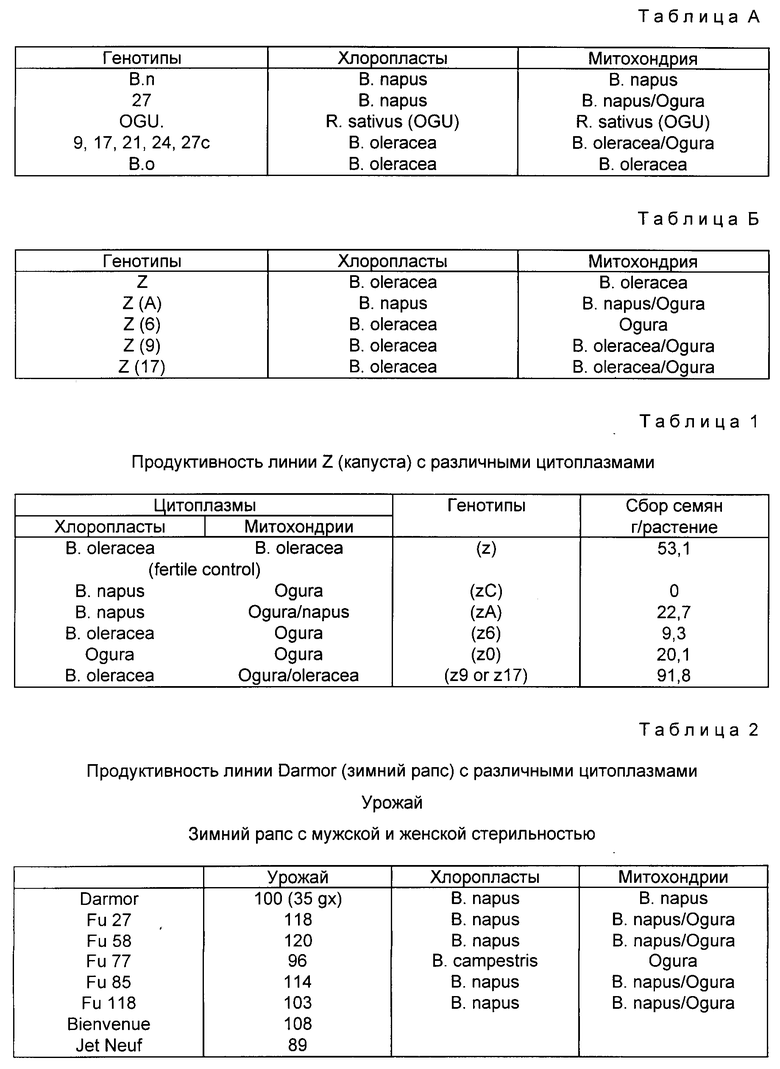
Первый случай мужской стерильной цитоплазмы или CMS в семействе крестоцветных был описан Ogura (1968 г. ) в редьке Raphanus sativus. Bannerot (1974, 1977) перенес цитоплазму Ogura в Brassica, получая таким образом растения, обладающие цитоплазмовой мужской стерильностью. Эти же самые растения не обладают требуемыми агрономическими характеристиками (хлороз при понижении температур, слабая женская фертильность), что приводит в результате к низкой урожайности, ввиду чего они непригодны для коммерческого использования.
Для устранения хлороза в растениях крестоцветных ядерные и хлоропластовые геномы одного и того же рода должны быть объединены в одной и той же клетке. Так, растения вида Brassica, имеющие один из хлоропластовых геномов Brassica, уже больше не проявляют хлороз. Если они имеют полный митохондрический геном Ogura, то они проявляют полную цитоплазмовую мужскую стерильность, но, однако, цветы будут иметь отклоняющуюся от нормы морфологию, что делает невозможным для них опыление естественными векторами.
Кроме того, для тех видов, к семенам которых проявляется интерес, очень важно восстановить мужскую фертильность гибридных видов, которые маркетируются посредством ядерных генов, известных как гены-восстановители.
Трудно восстановить мужскую фертильность растения, имеющего всю полноту митохондрического генома Ogura, поскольку необходимо одновременное участие нескольких генов восстановителей.
Авторы провели работу с целью получения подходящей системы мужской стерильности путем удаления генов ответственных за нежелаемые характеристики цитоплазмы Ogura с сохранением мужской стерильности, которая эффективна и легко восстанавливается.
Таким образом, настоящее изобретение касается последовательности ДНК, которая далее будет рассматриваться как последовательность ДНК со стерильностью Ogura, которая отличается тем, что:
a) ее переносит последовательность ДНК, связанная нуклеотидами 928 и 2273, как показано на фиг. 1-9, или
b) она по меньшей мере на 50% гомологична указанной последовательности, упомянутой в а).
и в случае, когда она присутствует в митохондриальном геноме растения, она придает цитоплазмовую мужскую стерильность указанному растению.
В частности, объектом данного изобретения является последовательность ДНК со стерильностью Ogura, отличающаяся тем, что:
c) представляет последовательность между нуклеотидами 928 и 1569, как показано на фиг. 1-9, или
d) по меньшей мере на 50% гомологична указанной последовательности в c),
причем транскрибируется в РНК в митохондриях растений с мужской стерильностью.
Далее указываются сопровождающие описание рисунки:
Фиг. 1-9: Нуклеотидная последовательность митохондриального фрагмента ДНК редьки Ogura, несущая признак CMS.
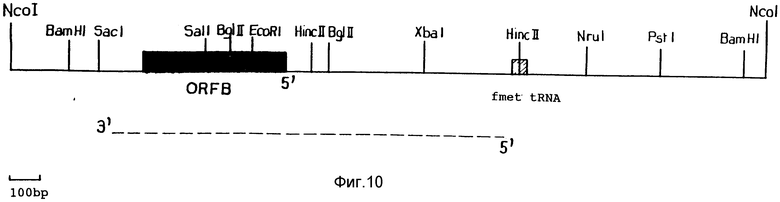
Фиг. 10: Рестрикционная карта митохондриального фрагмента ДНК, описанного на фиг. 1-9.
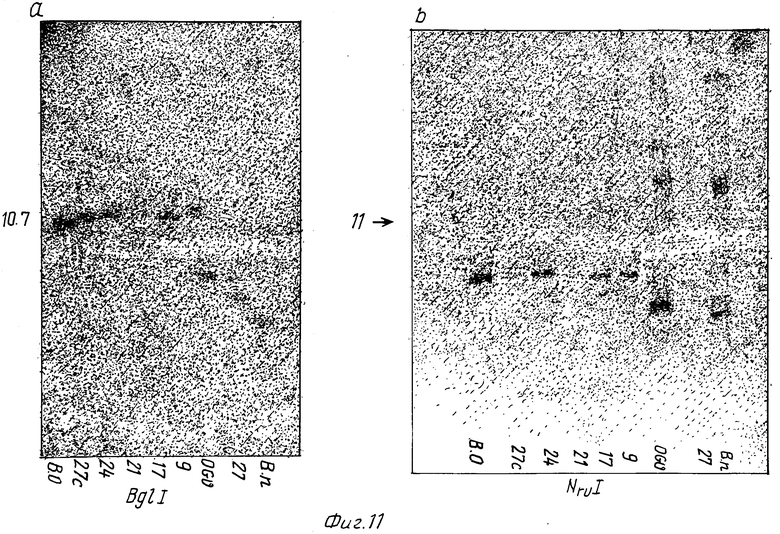
Фиг. 11: Электрофорез митохондриальной ДНК после расщепления BglI (3a) и NruI (3b). Обнаруженные полосы соответствуют гибридизации с пробой CoxI (Hiesel и др., 1987).
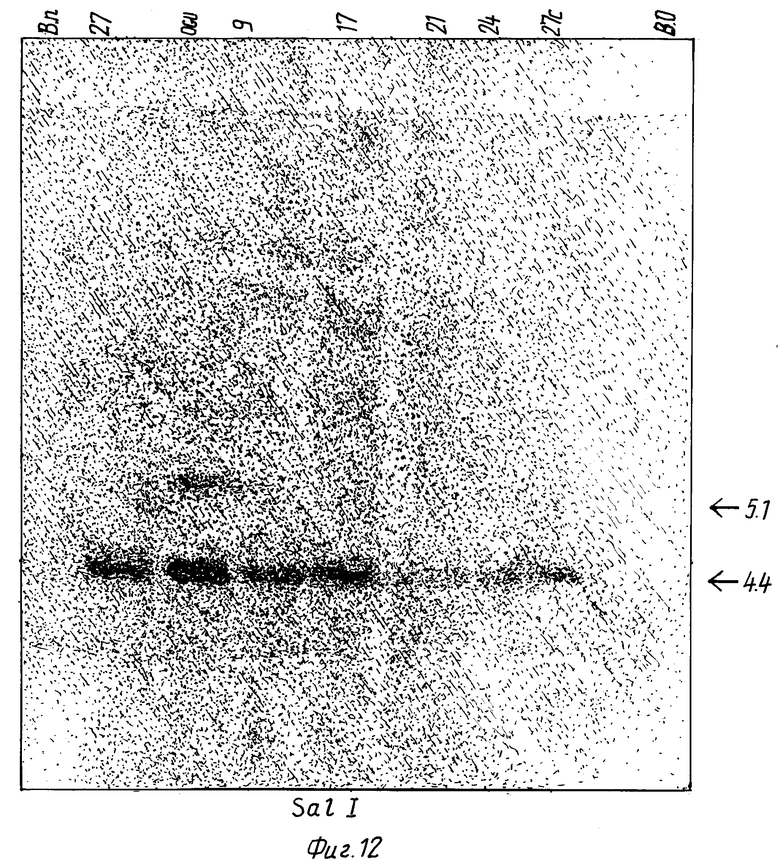
Фиг. 12: Электрофорез митохондриальной ДНК после расщепления SalI.
Обнаруженные полосы соответствуют гибридизации с пробой, содержащей последовательность между нуклеотидами NN 389 и 1199 последовательности, описанной на фиг. 1-9.
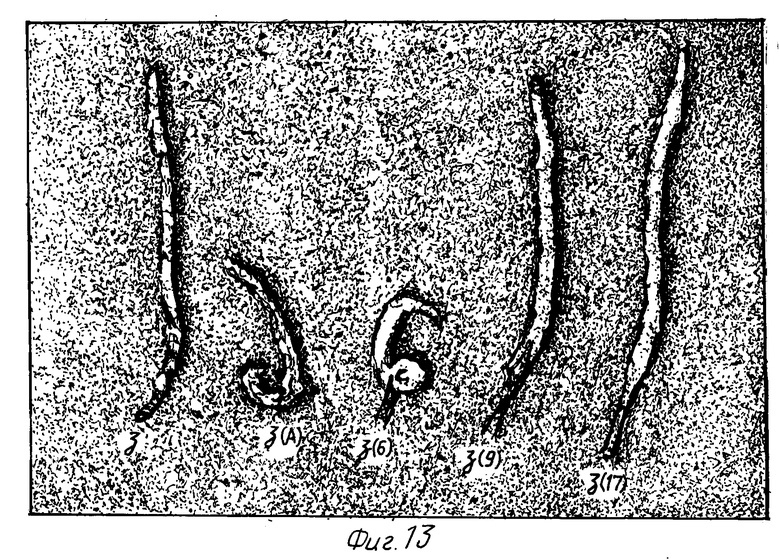
Фиг. 13: Плоды капустных растений, несущих различные цитоплазмовые геномы.
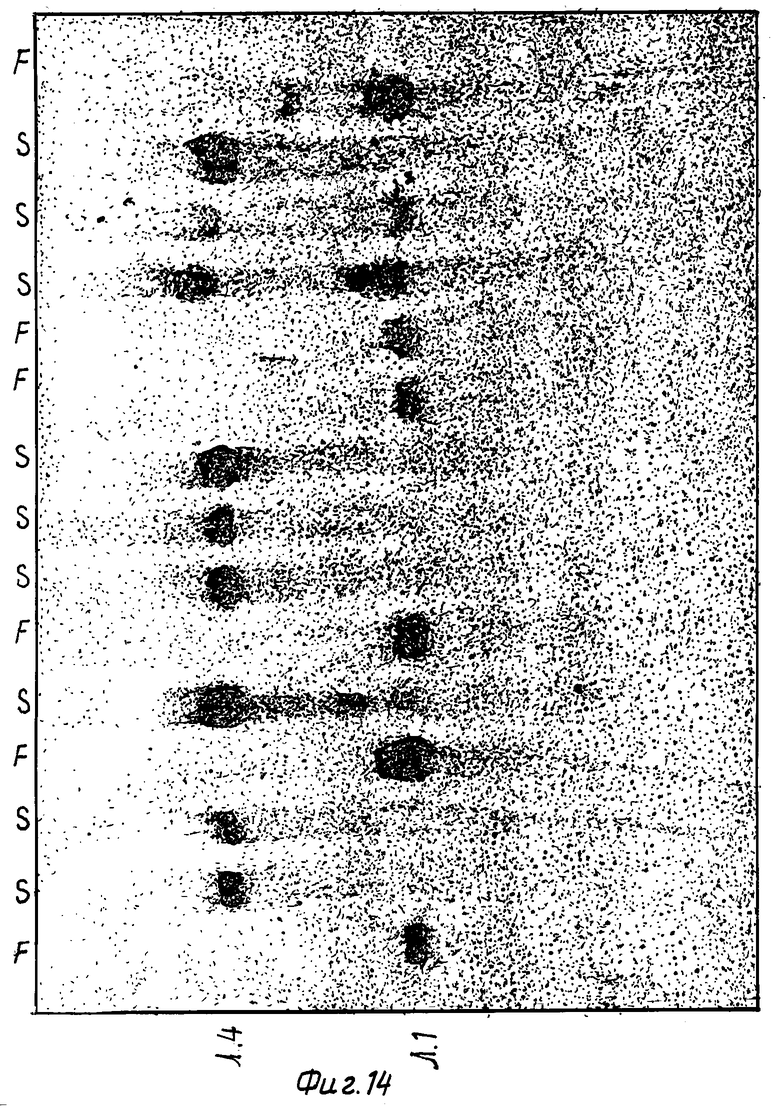
Фиг. 14: Электрофорез митохондриальной РНК. Обнаруженные полосы соответствуют гибридизации с пробой, фрагментом EcoRI - BamHI, включая участок последовательности, относящейся к ORFB.
Последовательность ДНК со стерильностью Ogura определена в отношении последовательности между номерами 1 и 2428, как показано на фиг. 1-9. Она переносится транскрибированной последовательностью, у которой 3' и 5' концы связаны разорванной линией на фиг. 10 и которая наблюдается лишь у растений с мужской стерильностью. ORFB соответствует открытой рамке считки; это обозначение дано на основании наблюдаемой гомологии с последовательностью, описанной Brennicke. На фиг. 10, последовательность, соответствующая одному из генов транспортной РНК, затемнена.
Последовательность ДНК, между нуклеотидами под номером 928 и 2273, как показано на фиг. 1-9, соответствует транскрипту, который может визуализироваться путем молекулярной гибридизации (1, 4), как показано на фиг. 14. На фиг. 14 каждая ячейка соответствует фертильному растению (F) или растению с мужской стерильностью (S). Лишь растения с мужской стерильность синтезируют транскрипт примерно из 1400 оснований. Этот транскрипт начинается с положения 928 (±10 оснований) последовательности, показанной на фиг. 1-9, и заканчивается в положении 2273 (±5) (начало и завершение транскрипции может иметь место в различных положениях в растительной митохондрии).
Настоящее изобретение касается предпочтительно цитоплазмы, содержащей последовательность ДНК, имеющую не менее чем на 50% гомологии с последовательностью, между нуклеотидами 928 и 2273, на фиг. 1-9, сообщающей признаки CMS, или касается цитоплазмы, содержащей последовательность ДНК, имеющей не менее чем на 50% гомологию с последовательностью, между нуклеотидами 928 и 1569, фиг. 1-9, и транскрибированную в РНК, сообщающей признак CMS и отличающейся тем, что:
- содержит хлоропласты тех же видов, что и ядерный геном или другие виды, но которые совместимы с данным ядерным геномом, - не содержит вовсе монохондриального генома Ogura, определяемого ниже:
* несущего один из двух формилметиониновых гена транспортной РНК, используемых для инициирования трансляции.
* несущего ген CoxI, кодирующий субъединицу N 1 цитохромооксидазы.
Отсутствие этих фрагментов, рассматриваемых как "нежелательные последовательности", необходимо для того, чтобы получить митохондрические геномы, соответствующие мужской стерильности высокого качества, соответствующие четырем определяемым выше характеристикам.
Согласно следующему аспекту, настоящее изобретение касается рекомбинантного растительного ядра или митохондрического генома, отличающегося тем, что содержит последовательность ДНК со стерильностью Ogura,
a) в которую несет последовательность ДНК между нуклеотидами 928 и 2273 последовательности, показанной на фиг. 1-9, или
b) которая по меньшей мере на 50% гомологична указанной последовательности, упомянутой в a),
и сообщает в случае присутствия в цитоплазме растения цитоплазмовую мужскую стерильность указанному растению.
В частности, одним из объектов данного изобретения является рекомбинантное растительное ядро или митохондрический геном, отличающийся тем, что содержит последовательность ДНК со стерильностью Ogura,
c) которая представляет последовательность между нуклеотидами под номерами 928 и 1569, фиг. 1-9, или
d) которая по меньшей мере на 50% гомологична указанной последовательности, упомянутой в c),
и сообщает в случае присутствия в цитоплазме растения и транскрибирования в РНК цитоплазмовую мужскую стерильность указанному растению.
Ядерный или митохондриальный геном, отвечающий настоящему изобретению, может отличаться тем, что этот рекомбинантный митохондриальный геном лишен всех или части геномных фрагментов Ogura:
- несущих один из двух генов формилметиониновой транспортной РНК, используемых для инициирования трансляции,
- несущих ген CoxI, кодирующий субъединицу N 1 цитохромоксидазы, или в котором указанные фрагменты неактивны.
В частности, рекомбинантный митохондриальный геном, отвечающий данному изобретению, может отличаться:
1) тем, что он лишен всего или части фрагмента примерно 10,7 kb после выпаривания с BglI или фрагмента примерно 11 kb после вываривания с NruI, которые (фрагменты) несут ген CoxI.
Это иллюстрируется, в частности, как показано на фиг. 11, молекулярной гибридизацией с пробой, несущей последовательность CoxI,
2) тем, что он лишен всего или части фрагмента 5,1 kb после вываривания с SalI, или фрагмента примерно 15 kb после вываривания с NruI, или фрагмента примерно 18,5 kb после вываривания с BglI, которые (фрагменты) несут один из двух генов формилметиониновой транспортной РНК.
Это продемонстрировано, в частности, как показано на фиг. 12, молекулярной гибридизацией с пробой, связанной нуклеотидами NN 389 и 1199 последовательности, описанной на фиг. 1-9.
На фиг. 11 и 12 генотипы, обозначенные цифрами, соответствуют растениям, имеющим подходящую систему с мужской стерильностью (см. табл. А).
Кроме того, присутствие признака CMS высокого качества вызывает необходимость присутствия последовательности ДНК, которая может быть идентифицирована путем гибридизации ДНК/ДНК при обработке рестриктазами. Таким образом, настоящее изобретение касается последовательности ДНК, которая может быть определена и которая отличается тем, что заключает в себе последовательность, дающую фрагмент 2,5 kb после расщепления McoI, дает фрагмент 6,8 kb после расщепления NruI и дает фрагмент 4,4 kb после расщепления SalI.
Эта последовательность может быть также идентифицирована путем гибридизаций на полной РНК растений с мужской стерильностью. Проиллюстрирован транскрипт примерно на 1400 оснований. Он отсутствует в растениях, возвращающихся к фертильности.
Определение "нежелательных" нуклеотидных последовательностей и нуклеотидных последовательностей "существенно важное" для стерильности согласно данному изобретению позволяет выбрать растительный материал, несущий хлоропласты, которые совместимы с ядерным геномом и несут митохондрии высокого качества, путем ДНК гибридизации, способа хорошо известного для специалистов в данной области, не ожидая при этом взрослых растительных особей и появления цветов и плодов.
Таким образом, в распоряжении потребителя имеется высоко эффективное средство для выбора растений, имеющих цитоплазму с мужской стерильностью с высокими агрономическими характеристиками.
Согласно следующему аспекту, настоящее изобретение касается митохондриона, отличающегося тем, что включает нуклеотидную последовательность, соответствующую ДНК, имеющую не менее чем примерно на 50% гомологию с последовательностью, между основаниями под номерами 928 и 2273, как показано на фиг. 1-9, и кодирующую цитоплазмовую мужскую стерильность Ogura; или же касается митохондриона, включающего последовательность ДНК, между нуклеотидами 928 и 1569, фиг. 1-9, или имеющую на 50% гомологию с данной последовательностью, и которая транскрибируется в РНК в митохондриях растений с мужской стерильностью. Эта ДНК может обладать, кроме того, свойствами, которые определены выше, в частности, в ней могут отсутствовать нежелательные последовательности.
Настоящее изобретение касается также цитоплазмы крестоцветных, отличающейся тем, что включает последовательность ДНК со "стерильностью Ogura"; эта цитоплазма включает, кроме того, хлоропласты тех же или других видов, но которые совместимы с ядерным геномом.
Последовательность со стерильностью Ogura отличается тем, что:
a) содержится в последовательности ДНК на 2428 основных пар, как показано на фиг. 1-9.
b) находится между нуклеотидами 928 и 2273, показанными на фиг. 1-9, и соответствует транскрипту, который на фиг. 10 показан разорванной линией, и визуализируется посредством молекулярной гибридизации (1, 4), как показано на фиг. 14,
c) имеет не менее чем на 50% гомологию с указанной последовательностью в b) и в случае ее присутствия в митохондриальном геноме растения сообщает цитоплазмовую мужскую стерильность указанному растению, или
d) представляет последовательность, между нуклеотидами 928 и 1569, и она транскрибируется в РНК в митохондрии стерильных растений, или
e) имеет не менее чем на 50% гомологию с последовательностью, описанной в d), и транскрибируется в РНК в митохондриях стерильных растений.
Настоящее изобретение касается также растения из семейства крестоцветных, отличающегося тем, что содержит хлоропласты и ядра тех же видов или которые совместимы, и митохондрии, несущие геном, сообщающий признак CMS, как определено выше.
В частности, настоящее изобретение касается также растения, принадлежащего к семейству Brassica (капустных), отличающегося тем, что содержит в себе хлоропласты и ядра Brassica и митохондрии, несущие геном, придающий признак CMS, как было определено выше.
Эти митохондриальные геномы должны также нести определенное число генов растений семейства Brassica. Это достигается путем рекомбинации между геномом Ogura и геномом Brassica.
Настоящее изобретение касается, в частности, растения, принадлежащего к разновидности Brassica napus, отличающегося тем, что содержит в себе ядро Brassica, и тем, что цитоплазма содержит в себе хлоропласты Brassica и стерильные мужские митохондрии, несущие ДНК, отвечающие данному изобретению, как было определено выше; эти митохондрии могут нести также наибольшую часть митохондрических генов Brassica napus (18S, Atp9, Atp6, CoxII, ndh1, cob). Brassica napus соответствует рапсу или каноле и брюkbе.
Настоящее изобретение касается растения разновидности Brassica oleracea, отличающегося тем, что оно содержит ядро Brassica и тем, что цитоплазма содержит хлоропласты Brassica и митохондрии, заключающие в себя последовательность ДНК, кодирующую признак CMS, который определен выше.
Brassica oleracea охватывает различные типы капустных растений: капусту с круглой формой кочана, Брюссельскую капусту, kohl-rabi, Брокколи, кормовую капусту и капусту цветную.
Настоящее изобретение касается также растений разновидности капустных (Brassica campestris), отличающейся тем, что она заключает в себе ядро Brassica и тем, что цитоплазма содержит хлоропласты Brassica, которые совместимы с ядерным геномом, и митохондрии, включающие последовательность ДНК, кодирующую признак CMS, который определен выше.
Brassica campestris соответствует рапсу, турнепсу и Китайской, Пекинской и Японской капусте.
Настоящее изобретение касается также растений, выбранных из группы, включающей разновидности B. juncea, B. nigra, B, hirta и B. carinata, отличающиеся тем, что содержат в себе ядро Brassica, и тем, что цитоплазма заключает в себе хлоропласты Brassica, которые совместимы с ядерным геномом, и митохондрии, содержащие последовательность ДНК, кодирующую признак CMS, который определен выше.
Согласно следующим аспектам объектом данного изобретения является растение, принадлежащее к семейству капустных (Brassica), у которого ядерный геном заключает в себе последовательность со стерильностью Ogura, которая определена выше, а также элементы, действующие на экспрессию и транспорт продукта трансляции в митохондрион. Это растение, в частности, принадлежат к одному из следующих видов: B. napus, B. oleracea, B. campestrus, B. nigra, B. juncea, B. hirta, B. carinata.
Присутствие "последовательности со стерильностью Ogura" необходимо и достаточно для того, чтобы индуцировать полное отсутствие пыльцы при отсутствии генов восстановителей. Опыление этих растений является обычно результатом хорошего продуцирования нектара.
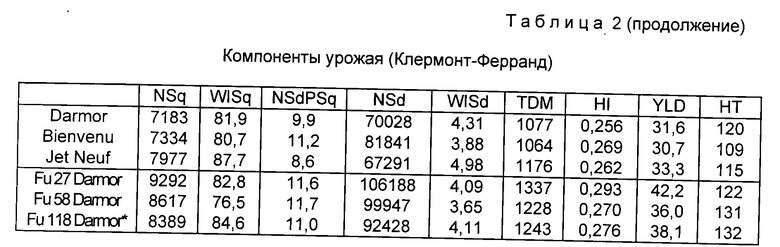
Морфология женских органов обычная и плоды (стручки), которые образуются, содержат нормальное число семян. На фиг. 13 показана морфология, наблюдаемая у нормальных контрольных растений (z), растений, имеющих отклоняющуюся от нормы морфологию, имеющих полный геном Ogura (z(6)) и хлоропласты Brassica oleracea капустных растений, несущих хлоропласты Brassica napus и митохондрии с мужской стерильностью, имеющие гены Brassica napus (z(A)), и у растений, несущих хлоропласты Brassica oleracea и рекомбинантные митохондрии, уже более не содержащие нежелательных последовательностей (z(9)) и (z(17)).
Эти растения имеют следующие характеристики (см. табл. Б).
Генотипы z(A) и z(6) уже более не имеют нужной цитоплазмовой системы с мужской стерильностью.
Такие растения могут быть получены, например, путем слияния протопластов или другими способами, при которых происходит хорошая рекомбинация между митохондриальным геномом данных рассматриваемых видов и митохондриальным геномом Ogura. У таких растений фертильность восстанавливается посредством одного гена восстановителя, который обозначается как Rf1, источником которого является редька, что не бывает у растений, которые несут полностью нежелательный митохондриальный геном. Такие растения могут быть получены также путем естественного или искусственного воспроизведения половым путем.
Растения, имеющие митохондриальный геном, отвечающие данному изобретению, могут быть получены также путем генного переноса в митохондрион.
Во всех случаях эти растения имеют желательную систему CMS, а именно:
- полную мужскую стерильность,
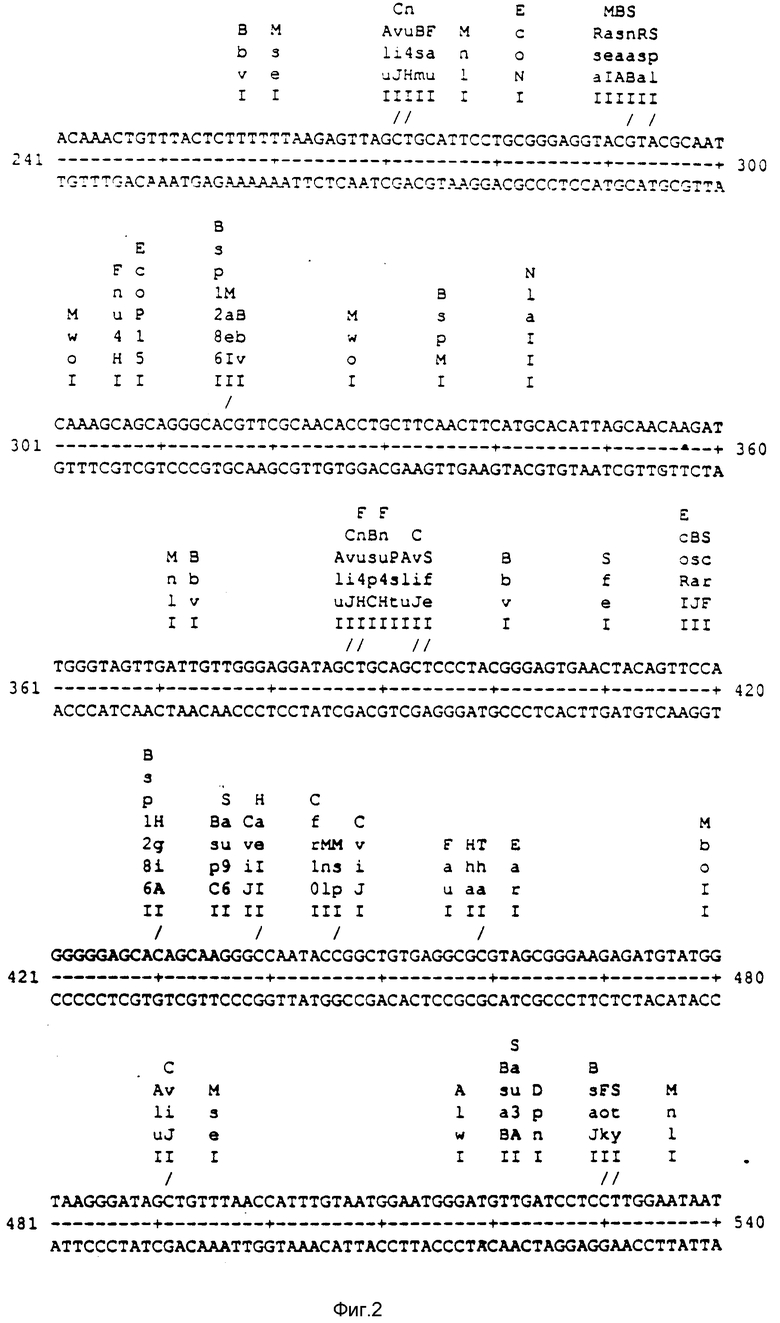
- морфологию, допускающую хорошее опыление и хорошее продуцирование семян, как иллюстрировано в табл. 1 и 2.
Таким образом, настоящее изобретение касается способа получения гибридных растений, отличающихся тем, что они имеют подходящий признак, CMS, содержащих последовательность со стерильностью Ogura в их митохондриальном или ядерном геноме, способны к скрещиванию с нормальным растением в случае пищевых или кормовых культур, или с растением, дающим восстанавливающий фертильность ген, Rf1, в случае, когда должны быть собраны семена. Настоящее изобретение касается гибридного растения, получаемого данным путем.
Вообще говоря, наилучшие агрономические качества достигаются в случае растений с мужской стерильностью, имеющих хлоропласты тех же видов, что и ядра или митохондрии с подходящей системой с мужской стерильностью.
В табл. 1 показана продуктивность капустной линии с различными цитоплазмами (подходящими являются генотипы z9 и z17). В табл. 2 показана продуктивность рапсовой линии с различными цитоплазмами (подходящими являются генотипы Fu27, Fu58 и Fu85).
NSq: Число стручков на м2 - WISq: Вес одного стручка (мг) - NSdPSq: Число семян на стручок
NSd: Число семян на м2 - WISd: Вес одного семени (мг) - TPM: Общая сухая масса (г/м2)
HI - Индекс урожая (%) - YLD: Урожай (qx/га); HT: Высота (см)
Данные растения очень часто имеют деформированные плоды (стручки).
Предметом данного изобретения является также проба, заключающая в себе последовательность не менее чем из 10 рамок, предпочтительно из 15 рамок, которая связана нуклеотидами под номерами 928 и 1569, показанными на фиг. 1-9; и эта проба может быть мечена, например, радиоактивным основанием или другими средствами, например посредством флуоресценции. Эта проба может быть использована для демонстрации мужской стерильности и может быть использована, в частности, для отбора клонов.
Некоторые отличительные особенности и преимущества данного изобретения станут более ясными из описания нижеследующих примеров,
ПРИМЕР 1: ИЛЛЮСТРАЦИЯ ПОСЛЕДОВАТЕЛЬНОСТИ ДНК, ОТВЕТСТВЕННОЙ ЗА ЦИТОПЛАЗМОВУЮ МУЖСКУЮ СТЕРИЛЬНОСТЬ OGURA
1. Растение. (имеется в виду гибрид - перев.) означает формы, полученные путем слияния изолированных протопластов с последующей регенерацией всего растения. Этот способ продуцирования позволяет получить информацию о цитоплазме от обоих родителей, которые одновременно находятся в клетке. Цибрид N 13 получен от растений в количестве до 820, регенерированных слияниями протопластов Ogura-cms, стойкого к триазину цибрида B. napus (потомство от Цибрида 77, описанного в публикации Pelletier и др., 1983 г. и Chetrit и др. , 1985 г. ) и чувствительной к триазину и фертильной разновидности Brutor. Испытание на стойкость к триазину (Ducruet и Gasquez, 1978) осуществлялось на образцах листьев каждого регенеранта, дающего тип хлоропласта (стойкие к триазину хлоропласты от родителя 77 или чувствительные к триазину хлоропласты, происходящие от линии Brutor), который должен быть определен. Осуществляли культивацию данных растений, и наблюдались следующие стадии цветения. Растения, проявляющие неродительские комбинации (как чувствительные / с мужской стерильностью, так и стойкие / с мужской фертильностью) были выбраны в качестве цибридов (Cybrids). Цибрид N 13 был чувствительным / с мужской стерильностью цибридом. Цибрид 1 был стойким / с мужской фертильностью цибридом.
2. Изоляция нуклеиновой кислоты.
Полная ДНК была выделена из листьев от четырехнедельных растений согласно способу, описанному Dellaporta (1983 г.), Митохондрическая ДНК была экстрагирована из листьев 8-недельных растений, как было описано Vedel и Mathieu, 1982 г., со следующими возможными вариантами:
Митохондрии не очищались на сахарозном градиенте перед лизисом и лизис осуществлялся в 4% саркозиле с содержанием 0,5 мг/мл протеиназы (Bochringer Mannheim GmbH) в 50 мМол. Трис, pH-8, 20 мМол. этилендиаминтетрауксусной кислоты (ЕДТА). После осаждения митохондрическая ДНК очищалась путем центрифугирования на градиенте этилиденбромид/хлорид цезия (Метод 1 - Vedel и Mathieu 1082 г.) в пробирках из полиалломера.
Полная РНК была выделена из листьев или цветочных почек согласно способу Logemann и др., 1987 г.
Митохондриальная РНК была экстрагирована из 8-недельной цветной капусты согласно способу Stern и Newton 1986 г.
3. Рестрикционные анализы митохондрической ДНК и электрофорез на агарозном геле.
Данные процедуры осуществлялись как описано Pelletier и др., 1983 г. Полная или митохондрическая РНК была введена в гели для электрофореза, содержащие формальдегид, как было описано Sambrook и др., 1989 г.
4. Гибридизация
Осуществляли перенос ДНК или РНК на нейлоновые фильтры (Hybond-N, Amersham) путем капиллярной абсорбции с использованием 6 x SSC или 10 x SSPE соответственно согласно инструкциям изготовителя. Предварительная гибридизация и гибридизация осуществлялись согласно Amersham с использованием проб, меченых посредством системы мечения мультипраймерной ДНК (Amersham) после очистки в колонке с Sephadex G50 (Sambrook и др., 1989 г.).
5. Клонирование митохондриальной ДНК
Были построены две геномные библиотеки цибридных линий с мужской стерильностью (13 - 7) и ревертанта (13 - 6) в фаговом векторе EMBL3, культивированном в рестрикционном штамме Nm539 E.coli (Frischauf и др., 1983 г.). Получалось примерно 2,5•104 клонов на мкг митохондрической ДНК.
Митохондрические библиотеки ДНК анализировались и высевались с целью изоляции колоний, которые переносились на нейлоновые фильтры, как описано в работе Sambrook и др. , 1989 г. Гибридизационная проба, используемая для отсева двух библиотек митохондриальной ДНК, приготавливалась следующим образом: Фрагмент митохондриальной ДНК специфический для cms, элюировался с использованием процедуры генной очистки TM (BIO 101 INC.) из продукта расщепления митохондриальной ДНК на препаративном агарозном геле. Элюированная ДНК затем метилась, как уже было описано.
Экстракция лямбда ДНК, субклонирование фрагмента 2,5 NcoI в NcoI сайт pTrc99A (Amann и др., 1988) и экстракции ДНК плазмиды осуществлялись согласно процедуре Sambrook и др., 1989 г. Рекомбинантные плазмиды вводились в штамм NM522 E.coli (Gough и Murray, 1983 г.).
6. Генетическое исследование цибрида 13 и его потомства.
В первой генерации потомства, полученного путем опыления цибрида 13 посредством Brutor, которая включала 13 растений, пять растений были полностью с мужской стерильностью (включая растения 13-2 и 13-7), одно было с мужской фертильностью (N 13-6) и 7 растений были полностью стерильны с несколькими цветками с мужской фертильностью.
Фертильное растение 13-6 было самоопыленным и было скрещенным с Brutor. В обоих случаях получались лишь фертильные растения (соответственно 42 и 43).
При скрещиваниях растения с мужской стерильностью N 13-7 и Brutor, 24 потомства были полностью стерильными и 6 растений имели несколько фертильных цветочков, результат, аналогичный тому, который наблюдается у самого цибрида. Растения 13-2 скрещивались с линией восстановителя RF, которая являлась гетерозиготной для специфических генов восстановителей для мужской стерильности (Chetrit и др., 1985 г.). Потомство от данного скрещивания включало 53 растения с мужской стерильностью, 37 растений с мужской фертильностью и 9 растений, которые были почти полностью стерильны, хотя они имели несколько фертильных цветочков. Эти результаты подтверждают, что растения с мужской стерильностью из семейства цибрида 13 заключают в себе детерминанту Ogura, как и другие цибриды, изучаемые ранее с более простым восстановительным профилем (Chetrit и др., 1985 г.).
На данной стадии могут быть рассмотрены две возможности: Либо цибрид 13 содержит смесь монохондриальных геномов "с мужской фертильностью" и "с женской стерильностью" и возможно отобрать дополнительно два фенотипа, либо цибрид 13 содержит рекомбинантный митохондриальный геном с нестойкой структурой, который превращается в более стойкую "фертильную" конфигурацию и уже невозможно сохранение фенотипа с гомогенной мужской фертильностью в последующих генерациях.
Растения с мужской стерильностью, получаемые от потомства растения с мужской стерильностью N 13-7, культивировались путем срезания черенков и скрещивания половым путем с Brutor. После различного числа генераций (1 - 5), осуществляемых обоими способами, все семейства давали фертильные растения. В противоположность этому получаемые таким путем фертильные растения никогда не давали стерильных растений.
В свете этих результатов можно заключить, что правильным является второе предложенное выше объяснение, то есть что цибрид 13 несет неустойчивый митохондриальный геном, который теряет детерминанту Ogura-cms в ходе данного процесса, приводя к "фертильной" конфигурации без возможности возврата к стерильному фенотипу.
7. Сравнение митохондриальных ДНК ревертантного потомства с мужской стерильностью и с фертильностью. Изоляция фрагментов, специфических для растений с мужской стерильностью.
Митохондриальная ДНК была экстрагирована из листьев потомства с мужской стерильностью 13-7 и из фертильных ревертантов (13-6 или 13-7 потомства) и была выварена с некоторыми рестрикционными ферментами для сравнения их рестрикционных профилей. Митохондрические геномы этих двух типов очень близки, поскольку никакого различия не наблюдалось между рестрикционным профилем митохондрии с мужской стерильностью и фертильными ревертантами с использованием различных ферментов. Однако, был обнаружен рестрикционный фермент 6,8 kb в рестрикционном профиле митохондриальной ДНК растений с мужской стерильностью, обработанных NruI, и он никогда не наблюдался в соответствующих профилях фертильных ревертантов.
Данный фрагмент (рассматриваемый как N 6,8) был элюирован из агарозного геля, он метился и использовался как проба на рестрикционных профилях митохондрической ДНК NruI: широкий сигнал, соответствующий 6,8 kb наблюдался в потомстве с полностью мужской стерильностью цибрида 13, в то время как никакой фрагмент данного размера не гибридизировался с данной пробой в геномах митохондрии фертильных ревертантов. Кроме того, проба N 6,8 гибридизируется с фрагментом 6,8 kb в митохондрической ДНК Ogura, вываренной с NruI, но не в B.napus cv Brutor, что показывает происхождение данного фрагмента от Ogura.
Библиотека лямбда, включающая экстракты митохондриальной ДНК, происходящей от растений с мужской стерильностью (13-7), испытывалась с элюированным меченым фрагментом, и из 8 гибридизирующихся клонов было изолировано 2 гекомбинантных фага, содержащих полный фрагмент N 6,8 и соседние последовательности. Была получена подробная рестрикционная карта этой зоны. Гибридизация рестрикционных профилей митохондриальной ДНК, происходящей от фертильного и стерильного потомства цибрида 13 с N 6,8 как пробы, подходящей для зоны специфической для генотипа с мужской стерильностью, должна быть ограничена фрагментом 2,5 kb.
Фрагмент 2,5 kb NcoI метился и использовался как проба в отношении митохондрической ДНК, происходящей от потомства 13-7 и 13-6, вываренного с NcoI. Не считая сигнала, соответствующего 2,5 kb, который является специфическим для профиля с мужской стерильностью, некоторые фрагменты NcoI гибридизируются как в фертильном ревертанте, так и в профилях с мужской стерильностью; этими фрагментами являются фрагменты 2,2, 10 и 14 kb. Фрагменты 2,7 kb NcoI сильно гибридизируются в митохондрическом геноме фертильного потомства, а не в геноме стерильного потомства. Анализ данного профиля гибридизации позволил сделать заключение, что фрагмент 2,5 kb NcoI, хотя и специфический для митохондрической ДНК с мужской стерильностью, но заключает в себе последовательности, которые повторяются в другом месте в митохондрическом геноме (на 2,2 - 10- и 14-kb фрагментах после NcoI), и эти повторяемые последовательности присутствуют также в митохондрической ДНК фертильных ревертантов, не считая специфического фрагмента 2,7 kb.
Полная РНК экстрагируется из листьев или почек потомства цибридов 13, или цибридов с мужской стерильностью или с фертильностью (полученных в других экспериментах по слиянию), и линии Brutor. Осуществляли Нозерн-блотингом и реплики гибридизировались с пробой, соответствующей вставке лямбда клона, включающего N 6,8, описанный в примере 3. Основной транскрипт 1,4 kb был обнаружен во всех цибридах с мужской стерильностью, включая цибрид 13-7, в то время как никакого транскрипта данного размера не обнаруживалось в линии Brutor или в двух фертильных цибридах (отличных от 13). Более того, фертильные растения имеют транскрипт 1,1 kb, который гибридизируется с данной пробой, которая отсутствует или присутствует в очень низких концентрациях во всех испытанных гибридах с мужской стерильностью.
Некоторые транскрипты, общие для всех образцов, гибридизируются слабо с данной пробой ввиду большого размера меченой вставки. Это подтверждает, что митохондрические транскрипты могут быть обнаружены в образцах полной РНК путем Нозерн-гибридизации той же реплики с фрагментом ДНК, включающим генную последовательность atpa.
Тот же специфический транскрипт 1,4 был найден в митохондриальной РНК Ogura, экстрагированной из цветной капусты, с использованием в качестве пробы фрагмента 2,5 NcoI. Экстракционные пределы данного транскрипта были определены с использованием в качестве пробы субклонов фрагмента 2,5 NcoI.
8. Изучение цибрида 1 и его потомства.
Цибрид 1 был с мужской фертильностью. В этом потомстве растение 1.12 было фертильным и растение 1.18 было стерильным. Растение 1.12 давало в своем потомстве стерильные растения (S3), и фертильные растения (RF3). Растение 1.18 давало стерильные растения (S2) и фертильную ветвь (RF2). Растения S2 и S3 восстанавливались тем же ядерным геном, что восстанавливает достигаемую опылением фертильность, как и стерильный цибрид 13.
При гибридизации с меченым фрагментом 2,5 kb NcoI митохондрическая ДНК растений S2 и S3 не давала сигнала фрагмента 2,5 kb при вываривании с NcoI или сигнала фрагмента 6,8 kb при вываривании с NruI.
Аналогично гибридизация с полной РНК (Нозерн-блоттинг) с пробой, соответствующей последовательности ORFB, не давала сигнала, соответствующего 1,4 kb, как это происходило со стерильным цибридом 13. В противоположность этому, проба, соответствующая последовательности между нуклеотидами 928 и 1569, показанными на фиг. 1-9, давала сигнал при Нозерн-блоттинге, соответствующий примерно 1,3 kb. Этот сигнал отсутствует в РНК растений RF1, RF2, RF3 или Brutor. Аналогично, можно использовать эту последовательность (928 - 1569) как пробу в дотблоттинге полной РНК, и в данном случае будут давать сигнал лишь растения с мужской стерильностью и каждое из них.
Эти результаты показывают, что растения S2 и S3, хотя они и с мужской стерильностью, но не сохраняются в нуклеотидной последовательности, показанной на фиг. 1-9, в исходной конформации, и они показывают, что в данной последовательности участок, связанный нуклеотидами 928 и 1569, является таким участком, который несет "специфическую детерминанту" стерильности Ogura", которая дает растениям мужскую стерильность, при транскрибировании данной последовательности.
Данная последовательность не имеет значительной гомологии с последовательностью, присутствующей в банке данных.
ПРИМЕР 2. ИЛЛЮСТРАЦИЯ НЕЖЕЛАТЕЛЬНЫХ ИСТОЧНИКОВ В МИТОХОНДРИАЛЬНОМ ГЕНОМЕ
Была получена коллекция гибрида семейства B. napus путем протопластового слияния между рапсом, несущим цитоплазму Ogura, и обычным рапсом. Первый является растением с мужской стерильностью и дефицитом хлорофилла при низкой температуре, в то время как последний - обычно зеленый и фертильный. Цибриды отбирались из числа регенерированных растений и те, которые имели мужскую стерильность и обычно были зелеными, были приняты.
В том же случае получали коллекцию цибридов в семействе B. oleracea путем протопластового слияния между капустой, несущей цитоплазму Ogura, и обычной капустой. Цибриды, которые имели мужскую стерильность и обычно были зелеными, отбирались из числа регенерированных растений.
Эти цибриды скрещивались с различными видами рапса в первом случае и капусты во втором случае. Скрещивания повторялись для каждой генерации с теми же видами, так чтобы получался определенный генотип, близкий к генотипу повторяющегося вида.
Эти различные виды таким путем трансформировались цитоплазмами различных цибридов, подвергались агрономическим испытаниям для определения продуктивности по семенам, которая зависит от ряда факторов: достаточной степени продуцирования нектара для осуществления опыливания насекомыми и нормальной цветочной морфологией с тем, чтобы это опыливание было эффективным и плоды развивались нормально.
Коллекция цибридов, таким образом, может быть разделена на две партии:
- партия цибридов, имеющих мужскую стерильность, пригодная для коммерческого получения семян.
- партия цибридов, не обладающих всеми благоприятными характеристиками для должного коммерческого получения семян.
Так, например, рапсовые цибриды NN 27, 58 и 85 и капустные цибриды NN 9, 17, 21, 24 и 27 с принадлежат к первой партии.
Рапсовые цибриды NN 23s, 77 и 118 и капустные цибриды NN 1, 6 и 14, например, принадлежат ко второй партии.
Полная ДНК этих цибридов подвергалась обработке с SalI, NcoI, NruI, BglI, PstI и KpnI. Полученные реплики Southern гибридизировались с различными митохондриальными пробами Atpa, Cob, Cox1, Atp6, 26s и 18s и двумя фрагментами генома Ogura на 2,5 kb, полученными расщеплением NcoI и 19,4 kb, полученного расщеплением NruI.
Обе партии цибридов отличаются тем, что:
a) NN 23s, 55 и 11s в рапсах и 1, 16 и 11 в капусте включают зону генома Ogura, которая окружает ген Cox1, распознаваемый фрагментами 10,7 kb BglI или 11 kb NruI и зону генома Ogura, которая окружает один из формилметиониновых транспортных генов РНК, распознаваемых фрагментами 5,1 kb SalI или 15 kb NruI.
b) NN 27, 58 и 85 в рапсе и 9, 17, 21, 24 и 27c в капусте не содержат соответствующих зон, которые были заменены в результате рекомбинаций между геномами двух родителей, которые были слиты, аналогичными зонами митохондрического генома рапса в NN 27, 58 и 85 и капусты в NN 9, 17, 21, 24 и 27c.
Из этого можно сделать заключение, что обе рассматриваемые зоны генома Ogura нежелательны, если желательно иметь систему с мужской стерильностью для коммерческого получения семян.
ПРИМЕР 3.
Данный пример иллюстрирует важность знания последовательностей "мужской стерильности Ogura" и нежелательных последовательностей для осуществления непосредственного отбора цибридов, без ожидания в течение нескольких лет обратного скрещивания и без агрономических испытаний.
Протопласты растения Brassica, несущие цитоплазму Ogura, сливались с протопластами рассматриваемых видов Brassica. Колонии от слияния культивировались в условиях "ин витро" и регенерировались на среде, которая ускоряла образование стручков (см. Pelletier и др., 1983 г.).
Из одного грамма свежего материала, либо каллуса, либо фрагмента регенерированного проростка, путем описанных выше приемов можно выделять всю ДНК. После обработки SalI гибридизации по Саузерну с пробой, представляющей последовательность между нуклеотидами NN 389 и 1199 (фиг. 1-9) будет давать сигнал лишь для фрагмента 4,4 kb (не будет давать сигнал для 5,1 kb). Аналогичным образом после расщепления NruI и гибридизации с пробой, несущей ген Cox1 должен быть получен сигнал для фрагмента отличного от 11 kb.
Эти данные позволяют предсказать, что растение, которое было получено, является действительно стерильным и пригодным для коммерческого получения семян.
ПРИМЕР 4.
Данный пример является вариантом примера 1, основанного на идее полового скрещивания двух родителей в специальных условиях или с определенными генотипами вместо осуществления протопластовых слияний. Результатом является то, что в отличие от известных способов оплодотворения происходит смешивание протоплазм оосфер и пыльцевой трубки или мужской гаметы. Если бы такие способы были описаны, то мог бы быть осуществлен ранее отсев уже известным образом на молодых растениях, происходящих от этих искусственных оплодотворений с использованием указанных проб и тех же критериев, что в примере 3.
ПРИМЕР 5
Данный пример иллюстрирует важность знания последовательности стерильности Ogura в типе генетической манипуляции, который уже был описан для дрожжей (Johnston и др., 1988 г.).
Используя обычно (нормальное) растение Brassica, меристемы или альтернативно клетки "ин витро" бомбардировали микрочастицами, покрытыми ДНК, несущей последовательность стерильности Ogura. Растения, полученные в потомстве таких обработанных меристем или регенерированные проростки будут с цитоплазмой мужской стерильностью, если ДНК будет в состоянии вводиться в митохондрии и становиться интегрированной в геноме данных органелл. Данная процедура исключает проблемы, создаваемые нежелательными последовательностями, когда имеются хлоропласты Ogura редьки или определяемые таким путем последовательности митохондрического генома.
ПРИМЕР 6.
Данный пример иллюстрирует важность знания последовательности "стерильности Ogura" в построении ядерной, а не цитоплазмической стерильности согласно теории Менделя.
При использовании в качестве источника последовательности ДНК между нуклеотидами 928 и 1569 может быть построен химерный ген, который будет транскрибироваться после генетической трансформации клеток Brassica или другого гена, в ядре клеток получаемых трансформированных растений. Если химерный ген включает предварительную последовательность, которая позволяет ее протеиновому продукту трансляции вводиться в митохондрион, то эти трансформанты будут иметь мужскую стерильность, и этот признак будет проявляться как доминантный Менделевский признак.
Список литературы
1. Amann E., Ochs B. and Abel K-J. (1988) Gene 69:301-315
2. Bannerot H., Boulidard L., Cauderon Y. and Tempe J. (1974) Proc Eucarpia Meeting Cruciferae 25:52-54
3. Bannerot H., Boulidard L. and Chupeau Y. (1977) Eucarpia Cruciferae Newsl: 2-16
4. Chetrit P., Mathieu С., Vedel F., Pelletier G. and Primard C. (1985) Theor Appl Genet 69:361-366
5. Dellaporta S. L., Wood J. and J. B. (1983) Plant Mol Biol Rep 1:19-21
6. Ducruet J. M. and Gasquez J. (1978) Chemosphere 8:691-696
7. Frishauf A. M., Lehrach H., Poutska A. and Murray N. (1983) J Mol Biol 170:827-842
8. Gough J. and Murray N. (1983) J Mol Biol 166:1-19
9. Hiesel R., Shobel W., Schuster W. and Brennicke A. (1987) EMBO J 6: 29-34
10. Johnston S. A., Anziano P. Q., Shark K., Sanford J. C. and Butow R. A. (1988) Science 240:1538-1541
11. Logemann J., Schell J. and Willmitzer L. (1987) Analytical Biochem 163:16-20
12. Ogura H. (1968) Mem Fac Agric Kagoshima Univ 6:39-78
13. Pelletier G., Primard C., Vedel F., Chetrit P., Remy R., Rousselle P. and Renard M. (1983) Mol Gen Genet 191:244-250
14. Sambrook J., Fritsch E. F. and Maniatis T. (1989) Molecular cloning, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York
15. Stern D. B. and Newton K. J. (1986) Methods Enzymol 118:488-496
16. Vedel F. and Mathieu C. (1982) Anal Biochem 127:1-8о







Фрагмент ДНК предназначен для придания цитоплазматической мужской стерильности ЦМС при введении его в геном растений и может быть использован для создания трансгенных растений с ЦМС. Для выделения или выявления данного фрагмента используют пробу ДНК, которая имеет не менее 10 последовательно расположенных нуклеотидов, меченных радиоактивными или нерадиоактивными средствами. Приведены нуклеотидные последовательности фрагмента ДНК и пробы ДНК. 2 с.п.ф-лы, 14 ил., 2 табл.
| GB, 2211205 C 12 N 15/00, 1989 | |||
| WO, 8701726, C 12 N 15/00, 1987. |
Авторы
Даты
1998-08-20—Публикация
1991-09-20—Подача