Изобретение относится к гетероциклическим аминам, способам их получения и содержащим их лекарственным препаратам.
Изобретение относится к 1,4-дизамещенным пиперазинам формулы (I):
их энантиомерным и диастереомерным формам, их смесям и их солям фармацевтически приемлемых кислот и оснований, в которой:
B является -CO, -CH2OCO-, CH2OCS-, -CH2NHCO-, -CH2NHCS-группой;
D является 5-6-членным гетероциклом с 1-3 атомами азота, возможно замещенными 1 или 2 амино, моно-C1-C6-алкиламино, моно-C3-C7-алкенил- или моно-C3-C7-алкиниламино, ди-C1-C6-алкиламино, (C1-C6)алкил(C3-C7)алкениламино, пиперидин-1-ил, морфолин-4-ил, пирролидин-1-ил группами;
Ra и Rb являются водородом, C1-C3-алкилом или взятые вместе с углеродным атомом, к которому они присоединены, они образуют C3-C6-циклоалкильную группу;
n является целым числом от 1 до 4.
Примерами C1-C3- или C1-C6-алкильных групп являются метильная, этильная, н-пропильная, изопропильная, н-бутильная, трет-бутильная, н-пентильная, н-гексильная.
Примерами 5- или 6-членных гетероциклических групп с 1-3 атомами азота, возможно замещенными 1-2 аминогруппами, являются [2,6-бис(диэтиламино)-4-пиримидинил], [2,6-бис(пирролидин-1-ил)-4-пиримидинил], [4,6-бис/аллиламино)-1,3,5-триазин-2-ил] , [4,6-бис-(диэтиламино)-1,3,5-триазин-2-ил], [4,6-бис(пирролидин-1-ил)-1,3,5-триазин-2-ил], [3,6-бис(диэтиламино)пиридин-2-ил] , [3,6-бис(пирролидин-1-ил)пиридин-2-ил] , [3,6-бис(аллиламино)пиридин-2-ил] , [3,6-бис(пропаргиламино)пиридин-2-ил] , [3,6-бис(N-этил-N-аллиламино)пиридин-2-ил], [3-этиламинопиридин-2-ил].
Примерами моно-C1-C6-алкиламиногрупп являются метиламино, этиламино, пропиламино, изопропиламино, н-бутиламино, трет-бутиламино.
Примерами моно-C3-C6-алкенил- или моноалкинилгрупп являются аллиламино, пропаргиламино.
Примерами ди-C1-C6-алкиламиногрупп являются диметиламино, диэтиламино, метилэтиламино, метилпропиламино, метилэтилпропиламино, диизопропиламино, метил-н-бутиламино.
Примерами (C1-C6)алкил-(C3-C7)алкениламиногрупп являются метилаллиламино, этилаллиламино, пропилаллиламино, изопропилаллиламино. Ra и Rb предпочтительно являются водородом, метилом, этилом или, вместе взятые с углеродным атомом, к которому они присоединены, являются циклопропильной, циклопентильной или циклогексильной группой.
В особенности предпочтительными соединениями (I) являются такие, в которых B представляет -CO- или -CH2OCO-группу; D является гетероциклом, выбранным из группы, состоящей из [2,6-бис(пирролидин-1-ил)-4-пиримидинила], [4,6-бис(пирролидин-1-ил)-1,3,5-триазин-2-ила), [3,6-(бис(диэтиламино)-пиридин-2-ила] и [3-этиламинопиридин-2-ила], Ra, который является тем же самым, что Rb, представляет водород или метил, и n равно 1.
Кислотные или основные группы могут соответственно образовывать соли с фармацевтически приемлемыми основаниями и кислотами. Нетоксичные соли, полученные таким образом, а также одиночные энантиомеры, диастереомеры, диастереомерные смеси и рацематы соединений формулы (I) входят в объем изобретения.
Соединения (I) могут образовывать соли с неорганическими и органическими кислотами, которые являются фармацевтически приемлемыми, например с хлористоводородной, бромистоводородной, иодистоводородной, фосфорной, метафосфорной, азотной или серной, уксусной, щавелевой, винной, лимонной, бензойной, гликолевой, глюконовой, глюкуруновой, янтарной, малеиновой, фумаровой и т. д. кислотами. Карбоксигруппа может образовать соли с основаниями различной природы при одном условии, состоящем в том, что соли являются фармацевтически приемлемыми. Примеры упомянутых солей включают соли с аммонием, натрием, калием, кальцием, магнием, алюминием, железом, цинком, медью или соли с фармацевтически приемлемыми органическими основаниями, например, аргинином, лизином, гистидином, метиламином, этиламином, диэтиламином, дибензиламином, морфолином, фенилглицином и D-глюкозамином.
Пролинамиды с пиперазинхиназолином описаны как ACE-ингибиторы (Sankyo Co. , JP 82 91, 987; C.A., 97: 1982 18W, 1982). N-карбамоилпролинамиды с N-метилпиперазином известны как филярицидные средства (Indian J. Chem., Sect. b, 1987, 26B(8), 748-751).
Соединения изобретения проявляют фармакологические свойства, в частности, бронхиальную повышенную реактивность.
Бронхиальная повышенная реактивность является клиническим симптомы астмы и предполагается, что она является прямым следствием патологической и скрытой сократительной способности и чувствительности слизистой оболочки бронхов.
Бронхиальная повышенная реактивность может вызвать острый кризис астмы после физической деятельности и/или после воздействия внешнего раздражителя, например, вдыхания дыма или пыли, стоящей в воздухе, загрязняющих воздух веществ, аллергенов и физиологически активных веществ.
Состояния бронхиальной повышенной реактивности можно моделировать экспериментальной моделью, заключающейся во вливании PAF (600μ/л) морским свинкам мужского пола, весящим 400-450 г, которых держат при принудительной вентиляции под уретаном и бромидом обезболивании.
PAF, который является одним из наиболее важных медиаторов, вовлеченных в воспалительный процесс дыхательных путей, после вливания в течение 1 часа вызывает реакцию повышенной реактивности (бронхостеноз) к специфическим и различным веществам.
Активность соединений изобретения в рассмотренной фармакологической модели установлена посредством предотвращения повышенной реактивности, вызванной PAF, измеренной в виде возрастания инсуфляторного давления в легочной артерии (измеренного в соответствии с видоизмененной методикой Konzett u Rossler, Haun. Schmied. Anh. bxper. Pathol. Pharmacol. 191,71, 1970).
Соединения изобретения, которые вводят за 10 минут до введения PAF дозами, которые изменяются между 2 и 50 μг/кг, показывают защитное действие, которое продолжается по крайней мере 4-6 часов и приводит к уменьшению повышенной реактивности, вызванной PAF. Такие фармакологические эффекты связаны с дозой.
Из вышесказанного становится ясным, что соединения изобретения могут быть использованы при терапии человека, лечении астматических и закупоренных состояний дыхательных путей, при лечении воспалительных процессов.
Для предназначенных терапевтических применений соединения изобретения можно вводить в форме лекарственных препаратов, которые можно получить с обычными наполнителями, общепринятыми методиками, например, такими, которые описаны в Remington's Pharmaccutical Sciences Handbook, Mack Pub. Co., N. 4. USA, 17 08 изд. 1985, приспособленными для внутримышечного, внутривенного, перорального, аэрозольного и ректального введения.
Дневная доза будет зависеть от нескольких факторов, например, тяжести патологии и состояния пациента: обычно она составляет от 1 до 50 мг соединения формулы (I) пациенту, весящему 70 кг, при этом ее вводят один или несколько раз в день.
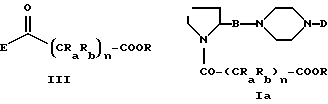
Соединения формулы (I) получают путем взаимодействия соединения формулы (II)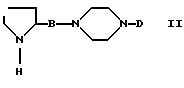
в которой
B и D являются такими, как они определены выше, с соединением формулы (III)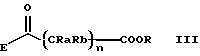
в которой
Ra, Rb и n имеют вышеописанные значения, R является C1-C6-алкильной, бензильной, аллильной группой или любой другой группой, которую можно легко удалить;
E является галогеном (хлором, бромом), N-имидазолиллом, OH, O-гидроксисукцинимидолом, или взятый вместе с карбонильной группой он образует смешанный ангидрид с карбоновой или сульфокислотой (например, трифторметансульфокислотой) для получения соединений формулы (Ia)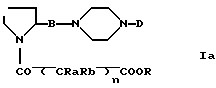
Соединения формулы (Ia) можно превратить в соединения формулы (I) посредством обычных реакций, например:
a) когда R является C1-C6-алкилом, гидролизом с минеральными основаниями, например, гидроксидами натрия, калия, лития различных концентраций и в различных растворителях (например, метаноле, этаноле, диметилформамиде);
b) когда R является аллилом или бензилом, каталитической гидрогенизацией с различными катализаторами (например, с палладием на угле при различных концентрациях, скелетным никелевым катализатором палладийтетракис(трифенилфосфином) и т. п. и в различных растворителях (например, метаноле, этаноле, толуоле, метиленхлориде) или посредством методик передачи водорода, например с формиатом аммония, циклогексеном или гипофосфитом натрия, в присутствии палладия на угле в растворителях, например, воде, низших спиртах или их смесях.
Реакцию соединения (II) с соединением (III) обычно осуществляют в инертном растворителе и в присутствии подходящего основания. В случае, когда E-CO- является карбоксигруппой (E=OH), реакцию осуществляют в инертном растворителе и в присутствии конденсирующих средств, например, карбодиимидов, изонитрилов и т.п.
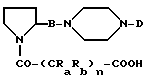
Получение соединений формулы (II) осуществляют исходя из кислоты формулы (IV)
в которой
R' является подходящей защитной группой, которую можно удалить реакциями, описанными ниже и с функциональными группами, присутствующими в молекуле. Обычными защитными группами формулы R' могут быть: трет-бутоксикарбонил, метоксикарбонил, 9-фтороксикарбонил, 2,2,2-трихлорэтоксикарбонил, аллилоксикарбонил, бензилоксикарбонил. Соединения формулы (IV) являются коммерчески доступными или их можно получить из пролина посредством обычных и широко известных реакций, которые приводятся в литературе.
Если упомянутые соединения являются коммерчески недоступными, как их энантиомерно чистые формы, их можно растворить общепринятыми способами, например, солеобразованием с оптически активными основаниями и отделением диастереомерных солей.
Превращение соединений формулы (IV) в соединения формулы (V)
в которой R' имеет вышеопределенные значения, можно осуществлять обычными реакциями.
В частности:
a) синтез соединений формулы (Va)
исходя из соединений формулы (IV), можно проводить путем превращения карбоксигруппы в сукцинимидоэфир, хлорангидрид, смешанный ангидрид, имидазолид или другие реагирующие производные карбоксигруппы и их конденсации с аминами формулы (VI)
b) синтез соединений формулы (Vb)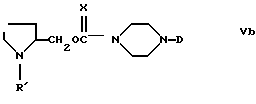
в которой
X=O или S, исходя из соединений формулы (IV),
можно осуществлять путем восстановления карбоксигруппы или соответствующего смешанного ангидрида или производной эфира карбоновой кислоты до первичного спирта (CH2OH), который можно превратить в карбамат или тиокарбамат путем реакции с карбонилдиимидазолом или тиокарбонилдиимидазолом и в дальнейшем с амином формулы (VI). Восстановление карбоксигруппы пролина или ее смешанного ангидрида до спирта можно подходяще осуществлять восстановителями, например, дибораном или боргидридом щелочного или щелочноземельного металла;
c) синтез соединений формулы (Vc)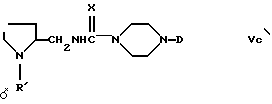
в которой
X= O или S, можно осуществлять путем превращения спиртов, полученных как описано в пункте b), в соответствующие амины согласно реакции Mitsunobu's при использовании в качестве нуклеофильного агента ди-трет-бутилиминодикарбоксилата и последующего удаления аминогруппы газообразной хлористоводородной кислотой или трифторуксусной кислотой. Полученные амины можно превратить в соответствующие мочевины или тиомочевины путем взаимодействия соответственно с карбонил- или тиокарбонилдиимидазолом и в дальнейшем с амином формулы (VI).
Превращение соединений формулы (V) в соединения формулы (II) можно осуществлять обычными способами удаления (отщепления), которые являются специфическими и селективными для использований защитной группы, и, в частности, в случае BOC-производных, с помощью трифторуксусной кислоты или триметилсилилиодида.
Соединения формулы (III) получают в соответствии с обычными способами, описанными в литературе.
Изобретение иллюстрируют последующие примеры и формулировки. Концентрации выражены в виде % соотношения W/V. Описанные соединения следует рассматривать как рацемические смеси, если не установлено иным образом посредством обозначений (+) и (-). Моноалкильные или монобензильные эфиры малоновой кислоты и ее ацилхлориды известны в литературе или, во всяком случае, могут быть получены в соответствии с обычными способами, которые широко описаны в литературе.
Пример 1.
Раствор, содержащий 2,5 г BOC- α -пролина в безводном ТГФ (тетрагидрофуране) (10 мл) при температуре 0oC под атмосферой инертного газа и при перемешивании добавляют к 2,9 г N-гидроксилсукцинимида, растворенного в 10 мл ТГФ. Упомянутый раствор добавляют по каплям к раствору 2,1 мл морфолинэтилизонитрила в 5 мл ТГФ и перемешивание продолжают при комнатной температуре в течение 2 часов; реакционную смесь подкисляют 1 N хлористоводородной кислотой до кислых значений pH (используют лакмусовую бумагу) и экстрагируют этилацетатом (3x10 мл). Соединенные органические экстракты концентрируют под вакуумом до кристаллизации BOC- α -пролинсукцинимидоэфира, который отделяют фильтрацией для получения 2,6 г точка плавления: 128-130oC.
1 г BOC- α - пролинсукцинимидоэфира растворяют в ацетонитриле (7 мл) при комнатной температуре и под атмосферой инертного газа, затем при перемешивании добавляют 0,97 г N-[4,6-бис/пирролидин-1-ил] 1,3,5-триазин-2-ил] пиперазина, растворенного в ацетонитриле (5 мл). Через 5 часов реакционную смесь концентрируют под вакуумом до маленького объема, затем ее добавляют к насыщенному раствору бикарбоната натрия до слабоосновного значения pH. Смесь экстрагируют этилацетатом (3 x 10 мл), затем объединенные экстракты концентрируют под вакуумом до маленького объема. При добавлении этилового эфира получают осадок 1,5 г (-)-N-пирролидин-1-трет-бутоксикарбонил-2-ил) карбонил] - N' -[4,6-бис(пирролидин-1-ил)-1,3,5-триазин-2-ил] пиперазина после перекристаллизации из диизопропилового эфира, точка плавления: 148oC, [α]D= -20,25o (c=2,01 в EtOH).
Пример 2.
Путем взаимодействия раствора BOC-пролин-N-гидроксисукцинимидоэфира в ацетонитриле с подходящим N-замещенным пиперазином в соответствии с методикой, описанной в примере 1, получают следующие N',N-дизамещенные пиперазины:
N'-[пирролидин-1-трет-бутоксикарбонил-2-ил/карбонил]-N-[2,6- бис/диэтиламино/пиримидин-4-ил/пиперазин];
N'-[пирролидин-1-трет-бутоксикарбонил-2-ил/карбонил]-N-[2,6- бис/аллиламино/пиримидин-4-ил]пиперазин;
(-)-N'-[(пирролидин-1-трет-бутоксикарбонил-2-ил/карбонил] -N-[2,6- бис(пирролидин-1-ил)пиримидин-4-ил]пиперазин, точка плавления: 168-170oC;
[α]D = -20,7o (с = 2 в EtOH);
(+)-N'-[пирролидин-1-трет-бутоксикарбонил-2-ил/карбонил] -N-[2,6- бис(пирролидин-1-ил)пиримидин-4-ил]пиперазин, [ [α]D ]D = +20,2o (c = 2,03 в EtOH);
N'-[(пирролидин-1-трет-бутоксикарбонил-2-ил/карбонил] -N- [2,6-бис/пирролидин-1-ил/пиримидин-4-ил] пиперазин, точка плавления: 125o;
N'-(пирролидин-1-трет-бутоксикарбонил-2-ил)-N-[4,6-бис/ аллиламино-1,3,5-триазин-2-ил]пиперазин;
N'-[(пирролидин-1-трет-бутоксикарбонил-2-ил/карбонил] -N- [4,6-бис/диэтиламино/-1,3,5-триазин-2-ил]пиперазин;
(-)-N'-[(пирролидин-1-трет-бутоксикарбонил-2-ил/карбонил] -N- 3,6-бис/диэтиламино/пиридин-2-ил]пиперазин,
[α]D = -19,3o (c = 2,07 в EtOH);
(+)-N'-[(пирролидин-1-трет-бутоксикарбонил-2-ил/карбонил] -N- 3,6-бис/диэтиламино/пиридин-2-ил]пиперазин,
[α]D = +19,8o (c = 2,01 в EtOH);
N'-[(пирролидин-1-трет-бутоксикарбонил-2-ил/карбонил] -N- [3,6-бис(пирролидин-1-ил)пиридин-2-ил]пиперазин;
N'-[(пирролидин-1-трет-бутоксикарбонил-2-ил/карбонил] -N- [3,6-бис/аллиламино/пиридин-2-ил]пиперазин;
N'-[(пирролидин-1-трет-бутоксикарбонил] -2-ил/карбонил]-N- [3,6-бис((N-этил-N-аллиламино)пиридин-2-ил]пиперазин;
N'-[(пирролидин-1-трет-бутоксикарбонил-2-ил/карбонил] -N- [3-этиламинопиридин-2-ил]пиперазин.
Пример 3.
При перемешивании и под атмосферой инертного газа к раствору 1,4 г (-)-N'-[(пирролидин-1-трет-бутоксикарбонил-2-ил)карбонил]-N- [4,6-бис/пирролидин-1-ил)-1,3,5-триазин-2-ил] пиперазина в 10 мл метиленхлорида добавляют 2,54 мл трифторуксусной кислоты. Через 3 часа при комнатной температуре реакционную смесь добавляют к 1N NaOH до основного значения pH, затем ее экстрагируют метиленхлоридом и повторно промывают водой. Объединенные органические экстракты сушат над сульфатом натрия и растворитель выпаривают под пониженным давлением. Сырой продукт выкристаллизовывают из этилового эфира до получения 950 мг (-)-N'-[(пирролидин-2-ил/карбонил]-N-[4,6-бис/ пирролидин-1-ил/1,3,5-триазин-2-ил]пиперазина, точка плавления: 143oC,
[α]D = -65,75o (с = 0,23 в EtOH):
Пример 4
Путем взаимодействия N,N'-дизамещенного пиперазина, описанного в примере 2, согласно методике, описанной в примере 3, получают следующие N'-замещенные N-[пирролидин-2-ил(карбонил)пиперазины:
N'-[(пирролидин-2-ил/карбонил] -N-[2,6-бис(диэтиламино) пиримидин-4-ил] пиперазин;
N'-[(пирролидин-2-ил/карбонил] -N-[2,6-бис(аллиламино)- пиримидин-4-ил] пиперазин;
(-)-N'-[(пирролидин-2-ил/карбонил]-N-[2,6-бис/пирролидин-1-ил/ пиримидинил-4-ил] пиперазин, точка плавления: 172 - 174oC, [α]D = -56,6, (C = 1,88 в EtOH),
(+)-N-[(пирролидин-2-ил/карбонил] -N-2,6-бис/пирролидин-1-ил/ пиримидин-4-ил] пиперазин, точка плавления: 148 - 151oC, [α]D = +53,5o (C = 2,02 в EtOH);
N'-[(пирролидин-2-ил/карбонил] -N-2,6-бис/пирролидин-1-ил/ пиримидин-4-ил]пиперазин, точка плавления: 137oC;
N'-[(пирролидин-2-ил/карбонил] -N-4,6-бис/аллиламино/-1,3,5- триазин-2-ил]пиперазин;
N'-[(пирролидин-2-ил/карбонил] -N-4,6-бис(диэтиламино)-1,3,5- триазин-2-ил]пиперазин;
(-)-N'-[(пирролидин-2-ил/карбонил]-N-[3,6-бис(диэтиламино) пиридин-2-ил] пиперазин, масло, [α]D = -43,3o (C = 2,56 в EtOH);
(+)-N'-[(пирролидин-2-ил/карбонил]-N-[3,6-бис(диэтиламино) пиридин-2-ил] пиперазин; [α]D = +48,4o (C = 2,01 в EtOH);
N'-[(пирролидин-2-ил/карбонил]-N-[3,6-бис(пирролидин-1-ил) пиридин-2-ил] пиперазин;
N'-[(пирролидин-2-ил/карбонил] -N-[3,6-бис(аллиламино)-пиридин- 2-ил]пиперазин;
N'-[(пирролидин-2-ил/карбонил] -N-[3,6-бис(N-этил-N-аллиламино/ пиридин-2-ил]пиперазин;
N'-[(пирролидино-2-ил/карбонил]-N-[3-этиламинопиридин-2-ил] пиперазин.
Пример 5
0,8 г (-)-N'-[(пирролидин-2-ил/карбонил]-N-[4,6-бис-(пирролидин-1-ил)- 1,3,5-триазин-2-ил]пиперазина, растворенного в 20 мл ацетонитрила, добавляют при 0oC и перемешивании к 0,22 г бикарбоната калия и к раствору 0,28 мл этилмалонилхлорида в 5 мл ацетонитрила. Через 4 часа при комнатной температуре и перемешивании реакционную смесь прибавляют к воде (50 мл) и экстрагируют повторно этилацетатом (3•20 мл). Соединенные органические экстракты сушат над сульфатом натрия и растворитель выпаривают под пониженным давлением. Остаток (0,86 г) очистили хроматографией на силикагеле (при использовании в качестве элюента гексена (AcOEt при их соотношении 1:1) до получения 0,6 г (-)-N'-[(1-этоксималонилпирролидин-2-ил/карбонил]-N-[4,6-бис/ пирролидин-1-ил)-1,3,5-триазин-2-ил]пиперазина, точка плавления: 115oC,
[α]D = -23,95 (c = 0,2 в EtOH).
Пример 6
В соответствии с методикой, описанной в примере 5, исходя из N,N'-дизамещенных пиперазинов, описанных в примере 4, и из сложного моноэфира хлорангидридов малоновых кислот, возможно 2,2-дизамещенных, получают следующие пиперазины:
N'-[(1-этоксималонилпирролидин-2-ил/карбонил] -N-[2,6-бис/ диэтиламино/пиримидин-4-ил]пиперазин;
N'-[(1-этоксималонилпирролидин-2-ил/карбонил] -N-[2,6-бис/ аллиламино/пиримидин-4-ил]пиперазин;
(-)-N'-[(1-этоксималонилпирролидин-2-ил/карбонил] -N-2,6-бис/ пирролидин-1-ил/пиримидин-4-ил/пиперазин; точка плавления: 170 - 172oC, [α]D = -26,5o (c = 2,19 в EtOH);
(+)-N'-[(1-этоксималонилпирролидин-2-ил/карбонил]-N-[2,6-бис (пирролидин-1-ил/пиримидин-4-ил] пиперазин; точка плавления: 133 - 135oC; [α]D = +26,5o (C = 2,14 в EtOH).
N'-[(1-этоксималонилпирролидин-2-ил/карбонил] -N-[2,6-бис (пирролидин-1-ил)пиримидин-4-ил]пиперазин, точка плавления: 127 - 129oC;
N'-[(1-этоксималонилпирролидин-2-ил/карбонил] -N-[4,6-бис/ аллиламино/-1,3,5-триазин-2-ил]пиперазин;
N'-[(1-этоксималонилпирролидин-2-ил/карбонил] -N-[4,6-бис/ диэтиламино/-1,3,5-триазин-2-ил]пиперазин;
(-)-N'-[(1-этоксималонилпирролидин-2-ил)карбонил]-N-[3,6-бис (диэтиламино/пиридин-2-ил]пиперазин. Температура плавления гидрохлорида 80 - 85oC, [α]D = -20,6 (свободное основание, c = 2,09 в EtOH), (+)-N'-[(1-этоксималонилпирролидин-2-ил) карбонил]-N'-[3,6-бис(диэтиламино)пиридин-2-ил] пиперазин, [α]D = +2,01 (c = 2,01 в EtOH);
N'-[(1-этоксималонилпирролидин-2-ил)карбонил] -N-[3,6-бис/ пирролидин-1ил/пиридин-2-ил]пиперазин;
N'-[(1-этоксималонилпирролидин-2-ил/карбонил] -N-[3,6-бис/ аллиламино/пиридин-2-ил]пиперазин;
N'-[(1-этоксималонилпирролидин-2-ил/карбонил]-N-[3,6-бис/N-этил- N-аллиламино/пиридин-2-ил]пиперазин;
N'-[(1-этоксималонилпирролидин-2-ил/карбонил] -N-[3-этил- аминопиридин-2-ил]пиперазин;
N'-[(1-бензилоксималонилпирролидин-2-ил/карбонил]-N-[2,6-бис/ диэтиламино/пиримидин-4-ил]пиперазин;
N'-[(1-бензилоксималонилпирролидин-2-ил/карбонил]-N-[2,6-бис( аллиламино)пиримидин-4-ил]пиперазин;
(-)-N'-[(1-бензилоксималонилпирролидин-2-ил/карбонил]-N-[2,6- бис/пирролидин-1-ил/пиримидин-1-ил/пиримидин-4-ил] пиперазин; точка плавления: 144 - 145oC; [α]D = -26,5 (c = 0,23 в EtOH);
N'-[(1-бензилоксималонилпирролидин-2-ил/карбонил]-N-[4,6-бис( аллиламино)-1,3,5-триазин-2-ил]пиперазин;
N'-(1-бензилоксималонилпирролидин-2-ил/карбонил]-N-[4,6-бис (диэтиламино)-1,3,5-триазин-2-ил]пиперазин;
N'-[(1-бензилоксималонилпирролидин-2-ил/карбонил]-N-[4,6-бис (пирролидин-1-ил)-1,3,5-триазин-2-ил]пиперазин;
N'-[(1-бензилоксималонилпирролидин-2-ил/карбонил]-N-[3,6-бис (диэтиламино)пиридин-2-ил]пиперазин;
N'-[(1-бензилоксималонилпирролидин-2-ил/карбонил] -N-[3,6- (пирролидин-1-ил)пиридин-2-ил]пиперазин;
N'-[(1-бензилоксималонилпирролидин-2-ил/карбонил]-N-[3,6-бис (аллиламино)пиридин-2-ил]пиперазин;
N'-[(1-бензилоксималонилпирролидин-2-ил)карбонил] -N-[3,6-бис /N-этил-N-аллиламино/пиридин-2-ил]пиперазин;
N'-[(1-бензилоксималонилпирролидин-2-ил)карбонил] -N-[3,6-бис (N-этил-N-аллиламино)пиридин-2-ил]пиперазин;
N'-[(1-бензилоксималонилпирролидин-2-ил)карбонил] -N-[3-N-этил- аминопиридин-2-ил]пиперазин;
N'-[(1-//2', 2'-диметил(бензилоксималонил/пирролидин-2-ил/карбонил]- N-[2,6-бис(диэтиламино)пиримидин-4-ил]пиперазин;
N'-[1-//2', 2'-диметил/бензилоксималонил/пирролидин-2-ил/ карбонил]-N-[2,6-бис/аллиламино/пиримидин-4-ил]пиперазин;
(-)-N'-[(1-//2', 2'-диметил/бензилоксималонил/пирролидин-2-ил/ карбонил] -N-[2,6-бис/пирролидин-1-ил/пиримидин-4-ил]пиперазин, точка плавления: 104 - 106o, [α]D = -43,2o (c = 0,24 в EtOH);
N'-[/1-//2', 2'-диметил/бензилоксималонил/пирролидин-2-ил/ карбонил]-N-[4,6-бис/аллиламино/-1,3,5-триазин-2-ил]пиперазин;
N'-[/1-//2',2'-диметил/бензилоксималонил/пирролидин-2-ил/карбонил]-
N-[4,6-бис/диэтиламино/-1,3,5-триазин-2-ил]пиперазин;
N'-[(1-//2', 2'-диметил/бензилоксималонил/пирролидин-2-ил/ карбонил]-N-[3,6-бис/диэтиламино/пиридин-2-ил]пиперазин;
N'-[/1-//2', 2'-диметил/бензилоксималонил/пирролидин-2-ил/ карбонил]-N-[3,6-бис/пирролидин/пиридин-2-ил]пиперазин;
N'-[/1-//2', 2'-диметил/бензилоксималонил/пирролидин-2-ил/ карбонил]-N-[3,6-бис/-(аллиламино)пиридин-2-ил]пиперазин;
N'-[/1-//2', 2'-диметил/бензилоксималонил/пирролидин-2-ил/ карбонил]-N-[3-этиламинопиридин-2-ил]пиперазин.
Пример 7
Раствор 0,5 г (-)-N'-[(1-этоксималонилпирролидин-2-ил/карбонил] - N-[4,6-бис/пирролидин-1-ил/-1,3,5-триазин-2-ил] пиперазина в 5 мл метанола добавляют при перемешивании и под атмосферой инертного газа к 80 мл гидроксида натрия (35%-ый водный раствор). Перемешивание продолжают в течение более 20 часов, затем реакционную смесь доводят до нейтрального значения pH путем добавления бикарбоната натрия, фильтруют над броунмиллеритом и растворитель выпаривают под пониженным давлением. Сырой продукт (0,52 г) очищают хроматографией на силикагеле (при использовании в качестве элюента смеси метиленхлорида и метанола при их соотношении в смеси 9:1) для получения 0,43 г (-)-N'-[/1-/1'-малонил/пирролидин-2-ил/карбонил/]-N- [4,6-бис/пирролидин-1-ил/-1,3,5-триазин-2-ил] пиперазина, точка плавления: 208 - 211oC, [α]D = -21,7o; (C = 0,3 в EtOH).
Пример 8
1,5 г (-)-N'-[/1-бензилоксималонилпирролидин-2-ил/карбонил] -N- [2,6-бис/пирролидин-1-ил/пиримидин-4-ил] пиперазина растворяют в смеси 20 мл метанола и 6 мл толуола, затем осторожно под азотной защитой добавляют 1,5 г 10% палладия на угле. Полученную реакционную смесь подвергают каталитической гидрогенизации под атмосферным давлением, используя, например, такую аппаратуру, которая описана в Vogel's Textbook of Practical Organic Chemistry, 5-е изд., Longman Scientific & Technical (USA Gohn Wiley & Sons, Inc.). 1989, с. с. 89 - 92. Через 10 минут реакционную смесь фильтруют через броунмиллеритовую пробку для удаления катализатора и растворитель выпаривают под пониженным давлением. Путем кристаллизации сырого продукта из этилового эфира (5 мл) получают 1,1 г (-)-N'-[(1-(1'-малонил/пирролидин-2-ил/карбонил]-N-[2,6-бис- (пирролидин-1-ил)пиримидин-4-ил] пиперазина, точка плавления: 205 - 207oC, [α]D = -19,25o (c = 0,21 в EtOH).
Пример 9
Следуя методике, описанной в примере 7 или в примере 8, исходя из соответствующих эфиров, описанных в примере 6, получают следующие карбоновые кислоты:
N'-[/1-/1'-малонил/пирролидин-2-ил/карбонил] -N-[2,6-бис/ диэтиламино/пиримидин-4-ил]пиперазин, точке плавления: 193 - 195oC.
N'-[/1-/1'-малонил/пирролидин-2-ил/карбонил] -N-[2,6-бис/ аллиламино/пиримидин-4-ил]пиперазин;
N'-[/1-/1'-малонил/пирролидин-2-ил/карбонил] -N-[4,6-бис/ аллиламино/-1,3,5-триазин-2-ил]пиперазин, точка плавления - 200 - 201oC;
N'-[/1-/1'-малонил/пирролидин-2-ил/карбонил] -N-[4,6-бис/ диэтиламино/1,3,5-триазин-2-ил]пиперазин;
N'-[/1-/1'-малонил/пирролидин-2-ил/карбонил] -N-[3,6-бис/ диэтиламино/пиридин-2-ил]пиперазин, точка плавления натриевой соли: 188 - 191oC.
N'-[/1/1'-малонил/пирролидин-2-ил/карбонил] -N-[3,6-бис/ пирролидин-1-ил/пиридин-2-пиперазин;
N'-[/1-/1'-малонил/пирролидин-2-ил/карбонил] -N-[3,6-бис/ аллиламино/пиридин-2-ил]пиперазин, точка плавления калиевой соли 179 - 180oC.
N'-[/1-/1'-малонил/пирролидин-2-ил/карбонил] -N-[3,6-бис/N-этил- N-аллиламино/пиридин-2-ил]пиперазин;
N'-[/1-/1'-малонил/пирролидин-2-ил/карбонил] -N-[3- этиламинопиридин-2-ил]пиперазин, точка плавления натриевой соли 171 - 174oC;
N'-[/1-2', 2'-диметил-1'-малонил/пирролидин-2-ил/карбонил] -N- [2,6-бис/диэтиламино/пиримидн-4-ил]пиперазин, точка плавления 166 - 168oC.
N'-[/1-/2', 2'-диметил-1'-малонил/пирролидин-2-ил/карбонил] -N- [2,6-бис/аллиламино/пиримидин-4-ил]пиперазин;
(-)-N'-[/1-/2', 2'-диметил-1'-малонил/пирролидин-2-ил/карбонил] -N- [2,6-бис/пирролидин-1-ил/пиримидин-4-ил] пиперазин, точка плавления: 160 - 163oC, [α]D = -28,4o (c = 0,2 в EtOH);
N'-[/1-/2', 2'-диметил-1'-малонил/пирролидин-2-ил/карбонил] -N- [4,6-бис/аллиламино/-1,3,5-триазин-2-ил]пиперазин точка плавления 170 - 172oC;
N'-[/1-/2', 2'-диметил-1'-малонил/пирролидин-2-ил/карбонил] -N- [4,6-бис/диэтиламино)-1,3,5-триазин-2-ил]пиперазин;
N'-[/1-/2', 2'-диметил-1'-малонил/пирролидин-2-ил/карбонил] -N- [4,6-бис/пирролидин-1-ил/-1,3,5-триазин-2-ил] пиперазин, точка плалвения: 180 - 181oC;
N'-[/1-/2', 2'-диметил-1'-малонил/пирролидин-2-ил/карбонил] - N-[3,6-бис/диэтиламино/пиридин-2-ил] пиперазин, температура плавления натриевой соли: 189-192oC;
N'-/1-/2', 2'-диметил-1'-малонил/пирролидин-2-ил/карбонил] -N- [3,6-бис/пирролидин-1-ил/пиридин-2-ил]пиперазин,
N'[/1-/2', 2'-диметил-1'-малонил/пирролидин-2-ил/карбонил] - N-[3,6-бис/аллиламино/пиридин-2-ил]пиперазин;
N'-[/1-2', 2'-диметил-1'-малонил/пирролидин-2-ил/карбонил] - N-[3,6-бис/N-этил-аллиламино/пиридин-2-ил]пиперазин, температура плавления калиевой соли: 195-200oC;
N'-[/1-/2', 2'-диметил-1'-малонил/пирролидин-2-ил/карбонил] - N-[3-этиламинопиридин-2-ил] пиперазин, температура плавления калиевой соли: 206-208oC.
Пример 10
Раствор BOC-(L)-пролина в 60 мл безводного ТГФ (тетрагидрофурана), охлажденного до -10oC рассолом, добавляют к 6,1 мл триэтиламина и 1 г 4oA молекулярных сит, затем при поддержании температуры ниже -5oC туда по каплям добавляют раствор 4,16 мл этилхлорформиата в 5 мл безводного ТГФ. Через 30 минут при перемешивании реакционную смесь фильтруют для удаления осадка триэтиламмонийхлорида и фильтрат концентрируют под пониженным давлением до объема 30 мл. Полученный раствор по каплям вливают в суспензию 7,5 г боргидрида натрия в 50 мл безводного ТГФ, охлаждают до -10oC рассолом. Через 2 часа реакционную смесь добавляют к 200 мл водного насыщенного раствора первичного кислого фосфорнокислого натрия при поддержании температуры 0oC с помощью смеси воды со льдом, затем ее экстрагируют этилацетатом (3x50 мл). Объединенные органические экстракты повторно промывают водным насыщенным раствором бикарбоната натрия (3x30 мл), сушат над сульфатом натрия и растворитель выпаривают под пониженным давлением. Путем кристаллизации остатка из гексана получают 6,1 г BOC-(L)-пролинола, температура плавления: 59-60oC, [α]D = 54,9o, (C=0,2 в EtOH).
Пример 11
Раствор 3 г BOC-(L)-пролинола в 100 мл безводного ТГФ, охлажденного до 0oC смесью со льдом, при перемешивании и под атмосферой инертного газа порциями добавляют к 2,9 карбонилдиимидазола, затем реакционную смесь нагревают до комнатной температуры и перемешивание продолжают в течение 3 часов. Упомянутый раствор порциями добавляют к 4,5 г N-[2,6-бис/пирролидин-1-ил/пиримидин-4-ил] пиперазина в перемешивание продолжают в течение 18 часов. Реакционную смесь добавляют к 400 мл водного насыщенного раствора первичного кислого фосфорнокислого натрия и экстрагируют этилацетатом (3x100 мл). Объединенные органические экстракты сушат над сульфатом натрия и растворитель выпаривают под пониженным давлением.
Остаток (7,5 г) очищают хроматографией на силикагеле при использовании в качестве элюента смеси гексана и этилацетата при их соотношении в смеси 7:3 (для получения 5,5 г (-(-N'-[/1-/трет-бутоксикарбонил/пирролидин-2-ил/метилоксикарбонил] - N-[/2,6-бис/пирролидин-1-ил/пиримидин-4-ил] пиперазина, точка плавления: 147oC, [α]D = -32oC, (C=0,25 в EtOH).
Пример 12
17,4 мл трифторуксусной кислоты вливают по каплям в раствор 10 г (-)-N'[/1-трет-бутоксикарбонил/пирролидин-2-ил/метилоксикарбонил] -N- [2,6-бис/пирролидин-1-ил/пиримидин-4-ил]пиперазина в 300 мл метиленхлорида. Почти через 18 часов реакционную смесь добавляют к 1 N водному раствору гидроксида натрия и экстрагируют метиленхлоридом (3x150 мл). Соединенные органические экстракты промывают водой (2x100 мл), сушат над сульфатом натрия и растворитель выпаривают под пониженным давлением. Путем кристаллизации остатка из смеси диизопропилового эфира и этилацетата при соотношении компонентов в смеси 9:1 получают 65 г (-)-N'-[/пирролидин-2-ил(метоксикарбонил]- N-[2,6-бис(пирролидин-1-ил)пиримидин-4-ил] пиперазина, точка плавления: 137-138oC., [α]D = -8,7o (c=0,23 в EtOH).
Пример 13
Раствор 3,4 г монобензилового эфира 2,2-диметилмалоновой кислоты в 75 мл безводного диметилформамида, охлажденного до 0oC рассолом, последовательно при перемешивании и под атмосферой инертного газа добавляют к 3,77 г 1-гидроксибензотриазола, 1,55 мл N-метилморфолина, 6 г (-)-N'-[/пирролидин-2-ил/метилоксикарбонил] - N-[2,6-бис/пирролидин-1-ил/пиримидин-4-ил]пиперазина и в заключение к 5,35 г N'-/3-диметиламинопропил/-N-этил-карбодиимидгидрохлорида, растворенного в 25 мл диметилформамида. Смесь оставляют нагреваться до комнатной температуры, затем перемешивание продолжают в течение еще 18 часов. Растворитель выпаривают под пониженным давлением, затем реакционную смесь добавляют к 200 мл насыщенного водного раствора бикарбоната натрия и экстрагируют этилацетатом (3x100 мл). Соединенные органические экстракты сушат над сульфатом натрия и растворитель выпаривают под пониженным давлением. Получают 10,2 г сырого продукта, который очищают силикагельной хроматографией (300 г диоксида кремния, при использовании в качестве элюента смеси петролейного эфира и этилацетата при соотношении компонентов в смеси 1: 1) для получения 6,5 г (-)-N'-[/1-/3'-бензилокси-2',2'-диметилмалон-1-ил/пирролидин-2-ил/ метилоксикарбонил]-N-[2,6-бис/пирролидин-1-ил/пиримидин-4-ил] пиперазина в виде светло-коричневой пены. 6,45 г (-)-N'-[/1-/3'-бензилокси-2',2'-диметилмалон-1'-ил/пирролидин- 2-ил/метоксикарбонил] -N-[2,6-бис/пирролидин-1-ил/пиримидин-4-ил] пиперазина растворяют в смеси 100 мл метанола и 40 мл толуола. Упомянутый раствор осторожно добавляют к 0,65 г 10% палладия на угле и образованную реакционную смесь подвергают каталитической гидрогенизации под атмосферным давлением, используя, например, такую аппаратуру, которая описана в Vogel's Textbook, of Practical Organic Chemistry, 5-е изд. Longman Scientific & Technical (USA Gohn Wiley & Sons, Inc) 1989, с. 89-92. Через 10 минут реакционную смесь отфильтровывают через броунмиллеритовую пробку для удаления катализатора, и растворитель выпаривают под пониженным давлением. Путем кристаллизации сырого продукта из диизопропилового эфира получают 5,5 г (-)-N'-[/1-/2',2'-диметилмалон-1'-ил/пирролидин-2- ил/метилоксикарбонил]-N-[2,6-бис/пирролидин-1-ил/пиримидин-4-ил] пиперазина, точка плавления: 159-160oC, [α]D = -49,8o (с=0,21 в EtOH).
Пример 14.
Следуя методикам, описанным в примерах 11, 12 и 13, исходя из соответствующих N-замещенных пиперазинов и из соответствующих моноалкильных или монобензиловых эфиров малоновых кислот, возможно 2,2-дизамещенных, получали N'-, N'-дизамещенные пиперазины:
N'-[/1-/1'-малонил/пирролидин-2-ил/метилоксикарбонил] -N- [2,6-бис/диэтиламино/пиримидин-4-ил]пиперазин, точка плавления: 168 - 170oC.
N'-[/1-/1'-малонил/пирролидин-2-ил/метоксикарбонил]-N-[2,6- бис/аллиламино/пиримидин-4-ил]пиперазин;
(-)-N'-[/1-(1'-малонил/пирролидин-2-ил)метилоксикарбонил] -N- [2,6-бис/пирролидин-1-ил/пиримидин-4-ил] пиперазин, точка плавления: 169 - 170oC, [α]D = -38,1o (c = 0,2, в EtOH);
N'-[1-/1'-малонил/пирролидин-2-ил/метилоксикарбонил]-N-[4,6- бис/аллиламино/-1,3,5-триазин-2-ил]пиперазин, точка плавления: 177 - 181oC;
N'-[/1-/1'-малонил/пирролидин-2-ил/метилоксикарбонил]-N-[4,6- бис/диэтиламино/1,3,5-триазин-2-ил]пиперазин;
N'-[/1-/1'-малонил/пирролидин-2-ил/метилоксикарбонил]-N-[3,6- бис/диэтиламино/пиридин-2-ил] пиперазин, температура плавления натриевой соли: 198 - 199oC;
N'-[/1-/1'-малонил/пирролидин-2-ил/метилоксикарбонил] -N- [3,6-бис/пирролидин-1-ил/пиридин-2-ил] пиперазин, температура плавления натриевой соли: 203 - 205oC;
N'-[1-/1'-малонил/пирролидин-2-ил/метилоксикарбонил]-N- 3,6-бис/аллиламино/пиридин-2-ил]пиперазин;
N'[/1-/1'-малонил/пирролидин-2-ил/метилоксикарбонил] -N- [3,6-бис/N-этил-N-аллиламино/пиридин-2-ил]пиперазин;
N'-[/1-/1'малонил/пирролидин-2-ил/метилоксикарбонил]-N-[3- этиламинопиридин-2-ил]пиперазин, температура плавления натриевой соли: 200 - 201oC;
N'-[/1-/2', 2'-диметил-1'-малонил/пирролидин-2- ил/метилоксикарбонил]-N-[2,6-бис/диэтиламино/пиримидин-4-ил]пиперазин;
N'[/1-/2', 2'-диметил-1'-малонил/пирролидин-2- ил/метилоксикарбонил]-N-[2,6-бис/аллиламино/пиримидин-4-ил/пиперазин, точка плавления: 161 - 162oC.
N'-[/1-/2', 2'-диметил-1'-малонил/пирролидин-2- ил/метилоксикарбонил]-N-[4,6-бис/аллиламино/-1,3,5-триазин-2-ил] пиперазин, точка плавления: 167 - 170oC;
N'-[/1-/2', 2'-диметил-1'-малонил/пирролидин-2- ил/метилоксикарбонил]-N-[4,6-бис/диэтиламино/-1,3,5-триазин-2- ил]пиперазин;
N'-[/1-/2', 2'-диметил-1'-малонил/пирролидин-2- ил/метилоксикарбонил]-N-[4,6-бис/пирролидин-1-ил/1,3,5-триазин- 2-ил] пиперазин, точка плавления: 172 - 173oC;
N'-[/1-/2', 2'-диметил-1'-малонил/пирролидин-2- ил/метилоксикарбонил]-N-[3,6-бис/диэтиламино/пиридин-2-ил]пиперазин;
N'-[/1-/2', 2'-диметил-1'-малонил/пирролидин-2- ил/метоксикарбонил]-N-[3,6-бис/пирролидин-1-ил/пиридин-2- ил] пиперазин, температура плавления калиевой соли: 206 - 209oC;
N'-[/1-/2', 2'-диметил-1'-малонил/пирролидин-2- ил/метилоксикарбонил]-N-[3,6-бис/аллиламино/пиридин-2-ил]пиперазин;
N'-[/1-/2', 2'-диметил-1'-малонил/пирролидин-2- ил/метилоксикарбонил]-N-[3,6-бис/N-этил-N-аллиламино/пиридин-2-ил] пиперазин, температура плавления натриевой соли: 210 - 213oC;
N-[/1-/2', 2'-диметил-1'-малонил/пирролидин-2- ил/метилоксикарбонил]-N-[3-этиламинопиридин-2-ил]пиперазин, температура плавления калиевой соли: 220 - 225oC.
Токсичность полученных соединений очень низкая и соответствует DL50 > 1000 мг/кг per os.
ЭФР тест заключается в подсчете количества воспалительных клеток (нейтрофилы и зозинофилы) после "Бронхоальвелярного Лаважа" (БЛ) проведенного после 72 ч после экспозиции морских свинок предварительно обработанных овальбумином, к более высокой аэрозольной дозе овальбумина, как описано в Hustou, P.A. et al., Am. Rev. Pespir. Dis, 137,548(1988). ЭФР характеризуется увеличением в БЛ числа суммарных воспалительных клеток.
Этот тест вместе с тестом гиперреактивности может точно предсказать клиническую активность, т. к. астма обычно рассматривается как воспалительное заболевание.
Значение LD50 для соединения C и D равны 0,96 мг/кг и 0,6 мг/кг соответственно.
Данные представленные в таблице являются достаточными, чтобы установить основную тенденцию для всех заявленных в заявке соединений, т. к. они относятся к представленным изменениям заявленных значений.
Пример.
Таблетки готовят путем смешивания и прессования обычным путем следующих компонентов:
соединение примера 13 мг - 3,00
кукурузный крахмал мг - 140,00
лактоза мг - 160,00
стеарат магния мг - 10,00
тальк мг - 60,00
коллоидальный кремний мг - 40,006
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕТЕРОЦИКЛИЧЕСКИЕ АМИНЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1992 |
|
RU2108325C1 |
| УСОВЕРШЕНСТВОВАННЫЕ СПОСОБЫ ПОЛУЧЕНИЯ ДИМАЛЕАТА 6,9-БИС-[(2-АМИНОЭТИЛ)-АМИНО]БЕНЗО[G]ИЗОХИНОЛИН-5,10-ДИОНА | 1995 |
|
RU2144028C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНАНТИОМЕРНО ЧИСТЫХ 1,4-ДИГИДРОПИРИДИНОВ, ЭНАНТИОМЕРНО ЧИСТЫЕ 1,4-ДИГИДРОПИРИДИНЫ И ИЗОТИОУРЕИДЫ | 1990 |
|
RU2069658C1 |
| 2-АМИНОАЛКИЛ-5-АМИНОАЛКИЛАМИНОЗАМЕЩЕННЫЕ ИЗОХИНОИНДАЗОЛ-6-(2Н)-ОНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ ОПУХОЛИ | 1993 |
|
RU2130937C1 |
| ТРЕХЪЯДЕРНЫЕ КАТИОННЫЕ КОМПЛЕКСЫ ПЛАТИНЫ, ПРОЯВЛЯЮЩИЕ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЭТИ КОМПЛЕКСЫ | 1995 |
|
RU2130941C1 |
| ГЕРБИЦИДНЫЕ КОМПОЗИЦИИ | 2007 |
|
RU2472343C9 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛОНА, СМЕСИ ИХ ИЗОМЕРОВ ИЛИ ИХ КИСЛОТНО-АДДИТИВНЫЕ СОЛИ В КАЧЕСТВЕ АНТАГОНИСТА РЕЦЕПТОРА 5-HT*00I*00A И 5-НТ*002 | 1992 |
|
RU2096411C1 |
| ИММУНОДЕПРЕССАНТ И ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2006 |
|
RU2443441C2 |
| СОЕДИНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТА АДЕНОЗИНОВОГО РЕЦЕПТОРА A2a И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2022 |
|
RU2840068C2 |
| 1-N-АЛКИЛ-N-АРИЛПИРИМИДИНАМИНЫ, СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2153494C2 |

Изобретение относится к 1,4-дизамещенным пиперазинам общей формулы (I), в которой В означает группу -CO- или CH2-OCO; D - гетероарил, выбранный из ряда, включающего 1, 3, 5-триазинил, пиримидинил и пиридинил, возможно замещенный одним или двумя заместителями, выбранными из ряда, включающего моно-(С1-С6)-алкиламино, моно-(С3-С7)- алкениламино-, ди-(С1-С6)-алкиламино-,
(С1-С6)-алкил-(С3-С7)-алкеламино- и пирролидин-I-ил-группы; Ra и Rb - атом водорода или (С1-С3)-алкил; n является целым числом от 1 до 4; их энантиомеры, рацемические смеси и их соли с фармацевтически приемлемыми кислотами и основаниями. Способ получения соединений формулы (I) путем взаимодействия соединения формулы (II) с соединением формулы (III) с получением соединения формулы (Ia), которые превращают в соединения формулы (I) посредством превращения -COOR группы в -COOH группу. Лекарственный препарат для снижения повышенной бронхиальной реактивности, содержащий в качестве активного ингредиента эффективное количество соединения формулы (I), и способ его получения. 4 с. и 6 з. п. ф-лы, 1 табл. 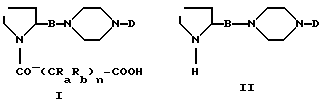
в которой B означает группу -CO- или -CH2-OCO-;
D означает гетероарил, выбранный из ряда, включающего 1,3,5-триазинил, пиримидинил и пиридинил, возможно замещенный одним или двумя заместителями, выбранными из ряда, включающего моно-(C1-C6)алкиламино-, моно-(C3-C7)-алкениламино-, ди-(C1-C6)-алкиламино-, (C1- C6)-алкил-(C3-C7)-алкениламино- и пирролидин-1-ил группы;
Ra и Rb означают атом водорода или (C1-C3) -алкил;
n является целым числом от 1 до 4,
их энантиомеры, рацемические смеси и их соли с фармацевтически приемлемыми кислотами и основаниями.
где B является -CO-, -CH2OCO - группой;
D означает гетерил, выбранный из ряда, включающего 1,3,5-триазинил, пиримидинил и пиридинил, возможно замещенный одним или двумя заместителями, выбранными из ряда, включающего моно-(C1-C6)-алкиламино; моно-(C3-C7)-алкениламино-, ди-(C1-C6)-алкиламино-, (C1-C6)алкил-(C3-C7)алкениламино- и пирролидин-1-ил группы;
Ra и Rb означают атом водорода или (C1-C3)- алкил;
n является целым числом от 1 до 4,
их энантомеров, рацемических смесей и их солей с фармацевтически приемлемыми кислотами и основаниями, отличающийся тем, что соединение формулы (II)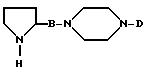
в которой B и D являются такими, как определены выше,
взаимодействует с соединением формулы (III)
в которой n, Ra и Rb имеют вышеописанные значения;
R является (C1-C6)-алкильной, бензильной, аллильной группой или любой другой группой, которую можно легко удалить,
E является галогеном (хлором, бромом), N-имидазолом, ОН, О-гидроксисукцинимидилом или взятый вместе с карбонильной группой, он образует смешанный ангидрид с карбоновой или сульфокислотой, получая соединения формулы (Ia)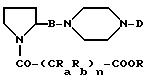
которые превращают в соединения формулы (I) посредством превращения -COOR-группы в -COOH-группу.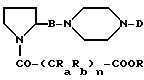
в которой B, D, Ra, n и Rb являются такими, как они определены выше;
R является (C1-C6)-алкилом,
превращают в соединения формулы (I) посредством гидролиза с минеральными основаниями соответствующей концентрации и в подходящем растворителе.
в которой B, D, Ra, Rb и n являются такими, как они определены выше;
R является аллилом или бензилом,
превращают в соединения формулы (I) посредством каталитической гидрогенизации.
| ФОРМИРУЮЩАЯ ПРИСТАВКА ДЛЯ ТОЛКАЕМОГО ДВУХНИТОЧНОГО СОСТАВА | 0 |
|
SU288575A1 |
| EP 468469 A3, 29.01.92 | |||
| Автоматический огнетушитель | 0 |
|
SU92A1 |
Авторы
Даты
1998-10-10—Публикация
1993-08-24—Подача