Изобретение относится к новым химическим веществам, обладающим ценными свойствами, в частности к производным пиридила общей формулы (I)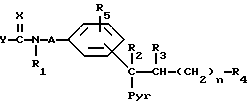
где
n - число 2, 3, 4 или 5,
A - углеродазотная связь или неразветвленная алкиленовая группа с 1 - 4 атомами углерода, незамещенная или замещенная одной или двумя алкильными группами,
X - нитрометиленовая группа, цианометиленовая группа, незамещенная или замещенная остатком R6, имеющим указанные ниже для R4 значения за исключением тетразола, или группа формулы =N-R7, где R7 - цианогруппа, алкансульфонильная группа, фенилсульфонильная группа, фенилалкансульфонильная группа, аминосульфонильная группа, алкиламиносульфонильная группа, диалкиламиносульфонильная группа, фенилкарбонильная группа, аминокарбонильная группа, алкиламикарбонильная группа или диалкиламинокарбонильная группа,
Y - алкоксигруппа, феноксигруппа, алкилтиогруппа, фенилтиогруппа или группа формулы -R8NR9, где R8 означает атом водорода, неразветвленную или разветвленную алкильную группу с 1 - 10 атомами углерода, которая во 2-м, 3-м или 4-м положении может быть замещена гидроксигруппой, аминогруппой, алкиламиногруппой или диалкиламиногруппой, замещенную фенильной группой или пиридильной группой алкильную группу с 1 - 4 атомами углерода, которая может быть дополнительно замещена гидроксильной группой во 2-м, 3-м или 4-м положении, циклоалкильную группу с 3 или 4 атомами углерода, циклоалкильную группу с 5-8 атомами углерода, в которой один этиленовый мостик может быть заменен о-фениленовой группой, бициклоалкильную группу с 6 - 8 атомами углерода, незамещенную или замещенную 1, 2 или 3 алкильными группами, адамантильную группу, алкоксигруппу или триметилсилилалкильную группу, а R9 - атом водорода или неразветвленная алкильная группа, или R8 и R9 вместе с находящимися между ними атомам азота образуют незамещенную или замещенную одной или двумя алкильными группами или фенильной группой циклическую алкилениминогруппу с 4 - 6 атомами углерода, в которой один этиленовый мостик в положениях 3,4 может быть заменен о-фениленовой группой, морфолиногруппу или пиперазиногруппу, незамещенную или замещенную в 4-м положении алкильной группой с 1 - 3 атомами углерода или фенильной группой,
R1 - атом водорода или алкильная группа с 1 - 3 атомами углерода,
R2 и R3 - атом водорода или вместе образуют углерод-углеродную связь,
Pyr - пиридильная группа, незамещенная или замещенная в положениях 3 - 5 алкильной группой,
R4 - цианогруппа, тетразолильная группа, аминокарбонильная группа, алкиламинокарбонильная группа, диалкиламикарбонильная группа, группа, переводимая in vivo метаболическим путем в карбоксильную группу, или карбоксильная группа, если Y означает группу R8NR9, где R8 и R9 имеют вышеуказанное значение,
R5 - атом водорода или галогена, алкил, алкоксил или трифторметил,
причем все упомянутые алкильные и алкоксильные остатки, если ничего другого не упомянуто, имеют 1 - 3 атомов углерода, а, если ничего другого не упомянуто, то все вышеупомянутые фенильные ядра могут быть моно- или дизамещены одинаковыми или различными заместителями из группы, включающей атом фтора, хлора, или брома, алкил, гидроксил, алкоксил, карбоксил, фенил, нитро-, амино-, алкиламино, диалкиламино, алканоиламино, циано, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, трифторметил, алканоил, аминосульфонил, алкиламиносульфонил и диалкиламиносульфонил,
их энантиомерам, цис- или транс-изомерам, если R2 и R3 вместе означают углерод-углеродную связь, и их солям.
Под понятием "группа, переводимая метаболическим путем in vivo в карбоксильную группу", следует, например, понимать ее сложный эфир формул
-CO-OR',
-CO-O-(HCR'')-O-CO-R'' и
-CO-O-(HCR'')-O-CO-OR''
где R' - неразветвленная или разветвленная алкильная группа с 1 - 6 атомами углерода, циклоалкильная группа с 5 - 7 атомами углерода, бензильная, 1-фенилэтильная, 2-фенилэтильная, метоксиметильная или циннамильная группы,
R'' - атом водорода или метильная группа и
R'' - неразветвленная или разветвленная алкильная группа с 1 - 6 атомами углерода, циклоалкильная группа с 5 - 7 атомами углерода, фенильная, бензильная, 1-фенилэтильная, 2-фенилэтильная и 3-фенилпропильная группы.
Соединения вышеприведенной общей формулы (I), где Y означает алкокси-, фенокси-, алкилтио- и фенилтиогруппы, представляют собой промежуточные продукты для получения соединений общей формулы I, где Y означает группу R8NR9, а соединения вышеприведенной общей формулы (I), где R4 означает цианогруппу, представляют собой промежуточные продукты для получения соединений общей формулы (I), где R4 означает тетразолильную группу.
Соединения общей формулы (I), где Y означает группу R8NR9 имеют, в частности, антитромботические действия. Кроме того, новые соединения одновременно представляют собой антагонисты тромбоксана и ингибиторы синтеза тромбоксана и таким образом они также ингибируют вызываемые тромбоксаном действия. Кроме того, они воздействуют также на производство PGE2 в легких и на производство PGD2, PGE2 и PGF 2α в тромбоцитах человека.
В качестве предпочтительных соединений вышеприведенной общей формулы (I) следует назвать такие, где
n - число 2, 3, 4 или 5,
A - связь или этиленовая группа,
X- нитрометиленовая группа, цианометиленовая группа, незамещенная или замещенная остатком R6, имеющим указанные ниже для R4 значения за исключением тетразола, или группа формулы =N-R7, где R7 означает цианогруппу, фенилсульфонильную или алканосульфонильную группу,
Y - фенокси- или метилтиогруппа или группа R8NR9, где R8 - атом водорода, неразветвленная или разветвленная алкильная группа с 1 - 8 атомами углерода, незамещенная или замещенная во 2-м, 3-м или 4-м положении гидроксилом или диметиламиногруппой, замещенная фенильной или пиридильной группой алкильная группа с 1 - 4 атомами углерода, которая может быть замещена гидроксилом в положении 2,3 или 4, циклоалкильная группа с 3 - атомами углерода, метоксигруппа, триметилсилилметильная группа, индан-2-ил или бициклогептильная группа, незамещенная или замещенная одной, двумя или тремя алкильными группами, R9 - атом водорода или метильная группа или
R8 и R9 вместе с расположенным между ними атомами азота означают пиперидиногруппу, которая может быть замещена одной или двумя метильными группами или фенильной группой и в которой дополнительно один этиленовый мостик в положении 3, 4 может быть замещен на о-фениленовую группу, морфолиновую группу или пиперазиногруппу, незамещенную или замещенную в 4-м положении фенильной группой,
R1 - атом водорода или метильная группа,
R2 и R3 - атом водорода или вместе означают углерод-углеродную связь,
Pyr - 3-пиридильная или 4-пиридильная группа,
R4 - цианогруппа, карбоксил, тетразолильная, алкоксикарбонильная, аминокарбонильная группы, каждая с 1 - 3 атомами углерода в алкоксильной и алкильной частях,
R5 - атом водорода, фтора, хлора или брома, алкильная, алкоксильная или трифторметильная группа, причем все вышеупомянутые алкильные и алкоксильные группы, если ничего другого не упомянуто, содержат 1 - 3 атомов углерода, их энантиомеры, цис- и трансизомеры, если R4 и R5 вместе представляют собой углерод-углеродную связь, и их соли.
Особенно предпочтительными являются те соединения формулы (I), где n - число 3,
A - связь или этиленовая группа,
X - группа формулы = N-R7, причем R7 - цианогруппа, фенилсульфонильная группа или дицианометиленовая группа,
Y - группа R8NR9, где R8 - неразветвленная или разветвленная алкильная группа с 1 - 8 атомами углерода, циклоалкильная группа с 3 - 8 атомами углерода или эксо-норборнил-(2), а R9 - атом водорода,
R1 - атом водорода,
R2 и R3 - атом водорода или вместе означают углерод-углеродную связь,
Pyr - 3-пиридильная группа,
R4 - карбоксигруппа или алкоксикарбонильная группа с общим числом 2 - 4 атомов углерода,
R5 - атом водорода, хлора или брома, метильная или трифторметильная группа, их энантиомеры, цис- и трансизомеры и их соли.
Новые соединения вышеприведенной формулы (I) можно получать следующими способами-аналогами.
A.
Для получения соединений общей формулы (I), где Y означает алкокси-, фенокси-, алкилтио- и фенилтиогруппы:
Взаимодействие соединения общей формулы (II)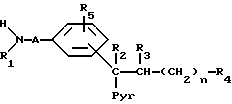
где
A, n, R1 - R5 и Pyr имеют вышеуказанные значения, с соединением общей формулы (III)
(Y')2C=X
где
X имеет вышеуказанные значения,
Y' - алкокси-, фенокси-, алкилтио- или фенилтиогруппа.
Реакцию предпочтительно проводят в среде растворителя, такого как, например, метанол, этанол, изопропанол, диоксан, тетрагидрофуран или хлороформ, в случае необходимости в присутствии связывающего кислоту агента, как карбоната калия, триэтиламина или пиридина, причем триэтиламин и пиридин можно также использовать в качестве растворителя. Реакцию целесообразно проводят при температуре 0 - 50oC, в частности при комнатной температуре.
Б.
Для получения соединения общей формулы (I), где Y означает группу R8NR9:
Взаимодействие соединения общей формулы (IV)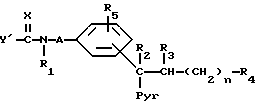
где
A, X, n, R1-R5 и Pyr имеют вышеуказанные значения и Y' означает алкокси-, фенокси-, алкилтио- или фенилтиогруппы, с амином общей формулы (V)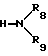
где
R8 и R9 имеют вышеуказанные значения.
Реакцию предпочтительно проводят в среде растворителя, такого как, например, этанол, изопропанол, тетрагидрофуран, диоксан или бензол, или в избытке используемого амина общей формулы (V), в случае необходимости в автоклаве и в случае необходимости в присутствии основания, такого как, например, карбонат натрия и калия, триэтиламин или пиридин, при температуре 0 - 125oC, предпочтительно 50-100oC.
В.
Для получения соединений общей формулы (I), где Y означает группу R8NR9 и R4 означает карбоксильную группу:
Отщепление защитного радикала от соединения общей формулы (VI)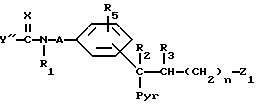
где
R1, R2, R3, R5, Pyr, A, X и n имеют вышеуказанные значения, Y'' означает группу R8NR9, где R8 и R9 имеют вышеуказанные значения,
Z1 - группа, переводимая посредством гидролиза, термолиза или гидрогенолиза в карбоксильную группу.
В качестве гидролизуемых групп можно использовать, например, такие функциональные производные карбоксигруппы, как, например, незамещенные или замещенные амиды, сложные эфиры, сложные тиоэфиры, сложные ортоэфиры, простые иминоэфиры, амидины или ангидриды, нитрильную группу, эфирные группы, как, например, метокси-, этокси-, трет.бутокси- и бензилоксигруппы или лактоны, в качестве поддающихся термолизу групп - например, сложный эфир с третичными спиртами, как, например, сложный трет.бутиловый эфир, а в качестве отщепляемого гидрогенолизом остатка - например, аралкильные группы, как, например, бензил.
Гидролиз целесообразно проводят или в присутствии кислоты, как, например, соляной кислоты, серной кислоты, фосфорной кислоты или трихлоруксусной кислоты или в присутствии основания, как, например, гидроокиси натрия или калия, в среде пригодного растворителя, такого, как, например, вода, смесь воды и метанола, этанол, смесь воды и этанола, смесь воды и изопропанола или диоксана, при температуре от -10 до 120oC, например, при температуре от комнатной температуры до температуры кипения реакционной смеси.
Если, например, соединение формулы (VI) содержит нитрильную или аминокарбонильную группу, то эту группу можно переводить в карбоксильную группу путем обработки 100%-ной фосфорной кислотой при температуре 100-180oC, предпочтительно при температуре 120-160oC, или же нитритом, например, нитритом натрия, в присутствии кислоты, как, например, серной кислоты, которую целесообразно одновременно использовать одновременно в качестве растворителя, при температуре 0-50oC.
Если, например, соединение формулы VI содержит амидную группу, как, например, диэтиламинокарбонильную или пиперидинокарбонильную группу, то эту группу можно переводить в карбоксильную группу гидролизом при температуре от (-10) - (+120oC), например, при температуре от комнатной до температуры кипения реакционной смеси, в присутствии кислоты, как, например, соляной кислоты, серной кислоты, фосфорной кислоты или трихлоруксусной кислоты, или же в присутствии основания, как, например, гидроокиси натрия или калия, в среде пригодного растворителя, как, например, воды, смеси воды и метанола, этанола, смеси воды и этанола или изопропанола, или диоксана.
Если, например, соединение общей формулы VI содержит трет.бутилоксикарбонильную группу, то трет.бутильную группу можно отщеплять путем термолиза при температуре 40 - 100oC, в случае необходимости в среде инертного растворителя, такого как, например, метиленхлорид, хлороформ, бензол, толуол, тетрагидрофуран или диоксан, и предпочтительно в присутствии каталитического количества кислоты, как, например, п-толуолсульфокислоты, серной кислоты, фосфорной и полифосфорной кислот. Термолиз предпочтительно проводят при температуре кипения используемого растворителя, например, при температуре 40 - 100oC.
В случае, если соединение формулы (VI) содержит бензилокси- или бензилоксикарбонилгрупппу, то бензильную группу можно отщеплять путем гидрогенолиза, предпочтительно при температуре 0 - 50oC, например, при комнатной температуре, и давлении водорода 1-5 бар в среде пригодного растворителя, такого как, например, метанол, этанол, смесь метанола и воды, смесь этанола и воды, ледяная уксусная кислота, сложный этиловый эфир уксусной кислоты, диоксан или диметилформамид. В процессе гидрогенолиза галогенсодержащее соединение можно подвергать одновременному дегалогенированию и имеющуюся двойную связь можно подвергать гидрированию.
Г.
Для получения соединений общей формулы I, где R1 и R3 означают атом водорода:
Гидрирование соединения общей формулы (VII)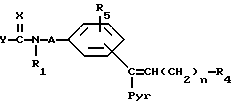
где
A, X, Y, n, R1, R4, R5 и Pyr имеют вышеуказанные значения.
Гидрирование осуществляют каталитически возбужденным водородом, например, водородом в присутствии катализатора гидрирования как, например, никеля Ренея, палладия, палладия на угле, платины или платины на угле, при давлении водорода 1 - 5 бар, или водородом в моменте выделения, например, обработкой железом в присутствии соляной кислоты, цинком в присутствии ледяной уксусной кислоты, дихлоридом олова (II) в присутствии соляной кислоты или сульфатом железа (II) В присутствии серной кислоты, при температуре 0 - 50oC, предпочтительно при комнатной температуре, в среде пригодного растворителя, такого, как, например, метанол, этанол, диоксан, сложный, этиловый эфир уксусной кислоты или ледяная уксусная кислота. Однако каталитическое гидрирование можно также осуществлять стереоселективно в присутствии пригодного катализатора.
Д.
Для получения соединения общей формулы I, где X за исключением содержащих цианогруппу радикалов имеет вышеупомянутые значения, а R4 означает тетразолильную группу:
Взаимодействие соединения общей формулы (VIII)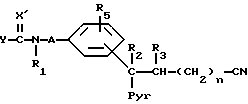
где
A, n, Y, R1, R2, R3, R5 и Pyr имеют вышеуказанные значения,
X' за исключением содержащих цианогруппу радикалов имеют вышеупомянутые для X значения,
с азотистоводородной кислотой или ее солями.
Реакцию предпочтительно проводят в среде растворителя, такого как, например, бензол, толуол или диметилформамид, при температуре 80-150oC, предпочтительно при температуре 125oC. При этом целесообразно поступать так, что либо азотистоводородная кислота высвобождается во время реакции из азида щелочного металла, например, азида натрия, в присутствии слабой кислоты, как, например, хлорида аммония, либо получаемую в реакционной смеси при реакции с солью азотистоводородной кислоты, предпочтительно азидом алюминия или трибутилолова (которую целесообразно получают в реакционной смеси путем взаимодействия хлористого алюминия или хлористого трибутилолова с азидом щелочного металла, как, например, азидом натрия), тетразолильную соль затем высвобождают путем подкисления разбавленной кислотой, как, например, 2N соляной кислотой или 2N серной кислотой.
Если согласно изобретению получают соединение общей формулы I, где X означает группу формулы =N-CN, то ее можно перевести посредством омыления в соответствующее соединение формулы (I), где X означает группу формулы =N-CONH2, или если получать соединение формулы (I), где R4 означает карбоксильную группу, то ее можно перевести посредством омыления или амидирования в соответствующее соединение формулы (I), где R4 означает группу, переводимую in vivo метаболическим путем в карбоксильную группу, аминокарбонильную, алкиламинокарбонильную или диалкиламинокарбонильную группу, или если получать соединение формулы (I), где R4 означает аминокарбонильную группу, то эту группу можно перевести посредством дегидратации в соответствующее соединение формулы (I), где R4 означает цианогруппу.
Дополнительное омыление группы формулы =N-CN проводят путем гидролиза в присутствии кислоты или основания, например, серной кислоты, фосфорной кислоты, муравьиной кислоты, соляной кислоты, бромистоводородной кислоты, уксусной кислоты, бортрифторида, четыреххлористого титана, или перекиси водорода и натрового щелока или едкого калия, при температуре 0-100oC, предпочтительно 20 - 50oC.
Последующую этерификацию или последующее амидирование целесообразно проводят в среде растворителя, например, в избытке используемого спирта, такого как, например, метанол, этанол или изопропанол, или используемого амина, такого как, например, аммиак, метиламин, н-пропиламин или диметиламин, в присутствии активирующего кислоту средства, такого как, например, тионилхлорид или хлористый водород, карбонилдиимидазол или N,N'-дициклогексилкарбодиимид, при температуре 0 - 180oC, однако предпочтительно при комнатной температуре.
Переведение карбоксильной группы в группу, которую переводят in vivo метаболическим путем в карбоксильную группу, осуществляют целесообразно путем этерификации соответствующим спиртом или соответствующим реакционноспособным ацильным производным, целесообразно в среде растворителя или смеси растворителя, как например, воды, метиленхлорида, хлороформа, простого диэтилового эфира, тетрагидрофурана, диоксана или диметилформамида или в избытке ацилирующего средства в качестве растворителя, в случае необходимости в присутствии активирующего кислоту или обезвоживающего средства, как, например, тионилхлорида, ангидридами, сложными эфирами или галогенидами, в случае необходимости в присутствии неорганического или третичного органического основания, как, например, гидроокиси натрия, карбоната калия, триэтиламина или пиридина, причем оба последних могут также служить в качестве растворителя, при температуре от -25 до +100oC, однако предпочтительно при температуре от -10 до +80oC.
Дополнительную дегидратацию проводят с использованием обезвоживающего средства, как, например, пятиокиси фосфора, серной кислоты или хлорангидрида п-толуолсульфокислоты, в случае необходимости в среде растворителя, как, например, метиленхлорида или пиридина, при температуре 0-100oC, предпочтительно при температуре 20 - 80oC.
Получаемые соединения формулы (I) можно также разделять на их энантиомеры. Так, например, получаемые соединения формулы (I), содержащие только один оптически активный центр, можно разделить известными приемами на их оптические антиподы, например, путем перекристаллизации из оптически активного растворителя или путем взаимодействия с образующим соль с рацемическим соединением оптически-активным веществом, в частности основаниями, и разделения получаемых при этом смеси солей, например, на основе их различной растворимости, на диастереомерные соли, из которых можно получать свободные антиподы путем воздействия пригодных средств. В качестве особенно пригодных оптически активных оснований можно назвать, например, D- и L-формы альфа-фенил-этиламина или цинхонидина.
Кроме того, получаемые соединения формулы I, имеющие по меньшей мере два асимметричных атома углерода, можно разделять на их диастереомеры известными приемами, например, путем хроматографии и/или фракционной кристаллизации, используя их физико-химические различия. Получаемую при этом энантиомерную пару можно затем разделять, как это описано выше, на оптические антиподы. В случае, если соединение общей формулы (I) содержит два оптически активных атома углерода, то получают соответствующие формы (R,R', SS' и RS', SR').
Кроме того, получаемые соединения формулы (I), где R2 и R3 вместе означают углерод-углеродную связь, можно переводить в их цис- и трансизомеры известными приемами, например, путем хроматографии на носителе, например, на силикагеле, или путем кристаллизации.
Кроме того, если получаемые новые соединения формулы (I) содержат карбоксильную группу, то их можно переводить в аддитивные соли с неорганическими или органическими основаниями, или если они содержат основную группу, то в случае необходимости их можно переводить в соли с неорганическими или органическими кислотами, в частности в физиологически переносимые соли для фармацевтического использования. При этом в качестве оснований можно использовать, например, гидроокись натрия, гидроокись калия, циклогексиламин, этаноламин, диэтаноламин и триэтаноламин, N-метилглюкозамин, аргинин и лизин, а в качестве кислот - например, соляная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота, фумаровая кислота, янтарная кислота, молочная кислота, лимонная кислота, винная кислота или малеиновая кислота.
Используемые в качестве исходных веществ формул (II) - (VIII) получают известными из литературы способами или же они известны из литературы.
Используемое в качестве исходного вещества соединение формулы (II) получают путем ацилирования по Фиделью-Крафтсу соответствующего N-ациламиносоединения с последующим деацилированием и, в случае необходимости, восстановлением, гидролизом и/или этерификацией или же путем взаимодействия соответствующего магниевого или литиевого соединения с соответственно замещенным пиридином, как, например, 3-циано-пиридином, пиридин-3-альдегидом или производным пиридин-3-карбоновой кислоты и последующего, в случае необходимости, окисления.
Используемые в качестве веществ соединения формул (II), где R2 и R3 вместе означают углерод-углродную связь, получают путем взаимодействия соединения общей формулы (IX)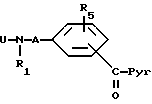
где
R1, Pyr, R5 и A имеют вышеуказанные значения и U означает защитную группу для аминогруппы, с соединением общей формулы (X)
W-CH2-(CH2)n-R4
где
R4 и n имеют вышеуказанные значения,
W - радикал галогенида трифенилфосфония, диалкилфосфоновой кислоты или галогенида магния, с последующим отщеплением используемого защитного радикала и, в случае необходимости, дегидратацией.
Реакцию предпочтительно проводят в пригодном растворителе, таком как, например, простой диэтиловый эфир, тетрагидрофуран, диоксан или диметилформамид при температуре - 30 -> 100oC, предпочтительно при температуре - 20 - 25oC, в случае необходимости в присутствии основания.
Реакцию с галогенидом трифенилфосфония формулы X особенно выгодно проводят в присутствии основания, как, например, трет.бутилата калия или гидрида натрия.
В случае, если во время реакции с галогенидом магния формулы X от получаемого в реакционной смеси карбинола гидроксильная группа не отщепляется, то она снимается в присутствии кислоты, как например, соляной кислоты, серной кислоты, фосфорной кислоты или трихлоруксусной кислоты, или в присутствии основания, как, например, гидроокиси натрия или калия, в среде пригодного растворителя, как, например, этанола, изопропанола или диоксана, при температуре 0 - 120oC, например, при температуре от комнатной до температуры кипения реакционной смеси.
Последующую дегидратацию осуществляют обезвоживающим средством, как, например, пятиокисью фосфора, серной кислотой или хлорангидридом п-толуолсульфокислоты, в случае необходимости, в среде растворителя, такого как например, метиленхлорид или пиридин, при температуре 0 - 100oC, предпочтительно при температуре 20 - 80oC.
Используемые в качестве исходных соединений соединения формулы (III) получают известными приемами или путем взаимодействия дифеноксидихлорметана с соответственно замещенным амином, или путем взаимодействия сероуглерода с соответственно замещенным C-H-ацидным метильным или метиленовым компонентом метила или метилена с последующим метилированием.
Используемые в качестве исходных соединений соединения формул (VI), (VII) и (VIII) получают путем реакции соответствующего аминосоединения с соответствующим производным угольной кислоты.
Используемые в качестве исходных соединений соединения формулы IX получают путем ацилирования по Фиделю-Крафтсу соответствующего амина.
Используемые в качестве исходных веществ соединения формулы (X) получают путем взаимодействия соответствующего галоидного соединения с трифенилфосфаном или со сложным эфиром триалкилфосфоновой кислоты.
Как уже указывалось выше, новые соединения общей формулы (I), где Y означает группу R8NR9 и их физиологически переносимые соли с неорганическими или органическими основаниями имеют ценные фармакологические свойства, в частности, антитромботические действия и задерживающее агрегацию тромбоцитов действие. Кроме того, они представляют собой также антагонисты тромбоксана и ингибиторы синтеза тромбоксана, причем особенно следует обратить внимание на то, что соединения формулы (I) одновременно проявляют указанные действия. Наряду с указанными действиями они также оказывают влияние на производство PGE2 в легких и на производство PGD2, PGE2 и PGF 2α в тромбоцитах человека.
Биологические свойства соединений A - III исследовались нижеследующими методами.
А = 5Е-6-(3-(2-циано-3-циклопропил-гуанидино)фенил)-6-(3- пиридил)гекс-5-еновая кислота,
Б = 5Е-6-(3-(2-циано-3-трет.бутил-гуанидино)фенил)-6- (3-пиридил)гекс-5-еновая кислота,
В = 5Е-6-(3-(2-циано-3-циклопентил-гуанидино)фенил)-6- (3-пиридил)гекс-5-еновая кислота,
Г = 5Е-6-(3-(2-циано-3-изопропил-гуанидино)фенил)-6- (3-пиридил)гекс-5-еновая кислота,
Д = 5Е-6-(3-(2-циано-3-(эксо-норборн-2-ил)гуанидино)фенил)- 6-(3-пиридил)-гекс-5-еновая кислота,
Е = 5Е-6-(3-(2-циано-3-(2-метилпропил)гуанидино)фенил)-6- (3-пиридил)гекс-5-еновая кислота,
Ж = 5Е-6-(3-(2-циано-3-неопентил-гуанидино)фенил)-6- (3-пиридил)гекс-5-еновая кислота,
З = 5Е-6-(3-(2-циано-3-пентил-гуанидино)фенил)-6-(3- пиридил)гекс-5-еновая кислота,
И = 5Е-6-(3-(2-циано-3-(3-метилбутил)гуанидино)фенил)-6- (3-пиридил)гекс-5-еновая кислота,
Й = 5Е-6-(3-(2,2-дициано-1-(2-метилпропиламино)этиламино)фенил)- 6-(3-пиридил)гекс-5-еновая кислота,
К = 5Е-6-(3-(2,2-дициано-1-изопропиламино-этиленамино)фенил)- 6-(3-пиридил)гекс-5-еновая кислота,
Л = 5Е-6-(3-(2,2-дициано-1-(3-метилбутиламино)-этиламино)фенил)- 6-(3-пиридил)гекс-5-еновая кислота,
М = 5Е-6-(3-(2,2-дициано-1-циклопентиламино-этиленамино)- фенил)-6-(3-пиридил)гекс-5-еновая кислота,
Н = 5Е-6-(3-(2,2-дициано-1-неопентиламино-этиленамино)фенил)- 6-(3-пиридил)гекс-5-еновая кислота,
О = 5Е-6-(3(2,2-дициано-1-циклопропиламино-этиленамино)- фенил)-6-(3-пиридил)гекс- 5-еновая кислота,
П = 5Е-6-(3-(2,2-дициано-1-пропиламино-этиленамино)фенил)- 6-(3-пиридил)гекс-5-еновая кислота,
Р = 5Е-6-(3-(2,2-дициано-1-трет.бутиламино-этиленамино)фенил)- 6-(3-пиридил)гекс-5-еновая кислота,
С = 5Е-6-(4-(2-циано-3-циклогексил-гуанидино)фенил)-6- (3-пиридил)гекс-5-еновая кислота,
Т = 6(3-(2-циано-3-трет.бутил-гуанидино)фенил)-6- (3-пиридил)гексанкарбоновая кислота,
У = 5Е-6-(3-(1-неопентиламино-2-нитро-этиламино)фенил)6- (3-пиридил)гекс-5-еновая кислота,
Ф = E/Z-6-(4-(2-циано-3-трет. бутил-гуанидино)этил)- фенил)-6-(3-пиридил)гекс-5-еновая кислота,
Х = 5Е-6-(3-(3-трет. бутил-5-фенилсульфонил-гуанидино)фенил)- 6-(3-пиридилгекс-5-еновая кислота,
Ц = 5Е-6-(3-(2-имидосульфонил-3-(2-метилпропил)гуанидино)фенил)- 6-(3-пиридил)гекс-5-еновая кислота,
Ч = 5Е-6-(3-(2-карбамоил-2-циано-1-(2- метилпропиламино)этиленамино)фенил)-6-(3-пиридил)гекс-5-еновая кислота,
Щ = 4Е-1-(5-(3-(2-циано-3-циклопентил-гуанидино)фенил)-5- (3-пиридил)-4-пентенил)тетразол.
1. Антитромботическое действие.
Методика.
Методом Борна и Кросса (J. Physiol. 170, 397 (1964 г.)) в богатой кровяными пластинками плазме здоровых испытуемых измеряют агрегацию тромбоцитов. Для обеспечения антикоагуляционного действия к крови прибавляют цитрат натрия (3,14%) в объемном соотношении 1 : 10.
Индуцируемая коллагеном агрегация.
Уменьшение оптической плотности суспензии тромбоцитов фотометрически измеряют и реагируют после добавления вызывающего агрегацию вещества. По углу наклона кривой плотности делают вывод на скорость агрегации. Точка кривой, где установлено наибольшее пропускание света, служит для определения оптической плотности.
Количество коллагена выбирают по возможности незначительно так, чтобы получать необратимо проходящую кривую. Используют торговый коллаген инофирмы Гормонхеми, Мюнхен, DE.
Перед добавлением коллагена плазму вместе с веществом инкубируют при температуре 37oC в течение соответственно 10 минут.
По полученным данным измерения графически определяют эффективную дозу ЭД50, относящуюся к 50%-ному изменению оптической плотности, то есть задержки агрегации.
2. Антагонистическое в отношении тромбоксана действие.
Венозную кровь человека антикоагулируют с помощью 13 мМ цитрата натрия и в течение 10 минут при 170 x g центрифугируют. Надосадочную, богатую тромбоцитами плазму для удаления плазменных протеинов пропускают через колонку, содержащую ионит марки сефарозе 2B. Аликвоты полученной суспензии тромбоцитов вместе с исследуемым веществом, лигандом (3H-меченым) и маркером (14C-меченым) в течение 60 минут при комнатной температуре инкубируют и затем в течение 20 с при 10000 x g отделяют центрифугированием. Надосадочную жидкость отводят и остаток растворяют в гидроокиси натрия. 3H-активность в надосадочной жидкости соответствует свободному лиганду, 14C указывает концентрацию маркера. 3H в остатке соответствует связанному лиганду, 14C используют для коррекции лиганда во внеклеточном пространстве. По значениям связывания для различных концентраций исследуемого вещества определяют после повторения кривую вытеснения и 50%-ную концентрацию торможения (КТ50).
3. Определение задерживающего действия на синтез тромбоксана.
Венозную кровь антикоагулируют с помощью 13 мМ цитрата натрия и в течение 10 минут при 170 x g центрифугируют. Надосадочную, богатую тромбоцитами плазму для удаления плазменных протеинов пропускают через колонку, содержащую ионит марки сефароз 2B. Аликвоты полученной суспензии тромбоцитов вместе с исследуемым веществом или растворителем в качестве контроля инкубируют в течение 10 минут при комнатной температуре и после добавления 14C-меченой арахидоновой кислоты инкубацию продолжают в течение 10 минут. После прекращения инкубации добавлением 50 мл лимонной кислоты трижды экстрагируют 500 мл сложного этилового эфира уксусной кислоты и объединенные экстракты подвергают продувке азотом. Остаток поглощают в сложном этиловом эфире уксусной кислоты, наносят на предназначенную для тонкослойной хроматографии пленку и разделяют с помощью смеси хлороформа, метанола, этилового эфира уксусной кислоты и воды в объемном соотношении 90 : 8 : 1 : 0,8. Высушенные тонкослойные пленки на 3 для кладут на рентгеновскую пленку, проявляют авторадиограмму и с ее помощью мечат активные зоны на пленке. После вырезания определяют активность с помощью сцинтилляционного счетчика и вычисляют задержку образования тромбоксана B2. КТ50 определяют путем линейной интерполяции.
В таблице приведены полученные значения.
4. Острая токсичность.
Острая токсичность исследуемых веществ определялась на группах по 10 мышей в каждой группе оральной дачи разовой дозы 250 мг/кг (время наблюдения: 14 дней). При этой дозе не умерло ни одно подопытное животное.
По их фармакологическим свойствам новые соединения и их физиологически переносимые аддитивные соли пригодны для лечения и профилактики тромбоэмболических заболеваний, таких как инфаркт миокарда, церебральный инфаркт, временной ишемический приступ, скоропроходящий амауроз, для профилактики артериосклероза и для профилактики от метастазирования, а также для лечения ишемии, астмы и аллергий.
Необходимая для получения соответствующего действия дозировка целесообразно составляет 2 - 4 раза в день 0,3 - 4 мг/кг, предпочтительно 0,3 - 2 мг/кг веса тела. Для этого новые соединения формулы I, в случае необходимости в комбинации с другими активными началами, можно вырабатывать вместе с одним или несколькими инертными обычными носителями и/или разбавителями, как, например, кукурузным крахмалом, молочным сахаром, сахаром-сырцом, микрокристаллической целлюлозой, стеаратом магния, поливинилпирролидоном, лимонной кислотой, винной кислотой, водой, смесью воды и этанола, или глицерина, или сорбита, или полиэтиленгликоля, пропиленгликолем, цетилстеариловым спиртом, карбоксиметилцеллюлозой или содержащими жир веществами, как, например, отвержденным жиром или их пригодными смесями, в обычные галенические препараты, как, например, таблетки, драже, капсулы, порошки, суспензии или суппозитории.
С учетом вышеизложенного дальнейшим объектом изобретения является фармацевтическая композиция с антитромботической антагонистической в отношении тромбоксана и тормозящей агрегацию тромбоцитов и синтез тромбоксана активностью, содержащая по меньшей мере один фармацевтически приемлемый носитель и активное начало, в качестве которого взято по меньшей мере одно производное пиридила вышеприведенной формулы (I) или его энантиомер, цис- или транс-изомер, если R2 и R3 вместе означают углерод-углеродную связь, или его фармацевтически приемлемую соль в эффективном количестве.
Нижеследующие примеры иллюстрируют получение исходных соединений.
Пример 1. Сложный метиловый эфир 6-(4-аминофенил)-6-(3-пиридил)гекс- 5-еновой кислоты.
а) 4-Ацетиламинофенил-3-пиридил-кетон
980 г трихлорида алюминия медленно смешивают с 155 мл диметилформамида. К этой смеси последовательно добавляют при температуре 90 - 110oC 342 г гидрохлорида хлорангидрида никотиновой кислоты и 206 г N-ацетиланилина. Затем реакционную смесь смешивают с 600 мл этиленхлорида, подают на лед и подвергают нейтрализации при охлаждении путем добавления 15N натрового щелока. Водную фазу экстрагируют метиленхлоридом. Объединенные органические фазы сгущают и остаток перекристаллизовывают из метанола.
Выход: 44% теории,
точка плавления: 189 - 191oC
C14H12N2O3 (240,26):
рассчитано: C 69,9; H 5,03; N 11,66,
найдено: C 69,87; H 5,14; N 11,58.
б) 6-(4-Ацетиламинофенил)-6-(3-пиридил)гекс-5-еновая кислота.
К суспензии 307 г бромида 4-карбоксибутил-трифенилфосфония и 233 г трет. бутилата калия в 2,8 л тетрагидрофурана добавляют при температуре - 40oC 140 г 4-ацетиламинофенил-3-пиридил-кетона и перемешивают в течение двух часов. Реакционную смесь разлагают путем добавления ледяной воды и сгущают. Остаток подают в воду и промывают сложным этиловым эфиром уксусной кислоты. Водную фазу доводят до pH 5 - 6 и экстрагируют сложным этиловым эфиром уксусной кислоты. Органическую фазу сгущают и остаток перекристаллизовывают из смеси сложного этилового эфира и простого диизопропилового эфира.
Выход: 86% теории,
точка плавления: 155 - 156oC
C19H20N2O3 (324,38):
рассчитано: C 70,35; H 6,21; N 8,64;
найдено: C 70,19; H 6,27; N 8,66.
в) Сложный метиловый эфир 6-(4-аминофенил)-6-(3-пиридил)гекс- 5-еновой кислоты.
65 г 6-(4-ацетиламинофенил)-6-(3-пиридил)гекс)-5-еновой кислоты в смеси 300 мл метанола и 150 мл насыщенной метанольной соляной кислоты кипятят с обратным холодильником в течение двух часов. Реакционную смесь смешивают с 500 мл воды, нейтрализуют путем добавления карбоната натрия и экстрагируют сложным этиловым эфиром уксусной кислоты. Органическую фазу промывают, сушат и сгущают.
Выход: 71% теории,
масло; значение Rf (силикагель; смесь дихлорметана и ацетона в объемном соотношении 9 : 1)
C18H20N2O2 (296,37)
рассчитано: C 72,95; H 6,80; N 9,45;
найдено: C 72,83; H 6,85; N 9,23.
Аналогично примеру 1 получают еще сложный метиловый эфир 6-(4-метиламинофенил)-6-(3-пиридил)гекс-5-еновой кислоты в виде масла.
Значение Rf 0,56 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20 : 1)
C19H22N2O2 (310,40);
рассчитано: C 73,52; H 7,14; N 9,03;
найдено: C 73,35; H 7,24; N 5,91.
Пример 2. Сложный метиловый эфир 6-(3-аминофенил)-6-(3-пиридил)гекс- 5-еновой кислоты.
а) Ацетиламинофенил-3-пиридилкетон
114 г 3-нитрофенил-3-пиридилкетона в 1000 мл уксусной кислоты и 35 г никеля Ренея гидрируют при давлении 5 бар и температуре 50oC в течение двух часов. Катализатор отфильтровывают и фильтрат смешивают с 80 мл ангидрида уксусной кислоты. После истечения 30 минут сгущают при комнатной температуре и остаток поглощают в сложном этиловом эфире уксусной кислоты. Органическую фазу промывают водным раствором карбоната калия и сушат над сульфатом натрия. Растворитель отводят и остаток перекристаллизовывают из смеси сложного этилового эфира уксусной кислоты и простого диизопропилового эфира.
Выход: 69% теории,
точка плавления: 116 - 117oC
C14H12N2O2 (240,26)
рассчитано: C 69,99; H 5,03; N 11,66;
найдено: C 70,01; H 5,11; N 11,81.
б) 6-(3-Ацетиламинофенил)-6-(3-пиридил)гекс-5-еновая кислота.
К смеси 217 г бромида 4-карбоксибутил-трифенилфосфония и 154 г трет.бутилата калия в 1,8 л тетрагидрофурана добавляют при температуре - 25oC 94 г 3-ацетиламинофенил- 3-пиридилкетона. После перемешивания при комнатной температуре в течение двух часов реакционную смесь смешивают с 200 мл воды и затем сгущают. Остаток поглощают в 500 мл воды и промывают сложным этиловым эфиром уксусной кислоты. Затем водную фазу нейтрализуют путем добавления лимонной кислоты и экстрагируют сложным этиловым эфиром уксусной кислоты. Органическую фазу сгущают и остаток перекристаллизовывают из смеси сложного этилового эфира уксусной кислоты и ацетона.
Выход: 85% теории,
точка плавления: 86 - 89oC
C19H20N2O2 (324,38)
рассчитано: C 70,35; H 6,21; N 8,64;
найдено: C 70,15; H 6,36; N 8,51.
в) Сложный метиловый эфир 6-(3-аминофенил)-6-(3-пиридил)гекс- 5-еновой кислоты.
65 г 6-(3-Ацетиламинофенил)-6-(3-пиридил)гекс-5-еновой кислоты кипятят с обратным холодильником в течение четырех часов в смеси 400 мл метанола и 200 мл метанольной соляной кислоты. Растворитель удаляют и остаток смешивают с водой. Водную фазу промывают сложным этиловым эфиром уксусной кислоты и путем добавления 4N натрового щелока доводят до значения pH 8 - 9. Водную фазу экстрагируют сложным этиловым эфиром уксусной кислоты. Органическую фазу промывают, сушат и сгущают.
Выход: 71% теории.
Масло. Значение Rf 0,55 (силикагель; смесь дихлорметана и этанола в объемном соотношении 9 : 1)
C18H20N2O2 (296,37)
рассчитано: C 72,95; H 6,80; N 9,45;
найдено: C 72,83; H 6,91; N 9,18;
Аналогично примеру 2 получают следующие соединения:
Сложный метиловый эфир 5-(3-аминофенил)-5-(3-пиридил)пент- 4-еновой кислоты
Смола, значение Rf:0,58 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20 : 1)
C17H18N2O2 (282,34)
рассчитано: C 72,32; H 6,43; N 9,92;
найдено: C 72,29; H 6,55; N 9,70.
Сложный метиловый эфир 7-(3-аминофенил)-7-(3-пиридил)гепт-7- еновой кислоты
Смола, значение Rf:0,63 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20 : 1)
C19H22N2O2 (310,40)
рассчитано: C 73,52; H 7,14; N 8,03;
найдено: C 7,41; H 7,18; N 8,89.
Сложный метиловый эфир 8-(3-аминофенил)-8-(3-пиридил)окт-7- еновой кислоты
Смола, значение Rf: 0,66 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20 : 1).
C20H24N2O2 (324,44)
рассчитано: C 74,05; H 7,46; N 8,63;
найдено: C 73,92; H 7,49; N 8,48
Пример 3. Сложный метиловый эфир 6-метиламинофенил)-6-(3-пиридил)гекс-5 -еновой кислоты.
а) N-ацетил-3-метиламинофенил-3-пиридилкетон.
К 84 г 3-ацетиламинофенил-3-пиридилкетона в 600 мл диметилформамида порциями добавляют при охлаждении 17 г гидрида натрия и затем 22 мл метилйодида. Перемешивают при комнатной температуре в течение одного часа и реакционную смесь разлагают путем добавления 100 мл воды. Растворитель удаляют и остаток смешивают со сложным этиловым эфиром уксусной кислоты. Органическую фазу промывают, сушат и сгущают. Остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дихлорметана и этанола в объемном соотношении 30 : 1.
Масло, значение Rf: 0,45 (силикагель; смесь дихлорметана и этанола в объемном соотношении 30 : 1)
C15H14N2O2 (254,29)
рассчитано: C 70,85; H 5,55; N 11,02;
найдено: C 70,96; H 5,65; N 10,92.
б) Сложный метиловый эфир 6-(3-метиламинофенил)-6-(3- пиридил)гекс-5-еновой кислоты.
Получают из N-ацетил-3-метиламинофенил-3-пиридилкетона и бромида 4-карбоксибутил-трифенилфосфония аналогично примеру 26 с последующей этерификацией аналогично примеру 2в.
Масло, значение Rf: 0,56 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20 : 1)
C19H22N2O2 (310,40)
рассчитано: C 73,52; H 7,14; N 9,03;
найдено: C 73,53; H 7,20; N 8,84.
Пример 4. Сложный метиловый эфир 6-(3-амино-4-метилфенил)-6-(3-пиридил)-гекс-5-еновой кислоты.
а) 4-Метил-3-нитрофенил-3-пиридилкетон.
К охлажденной до температуры 5 - 10oC смеси 22 мл концентрированной серной кислоты и 16 мл дымящей азотной кислоты добавляют порциями 16,4 г 4-метилфенил-3-пиридилкетона. Затем перемешивают при комнатной температуре в течение двух часов, реакционную смесь подают на лед и подщелачивают путем добавления концентрированного аммиака. Водную фазу экстрагируют сложным этиловым эфиром уксусной кислоты. Органическую фазу сушат, сгущают и остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси сложного этилового эфира уксусной и циклогексана в объемном соотношении 1: 1. Фракцию продукта сгущают и остаток перекристаллизовывают из смеси сложного этилового эфира уксусной кислоты и простого диизопропилового эфира.
Выход: 60% теории.
C13H10N2O2 (242,24)
рассчитано: C 64,46; H 4,16; N 11,56;
найдено: C 64,42; H 4,19; N 11,64.
б) 3-Ацетиламино-4-метилфенил-3-пиридилкетон.
12 г 4-Метил-3-нитрофенил-3-пиридилкетона растворяют в смеси 120 мл сложного этилового эфира уксусной кислоты и 15 мл метанола и после добавления 2 г никеля Ренея гидрируют при температуре 50oC под давлением водорода 3,5 бар в течение трех часов. Катализатор отфильтровывают, фильтрат сгущают и остаток смешивают с 30 мл ледяной уксусной кислоты. Раствор смешивают с 10 мл ангидрида уксусной кислоты и перемешивают при комнатной температуре в течение одного часа. Реакционную смесь сгущают, остаток смешивают со сложным этиловым эфиром уксусной кислоты и промывают 2N раствором карбоната натрия. Органический экстракт сушат, сгущают и остаток перекристаллизовывают из смеси сложного этилового эфира уксусной кислоты и простого диизопропилового эфира.
Выход: 77% теории,
точка плавления: 92 - 94oC
C15H14N2O2 (254,29)
рассчитано: C 70,85; H 5,55; N 11,02;
найдено: C 70,77; H 5,64; N 10,96.
Аналогично примеру 4б получают следующее соединение:
3-ацетиламино-5-трифторметилфенил-3-пиридилкетон
точка плавления 128oC (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C15H11F3N2O2 (308,26)
рассчитано: C 58,45; H 3,59; N 9,09;
найдено: C 58,42; H 3,72; N 9,10.
в) 6-(3-Ацетиламино-4-метилфенил)-6-(3-пиридил)гекс-5-еновую кислоту
Получают аналогично примеру 1б.
Выход: 70% теории,
точка плавления: 177 - 179oC (смесь изопропанола и простого диизопропилового эфира).
C20H22N2O3 (338,41)
рассчитано: C 70,99; H 6,55; N 8,28;
найдено: C 70,83; H 6,46; N 8,19.
Аналогично примеру 4в получают следующее соединение:
6-(3-ацетиламино-5-трифторметилфенил)-6-(3-пиридил)гекс-5-еновую кислоту
точка плавления: 164oC (дихлорметан)
C20H19F3N2O3 (392,38)
рассчитано: C 61,22; H 4,88; N 7,14;
найдено: C 61,17; H 4,79; N 7,05.
г) Сложный метиловый эфир 6-(3-амино-4-метилфенил)-6-(3-пиридил)гекс-5-еновой кислоты
Получают аналогично примеру 1в.
Выход: 92% теории,
масло, значение Rf: 0,34 (силикагель; смесь дихлорметана и ацетона в объемном соотношении 9 : 1)
C19H22N2O2 (310,40)
рассчитано: C 73,52; H 7,14; N 9,03;
найдено: C 73,35; H 7,28; N 8,86.
Аналогично примеру 4г получают следующее соединение.
Сложный метиловый эфир 6-(3-амино-5-трифторметилфенил)-6-(3-пиридил)-гекс-5-еновой кислоты,
масло, значение Rf: 0,46 (силикагель; смесь дихлорметана и ацетона в объемном соотношении 10 : 1)
C19H19N2O2 (364,37)
рассчитано: C 62,63; H 5,26; N 7,69;
найдено: C 62,55; H 5,24; N 7,72.
Пример 5. 3-нитро-5-трифторметилфенил-3-пиридилкетон.
К 101 г 5-трифторметилфенил-3-пиридилкетона осторожно добавляют последовательно 400 мл концентрированной серной кислоты, 200 мл олеума и 140 мл дымящей азотной кислоты, причем внутренняя температура не должна превышать 35oC. Реакционную смесь перемешивают при комнатной температуре в течение 122 часов и затем подают на лед. Реакционный раствор нейтрализуют путем добавления 50%-го натрового щелока, причем выпадает нитритная соль. Эту соль отсасывают и затем растворяют в 6N натровом щелоке. Водную фазу экстрагируют сложным этиловым эфиром уксусной кислоты. Органический экстракт сушат и сгущают, причем получаемое масло при стоянии выкристаллизовывает.
Выход: 68% теории,
точка плавления: 182 - 184oC
C13H7F3N2O3 (296,20)
рассчитано: C 52,71; H 2,38; N 9,46;
найдено: C 52,56; H 2,45; N 9,55.
Пример 6. 4E-1-(5-(3-аминофенил)-5-(3-пиридил)пент-4-енил)тетразол.
а) 4E-5-(3-ацетиламинофенил)-5-(3-пиридил)пент-4-енкарбонитрил.
К суспензии 25,5 г бромида 4-цианобутил-трифенилфосфония и 14 г трет. бутилата калия в 200 мл тетрагидрофурана добавляют при температуре - 40oC 12 г 3-ацетиламинофенил-3-пиридилкетона. Перемешивают при комнатной температуре в течение трех часов и реакционную смесь разлагают путем добавления 50 мл ледяной воды. Смесь сгущают, остаток смешивают с водой и экстрагируют сложным этиловым эфиром уксусной кислоты. Органическую фазу сгущают и остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дихлорметана и этанола в объемном соотношении 40 : 1. Фракцию продукта сгущают и остаток перекристаллизовывают из смеси сложного этилового эфира уксусной кислоты и простого диизопропилового эфира.
Выход: 71% теории,
точка плавления: 144 - 146oC
C19H19N3O (305,38)
рассчитано: C 74,73; H 6,27; N 13,76;
найдено: C 74,57; H 6,14; N 13,59.
б) 4E-1-(5-(3-ацетиламинофенил)-5-(3-пиридил)пент-4-енил)-тетразол.
5,8 г 4E-5-(3-ацетиламинофенил)-5-(3-пиридил)пент-4-енкарбонитрила и 9,96 г азида трибутилолова в 300 мл толуола кипятят с обратным холодильником в течение 48 часов. Органическую фазу экстрагируют 100 мл 1N натрового щелока. Водную фазу промывают сложным этиловым эфиром уксусной кислоты и путем добавления лимонной кислоты доводят до pH 4 - 5. Выпавший осадок отсасывают, промывают водой и сушат.
Выход: 83% теории,
точка плавления: 174 - 175oC
C19H20N6O (348,41)
рассчитано: C 65,50; H 5,79; N 24,12;
найдено: C 65,39; H 5,86; N 23,96.
в) 4E-1-(5-(3-аминофенил)-5-(3-пиридил)пент-4-енил)тетразол.
5,7 г 4E-1-(5-(3-ацетиламинофенил)-5-(3-пиридил)пент-4-енил)тетразола в 60 мл 4N соляной кислоты нагревают до температуры 60oC в течение пять часов. Реакционный раствор нейтрализуют путем добавления бикарбоната натрия и затем доводят до значения 4 - 5 путем добавления лимонной кислоты. Водную фазу экстрагируют смесью дихлорметана и метанола в объемном соотношении 4 : 1. Органическую фазу промывают насыщенным раствором хлорида натрия, сушат и сгущают.
Выход: 91% теории,
масло, значение Rf: (силикагель марки RP8; смесь 5%-ного раствора хлорида натрия и метанола в объемном соотношении 4 : 6)
C17H18N6 (306,37)
рассчитано: C 66,65; H 5,92; N 27,43;
найдено: C 66,53; H 6,04; N 27,21.
Нижеследующие примеры иллюстрируют получение производных пиридила формулы (I).
Пример 7. 5E-6-(4-(2-циано-3-циклогексил-гуанидино)фенил)-6-(3-пиридил)- гекс-5-еновая кислота.
а) Сложный метиловый эфир 5E-6-(4-(цианимидо-феноксиметиленамино)фенил)-6-(3- пиридил)гекс-5-еновой кислоты.
11,4 г дифеноксиметилен-цианамида и 15 г сложного метилового эфира 5E-6-(4-(аминофенил)-6-(3-пиридил)гекс-5-еновой кислоты растворяют в 250 мл изопропанола и перемешивают при комнатной температуре в течение шести часов. Образовавшийся осадок отсасывают и промывают простым диэтиловым эфиром.
Выход: 87% теории,
точка плавления: 163 - 165oC
C26H24N4O3 (440,50)
рассчитано: C 70,89; H 5,49; N 12,77;
найдено: C 70,67; H 5,51; N 12,50.
б) 5E-6-(4-(2-циано-3-циклогексил-гуанидино)фенил)-6-(3- пиридил)гекс-5-еновая кислота.
2,2 г сложного метилового эфира 5E-6-(4-(цианимидо-феноксиметиленамино)-фенил)-6-(3-пиридил)гекс-5- еновой кислоты и 0,8 г циклогексиламина в 40 мл изопропанола нагревают с обратным холодильником в течением двух часов. Еще горячий реакционный раствор фильтруют, фильтрат смешивают с 6 мл 2N натрового щелока при температуре 40 - 50oC и затем перемешивают еще при температуре 40 - 50oC в течение двух часов. Реакционный раствор сгущают и остаток смешивают с водой. Водную фазу промывают сложным этиловым эфиром уксусной кислоты и путем добавления лимонной кислоты доводят до значения pH 4 - 5. Водную фазу экстрагируют сложным этиловым эфиром уксусной кислоты. Органический экстракт промывают водой, сушат и сгущают. Остаток перекристаллизовывают из смеси сложного этилового эфира уксусной кислоты и изопропанола.
Выход: 40% теории,
точка плавления: 145 - 147oC
C25H29N5O2 (431,54)
рассчитано: C 69,58; H 6,77; N 16,23;
найдено: C 69,53; H 7,01; N 15,98.
Аналогично примеру 7 получают следующие соединения:
1) 5E-6-(4-(2-циано-3-циклопропил-гуанидино)фенил)-6-(3-пиридил)гекс- 5-еновую кислоту.
Точка плавления: 118oC (смесь сложного этилового эфира уксусной кислоты и изопропанола).
C22H23N5O2 (389,46)
рассчитано: C 67,85; H 5,95; N 17,98;
найдено: C 67,61; H 6,04; N 17,79.
2) E/Z-6-(4-(2-циано-3-циклопропил-1-метил-гуанидино)фенил)-6- (3-пиридил)гекс-5-еновую кислоту
Исходя из сложного метилового эфира 6-(4-метиламинофенил)6-(3-пиридил)-гекс-5-еновой кислоты; очистку целевого продукта проводят хроматографией на силикагельсодержащей колонке с применением в качестве элюента смеси дихлорметана и этанола в объемном соотношении 20 : 1.
Пена, значение Rf: 0,25 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20 : 1).
C23H25N5O2 (403,49)
рассчитано: C 68,47; H 6,25; N 17,36;
найдено: C 68,24; H 6,40; N 17,52.
Пример 8. 5E-6-((3-(2-циано-3-(2-окси-1,1-диметилэтил)гуанидино)-фенил)- 6-(3-пиридил)гекс-5-еновая кислота.
а) Сложный метиловый эфир 5E-6-(3-цианимидо-феноксиметиленамино)фенил)-6-(3-пиридил)гекс-5-еновой кислоты
8,4 г цианамида дифенилоксиметилена и 10,5 г сложного метилового эфира 5E-6-(3-аминофенил)-6-(3-пиридил)гекс-5-еновой кислоты растворяют в 100 мл изопропанола и перемешивают при комнатной температуре в течение пяти часов. Затем реакционную смесь сгущают и остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дихлорметана и этанола в объемном соотношении 40 : 1.
Выход: 86% теории,
смола, значение Rf: 0,61 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20 : 1).
C26H24N4O3 (440,50)
рассчитано: C 70,89; H 5,49; N 12,72;
найдено: C 70,68; H 5,60; N 12,79
Аналогично примеру 8а получают следующие соединения.
1) Сложный метиловый эфир 5E-6-(3-цианимидо-фенокси-метиленамино)-4-метилфенил)-6-(3-пиридил)гекс-5- еновой кислоты
точка плавления: 147-149oC (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C27H26N4O3 (454,53)
рассчитано: C 71,35; H 5,77; N 12,33;
найдено: C 71,19; H 5,92; N 12,26.
2) Сложный метиловый эфир 5E-6-(3-цианимидо-фенокси-метиленамино)-5-трифторметилфенил)-6-(3-пиридил) гекс-5-еновой кислоты
точка плавления: 148-149oC (простой диизопропиловый эфир)
C27H23F3N4O3 (508,5)
рассчитано: C 63,78; H 4,56; N 11,02;
найдено: C 63,67; H 4,61; N 11,11.
б) 5E-6-(3-(2-циано-3-(2-окси-1,1-диметилэтил)гуанидино)фенил)-6-(3-пиридил) гекс-5-еновая кислота.
2,2 г сложного метилового эфира 5E-6-(3-(цианимидо-феноксиметиленамино)фенил)-6-(3-пиридил)гекс-5-еновой кислоты и 2 мл 2-окси-1,1-диметилэтиламина нагревают в 22 мл изопропанола нагревают с обратным холодильником в течение шести часов. Еще горячую реакционную смесь фильтруют и при температуре 50oC смешивают с 15 мл 2N натрового щелока. Реакционный раствор перемешивают при температуре 50oC в течение одного часа, затем сгущают и остаток смешивают с водой. Водную фазу промывают сложным этиловым эфиром уксусной кислоты и затем путем добавления лимонной кислоты доводят до значения pH 4-5. Водную фазу экстрагируют сложным этиловым эфиром уксусной кислоты, органический экстракт сушат и сгущают. Остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дихлорметана и этанола в объемном соотношении 19 : 1. Продукт фракции сгущают и остаток перекристаллизовывают из смеси сложного этилового эфира уксусной кислоты и простого диизопропилового эфира.
Выход: 13% теории,
точка плавления: 155oC (разложение)
C23H27N5O3 (421,50)
рассчитано: C 65,54; H 6,46; N 16,62;
найдено: C 65,57; H 6,36; N 16,41.
Аналогично примеру 8 получают следующие соединения:
1) 5E-6-(3-(2-циано-3-(2-фенилэтил)гуанидино)фенил-6-(3- пиридил)гекс-5-еновую кислоту
точка плавления: 164oC (разложение, смесь воды и изопропанола)
C27H27N5O2 (454,50)
рассчитано: C 71,50; H 6,00; N 15,44;
найдено: C 71,34; H 6,13; N 15,26.
2) 5E-6-(3-(цианимидо-(4-фенилпиперазин-1-ил)-метиленамино)фенил)- 6-(3-пиридил)гекс-5-еновую кислоту
точка плавления: 125oC (разложение, смесь воды и изопропанола)
C29H30N6O2 (494,61)
рассчитано: C 70,42; H 6,11; N 16,99;
найдено: C 70,20; H 5,99; N 17,19.
3) 5E-6-(3-(цианимидо-(4-фенилпиперидин-1-ил)-метиленамино)фенил)- 6-(3-пиридил)гекс-5-еновую кислоту
точка плавления: 119oC (разложение, смесь воды и изопропанола)
C30H31N5O2 (493,60)
рассчитано: C 73,00; H 6,33; N 14,19;
найдено: C 72,73; H 6,25; N 14,05.
4) 5E-6-(3-цианимидо-(1,2,3,4-тетрагидроизохинолин-2-ил)- метиленамино)-фенил)-6-(3-пиридил)гекс-5-еновую кислоту
точка плавления: 194oC (разложение, смесь воды и изопропанола)
C28H27N5O2 (465,60)
рассчитано: C 72,24; H 5,85; N 15,04;
найдено: C 72,06; H 5,97; N 14,94;
5) 5E-6-(3-(2-циано-(3-(индан-2-ил)гуанидино)фенил)-6-(3-пиридил)гекс-5-еновую кислоту,
точка плавления: 132oC (разложение, этилацетат)
C28H27N5O2 (465,60)
рассчитано: C 72,24; H 5,85; N 15,04;
найдено: C 72,07; H 5,88; N 14,82.
6) 5E-6-(3-(2-циано-3-циклопропил-гуанидинофенил)-6-(3-пиридил) гекс-5-еновую кислоту
точка плавления: 125oC (разложение)
C22H23N5O2 (389,50)
рассчитано: C 67,85; H 5,95; N 17,98;
найдено: C 67,62; H 5,90; N 17,74;
7) 5E-6-(3-цианимидо-пиперидин-1-ил-метиленамино)фенил)-6-(3- пиридил)-гекс-5-еновую кислоту
точка плавления: 197oC (разложение, смесь воды и изопропанола)
C24H27N5O2 x 0,5 H2O (417,51)
рассчитано: C 67,58; H 6,61; N 16,42;
найдено: C 67,72; H 6,72; N 16,21.
8) 5E-6-(3-(2-циано-3-трет. бутил-гуанидино)фенил)-6-(3-пиридил)гекс-5- еновую кислоту
точка плавления: 150-151oC (разложение, смесь этанола и простого диизопропилового эфира)
C23H27N5O2 (405,50)
рассчитано: C 68,12; H 6,71; N 17,27;
найдено: C 67,94; H 6,78; N 17,08.
9) 5E-6-(3-(2-циано-3-циклогексил-гуанидино)фенил)-6-(3-пиридил) гекс-5-еновую кислоту
точка плавления: 156oC (разложение, смесь сложного этилового эфира уксусной кислоты и простого диэтилового эфира)
C25H29N5O2 (431,54)
рассчитано: C 69,58; H 6,77; N 16,23;
найдено: C 69,38; H 6,80; N 16,06.
10) 5E-6-(3-(2-циано-3-циклопентил-гуанидино)фенил)-6-(3-пиридил) гекс-5-еновую кислоту
точка плавления: 136oC (разложение, смесь сложного этилового эфира уксусной кислоты и простого диэтилового эфира)
C24H27N5O2 (417,51)
рассчитано: C 69,04; H 6,57; N 16,77;
найдено: C 68,96; H 6,48; N 16,61.
11) 5E-6-(3-(2-циано-3-изопропил-гуанидино)фенил-6-(3-пиридил)гекс- 5-еновую кислоту
точка плавления: 186oC (разложение, смесь сложного этилового эфира уксусной кислоты и простого диэтилового эфира)
C22H25N5O2 (391,47)
рассчитано: C 67,50; H 6,44; N 17,89;
найдено: C 67,31; H 6,50; N 17,71.
12) 5E-6-(3-(2-циано-3-(эксо-норборн-2-ил)-гуанидино)фенил)-6- (3-пиридил)гекс-5-еновую кислоту
точка плавления: 172-173oC (разложение, смесь изопропанола и простого диизопропилового эфира)
C26H29N5O2 (443,55)
рассчитано: C 70,41; H 6,60; N 15,79;
найдено: C 70,50; H 6,63; N 15,63;
13) 5E-6-(3-(цианимидо-(3,3-диметилпиперидин-1-ил)метиленамино) фенил)-6-(3-пиридил)гекс-5-еновую кислоту
точка плавления: 138oC (разложение, смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C26H31N5O2 (445,56)
рассчитано: C 70,09; H 7,01; N 15,72;
найдено: C 69,98; H 7,10; N 15,59;
14) 5E-6-(3-(2-циано-3-триметилсилилметил-гуанидино)фенил)- 6-(3-пиридил)гекс-5-еновую кислоту
точка плавления: 92oC (разложение, смесь сложного этилового эфира уксусной кислоты и простого диэтилового эфира)
C23H29N5O2Si (435,60)
рассчитано: C 63,42; H 6,71; N 16,08;
найдено: C 63,23; H 6,80; N 15,87;
15) 5E-6-(3-(2-циано-3-(3-пиридилметил)-гуанидино)фенил)-6- (3-пиридил)-гекс-5-еновую кислоту
точка плавления: 125 - 126oC (разложение, смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C25H24N6O2 (440,51)
рассчитано: C 68,17; H 5,49; N 19,08;
найдено: C 67,96; H 5,52; N 18,93;
16) 5E-6-(3-(2-циано-3-(1,1,3,3-тетраметилбутил)гуанидино)фенил)- 6-(3-пиридил)-гекс-5-еновую кислоту
точка плавления: 170oC (разложение, смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C27H35N5O2 (461,61)
рассчитано: C 70,25; H 7,64; N 15,17;
найдено: C 70,25; H 7,73; N 15,12;
17) 5E-6-(3-(2-циано-3-(2-окси-1-метил-2-фенилэтил)-гуанидино) фенил)-6-(3-пиридил)гекс-5-еновую кислоту
точка плавления: 152 - 153oC (разложение, смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C28H29N5O3 (483,57)
рассчитано: C 69,55; H 6,05; N 14,49;
найдено: C 69,43; H 6,16; N 14,38;
18) 5E-6-(3-(2-циано-3-(2-окси-1-фенилэтил)гуанидино)фенил)-6- (3-пиридил)гекс-5-еновую кислоту
пена, значение Rf: 0,33 (смесь дихлорметана и эталона в объемном соотношении 19 : 1:
C27H27N5O3 (469,54)
рассчитано: C 69,07; H 5,80; N 14,92;
найдено: C 68,98; H 5,87; N 14,80;
19) 5E-6-(3-(2-циано-3-метил-3-изопропил-гуанидино)фенил)-6-(3- пиридил)-гекс-5-еновую кислоту
точка плавления: 168oC (смесь сложного этилового эфира уксусной кислоты и изопропанола)
C23H27N5O2 (405,50)
рассчитано: C 68,13; H 6,71; N 17,27;
найдено: C 68,03; H 6,74; N 17,33;
20) 5E-6-(3-(2-циано-3-бензил-гуанидино)фенил)-6-(3-пиридил)-гекс-5 -еновую кислоту
точка плавления: 138 - 140oC (смесь сложного этилового эфира уксусной кислоты и простого трет.бутилметилового эфира)
C26H25N5O2 (439,52)
рассчитано: C 71,05; H 5,73; N 15,93;
найдено: C 71,04; H 5,76; N 15,94;
21) 5E-6-(3-(2-циано-3-(2-метилпропил)гуанидино)фенил)-6-(3-пиридил)- гекс-5-еновую кислоту
точка плавления: 129oC (разложение, смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C23H27N5O2 (405,50)
рассчитано: C 68,13; H 6,71; N 17,21;
найдено: C 68,03; H 6,72; N 17,08;
22) 5E-6-(3-(2-циано-3-неопентил-гуанидино)фенил)-6-(3-пиридил)- гекс-5-еновую кислоту
точка плавления: 115 - 116oC (смесь сложного этилового эфира уксусной кислоты и простого трет.бутилового эфира)
C24H29N5O2 (419,53)
рассчитано: C 68,71; H 6,97; N 16,69;
найдено: C 68,53; H 7,07; N 16,53;
23) 5E-6-(3-(2-циано-3-пентил-нуанидино)фенил)-6-(3-пиридил)гекс- 5-еновую кислоту
точка плавления: 140 - 142oC (смесь сложного этилового эфира уксусной кислоты и изопропанола)
C24H29N5O2 (419,53)
рассчитано: C 68,71; H 6,97; N 16,69;
найдено: C 68,57; H 7,11; N 16,63;
24) 5E-6-(3-(2-циано-3,3-диметил-гуанидино)фенил)-6-(3-пиридил) гекс-5-еновую кислоту
Получают аналогично примеру 2б путем взаимодействия с диметиламином в тугоплавкой трубке.
Точка плавления: 194oC (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C21H23N5O2 (377,45)
рассчитано: C 66,83; H 6,14; N 18,55;
найдено: C 66,63; H 6,25; N 18,38;
25) 5E-6-(3-(2-циано-3-метил-гуанидино)фенил)-6-(3-пиридил)гекс- 5-еновую кислоту
Получают аналогично примеру 2б путем взаимодействия с метиламином в тугоплавкой трубке.
Точка плавления: 120oC (смесь сложного этилового эфира уксусной кислоты и изопропанола)
C20H21N5O2 (363,42)
рассчитано: C 66,10; H 5,82; N 19,27;
найдено: C 66,00; H 5,98; N 19,35;
26) 5E-6-(3-(2-цианогуанидино)фенил)-6-(3-пиридил)гекс-5-еновую кислоту 2,2 г сложного метилового эфира 6-(3-(2-цианимидо-феноксиметиленамино)фенил)-6-(3-пиридил)некс-5-еновой кислоты и 4,8 г карбоната аммония перемешивают в 40 мл метанола при комнатной температуре в течение 72 часов.
Реакционную смесь сгущают и остаток подвергают омылению в среде изопропанола путем добавления натрового щелока аналогично примеру 2б.
Точка плавления: 174oC (смесь сложного этилового эфира уксусной кислоты и изопропанола)
C19 H19N5O2 (349,39)
рассчитано: C 65,32; H 5,48; N 20,04;
найдено: C 65,17; H 5,53; N 19,87;
27) 5E-6-(3-цианимидо-морфолин-1-ил-метиленамино)фенил)-6-(3- пиридил)-гекс-5-еновую кислоту
точка плавления: 189oC (смесь воды и изопропанола)
C23H25N5O3 (419,49)
рассчитано: C 65,86; H 6,01; N 16,70;
найдено: C 65,88; H 5,96; N 16,53;
28) 5E-6-(3-(2-циано-3-(2-диметиламиноэтил)-гуанидино)фенил)- 6-(3-пиридил)гекс-5-еновую кислоту
пена, значение Rf: 0,28 (смесь дихлорметана и метанола в объемном соотношении 9 : 1)
C23H28N6O2 (420,51)
рассчитано: C 62,94; H 6,90; N 19,17;
найдено: C 62,74; H 6,76; N 18,96;
29) 5E-6-(3-(2-циано-3-циклогексилметил)-гуанидино)фенил)-6-(3- пиридил)-гекс-5-еновую кислоту
точка плавления: 111oC (смесь сложного этилового эфира уксусной кислоты и изопропанола)
C26H31N5O2 • 0,5 сложного этилового эфира уксусной кислоты (445,57)
рассчитано: C 68,69; H 7,20; N 14,30;
найдено: C 68,55; H 7,28; N 14,41;
30) 5E-6-(3-(2-циано-3-(3-метилбутил)-гуанидино)фенил)-6-(3- пиридил)-гекс-5-еновую кислоту
точка плавления: 108oC (разложение: смесь сложного этилового эфира уксусной кислоты и простого трет.бутилметилового эфира)
C24H29N5O2 (419,53)
рассчитано: C 68,71; H 6,97; N 16,69;
найдено: C 68,67; H 7,09; N 16,73;
31) 5E-6-(3-(2-циано-3-метокси-гуанидино)фенил)-6-(3-пиридил)-гекс-5- еновую кислоту
точка плавления: 118oC (разложение: смесь сложного этилового эфира уксусной кислоты и изопропанола)
C20H21N5O3 (379,42)
рассчитано: C 63,31; H 5,58; N 18,46;
найдено: C 63,19; H 5,53; N 18,28;
32) 5E-6-(3-(2-циано-3-метокси-3-метил-гуанидино)фенил)-6-(3-пиридил)- гекс-5-еновую кислоту
точка плавления: 116oC (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C21H23N5O3 (393,45)
рассчитано: C 64,11; H 5,89; N 17,80;
найдено: C 64,21; H 5,85; N 17,62;
33) E/Z-5-(3-(2-циано-3-(2-метилпропил)-гуанидино)фенил)-5-(3-пиридил)-пент-4-еновую кислоту
точка плавления: 189oC (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C22H25N5O2 (391,47)
рассчитано: C 67,50; H 6,44; N 17,89;
найдено: C 67,31; H 6,48; N 17,79;
34) E/Z-5-(3-(2-циано-3-трет. бутил-гуанидино)фенил)-5-(3-пиридил) пент-4-еновую кислоту
точка плавления: 146 - 148oC (смесь сложного этилового эфира уксусной кислоты и изопропанола)
C22H25N5O2 (391,47)
рассчитано: C 67,50; H 6,44; N 17,89;
найдено: C 67,32; H 6,50; N 17,68;
35) 6E-7-(3-(2-циано-3-циклопропил-гуанидино)фенил)-7-(3-пиридил) гепт-6-еновую кислоту
пена, значение Rf: 0,24 (силикагель: смесь дихлорметана и этанола в объемном соотношении 20 : 1)
C23H25N5O2 (403,49)
рассчитано: C 68,47; H 6,25; N 17,36;
найдено: C 68,40; H 6,39; N 17,20;
36) 6E-7-(3-(2-циано-3-циклогексил-гуанидино)фенил)-7-(3-пиридил) гепт-6-еновую кислоту
пена, значение Rf: 0,26 (силикагель: смесь дихлорметана и этанола в объемном соотношении 20 : 1)
C26H31N5O2 (445,56)
рассчитано: C 70,09; H 7,01; N 15,72;
найдено: C 70,17; H 7,05; N 15,52;
37) 6E-7-(3-(2-циано-3-трет.бутил-гуанидино)фенил)-7-(3-пиридил) гепт-6-еновую кислоту
точка плавления: 96oC (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C24H29N5O2 (419,53)
рассчитано: C 68,71; H 6,97; N 16,69;
найдено: C 68,54; H 7,08; N 16,44;
38) 7E-8-(3-(2-циано-3-(2-метилпропил)-гуанидино)фенил)-8- (3-пиридил)окт-7-еновую кислоту
пена, значение Rf: 0,62 (силикагель, смесь дихлорметана и этанола в объемном соотношении 9 : 1)
C25H31N5O2 (433,55)
рассчитано: C 69,26; H 7,21; N 16,15;
найдено: C 69,14; H 7,30; N 16,99;
39) 7E-8-(3-(2-циано-3-трет. бутил-гуанидино)фенил)-8- (3-пиридил)окт-7-еновую кислоту
точка плавления: 136 - 138oC (сложный этиловый эфир уксусной кислоты)
C25H31N5O2 (433,55)
рассчитано: C 69,26; H 7,21; N 16,15;
найдено: C 69,04; H 7,15; N 16,17;
40) E/Z-6-(3-(2-циано-3-циклопропил-1-метил-гуанидино)фенил)-6- (3-пиридил)гекс-5-еновую кислоту
точка плавления: 158 - 160oC (смесь сложного этилового эфира уксусной кислоты и изопропанола)
C23H25N5O2 (403,49)
рассчитано: C 68,47; H 6,25; N 17,36;
найдено: C 68,34; H 6,25; N 17,26;
41) 5E-6-(3-(2-циано-3-циклопропил-гуанидино)-4-метилфенил)-6- (3-пиридил)гекс-5-еновую кислоту
точка плавления: 156 - 158oC (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C25H29N5O2 (431,54)
рассчитано: C 69,58; H 6,77; N 16,23;
найдено: C 69,39; H 6,93; N 16,29;
42) 5E-6-(3-(2-циано-3-неопентил-гуанидино)-4-метилфенил)-6- (3-пиридил)гекс-5-еновую кислоту
точка плавления: 148 - 149oC (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C25H31N5O2 (433,55)
рассчитано: C 69,26; H 7,21; N 16,15;
найдено: C 69,08; H 7,33; N 16,24;
43) 5E-6-(3-(2-циано-3-пропил-гуанидино)-4-метилфенил)-6- (3-пиридил)гекс-5-еновую кислоту
точка плавления: 169 - 171oC (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C23H27N5O2 (405,50)
рассчитано: C 68,13; H 6,71; N 17,27;
найдено: C 67,95; H 6,87; N 17,24;
44) 5E-6-(3-(3-трет. бутил-2-циано-гуанидино)-4-метилфенил)-6- (3-пиридил)гекс-5-еновую кислоту
точка плавления: 127 - 129oC (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C24H29N5O2 (419,53)
рассчитано: C 68,71; H 6,97; N 16,69;
найдено: C 68,56; H 7,05; N 16,84;
45) 5E-6-(3-(2-циано-3-циклопентил-гуанидино)-5- трифторметилфенил)-6-(3-пиридил)гекс-5-еновую кислоту
точка плавления: 152oC (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C25H26F3N5O2 (485,51)
рассчитано: C 61,85; H 5,40; N 14,42;
найдено: C 61,73; H 5,50; N 14,48;
46) 5E-6-(3-(2-циано-3-(2-метилпропил)-гуанидино)-5- трифторметилфенил)-6-(3-пиридил)гекс-5-еновую кислоту
точка плавления: 164oC (сложный этиловый эфир уксусной кислоты)
C24H26F3N5O2 (473,50)
рассчитано: C 60,88; H 5,53; N 14,79;
найдено: C 60,69; H 5,47; N 14,88;
47) 5E-6-(3-(2-циано-3-(эксо-норборн-2-ил)гуанидино)-5- трифторметилфенил)-6-(3-пиридил)гекс-5-еновую кислоту
точка плавления: 144 - 145oC (сложный этиловый эфир уксусной кислоты)
C27H28F3N5O2 (511,55)
рассчитано: C 63,39; H 5,42; N 13,69;
найдено: C 63,25; H 5,42; N 13,58;
48) 5E-6-(3-(2-циано-3-циклогептил-гуанидино)фенил)-6- (3-пиридил)гекс-5-еновую кислоту
точка плавления: 178oC (разложение, смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C26H31N5O2 (445,57)
рассчитано: C 70,09; H 7,01; N 15,72;
найдено: C 69,96; H 7,08; N 15,52;
49) 5E-6-(3-(2-циано-3-циклооктил-гуанидино)фенил)-6- (3-пиридил)гекс-5-еновую кислоту
точка плавления: 154oC (разложение, смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C27H33N5O2 (459,59)
рассчитано: C 70,56; H 7,24; N 15,24;
найдено: C 70,39; H 7,18; N 15,14;
50) 5E-6-(3-(3-адамант-1-ил)-2-циано-гуанидино)фенил)-6- (3-пиридил)гекс-5-еновую кислоту
точка плавления: 148oC (разложение, смесь изопропанола и воды)
C29H33N5O2 (483,61)
рассчитано: C 72,02; H 6,88; N 14,48;
найдено: C 71,86; H 6,85; N 14,45;
Пример 9. 6-(3-(2-циано-3-изопропил-гуанидино)фенил)-6-(3-пиридил)- гексановая кислота.
а) 6-(3-Ацетиламинофенил)-6-(3-пиридил)гексанкарбоновая кислота
9,75 г 6-(3-ацетиламинофенил)-6-(3-пиридил)-гекс-5-еновой кислоты растворяют в 33 мл 1N натрового щелока и после добавления 1 г 10%-го палладия на угле гидрируют при комнатной температуре и давлении водорода 5 бар в течение одного часа. Затем отфильтровывают от катализатора, фильтрат доводят до значения pH 4,5 путем добавления лимонной кислоты и сгущают. Остаток кипятят три раза путем варения смесью метанола и этанола в объемном соотношении 9 : 1. Объединенные органические экстракты сгущают и остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дихлорметана и метанола в объемном соотношении 19 : 1.
Выход: 73% теории,
пена, значение Rf: 0,72 (силикагель; смесь дихлорметана и метанола в объемном соотношении 9 : 1)
C19H22N2O3 (326,40)
рассчитано: C 69,92; H 6,79; N 8,58;
найдено: C 69,70; H 6,72; N 8,43;
б) Сложный метиловый эфир 6-(3-аминофенил)-6- (3-пиридил)гексанкарбоновой кислоты.
6,9 г 6-(3-ацетиламинофенил)-6-(3-пиридил)гексанкарбоновой кислоты в 40 мл 9N метанольной соляной кислоты перемешивают при комнатной температуре в течение 24 часов. Реакционную смесь сгущают, остаток смешивают с водой и подщелачивают путем добавления карбоната натрия. Водную фазу экстрагируют сложным этиловым эфиром уксусной кислоты. Органический экстракт промывают водой, сушат и сгущают.
Выход: 81% теории,
масло, значение Rf: 0,52 (силикагель; смесь дихлорметана и этанола в объемном соотношении 19 : 1)
C18H22N2O2 (298,38)
рассчитано: C 72,46; H 7,43; N 9,39;
найдено: C 72,28; H 7,58; N 9,23;
в) Сложный метиловый эфир 6-(3-цианамидо- феноксиметиленамино)фенил)-6-(3-пиридил)гексанкарбоновой кислоты.
5,1 г сложного метилового эфира 6-(3-аминофенил)-6- (3-пиридил)гексанкарбоновой кислоты и 4,1 г дифеноксиметиленцианамида в 130 мл изопропанола перемешивают при комнатной температуре в течение четырех дней. Реакционную смесь сгущают и остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дихлормената и этанола в объемном соотношении 19 : 1.
Выход: 91% теории,
смола, значение Rf: 0,54 (силикагель; смесь дихлорметана и этанола в объемном соотношении 9 : 1)
C26H26N4O3 (442,52)
рассчитано: C 70,57; H 5,92; N 15,66;
найдено: C 70,41; H 6,03; N 15,68;
г) 6-(3-(2-циано-3-изопропил-гуанидино)фенил)-6- (3-пиридил)гексанкарбоновая кислота
3,1 г сложного метилового эфира 6-(3-цианимидо- феноксиметиленамино)фенил)-6-(3-пиридил)гексанкарбоновой кислоты и 5 мл изопропиламина в 50 мл изопропанола нагревают с обратным холодильником в течение трех часов. Затем при температуре 50oC добавляют 10 мл 2N натрового щелока и реакционный раствор перемешивают при этой температуре в течение 30 минут. Затем сгущают, остаток смешивают с водой и промывают сложным этиловым эфиром уксусной кислоты. Водную фазу доводят до значения pH 4 - 5 путем добавления лимонной кислоты, получаемый осадок отсасывают и перекристаллизовывают из смеси сложного этилового эфира уксусной кислоты и изопропанола.
Выход: 64% теории,
точка плавления: 168 - 169oC
C22H27N5O2 (393,49)
рассчитано: C 67,15; H 6,92; N 17,80;
найдено: C 67,12; H 6,95; N 17,87.
Аналогично примеру 9 получают следующее соединение:
6-(3-(2-циано-3-трут.бутил-гуанидино)фенил)-6- (3-пиридил)гексанкарбоновую кислоту с точкой плавления 142oC (смесь сложного этилового эфира уксусной кислоты и изопропанола)
C23H29N5O2 (407,51)
рассчитано: C 67,79; H 7,17; N 17,19;
найдено: C 67,62; H 7,25; N 17,07;
Пример 10
5E-6-(3-(1-неопентиламино-2-нитро-этиленамино)фенил)-6- (3-пиридил)гекс-5-еновая кислота
а) Сложный метиловый эфир 5E-6-(3-(1-метилтио-2-нитро- этиленамино)фенил)-6-(3-пиридил)гекс-5-еновой кислоты
3 г сложного метилового эфира 5E-6-(3-аминофенил)-6- (3-пиридил)гекс-5-еновой кислоты и 1,65 г 1,1-бис-(метилтио)-2-нитроэтена в 50 мл изопропанола нагревают с обратным холодильником в течение 20 часов. Реакционную смесь фильтруют, фильтрат сгущают и остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дихлорметана и этанола в объемном соотношении 30 : 1. Фракцию продукта сгущают и остаток перекристаллизовывают из простого трет.бутилового эфира.
Выход: 63% теории,
точка плавления: 84oC
C21H23N3O4S (423,50)
рассчитано: C 61,00; H 5,61; N 10,16; S 7,75;
найдено: C 60,99; H 5,52; N 10,23; S 7,62;
б) 5E-2-(3-(1-неопентиламино-2-нитро-этиленамино)фенил)- 6-(3-пиридил)гекс-5-еновая кислота
2,1 г сложного метилового эфира 5E-6-(3-(1-метилтио-2-нитро- этиленамино)фенил)-6-(3-пиридил)гекс-4-еновой кислоты и 2,4 мл неопентиламина в 20 мл изопропанола нагревают с обратным холодильником в течение 5 часов. Реакционную смесь смешивают при температуре 60oC с 10 мл 2N натрового щелока и перемешивают при этой температуре в течение 30 минут. Затем реакционный раствор сгущают, остаток смешивают с водой и водную фазу промывают сложным этиловым эфиром уксусной кислоты. Водную фазу доводят до значения pH 4-5 путем добавления лимонной кислоты и экстрагируют сложным этиловым эфиром уксусной кислоты. Водную фазу доводят до значения рН 4 - 5 путем добавления лимонной кислоты и экстрагируют сложным этиловым эфиром уксусной кислоты. Органический экстракт сгущают и остаток перекристаллизовывают из смеси воды и изопропанола.
Выход: 70% теории,
точка плавления: 190-191oC
C24H30N4O4 (438,53)
рассчитано: C 65,73; H 6,90; N 12,78;
найдено: C 65,62; H 6,98; N 12,61;
Аналогично примеру 10 получают следующее соединение:
5E-6-(3-(1-циклогексиламино-2-нитро-этиленамино)фенил)- 6-(3-пиридил)гекс-5-еновую кислоту с точкой плавления 155-157oC (смесь сложного этилового эфира уксусной кислоты и изопропанола).
C25H30N4O4 (450,54)
рассчитано: C 66,65; H 6,71; N 12,44;
найдено: C 66,61; H 6,71; N 12,39;
Пример 11. 5E-6-(3-2,2-дициано-(2-меилпропиламино)этиленамино)фенил)- 6-(3-пиридил)гекс-5-еновая кислота.
а) Сложный метиловый эфир 5Е-6-(3-(2,2-дициано-1-метилтио-этиленамино)-фенил)-6-(3-пиридил)гекс-5-еновой кислоты.
13,4 сложного метилового эфира 5E-6-(3-аминофенил)-6-(3-пиридил)гекс-5-еновой кислоты и 7,7 г 2,2-дициано-1,1-бис(метилтио)этена в 130 мл изопропанола нагревают с обратным холодильником в течение 6 часов. Реакционную смесь сгущают и остаток перекристаллизовывают из смеси сложного этилового эфира уксусной кислоты и простого диизопропилового эфира.
Выход: 45% теории,
точка плавления: 125-127oC
C23H22N4O2S (418,51)
рассчитано: C 66,01; H 5,30; N 13,39; S 7,66;
найдено: C 65,97; H 5,27; N 13,49; S 7,66;
б) 5E-6-(3-(2,2-дициано-1-(2-метилпропиламино)этиленамино)-фенил)- 6-(3-пиридил)гекс-5-еновая кислота
4 г сложного метилового эфира 5E-6-(3-(2,2-дициано-1-(2-метилтио- этиленамино)фенил)-6-(3-пиридил)гекс-5-еновой кислоты и 10 мл 2-метилпропиламина в 80 мл изопропанола нагревают с обратным холодильником в течение 4 часов. Реакционную смесь смешивают при температуре 40oC с 10 мл 2N натрового щелока и перемешивают при этой температуре в течение одного часа. Затем сгущают, остаток смешивают с водой и промывают сложным этиловым эфиром уксусной кислоты. Водную фазу доводят до значения pH 4-5 путем добавления лимонной кислоты и экстрагируют сложным этиловым эфиром уксусной кислоты. Органический экстракт сгущают и остаток очищают на силикагельсодержащей колонке смесью дихлорметана и этанола в объемном соотношении 29:1.
Выход: 68% теории,
пена, значение Rf: 0,48 (силикагель; смесь дихлорметана и этанола в объемном соотношении 19:1)
C25H27N5O2 (429,52)
рассчитано: C 69,91; H 6,34; N 16,30;
найдено: C 69,70; H 6,23; N 16,16;
Аналогично примеру 11 получают следующие соединения:
1) 5E-6-(3-(2,2-дициано-1-изопропиламино-этиленамино)фенил)- 6-(3-пиридил)гекс-5-еновую кислоту
точка плавления: 164-165oC (смесь сложного этилового эфира уксусной кислоты и простого диэтилового эфира)
C24H25N5O2 (415,49)
рассчитано: C 69,38; H 6,06; N 16,86;
найдено: C 69,22; H 6,11; N 16,68;
2) 5E-6-(3-(2,2-дициано-1-(3-метилбутиламино)-этиленамино)фенил)- 6-(3-пиридил)гекс-5-еновую кислоту
точка плавления: 139oC (смесь сложного этилового эфира уксусной кислоты и простого диэтилового эфира)
C26H29N5O2 (443,55)
рассчитано: C 70,41; H 6,59; N 15,79;
найдено: C 70,47; H 6,72; N 15,61;
3) 5E-6-(3-(2,2-дициано-1-циклопентиламино-этиленамино)фенил)- 6-(3-пиридил)гекс-5-еновую кислоту
точка плавления: 150oC (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C26H27N5O2 (441,53)
рассчитано: C 70,73; H 6,16; N 15,86;
найдено: C 70,55; H 6,27; N 15,90;
4) 5E-6-(3-(2,2-дициано-1-неопентиламино-этиленамино)фенил)- 6-(3-пиридил)гекс-5-еновую кислоту
точка плавления: 116oC (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C26H29N5O2 (443,55)
рассчитано: C 70,41; H 6,59; N 15,79;
найдено: C 70,29; H 6,63; N 15,65;
5) 5E-6-(3-(2,2-дициано-1-циклопропиламино-этиленамино)фенил)- 6-(3-пиридил)гекс-5-еновую кислоту
точка плавления: 173oC (смесь сложного этилового эфира уксусной кислоты и простого трет.-бутилметилового эфира)
C24H23N5O2 (413,48)
рассчитано: C 69,72; H 5,61; N 16,94;
найдено: C 69,57; H 5,77; N 17,05;
6) 5E-6-(3-(2,2-дициано-1-бензиламино-этиленамино)фенил)- 6-(3-пиридил)гекс-5-еновую кислоту
точка плавления: 154oC (смесь изопропанола и воды)
C28H25N5O2 (463,54)
рассчитано: C 72,55; H 5,44; N 15,11;
найдено: C 72,42; H 5,59; N 15,02;
7) 5E-6-(3-(2,2-дициано-1-пропиламино-этиленамино)фенил)- 6-(3-пиридил)гекс-5-еновую кислоту
точка плавления: 116oC (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C24H25N5O2 (415,49)
рассчитано: C 69,38; H 6,06; N 16,86;
найдено: C 69,25; H 6,13; N 16,77;
8) 5E-6-(3-(2,2-дициано-1-метиламино-этиленамино)фенил)- 6-(3-пиридил)гекс-5-еновую кислоту
Получают аналогично примеру 5б путем взаимодействия с метиламином в тугоплавкой трубке.
Точка плавления: 178oC (сложный этиловый эфир уксусной кислоты)
C22H21N5O2 (387,44)
рассчитано: C 68,20; H 5,46; N 18,08;
найдено: C 68,10; H 5,58; N 18,12;
9) 5E-6-(3-(2,2-дициано-1-диметиламино-этиленамино)фенил)- 6-(3-пиридил)гекс-5-еновую кислоту
Получают аналогично примеру 5б путем взаимодействия с диметиламином в тугоплавкой трубке.
Точка плавления: 147oC (сложный этиловый эфир уксусной кислоты)
C23H23N5O2 (401,47)
рассчитано: C 68,81; H 5,77; N 17,44;
найдено: C 68,75; H 5,83; N 17,28;
10) 5E-6-(3-(2,2-дициано-1-эксо-норборн-2-иламино)-этиленамино)фенил)- 6-(3-пиридил)гекс-5-еновую кислоту
точка плавления: 154-156oC (простой трет.бутилметиловый эфир)
C28H29N5O2 (467,57)
рассчитано: C 71,93; H 6,25; N 14,98;
найдено: C 71,81; H 6,31; N 14,87;
11) 5E-6-(3-(2,2-дициано-1-циклооктиламино-этиленамино)фенил)- 6-(3-пиридил)гекс-5-еновую кислоту
точка плавления: 167-169oC (сложный этиловый эфир уксусной кислоты)
C29H33N5O2 (483,61)
рассчитано: C 72,02; H 6,88; N 14,48;
найдено: C 72,00; H 6,94; N 14,40;
12) 5E-6-(3-(2,2-дициано-1-циклопентиламино-этиленамино)фенил)-6- (3-пиридил)гекс-5-еновую кислоту
точка плавления: 140-142oC (сложный этиловый эфир уксусной кислоты)
C28H31N5O2(469,59)
рассчитано: C 71,62; H 7,07; N 14,91;
найдено: C 71,49; H 7,16; N 14,84;
13) 5E-6-(3-(2,2-дициано-1-циклопентиламино-этиленамино)-5- трифторметилфенил)-6-(3-пиридил)гекс-5-еновую кислоту
точка плавления: 118oC (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C27H28F3N5O2 (509,54)
рассчитано: C 63,65; H 5,14; N 13,74;
найдено: C 63,50; H 5,25; N 13,57;
Пример 12. 5E-6-(3-(2,2-дициано-1-трет.бутиламино-этиленамино)фенил)-6-(3- пиридил)гекс-5-еновая кислота.
2,1 г сложного метилового эфира 5E-6-(3-(2,2-дициано-1-метилтио-этиленамино)фенил)-6-93-пиридил)гекс-5-еновая кислоты растворяют в 100 мл дихлорметана, после чего добавляют 1,9 г 3-хлорпербензойной кислоты и перемешивают при комнатной температуре в течение одного часа. Затем реакционную смесь смешивают с 10 мл трет.бутиламина и перемешивают при комнатной температуре в течение 12 часов. Реакционную смесь промывают водой, сгущают, остаток смешивают с 20 мл этанола и 20 мл 1N натрового щелока и нагревают до температуры 50oC в течение трех часов. Реакционный раствор сгущают, остаток смешивают с водой и промывают сложным этиловым эфиром уксусной кислоты. Водную фазу доводят до значения pH 4-5 путем добавления лимонной кислоты и экстрагируют сложным этиловым эфиром уксусной кислоты. Органическую фазу сгущают и остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дихлорметана и этанола в объемном соотношении 20:1. Фракцию продукта сгущают и остаток перекристаллизовывают из смеси сложного этилового эфира уксусной кислоты и диизопропилового эфира.
Выход: 43% теории,
точка плавления: 188-189oC
C25H27N5O2 (429,52)
рассчитано: C 69,91; H 6,34; N 16,30;
найдено: C 69,71; H 6,37; N 16,18.
Аналогично примеру 12 получают следующие соединения:
1) 5E-6-(3-(1-адамант-1-иламино-4,2-дициано-этиленамино)-фенил)-6- (3-пиридил)гекс-5-еновую кислоту с точкой плавления 142oC (смесь изопропанола и простого диизопропилового эфира).
C31H33N5O2 (507,64)
рассчитано: C 73,35; H 6,55; N 13,80;
найдено: C 73,22; H 6,61; N 13,71;
2) 5E-6-(3-92,2-дициано-1-диэтиламино-этиленамино)фенил)-6- (3-пиридил)-гекс-5-еновую кислоту с точкой плавления 118oC (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира).
C25H27N5O2 (429,52)
рассчитано: C 69,91; H 6,34; N 16,30;
найдено: C 69,73; H 6,46; N 16,24;
Пример 13. EZ-6-(4-(2-(2-циано-3-трет. бутил-гуанидино)этил)фенил)-6- (3-пиридил)гекс-5-еновая кислота.
a) Сложный метиловый эфир E/Z-6-(4-(2-цианимидо-феноксиметиленамино)-этил)фенил)-6-(3-пиридил) гекс-5-еновой кислоты
26,5 г E/Z-6-(4-(2-(ацетиламино)этил)фенил)-6-(3-пиридил)-гекс-5- еновой кислоты в 200 мл 6N соляной кислоты нагревают с обратным холодильником в течение 12 часов. Реакционный раствор сгущают, остаток смешивают с 200 мл 2N метанольной соляной кислоты и перемешивают при комнатной температуре в течение 12 часов. Реакционный раствор сгущают, остаток растворяют в воде и промывают сложным этиловым эфиром уксусной кислоты. Водную фазу подщелачивают при температуре 0oC путем добавления концентрированного аммиака и экстрагируют дихлорметаном. Органический экстракт промывают водой, сушат и сгущают. Остаток вместе с 14,9 дифеноксиметиленцианамида в 300 мл изопропанола перемешивают при комнатной температуре в течение 14 часов. Растворитель выделяют и остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дихлорметана и этанола в объемном соотношении 30:1.
Выход: 80% теории,
масло, значение Rf: 0,72 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20:1)
C28H28N4O3 (468,56)
рассчитано: C 71,78; H 6,02; N 11,96;
найдено: C 71,64; H 6,08; N 11,85;
б) E/Z-6-(4-(2-(2-циано-3-трет. бутил-гуанидино)этил)фенил)-6-(3- пиридил)-гекс-5-еновая кислота
2,35 г сложного метилового эфира E/Z-6-(4-(2-цианимидо-феноксиметиленамино)этил)фенил)-6-(3-пиридил) гекс-5-еновой кислоты и 3 мл трет.бутиламина в 40 мл изопропанола кипятят с обратным холодильником в течение трех часов. Затем реакционный раствор смешивают с 10 мл 2N натрового щелока при температуре 50oC и перемешивают при комнатной температуре в течение 30 минут. Реакционный раствор сгущают, остаток смешивают с водой и промывают сложным этиловым эфиром уксусной кислоты. Водную фазу доводят до значения pH 4-5 путем добавления лимонной кислоты и экстрагируют сложным этиловым эфиром уксусной кислоты. Органический экстракт промывают водой, сгущают и остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дихлорметана и этанола в объемном соотношении 20:1.
Выход: 55% теории,
пена, значение Rf: 0,64 (смесь дихлорметана и этанола в объемном соотношении 9:1)
C25H31N5O2 (433,55)
рассчитано: C 69,26; H 7,21; N 16,15;
найдено: C 69,27; H 7,29; N 15,95;
Аналогично примеру 13 получают следующее соединение:
E/Z-6-(4-(2-(2-циано-3-(2-метилпропил)гуанидино)этил)фенил)-6-(3- пиридил)гекс-5-еновую кислоту в виде смолы. Значение Rf: 0,48 (смесь дихлорметана и этанола в объемном соотношении 9:1).
C25H31N5O2 (433,55)
рассчитано: C 69,26; H 7,21; N 16,15;
найдено: C 69,17; H 7,26; N 16,17;
Пример 14. Метиламид 5E-6-(3-(2,2-дициано-1-(2-метилпропиламино)-этиленамино) фенил)-6-(3-пиридил)гекс-5-еновой кислоты
1,1 г 5E-6-(3-(2,2-дициано-1-(2-метилпропиламино)-этиленамино)фенил)- 6-(3-пиридил)гекс-5-еновой кислоты растворяют в 20 мл абсолютного тетрагидрофурана. Затем добавляют 0,5 г карбонилдиимидазола, перемешивают до окончания выделения газа и добавляют 0,09 г метиламина. Реакционную смесь перемешивают при комнатной температуре в течение 12 часов, затем смешивают с 2 мл воды и сгущают. Остаток смешивают со сложным этиловым эфиром уксусной кислоты. Органический экстракт промывают водой, сушат, сгущают и остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дихлорметана и этанола в объемном соотношении 14:1.
Выход: 60% теории,
пена, значение Rf: 0,61 (силикагель; смесь дихлорметана и этанола в объемном соотношении 9:1)
C26H30N6O (442,56)
рассчитано: C 70,56; H 6,83; N 18,99;
найдено: С 70,39; H 6,86; N 18,82;
Аналогично примеру 14 получают следующие соединения:
1) Диметиламид 5E-6-(3-(2,2-дициано-1-(2-метилпропиламино)- этиленамино)-фенил)-6-(3-пиридил)гекс-5-еновой кислоты
пена, значение Rf: 0,63 (силикагель; смесь дихлорметана и этанола в объемном соотношении 9:1)
C27H32N6O (456,59),
рассчитано: C 71,03; H 7,06; N 18,41;
найдено: C 70,83; H 7,17; N 18,43.
2) Сложный метиловый эфир 5E-6-(3-(2,2-дициано-1-(2-метилпропиламино)-этиленамино)фенил)-6-(3-пиридил) гекс-5-еновой кислоты
точка плавления: 127-129oC (простой трет.бутилметиловый эфир)
C26H29N5P2 (443,55),
рассчитано: C 70,41; H 6,59; N 15,79;
найдено: C 70,45; H 6,62; N 15,83;
3) Сложный метиловый эфир 5E-6-(3-(2,2-дициано-1-изопропиламино)-этиленамино)фенил)-6-(3-пиридил) гекс-5-еновой кислоты
точка плавления: 159oC (простой диизопропиловый эфир)
C25H27N5O2 (429,52),
рассчитано: C 69,91; H 6,34; N 16,31;
найдено: C 69,87; H 6,41; N 16,48;
4) Сложный 2-метилпропиловый эфир 5E-6-(3-(2,2-дициано-1-изопропиламино)-этиленамино)фенил)-6-(3-пиридил) гекс-5-еновой кислоты
масло, значение Rf: 0,53 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20:1)
C28H33N5O2 (471,61),
рассчитано: C 71,31; H 7,05; N 14,85;
найдено: C 71,10; H 7,16; N 15,09.
5) Сложный изопропиловый эфир 5E-6-(3-(2,2-дициано-1-изопропиламино)-этиленамино)фенил)-6-(3-пиридил)гекс -5-еноовой кислоты
точка плавления 119oC (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C27H31N5O2 (457,58)
рассчитано: C 70,87; H 6,83; N 15,31;
найдено: C 70,65; H 6,99; N 15,35;
6) Сложный метиловый эфир 5Е-6-(3-(2-циано-3-(2-метилпропил)- гуанидино)фенил-6-(3-пиридил)гекс-5-еновой кислоты
масло; значение Rf; 0,35 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20:1)
C24H29N5O2 (419,53),
рассчитано: C 68,71; H 6,97; N 16,69;
найдено: C 68,52; H 7,12; N 16,50.
7) Сложный 2-метилпропиловый эфир 5E-6-(3-(2-циано-3-(2-метилпропил)-гуанидино)фенил)-6-(3-пиридил)гекс -5-еновой кислоты
масло; значение Rf: 0,38 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20:1)
C27H35N5O2 (461,61),
рассчитано: C 70,25; H 7,64; N 15,17;
найдено: C 70,04; H 7,78; N 14,98;
8) Сложный изопропиловый эфир 5E-6-(3-(2-циано-3-(2-метилпропил)- гуанидино)фенил)-6-(3-пиридил)гекс-5-еновой кислоты
масло; значение Rf: 0,37 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20:1)
C26H33N5O2 (447,58),
рассчитано: C 69,77; H 7,43; N 15,65;
найдено: C 69,65; H 7,55; N 15,51;
9) Амид 5E-6-(3-(2,2-дициано-1-изопропиламино-этиленамино)фенил)-6-(3-пиридил)гекс-5-еновой кислоты
точка плавления: 123oC (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C24H26N6O (414,50),
рассчитано: C 69,55; H 6,32; N 20,28;
найдено: C 69,46; H 6,43; N 20,42;
10) Сложный циклогексиловый эфир 5E-6-(3-(2-циано-3-(2-метилпропил)-гуанидино)фенил)-6-(3-пиридил)гекс -5-еновой кислоты
масло; значение Rf: 0,42 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20:1)
C29H37N5O2 (487,65),
рассчитано: C 71,43; H 7,65; N 14,36;
найдено: C 71,38; H 7,68; N 14,18;
Пример 15. 5E-6-(3-(3-неопентил-2-фенилсульфонил-гуанидино)фенил) -6-(3-пиридил)гекс-5-еновая кислота.
а) Дифеноксиметилен-фенилсульфонамид
13,5 г дихлор-дифеноксиметана и 17,3 г фенилсульфонамида в 160 мл сложного этилового эфира уксусной кислоты нагревают с обратным холодильником в течение 48 часов. Реакционную смесь сгущают, остаток смешивают с водой и путем добавления бикарбоната натрия доводят до значения pH 8. Водную фазу экстрагируют сложным этиловым эфиром уксусной кислоты. Органический экстракт сгущают, остаток нагревают в дихлорметане и фильтруют. Фильтрат сгущают и остаток очищают на силикагельсодержащей колонке с применением в качестве элюента дихлорметана. Фракцию продукта сгущают и остаток перекристаллизовывают из смеси сложного этилового эфира уксусной кислоты и простого диизопропилового эфира.
Выход: 26% теории,
точка плавления: 121 - 122oC
C19H15NO4S (353,40)
рассчитано: C 64,58; H 4,28; N 3,96; S 9,07;
найдено: C 64,60; H 4,41; N 3,94; S 8,94;
Аналогично примеру 15а получают следующее соединение:
дифеноксиметилен-метилсульфонамид,
точка плавления: 124oC (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира).
C14H13NO4S (291,33)
рассчитано: C 57,72; H 4,50; N 4,81; S 11,01;
найдено: С 57,62; H 4,58; N 4,87; S 11,10.
б) Сложный метиловый эфир 5E-6-(3-(фенилсульфонимидо- феноксиметиленамино)фенил)-6-(3-пиридил)гекс-5-еновой кислоты
3,5 г дифенилоксиметилен-фенилсульфонамида и 3 г сложного метилового эфира 5E-6-(3-аминофенил)-6-(3-пиридил)гекс-5-еновой кислоты в 60 мл изопропанола перемешивают при комнатной температуре в течение 48 часов. Реакционную смесь сгущают и остаток очищают на силикагельсодержащей колонке с применением в качестве элюента дихлорметана. Фракцию продукта сгущают и остаток перекристаллизовывают из смеси простого диэтилового эфира и петролейного эфира.
Выход: 86% теории,
точка плавления: 90 - 92oC
C31H29N3O5S (555,65)
рассчитано: C 67,01; H 5,26; N 7,56; S 5,77;
найдено: C 66,82; H 5,35; N 7,63; S 5,81;
Аналогично примеру 15б получают следующее соединение:
Сложный метиловый эфир 5E-6-(3-метилсульфонимидо-феноксиметиленамино)-фенил)-6-(3-пиридил)гекс -5-еновой кислоты.
Точка плавления: 101 - 102oC (смесь сложного этилового эфира уксусной кислоты и петролейного эфира)
C26H27N3O5S (493,58)
рассчитано: C 63,27; H 5,51; N 8,51; S 6,50;
найдено: C 63,39; H 5,58; N 8,56; S 6,59;
а) 5E-6-(3-(3-неопентил-2-фенилсульфонил-гуанидино)фенил) -6-(3-пиридил)-гекс-5-еновая кислоты
2,4 г сложного метилового эфира 5E-6-(3-фенилсульфонимидо-феноксиметиленамино)фенил)-6-(3-пиридил)гекс-5-еновой кислоты и 2,4 мл неопентиламина в 40 мл изопропанола нагревают с обратным холодильником в течение одного часа. Затем охлаждают до температуры 50oC, реакционный раствор смешивают с 10 мл 2N натрового щелока и перемешивают при температуре 50oC в течение 30 минут. Реакционную смесь сгущают, остаток смешивают с водой и экстрагируют сложным этиловым эфиром уксусной кислоты. Водную фазу доводят до значения pH 4 - 5 путем добавления лимонной кислоты и экстрагируют сложным этиловым эфиром уксусной кислоты. Органический экстракт сгущают и остаток перекристаллизовывают из смеси сложного этилового эфира уксусной кислоты и изопропанола.
Выход: 91% теории,
точка плавления: 159 - 160oC
C29H34N4O4S (534,58)
рассчитано: C 65,15; H 6,41; N 10,48; S 6,00;
найдено: C 65,05; H 6,52; N 10,48; S 6,04.
Аналогично примеру 15в получают следующие соединения:
5E-6-(3-(3-трет. бутил-2-фенилсульфонил-гуанидино)фенил) -6-(3-пиридил)гекс-5-еновую кислоту в виде пены.
Значение Rf: 0,20 (смесь дихлорметана и этанола в объемном соотношении 30:1)
C28H32N4O4S (520,65)
рассчитано: C 64,59; H 6,19; N 10,76; S 6,16;
найдено: C 65,39; H 6,27; N 10,61; S 6,13;
2) 5Е-6-(3-(3-(2-метилпропил)-2-фенилсульфонил-гуанидино)-фенил) -6-(3-пиридил)гекс-5-еновую кислоту с точкой плавления 124 -125oC (сложный этиловый эфир уксусной кислоты).
C28H32N4O4S (520,65)
рассчитано: C 64,59; H 6,19; N 10,76; S 6,16;
найдено: C 64,45; H 6,24; N 10,59; S 6,11;
3) 5Е-6-(3-(3-неопентил-2-метилсульфонил-гуанидино)-фенил) -6-(3-пиридил)гекс-5-еновую кислоту с точкой плавления 143 - 144oC (смесь сложного этилового эфира уксусной кислоты и изопропанола).
C24H32N4O4S (472,61)
рассчитано: C 60,99; H 6,83; N 11,86; S 6,78;
найдено: C 60,87; H 6,95; N 11,79; S 6,73;
4) 5E-6-(3-(3-(2-метилпропил)-2-фенилсульфонил-гуанидино)-фенил)-6-(3-пиридил)гекс-5-еновую кислоту с точкой плавления 158oC (смесь сложного этилового эфира уксусной кислоты и изопропанола).
C23H30N4S (458,58)
рассчитано: C 60,24; H 6,59; N 12,22; S 6,99;
найдено: C 60,15; H 6,65; N 12,08; S 6,92;
5) 5E-6-(3-(3-(2-циклопентил-2-метилсульфонил-гуанидино)- фенил)-6-(3-пиридил)гекс-5-еновую кислоту с точкой плавления 169-170oC (смесь сложного этилового эфира уксусной кислоты и изопропанола).
C24H30N4S (470,59)
рассчитано: C 61,26; H 6,43; N 11,91; S 6,81;
найдено: C 61,41; H 6,45; N 12,10; S 6,90;
6) 5E-6-(3-(3-трет.бутил-2-метилсульфонил-гуанидино)- фенил)-6-(3-пиридил)гекс-5-еновую кислоту с точкой плавления 150-151oC (смесь сложного этилового эфира уксусной кислоты и простого диизопропилвого эфира).
C23H30N4S (458,58)
рассчитано: C 60,24; H 6,59; N 12,22; S 6,99;
найдено: C 60,33; H 6,62; N 12,35; S 7,04;
7) 5E-6-(3-(3-циклопентил-2-фенилсульфонил-гуанидино)- фенил)-6-(3-пиридил)гекс-5-еновую кислоту с точкой плавления 116-117oC (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира).
C29H32N4S (532,66)
рассчитано: C 65,39; H 6,06; N 10,52; S 6,02;
найдено: C 65,20; H 6,08; N 10,39; S 6,19;
Пример 16. 5E-6-(3-(2-амидосульфонил-3-(2-метилпропил)гуанидино)фенил)-6- (3-пиридил)гекс-5-еновая кислота.
а) Сложный метиловый эфир 5E-6-(3-(сульфамоилимидо-феноксиметиленамино)-фенил)-6-(3-пиридил)гекс -5-еновой кислоты.
2,4 N-сульфамоил-дифенил-имидокарбоната и 3 г сложного метилового эфира 5E-6-(3-аминофенил)-6-(3-пиридил)гекс-5-еновой кислоты растворяют в 60 мл изопропанола и перемешивают при комнатной температуре в течение 36 часов. Растворитель удаляют и остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дихлорметана и этанола в объемном соотношении 40:1.
Выход: 89% теории,
масло, значение Rf: 0,59 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20:1)
C25H26N4O4S (494,57)
рассчитано: C 60,71; H 5,30; N 11,33; S 6,48;
найдено: C 60,55; H 5,43; N 11,18; S 6,39;
б) 5E-6-(3-(2-амидосульфонил-3-(2-метилпропил)гуанидино)фенил)- 6-(3-пиридил)гекс-5-еновая кислота
2,2 г сложного метилового эфира 5E-6-(3-(сульфамоилимидо-феноксиметиленамино)фенил)-6-(3-пиридил) гекс-5-еновой кислоты и 5 мл метилпропиламино в 50 мл изопропанола кипятят с обратным холодильником в течение четырех часов. Реакционной смеси дают охлаждаться до температуры 50oC, после чего ее смешивают с 10 мл 2N натрового щелока и перемешивают при температуре 50oC в течение 60 минут. Реакционную смесь сгущают, остаток смешивают с водой и экстрагируют сложным этиловым эфиром уксусной кислоты. Водную фазу доводят до значения pH 4 - 5 путем добавления лимонной кислоты и экстрагируют сложным этиловым эфиром уксусной кислоты. Органический экстракт сгущают и остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дихлорметана и этанола в объемном соотношении 30:1. Фракцию продукта сгущают и остаток перекристаллизовывают из смеси сложного этилового эфира уксусной кислоты и простого диизопропилового эфира.
Выход: 38% теории,
точка плавления: 98oC
C22H29N5O4S (459,57)
рассчитано: C 57,50; H 6,36; N 15,24; S 6,98;
найдено: C 57,62; H 6,51; N 15,38; S 7,05;
Аналогично примеру 16б получают следующие соединения:
1) 5E-6-(3-(2-амидосульфонил-3-неопентил-гуанидино)фенил)-6- (3-пиридил)гекс-5-еновую кислоту с точкой плавления 136-140oC (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C23H31N5O4S (473,60)
рассчитано: C 58,33; H 6,60; N 14,79; S 6,77;
найдено: C 58,28; H 6,73; N 14,53; S 6,50;
1) 5E-6-(3-(2-амидосульфонил-3-циклопентил-гуанидино)фенил)-6- (3-пиридил)гекс-5-еновую кислоту с точкой плавления 95oC разложение; (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира).
C23H29N5O4S (471,58)
рассчитано: C 58,58; H 6,20; N 14,85; S 6,80;
найдено: C 58,29; H 6,33; N 14,65; S 6,68;
Пример 17. 5E-6-(3-(2-карбамоил-2-циано-1-(2-метилпропиламино) этиленамино)фенил)-6-(3-пиридил)гекс-5-еновая кислота.
1,5 г сложного метилового эфира 5E-6-(3-аминофенил)-6-(3-аминофенил)-6-(3-пиридил)гекс-5-еновой кислоты и 0,95 г 1-карбамоил-1-циано-2,2-бис(метилтио)-этена в 25 мл изопропанола кипятят с обратным холодильником в течение 20 часов. Реакционную смесь сгущают, маслянистый остаток смешивают с 40 мл изопропанола и подают в 5 мл 2-метилбутиламина. Реакционную смесь кипятят с обратным холодильником в течение четырех часов и затем смешивают при температуре 50oC с 10 мл 2N натрового щелока. Реакционный раствор перемешивают при температуре 50oC в течение 30 минут и затем его сгущают. Остаток смешивают с водой и промывают сложным этиловым эфиром уксусной кислоты. Водную фазу доводят до значения pH 4 - 5 путем добавления лимонной кислоты и экстрагируют сложным этиловым эфиром уксусной кислоты. Органический экстракт сушат, сгущают и остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дихлорметана и этанола в объемном соотношении 30 : 1.
Выход: 40% теории,
пена, значение Rf: 0,38 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20:1)
C25H29N5O3 (447,54)
рассчитано: C 67,09; H 6,53; N 15,65;
найдено: C 66,94; H 6,63; N 15,69;
Аналогично примеру 17 получают следующие соединения:
1) 5E-6-(3-(2-карбамоил-2-циано-1-циклопентиламино- этиленамино)фенил)-6-(3-пиридил)гекс-5-еновую кислоту в виде пены.
Значение Rf: 0,35 (силикагель; смесь дихлорметана и этанола в объемном соотношении 20:1)
C26H29N5O3 (459,55)
рассчитано: C 67,95; H 6,36; N 15,24
найдено: C 67,99; H 6,48; N 15,06
2) 5E-6-(3-(2-карбамоил-2-циано-1-пропиламино-этиленамино) фенил)-6-(3-пиридил)гекс-5-еновую кислоту с точкой плавления 161-163oC (смесь сложного этилового эфира уксусной кислоты и изопропанола).
C24H27N5O3 (433,51)
рассчитано: C 66,50; H 6,28; N 16,16;
найдено: C 66,37; H 6,42; N 16,05;
3) 5E-6-(3-(2-карбамоил-2-циано-1-диметиламино-этиленамино) фенил)-6-(3-пиридил)гекс-5-еновую кислоту в виде пены.
Значение Rf: 0,34 (силикагель; смесь дихлорметана и этанола в объемном соотношении 10:1)
C23H25N5O3 (419,50)
рассчитано: C 65,85; H 6,01; N 16,69;
найдено: C 65,69; H 6,10; N 16,54;
4) 5E-6-(3-(2-циано-2-метоксикарбонил-1-(2-метилпропиламино- этиламино)фенил)-6-(3-пиридил)гекс-5-еновую кислоту
Получают аналогично примеру 17 путем взаимодействия сложного эфира с 1-циано-1-метоксикарбонил-2,2-бис(метилтио)этеном.
Точка плавления: 134-135oC (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C26H30N4O4 (462,55)
рассчитано: C 67,51; H 6,54; N 12,11;
найдено: C 67,33; H 6,48; N 12,28;
5) 5E-6-(3-(2-циано-1-циклопентиламино-2-метоксикарбонил- этиламино)фенил)-6-(3-пиридил)гекс-5-еновую кислоту
Получают аналогично примеру 17 путем взаимодействия сложного эфира с 1-циано-1-метоксикарбонил-2,2-бис(метилтио)этеном.
Точка плавления: 150-151oC (смесь сложного этилового эфира уксусной кислоты и простого диизопропилового эфира)
C27H30N4O4 (474,56)
рассчитано: C 68,34; H 6,37; N 11,81;
найдено: C 68,31; H 6,46; N 11,88;
Пример 18. 4E-1-(5-(3-(2-циано-3-(2-метилпропил)гуанидино)фенил)-5- (3-пиридил)пент-4-енил)тетразол.
2,25 г 4E-1-(3-аминофенил)-5-(3-пиридил)пент-4-енил)тетразола и 2,4 г дифеноксиметил-цианамида в 500 мл толуола перемешивают при комнатной температуре в течение 20 часов. Реакционную смесь фильтруют, фильтрат смешивают с 5 мл 2-метилпропиламина и нагревают с обратным холодильником в течение 13 часов. Растворитель удаляют и остаток очищают на силикагельсодеражащей колонке с применением в качестве элюента смеси дихлорметана, метанола и уксусной кислоты в объемном соотношении 96:4:3.
Выход: 66% теории,
пена, значение Rf: 0,27 (силикагель; смесь дихлорметана, метанола и уксусной кислоты в объемном соотношении 90:10:3)
C23H27N9 • CH3COOH (459,56)
рассчитано: C 62,73; H 6,36; N 27,43;
найдено: C 62,61; H 6,52; N 27,64.
Аналогично примеру 18 получают следующее соединение:
1) 4E-1-(5-(3-(2-циано-3-циклопентил-гуанидино)фенил)-5- (3-пиридил)пент-4-енил)тетразол в виде пены.
Значение Rf: 0,07 (силикагель; смесь дихлорметана и этанола в объемном соотношении 10:1)
C24H27N9 (441,54)
рассчитано: C 65,29; H 6,16; N 28,55;
найдено: C 65,03; H 6,28; N 28,42;
Пример 19. 4E-1(5-(3-(2,2-дициано-1-циклопентиламино-этиламино)-фенил- 5-(3-пиридил)пент-4-енил)тетразол.
2,25 г 4E-1-(5-(3-аминофенил)-5-(3-пиридил)пент-4-енил) тетразола и 2,15 г 2,2-дициано-1,1-бис(метилтио)этена в 50 мл изопропанола нагревают с обратным холодильником в течение 48 часов. Реакционную смесь смешивают с 3 мл циклопентиламина и кипятят с обратным холодильником в течение дальнейших 26 часов. Растворитель удаляют и остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дихлорметана, метанола и уксусной кислоты в объемном соотношении 96 : 4 : 3.
Выход: 58% теории,
пена, значение Rf: 0,35 (силикагель марки RP8; 5%-ный раствор хлорида натрия и метанол в объемном соотношении 4 : 6)
C26H27N9 • 0,5 CH3COOH (495,59)
рассчитано: C 65,44; H 6,90; N 25,44;
найдено: C 65,26; H 6,07; N 25,35;
Пример 20. 5E-6-(3-(2-бензоил-3-(2-метилпропил)гуанидино)фенил)-6- (3-пиридил)гекс-5-еновая кислота.
а) Сложный метиловый эфир 5E-6-(3-бензоилимино-фенокси-метиленамино)фенил)-6-(3-пиридил)гекс-5-еновой кислоты
5г N-бензоил-дифенилимидокарбаната и 4,14 г сложного метилового эфира 5E-6-(3-аминофенил)-6-(3-пиридил)гекс-5-еновой кислоты растворяют в 200 мл изопропанола и перемешивают при комнатной температуре в течение четырех часов. Получаемый осадок отсасывают, промывают изопропанолом и сушат.
Выход: 79% теории,
точка плавления: 112oC
C32H29N3O4 (519,60)
рассчитано: C 73,97; H 5,63; N 8,09;
найдено: C 73,94; H 5,68; N 8,10;
б) 5E-6-(3-(2-бензоил-3-(2-метилпропил)гуанидино)фенил)-6- (3-пиридил)гекс-5-еновая кислота
2,6 г сложного метилового эфира 5E-6-(3-(бензоилимино-фенокси-метиленамино)фенил)-6-(3-пиридил)гекс-5-еновой кислоты и 5 мл 2-метилпропиламина в 50 мл изопропанола нагревают с обратным холодильником в течение одного часа. Реакционной смеси дают охлаждаться до температуры 50oC, смешивают с 15 мл 1N натрового щелока и перемешивают при этой температуре в течение 30 минут. Растворитель удаляют, остаток смешивают с водой и промывают сложным этиловым эфиром уксусной кислоты. Водную фазу доводят до значения pH 4-5 путем добавления лимонной кислоты, полученный осадок отсасывают и промывают водой. Фильтровальный осадок перекристаллизовывают из сложного этилового эфира уксусной кислоты.
Выход: 74% теории,
точка плавления: 159-160oC
C29H32N4O3 (484,60)
рассчитано: C 71,88; H 6,66; N 11,56;
найдено: C 71,92; H 6,70; N 1 1,73.
Аналогично примеру 20 получают следующее соединение:
1) 5E-6-(3-(2-бензоил-3-циклопентил-гуанидино)фенил)-6-(3- пиридил)гекс-5-еновую кислоту с точкой плавления 171oC (смесь изопропанола и сложного этилового эфира уксусной кислоты).
C30H32N4O3 (496,61)
рассчитано: C 72,56; H 6,50; N 11,28;
найдено: C 72, 42; H 6,55; N 11,15;
Пример 21. 5E-6-(3-(2-карбамоил-3-(2-метилпропил)гуанидино)фенил)-6- (3-пиридил)гекс-5-еновая кислота.
1,34 г 5E-6-(3-(2-циано-3-(2-метилпропил)гуанидино)фенил) -6-(3-пиридил)гекс-5-еновой кислоты растворяют в 50 мл 4N соляной кислоты и затем перемешивают при комнатной температуре в течение 48 часов. Раствор доводят до значения pH 5-6 путем добавления ацетата натрия и экстрагируют сложным этиловым эфиром уксусной кислоты. Органический экстракт сгущают и остаток очищают на силикагельсодержащей колонке с применением в качестве элюента смеси дихлорметана и этанола в объемном соотношении 19 : 1.
Выход: 54% теории,
пена, значение Rf: 0,20 (силикагель; смесь дихлорметана и этанола в объемном соотношении 19 : 1)
C23H29N5O3 (423,52)
рассчитано: C 65,22; H 6,90; N 16,54;
найдено: C 65,30; H 6,05; N 16,37;
Нижеследующие примеры иллюстрируют конкретные составы предлагаемой фармацевтической композиции.
Пример 22. Таблетки с 100 мг 5E-6-(3-(2,2-дициано-1-циклопентил-амино- этиленамино)фенил)-6-(3-пиридил)гекс-5-еновой кислоты.
Состав:
1 таблетка содержит, мг:
активное вещество - 100,0
лактозу - 80,0
кукурузный крахмал - 34,0
поливинилпирролидон - 4,0
стеарат магния - 2,0 - 220,0
Приготовление. Активное вещество, лактозу и крахмал смешивают и равномерно увлажняют водным раствором поливинипирролидона. Влажную массу пропускают через сито величиной ячеек 2,0 мм, сушат во многоступенчатом сушильном шкафу при температуре 50oC, а затем пропускают через сито величиной ячеек 1,5 мм. После этого добавляют стеарат магния и размешивают. Готовую массу прессуют в таблетки.
Вес одной таблетки: 220 мг
Диаметр: 9 мм, плоские с обеих сторон с двусторонним фасетом и односторонним надрезом.
Пример 23. Капсулы из твердой желатины, содержащие 150 мг 5E-6-(3-(2,2-дициано-1-циклопентиламино-этиленамино)фенил)- 6-(3-пиридил)гекс-5-еновой кислоты.
1 капсула содержит, мг:
активное вещество - 150,0
сушеный кукурузный крахмал, примерно - 180,0
лактоза в виде порошка, примерно - 87,0
стеарат магния, примерно - 3,0 - 420,0
Приготовление. Активное вещество смешивают со вспомогательными веществами, полученную массу пропускают через сито величиной ячеек 0,75 мм, и с помощью пригодного устройства размешивают до получения гомогенной массы.
Готовую массу подают в капсулы из твердой желатины размером 1.
Содержание одной капсулы: примерно 420 мг
Оболочка капсулы: капсула из твердой желатины, размер 1.
Пример 24. Суппозитории, содержащие 150 мг 5E-6-(3-(2,2-дициано-1- циклопентиламино-этиленамино)фенил-6-(3-пиридил)гекс-5-еновой кислоты.
1 суппозиторий содержит, мг:
активное вещество - 150,0
полиэтиленгликоль (молекулярный вес 1500) - 550,0
полиэтиленгликоль (молекулярный вес 6000) - 460,0
моностеарат полиэтиленсорбитана - 840,0 - 2000,0
Приготовление. Полиэтиленгликоль и моностерат полиэтиленсорбитана расплавляют, активное вещество гомогенно распределяют в полученной массе, и готовую массу разливают по предварительно охлажденным формам.
Пример 25. Суспензия,содержащая 50 мг 5E-6-(3-(2,2-дициано-1-циклопентиламино-этиленамино)фенил)- 6-6(3-пиридил)гекс-5-еновой кислоты.
100 мл суспензии содержат
активное вещество - 1,0 г
натриевую соль карбоксиметилцеллюлозы - 0,2 г
сложный метиловый эфир п-оксибензойной кислоты - 0,05 г
сложный пропиловый эфир п-оксибензойной кислоты - 0,01 г
глицерин - 5,0 г
70%-ный раствор сорбита - 50,0 г
аромат - 0,3 г
дистиллированную воду - до 100,0 мл
Приготовление. Дистиллированную воду нагревают до температуры 70oC. В нем при размешивании растворяют сложные метиловый и пропиловый эфиры п-оксибензойной кислоты, глицерин и натриевую соль карбоксиметилцеллюлозы. Охлаждают до комнатной температуры, при размешивании добавляют активное вещество и смешивают до получения гомогенной дисперсии. Затем добавляют раствор сорбита и аромат, и суспензию размешивают при удалении воздуха.
5 мл суспензии содержат 50 мг активного вещества.
Пример 26. Таблетки, содержащие 150 мг 5E-6-(3-(2,2-дициано-1- циклопентиламино)фенил)-6-(3-пиридил)гекс-5-еновой кислоты.
Состав.
1 таблетка содержит, мг:
активное вещество - 150,0
лактозу в виде порошка - 89,0
кукурузный крахмал - 40,0
коллодиальную кремневую кислоту - 10,0
поливинилпирролидон - 10,0
стеарат магния - 1,0 - 300,0
Приготовление. Активное вещество смешивают с лактозой, кукурузным крахмалом и кремневой кислотой. Полученную смесь увлажняют 20%-ным водным раствором поливинилпирролидона и пропускают через сито величиной ячеек 1,5 мм.
Полученный гранулят сушат при температуре 45oC, и после этого его вновь дробят путем пропускания через то же сито, добавляют стеарат магния и размешивают. Полученную массу прессуют в таблетки.
Вес одной таблетки: 300 мг
диаметр пуансона: 10 мм, плоский
Пример 27. Таблетки с покрытием, содержащие 75 мг 5E-6-(3-(2,2-дициано- 1-циклопентиламино-этиленамино)фенил)-6-(3-пиридил)гекс-5-еновой кислоты.
1 таблетка содержит, мг:
активное вещество, - 75,0
фосфат кальция - 93,0
кукурузный крахмал - 35,5
поливинпирролидон - 10,0
оксипропилметилцеллюлозу - 15,0
стеарат магния - 1,5 - 230,0
Приготовление. Активное вещество смешивают с фосфатом кальция, кукурузным крахмалом, поливинилпирролидоном, оксипропилметилцеллюлозой и половиной указанного количества стеарата магния. С помощью соответствующего аппарата изготавливают прессованные заготовки диаметром примерно 13 мм, которые с помощью другого пригодного устройства дробят путем пропускания через сито величиной ячеек 1,5 мм. Затем добавляют остаток стеарата магния. Из полученного гранулята с помощью соответствующего аппарата прессуют таблетки желаемой формы.
Вес одной таблетки без покрытия: 230 мг
Диаметр пуансона: 9 мм, изогнутый
Полученные таким образом таблетки снабжают тонким покрытием, в основном состоящим из оксиметилцеллюлозы. Готовые таблетки, снабженные покрытием, полируют с использованием пчелиного воска.
Вес одной таблетки с покрытием: 245 мг
Само собой разумеется, что в вышеописанных препаратах в качестве активного вещества можно использовать и все остальные соединения общей формулы (1).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ПИРИДИЛА, СМЕСЬ ИХ ИЗОМЕРОВ, ИЛИ ИНДИВИДУАЛЬНЫЕ ИЗОМЕРЫ, ИЛИ ИХ ФИЗИОЛОГИЧЕСКИ ПЕРЕНОСИМЫЕ АДДИТИВНЫЕ СОЛИ, ОБЛАДАЮЩИЕ БИОЛОГИЧЕСКОЙ АКТИВНОСТЬЮ | 1991 |
|
RU2028292C1 |
| ПРОИЗВОДНЫЕ АРИЛСУЛЬФОНАМИДА, ИХ СМЕСИ ИЗОМЕРОВ ИЛИ ИНДИВИДУАЛЬНЫЕ ИЗОМЕРЫ И ИХ ФИЗИОЛОГИЧЕСКИ ПЕРЕНОСИМЫЕ АДДИТИВНЫЕ СОЛИ С ОСНОВАНИЯМИ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АНТИТРОМБИЧЕСКОЙ АКТИВНОСТЬЮ | 1992 |
|
RU2096405C1 |
| ЦИКЛИЧЕСКИЕ АЗОТСОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ, СМЕСЬ ИХ ИЗОМЕРОВ, ОТДЕЛЬНЫЕ ИЗОМЕРЫ ИЛИ ИХ СОЛИ | 1994 |
|
RU2126002C1 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ АНГИОТЕНЗИНА, НА ИХ ОСНОВЕ | 1992 |
|
RU2053229C1 |
| ПРОИЗВОДНЫЕ ДИАЗЕПИНОНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2081870C1 |
| ПРОИЗВОДНЫЕ ФЕНИЛАМИДИНА, ИХ ТАУТОМЕРЫ И СТЕРЕОИЗОМЕРЫ, ИХ СМЕСИ, ИХ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С АНТИТРОМБОТИЧЕСКИМ И АНТИАГРЕГАТОРНЫМ ДЕЙСТВИЕМ | 1996 |
|
RU2167857C2 |
| ЦИКЛИЧЕСКИЕ ИМИНОПРОИЗВОДНЫЕ, ИХ СМЕСИ ИЗОМЕРОВ, ЭНАНТИОМЕРЫ, ДИАСТЕРЕОМЕРЫ ИЛИ ФИЗИОЛОГИЧЕСКИ ПЕРЕНОСИМЫЕ СОЛИ, ОБЛАДАЮЩИЕ ПРОТИВОТРОМБОТИЧЕСКИМ ДЕЙСТВИЕМ | 1991 |
|
RU2040519C1 |
| Производные бензимидазола, их изомеры, смеси изомеров, гидраты или их физиологически переносимые соли, обладающие антагонистическими в отношении ангиотензина свойствами | 1991 |
|
SU1836357A3 |
| КОНДЕНСИРОВАННЫЕ 5-ЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ ИЛИ ИХ СОЛИ, ПРОЯВЛЯЮЩИЕ АКТИВНОСТЬ ПО ТОРМОЖЕНИЮ АГРЕГАЦИИ | 1992 |
|
RU2041211C1 |
| Способ получения производных фенилуксусной кислоты или их солей | 1983 |
|
SU1170969A3 |
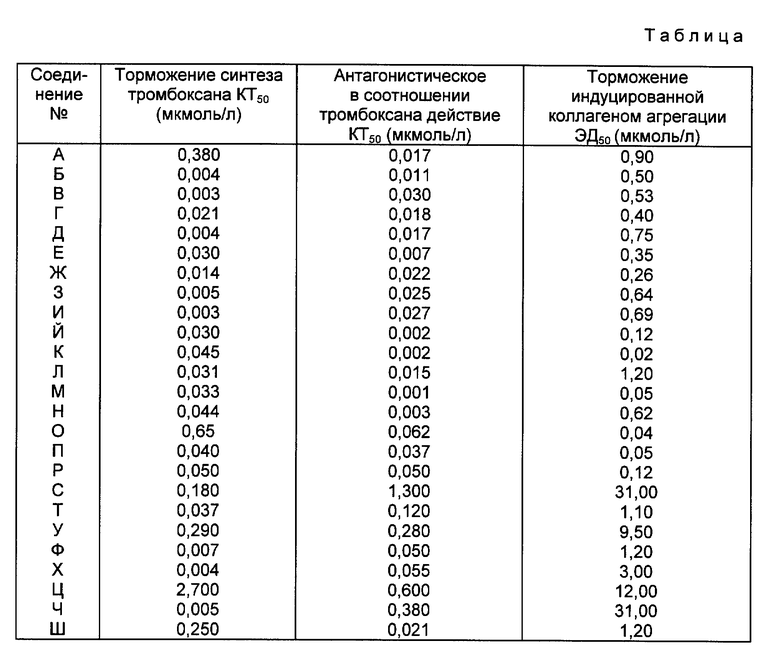
Производные пиридина, их энантиомеры, цис- или трансизомеры и их соли используемые в фармацевтической композиции с антитробмотической, антагонистической в отношении тромбоксана и тормозящей агрегацию тромбоцитов и синтез тромбоксана активностью. Соединения имеют форму I, где А - углеродазотная связь или неразветвленная С1-С4-алкиленовая группа; Х-нитрометиленовая группа, цианометиленовая группа, замещенная цианогруппой, аминокарбонилом или С1-С3-алкоксикарбонилом или группа формулы =N-R7, где R7 -цианогруппа, С1-С3-алкансульфонил, аминосульфонил, аминокарбонил или фенилкарбонил, Y - С1-С3-алкоксигруппа, фенокси или группа R8NR9, где R8 - водород, СI-С8-алкил, которая во 2-м, 3-м или 4-м положении может быть замещена гидроксигруппой, С1-С3-диалкиламиногруппой, замещенную С1-С4-алкильную группу, которая может быть дополнительно замещена гидроксильной группой во 2-м, 3-м или 4-м положении и др. R1 - водород, С1-С3-алкил, R9 - водород, С1-С3-алкил, R2 и R3 -водород или вместе образуют углерод-углеродную связь; Pyr - пиридильная группа, R4 -тетразолил, аминокарбонил, C1 - C4 - диалкиламинокарбонил и др. , R5 - водород, трифторметил, С1 - C3 - алкоксил, n равно 2,3,4,5. 2 с. и 3 з.п. ф-лы, 1 табл. 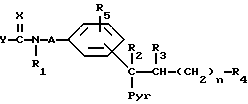 и
и
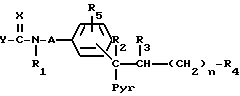
где A - углерод-азотная связь или неразветвленная алкиленовая группа с 1-4 атомами углерода;
X - нитрометиленовая группа, цианометиленовая группа, замещенная цианогруппой, аминокарбонилом или алкоксикарбонилом с 1-3 атомами углерода в алкоксильной группе, или группа формулы =N-R7, где R7 означает цианогруппу, алкансульфонил с 1-3 атомами углерода, фенилсульфонил, аминосульфонил, аминокарбонил или фенилкарбонил,
Y - алкоксигруппа с 1-3 атомами углерода, феноксигруппа, или группа формулы R8NR9, где R8 означает атом водорода, неразветвленную или разветвленную алкильную группу с 1-8 атомами углерода, которая во 2-м, 3-м или 4-м положении может быть замещена гидроксигруппой или диалкиламиногруппой с 1-3 атомами углерода в каждой алкильной части, замещенную фенилом алкильную группу с 1-4 атомами углерода, которая может быть дополнительно замещена гидроксильной группой во 2-м, 3-м или 4-м положении, замещенную пиридилом алкильную группу с 1-4 атомами углерода, циклоалкильную группу с 3-8 атомами углерода, инданил, норборнил, адамантил, алкоксигруппу с 1-3 атомами углерода или триметилсилилалкил с 1-3 атомами углерода в алкильной части, а R9 - атом водорода или алкильная группа с 1-3 атомами углерода, или R8 и R9 вместе с находящимся между ними атомом азота образуют 1-пиперидинил, незамещенный или замещенный одной или двумя метильными группами или фенилом, морфолиногруппу, 1-пиперазинил, незамещенный или замещенный в 4-м положении фенилом или 1,2,3,4-тетрагидроизохинолин-2-ил,
R1 - атом водорода или алкил с 1-3 атомами углерода;
R2 и R3 - атом водорода или вместе образуют углерод-углеродную связь;
Pyr - пиридильная группа;
R4 - тетразолил, аминокарбонил, алкиламинокарбонил и диалкиламинокарбонил, каждый с 1 - 3 атомами углерода в алкильных частях, сложно-эфирная группа, переводимая in vivo метаболическим путем в карбоксильную группу, или же карбоксил, если Y означает группу R8NR9, где R8 и R9 имеют вышеуказанное значение,
R5 - атом водорода, алкил с 1-3 атомами углерода, алкоксил с 1-3 атомами углерода или трифторметил;
n - 2, 3, 4, 5,
их энантиомеры, цис- или трансизомеры, если R2 и R3 вместе означают углерод-углеродную связь, и их фармацевтически приемлемые соли.
Приоритет по признакам:
14.12.91 - A - углерод-азотная связь или неразветвленная алкиленовая группа с 1-4 атомами углерода; X - нитрометиленовая группа, цианометиленовая группа, замещенная цианогруппой, аминокарбонилом или алкоксикарбонилом с 1-3 атомами углерода в алкоксильной группе, или группа формулы =N-R7, где R7 означает цианогруппу, алкансульфонил с 1-3 атомами углерода, фенилсульфонил, аминосульфонил, аминокарбонил; Y - алкоксигруппа с 1-3 атомами углерода, феноксигруппа, или группа формулы -R8NR9, где R8 означает атом водорода, неразветвленную или разветвленную алкильную группу с 1-8 атомами углерода, которая во 2-м, 3-м или 4-м положении может быть замещена гидроксигруппой или диалкиламиногруппой с 1-3 атомами углерода в каждой алкильной части, замещенную фенилом алкильную группу с 1-4 атомами углерода, которая может быть дополнительно замещена гидроксильной группой во 2-м, 3-м или 4-м положении, замещенную пиридилом алкильную группу с 1-4 атомами углерода, циклоалкильную группу с 3-6 атомами углерода, инданил, норборнил, алкоксигруппу с 1-3 атомами углерода или триметилсилилалкил с 1-3 атомами углерода в алкильной части, а R9 - атом водорода или алкильная группа с 1-3 атомами углерода, или R8 и R9 вместе с находящимся между ними атомом азота образуют 1-пиперидинил, незамещенный или замещенный одной или двумя метильными группами или фенилом, морфолиногруппу, 1-пиперазинил, незамещенный или замещенный в 4-м положении фенилом или 1,2,3,4-тетрагидроизохинолин-2-ил; R1 - атом водорода для алкил с 1-3 атомами углерода; R2 и R3 - атом водорода или вместе образуют углерод-углеродную связь; Pyr - пиридильная группа, R4 - аминокарбонил, алкиламинокарбонил и диалкиламинокарбонил, каждый с 1-3 атомами углерода в алкильных частях или карбоксил, если Y означает группу R8NR9, где R8 и R9 имеют вышеуказанное значение; R5 - атом водорода, алкил с 1-3 атомами углерода, алкоксил с 1-3 атомами углерода или трифторметил; n - 2, 3, 4, 5, их энантиомеры, цис- или трансизомеры, если R2 и R3 вместе означают углерод-углеродную связь, и их фармацевтически приемлемые соли;
18.05.92 - X - фенилкарбонил; Y - группа формулы -R8NR9, где R8 означает циклоалкильную группу с 7 или 8 атомами углерода, адамантил; R4 - тетразолил, сложно-эфирная группа, переводимая in vivo метаболическим путем в карбоксильную группу.
| Trombosis and Haemostasis, 1989, т | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
| Зубчатое колесо со сменным зубчатым ободом | 1922 |
|
SU43A1 |
Авторы
Даты
1998-10-10—Публикация
1992-12-14—Подача