Настоящее изобретение относится к новым биологически активным полиеновым соединениям и к применению этих соединений в фармацевтических композициях или в косметических композициях.
Соединения согласно изобретению обладают значительной активностью в области дифференцировкb и пролиферации клеток и, более конкретно, они могут найти применение при местном и системном лечении дерматологических расстройств, связанных с нарушением кератинизации, дерматологических или других заболеваний с воспалительной и/или иммуноаллергической компонентой, и дермической или эпидермической пролиферации, которые являются доброкачественными или злокачественными. Кроме того, эти соединения могут быть использованы для лечения болезней, вызывающих перерождение соединительной ткани, для борьбы со старением кожи, которое вызвано световым облучением или возрастом, и для лечения расстройств при рубцевании. Они также могут найти применение в области офтальмологии, например для лечения заболеваний роговицы. Кроме того, соединения согласно изобретению могут найти интересное применение при лечении остеопороза или при лечении вирусных заболеваний, а также для лечения любого состояния, ассоциированного с гипервитаминозом A. В общем, они могут найти применение для лечения любого заболевания, которое ассоциировано с модификацией экспрессии рецепторов, принадлежащих к суперсемейству рецепторов стероидных и тироидных гормонов.
Также можно использовать соединения согласно изобретению в косметических композициях для гигиены тела и капилляров.
Соединения согласно изобретению могут быть представлены общей формулой /I/
в которой:
R4 является радикалом - CH3, радикалом - CH2 - O -R9, радикалом - CH2-O-CO-R10 или радикалом - CO-R11 при этом радикалы R9, R10 и R11 имеют приведенные ниже значения,
R2 является атомом водорода или низшим алкильным радикалом,
R3 является атомом водорода или низшим алкильным радикалом,
R4 является атомом водорода,
R5 является атомом водорода или низшим алкильным радикалом,
R6 является атомом водорода, алкильным радикалом, линейным или разветвленным, имеющим 1 - 20 атомов углерода, радикалом -O-CH2-O-CH2-CH2-O-OCH3 или же радикалом -O-R13, где R13 имеет указанные ниже значения,
R7 и R8 независимо друг от друга являются:
а/ атомом водорода, б/ алкильным радикалом, линейным или разветвленным, имеющим 1 - 20 атомов углерода, в/ циклоалифатическим радикалом, г/ радикалом -O-CH2-O-CH2-CH2-O-CH3, д/ радикалом -O-R13 или же е/ радикалом -S/O/ R13, где R13 и имеют указанные ниже значения
при этом:
R4 и R6, взятые вместе, могут образовать с соседним бензольным циклом нафталиновый цикл,
по крайней мере один из радикалов R7 или R8 является радикалом /б/ или /в/,
R9 является атомом водорода или низшим алкильным радикалом,
R10 является низшим алкильным радикалом,
R11 является:
а/ атомом водорода,
б/ низшим алкильным радикалом,
в/ радикалом формулы 
в которой R' и R'' независимо друг от друга являются атомом водорода, низшим алкильным радикалом, моно- или полиоксиалкильным радикалом, арильным радикалом, возможно замещенным, или аминокислотным или пептидным остатком или остатком сахара, или взятые вместе образуют гетероцикл,
г/ радикалом -OR12, где R12 является атомом водорода, линейным или разветвленным алкильным радикалом, имеющим 1 - 20 атомов углерода, алкенильным радикалом, моно- или полиоксиалкильным радикалом, арильным или аралкильным радикалом, возможно замещенным, или остатками сахара, или остатком аминокислоты или пептида,
R13 является атомом водорода или алкильным радикалом, линейным или разветвленным, имеющим 1 - 20 атомов углерода,
и n является целым числом, равным 0, 1 или 2.
Изобретение также охватывает соли соединений формулы /I/ выше, в случае, когда R1 является функцией карбоновой кислоты или когда R7 и/или R8 являются сульфоновой функцией, а также оптические изомеры и геометрические изомеры указанных соединений. Когда соединения согласно изобретению находятся в виде солей, речь предпочтительно идет о солях щелочных или щелочноземельных металлов, или цинка или органического амина.
Согласно настоящему изобретению под низшим алкильным радикалом понимают радикал, содержащий 1 - 6 атомов углерода, предпочтительно метильный, этильный, изопропильный, бутильный, трет.бутильный и гексильный радикалы.
Под линейным или разветвленным алкильным радикалом, содержащим 1 - 20 атомов углерода, понимают, например метильный, этильный, пропильный, 2-этилгексильный, октильный, додецильный, гексадецильный и октадецильный радикалы.
Под циклоалифатическим радикалом понимают моно- или полициклический радикал, такой как, например, 1-метилциклогексильный или 1-адамантильный радикал.
Под монооксиалкильным радикалом понимают радикал, имеющий предпочтительно 2 или 3 атома углерода, например 2-оксиэтильный, 2-оксипропильный или 3-оксипропильный радикалы.
Под полиоксиалкильным радикалом понимают радикал, содержащий предпочтительно 3 - 6 атомов углерода и 2 - 5 гидроксильных групп, такой как 2,3-диоксипропильный, 2,3,4-триоксибутильный, 2,3,4,5-тетраоксипентильный радикалы или остаток пентаэритрита.
Под арильным радикалом понимают предпочтительно фенильный радикал, возможно замещенный по крайней мере одним атомом галоида, гидроксилом или нитрогруппой.
Под аралкильным радикалом понимают предпочтительно бензильный или фенетильный радикал, возможно замещенный по крайней мере одним атомом галоида, гидроксилом или нитрогруппой.
Под алкенильным радикалом понимают радикал, содержащий предпочтительно 2 - 5 атомов углерода и имеющий одну или несколько этиленовых ненасыщенностей, такой как аллильный радикал.
Под остатком сахара понимают остаток, происходящий, например, из глюкозы, галактозы или маннозы, или же глюкуроновой кислоты.
Под остатком аминокислоты понимают, например, остаток, происходящий из лизина, глицина или аспартамовой кислоты, а под остатком пептида более конкретно понимают остаток дипептида или трипептида, полученный в результате сочетания аминокислот.
Наконец, под гетероциклом понимают предпочтительно пиперидиновый, морфолиновый, пирролидиновый или пиперазиновый радикал, необязательно замещенный в положении 4 C1 - C6-алкильным радикалом или моно- или полиоксиалкильным радикалом, таким как определен выше.
Среди соединений указанной формулы /I/ можно, например, привести следующие:
транс-7-[3-(1-адамантил)-4-оксифенил] -3,7-диметил-2,4,6- гептатриеновая кислота,
этиловый эфир транс-7-[3-(1-адамантил)-4-метоксифенил] - 3,7-диметил-2,4,6-гептатриеновой кислоты,
транс-7-[3-(1-адамантил)-4-метоксифенил] -3,7-диметил- 2,4,6-гептатриеновая кислота,
/2Z,4E,6E/-7-[3-(1-адамантил)-4-метоксифенил]-3,7-диметил- 2,4,6-гептатриеновая кислота,
транс-5-[7-(1-адамантил)-6-метоксиэтоксиметокси-2-нафтил] - 3-метил-2,4-пентадиеновая кислота,
транс-5-[7-(1-адамантил)-6-окси-2-нафтил] -3-метил-2,4-пентадиеновая кислота,
транс-5-[7-(1-адамантил)-6-метокси-2-нафтил] -3-метил-2,4-пентадиеновая кислота,
транс-5-[7-(1-адамантил)-6-пропокси-2-нафтил] -3-метил-2,4-пентадиеновая кислота,
транс-7-[3-(1-метилциклогексил)-4-оксифенил] -3,7-диметил- 2,4,6-гептатриеновая кислота,
/2Z, 4E, 6E/-7-[3-(1-метилциклогексил)-4-оксифенил]-3,7-диметил- 2,4,6-гептатриеновая кислота,
транс-7-[3-(1-адамантил)-4-изопропилоксифенил] -3,7-диметил- 2,4,6-гептатриеновая кислота,
транс-7-[3-(1-адамантил)-4-метоксиэтоксиметоксифенил] -3,7-диметил- 2,4,6-гептатриеновая кислота,
транс-7-[3-(1-адамантил)-4-метоксифенил] -3,7-диметил- 2,4,6-гептатриеновая кислота,
транс-7-[3-(1-адамантил)-4-метоксифенил] -3,7-диметил- 2,4,6-гептатриен-1-ол,
транс-7-[3-(1-адамантил)-4-метоксифенил] -3,7-диметил- 2,4,6-гептатриен-1-аль,
транс-N-этил-7-[3-(1-адамантил)-4-метоксифенил] -3,7-диметил- 2,4,6-гептатриенкарбоксамид,
транс-N-этил-4-оксифенил-7-[3-(1-адамантил)-4-метоксифенил]- 3,7-диметил-2,4,6-гептатриенкарбоксамид,
транс-7-(3-трет. бутил-4-метоксиэтоксиметоксифенил)-3,7-диметил- 2,4,6-гептатриеновая кислота,
этиловый эфир транс-7-(3-трет.бутил-4-оксифенил)-3,7-диметил- 2,4,6-гептатриенкарбоновой кислоты,
этиловый эфир транс-7-(3-трет. бутил-4-метоксифенил)-3,7-диметил- 2,4,6-гептатриеновой кислоты,
этиловый эфир транс-7-[4-(1-адамантил)-3-метоксифенил)-3,7-диметил- 2,4,6-гептатриеновой кислоты.
Согласно настоящему изобретению особенно предпочтительными соединениями формулы (I) являются те, для которых выполняется по крайней мере одно, а предпочтительно все условия, приведенные ниже:
R1 является радикалом -CO-R11,
R7 является адамантильным радикалом,
R4 является атомом водорода,
R6 является атомом водорода или алкильным радикалом, линейным или разветвленным, имеющим 1-20 атомов углерода,
R4 и R6 образуют вместе соседним бензольным циклом нафталиновый цикл.
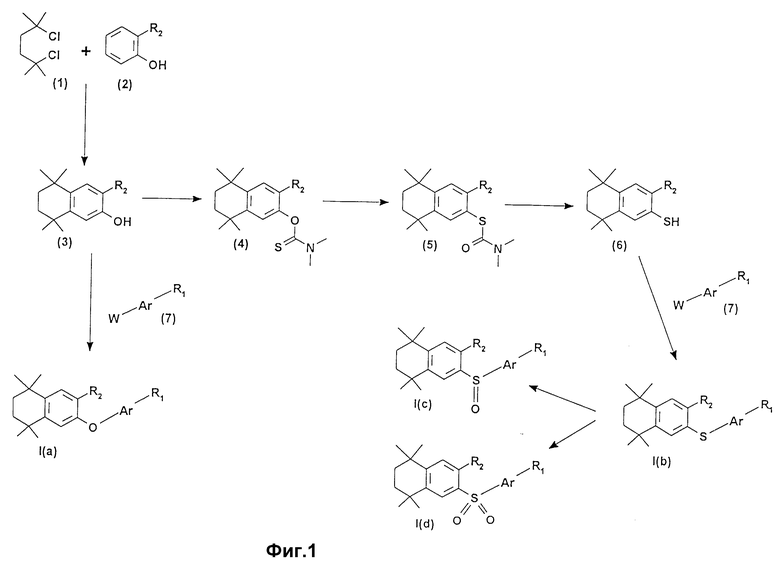
Объектом настоящего изобретения также являются способы получения соединений формулы /I/, осуществляемые, в частности, согласно реакционным схемам, приведенным на фиг. 1 и 2.
Так, соединения формулы /Ia/ могут быть получены, например, двумя путями /см. фиг. 1/:
- либо согласно синтезу, описанному M.Julia et D.Arnould в Bull. Soc. Chim. /1973/, 746. Так, при взаимодействии между производным ацетофенона /1/ и винилмагнийбромидом получают α-оксивинильное соединение /2/, которое затем вводят в реакцию с фенилсульфинатом натрия, чтобы получить соединение /3/. Анион производного /3/, образующийся в присутствии основания, например третбутилата калия, вводят в реакцию с этиловым эфиром γ- бромкротоновой кислоты, чтобы получить сложный сульфоновый эфир /4/. Удаление сульфоновой группы осуществляются в присутствии основания, например трет.бутоксида калия или ДВИ, а после омыления сложноэфирной функции в спиртовом растворе гидроксида натрия или калия получают кислоту /Ia/;
- либо при взаимодействии ацетофенона /1/ по реакции типа Хорнера с C2-фосфононитрилом, чтобы получить производное пропеннитрила /5/. После частичного восстановления диизобутилалюминийгидридом /DIBAH/ получают производное пропеналя /6/. Обработка этого альдегида литиевым производным сложного фосфонатного эфира приводит к образованию сложного эфира /7/, который при омылении в спиртовом растворе гидроксида натрия или калия дает кислоту /Ia/.
Соединения формулы /Ib/ и /Ic/ могут быть получены следующим образом /см. фиг. 2/:
- либо из альдегида /1/ путем его восстановления гидридом щелочного металла, таким как боргидриднатрия или двойной гидрид лития и алюминия. Полученный таким образом спирт /2/ затем превращают в фосфониевую соль /3/ при взаимодействии с (C6H5)3P•HBr в метаноле, это соединение /3/ затем превращают в сложный эфир формулы I/b/ при действии литиевого или натриевого производного фосфонатного сложного эфира;
- либо из альдегида /1/ по одной из двух реакций типа Хорнера. Сначала проводят реакцию соединения /I/ с диметтил-2-оксопропилфософнатом в присутствии ДВИ в ТГФ, чтобы получить кетон /4/, потом превращают этот последний в сложноэфирное производное I/b/ при взаимодействии с литиевым или натриевым производным фосфонатного сложного эфира. При омылении сложного эфира I/b/ в присутствии спиртового раствора гидроксида натрия или калия получают кислоту I/c/.
Когда R6, R7 и R8 являются гидроксильным радикалом, соединения формулы /I/ целесообразно получать, защитив фенольную функцию, предпочтительно в форме трет. бутилдиметилсилилокси или метоксиэтоксиметокси, снятие защиты затем проводят или в присутствии тетрабутиламмонийфторида, или триметилсилилиодида, или в кислой среде /HCl/.
Новые соединения обладают антагонистической активностью по отношению к экспрессии одного или нескольких биологических маркеров в тесте дифференциации клеток /F9/ эмбриональной тератокарциномы мыши /Skin.Pharmacol., 3, стр. 256-267, 1990/ и/или дифференциации человеческих кератиноцитов in vitro /Anal. Biochem. , 192, стр. 232-235, 1991/. Кроме того, они также могут обладать специфической агонистической активностью по отношению к некоторым рецепторам и антагонистической по отношению к другим.
Соединения согласно изобретению могут быть особенно полезными, например, в следующих областях:
1/ при лечении дерматологических заболеваний, связанных с нарушением кератинизации, вызывающим дифференцировку и пролиферацию, например при лечении обыкновенных угрей, черных угрей, полиморфных, красных угрей, узелковокистозных акне, конглобата, старческих акне, вторичных акне, таких как солнечная акне, медикаментозная или профессиональная акне,
2/ для лечения других типов нарушений кератинизации, например ихтиозов, ихтиозоподобных состояний, болезни Даррье, кератодермии пальцев подошвы, лейкоплазий и лейкоплазиеподобных состояний, лишая кожи или слизистой /во рту/,
3/ для лечения других дерматологических заболеваний, связанных с нарушением кератинизации с воспалительной и/или иммуноаллергической компонентой, например любых форм псориаза, таких как кожный, слизистый или ногтевой псориаз и даже псориазного ревматизма, или кожной атопии, такой как экзема, или респираторной атопии, или гипертрофии десен; соединения также могут быть использованы при некоторых воспалительных заболеваниях, не представляющих собой нарушений кератинизации,
4/ для лечения любых дермических или эпидермических пролифераций, доброкачественных или злокачественных, которые могут иметь вирусное происхождение, таких как обычные бородавки, плоские юношеские бородавки и бородавчатоподобная эпидермодисплазия, оральные флоридные папилломатозы, и пролифераций, которые могут быть вызваны ультрафиолетовым облучением, например в случае базально-клеточных и спиноклеточных эпителиом;
5/ для лечения других дерматологических нарушений, таких как буллезные дерматозы и коллагеноз,
6/ для лечения некоторых офтальмологических расстройств, например заболеваний роговицы,
7/ для восстановления или борьбы со старением кожи, которое является возрастным или фотоинициированным, или для уменьшения пигментации и актинических кератозов или любых патологий, ассоциированных с возрастным или актиничным старением,
8/ для предупреждения или излечивания стигматов эпидермической и/или дермической атрофии, вызванной локальными или системными кортикостероидами, или любой другой формы кожной атрофии,
9/ для предотвращения или лечения нарушений заживления или для профилактики или для восстановления рубцов на коже,
10/ для борьбы с нарушением жировой функции, такими как гиперсеборрейная акне или простая себоррея,
11/ для лечения или профилактики раковых или предраковых состояний,
12/ для лечения воспалительных заболеваний, таких как артрит,
13/ для лечения любого заболевания вирусного происхождения кожного или общего;
14/ для профилактики или лечения выпадения волос,
15/ для лечение дерматологических или общих заболеваний с иммунологической компонентной,
16/ для лечение заболеваний сердечнососудистой системы, таких как атеросклероз,
17/ для лечения или профилактики остеопороза.
В упомянутых выше областях терапии соединения согласно изобретению могут быть применены в сочетании с другими активными соединениями, например с витаминами D или их производными, с кортикостероидами, со средствами против свободных радикалов, α-окси - или α-кетокислотами или их производными или с блокаторами ионных каналов. Под витамином D имеют в виду, например, производные витамина D2 или D3, в частности 1,25-диоксивитамин D3. Под средствами против свободных радикалов имеют в виду, например, α-токоферол, Супер Оксид Дисмутазу, Убихинол или некоторые хелаты металлов. Под α-окси- или α-кетокислотами или их производными имеют в виду, например, молочную, яблочную, лимонную, гликолевую, миндальную, винную, глицериновую или аскорбиновую кислоты или их соли, амиды или сложные эфиры. Наконец, под блокаторами ионных каналов имеют в виду, например, Миноксидил /2,4-диамино-6-пиперидинопиримидин-3-оксид/ и его производные.
Объектом настоящего изобретения также являются фармакологические композиции, содержание по крайней мере одно соединение формулы /I/, выше или один из его оптических или геометрических изомеров или одну из его солей, и фармацевтические добавки.
Введение соединений согласно изобретению может быть осуществлено энтеральным, парентеральным, топическим путем или через глаза.
При энтеральном пути лекарства могут находиться в виде таблеток, капсул, драже, сиропов, суспензий, растворов, порошков, гранул, эмульсий, микросфер или наносфер, или липидных или полимерных пузырьков, позволяющих контролированное выделение. При парентеральном пути композиции могут находиться в виде растворов или суспензий для перфузии или для инъекции.
Соединения согласно изобретению обычно вводят дневной дозой от примерно 0,01 мг/кг до 100 мг/кг массы тела за 1-3 приема.
При топическом пути фармацевтические композиции на основе соединений согласно изобретению более конкретно предназначены для лечения кожи и слизистых оболочек и тогда могут находиться в виде мазей, кремов, молочка, помады, порошков, впитывающих тампонов, растворов, гелей, спреев, лосьонов и суспензий. Они могут находиться в виде микросфер или наносфер, или липидных или полимерных пузырьков, или полимерных пластырей и гидрогелей, обеспечивающих дозируемое выделение активного начала. Композиции для местного нанесения, кроме того, могут находиться в безводной форме или в водной форме в зависимости от клинических показаний. При введении через глаза они главным образом представляют собой глазные капли.
Эти композиции для топического введения или для введения через глаза содержат по крайней мере одно соединение формулы /I/, такое, как определено выше, или один из его оптических или геометрических изомеров, или одну из его солей, при концентрации, предпочтительно лежащей между 0,001% и 5% масс. по отношению к общей массе композиции.
Соединения формулы /I/ согласно изобретению могут находить применение также и в области косметики, в частности для гигиены тела и обработки волос, например для обработки кожи, имеющей тенденцию к акне, для нового роста волос, против выпадения волос, для борьбы с жирным видом кожи или волос, для защиты против вредного воздействия солнца или для обработки физиологически сухой кожи, для предотвращения и/или для борьбы с вызванным облучением или возрастом старением.
В области косметики композиции согласно изобретению кроме того, могут быть применены в сочетании с другими соединениями, обладающими активностью ретиноидного типа, с витаминами D и их производными, с кортикостероидами, со средствами против свободных радикалов, с α-окси- и или α-кетокислотами или их производными или с блокаторами ионных каналов, при этом эти различные продукты определены выше.
Следовательно настоящее изобретение касается косметической композиции, которая отличается тем, что она содержит в косметически приемлемом для топического нанесения косметическом носителе по крайней мере одно соединение общей формулы /I/ или один из его оптических или геометрических изомеров, или одну из его солей, причем эта косметическая композиция может находиться, например, в виде крема, молочка, лосьона, геля, микросфер или наносфер, или липидных или полимерных пузырьков, мыла или шампуня.
Концентрация соединения формулы /I/ в косметических композициях согласно изобретению обычно находится между 0,001% и 3% масс. по отношению к массе всей композиции.
Фармацевтические и косметические композиции согласно изобретению могут, кроме того, содержать инертные добавки или фармакодинамически или косметически активные добавки или смесь этих добавок, например: смачивающие агенты, депигментирующие агенты, такие как гидрохинон, азелаиновая кислота, кофейная кислота или койевая кислота.
Смягчающие агенты: гидратирующие агенты, такие как глицерин, ПЭГ 400, тиаморфолинон и его производные, или мочевину; противосеборрейные или противоакневые агенты, такие как s-карбоксиметилцистеин, s-бензилцистеамин, их соли или их производные, или пероксид бензоила; антибиотики, например эритромицин и его сложные эфиры, неомицин, клиндамицин и его сложные эфиры, тетрациклины; противогрибковые агенты, такие как кетоконазол или полиметилен-4,5-изотиазолидоны-3; агенты, благоприятствующие новому росту волос, например Миноксидил /2,4-диамино-6-пиперидинопиримидин-3-оксид/ и его производные, Диазоксид /7-хлор-3-метил-1,2,4-бензотиадиазин-1,1-диоксид/ и Фенитоин /5,5-дифенилмидазолин-2,4-дион/; нестероидные противовоспалительные агенты; каротиноиды, например β-каротин; противопсориазные агенты, такие как антралин и его производные, и наконец, эйкоза-5,8,11,14-тетраиновая и эйкоза-5,8,11-трииновая кислоты, их сложные эфиры и амиды.
Композиции согласно изобретению также могут содержать агенты, улучшающие вкус, консерванты, такие как сложные эфиры параоксибензойной кислоты, стабилизаторы, агенты, регулирующие влажность, агенты, регулирующие pH, модификаторы осмотического давления, эмульгаторы, УФ-А и УФ-В фильтры, антиоксиданты, такие как α- токоферол, бутилоксианизол или бутилокситолуол.
Ниже приведены примеры, не имеющие ограничительного характера, получения активных соединений формулы /I/ согласно изобретению, а также конкретные различные рецептуры на основе таких соединений.
Пример 1.
Транс-7-[3-(1-адамантил)-4-оксифенил] -3,7-диметил- 2,4,6-гептатриеновая кислота.
а/ 2-[3-(1-адамантил)-4-трет.бутилдиметилсилилоксифенил]-3-бутен-2-ол.
В трехгорлую колбу вводят 385 г (1 ммоль) 2-(1-адамантил)-4-трет.-бутиодиметилсилилоксиацетофенона и 20 мл ТГФ, потом по каплям прибавляют 1,1 мл /1,1 ммоля/ раствора винилмагнийбромида /1M/ таким образом, чтобы температура реакционной среды не превышала 20oC. Потом перемешивают при комнатной температуре в течение часа, выливают реакционную смесь в смесь льда и воды, экстрагируют этиловым эфиром, декантируют органическую фазу, сушат над сульфатом магния, выпаривают. Полученный остаток очищают хроматографией на колонке с оксидом кремния, элюируя смесью этилового эфира и гексана /15-85/. При этом собирают 380 мг /выход 92%/ целевого спирта в виде масла.
б/ 3-[3-(1-адамантил)-4-трет. бутилдиметилсилилоксифенил] -2-бутенсульфонилбензол.
В колбу загружают 5,9 г /35,8 ммоля/ бензолсульфината натрия, 8 мл воды и 12 мл уксусной кислоты. Нагревают до 60oC, затем прибавляют в течение 15 минут 7,37 г /17,8 ммоля/ спиртового производного, полученного выше, и выдерживают при этой температуре в течение 4 часов. Полученную таким образом реакционную смесь затем выливают в воду, экстрагируют гексаном, декантируют органическую фазу, промывают водой, сушат над сульфатом магния и выпаривают. Полученный остаток очищают хроматографией на колонке с оксидом кремния, элюируя смесью этилацетата и гексана /10-90/. После выпаривания растворителей получают 3,1 г /выход 32%/ целевого продукта.
в/ Этиловый эфир транс-7-[3-(1-адамантил)-4-трет.бутилдиметилсилилоксифенил] -5-бензолсульфонил-3,7-диметил-2,6-гептадиеновой кислоты.
В колбу загружают 765 мг /6,8 ммоля/ трет.бутилата калия и 5 мл раствора, состоящего из смеси ТГФ и N-метилпирролидина /5-1/. Смесь охлаждают до -65oC, затем прибавляют к полученной смеси последовательно по каплям сначала первый раствор, состоящий из 3 г /5,68 ммоля/ производного, полученного в пункте б/, растворенного в 2,5 мл смеси /ТГФ/ N-метилпирролидин/, идентичной приведенной выше, потом второй раствор, состоящей из 1,3 г /6,25 ммоля/ этилового эфира γ-бромкротоновой кислоты, растворенных в 1 мл ТГФ, и перемешивают все в течение 1 часа при -65oC.
Затем прибавляют 25 мл этилового эфира, дают нагреться до 0oC, прибавляют 35 мл воды и экстрагируют этиловым эфиром. Декантируют органическую фазу, сушат над сульфатом магния, затем выпаривают. Полученный остаток очищают хроматографией на колонке с оксидом кремния, элюируя смесью этилацетата и гексана /15-85/. После выпаривания получают 4 г /выход 100%/ целевого сложного эфира в виде бесцветного масла.
г/ Этиловый эфир транс-7-[3-(1-адамантил)-4-оксифенил] -3,7-диметил-2,4,6-гептатриеновой кислоты.
В колбу в токе азота вводят 4 г /6,25 ммоля/ сложного эфира, полученного ранее в пункте в/, и 40 мл ТГФ, охлаждают все до -30oC и прибавляют 700 мг /6,25 ммоля/ трет.бутилата калия. Перемешивают при этой температуре в течение часа, дают нагреться до комнатной температуры, нейтрализуют реакционную среду и экстрагируют этиловым эфиром. Декантируют органическую фазу, сушат над сульфатом магния, выпаривают. Полученный остаток очищают хроматографией на колонке с оксидом кремния, элюируя смесью этилацетата и гексана /20-80/. Собирают после выпаривания растворителей 863 мг /выход 34%/ этилового эфира 7-[3-(1-адамантил)-4-оксифенил] -3,7-диметил-2,4,6-гептатриеновой кислоты в виде масла.
д/ Транс-7-[3-(1-адамантил)-4-оксифенил] -3,7-диметил-2, 4, 6-гептатриеновая кислота.
В защищенную от света колбу в токе азота вводят 813 мг /2 ммоля/ сложного эфира, полученного в пункте г/ ранее, и 50 мл метанола. Прибавляют по каплям 2,5 мл /10 ммолей/ 4 н. раствора гидроксида натрия и кипятят с обратным холодильником 2 часа. После охлаждения прибавляют этилацетат, подкисляют 4 н. соляной кислотой, декантируют органическую фазу, промывают водой, сушат над сульфатом магния и выпаривают. Полученный остаток очищают хроматографией на колонке с оксидом кремния, элюируя смесью ТГФ и гексана /30-70/. После выпаривания растворителей собирают 400 мг /выход 53%/ транс-7-[3-(1-адамантил)-4-оксифенил] -3,7-диметил-2,4,6-гептатриеновой кислоты, т.пл.210oC с разложением.
Пример 2.
Этиловый эфир транс-7-[3-(1-адамантил)-4-метоксифенил] -3,7-диметил-2,4,6-гептатриеновой кислоты
В колбу в токе азота вводят 813 мг /2 ммоля/ сложного эфира, полученного в примере 1 /г/, и 30 мл ТГФ. Прибавляют малыми порциями 60 мг /2 ммоля/ гидрида натрия /80% в масле/ и перемешивают до прекращения выделения газов. Затем прибавляют 125 мкл /2 ммоля/ метилиодида и перемешивают при комнатной температуре 3 часа. Выливают реакционную среду в воду, экстрагируют этиловым эфиром, декантируют органическую фазу, сушат над сульфатом магния и выпаривают. Полученный остаток очищают хроматографией на колонке с оксидом кремния, элюируя смесью дихлорметана и гексана /50-50/. Получают 714 мг /выход 85%/ целевого сложного эфира в виде масла.
Пример 3.
Транс-7-[3-(1-адамантил)-4-метоксифенил/-3,7-диметил-2,4,6-гептатриеновая кислота.
а/ 2-[3-(1-адамантил)-4-метоксифенил]-3-бутен-2-ол.
Работают по методике примера 1/а/, исходя из 12,7 г /44,6 ммоля/ 3-(1-адамантил)-4-метоксиацетофенона, и после хроматографии на колонке с оксидом кремния, элюируя смесью этилацетата и гексана /10-90/, получают 7,6 г /выход 54%/ целевого спирта в виде желтого масла.
б/ 3-[3-(1-адамантил)-4-метоксифенил]-2- бутенсульфонилбензол.
Работают по методике примера 1/б/, исходя из 7,6 г /24,2 ммоля/ спирта, полученного в пункте /а/ выше, и после хроматографии на колонке с оксидом кремния, элюируя смесью этилацетата и гексана /15-85/, получают 5,2 г /выход 49%/ целевого продукта.
в/ Этиловый эфир транс-7-[3-(1-адамантил)-4-метоксифенил] -5- бензолсульфонил-3,7-диметил- 2,6-гептадиеновой кислоты.
Работают по методике примера 1/в/, исходя из 5,18 г /11,9 ммоля/ 3-[3-(1-адамантил)-4-метоксифенил] -2-бутенсульфонилбензола, полученного в пункте /б/ выше, и после хроматографии на колонке с оксидом кремния, элюируя смесью этилацетата и гексана /20-80/, получают 5 г /75%/ целевого сложного эфира.
г/ Транс-7-[3-(1-адамантил)-4-метоксифенил] -3,7-диметил-2,4,6- гептатриеновая кислота.
В колбу, защищенную от света, в токе азота вводят 4,6 г /8,2 ммоля/ сложного эфира, полученного в пункте /в/ ранее, и 50 мл метанола. Потом прибавляют по каплям 23 мл /98 ммолей/ 4 н. метанольного раствора гидроксида калия и кипятят с обратным холодильником в течение 2 ч. После охлаждения прибавляют этиловый эфир и воду, подкисляют 4 н. серной кислотой, декантируют органическую фазу, промывают водой, сушат над сульфатом магния и выпаривают. Полученный остаток очищают хроматографией на колонке с оксидом кремния, элюируя смесью этилацетата и дихлорметана /15-85/. После выпаривания растворителей собирают 2,3 г /выход 72%/ транс-7-[3-(1-адамантил)-4-метоксифенил] -3,7-диметил-2,4,6- гептатриеновой кислоты, т.пл. 212oC с разложением.
Пример 4.
/2Z, 4E, 6E/-7-[3-(1-адамантил)-4-метоксифенил]-3,7-диметил-2,4,6- гептатриеновая кислота.
Согласно реакции примера 3/г/ при хроматографии на колонке с оксидом кремния, элюируя смесью этилацетата и дихлорметана /15-85/, получают 310 мг /выход 9%/ /2Z, 4E, 6E/-7-[3-(1-адамантил)-4-метоксифенил]-3,7-диметил-2,4,6-гептатриеновой кислоты с т.пл. 207oC с разложением.
Пример 5.
Транс-5-[7-(1-адамантил)-6-метоксиэтоксиметокси-2-нафтил] -3-метил-2,4- пентадиеновая кислота.
а/ 7-(1-адамантил)-6-окси-2-бромнафталин.
В колбу загружают 22,3 г /0,1 моля/ 6-бром-2-нафтола, 15,2 г /0,1 моля/ 1-адамантола и 100 мл дихлорметана. Прибавляют 5,5 мл концентрированной соляной кислоты и перемешивают при комнатной температуре в течение 12 часов. Выпаривают досуха, обрабатывают водой и нейтрализуют бикарбонатом натрия. Экстрагируют этилацетатом, декатируют органическую фазу, сушат над сульфатом магния, выпаривают. Полученный остаток тщательно растирают в смеси дихлорметана и гептана /30-70/, фильтруют и сушат. Получают 19 г /53%/ целевого продукта с т.пл. 215-216oC.
б/ 7-/1-адамантил/-6-метоксиэтоксиметокси-2-бромнафталин.
В трехгорлую колбу в токе азота вводят 17,85 г /50 ммолей/ 7-(1-адамантил)-6-окси-2-бромнафталина и 200 мл ДМФ. Загружают малыми порциями 1,8 г /60 ммолей/ гидрида натрия /80% в масле/ и перемешивают при комнатной температуре до прекращения выделения газов. Охлаждают до 5oC и вводят по каплям 6,9 мл /60 молей/ метоксиэтоксихлорида и перемешивают 2 часа. Реакционную среду выливают в ледяную воду, экстрагируют этиловым эфиром, декантируют органическую фазу, сушат над сульфатом магния, выпаривают. Полученный остаток очищают хроматографией на колонке с оксидом кремния, элюируя смесью дихлорметана и гептана /40-60/. После выпаривания растворителей собирают 19,5 г /87%/ целевого продукта с т.пл. 99-100oC.
в/ 7-/1-адамантил/-6-метоксиэтоксиметокси-2-нафталин-карбоксальдегид.
В трехгорлую колбу в токе азота вводят 15 г /33,7 ммоля/ 7-(1-адамантил)-6-метоксиэтоксиметокси-2-бромнафталина и 150 мл ТГФ. Прибавляют при -78oC по каплям раствор 14,9 мл н-бутиллития /2,5 М в гексане/ и перемешивают 1 час. При этой же температуре прибавляют 3,1 мл /40,4 ммоля/ ДМФ и дают нагреться до комнатной температуры. Реакционную смесь выливают в насыщенный водный раствор хлорида аммония, экстрагируют этиловым эфиром, декантируют органическую фазу, сушат над сульфатом магния, выпаривают. Полученный остаток очищают хроматографией на колонке с оксидом кремния, элюируя смесью этилацетата и гептана /1-4/. После выпаривания растворителей получают 7,7 г /57%/ целевого альдегидного производного с т.пл. 115-116oC.
г/ этиловый эфир транс-5-[7-(1-адамантил)-6-метоксиэтоксиметокси-2-нафтил]-3-метил-2,4- пентадиеновой кислоты.
В трехгорлую колбу в токе азота загружают 3,1 мл /22,2 ммоля/ диизопропиламина, 40 мл ГМФА и 60 мл ТГФ. При 0oC загружают по каплям 8,9 мл н-бутиллития /2,5 М в гексане/ и перемешивают 30 минут. При -60oC прибавляют по каплям раствор 6,3 мл /20,7 ммоля/ триэтил-3-метил-4-фосфонокротоната в 50 мл ТГФ, перемешивают 1 час, потом прибавляют по каплям раствор 6 г /14,8 ммоля/ 7-(1-адамантил)-6-метоксиэтоксиметокси-2-нафталинкарбоксиальдегида, растворенного в 30 мл ТГФ, и дают нагреться до комнатной температуры. Реакционную смесь выливают в насыщенный раствор хлорида аммония, экстрагируют этиловым эфиром, декантируют органическую фазу, сушат над сульфатом магния, выпаривают. Полученный остаток очищают хроматографией на колонке с оксидом кремния, элюируя смесью этилацетата и гептана /1-9/. После выпаривания растворителей получают 6 г /85%/ целевого этилового эфира в виде желтого масла.
д/ Транс-5-[7-(1-адамантил)-6-метоксиэтоксиметокси-2-нафтил] -3-метил- 2,4-пентадиеновая кислота.
Работают по методике примера 1/д/, исходя из 1,2 г /2,5 ммолей/ полученного ранее этилового сложного эфира, получают 350 мг /35%/ транс-5-[7-(1-адамантил)-6-метоксиэтоксиметокси-2-нафтил] -3-метил- 2,4-пентадиеновой кислоты с т.пл. 195-196oC.
Пример 6.
Транс-5-[7-(1-адамантил)-6-окси-2-нафтил] -3-метил-2,4- пентадиеновая кислота.
а/ этиловый эфир транс-5-[7-(1-адамантил)-6-окси-2-нафтил] -3-метил-2,4-пентадиеновой кислоты.
В трехгорлую колбу в токе азота загружают 5,6 г /11,8 ммоля/ этилового эфира транс-5-[7-(1-адамантил)-6-метоксиэтоксиметокси-2-нафтил] -3-метил- 2,4-пентадиеновой кислоты и 60 мл дихлорметана. При -70oC прибавляют по каплям 13 мл трихлорида бора /1M в дихлорметане/ и дают нагреться до комнатной температуры. Реакционную смесь выливают в ледяную воду, экстрагируют этиловым эфиром, декантируют органическую фазу, сушат над сульфатом магния, выпаривают. Полученный остаток очищают хроматографией на колонке с оксидом кремния, элюируя смесью этилацетата и гептата /1-4/. После выпаривания растворителей получают 1,4 г /85%/ целевого этилового эфира с т.пл. 212-214oC.
б/ Транс-5-[7-(1-адамантил)-6-окси-2-нафтил]-3-метил-2,4- пентадиеновая кислота.
Работают по методике примера 1/д/, исходя из 1,3 г /3,1 ммоля/ этилового эфира, полученного ранее, получают 320 мг /25%/ транс-5-[7-(1-адамантил)-6-окси-2-нафтил]-3-метил-2,4-пентадиеновой кислоты с т.пл. 240-245oC.
Пример 7.
Транс-5-[7-(1-адамантил)-6- метокси-2-нафтил] - 3-метил-2,4- пентадиеновая кислота.
а/ Этиловый эфир транс-5-[7-(1-адамантил)-6-метокси-2-нафтил]-3-метил-2,4- пентадиеновой кислоты.
Работают по методике примера 2 при взаимодействии 1,4 г /3,3 ммоля/ этилового эфира транс-5-[7-(1-адамантил)-6-окси-2-нафтил] -3-метил-2,4-пентадиеновой кислоты с 260 мкл /4 ммолями/ метилиодида, получают 330 мг /80%/ целевого сложного эфира.
б/ Транс-5-[7-(1-адамантил)-6-метокси-2-нафтил] -3-метил-2,4- пентадиеновая кислота.
Работают по методике примера 1/д/, исходя из 1,1 г /2,7 ммоля/ полученного ранее сложного этилового эфира, получают 478 мг /43%/ транс-5-[7-(1-адамантил)-6-метокси-2-нафтил] -3-метил-2,4- пентадиеновой кислоты с т.пл. 290-291oC.
Пример 8.
Транс-5-[7-(1-адамантил)-6-пропилокси-2-нафтил] -3-метил-2,4- пентадиеновая кислота.
а/ Этиловый эфир транс-5-[7-(1-адамантил)-6-пропилокси-2-нафтил]-3-метил-2,4- пентадиеновой кислоты.
Работают по методике примера 2, проводят взаимодействие 1,4 г /3,3 ммоля/ этилового эфира транс-5-[7-(1-адамантил)-6-окси-2-нафтил]-3-метил-2,4-пентадиеновой кислоты с 400 мкл /4 ммолями/ 3-иодпропана, получают 1,12 мг /75%/ целевого сложного этилового эфира с т.пл. 133-134oC.
б/ Транс-5-[7-(1-адамантил)-6-пропилокси-2-нафтил] -3-метил-2,4- пентадиеновая кислота.
Работают по методике примера 1/д/, исходя из 1,1 г /2,4 ммоля/ полученного ранее сложного этилового эфира, получают 770 мг /80%/ транс-5-[7-(1-адамантил)-6-пропилокси-2-нафтил]-3-метил-2,4- пентадиеновой кислоты с т. пл. 240-241oC.
Пример 9.
Транс-5-[7-(1-метилциклогексил)-4-оксифенил] -3,7-диметил-2,4,6- гептатриеновая кислота.
а/ 3-(1-метилциклогексил)-4-метоксифенилэтанола.
В трехгорлую колбу в токе азота вводят 4,36 г /1,85 ммоля/ 3-(1-метилциклогексил)-4-метоксибензойной кислоты и 50 мл ТГФ. При -30oC прибавляют по каплям 29 мл /4,6 ммоля/ метиллития /1,6 М в этиловом эфире/ и дают нагреться до комнатной температуры. Реакционную среду выливают в ледяную воду, экстрагируют этилацетатом, декантируют органическую фазу, сушат над сульфатом магния, выпаривают. Получают 4,6 г /99%/ целевого кетонового производного в виде бесцветного масла.
б/ 3-Метил-3-[3-(1-метилциклогексил)-4-метоксифенил]- акрилонитрил.
Растворяют 4,5 г /18,3 ммоля/ 3-(1-метилциклогексил)-4-метоксифенилэтанона в 50 мл ТГФ и прибавляют последовательно 3,2 г /27 ммолей/ диэтилцианометилфосфоната, 2,4 г измельченного гидроксида калия. Перемешивают 4 часа при комнатной температуре. Реакционную смесь выливают в ледяную воду, экстрагируют этилацетатом, декантируют органическую фазу, сушат над сульфатом магния, выпаривают. Полученный остаток очищают хроматографией на колонке с оксидом кремния, элюируя смесью дихлорметана и гептана /50-50/. Получают 2,86 г /58%/ целевого нитрила.
в/ 3-[3-(1-метилциклогексил)-4-метоксифенил]-кротональдегид.
Растворяют 2,8 г /10,4 ммоля/ полученного ранее нитрила в 50 мл безводного толуола и при -70oC прибавляют по каплям 13 мл /13 ммолей/ раствора диизобутилалюминийгидрида /1М в толуоле/. Дают нагреться до 0oC и перемешивают 30 минут. Медленно прибавляют разбавленную соляную кислоту, затем фильтруют на целите. Фильтрат промывают водой, сушат над сульфатом магния, выпаривают. Полученный остаток очищают хроматографией на колонке с оксидом кремния, элюируя смесью дихлорметана и гептана /70-30/. Получают 2,34 г /83%/ целевого альдегида.
г/ Этиловый эфир транс-7- [3-(1-метилциклогексил)-4-оксифенил]-3,7-диметил-2,4,6- гептатриеновой кислоты.
Работают по методике примера 5 /г/, проводят взаимодействие 2,3 г /8,6 ммоля/ 3-[3-(1-метилциклогексил)-4-метоксифенил] -кротональдегида с 4,4 мл /12,8 ммоля/ триэтил-3-метил-4-фосфоно-2-бутеноата, получают 2,13 г (65%) целевого этилового эфира в виде желтого масла.
д/ Транс-7-[3-(1-метилциклогексил)-4-оксифенил] -3,7-диметил-2,4,6- гептатриеновая кислота.
Работают по методике примера 1 /д/, исходя из 2,13 г /5,5 ммоля/ полученного выше этилового сложного эфира, получают после хроматографии на колонке с оксидом кремния, элюируя дихлорметаном, 540 мг /27%/ транс-7-[3-(1-метилциклогексил)-4-оксифенил] -3,7-диметил-2,4,6- гептатриеновой кислоты с т.пл. 175-177oC.
Пример 10.
/2Z, 4E, 6E/-7-[3-(1-метилциклогексил)-4-метоксифенил] -3,7- диметил-2,4,6-гептатриеновая кислота.
Согласно реакции примера 9 /д/ при хроматографии на колонке с оксидом кремния, элюируя дихлорметаном, получают также 100 мг /5%/ /2Z,4E,6E/-7-[3-(1-метилциклогексил)-4-метоксифенил] -3,7- диметил-2,4,6-гептатриеновой кислоты с т.пл. 165-167oC.
Пример 11.
Транс-7-[3-(1-адамантил)-4-изопропилоксифенил] -3,7-диметил- 2,4,6-гептатриеновая кислота.
а/ 3-(1-адамантил)-4-изопропилоксифенилэтанон.
Работают по методике примера 9 /а/, проводят взаимодействие 5 г /16 ммолей/ 3-(1-адамантил)-4-изопропилоксибензойной кислоты с 25 мл /44 ммолями/ метиллития /1,6 М/, получают 4,9 г /98%/ целевого кетонового производного с т.пл. 101-102oC.
б/ 3-метил-3-[3-(1-адамантил)-4-изопропилоксифенил]акрилонитрил.
Работают по методике примера 9 /б/, проводят взаимодействие 3,6 г /11,5 ммоля/ полученного выше кетона с 2,03 г /17,3 ммоля/ диэтилцианометилфосфоната, получают 2,07 г /54%/ целевого нитрила.
в/ 3-метил-3-[3-(1-адамантил)-4-изопропилоксифенил] кротональдегид.
Работают по методике примера 9 /в/, исходя из 3,1 г /9,2 ммоля/ полученного выше нитрила, получают 2,28 г /73%/ целевого альдегида.
г/ этиловый эфир транс-7-[3-(1-адамантил)-4-изопропилоксифенил]-3,7-диметил-2,4,6- гептатриеновой кислоты.
Работают по методике примера 5 /г/, проводят взаимодействие 1,67 г /4 ммолей/ 3-[3-(1-адамантил)-4-изопропилоксифенил] -кротональдегида с 1,92 мл (6 ммолями) триэтил-3-метил-4-фосфоно-2-бутеноата, получают 1 г /57%/ целевого этилового эфира в виде желтого масла.
д/ Транс-7-[3-(1-адамантил)-4-изопропилоксифенил] -3,7-диметил- 2,4,6-гептатриеновая кислота.
Работают по методике примера 1/д/; исходя из 1,7 г /3,7 ммоля/ полученного выше этилового эфира, получают после хроматографии на колонке с оксидом кремния, элюируя дихлорметаном, 800 мг /50%/ транс-7-[3-(1-адамантил)-4-изопропилоксифенил] -3,7-диметил-2,4,6- гептатриеновой кислоты с т.пл. 209-210oC.
Пример 12.
Транс-7-[3-(1-адамантил)-4-метоксиэтоксиметоксифенил] -3,7- диметил-2,4,6-гептатриеновая кислота.
а/ 3-(1-адамантил)-4-метоксиэтоксиметоксифенилэтанон
Работают по методике примера 9 /а/, проводят взаимодействие 17 г /47 ммоля/ 3-(1-адамантил)-4-метоксиэтоксиметоксибензойной кислоты с 73 мл /118 ммолями/ метиллития /1,6 М/, получают 18 г /100%/ целевого кетоного производного в виде желтого масла.
б/ 3-метил-3-[3-1-адамантил)-4-метоксиэтоксиметоксифенил]-акрилонитрил.
Работаю по методике примера 9 /б/, проводят взаимодействие 5 г /14 ммолей/ полученного выше кетона с 3,4 мл /21 ммолями/ диэтилцианометилфосфоната, получают 5,8 г /100%/ целевого нитрила в виде желтого масла.
в/ 3-[3-(1-адамантил)-4-метоксиэтоксиметоксифенил]-кротональдегид.
Работают по методике примера 9 /в/, исходя из 5,3 г (13,9 ммоля) полученного выше нитрила, получают 2,4 г /100%/ целевого альдегида с т.пл. 80oC.
г/ этиловый эфир транс-7-[3-(1-адамантил)-4-метоксиэтоксиметоксифенил] -3,7-диметил-2,4,6- гептатриеновой кислоты.
Работают по методике примера 5 /г/, проводят взаимодействие 1,9 г /4,9 ммоля/ 3-[3-адамантил)-4-метоксиэтоксиметоксифенил] -кротональдегида с 2 мл /7,3 ммолями/ триэтил-3-метил-4-фосфоно-2-бутеноата, получают 2 г /82%/ целевого этилового эфира с т.пл. 83-85oC.
д/ Транс-7-[3-(1-адамантил)-4-метоксиэтоксиметоксифенил] -3,7-диметил- 2,4,6-гептатриеновая кислота.
Работают по методике примера 1 /д/, исходя из 2 г /4 ммолей/ полученного выше этилового сложного эфира, получают после хроматографии на колонке с оксидом кремния, элюируя смесью этилацетата и дихлорметана /10-90/, 710 мг /38%/ транс-7-[3-(1-адамантил)-4-метоксиэтоксиметоксифенил] -3,7-диметил- 2,4,6-гептатриеновой кислоты с т.пл. 170-172oC.
Пример 13.
Этиловый эфир транс-7-[3-(1-адамантил)-4-метоксифенил]-7-метил-2,4,6-гептатриеновой кислоты.
а/ 3-метил-3-[3-(1-адамантил)-4-метоксифенил]акрилонитрил.
Работают по методике примера 9 /б/, проводят взаимодействие 5 г /17,6 ммоля/ 3-(1-адамантил)-4-метоксифенилэтанола с 8,4 мл /52,8 ммоля/ диэтилцианометилфосфоната, получают 3,8 г /70%/ целевого нитрила с т.пл. 163-165oC.
б/ 3-[3-(1-адамантил)-4-метоксифенил]кротональдегид.
Работают по методике примера 9 /в/, исходя из 7 г /22,8 ммоля/ полученного выше нитрила, получают 4,8 г /68%/ целевого альдегида с т.пл. 163-165oC.
в/ этиловый эфир транс-7-[3-(1-адамантил)-4-метоксифенил] -7-метил-2,4,6-гептатриеновой кислоты.
Работают по методике примера 5 /г/, проводят взаимодействие 500 мг /1,6 ммоля/ 3-[3-(1-адамантил)-4-метоксифенил] -кротональдегида с 550 мкл /2,4 ммолями/ триэтил-транс-4-фосфоно-2-бутеноата, получают 540 мг /82%/ целевого этилового сложного эфира с т.пл. 143-145oC.
г/ транс-7-[3-1-адамантил)-4-метоксифенил]-7-метил-2,4,6-гептатриеновая кислота.
Работают по методике примера 1 /д/, исходя из 540 мг /1,3 ммоля/ полученного выше сложного этилового эфира, получают после хроматографии на колонке с оксидом кремния, элюируя смесью этилацетата и дихлорметана /5-95/, 220 мг /45%/ 7-[3-(1-адамантил)-4-метоксифенил]- 7-метил-2,4,6-гептатриеновой кислоты.
Пример 14.
Этиловый эфир транс-7-(3-трет.бутил-4-метоксиэтоксиметоксифенил)-3,7-диметил-2,4,6- гептатриеновой кислоты.
а/ 3-трет.бутил-4-метоксиэтоксиметокси-1-бромбензол.
В трехгорлую колбу в токе азота вводят 2,4 г /81 ммоль/ гидрида натрия /80% в масле/, 50 мл ДМФ, прибавляют по каплям раствор 17,6 г /77 ммолей/ 2-трет. бутил-4-бромфенола в 100 мл ДМФ и перемешивают до прекращения выделения газа. Затем по каплям прибавляют раствор 10,5 г /92 ммолей/ 2-метоксиэтоксиметилхлорида в 20 мл ДМФ и перемешивают 4 часа при комнатной температуре. Реакционную смесь выливают в воду, экстрагируют этиловым эфиром, декантируют органическую фазу, промывают водой, сушат над сульфатом магния, выпаривают. Остаток очищают хроматографией на колонке с оксидом кремния, элюируя смесью дихлорметана и гексана /50-50/. После выпаривания растворителей собирают 21,4 г /88%/ целевого продукта в виде светло-каштанового масла.
б/ 3-трет.-бутил-4-метоксиэтоксиметоксибензойная кислота.
Растворяют 21,4 г /68 ммоля/ полученного выше соединения в 200 мл ТГФ и при -78oC в токе азота прибавляют по каплям раствор 30 мл н-бутиллития /2,5 М в гексане/ и перемешивают 30 минут. При -78oC пропускают ток CO2 в течение часа и дают нагреться до комнатной температуры, реакционную смесь выливают в насыщенный раствор хлорида аммония, экстрагируют этиловым эфиром, декантируют органическую фазу, сушат над сульфатом магния, выпаривают. Полученный остаток очищают хроматографией на колонке с оксидом кремния, элюируя дихлорметаном. Получают 11 г /58%/ целевой кислоты.
в/ 3-трет.бутил-4-метоксиэтоксиметоксифенилэтанон.
Работают по методике примера 9 /а/, проводят взаимодействие 11 г /39 ммолей/ 3-трет. бутил-4-метоксиэтоксимектоксибензойной кислоты с 49 мл /78 ммолями/ метиллития /1,6 М/, получают 8,5 г /75%/ целевого кетонного производного в виде желтого масла.
б/ 3-метил-3-/3-трет.бутил-4-метоксиэтоксиметоксифенил/акрилонитрил.
Работают по методике примера 9 /б/, проводят взаимодействие 8,5 г /30 ммолей/ полученного выше кетона с 14,3 мл /90 ммолями/ диэтилцианометилфосфоната, получают 7 г /76%/ целевого нитрила в виде желтого масла.
в/ 3-трет.-бутил-4-метоксиэтоксиметоксифенил/кротональдегид.
Работают по методике примера 9 /в/, исходя из 7 г /23 ммолей/ полученного ранее нитрила, получают 6 г /85%/ целевого альдегида в виде желтого масла.
г/ этиловый эфир транс-7-(3-трет.бутил-4-метоксиэтоксиметоксифенил)-3,7-диметил-2,4,6- гептатриеновой кислоты.
Работают по методике примера 5 /г./, проводят взаимодействие 6 г /19,6 ммоля/ 3-(3-трет.бутил-4-метоксиэтоксиметоксифенил)кротональдегида с 8,1 мл /29,4 ммоля/ триэтил-3-метил-4-фосфоно-2-бутеноата, получают 6,6 г /81%/ целевого сложного этилового эфира в виде желтого масла.
д/ транс-7-(3-трет.бутил-4-метоксиэтоксиметоксифенил)-3,7-диметил-2,4,6- гептатриеновая кислота.
Работают по методике примера 1 /д/, исходя из 1.1 г /2,6 ммоля/ полученного ранее сложного этилового эфира, получают после перекристаллизации из смеси дихлорметана и гептана 320 мг /32%/ транс-7-(3-трет.бутил-4-метоксиэтоксиметоксифенил)- 3,7-диметил-2,4,6- гептатриеновой кислоты с т.пл. 147-148oC.
Пример 15.
В этом примере приведены конкретные различные рецептуры на основе соединений согласно изобретению.
A - Оральное введение:
а) Таблетка 0,2 г
Соединение, полученное в примере 3 - 0,001 г
Крахмал - 0,114 г
Дикальцийфосфат - 0,020 г
Оксид кремния - 0,020 г
Лактоза - 0,030 г
Тальк - 0,010 г
Стеарат магния - 0,005 г
б/ Пригодная для питья суспензия в ампулах 10 мл
Соединение примера 3 - 0,05 г
Глицерин - 1,000 г
70%-ный сорбит - 1,000 г
Сахаринат натрия - 0,010 г
Метиловый эфир пара-оксибензойной кислоты - 0,080 г
Отдушка - По потребности
Очищенная вода - До 10 мл
Б - Топическое нанесение:
а/ Мазь
Соединение примера 3 - 0,020 г
Изопропилмиристат - 81,700 г
Жидкое вазелиновое масло - 9,100 г
Оксид кремния /"Аэросил 200", продаваемый ДЕГУССА/ - 9,180 г
б/ Мазь
Соединение примера 3 - 0,300 г
Вазелин белый - До 100 г
в/ Крем вода-в-масле неионный
Соединение примера 3 - 0,100 г
Смесь спиртов эмульгированного ланолина, восков и масел /"Эуцерин безводный", продаваемый БДФ/ - 39,900 г
Метиловый эфир пара-оксибензойной кислоты - 0,075 г
Пропиловый эфир пара-оксибензойной кислоты - 0,075 г
Стерильная деминерализованная вода - До 100 г
г/ Лосьон
Соединение примера 3 - 0,100 г
Полиэтиленгликоль, /ПЭГ 400/ - 69,900 г
95%-ный этанол - 30,00 г
д/ Гидрофобная мазь
Соединение примера 3 - 0,300 г
Изопропилмиристат - 36,400 г
Силиконовое масло /"Родорсил 47 У 300", продаваемое Рон-Пуленк/ - 36,400 г
Пчелиный воск - 13,600 г
Силиконовое масло /"Абил 300.000 cst", продаваемое Гольдшмит/ - До 100 г
е/ Неионный крем вода-в-масле
Соединение примера 3 - 0,500 г
Цетиловый спирт - 4,00 г
Моностеарат глицерина - 2,500 г
Стеарат ПЭГ 50 - 2,500 г
Масло сального дерева - 9,200 г
Пропиленгликоль - 2,00 г
Метиловый эфир пара-оксибензойной кислоты - 0,075 г
Пропиловый эфир пара-оксибензойной кислоты - 0,075 г
Стерильная деминерализованная вода - До 100 г
Соединения согласно изобретению обладают антагонистической активностью по отношению к экспрессии одного или нескольких биологических маркеров в тесте на дифференцировку клеток F9 эмбриональной тератокарциономы мыши. Тест F9 является фундаментальным тестом для определения ретиноидной активности соединения. Ретиноиды известны тем, что обладают целым рядом биологической активности и это позволяет использовать их для лечения многочисленных патологий, таких, например, которые указаны выше в описании. В тесте на антагонистическую активность соединений настоящего изобретения определяют молярную концентрацию (САД 50), которая ингибирует секрецию активатора плазминогена (выбранный маркер) на 50% клетками F9, обработанными 10 nM соединения A, которое является антагонистом (описание теста в публикации Strickland и сотр. Canser Research 43 5268-5272, ноябрь 1983).
Соединением A является 4-[(5,5,8,8-тетраметил- 5,6,7,8-тетрагидро-нафталин-2-иламино) метил]-бензойная кислота.
Для сравнения использовалось соединение примера 1 патента EP 0514264, которое тоже обладает антагонистической активностью. В указанном выше это соединение имело показатель САД 50, равный 550 нМ. Хотя соединение и обладает антагонистической активностью, но она намного слабее, потому что для ингибирования на 50% секреции активатора плазминогена необходима высокая концентрация.
Тест "ухо мыши" является известным фармакологическим тестом ин виво для исследования ретиноидов. Поскольку соединения настоящего изобретения являются антагонистическими, определяют процент ингибирования соединениями согласно изобретению отека, вызванного контрольным соединением B, являющимся агонистом.
Соединением B является 2-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-6-бензо /b/ тиофенкарбоновая кислота.
Последний тест в таблице является тестом на определение тератогенеза ретиноидов. Тест на тератогенез проводился с концентрацией 30 мг/кг соединения примера 3. Этот результат представляет интерес, потому что он приводит к 0% аномальных эмбрионов.
Результаты испытаний сведены в таблицу.


Изобретение относится к новым полиеновым соединениям формулы I, где R1 - COR9; R2, R4, R6 - водород; R3, R5, R10, R11 - водород или низший алкил; R7 - циклоалифатический радикал или низший алкил; R8 - радикал -O-CH2-OCH2-CH2-O-CH3 или OR11; R4 и R6 взятые вместе могут образовывать с соседним бензольным циклом нафталиновый цикл; R9 - O-R10, а также их солям и их оптическим и геометрическим изомерам. Соединения I обладают значительной активностью в области дифференциации и пролиферации клеток и могут найти применение при местном и системном лечении дерматологических расстройств, связанных с нарушением кератинизации, дерматологических или других заболеваний с воспалительной и/или иммуноаллергической компонентой. 3 c. и 8 з.п. ф-лы, 2 ил., 1 табл.


в которой R1 - радикал COR9;
R2 - атом водорода;
R3 - атом водорода или низший алкильный радикал;
R4 - атом водорода;
R5 - атом водорода или низший алкильный радикал;
R6 - атом водорода;
R7 - циклоалифатический радикал или низший алкильный радикал, линейный или разветвленный;
R8 - радикал -O-CH2-O-CH2-O-CH3 или OR1, причем, когда R4 и R6 взяты вместе, тогда они могут образовывать с соседним бензольным циклом нафталиновый цикл;
R9 - радикал -O-R10;
R10 - атом водорода или низший алкильный радикал, линейный и разветвленный;
R11 - атом водорода или низший алкильный радикал, линейный или разветвленный,
а также их соли и их оптические и геометрические изомеры.
-транс-7-[3-(1-адамантил)-4-оксифенил] -3,7-диметил-2,4,6-гептатриеновую кислоту,
этиловый эфир транс-7-[3-(1-адамантил)-4-метоксифенил] -3,7-диметил-2,4,6-гептатриеновой кислоты,
транс-7-[3-(1-адамантил)-4-метоксифенил] -3,7-диметил-2,4,6-гептатриеновую кислоту,
(2Z, 4E, 6E)-7-[3-(1-адамантил)-4-метоксифенил] -3,7-диметил-2,4,6-гептатриеновую кислоту,
транс-5-[7-(1-адамантил)-6-метоксиэтоксиметокси-2-нафтил] -3-метил-2,4-пентадиеновую кислоту,
транс-5-[7-(1-адамантил)-6-окси-2-нафтил]-3-метил-2,4-пентадиеновую кислоту,
транс-5-[7-(1-адамантил)-6-метокси-2-нафтил] -3-метил-2,4-пентадиеновую кислоту,
транс-5-[7-(1-адамантил)-6-пропокси-2-нафтил] -3-метил-2,4-пентадиеновую кислоту,
транс-7-[3-(1-метилциклогексил)-4-оксифенил] -3,7-диметил-2,4,6-гептатриеновую кислоту,
(2Z, 4E, 6E)-7-[3-(1-метилциклогексил)-4-метоксифенил] -3,7-диметил-2,4,6-гептатриеновую кислоту,
транс-7-[3-(1-адамантил)-4-изопропилоксифенил] -3,7-диметил-2,4,6-гептатриеновую кислоту,
транс-7-[3-(1-адамантил)-4-метоксиэтоксиметоксифенил] -3,7-диметил-2,4,6-гептатриеновую кислоту,
транс-7-[3-(1-адамантил)-4-метоксифенил] -7-метил-2,4,6-гептатриеновую кислоту,
транс-7-[3-(1-адамантил)-4-метоксифенил] -3,7-диметил-2,4,6-гептатриен-1-ол,
транс-7-[3-(1-адамантил)-4-метоксифенил] -3,7-диметил-2,4,6-гептатриен-1-аль,
транс-N-этил-7-[3-(1-адамантил)-4-метоксифенил] -3,7-диметил-2,4,6-гептатриенкарбоксамид,
транс-N-4-оксифенил-7-[3-(1-адамантил)-4-метоксифенил] -3,7-диметил-2,4,6-гептатриенкарбоксамид,
транс-7-(3-трет. бутил-4-метоксиэтоксиметоксифенил)-3,7-диметил-2,4,6-гептатриеновую кислоту,
этиловый эфир 7-(3-трет.бутил-4-оксифенил)-3,7-диметил-2,4,6-гептатриеновой кислоты,
этиловый эфир транс-7-(3-трет.бутил-4-метоксифенил)-3,7-диметил-2,4,6-гептатриеновой кислоты,
этиловый эфир транс-7-[4-(1-адамантил)-3-метоксифенил] -3,7-диметил-2,4,6-гептатриеновой кислоты.
| СПОСОБ БАЛАНСИРОВКИ ТЕЛ | 0 |
|
SU315071A1 |
| Контактное устройство часов | 1974 |
|
SU514264A1 |
Авторы
Даты
1998-11-20—Публикация
1995-04-25—Подача