Настоящее изобретение относится к новым производным [3-(4-фенилпиперазин-1-ил)пропил] -, [3-(4-фенилпиперазин-1-ил)-2,2-диметилпропил]- и [1-(4-фенилпиперазин-1-илметил)циклопроп-1-илметил] -2,4(1H, 3H)-пиримидиндиона, 2,4,6(1H, 3H, 5H)-пиримидинтриона, 5,6-дигидро-2,4(1H, 3H)-пиримидиндиона, 1,2,4-триазин-3,5(2H, 4H)-диона и 5,6,7,8-тетрагидро-2,4(1H,3H)-хиназолиндиона в качестве антагонистов α1-адренорецептора, их применению в качестве терапевтических агентов и способам их получения.
α1-Адренорецепторы медиируют способность гладкомышечной ткани к сокращению. Например, гиперсимпатическая активность вызывает сокращение гладких мышц сосудов, что приводит к повышению кровяного давления. Таким образом, антагонисты α1-адренорецептора находят применение в качестве гипотензивных агентов. Стимуляция α1-адренорецептора также вызывает сокращение гладкой мышцы мочеиспускательного канала и шейки мочевого пузыря, приводя к увеличению сопротивления при оттоке мочи. Таким образом, антагонисты α1-адренорецептора пригодны при лечении состояний, связанных прямо или косвенно с закупоривающими уропатиями, в частности с закупоркой вследствие доброкачественной гиперплазии простаты (ДГП) (Lepor H., The Prostate Supplement, 1990, 3, 75-84). Однако количество антагониста α1-адренорецептора, требуемое для получения терапевтического эффекта в отношении оттока мочи, может привести к чрезмерному снижению кровяного давления и/или ингибированию механизма, с помощью которого поддерживается нормальное кровяное давление при изменении позы (т.е. к постуральной гипотензии). Таким образом, существует потребность в α1-антагонистах, которые могут избирательно понижать гиперактивность α1-адренорецептора в гладких мышцах простаты и/или нижних мочевых путей без воздействия на кровяное давление или, не приводя к ортостатической гипотензии.
Первым предметом настоящего изобретения является соединение формулы
где R1 обозначает ацетиламино, амино, циано, трифторацетиламино, галоген, водород, гидрокси, нитро, метилсульфониламино, 2-пропинилоксигруппу, выбранную из C1-C6алкила, C3-C6циклоалкила, C3-C6циклоалкилC1-C4алкила,
C1-C6алкилокси, C3-C6циклоалкилокси, C3-C6циклоалкилC1-C4алкилокси и C1-C4алкилтио (причем указанная группа, кроме того, необязательно замещена одним-тремя атомами галогена), или группу, выбранную из арила, арилC1-C4алкила, гетероарила, гетероарилC1-C4алкила, арилокси, арилC1-C4алкилокси, гетероарилокси и гетероарилC1-C4алкилокси (причем указанные арил и гетероарил, кроме того, необязательно замещены одним-двумя радикалами, независимо выбранными из галогена и циано);
R2 обозначает циано, галоген, водород, гидрокси или группу, выбранную из C1-C6алкила и C1-C6алкилокси (причем указанная группа, кроме того, необязательно замещена одним-тремя атомами галогена);
R3 и R4 каждый обозначает водород или метил или вместе обозначают этилен; и
R5 обозначает группу, выбранную из формул (a), (b), (c) и (d):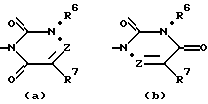

в которых X обозначает C(O), CH2 или CH(OH);
Y обозначает CH2 или CH(OH);
Z обозначает N или C(R9), где R9 обозначает водород, C1-C6алкил или гидрокси;
R6 обозначает водород, группу, выбранную из C1-C6алкила, C3-C6циклоалкила, C3-C6циклоалкилC1-C4алкила (причем указанная группа, кроме того, необязательно замещена одним-тремя атомами галогена), или группу, выбранную из арила, гетероарила, арилC1-C4алкила и гетероарилC1-C4алкила (причем указанные арил и гетероарил, кроме того, необязательно замещены одним-тремя радикалами, выбранными из галогена, циано, C1-C6алкилокси, C1-C6алкила и арила);
R7 обозначает C1-C6алканоил, карбамоил, циано, диC1-C6алкиламино, галоген, водород, гидрокси, гидроксииминометил, C1-C6алкилсульфонил, C1-C6алкилтиогруппу, выбранную из C1-C6алкила, C3-C6циклоалкила, C1-C6алкилокси и C1-C6алкилоксиC1-C4алкила (причем указанная группа, кроме того, необязательно замещена одним-тремя радикалами, выбранными из галогена, гидрокси или C1-C6алкилокси), или группу, выбранную из арила, гетероарила, арилC1-C4алкила и гетероарилC1-C4алкила (причем указанный арил и гетероарил, кроме того, необязательно замещены одним-тремя радикалами, выбранными из галогена, циано, C1-C6алкилокси, C1-C6алкила и арила), или R7 и R9 вместе обозначают тетраметилен; и каждый R8 независимо обозначает водород, гидрокси, метил или этил;
и его фармацевтически приемлемые соли и N-оксиды.
Вторым предметом настоящего изобретения является фармацевтическая композиция, содержащая соединение формулы I в смеси с одним или более пригодными эксципиентами.
Третьим предметом настоящего изобретения являются способы получения соединений формулы I.
Если не указано иное, следующие термины, использованные в описании и в формуле изобретения, имеют значения, приведенные ниже.
"Алкил", как, например, в случае C1-C4алкилтио, C1-C6алкила или C1-C6алкилокси, обозначает прямой или разветвленный насыщенный углеводородный радикал, имеющий от одного до указанного числа атомов углерода, необязательно замещенный одним-тремя атомами галогена (например, необязательно замещенный C1-C4алкилтио включает метилтио, этилтио, 2,2,2-трифторэтилтио и т. д. ; необязательно замещенный C1-C6алкил включает метил, трифторметил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил и т.д.; и необязательно замещенный C1-C6алкилокси включает метокси, дифторметокси, трифторметокси, этокси, 2,2,2-трифторэтокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси и т.д.).
"Алканоил" обозначает радикал -C(O)R, имеющий от одного до указанного числа атомов углерода (например, формил, ацетил, пропионил, бутирил и т.д.).
"Циклоалкил", как, например, в случае C3-C6циклоалкила, C3-C6циклоалкилC1-C4алкила, C3-C6циклоалкилокси или C3-C6циклоалкилC1-C4алкилокси, обозначает насыщенный моноциклический углеводородный радикал, имеющий от трех до указанного числа атомов углерода (например, C3-C6циклоалкил включает радикалы циклопропил, циклобутил, циклопентил и циклогексил, а C3-C6циклоалкилокси включает радикалы циклопропилокси, циклобутилокси, циклопентилокси и циклогексилокси).
"Арил", как, например, в случае арила, арилC1-C4алкила, арилокси и арилC1-C4алкилокси, обозначает органический радикал, образованный из ароматического углеводорода, содержащего 6-14 атомов углерода и включающий моноциклические или конденсированные карбоциклические ароматические кольца (например, фенил, нафтил, антраценил, фенантренил и т.д.), необязательно замещенный одним-двумя радикалами, независимо выбранными из галогена и циано.
"Гетероарил", как, например, в случае гетероарила, гетероарилC1-C4алкила, гетероарилокси и гетероарилC1-C4алкилокси, обозначает органический радикал, образованный из ароматического углеводорода, содержащего 5-14 атомов, из которых 1-5 являются гетероатомами, выбранными из N, O или S, и включает моноциклические, конденсированные гетероциклические и конденсированные карбоциклические и гетероциклические ароматические кольца (например, тиенил, фурил, пирролил, пиримидинил, изоксазолил, оксазолил, индолил, бензо[b] тиенил, изобензофуранил, пуринил, изохинолил, птердинил, перимидинил, имидазолил, пиридил, пиразолил, пиразинил и т.д.), необязательно замещенный одним-двумя радикалами, независимо выбранными из галогена и циано.
"Карбамоил" обозначает аминокарбонил.
"Галоген" обозначает фтор, хлор, бром или йод.
"Тетраметилен" обозначает радикал -CH2•(CH2)2•CH2-.
"Отщепляемая группа" имеет обычное значение, употребляемое в синтетической органической химии, т. е. обозначает атом или группу, замещаемую в щелочных условиях, и включает галоген и алкан- или аренсульфонилокси, такие как метансульфонилокси, этансульфонилокси, бензолсульфонилокси и тозилокси, и тиенилокси, дигалофосфиноилокси, тетрагалофосфаокси и т.п.
"Металлорганическое основание" обозначает основание, способное взаимодействовать с органическим соединением, образуя "металлизованное" соединение формулы R-Met1, где Met1 обозначает любой одновалентный электроположительный элемент-металл, обычно алкилметаллическое основание и предпочтительно алкильное основание щелочного металла (например, н-бутиллитий, н-бутилнатрий, н-бутилкалий и т.п.).
"Животное" включает людей, других млекопитающих, например собак, кошек, кроликов, крупный рогатый скот, лошадей, овец, коз, свиней и оленей, и не млекопитающих, например птиц и т.п.
"Заболевание" включает, в частности, любое нездоровое состояние животного или его органа и включает нездоровое состояние, которое может быть обусловлено или которое может быть присуще медицинской или ветеринарной терапии, примененной к этому животному, т.е. "побочными эффектами" такой терапии.
"Необязательный" или "необязательно" означает, что последовательно описываемое событие или обстоятельство может иметь место или его может не быть и что описание включает случаи, когда событие или обстоятельство имеет место, и случаи, когда его нет. Например, фраза "где группа необязательно замещена одним-тремя атомами галогена" означает, что указанная группа может быть, а может и не быть замещенной для того, чтобы подпадать под объем данного изобретения.
"Защитная группа" имеет обычное значение, употребляемое в синтетической органической химии, т. е. обозначает группу, которая селективно блокирует один реакционноспособный участок в многофункциональном соединении так, что химическая реакция может происходить избирательно в другом незащищенном реакционноспособном участке, и которая может быть легко удалена после завершения избирательной реакции.
"Защитный агент" означает вещество, которое может реагировать с многофункциональным соединением и создавать защитную группу на реакционноспособных атомах азота.
"Защищенный" в применении к соединению или группе означает производное соединения или группы, в котором реакционноспособный участок или участки заблокированы защитными группами.
"Удаление защиты" относится к удалению любых присутствующих защитных групп после завершения избирательной реакции.
"Фармацевтически приемлемый" означает, что нечто, пригодное для получения фармацевтической композиции, является полностью безопасным, нетоксичным и не является нежелательным ни с биологической, ни с другой точки зрения, и включает нечто, полезное для применения как в ветеринарии, так и в фармацевтике для человека.
"Фармацевтически приемлемые соли" означает соли, которые являются фармацевтически приемлемыми в том отношении, как это определено выше, и которые обладают требуемой фармакологической активностью. Такие соли включают кислотно-аддитивные соли, образованные с использованием неорганических кислот, таких как бромистоводородная кислота, соляная кислота, азотная кислота, фосфорная кислота, серная кислота и т.п.; или с использованием органических кислот, таких как уксусная кислота, бензолсульфоновая кислота, бензойная кислота, камфорсульфоновая кислота, пара-хлорбензолсульфоновая кислота, коричная кислота, лимонная кислота, циклопентанпропионовая кислота, 1,2-этандисульфоновая кислота, этансульфоновая кислота, фумаровая кислота, глюкогептоновая кислота, глюконовая кислота, глутаминовая кислота, гликолевая кислота, гексановая кислота, гептановая кислота, орто-(4-гидроксибензоил)бензойная кислота, 2-гидроксиэтансульфоновая кислота, гидроксинафтойная кислота, молочная кислота, лаурилсерная кислота, малеиновая кислота, яблочная кислота, малоновая кислота, миндальная кислота, метансульфоновая кислота, 4-метилбицикло[2.2.2] окт-2-ен-1-карбоновая кислота, 4,4'-метиленбис(3-гидрокси-2-ен-1-карбоновая кислота), муконовая кислота, 2-нафталинсульфоновая кислота, щавелевая кислота, 3-фенилпропионовая кислота, пропионовая кислота, пировиноградная кислота, салициловая кислота, стеариновая кислота, янтарная кислота, винная кислота, трет-бутилуксусная кислота, пара-толуолсульфоновая кислота, триметилуксусная кислота и т.п.
Фармацевтически приемлемые соли также включают соли присоединения оснований, которые могут быть образованы в том случае, когда присутствующие кислотные протоны способны взаимодействовать с неорганическими или органическими основаниями. Приемлемые неорганические основания включают гидроксид алюминия, гидроксид кальция, гидроксид калия, карбонат натрия и гидроксид натрия. Приемлемые органические основания включают диэтаноламин, этаноламин, N-метилглюкамин, триэтаноламин, трометамин и т.п.
"N-оксид" в отношении соединения формулы I означает такое соединение, в котором атомы азота находятся в окисленном состоянии, т.е. O<---N. N-оксиды соединений формулы I могут быть получены способами, известными обычным специалистам в данной области техники.
"Терапевтически эффективное количество" означает такое количество, которое, будучи введенным животному для лечения болезни, является достаточным для осуществления такого лечения этой болезни.
Термин "q. s. " означает добавление количества, достаточного для достижения установленной функции, например, для доведения раствора до требуемого объема, (т.е. до 100%).
"Процесс лечения" или "лечение" болезни включает:
(1) предотвращение наступления болезни у животного, которое может быть предрасположенным к болезни, но еще не испытывает и не проявляет симптомов болезни,
(2) ингибирование болезни, т.е. задержание ее развития, или
(3) облегчение болезни, т.е. обеспечение регрессии болезни.
Изомерия представляет собой явление, когда соединения имеют одинаковые молекулярные формулы, но различаются природой или последовательностью связывания их атомов или расположением их атомов в пространстве. Изомеры, которые различаются расположением их атомов в пространстве, называют "стереоизомерами". Стереоизомеры, которые не являются зеркальными изображениями друг друга, называют "диастереомерами", а стереомеры, которые представляют собой несовпадающие зеркальные изображения, называют "энантиомерами" или иногда оптическими изомерами. Атом углерода, связанный с четырьмя неидентичными заместителями, называют "хиральным центром".
Соединение с одним хиральным центром имеет две энантиомерные формы с противоположной хиральностью и может существовать либо в виде индивидуального энантиомера, либо в виде смеси энантиомеров. Смесь, содержащая равные количества индивидуальных энантиомерных форм с противоположной хиральностью, называют "рацемической смесью". Соединение, имеющее больше одного хирального центра, имеет 2n-1 энантиомерных пар, где n обозначает количество хиральных центров. Соединения, имеющие более одного хирального центра, могут существовать либо в виде индивидуального диастереомера, либо в виде смеси диастереомеров, называемой "диастереомерной смесью".
Когда имеется один хиральный центр, стереоизомер может быть охарактеризован с помощью абсолютной конфигурации указанного хирального центра. Абсолютная конфигурация относится к расположению в пространстве заместителей, присоединенных к хиральному центру. Заместители, присоединенные к рассматриваемому хиральному центру, классифицируются в соответствии с "Правилом последовательности" Кана, Ингольда и Прелога и абсолютный дескриптор R или S указывают в скобках, за которыми следует дефис и химическое название соединения.
Соединения формулы I могут существовать как в виде индивидуальных стереоизомеров, так и в виде смесей стереоизомеров. Например, соединения формулы I, где R5 обозначает группу формулы (c) или (d), могут иметь хиральные центры в 5-м и/или 6-м положениях фрагмента 5,6-дигидро-2,4(1H,3H)-пиримидиндиона. Когда хиральные центры находятся как в положении 5, так и в положении 6, возможны две энантиомерные пары (т.е. энантиомерная пара 5R,6S/5S, 6R, также соответствующая цис-изомерам, и энантиомерная пара 5R,6R/5S,6S, также соответствующая транс-изомерам). В настоящем описании, если при ссылке на соединение формулы I с использованием его названия или формулы не указана конфигурация, то подразумевается, что данная ссылка включает все возможные конфигурации данного соединения.
Соединения формулы I названы в соответствии с принятыми правилами номенклатуры, обычно применяемыми в "Chemical Abstracts". Например, соединение формулы I, в котором R1 обозначает метокси и каждый из R2, R3 и R4 обозначает водород, названо 3-{3-[4-(2- метоксифенил)пиперазин-1-ил]пропил}-5-метил-2,4(1H,3H)-пиримидиндионом, когда R5 обозначает группу формулы (a), где Z обозначает CH и R7 обозначает метил; названо 3-{3-[4-(2-метоксифенил)пиперазин-1-ил] пропил} -5,6,7,8-тетрагидро- 2,4(1H,3H)-хиназолиндионом, когда R5 обозначает группу формулы (a), где Z обозначает C(R9) и R7 и R9 вместе обозначают тетраметилен; названо 4-{3-[4-(2-метоксифенил)пиперазин-1-ил] пропил} -6-метил-1,2,4-триазин- 3,5(2H,4H)-дионом, когда R5 обозначает группу формулы (a), где Z обозначает N и R7 обозначает метил; и названо 3-{ 3-[4-(2-метоксифенил)пиперазин-1-ил] пропил} -5,5-диметил- 2,4,6(1H,3H,5H)-пиримидинтрионом, когда R5 обозначает группу формулы (c) и каждый из радикалов R8 обозначает метил.
ПРЕДПОЧТИТЕЛЬНЫЕ ВАРИАНТЫ ВЫПОЛНЕНИЯ ИЗОБРЕТЕНИЯ
Хотя в кратком изложении сущности изобретения приведено наиболее общее определение настоящего изобретения, некоторые соединения формулы I являются предпочтительными. Например, предпочтительными соединениями формулы I являются таковые, в которых R1 обозначает C1-C6алкилокси (кроме того, необязательно замещенный одним-тремя атомами фтора) или гетероарил; R2 обозначает водород, галоген, гидрокси или C1-C6алкил и R5 обозначает группу, выбранную из формул (a), (b) и (c), где R6 обозначает водород, C1-C6алкил, C3-C6циклоалкилC1-C4алкил, гетероарилC1-C4алкил, или группу, выбранную из бензила и фенила (кроме того, указанная группа необязательно замещена одним-тремя радикалами, выбранными из галогена, C1-C6алкилокси, C1-C6алкила и арила), и R7 обозначает карбамоил, циано, галоген, водород, гидроксииминометил, гидроксиметил или C1-C6алкил (указанный алкил необязательно замещен одним-тремя атомами фтора) или вместе с R9 обозначает тетраметилен.
Особенно предпочтительными соединениями формулы I являются таковые, где R1 обозначает метокси, этокси, 2,2,2-трифторэтокси, оксазолил или пирролил; R2 обозначает водород, хлор, фтор, гидрокси или метил и R5 обозначает группу, выбранную из формул (a), (b) или (c), где R6 обозначает водород, метил, циклогексилметил, пиридилметил, пиразинилметил, фурилметил, тиенилметил, бифенилметил, или группу, выбранную из бензила или фенила (кроме того, указанная группа необязательно замещена одним-тремя радикалами, выбранными из хлора, фтора, метила или метокси), и R7 обозначает карбамоил, циано, галоген, водород, гидроксииминометил, гидроксиметил, метил, этил, пропил, трифторметил или вместе с R9 обозначает тетраметилен; X обозначает CH2 и каждый из радикалов R8 обозначает водород или X обозначает CH(OH) и один из радикалов R8 обозначает гидрокси.
Наиболее предпочтительными являются такие соединения формулы I, в которых R1 обозначает 2,2,2-трифторэтокси; R2 обозначает водород, хлор, фтор, гидрокси или метил; каждый из радикалов R3 и R4 обозначает водород; R5 обозначает группу формулы (a), где R7 обозначает водород или метил и Z обозначает C(R9), где R9 обозначает водород, или метил, или группу формулы (c), в которой X обозначает CH(OH), один из радикалов R8 обозначает гидрокси, а другой обозначает метил; и R6 обозначает водород, метил, циклогексилметил, пиридилметил, пиразинилметил, фурилметил, тиенилметил, бифенилметил, или группу, выбранную из бензила и фенила (кроме того, указанная группа необязательно замещена одним-тремя радикалами, выбранными из хлора, фтора, метила или метокси).
ФАРМАКОЛОГИЯ И ПРИМЕНЕНИЕ
Фармакологию соединений по изобретению в отношении α1-адренорецептора определяли с помощью методов, принятых в данной области техники. Опыты in vitro по определению относительного влияния изучаемых соединений на медиируемое α1-адренорецептором сокращение выделенных гладких мышц аорты крысы и мочевого пузыря кролика описаны в примере 38. Опыты in vitro для оценки относительного влияния изучаемых соединений на медиируемое α1-адренорецептором сокращение выделенных гладких мышц артерии, простаты и мочевого пузыря человека описаны в примере 39. Опыты in vivo для оценки влияний изучаемых соединений на понижение кровяного давления у нормотензивных крыс и у крыс с самопроизвольно повышенным кровяным давлением описаны в примере 40. Опыты in vivo для оценки влияния изучаемых соединений на рефлекторное поддерживание нижнего кровяного давления в ответ на изменение позы из положения лежа в вертикальное описаны в примере 41. Опыты in vivo для оценки относительного влияния изучаемых соединений на медиируемое α1-адренорецептором повышение кровяного и внутрипочечного давлений описаны в примере 42.
В целом, соединения по изобретению тестировали с помощью вышеописанных методов и обнаружили избирательное ингибирование ими α1-адренорецепторов, которые медиируют состояние сокращения гладких мышц простаты и нижних мочевых путей. Соединения по изобретению могут снижать сопротивление при оттоке мочи, не вызывая эффекта понижения кровяного давления и/или ортостатической гипотензии, что характерно для ранее описанных антагонистов α1/ -адренорецептора. Следовательно, соединения по изобретению пригодны для лечения состояний, прямо или косвенно связанных с закупоривающими уропатиями, в частности с закупоркой вследствие доброкачественной гиперплазии простаты.
НАЗНАЧЕНИЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ
Обычно соединения формулы I могут быть введены в терапевтически эффективных количествах с помощью любых обычных и приемлемых способов, известных в данной области техники, либо по отдельности, либо в сочетании с другим соединением формулы I, либо с другим терапевтическим агентом. Терапевтически эффективное количество может широко варьироваться в зависимости от серьезности заболевания, возраста и состояния здоровья пациента, действенности используемого соединения и других факторов. Терапевтически эффективные количества соединений формулы I могут составлять от 0,1 микрограмма на килограмм веса тела (мкг/кг) в день до 1 миллиграмма на килограмм веса тела (мг/кг) в день, обычно от 1 мкг/кг/день до 10 мкг/кг/день. Следовательно, терапевтически эффективное количество для человека весом 80 кг может составлять от 8 мкг/день до 800 мг/день, обычно от 80 мкг/день до 0,8 мг/день.
Любой обычный специалист в области лечения таких болезней способен без проведения длительных экспериментов и, полагаясь на собственные знания и описание настоящего изобретения, установить для данной болезни терапевтически эффективное количество соединения формулы I.
Обычно соединения формулы I могут быть введены в виде фармацевтических композиций одним из следующих путей: орально, системно (например, трансдермально, интраназально или с помощью суппозиториев) или парентерально (например, внутримышечно, внутривенно или подкожно). Композиции могут иметь форму таблеток, пилюль, капсул, полутвердых препаратов, порошков, препаратов с непрерывным высвобождением, растворов, суспензий, эликсиров, аэрозолей или могут быть в форме любой другой пригодной композиции, и они обычно включают соединение формулы I в комбинации с по крайней мере одним фармацевтически приемлемым эксципиентом. Приемлемые эксципиенты нетоксичны, способствуют введению и не оказывают вредного воздействия на терапевтическое действие соединения формулы I. Такой эксципиент может быть любым твердым, жидким, полутвердым или, в случае аэрозольной композиции, газообразным эксципиентом, который обычно имеется в распоряжении специалиста в данной области техники.
Твердые фармацевтические эксципиенты включают крахмал, целлюлозу, тальк, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат магния, стеарат натрия, моностеарат глицерина, хлорид натрия, сухое обезжиренное молоко и т. п. Жидкие и полутвердые эксципиенты могут быть выбраны из воды, этанола, глицерина, пропиленгликоля и различных масел, включающих нефтяные масла, масла животного или растительного происхождения или синтетические масла (например, арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.д.). Предпочтительные жидкие носители, в частности, для инъецируемых растворов включают воду, физиологический раствор, водную декстрозу и гликоли.
Для распыления соединения формулы I в аэрозольной форме могут быть использованы сжатые газы. Пригодными для этой цели инертными газами являются азот, двуокись углерода, закись азота и т.д. Другие фармацевтически пригодные носители и их формы описаны у A.R. Alfonso в Remington's Pharmaceutical Sciences 1985, 17-е издание, Easton, Pa.: Mack Publishing Company.
Количество соединения формулы I в композиции может широко варьироваться в зависимости от типа композиции, величины стандартной дозы, типа эксципиентов и других факторов, известных специалистам в данной области фармацевтических наук. Обычно окончательная композиция может содержать от 0,000001 мас. % до 10,0 мас.% соединения формулы I, предпочтительно от 0,00001 мас.% до 1,0 мас.% с дополнением недостающего количества за счет эксципиента или эксципиентов.
Предпочтительно фармацевтическую композицию вводят в форме однократной стандартной дозы для непрерывного лечения или ad libitum (по желанию) в форме однократной стандартной дозы, когда особо требуется облегчение симптомов. Репрезентативные фармацевтические композиции, содержащие соединение формулы I, описаны в примере 37.
ХИМИЯ
Соединения формулы I
Соединения формулы I могут быть получены с помощью процесса, изображенного на следующей реакционной схеме I:
где L обозначает отщепляемую группу и каждый из радикалов R1, R2, R3, R4 и R5 имеет значения, указанные в кратком изложении сущности изобретения для формулы I.
Обычно соединения формулы I могут быть получены путем алкилирования необязательно замещенного 1-фенилпиперазина формулы 2 с помощью соединения формулы 3 или его защищенного производного с последующим удалением в случае необходимости защитной группы. Алкилирование может быть выполнено без добавок при 100-250oC, обычно при 150-200oC и предпочтительно при 180-190oC в течение 1-3 часов (более подробно описано ниже в примере 24). В альтернативном варианте реакция может быть осуществлена в пригодном инертном органическом растворителе (например, в ацетонитриле, N,N-диметилформамиде (ДМФ), N-метилпирролидоне (МП), любой приемлемой смеси пригодных растворителей и т. д. , предпочтительно в ацетонитриле) в присутствии приемлемого основания (например, карбоната натрия, карбоната калия, карбоната цезия, 2,4,6-триметилпиридина и т.д., предпочтительно карбоната калия) и необязательно соли йодистоводородной кислоты (например, йодида натрия, йодида лития, йодидов тетраалкиламмония, таких, как йодид тетраметиламмония и т. п., и т.д., предпочтительно йодида натрия) при 40-90oC, обычно при 70-85oC и предпочтительно при температуре кипения с обратным холодильником в течение 6-72 часов (более подробно описано ниже в примере 25).
Удаление защитной группы в случае наличия азотной защитной группы может быть осуществлено с помощью любых приемов, позволяющих удалить защитную группу и обеспечить приемлемый выход требуемого продукта. Подробное описание методов, применимых для введения защитных групп и их удаления, можно найти у T. W. Green, Protective Groups in Organic Synthesis, John Wiley & Sons, Inc. 1981. Например, приемлемым способом удаления защитной группы, когда защитная группа представляет собой 2-(триметилсилил)этоксиметил, является использование тетрабутиламмонийфторида в приемлемом инертном органическом растворителе (например, тетрагидрофуране (ТГФ), гексаметилфосфорамиде (ГМФА), любой пригодной смеси приемлемых растворителей и т.д., предпочтительно в ТГФ) при 10-65oC, обычно при 20-25oC и предпочтительно приблизительно при 25oC в течение 8-24 часов (более подробно описано ниже в примере 27). Удаление защитной группы, когда защитная группа является метоксиметилом, может быть осуществлено с помощью концентрированной соляной кислоты в пригодном растворителе, обычно смеси вода/спирт (9:1-1:9) (например, вода/метанол, /этанол, /изопропанол, /любая пригодная смесь приемлемых спиртов и т.д.) и предпочтительно в воде/изопропаноле (7:1) при 20-100oC, обычно при 70-90oC и предпочтительно приблизительно при температуре кипения с обратным холодильником в течение 2-14 часов.
Кроме того, любые гидроксильные группы, присутствующие в соединении формулы 2 или 3, должны быть защищены с помощью приемлемой защитной группы (например, бензила, пара-метоксибензила, 1-нафтилметила и т.д., предпочтительно бензила). Приемлемым способом удаления бензильной защитной группы, защищающей гидроксигруппу, является каталитическая гидрогенизация. Гидрогенизацию проводят с помощью пригодного катализатора (например, 10%-ного палладия на древесном угле (10% Pd/C), гидроксида палладия, ацетата палладия и т. д. , предпочтительно 10%-ного Pd/C)в присутствии формиата аммония и в приемлемом растворителе, обычно в спирте (например, этаноле, метаноле, изопропаноле, любой пригодной смеси спиртов и т.д.) и предпочтительно в метаноле при 50-66oC, обычно при 63-66oC и предпочтительно при температуре кипения с обратным холодильником. В другом варианте бензильную группу удаляют с помощью обработки защищенного соединения катализатором в атмосфере водорода при давлении 0-50 фунтов/кв.дюйм, обычно при 10-20 фунтов/кв.дюйм и предпочтительно приблизительно при 15 фунтов/кв.дюйм при 20-50oC, обычно при 23-27oC и предпочтительно при 25oC.
В другом варианте соединения формулы I могут быть получены с помощью процесса, изображенного на следующей реакционной схеме II:
где L обозначает отщепляемую группу и каждый из радикалов R1, R2, R3, R4 и R5 имеет значения, указанные в кратком изложении сущности изобретения для формулы I.
Альтернативный способ получения соединений формулы I включает алкилирование соединения формулы H-R5 (формула 4) или его защищенного производного с помощью соединения формулы 5 с последующим удалением защитной группы в случае необходимости. Алкилирование выполняют в присутствии пригодного основания (например, карбоната натрия, фторида тетрабутиламмония, хлорида бензилтриметиламмония с гидроксидом натрия, гидроксида тетрабутиламмония, карбоната калия, карбоната цезия, гидрида натрия и т.д., предпочтительно карбоната калия) в приемлемом инертном органическом растворителе (например, ДМФ, ТГФ, ацетонитриле, смесях толуола и воды, любой пригодной смеси приемлемых растворителей и т.д., предпочтительно в ТГФ) при 10-40oC, обычно при 20-25oC и предпочтительно приблизительно при 20oC в течение 1-24 часов (более подробно описано ниже в примерах 30 и 31). Удаление защитной группы осуществляют аналогично описанному выше в отношении реакционной схемы I.
В другом варианте алкилирование соединения формулы 4 осуществляют с помощью обработки соединения формулы 4 приемлемым силилирующим агентом (например, 1,1,1,3,3,3-гексаметилдисилазаном (ГМДС), N,O-бис-триметилсилилацетамидом, гексаметилсилоксаном и т.д., предпочтительно ГМДС) в пригодном инертном органическом растворителе (например, трифторметансульфоновой кислоте, ДМФ, МП, ТГФ, ДМЭ, толуоле, любой пригодной смеси приемлемых растворителей и т. д. , предпочтительно в трифторметансульфоновой кислоте) при 100-180oC, обычно при 150-180oC и предпочтительно приблизительно при 90oC в течение 6-24 часов и затем подвергают взаимодействию с 1 молярным эквивалентом чистого соединения формулы 5 или в приемлемом инертном органическом растворителе (например, трифторметансульфоновой кислоте, безводном бензоле, толуоле, 1,2-дихлорбензоле, любой пригодной смеси приемлемых растворителей и т. д. , предпочтительно в трифторметансульфоновой кислоте) при 60-150oC, обычно при 60-110oC и предпочтительно приблизительно при 70oC в течение 0,25-15 часов. С помощью описанного выше процесса получали следующее соединение формулы I: фумарат 1-(3-{4-[2-метоксифенил]пиперазин-1-ил}пропил)-5,6-диметил- 2,4(1H, 3H)-пиримидиндиона, tпл 216-218oC; анализ: рассчитано для C20H28N4O3•C2H2O2: C 59,01; H 6,60; N 11,47%; обнаружено: C 58,95; H 6,61; N 11,36%.
Соединения формулы 2
Соединения формулы 2 являются коммерчески доступными или могут быть получены с помощью способов, известных обычным специалистам в данной области техники. Например, соединения формулы 2 могут быть получены путем взаимодействия соединения формулы 6: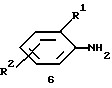
где каждый из радикалов R1 и R2 имеет значения, указанные в кратком изложении сущности изобретения для формулы I, с бис(хлорэтил)амингидрохлоридом. Реакция может быть выполнена в присутствии приемлемого основания, обычно азотистого основания (например, триэтиламина, N, N-диизопропилэтиламина и т. д. ) или основной соли угольной кислоты (например, карбоната калия, карбоната натрия, карбоната цезия и т.д., предпочтительно карбоната калия) и необязательно в присутствии соли йодистоводородной кислоты (например, йодида натрия, йодида лития, йодидов тетраалкиламмония, таких как йодид тетраметиламмония и т.п., и т.д., предпочтительно йодида натрия) в пригодном инертном органическом растворителе (например, н-бутаноле, трет-бутаноле, 2-метоксиэтиловом эфире (диглиме), 2-этоксиэтаноле, ксилоле, любой приемлемой смеси пригодных растворителей и т.д., предпочтительно в диглиме) при 110-170oC, обычно при 140-165oC и предпочтительно при температуре кипения с обратным холодильником в течение 2-24 часов (более подробно описано ниже в примере 13). В альтернативном варианте реакция может быть выполнена без добавок при 150-300oC, обычно при 180-200oC и предпочтительно приблизительно при 180oC в течение 2-5 часов.
Предпочтительно реакцию осуществляют взаимодействием бис(хлорэтил)амингидрохлорида с кислотно-аддитивной солью соединения формулы 6, предпочтительно с солью соляной кислоты в пригодном растворителе (например, ксилолах, диглиме, орто-дихлорбензоле, н-гексаноле, любой пригодной смеси приемлемых растворителей и т.д., предпочтительно в орто-дихлорбензоле/н-гексаноле (10:1)) при 140-180oC, обычно при 160-180oC и предпочтительно при температуре кипения с обратным холодильником в течение 1-8 часов (более подробно описано ниже в примере 14).
Соединения формулы 2 также могут быть получены путем взаимодействия соединения формулы 7: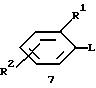
где L обозначает отщепляемую группу, обычно атом галогена и предпочтительно фтора, и каждый радикал R1 и R2 имеет значения, указанные в кратком изложении сущности изобретения для формулы I, с необязательно защищенным 1-металлированным пиперазином, обычно с защищенным 1-пиперазинидом лития и предпочтительно 4-бензил-1-пиперазинидом лития с последующим удалением защитной группы. Защищенный 1-металлированный пиперазин получают с помощью охлаждения раствора защищенного пиперазина в пригодном инертном органическом растворителе, предпочтительно в простом эфире (например, в ТГФ, диэтиловом эфире, моноглиме, диглиме, любой приемлемой смеси пригодных растворителей и т. д. , предпочтительно в ТГФ) до температуры в диапазоне от -70 до 10oC, обычно до температуры в диапазоне от -35 до 5oC и предпочтительно до приблизительно 0oC, добавляя металлорганическое основание, обычно алкилметаллическое основание и предпочтительно алкил щелочного металла (например, н-бутиллитий, н-бутилнатрий, н-бутилкалий и т.д., предпочтительно н-бутиллитий) с такой скоростью, чтобы температура реакции поддерживалась на уровне ниже 15oC, предпочтительно ниже 5oC, и затем давая реакции протекать при температуре от -70 до 45oC, обычно при температуре от -10 до 35oC и предпочтительно приблизительно при 25oC в течение промежутка времени от 10 минут до 1 часа.
Взаимодействие с соединением формулы 7 осуществляют путем охлаждения раствора, содержащего 1-металлированный пиперазин, до температуры от -60 до 15oC, обычно до температуры от -45 до 10oC и предпочтительно приблизительно до 0oC, добавляя соединение формулы 7 и затем давая реакции протекать при температуре от -10 до 30oC, обычно при 15-25oC и предпочтительно приблизительно при 25oC в течение промежутка времени от 30 минут до 48 часов. Пригодным способом удаления защитной группы, когда защитная группа представляет собой бензил, является обработка приемлемым катализатором (например, 10%-ным палладием на древесном угле (10% Pd/C), гидроксидом палладия, ацетатом палладия и т.д., предпочтительно 10%-ным Pd/C) в атмосфере водорода при давлении 0-50 фунтов/кв. дюйм, обычно при 10-20 фунтов/кв.дюйм и предпочтительно приблизительно при 15 фунтов/кв.дюйм и в пригодном растворителе, обычно в спирте (например, в этаноле, метаноле, изопропаноле, любой приемлемой смеси спиртов и т.д., предпочтительно в метаноле) при 20-50oC, обычно при 23-27oC и предпочтительно при 25oC. Более подробно стадии реакции, описанные в этом и предыдущем абзаце, приведены в примере 16 ниже.
Пригодный способ получения соединения формулы 2, где R1 обозначает пиррол-1-ил, включает взаимодействие защищенного 4-(2-аминофенил)пиперазина, предпочтительно 4-(2-аминофенил)пиперазин-1-карбальдегида с 2,5-диметокситетрагидрофураном и последующее удаление защитной группы. Взаимодействие с 1-карбальдегидом проводят в пригодном растворителе, обычно кислоте (например, концентрированной уксусной кислоте, пропионовой кислоте, трифторуксусной кислоте, любой пригодной смеси приемлемых кислот и т.д., предпочтительно в концентрированной уксусной кислоте) при 100-150oC, обычно при 110-120oC и предпочтительно при температуре кипения с обратным холодильником в течение 1-3 часов. Удаление защитной группы может быть осуществлено с помощью сильного основания (например, гидроксида натрия, гидроксида лития, гидроксида калия, любой пригодной смеси оснований и т.д., предпочтительно гидроксида натрия) в приемлемом растворителе, обычно в спирте (например, в этаноле, метаноле, изопропаноле, любой пригодной смеси спиртов и т.д., предпочтительно в метаноле) при 20-65oC, обычно при 50-55oC и предпочтительно приблизительно при 50oC в течение 3-6 часов.
4-(2-аминофенил)пиперазин-1-карбальдегид может быть получен путем взаимодействия 1-хлор-2-нитробензола с пиперазин-1-карбальдегидом, что приводит к получению 4-(2-нитрофенил)пиперазин-1-карбальдегида, и последующего восстановления. Реакцию между 1-карбальдегидом и 2-нитробензолом проводят в приемлемом растворителе (например, ДМФ, МП, ацетонитриле, любой пригодной смеси приемлемых растворителей и т.д., предпочтительно в ДМФ) при 50-100oC, обычно при 60-80oC и предпочтительно приблизительно при 100oC в течение 20-50 часов. Восстановление может быть осуществлено с помощью пригодного химического восстановителя (например, борида никеля, хлорида олова и т.д., предпочтительно борида никеля) в пригодном растворителе, обычно в спирте (например, этаноле, метаноле, изопропаноле, любой пригодной смеси спиртов и т. д. , предпочтительно в метаноле) при 20-65oC, обычно при 50-65oC и предпочтительно приблизительно при 60oC в течение 1-20 часов. В другом варианте восстановление может быть осуществлено в атмосфере водорода при давлении 0-50 фунтов/кв.дюйм, обычно при 10-20 фунтов/кв.дюйм и предпочтительно приблизительно при 15 фунтах/кв.дюйм с использованием приемлемого катализатора (например, 10%-ного палладия на древесном угле (10% Pd/C), гидроксида палладия, ацетата палладия и т.д., предпочтительно 10%-ного Pd/C)и в пригодном растворителе, обычно в спирте (например, в этаноле, метаноле, изопропаноле, любой приемлемой смеси спиртов и т.д., предпочтительно в метаноле) при 20-50oC, обычно при 23-27oC и предпочтительно при 25oC в течение 5-40 часов. Более подробно стадии реакции, описанные в этом и предыдущем абзаце, приведены ниже в примере 17.
Приемлемый способ получения соединения формулы 2, в котором R2 обозначает гидрокси, включает деметилирование соединения формулы 2, в котором R2 обозначает метокси. Деметилирование осуществляют путем нагревания в пригодной водной кислоте (например, водной бромистоводородной кислоте, пиридингидрохлориде, любой пригодной смеси приемлемых кислот, и т.д., предпочтительно в водной бромистоводородной кислоте) при 100-200oC, обычно при 120-140oC и предпочтительно при температуре кипения с обратным холодильником в течение 5-20 часов (более подробно описано ниже в примере 18).
Соединения формулы 3
Обычно соединения формулы 3 могут быть получены алкилированием соединения формулы H-R5 (формула 4) или его защищенного производного, соединением формулы 8:
в котором каждый символ L обозначает отщепляемую группу и R3 и R4 имеют значения, указанные в кратком изложении сущности изобретения для формулы I, и последующего удаления при необходимости защитной группы. Взаимодействие осуществляют в присутствии пригодного основания (например, галогенида тетраалкиламмония, такого как фторид тетра-н-бутиламмония, бромида тетра-н-бутиламмония, хлорида бензилтриметиламмония и т.п., гидроксида тетраалкиламмония, хлорида тетраалкиламмония с гидроксидом калия, карбоната калия и т.д. , предпочтительно бромида тетра-н-бутиламмония)и в пригодном инертном органическом растворителе (например, ТГФ, ДМФ, ацетонитриле, смесях толуола и воды, любой приемлемой смеси пригодных растворителей и т.д., предпочтительно в ДМФ) при 10-40oC, обычно при 20-30oC и предпочтительно приблизительно при 25oC в течение 1-24 часов (более подробно описано ниже в примере 19). Алкилирование может быть выполнено в отношении одного из двух или обоих вторичных атомов азота кольца, присутствующих в соединении формулы 3. Приемлемая защитная группа азота может определять направление алкилирования. Соответствующими защитными группами являются метоксиметил, 2-(триметилсилил)этоксиметил, трет-бутилоксикарбонил, бензилоксикарбонил и т. д. , предпочтительно метоксиметил. Удаление защитной группы осуществляют в соответствии с методикой, описанной выше для реакционной схемы I (более подробно описано ниже в примере 20).
Соединения формулы 3, в которых R6 обозначает водород, могут быть получены с помощью дебензилирования соответствующего соединения формулы 3, в котором R6 обозначает бензил. Дебензилирование проводят с помощью формиата аммония в присутствии палладиевого катализатора (например, 10%-ного палладия на древесном угле (10%-ного Pd/C), увлажненного 20%-ного гидроксида палладия на древесном угле, палладиевой черни и т.д., предпочтительно 10%-ного Pd/C) и в пригодном растворителе, обычно в спирте (например, метаноле, этаноле, 2-этоксиэтаноле, любой приемлемой смеси пригодных спиртов и т.д., предпочтительно в метаноле) при 50-66oC, обычно при 62-66oC и предпочтительно при температуре кипения с обратным холодильником в течение 3-96 часов (более подробно описано ниже в примере 21).
Соединения формулы 3, где R5 обозначает группу формулы (a), в которой R6 обозначает C1-C6алкил, C3-C6циклоалкил, C3-C6циклоалкилC1-C4алкил или группу, выбранную из арилC1-C4алкила и гетероарилC1-C4алкила (кроме того, указанные арил и гетероарил необязательно замещены одним-тремя радикалами, выбранными из галогена, циано, C1-C6алкилокси, C1-C6алкила и арила), могут быть получены путем взаимодействия соответствующего соединения формулы 3, где R6 обозначает водород, с одним молярным эквивалентом соответствующего алкилирующего агента (например, йодметана, бензилбромида, 4-метилбензилбромида, циклогексилметилбромида, пиразин-2-илметилбромида, тиен-2-илметилбромида, фур-3-илметилбромида, бифенил-2-илметилбромида и т.д. в присутствии приемлемого основания (например, карбоната натрия, карбоната калия, карбоната цезия, гидрида натрия и т.д., предпочтительно карбоната калия). Реакцию проводят в пригодном растворителе (например, в ДМФ, МП, ТГФ, ДМЭ, любой приемлемой смеси пригодных растворителей и т.д., предпочтительно в ДМФ) при 22-70oC, обычно при 40-65oC и предпочтительно приблизительно при 40oC в течение 5-24 часов.
Соединения формулы 3, где L обозначает гидрокси и R3 и R4 вместе обозначают этилен, могут быть получены путем гидролиза соответствующего 3- или 1-(1-цианциклопроп-1- илметил)-2,4(1H, 3H)-пиримидиндиона или 1-(1-цианциклопроп-1-илметил)-2,4,6(1H, 3H, 5H)-пиримидинтриона соответственно для получения соответствующей 1-циклопропанкарбоновой кислоты, взаимодействия карбоновой кислоты с метилхлорформиатом для получения соответствующего метоксикарбонилкарбоксилата и последующего восстановления карбоксилата. Гидролиз может быть осуществлен с помощью нагревания нитрила с кислотой (например, с концентрированной соляной кислотой, уксусной кислотой, серной кислотой, трифторуксусной кислотой, любой приемлемой смесью пригодных кислот и т.д., обычно смесью концентрированной уксусной кислоты и концентрированной соляной кислоты и предпочтительно смесью приблизительно 20%-ной (объем/объем) уксусной кислоты/концентрированной соляной кислоты) при 50-150oC, обычно при 100-120oC и предпочтительно при температуре кипения с обратным холодильником в течение 1-5 часов.
Превращение карбоновой кислоты в метоксикарбонилкарбоксилат проводят в приемлемом инертном органическом растворителе (например, в ТГФ, метиленхлориде, 1,2-дихлорэтане, простом эфире, любой приемлемой смеси пригодных растворителей и т. д. , предпочтительно в ТГФ) в атмосфере инертного газа (например, аргона, азота и т.д.) при температуре от -20 до 20oC, обычно при 0-10oC и предпочтительно приблизительно при 0oC в течение 0,2-2 часов. Восстановление карбоксилата может быть осуществлено с помощью приемлемого химического восстановителя (например, борогидрида натрия, борогидрида лития и т. д. , предпочтительно борогидрида натрия) при 0-25oC, обычно при 10-20oC и предпочтительно приблизительно при 20oC в течение 1-3 часов. Соединения формулы 3, где L обозначает метансульфонилокси и R3 и R4 вместе обозначают этилен, могут быть получены путем обработки соответствующего соединения формулы 3, где L обозначает гидрокси, метансульфонилхлоридом в приемлемом инертном органическом растворителе (например, в метиленхлориде, дихлорэтане, пиридине, любой приемлемой смеси пригодных растворителей и т.д., предпочтительно в метиленхлориде) при 0-25oC, обычно при 0-10oC и предпочтительно приблизительно при 0oC в течение 0,5-2 часов.
Соответствующие 3- и 1-(1-цианциклопроп-1-илметил)-2,4(1H,3H)-пиримидиндионы или 1-(1-цианциклопроп-1-илметил)-2,4,5(1H,3H,5H)-пиримидинтрионы получают путем алкилирования 1-цианциклопроп-1-илметилметансульфонатом соединения формулы H-R5 или его защищенного производного. Алкилирование проводят в присутствии основания (например, гидрида натрия, гидрида калия, карбоната калия, гексаметилдисилазида лития и т.д., предпочтительно гидрида натрия) в приемлемом инертном органическом растворителе (например, ДМФ, ТГФ, ацетонитриле, любой приемлемой смеси пригодных растворителей и т.д., предпочтительно в ДМФ) при 20-70oC, обычно при 50-60oC и предпочтительно приблизительно при 50oC в течение 4-24 часов.
1-цианциклопроп-1-илметилметансульфонат получают путем обработки 1-цианциклопроп-1-илметанола метансульфонилхлоридом в приемлемом инертном органическом растворителе (например, в метиленхлориде, дихлорэтане, пиридине, любой приемлемой смеси пригодных растворителей и т.д., предпочтительно в метиленхлориде) при 0-25oC, обычно при 0-10oC и предпочтительно приблизительно при 0oC в течение 0,5-2 часов.
1-цианциклопроп-1-илметанол получают превращением 1-цианпропан-1-карбоновой кислоты в метоксикарбонил-1-цианпропан-1-карбоксилат и последующим восстановлением карбоксилата. Превращение карбоновой кислоты в метоксикарбонилкарбоксилат, равно как и его последующее восстановление до соответствующего спирта, выполняют способом, аналогичным описанному выше при получении соединений формулы 3 из соответствующей 1-циклопропанкарбоновой кислоты. Более подробно стадии реакции, описанные в данном и трех предыдущих абзацах, приведены ниже в примере 22.
1-цианциклопропан-1-карбоновую кислоту получают взаимодействием 1,2-дибромэтана с этилцианацетатом. Реакцию проводят в присутствии водного гидроксида четвертичного аммония (например, гидроксида триэтилбензиламмония, гидроксида тетрабутиламмония и т.д., предпочтительно гидроксида триэтилбензиламмония) при 0-50oC, обычно при 10-30oC и предпочтительно приблизительно при 22oC в течение 0,5-2 часов (более подробно см. у R.K. Singh, S. Danishefsky, J. Org. Chem. (1975)40, 2969).
N-оксиды соединений формулы 3 могут быть получены путем обработки неокисленной формы соединения формулы 3 окислителем (например, трифторперуксусной кислотой, пермалеиновой кислотой, пербензойной кислотой, перуксусной кислотой, 3-хлорпероксибензойной кислотой и т.д.) в приемлемом инертном органическом растворителе (например, в галогенированном углеводороде, таком как метиленхлорид) при температуре от -10 до 25oC, обычно при 0-10oC и предпочтительно приблизительно при 0oC в течение 1-14 часов (более подробно описано ниже в примере 23).
Соединения формулы 4
Соединения формулы 4 являются коммерчески доступными или могут быть получены способами, известными обычным специалистам в данной области техники. Например, соединения формулы 4, где R6 обозначает водород, могут быть получены путем взаимодействия эфира уксусной кислоты формулы R7CH2C(O)OR, где R7 имеет значения, указанные в кратком изложении сущности изобретения для формулы I (например, этилизовалерата, метилметоксиацетата и т.д.) с этилформиатом для получения соответствующего 3-оксопропионата, взаимодействия 3-оксопропионата с тиомочевиной для получения соответствующего 2-тиоксо-4(1H, 3H)-пиримидинона и последующего превращения тиоксопиримидинона в соответствующий пиримидиндион. Взаимодействие между эфиром уксусной кислоты и этилформиатом проводят в присутствии приемлемого основания (например, натрия, гидрида натрия, гидрида калия, этоксида натрия и т.д.) в приемлемом растворителе (например, диэтиловом эфире, этаноле, ТГФ, любой приемлемой смеси пригодных растворителей и т.д., предпочтительно в диэтиловом эфире) при температуре от -10 до 40oC, обычно при 0-25oC и предпочтительно приблизительно при 10oC в течение 20-90 часов. Взаимодействие с тиомочевиной проводят в приемлемом растворителе, обычно спирте (например, этаноле, метаноле, изопропаноле, любой приемлемой смеси пригодных спиртов и т.д., предпочтительно в этаноле) при 20-100oC, обычно при 50-80oC и предпочтительно приблизительно при 75oC в течение 1-10 часов. Превращение тиоксопиримидинона в пиримидиндион осуществляют с помощью водной кислоты (например, концентрированной соляной кислоты) в приемлемом растворителе (например, воде, этаноле, ДМСО, любой приемлемой смеси пригодных растворителей и т.д.) при 50-120oC, обычно при 70-110oC и предпочтительно приблизительно при 100oC в течение 2-12 часов (более подробно описано ниже в примере 2).
Соединения формулы 4, где R5 обозначает группу формулы (a), в которой R6 обозначает C1-C6алкил, C3-C6циклоалкил, C3-C6циклоалкилC1-C4алкил или группу, выбранную из арилC1-C4алкила и гетероарилC1-C4алкила (кроме того, указанные арил и гетероарил необязательно замещены одним-тремя радикалами, выбранными из галогена, циано, C1-C6алкилокси, C1-C6алкила и арила), могут быть получены путем взаимодействия соответствующего соединения формулы 4, где R6 обозначает водород с одним молярным эквивалентом соответствующего алкилирующего агента в присутствии приемлемого основания. Взаимодействие осуществляют в соответствии с методикой, описанной выше для алкилирования соединения формулы 3, где R6 обозначает водород (более подробно описано ниже в примере 5).
В другом варианте соединения формулы 4, где R5 обозначает группу формулы (a), в которой R6 обозначает C1-C6алкил, гетероциклоC1-C4алкил, арилC1-C4алкил или гетероарилC1-C4алкил и определенные защищенные производные соединений формулы 4, где R5 обозначает группу формулы (a), могут быть получены с помощью обработки соответствующего соединения формулы 4, где R6 обозначает водород, соответствующим силилирующим агентом (например, 1,1,1,3,3,3-гексаметилдисилазаном (ГМДС), N,O-бис-триметилсилилацетамидом, гексаметилсилоксаном и т. д. , предпочтительно ГМДС) в приемлемом инертном органическом растворителе (например, трифторметансульфоновой кислоте, ДМФ, МП, ТГФ, ДМЭ, толуоле, любой приемлемой смеси пригодных растворителей и т.д. , предпочтительно в трифторметансульфоновой кислоте) при 100-180oC, обычно при 150-180oC и предпочтительно приблизительно при 90oC в течение 6-24 часов и последующего взаимодействия с 1 молярным эквивалентом алкилирующего агента (например, метоксиметилацетата, бензилбромида и т.д.), чистого или в приемлемом инертном органическом растворителе (например, трифторметансульфоновой кислоте, безводном бензоле, толуоле, 1,2-дихлорбензоле, любой приемлемой смеси пригодных растворителей и т.д., предпочтительно в трифторметансульфоновой кислоте) при 60-150oC, обычно при 60-110oC и предпочтительно приблизительно при 70oC в течение 0,25-15 часов (более подробно описано ниже в примере 6).
Соединения формулы 4, где R5 обозначает группу формулы (a), в которой R7 обозначает циано, могут быть получены путем взаимодействия (Z)-1-циан-2-этокси-N-этоксикарбонилакриламида с соединением формулы NH2R6 или его защищенным производным, где R6 имеет значения, указанные в кратком изложении сущности изобретения для формулы 1. Реакцию осуществляют в приемлемом растворителе (например, воде, этаноле, 2-метоксиэтаноле, любой приемлемой смеси пригодных растворителей и т.д., предпочтительно в воде) при 30-100oC, обычно при 50-70oC и предпочтительно приблизительно при 60oC в течение 0,1-2 часов (более подробно описано ниже в примере 1).
Защищенные соединения формулы 4, где R5 обозначает группу формулы (a), могут быть получены путем взаимодействия соответствующего соединения формулы 4, где R6 обозначает водород, с соответствующим защитным агентом (например, 2-(триметилсилил)этоксиметилхлоридом, ди-трет-бутилдикарбонатом и т.д.). Например, защищенное соединение формулы 4, в котором защитная группа является 2-(триметилсилил)этоксиметилом, может быть получено путем взаимодействия незащищенного соединения с 2-(триметилсилил)этоксиметилхлоридом в присутствии приемлемого основания (например, диизопропилэтиламина, диэтиланилина, карбоната калия, гидрида натрия и т. д., предпочтительно гидрида натрия) в приемлемом растворителе (например, метиленхлориде, ТГФ, ДМФ, МП и т.д., предпочтительно в ДМФ) при 0-30oC, обычно при 20-30oC и предпочтительно приблизительно при 22oC в течение 1-16 часов (более подробно описано ниже в примере 7).
Соединение формулы 4, где R5 обозначает группу формулы (a), в которой Z обозначает C(R9), R7 и R9 вместе обозначают -(CH2)4- и R9 обозначает водород (т. е. 5,6,7,8-тетрагидро-2,4(1H,3H)-хиназолиндион), может быть получено путем гидролиза 4-этокси-5,6,7,8-гексагидро-2(3H)-хиназолинона. Гидролиз выполняют с помощью кислоты (например, соляной кислоты) в приемлемом растворителе, обычно в спирте (например, этаноле, метаноле, изопропаноле, любой приемлемой смеси спиртов и т.д., предпочтительно в этаноле) при 50-85oC, обычно при 60-70oC и предпочтительно приблизительно при 65oC в течение 0,5-5 часов (более подробно см. у C. Bischoff и E. Schroder, J. f. pract. Chemie 1985, 327, 129-132). 4-этокси-5,6,7,8-гексагидро-2(3H)-хиназолинон получают путем взаимодействия этил-2-оксоциклогексанкарбоксилата с цианамидом. Реакцию с цианамидом проводят в приемлемом растворителе, обычно в спирте (например, этаноле, метаноле, изопропаноле, любой приемлемой смеси спиртов и т. д. , предпочтительно в этаноле) при 25-100oC, обычно при 50-80oC и предпочтительно приблизительно при 75oC в течение 1-40 часов.
Соединения формулы 4, где R5 обозначает группу формулы (b), могут быть получены путем алкилирования соответствующего соединения формулы P-R5, где P обозначает защитную группу (например, бензил, 2-(триметилсилил)этоксиметил, трет-бутилоксикарбонил и т. д.) и R5 обозначает группу формулы (b), где R6 обозначает водород, соответствующим алкилирующим агентом (например, йодметаном, бензилбромидом, 4-метилбензилбромидом, циклогексилметилбромидом, пиразин-2-илметилбромидом, тиен-2-илметилбромидом, фур-3-илметилбромидом, бифенил-2-илметилбромидом и т.д.) и последующего удаления защитной группы. Аналогичным способом соединение формулы 4, где R5 обозначает группу формулы (b) и R6 обозначает бензил, может быть получено путем алкилирования соответствующего соединения формулы 4, где R6 обозначает водород, бензилбромидом и последующего удаления защитной группы.
Алкилирование осуществляют по крайней мере с 2 молярными эквивалентами алкилирующего агента в присутствии избыточного количества приемлемого основания (например, карбоната натрия, карбоната калия, карбоната цезия, гидрида натрия и т.д., предпочтительно гидрида натрия) и в приемлемом растворителе (например, ДМФ, МП, ТГФ, ДМЭ, любой приемлемой смеси пригодных растворителей и т. д. , предпочтительно в ДМФ) при 20-80oC, обычно при 30-50oC и предпочтительно приблизительно при 50oC в течение 4-40 часов.
Удаление защитной группы может быть осуществлено любыми способами, позволяющими удалить защитную группу без удаления радикала, обозначенного как R6. Например, удаление защитной группы, когда защитная группа является бензилом, может быть осуществлено в условиях, сходных с описанными выше для дебензилирования соединения формулы 3, где R6 обозначает бензил (более
подробно описано ниже в примере 9). Удаление защитной группы, когда защитная группа является 2-(триметилсилил)этоксиметилом, может быть осуществлено в условиях, описанных выше для удаления защитной группы защищенного аналогичным образом соединения формулы I.
Соединения формулы 4, где R7 обозначает гидроксиметил, могут быть получены путем взаимодействия соответствующего соединения формулы 4, где R7 обозначает водород, с параформальдегидом. Реакцию выполняют в присутствии водного основания (например, водного гидроксида натрия, водного гидроксида калия и т.д.) при 20-100oC, обычно при 40-60oC и предпочтительно приблизительно при 50oC в течение 40-90 часов (более подробно описано ниже в примере 3).
Соединения формулы 4, где R7 обозначает гидроксииминометил, могут быть получены путем превращения соответствующего соединения формулы 4, где R7 обозначает водород, в производное 2,4-диоксо-5(1H,3H)-пиримидинкарбальдегида с помощью модифицированной реакции Раймера-Тимана (см. Gupta V.S. и Huennekens F. M. (1967), Biochemistry, 6(7), 2168) и последующего взаимодействия карбальдегида с гидроксиламингидрохлоридом. Превращение в карбальдегид выполняют с хлороформом в присутствии водного гидроксида натрия при 10-100oC, обычно при 60-80oC и предпочтительно при температуре кипения с обратным холодильником в течение 0,5-15 часов. Реакцию с гидроксиламингидрохлоридом проводят в присутствии ацетата калия в приемлемом растворителе (например, в воде, метаноле, смеси вода/метанол (1:1), любой приемлемой смеси пригодных растворителей и т.д., предпочтительно в смеси вода/метанол (1:1)) при 20-100oC, обычно при 60-90oC и предпочтительно при температуре кипения с обратным холодильником в течение 0,2-5 часов. (Более подробно стадии указанной выше реакции представлены ниже в примере 4).
Соединения формулы 4, где R6 обозначает необязательно замещенный арил или гетероарил, могут быть получены путем взаимодействия соединения формулы 4, где R6 обозначает водород, с соответствующим алкилирующим агентом (например, 1-фтор-4-йодбензолом, бромбензолом, 2-бромпиридином и т.д.) в присутствии соответствующего источника меди (например, оксида меди (I), медной бронзы, бромида меди (I) и т.д., предпочтительно оксида меди (I)) в приемлемом инертном органическом растворителе (например, 2,4,6-триметилпиридине, диэтиланилине, МП, любой приемлемой смеси пригодных растворителей и т. д. , предпочтительно в 2,4,6-триметилпиридине) при 100-180oC, обычно при 150-175oC и предпочтительно при температуре кипения с обратным холодильником в течение 4-20 часов (более подробно описано ниже в примере 8).
Соединения формулы 4, где R5 обозначает группу формулы (c), где X обозначает C(O), могут быть получены путем взаимодействия соединения формулы H2NC(O)NHR6 (например, мочевины, бензилмочевины и т.д.) с алкилмалонатом формулы (R8)2C(COOR)2, где каждый радикал R6 и R8 имеет значения, указанные в кратком изложении сущности изобретения для формулы I. Реакцию проводят в присутствии основания (например, метоксида натрия, трет-бутоксида калия, гидрида натрия и т.д., предпочтительно метоксида натрия) в приемлемом растворителе, обычно в спирте (например, этаноле, метаноле, изопропаноле, любой приемлемой смеси спиртов и т.д., предпочтительно в метаноле) при 50-100oC, обычно при 60-70oC и предпочтительно при температуре кипения с обратным холодильником (более подробно описано ниже в примере 10).
Соединения формулы 5
Соединения формулы 5 получают в основном путем взаимодействия соединения формулы 2 с соединением формулы 8. Реакцию осуществляют в присутствии приемлемого основания (например, карбоната натрия, карбоната калия, карбоната цезия, гидрида натрия и т.д., предпочтительно карбоната калия) в приемлемом инертном органическом растворителе (например, ацетонитриле, ДМФ, МП, любой приемлемой смеси пригодных растворителей и т.д., предпочтительно в ацетонитриле) при 50-85oC, обычно при 70-80oC и предпочтительно при температуре кипения с обратным холодильником в течение 2-16 часов (более подробно описано ниже в примере 28).
Соединения формулы 5, где L обозначает гидрокси и оба радикала R3 и R4 обозначают метил, могут быть получены путем ацилирования соединения формулы 2 с помощью защищенного галогенида 3-гидрокси-2,2-диметилпропионила (например, хлорида 3-бензилокси-2,2-диметилпропионила) для получения соответствующего защищенного 3-гидрокси-2,2-диметил-1-(4-фенилпиперазин-1-ил)-1-пропанона и последующего восстановления и удаления защитной группы для получения соответствующего 2,2-диметил-3-(4-фенилпиперазин-1-ил)-1-пропанола. Ацилирование проводят в приемлемом растворителе (например, бензоле, метиленхлориде, любой приемлемой смеси пригодных растворителей и т.д.) и в течение 0,1-6 часов приблизительно при 0oC. Восстановление может быть осуществлено с помощью соответствующего химического восстановителя (например, алюмогидрида лития и т.д.) в приемлемом растворителе (например, ТГФ, любой приемлемой смеси пригодных растворителей и т.д.) в течение 1-30 часов при температуре кипения с обратным холодильником. Удаление защитной группы, когда защитная группа является бензилом, обычно выполняют с помощью каталитической гидрогенизации в условиях фазового переноса (например, с помощью формиата аммония, Pd/C и т. д.) в приемлемом растворителе, обычно в спирте (например, метаноле, любой приемлемой смеси пригодных спиртов и т.д.) в течение 2-14 часов при температуре кипения с обратным холодильником. 1-пропанол может быть превращен в соответствующий 1-хлор-2,2-диметил-3-(4-фенилпиперазин-1-ил)пропан путем взаимодействия с соответствующим галогенирующим агентом (например, пара-толуолсульфонилхлоридом и т.д.) в приемлемом растворителе (например, метиленхлориде, пиридине, любой приемлемой смеси пригодных растворителей и т.д.) в течение 0,1-12 часов приблизительно при 25oC.
Защищенный галогенид 3-гидрокси-2,2-диметилпропионила получают путем метилирования этилцианацетата для получения 2-циан-2-метилпропионовой кислоты, восстановления пропионовой кислоты и введения защитной группы для получения защищенного 3-гидрокси-2,2-диметилпропаннитрила, гидролиза защищенного 3-гидрокси-2,2-диметилпропаннитрила для получения защищенной 3-гидрокси-2,2-диметилпропионовой кислоты и последующего превращения пропионовой кислоты в соответствующий галогенангидрид. Метилирование может быть осуществлено с помощью соответствующего метилирующего агента (например, йодметана и т.д.) в присутствии основания (например, гидроксида триэтилбензиламмония и т. д.) в приемлемом растворителе (например, воде, любой приемлемой смеси пригодных растворителей и т.д.) в течение 1-12 часов приблизительно при 20oC. Восстановление проводят путем взаимодействия пропионовой кислоты с метилхлорформиатом в течение 0,1-2 часов при температуре от -5 до 0oC и последующего взаимодействия с соответствующим химическим восстановителем (например, с борогидридом натрия и т.д.) в приемлемом растворителе (например, ТГФ, любой приемлемой смеси пригодных растворителей и т.д.) в течение 1-4 часов приблизительно при 20oC. Защита в случае, когда защитная группа является бензилом, может быть осуществлена путем взаимодействия незащищенного 3-гидрокси-2,2- диметилпропаннитрила с бензилбромидом в течение 1-4 часов приблизительно при -5oC. Гидролиз может быть осуществлен с помощью водного основания (например, 10%-ного гидроксида натрия и т.д.) в приемлемом растворителе, обычно в спирте (например, в метаноле, любой приемлемой смеси пригодных спиртов и т.д.) в течение 2-12 часов при температуре кипения с обратным холодильником. Превращение галогенангидрида может быть осуществлено с помощью соответствующего галогенирующего агента (например, оксалилхлорида и т. д. ) в приемлемом растворителе (например, бензоле, метиленхлориде, любой приемлемой смеси пригодных растворителей и т.д.) в течение 1-6 часов приблизительно при 25oC. Более подробно стадии реакции, описанные в данном и предыдущем абзаце, представлены ниже в примере 29.
Соединения формулы 6
Соединения формулы 6 могут быть получены путем восстановления соответствующего нитробензола. Восстановление может быть осуществлено с помощью соответствующего химического восстановителя или путем каталитического гидрирования и его выполняют способом, аналогичным описанному выше для восстановления 4-(2-нитрофенил)-1-пиперазинкарбальдегида при получении соединения формулы 2, где R1 обозначает пиррол-1-ил. Приемлемые для получения соединений формулы 6 нитробензолы являются коммерчески доступными или могут быть получены способами, известными обычным специалистам в данной области техники. Например, приемлемые 2-оксинитробензолы могут быть получены путем взаимодействия 2-фторнитробензола с соответствующим спиртом (например, C1-C6спиртом, таким как метанол, этанол, 2,2,2-трифторэтанол и т. п.; C3-C6циклоспиртом, таким как циклопропилметанол, 2-циклогексилэтанол и т.п.; арилспиртом, таким как фенол и т.п.; арилC1-C4спиртом, таким как бензиловый спирт и т.п.; гетероспиртом, таким как 2-пиридинол и т.п.; гетероC1-C4спиртом, таким как 2-пиридинметанол и т.п.; и т.д.) в присутствии сильного основания (например, трет-бутоксида калия, гидрида натрия, гидрида калия, гексаметилдисилазида лития и т.д., предпочтительно трет-бутоксида калия). Реакцию проводят в приемлемом растворителе (например, 1,2-диметоксиэтане, ТГФ, трет-бутилметиловом эфире, любой приемлемой смеси растворителей и т. д. , предпочтительно в 1,2-диметоксиэтане) при температуре от -30 до 30oC, обычно при температуре от -20 до 20oC и предпочтительно приблизительно при -10oC в течение 0,2-2 часов (более подробно описано ниже в примере 11).
Альтернативно этому приемлемые 2-оксинитробензолы могут быть получены путем взаимодействия соответствующего 2-нитрофенола с соединением формулы R1-L, где L обозначает отщепляемую группу (обычно метансульфонилокси) и R1 обозначает 2-пропинил, группу, выбранную из C1-C6алкила, C3-C6циклоалкила и C3-C6циклоалкилC1-C4алкила (кроме того, указанная группа необязательно замещена одним-тремя атомами галогена), или группу, выбранную из арилC1-C4алкила и гетероарилC1-C4алкила (кроме того, указанные арил и гетероарил необязательно замещены одним-тремя радикалами, выбранными из галогена, циано, C1-C6алкилокси, C1-C6алкила и арила), в присутствии приемлемого основания, обычно азотистого основания (например, триэтиламина, N,N-диизопропилэтиламина и т.д.) или основной соли угольной кислоты (например, карбоната калия, карбоната натрия, карбоната цезия и т.д., предпочтительно карбоната калия) в приемлемом инертном органическом растворителе (например, ДМФ, МП, ТГФ, ДМСО, любой приемлемой смеси пригодных растворителей и т.д., предпочтительно в ДМФ) при 60-160oC, обычно при 140-160oC и предпочтительно приблизительно при 150oC в течение 10-24 часов (более подробно описано ниже в примере 12).
Соединения формулы 7
Соединения формулы 7 являются коммерчески доступными или могут быть получены способами, известными обычным специалистам в данной области техники. Например, соединение формулы 7, где L обозначает фтор, R1 обозначает оксазол-2-ил и R2 обозначает водород (т.е. 2-фтор-1-оксазол-2-илбензол), может быть получено путем взаимодействия хлорида 2-фторбензойной кислоты с гидробромидом 2-бромэтиламина для получения 2-фтор-1-(4,5-дигидрооксазол-2-ил)бензола и последующего окисления. Реакцию с гидробромидом 2-бромэтиламина проводят в присутствии приемлемого основания, обычно азотистого основания (например, триэтиламина, N, N-диизопропилэтиламина и т.д., предпочтительно триэтиламина) и в приемлемом растворителе (например, бензоле, метиленхлориде, ДМФ, толуоле, ТГФ, любой приемлемой смеси пригодных растворителей и т. д. , предпочтительно в бензоле) при 50-110oC, обычно при 100-110oC и предпочтительно при температуре кипения с обратным холодильником в течение 2-20 часов. Окисление может быть проведено с помощью соответствующего окислителя (например, гидрата пероксида никеля, диоксида марганца и т.д., предпочтительно гидрата пероксида никеля) в приемлемом растворителе (например, бензоле, метиленхлориде, 1,2-дихлорэтане, декалине, любой приемлемой смеси пригодных растворителей и т.д., предпочтительно в бензоле) при 20-150oC, обычно при 50-120oC и предпочтительно при температуре кипения с обратным холодильником в течение 2-40 часов. Более подробно стадии процесса, описанные в данном абзаце, представлены ниже в примере 15.
Дополнительные процессы
Соединения формулы I, где R5 обозначает группу формулы (c), в которой X обозначает CH(OH) и один из радикалов R8 обозначает цис-гидрокси, или группу формулы (d), в которой один из радикалов R8 обозначает цис-гидрокси, могут быть получены путем гидроксилирования соответствующего соединения формулы I, где R5 обозначает соответственно группу формулы (a) или (b), где Z обозначает CH. Гидроксилирование может быть осуществлено путем обработки кислотой (например, муравьиной кислотой, трифторуксусной кислотой и т.д.) и N-бромсукцинимидом в соответствующем водном растворителе (например, в водных смесях с соотношением от 9:1 до 1:9 ДМСО, ДМФ и т.д., предпочтительно в смеси 5: 1 ДМСО/вода) при 0-40oC, обычно при 10-25oC и предпочтительно приблизительно при 20oC в течение 4-24 часов с последующей нейтрализацией до pH 7-8 путем обработки приемлемым водным основанием (например, водным бикарбонатом натрия, бикарбонатом калия, вторичным кислым фосфатом натрия и т.д., предпочтительно водным бикарбонатом натрия) при температуре от -10 до 30oC, предпочтительно приблизительно при 10oC в течение 10-30 минут (более подробно описано ниже в примере 35).
Соединения формулы I, где R6 обозначает водород, могут быть получены путем дебензилирования соединения формулы I, где R обозначает бензил. Дебензилирование проводят в условиях, аналогичных описанным выше для дебензилирования соединения формулы 3(a), где R6 обозначает бензил (более подробно описано ниже в примере 32).
Соединения формулы I, где R6 обозначает C1-C6алкил, C3-C6циклоалкил, C3-C6циклоалкилC1-C4алкил или группу, выбранную из арилC1-C4алкила и гетероарилC1-C4алкила (кроме того, указанные арил и гетероарил необязательно замещены одним-тремя радикалами, выбранными из галогена, циано, C1-C6алкилокси, C1-C6алкила или арила), могут быть получены путем взаимодействия соединения формулы I, где R6 обозначает водород, с соответствующим алкилирующим агентом (например, диметилсульфатом, бензилбромидом, 4-метилбензилбромидом, циклогексилметилбромидом, пирид-2-илметилхлоридом, 1,6-диметилбензилхлоридом, 4-хлорбензилхлоридом, пиразин-2-илметилбромидом, тиен-2-илметилбромидом, фур-3-илметилбромидом, бифенил-2-илметилбромидом и т.д.). Обычно реакцию проводят в присутствии приемлемого основания (например, галогенида тетраалкиламмония, такого как фторид тетрабутиламмония, хлорид бензилтриметиламмония и т.п., гидроксида тетраалкиламмония, хлорида тетраалкиламмония с гидроксидом калия, карбоната калия и т.д., предпочтительно фторида тетрабутиламмония) в соответствующем инертном органическом растворителе (например, ТГФ, ДМЭ, ДМФ, любой приемлемой смеси пригодных растворителей и т. д. , предпочтительно в ТГФ) при 10-50oC, обычно при 20-25oC и предпочтительно приблизительно при 20oC в течение 1-20 часов (более подробно описано ниже в примере 33).
Соединения формулы I, где R6 обозначает необязательно замещенный арил или гетероарил, могут быть получены путем взаимодействия соединения формулы I, где R6 обозначает водород, с соответствующим алкилирующим агентом (например, 1-фтор-4-йодбензолом, бромбензолом, 2-бромпиридином и т.д.) в присутствии соответствующего источника меди (например, оксида меди (I), медной бронзы, бромида меди (I) и т.д., предпочтительно оксида меди (I)) в приемлемом инертном органическом растворителе (например, 2,4,6-триметилпиридине, диэтиланилине, МП, любой приемлемой смеси пригодных растворителей и т. д. , предпочтительно в 2,4,6-триметилпиридине) при 100-180oC, обычно при 150-170oC и предпочтительно при температуре кипения с обратным холодильником в течение 4-24 часов.
Соединения формулы I, где R7 обозначает карбамоил, могут быть получены путем обработки соединения формулы I, где R7 обозначает циано, кислотой (например, трифторуксусной кислотой (ТФК), концентрированной серной кислотой, любой приемлемой смесью пригодных кислот и т.д., предпочтительно ТФК) при 50-100oC, обычно при 70-85oC и предпочтительно при температуре кипения с обратным холодильником в течение 0,1-96 часов (более подробно описано ниже в примере 34).
Соединения формулы I, где R1 обозначает амино, могут быть получены путем гидрогенизации соединения формулы I, где R1 обозначает нитро. Гидрогенизацию проводят с помощью соответствующего катализатора (например, 10%-ного Pd/C, гидроксида палладия, ацетата палладия и т.д., предпочтительно 10%-ного Pd/C) в соответствующем спиртовом растворителе (например, этаноле, метаноле, любой приемлемой смеси пригодных спиртов и т.д., предпочтительно в этаноле) при 20-40oC, обычно при 20-30oC и предпочтительно приблизительно при 25oC и при давлении 15-40 фунтов/кв. дюйм, обычно при давлении 15-30 фунтов/кв.дюйм и предпочтительно приблизительно при 15 фунтов/кв.дюйм в течение 4-24 часов.
Соединения формулы I, где R1 обозначает ацетиламино, трифторацетиламино или метилсульфониламино, могут быть получены путем взаимодействия соединения формулы I, где R1 обозначает амино, с уксусным ангидридом, трифторуксусным ангидридом или метансульфонилхлоридом соответственно. Реакцию проводят в соответствующем инертном органическом растворителе (например, пиридине, 2,6-диметилпиридине, дихлорметане, триэтиламине, любой приемлемой смеси пригодных растворителей и т.д., предпочтительно в пиридине) при 0-40oC, обычно при 0-10oC и предпочтительно приблизительно при 0oC в течение 0,5-3 часов.
Соединения формулы I, где R1, R2 и/или R5 обозначает гидрокси, могут быть получены путем деметилирования соединения формулы I, где R1, R2 и/или R5 обозначает метокси. Деметилирование может быть осуществлено с помощью соответствующего деметилирующего агента (например, цианида натрия, трибромида бора, трихлорида бора и т.д., предпочтительно цианида натрия) в приемлемом инертном органическом растворителе (например, диметилсульфоксиде (ДМСО), МП, ГМФА, метиленхлориде, 1,2-дихлорэтане, любой приемлемой смеси пригодных растворителей и т. д. , предпочтительно в ДМСО) при 80-180oC, обычно при 100-160oC и предпочтительно при температуре кипения с обратным холодильником в течение 2-24 часов. Альтернативно этому деметилирование может быть осуществлено с помощью соответствующей водной кислоты (например, водной бромистоводородной кислоты, гидрохлорида пиридина, любой приемлемой смеси пригодных кислот и т.д., предпочтительно водной бромистоводородной кислоты) при температуре кипения с обратным холодильником в течение 5-20 часов. С помощью вышеописанных процессов было получено следующее соединение формулы I: 3-(3-{ 4-[4-фтор-2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил}пропил)-5-гидрокси-2,4 (1H,3H)-пиримидиндион, tпл 192-194oC; анализ: рассчитано для C19H22F4N4O4• (C2H2O2)1,5: C 48,39; H 4,55; N 9,03%; обнаружено: C 48,20; H 4,67; N 9,18%.
Соединения формулы I, где R2 обозначает галоген, могут быть получены путем галогенирования соединения формулы I, где R2 обозначает водород. Галогенирование может быть осуществлено с помощью соответствующего галогенирующего агента (например, N-хлорсукцинимида, N-бромсукцинимида и т.д.) в приемлемом инертном органическом растворителе (например, ДМФ, ДМСО, 1,3-диметил-3,4,5,6-тетрагидро-2(1H)-пиримидиноне (ДМТП), МП, любой приемлемой смеси пригодных растворителей и т.д., предпочтительно в ДМФ) при 0-100oC, обычно при 20-60oC и предпочтительно приблизительно при 20oC в течение 1-48 часов.
Соединения формулы I, где R2 обозначает циано, могут быть получены путем циан-дегалогенирования соединения формулы I, где R2 обозначает галоген. Реакцию проводят с цианидом меди (I) в соответствующем инертном органическом растворителе (например, МП, ДМТП, ДМФ, МП, любой приемлемой смеси пригодных растворителей и т. д. , предпочтительно в МП) в атмосфере инертного газа (например, аргона, азота и т.д.) при 150-220oC, предпочтительно приблизительно при 200oC в течение 8-24 часов.
Соединения формулы I могут быть получены в виде фармацевтически приемлемых кислотно-аддитивных солей путем взаимодействия соединения формулы I в виде свободных оснований с фармацевтически приемлемой неорганической или органической кислотой. И, наоборот, фармацевтически приемлемые соли присоединения оснований соединений формулы I могут быть получены путем взаимодействия соединений формулы I в виде свободных кислот с фармацевтически приемлемыми неорганическими или органическими основаниями. Неорганические и органические кислоты и основания, пригодные для получения фармацевтически приемлемых солей соединений формулы I, приведены выше в разделе "Определения" настоящего описания. И, наоборот, соединения формулы I в виде солей могут быть получены с использованием солей исходных материалов или промежуточных продуктов.
Соединения формулы I в виде свободных кислот или свободных оснований могут быть получены из соответствующих солей присоединения основания или кислотно-аддитивных солей. Например, соединения формулы I в виде кислотно-аддитивной соли могут быть превращены в соответствующее свободное основание путем обработки приемлемым основанием (например, раствором гидроксида аммония, гидроксидом натрия и т.д.). Соединения формулы I в виде соли присоединения основания могут быть превращены в соответствующую свободную кислоту путем обработки соответствующей кислотой (например, соляной кислотой и т.д. ).
N-оксиды соединений формулы I могут быть получены путем обработки неокисленной формы соединения формулы I окислителем (например, трифторперуксусной кислотой, пермалеиновой кислотой, пербензойной кислотой, перуксусной кислотой, мета-хлорпероксибензойной кислотой и т.д.) в приемлемом инертном органическом растворителе (например, галогенированном углеводороде, таком как метиленхлорид) приблизительно при 0oC. В другом варианте N-оксиды соединений формулы I могут быть получены из N-оксида соответствующего исходного материала.
Соединения формулы I в неокисленной форме могут быть получены из N-оксидов соединений формулы I путем обработки восстановителем (например, серой, диоксидом серы, трифенилфосфином, борогидридом лития, борогидридом натрия, треххлористым фосфором, трибромидом и т.д.) в приемлемом инертном органическом растворителе (например, ацетонитриле, этаноле, водном диоксане и т.д. ) при 0-80oC.
Обычному специалисту в данной области техники очевидно, что соединения формулы I могут быть получены как в виде индивидуальных изомеров, так и в виде смесей изомеров. Изомеры, являющиеся диастереомерами, характеризуются различными физическими свойствами (например, температурой плавления, температурой кипения, растворимостью, реакционной способностью и т.д.) и, легко разделяются благодаря этим различиям в свойствах. Например, диастереомеры могут быть разделены с помощью хроматографии или предпочтительно с помощью методов разделения/расщепления на основе различий в растворимости. Оптические изомеры могут быть разделены путем взаимодействия рацемической смеси с оптически активным расщепляющим агентом для образования пары диастереомерных соединений. Затем изомеры разделяют с помощью любых описанных выше методик разделения диастереомеров и получают чистый оптический изомер вместе с расщепляющим агентом с помощью любых практических способов, которые не должны приводить к рацемизации. Поскольку расщепление оптических изомеров может быть выполнено с использованием ковалентных диастереомерных производных соединений формулы I, предпочтительными являются комплексы, способные к диссоциации, например, кристаллические диастереомерные соли. Соответствующие расщепляющие кислоты включают винную кислоту, орто-нитротартраниловую кислоту [=3,4-дигидрокси-1-(2-нитрофенил)-2,5-пирролидиндион], миндальную кислоту, яблочную кислоту, кислоты, подпадающие под 2-арилпропионовые кислоты, и камфорсульфоновую кислоту. Индивидуальные изомеры соединений формулы I также могут быть разделены с помощью таких способов, как прямая или избирательная кристаллизация, или с помощью любого другого способа, известного обычному специалисту в данной области техники. Более детальное описание методик, применимых для разделения стереоизомеров соединений формулы I, можно найти у Jean Jacques, Andre Collet, Samuel H. Wilen, Enantiomers, Racemates and Resolutions, John Wiley & Sons, Inc. (1981). В другом варианте индивидуальные изомеры соединений формулы I могут быть получены с использованием изомерных форм исходных материалов.
Таким образом, предметом настоящего изобретения является способ получения соединения формулы I:
где R1 обозначает ацетиламино, амино, циано, трифторацетиламино, галоген, водород, гидрокси, нитро, метилсульфониламино, 2-пропинилокси, группу, выбранную из C1-C6алкила, C3-C6циклоалкила, C3-C6циклоалкилC1-C4алкила,
C1-C6алкилокси, C3-C6циклоалкилокси, C3-C6циклоалкилC1-C4алкилокси и C1-C4алкилатио (причем указанная группа, кроме того, необязательно замещена одним-тремя атомами галогена), или группу, выбранную из арила, арилC1-C4алкила, гетероарила, гетероарилC1-C4алкила, арилокси, арилC1-C4алкилокси, гетероарилокси и гетероарилC1-C4алкилокси (причем указанные арил и гетероарил, кроме того, необязательно замещены одним-двумя радикалами, независимо выбранными из галогена и циано);
R2 обозначает циано, галоген, водород, гидрокси или группу, выбранную из C1-C6алкила и C1-C6алкилокси (причем указанная группа, кроме того, необязательно замещена одним-тремя атомами галогена);
R3 и R4 каждый обозначает водород или метил или вместе обозначают этилен; и
R5 обозначает группу, выбранную из формул (a), (b), (c) и (d):

в которых X обозначает C(O), CH2 или CH(OH);
Y обозначает CH2 или CH(OH);
Z обозначает N или C(R9), где R9 обозначает водород, C1-C6алкил или гидрокси;
R6 обозначает водород, группу, выбранную из C1-C6алкила, C3-C6циклоалкила, C3-C6циклоалкилC1-C4алкила (причем указанная группа, кроме того, необязательно замещена одним-тремя атомами галогена), или группу, выбранную из арила, гетероарила, арилC1-C4алкила и гетероарилC1-C4алкила (причем указанные арил и гетероарил, кроме того, необязательно замещены одним-тремя радикалами, выбранными из галогена, циано, C1-C6алкилокси, C1-C6алкила и арила);
R7 обозначает C1-C6алканоил, карбамоил, циано, диC1-C6алкиламино, галоген, водород, гидрокси, гидроксииминометил, C1-C6алкилсульфонил, C1-C4алкилтио, группу, выбранную из C1-C6алкила, C3-C6циклоалкила, C1-C6алкилокси и C1-C6алкилоксиC1-C4алкила (причем указанная группа, кроме того, необязательно замещена одним-тремя радикалами, выбранными из галогена, гидрокси или C1-C6алкилокси), или группу, выбранную из арила, гетероарила, арилC1-C4алкила и гетероарилC1-C4алкила (причем указанный арил и гетероарил, кроме того, необязательно замещены одним-тремя радикалами, выбранными из галогена, циано, C1-C6алкилокси, C1-C6алкила и арила), или R7 и R9 вместе обозначают тетраметилен; и каждый R8 независимо обозначает водород, гидрокси, метил или этил;
и его фармацевтически приемлемых солей и N-оксидов, включающий:
(а) алкилирование соединения формулы 3:
или его защищенного производного, где L обозначает отщепляемую группу и каждый радикал R3, R4 и R5 имеет значение, указанное выше для формулы I, соединением формулы 2:
или его защищенным производным, где каждый радикал R1 и R2 имеет значение, указанное выше для формулы I, и при необходимости последующее удаление защитной группы; или
(б) алкилирование соединения формулы H-R5 соединением формулы 5:
где L обозначает отщепляемую группу и каждый радикал R1, R2, R3 и R4 имеет значение, указанное выше для формулы I; и
(в) необязательно последующее дебензилирование соединения формулы I, где R6 обозначает бензил, для получения соединения формулы I, где R6 обозначает водород;
(г) необязательно последующее алкилирование соединения формулы I, где R6 обозначает водород, для получения соединения формулы I, где R6 обозначает C1-C6алкил, C3-C6циклоалкил, C3-C6циклоалкилC1-C4алкил или группу, выбранную из арила, гетероарила, арилC1-C4алкила и гетероарилC1-C4алкила (указанные арил и гетероарил, кроме того, необязательно замещены одним-тремя радикалами, выбранными из галогена, циано, C1-C6алкилокси, C1-C6алкила и арила);
(д) необязательно последующее окисление соединения формулы I для получения N-оксидного производного;
(е) необязательно последующее восстановление N-оксидного производного соединения формулы I до неокисленной формы;
(ж) необязательно последующее превращение соединения формулы I в фармацевтически приемлемую соль; и
(з) необязательно последующее превращение соединения формулы I в виде соли в несолевую форму.
В любом из вышеуказанных процессов ссылка на формулу I относится к такой формуле, где Z, R1, R2, R3, R4, R5, R6, R7 и R8 имеют значения в их самой широкой расшифровке, приведенной в кратком изложении сущности изобретения, причем указанные процессы относятся к предпочтительным вариантам выполнения изобретения.
ПРИМЕРЫ
ПРИМЕР 1
1-(4-метоксибензил)-5-циан-2,4(1H,3H)-пиримидиндион
Ниже приведен способ получения соединения формулы 4, где R5 обозначает группу формулы (a), в которой Z обозначает CH, R6 обозначает 4-метоксибензил и R7 обозначает циано.
Смесь, содержащую (Z)-1-циан-2-этокси-N-этоксикарбонилакриламид (1 г, 4,71 ммоля), 4-метоксибензиламин (1,29 г, 9,42 ммоля) и воду (15 мл), выдерживали в течение 10 минут при приблизительно 70oC. Реакционную смесь охлаждали и обрабатывали 10 Н соляной кислотой (1 мл). Твердые фракции собирали, промывали водой, сушили под вакуумом и перекристаллизовывали из этанола/хлороформа, получая 1-бензил-5-циан-1-(4-метоксибензил)-2,4(1H, 3H)-пиримидиндион (788 мг, 3,06 ммоля).
ПРИМЕР 2
5-проп-2-ил-2,4(1H,3H)-пиримидиндион
Ниже приведен способ получения соединения формулы 4, где R5 обозначает группу формулы (a), в которой Z обозначает CH, R6 обозначает водород и R7 обозначает проп-2-ил.
Суспензию натрия (2,84 г, 123,5 ммоля) в безводном диэтиловом эфире (27 мл) охлаждали до 0oC и по каплям добавляли смесь, содержащую этилизовалерат (23,04 мл, 153 ммоля), этилформиат (16,65 мл, 206 ммолей) и безводный диэтиловый эфир (19 мл). Смесь сначала выдерживали в течение 48 часов при 0oC, затем оставляли на 24 часа при 25oC, после чего концентрировали под вакуумом. Остаток перемешивали с тиомочевиной (5,95 г, 78 ммолей) и абсолютным этанолом (44 мл) в течение 7 часов при температуре кипения с обратным холодильником. Смесь концентрировали и остаток растворяли в воде (40 мл). Раствор промывали диэтиловым эфиром, обрабатывали концентрированной соляной кислотой и охлаждали до 0oC. Твердые фракции собирали и перекристаллизовывали из этанола. Кристаллы суспендировали в 10%-ной водной хлоруксусной кислоте (11 мл) и суспензию кипятили в течение 8 часов с обратным холодильником и затем охлаждали. Твердые фракции собирали и перекристаллизовывали из этанола, получая 5-проп-2-ил-2,4(1H,3H)- пиримидиндион, tпл 284-286oC.
Работая аналогично примеру 2, но заменяя этилизовалерат на метилметоксиацетат, получали 5-метокси-2,4(1H,3H)-пиримидиндион.
ПРИМЕР 3
5-гидроксиметил-2,4(1H,3H)-пиримидиндион
Ниже приведен способ получения соединения формулы 4, где R5 обозначает группу формулы (a), в которой Z обозначает CH, R6 обозначает водород и R7 обозначает гидроксиметил.
Смесь, содержащую урацил (9 г, 80,3 ммоля), параформальдегид (3 г) и 0,42H гидроксид калия (125 мл), выдерживали в течение 90 часов при 50oC. Реакционную смесь разбавляли водой (350 мл), перемешивали с ионообменной смолой Dowex® 50 (30 г, Н-форма, 100-200 меш), фильтровали, концентрировали под вакуумом до объема 20 мл и замораживали. Твердые фракции собирали и перекристаллизовывали из воды (50 мл), получая 5-гидроксиметил-2,4(1H,3H)-пиримидиндион (9,5 г, 65,04 ммоля), tпл 260-300oC (разл.).
ПРИМЕР 4
5-гидроксииминометил-2,4(1H,3H)-пиримидиндион
Ниже приведен способ получения соединения формулы 4, где R5 обозначает группу формулы (a), в которой Z обозначает CH, R6 обозначает водород и R7 обозначает гидроксииминометил.
Смесь, содержащую урацил (6 г, 53,5 ммоля), 50%-ный гидроксид натрия (12 мл, 150 ммолей) и хлороформ (5 мл), кипятили с обратным холодильником и в течение 15 минут дополнительно добавляли хлороформ (20 мл). Смесь кипятили в течение 4 часов с обратным холодильником и затем концентрировали при 50oC с использованием водного аспиратора. Остаток растворяли в воде (5 мл) и раствор обрабатывали 5Н соляной кислотой. Раствор хроматографировали на Dowex® 50 с использованием воды в качестве элюента, получая 2,4-диоксо-5(1H, 3H)-пиримидинкарбальдегид (1,79 г, 11,2 ммоля).
Смесь, содержащую 2,4-диоксо-5(1H, 3H)-пиримидинкарбальдегид (1,79 г, 12,8 ммоля), метанол (35 мл) и воду (35 мл), кипятили с обратным холодильником и затем добавляли смесь, содержащую гидроксиламиногидрохлорид (905 мг, 13 ммолей), ацетат калия (1,28 г, 13 ммолей) и воду (15 мл). Смесь охлаждали и собирали твердые фракции, промывали водой и перекристаллизовывали из смеси вода/метанол, получая 5-гидроксииминометил-2,4(1H,3H)-пиримидиндион (1,68 г, 10,8 ммоля).
ПРИМЕР 5
1-бензил-5-метил-2,4(1H,3H)-пиримидиндион
Ниже приведен способ получения соединения формулы 4, где R5 обозначает группу формулы (a), в которой Z обозначает CH, R6 обозначает бензил и R7 обозначает метил.
Смесь, содержащую тимин (7,68 г, 61 ммоль), бензилбромид (10,55 г, 61 ммоль), карбонат калия (17,05 г, 123 ммоля) и ДМФ (90 мл), перемешивали в течение 12 часов при 25oC. Реакционную смесь сливали в воду (500 мл) и экстрагировали этилацетатом (3х200 мл). Объединенный экстракт промывали водой (5х100 мл), сушили (Na2SO4) и концентрировали под вакуумом. Остаток кристаллизовали из гексана/этилацетата, получая 1-бензил-5-метил-2,4(1H,3H)-пиримидиндион (9,4 г, 43,9 ммоля), tпл 170-173oC.
Работая аналогично примеру 5, но заменяя бензилбромид и/или 5-метил-2,4(1H, 3H)-пиримидиндион на различные исходные вещества, получали следующие соединения формул 3 и 4:
заменяя на 3-(3-хлорпропил)-5-метил-2,4(1H,3H)-пиримидиндион и на пирид-4-илметилхлорид, получали 3-(3-хлорпропил)-5-метил-1-пирид-4-илметил-2,4(1H,3H)-пиримидиндион;
заменяя на 5-этил-2,4(1H,3H)-пиримидиндион, получали 1-бензил-5-этил-2,4(1H,3H)-пиримидиндион, tпл 154-155oC;
заменяя на 5-пропил-2,4(1H,3H)-пиримидиндион, получали 1-бензил-5-пропил-2,4(1H,3H)-пиримидиндион;
заменяя на 5-трифторметил-2,4(1H,3H)-пиримидиндион, получали 1-бензил-5-трифторметил-2,4(1H,3H)-пиримидиндион, tпл 194-195oC;
заменяя на 6-метил-1,2,4-триазин-3,5(2H,4H)-дион, получали 4-бензил-6-метил-1,2,4-триазин-3,5(2H,4H)-дион, tпл 143-146oC;
заменяя на 2,4-диоксо-5(1H, 3H)-пиримидинкарбальдегид, получали 1-бензил-2,4-диоксо-5(1H,3H)-пиримидинкарбальдегид;
заменяя на 6-циан-5-метил-2,4(1H,3H)-пиримидиндион, получали 1-бензил-6-циан-5-метил-2,4(1H,3H)-пиримидиндион;
заменяя на 2,4(1H, 3H)-пиримидиндион, получали 1-бензил-2,4(1H,3H)-пиримидиндион;
заменяя на 4-метоксибензилбромид, получали 1-(4-метоксибензил)-5-метил-2,4(1H,3H)-пиримидиндион;
заменяя на 2,4-диметилбензилбромид, получали 1-(2,4-диметилбензил)-5-метил-2,4(1H,3H)-пиримидиндион;
заменяя на 2-метилбензилбромид, получали 1-(2-метилбензил)-5-метил-2,4(1H,3H)-пиримидиндион;
заменяя на бифенил-3-илметилбромид, получали 1-бифенил-3-илметил-5-метил-2,4(1H,3H)-пиримидиндион;
заменяя на циклогексилметилбромид, получали 1-циклогексилметил-5-метил-2,4(1H,3H)-пиримидиндион;
заменяя на пиразин-2-илметилхлорид, получали 1-пиразин-2-илметил-5-метил-2,4(1H,3H)-пиримидиндион;
заменяя на пирид-4-илметилхлорид, получали 1-пирид-4-илметил-5-метил-2,4(1H,3H)-пиримидиндион;
заменяя на пирид-3-илметилхлорид, получали 1-пирид-3-илметил-5-метил-2,4(1H,3H)-пиримидиндион;
заменяя на фур-2-илметилхлорид, получали 1-фур-2-илметил-5-метил-2,4(1H, 3H)-пиримидиндион;
заменяя на фур-3-илметилхлорид, получали 1-фур-3-илметил-5-метил-2,4(1H, 3H)-пиримидиндион;
заменяя на тиен-2-илметилхлорид, получали 1-тиен-2-илметил-5-метил-2,4(1H,3H)-пиримидиндион; и
заменяя на метилйодид, получали 1,5-диметил-2,4 (1H,3H)-пиримидиндион.
ПРИМЕР 6
1-метоксиметил-5-метил-2,4(1H,3H)-пиримидиндион
Ниже приведен способ получения защищенного производного соединения формулы 4, где R5 обозначает группу формулы (a), в которой Z обозначает C(CH3), R7 обозначает метил и защитная группа является метоксиметилом.
Смесь, содержащую тимин (100 г, 0,79 моля), трифторметансульфоновую кислоту (2 мл, 20 ммолей) и ГМДС (418 мл, 1,98 моля), выдерживали в течение 16 часов при 90oC при перемешивании и в течение короткого промежутка времени при температуре кипения с обратным холодильником и затем перегоняли под вакуумом при 80oC для удаления избытка ГМДС. Смесь обрабатывали трифторметансульфоновой кислотой (1,5 мл, 20 ммолей) и затем добавляли метоксиметилацетат (88 мл, 0,89 моля) с такой скоростью, чтобы температура реакции не превышала 95oC. Смесь выдерживали в течение 20 минут при 70oC и затем перегоняли под вакуумом для удаления триметилсилилацетата, образовавшегося в качестве побочного продукта. Реакционную смесь сливали в изопропанол (800 мл) и перемешивали в течение 18 часов. Твердые фракции собирали, промывали этилацетатом и сушили, получая 1-метоксиметил-5-метил-2,4(1H,3H)-пиримидиндион (116 г, 0,68 моля).
Работая аналогично примеру 6, но заменяя тимин и/или метоксиметилацетат на различные исходные вещества, получали следующие соединения формулы 4:
заменяя на 5,6-диметил-2,4(1H,3H)-пиримидиндион и бензилбромид, получали 1-бензил-5,6-диметил-2,4(1H,3H)-пиримидиндион, tпл 187-189oC;
заменяя на 5-метоксиметил-2,4(1H,3H)-пиримидиндион и бензилбромид, получали 1-бензил-5-метоксиметил-2,4(1H,3H)-пиримидиндион, tпл 134-136oC;
заменяя на 6-метил-2,4(1H, 3H)-пиримидиндион и бензилбромид, получали 1-бензил-6-метил-2,4(1H,3H)-пиримидиндион, tпл 228-230oC;
заменяя на 5-гидроксииминометил-2,4(1H,3H)-пиримидиндион и бензилбромид, получали 1-бензил-5-гидроксииминометил-2,4(1H, 3H)-пиримидиндион, tпл 172-174oC; и
заменяя на 2,2,2-трифторэтил-пара-толуолсульфонат, получали 1-(2,2,2-трифторэтокси)-5-метил-2,4(1H,3H)-пиримидиндион.
ПРИМЕР 7
1-[2-(триметилсилил)этоксиметил]-2,4(1H,3H)-пиримидиндион
Ниже приведен способ получения защищенного соединения формулы 4, где R5 обозначает группу формулы (a), в которой Z обозначает CH, R7 обозначает водород и защитная группа является 2-(триметилсилилэтокси)метилбензилом.
Раствор 60%-ного гидрида натрия (2 г, 50 ммолей) в минеральном масле промывали гексаном (2х20 мл) и охлаждали до 0oC. Раствор разбавляли ДМФ (200 мл) и затем в течение 30 минут порциями добавляли урацил (5,6 г, 50 ммолей). Смесь обрабатывали 2-(триметилсилил)этоксиметилхлоридом (8,8 мл, 50 ммолей) и давали нагреться до 25oC и выдерживали в течение 4 часов. Реакционную смесь разбавляли водой (500 мл) и экстрагировали диэтиловым эфиром (4х100 мл). Объединенный экстракт промывали соляным раствором, сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали с помощью хроматографии на силикагеле, элюируя смесью гексан/этилацетат (2:1), получая 1-[2-(триметилсилил)этоксиметил]-2,4(1H,3H)-пиримидиндион (1,8 г, 7,4 ммоля), tпл 120-122oC.
Работая аналогично примеру 7, но заменяя урацил и/или 2-(триметилсилил)этоксиметилхлорид на различные исходные вещества, получали следующие соединения формулы 4:
заменяя на 5-проп-2-ил-2,4(1H, 3H)-пиримидиндион и на ди-трет-бутилбикарбонат, получали трет-бутил-5-проп-2-ил-2,4-диоксо-(1H, 3H)-1-пиримидинкарбоксилат;
заменяя на 5-метилтио-2,4(1H, 3H)-пиримидиндион и на ди-трет-бутилбикарбонат, получали трет-бутил-5-метилтио-2,4-диоксо-(1H, 3H)-1-пиримидинкарбоксилат;
заменяя на 5-фур-2-ил-2,4(1H, 3H)-пиримидиндион и на ди-трет-бутилбикарбонат, получали трет-бутил-5-фур-2-ил-2,4-диоксо-(1H, 3H)-1-пиримидинкарбоксилат;
заменяя на 5-метокси-2,4(1H,3H)-пиримидиндион, получали 1-[2-(триметилсилил)этоксиметил]-5-метоксиметил-2,4(1H,3H)-пиримидиндион; и
заменяя на 5-гидроксиметил-2,4(1H, 3H)-пиримидиндион, получали 1-[2-(триметилсилил)этоксиметил]-5-гидроксиметил-2,4(1H,3H)-пиримидиндион.
ПРИМЕР 8
1- и 3-(4-фторфенил)-5-метил-2,4(1H,3H)-пиримидиндион
Ниже приведен способ получения соединения формулы 4, где R5 обозначает группу формулы (a), в которой Z обозначает CH, R6 обозначает 4-фторфенил и R7 обозначает метил, и соединения формулы 4, где R5 обозначает группу формулы (b), в которой Z обозначает CH, R6 обозначает 4-фторфенил и R7 обозначает метил.
Смесь, содержащую тимин (5 г, 39,6 ммоля), 1-фтор-4-йодбензол (9,68 г, 5 мл, 43,6 ммоля), оксид меди (I) (6,24 г, 43,6 ммоля) и 2,4,6-триметилпиридин (200 мл), кипятили при перемешивании в течение 12 часов с обратным холодильником и в атмосфере аргона. Затем реакционную смесь охлаждали до 25oC, разбавляли метиленхлоридом (300 мл), промывали 5%-ной серной кислотой (5х300 мл) и концентрировали. Остаток очищали с помощью быстрой хроматографии на силикагеле, элюируя смесью гексан/этилацетат (1:1), получая 1-(4-фторфенил)-5-метил-2,4(1H, 3H)-пиримидиндион (1,85 г, 9,2 ммоля), tпл 212-214oC, и 3-(4-фторфенил)-5-метил-2,4(1H, 3H)-пиримидиндион (2,39 г, 10,2 ммоля), tпл 229-231oC.
Работая аналогично примеру 8, но заменяя 1-фтор-4-йодбензол на бромбензол, получали 5-метил-1-фенил-2,4(1H,3H)-пиримидиндион, tпл 200-202oC, и 5-метил-3-фенил-2,4(1H,3H)-пиримидиндион, tпл 258-260oC.
ПРИМЕР 9
3-бензил-5-метил-2,4(1H,3H)-пиримидиндион
Ниже приведен способ получения соединения формулы 4, где R5 обозначает группу формулы (b), в которой Z обозначает CH, R6 обозначает бензил и R7 обозначает метил.
Смесь, содержащую 1,3-дибензил-5-метил-2,4(1H, 3H)-пиримидиндион (2 г, 6,5 ммоля), 5%-ный палладий на древесном угле (3 г) и 0,4Н формиат аммония (250 мл в метаноле) кипятили в течение 1,5 часов с обратным холодильником. Затем реакционную смесь фильтровали и концентрировали под вакуумом. Остаток очищали с помощью хроматографии на колонках на силикагеле, элюируя смесью метиленхлорид/метанол (95:5) и получая 3-бензил-5-метил-2,4(1H,3H)-пиримидиндион, tпл 208-210oC.
Работая аналогично примеру 9, но заменяя 1,3-дибензил-5-метил-2,4(1H, 3H)-пиримидиндион на различные исходные вещества, получали следующие соединения формулы 4:
заменяя на 2,4-дибензил-6-метил-1,2,4-триазин-3,5(2H,4H)-дион, получали 2-бензил-6-метил-1,2,4-триазин-3,5(2H,4H)-дион, tпл 141-142oC;
заменяя на 1,3-дибензил-5,6-диметил-2,4(1H,3H)-пиримидиндион, получали 3-бензил-5,6-диметил-2,4(1H,3H)-пиримидиндион; и
заменяя на 1,3-дибензил-6-метил-2,4(1H,3H)-пиримидиндион, получали 3-бензил-6-метил-2,4(1H,3H)-пиримидиндион.
ПРИМЕР 10
1-бензил-5,5-диметил-2,4,6(1H,3H,5H)-пиримидинтрион
Ниже приведен способ получения соединения формулы 4, где R5 обозначает группу формулы (c), в которой X обозначает C(O), R6 обозначает бензил и каждый из R8 обозначает метил.
Смесь, содержащую метоксид натрия (0,343 г, 14,9 ммоля), бензилмочевину (1,6 г, 10,6 ммоля), диэтилдиметилмалонат (1,9 г, 10 ммолей) и метанол (15 мл), кипятили в течение 6 часов с обратным холодильником. Реакционную смесь концентрировали и остаток перемешивали с водой (30 мл) при 5oC и затем добавляли соляную кислоту. Твердые фракции собирали, промывали водой и сушили, получая 1-бензил-5,5-диметил-2,4,б(1H,3H,5H)-пиримидинтрион, tпл 136-137oC.
ПРИМЕР 11
4-фтор-2-(2,2,2-трифторэтокси)анилин
Ниже приведен способ получения соединения формулы 6, где R1 обозначает 2,2,2-трифторметокси и R2 обозначает фтор в положении 4.
Раствор трифторэтанола (88 г, 64 мл, 88 ммолей) добавляли к суспензии трет-бутоксида калия (98,8 г, 0,88 моля) в 1,2-диметоксиэтане (145 мл) так, чтобы температура реакции поддерживалась ниже 11oC. Затем смесь охлаждали в течение 1,5 часов до 0-5oC и в течение 2,5 ч добавляли к раствору 2,4- дифторнитробензола (135 г, 0,85 моля) в 1,2-диметоксиэтане (150 мл) при -10oC. Смесь выдерживали в течение 1 часа при -10oC и затем добавляли водный раствор дигидрофосфата калия (13 г, 130 мл). Смесь нагревали до 25oC и добавляли твердый дигидрофосфат калия (7 г). Смесь разбавляли метил-трет-бутиловым эфиром (600 мл) и водой (300 мл), отделяли органический слой, разбавляли метил-трет-бутиловым эфиром (100 мл), промывали водой (2х400 мл), фильтровали через целит (2 г) и концентрировали под вакуумом, получая 4-фтор-2-(2,2,2-трифторэтокси)нитробензол (13 г, 57,2 ммоля).
Суспензию 20%-ного гидроксида палладия на древесном угле (30 мг) в этилацетате (3 мл) гидрировали в течение 17 часов при перемешивании и затем добавляли раствор 4-фтор-2-трифторэтоксинитробензола (3 г, 13 ммолей) в этилацетате (6 мл). Смесь гидрировали в течение 16 часов при перемешивании, фильтровали через целит, промывали этилацетатом (10 мл), разбавляли 4,3М хлористым водородом (3 мл, 13 ммолей в изопропаноле) и концентрировали под вакуумом. Остаток растворяли в этилацетате (25 мл) и суспензию концентрировали, разбавляли этилацетатом (25 мл), повторно концентрировали и разбавляли этилацетатом (5 мл). Суспензию перемешивали в течение 17 часов, разбавляли этилацетатом (10 мл) и перемешивали 5 часов. Твердые фракции собирали, промывали этилацетатом (3 мл) и сушили под вакуумом при 60oC, получая гидрохлорид 4-фтор-2-(2,2,2-трифторэтокси)анилина (2,5 г, 10,4 ммоля), tпл 203-204oC.
ПРИМЕР 12
2-(2,2,2-трифторэтокси)анилин
Ниже приведен способ получения соединения формулы 6, где R1 обозначает 2,2,2-трифторметокси и R2 обозначает водород.
Смесь, содержащую 2-нитрофенол (18,8 г, 135 ммолей), 2,2,2-трифторэтил-пара-толуолсульфонат (34,36 г, 135 ммолей), карбонат калия (18,7 г, 135 ммолей) и ДМФ (200 мл), выдерживали в течение 16 часов при 140oC. Затем реакционную смесь охлаждали, разбавляли водой (600 мл) и экстрагировали эфиром/гексаном (1:1; 3х400 мл). Объединенные экстракты промывали насыщенным бикарбонатом натрия (3х100 мл) и соляным раствором, сушили (Na2SO4), фильтровали и концентрировали, получая 1-(2,2,2-трифторэтокси)-2-нитробензол (27 г, 117 ммолей) в виде масла. Смесь, содержащую 1-(2,2,2-трифторэтокси)-2-нитробензол (15 г, 68 ммолей), гидрат оксида платины (100 мг) и абсолютный этанол (80 мл), гидрировали в течение 18 часов при перемешивании при температуре 25oC и давлении 15 фунтов/кв.дюйм. Затем реакционную смесь фильтровали и концентрировали. Остаток очищали с помощью хроматографии на колонках на силикагеле, элюируя смесью гексан/этилацетат (9:1) и получая 2-(2,2,2-трифторэтокси)анилин (10,4 г, 54,5 ммоля), tпл 49-50oC.
ПРИМЕР 13
1-[2-(2,2,2-трифторэтокси)фенил]пиперазин
Ниже приведен способ получения соединения формулы 2, где R1 обозначает 2,2,2-трифторэтокси и R2 обозначает водород.
Смесь, содержащую 2-(2,2,2-трифторэтокси)анилин (2,85 г, 14,9 ммоля), гидрохлорид бис(2-хлорэтил)амина (2,66 г, 14,9 ммоля), карбонат калия (2,06 г, 14,9 ммоля), йодид натрия (0,45 г, 3 ммоля) и бис(2-метоксиэтиловый)эфир (7,3 мл), кипятили в течение 8 часов с обратным холодильником. Затем реакционную смесь охлаждали, обрабатывали концентрированным гидроксидом аммония, сливали в воду (30 мл) и экстрагировали этилацетатом (3х30 мл). Объединенные экстракты промывали водой (2х30 мл) и соляным раствором (1х30 мл), сушили (MgSO4) и концентрировали под вакуумом. Остаток очищали с помощью хроматографии на колонках на силикагеле, элюируя метиленхлоридом/метанолом (95:5) и получая 1-[2-(2,2,2-трифторэтокси)фенил] пиперазин (2,93 г, 11,2 ммоля), tпл 107-108oC.
Работая аналогично примеру 13, но заменяя 2-(2,2,2-трифторэтокси)анилин на различные исходные вещества, получали следующие соединения формулы 2:
заменяя на 4-хлор-2-метоксианилин, получали 1-(4-хлор-2-метоксифенил)пиперазин в виде масла;
заменяя на 4-хлор-2-(2,2,2-трифторэтокси)анилин, получали 1-[4-хлор-2-(2,2,2-трифторэтокси)фенил]пиперазин в виде пены;
заменяя на 4-фтор-2-(2,2,2-трифторэтокси)анилин и проводя перекристаллизацию из раствора соляной кислоты в спирте, получали гидрохлорид 1-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазина, tпл 206-208oC;
заменяя на 5-фтор-2-метоксианилин, получали 1-(5-фтор-2-метоксифенил)пиперазин, tпл 181-183oC;
заменяя на 4-фтор-2-этоксианилин, получали 1-(4-фтор-2-этоксифенил)пиперазин в виде масла;
заменяя на 2-(трифторметокси)анилин, получали 1-(2-трифторметоксифенил)пиперазин в виде масла;
заменяя на 4-фтор-2-метоксианилин и проводя перекристаллизацию из раствора соляной кислоты в спирте, получали гидрохлорид 1-(4-фтор-2-метоксифенил)пиперазина, tпл 202-204oC;
заменяя на 5-хлор-2-метоксианилин, получали 1-(5-хлор-2-метоксифенил)пиперазин;
заменяя на 5-хлор-2-(2,2,2-трифторэтокси)анилин, получали 1-[5-хлор-2-(2,2,2-трифторэтокси)фенил]пиперазин;
заменяя на 2-аминобифенил, получали 1-бифенил-2-илпиперазин в виде масла;
заменяя на 4-метил-2-(2,2,2-трифторэтокси)анилин и проводя перекристаллизацию из раствора соляной кислоты в спирте, получали 1-[4-метил-2-(2,2,2-трифторэтокси)фенил]пиперазин, tпл 215oC (разл.);
заменяя на 4-метокси-2-(2,2,2-трифторэтокси)анилин, получали 1-[4-метокси-2-(2,2,2-трифторэтокси)фенил]пиперазин;
заменяя на 2-трифторметиланилин, получали 1-(2-трифторметилфенил)пиперазин;
заменяя на 2-н-пропиланилин, получали 1-(2-н-пропилфенил)пиперазин, tпл 213-215oC;
заменяя на 2-неопентоксианилин, получали 1-(2-неопентоксифенил)пиперазин;
заменяя на 2-(2-пропинилокси)анилин, получали 1-[2-(2-пропинилокси)фенил]пиперазин;
заменяя на 2-циклопропиланилин, получали дигидрохлорид 1-(2-циклопропилфенил)пиперазина, tпл 124-133oC;
заменяя на 2-бензиланилин, получали 1-(2-бензилфенил)пиперазин;
заменяя на N-(2-аминофенил)ацетамид, получали N-(2-пиперазин-1-илфенил)ацетамид;
заменяя на N-(2-аминофенил)трифторацетамид, получали N-(2-пиперазин-1-илфенил)трифторацетамид;
заменяя на 4-метил-2-метоксианилин, получали 1-(4-метил-2-метоксифенил)пиперазин, tпл 207-224oC;
заменяя на 2-бром-4-фторанилин, получали 1-(2-бром-4-фторфенил)пиперазин;
заменяя на 2,4-ди(2,2,2-трифторэтокси)анилин, получали 1-[2,4-ди(2,2,2-трифторэтокси)фенил]пиперазин; и
заменяя на 2-(2,2,2-трифторэтокси)-2-метиланилин, получали 1-[2-(2,2,2-трифторэтокси)-4-метилфенил]пиперазин.
ПРИМЕР 14
1-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин
Ниже приведен способ получения соединения формулы 2, где R1 обозначает 2,2,2-трифторэтокси и R2 обозначает фтор в положении 4.
Смесь, содержащую гидрохлорид бис(2-хлорэтил)амина (14,3 г, 80 ммолей), гидрохлорид 4-фтор-2-(2,2,2-трифторэтокси)анилина (20 г, 81 ммоль), полученный в соответствии с примером 11, орто-дихлорбензол (40 мл) и н-гексанол (4 мл), кипятили в течение 4 часов с обратным холодильником. Реакционной смеси давали охладиться до 80oC, затем медленно разбавляли этилацетатом (100 мл) и давали охладиться до 25oC. Твердые фракции собирали, промывали этилацетатом (20 мл) и сушили под вакуумом при 60-65oC, получая дигидрохлорид 1-[4-фтор-2-(2,2,2-трифторэтокси)фенил] пиперазина (20,1 г, 56,4 ммоля), tпл 208-210oC.
ПРИМЕР 15
2-фтор-1-оксазол-2-илбензол
Ниже приведен способ получения соединения формулы 7, где L обозначает фтор, R1 обозначает оксазол-2-ил и R2 обозначает водород.
Смесь, содержащую 2-фторбензойную кислоту (4,5 г, 32,14 ммоля), оксалилхлорид (4,1 мл, 48,2 ммоля), ДМФ (2 капли) и метиленхлорид (40 мл), кипятили в течение 2 часов с обратным холодильником. Реакционной смеси давали охладиться до 25oC, затем перемешивали в течение приблизительно 12 часов и концентрировали. Остаток медленно добавляли к суспензии, содержащей гидробромид 2-бромэтиламина (5,7 г, 28 ммолей), триэтиламин (21 мл, 160 ммолей) и бензол (200 мл). Смесь кипятили в течение 12 часов с обратным холодильником, давали охладиться до 25oC, дополнительно перемешивали в течение 12 часов и разбавляли водой. Водный слой отделяли и экстрагировали метиленхлоридом (2х50 мл). Объединенные экстракты сушили (MgSO4) и концентрировали. Остаток очищали на силикагеле с помощью хроматографии на колонках, элюируя гексаном/этилацетатом (5: 1) и получая 2-фтор-1-(4,5-дигидрооксазол-2-ил)бензол (1,96 г, 11,9 ммоля).
Смесь, содержащую 2-фтор-1-(4,5-дигидрооксазол-2-ил)бензол (4,5 г, 27,3 ммоля), гидрат пероксида никеля (7 г) и бензол (40 мл), кипятили с обратным холодильником в течение 24 часов. Реакционной смеси давали охладиться до 25oC, затем фильтровали и концентрировали с помощью роторного испарителя. Остаток очищали на силикагеле с помощью хроматографии на колонках, элюируя гексаном/этилацетатом (5: 1) и получая 2-фтор-1-оксазол-2-илбензол (0,5 г, 3,07 ммоля).
ПРИМЕР 16
1-(2-оксазол-2-илфенил)пиперазин
Ниже приведен способ получения соединения формулы 2, где R1 обозначает оксазол-2-ил и R2 обозначает водород.
Смесь, содержащую N-бензилпиперазин (3,56 г, 20,2 ммоля) и ТГФ (25 мл), охлаждали до 0oC и добавляли н-бутиллитий (2,5 М в гексане, 7,6 мл, 19 ммолей). Смесь охлаждали и выдерживали при 0oC в течение 30 минут при перемешивании, перемешивали 1 час при 25oC, затем охлаждали до 0oC и медленно добавляли 2-фтор-1-оксазол- 2-илбензол (1,1 г, 6,75 ммоля). Реакционной смеси давали нагреться до 25oC, затем перемешивали в течение 90 минут и разбавляли водой. Водный слой отделяли и экстрагировали этилацетатом (3х30 мл). Объединенные экстракты промывали соляным раствором, сушили (MgSO4) и концентрировали. Остаток очищали на силикагеле с помощью хроматографии на колонках, элюируя гексаном/этилацетатом (9:1), получая 4-бензил-1-(2-оксазол-2-илфенил)пиперазин (0,805 г, 2,52 ммоля).
Смесь, содержащую 4-бензил-1-(2-оксазол-2-илфенил)пиперазин (0,906 г, 2,84 ммоля), полученный в соответствии с предыдущим абзацем, 10%-ный палладий на древесном угле (1 г) и метанол (20 мл), перемешивали в течение 4 часов при 25oC в атмосфере водорода (15 фунтов/кв.дюйм). Реакционную смесь фильтровали и концентрировали с помощью роторного испарителя, получая 1-(2-оксазол-2-илфенил)пиперазин (0,480 г, 2,1 ммоля).
Работая аналогично примеру 16, но заменяя на 2,4-дифтор-1-оксазол-2-илбензол, получали 1-(4-фтор-2-оксазол-2-илфенил)пиперазин.
ПРИМЕР 17
1-(2-пиррол-1-илфенил)пиперазин
Ниже приведен способ получения соединения формулы 2, где R1 обозначает пиррол-1-ил и R2 обозначает водород.
Смесь, содержащую 1-хлор-2-нитробензол (6,54 г, 41,5 ммоля), пиперазин-1-карбоксальдегид (4,7 г, 41,5 ммоля) и ДМФ (18 мл), выдерживали в течение 48 часов при 100oC. Затем реакционную смесь охлаждали, разбавляли водой и экстрагировали этилацетатом (3 раза). Объединенные экстракты промывали водой, сушили (MgSO4), фильтровали и концентрировали. Остаток очищали с помощью хроматографии на колонках на силикагеле, элюируя метиленхлоридом/метанолом (98:2), получая 4-(2-нитрофенил)пиперазин-1-карбальдегид (3,2 г, 13,7 ммоля).
Смесь, содержащую 4-(2-нитрофенил)пиперазин-1-карбальдегид (3,57 г, 15,2 ммоля), полученный в соответствии с предыдущим абзацем, 10%-ный палладий на древесном угле и этанол (50 мл), перемешивали в течение приблизительно 12 часов при 25oC в атмосфере водорода (15 фунтов/кв.дюйм). Затем реакционную смесь фильтровали и концентрировали, получая 4-(2-аминофенил)пиперазин-1-карбальдегид (2,91 г, 14,1 ммоля), tпл 129-133oC.
Смесь, содержащую 4-(2-аминофенил)пиперазин-1-карбальдегид (1,27 г, 6,2 ммоля), 2,5-диметокситетрагидрофуран (1,13 г, 8,6 ммоля) и концентрированную уксусную кислоту (4 мл), кипятили в течение 1,75 часа с обратным холодильником. Затем реакционную смесь охлаждали в ледяной бане, разбавляли водой со льдом и экстрагировали метиленхлоридом. Метиленхлоридный экстракт промывали водным гидроксидом натрия и затем водой, сушили (MgSO4), фильтровали и концентрировали. Остаток очищали с помощью хроматографии на колонках на силикагеле, элюируя метиленхлоридом/метанолом (97,5: 2,5) и получая 4-(2-пиррол-1-илфенил)пиперазин-1-карбальдегид (1,12 г, 4,4 ммоля) в виде масла.
Смесь, содержащую 4-(2-пиррол-1-илфенил)пиперазин-1-карбальдегид (1,12 г, 4,4 ммоля), гидроксид натрия (440 мг, 11 ммолей) и метанол (10 мл), выдерживали в течение 14 часов при 50oC. Реакционной смеси давали охладиться до приблизительно 25oC и затем разделяли между водой (20 мл) и дихлорэтаном (30 мл). Водный слой отделяли и экстрагировали дихлорэтаном (3х30 мл). Объединенные дихлорэтановые экстракты промывали соляным раствором и сушили (K2CO3). Остаток очищали с помощью хроматографии на колонках на силикагеле, элюируя градиентом от 1 до 5% метанол/0,1% триэтиламин/дихлорэтан и получая 1-(2-пиррол-2-илфенил)пиперазин (0,77 г, 3,4 ммоля). Работая аналогично примеру 17, но заменяя 1-хлор-2-нитробензол на 4-хлор-3-нитротолуол, получали 1-(4-метил-2-пиррол-1-илфенил)пиперазин.
ПРИМЕР 18
1-[2-(2,2,2-трифторэтокси)-4-гидроксифенил]пиперазин
Ниже приведен способ получения соединения формулы 2, где R1 обозначает 2,2,2-трифторэтокси и R2 обозначает водород.
Смесь, содержащую 1-[2-(2,2,2-трифторэтокси)-4-метоксифенил] пиперазин (1,87 г, 6,4 ммоля) и 48%-ную водную бромистоводородную кислоту (5 мл), кипятили с обратным холодильником в течение 17 часов. Реакционной смеси давали охладиться и затем концентрировали под вакуумом. Остаток растворяли в этаноле (10 мл) приблизительно при 55oC и раствор охлаждали до 0oC. Твердые фракции собирали, промывали холодным этанолом (3х10 мл) и сушили под вакуумом приблизительно при 80oC, получая гидробромид 1-[2-(2,2,2-трифторэтокси)-4-гидроксифенил] пиперазина, tпл 190-194oC. Анализ: рассчитано для C12H14F3N2O2•(HBr)0,5• H2O: C 43,00; H 5,27; N 8,37%; обнаружено: C 43,41; H 4,97; N 8,36%.
ПРИМЕР 19
1-метоксиметил-3-(3-хлорпропил)-5-метил-2,4(1H,3H)-пиримидиндион
Ниже приведен способ получения защищенного производного соединения формулы 3, где L обозначает хлор, каждый радикал R3 и R4 обозначает водород и R5 обозначает группу формулы (a), в которой Z обозначает CH, R7 обозначает метил и защитная группа является метоксиметилом.
Смесь, содержащую 1-метоксиметил-5-метил-2,4(1H,3H)-пиримидиндион (115 г, 0,68 моля), полученный в соответствии с примером 6, гидроксид натрия (29,7 г, 0,74 моля), бромид тетра-н-бутиламмония (10,9 г, 30 ммолей) и ДМФ (350 мл), выдерживали при 25-35oC при интенсивном перемешивании до получения практически гомогенного раствора. Затем смесь охлаждали до 25oC и добавляли 1-бром-3-хлорпропан (73,5 мл, 0,75 молей). Смесь выдерживали при перемешивании в течение 16 часов при 25-35oC и затем распределяли
между этилацетатом (250 мл) и водой (600 мл). Водный слой экстрагировали этилацетатом (4х50 мл) и объединенные экстракты промывали разбавленным гидроксидом натрия и водой, сушили (MgSO4), фильтровали и концентрировали под вакуумом, получая 1-метоксиметил-3-(3-хлорпропил)-5-метил-2,4(1H,3H)-пиримидиндион (154,5 г, 0,63 моля) в виде масла.
Работая аналогично примеру 19, но заменяя 1-метоксиметил-5-метил-2,4(1H, 3H)-пиримидиндион на различные исходные вещества, получали следующие соединения формулы 3 или их защищенные производные:
заменяя на 1-бензил-5-метил-2,4(1H,3H)-пиримидиндион, получали 1-бензил-3-(3-хлорпропил)-5-метил-2,4(1H,3H)-пиримидиндион, tпл 48-50oC;
заменяя на 4-бензил-6-метил-1,2,4-триазин-3,5(2H,4H)-дион, получали 2-(3-хлорпропил)-6-метил-1,2,4-триазин-3,5(2H,4H)-дион;
заменяя на 2-бензил-6- метил-1,2,4-триазин-3,5(2H, 4H)-дион, получали 4-(3-хлорпропил)-6- метил-1,2,4-триазин-3,5(2H,4H)-дион;
заменяя на 1-(4-метоксибензил)-5-циан-2,4(1H,3H)-пиримидиндион, получали 3-(3-хлорпропил)-1-(4-метоксибензил)-5-циан-2,4(1H,3H)-пиримидиндион;
заменяя на 1-бензил-5-этил-2,4(1H, 3H)-пиримидиндион, получали 1-бензил-3-(3-хлорпропил)-5-этил-2,4(1H,3H)-пиримидиндион в виде масла;
заменяя на 1-бензил-5-пропил-2,4(1H,3H)-пиримидиндион, получали 1-бензил-3-(3-хлорпропил)-5-пропил-2,4(1H,3H)-пиримидиндион в виде масла;
заменяя на 1-[2-(триметилсилил)этоксиметил] -2,4(1H,3H)-пиримидиндион, получали 3-(3-хлорпропил)-1-[2-(триметилсилил)этоксиметил] -2,4(1H,3H)- пиримидиндион в виде масла;
заменяя на 1-бензил-6-метил-2,4(1H, 3H)-пиримидиндион, получали 1-бензил-3-(3-хлорпропил)-6-метил-2,4(1H,3H)-пиримидиндион;
заменяя на 3-бензил-6-метил-2,4(1H, 3H)-пиримидиндион, получали 3-бензил-1-(3-хлорпропил)-6-метил-2,4(1H,3H)-пиримидиндион;
заменяя на 5-метил-1-фенил-2,4(1H,3H)-пиримидиндион, получали 3-(3-хлорпропил)-5-метил-1-фенил-2,4(1H,3H)-пиримидиндион;
заменяя на 5-метил-3-фенил-2,4(1H, 3H)-пиримидиндион, получали 1-(3-хлорпропил)-5-метил-3-фенил-2,4(1H,3H)-пиримидиндион;
заменяя на 1-(4-фторфенил)-5-метил-2,4(1H, 3H)-пиримидиндион, получали 3-(3-хлорпропил)-1-(4-фторфенил)-5-метил-2,4(1H,3H)-пиримидиндион;
заменяя на 3-(4-фторфенил)-5-метил-2,4(1H, 3H)-пиримидиндион, получали 1-(3-хлорпропил)-3-(4-фторфенил)-5-метил-2,4(1H,3H)-пиримидиндион;
заменяя на 1- бензил-5-циан-2,4(1H,3H)-пиримидиндион, получали 1-бензил-3-(3-хлорпропил)-5-циан-2,4(1H,3H)-пиримидиндион;
заменяя на 1-бифенил-3-илметил-5-метил-2,4(1H,3H)-пиримидиндион, получали 1-бифенил-3-илметил-3-(3-хлорпропил)-5-метил-2,4(1H,3H)-пиримидиндион;
заменяя на 1-(2-метилбензил)-5-метил-2,4(1H,3H)-пиримидиндион, получали 3-(3-хлорпропил)-1-(2-метилбензил)-5-метил-2,4(1H,3H)-пиримидиндион;
заменяя на 1-(2,4-диметилбензил)-5-метил-2,4(1H,3H)-пиримидиндион, получали 3-(3-хлорпропил)-1-(2,4-диметилбензил)-5-метил-2,4(1H, 3H)-пиримидиндион;
заменяя на 1-(4-метоксибензил)-5-метил-2,4(1H,3H)-пиримидиндион, получали 3-(3-хлорпропил)-1-(4-метоксибензил)-5-метил-2,4(1H,3H)-пиримидиндион;
заменяя на 1-циклогексилметил-5-метил-2,4(1H,3H)-пиримидиндион, получали 3-(3-хлорпропил)-1-циклогексилметил-5-метил-2,4(1H,3H)-пиримидиндион;
заменяя на 5-метил-1-пиразин-2-ил-2,4(1H, 3H)-пиримидиндион, получали 3-(3-хлорпропил)-5-метил-1-пиразин-2-ил-2,4(1H,3H)-пиримидиндион;
заменяя на 1-бензил-2,4-диоксо-5(1H,3H)-пиримидинкарбальдегид, получали 1-бензил-3-(3-хлорпропил)-2,4-диоксо-5(1H,3H)-пиримидинкарбальдегид;
заменяя на 1-фур-2-ил-5-метил-2,4(1H, 3H)-пиримидиндион, получали 1-фур-2-ил-3-(3-хлорпропил)-5-метил-2,4(1H,3H)-пиримидиндион;
заменяя на 1,5-диметил-2,4(1H,3H)-пиримидиндион, получали 3-(3-хлорпропил)-1,5-диметил-2,4(1H,3H)-пиримидиндион;
заменяя на 5-метил-1-тиен-2-ил- 2,4(1H,3H)-пиримидиндион, получали 3-(3-хлорпропил)-5-метил-1-тиен-2-ил-2,4(1H,3H)-пиримидиндион;
заменяя на 1-фур-3-ил-5-метил-2,4(1H, 3H)-пиримидиндион, получали 1-фур-3-ил-3-(3-хлорпропил)-5-метил-2,4(1H,3H)-пиримидиндион;
заменяя на 5-метил-1-пирид-4-ил- 2,4(1H,3H)-пиримидиндион, получали 3-(3-хлорпропил)-5-метил-1-пирид-4-ил-2,4(1H,3H)-пиримидиндион;
заменяя на 1-бензил-2,4(1H,3H)-пиримидиндион, получали 1-бензил-3-(3-хлорпропил)-2,4(1H,3H)-пиримидиндион;
заменяя на 5-метил-1-пирид-3-ил-2,4(1H,3H)-пиримидиндион, получали 3-(3-хлорпропил)-5-метил-1-пирид-3-ил-2,4(1H,3H)-пиримидиндион;
заменяя на 5-метил-1-пирид-2-ил-2,4(1H,3H)-пиримидиндион, получали 3-(3-хлорпропил)-5-метил-1-пирид-2-ил-2,4(1H,3H)-пиримидиндион;
заменяя на 3-бензил-5,6-диметил-2,4(1H,3H)-пиримидиндион, получали 3-бензил-1-(3-хлорпропил)-5,6-диметил-2,4(1H,3H)-пиримидиндион;
заменяя на 1-бензил-5,6-диметил-2,4(1H,3H)-пиримидиндион, получали 1-бензил-3-(3-хлорпропил)-5,6-диметил-2,4(1H,3H)-пиримидиндион, tпл 72-74oC;
заменяя на 3-бензил-5-метил-2,4(1H, 3H)-пиримидиндион, получали 3-бензил-1-(3-хлорпропил)-5-метил-2,4(1H,3H)-пиримидиндион в виде масла;
заменяя на 1-бензил-5-трифторметил-2,4(1H, 3H)-пиримидиндион, получали 1-бензил-3-(3-хлорпропил)-5-трифторметил-2,4(1H, 3H)-пиримидиндион, tпл 100-101oC;
заменяя на 5-гидроксиметил-1-[2-(триметилсилил)этоксиметил] -2,4(1H, 3H)-пиримидиндион, получали 3-(3-хлорпропил)-5-гидроксиметил-1-[2-(триметилсилил)этоксиметил]- 2,4(1H,3H)-пиримидиндион;
заменяя на 1-[2-(триметилсилил)этоксиметил]-5-метокси-2,4(1H,3H)-пиримидиндион, получали 3-(3-хлорпропил)-1-[2-(триметилсилил)этоксиметил]-5-метокси- 2,4(1H,3H)-пиримидиндион;
заменяя на трет-бутил-5-проп-2-ил-2,4-диоксо-(1H, 3H)-1-пиримидинкарбоксилат, получали трет-бутил-3-(3-хлорпропил)-5-проп-2-ил-2,4-диоксо-(1H, 3H)-1- пиримидинкарбоксилат;
заменяя на 1-(2,2,2-трифторэтокси)-5-метил-2,4(1H, 3H)-пиримидиндион, получали 3-(3-хлорпропил)-1-(2,2,2-трифторэтокси)-5-метил-2,4(1H,3H)-пиримидиндион;
заменяя на трет-бутил-5-метилтио-2,4-диоксо-(1H,3H)-1-пиримидинкарбоксилат, получали трет-бутил-3-(3-хлорпропил)-5-метилтио-2,4-диоксо-(1H,3H)-1- пиримидинкарбоксилат; и
заменяя на трет-бутил-5-фур-2-ил-2,4-диоксо-(1H,3H)-1-пиримидинкарбоксилат, получали трет-бутил-3-(3-хлорпропил)-5-фур-2-ил-2,4-диоксо-(1H,3H)-1- пиримидинкарбоксилат.
ПРИМЕР 20
3-(3-хлорпропил)-5-метил-2,4(1H,3H)-пиримидиндион
Ниже приведен способ получения соединения формулы 3, где L обозначает хлор, каждый радикал R3 и R4 обозначает водород и R5 обозначает группу формулы (a), в которой Z обозначает CH, R6 обозначает водород и R7 обозначает метил.
Смесь, содержащую 1-метоксиметил-3-(3-хлорпропил)-5-метил-2,4(1H,3H)-пиримидиндион (40,4 г, 0,16 моля) и изопропанол (200 мл), нагревали до 60oC и добавляли к концентрированной при температуре кипения с обратным холодильником соляной кислоте (200 мл) с такой скоростью, чтобы реакционная смесь продолжала медленно кипеть с обратным холодильником. Смесь кипятили в течение 3 часов с обратным холодильником и затем перегоняли для удаления побочного продукта - метанола. Смесь выдерживали в течение 4,5 часов при 92oC, охлаждали до 25oC, сливали в воду (650 мл), насыщенную гидроксидом натрия, и экстрагировали этилацетатом (5х300 мл). Объединенные экстракты промывали бикарбонатом натрия и водой и концентрировали под вакуумом. Остаток перекристаллизовывали из толуола/изопропанола (10:1, 55 мл) и твердые фракции собирали, промывали гексаном и сушили при 60oC (15 г 1-й выход). Маточные растворы концентрировали, собирали твердые фракции, сушили (2-й выход) и объединяли с первым выходом, получая 3-(3-хлорпропил)-5-метил-2,4(1H,3H)-пиримидиндион (19,8 г, 94 ммоля).
ПРИМЕР 21
3-(3-хлорпропил)-5-метил-2,4(1H,3H)-пиримидиндион
Ниже приведен способ получения соединения формулы 3, где L обозначает хлор, каждый из R3 и R4 обозначает водород и R5 обозначает группу формулы (a), в которой Z обозначает CH, R6 обозначает водород и R7 обозначает метил.
Смесь, содержащую 1-бензил-3-(3-хлорпропил)-5-метил-2,4(1H,3H)-пиримидиндион (1 г, 3,41 ммоля), полученный в соответствии с примером 19, 10%-ный палладий на древесном угле (1 г) и 0,1 М формиат аммония/метанол (340 мл), кипятили с обратным холодильником в течение 3 часов в атмосфере аргона. Реакционной смеси давали охладиться до 25oC, затем фильтровали и концентрировали под вакуумом. Остаток очищали с помощью хроматографии на колонках на силикагеле, элюируя гексаном/этилацетатом (1:1), получая 3-(3-хлорпропил)-5-метил-2,4(1H,3H)-пиримидиндион (0,52 г, 2,57 ммоля), tпл 117-121oC.
Работая аналогично примеру 21, но заменяя 1-бензил-3-(3-хлорпропил)-5-метил-2,4(1H,3H)-пиримидиндион на различные исходные вещества, получали следующие соединения формулы 3 или их защищенные производные:
заменяя на 4-бензил-2-(3-хлорпропил)-6-метил-1,2,4-триазин-3,5(2H,4H)-дион, получали 2-(3-хлорпропил)-6-метил-1,2,4-триазин-3,5(2H,4H)-дион;
заменяя на 2-бензил-2-(3-хлорпропил)-6-метил-1,2,4-триазин-3,5(2H,4H)-дион, получали 4-(3-хлорпропил)-6-метил-1,2,4-триазин-3,5(2H,4H)-дион;
заменяя на 3-бензил-1-(3-хлорпропил)-5-метил-2,4(1H,3H)-пиримидиндион, получали 1-(3-хлорпропил)-5-метил-2,4(1H,4H)-пиримидиндион;
заменяя на 3-бензил-1-(3-хлорпропил)-5,6-диметил-2,4(1H,3H)-пиримидиндион, получали 1-(3-хлорпропил)-5,6-диметил-2,4(1H,3H)-пиримидиндион;
заменяя на 3-бензил-1-(3-хлорпропил)-6-метил-2,4(1H,3H)-пиримидиндион, получали 1-(3-хлорпропил)-6-метил-2,4(1H,3H)-пиримидиндион;
заменяя на 1-бензил-3-(3-хлорпропил)-5-трифторметил-2,4(1H,3H)-пиримидиндион, получали 3-(3-хлорпропил)- 5-трифторметил-2,4(1H,3H)-пиримидиндион;
заменяя на 1-бензил-3-(3-хлорпропил)-6-метил-2,4(1H,3H)-пиримидиндион, получали 3-(3-хлорпропил)-6-метил-2,4(1H,3H)-пиримидиндион;
заменяя на 1-бензил-3-(3-хлорпропил)-5-этил-2,4(1H, 3H)-пиримидиндион, получали 3-(3-хлорпропил)-5-этил-2,4(1H,3H)-пиримидиндион;
заменяя на 1-бензил-5-метил-2,4,6(1H, 3H, 5H)-пиримидинтрион, получали 5-метил-2,4,6(1H,3H,5H)-пиримидинтрион; и
заменяя на 1-бензил-3-(3-хлорпропил)-5-метил-2,4(1H,3H)-пиримидиндион, получали 3-(3-хлорпропил)-5-метил-2,4(1H,3H)-пиримидиндион.
ПРИМЕР 22
1-(1-бензил-5-метил-2,4-диоксо-(1H, 3H)-пиримидин-3- илметил)циклопроп-1-илметилметансульфонат
Ниже приведен способ получения соединения формулы 3, где L обозначает метансульфонилокси, R3 и R4 вместе обозначают тетраметилен и R5 обозначает группу формулы (a), в которой Z обозначает CH, R6 обозначает бензил и R7 обозначает метил.
Смесь, содержащую 1-циан-1-пропанкарбоновую кислоту (2 г, 18 ммолей), безводный триэтиламин (3,3 мл, 23,5 ммоля) и ТГФ (25 мл), охлаждали до температуры между -5oC и 0oC и добавляли смесь метилхлорформиата (1,7 мл, 21,5 ммоля) и ТГФ (10 мл) с такой скоростью, чтобы температура реакционной смеси поддерживалась между -5oC и 0oC. Смесь перемешивали в течение 30 минут, охлаждали до 0oC и фильтровали (промывая ТГФ (5х10 мл)). Объединенный фильтрат охлаждали до 0oC в атмосфере аргона и добавляли к смеси борогидрида натрия (2,04 г, 53,9 ммоля) и воды (12,5 мл) при температуре <10oC. Смесь перемешивали в течение 2 часов при 25oC, обрабатывали 10%-ной соляной кислотой и концентрировали. Оставшуюся смесь обрабатывали 10%-ным бикарбонатом натрия и экстрагировали этилацетатом. Органический слой промывали соляным раствором, сушили (MgSO4) и концентрировали досуха. Остаток очищали с помощью быстрой хроматографии на силикагеле, элюируя гексаном/этилацетатом (7:3), получая 1-цианциклопроп-1-илметанол (1,16 г, 11,9 ммоля) в виде масла.
Смесь, содержащую 1-цианциклопроп-1-илметанол (4,31 г, 44,4 ммоля), полученный в соответствии с описанием в предыдущем абзаце, триэтиламин (9,04 мл, 64,8 ммоля) и метиленхлорид (78 мл), охлаждали в атмосфере аргона до температуры между 0oC и 5oC и медленно добавляли метансульфонилхлорид (4,67 мл, 59,9 ммоля). Смесь выдерживали в течение 3 часов при перемешивании при 0-5oC, затем разбавляли водой и экстрагировали метиленхлоридом. Экстракт промывали 5%-ным бикарбонатом натрия, сушили (MgSO4) и концентрировали досуха, получая 1-цианциклопроп-1-илметилметансульфонат.
Смесь 1-цианциклопроп-1-илметилметансульфоната и ДМФ (78 мл) добавляли к смеси, содержащей 1-бензил-5-метил-2,4(1H, 3H)-пиримидиндион (9,1 г, 42,2 ммоля), 60%-ный гидрид натрия (1,95 г, 48,8 ммоля) и ДМФ (117 мл), при 0-5oC. Смесь выдерживали в течение 20 часов при 45-55oC, затем разбавляли водой (20 мл) и насыщенным хлоридом аммония (20 мл) и экстрагировали этилацетатом. Экстракт промывали водой и затем соляным раствором, сушили (MgSO4) и концентрировали досуха. Остаток очищали с помощью быстрой хроматографии на силикагеле, элюируя гексаном/этилацетатом (1:1), получая 1-бензил-3-(1-цианциклопроп-1-илметил)-5-метил-2,4(1H, 3H)-пиримидиндион (10,4 г, 35,2 ммоля).
Смесь, содержащую 1-бензил-3-(1-цианциклопроп-1-илметил)-5-метил-2,4(1H, 3H)-пиримидиндион (10,4 г, 35,2 ммоля), уксусную кислоту (37,4 мл) и концентрированную соляную кислоту (164,4 мл), кипятили в течение 2 часов с обратным холодильником. Затем реакционную смесь разбавляли водой (150 мл) и экстрагировали метиленхлоридом. Экстракт подвергали экстракции 5%-ным гидроксидом натрия (3 раза). Объединенную водную фазу обрабатывали 10%-ной соляной кислотой и экстрагировали метиленхлоридом. Метиленхлоридный экстракт промывали водой, сушили (MgSO4) и концентрировали досуха, получая 1-(1-бензил-5-метил-2,4-диоксо-(1H, 3H)-пиримидин-3-илметил)-1- циклопропанкарбоновую кислоту (11,03 г, 35,1 ммоля).
Смесь, содержащую 1-(1-бензил-5-метил-2,4-диоксо-(1H,3H)-пиримидин-3-илметил)-1- циклопропанкарбоновую кислоту (11 г, 35 ммолей), триэтиламин (6,46 мл, 45,6 ммоля) и ТГФ (138 мл), охлаждали до 0oC в атмосфере аргона и добавляли смесь метилхлорформиата (3,23 мл, 42 ммоля) и ТГФ (20 мл) с такой скоростью, чтобы температура реакционной смеси сохранялась на уровне 0oC. Смесь выдерживали в течение 30 минут при перемешивании при температуре 0-2oC и затем фильтровали (промывая ТГФ, (3х50 мл)). Объединенный фильтрат охлаждали до 0oC в атмосфере аргона и добавляли к смеси борогидрида натрия (3,29 г, 87 ммолей) и воды (23,3 мл) при температуре <10oC. Смесь перемешивали в течение 2 часов, разбавляли водой (20 мл), обрабатывали 10%-ной соляной кислотой, разбавляли соляным раствором (40 мл) и экстрагировали этилацетатом (4х100 мл). Объединенные экстракты промывали соляным раствором, сушили (MgSO4) и концентрировали досуха. Остаток очищали с помощью быстрой хроматографии на силикагеле, элюируя гексаном/этилацетатом (7:3), получая 1-(1-бензил-5-метил-2,4-диоксо-(1H,3H)-пиримидин-3- илметил)циклопроп-1-илметанол (9,52 г, 31,7 ммоля), tпл 81,5oC.
Смесь, содержащую 1-(1-бензил-5-метил-2,4-диоксо-(1H,3H)-пиримидин-3-илметил)циклопроп-1- илметанол (1,95 г, 6,5 ммоля), триэтиламин (1,32 мл, 9,5 ммоля) и метиленхлорид (20 мл), охлаждали до температуры между 0oC и 5oC в атмосфере аргона и медленно добавляли метансульфонилхлорид (0,69 мл, 8,85 ммоля). Смесь выдерживали в течение 2 часов при перемешивании при 0-5oC, затем разбавляли водой (20 мл) и экстрагировали метиленхлоридом. Экстракт промывали 5%-ным бикарбонатом натрия, сушили (MgSO4) и концентрировали, получая 1-(1-бензил-5-метил-2,4-диоксо-(1H,3H)-пиримидин-3-илметил)циклопроп-1- илметилметансульфонат.
ПРИМЕР 23
1-оксид 3-(3-хлорпропил)-5-метил-2,4-диоксо-(1H,3H)-пиримидин-1- илметилпиридина
Ниже приведен способ получения соединения формулы 3, где L обозначает хлор, каждый радикал R3 и R4 обозначает водород и R5 обозначает группу формулы (a), в которой Z обозначает CH, R6 обозначает 1-оксидопирид-4-илметил и R7 обозначает метил.
Смесь, содержащую 3-(3-хлорпропил)-5-метил-1-пирид-4-ил-2,4(1H,3H)-пиримидиндион (0,54 г, 1,84 ммоля), полученный в соответствии с примером 4, и метиленхлорид (20 мл), охлаждали до 0oC, обрабатывали 3-хлорпероксибензойной кислотой (технической чистоты, 0,55 г, 2,2 ммоля), перемешивали в течение 10 часов и затем распределяли между водным бикарбонатом натрия (20 мл) и метиленхлоридом (50 мл). Органический слой отделяли, промывали 10%-ным сульфатом натрия (1х10 мл) и соляным раствором (1х10 мл) и концентрировали под вакуумом, получая 1-оксид 3-(3-хлорпропил)-5-метил-2,4-диоксо-(1H,3H)-пиримидин-1- илметилпиридина (0,53 г, 1,7 ммоля).
ПРИМЕР 24
3-{ 3-[4-(4-хлор-2-метоксифенил)пиперазин-1-ил] пропил}-5-метил- 2,4(1H, 3H)-пиримидиндион
Ниже приведен способ получения соединения формулы I, где R1 обозначает метокси, R2 обозначает хлор в положении 4, каждый радикал R3 и R4 обозначает водород и R5 обозначает группу формулы (a), в которой Z обозначает CH, R6 обозначает водород и R7 обозначает метил.
Смесь, содержащую 3-(3-хлорпропил)-5-метил-2,4(1H,3H)-пиримидиндион (223 мг, 0,98 ммоля), полученный в соответсвии с примером 19, и 1-(4-хлор-2-метоксифенил)пиперазин (200 мг, 0,98 ммоля), полученный в соответствии с примером 12, выдерживали в течение 2 часов при перемешивании при 180-190oC, давали охладиться до 25oC и затем очищали с помощью препаративной тонкослойной хроматографии на силикагеле, элюируя смесью метиленхлорид/(метиленхлорид/метанол/гидроксид аммония 60:10:1) (7:3), и получали 3-{ 3-[4-(4-хлор-2-метоксифенил)пиперазин-1-ил]пропил}-5-метил- 2,4(1H,3H)-пиримидиндион. Путем перекристаллизации свободного основания из раствора хлористого водорода в метаноле получали гидрохлорид 3-{3-[4-(4-хлор-2-метоксифенил)пиперазин-1-ил] пропил} -5-метил- 2,4(1H, 3H)-пиримидиндиона, tпл 182-184oC. Анализ: рассчитано для C19H25ClN4O3•(HCl)2: C 48,25; H 5,92; N 11,84%; обнаружено: C 48,55; H 5,81; N 11,85%.
Работая аналогично примеру 24, но заменяя 1-(4-хлор-2-метоксифенил)пиперазин и/или 3-(3-хлорпропил)-5-метил-2,4(1H, 3H)-пиримидиндион на различные исходные материалы, получали следующие соединения формулы I:
заменяя на 1-[4-хлор-2-(2,2,2, -трифторэтокси)фенил]пиперазин и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-{ 3-[4-(4-хлор-2-(2,2,2-трифторэтокси)фенил)пиперазин-1-ил] пропил}-5- метил-2,4(1H,3H)-пиримидиндиона, tпл 180-182oC; анализ: рассчитано для C20H24ClN4O3•C4H4O4: C 49,19; H 4,84; N 9,57%; обнаружено: C 49,29; H 4,78; N 9,40%;
заменяя на 1-(2-фур-2-илфенил)пиперазин и 1-трет-бутил-3-(3-хлорпропил)-5-метил-2,4-диоксо-(1H, 3H)-1- пиримидинкарбоксилат и перекристаллизовывая из раствора щавелевой кислоты в спирте, получали оксалат 3-{3-[4-(2-фур-2-илфенил)пиперазин-1-ил]пропил}-5-метил-2,4(1H,3H)- пиримидиндиона, tпл 225-226oC;
заменяя на 1-(4-фтор-2-гидроксифенил)пиперазин и 1-трет-бутил-3-(3-хлорпропил)-5-метил-2,4-диоксо-(1H,3H)-1- пиримидинкарбоксилат и перекристаллизовывая из раствора бромистоводородной кислоты в спирте, получали гидробромид 3-{3-[4-(4-фтор-2-гидроксифенилфенил)пиперазин-1-ил]пропил}-5-метил- 2,4(1H,3H)-пиримидиндиона, tпл 265-268oC; анализ: рассчитано для C18H23FN4O3•HBr: C 41,24; H 4,81; N 10,69%; обнаружено: C 41,44; H 4,91; N 10,61%;
заменяя на 1-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин и 1-трет-бутил-3-(3-хлорпропил)-5-метилтио-2,4-диоксо-(1H, 3H)-1- пиримидинкарбоксилат, получали гидрохлорид 3-{3-[4-(4-фтор-2-(2,2,2-трифторэтокси)фенил)пиперазин-1-ил] пропил} -5- метил-2,4(1H, 3H)-пиримидиндиона, tпл 183-186oC (разл.); анализ: рассчитано для C20H25F4N4O3•HCl: C 46,83; H 4,91; N 10,92%; обнаружено: C 46,91; H 5,01; N 10,78%;
заменяя на 1-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин и трет-бутил-3-(3-хлорпропил)-5-проп-2-ил-2,4-диоксо-(1H, 3H)-1- пиримидинкарбоксилат, получали гидрохлорид 3-{3-[4-(2-(4-фтор-2,2,2-трифторэтокси)фенил)пиперазин-1-ил] пропил}-5- проп-2-ил-2,4(1H,3H)-пиримидиндиона, tпл 204-206oC; анализ: рассчитано для C22H28F4N4O3•(HCl)1,5• (H2O)0,5: C 49,28; H 5,73; N 10,45%; обнаружено: C 49,57; H 5,62; N 10,42%; и
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил] пиперазин и трет-бутил-3-(3-хлорпропил)-5-фур-2-ил-2,4-диоксо-(1H, 3H)-1- пиримидинкарбоксилат и перекристаллизовывая из раствора щавелевой кислоты в спирте, получали оксалат 3-{ 3-[4-(2-(2,2,2-трифторэтокси)фенил)пиперазин-1-ил] пропил}-5-фур-2- ил-2,4(1H,3H)-пиримидиндиона, tпл 202-206oC; анализ: рассчитано для C23H25F3N4O2• C2H2O4: C 52,81; H 4,78; N 9,85%; обнаружено: C 52,68; H 4,89; N 9,61%;
ПРИМЕР 25
1-бензил-3-{3-[4-(2-метоксифенил)пиперазин-1-ил]пропил}-5-метил- 2,4(1H, 3H)-пиримидиндион
Ниже приведен способ получения соединения формулы I, где R1 обозначает метокси, каждый из R2, R3 и R4 обозначает водород и R5 обозначает группу формулы (a), в которой Z обозначает CH, R6 обозначает бензил и R7 обозначает метил.
Смесь, содержащую 1-бензил-3-(3-хлорпропил)-5-метил-2,4(1H, 3H)- пиримидиндион (550 мг, 1,87 ммоля), полученный в соответствии с примером 19, 1-(2-метоксифенил)пиперазин (367 мг, 1,87 ммоля), йодид натрия (623 мг, 3,75 ммоля), карбонат калия (260 мг, 1,81 ммоля) и ацетонитрил (50 мл), перемешивали в течение 8 часов при температуре кипения с обратным холодильником. Затем реакционную смесь сливали в воду (200 мл) и экстрагировали метиленхлоридом (3х100 мл). Объединенные экстракты сушили (Na2SO4) и концентрировали под вакуумом. Остаток очищали с помощью хроматографии на колонках на силикагеле, элюируя гексаном/этилацетатом (1:1), получая 1-бензил-3-{3-[4-(2-метоксифенил)пиперазин-1-ил] пропил} -5-метил- 2,4(1H,3H)-пиримидиндион (800 мг, 1,78 ммоля) в виде масла. Путем перекристаллизации свободного основания из раствора соляной кислоты в спирте получали гидрохлорид 1-бензил-3-{3-[4-(2-метоксифенил)пиперазин-1-ил] пропил} -5-метил- 2,4(1H,3H)-пиримидиндиона, tпл 195-198oC. Анализ: рассчитано для C26H32N4O3•(HCl)2: C 59,88; H 6,57; N 10,74%; обнаружено: C 59,71; H 6,64; N 10,73%.
Работая аналогично примеру 25, но заменяя 3-(3-хлорпропил)-1-бензил-5-метил-2,4(1H, 3H)-пиримидиндион и/или 1-(2-метоксифенил)пиперазин на различные исходные материалы, получали следующие соединения формулы I или их защищенные производные:
заменяя на 3-бензил-1-(3-хлорпропил)-5-метил-2,4(1H,3H)-пиримидиндион, получали гидрохлорид 3-бензил-1-{3-[4-(2-метоксифенил)пиперазин-1-ил]пропил} -5-метил-2,4(1H, 3H)- пиримидиндиона, tпл 209-211oC; анализ: рассчитано для C26H32N4O3•(HCl)2: C 59,88; H 6,57; N 10,74%; обнаружено: C 59,85; H 6,57; N 10,70%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил]пиперазин, получали гидрохлорид 1-бензил-3-{3-[4-(2-(2,2,2-трифторэтокси)фенил)пиперазин-1- ил]пропил} -5-метил-2,4(1H, 3H)-пиримидиндиона, tпл 87-89oC; анализ: рассчитано для C27H31F3N4O3•HCl: C 55,91; H 6,08; N 9,66%; обнаружено: C 56,20; H 5,96; N 9,33%;
заменяя на 1-(5-фтор-2-метоксифенил)пиперазин, получали гидрохлорид 1-бензил-3-{ 3-[4-(5-фтор-2-метоксифенил)пиперазин-1- ил] пропил} -5-метил-2,4(1H,3H)-пиримидиндиона, tпл 165-167oC; анализ: рассчитано для C26H31FN4O3•(HCl)2: C 57,88; H 6,16; N 10,38%; обнаружено: C 57,67; H 6,20; N 10,30%;
заменяя на 1-[4-хлор-2-(2,2,2-трифторэтокси)фенил] пиперазин и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 1-бензил-3-{ 3-[4-(4-хлор-2-(2,2,2-трифторэтокси)фенил)пиперазин-1- ил]пропил} -5-метил-2,4(1H, 3H)-пиримидиндиона, tпл 156-158oC; анализ: рассчитано для C27H30F3N4O3• C4H4O4: C 55,07; H 5,22; N 8,29%; обнаружено: C 55,22; H 5,16; N 8,30%;
заменяя на 3-(3-хлорпропил)-1-бензил-5,6-диметил-2,4(1H,3H)-пиримидиндион, получали гидрохлорид 1-бензил-3-{3-[4-(2-метоксифенил)пиперазин-1-ил] пропил}-5,6- диметил-2,4(1H,3H)-пиримидиндиона, tпл 239-241oC; анализ: рассчитано для C27H34N4O3•(HCl)2: C 60,55; H 6,77; N 10,46%; обнаружено: C 60,33; H 6,79; N 10,37%;
заменяя на 1-(4-фтор-2-метоксифенил)пиперазин, получали гидрохлорид 1-бензил-3-{ 3-[4-(4-фтор-2-метоксифенил)пиперазин-1- ил] пропил} -5-метил-2,4(1H,3H)-пиримидиндиона, tпл 178-180oC; анализ: рассчитано для C26H31FN4O3•(HCl)2: C 57,50; H 6,20; N 10,32%; обнаружено: C 57,42; H 6,14; N 10,13%;
заменяя на 1-(4-хлор-2-метоксифенил)пиперазин, получали гидрохлорид 1-бензил-3-{ 3-[4-(4-хлор-2-метоксифенил)пиперазин-1-ил] пропил} -5- метил-2,4(1H,3H)-пиримидиндиона, tпл 184-186oC; анализ: рассчитано для C26H31ClN4O3•(HCl)2: C 55,86; H 5,96; N 10,00%; обнаружено: C 55,53; H 5,85; N 9,95%;
заменяя на 3-(3-хлорпропил)-1-бензил-5-трифторметил-2,4(1H,3H)-пиримидиндион, получали гидрохлорид 1-бензил-3-{3-[4-(2-метоксифенил)пиперазин-1-ил] пропил} -5- трифторметил-2,4(1H, 3H)-пиримидиндиона, tпл 240-241oC; анализ: рассчитано для C26H29F3N4O3•(HCl)2: C 54,26; H 5,43; N 9,73%; обнаружено: C 53,97; H 5,40; N 9,59%;
заменяя на 3-(3-хлорпропил)-5-циан-1-(4-метоксибензил)-2,4(1H,3H)-пиримидиндион, получали гидрохлорид 5-циан-1-(4-метоксибензил)-3-{3-[4-(2-метоксифенил)пиперазин-1- ил] пропил} -2,4(1H, 3H)-пиримидиндиона, tпл 248-249oC (разл. ); анализ: рассчитано для C27H31N5O4•(HCl)1,5: C 57,67; H 6,18; N 12,46%; обнаружено: C 57,68; H 6,02; N 12,36%;
заменяя на 1-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 1-бензил-3-(3-{ 4-[4-фтор-2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил}пропил)-5-метил-2,4(1H, 3H)-пиримидиндиона, tпл 145-146oC; анализ: рассчитано для C27H30F4N4O3• C4H4O4: C 57,22; H 5,26; N 8,61%; обнаружено: C 57,07; H 5,28; N 8,46%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил] пиперазин и на 3-(3-хлор)пропил-1-(2,4-диметилбензил)-5-метил-2,4(1H,3H)-пиримидиндион, получали гидрохлорид 3-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил}пропил)-1-(2,4- диметилбензил)-5-метил-2,4 (1H, 3H)-пиримидиндиона, tпл 113-115oC; анализ: рассчитано для C29H37F3N4O3•(HCl)2: C 55,04; H 6,16; N 8,85%; обнаружено: C 55,33; H 6,00; N 8,64%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил] пиперазин и на 3-(3-хлор)пропил-1-(2-метилбензил)-2,4(1H,3H)-пиримидиндион, получали гидрохлорид 3-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропил)-1-(2- метилбензил)-2,4(1H, 3H)-пиримидиндиона, tпл 172-174oC; анализ: рассчитано для C28H34F3N4O3•HCl: C 57,93; H 6,16; N 9,65%; обнаружено: C 57,86; H 6,02; N 9,55%;
заменяя на 3-(3-хлорпропил)-1-бензил-5-пропил-2,4(1H,3H)-пиримидиндион, получали гидрохлорид 1-бензил-3-{3-[4-(2-метоксифенил)пиперазин-1-ил]пропил} -5- пропил-2,4(1H,3H)-пиримидиндиона, tпл 202-204oC; анализ: рассчитано для C28H36N4O3•HCI: C 65,30; H 7,28; N 10,88%; обнаружено: C 65,07; H 7,24; N 10,74%;
заменяя на 3-(3-хлорпропил)-1-бензил-5-этил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 1-бензил-3-{3-[4-(2-метоксифенил)пиперазин-1-ил]пропил} -5-этил- 2,4(1H, 3H)-пиримидиндиона, tпл 183-185oC; анализ: рассчитано для C27H34N4O3•(HCl)2: C 60,55; H 6,77; N 10,46%; обнаружено: C 60,40; H 6,86; N 10,25%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил]пиперазин и на 1-бифенил-3-илметил-3-(3-хлорпропил)-5-метил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 1-бифенил-3-илметил-3-(3-{4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1- ил} пропил)-5-метил-2,4(1H, 3H)-пиримидиндиона, tпл 93-94oC; анализ: рассчитано для C33H35F3N4O3•HCl: C 63,06; H 5,77; N 8,92%; обнаружено: C 61,66; H 5,90; N 8,50%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил] пиперазин и на 3-(3-хлорпропил)-1-бензил-5-этил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 1-бензил-3-{ 3-[4-(2-(2,2,2-трифторэтокси)фенил)пиперазин-1-ил] пропил} -5- этил-2,4(1H, 3H)-пиримидиндиона, tпл 180-181oC; анализ: рассчитано для C28H33F3N4O3•HCl: C 58,56; H 6,11; N 9,76%; обнаружено: C 58,83; H 6,11; N 9,77%;
заменяя на 1-(4-фтор-2-метоксифенил)пиперазин и на 1-(3-хлорпропил)-3-бензил-5-метил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 3-бензил-1-{ 3-[4-(4-фтор-2-метоксифенил)пиперазин-1-ил] пропил} -5-метил- 2,4(1H,3H)-пиримидиндиона, tпл 210-212oC; анализ: рассчитано для C26H31FN4O3•(HCl)2: C 57,88; H 6,16; N 10,38%; обнаружено: C 57,50; H 6,18; N 10,62%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил]пиперазин и на 3-(3-хлорпропил)-1-бензил-5,6-диметил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 1-бензил-3-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропил)- 5,6-диметил-2,4(1H,3H)-пиримидиндиона, tпл 221-222oC; анализ: рассчитано для C28H33F3N4O3•(HCl)1,1: C 58,37; H 6,06; N 9,72%; обнаружено: C 58,38; H 5,96; N 9,58%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил]пиперазин и на 1-(3-хлорпропил)-3-бензил-5-метил-2,4(1H,3H)-пиримидиндион, получали гидрохлорид 3-бензил-1-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил}пропил)-5- метил-2,4(1H,3H)-пиримидиндиона, tпл 168-169oC; анализ: рассчитано для C27H31F3N4O3•(HCl)1,9: C 55,01; H 5,69; N 9,50%; обнаружено: C 54,95; H 5,59; N 9,43%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил] пиперазин и на 3-(3-хлорпропил)-1-циклогексилметил-5-метил-2,4(1H,3H)-пиримидиндион, получали гидрохлорид 1-циклогексилметил-3-(3-{4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1- ил} пропил)-5-метил-2,4(1H, 3H)- пиримидиндиона, tпл 130-132oC; анализ: рассчитано для C27H37F3N4O3•HCl: C 57,99; H 6,88; N 10,02%; обнаружено: C 58,01; H 6,80; N 9,87%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил] пиперазин и на 3-(3-хлорпропил)-1-пиразин-2-илметил-5-метил-2,4(1H, 3H)-пиримидиндион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил}пропил)-5-метил-1- пиразин-2-илметил-2,4(1H, 3H)-пиримидиндиона, tпл 149-151oC; анализ: рассчитано для C25H29F3N6O3• C4H4O4: C 53,08; H 5,44; N 12,81%; обнаружено: C 52,87; H 5,13; N 12,83%;
заменяя на 1-(4-хлор-2-метоксифенил)пиперазин и на 3-бензил-1-(3-хлорпропил)-5-метил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 3-бензил-1-{ 3-[4-(4-хлор-2-метоксифенил)пиперазин-1-ил] пропил}-5- метил-2,4(1H, 3H)-пиримидиндиона, tпл 194-195oC; анализ: рассчитано для C26H31ClN4O3•(HCl)2: C 55,63; H 6,03; N 9,98%; обнаружено: C 55,82; H 5,94; N 9,85%;
заменяя на 1-[4-хлор-2-(2,2,2-трифторэтокси)фенил] пиперазин и на 3-бензил-1-(3-хлорпропил)-5-метил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 3-бензил-1-(3-{4-[4-хлор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1- ил} пропил)-5-метил-2,4(1H,3H)-пиримидиндиона, tпл 251-252oC; анализ: рассчитано для C27H30F3ClN4O3•HCl: C 53,55; H 5,49; N 9,25%; обнаружено: C 53,74; H 5,26; N 9,37%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил]пиперазин и на 1-бензил-3-(3-хлорпропил)-5-пропил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 1-бензил-3-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил} пропил)-5-пропил-2,4(1H, 3H)-пиримидиндиона, tпл 178oC; анализ: рассчитано для C29H35F3N4O3•HCl: C 59,03; H 6,32; N 9,49%; обнаружено: C 59,08; H 6,26; N 9,52%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил]пиперазин и на 1-бензил-3-(3-хлорпропил)-5-трифторметил-2,4(1H,3H)-пиримидиндион, получали гидрохлорид 1-бензил-3-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил}пропил)-5-трифторметил-2,4(1H, 3H)-пиримидиндиона, tпл 125-127oC; анализ: рассчитано для C27H28F6N4O3•HCl: C 52,65; H 4,91; N 9,10%; обнаружено: C 52,44; H 4,79; N 8,92%;
заменяя на 1-бензил-3-(3-хлорпропил)-2,4-диоксо-5(1H,3H)-пиримидинкарбальдегид и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 1-бензил-3-{3-[4-(2-метоксифенил)пиперазин-1-ил]пропил}-2,4-диоксо- 5(1H, 3H)-пиримидинкарбальдегида, tпл 198oC; анализ: рассчитано для C26H30N4O4• (C4H4O4)0,5: C 64,37; H 6,16; N 10,72%; обнаружено: C 64,07; H 6,25; N 11,12%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил]пиперазин и на 1-бензил-3-(3-хлорпропил)-5-циан-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 1-бензил-3-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил}пропил)-5-циан-2,4(1H,3H)-пиримидиндиона, tпл 142-143oC; анализ: рассчитано для C27H28F3N5O3•(HCl)1,2• (H2O)0,5: C 57,50; H 5,18; N 12,42%; обнаружено: C 55,93; H 5,22; N 11,94%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил] пиперазин и на 3-(3-хлорпропил)-1-фур-2-илметил-5-метил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 3-(3-{4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил}пропил)-1-фур-2- илметил-5-метил-2,4(1H,3H)-пиримидиндиона, tпл 132-134oC; анализ: рассчитано для C25H29F3N4O4•(HCl)2: C 51,81; H 5,39; N 9,66%; обнаружено: C 51,89; H 5,44; N 9,55%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил] пиперазин и на 3-(3-хлорпропил)-5-трифторметил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 3-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропил)-5- трифторметил-2,4(1H,3H)-пиримидиндиона, tпл 225-226oC; анализ: рассчитано для C20H22F6N4O3•(HCl)2: C 43,06; H 4,43; N 10,04%; обнаружено: C 43,12; H 4,59; N 9,81%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил] пиперазин и на 3-(3-хлорпропил)-1,5-диметил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 3-(3-{4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропил)-1,5- диметил-2,4(1H, 3H)-пиримидиндиона, tпл 212-213oC; анализ: рассчитано для C21H27F3N4O3•(HCl)2: C 49,12; H 5,69; N 10,91%; обнаружено: C 48,97; H 5,68; N 10,77%;
заменяя на 1-(4-фтор-2-метоксифенил)пиперазин и на 1-(3-хлорпропил)-5-метил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 1-{3-[4-(4-фтор-2-метоксифенил)пиперазин-1-ил] пропил} -5-метил- 2,4(1H,3H)-пиримидиндиона, tпл 196-197oC; анализ: рассчитано для C19H25FN4O3•(HCl)2: C 49,79; H 6,16; N 12,22%; обнаружено: C 50,13; H 6,37; N 12,27%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил] пиперазин и на 1-(3-хлорпропил)-3-бензил-5,6-диметил-2,4(1H, 3H)-пиримидиндион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 1-(3-{4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропил)-3- бензил-5,6-диметил-2,4(1H,3H)-пиримидиндиона, tпл 125-127oC; анализ: рассчитано для C28H33F3N4O3• C2H2O2: C 58,62; H 5,84; N 8,55%; обнаружено: C 58,63; H 5,67; N 8,42%;
заменяя на 1-[4-хлор-2-(2,2,2-трифторэтокси)фенил]пиперазин и на 1-(3-хлорпропил)-5-метил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 1-(3-{ 4-[4-хлор-2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил} пропил)-5-метил-2,4(1H,3H)-пиримидиндиона, tпл 205-206oC; анализ: рассчитано для C20H24ClF3N4O3•(HCl)2: C 43,53; H 5,10; N 10,15%; обнаружено: C 43,77; H 5,10; N 10,13%;
заменяя на 1-(4-хлор-2-метоксифенил)пиперазин и на 1-(3-хлорпропил)-5-метил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 1-{3-[4-(4-хлор-2-метоксифенил)пиперазин-1-ил] пропил} -5- метил-2,4(1H,3H)-пиримидиндиона, tпл 154-155oC; анализ: рассчитано для C19H25CIN4O3•(HCl)2: C 44,05; H 6,37; N 10,81%; обнаружено: C 44,26; H 6,08; N 10,46%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил] пиперазин и на 3-(3-хлорпропил)-5-метил-1-тиен-2-илметил-2,4 (1H,3H)-пиримидиндион, получали гидрохлорид 3-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропил)-5-метил-1- тиен-2-ил-2,4(1H, 3H)-пиримидиндиона, tпл 103-106oC; анализ: рассчитано для C25H29SF3N4O3•(HCl)2: C 53,03; H 5,48; N 9,89%; обнаружено: C 53,25; H 5,31; N 9,52%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил]пиперазин и на 1-бензил-3-(3-хлорпропил)-2,4-диоксо-5(1H, 3H)-пиримидиндкарбальдегид и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 1-бензил-3-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил}пропил)- 2,4-диоксо-5(1H,3H)-пиримидинкарбальдегида, tпл 175oC; анализ: рассчитано для C27H29F3N4O4• C4H4O4: C 57,58; H 5,14; N 8,66%; обнаружено: C 57,42; H 5,13; N 8,61%;
заменяя на 1-[4-гидрокси-2-(2,2,2-трифторэтокси)фенил] пиперазин и на 3-(3-хлорпропил)-5-метил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 3-(3-{ 4-[4-гидрокси-2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил}пропил)-5-метил-2,4(1H, 3H)-пиримидиндиона, tпл 232-242oC; анализ: рассчитано для C20H25F3N4O4•HCl: C 49,63; H 5,59; N 11,02%; обнаружено: C 49,62; H 5,65; N 10,66%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил]пиперазин и на 3-(3-хлорпропил)-1-фур-3-илметил-5-метил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 3-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил}пропил)-1- фур-3-илметил-5-метил-2,4(1H,3H)-пиримидиндиона, tпл 128-131oC; анализ: рассчитано для C25H29F3N4O4•(HCl)2: C 50,26; H 5,57; N 9,38%; обнаружено: C 50,55; H 5,25; N 9,22%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил]пиперазин и на 1-(3-хлорпропил)-5,6- диметил-2,4(1H,3H)-пиримидиндион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 1-(3-{4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропил)- 5,6-диметил-2,4(1H,3H)-пиримидиндиона, tпл 201-203oC; анализ: рассчитано для C21H27F3N4O3• C4H4O4: C 53,95; H 5,61; N 10,06%; обнаружено: C 53,92; H 5,71; N 10,00%;
заменяя на 3-(3-хлорпропил)-5-метил-1-пирид-4-илметил-2,4(1H,3H)-пиримидиндион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат ди(3-{ 3-[4-(2-метоксифенил)пиперазин-1-ил] пропил}-5-метил-1- пирид-4-илметил-2,4(1H, 3H)-пиримидиндиона), tпл 210-212oC; анализ: рассчитано для (C25H31N5O3)2• C4H4O4: C 66,33; H 6,59; N 13,68%; обнаружено: C 63,49; H 6,65; N 13,58%;
заменяя на 3-бензил-1-(3-хлорпропил)-5,6-диметил-2,4(1H,3H)-пиримидиндион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-бензил-1-{3-[4-(2-метоксифенил)пиперазин-1-ил]пропил}-5,6- диметил-2,4(1H,3H)-пиримидиндиона, tпл 164-166oC; анализ: рассчитано для C27H34N4O3•C4H4O4: C 64,35; H 6,62; N 9,68%; обнаружено: C 64,57; H 6,67; N 9,71%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил]пиперазин и на 3-(3-хлорпропил)-5-метил-1-пирид-4-илметил-2,4(1H, 3H)-пиримидиндион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-(3-{4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропил)-5-метил-1- пирид-4-илметил-2,4(1H, 3H)-пиримидиндиона, tпл 122-124oC; анализ: рассчитано для C 56,07; H 5,49; N 10,90%; обнаружено: C 56,36; H 5,55; N 10,61%;
заменяя на 3-(3-хлорпропил)-6-метил-2,4(1H,3H)-пиримидиндион, получали гидрохлорид 3-{ 3-[4-(2-метоксифенил)пиперазин-1-ил]пропил}-6-метил-2,4(1H, 3H)- пиримидиндиона, tпл 232-234oC; анализ: рассчитано для C19H26N4O3•(HCl)2: C 51,19; H 6,68; N 12,56%; обнаружено: C 51,11; H 6,47; N 12,44%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил]пиперазин и на 1-бензил-3-(3-хлорпропил)-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 1-бензил-3-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил}пропил)-2,4(1H,3H)-пиримидиндиона; анализ: рассчитано для C26H29F3N4O3•(HCl)2: C 53,43; H 5,52; N 9,59%; обнаружено: C 53,22; H 5,34; N 9,37%;
заменяя на 1-[4-метил-2-(2,2,2-трифторэтокси)фенил] пиперазин и на 3-(3-хлорпропил)-5-метил-2,4(1H, 3H)-пиримидиндион и перекристаллизовывая из раствора бромистоводородной кислоты в спирте, получали гидробромид 3-(3-{ 4-[4-метил-2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропил)-5- метил-2,4(1H,3H)-пиримидиндиона, tпл 86-90oC; анализ: рассчитано для C21H27F3N4O3•HBr: C 48,38; H 5,41; N 10,75%; обнаружено: C 48,73; H 5,62; N 10,51%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил]пиперазин и на 3-(3-хлорпропил)-6-метил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 3-(3-{4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропил)-6- метил-2,4(1H,3H)-пиримидиндиона, tпл 218-220oC; анализ: рассчитано для C20H25F3N4O3•(HCl)2: C 48,10; H 5,44; N 11,22%; обнаружено: C 47,85; H 5,48; N 11,08%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил]пиперазин и на 3-(3-хлорпропил)-5-метил-1-пирид-3-илметил-2,4(1H, 3H)-пиримидиндион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-(3-{4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропил)-5- метил-1-пирид-3-илметил-2,4(1H, 3H)-пиримидиндиона, tпл 158-160oC; анализ: рассчитано для C26H30F3N5O3• C4H4O4: C 56,55; H 5,93; N 10,30%; обнаружено: C 56,27; H 5,82; N 10,05%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил] пиперазин и на 3-(3-хлорпропил)-5-метил-1-фенил-2,4(1H, 3H)-пиримидиндион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-(3-{4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропил)-5- метил-1-фенил-2,4(1H,3H)-пиримидиндиона, tпл 190-192oC; анализ: рассчитано для C26H29F3N4O3• C4H4O4: C 58,25; H 5,38; N 9,06%; обнаружено: C 58,11; H 5,45; N 9,20%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил] пиперазин и на 1-(3-хлорпропил)-5-метил-3-фенил-2,4(1H, 3H)-пиримидиндион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 1-(3-{4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропил)-5- метил-3-фенил-2,4(1H,3H)-пиримидиндиона; анализ: рассчитано для C26H29F3N4O3• C4H4O4: C 57,41; H 5,46; N 8,93%; обнаружено: C 57,37; H 5,45; N 8,63%;
заменяя на 1-(3-хлорпропил)-6-метил-2,4(1H,3H)-пиримидиндион, получали гидрохлорид 1-{ 3-[4-(2-метоксифенил)пиперазин-1-ил]пропил}-6-метил-2,4(1H, 3H)- пиримидиндиона, tпл 228-230oC; анализ: рассчитано для C19H26N4O3•(HCl)2: C 51,39; H 6,66; N 12,62%; обнаружено: C 51,14; H 6,36; N 12,38%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил] пиперазин и на 1-(3-хлорпропил)-6-метил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 1-(3-{4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропил)-6- метил-2,4(1H,3H)-пиримидиндиона; tпл 217-219oC; анализ: рассчитано для C20H25F3N4O3•(HCl)2: C 48,10; H 5,44; N 11,22%; обнаружено: C 47,96; H 5,46; N 11,15%;
заменяя на 1-(4-фтор-2-метоксифенил)пиперазин и на 3-(3-хлорпропил)-6-метил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 3-{3-[4-(4-фтор-2-метоксифенил)пиперазин-1-ил] пропил} -6- метил-2,4(1H,3H)-пиримидиндиона, tпл 235-237oC; анализ: рассчитано для C19H25FN4O3•(HCl)2: C 49,20; H 6,21; N 12,08%; обнаружено: C 49,02; H 6,22; N 12,01%;
заменяя на 1-(4-фтор-2-метоксифенил)пиперазин и на 3-(3-хлорпропил)-5-метил-1-пирид-3-илметил-2,4(1H, 3H)-пиримидиндион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-{3-[4- (4-фтор-2-метоксифенил)пиперазин-1-ил] пропил} -5-метил-1- пирид-3-илметил-2,4(1H,3H)-пиримидиндиона; анализ: рассчитано для C25H30FN5O3•C4H4O4: C 57,90; H 6,03; N 11,64%; обнаружено: C 58,07; H 5,93; N 11,34%;
заменяя на 1-(4-фтор-2-этоксифенил)пиперазин и на 3-(3-хлорпропил)-5-этил-2,4(1H,3H)-пиримидиндион и перекристаллизовывая из раствора бромистоводородной кислоты в спирте, получали гидробромид 3-{3-[4-(4-фтор-2-этоксифенил)пиперазин-1-ил] пропил} -5- этил-2,4(1H,3H)-пиримидиндиона, tпл 224-227oC; анализ: рассчитано для C21H29FN4O3•HBr: C 44,54; H 5,52; N 9,89%; обнаружено: C 44,22; H 5,48; N 9,76%;
заменяя на 1-(4-фтор-2-оксазол-2-илфенил)пиперазин и на 3-(3-хлорпропил)-5-метил-2,4(1H, 3H)-пиримидиндион и перекристаллизовывая из раствора щавелевой кислоты в спирте, получали оксалат 3-{3-[4-(4-фтор-2-оксазол-2-илфенил)пиперазин-1- ил] пропил}-5-метил-2,4(1H,3H)-пиримидиндиона, tпл 207-210oC; анализ: рассчитано для C21H24FN5O3•C2H2O4: C 54,86; H 5,20; N 13,91%; обнаружено: C 54,71; H 5,30; N 13,93%;
заменяя на 1-(2-оксазол-2-илфенил)пиперазин и на 3-(3-хлорпропил)-5-метил-2,4(1H, 3H)-пиримидиндион и перекристаллизовывая из раствора щавелевой кислоты в спирте, получали оксалат 3-{3-[4-(2-оксазол-2-илфенил)пиперазин-1-ил] пропил} -5- метил-2,4(1H, 3H)-пиримидиндиона, tпл 214-215oC; анализ: рассчитано для C21H25N5O3•C2H2O4: C 55,13; H 6,11; N 13,85%; обнаружено: C 55,22; H 5,70; N 14,15%;
заменяя на 3-(3-хлорпропил)-5-метил-1-пирид-2-илметил-2,4(1H,3H)-пиримидиндион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-{ 3-[4-(2-метоксифенил)пиперазин-1-ил]пропил}-5-метил-1-пирид-2- илметил-2,4(1H,3H)-пиримидиндиона в виде пены; анализ: рассчитано для C25H31N5O3• (C4H4O4)1,5•(H2O)0,25: C 59,27; H 6,02; N 11,15%; обнаружено: C 59,25; H 6,13; N 11,27%;
заменяя на 2-(3-хлорпропил)-6-метил-1,2,4-триазин-3,5(2H,4H)-дион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат ди(2-{ 3-[4-(2-метоксифенил)пиперазин-1-ил] пропил}-6- метил-1,2,4-триазин-3,5(2H, 4H)-диона), tпл 235-237oC; анализ: рассчитано для (C18H25N5O3)2• C4H4O4: C 56,93; H 6,57; N 16,60%; обнаружено: C 56,97; H 6,59; N 16,54%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил]пиперазин и на 4-(3-хлорпропил)-6-метил-1,2,4-триазин-3,5(2H,4H)-дион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат ди[4-(3-{4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил}пропил)-6-метил-1,2,4-триазин-3,5(2H,4H)-диона] , tпл 242-245oC; анализ: рассчитано для (C19H24F3N5O3)2• C4H4O4: C 51,48; H 5,45; N 14,29%; обнаружено: C 51,20; H 5,29; N 14,20%;
заменяя на 4-(3-хлорпропил)-6-метил-1,2,4-триазин-3,5(2H, 4H)-дион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 4-{3-[4-(2-метоксифенил)пиперазин-1-ил]пропил}-6- метил-1,2,4-триазин-3,5(2H, 4H)-диона, tпл 204-206oC; анализ: рассчитано для C18H25N5O3•C4H4O4: C 54,54; H 6,24; N 14,45%; обнаружено: C 54,28; H 6,38; N 14,65%;
заменяя на 1-(4-фтор-2-метоксифенил)пиперазин и на 4-(3-хлорпропил)-6-метил-1,2,4-триазин-3,5(2H, 4H)-дион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 4-{3-[4-(4-фтор-2-метоксифенил)пиперазин-1-ил] пропил} -6- метил-1,2,4-триазин-3,5(2H, 4H)-диона, tпл 193-195oC; анализ: рассчитано для C18H25N5O3•C4H4O4: C 51,75; H 5,90; N 13,72%; обнаружено: C 51,93; H 5,56; N 13,91%;
заменяя на 1-(2-трифторметоксифенил)пиперазин и на 3-(3-хлорпропил)-5-этил-2,4(1H,3H)-пиримидиндион и перекристаллизовывая из раствора бромистоводородной кислоты в спирте, получали гидробромид 3-{3-[4-(2-трифторметоксифенил)пиперазин-1-ил]пропил}-5-этил- 2,4(1H,3H)-пиримидиндиона, tпл 64-73oC; анализ: рассчитано для C20H25F3N4O3•(HBr)0,25: C 53,78; H 5,70; N 12,54%; обнаружено: C 54,39; H 6,09; N 12,61%;
заменяя на 1-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин и на 3-(3-хлорпропил)-5-этил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 3-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил}пропил)-5-этил-2,4(1H, 3H)-пиримидиндиона, tпл 186-188oC; анализ: рассчитано для C21H27F4N4O3•(HCl)2: C 47,46; H 5,31; N 10,54%; обнаружено: C 47,67; H 5,34; N 10,64%;
заменяя на 1-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин и на 3-(3-хлорпропил)-6-метил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 3-(3-{ 4-[4-фтор-2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил} пропил)-6-метил-2,4(1H,3H)-пиримидиндиона, tпл 225-228oC; анализ: рассчитано для C20H24F4N4O3•(HCl)2: C 46,12; H 5,06; N 10,83%; обнаружено: C 46,28; H 4,98; N 10,66%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил]пиперазин и на 1-(1-бензил-5-метил-2,4-диоксо-(1H, 3H)-пиримидин-3-илметил)циклопроп-1- илметилметансульфонат, получали 1-бензил-3-(1-{4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1- илметил}циклопроп-1-илметил)-5-метил-2,4(1H,3H)-пиримидиндиона в виде масла;
заменяя на 1-(4-фтор-2-метоксифенил)пиперазин и на 1-бензил-3-(3-хлорпропил)-5,5-диметил-2,4,6(1H, 3H, 5H)-пиримидинтрион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 1-бензил-3-{ 3-[4-(4-фтор-2-метоксифенил)пиперазин-1- ил]пропил}-5,5-диметил-2,4,6(1H,3H, 5H)-пиримидинтриона, tпл 168-169oC; анализ: рассчитано для C27H33FN4O4• (C4H4O4)0,5•(H2O)0,5: C 61,80; H 6,44; N 9,94%; обнаружено: C 61,72; H 6,25; N 10,02%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил]пиперазин и на 1-бензил-3-(3-хлорпропил)-5,5-диметил-2,4,6(1H,3H,5H)-пиримидинтрион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 1-бензил-3-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил}пропил)-5,5-диметил-2,4,6(1H, 3H, 5H)-пиримидинтриона, tпл 176-177oC; анализ: рассчитано для C28H33F3N4O4• C4H4O4: C 58,00; H 5,63; N 8,45%; обнаружено: C 58,20; H 5,62; N 8,48%;
заменяя на 1-бензил-3-(3-хлорпропил)-5,5-диметил-2,4,6(1H,3H,5H)-пиримидинтрион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 1-бензил-3-{3-[4-(2-метоксифенил)пиперазин-1-ил]пропил}-5,5- диметил-2,4,6(1H,3H,5H)-пиримидинтриона, tпл 184oC; анализ: рассчитано для C27H34N4O4•C4H4O4•(CH4O)0,5: C 61,95; H 6,60; N 9,17%; обнаружено: C 62,00; H 6,89; N 9,45%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил]пиперазин и на 1-(3-хлорпропил)-3-(4-фторфенил)-5-метил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 1-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил}пропил)-3-(4- фторфенил)-5-метил-2,4(1H, 3H)-пиримидиндиона, tпл 220-222oC; анализ: рассчитано для C26H28F4N4O3• (HCl)2•(H2O)0,1: C 52,46; H 5,11; N 9,41%; обнаружено: C 52,21; H 4,91; N 9,26%;
заменяя на 1-(4-фтор-2-метоксифенил)пиперазин и на 3-(3-хлорпропил)-1-пирид-4-илметил-5-метил-2,4(1H, 3H,)-пиримидиндион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-{3-[4-(4-фтор-2-метоксифенил)пиперазин-1-ил] пропил}-1-пирид-4- илметил-5-метил-2,4(1H,3H)-пиримидиндиона в виде пены; анализ: рассчитано для C25H30FN5O3• (C4H4O4)1,5: C 58,03; H 5,65; N 10,91%; обнаружено: C 57,92; H 5,71; N 11,00%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил] пиперазин и на 3-(3-хлорпропил)-1-(4-фторфенил)-5-метил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 3-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропил)-1-(4- фторфенил)-5-метил-2,4(1H,3H)-пиримидиндиона, tпл 166-168oC; анализ: рассчитано для C26H28F4N4O3• HCl•(C4H10O)0,3: C 56,34; H 5,56; N 9,66%; обнаружено: C 56,06; H 5,76; N 9,36%;
заменяя на 1-(2-пиррол-1-илфенил)пиперазин и на 3-(3-хлорпропил)-5-метил-2,4(1H, 3H)-пиримидиндион, получали гидробромид 3-{3-[4-(2-пиррол-1-илфенил)пиперазин-1-ил] пропил} -5- метил-2,4(1H,3H)-пиримидиндиона, tпл 249-252oC; анализ: рассчитано для C22H27N5O2•HBr: C 55,60; H 5,95; N 14,80%; обнаружено: C 55,49; H 6,10; N 14,04%;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил] пиперазин и на 1-оксид 3-(3-хлорпропил)-5-метил-2,4-диоксо-(1H, 3H)-пиримидин-1-илметилпиридина, получали фумарат 1-оксида 3-(3-{4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил} пропил)-5- метил-2,4-диоксо-(1H, 3H)-пиримидин-1-илметилпиридина, tпл 120-122oC; анализ: рассчитано для C26H30F3N5O4• (C4H4O4)1,5: C 54,31; H 5,13; N 9,90%; обнаружено: C 54,55; H 5,15; N 9,93%;
заменяя на 1-(4-фтор-2-метоксифенил)пиперазин и на 3-(3-хлорпропил)-1-(2,2,2-трифторэтокси)-5-метил-2,4(1H,3H)-пиримидиндион, получали гидробромид 3-{ 3-[4-(4-фтор-2-метоксифенил)пиперазин-1-ил]пропил}-1-(2,2,2- трифторэтокси)-5-метил-2,4(1H, 3H)-пиримидиндиона, tпл 179-181oC; анализ: рассчитано для C21H26F4N4O3•HBr: C 46,76; H 5,05; N 10,39%; обнаружено: C 47,13; H 5,15; N 10,21%;
заменяя на 3-(3-хлорпропил)-1-[2-(триметилсилил)этоксиметил]-2,4(1H,3H)- пиримидиндион, получали 3-(3-{4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил}пропил)- 1-[2-(триметилсилил)этоксиметил]-2,4(1H,3H)-пиримидиндион;
заменяя на 1-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин и на 3-(3-хлорпропил)-1-[2-(триметилсилил)этоксиметил] -2,4(1H, 3H)-пиримидиндион, получали 3-(3-{4-[4-фтор-2-(2,2,2- трифторэтокси)фенил]пиперазин-1- ил}пропил)-1-[2-(триметилсилил)этоксиметил]-2,4(1H,3H)-пиримидиндион;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил]пиперазин и на 2-(3-хлорпропил)-6-метил-4-[2-(триметилсилил)этоксиметил] -1,2,4- триазин-3,5(2H, 4H)-дион, получали 2-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил}пропил)-6- метил-4-[2-(триметилсилил)этоксиметил] -1,2,4-триазин-3,5(2H, 4H)-дион;
заменяя на 1-(4-фтор-2-метоксифенил)пиперазин и на 2-(3-хлорпропил)-6-метил-4-[2-(триметилсилил)этоксиметил] -1,2,4- триазин-3,5(2H,4H)-дион, получали 2-{ 3-[4-(4-фтор-2-метоксифенил)пиперазин-1-ил] пропил}-6- метил-4-[2-(триметилсилил)этоксиметил]-1,2,4-триазин-3,5(2H,4H)-дион;
заменяя на 1-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин и на 3-(3-хлорпропил)-5-гидроксиметил-1-[2-(триметилсилил)этоксиметил] - 2,4(1H,3H)-пиримидиндион, получали 3-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил}пропил)-5- гидроксиметил-1-[2-(триметилсилил)этоксиметил]-2,4(1H, 3H)-пиримидиндион;
заменяя на 1-(2-хлорфенил)пиперазин и на 3-(3-хлорпропил)-5-метил-1-[2-(триметилсилил)этоксиметил] - 2,4(1H, 3H)-пиримидиндион, получали 3-{3-[4-(2-хлорфенил)пиперазин-1-ил]пропил}-5-метил- 1-[2-(триметилсилил)этоксиметил]-2,4(1H,3H)-пиримидиндион;
заменяя на 1-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин и на 3-(3-хлорпропил)-5-фтор-1-[2-(триметилсилил)этоксиметил]-2,4(1H,3H)- пиримидиндион, получали 3-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1- ил} пропил)-5-фтор-1-[2-(триметилсилил)этоксиметил]-2,4(1H,3H)-пиримидиндион;
заменяя на 1-[2-(4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин и на 3-(3-хлорпропил)-5-хлор-1-[2-(триметилсилил)этоксиметил]- 2,4(1H,3H)-пиримидиндион, получали 3-(3-{ 4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1- ил}пропил)-5-хлор-1-[2-(триметилсилил)этоксиметил]-2,4(1H,3H)-пиримидиндион;
заменяя на 1-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин и на 1-[2-(триметилсилил)этоксиметил] -5-метокси-2,4(1H, 3H)-пиримидиндион, получали 3-(3-{ 4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил}пропил)- 1-[2-(триметилсилил)этоксиметил]-5-метокси-2,4(1H,3H)-пиримидиндион в виде масла;
заменяя на 1-[2-(2,2,2-трифторэтокси)фенил] пиперазин и на 1-[2-(триметилсилил)этоксиметил] -5-гидроксиметил-2,4(1H, 3H)-пиримидиндион, получали 3-(3-{4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил}пропил)- 1-[2-(триметилсилил)этоксиметил] -5-гидроксиметил-2,4(1H,3H)-пиримидиндион в виде масла; и
заменяя на 1-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин и на 2-(3-хлорпропил)-6-метил-4-[2-(триметилсилил)этоксиметил] -1,2,4-триазин- 3,5(2H, 4H)-дион, получали 2-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил} пропил)-6- метил-4-[2-(триметилсилил)этоксиметил]-1,2,4-тризин-3,5(2H, 4H)-дион.
ПРИМЕР 26
3-(3-{ 4-[4-фтор-2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропил)- 5-диметиламино-1-[2-(триметилсилил)этоксиметил]-2,4(1H,3H)-пиримидиндион
Ниже приведен способ получения защищенного производного соединения формулы I, где R1 обозначает 2,2,2-трифторэтокси, R2 обозначает фтор в положении 4, каждый из R3 и R4 обозначает водород и R5 обозначает группу формулы (a), в которой Z обозначает CH, R7 обозначает диметиламино и защитная группа является 2-(триметилсилил)этоксиметилом.
Смесь, содержащую 3-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил} пропил)-5- хлор-1-[2-(триметилсилил)этоксиметил]-2,4(1H,3H)-пиримидиндион (0,5 г, 0,84 ммоля), полученный в соответсвии с примером 25, водный диметиламин (40%-ный, 3 мл) и этанол (3 мл), выдерживали в герметично закрытой пробирке в течение 3 часов при 130oC. Реакционную смесь концентрировали и остаток очищали с помощью хроматографии на колонках на силикагеле, элюируя метиленхлоридом/метанолом (95:5 + 3%-ный гидроксид аммония), получая 3-(3-{ 4-[4-фтор-2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропил)-5- диметиламино-1-[2-(триметилсилил)этоксиметил]-2,4(1H,3H)-пиримидиндион (0,26 г, 0,44 ммоля).
ПРИМЕР 27
3-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропил)- 2,4(1H, 3H)-пиримидиндион
Ниже приведен способ получения соединения формулы I, где R1 обозначает 2,2,2-трифторэтокси, каждый из R2, R3 и R4 обозначает водород и R5 обозначает группу формулы (a), в которой Z обозначает CH и их радикал R6 и R7 обозначает водород.
Смесь, содержащую 3-(3-{4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил} пропил)- 1-[2-(триметилсилил)этоксиметил]-2,4(1H,3H)-пиримидиндион (273 мг, 0,5 ммоля), полученный в соответсвии с примером 25, тетрабутиламмонийфторид (2 ммоля) и ТГФ (5 мл), перемешивали в течение 24 часов при 25oC. Затем реакционную смесь концентрировали и остаток очищали с помощью колоночной хроматографии на силикагеле, элюируя этилацетатом, получая 3-(3-{4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил}пропил)-2,4(1H,3H)-пиримидиндион (160 мг, 0,39 ммоля). Свободное основание перекристаллизовывали из раствора хлористого водорода в этаноле, получая гидрохлорид 3-(3-{4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропил)- 2,4(1H, 3H)-пиримидиндиона, tпл 247-249oC; анализ: рассчитано для C19H23F3N4O3•(HCl)2: C 47,01; H 5,19; N 11,54%; обнаружено: C 46,84; H 5,18; N 11,34%.
Работая аналогично примеру 27, но заменяя 3-(3-{4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил}пропил)- 1-[2-(триметилсилил)этоксиметил]-2,4(1H, 3H)-пиримидиндион на различные исходные вещества, получали следующие соединения формулы I:
заменяя на 3-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1- ил} пропил)-1-[2-(триметилсилил)этоксиметил] -2,4(1H, 3H)-пиримидиндион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1- ил}пропил)-2,4(1H, 3H)-пиримидиндиона, tпл 187oC; анализ: рассчитано для C19H22F4N4O3• C4H4O4: C 50,55; H 4,80; N 10,25%; обнаружено: C 50,46; H 4,75; N 10,13%;
заменяя на 2-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил}пропил)-6- метил-4-[2-(триметилсилил)этоксиметил]-1,2,4-триазин-3,5(2H,4H)-дион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат ди[2-(3-{4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1- ил}пропил)-6-метил-1,2,4-триазин-3,5(2H, 4H)-диона, tпл 213-215oC; анализ: рассчитано для (C19H24F3N5O3)2• C4H4O4: C 51,96; H 5,40; N 14,43%; обнаружено: C 52,23; H 5,38; N 14,35%;
заменяя на 2-{3-[4-(4-фтор-2-метоксифенил)пиперазин-1-ил]пропил}-6- метил-4-[2-(триметилсилил)этоксиметил] -1,2,4-триазин-3,5(2H, 4H)-дион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 2-{ 3-[4-(4-фтор-2-метоксифенил)пиперазин-1-ил] пропил}-6- метил-1,2,4-триазин-3,5(2H,4H)-диона, tпл 201-203oC;
заменяя на 3-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1- ил} пропил)-5-гидроксиметил-1-[2-(триметилсилил)этоксиметил] -2,4(1H, 3H)- пиримидиндион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1- ил} пропил)-5-гидроксиметил-2,4(1H, 3H)-пиримидиндиона, tпл 181oC; анализ: рассчитано для C20H24F4N4O4• (C4H4O4)0,5: C 50,18; H 5,49; N 10,18%; обнаружено: C 49,98; H 5,49; N 10,01%;
заменяя на 3-{3-[4-(2-хлорфенил)пиперазин-1-ил]пропил}-5- метил-1-[2-(триметилсилил)этоксиметил] -2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 3-{ 3-[4-(2-хлорфенил)пиперазин-1-ил]пропил}-5- метил-2,4,(1H,3H)-пиримидиндиона, tпл 240-242oC; анализ: рассчитано для C18H23ClN4O2•HCl•(H2O)0,75: C 52,37; H 6,23; N 13,57%; обнаружено: C 52,14; H 6,03; N 13,54%;
заменяя на 3-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1- ил} пропил)-5-фтор-1-[2-(триметилсилил)этоксиметил] -2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 3-(3-{ 4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил} пропил)-5- фтор-2,4(1H,3H)-пиримидиндиона, tпл 187-189oC; анализ: рассчитано для C19H21F5N4O3•(HCl)2: C 43,77; H 4,44; N 10,74%; обнаружено: C 43,52; H 4,35; N 10,83%;
заменяя на 3-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1- ил} пропил)-5-хлор-1-[2-(триметилсилил)этоксиметил] -2,4(1H, 3H)-пиримидиндион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-(3-{ 4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1- ил}пропил)-5-хлор-2,4(1H, 3H)-пиримидиндиона, tпл 210-212oC; анализ: рассчитано для C19H21F4N4O3• C4H4O4•(CH4O)0,5: C 47,28; H 4,56; N 9,39%; обнаружено: C 47,44; H 4,28; N 9,08%;
заменяя на 3-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин- 1-ил} пропил)-5-диметиламино-1-[2-(триметилсилил)этоксиметил] - 2,4(1H, 3H)-пиримидиндион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил}пропил)-5- диметиламино-2,4(1H,3H)-пиримидиндиона, tпл 182-184oC; анализ: рассчитано для
C21H27F4N5O3• C4H4O4: C 50,93; H 5,30; N 11,88%; обнаружено: C 50,82; H 5,35; N 11,62%;
заменяя на 3-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин- 1-ил} пропил)-1-[2-(триметилсилил)этоксиметил] -5-метокси-2,4(1H, 3H)- пиримидиндион, получали гидрохлорид 3-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил} пропил)-5- метокси-2,4(1H, 3H)-пиримидиндиона, tпл 188-189oC; анализ: рассчитано для C20H24F4N4O4•(HCl)2: C 45,04; H 4,91; N 10,51%; обнаружено: C 44,88; H 4,87; N 10,40%;
заменяя на 3-(3-{4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1- ил}пропил)-1-[2-(триметилсилил)этоксиметил]-5-гидроксиметил-2,4(1H,3H)- пиримидиндион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-(3-{4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил}пропил)-5- гидроксиметил-2,4(1H, 3H)-пиримидиндиона, tпл 143oC; анализ: рассчитано для C20H25F3N4O4• C2H2O2: C 51,41; H 5,34; N 9,89%; обнаружено: C 51,15; H 5,56; N 10,29%; и
заменяя на 2-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1- ил} пропил)-6-метил-4-[2-(триметилсилил)этоксиметил] -1,2,4-триазин- 3,5(2H, 4H)-дион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 2-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил} пропил)-6- метил-1,2,4-триазин-3,5(2H,4H)-диона, tпл 204-206oC; анализ: рассчитано для C19H23F4N5O3• (C4H4O4)9,5: C 49,63; H 4,92; N 13,15%; обнаружено: C 49,03; H 5,12; N 13,19%.
ПРИМЕР 28
1-бром-3-{4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил}пропан
Ниже приведен способ получения соединения формулы 5, где L обозначает бром, R1 обозначает 2,2,2-трифторэтокси, каждый из R2, R3 и R4 обозначает водород.
Смесь, содержащую 4-[2-(2,2,2-трифторэтокси)фенил]пиперазин (2,37 г, 9,1 ммоля), 1-бром-3-хлорпропан (14,34 г, 9 мл, 91,1 ммоля), карбонат калия (1,88 г, 13,6 ммоля) и ацетонитрил (40 мл), кипятили в течение 16 часов с обратным холодильником в атмосфере аргона. Реакционной смеси давали охладиться до 25oC, затем фильтровали и концентрировали под вакуумом. Остаток дополнительно концентрировали при 60oC под вакуумом для удаления избытка 1-бром-3-хлорпропана. Остаток очищали с помощью быстрой хроматографии на силикагеле, элюируя гексаном/этилацетатом (1:1), получая смесь 1-хлор- и 1-бром-3-{4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил}пропана (1,4 г).
ПРИМЕР 29
1-хлор-2,2-диметил-3-{ 4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил} пропан
Ниже приведен способ получения соединения формулы 5, где L обозначает хлор, R1 обозначает 2,2,2-трифторэтокси, R2 обозначает водород и каждый из R3 и R4 обозначает метил.
Смесь, содержащую этилцианацетат (5 г, 4 мл, 44 ммоля), хлорид триэтилбензиламмония (10,05 г, 44 ммоля), йодметан (11 мл, 177 ммолей) и 50%-ный гидроксид натрия (88 мл), перемешивали в течение 2 часов при 20oC. Затем реакционную смесь разбавляли водой (220 мл) и водную фазу отделяли, промывали диэтиловым эфиром, обрабатывали концентрированной соляной кислотой и экстрагировали диэтиловым эфиром (3х50 мл). Объединенные экстракты промывали соляным раствором (1х50 мл), сушили (MgSO4) и концентрировали, получая 2-циан-2-метилпропионовую кислоту (4,3 г, 37,5 ммоля).
Смесь, содержащую 2-циан-2-метилпропионовую кислоту (4,1 г, 36,1 ммоля), безводный триэтиламин (6,6 мл, 46,9 ммоля) и ТГФ (70 мл), охлаждали до температуры между -5oC и 0oC в атмосфере аргона и добавляли метилхлорформиат (3,4 мл, 43,3 ммоля). Смесь перемешивали в течение 1 часа, фильтровали при 0oC (промывая с помощью ТГФ) и повторно охлаждали до 0oC в атмосфере аргона и затем добавляли смесь борогидрида натрия (4,1 г, 108 ммолей) и холодной воды (25 мл) с такой скоростью, чтобы температуру реакционной смеси поддерживалась ниже 10oC. Смесь перемешивали в течение 2,5 часов при 20oC, обрабатывали 10%-ной соляной кислотой, промывали соляным раствором (1х40 мл) и экстрагировали этилацетатом (4х40 мл). Объединенные экстракты промывали соляным раствором, сушили (MgSO4) и концентрировали. Остаток очищали с помощью хроматографии на силикагеле, элюируя гексаном/этилацетатом (7:3), получая 3-гидрокси-2,2-диметилпропаннитрил (2,7 г, 27,1 ммоля).
Раствор 60%-ного гидрида натрия (367,1 мг, 15,3 ммоля) промывали гексаном (3х2 мл) и суспендировали в ДМФ (2 мл). Суспензию охлаждали до -10oC и затем добавляли смесь 3-гидрокси-2,2-диметилпропаннитрила (1,4 г, 13,9 ммоля) и ДМФ (8 мл). Смесь выдерживали в течение 2,5 часов при перемешивании при температуре от -10oC до -5oC и затем добавляли бензилбромид (1,7 мл, 13,9 ммоля). Смесь выдерживали при -5oC при перемешивании в течение 2 часов, разбавляли водой (10 мл) и экстрагировали диэтиловым эфиром (3х10 мл). Объединенные экстракты промывали водой (1х10 мл) и соляным раствором (1х10 мл), сушили (MgSO4) и концентрировали, получая 3-бензилокси-2,2-диметилпропаннитрил (2,5 г, 13,2 ммоля).
Смесь, содержащую 3-бензилокси-2,2-диметилпропаннитрил (2,5 г, 13,2 ммоля), 10%-ный водный гидроксид натрия (10 мл) и метанол (150 мл), кипятили в течение 8 часов с обратным холодильником и затем концентрировали. Остаток растворяли в воде (30 мл) и раствор промывали дихлорметаном (2х10 мл), обрабатывали 10%-ной соляной кислотой и экстрагировали этилацетатом (4х20 мл). Объединенные экстракты промывали водой и соляным раствором, сушили (MgSO4) и концентрировали, получая 3-бензилокси-2,2-диметилпропионовую кислоту (1,6 г, 7,5 ммоля).
Смесь 3-бензилокси-2,2-диметилпропионовой кислоты (1,6 г, 7,5 ммоля), бензола (10 мл) и ДМФ (2 капли) охлаждали до температуры между 0 и 5oC и затем медленно добавляли оксалилхлорид (0,98 мл, 11,2 ммоля). Смесь перемешивали в течение 1,5 часа при температуре от 20 до 25oC и концентрировали. Остаток растворяли в бензоле (10 мл) и раствор повторно концентрировали (однократно). Затем остаток растворяли в бензоле (6 мл) и раствор охлаждали до 0oC и добавляли к холодной (0oC) смеси 1-[2-(2,2,2-трифторэтокси)фенил] пиперазина (2,1 г, 8,24 ммоля) и бензола (6 мл). Смесь выдерживали в течение 15 часов при 0oC и затем добавляли триэтиламин (3 мл, 21,3 ммоля). Смесь дополнительно перемешивали в течение 20 минут, разбавляли 10 мл насыщенного карбоната натрия и экстрагировали метиленхлоридом (3х15 мл). Объединенные экстракты промывали водой (1х10 мл), сушили (MgSO4) и концентрировали. Остаток очищали с помощью хроматографии на силикагеле, элюируя гексаном/этилацетатом (8: 2), получая 3-бензилокси-2,2-диметил-1-{4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1- ил}-1-пропанон (2,8 г, 6,4 ммоля).
Суспензию алюмогидрида лития (0,49 г, 12,8 ммоля) и ТГФ (5 мл)охлаждали до 0oC и добавляли к раствору 3-бензилокси-2,2-диметил-1-{4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил}-1-пропанона (2,8 г, 6,4 ммоля) в 12 мл ТГФ. Смесь кипятили в течение 2 часов с обратным холодильником, медленно разбавляли водой, фильтровали и концентрировали. Остаток растворяли в воде и раствор экстрагировали метиленхлоридом (4х30 мл). Объединенные экстракты промывали водой (1х25 мл), сушили (MgSO4) и концентрировали. Остаток очищали с помощью хроматографии на силикагеле, элюируя гексаном/этилацетатом (8:2), получая 3-бензилокси-2,2-диметил-1-{ 4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил}пропан (2,6 г, 6,2 ммоля).
Смесь, содержащую 3-бензилокси-2,2-диметил-1-{4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил} пропан (2,5 г, 6 ммолей), 10%-ный палладий на древесном угле (2,8 г), формиат аммония (3,8 г, 59,6 ммоля) и метанол (130 мл), кипятили в течение 1 часа с обратным холодильником. Реакционной смеси давали охладиться до приблизительно 25oC, затем фильтровали через целит (промывая метанолом и насыщенным карбонатом натрия (20 мл)) и концентрировали. Остаток растворяли в воде и раствор экстрагировали метиленхлоридом (3х20 мл). Объединенные экстракты сушили (MgSO4) и концентрировали. Остаток очищали с помощью хроматографии на силикагеле, элюируя гексаном/этилацетатом (8: 2), получая 2,2-диметил-3-{4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1- ил} -1-пропанол (1,6 г, 5,1 ммоля).
Смесь, содержащую 2,2-диметил-3-{4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил}-1-пропанол (991 мг, 2,9 ммоля), триэтиламин (0,4 мл, 2,9 ммоля), пара-толуолсульфонилхлорид (678 мг, 3,4 ммоля), 4-диметиламинопиридин (35 мг, 0,29 ммоля) и метиленхлорид (15 мл), перемешивали в течение 8 часов при 20-25oC. Затем реакционную смесь фильтровали и концентрировали и остаток очищали с помощью хроматографии на силикагеле, элюируя гексаном/этилацетатом (95: 5), получая 1-хлор-2,2-диметил-3-{4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил}пропан (238 мг, 0,67 ммоля).
ПРИМЕР 30
3-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропил)-5,6,7,8- тетрагидро-2,4(1H,3H)-хиназолиндион
Ниже приведен способ получения соединения формулы I, где R1 обозначает метокси, каждый из R2, R3 и R4 обозначает водород и R5 обозначает группу формулы (a), в которой Z обозначает C(R9), R6 обозначает бензил и R7 и R9 вместе обозначают тетраметилен.
Смесь, содержащую 5,6,7,8-тетрагидро-2,4(1H,3H)-хиназолиндион (665 мг, 4 ммоля), 1-хлор- и 1-бром-3-{4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил} пропан (1,4 г), полученный в соответствии с примером 28, карбонат калия (552 мг, 4 ммоля) и безводный ДМФ (20 мл), выдерживали в течение 16 часов при 65oC в атмосфере аргона. Затем реакционную смесь охлаждали до 25oC, фильтровали, промывали метиленхлоридом и концентрировали при 70oC под вакуумом. Остаток очищали с помощью препаративной тонкослойной хроматографии на силикагеле, элюируя метиленхлоридом/метанолом (95: 5), получая 3-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропил)- 5,6,7,8-тетрагидро-2,4(1H, 3H)-хиназолиндион (838 мг, 1,8 ммоля), tпл 148-150oC; анализ: рассчитано для C23H30F3N4O3•HCl• (H2O)2,5: С 49,56; H 5,97; N 10,05%; обнаружено: C 47,26; H 5,90; N 9,55%.
Работая аналогично примеру 30, но заменяя 1-хлор- и 1-бром-3-{4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропан на различные исходные вещества, получали следующие соединения формулы I:
заменяя на 1-хлор- и 1-бром-3-[4-(4-фтор-2-метоксифенил)пиперазин-1-ил] пропан, получали 3-{ 3-[4-(4-фтор-2-метоксифенил)пиперазин-1-ил] пропил}-5,6,7,8- тетрагидро-2,4(1H, 3H)-хиназолиндион, tпл 230-232oC; анализ: рассчитано для C20H29FN4O3• (HCl)2•(H2O)0,5: C 53,99; H 6,38; N 11,45%; обнаружено: C 52,75; H 6,28; N 11,03%; и
заменяя на 1-хлор- и 1-бром-3-[4-(2-метоксифенил)пиперазин-1-ил]пропан, получали 3-{ 3-[4-(2-метоксифенил)пиперазин-1-ил]пропил}-5,6,7,8- тетрагидро-2,4(1H,3H)-хиназолиндион, tпл 212-214oC; анализ: рассчитано для C22H30N4O3• (HCl)2•(H2O)0,3: C 55,41; H 6,89; N 11,75%; обнаружено: C 55,19; H 6,95; N 11,55%.
ПРИМЕР 31
1-бензил-3-{ 3-[4-(2-метоксифенил)пиперазин-1-ил]пропил}-5- гидроксииминометил-2,4(1H,3H)-пиримидиндион
Ниже приведен способ получения соединения формулы I, где R1 обозначает метокси, каждый из R2, R3 и R4 обозначает водород и R5 обозначает группу формулы (a), в которой Z обозначает CH, R6 обозначает бензил и R7 обозначает гидроксииминометил.
Смесь, содержащую 1-бром-3-[4-(2-метоксифенил)пиперазин-1-ил] пропан (1,09 г, 3,5 ммоля), полученный в соответсвии с примером 25, 1-бензил-5-гидроксииминометил-2,4(1H, 3H)-пиримидиндион (0,86 г, 3,5 ммоля), тетрабутиламмонийфторид (4,5 г, 17,5 ммоля) и ацетонитрил (50 мл), перемешивали в течение 24 часов при 25oC. Затем реакционную смесь концентрировали под вакуумом и остаток растворяли в этилацетате (50 мл). Раствор промывали водой (3х50 мл) и соляным раствором (1х50 мл) и очищали с помощью препаративной тонкослойной хроматографии на силикагеле, элюируя метиленхлоридом/метанолом (95: 5) и 1%-ным гидроксидом аммония, получая 1-бензил-3-{3-[4-(2-метоксифенил)пиперазин-1-ил] пропил}-5- гидроксииминометил-2,4(1H,3H)-пиримидиндион (250 мг, 0,6 ммоля). Свободное основание перекристаллизовывали из раствора фумаровой кислоты в спирте, получая фумарат 1-бензил-3-{3-[4-(2-метоксифенил)пиперазин-1-ил] пропил}-5- гидроксииминометил-2,4(1H,3H)-пиримидиндиона, tпл 198-200oC; анализ: рассчитано для C26H31N5O4•C4H4O4: C 59,78; H 6,02; N 11,62%; обнаружено: C 59,74; H 6,03; N 11,83%.
Работая аналогично примеру 31, но заменяя 1-бром-3-[4-(2-метоксифенил)пиперазин-1-ил] пропан и/или 1-бензил-5-гидроксииминометил-2,4(1H,3H)-пиримидиндион на различные исходные вещества, получали следующие соединения формулы I:
заменяя на 1-хлор-3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил}пропан и 5,6-дигидро-2,4(1H,3H)-пиримидиндион и перекристаллизовывая из раствора соляной кислоты в спирте, получали гидрохлорид 3-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил}пропил)-5,6- дигидро-2,4(1H,3H)-пиримидиндиона, tпл 186-189oC; анализ: рассчитано для C19H24F4N5O3•(HCl)2: C 44,10; H 5,06; N 10,83%; обнаружено: C 43,99; H 5,16; N 10,78%; и
заменяя на 1-хлор-2,2-диметил-3-{4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1- ил}пропан и 1-бензил-5-метил-2,4(1H,3H)-пиримидиндион, получали 1-бензил-3-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} -2,2- диметилпропил)-5-метил-2,4(1H,3H)-пиримидиндион.
ПРИМЕР 32
3-{3-[4-(2-метоксифенил)пиперазин-1-ил]пропил}-5-метил-2,4(1H,3H)- пиримидиндион
Ниже приведен способ получения соединения формулы I, где R1 обозначает метокси, каждый из R2, R3 и R4 обозначает водород и R5 обозначает группу формулы (a), в которой Z обозначает CH, R6 обозначает водород и R7 обозначает метил.
Смесь, содержащую 1-бензил-3-{3-[4-(2-метоксифенил)пиперазин-1-ил]пропил} -5-метил- 2,4(1H, 3H)-пиримидиндион (809 мг, 1,8 ммоля), полученный в соответствии с примером 25, 10%-ный палладий на древесном угле (800 мг) и 0,1 Н формиат аммония (180 мл, 18 ммолей в метаноле), кипятили в течение 10 часов с обратным холодильником. Затем реакционную смесь фильтровали и концентрировали под вакуумом. Остаток очищали с помощью хроматографии на колонках на силикагеле (30 г), элюируя этилацетатом, получая 3-{3-[4-(2-метоксифенил)пиперазин-1-ил] пропил)-5-метил-2,4(1H, 3H)- пиримидиндион (459 мг, 1,28 ммоля), tпл 168-170oC. Свободное основание перекристаллизовывали из раствора соляной кислоты в метаноле, получая гидрохлорид 3-{3-[4-(2-метоксифенил)пиперазин-1-ил] пропил} -5-метил-2,4(1H, 3H)- пиримидиндиона, tпл 245-248oC; анализ: рассчитано для C19H26N4O3•(HCl)2: C 50,99; H 6,71; N 12,52%; обнаружено: C 51,06; H 6,47; N 12,58%.
Работая аналогично примеру 32, но заменяя 1-бензил-3-{3-[4-(2-метоксифенил)пиперазин-1-ил] пропил} -5-метил- 2,4(1H, 3H)-пиримидиндион на другие исходные вещества, получали следующие соединения формулы I:
заменяя на 1-бензил-3-(3-{4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил} пропил)-5- пропил-2,4(1H,3H)-пиримидиндион, получали гидрохлорид 3-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропил)-5- пропил-2,4(1H, 3H)-пиримидиндиона, tпл 135-137oC; анализ: рассчитано для C22H29F3N4O3•(HCl)2: C 48,85; H 6,06; N 10,36%; обнаружено: C 48,84; H 5,95; N 10,21%;
заменяя на 3-бензил-1-{3-[4-(2-метоксифенил)пиперазин-1- ил]пропил}-5-метил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 1-{3-[4-(2-метоксифенил)пиперазин-1-ил] пропил} -5-метил-2,4(1H, 3H)- пиримидиндиона, tпл 239-242oC; анализ: рассчитано для C19H26N4O3•(HCl)2: C 52,90; H 6,54; N 12,98%; обнаружено: C 53,32; H 6,53; N 13,13%;
заменяя на 1-бензил-3-{ 3-[4-(4-фтор-2-метоксифенил)пиперазин-1- ил] пропил} -5-метил-2,4(1H,3H)-пиримидиндион, получали гидрохлорид 3-{3-[4-(4-фтор-2-метоксифенил)пиперазин-1-ил] пропил} -5-метил- 2,4(1H,3H)-пиримидиндиона, tпл 240-242oC; анализ: рассчитано для C19H25FN4O3•(HCl)2: C 50,78; H 6,05; N 12,46%; обнаружено: C 50,60; H 6,03; N 12,22%;
заменяя на 1-бензил-3-{3-[4-(2-(2,2,2-трифторэтокси)фенил)пиперазин-1- ил] пропил}-5-метил-2,4(1H,3H)-пиримидиндион, получали гидрохлорид 3-{3-[4-(2-(2,2,2-трифторэтокси)фенил)пиперазин-1-ил]пропил}-5-метил- 2,4(1H,3H)-пиримидиндиона, tпл 169-171oC; анализ: рассчитано для C20H25F3N4O3•(HCl)2: C 47,93; H 5,47; N 11,18%; обнаружено: C 48,06; H 5,52; N 10,88%;
заменяя на 1-бензил-3-{ 3-[4-(2-метоксифенил)пиперазин-1-ил] пропил} - 5,6-диметил-2,4(1H,3H)-пиримидиндион, получали гидрохлорид 3-{3-[4-(2-метоксифенил)пиперазин-1-ил] пропил} -5,6-диметил-2,4(1H,3H)- пиримидиндиона, tпл 237-239oC; анализ: рассчитано для C20H28N4O3•(HCl)2: C 53,93; H 6,78; N 12,58%; обнаружено: C 53,73; H 6,77; N 12,36%;
заменяя на 1-бензил-3-{3-[4-(2-метоксифенил)пиперазин-1- ил]пропил}-5-метоксиметил-2,4(1H, 3H)-пиримидиндион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-{3-[4-(2-метоксифенил)пиперазин-1-ил] пропил}-5-метоксиметил- 2,4(1H,3H)-пиримидиндиона в виде пены; анализ: рассчитано для C20H28N4O4•C4H4O4: C 56,13; H 6,47; N 10,91%; обнаружено: C 56,22; H 6,47; N 11,02%;
заменяя на 1-бензил-3-{ 3-[4-(5-фтор-2-метоксифенил)пиперазин-1- ил] пропил} -5-метил-2,4(1H,3H)-пиримидиндион, получали гидрохлорид 3-{3-[4-(5-фтор-2-метоксифенил)пиперазин-1-ил] пропил} -5-метил- 2,4(1H,3H)-пиримидиндиона, tпл 270oC (разл. ); анализ: рассчитано для C19H25FN4O3•(HCl)2: C 55,27; H 6,35; N 13,57%; обнаружено: C 55,03; H 6,30; N 13,56%;
заменяя на 1-бензил-3-{ 3-[4-(2-метоксифенил)пиперазин-1-ил]пропил}-5- трифторметил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 3-{3-[4-(2-метоксифенил)пиперазин-1-ил]пропил}-5-трифторметил- 2,4(1H,3H)-пиримидиндиона, tпл 257oC (разл.); анализ: рассчитано для C19H23F3N4O3•(HCl)1,1: C 50,42; H 5,36; N 12,38%; обнаружено: C 50,36; H 5,62; N 12,21%;
заменяя на 1-бензил-3-{3-[4-(4-фтор-2-(2,2,2-трифторэтокси)фенил)пиперазин-1- ил] пропил}-5-метил-2,4(1H,3H)-пиримидиндион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-{ 3-[4-(4-фтор-2-(2,2,2-трифторэтокси)фенил)пиперазин-1-ил] пропил}-5- метил-2,4(1H,3H)-пиримидиндиона, tпл 190-192oC; анализ: рассчитано для C20H24N4O3•C4H4O4: C 51,40; H 5,03; N 9,99%; обнаружено: C 51,45; H 5,07; N 9,92%;
заменяя на 1-бензил-3-{ 3-[4-(2-метоксифенил)пиперазин-1-ил]пропил}-5- этил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 3-{3-[4-(2-метоксифенил)пиперазин-1-ил]пропил}-5-этил-2,4(1H,3H)- пиримидиндиона, tпл 244-246oC; анализ: рассчитано для C20H28N4O3•(HCl)2: C 52,87; H 6,88; N 12,33%; обнаружено: C 53,06; H 6,71; N 12,27%;
заменяя на 1-бензил-3-{3-[4-(2-(2,2,2-трифторэтокси)фенил)пиперазин-1- ил] пропил} -5-этил-2,4(1H,3H)-пиримидиндион, получали гидрохлорид 3-{3-[4-(2-(2,2,2-трифторэтокси)фенил)пиперазин-1-ил] пропил} -5- этил-2,4(1H,3H)-пиримидиндиона, tпл 169-171oC; анализ: рассчитано для C21H27N4O3•(HCl)2: C 49,13; H 5,69; N 16,91%; обнаружено: C 49,01; H 5,82; N 11,20%;
заменяя на 3-бензил-1-{3-[4-(2-(2,2,2-трифторэтокси)фенил)пиперазин-1- ил] пропил}-5-метил-2,4(1H,3H)-пиримидиндион, получали гидрохлорид 1-{3-[4-(2-(2,2,2-трифторэтокси)фенил)пиперазин-1-ил] пропил} -5- метил-2,4(1H,3H)-пиримидиндиона, tпл 202-203oC; анализ: рассчитано для C20H25F3N4O3•(HCl)2: C 47,25; H 5,54; N 11,02%; обнаружено: C 46,98; H 5,73; N 10,82%;
заменяя на 1-бензил-3-{ 3-[4-(2-метоксифенил)пиперазин-1-ил]пропил}-5- пропил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 3-{3-[4-(2-метоксифенил)пиперазин-1-ил] пропил}-5-пропил-2,4(1H,3H)- пиримидиндиона, tпл 237-238oC; анализ: рассчитано для C21H30N4O3•(HCl)1,9: C 59,63; H 7,38; N 13,24%; обнаружено: C 53,24; H 6,70; N 11,54%;
заменяя на 1-бензил-3-{3-[4-(2-(2,2,2-трифторэтокси)фенил)пиперазин-1- ил] пропил} -5,6-диметил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 3-{ 3-[4-(2-(2,2,2-трифторэтокси)фенил)пиперазин-1-ил] пропил} -5,6- диметил-2,4(1H,3H)-пиримидиндиона, tпл 198-199oC; анализ: рассчитано для C21H27F3N4O3•(HCl)2: C 48,28; H 5,78; N 10,72%; обнаружено: C 48,26; H 5,81; N 10,77%;
заменяя на 1-бензил-3-(3-{4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1- ил}пропил)-5,5-диметил-2,4,6(1H,3H,5H)-пиримидинтрион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-(3-{4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил}пропил)-5,5-диметил-2,4,6(1H,3H, 5H)-пиримидинтриона, tпл 200oC; анализ: рассчитано для C21H27F3N4O4• (C4H4O4)0,5•(CH4O)1,5: C 52,31; H 6,27; N 9,96%; обнаружено: C 51,95; H 5,91; N 10,35%;
заменяя на 1-бензил-3-{ 3-[4-(2-метоксифенил)пиперазин-1-ил] пропил} - 5,5-диметил-2,4,6(1H, 3H, 5H)-пиримидинтриона и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-{3-[4-(2-метоксифенил)пиперазин-1-ил] пропил} -5,5-диметил- 2,4,6(1H,3H,5H)-пиримидинтриона, tпл 196oC; анализ: рассчитано для C20H28N4O4• C4H4O4•(H2O)0,5: C 56,13; H 6,48; N 10,91%; обнаружено: C 56,02; H 6,43; N 10,85%;
заменяя на 1-бензил-3-(3-{4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1- ил} -2,2-диметилпропил)-5-метил-2,4(1H, 3H)-пиримидиндион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-(3-{4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} -2,2- диметилпропил)-5-метил-2,4(1H,3H)-пиримидиндиона, tпл 143-144oC; анализ: рассчитано для C22H29F3N4O3• C4H4O4: C 54,73; H 5,83; N 9,82%; обнаружено: C 54,77; H 5,81; N 9,78%;
заменяя на 1-бензил-3-{3-[4-(4-фтор-2-метоксифенил)пиперазин-1- ил]пропил} -5,5-диметил-2,4,6(1H, 3H, 5H)-пиримидинтриона и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-{3-[4-(4-фтор-2-метоксифенил)пиперазин-1-ил] пропил} -5,5- диметил-2,4,6(1H, 3H,5H)-пиримидинтриона, tпл 171oC; анализ: рассчитано для C20H27FN4O4• (C4H4O4)0,5•(H2O)1,25: C 54,26; H 6,52; N 11,50%; обнаружено: C 54,07; H 6,35; N 11,39%;
заменяя на 1-бензил-3-(1-{4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1- илметил} циклопроп-1-илметил)-5-метил-2,4(1H, 3H)-пиримидиндион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-(1-{ 4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1- илметил}циклопроп-1-илметил)-5-метил-2,4(1H, 3H)-пиримидиндиона в виде пены; анализ: рассчитано для C22H27F3N4O3• (C4H4O4)1,5: C 53,67; H 5,31; N 8,94%; обнаружено: C 53,61; H 5,50; N 8,90%;
заменяя на 1-бензил-3-{ 1-[4-(2-метоксифенил)пиперазин-1- илметил]циклопроп-1-илметил}-5-метил-2,4(1H,3H)-пиримидиндион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-{1-[4-(2-метоксифенил)пиперазин-1-илметил] циклопроп-1- илметил}-5-метил-2,4(1H,3H)-пиримидиндиона в виде пены; анализ: рассчитано для C21H28N4O3•C4H4O4: C 58,11; H 6,59; N 10,84%; обнаружено: C 58,38; H 6,50; N 10,52%; и
заменяя на 1-бензил-3-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1- ил} пропил)-5,5-диметил-2,4,6(1H, 3H, 5H)-пиримидинтрион и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-(3-{ 4-[4-фтор-2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил} пропил)-5,5-диметил-2,4,6(1H, 3H, 5H)-пиримидинтриона, tпл 132oC; анализ: рассчитано для C21H26F4N4O4• (C4H4O4)0,5•(H2O)1,25: C 49,77; H 5,54; N 10,09%; обнаружено: C 49,69; H 5,44; N 9,96%.
ПРИМЕР 33
3-{ 3-[4-(2-метоксифенил)пиперазин-1-ил] пропил} -1,5-диметил- 2,4(1H, 3H)-пиримидиндион
Ниже приведен способ получения соединения формулы I, где R1 обозначает метокси, R2 обозначает водород, R3 и R4 обозначают водород и R5 обозначает группу формулы (a), в которой Z обозначает CH и каждый из R6 и R7 обозначает метил.
Смесь, содержащую 3-{ 3-[4-(2-метоксифенил)пиперазин-1-ил] пропил} -5- метил-2,4(1H, 3H)-пиримидиндион (550 мг, 1,53 ммоля), полученный в соответствии с примером 32, диметилсульфат (193 мг, 1,53 ммоля) и 0,1Н тетрабутиламмонийфторид (100 мл, 10 ммолей в ТГФ), перемешивали в течение 4 часов при 25oC. Затем реакционную смесь концентрировали под вакуумом и остаток очищали с помощью хроматографии на колонках на силикагеле, элюируя этилацетатом, получая 3-{3-[4-(2-метоксифенил)пиперазин-1-ил]пропил}-1,5-диметил- 2,4(1H, 3H)-пиримидиндион в виде масла. Путем перекристаллизации свободного основания из раствора соляной кислоты в спирте получали гидрохлорид 3-{3-[4-(2-метоксифенил)пиперазин-1-ил] пропил} -1,5- диметил-2,4(1H,3H)-пиримидиндиона, tпл 256-258oC; анализ: рассчитано для C20H28N4O3•(HCl)2: C 53,93; H 6,79; N 12,58%; обнаружено: C 54,05; H 6,87; N 12,58%;
Работая аналогично примеру 33, но заменяя 3-{ 3-[4-(2-метоксифенил)пиперазин-1-ил]пропил}-5-метил-2,4(1H,3H)- пиримидиндион и/или диметилсульфат на другие исходные вещества, получали следующие соединения формулы I:
заменяя на 1-{ 3-[4-(2-метоксифенил)пиперазин-1-ил] пропил}-5- метил-2,4(1H, 3H)-пиримидиндион, получали гидрохлорид 1-{ 3-[4-(2-метоксифенил)пиперазин-1-ил] пропил} -3,5-диметил-2,4(1H, 3H)- пиримидиндиона, tпл 242-244oC; анализ: рассчитано для C20H28N4O3•(HCl)2: C 53,93; H 6,78; N 12,58%; обнаружено: C 53,70; H 6,92; N 12,58%;
заменяя на 3-{3-[4-(2-(2,2,2-трифторэтокси)фенил)пиперазин-1- ил]пропил} -5-метил-2,4(1H, 3H)-пиримидиндион и на 4-хлорбензилхлорид, получали гидрохлорид 1-(4-хлорбензил)-3-{3-[4-(2-(2,2,2-трифторэтокси)фенил)пиперазин-1- ил] пропил} -5-метил-2,4(1H,3H)-пиримидиндиона, tпл 170-172oC; анализ: рассчитано для C27H30ClF3N4O3•HCl: C 55,20; H 5,31; N 9,53%; обнаружено: C 55,01; H 5,24; N 9,56%;
заменяя на 3-{3-[4-(2-(2,2,2-трифторэтокси)фенил)пиперазин-1- ил]пропил} -5-метил-2,4(1H, 3H)-пиримидиндион и на 3-хлорбензилхлорид, получали гидрохлорид 1-(3-хлорбензил)-3-{3-[4-(2-(2,2,2-трифторэтокси)фенил)пиперазин-1- ил] пропил} -5-метил-2,4(1H,3H)-пиримидиндиона, tпл 142-144oC; анализ: рассчитано для C27H30ClF3N4O3•HCl: C 55,03; H 5,33; N 9,50%; обнаружено: C 54,80; H 5,27; N 9,46%;
заменяя на 3-{3-[4-(2-(2,2,2-трифторэтокси)фенил)пиперазин-1- ил]пропил} -5-метил-2,4(1H, 3H)-пиримидиндион и на 2-пиколилхлорид и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-{3-[4-(2-(2,2,2-трифторэтокси)фенил)пиперазин-1-ил] пропил} -5- метил-1-пирид-2-илметил-2,4(1H, 3H)-пиримидиндиона, tпл 134-135oC; анализ: рассчитано для C26H30F3N5O3• C4H4O4: C 56,07; H 5,49; N 10,90%; обнаружено: C 55,82; H 5,64; N 11,05%;
заменяя на 3-{3-[4-(2-(2,2,2-трифторэтокси)фенил)пиперазин-1- ил]пропил} -5-метил-2,4(1H, 3H)-пиримидиндион и на 2-хлорбензилхлорид, получали гидрохлорид 1-(2-хлорбензил)-3-{3-[4-(2-(2,2,2-трифторэтокси)фенил)пиперазин-1- ил] пропил} -5-метил-2,4(1H,3H)-пиримидиндиона, tпл 152-153oC; анализ: рассчитано для C27H30ClF3N4O3•HCl: C 55,20; H 5,31; N 9,53%; обнаружено: C 54,99; H 5,38; N 9,56%;
заменяя на 3-{3-[4-(2-(2,2,2-трифторэтокси)фенил)пиперазин-1- ил]пропил} -5-метил-2,4(1H, 3H)-пиримидиндион и на 2,6-диметилбензилхлорид и перекристаллизовывая из раствора фумаровой кислоты в спирте, получали фумарат 3-{ 3-[4-(2-(2,2,2-трифторэтокси)фенил)пиперазин-1-ил] пропил}-5- метил-1-(2,6-диметилбензил)-2,4(1H, 3H)-пиримидиндиона, tпл 121-124oC; анализ: рассчитано для C29H35F3N4O3• C4H4O4: C 58,40; H 6,09; N 8,26%; обнаружено: C 58,63; H 6,14; N 8,36%; и
заменяя на 3-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1- ил}пропил)-5-метил-2,4(1H, 3H)-пиримидиндион и на 4-метилбензилхлорид, получали гидрохлорид 3-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил}пропил)-1-(4- метилбензил)-5-метил-2,4(1H,3H)-пиримидиндиона, tпл 141-143oC; анализ: рассчитано для C28H33F3N4O3•(HCl)2: C 55,89; H 5,99; N 9,12%; обнаружено: C 56,18; H 5,99; N 9,31%.
ПРИМЕР 34
1-(4-метоксибензил)-3-{ 3-[4-(2-метоксифенил)пиперазин-1- ил] пропил}-2,4-диоксо-5(1H,3H)-пиримидинкарбоксамид
Ниже приведен способ получения соединения формулы I, где R1 обозначает метокси, каждый из R2, R3 и R4 обозначает водород и R5 обозначает группу формулы (a), в которой Z обозначает CH, R6 обозначает 4-метоксифенил и R7 обозначает карбамоил.
Смесь, содержащую 5-циан-1-(4-метоксибензил)-3-{ 3-[4-(2-метоксифенил)пиперазин-1- ил] пропил}-2,4(1H,3H)-пиримидиндион (450 мг, 0,92 ммоля), полученный в соответствии с примером 25, и трифторуксусную кислоту (4 мл), кипятили с обратным холодильником в течение 4 дней. Затем реакционную смесь концентрировали под вакуумом и остаток растворяли в метиленхлориде. Раствор промывали 10%-ным водным гидроксидом натрия и затем водой, сушили (Na2SO4), фильтровали и концентрировали под вакуумом. Остаток очищали с помощью препаративной тонкослойной хроматографии на силикагеле, элюируя метиленхлоридом/метанолом (97: 3), получая 1-(4-метоксибензил)-3-{ 3-[4-(2-метоксифенил)пиперазин-1-ил] пропил}-2,4- диоксо-5(1H,3H)-пиримидинкарбоксамид в виде пены. Путем перекристаллизации свободного основания из раствора соляной кислоты в спирте получали гидрохлорид 1-(4-метоксибензил)-3-{3-[4-(2-метоксифенил)пиперазин-1- ил] пропил}-2,4-диоксо-5(1H,3H)-пиримидинкарбоксамида, tпл 157-158oC; анализ: рассчитано для C27H33N5O5•(HCl)2: C 53,06; H 6,30; N 11,46%; обнаружено: C 53,35; H 5,90; N 11,12%.
ПРИМЕР 35
Цис-3-(3-{ 4-[4-фтор-2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил}пропил)-5,6-дигидрокси-5-метил-5,6-дигидро-2,4(1H,3H)-пиримидиндион
Ниже приведен способ получения цис-изомеров соединения формулы I, где R1 обозначает 2,2,2-трифторэтокси, R2 обозначает фтор в положении 4, каждый из R3 и R4 обозначает водород и R5 обозначает группу формулы (c), в которой X обозначает CH(OH), R6 обозначает водород и один из радикалов, R8 обозначает гидрокси, а другой обозначает метил.
Смесь, содержащую 3-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил}пропил)-5- метил-2,4(1H,3H)-пиримидиндион (1,12 г, 2,52 ммоля), полученный в соответствии с примером 32, трифторуксусную кислоту (0,86 г, 7,56 ммоля), воду (0,82 мл) и ДМСО (22 мл), охлаждали до температуры между 0 и 5oC и добавляли N-бромсукцинимид (3,02 г/мл, 0,58 мл, 10,08 ммоля). Смесь перемешивали в темноте при 25oC, обрабатывали 5%-ным бикарбонатом натрия, перемешивали в течение 1 часа, разбавляли водой (10 мл) и затем экстрагировали этилацетатом (4х20 мл). Объединенные экстракты промывали водой/соляным раствором (1:1, 1х30 мл), сушили (MgSO4) и концентрировали. Остаток очищали с помощью быстрой хроматографии на силикагеле, элюируя метиленхлоридом/метанолом (93: 7), получая цис-3-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропил)- 5,6-дигидрокси-5-метил-5,6-дигидро-2,4(1H, 3H)-пиримидиндион (0,49 г, 1,03 ммоля), tпл 110oC. Путем перекристаллизации свободного основания (0,49 мг, 1,01 ммоля) из раствора фумаровой кислоты в метаноле получали фумарат цис-3-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил} пропил)-5,6-дигидрокси-5-метил-5,6-дигидро-2,4(1H, 3H)-пиримидиндиона (493 мг, 0,83 ммоля), tпл 155oC; анализ: рассчитано для C20H26F4N4O5• C4H4O4: C 48,49; H 5,09; N 9,42%; обнаружено: C 48,33; H 5,08; N 9,61%.
Работая аналогично примеру 35, но заменяя 3-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил}пропил)-5- метил-2,4(1H,3H)-пиримидиндион на 3-(3-{ 4-[2-(2,2,2-трифторэтокси)фенил]пиперазин-1-ил}пропил)-5- метил-2,4(1H, 3H)-пиримидиндион, получали фумарат цис-3-(3-{4-[2-(2,2,2-трифторэтокси)фенил] пиперазин-1-ил} пропил)-5,6- дигидрокси-5-метил-5,6-дигидро-2,4(1H,3H)-пиримидиндиона, tпл 125-126oC; анализ: рассчитано для C20H27F3N4O5• (C4H4O4)0,5•(H2O)0,75: C 49,67; H 5,78; N 10,53%; обнаружено: C 49,73; H 5,55; N 10,48%.
ПРИМЕР 35A
Полученный аналогично описанному выше фумарат цис-3-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил}пропил)-5,6-дигидрокси-5-метил-5,6-дигидро-2,4(1H, 3H)-пиримидиндиона, растворяли в этаноле до концентрации 20 мг/мл. Фракцию объемом 2,0 мл вводили в колонку типа Chiralpak AS (2х250 см) и элюировали гексаном/этанолом/диэтиламином (90:9,9:0,1) при скорости 8,0 мл/мин, контролируя элюат с помощью абсорбции в УФ-области при 230 нм. Первым из адсорбента элюировали (+)-энантиомер, а затем (-)-энантиомер.
После повторных введений и элюирований собирали вместе фракции с высоким содержанием (+)-энантиомера и концентрировали, получая 610 мг (1,28 ммоля) свободного основания. Этот материал растворяли в теплом метаноле (10 мл), добавляли фумаровую кислоту (148 мг, 1,28 ммоля) и растворяли. После добавления этилацетата (15 мл) получали суспензию тонкого порошка. Суспензию выдерживали при комнатной температуре, фильтровали и сушили под вакуумом и после перекристаллизации твердых фракций получали 400 мг (+)-энантиомера фумарата цис-3-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1- ил}пропил)-5,6-дигидрокси-5-метил-5,6-дигидро-2,4(1H, 3H)-пиримидиндиона, tпл 183,5-192,1oC, [ α ]D +13,2o (c = 0,34, MeOH). Продукт анализировали с использованием аналитической колонки типа Chiralpak AS и обнаружили, что он состоит на 94,9% из (+)-энантиомера и на 5,1% из (-)-энантиомера.
Аналогичным образом собирали вместе фракции с высоким содержанием (-)-энантиомера и концентрировали, получая 540 мг свободного основания. Этот материал растворяли в теплом метаноле (10 мл), добавляли фумаровую кислоту (130 мг) и растворяли. После добавления этилацетата (15 мл)получали суспензию тонкого порошка. Суспензию выдерживали при комнатной температуре, фильтровали и сушили под вакуумом, получая 356 мг (-)-энантиомера фумарата цис-3-(3-{ 4-[4-фтор-2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил}пропил)-5,6-дигидрокси-5-метил-5,6-дигидро-2,4(1H, 3H)-пиримидиндиона, tпл 169,5-178,0oC, [ α ]D -15,6o (c = 0,48, MeOH). Продукт анализировали с использованием аналитической колонки типа Chiralpak AS и обнаружили, что он состоит на 91,9% из (-)-энантиомера и на 8,1% из (+)-энантиомера.
ПРИМЕР 36
Транс-3-(3-{ 4-[4-фтор-2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил} пропил)-5,6-дигидрокси-5-метил-5,6-дигидро-2,4(1H,3H)-пиримидиндион
Ниже приведен способ получения транс-изомеров соединения формулы I, где R1 обозначает 2,2,2-трифторэтокси, R2 обозначает фтор в положении 4, каждый из R3 и R4 обозначает водород и R5 обозначает группу формулы (c), в которой X обозначает CH(OH), R6 обозначает водород и один из радикалов R8 обозначает гидрокси, а другой обозначает метил.
Смесь, содержащую, цис-3-(3-{ 4-[4-фтор-2-(2,2,2-трифторэтокси)фенил] пиперазин-1- ил}пропил)-5,6-дигидрокси-5-метил-5,6-дигидро-2,4(1H,3H)-пиримидиндион (600 мг, 1,42 ммоля), полученный в соответствии с примером 35, моногидрат пара-толуолсульфоновой кислоты (1,2 г, 6,3 ммоля) и ДМСО (46 мл), выдерживали в течение 14 часов при 50oC. Смеси давали охладиться до приблизительно 25oC, доводили до нейтрального значения pH путем обработки насыщенным бикарбонатом натрия и экстрагировали этилацетатом (4х30 мл). Объединенные экстракты промывали водой (1х20 мл) и соляным раствором, сушили (MgSO4) и концентрировали. Остаток очищали, загружая на силикагелевые пластинки для препаративной хроматографии и проявляли дважды метиленхлоридом/метанолом (93:7), получая транс-3-(3-{4-[4-фтор-2-(2,2,2-трифторэтокси)фенил]пиперазин-1- ил}пропил)-5,6-дигидрокси-5-метил-5,6-дигидро-2,4(1H,3H)-пиримидиндион (102 мг, 0,21 ммоля) в виде пены.
ПРИМЕР 37
Ниже представлены репрезентативные фармацевтические композиции, содержащие соединение формулы I.
КОМПОЗИЦИЯ ДЛЯ ОРАЛЬНОГО ПРИМЕНЕНИЯ
Репрезентативный раствор для орального введения содержит:
Соединение формулы I - 100-1000 мг
Моногидрат лимонной кислоты - 105 мг
Гидроксид натрия - 18 мг
Корригент
Вода - q.s. до 100 мл
КОМПОЗИЦИЯ ДЛЯ ВНУТРИВЕННОГО ПРИМЕНЕНИЯ
Репрезентативный раствор для внутривенного введения содержит:
Cоединение формулы I - 10-100 мг
Моногидрат декстрозы - q.s. до изотоничности
Моногидрат лимонной кислоты - 1,05 мг
Гидроксид натрия - 0,18 мг
Вода для инъекции - q.s. до 1.0 мл
ТАБЛЕТИРОВАННАЯ КОМПОЗИЦИЯ
Репрезентативная таблетированная форма соединения формулы I может содержать:
Соединение формулы I - 1%
Микрокристаллическая целлюлоза - 73%
Стеариновая кислота - 25%
Коллоидная двуокись кремния - 1%
ПРИМЕР 38
Функциональный анализ in vitro α1 -адренорецептора в тканях, выделенных из кролика и крысы
Ниже описаны опыты in vitro по оценке относительного влияния тестируемых соединений на медиируемое α1 -адренорецептором сокращение выделенной гладкой мышцы аорты крысы и выделенной гладкой мышцы мочевого пузыря кролика.
Грудные аорты выделяли из крыс и немедленно погружали в раствор Кребса (содержащий в мМ концентрациях: NaCl 118,5; NaHCO3 25; декстрозу 5; KCl 4,8; CaCl2 2,5; MgSO4 1,2; KH2PO4 1,2; кокаин 0,03; кортикостерон 0,03; пропранолол 0,001; аскорбиновую кислоту 0,1; и индометацин 0,01). Аорты отсекали от периферической ткани, а затем от наиболее проксимального сегмента отсекали кольцевой поперечный срез длиной приблизительно 3 мм. Кольца аорты подвешивали вертикально в тканевые ванны объемом 10 куб. см и выдерживали в растворе Кребса, поддерживая температуру 37oC, с постоянной аэрацией газовой смесью 95% O2 и 5% CO2. К каждому кольцу прикладывали постоянное растягивающее усилие в 1 г и затем периодически регулировали для поддержания этой нагрузки в 1 г на протяжении опыта.
Мочевые пузыри опорожняли и выделяли из крыс. Мочевые пузыри отсекали от периферической ткани и затем от шейки мочевого пузыря отсекали кольцевой поперечный срез в области выше мочеиспускательного канала на расстоянии приблизительно одной трети до мочевого пузыря. Шейку мочевого пузыря рассекали параллельно продольным мышечным волокнам, чтобы получить плоский срез мышечной ткани, и затем этот плоский срез рассекали параллельно продольным мышцам, чтобы получить несколько плоских полосок. Полоски ткани мочевого пузыря подвешивали вертикально в тканевые ванны объемом 10 см3 и выдерживали в растворе Кребса, поддерживая температуру 33oC, с постоянной аэрацией газовой смесью 95% O2 и 5% CO2. К каждой полоске ткани мочевого пузыря прикладывали постоянное растягивающее усилие в 5 г. Полоскам давали возможность сократиться до постоянного растягивающего усилия в 1 г и затем периодически регулировали для поддержания этой нагрузки в 1 г на протяжении опыта.
Препаратам кольца аорты или полоски мочевого пузыря давали возможность уравновеситься в течение 60 минут, за это время раствор ванны обновляли каждые 15 минут. Затем ткань выдерживали в растворе ванны, содержащем норэпинефрин (0,1-10 мкМ) и после того, как достигалось состояние стационарного сокращения, ткань выдерживали в растворе ванны без норэпинефрина, обновляя раствор дважды каждые 5 минут на протяжении 30 минут. Кольца аорты выдерживали в норэпинефрине, а полоски ткани мочевого пузыря в фенилэфрине таким образом, чтобы накапливалась концентрация. А именно, выделенную ткань выдерживали в растворе ванны, содержащем пороговую концентрацию либо норэпинефрина, либо фенилэфрина до достижения состояния стационарной сократительной реакции, а затем концентрацию агониста кумулятивно увеличивали с приращениями по 0,5 log до достижения максимальной или близкой к максимальной реакции. Норэпинефрин вызывал зависящее от концентрации, медиируемое α1-адренорецептором сокращение колец аорты. Фенилэфрин вызывал зависящее от концентрации медиируемое α1-адренорецептором сокращение полосок ткани мочевого пузыря. Затем ткань выдерживали в растворе без агониста, обновляя раствор дважды каждые 5 минут в течение 30 минут. После того как устанавливали заданный уровень растягивающего усилия и корректировали его до 1 г, ткань выдерживали в растворе ванны, содержащем тестируемое соединение, обновляя раствор каждые 15 минут в течение 60 минут. В присутствии тестируемого соединения ткань вновь выдерживали либо в норэпинефрине, либо в фенилэфрине таким образом, чтобы накапливалась концентрация, увеличивая концентрацию агониста до достижения максимальной или близкой к максимальной реакции.
Определяли отношение концентраций (ОК) агониста, необходимых для получения одинаковых по активности реакций, в отсутствии и присутствии тестируемого соединения. Основываясь на отношении концентраций, установленной концентрации (молярной) тестируемого соединения и соотношении:
определяли отрицательный логарифм константы диссоциации (pA2) для каждого тестируемого соединения в отношении α1 -адренорецепторов как ткани аорты, так и ткани мочевого пузыря.
Аналогично процедуре, описанной в примере 38, испытывали соединения формулы I и установили, что они избирательно ингибируют медиируемые α1-адренорецептором сокращения выделенной гладкой мышцы мочевого пузыря кролика. И, наоборот, антагонист α1-адренорецептора празозин, назначаемый для лечения ДГП, избирательно ингибировал медиируемые α1-адренорецептором сокращения выделенной гладкой мышцы аорты крысы.
ПРИМЕР 39
Функциональный анализ in vitro α1 -адренорецептора в ткани, выделенной из человека
Ниже описаны опыты in vitro по оценке относительного влияния тестируемых соединений на медиируемые α1-адренорецептором сокращения выделенных гладких мышц артерий и мочевого пузыря человека.
Артериальные кровеносные сосуды брали после смерти человека и немедленно погружали в холодный физиологический солевой раствор. Hе позднее, чем через 24 часа после отделения, выделенную артериальную ткань погружали в раствор Кребса (содержащий в мМ концентрациях: NaCl 118,5; NaHCO3 25; декстрозу 5; КC1 4,8; CaCl2 2,5; MgSO4 1,2; KH2PO4 1,2; кокаин 0,03; кортикостерон 0,03; пропранолол 0,001; аскорбиновую кислоту 0,1; и индометацин 0,01). Артерии отсекали от периферической ткани, а затем отсекали кольцевые поперечные срезы длиной приблизительно 3 мм. Артериальные кольца подвешивали вертикально в тканевую ванну объемом 10 куб.см и выдерживали в растворе Кребса, поддерживая температуру 37oC, с постоянной аэрацией газовой смесью 95% O2 и 5% CO2. К каждому кольцу прикладывали постоянное растягивающее усилие в 1-1,5 г и затем периодически регулировали для поддержания этой нагрузки в 1 г на протяжении опыта.
Гладкомышечную ткань простаты и шейки мочевого пузыря человека получали с помощью радикальных цистопростатэктомий или радикальных простатэктомий и немедленно погружали в раствор Кребса. Ткань простаты и мочевого пузыря отсекали от периферической ткани, затем нарезали полоски ткани длиной 0,8-1,2 см и шириной 3-5 мм, и подвешивали вертикально в тканевые ванны объемом 10 куб.см и выдерживали в растворе Кребса, поддерживая температуру 37oC, с постоянной аэрацией газовой смесью 95% O2 и 5% CO2. К каждой полоске мышечной ткани прикладывали постоянное растягивающее усилие в 0,75-1 г и затем периодически регулировали для поддержания этой нагрузки в 1 г на протяжении опыта.
Препаратам артериального кольца и полосок простаты и шейки мочевого пузыря давали уравновеситься в течение 60 минут, за это время раствор ванны обновляли каждые 15 минут. Затем ткань выдерживали в растворе ванны, содержащем норэпинефрин (1-10 мкМ) и после достижения состояния стационарного сокращения ткань выдерживали в растворе ванны без норэпинефрина, обновляя раствор дважды каждые 5 минут на протяжении 30 минут. Препараты артериального кольца и полосок ткани простаты и шейки мочевого пузыря выдерживали в норэпинефрине таким образом, чтобы накапливалась концентрация. А именно, выделенную ткань выдерживали в растворе ванны, содержащем пороговую концентрацию норэпинефрина, до достижения состояния стационарной сократительной реакции, а затем концентрацию норэпинефрина кумулятивно увеличивали с приращениями по 0,5 log до достижения максимальной или близкой к максимальной реакции. Норэпинефрин вызывал зависящее от концентрации медиируемое α1-адренорецептором сокращение препаратов артериального кольца и полосок ткани простаты и шейки мочевого пузыря.
Затем ткань выдерживали в растворе без норэпинефрина, обновляя раствор дважды каждые 5 минут в течение 30 минут. После того как устанавливали заданный уровень растягивающего усилия и корректировали его до 1 г, ткань выдерживали в растворе ванны, содержащем тестируемое соединение, обновляя раствор каждые 15 минут в течение 60 минут. В присутствии тестируемого соединения ткань вновь выдерживали в норэпинефрине таким образом, чтобы накапливалась концентрация, увеличивая концентрацию норэпинефрина до достижения максимальной или близкой к максимальной реакции.
Определяли отношение концентраций (ОК) норэпинефрина, необходимых для получения одинаковых по активности реакций, в отсутствии и присутствии тестируемого соединения. Основываясь на отношении концентраций, установленной концентрации (молярной) тестируемого соединения, и соотношении:
определяли отрицательный логарифм константы диссоциации (pA2) для каждого тестируемого соединения в отношении α1 -адренорецепторов препаратов артериального кольца и полосок ткани простаты и шейки мочевого пузыря.
Аналогично процедуре, описанной в примере 39, тестировали соединения формулы I и установили, что они избирательно ингибируют медиируемые α1-адренорецептором сокращения выделенной гладкой мышцы простаты и шейки мочевого пузыря человека. И, наоборот, празозин неизбирательно ингибировал медиируемые α1-адренорецептором сокращения как выделенной гладкой мышцы простаты/шейки мочевого пузыря, так и выделенной гладкой артериальной мышцы человека.
ПРИМЕР 40
Анализ in vivo кровяного давления у крыс
Ниже описаны опыты in vivo по оценке влияния тестируемых соединений на кровяное давление у нормотензивных крыс и крыс с самопроизвольно повышенным кровяным давлением.
Нормотензивных или с самопроизвольно повышенным кровяным давлением крыс (0,25-0,45 кг) заставляли голодать в течение 18 часов и анестезировали с помощью эфира. Правую бедренную вену выделяли и канюлировали с помощью наполненной жидкостью полиэтиленовой канюли для быстрого внутривенного введения большого объема тестируемого вещества. Правую бедренную артерию выделяли и канюлировали с помощью наполненной жидкостью полиэтиленовой канюли, соединенной с внешним датчиком давления для регистрации среднего артериального кровяного давления (СКД).
Крыс помещали в клетки для иммобилизации и давали возможность отойти от анестезии. После 30-минутного периода стабилизации вводили внутривенно тестируемые соединения или наполнитель и непрерывно регистрировали кровяное давление в течение по меньшей мере 4 часов после введения.
Аналогично процедуре, описанной в примере 40, тестировали соединения формулы I и установили, что они способны в существенно меньшей степени, чем празозин, оказывать влияние на понижение кровяного давления.
ПРИМЕР 41
Анализ in vivo реакции крыс на наклонное положение тела
Ниже описаны опыты in vivo по оценке способности тестируемых соединений ингибировать у нормотензивных крыс рефлекторное повышение уровня нижнего кровяного давления в ответ на вертикальный наклон. Нормотензивных крыс (0,25-0,45 кг) заставляли голодать в течение 18 часов и анестезировали с помощью эфира. Правую бедренную вену выделяли и канюлировали с помощью наполненной жидкостью полиэтиленовой канюли для быстрого внутривенного введения большого объема тестируемого вещества. Правую бедренную артерию выделяли и канюлировали с помощью наполненной жидкостью полиэтиленовой канюли, соединенной с внешним датчиком давления для регистрации среднего артериального кровяного давления (СКД).
Крыс иммобилизировали в положении лежа на спине и давали возможность отойти от анестезии. После 30-минутного периода стабилизации вводили внутривенно тестируемые соединения или наполнитель и непрерывно регистрировали кровяное давление, в то время как крыс наклоняли вертикально на 30-60 градусов от положения лежа на спине, через 15, 30 и 45 минут после введения.
Аналогично процедуре, описанной в примере 41, тестировали соединения формулы I и установили, что они способны в существенно меньшей степени, чем празозин, ингибировать рефлекторное повышение уровня нижнего кровяного давления в ответ на вертикальный наклон.
ПРИМЕР 42
Анализ in vivo кровяного и внутрипочечного давления у собак
Ниже описаны опыты in vivo по оценке относительного влияния тестируемых соединений на повышение внутрипочечного давления, вызванного стимуляцией подчревного нерва, и на повышение диастолического кровяного давления, вызванного фенилэфрином, у анестезированной собаки.
Нечистокровных собак (10-20 кг) заставляли голодать в течение 12-18 часов и анестезировали пентобарбиталом натрия (35 мг/кг, внутривенно). Вводили эндотрахеальную трубку и после этого легкие механически вентилировали комнатным воздухом. Правую бедренную вену выделяли и канюлировали с помощью двух полиэтиленовых канюль, одной для введения путем непрерывного вливания пентобарбитала натрия (5-10 мг/кг/час) и второй для быстрого внутривенного введения большого объема тестируемых веществ в виде болюсов. Правую бедренную артерию выделяли и канюлировали до брюшной аорты с помощью наполненной жидкостью полиэтиленовой канюли, соединенной с внешним датчиком давления для регистрации диастолического аортального кровяного давления (ДАД). Мочевой пузырь открывали путем разреза по вентральной средней линии брюшного отдела и опорожняли с помощью иглы 22 размера. Мочевой пузырь канюлировали путем прокола наполненным водой баллонным катетером, соединенным с внешним датчиком давления для регистрации простатического внутрипочечного давления (ВПД). Правый подчревный нерв (ППН) тщательно выделяли и присоединяли к электроду Dastre для стимуляции нерва.
Препарированному объекту давали возможность стабилизироваться по крайней мере в течение 30 минут, и он должен был иметь стабильное нижнее ВПД не менее чем за 15 минут до начала программы эксперимента. ППН стимулировали (20-50 В, 10 Гц, серия импульсов по 10 мс в течение 10 с) для индуцирования измеримого повышения ВПД и затем вводили фенилэфрин (ФЭ) путем быстрой внутривенной инъекции большого объема (0,5-0,6 мкг/кг) для индуцирования измеримого повышения ДАД. Стимуляцию ППН и быструю внутривенную инъекцию большого объема ФЭ повторяли каждые 5 минут до тех пор, пока не достигали трех последовательных воспроизводимых повышений ВПД и ДАД. Вводили наполнитель (0,1-0,3 мл/кг) и спустя 20 минут повторяли стимуляцию ППН и быструю внутривенную инъекцию большого объема ФЭ. Затем вводили тестируемое соединение и спустя 20 минут повторяли стимуляцию ППН и быструю внутривенную инъекцию большого объема ФЭ. Тестируемое соединение вводили приблизительно каждые 20 минут, увеличивая дозу, пока не достигали максимального или близкого к максимальному ингибирования повышения ВПД и ДАД.
Аналогично методике, описанной в примере 42, тестировали соединения формулы I и установили, что они избирательно ингибируют повышение ВПД, 5 вызванное стимуляцией ППН. И, наоборот, празозин сходным образом ингибирует повышение как ВПД, так и ДАД.
Сравнительные данные относительно селективности (заявленных соединений) в отношении α1-адренергического рецептора приведены в таблице 1.
Результаты анализа основаны на протоколе испытаний in vitro, приведенном в примере 38. Анализируемые соединения по изобретению обладали по крайней мере в 10 раз более высокой активностью в отношении ингибирования опосредованного α1-адренергическим рецептором сокращения гладкой мышцы изолированного мочевого пузыря кролика по сравнению с ингибированием сокращения гладкой мышцы изолированной аорты крысы, опосредованным α1-адренергическим рецептором.
| название | год | авторы | номер документа |
|---|---|---|---|
| 2-(АРИЛФЕНИЛ)АМИНОИМИДАЗОЛИНОВЫЕ ПРОИЗВОДНЫЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1998 |
|
RU2211834C2 |
| ПРОИЗВОДНЫЕ ЦЕФАЛОСПОРИНА И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 1994 |
|
RU2130939C1 |
| ПРОИЗВОДНЫЕ КАРБАМИНОВОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ | 1999 |
|
RU2179969C2 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ 2-ФЕНИЛАМИНОИМИДАЗОЛИНФЕНИЛКЕТОНА В КАЧЕСТВЕ АНТАГОНИСТОВ IP | 2001 |
|
RU2284995C2 |
| АРИЛСУЛЬФОНИЛЬНЫЕ ПРОИЗВОДНЫЕ, ОБЛАДАЮЩИЕ СРОДСТВОМ К РЕЦЕПТОРУ 5-HT, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2002 |
|
RU2268884C2 |
| 2-АМИНОБЕНЗОТИАЗОЛЫ В КАЧЕСТВЕ ОБРАТНЫХ АГОНИСТОВ РЕЦЕПТОРОВ CB | 2004 |
|
RU2344132C2 |
| ИМИДАЗО[1,5-а] ПИРИМИДО[5,4-d][1] БЕНЗАЗЕПИНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ РЕЦЕПТОРА GABA A | 2002 |
|
RU2287531C2 |
| ПРОИЗВОДНЫЕ 1,2,4,5-ТЕТРАГИДРОБЕНЗО[D]АЗЕПИНОВ И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 2000 |
|
RU2240317C2 |
| ЗАМЕЩЕННЫЕ КАРБОНОВЫМИ КИСЛОТАМИ ОКСАЗОЛОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ PPAR-АЛЬФА И ГАММА-АКТИВАТОРОВ ПРИ ЛЕЧЕНИИ ДИАБЕТА | 2002 |
|
RU2278859C2 |
| ПРОИЗВОДНЫЕ ДИГИДРОБЕНЗОДИАЗЕПИН-2-ОНА ДЛЯ ЛЕЧЕНИЯ НЕВРОЛОГИЧЕСКИХ НАРУШЕНИЙ | 2003 |
|
RU2315764C2 |

Описываются новые производные пиримидинона, триазиндиона и тетрагидрохиназолиндиона общей формулы (I), где R1 обозначает галоген, водород, гидрокси, нитрогруппу, выбранную из C1-С6алкила, C1-С6алкилокси, причем указанная группа, кроме того, необязательно замещена одним-тремя атомами галогена, или группу, выбранную из фенила, фенил C1-С4алкила, фурила, оксазолила или пирролила; R2 обозначает галоген, водород, гидрокси или группу, выбранную из C1-С6алкила и C1-С6алкилокси (причем указанная группа, кроме того, необязательно замещена одним-тремя атомами галогена); R3 и R4 каждый обозначает водород или метил или вместе обозначают этилен; и R5 обозначает группу, выбранную из формул (а), (b), (с) и (d), в которых Х обозначает С(O), СН2 или СН(ОН); Y обозначает СН2 или СН(ОН); Z обозначает N или C(R9), где R9 обозначает водород или C1-С6алкил; R6 обозначает водород, группу, выбранную из C1-С6алкила, C3-С6циклоалкил C1-С4алкила или группу, выбранную из фенила, фенил C1-С4алкила, тиенила, пиридила, фурила, пирролила или пиразинила, гетероарил C1-С4алкила (причем указанные арил и гетероарил, кроме того, необязательно замещены одним-тремя радикалами, выбранными из галогена, C1-C6алкилокси, C1-C6алкила и фенила); R7 обозначает карбамоил, циано, диC1-C6алкиламино, галоген, водород, гидрокси, гидроксииминометил, группу, выбранную из C1-C6алкила, C3-C6циклоалкила и C1-C6алкилокси (причем указанная группа, кроме того, необязательно замещена одним-тремя радикалами, выбранными из галогена, гидрокси или C1-C6алкилокси), или группу, выбранную из фенила, фурила, фенил C1-C4алкила (причем указанный арил и гетероарил, кроме того, необязательно замещены одним-тремя радикалами, выбранными из галогена, C1-C6алкила и фенила), или R7 и R8 вместе обозначают тетраметилен; и каждый R8 независимо обозначает водород, гидрокси, метил или этил; и их фармацевтически приемлемые соли и N-оксиды. Новые соединения формулы (I) могут найти применение в качестве антагонистов α1-адренорецепторов. Описываются также способы их получения и фармацевтическая композиция на их основе. 4 с. и 18 з.п. ф-лы, 1 табл.

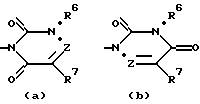


где R1 обозначает галоген, водород, гидрокси, нитро, группу, выбранную из C1 - C6алкила, C1 - C6алкилокси, причем указанная группа, кроме того, необязательно замещена одним-тремя атомами галогена, или группу, выбранную из фенила, фенилC1 - C6алкила, фурила, оксазолила или пирролила;
R2 обозначает галоген, водород, гидрокси или группу, выбранную из C1 - C6алкила и C1 - C6алкилокси, (причем указанная группа, кроме того, необязательно замещена одним-тремя атомами галогена);
R3 и R4 каждый обозначает водород или метил или вместе обозначают этилен; и
R5 обозначает группу, выбранную из формул (a), (b), (c) и (d)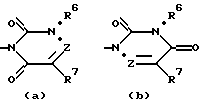
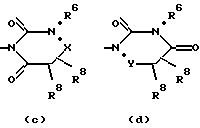
в которых X обозначает C(O), CH2 или CH(OH);
Y обозначает CH2 или CH(OH);
Z обозначает N или C(R9), где R9 обозначает водород или C1 - C6алкил;
R6 обозначает водород, группу, выбранную из C1 - C6алкила, C3 - C6циклоалкил C1 - C4алкила или группу, выбранную из фенила, фенилC1 - C4алкила, тиенила, пиридила, фурила, пирролила или пиразинила, гетероарилC1 - C4алкила (причем указанные арил и гетероарил, кроме того, необязательно замещены одним-тремя радикалами, выбранными из галогена, C1 - C6алкилокси, C1 - C6алкила и фенила);
R7 обозначает карбамоил, циано, диC1 - C6алкиламино, галоген, водород, гидрокси, гидроксииминометил, группу, выбранную из C1 - C6алкила, C3 - C6циклоалкила и C1 - C6алкилокси (причем указанная группа, кроме того, необязательно замещена одним-тремя радикалами, выбранными из галогена, гидрокси или C1 - C6алкилокси), или группу, выбранную из фенила, фурила, фенилC1 - C4алкила (причем указанный арил и гетероарил, кроме того, необязательно замещены одним-тремя радикалами, выбранными из галогена, C1 - C6алкила и фенила), или R7 и R9 вместе обозначают тетраметилен; и каждый R8 независимо обозначает водород, гидрокси, метил или этил;
и их фармацевтически приемлемые соли и N-оксиды.
где каждый из радикалов R1, R2, R3, R4 и R5 имеет значение, указанное в п. 1, и его фармацевтически приемлемых солей и N-оксидов, заключающийся в том, что соединение формулы 3
или его защищенное производное, где L обозначает отщепляемую группу и каждый радикал R3, R4 и R5 имеет значение, указанное в п.1 для формулы I, алкилируют соединением формулы 2
или его защищенным производным, где каждый из R1 и R2 имеет значение, указанное в п. 1 для формулы I, с удалением при необходимости защитной группы, необязательными дебензилированием полученного соединения формулы I, где R6 обозначает бензил, алкилированием полученного соединения формулы I, где R6 обозначает водород, с получением соединений формулы I, где R6 обозначает C1 - C6алкил, C3 - C6циклоалкил, C3 - C6циклоалкилC1 - C4алкил или группу, выбранную из фенила, фенилC1 - C4алкила, тиенила, фурила, пирролила, пиразинила и гетероарилC1 - C4алкила (причем указанные фенил и гетероарил, кроме того, необязательно замещены одним-тремя радикалами, выбранные из галогена, C1 - C6алкилокси, C1 - C6алкила и фенила), необязательным последующим окислением соединения формулы I с получением N-оксидного производного, необязательным последующим восстановлением этого N-оксидного производного соединения формулы I до неокисленной формы с последующим при желании переведении полученных соединений формулы I в фармацевтически приемлемую соль или обратно в несолевую форму.
где каждый из радикалов R1, R2, R3, R4 и R5 имеет значение, указанное в п. 1, и его фармацевтически приемлемых солей и N-оксидов, заключающийся в том, что соединение формулы 5
где L обозначает отщепляемую группу и каждый R1, R2, R3 и R4 имеет значение, указанное в п.1 для формулы I,
алкилируют соединением формулы H-R5, где R5 имеет значение, указанное в п. 1, с необязательными дебензилированием полученного соединения формулы I, где R6 обозначает бензил, алкилированием полученного соединения формулы I, где R6 обозначает водород, с получением соединений формулы I, где R6 обозначает C1 - C6алкил, C3 - C6циклоалкил, C3 - C6циклоалкилC1 - C4алкил или группу, выбранную из фенила, фенилC1 - C4алкила, тиенила, фурила, пирролила, пиразинила и гетероарилC1 - C4алкила (причем указанные фенил и гетероарил, кроме того, необязательно замещены одним-тремя радикалами, выбранными из галогена, C1 - C6алкилокси, C1 - C6алкила и фенила), необязательным последующим окислением соединения формулы I с получением N-оксидного производного, необязательным последующим восстановлением этого N-оксидного производного соединения формулы I до неокисленной формы с последующим при желании переведении полученных соединений формулы I в фармацевтически приемлемую соль или обратно в несолевую форму.
| Устройство для регулирования толщины прокатываемого металла | 1976 |
|
SU655442A1 |
| Крепежная подвеска для полособульба | 1973 |
|
SU502786A1 |
| WO 9421630 A1, 29.09.1994 | |||
| Способ получения производных бензимидазола | 1976 |
|
SU651701A3 |
Авторы
Даты
2001-10-27—Публикация
1996-06-07—Подача