Изобретение относится к новому способу лечения больных, например людей с доброкачественной гиперплазией предстательной железы (ДГПЖ), который включает лечение путем назначения терапевтически эффективного количества ингибитора 5α- редуктазы в сочетании с блокатором α1- адренергического рецептора.
Доброкачественная гиперплазия предстательной железы (ДГПЖ) поражает значительное число мужчин в возрасте старше 50 лет и обычно требует хирургического вмешательства на прогрессирующей стадии для ослабления болезни.
Известно, что тестостерон (Т) выделяется надпочечниками, но в периферийных участках, включая печень, кожу и предстательную железу, может подвергаться превращению в дигидротестостерон (ДГТ) через промежуточное использование 5α- редуктазы. ДГТ предпочтительно связывается ядром клеток предстательной железы, указывая таким образом что ДГТ, а не Т, является первичным андрогеном, который необходим предстательной железе для роста и жизнедеятельности. Эти данные привели к предположению, что путем ингибирования 5α- редуктазы может быть уменьшено образование ДГТ и достигнуто восстановление предстательной железы.
Финастерид, 17β- (N-трет.-бутил)-карбамоил-4-аза- 5α- андрост-1-ен-3-он, был предложен в качестве соединения, которое, как было установлено, ингибирует 5α- редуктазу и обладает положительным влиянием на доброкачественную гиперплазию предстательной железы. Финастерид представляет собой 4-азастероид и является конкурентоспособным ингибитором фермента. Он не обладает сродством к андрогенному рецептору и, следовательно, не должен, как ожидается, вмешиваться в процесс связывания и действия Т в таких тканях, как мышцы, которые реагируют на Т, и, следовательно, не должен приводить к выраженности женских признаков.
Типичными 4-аза-стероидными ингибиторами 5α- редуктазы являются 4-аза-стероиды, разработанные фирмой Мерк (см. Пат. США 4377584, Размуссон и др.; Пат. США 4220735, Размуссон и др.; Пат. США 4845104, Карлин и др.; Пат. США 4760071, Размуссон и др., в которых раскрывается финастерид, представляющий собой 17β- (N-трет.-бутил)-карбамоил-4-аза- 5α- андрост-1-ен-3-он, известный под торговой маркой ПРОСКАР: Пат. США 4732897, Квинелли и др.; Пат. США 4859681, Размуссон и др.; Евр. Пат. 0155076; Евр. Пат. 0004949; и Евр. Пат. 0314189.
Во многих случаях полная остановка процесса увеличения предстательной железы сопровождается симптоматичным ослаблением никрутии, нерешительностью и затруднением при мочеиспускании. Однако симптоматическое ослабление наблюдается не во всех случаях. Если ингибитор 5α- редуктазы замедляет скорость развития процесса роста предстательной железы без сопутствующего сокращения, то ослабление симптоматики может не наблюдаться.
В данной области желательным является именно сочетание терапии как для лечения причин, вызывающих ДГПЖ, так и для лечения кратковременных симптомов самой болезни.
Данное изобретение предлагает способ лечения страдающих доброкачественной гиперплазией предстательной железы больных, подвергнутых лечению с помощью 4-аза-стероидного ингибитора 5α- редуктазы и имеющих недостаточное ослабление симптоматики, нуждающихся в таком лечении, которое включает стадию назначения таким больным терапевтически эффективного количества ингибитора 5α- редуктазы, 17β- замещенного 4-азастероида, 17β- замещенного неазастероида, 17β- ацил-3-карбоксиандрост-3,5-диена, производного бензоиламинофеноксибутановой кислоты, конденсированного бенз(тио)-амида или производного циннамоиламида, ароматических 1,2-диэфиров или тиоэфиров, ароматических ортоациламинофеноксиалкановых кислот, орто-тиоалкилациламино- феноксиалкановых кислот, их фармацевтически приемлемых солей и эфиров, в сочетании с агентом, блокирующим α- адренергический рецептор, называемый в данном описании " α1- блокатором".
Таким образом, объединенный эффект ингибитора 5α- редуктазы, ингибирующего образование ДГТ в предстательной железе, и блокатора α1- адренергического рецептора, например теразосина, приводит к достижению большего воздействия на подавление роста и симптоматическое ослабление процесса ослабления предстательной железы, чем это достигалось при самостоятельном использовании каждого агента.
В соответствии с одним из предпочтительных аспектов настоящее изобретение обеспечивает эффективный способ лечения ДГПЖ у больных, нуждающихся в ослаблении симптоматики, путем назначения терапевтически эффективных количеств α1- блокатора в сочетании с ингибитором 5α- редуктазы, или их фармацевтического препарата. Активные соединения могут применяться вместе или в любом порядке, описанном ниже.
Понятие "больной, нуждающийся в таком лечении" относится к больным мужского рода с функционирующими половыми железами, которых лечат с помощью ингибиторов 5α- редуктазы по терапевтической программе, направленной на борьбу с доброкачественной гиперплазией предстательной железы (ДГПЖ) и которые, как обнаружено, нуждаются в ослаблении симптоматики.
Использование терапевтически эффективных количеств ингибитора α- редуктазы и α1- блокатора в соответствии с настоящим изобретением эффективно лечит неблагоприятные симптомы ДГПЖ, включая никрутию, нерешительность, уменьшение потока мочи, и им подобные симптомы.
Показано, что стимулирование α- адренорецепторов вносит вклад в блокаду доброкачественной гиперплазии предстательной железы (М.Кайнэ и др., Br. J. Urol., Vol. 48, pp. 255-263, 1977).
Блокаторы α- адренергического рецептора действуют обычно как антигипертензивные агенты за счет блокирования участков α- адренергического рецептора. Они расслабляют стромальные (мягкие) ткани в мочевом пузыре, которые вызывают контактирование волокнистых тканей при стимулировании с помощью норадреналина, что приводит к уменьшению мочевого потока. Следовательно, воздействие α1- блокатора заключается в расслаблении волокнистых тканей и увеличении действия при этих условиях.
Существуют очень заметные отличия в относительных способностях α- адренергических блокирующих агентов в подавлении влияний симпатомиметрических аминов на двух подвидах α- рецепторов. Известно, что Празозин обладает намного большей способностью блокировать α1- (постоинаптических) рецепторы, чем α2- рецепторы, которые наряду с другими эффектами, модулируют нервное высвобождение медиатора (проеположительные досинаптические рецепторы). Феноксибензамид представляет собой среднеселективный α1- блокирующий агент, тогда как пентоламин только в 3-5 раз более эффективен в ингибировании α- рецепторов, чем α2- адренергических рецепторов. Напротив, уохимбин является селективным α2- блокатором и, как показано, предотвращает антигипертензивное действие клонидина, α2- агониста.
Однако предпочтительными в настоящем изобретении являются α- адренергические блокирующие агенты, которые представляют собой предпочтительно α1- блокаторы и проявляют незначительную α2- блокирующую активность.
Примерами α- адренергических рецепторных блокаторов являются теразозин (Abbott-Hytrin), химическое название 1-(4-амино-6,7-диметокси- 2-хиназолинил)-4-[(тетрагидро-2-фуранил)карбонил] пиперазин, который описан в Пат. Германии 264186 и Пат. США 4026894; доксазозин (Pfizer-Cardura), химическое название 1-(4-амино-6,7-диметокси-2- хиназолинил)-4-[(2,3-дигидро-1,4-бензодиоксин-2-ил)-карбонил]пиперазин, который описан в Пат. Германии 2847623 и Пат. США 4188390; празозин (Pfizer-Minipres), химическое название 1-(4-амино-6,7-диметокси-2- хиназолинил)-4-(2-фуранилкарбонил)пиперазин, который описан в Брит. Пат. 1156973. Пат. США 3511836 и Гол. Заявке 7206067; буназозин (Sandoz-Detantol), химическое название 1-(4-амино-6,7-диметокси-2- хиназолинил)гексагидро-4-(1-оксобутил)-1H-1,4-диазепин, который описан в Бельгийской заявке 806626. Пат. США 3920636 и в Яп. заявке 75140474; индорамин (Baratol-Wyeth), химическое название N-[1-[2-(1H-индол-3-ил)-этил]-4-пиперидинил] бензамид, который описан в Пат. ЮАР 6803204, Пат. США 3527761; Альфузозин (Synthelabs), химическое название N-[3-[(4-амино-6,7-диметокси-2-хиназолинил) метиламино]пропил]тетрагидро-2-фуранкарбоксамид, который описан в Пат. Германии 2904445 и Пат. США 4315007.
Предпочтительным является 4-азастероид формулы
где пунктирная линия представляет собой двойную связь, если она присутствует,
R1 и R3 независимо друг от друга представляют собой атом водорода, метил или этил;
R2 представляет собой углеводородный радикал, выбираемый из числа линейного или разветвленного, насыщенного или ненасыщенного алкила, циклоалкила, или аралкила с 1-12 атомами углерода или моноциклического арила, возможно содержащего 1 или более низших алкильных заместителей с 1-2 атомами углерода и/или один или более заместителей из числа атомов галогена;
R' представляет собой галоген или метил;
R'' представляет собой водород или β- метил;
R''' представляет собой водород, α- метил или β- метил,
а также его фармацевтически приемлемые соли или эфиры.
В предпочтительном воплощении соединение формулы I, которое может быть использовано в способе настоящего изобретения, имеет формулу: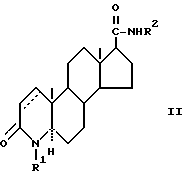
где R1 представляет собой водород, метил или этил;
R2 представляет собой разветвленный алкил, циклоалкил, аралкил с 4 - 12 атомами углерода, фенил, возможно замещенный метилом, атомом хлора и фтора, замещенный или незамещенный 1-, 2-адамантил, 1-, 2-адамантилметил, 1-, 2- или 7-норблрнанил, 1-, 2- или 7-норборнанилметил.
Типичными соединениями настоящего изобретения являются следующие соединения:
17β- (N-трет.-амилкарбамоил)-4-аза -5α- андрост-1-ен-3-он,
17β- (N-трет.-гексилкарбамоил)-4-аза- -5α- андрост-1-ен-3-он,
17β- (N-трет.-бутилкарбамоил)-4-аза -5α- андрост-1-ен-3-он,
17β- (N-изо-бутилкарбамоил)-4-аза -5α- андрост-1-ен-3-он,
17β- (N-трет.-октилкарбамолил)-4-аза -5α- андрост-1-ен-3-он,
17β- (N-октилкарбамоил)-4-аза -5α- андрост-1-ен-3-он,
17β- (N-1,1-диэтилбутилкарбамоил)-4-аза -5α- андрост-1-ен-3-он,
17β- (N-неопентилкарбамоил)-4-аза -5α- андрост-1-ен-3-он,
17β- (N-2-адамантилкарбамоил)-4-аза -5α- андрост-1-ен-3-он,
17β- (N-1-адамантилкарбамоил)-4-аза -5α- андрост-1-ен-3-он,
17β- (N-2-норборнилкарбамоил)-4-аза -5α- андрост-1-ен-3-он,
17β- (N-1-норборнилкарбамоил)-4-аза -5α- андрост-1-ен-3-он,
17β- (N-фенилкарбамоил)-4-аза-4-метил -5α- андрост-1-ен-3-он,
17β- (N-бензилкарбамоил)-4-аза-4-метил -5α- андрост-1-ен-3-он,
17β- (N-трет.амилкарбамоил)-4-аза-4-метил -5α- андрост-1-ен-3-он,
17β- (N-трет.гексилкарбамоил)-4-аза-4-метил -5α- андрост-1-ен-3-он,
17β- (N-трет.-бутилкарбамоил)-4-аза-4-метил -5α- андрост-1-ен-3-он,
17β- (N-изо-бутилкарбамоил)-4-аза-4-метил -5α- андрост-1-ен-3-он,
17β- (N-трет.-октилкарбамоил)-4-аза-4-метил -5α- андрост-1-ен-3-он,
17β- (N-1,1,3,3-тетраметилбутилкарбамоил)-4-аза-5α- андрост-1-ен-3-он,
17β- (N-октилкарбамоил)-4-аза-4-метил -5α- андрост-1-ен-3-он
17β- (N-1,1-диэтилбутилкарбамоил)-4-аза-4-метил -5α- андрост-1-ен-3-он
17β- (N-неопентилкарбамоил)-4-аза-4-метил -5α- андрост-1-ен-3-он
17β- (N-1-адамантилкарбамоил)-4-аза -5α- андростан-3-он
17β- (N-1-адамантилкарбамоил)-4-метил-4-аза -5α- андрост-1-ен-3-он
17β- (N-1-адамантилкарбамоил)-4-метил-4-аза -5α- андростан-3-он
17β- (N-1-адамантилметилкарбамоил)-4-аза -5α- андрост-1-ен-3-он
17β- (N-2-адамантилкарбамоил)-4-аза -5α- андростан-3-он
17β- (N-метил-N-2-адамантилкарбамоил)-4-метил-4-аза -5α- андростан-3-он
17β- (N-2-адамантилкарбамоил)-4-метил-4-аза -5α- андростан-3-он
17β- (N-2-адамантилкарбамоил)-4-метил-4-аза -5α- андрост-1-ен-3-он
17β- (N-метил-N-2-адамантилкарбамоил)-4-метил-4-аза -андрост-1-ен-3-он
17β- (N-(3-метил)-1-адамантилкарбамоил)-4-аза-4-метил - 5α- андростан-3-он
17β- (N-экзо-2-норборнанилкарбамоил)-4-аза-4-метил -5α- андрост-1-ен-3-он
17β- (N-экзо-2-норборнанилкарбамоил)-4-аза -5α- андрост-1-ен-3-он
17β- (N-2-адамантилкарбамоил)-4-аза -5α- андрост-1-ен-3-он,
17β- (N-метил-N-2-адамантилкарбамоил)-4-аза-4-метил андростан-3-он,
17β- (N-2-адамантилкарбамоил)-4-метил-4-аза -5α- андростан-3-он,
17β- (N-метил-N-2-адамантилкарбамоил)-4-метил-4-аза- 5α- андрост-1-ен-3-он,
Соответствующие соединения из перечисленных выше соединений, в которых 4-аза-заместитель замещен в каждом из названных выше соединений атомом водорода, метилом или этилом, образуя различные N-заместители, могут содержать двойную связь, которая показана пунктирной линией в положении 1.
Алкильный, циклоалкильный, аралкильный, моноциклический арильный, 1- и 2-адамантильный или 1-, 2-норборнанильный остатки могут быть замещены одним или несколькими заместителями из числа следующих: C1 -C4-линейный /разветвленный алкил, включая метил, этил, изопропил, н.-бутил: нитрогруппа; оксогруппа; C7-C9-аралкил, включая бензил; (CH2)n COOR, где n принимает значения 0 - 2, а заместитель R представляет собой атом водорода или C1-C4-линейный/разветвленный алкил, включая метил, этил; CH2OH: OH: OR, где заместитель R представляет собой C1-C4-линейный/разветвленный алкил, включая метил, этил; атом галогена, включая фтор, бром, йод; COOH; COOR, где заместитель R представляет собой C1-C4-линейный/разветвленный алкил; - CONH2; CH2NH2; CH2NHCOR, где заместитель R представляет собой C1-C4-линейный/разветвленный алкил, включая метил, этил; фенил; о-, м-, п-замещенный фенил, включая п-нитро, п-амино- и п-сульфо-фенил; или цианогруппа, аминогруппа адамантильного или норборнанильного фрагмента может быть также замещена как заместитель R1 метилом и этилом, а также атомом водорода.
Также под объем данного изобретения подпадают фармацевтически приемлемые соли и эфиры, если у замещенного алкильного, циклоалкильного, аралкильного, адамантильного или норборнанильного фрагмента присутствует основная или кислотная группа. Когда присутствует кислотный заместитель, то есть COOH-группа, может быть получена аммонийная, натровая, калиевая и кальциевая соль, а также им подобные соли, которые используются в качестве дозирующей формы.
Когда в соединении присутствует основная группа, например аминогруппа, то в дозирующей форме используются кислые соли, то есть гидрохлориды, гидробромиды, ацетаты, памоаты и др.
Кроме того, в том случае, когда в соединении присутствует COOH-группа могут быть получены фармацевтически приемлемые соли, например ацетат, малеат, пивалоилоксиметильная и им подобные соли, а также эфиры, известные в данной области, для модификации растворимости или гидролитических свойств для применения в препаратах с постоянным выделением или в пролекарственных препаратах.
Типичными примерами заместителя R2 являются (АД= адамантил); 3,5,7-тринитро-1-АД; 4-оксо-1-АД; 1-бензил-1-АД; 4,4-диметил-1-АД 3,7-диметил-5-карбоксиметил-1-АД; 3-карбоксиметил-1-АД; 3-хлор-1-АД; 1,3-дигидрокси-6,6-диметил-2-АД; 3-хлор-1-АД; 4-карбэтокси-2-АД; 4-карбэтокси-2-АД; 3-изопропил-1-АД; 3-н. -бутил-1-АД; 3-пропил-1-АД; 3-, 5-диэтил-1-АД; 3-гидроксиметил-1-АД; 2-карбокси-1-АД; 3-метил-1-АД; 5-гидрокси-2-АД; 2-гидрокси-1-АД 1-аминометил-1-гидрокси-2-АД; 2-оксо-1-АД; 2-фенил-2-АД; 1-аминометил-2-АД; 1-карбокси-2-АД; 1-аминокарбонил-2-АД; 3-гидрокси-5,7-диметил-1-АД; 4-фтор-1-АД; 3-фтор-1-АД; 4-гидрокси-2-АД; 3-фенил-1-АД; 3-(п-аминофенил)-1-АД; 3-(п-нитрофенил)-1-АД; 3-метил-5-гидроксиметил-1-АД; 3,5-диметил-4-гидрокси-1-АД; 2-гидроксиметил-2-АД; 3-(п-сульфофенил)-1-АД; 3-метил-5-этил-1-АД; 2-карбокси-2-АД; 3,5,7-триметил-1-АД; 4-йод-2-АД; 4-бром-2-АД; 4-хлор-2-АД; 1-ацетиламинометил-2-АД; 1-карбоксиметил-2-АД; 1-метил-2-АД; 1-аминокарбоксиметил-2-АД; 1-аминокарбоксил-1-АД; 2-циано-2-АД; 3,5-диметил-7-этил-1-АД; 4-гидрокси-1-АД; 1-гидрокси-2-АД; 5-карбокси-3-метил-1-АД; 3,5-диметил-7-карбокси-1-АД; 3-карбокси-1-АД; и им подобные.
Типичными примерами заместителя R2, представляющего собой замещенный норборнанильный фрагмент, являются (НБ = норборнанил); 2-НБ: 1,7,7-триметил-4-фенил-2-НБ; 3-карбокси-2-НБ; 3-фенил-2-карбокси-2-НБ; 2-циано-3-фенил-2-НБ; 3-гидрокси-4,7,7-триметил-2НБ; 6-гидроксиметил-2-НБ; 5-циано-2-НБ; 3-аллил-2-НБ; 1-НБ; 7,7-диметил-1-гидроксиметил-2-НБ; 3-метокси-4,7,7-триметил-2-НБ; 3-аминокарбонил-2-НБ; 3-этоксикарбонил-2-НБ; 3,3-диметил-2-НБ; 7-оксо-1-НБ; 3-фенил-2-НБ; 1-карбоксиметил-7,7-диметил-2-НБ; 1-этил-2-НБ; 1-метил-2-НБ; 2,2,3,3,5,5,6,6,7,7-декафтор-1-НБ; 3-гидрокси-2-НБ; 3-хлор-2-НБ; 3-(п-метоксифенил)-2-НБ; 2,2-диметил-3-метилен-7-НБ; 3-оксо-2-НБ; 1-метокси-2-НБ; 7-НБ; 3-изопропил-2-НБ; 2-бром-1-НБ; 3-хлор-1-НБ; и им подобные.
Методики получения соединений формулы I изобретения, включая указанные выше, хорошо известны в данной области.
Новые соединения формулы I данного изобретения могут быть получены по методу, в котором в качестве исходного соединения используется известный стероидный эфир (IIIА) формулы
( 17β- (карбометокси)-4-аза -5α- андростан-3-он), который включает следующие возможные стадии 1) дигидрирование вышеуказанного исходного соединения с получением соответствующего соединения, содержащего двойную связь в 1,2-положении кольце A, 2) превращение 17-карбоксиметоксизаместителя в N-замещенный алкил, циклоалкил, аралкил, моноциклический ацил или адамантилкарбамоил, и, если желательно, алкилирование атома азота кольца A для введения N-метильной или N-этильной группы в положение 4 кольца А. Для проведения стадии дегидрирования предпочтительно, чтобы атом азота 4-аза был незамещен. Альтернативные пути могут включать одну или несколько отдельных химических стадий и, если желательно, могут проводиться перед стадией (1) или после стадии (1) или стадии (3).
В соответствии со способом настоящего изобретения (см. схему процесса) продукты настоящего изобретения образуются следующим образом; (I) нагревание 17β- алкоксикарбонил-4-аза -5α- андростан-3-онов, соединений III (полученных по методике, описанной в Пат. США 4377584) с дегидрирующим агентом, таким как бензолселенинилальдегид, в инертном растворителе, например в хлорбензоле, приводит к 17β- алкоксикарбонил-4-аза -5α- андрост-1-ен-3-ону IV (по альтернативной методике может быть использован дихлордицианобензохиноновый способ, описанный Доллингом и др., JACS 1988, Vol. 110, pp. 3318-3319; (2) взаимодействие полученного на стадии 1 5α- андрост-1-ен-3-онового соединения с, например, гидридом натрия в безводной среде в инертном растворителе, таком как диметилформамид; (3) контактирование полученной реакционной смеси с алкил (метил или этил) йодидом с образованием соответствующего 17β- алкокси-адамантил-карбамоил-4-алкил-4-аза -5α- андрост-1-ен-3-она V; (4) последующий гидролиз вышеуказанного 17β- -алкокси-арбонил-4-алкил-4-аза -5α- андрост-1-он-3-она в сильном основании, таком как водно-метанольный раствор гидроксида калия при кипячении, с последующим подкислением и выделением конечной стероидной кислоты дает 17β- карбокси-4-алкил-4-аза -5α- андрост-1-ен-3-он VI; (5) вышеуказанная стероидная кислота может быть затем превращена в соответствии 2-пиридилтио-эфир путем кипячения с трифенилфосфином и 2,2'-дипиридилдисульфидом в инертном растворителе, таком как толуол, а полученный 17β- (2-пиридилтио-карбонил)-4-алкил-4-аза -5α- андрост-1-ен-3-он VII может быть выделен с помощью хроматографии, например, на силикагеле; (6) вышеуказанный пиридилтио-эфир может затем взаимодействовать с 1-адамантил-, 2-адамантиламино или норборнаниламином в инертном растворителе, например в тетрагидрофуране, с образованием желаемого продукта 17β-(N-адамантилкарбамоил)-4- алкил-4-аза -5α- андрост-1-ен-3-она VIII, который может быть выделен с помощью хроматографии, например, на силикагеле. Если первоначальная реакция проводится без первичного образования двойной связи в положении 1, то в этом случае получают соответствующий 17β- (N-адамантилкарбамоил)-4-алкил-4-аза -5α- андростан-3-он (или N-норборнанилкарбамоильное соединение).
В соответствии с другим способом настоящего изобретения N-незамещенный 17β- (N-адамантилкарбамоил)-4-аза -5α- андрост-1-ен-3-он XIV легко получают из 17β (алкоксикарбонил)-4-аза -5α- андротан-3-она IV путем повторения вышеуказанной реакционной серии за исключением стадии алкилирования 2, описанной выше, то есть обработкой α- андрост-1-ен-3-она, например амидом натрия, а затем метил- или этилбромидом через интермедиат XII и XIII.
В соответствии с еще одним альтернативным способом настоящего изобретения при получении заявляемых соединений, содержащих атом водорода в качестве единственного заместителя у атома азота А-кольца, двойная связь вводится в кольцо А на последней стадии процесса. Следовательно, 17β (алкоксикарбонил)-4-аза- 5α- андростан-3-он III подвергается гидролизу до соответствующей стероидной кислоты IX - 17β (карбокси)-4-аза -5α- андростан-3-она, которую в свою очередь превращают в соответствующий пиридилтиоэфир - 17β (2-пиридилтиокарбонил)-4-аза -5α- андростан-3-он, X, с последующей обработкой эфира амином формулы R2NH2, где заместитель R2 принимает значения, описанные выше как 1- или 2-адамантил или 1, 2- или 7-норборнанил, с образованием 17β- (N-адамантилкарбамоил)-4-аза -5α- андростан-3-она ХI, который дегидрируют в соответствии со способом, описанным ранее, получая соединение XIV - 17β- (N-адамантилкарбамоил)-4-аза -5α- андрост-1-ен-3-он или соответствующее норборнанильное производное.
В соответствии с другим способом введения 17β- N-адамантилкарбамоильного заместителя в 17β- (карбокси)-андростан формулы VI соединение XII или IX обрабатывают по методике, аналогичной методике, описанной в журнале Steroids, Vol. 35 # 3, 1980, pp. 1-7, дихлоргексилкарбодиимидом и 1-гидроксибензотриазолом с образованием -5α- (1-бензотриазолкарбонил)-4-аза- 17β- андрост-1-ен-3-она, VII, XIII или объединения X, в которых заместитель X представляет собой бензотриазолокси-группу.
16-метильное производное, в котором заместитель R''' представляет собой метильную группу, получают из известных 16-метил-17-ацил-4-метил-4-аза -5α- андростан-3-онов, например, или 4,16β- диметил- 17β- ацетил-4-аза -5α- андростан-3-она, в соответствии с известными методиками дегидрирования 4-метил-4-аза- соединений с образованием соответствующего 4,16β- диметил -17β- ацетил-4-аза -5α- андрост-1-ен-3-она.
Рассмотренные выше реакции схематически представлены на схеме I (см. в конце описания)
X представляет собой 2-пиридилтио или 1-бензотриазолокси, R2 представляет собой 1- или 2- адамантил или норборнанил.
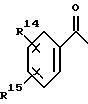
Также предпочтительными 4-азастероидами являются стероиды ряда 17β- ацил-4-аза- -5α- андрост-1-он-3-она формулы
где пунктирная линия представляет собой двойную связь, если таковая присутствует в молекуле;
R выбирается из числа атома водорода, метила и этила;
R2 представляет собой: (а) моновалентный радикал, выбираемый из числа линейного или разветвленного алкила или циклоалкила, содержащих 1-12 атомов углерода, которые могут быть замещены одним или несколькими C1-C2-алкилами или атомами галогена; (б) аралкильный радикал, выбираемый из бензила или фенетила: (в) полициклический ароматический радикал, который может быть замещен одной или несколькими: группами OH, группами, защищающими OH-группу, группами -OC1-C4-алкил, C1-C4-алкилами, атомами галогена или нитрогруппами; (г) моноциклический ароматический радикал, который может быть замещен одним или несколькими заместителями из числа: (1) -OH, OC1-C4-алкила, C1-C4-алкила, -(CH2)mOH, - (CH2)n, COOH, в том числе группы, защищающие OH-группу, где m = 1-4, а n = 1-3, при условии, что C1-C4- алкил присутствует только тогда, когда присутствует один из указанных выше кислородсодержащих радикалов; (2) -SH, -SC1-C4-алкила, -SOC1-C4-алкила, -SO2C1-C4-алкила,
-SO2N(C1-C4-алкила)2, C1-C4-алкила-(CH2)m6H, -S-(CH2)-O-COCH3, где m = 1-4, и n = 1-3, при условии, что C1-C4 -алкил присутствует только тогда, когда присутствует один из указанных выше серусодержащих радикалов; (3) N(R3)2 - группы, которая может быть защищена, где заместитель R3 представляет собой H или C1-C4-алкил, когда моноарильный радикал также может быть замещен C1-C4- алкилом; (4) гетероциклических радикалов из числа 2- или 4-пиридила, 2-пирролила, 2-фурила или тиофенила; а заместители R', R'' и R''' каждый выбираются из числа атома водорода и метила, а также их фармацевтически приемлемые соли.
Предпочтительное воплощение соединений настоящего изобретения представляет собой вышеуказанное соединение структуры IA, где пунктирная линия представляет собой двойную связь, заместитель R представляет собой атом водорода или метил, и заместитель R2 представляет собой разветвленный алкил или циклоалкил, содержащие 4-10 атомов углерода, а R'' и R''' представляют собой атом водорода.
Другим воплощением изобретения являются соединения приведенной выше структуры I, где заместитель R2 представляет собой фенил или фенил, замещенный заместителями, описанными выше, в том числе, когда заместитель R2 представляет собой фенил, 2-, 3- или 4-толил, ксилил, 2-бромфенил, 2-хлорфенил, 2,6-дихлорфенил, 2,6-дибромфенил, аминофенил, N-алкиламинофенил, N,N-диалкиламинофенил, 4-бифенил, 3-бифенил, нафтил, антрацил, фенантрил, тиофенил, метилтиофенил, метилсульфинилфенил, метилсульфонилметил, аминосульфофенил, тиоэтилфенил, ацетоксиметилтиофенил, 17β- (4-гидроксифенил), 17β- (3-гидроксифенил), 17β- (3,4-дигидроксифенил) или 17β- (3,5-диметил-4-гидроксифенил).
Типичными соединениями настоящего изобретения являются:
17β- (фенилкарбонил)-4-аза-4-метил- 5α- андрост-1-ен-3-он;
17β- (2-толилкарбонил)-4-аза-4-метил- 5α- андрост-1-ен-3-он;
17β- (3-толилкарбонил)-4-аза-4-метил- 5α- андрост-1-ен-3-он;
17β- (4-толилкарбонил)-4-аза-4-метил- 5α- андрост-1-ен-3-он;
17β- (2-бромфенилкарбонил)-4-аза-4-метил- 5α- андрост-1-ен-3-он;
17β- (2-хлорфенилкарбонил)-4-аза-4-метил -5α- андрост-1-ен-3-он;
17β- (2,6-дихлорфенилкарбонил)-4-аза-4-метил -5α- андрост-1-ен-3-он;
17β- (2,6-дибромфенилкарбонил)-4-аза-4-метил -5α- андрост-1-ен-3-он;
17β- (ксилилкарбонил)-4-аза-4-метил -5α- андрост-1-ен-3-он;
17β- (трет.-бутилкарбонил)-4-аза -5α- андрост-1-ен-3-он;
17β- (изо-бутилкарбонил)-4-аза -5α- андрост-1-ен-3-он;
17β- (изо-октилкарбонил)-4-аза -5α- андрост-1-ен-3-он;
17β- (1,1,-диэтилбутилкарбонил)-4-аза -5α- андрост-1-ен-3-он;
17β- (неопентилкарбонил)-4-аза -5α- андрост-1-ен-3-он;
17β- (трет.-амилкарбонил)-4-аза -5α- андрост-1-ен-3-он;
17β- (трет.-гексилкарбонил)-4-аза -5α- андрост-1-ен-3-он;
17β- (циклогексилкарбонил)-4-аза-5α- андрост-1-ен-3-он;
17β- (циклопентилкарбонил)-4-аза -5α- андрост-1-ен-3-он;
17β- (бензилкарбонил)-4-аза -5α- андрост-1-ен-3-он;
17β- (2-пиридилкарбонил)-4-аза -5α- андрост-1-ен-3-он;
17β- (4-пиридилкарбонил)-4-аза -5α- андрост-1-ен-3-он;
17β- (2-пирролилкарбонил)-4-аза -5α- андрост-1-ен-3-он;
17β- (2-фурилкарбонил)-4-аза -5α- андрост-1-ен-3-он;
17β- (тиофенилкарбонил)-4-аза -5α- андрост-1-ен-3-он;
17β- (2-адамантилкарбонил)-4-аза -5α- андрост-1-ен-3-он;
17β- (фенилкарбонил)-4-аза -5α- андрост-1-ен-3-он;
17β- (2-толилкарбонил)-4-аза -5α- андрост-1-ен-3-он;
17β- (3-толилкарбонил)-4-аза -5α- андрост-1-ен-3-он;
17β- (4-толилкарбонил)-4-аза -5α- андрост-1-он-3-он;
17β- (2-бромфенилкарбонил)-4-аза -5α- андрост-1-ен-3-он;
17β- (2-хлорфенилкарбонил)-4-аза -5α- андрост-1-ен-3-он;
17β- (2,6-дихлорфенилкарбонил)-4-аза -5α- андрост-1-ен-3-он;
17β- (2,6-дибромфенилкарбонил)-4-аза -5α- андрост-1-ен-3-он;
17β- (ксилилкарбонил)-4-аза -5α- андрост-1-ен-3-он;
17β- (фенилэтилкарбонил)-4-аза 5α- андрост-1-ен-3-он;
17β- (4-диметиламинофенилкарбонил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (3-диметиламинофенилкарбонил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (3,4-диэтиламинофенилкарбонил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (3,5-диметил-4-диэтиламинофенилкарбонил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (4-N-метиламинометилфенилкарбонил)-4-аза- 5α- андрост-1-ен-3-он; или
17β- (2-N-этиламино-4-этилфенилкарбонил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (4-фенилбензоил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (3-фенилбензоил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (4-бифенил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (3-бифенил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (1-нафтил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (2-нафтил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (1-фенантрил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (2-фенантрил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (1-бифенил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (9-антрацил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (4-тиофенилкарбонил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (3-тиофенилкарбонил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (4-метилтиофенилкарбонил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (4-метилсульфинилфенилкарбонил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (4-метилсульфофенилкарбонил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (3-метилсульфинилфенилкарбонил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (4-N, N-диметиламиносульфофенилкарбонил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (2-этил-4-метилтиофенилкарбонил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (4-тиоэтилфенилкарбонил)-4-аза-4-метил- 5α- андрост-1-ен-3-он;
17β- (4-ацетоксиметилтиофенилкарбонил)-4-аза-4-метил- 5α- андрост-1-ен-3-он;
17β- (2-метил-4-метилтиофенилкарбонил)-4-аза-4-метил- 5α- андрост-1-ен-3-он;
17β- (2-метил-4-метилсульфинилфенилкарбонил)-4-аза-4-метил- 5α- андрост-1-ен-3-он;
17β- (2-изопропил-4-метилсульфофенилкарбонил)-4-аза-4-метил- 5α- андрост-1-ен-3-он;
17β- (4-метилтиофенилкарбонил)-4-аза-4-метил- 5α- андростан 3-он;
17β- (4-метилсульфинилфенилкарбонил)-4-аза-4-метил- 5α- андростан-3-он;
17β- (4-метилсульфофенилкарбонил)-4-аза-4-метил- 5α- андростан-3-он;
17β- (4-гидроксифенил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (3-гидроксифенил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (3,4-дигидроксифенил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (3,5-диметил-4-гидроксифенил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (4-гидроксиметилфенил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (2-гидроксиэтилфенилкарбонил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (4-метоксифенил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (4-карбоксиметилфенил)-4-аза- 5α- андрост-1-ен-3-он;
17β- (4-гидроксифенил)-4-аза-4-метил- 5α- андрост-1-ен-3-он;
17β- (3-гидроксифенил)-4-аза-4-метил- 5α- андрост-1-ен-3-он;
17β- (3,4-дигидроксифенил)-4-аза-4-метил- 5α- андрост-1-ен-3-он;
17β- (3,5-диметил-4-гидроксифенил)-4-аза-4-метил- 5α- андрост-1-ен-3-он;
17β- (4-гидроксиметилфенил)-4-аза-4-метил- 5α- андрост-1-ен-3-он;
17β- (2-гидроксиэтилфенилкарбонил)-4-аза-4-метил- 5α- андрост-1-ен-3-он;
17β- (4-метоксифенил)-4-аза-4-метил- 5α- андрост-1-ен-3-он;
17β- (4-карбоксиметилфенил)-4-аза-4-метил- 5α- андрост-1-ен-3-он;
17β- (4-карбоксифенил)-4-аза- 5α- андрост-1-ен-3-он,
и соответствующие соединения, где атом водорода в положении 4 в каждом из приведенных выше соединений замещен на метил или этил.
Соединения настоящего изобретения формулы IA получают по способу, в котором в качестве исходного соединения используется стероидный эфир формулы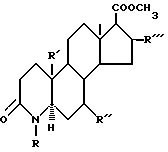
имеющий название 17β- (4-карбометокси)-4-аза- 5α- андростан-3-он, который включает стадии: (1) дегидрирование вышеуказанного исходного продукта с получением соответствующего соединения, содержащего двойную связь в положении 1, 2 кольца A, (2) превращение 17β- карбоксиметокси-заместителя в 17β- ацильный заместитель, если это необходимо, (3) алкилирование атома азота кольца A для введения 4-метильного или 4-этильного заместителя в кольцо A. Для проведения стадии дегидрирования предпочтительно, чтобы кольцо A было незамещено. Стадию дегидрирования можно проводить, например, по методике, описанной Доллингом и др., с использованием дихлордицианобензохинона, JACS (1988), V, 110, pp. 3318-3319. Стадия (2) может состоять из одной или нескольких химических стадий и, если необходимо, может быть проведена до стадии (1) или после стадии (1) или стадии (3).
В соответствии со способом настоящего изобретения соединения настоящего изобретения образуются путем (1) кипячения 17β- алкоксикарбонил-4-аза- 5α- андростан-3-она, соединения III, с дегидрирующим агентом, таким как бензолсилинилангидрид в хлорбензоле с образованием 17β- (4-алкоксикарбонил)-4-аза - 5α- андрост-1-ен-3-она (IV), (2) взаимодействия полученного на стадии (1) 5α- андрост-1-ен-3-она с гидридом натрия в безводной среде в инертном растворителе, таком как диметилформамид, (2) контактирования полученной реакционной смеси с алкил(метил или этил)йодидом с образованием соответствующего 17β- алкоксикарбонил-4-метил-4-аза- 5α- андрост-1-ен-3-она (V), (3) последующего гидролиза вышеуказанного 17β- (4-алкоксикарбонил)-4-метил-4-аза- 5α- андрост-1-ен-3-она при кипячении в сильном основании, таком как водно-метанольный раствор гидроксида калия, за которым следует подкисление и выделение получаемой стероидной кислоты, 17β- карбокси-4-алкил-4-аза -5α- андрост-1-ен-3-она (VI), (4) превращения вышеуказанной стероидной кислоты в соответствующий 2-пиридилтио-эфир путем кипячения с трифенилфосфином и 2,2'-дипиридилдисульфидом в инертном растворителе, таком как толуол, с выделением получаемого 17β- (2-пиридилтио-карбонил)-4-алкил-4-аза - 5α- андрост-1-ен-3-она (VII) с помощью хроматографии, например, на силикагеле; (5) взаимодействия вышеуказанного пиридилтио- эфира с R2-Li или R2MgX (X = Cl, Br), например, с втор.-бутилмагнийхлоридом, в тетрагидрофуране с образованием желаемого продукта 17β- (втор.-бутилкарбонил)-4-алкил-4-аза- 5α- андрост-1-ен-3-она (VIII), который может быть выделен с помощью хроматографии, например, на силикагеле. Если первоначальная реакция проводится с использованием R2MgX или R2-Li вместо втор.-бутилмагнийхлорида, то получают соответствующий 17β- (ацил)-4-алкил-4-аза- 5α- андростан-3-он, где заместитель R2 представляет собой карбонил.
В соответствии со способом настоящего изобретения соответствующий 17β- (ацил)-4-аза- 5α- андрост-1-ен-3-он (XV) легко получают из 17β- (алкоксикарбонил)-4-аза- 5α- андростен-3-она (IV) при повторении рассмотренных выше стадий, за исключением стадии 2, то есть за исключением обработки 4-аза- 5α- андростан-3-она амидом натрия с последующей обработкой метил- или этилйодидом.
В соответствии с еще одним альтернативным способом получения соединений настоящего изобретения, которые содержат только один атом водорода в качестве единственного заместителя в кольце A, 1,2-двойную связь в кольцо A вводят на последней стадии процесса. Следовательно, 17β- алкоксикарбонил-4-аза- 5α- андростан-3-он (III) подвергают гидролизу до соответствующей стероидной кислоты - 17β- карбокси-4-аза- 5α- андростан-3-она (IX), которая, в свою очередь, превращается в соответствующий тиопиридиловый эфир 17β- (2-пиридилтиокарбонил)-4-аза- 5α- андростан-3-он (X), с последующей обработкой эфира R2MgX или R2-Li, где заместитель R2 принимает значения, определенные выше, с образованием 17β- (ацил)-4-аза- 5α- андростан-3-она (XI), который дегидрируют по методике, описанной выше, до соединения XIV - 17β- (ацил)-4-аза- 5α- андрост-1-ен-3-она.
В соответствии с еще одним способом получения соединений формулы I, если в качестве исходного продукта используется эфир, в частности метиловый эфир, представленный в формулах III-V, взаимодействие с реактивом Гриньяра приводит к кетону -17β- R2CO-, соответствующему остатку R2 реактива Гриньяра.
16-метильное производное, в котором заместитель R''' представляет собой метильную группу, получают из известных 16-метил-17-ацил-4-метил-4-аза- 5α- андростан-3-онов, например из 4,16β- диметил- 17β- ацетил-4-аза- 5α- андростан-3-она, в соответствии с известными методиками дегидрирования 4-метил-4-аза-соединений с образованием соответствующего 4,16β- диметил- 17β- ацетил-4-аза- 5α- андрост-1-ен-3-она.
Рассмотренные выше реакции схематически представлены на схеме II (см. в конце описания),
где X представляет собой 2-пиридилтио, R2 принимает значения, описанные выше.
Приведенную выше реакционную схему, где заместитель R2 представляет собой п-гидроксибифенил, можно осуществить, используя в качестве исходного продукта бромбифенилфенол, например п-бромбифенилфенол, защищая его фенольную OH-группу обычной защитной группой, например триорганосилильной группой, то есть трет.-бутилдиметилсилильной, затем проводя реакцию с реактивом Гриньяра и снимая затем защитную силильную группу, например, кипячением в водном тетрабутиламмонийфториде.
Возможность использования других галогензамещенных бензолов для получения подходящего реактива Гриньяра, который может быть использован в настоящем изобретении, должна быть очевидна для любого квалифицированного в данной области специалиста.
Под термином "защищенная гидроксигруппа", используемом в данном описании, понимают спиртовую или карбоксильную OH-группу, которая может быть защищена обычными защитными группами в соответствии с методиками, описанными в книге "Защитные группы в органическом синтезе", Т. W. Greene, Wiley-Interscienсe, 1981, New York. Предпочтительными являются триорганосилильные группы, например трет.-бутилдиметилсилильная, фенилдиметилсилильная, дифенилметилсилильная и им подобные группы.
Под термином "C1-C4-алкил", используемом в данном описании, понимают линейный или разветвленный алкил, включая метил, этил, пропил, изо.-пропил, н. -бутил, изо.-бутил, втор.-бутил и трет.-бутил.
Если эту реакционную схему осуществляют с использованием соединений формул R2MgX или R2-Li, содержащих тиофенильный заместитель R2, например п-метилтиофенилмагний-хлорид, получают соответствующий 17β- (замещенный тиобензоил)-4-алкил-4-аза- 5α- андрост-1-ен-3-он, где фенил представляет собой R2.
Реактив Гриньяра R2MgX для приготовления всех образцов настоящего изобретения, подпадающих под объем настоящего изобретения, легкодоступен или может быть легко получен любым квалифицированным в данной области специалистом. Например, если заместитель R2 представляет собой C1-C4-алкилтиофенил, то реактив Гриньяра может быть получен из подходящего C1-C4-алкилтиобромбензола, например из п-метилтиобромбензола.
Образующийся C1-C4-алкилтиобензол может быть использован для получения C1-C4-алкилсульфоксидов путем окисления, например, м-хлорнадбензойной кислотой. Полученный сульфоксид может быть затем подвергнут окислению с помощью м-хлорнадбензойной кислоты в течение более длительного времени до соответствующего C1-C4-алкилсульфона.
Далее сульфоксид может быть использован в перегруппировке Пуммерера с образованием соответствующего тиола.
Фенил, замещенный группой -SO2N(C1-C4)-алкил)2 (R2) образуется из подходящего бромбензола, например из n-N,N-диметиламиносульфобромбензола, который непосредственно используется в реакции Гриньяра с образованием конечного продукта.
Тиоалкильные группы в фенильном кольце, то есть группы формулы -(CH2)mSH, где m принимает значения 1-4, легко образуются в четырехстадийном процессе из алкоксиалкилфенилбромида, Br-C6H4-(CH2)mOCH3. Прямое добавление реактива Гриньяра, полученного из вышеуказанного бромалкилфенильного производного, к тиопиридиловому эфиру приводит к кетопроизводному, то есть к 17β- (4-метоксиалкилбензоил)-4-аза- 5α- андрост-1-ен-3-ону. Он может быть легко превращен в тиоаналог путем обработки BBr3 при температуре -70oC с образованием гидроксиалкильного производного, с последующим замещением атомом галогена, например атомом брома, а затем превращением галогенированного соединения с помощью NaSH до конечного меркапто-соединения. Когда в реакционной схеме вышеуказанный пиридилтиоэфир реагирует с аминофенилсодержащим соединением формулы R2MgX или R2-Li (X = Cl, Br), таким как, например, п-диметиламинофенилмагнийхлорид, то этот процесс может быть проведен в тетрагидрофуране с образованием желаемого продукта - 17β- (п-диметиламинофенилкарбонил)-4-алкил-4-аза- 5α- андрост-1-ен-3-она (VIII), который выделяют с помощью хроматографии на силикагеле.
Реактив Гриньяра R2MgX для приготовления всех образцов настоящего изобретения, содержащих аминофенильный остаток и подпадающих под объем настоящего изобретения, легкодоступен или может быть легко получен любым квалифицированным в данной области специалистом.
Если вышеуказанный реактив Гриньяра содержит заместитель R2 фенольного типа, то вышеуказанный пиридилтиоэфир затем реагирует с реактивами Гриньяра формулы R2MgX или R2-Li (X = Cl, Br), таким как, например, п-метоксифенилмагнийхлорид, в тетрагидрофуране с образованием желаемого продукта, например 17β- (п-метоксифенилкарбонил)-4-алкил-4-аза- 5α- андрост-1-ен-3-она (VIII), который выделяют с помощью хроматографии на силикагеле. Если реакцию проводят с использованием других соединений формул R2MgX или R2-Li (X = Cl, Br) вместо п-метоксифенилмагнийхлорида, то получают соответствующий тетрагидрофурана 17β- (замещенный бензоил)-4-алкил-4-аза- 5α- андрост-1-ен-3-он, где фенил представляет собой заместитель R2.
Реактив Гриньяра R2MgX для приготовления всех образцов настоящего изобретения, подпадающих под объем настоящего изобретения, легкодоступен или может быть легко получен любым квалифицированным в данной области специалистом.
Например, если заместитель R2 представляет собой гидроксифенил, этот процесс можно осуществить, используя в качестве исходного продукта бромфенол, например п-бромфенол, защищая его фенольную OH-группу обычной защитной группой, например триорганосилильной группой, то есть трет.-бутилдиметилсилильной, затем проводя реакцию с реактивом Гриньяра и снимая затем защитную силильную группу, например, кипячением в водном тетрабутиламмонийфториде.
Для заместителя R2, представляющего собой карбоксифенил, такая же защитная реакция может быть проведена при использовании в качестве исходного продукта подходящего гидроксиалкилбромфенола, например п-гидроксиметилбромбензола или п-гидроксиэтилбромбензола.
Если заместитель R2 представляет собой карбоксифенил, то этот заместитель может быть получен при окислении хромовой кислотой подходящего гидроксиметилбензола, например п-бромгидрокси метилбензола, полученного так, как это описано выше.
Если заместитель R2 представляет собой -O-C1-C4-алкил, то для проведения реакции Гриньяра используется соответствующий п-метоксибромбензол.
Возможность использования других галогензамещенных бензолов для получения подходящего реактива Гриньяра, который может быть использован в изобретении, должна быть очевидна для любого квалифицированного в данной области специалиста.
Под термином "защищенная гидроксигруппа", используемом в данном описании, понимают спиртовую или карбоксильную OH-группу, которая может быть защищена обычными защитными группами в соответствии с методиками, описанными в книге "Защитные группы в органическом синтезе", T.W. Greene, Wiley-Interscience, 1981, New-York. Предпочтительными являются триорганосилильные группы, например трет.-бутилдиметилсилильная, фенилдиметилсилильная, дефенилметилсилильная и им подобные группы.
Также под объем изобретения подпадает использование продуктов восстановления кетонов 1A в сочетании с миноксидилом для лечения характерной элопеции, которые представляют собой вторичные спирты формулы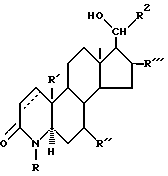
R2 выбирается из числа атома водорода, метила и этила;
R2 представляет собой (а) моновалентный радикал, выбираемый из числа линейного или разветвленного алкила или циклоалкила, содержащих 1-12 атомов углерода, которые могут быть замещены одним или несколькими C1-C2-алкилами или атомами галогена; (б) аралкильный радикал, выбираемый из бензила или фенетила; (в) полициклический ароматический радикал, который может быть замещен одной или несколькими: группами OH, группами, защищающими OH-группу, группами -OC1-C4-алкил, C1-C4-алкилами, атомами галогена или нитрогруппами; (г) моноциклический ароматический радикал, который может быть замещен одним или несколькими заместителями из числа: (1) -OH, -OC1-C4-алкила, C1-C4-алкила, -(CH2)mOH, -(CH2)n, COOH, в том числе, группы, защищающие OH-группу, где m = 1-4, а n = 1-3, при условии, что C1-C4-алкил присутствует только тогда, когда присутствует один из указанных выше кислородсодержащих радикалов; (2) -SH, -SC1-C4-алкила, -SOC1-C4-алкила, -SO2C1-C4-алкила, -SO2N(C1-C4-алкила)2, C1-C4-алкил-(CH2)mSH, -S-(CH2)n-O-COCH3, где m = 1-4, n = 1-3, при условии, что C1-C4-алкил присутствует только тогда, когда присутствует один из указанных выше серусодержащих радикалов; (3) N(R3)2 - группа, которая может быть защищена, где заместитель R3 представляет собой H или C1-C4-алкил, когда моноарильный радикал также может быть замещен C1-C4-алкилом; (4) гетероциклических радикалов из числа 2- или 4-пиридила, 2-пирролила, 2-фурила или тиофенила;
и заместители R', R'' и R''' каждый выбираются из числа атома водорода и метила, и где пунктирная линия представляет собой двойную связь, а также их фармацевтически приемлемые соли.
Такие соединения могут быть получены простым восстановлением боргидридом натрия карбонильной группы, присоединенной к заместителю R2, без восстановления амидного карбонила кольца A или 1,2-двойной связи, если таковые присутствуют. Если R2 - фенильный заместитель содержит карбонильную функцию, она может быть защищена, а затем после проведения восстановления боргидридом воспроизведена обычными способами.
Восстановление боргидридом может быть проведено, например, в воде или в водном метаноле при температуре от комнатной до 50oC, а образующийся продукт затем выделяют и очищают обычными способами. Эти соединения также активны в качестве ингибиторов 5-альфа-редуктазы при лечении характерной алопеции.
Соединения настоящего изобретения, полученные в соответствии со способом, описанным выше, являются, как уже описывалось, потенциальными агентами для лечения ДГПЖ в сочетании с альфа-блокатором альфа-адренергического рецептора.
17β- замещенные стероидные ингибиторы 5α- редуктазы, которые не являются 4-аза-стероидами, известны в данной области и представляют собой ингибиторы, разработанные Smithkline Beckmann и описанные в Пат. США 4882319. Холт и др. ; Пат. США 4910226, Холт и др.; Европ. Заявка 0289327, теперь Пат. США 4910226; Европ. Заявка 0277002, теперь Пат. США 4888336; Европ. Заявка 0343954; Европ. Заявка 375344, теперь Пат. США 4970205; Евр. заявка 0375349, теперь Пат. США 5026882.
В способе изобретения 17β- замещенные не-аза-стероиды представляют собой соединения формулы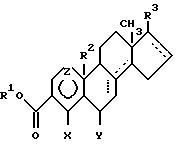
где A содержит до 2 двойных связей;
B, C и D содержат оптимальные двойные связи, которые указываются пунктирной линией, при условии, что кольца A, B и C не содержат соседних двойных связей и кольцо D не содержит C16-C17 двойной связи, когда заместитель R3 представляет собой два заместителя или двухвалентный заместитель;
Z представляет собой (CH2)n;
n = 0 или 2, при условии, что заместитель Z представляет собой (CH)n, если он находится в соседнем положении к двойной связи;
X представляет собой H, Cl, F, Br, I, CF3 или C1-C6-алкил;
Y представляет собой H, CF3, Cl, F, или CH3, при условии, что заместитель Y представляет собой атом водорода, если отсутствует C5-C6-двойная связь;
R1 представляет собой H или C1-C8-алкил;
R2, если он присутствует, представляет собой H или CH3, при условии, заместитель R2 отсутствует, если атом углерода, к которому он присоединяется, является ненасыщенным; и
R3 представляет собой
(1) α- водородный атом, или α- гидроксильную группу, или α- ацетоксигруппу и/или
(а) группу формулы
где W представляет собой связь или C1-C12-алкилиден;
R4 представляет собой (I) атом водорода, (II) гидроксигруппу, (III) C1-C8-алкил, (IV) гидрокси-C1-C8-алкил, (V) C1-C8-алкоксигруппу, (VI) NR5R6-группу, где заместители R5 и R6 каждый независимо друг от друга выбираются из числа атома водорода, C1-C8-алкила, C3-C6-циклоалкила, фенила, или заместители R5 и R6 вместе с атомом азота, к которому они присоединены, образуют 5-6-членное насыщенное кольцо, (VII) OR7-группу, где заместитель R7 представляет собой атом водорода, щелочной металл, C1-C8-алкил, бензил, или
(б) группу R8O-алкил, где алкил представляет собой C1-C12-алкилиден,
R8 представляет собой (I) фенил C1-C6-алкилкарбонил, (II) C5-C10-циклоалкилкарбонил, (III) бензоил, (IV) C1-C8-алкоксикарбонил, (V) аминокарбонил или C1-C8-алкилзамещенный аминокарбонил, (VI) атом водорода или (VII) C1-C8-алкил,
(2) группы формул -OH-W-COR4 или -CH-W-COR8, где заместитель W представляет собой связь или C1-C12-алкилиден, а заместители R4 и R8 принимают те же значения, которые описаны выше, а заместитель R8 также может быть атомом водорода или C1-C20-алкилкарбонильной группой.
(3) группу формулы
где прерванная связь замещает 17β- водородный атом,
(4) α- водородный атом или группу HNCOR9, где заместитель R9 представляет собой C1-C12-алкил или NR5R6-группу, где заместители R5 и R6 принимают значения, описанные выше,
(5) α- водородный атом или цианогруппу,
(6) α- водородный атом или тетразолил, или
(7) кетогруппу,
или их фармацевтически приемлемую соль, за исключением соединений, в которых (I) кольцо B содержит C5-C6-двойную связь, заместитель R1 представляет собой CH3, а заместитель R3 является кетогруппой, метоксикарбонилом, ацетилом, или (II) кольцо A-нор содержит C3-C4-двойную связь, а заместитель R3 представляет собой ацетокси или ацетил, (III) заместитель R1 представляет собой CH3, а заместитель R3 является ацетоксигруппой или ацетилом, или (IV) кольцо A-нор содержит C3-C4-двойную связь, а заместитель R1 представляет собой метил, или (V) кольцо B содержит C3-C4-двойную связь, заместитель R3 является β- гидроксигруппой.
Типичными соединениями, синтез и свойства которых раскрыты в приведенных выше патентах США, а также их фармацевтически приемлемыми солями являются следующие:
4-метил-4-аза-5a-8(14)-прегнен-3-он-(20R)-20-карбоновая кислота;
(20R)-гидроксиметил-4-метил-4-аза- 5α- 8(14)-прегнен-3-он;
4-метил-4-аза-5a-8(14)-андростен-3-он- 17β- N,N-диизопропилкарбоксамид;
17β- (N, N-диизопропилкарбоксамид)-эстр-1,3,5(10)-триен-3- фосфиновая кислота;
17β- (N-трет.-бутилкарбоксамид)-эстр-1,3,5(10)-триен-3- фосфиновая кислота;
17β- (N,N-диизопропилкарбоксамид)-эстр-1,3,5(10)16-тетраен-3- фосфиновая кислота;
17β- (N-трет.-бутилкарбоксамид)-эстр-1,3,5(10),16-тетраен-3- фосфиновая кислота;
17β- (N, N-диизопропилкарбоксамид)-эстр-1,3,5(10),6,8-пентаен-3- фосфиновая кислота;
17β- (N, N-диизопропилкарбоксамид)-2-метил-эстр-1,3,5(10) -триен-3-фосфиновая кислота;
17β- (N, N-диизопропилкарбоксамид)-4-метил-эстр-1,3,5(10) -триен-3-фосфиновая кислота;
17β- (N,N-диизопропилкарбоксамид)-эстр-1,3,5(10),6- тетраен-3-фосфиновая кислота;
17β- (N, N-диизопропилкарбоксамид)-2-хлор-эстр-1,3,5(10) -триен-3-фосфиновая кислота;
17β- (N, N-диизопропилкарбоксамид)-4-хлор-эстр-1,3,5(10) -триен-3-фосфиновая кислота;
17β- (N-бутилкарбоксамид)-эстр-1,3,5(10) -триен-3-фосфиновая кислота;
17β- (N-бутилкарбоксамид)-эстр-1,3,5(10), 16-тетраен -3-фосфиновая кислота;
17β- (N, N-диизопропилкарбоксамид)-4-метил-эстр-1,3,5(10)- триен-3-фосфиновая кислота;
17β- (N,N-диизопропилкарбоксамид)-эстр-1,3,5(10),6-тетраен- 3-фосфиновая кислота;
17β- (N, N-диизопропилкарбоксамид)-2-хлор-эстр-1,3,5(10) -триен-3-фосфиновая кислота;
17β- (N, N-диизопропилкарбоксамид)-4-хлор-эстр-1,3,5(10) -триен-3-фосфиновая кислота;
17β-(N, N-диизопропилкарбоксамид)-эстр-1,3,5(10)-триен-3-сульфоновая кислота
17β- (N-трет.-бутилкарбоксамид)-эстр-1,3,5(10) -триен-3-сульфоновая кислота;
17β- (N,N-диизопропилкарбоксамид)-эстр-1,3,5(10),16-тетраен- 3-сульфокислота;
17β- (N-трет.-бутилкарбоксамид)-эстр-1,3,5(10),16-тетраен- 3-сульфокислота;
17β- (N,N-диизопропилкарбоксамид)-эстр-1,3,5(10),6,8-пентаен- 3-сульфокислота;
17β- (N,N-диизопропилкарбоксамид)-2-метил-эстр-1,3,5(10)- триен-3-сульфокислота;
17β- (N,N-диизопропилкарбоксамид)-4-метил-эстр-1,3,5(10)- триен-3-сульфокислота;
17β- (N, N-диизопропилкарбоксамид)-2-хлор-эстр-1,3,5(10)- триен-3-сульфокислота;
17β- (N, N-диизопропилкарбоксамид)-4-хлор-эстр-1,3,5(10)- триен-3-сульфокислота;
17β- (N, N-диизопропилкарбоксамид)-андрост-3,5-диен-3- фосфиновая кислота;
17β- (N, N-диизопропилкарбоксамид)-андрост-3,5-диен-3- фосфиновая кислота;
17β- (N-трет.-бутилкарбоксамид)-андрост-3,5-диен-3- фосфиновая кислота;
17β- (N, N-диизопропилкарбоксамид)- 5α- андрост-3-ен-3- фосфиновая кислота;
17β- (N, N-диизопропилкарбоксамид)- 5α- андрост-2-ен-3- фосфиновая кислота;
17β- (N, N-диизопропилкарбоксамид)-андрост-2,4-диен-3- фосфиновая кислота;
метил 17β- (N,N-диизопропилкарбоксамид)-андрост-3,5-диен-3- фосфиновая кислота;
20α- (гидроксиметил)- 5α- прогн-3-ен-3- фосфиновая кислота;
17β- (N,N-диизопропилкарбоксамид)-4-фтор - 5α- андрост-3-ен-3- фосфиновая кислота;
20α- (гидроксиметил)-4-фтор- 5α- прегн-3-ен-3- фосфиновая кислота;
20α- (гидроксиметил)-4-нор- 5α- прегн-1-ен-2- фосфиновая кислота;
17β- (N, N-диизопропилкарбоксамид)- 5α- андрост-1,3-диен-3- фосфиновая кислота;
17β- (N,N-диизопропилкарбоксамид)- 5α- андростан- 3β- фосфиновая кислота;
17β- (N,N-диизопропилкарбоксамид)-эстр-3,5(10)-диен-3- фосфиновая кислота;
17β- (N,N-диизопропилкарбоксамид)-эстр-3,5-диен-3- фосфиновая кислота;
17β- (N, N-диизопропилкарбоксамид)-андрост-3,5,11-триен-3- фосфиновая кислота;
20α- (гидроксиметил)- 5α- прегн-3-ен-3-карбоновая кислота;
N,N-диизопропил- 5α- андрост-3-ен- 17β- карбоксамид-3- карбоновая кислота;
N, N-диизопропил-андрост-3,5-диен- 17β- карбоксамид-3- карбоновая кислота;
17β- (N,N-диизопропилкарбоксамид)-4-фтор- 5α- андрост-3-ен-3- карбоновая кислота;
20α- (гидроксиметил)-4-фтор- 5α- прегн-3-ен-3-карбоновая кислота;
20α- (гидроксиметил)-A-нор- 5α- прегн-3-ен-3-карбоновая кислота;
17β- (N, N-диизопропилкарбоксамид)- 5α- андрост-1,3-диен-3- карбоновая кислота;
N-трет.бутил-андрост-3,5-диен- 17β- карбоксамид-3- карбоновая кислота;
N,N-диизопропил- 5α- андрост-2-ен- 17β- карбоксамид-3- карбоновая кислота;
N, N-диизопропил-андрост-2,4-диен- 17β- карбоксамид-3- карбоновая кислота;
N,N-диизопропил -5α- андрост -17β- карбоксамид-3-карбоновая кислота;
N, N-диизопропил-эстр-3,5(10)-диен -17β- карбоксамид-3-карбоновая кислота;
N,N-диизопропил-эстр-3,5-диен -17β- карбоксамид-3-карбоновая кислота;
20α -(гидроксиметил) -5α- прегн-3-ен-3-карбоновая кислота;
N, N-диизопропил -5α- андрост-3-ен -17β- карбоксамид-3-карбоновая кислота;
N,N-диизопропил-андрост-3,5-диен -17β- карбоксамид-3-карбоновая кислота;
17β- (N,N-диизопропилкарбоксамид)-4-фтор -5α- андрост-3-ен-3- карбоновая кислота;
17β- (N, N-диизопропилкарбоксамид)-андрост-3,5,11-триен-3- карбоновая кислота;
17β- (N,N-диизопропилкарбоксамид)-андрост-3,5-диен-3- тиокарбоновая кислота;
17β- (N-трет.-бутилкарбоксамид)-андрост-3,5,11-триен-3- карбоновая кислота;
17β- (N-трет. -бутилкарбоксамид)-андрост-3,5-диен-3- тиокарбоновая кислота;
N-трет.-бутил-андрост-3,5-диен -17β- карбоксамид-3- карбоновая кислота;
N, N-диизопропил-андрост-3,5-диен -17β- карбоксамид-3- карбоновая кислота;
20α- (гидроксиметил) -3α- прегн-3-ен-3-карбоновая кислота;
20α- (гидроксиметил)-4-фтор -5α- прегн-3-ен-3-карбоновая кислота;
3-карбометокси-N,N-диизопропил-андрост-3,5-диен -17β- карбоксамид;
17β- (N, N-диизопропилкарбоксамид) -5α- андрост-1,3-диен-3- карбоновая кислота;
N, N-диизопропил -5α- андрост-2-ен- 17β- карбоксамид-3- карбоновая кислота;
N, N-диизопропил-андрост-2,4-диен -17β- карбоксамид -3β- карбоновая кислота;
N, N-диизопропил -5α- андростан -17β- карбоксамид -3β- карбоновая кислота;
N, N-диизопропил-эстр-3,5(10)-диен -17β- карбоксамид-3- карбоновая кислота;
N,N-диизопропил-эстр.3,5-диен -17β- карбоксамид-3-карбоновая кислота;
N-трет.-бутил-андрост-3,5-диен -17β- карбоксамид-3-карбоновая кислота;
N,N-диизопропил-андрост-3,5-диен -17β- карбоксамид-3-карбоновая кислота;
20α- (гидроксиметил)-4-фтор -5α- прегн-3-ен-3-карбоновая кислота;
N, N-диизопропил -5α- андрост-3-ен -17β- карбоксамид-3-карбоновая кислота;
17β- (N,N-диизопропилкарбоксамид)-4-фтор -5α- андрост-3-ен-3-карбоновая кислота;
17β- (N, N-диизопропилкарбоксамид)-4-фтор-андрост-3,5-диен-3-карбоновая кислота;
3-карбометокси-N,N-диизопропил-андрост-3,5-диен -17β- карбоксамид;
17β- (N, N-диизопропилкарбоксамид) -5α- андрост-1,3-диен-3-карбоновая кислота;
N, N-диизопропил -5α- андрост-2-ен -17β- карбоксамид-3-карбоновая кислота;
N,N-диизопропил-андрост-2,4-диен -17β- карбоксамид-3-карбоновая кислота;
N, N-диизопропил -5α- -андростан-17β- карбоксамид -3β- карбоновая кислота;
N, N-диизопропил-эстр-3,5(10)-диен -17β- карбоксамид-3-карбоновая кислота;
N,N-диизопропил-эстр-3,5-диен -17β- карбоксамид-3-карбоновая кислота;
17β- (N-трет. -бутилкарбоксамид)-андрост-3,5,11-триен-3-карбоновая кислота;
17β- (N-трет.бутилкарбоксамид)-андрост-3,5-диен-3-тиокарбоновая кислота;
N-трет.-бутил -5α- андрост-3-ен -17β- карбоксамид-3-карбоновая кислота;
17β- (N-трет. -бутилкарбоксамид)-6-фтор- -5α- андрост-3-ен-3-карбоновая кислота;
17β- (N-трет. -бутилкарбоксамид)-6-фтор-андрост-3,5-диен-3-карбоновая кислота;
3-карбометокси-N-трет.-бутил-андрост-3,5-диен -17β- карбоксамид;
17β- (N-трет. -бутилкарбоксамид) -5α- андрост-1,3-диен-3-карбоновая кислота;
N-трет.-бутил -5α- андрост-2-ен -17β- карбоксамид-3-карбоновая кислота;
N-трет. -бутил -5α- андрост-2,4-диен -17β- карбоксамид-3-карбоновая кислота;
N-трет.-бутил -5α- андростан -17β- карбоксамид-3-карбоновая кислота и
20α- (гидроксиметил)-A-нор -5α- прегн-1-ен-2-карбоновая кислота;
17β- (N-трет. -бутилкарбоксамид)-андрост-3,5,11-триен-3-карбоновая кислота;
17β- (N-трет. -бутилкарбоксамид)-андрост-3,5-диен-3-тиокарбоновая кислота;
N-трет.-бутил -5α- андрост-3-ен -17β- карбоксамид-3-карбоновая кислота;
17β- (N-трет. -бутилкарбоксамид)-6-фтор -5α- андрост-3-ен-3-карбоновая кислота;
17β- (N-трет. -бутилкарбоксамид)-6-фтор-андрост-3,5-диен-3-карбоновая кислота;
3-карбометокси-N-трет.-бутил-андрост-3,5-диен -17β- карбоксамид;
17β- N-бутилкарбоксамид -5α- андрост-1,3-диено-3-карбоновая кислота;
N-трет.-бутил-5α--андрост-2-ен-17β--карбоксамид-3-карбоновая кислота
N-трет. -бутил -5α- андрост-2,4-диен- 17β- карбоксамид-3-карбоновая кислота;
N-трет.-бутил -5α- андростан -17β- карбоксамид-3-карбоновая кислота;
N-трет.-бутил-эстр-3,5(10)-диен -17β- карбоксамид-3-карбоновая кислота;
N-трет.-бутил-эстр-4,5-диен -17β- карбоксамид-3-карбоновая кислота;
N-трет.-бутил-эстр-3,5(10)-диен -17β- карбоксамид-3-карбоновая кислота;
N-трет.-бутил-эстр-3,5-диен -17β- карбоксамид-3-карбоновая кислота;
20α- (трет.-бутилдиметилсилоксиметил)-3-трифторметилсульфонат) -5α- прегн-1-ен;
17β- (трет. -бутилдиметилсилоксиметил)-3-(трифторметилсульфонат) -5α- андрост-3-ен;
17β- (N, N-диизопропилкарбоксамид)-3-(трифторметилсульфонат)-андрост-3,5-диен;
17β- (N,N-диизопропилкарбоксамид)-3-(трифторметилсульфонат)-4-фтор -5α- андрост-1,3-диен;
20α- (трет. -бутилдиметилсилоксиметил)-4-фтор-3-(трифторметилсульфонат) -5α- прегн-1,3-диен;
17β- (N,N-диизопропилкарбоксамид)-3-(трифторметилсульфонат)- 5α- андрост-1,3-диен;
17β- (N-трет. -бутилкарбоксамид)-3-(трифторметилсульфонат)- 5α- андрост-3,5-диен;
17β- (N, N-диизопропилкарбоксамид)-3-(трифторметилсульфонат)- 5α- андрост-2-ен;
17β- (N, N-диизопропилкарбоксамид)-3-(трифторметилсульфонат)-андрост-2,4-диен;
N-трет.-бутил-андрост-3,5-диен-3-бром- 17β- карбоксамид и
N,N-диизопропил-андрост-3,5-диен-3-бром -17β- карбоксамид.
Также предлагаются 17β- ацил-3-карбокси-андрост-3,5-диены формулы;
где заместитель R1 представляет собой (а) C1-C6- линейный или разветвленный алкил; C3-C12-циклоалкил, который может быть замещен C1-C4 алкоксигруппой или C1-C4 линейным/разветвленным алкилом; C6-C12- арил или C7-C13- аралкил, которые могут быть замещены одним или несколькими заместителями из числа: -OH, -OC1-C4-алкила, C1-C4-алкила, -(CH2)mOH, -(CH2)nCOOH, включая защищенную OH-группу, где m = 1-4, а n = 1-3, (б) C1-C6- линейный или разветвленный алкил; C3-C12 -циклоалкил, который может быть замещен C1-C4- алкоксигруппой или C1-C4- линейным/разветвленным алкилом; C6-C12 -арил или C7-C13-аралкил, которые могут быть замещены одним или несколькими заместителями из числа: -OH, -OC1-C4-алкила, C1-C4 алкила, -(CH2)mOH, -(CH2)nCOOH, включая защищенную OH-группу, где m = 1-4, n = 1-3, заместитель R2 выбирается из числа COOH, SO3H, PO(OH)2, PH(O)OH.
Особенно предлагаются соединения, в которых заместитель - R1 представляет собой трет. -бутил, циклоалкил, фенил, п-гидрокси-фенил, 1-адамантил, 2-адамантил, NH-трет.-бутил, NH-изо-бутил, NH-циклогексил, NH-фенил, NH-п-гидроксифенил, NH-1-адамантил, NH-2-адамантил, а заместитель R2 представляет собой COOH- группу.
Типичными соединениями являются:
17β- (4-гидроксифенилкарбонил)-андроста-3,5-диен-3-карбоновая кислота;
17β- бензоил-андроста-3,5-диен-3-карбоновая кислота;
17β- (циклогексилкарбонил)-андроста-3,5-диен-3-карбоновая кислота;
17β- (изобутилкарбонил)-андроста-3,5-диен-3-карбоновая кислота;
17β- (4-гидроксиметилфенилкарбонил)-андроста-3,5-диен-3-карбоновая кислота;
17β- (2-гидроксиэтилфенилкарбонил)-андроста-3,5-диен-3-карбоновая кислота;
17β- (4-метоксифенилкарбонил)-андроста-3,5-диен-3-карбоновая кислота;
17β- (4-карбоксиметилфенилкарбонил)-андроста-3,5-диен-3-карбоновая кислота;
N-трет.-бутил-андрост-3,5-диен -17β- карбоксамид-3-карбоновая кислота;
N-фенил-андрост-3,5-диен -17β- карбоксамид-3-карбоновая кислота;
N-1-адамантил-андрост-3,5-диен -17β- карбоксамид-3-карбоновая кислота;
N-2-адамантил-андрост-3,5-диен -17β- карбоксамид-3-карбоновая кислота;
Также известны в данной области и используются нестероидные ингибиторы 5α- редуктазы, разработанные ONO Pharmaceutical Ca, LTD, Осака, Япония, и описанные в пат. США 4780469; 4847275; 4939141 и Евр. Пат. Заявка 0173516 и 0291245, а также в Пат. США 4980372; Евр. Заявка 291247 и Пат. США 5037852, раскрывающих соответственно некоторые новые конденсированные бенз (тио) амиды и производные бензиламинофенилбутановой кислоты.
Производные бензиламинофенилбутановой кислоты имеют формулу
где заместитель R1 представляет собой атом водорода или алкил, содержащий от 1 до 4 атомов углерода;
А представляет собой атом кислорода, атом серы или сульфинильную (SO) группу;
оба заместителя R1 представляют собой метил или атом хлора, или оба заместителя R1 и атомы углерода бензольного кольца, к которому присоединены два заместителя R1, вместе образуют циклопентановое, циклогексановое или бензольное кольца;
заместитель R2 представляет собой остатки формул

или
где заместитель B представляет собой атом кислорода, серы или остаток формулы NR11, R11 представляет собой атом водорода или алкила, содержащий от 1 до 4 атомов углерода;
заместители R3, R4, R5,R6, R7 и R8 независимо друг от друга представляют собой атом водорода, алкил, содержащий от 1 до 4 атомов углерода, атом галогена, трифторметильную или циклобутилметильную группы;
m = 0 или 1,
n принимает целые значения от 1 до 5;
заместитель R9 представляет собой атом водорода, алкил, содержащий от 1 до 5 атомов углерода или группу формулы
или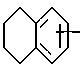
где заместители R12, R13, R14 и R15 независимо друг от друга представляют собой атом водорода, алкил, содержащий от 1 до 4 атомов углерода, атом галогена, трифторметильную или циклобутилметильную группы;
l принимает целые значения от 1 до 4;
заместитель R10 представляет собой остаток формулы
или
где заместители R12, R13, R14 и R15 независимо друг от друга представляют собой атом водорода, алкил, содержащий от 1 до 4 атомов углерода, атом галогена, трифторметильную или циклобутильную группы;
l1 принимает целые значения от 1 до 4;
а также их нетоксичные соли.
Типичными примерами каждого из этих двух классов соединений, синтез и свойства которых раскрыты в приведенных выше патентах США, являются следующие соединения:
4-[2-(4-бензилокси-2,3-диметилбензоиламино)фенокси]бутановая кислота;
4-[2-(4-(2-метилбензилокси)-2,3-диметилбензоиламино)фенокси] бутановая кислота;
4-[2-(4-(3-метилбензилокси)-2,3-диметилбензоиламино)фенокси] бутановая кислота;
4-[2-(4-(4-метилбензилокси)-2,3-диметилбензоиламино)фенокси] бутановая кислота;
4-[2-(4-(2-метилбензилокси)-2,3-диметилбензоиламино)фенокси] бутановая кислота;
4-[2-(4-(2,6-диметилбензилокси)-2,3-диметилбензоиламино)фенокси] бутановая кислота;
4-[2-(4-(4-этилбензилокси)-2,3-диметилбензоиламино)фенокси]бутановая кислота;
4-[2-(4-(4-пропилбензилокси)-2,3-диметилбензоиламино)фенокси] бутановая кислота;
4-[2-(4-(4-изо-пропилбензилокси)-2,3-диметилбензоиламино)фенокси] бутановая кислота;
4-[2-(4-(4-изо-бутилбензилокси)-2,3-диметилбензоиламино)фенокси] бутановая кислота;
4-[2-(4-(4-хлорбензилокси)-2,3-диметилбензоиламино)фенокси]бутановая кислота;
4-[2-(4-(4-циклобутилметилбензилокси)-2,3-диметилбензоиламино)фенокси] бутановая кислота;
4-[2-(4-(2-фенилэтокси)-2,3-диметилбензоиламино)фенокси]бутановая кислота;
4-[2-(4-(3-фенилпропокси)-2,3-диметилбензоиламино)фенокси]бутановая кислота;
4-[2-(4-(4-фенилбутокси)-2,3-диметилбензоиламино)фенокси] бутановая кислота;
4-[2-(4-(5-фенилпентилокси)-2,3-диметилбензоиламино)фенокси] бутановая кислота;
4-[2-(1-(4-изо-бутилфенил)этокси)-2,3-диметилбензоиламино)фенокси] бутановая кислота;
4-[2-(4-(4-пропилбензилокси)-2,3-диметилбензоиламино)фенилтио] бутановая кислота;
4-[2-(1-(4-изо-бутилфенил)этокси-2,3-диметилбензоиламино)фенилтио] бутановая кислота;
4-[2-(4-(4-пропилбензилокси)-2,3-диметилбензоиламино)фенилсульфинил] бутановая кислота;
4-[2-[4-(N-трифторметилфенилметил)амино] -2,3-диметилбензоиламино] фенокси] бутановая кислота;
4-[2-[4-(4-изо-бутилбензилокси)-5,6,7,8-тетрагидронафталин-1- карбониламино]фенокси]бутановая кислота;
4-[2-[4-(4-изо-бутилбензилокси)-нафталин-1-карбониламино]фенокси] бутановая кислота;
4-[2-[8-(4-изо-бутилбензилокси)-5,6,7,8-тетрагидронафталин-1-карбониламино] фенилтио]бутановая кислота;
4-[2-[4-[бис(4-пропилфенил)метокси] -2,3-диметилбензоиламино] фенокси] бутановая кислота;
4-[2-(4-дифенилметокси)-2,3-диметилбензоиламино)фенокси] бутановая кислота;
4-[2-[4-[бис(4-пропилфенил)метиламино] -2,3-диметилбензоиламино]фенокси] бутановая кислота;
4-[2-[4-[бис(4-пропилфенил)метилтио] -2,3-диметилбензоиламино] фенокси] бутановая кислота;
4-[2-[4-[N,N-бис(4-пропилфенилметил)амино]-2,3-диметилбензоиламино] фенокси]бутановая кислота;
4-[2-[4-[N, N-бис(4-трифторметилфенилметил)амино] -2,3- диметилбензоиламино]фенокси]бутановая кислота;
4-[2-[4-N-метил-N-(5,6,7,8-тетрагидронафт-1-ил)аминометил]-2,3- диметилбензоиламино]фенокси]бутановая кислота;
8-(п-пентилбензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-(п-пентилбензоил)амино-2-(5-тетразолил)-6-хлор-1,4-бензодиоксан;
8-(м-оксилбензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-(о-пентилбензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-(п-бутилбензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-(п-гексилбензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-(п-гептилбензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-(п-октилбензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-(п-нонилбензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-(п-децилбензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-(п-ундецилбензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-(п-додецилбензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-(п-пентилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-(м-пентилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-(о-пентилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-(п-бутилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-(п-нонилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-(п-пропоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксин;
8-(п-гексилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-(п-гептилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-(п-октилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-(о-децилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-(п-изо-пентилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-(п-изо-гексилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-[п-(1-метилбутокси)бензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-(N-метил-N-(п-октинилокси)бензоил)амино-2-(5-тетразолил)- 1,4-бензодиоксан;
8-(п-октилоксибензоил)амино-1,4-бензодиоксан-2-карбоновая кислота и ее метиловый эфир;
8-(п-изо-гептилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-(п-изо-октилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-[п-(3,7-диметилоктилокси)бензоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан;
8-(п-октилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан;
8-(п-гептилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан- 7-карбоновая кислота и ее метиловый эфир,
а также подобные им соединения.
Также в качестве ингибитора 5α- редуктазы в настоящее изобретение включен амид коричной кислоты (циннамоиламид) формулы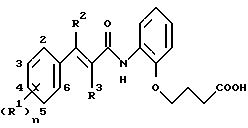
где заместители R2 и R3 каждый независимо друг от друга представляют собой атом водорода или метильную группу, при условии, что (I) если заместитель R2 представляет собой метильную группу, заместитель R3 представляет собой атом водорода, а заместитель (R1)n представляет собой заместитель, выбираемый из группы, включающей 3-пентильную, 4-пентильную, 4-неопентильную группы, 4-(2-этилбутил)- и 4-(2-метилфенил), или (II) если заместитель R2 представляет собой атом водорода, заместитель R3 представляет собой метильную группу, а заместитель (R1)n представляет собой 3-пентильную группу,
а также их нетоксичные соли.
Типичными соединениями являются:
4-[2-(4-бутилтио -β- метилциннамоиламино)фенокси]бутановая кислота;
4-[2-(4-циклобутилметил -β- метилциннамоиламино)фенокси]бутановая кислота;
4-[2-(4-циклогексилметил -β- метилциннамоиламино)фенокси]бутановая кислота;
4-[2-(4-(4-фенилбутил) -β- метилциннамоиламино)фенокси] бутановая кислота;
4-[2-(4-фенокси -β- метилциннамоиламино)фенокси]бутановая кислота;
4-[2-(3-пентил -α- метилциннамоиламино)фенокси]бутановая кислота;
4-[2-(4-фенетил -α- метилциннамоиламино)фенокси]бутановая кислота;
4-[2-(3-пентил -β- метилциннамоиламино)фенокси]бутановая кислота;
4-[2-(4-неопентил -β- метилциннамоиламино)фенокси]бутановая кислота;
4-[2-(4-(2-этилбутил) -β- метилциннамоиламино)фенокси]бутановая кислота и
4-[2-(2-фтор-4-пентилокси -β- метилциннамоиламино)фенокси] бутановая кислота;
В настоящее изобретение также включены конденсированные бенз(тио)амиды формулы
где заместитель A представляет собой одинарную связь или группу, выбираемую из числа метилена, этилена, триметилена, тетраметилена, винилена, пропенилена, бутенилена, бутадиенилена или этинилена, возможно замещенных одной, двумя или тремя линейными или разветвленными алкильными группами, содержащими от 1 до 10 атомов углерода и/или фенильной(ыми) группой(ами);
заместитель B представляет собой 4-8-членное гетероциклическое кольцо, содержащее один, два или три гетероатома, выбираемых из группы, включающей атомы кислорода, азота и серы, при этом вышеуказанное кольцо может быть возможно замещено заместителями из числа оксо-, тиоксо- и/или гидроксигрупп, включая кольца формул
или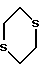
заместитель T представляет собой атом кислорода или атом серы;
заместитель R1 представляет собой остаток формул

или
(IV) линейный или разветвленный алкил, алкенил или алкинил, содержащие от 1 до 20 атомов углерода,
где заместители R5 и R6 независимо друг от друга представляют собой атом водорода или галогена, или разветвленный или линейный алкил, алкенил или алкинил, содержащие от 1 до 20 атомов углерода, которые могут быть незамещенными или замещенными по одному, двум, трем, четырем или пяти атомам углерода атомами кислорода, серы, галогена, азота, бензольными кольцами, тиофеновыми кольцами, нафталиновыми кольцами, карбоциклическими кольцами, содержащими от 4 до 7 атомов углерода, карбонильными группами, карбоксильными группами, гидроксильными группами, карбоксигруппами, азидогруппами и/или нитрогруппами;
заместитель R2 представляет собой атом водорода или линейный или разветвленный алкил, содержащий от 1 до 6 атомов углерода;
заместитель R3 представляет собой атом водорода, атом галогена, гидроксигруппу, нитрогруппу, группу общей формулы -COOR7, где заместитель R7 представляет собой атом водорода или линейный или разветвленный алкил, содержащий от 1 до 6 атомов углерода, линейную или разветвленную алкокси- или алкилтиогруппы, содержащие от 1 до 6 атомов углерода;
заместитель R4 представляет собой остаток общей формулы
-U-(CH2)n-COOR8,
-(CH2)p-COOR8,
или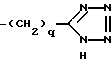
где заместитель U представляет собой атом кислорода или серы;
заместитель R8 представляет собой атом водорода или линейный или разветвленный алкил, содержащий от 1 до 6 атомов углерода;
n и m принимают значения от 1 до 10 соответственно;
p и q принимают значения 0 или целые значения от 1 до 10 соответственно,
а также их нетоксичные соли.
Типичными соединениями являются:
7-(n-гексилоксибензоил)амино-2-(5-тетразолил) бензофуран,
7-(п-октилоксибензоил)амино-2-(5-тетразолил)бензофуран,
7-(п-гептилоксибензоил)амино-2-(5-тетразолил)бензофуран,
7-(п-нонилоксибензоил)амино-2-(5-тетразолил)бензофуран,
7-[п-(4-фенилбутокси)бензоил]амино-2-(5-тетразолил)бензофуран,
7-[п-(2E,7-октидиенил)бензоил]амино-2-(5-тетразолил)бензофуран,
7-[п-(6-хлоргексилокси)бензоил]амино-2-(5-тетразолил)бензофуран,
7-(п-пептилциннамоил)амино-2-(5-тетразолил)бензофуран,
7-(п-гексилоксибензоил)амино-2-(5-тетразолил)-2,3-дигидро-1- бензофуран,
7-(п-октилоксибензоил)амино-2-(5-тетразолил)-2,3-дигидро-1- бензофуран,
7-(п-нонилоксибензоил)амино-2-(5-тетразолил)-2,3-дигидро-1-бензофуран,
7-(п-пентилциннамоил)амино-2-(5-тетразолил)-2,3-дигидро-1-бензофуран,
8-[п-(2E,7-октадиенил)бензоил)амино-2-(5-тетразолил)хинолин,
8-[п-(4-фенилбутокси)бензоил)амино-2-(5-тетразолил)хинолин,
8-[п-(6-хлоргексилокси)бензоил]амино-2-(5-тетразолил)хинолин,
8-[п-(2E, 7-октадиенил)бензоил]амино-4-гидроксихинолин-2-карбоновая кислота,
8-[п-(4-фенилбутокси)бензоил] амино-4-гидроксихинолин-2-карбоновая кислота,
8-[п-(4-(2-тиенил)бутокси)бензоил] амино-4-гидроксихинолин-2-карбоновая кислота,
8-[п-(2E,7-октадиенил)бензоил]амино-4-гидрокси-2-(5-тетразолил)хинолин,
8-[п-[4-(2-фенил)бутокси)бензоил] амино-4-гидрокси-2-(5-тетразолил)хинолин,
8-[п-пентилциннамоил)амино-4-гидрокси-2-(5-тетразолил)хинолин,
4-(п-гептилоксибензоил]амино-2-(5-тетразолил)-1,3-бензодиоксол,
4-(п-гексилоксибензоил)амино-2-(5-тетразолил)-1,3-бензодиоксол,
4-[п-[4-(фенилбутокси)бензоил]амино]-2-(5-тетразолил)-1,3-бензодиоксол,
4-(п-пентилциннамоил)амино-2-(5-тетразолил)-1,3-бензодиоксол,
4-[п-[4-(фенилбутокси)бензоил] амино]-2-(5-тетразолил)-3,4-дигидро- 2H-1,5-бензодиоксепин,
9-[п-(2E, 7-октадиенилокси)бензоил]амино-2-(5-тетразолил)-3,4- дигидро-2H-1,5-бензодиоксепин,
9-[п-(7-октенилокси)бензоил] амино-2-(5-тетразолил)-3,4-дигидро- 2H-1,5-бензодиоксепин,
8-(п-гептилоксибензоил)амино-2-(5-тетразолил)-2,3-дигидро-1,4- бензоксазин,
8-[п-(4-фенилокси)бензоил] амино-2-(5-тетразолил)-2,3-дигидро-1,4- бензоксазин,
8-(п-пентилциннамоил)амино-2-(5-тетразолил)-2,3-дигидро-1,4- бензоксазин,
8-[п-(4-фенилокси)бензоил] амино-2-(5-тетразолил)-4-оксо-4H-1- бензотиопиран,
8-[п-(4-пентилбутокси)бензоил] амино-2-(5-тетразолил)-3,4- дигидро-2H-1-бензопиран,
8-[п-(7-октенилокси)бензоил] амино-2-(5-тетразолил)-3,4- дигидро-2H-1-бензопиран,
8-(п-пентилбензоил)амино-2-(5-тетразолил)-оксо-4H- 1-бензопиран,
8-(п-фенилбензоил)амино-4-оксо-4H-1-бензопиран-2-карбоновая кислота и ее метиловый эфир,
8-(п-гексилбензоил)амино-2-(5-тетразолил)-4-оксо- 4H-1-бензопиран,
8-(п-гептилбензоил)амино-2-(5-тетразолил)-4-оксо- 4H-1-бензопиран,
8-(п-октилбензоил)амино-2-(5-тетразолил)-4-оксо- 4H-1-бензопиран,
8-(п-нонилбензоил)амино-2-(5-тетразолил)-4-оксо- 4H-1-бензопиран,
8-(п-бутоксибензоил)амино-2-(5-тетразолил)-4-оксо- 4H-1-бензопиран,
8-(п-пентилоксибензоил)амино-2-(5-тетразолил)-4-оксо- 4H-1-бензопиран,
8-(п-гексилбензоил)амино-2-(5-тетразолил)-4-оксо- 4H-1-бензопиран,
8-(п-гептилоксибензоил)амино-2-(5-тетразолил)-4-оксо- 4H-1-бензопиран,
8-(п-нонилоксибензоил)амино-2-(5-тетразолил)-4-оксо- 4H-1-бензопиран,
8-(п-октилоксибензоил)амино-2-(5-тетразолил)-4-оксо-4Н- 1-бензопиран,
8-(п-гептилоксибензоил)амино-2-(5-тетразолил)-6-фтор-4- оксо-4H-1-бензопиран,
8-(п-октилоксибензоил)амино-2-(5-тетразолил)-6-метил-4- оксо-4H-1-бензопиран,
8-(п-гептилоксибензоил)амино-2-(5-тетразолил)-6-метил-4- оксо-4H-1-бензопиран,
8-[п-(2E, 7-октадиенилокси)бензоил]амино-2-(5-тетразолил)-4- оксо-4H-1-бензопиран,
8-(п-геранилоксибензоил)амино-2-(5-тетразолил)-4- оксо-4H-1-бензопиран,
8-[п-(2E-нонилокси)бензоил] амино-2-(5-тетразолил)-4- оксо-4H-1-бензопиран,
8-[п-(2E-октенилокси)бензоил] амино-2-(5-тетразолил)-4- оксо-4H-1-бензопиран,
8-[п-(7-октенилокси)бензоил] амино-2-(5-тетразолил)-4- оксо-4H-1-бензопиран,
8-[п-(2E-гептенилокси)бензоил]амино-2-(5-тетразолил)-4- оксо-4H-1-бензопиран,
8-[п-(2E-гексенилокси)бензоил]амино-2-(5-тетразолил)-4- оксо-4H-1-бензопиран,
8-[п-(2E, 7-октадиенилокси)бензоил] амино-2-(5-тетразолил)-6-фтор-4- оксо-4H-1-бензопиран,
8-[п-(2E-октенилокси)бензоил] амино-2-(5-тетразолил)-6-метил-4- оксо-4H-1-бензопиран,
8-[п-(2E, 7-октадиенилокси)бензоил] амино-2-(5-тетразолил)-6-хлор-4- оксо-4H-1-бензопиран,
8-[п-(2-октинилокси)бензоил] амино-2-(5-тетразолил)-4-оксо- 4H-1-бензопиран,
8-[п-(4-хлорбутоксиокси)бензоил]амино-2-(5-тетразолил)-4- оксо-4H-1-бензопиран,
8-[п-(5-хлорпентилокси)бензоил] амино-2-(5-тетразолил)-4- оксо-4H-1-бензопиран,
8-[п-(6-хлоргексилокси)бензоил] амино-2-(5-тетразолил)-4- оксо-4H-1-бензопиран,
8-[п-(7-хлоргептилокси)бензоил] амино-2-(5-тетразолил)-4- оксо-4H-1-бензопиран,
8-[п-(8-хлороктилокси)бензоил]амино-2-(5-тетразолил)-4- оксо-4H-1-бензопиран,
8-[п-(7-хлоргептилокси)бензоил] амино-2-(5-тетразолил)-6- метил-4-оксо-4H-1-бензопиран,
8-[п-(8-хлороктилокси)бензоил]амино-2-(5-тетразолил)-4- оксо-4H-1-бензопиран,
8-[п-(3-фенилпропокси)бензоил]амино-2-(5-тетразолил)-4- оксо-4H-1-бензопиран,
8-[п-(3-фенил-2E-пропенилокси)бензоил] амино-2-(5- тетразолил)-4-оксо-4H-1-бензопиран,
8-[п-(4-фенилбутокси)бензоил]амино-2-(5-тетразолил)-4- оксо-4H-1-бензопиран,
8-[п-(4-фенилбутокси)бензоил] амино-2-(5-тетразолил)-6- метил-4-оксо-4H-1-бензопиран,
8-[п-[2-(2-нафтил)этокси] бензоил] амино-2-(5-тетразолил)- 4-оксо-4H-1-бензопиран,
8-[п-[2-(2-нафтил)этокси]бензоил]амино-2-(5-тетразолил)-6- метил-4-оксо-4H-1-бензопиран,
8-[п-[3-(3,4-дихлорфенил)пропокси] бензоил] амино-2- (5-тетразолил)-4-оксо-4H-1-бензопиран,
8-[п-[3-(3,4-дихлорфенил)пропокси] бензоил] амино-2- (5-тетразолил)-4-оксо-4H-1-бензопиран,
8-[п-[3-(п-хлорфенил)бутокси] бензоил] амино-2- (5-тетразолил)-4-оксо-4H-1-бензопиран,
8-[п-[3-(п-хлорфенил)бутокси] бензоил] амино-6-метил-2- (5-тетразолил)-4-оксо-4H-1-бензопиран,
8-[п-[4-(2-тиенил)бутокси] бензоил]амино-2-(5-тетразолил)- 4-оксо-4H-1-бензопиран,
8-[п-[4-(2-тиенил)бутокси] бензоил] амино-6-метил-2- (5-тетразолил)-4-оксо-4H-1-бензопиран,
8-(п-пентилциннамоил)амино-4-оксо-4H-1-бензопиран-2- карбоновая кислота и ее метиловый эфир,
8-(п-пентилциннамоил)амино-2-(5-тетразолил)-4-оксо-4H- 1-бензопиран,
8-(п-пентилциннамоил)амино-2-(5-тетразолил)-6-метил-4-оксо- 4H-1-бензопиран,
8-(п-пентилциннамоил)амино-2-(5-тетразолил)-6-фтор-4-оксо- 4H-1-бензопиран,
8-(п-пентилциннамоил)амино-6-метил-4-оксо-4H-1-бензопиран- 2-карбоновая кислота и ее метиловый эфир,
8-(п-бутилциннамоил)амино-2-(5-тетразолил)-4-оксо-4H-1- бензопиран,
8-(п-гексилциннамоил)амино-2-(5-тетразолил)-4-оксо-4H-1- бензопиран,
8-(п-гептилциннамоил)амино-2-(5-тетразолил)-4-оксо-4H- 1-бензопиран,
8-циннамоиламино-2-(5-тетразолил)-4-оксо-4H-1-бензопиран,
8-(п-гексилоксициннамоил)амино-2-(5-тетразолил)-4-оксо- 4H-1-бензопиран,
8-(п-гептилоксициннамоил)амино-2-(5-тетразолил)-4-оксо- 4H-1-бензопиран,
8-(п-изогексилоксициннамоил)амино-2-(5-тетразолил)-4-оксо- 4H-1-бензопиран,
8-[п-(2-октинилокси)циннамоил]амино-4-оксо-4H-1-бензопиран- 2-карбоновая кислота,
8-[п-(5-хлорпентилокси)циннамоил] амино-2-(5-тетразолил)-4- оксо-4H-1-бензопиран,
8-(п-пентилбензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-пентилбензоил)амино-2-(5-тетразолил)-6-хлор- 1,4-бензодиоксан,
8-(м-октилбензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(о-пентилбензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-бутилбензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-гексилбензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-гептилбензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-октилбензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-нонилбензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-децилбензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-ундецилбензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-додецилбензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-пентилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(м-пентилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(о-пентилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-бутилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-бутилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-нонилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-пропоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-гексилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-гептилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-октилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(о-децилоксибензоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-изо-пентилоксибензоил)амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-(п-изо-гексилоксибензоил)амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(1-метилбутокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[N-метил-N-(п-октинилокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-(п-октилоксибензоил)амино-1,4-бензодиоксан-2- карбоновая кислота и ее метиловый эфир,
8-(п-изо-гептилоксибензоил)амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-(п-изо-октилоксибензоил)амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(3,7-диметилоктилокси)бензоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-(п-октилоксибензоил)амино-2-(5-тетразолил)-1,4- бензодиоксан-7-карбоновая кислота
8-[п-(2E-октилокси)бензоил]амино-2-(5-тетразолил)-1,4- бензодиоксан,
8-[п-(3-бутенилоктилокси)бензоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(3Z-гексенилокси)бензоил]амино-2-(5-тетразолил)-1,4- бензодиоксан,
8-[п-(2Z-октенилокси)бензоил]амино-2-(5-тетразолил)-1,4- бензодиоксан,
8-[п-(2E-нонилокси)бензоил]амино-2-(5-тетразолил)-1,4- бензодиоксан,
8-[N-метил-N-[п-(2E-октенилокси)бензоил] амино-2- (5-тетразолил)-1,4-бензодиоксан,
8-[п-(3E-гептенилокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2E-октенилокси)бензоил] амино-1,4-бензодиоксан- 2-карбоновая кислота и ее метиловый эфир,
8-[п-(2E-гептенилокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(4-пентенилокси)бензоил]амино-2-(5-тетразолил)-1,4- бензодиоксан,
8-[п-(2E-деценилокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-(п-геранилокси)бензоил]амино-2-(5-тетразолил)-1,4- бензодиоксан,
8-[п-(2E, 7-октадиенилокси)бензоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2E-пентилокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2E-бутенилокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(7-октенилокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2E, 4E,-октадиенилокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2E-октадиенилокси)бензоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2-октинилокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2-октинилокси)бензоил]амино-1,4-бензодиоксан-2- карбоновая кислота и ее метиловый эфир,
8-[п-(2-изо-октинилокси)бензоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-(п-пентилтиобензоил)амино-2-(5-тетразолил)-1,4- бензодиоксан,
8-(м-пентилтиобензоил)амино-2-(5-тетразолил)-1,4- бензодиоксан,
8-(о-пентилтиобензоил)амино-2-(5-тетразолил)-1,4- бензодиоксан,
8-(о-гептилтиобензоил)амино-2-(5-тетразолил)-1,4- бензодиоксан,
8-[п-(6-хлоргексилокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(5-хлорпентилокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(4-хлорбутокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(7-хлоргептилокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(8-хлороктилокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(9-хлорнонилокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(3-бромпентилокси)бензоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан-2-карбоновая кислота и ее метиловый эфир,
8-[п-(гексилоксиметил)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(циклогексилметокси)бензоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(4-циклогексилбутокси)бензоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2-циклогексилэтокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(п-бутилфенил)метоксибензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(5-фенилпентилокси)бензоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(3-фенилпропокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(п-пропилфенил)метоксибензоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(3-фенил-2-пропенилокси)бензоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(4-фенилбутокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(о-пентилфенил)метоксибензоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(м-бутилфенил)метоксибензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-(п-фенилметоксибензоил)амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2-фенилэтокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(4-фенилбутокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-[2-(2-нафтил)этокси] бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-[3-(п-хлорфенил)пропокси]бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-[4-(п-хлорфенил)бутокси] бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(5-метоксикарбонилпентилокси)бензоил] амино-2- (5-тетразолил)-1,4-бензодиоксан,
8-[п-(6-ацетилоксигексилокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(6-гидроксигексилокси)бензоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2E-октеноилокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-(п-октаноилбензоил]амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-[п-(3-фенилтиопропокси)бензоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(3-феноксипропокси)бензоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2-фенилтиоэтокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2-феноксиэтокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-[2-(3-тиенил)этокси] бензоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-[4-(2-тиенил)бутокси] бензоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(5-азидофенилокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(5-диметиламинопентилокси)бензоил] амино-2- (5-тетразолил)-1,4-бензодиоксан,
8-[п-(4-нитробутокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2-азидоэтокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2-азидобутокси)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2-октеноиламино)бензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-(п-пентилокси-м-метоксибензоил)амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2E-октенилокси)-м-хлорбензоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-(2-нафтилкарбонил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-пентилциннамоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-пентилциннамоил)амино-1,4-бензодиоксан-2-карбоновая кислота и ее метиловый эфир,
8-(п-гептилциннамоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-[N-метил-[N-(пентилциннамоил)] амино] -2-(5-тетразолил)- 1,4-бензодиоксан,
8-(п-пентилциннамоил)амино-2-(5-тетразолил)-7-хлор-1,4- бензодиоксан,
8-(п-пентилциннамоил)амино-2-(5-тетразолил)-6-хлор-1,4- бензодиоксан,
8-(п-этилциннамоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-пропилциннамоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-бутилциннамоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-пентилциннамоил)амино-2-(5-тетразолил)-6-метил-1,4- бензодиоксан,
8-(о-пентилциннамоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(м-октилциннамоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-пентилциннамоил)амино-2-(5-тетразолил)-1,4-бензодиоксан- 5-карбоновая кислота и ее метиловый эфир,
8-(п-пентилциннамоил)амино-2-(5-тетразолил)-1,4-бензодиоксан- 8-карбоновая кислота и ее метиловый эфир,
8-(п-гексилциннамоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-нонилциннамоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-пентилциннамоил)амино-2-(5-тетразолил)-1,4-бензодиоксан- 6-карбоновая кислота и ее метиловый эфир,
8-(п-пентилциннамоил)амино-2-(5-тетразолил)-1,4-бензодиоксан- 7-карбоновая кислота и ее метиловый эфир,
8-(п-октилциннамоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-децилциннамоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-изо-пропилциннамоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-изо-бутилциннамоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-изо-пентилциннамоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-фенил-2-метилциннамоил)амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-(п-пентил-3-метилциннамоил)амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-(п-пентилциннамоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-пентилоксициннамоил)амино-2-(5-тетразолил)-1,4- бензодиоксан,
8-(м-пентилоксициннамоил)амино-2-(5-тетразолил)-1,4- бензодиоксан,
8-(о-пентилоксициннамоил)амино-2-(5-тетразолил)-1,4- бензодиоксан,
8-(п-пропоксициннамоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-бутоксициннамоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-октилоксициннамоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-гексилоксициннамоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-гептилоксициннамоил)амино-2-(5-тетразолил)-1,4-бензодиоксан,
8-(п-изо-пентилоксициннамоил)амино-2-(5-тетразолил)-1,4- бензодиоксан,
8-(п-изо-гексилоксициннамоил)амино-2-(5-тетразолил)-1,4- бензодиоксан,
8-[п-(1-метилбутокси)циннамоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-(п-изо-гептилоксициннамоил)амино-2-(5-тетразолил)-1,4- бензодиоксан,
8-(п-изо-октилоксициннамоил)амино-2-(5-тетразолил)-1,4- бензодиоксан,
8-(п-изо-гексилокси-2-метилциннамоил)амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-(п-изо-гексилокси-2-фенилциннамоил)амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2E-октенилокси)циннамоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2-пропенилокси)циннамоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(3-бутенилокси)циннамоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(3Z-гексенилокси)циннамоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2Z-пентенилокси)циннамоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2E-ноненилокси)циннамоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(3E-гептенилокси)циннамоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2E-гептенилокси)циннамоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2E-гексенилокси)циннамоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2E-пентенилокси)циннамоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(4-пентенилокси)циннамоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2E-бутенилокси)циннамоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2E-деценилокси)циннамоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2-октинилокси)циннамоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2-пентинилокси)циннамоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-(п-пентилтиоциннамоил)амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-(м-пентилтиоциннамоил)амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-(о-пентилтиоциннамоил)амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(6-хлоргексилокси)циннамоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(4-хлорбутокси)циннамоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(5-хлорпентилокси)циннамоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(7-хлоргептилокси)циннамоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-(п-изопентилоксиметилциннамоил)амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-(п-циклогексилциннамоил)амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-(п-циклогексилметоксициннамоил)амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(4-циклогексилбутокси)циннамоил] амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(4-циклогексилэтокси)циннамоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-(п-пентилметилциннамоил)амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-(п-пентилметоксициннамоил)амино-2-(5-тетразолил)- 1,4-бензодиоксан,
8-[п-(2-фенилэтокси)циннамоил]амино-2-(5-тетразолил)- 1,4-бензодиоксан,
5-(п-пентилциннамоил)амино-2-(5-тетразолил)-2,3-дигидро- 1,4-дитианафталин и его натровые соли.
В изобретение также включены ароматические 1,2-ди(тио)эфиры формулы
где остаток A представляет собой 1,2-дизамещенное ароматическое кольцо, предпочтительно бензольное кольцо;
заместитель R представляет собой O, S, SO, SO2;
заместитель R представляет собой атом водорода, C1-C4-алкил, фенил или замещенный фенил, атом галогена, гидроксигруппу, карбоксильную группу, цианогруппу, C1 - C4-алкоксигруппу, C1-C4-алкилтиогруппу, C1-C4-алкилсульфинильную группу, C1 - C4-алкилсульфонильную группу, нитрогруппу, аминогруппу, C1-C4-моно- или ди-алкиламиногруппу;
заместители R' и R'' независимо друг от друга представляют собой атом водорода, атом галогена, C1-C4-алкил или C1 - C4-алкоксигруппу, аминогруппу, или оксогруппу, когда фрагменты CH-R' или CHR'' в указанной формуле становятся группой -C=O;
y принимает значения 1 - 6;
z принимает значения 6 - 20;
(CH)y-R' и (CH)z-R'' могут независимо друг от друга представлять собой замещенные или незамещенные алкильные радикалы или алкенильные радикалы, содержащие по меньшей мере одну алкеновую связь;
а также их фармацевтически приемлемые соли.
Соединения изобретения представляют собой ингибиторы тестостерон-5 α -редуктазного фермента человека.
Соединения, подпадающие под объем изобретения, представлены приведенными выше формулами.
При описании формул использовались следующие понятия:
Заместитель X в приведенной выше общей формуле представляет собой O или S предпочтительно, если один из заместителей X является атомом кислорода, и более предпочтительно, когда оба заместителя X являются атомами кислорода, то есть конечное соединение имеет структуру катехола.
"C1-C4-алкил" означает линейный или разветвленный алкил, например метил, этил, н-пропил, изо-пропил, циклопропил, н-бутил, изо-бутил, втор-бутил, трет.-бутил.
"C1-C4-алкоксигруппа" означает линейную или разветвленную алкоксигруппу, например метокси, этокси, н-пропокси, изо-пропокси, н-бутокси, изобутокси, втор-бутокси, трет.-бутокси.
Под "галогеном" понимают атом фтора, хлора, брома или йода.
"Замещенный фенил" означает фенил, замещенный одним или несколькими C1-C4-алкилами, C1 - C4-алкоксигруппами, атомами галогена и др., как это определено выше, примерами таких заместителей являются о, м и р-метоксифенил, 2,4-диметоксифенил, 2-хлор-4-этоксифенил, 5,5-диметоксифенил, 2,4-дихлорфенил, 2-бром-4-метилфенил, о-фторфенил и др.
Понятие "галогеналкил" включает C1-C4-алкильные группы, описанные выше, замещенные одним или несколькими атомами "галогена", определенными выше, например - трифторметильную группу, 2,2-дихлорэтильную и др.
Заместитель "C1-C4-алкилтио" означает C1-C4-алкил, описанный выше, замещенный по меньшей мере одной двухвалентной тиогруппой (-S-), в том числе метилтио, этилтио, изо-пропилтио, н-бутилтио, и им подобные группы.
Заместитель "C1-C4- алкилсульфинил" означает C1-C4-алкильную группу, описанную выше, замещенную по меньшей мере одной -SO-группой, например, метилсульфинил, этилсульфинил, изопропилсульфинил и др.
Заместитель "C1-C4-алкилсульфонил" означает C1-C4-алкильную группу, описанную выше, замещенную по меньшей мере одной сульфогруппой -SO2-, например метилсульфонил, этилсульфонил, изопропилсульфонил, н-бутилсульфонил и др.
Заместитель "C1-C4-моно или диалкиламино" означает аминогруппу, замещенную одной или несколькими C1- C4-алкильными группами, описанными выше, например метиламино, этиламино, н-бутиламино, трет.-бутиламино, N,N-диметиламино, N,N-диэтиламино, метил-трет.-бутиламино и др.
Заместитель R или заместители у бензольного кольца могут присутствовать с первой стадии процесса, например, как заместители в исходном продукте I в схеме реакции A, такие как фенил, метил, метокси, циано, трифторметил, карбометокси, или могут быть введены позднее с помощью обычных реакций, например, такие заместители как хлор путем хлорирования, нитрогруппа путем нитрования, или путем превращения исходной или введенной группы, например превращением нитрогруппы в аминогруппу при каталитическом восстановлении, с последующим алкилированием аминогруппы до моно- или диалкиламиногруппы. Аминогруппа может быть подвергнута диазотированию с получением гидроксигруппы, которая может быть затем прометилирована до метоксигруппы. Аналогично, гидроксигруппа может быть превращена в тиольную группу по методике, аналогичной методике, описанной в J. Org. Chem. 31, pp 3980 - 3984 (1966) Ньюменом и Карнесом, и в J. Org. Chem. 31, pp 410 (1966) Квотом и Эвансом. Полученные тиолы могут быть проалкилированы до алкилтиопроизводных, которые могут быть, в свою очередь, окислены до соответствующих сульфоксидов и сульфонов. Предпочтительными заместителями являются атом водорода, C1-C4-алкил, C1-C4-алкокси и фенил. Такие реакции и их последовательности являются обычными в данной области и для любого квалифицированного в данной области специалиста будет очевидно, каким образом провести изменение бензольного кольца, чтобы ввести в него заместители, описанные выше.
Под названием "их фармацевтически приемлемые соли и эфиры" понимают соли и эфиры, полученные по кислотной группе конечного продукта, которые могут быть использованы в качестве лекарственной системы для человека и в число которых входят: соли натровые, калиевые, кальциевые, аммониевые, соли замещенного аммония, четвертичные аммонийные соли, и эфиры - этиловый эфир, ацетураты, бесилаты, адетаты, фенпропионаты, ацетаты, памоаты и эфиры, которые выполняют функцию пролекарственных препаратов, которые гидролизуются в теле под действием физиологической среды с образованием исходной кислоты, например пивалоидаты, то есть пивоксетил и пивоксил, а также эфиры Канебо и им подобные соединения.
Остаток (CH)yR', где y = 1 - 6, предпочтительно 3, может содержать по меньшей мере один заместитель R', определенный выше, и может представлять собой, например, -CH2-; -CH2-CH2-; -CH2-CH2-CH2-;

и им подобные заместители.
В заместителе (CH)yR' также может присутствовать алкеновая связь, например, в случае таких заместителей, как -CH2-CH=CH-; -CH2-CH=CH-CH2-; -CH2-CH=CH-(CH2)2- и им подобных заместителей.
Остаток (CH)zR'', где z = 6 - 20, предпочтительно 10 - 16, может содержать по меньшей мере один заместитель R'', определенный выше, и может представлять собой, например, -(CH2)6-; -(CH2)20-;
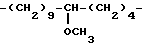
и им подобные заместители.
В заместителе (CH)zR'' также может присутствовать алкеновая связь, например, в случае таких заместителей, как -CH2-CH=CH-(CH2)8-; -(CH2)8-CH= CH-(CH2)2-; -(CH2)9-CH= CH-(CH2)9-; -(CH2)4-CH= CH-(CH2)4- и им подобных заместителей.
Заместители R' и R'' могут также представлять собой группу -NHCOCH3, которая может быть легко гидролизована до аминогруппы путем обычного кислотного или основного гидролиза конечного соединения; заместители R' и R'' могут также представлять собой оксогруппу, получаемую, например, при добавлении HBr к алкену с последующим превращением в спирт и окислением до кетона.
Предпочтительно, если один из заместителей R' или R'' представляет собой H, и особенно предпочтительно, когда оба заместителя (CH)yR' и (CH)zR'' являются алкилами.
Предпочтительные соединения изобретения представлены следующей формулой
где один из заместителей X представляет собой атом кислорода;
заместители R, R' и R'', y или z принимают значения, определенные выше. В особенности предпочтительно соединение формулы
где заместитель X представляет собой атом кислорода или серы, a принимает значения 10 - 16.
Соединения изобретения могут быть получены по методике, описанной в схеме A-1 (см. в конце описания).
Как видно из схемы A-1, соединение I является исходным продуктом способа изобретения и представляет собой 1,2-замещенный бензол. Заместитель X может представлять собой O или S, а "PG" представляет собой гидрокси- или тиозащитную группу, которая нереакционноспособна в процессе стадии (A), но в дальнейшем может быть удалена, например, с помощью палладия на угле с этаноле в атмосфере водорода.
"PG"-защитными группами являются группы, которые хорошо известны в данной области (см. "Защитные группы в органическом синтезе", N.W. Green, 1981-Jonn Wiley. - Глава 2, "Защита гидроксильной группы", 1,2 и 1,3-диолов", стр. 16 - 87, и глава 6, "Защита тиольной группы", стр. 193 - 218).
Типичными примерами "PG"-групп являются: бензил, п-метоксибензил, п-галогенбензил, включая п-хлорбензил, п-фторбензил, и др. Возможность использования других защитных групп для проведения стадии (A) также должна быть очевидно для любого квалифицированного в данной области специалиста.
Примерами соединений, которые могут быть использованы в настоящем изобретении, являются, но не ограничиваются только ими, следующие соединения: 2-(бензилокси)фенол, 2-бензилокси-тиофенол, 2-(бензилтио)фенол, 3-метокси-2-бензилоксифенол, 2-бензилокси-4-метоксифенол, 3-метил-2-бензилоксифенол, 2-бензилокси-5-метоксифенол, 2-бензилокси-4-метилоксифенол, 2-бензилокси-5-метилоксифенол, 2-бензилокси-3,5-диизопропилфенол, 2-бензилокси-3,5-ди-трет. -бутилфенол, 2-бензилокси-4-трет.-бутилфенол, 2-бензилокси-3-этилфенол, 2-бензилокси-5-фенилфенол, 2-бензилокси-4-метил-1-тиофенол, 2-бензилокси-5-трифторметил-1-тиофенол, 2-бензилокси-6-метокси-1-тиофенол, 2-бензилтио-4-метил-1-тиофенол, 2-бензилтио-5-метилсульфонил-фенол, и им подобные соединения,
Примерами соединений II, которые могут быть использованы в способе настоящего изобретения, в которых группа L представляет собой уходящую группу, например атом галогена, включая бром, хлор, или сульфонат и им подобные группы, Ra является линейной или разветвленной C1-C4-алкильной частью эфира, например метилового, этилового, изопропилового, трет.-бутилового, втор-бутилового и др., а заместители R1 и Y принимают значения, определенные выше, являются, но не ограничиваются только ими, следующие соединения: Br-CH2-COOMe, Cl-CH2CH2CH2COOCH2CH3, Br-CH2CH2CH2CH2COOMe, Br-CH2CH2CH2CH2CH2COOEt, Br-CH2CH2CH2CH2CH2CH2 COOCH2CH2CH2OH3,
Br-(CH2)2CH2(CH3)COOMe, Br-CH2CH(CH3)CH2COOEt, Br-CH2CH2CH2COOMe,
Br-CH2CH(ОCH3)CH3COOCH(CH3)2, Cl-CH2CH(OCH2CH3)CH2COOMe, Br-CH2CH(F)CH2COOMe, Cl-CH2CH2COOEt и им подобные соединения.
На стадии (A) конденсация соединения I и II с образованием соединения III осуществляется в не-гидроксильном полярном органическом растворителе, например в ацетоне, этилацетате, метилэтилкетоне, диоксане, ТГФ, диэтилкетоне и им подобных растворителях, в присутствии акцептора протона, например карбоната калия, бикарбоната натрия, пиридина, триэтиламина, и др. Обычно реакцию проводят в атмосфере азота при кипячении или выдерживают в течение длительного времени при комнатной температуре. Обрабатывают реакционную массу обычным способом.
На стадии (B) защитную группу "PG" снимают каталитически при комнатной температуре при повышенном давлении в атмосфере водорода в органическом растворителе, получают соединение IV, которое представляет собой фенил или тиофенол. В качестве катализатора используют 5%-ный палладий на угле и др. аналогичные катализаторы. Органический растворитель должен быть инертным в условиях реакции и примерами таких растворителей являются этилацетат, этанол, метанол, диоксан и др.
На стадии (C) осуществляется взаимодействие соединения IV с соединением V с получением диэфира VI. Условия реакции аналогичны условиям, описанным для стадии (A), с использованием инертного органического растворителя и акцептора протона.
Примерами соединений V, используемых в изобретении, являются следующие соединения: Br(CH2)6COOMe, Br(CH2)7COOMe, Br(CH2)8COOMe, Br(CH2)9COOMe,
Br(CH2)10COOMe, Br(CH2)11COOMe, Cl(CH2)12COOEt, Cl(CH2)13COOCH(CH3)2,
Cl(CH2)14COOCHCH2CH3, Br(CH2)15COOMe, Br(CH2)16COOMe, Br(CH2)16COOCH2CH3,
Br(CH2)17COOC(CH3)3, Br(CH2)18COOMe, Br(CH2)19COOEt, Br(CH2)20COOMe,
Br(CH2)2CH(CH3)-(CH2)10COOMe, BrCH2CH(CH3)-(CH2)10COOMe, BrCH2CH3CH(CH3)CH2COOEt, BrCH2CH(OCH3)(CH2)7COOCH(CH3)2, ClCH2CH(OCH2CH3)CH2CH2COOMe, BrCH2(NHCOCH3)-(CH2)10-CH2COOMe,
ClCH2C(=O)(CH2)11COOEt, Br-CH2-CH=CH-(CH2)8COOEt, BrCH2-C(= CH2)(CH2)10CH2COOMe, Br-CH2-(CH2)9-CH=CH-COOEt.
На стадии (D) диэфир может быть деэтерифицирован путем основного гидролиза в водной среде, например, с помощью NaOH в MeOH/H2O, с выделением после подкисления дикислоты.
Схема B1 приведена в конце описания.
Как видно из схемы B1, 2-бензилоксифенол 1, этил-бромбутират 2 и безводный K2CO3, например, в сухом ацетоне, кипятят или выдерживают при комнатной температуре в течение длительного времени в атмосфере азота, получая при этом этил-4-(2-бензилоксифенокси)бутират 3, Стадия (A).
Раствор соединения 3, например, в этилацетате подвергают каталитическому гидрированию при комнатной температуре в атмосфере водорода под давлением 40 фунтов/кв. дюйм в присутствии в качестве катализатора 5%-ного Pd/C, получают этил-4-(2-гидроксифенокси)-бутират 4, Стадия (B).
Стадия (C) включает взаимодействие соединения 4 и метил-12-бромдодеканоата 5 с карбонатом калия в ацетоне, аналогично стадии (A), с получением монометилового эфира 6.
На стадии (A) диэфир 6 подвергается деэтерификации, например, с помощью NaOH в водно-метанольном растворе, с образованием после подкисления конечного продукта - дикислоты 7.
На стадии C-1 представлен синтез сульфоаналога соединения 7, соединения 7A. Методика процесса включает в основном те же стадии, которые описаны на стадии B.
Схема C-1 приведена в конце описания.
Определенная замена соединений II и 2 другими замещенными и незамещенными галогеналкиловыми эфирами, которые известны и которые описаны в данной работе, и определенная замена соединений V и 5 другими доступными и описанными выше бромэфирами будет сопровождаться получением всех соединений, которые подпадают под объем формулы изобретения.
Примерами соединений, полученных в соответствии с данной методикой, являются:
4-(2-(20-карбоксиикосилокси)фенокси)бутановая кислота,
4-(2-(19-карбоксинонадецилокси)фенокси)бутановая кислота,
4-(2-(18-карбоксиоктадецилокси)фенокси)бутановая кислота,
4-(2-(17-карбоксигептадецилокси)фенокси)бутановая кислота,
4-(2-(16-карбоксигексадецилокси)фенокси)бутановая кислота,
4-(2-(15-карбоксипентадецилокси)фенокси)бутановая кислота,
4-(2-(14-карбокситетрадецилокси)фенокси)бутановая кислота,
4-(2-(13-карбокситридецилокси)фенокси)бутановая кислота,
4-(2-(12-карбоксидодецилокси)фенокси)бутановая кислота,
4-(2-(11-карбоксиундецилокси)фенокси)бутановая кислота,
4-(2-(10-карбоксидецилокси)фенокси)бутановая кислота,
4-(2-(9-карбоксинонилокси)фенокси)бутановая кислота,
4-(2-(8-карбоксиоктилокси)фенокси)бутановая кислота,
4-(2-(7-карбоксигептилокси)фенокси)бутановая кислота,
4-(2-(6-карбоксигексилокси)фенокси)бутановая кислота,
4-(2-(20-карбоксиикосилокси)фенилтио)бутановая кислота,
4-(2-(19-карбоксинонадецилокси)фенилтио)бутановая кислота,
4-(2-(18-карбоксиоктадецилокси)фенилтио)бутановая кислота,
4-(2-(17-карбоксигептадецилокси)фенилтио)бутановая кислота,
4-(2-(16-карбоксигексадецилокси)фенилтио)бутановая кислота,
4-(2-(15-карбоксипентадецилокси)фенилтио)бутановая кислота,
4-(2-(14-карбокситетрадецилокси)фенилтио)бутановая кислота,
4-(2-(13-карбокситридецилокси)фенилтио)бутановая кислота,
4-(2-(12-карбоксидодецилокси)фенилтио)бутановая кислота,
4-(2-(11-карбоксиундецилокси)фенилтио)бутановая кислота,
4-(2-(10-карбоксидецилокси)фенилтио)бутановая кислота,
4-(2-(9-карбоксинонилокси)фенилтио)бутановая кислота,
4-(2-(8-карбоксиоктилокси)фенилтио)бутановая кислота,
4-(2-(7-карбоксигептилокси)фенилтио)бутановая кислота,
4-(2-(6-карбоксигексилокси)фенилтио)бутановая кислота,
4-(2-(20-карбоксиикосилтио)фенокси)бутановая кислота,
4-(2-(19-карбоксинонадецилтио)фенокси)бутановая кислота,
4-(2-(18-карбоксиоктадецилтио)фенокси)бутановая кислота,
4-(2-(17-карбоксигептадецилтио)фенокси)бутановая кислота,
4-(2-(16-карбоксигексадецилтио)фенокси)бутановая кислота,
4-(2-(15-карбоксипентадецилтио)фенокси)бутановая кислота,
4-(2-(14-карбокситетрадецилтио)фенокси)бутановая кислота,
4-(2-(13-карбокситридецилтио)фенокси)бутановая кислота,
4-(2-(12-карбоксидодецилтио)фенокси)бутановая кислота,
4-(2-(11-карбоксиундецилтио)фенокси)бутановая кислота,
4-(2-(10-карбоксидецилтио)фенокси)бутановая кислота,
4-(2-(9-карбоксинонилтио)фенокси)бутановая кислота,
4-(2-(8-карбоксиоктилтио)фенокси)бутановая кислота,
4-(2-(7-карбоксигептилтио)фенокси)бутановая кислота,
4-(2-(6-карбоксигексилтио)фенокси)бутановая кислота,
4-(2-(20-карбоксиикосилтио)фенилтио)бутановая кислота,
4-(2-(19-карбоксинонадецилтио)фенилтио)бутановая кислота,
4-(2-(18-карбоксиоктадецилтио)фенилтио)бутановая кислота,
4-(2-(17-карбоксигептадецилтио)фенилтио)бутановая кислота,
4-(2-(16-карбоксигексадецилтио)фенилтио)бутановая кислота,
4-(2-(15-карбоксипентадецилтио)фенилтио)бутановая кислота,
4-(2-(14-карбокситетрадецилтио)фенилтио)бутановая кислота,
4-(2-(13-карбокситридецилтио)фенилтио)бутановая кислота,
4-(2-(12-карбоксидодецилтио)фенилтио)бутановая кислота,
4-(2-(11-карбоксиундецилтио)фенилтио)бутановая кислота,
4-(2-(10-карбоксидецилтио)фенилтио)бутановая кислота,
4-(2-(9-карбоксинонилтио)фенилтио)бутановая кислота,
4-(2-(8-карбоксиоктилтио)фенилтио)бутановая кислота,
4-(2-(7-карбоксигептилтио)фенилтио)бутановая кислота,
4-(2-(6-карбоксигексилтио)фенилтио)бутановая кислота,
3-(2-(16-карбоксигексадецилокси)фенокси)пропионовая кислота,
3-(2-(15-карбоксиизогексадецилокси)фенокси)бутановая кислота,
3-(2-(14-карбокситетрадецилокси)фенокси)бутановая кислота,
5-(2-(13-карбокситридецилокси)фенокси)валериановая кислота,
5-(2-(12-карбоксидодецилокси)фенокси)валериановая кислота,
5-(2-(11-карбоксиизододецилокси)фенокси)валериановая кислота,
4-(2-(11-карбоксиундецилокси)фенокси)валериановая кислота,
4-(2-(10-карбоксидецилокси)фенокси)валериановая кислота,
4-(2-(9-карбоксинонилокси)фенокси)валериановая кислота,
6-(2-(9-карбоксинонилокси)фенокси)капроновая кислота,
6-(2-(8-карбоксиоктилокси)фенокси)капроновая кислота,
6-(2-(7-карбоксиизооктилокси)фенокси)капроновая кислота,
7-(2-(7-карбоксигептилокси)фенокси)энантовая кислота,
7-(2-(6-карбоксигексилокси)фенокси)энантовая кислота,
7-(2-(5-карбоксиизогексилокси)фенокси)энантовая кислота,
2-(2-(12-карбоксидодецилтио)фенокси)уксусная кислота,
2-(2-(11-карбоксидецилтио)фенокси)уксусная кислота,
2-(2-(10-карбоксидецилтио)фенокси)уксусная кислота,
3-(2-(9-карбоксинонилокси)фенилтио)пропионовая кислота,
3-(2-(12-карбоксидодецилокси)фенилтио)пропионовая кислота,
3-(2-(11-карбоксиундецилокси)фенилтио)пропионовая кислота,
3-(2-(11-карбоксиундецилокси)фенилтио)бутановая кислота,
3-(2-(11-карбоксиундецилтио)-4-метил-фенилтио)бутановая кислота,
3-(2-(12-карбоксидодецилтио)фенилтио)бутановая кислота,
5-(2-(11-карбоксиундецилтио)фенилтио)валериановая кислота,
5-(2-(10-карбоксидецилокси)фенилтио)валериановая кислота,
5-(2-(9-карбоксинонилокси)фенилтио)валериановая кислота,
3-(2-(9-карбоксинонилокси)фенилтио)валериановая кислота,
3-(2-(11-карбоксидецилокси)фенилтио)валериановая кислота,
3-(2-(10-карбоксидецилокси)фенилтио)валериановая кислота,
6-(2-(9-карбоксинонилокси)фенилтио)капроновая кислота,
6-(2-(12-карбоксидодецилокси)фенилтио)капроновая кислота,
6-(2-(11-карбоксиундецилокси)фенилтио)капроновая кислота,
6-2-(11-карбоксиундецилокси)-3-метилфенилтио)энантовая кислота,
7-(2-(11-карбоксиундецилокси)-4-метилфенилтио)энантовая кислота,
7-(2-(12-карбоксидодецилтио)фенокси)энантовая кислота,
4-(2-(11-карбоксиундецилокси)-4-метилфенокси)бутановая кислота,
4-(2-(10-карбоксидецилокси)-3-метилфенокси)бутановая кислота,
4-(2-(9-карбоксинонилокси)-5-метилфенокси)бутановая кислота,
4-(2-(12-карбоксидодецилокси)-6-метилфенокси)бутановая кислота,
4-(2-(11-карбоксиундецилтио)-3-(метилтио)фенокси)бутановая кислота,
4-(2-(11-карбоксиундецилтио)-3-(метилсульфонил)фенокси)бутановая кислота,
4-(2-(11-карбоксиундецилтио)-4-(метилсульфонил)фенокси)бутановая кислота,
4-(2-(12-карбоксидодецилокси)-5-этилфенокси)бутановая кислота,
4-(2-(11-карбоксиундецилокси)-4-фенилфенокси)бутановая кислота,
4-(2-(10-карбоксидецилокси)-3,5-диметилфенокси)бутановая кислота,
4-(2-(9-карбоксинонилокси)-4-фторфенокси)бутановая кислота,
4-(2-(12-карбоксидодецилокси)-5-трифторметилфенокси)бутановая кислота,
4-(2-(12-карбоксидодецилтио)-3-нитрофенокси)бутановая кислота,
4-(2-(11-карбоксиундецилтио)-4-метилфенокси)валериановая кислота,
4-(2-(11-карбоксиундецилтио)-3,5-диметилфенокси)бутановая кислота,
4-(2-(12-карбоксидодецилокси)-4-(диметиламино)фенокси)бутановая кислота,
4-(2-(11-карбоксиундецилокси)-5-(этиламино)фенокси)бутановая кислота,
2-(2-(9-карбоксинонилокси)фенокси)пропионовая кислота,
3-(2-(12-карбоксидодецилокси)фенокси)-3-метилпропионовая кислота,
4-(2-(10-карбоксидецилокси)фенилтио)-3-метоксибутановая кислота,
4-(2-(9-карбоксинонилтокси)фенилтио)-3-этоксибутановая кислота,
4-(2-(11-карбоксиундецилокси)фенокси)-2-бутеновая кислота,
4-(2-(9-карбоксинонилокси)фенокси)-2-бутеновая кислота,
4-(2-(11-карбокси-2-метилундецилокси)фенокси)бутановая кислота,
4-(2-(11-карбоксиундецил-7-енокси)фенокси)бутановая кислота,
4-(2-(13-карбокси-2-метилен-тридецилокси)фенокси)бутановая кислота,
4-(2-(11-карбоксиундецилокси)фенилсульфонил)бутановая кислота,
4-(2-(11-карбоксиундецилокси)фенилсульфинил)бутановая кислота,
4-(2-(11-карбоксиундецилсульфинил)фенокси)бутановая кислота,
4-(2-(11-карбоксиундецилсульфонил)фенокси)бутановая кислота,
4-(2-(11-карбоксиундецилсульфинил)фенилсульфинил)бутановая кислота,
4-(2-(11-карбоксиундецилсульфонил)фенилсульфонил)бутановая кислота,
и им подобные соединения.
Также в изобретение в качестве ингибитора 5 α -редуктазы включено средство для лечения характерного облысения в сочетании с миноксидилом следующей формулы:
где A представляет собой 1,2-замещенное ароматическое кольцо, выбираемое из числа: (а) бензола, 1,2-замещенного нафталина; (б) 5-6-членного ароматического кольца, содержащего 1 - 2 атома азота, 1 атом серы или кислорода, или их сочетание;
заместители D и E независимо друг от друга представляют собой -COOH, CONH2, CONHRb, COORb, SO2OH, SO3(OH), SO2NH2, SSO2ONa, PH(O)(OH), P(O)(OH)2; заместитель X представляет собой O, S, SO или SO2;
заместитель R представляет собой H;
заместитель R представляет собой атом водорода, C1-C4-алкил, фенил или замещенный фенил, атом галогена, гидроксигруппу, карбоксильную группу, цианогруппу, C1- C4-алкоксигруппу, C1-C4-алкилтиогруппу, C1-C4-алкилсульфинильную группу, C1- C4-алкилсульфонильную группу, нитрогруппу, аминогруппу, C1-C4-моно- или ди-алкиламиногруппу;
заместители R' и R'' независимо друг от друга представляют собой атом водорода, атом галогена, C1-C4-алкил или C1- C4-алкоксигруппу, аминогруппу, или оксогруппу, когда фрагменты CH-R' или CHR'' в указанной формуле становятся группой -C=O;
Ra = H, C1-C4-алкил;
Rb = C1-C12-алкил, фенил, фенил C1-C4-алкил;
y = 1 - 6;
z = 6 - 20, и
где фрагменты (CH)y-R' и (CH)z-R''могут независимо друг от друга представлять замещенные или незамещенные алкильные радикалы или алкенильные радикалы, содержащие по меньшей мере одну алкеновую связь,
а также их фармацевтически приемлемые соли.
Соединения изобретения представляют собой ингибиторы тестостерон -5α- редуктазного фермента человека.
Соединения, подпадающие под объем изобретения, представлены приведенными выше формулами.
При описании формул использовались следующие понятия:
Заместитель X в приведенной выше общей формуле представляет собой O или S, предпочтительно атом кислорода.
"C1-C4-алкил" означает линейный или разветвленный алкил, например метил, этил, н-пропил, изопропил, циклопропил, н-бутил, изобутил, втор-бутил, трет. -бутил, а "C1-C12-алкил" означает алкильную группу, содержащую до 12 атомов углерода, например н-октил, трет.-децил, н-додецил.
"Фенил C1-C4-алкил" означает бензил, 2-фенетил и им подобные заместители.
"C1-C4-алкоксигруппа" означает линейную или разветвленную алкоксигруппу, например метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет.-бутокси.
Под "галогеном" понимают атом фтора, хлора, брома или йода.
Понятие "гетероароматическое кольцо" означает 5 - 6-членное кольцо, содержащее 1 - 2 атома азота, 1 атом серы или кислорода, или их сочетание, например пиридин, тиофен, фуран, имидазол, 1,3-тиазол, 1,3-оксазол, 1,2,3-тиадиазол и др. Ограничение состоит в том, что 1,2-дизамещение имеет место только по углеродным атомам гетероароматического кольца. Предпочтительными гетероциклами являются пиридин, фуран и тиофен.
"Замещенный фенил" означает фенил, замещенный одним или несколькими C1-C4-алкилами, C1- C4-алкоксигруппами, атомами галогена и др., как это определено выше; примерами таких заместителей являются о, м и р-метоксифенил, 2,4-диметоксифенил, 2-хлор-4-этоксифенил, 3,5-диметоксифенил, 2,4-дихлорфенил, 2-бром-4-метилфенил, о-фторфенил и др.
Понятие "галогеналкил" алкил включает C1- C4-алкильные группы, описанные выше, замещенные одним или несколькими атомами "галогена", определенными выше, например - трифторметильную группу, 2,2-дихлорэтильную и др.
Заместитель "C1-C4-алкилтио" означает C1-C4-алкил, описанный выше, замещенный по меньшей мере одной двухвалентной тиогруппой (-S-), в том числе метилтио, этилтио, изопропилтио, н-бутилтио, и им подобные группы.
Заместитель "C1-C4- -алкилсульфинил" означает C1-C4-алкильную группу, описанную выше, замещенную по меньшей мере одной группой, например метилсульфинил, этилсульфинил, изопропилсульфинил и др.
Заместитель "C1-C4-алкилсульфонил" означает C1-C4-алкильную группу, описанную выше, замещенную по меньшей мере одной сульфогруппой -SO2-, например метилсульфонил, этилсульфонил, изопропилсульфонил, н-бутилсульфонил и др.
Заместитель "C1-C4-моно или диалкиламино" означает аминогруппу, замещенную одной или несколькими C1- C4-алкильными группами, описанными выше, например метиламино, этиламино, н-бутиламино, трет.-бутиламино, N,N-диметиламино, N,N-диэтиламино, метил-трет.-бутиламино и др.
Заместитель R или заместители у бензольного кольца могут присутствовать с первой стадии процесса, например такие как, фенил, метил, метокси, циано, трифторметил, карбометокси (например, как в случае о-нитрофенола 1-исходного продукта в схеме A), или могут быть введены позднее с помощью обычных реакций, например такие заместители как хлор путем хлорирования, нитрогруппа путем нитрования, или путем превращения исходной или введенной группы, например, превращением нитрогруппы в аминогруппу при каталитическом восстановлении, с последующим алкилированием аминогруппы до моно- или диалкиламиногруппы. Аминогруппа может быть подвергнута диазотированию с получением гидроксигруппы, которая может быть затем прометилирована до метоксигруппы. Аналогично, гидроксигруппа может быть превращена в тиольную группу по методике, аналогичной методике, описанной в J. Org. Chem. 31, pp. 3980 - 3984 (1966) Ньюменом и Карнесом и в J. Org. Chem. 31, pp. 410 (1966) Квотом и Эвансом. Полученные тиолы могут быть проалкилированы до алкилтиопроизводных, которые могут быть, в свою очередь, окислены до соответствующих сульфоксидов и сульфонов. Предпочтительными заместителями являются атом водорода, C1-C4-алкил, C1-C4-алкокси и фенил. Такие реакции и их последовательности являются обычными в данной области и для любого квалифицированного в данной области специалиста будет очевидно, каким образом провести изменение бензольного кольца, чтобы ввести в него заместители, описанные выше.
Под названием "их фармацевтически приемлемые соли и эфиры" понимают соли и эфиры, полученные по кислотной группе конечного продукта, которые могут быть использованы в качестве лекарственной системы для человека и в число которых входят: соли натровые, калиевые, кальциевые, аммониевые, соли замещенного аммония, четвертичные аммонийные соли, и эфиры - этиловый эфир, ацетураты, бесилаты, эдетаты, фенпропионаты, ацетаты, памоаты и эфиры, которые выполняют функцию пролекарственных препаратов, которые гидролизуются в теле под действием физиологической среды с образованием исходной кислоты, например пивалоидаты, то есть пивоксетил и пивоксил, а также эфиры Канебо и им подобные соединения.
Остаток (CH)yR', где y принимает значения 1 - 6, предпочтительно 3, может содержать по меньшей мере один заместитель R', определенный выше, и может представлять собой, например -CH2-; -CH2-CH2-; -CH2-CH2-CH2-;



и им подобные заместители.
В заместителе (CH)yR' также может присутствовать алкеновая связь, например, в случае таких заместителей, как -CH2-CH=CH-; -CH2-CH=CH-CH2-; -CH2-CH2-CH=CH; -(CH2)3-CH=CH- и им подобных заместителей.
Остаток (CH)zR'', где z принимает значения 6 - 20, предпочтительно 10 - 16, может содержать по меньшей мере один заместитель R'', определенный выше, и может представлять собой, например, -(CH2)6-; -(CH2)20-;


и им подобные заместители.
В заместителе (CH)zR'' также может присутствовать алкеновая связь, например, в случае таких заместителей, как -CH2-CH=CH-(CH2)8-; -(CH2)8-CH= CH-(CH2)2-; -(CH2)9-CH= CH-(CH2)9-; -(CH2)4-CH= CH-(CH2)4- и им подобных заместителей.
Предпочтительно, если один из заместителей R' или R'' представляет собой H, и особенно предпочтительно, когда оба заместителя (CH)yR' и (CH)zR'' являются алкилами.
Предпочтительные соединения изобретения, подпадающие под приведенную выше общую формулу, имеют следующее строение


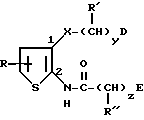
Особенно предпочтительными являются следующие соединения

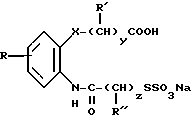


где заместитель X представляет собой атом кислорода или серы;
заместители R, R', R'', а также y и z принимают значения, определенные выше.
Предпочтительными соединениями этого класса являются




где X представляет собой O или S;
n = 8 - 14.
Также предпочтительными соединениями этого класса являются
где n = 8 - 14.

где n = 8 - 14.
Соединения изобретения могут быть получены в соответствии со схемами реакций A-2, B-2, C-2, D-2, E-2, F-2, G-2, H-2, представленными в конце описания.
Как видно из схемы A-2, о-нитрофенол 1,4-бромбутират 2 и безводный K2CO3, например, в сухом ацетоне, кипятят или выдерживают при комнатной температуре в течение длительного времени в атмосфере азота, получая при этом 4-(2-нитрофенокси)бутират 3 (Стадия A).
Раствор соединения 3, например, в этилацетате подвергают каталитическому гидрированию при комнатной температуре в атмосфере водорода под давлением 40 фунтов/кв. дюйм в присутствии в качестве катализатора 5%-ного Pd/C, получают 4-(2-аминофенокси)-бутират 4.
Стадия (B).
Стадия (С) включает взаимодействие диэтилдодеканоата 5 с октагидратом гидроксида бария в метаноле при комнатной температуре получением монометилового эфира 6.
На стадии (D) монометиловый эфир кислоты 6 кипятят с тионилхлоридом в течение 5 ч и получают монохлорид монометилового эфира 7.
На стадии (E) монохлорид 7 реагирует с амином 4, например, при 0 - 10oC, например, в сухом эфире в присутствии акцептора хлористого водорода, например в присутствии триэтиламина, с образованием амида 8.
На стадии (F) эфироамид 8 деэтерифицируют, например, с использованием 2,5 н. водно-метанольного раствора NaOH с выделением после подкисления конечного продукта - дикислоты 9.
Схема B-2 иллюстрирует синтез соответствующих тиосоединений.
Стадия (G) представляет собой реакцию о-аминобензолтиола с этил-4-бромбутиратом, которая может быть проведена, например, в сухом диметоксиэтане, в атмосфере азота, в присутствии акцептора протона, например, порошка K2CO3, при этом получают соединение 11.
Стадия (H) представляет собой ацилирование аминогруппы соединения 11 с помощью 11-бромдеканоата в сухом растворителе, например, в сухом эфире, при 0oC в присутствии акцептора кислорода, например в присутствии пиридина.
Стадия (I) представляет собой гидролиз диэфира до конечной кислоты 13, которая может быть проведена, например, с помощью NaOH/MeOH.
Как видно из схемы C-2, о-нитрофенол бензилируется в условиях, аналогичных условиям стадии (A).
На стадии (K) представлено восстановление нитрогруппы с использованием, например, никеля Ренея в смеси этанол/NH3 в атмосфере водорода под давлением 40 фунтов/кв.дюйм.
Стадия (L) представляет собой трифторацетилирование соединения 24 с использованием, например, трифторуксусного ангидрида в сухом эфире в присутствии порошка сухого карбоната натрия.
На стадии (M) показано N-метилирование, которое может быть проведено с использованием, например, метилиодида в сухом ацетоне в присутствии порошкообразного KOH с последующим удалением N-трифторацетильной группы с помощью MeOH/H2O.
На стадии (N) показано N-ацилирование соединения 27 с использованием ацилхлорида, например, соединения 7 в сухом метиленхлориде и пиридине при 0oC.
Стадия (O) представляет собой дебензилирование соединения 28, которое может быть проведено, например, с помощью 10%-ного Pd/C в метаноле в атмосфере водорода.
Стадия (P) представляет собой O-алкилирование соединения 29 с использованием, например, этил 4-бромбутирата и K2CO3 в безводном ацетоне.
Стадия (Q) представляет собой гидролиз диэфира 30 до кислоты 31, например, по методике, описанной для стадии (F).
На схеме D-2 показано получение фосфонатных кислот и эфиров.
Стадия (R) представляет собой конденсацию соединения 4 с 11-бромундекановой кислоты в безводном метиленхлориде с использованием N,N-дициклогексилкарбодиимида и 4-диметиламинопиридина с получением важного бром-интермедиата 32.
На стадии (S) показана реакция соединения 32 с триэтилфосфитом, например, при 180oC в атмосфере азота с получением фосфонатного эфира 33.
Стадия (T) представляет собой превращение соединения 33 через бромтриметилсилан в монокислоту 34.
Стадия (U) представляет гидролиз, аналогичный гидролизу стадии (F), в результате чего получают фосфорно-карбоновую дикислоту 35,
Схема E-2 иллюстрирует синтез сульфоновых кислот настоящего изобретения.
На стадии (Y) показана реакция интермедиата 32 с тиомочевиной в EtOH/H2O в атмосфере азота при 90oC с образованием изотиурониевой соли 36.
На стадии (W) показана реакция соединения 32 с тиосульфатом натрия в условиях, аналогичных условиям стадии (Y), с образованием эфира тиосульфата 37.
Дальнейшее окисление эфиров 36 и 37 по методике Шоувелла или Циглера, описанной на стадии (W) в примерах, приводит к соответствующей сульфоновой кислоте 38.
Соответствующую сульфиновую кислоту можно получить из соединения 36 по методике, описанной Дж. М. Спрагуе и Т.Б. Джонсоном, JACS 59, 2440 (1937).
Соответствующие сульфонамиды могут быть получены из сульфоновой кислоты 38 путем защиты, например, карбоновой кислоты эфирной группой, превращения сульфоновой кислоты до сульфонилхлорида, обработки сульфонилхлорида аммиаком с последующим гидролизом эфира карбоновой кислоты до соответствующей кислоты.
Схема F-2 представляет синтез соответствующих пиридиновых аналогов 8 и 9.
На стадии (X) нитрогидроксипиридин O-алкилируют в условиях, аналогичных условиям стадии (A) до соединения 40.
На стадии (Y) показано восстановление нитрогруппы таким же способом, какой описан для Стадии (B).
На стадии (Z) показано ацилирование аминогруппы по той же методике, которая описана для соединения 8 на стадии (E) с получением диэфира 42. При гидролизе получают дикислоту 43.
На схеме G-2 показано получение некоторых амидов 46 настоящего изобретения.
На стадии (AA) о-аминофенол реагирует непосредственно с соединением 7 в условиях, описанных на стадии (E) с получением N-ацилированного фенола 44.
На стадии (BB) проводят алкилирование соединения 44 с использованием 4-бромбутиронитрила в условиях, аналогичных условиям стадии (A), с получением соединения 45.
На стадии (CC) показан гидролиз нитрила до амида 46 в метиленхлориде с использованием MnO2.
Схема Н-2 иллюстрирует альтернативный способ получения соединения 9 с использованием в качестве исходного соединения о-аминофенола, который алкилируют до соединения 44 с последующим взаимодействием соединения 44 в условиях Стадии (A) с получением соединения 8 и гидролизом до соединения 9 в условиях, аналогичных условиям Стадии (F).
Таким образом, по способам, описанным выше в схемах, с использованием описанных выше реагентов и исходных продуктов, все описанные соединения и включены в формулу изобретения могут быть синтезированы любым квалифицированным специалистом.
Очевидно, что в схеме A-2 и C-2 могут быть использованы другие нитрофенолы, для того, чтобы получить все соединения настоящего изобретения, и в число этих соединения входят следующие: 2-нитрофенол, 2-нитро-6-метилфенол, 2-нитро-5-метилфенол, 2-нитро-4-метилфенол, 2-нитро-3-метилфенол, 2-нитро-4-фенилфенол, 2-нитро-5-фенилфенол, 2-нитро-4-фторфенол, 2-нитро-4-трифторметилфенол, 2-нитро-4-гидроксифенол, 2-нитро-4-метоксифенол, 2-нитро-6-этоксифенол, 2-нитро-4-метилтиофенол, 2-нитро-4-метилсульфинилфенол, 2-нитро-4-метилсульфонилфенол, 4-нитро-3-гидроксипиридин, 3-нитро-4-гидрокси-5-метилпиридин, 3-нитро-4-гидрокси-6-метилпиридин, 2-метил-3-нитро-4-гидроксипиридин, 2-гидрокси-3-нитро-5-фенилпиридин, 2-нитро-3-гидрокси-5-фенилпиридин, 2-гидрокси-3-нитро-5-хлорпиридин, 2-нитро-3-гидрокси-5-трифторметилпиридин, 2-метокси-4-нитро-5-гидроксипиридин, 3-нитро-4-гидрокси-5-этоксипиридинпиридин, 2-метилтио-4-нитро-5-гидроксипиридин, 2-нитро-3-гидрокси-тиофен, 3-нитро-4-гидрокси-тиофен, 3-гидрокси-2-нитро-5-метилтиофен, 3-гидрокси-2-нитро-4-метилтиофен, 2-гидрокси-3-нитро-5-фенилтиофен, 2-нитро-3-гидрокси-4-фенилтиофен, 2-гидрокси-3-нитро-4-хлортиофен, 2-гидрокси-3-нитро-4-фтортиофен и им подобные соединения.
Очевидно, что при соответствующей замене соединения 2 другими известными галогеналкиловыми эфирами и при соответствующей замене соединения 6 другими доступными диэфирами, будут получены все эфиро-амидные производные, подпадающие под объем формулы изобретения.
Примерами соединения 2, которые могут быть использованы в способе настоящего изобретения, являются, но не ограничиваются ими, следующие соединения: Br-CH2-COOMe, Cl-CH2CH2CH2COOCH(CH3)3, Br-CH2CH2CH2CH2COOMe, Br-CH2CH2CH2CH2CH2COOEt, Br-CH2CH2CH2CH2CH2CH2 COOCH2CH2CH2CH3,
Br-CH2CH(CH3)-COOMe, Br-CH2CH(CH3)CH2COOEt, Br-CH2CH2CH2COOMe, Br-CH2CH(CH3)CH2COOCH(CH3)2, Cl-CH2CH(OCH2CH3)CH2COOMe, Br-CH2CH(F)CH2COOMe. Примерами других соединений, которые могут быть использованы в способе настоящего изобретения в качестве соединений, являются следующие соединения: HOOC(CH2)6COOMe, HOOC(CH2)7COOMe, HOOC(CH2)8COOMe, HOOC(CH2)9COOMe, HOOC(CH2)10COOMe, HOOC(CH2)11COOMe, HOOC(CH2)12COOEt, HOOC(CH2)13COOCH(CH3)2,
HOOC(CH2)14COOCH2CH2CH3, HOOC(CH2)15COO(CH2)3CH3, HOOC(CH2)16COOCH3,
HOOC(CH2)17COOCH3, HOOC(CH2)18COOMe, HOOC(CH2)19COOEt, HOOC(CH2)20COOPh,
HOOC(CH2)10COOPh, HOOCCH2CH3CH(CH3)(CH2)10COOMe, HOOCCH2CH3CH(CH)CH2COOEt,
HOOCCH2CH2CH(Cl)CH2COOEt, HOOCCH2CH(OCH3)(CH2)7 COOCH(CH3)2, где Ph = фенил, а также подобные им соединения.
Примерами соединений настоящего изобретения, которые получены в соответствии с этим способом, приведены в следующем списке.
Для кислотных радикалов используется следующая номенклатура:
P(O)(OH)2 - фосфоно;
-COOH - карбокси;
-CONH2 - аминокарбонил;
SO3H - сульфо;
SO2H - сульфино;
SSO3H - тиосульфато, в виде натровой соли.
4-(2-(20-карбоксиэйкозаноиламино)фенокси)бутановая кислота;
4-(2-(19-карбоксинонадеканоиламино)фенокси)бутановая кислота;
4-(2-(18-карбоксиоктадеканоиламино)фенокси)бутановая кислота;
4-(2-(17-карбоксигептадеканоиламино)фенокси)бутановая кислота;
4-(2-(16-карбоксигексадеканоил-N-метиламино)фенокси)бутановая кислота;
4-(2-(15-карбоксипентадеканоиламино)фенокси)бутановая кислота;
4-(2-(14-карбокситетрадеканоиламино)фенокси)бутановая кислота;
4-(2-(13-карбокситридеканоиламино)фенокси)бутановая кислота;
4-(2-(12-карбоксидодеканоиламино)фенокси)бутановая кислота;
4-(2-(11-карбоксиундеканоиламино)фенокси)бутановая кислота;
4-(2-(10-карбоксидеканоиламино)фенокси)бутановая кислота;
4-(2-(9-карбоксинонаноиламино)фенокси)бутановая кислота;
4-(2-(8-карбоксиоктаноиламино)фенокси)бутановая кислота;
4-(2-(7-карбоксигептаноиламино)фенокси)бутановая кислота;
4-(2-(6-карбоксигексаноиламино)фенокси)бутановая кислота;
4-(2-(20-карбоксиэйкозаноиламино)фенилтио)бутановая кислота;
4-(2-(19-карбоксинонадеканоиламино)фенилтио)бутановая кислота;
4-(2-(18-карбоксиоктадеканоиламино)фенилтио)бутановая кислота;
4-(2-(17-карбоксигептадеканоил-N-этиламино)фенилтио)бутановая кислота;
4-(2-(16-карбоксигексадеканоиламино)фенилтио)бутановая кислота;
4-(2-(15-карбоксипентадеканоиламино)фенилтио)бутановая кислота;
4-(2-(14-карбокситетрадеканоиламино)фенилтио)бутановая кислота;
4-(2-(13-карбокситридеканоиламино)фенилтио)бутановая кислота;
4-(2-(12-карбоксидодеканоиламино)фенилтио)бутановая кислота;
4-(2-(11-карбоксиундеканоиламино)фенилтио)бутановая кислота;
4-(2-(10-карбоксидеканоиламино)фенилтио)бутановая кислота;
4-(2-(9-карбоксинонаноиламино)фенилтио)бутановая кислота;
4-(2-(8-карбоксиоктаноиламино)фенилтио)бутановая кислота;
4-(2-(7-карбоксигептаноиламино)фенилтио)бутановая кислота;
4-(2-(6-карбоксигексаноиламино)фенилтио)бутановая кислота;
3-(2-(16-карбоксигексадеканоиламино)фенокси)пропионовая кислота;
4-(2-(15-карбоксиизогексадеканоиламино)фенокси)бутановая кислота;
4-(2-(14-карбокситетрадеканоиламино)фенокси)бутановая кислота;
5-(2-(13-карбокситридеканоиламино)фенокси)валериановая кислота;
5-(2-(12-карбоксидодеканоиламино)фенокси)валериановая кислота;
5-(2-(11-карбоксиизододеканоиламино)фенокси)валериановая кислота;
5-(2-(11-карбоксиундеканоиламино)фенокси)валериановая кислота;
5-(2-(10-карбоксидеканоиламино)фенокси)валериановая кислота;
5-(2-(9-карбоксинонаноиламино)фенокси)валериановая кислота;
6-(2-(9-карбоксинонаноиламино)фенокси)капроновая кислота;
6-(2-(8-карбоксиоктаноиламино)фенокси)капроновая кислота;
6-(2-(7-карбоксиизооктаноиламино)фенокси)капроновая кислота;
7-(2-(7-карбоксигептаноиламино)фенокси)энантовая кислота;
7-(2-(6-карбоксигексаноиламино)фенокси)энантовая кислота;
7-(2-(5-карбоксиизогексаноиламино)фенокси)энантовая кислота;
2-(2-(12-карбоксидодеканоиламино)фенокси)уксусная кислота;
2-(2-(11-карбоксиундеканоиламино)фенокси)уксусная кислота;
2-(2-(10-карбоксидеканоиламино)фенокси)уксусная кислота;
3-(2-(9-карбоксинонаноиламино)фенокси)пропионовая кислота;
3-(2-(12-карбоксидодеканоиламино)фенилтио)пропионовая кислота;
3-(2-(11-карбоксиундеканоиламино)фенилтио)пропионовая кислота;
3-(2-(11-карбоксиундеканоиламино)фенилтио)изобутановая кислота;
5-(2-(11-карбоксиундеканоиламино)фенилтио)валериановая кислота;
5-(2-(10-карбоксидеканоиламино)фенилтио)валериановая кислота;
5-(2-(9-карбоксинонаноиламино)фенилтио)валериановая кислота;
4-(2-(12-карбоксидодеканоиламино)фенилтио)изовалериановая кислота;
4-(2-(11-карбоксидеканоиламино)фенилтио)изовалериановая кислота;
4-(2-(10-карбоксинонаноиламино)фенилтио)капроновая кислота;
4-(2-(12-карбоксидодеканоиламино)фенилтио)капроновая кислота;
7-(2-(11-карбоксиундеканоиламино)-3-метилфенилтио)энантовая кислота;
7-(2-(11-карбоксиундеканоиламино)-4-метилфенилтио)энантовая кислота;
7-(2-(12-карбоксидодеканоиламино)фенокси)энантовая кислота;
4-(2-(11-карбоксиундеканоиламино)-4-метилфенокси)бутановая кислота;
4-(2-(10-карбоксидеканоиламино)фенокси)-3-метилбутановая кислота;
4-(2-(9-карбоксинонаноиламино)-5-метилфенокси)бутановая кислота;
4-(2-(12-карбоксидодеканоиламино)-6-метилфенокси)бутановая кислота;
4-(2-(11-карбоксидеканоиламино)-3-хлорфенокси)бутановая кислота;
4-(2-(10-карбоксидеканоиламино)-4-метилфенокси)бутановая кислота;
4-(2-(9-карбоксинонаноиламино)-5-фторфенилтио)бутановая кислота;
4-(2-(12-карбоксидодеканоиламино)-6-метилфенокси)бутановая кислота;
5-(2-(11-карбоксиундеканоиламино)-3-метилтиофенокси)валериановая кислота;
4-(2-(11-карбоксиундеканоиламино)-3-метилсульфонилфенокси) бутановая кислота;
4-(2-(11-карбоксиундеканоиламино)-4-метилсульфонилфенилтио) бутановая кислота;
4-(2-(12-карбоксидодеканоиламино)-5-этилфенокси)бутановая кислота;
4-(2-(11-карбоксиундеканоиламино)-4-фенилфенокси)бутановая кислота;
4-(2-(10-карбоксидеканоиламино)-3,5-диметилфенокси)бутановая кислота;
4-(2-(9-карбоксинонаноиламино)-4-фторфенокси)бутановая кислота;
4-(2-(12-карбоксидодеканоиламино)-5-трифторметилфенокси)бутановая кислота;
4-(2-(11-карбоксиундеканоиламино)-5-гидроксифенилтио)бутановая кислота;
4-(2-(10-карбоксидеканоиламино)-4-гидроксифенилтио)бутановая кислота;
4-(2-(9-карбоксинонаноиламино)-3,5-диметоксифенилтио)бутановая кислота;
4-(2-(12-карбоксидодеканоиламино)-5-нитрофенокси)бутановая кислота;
5-(2-(11-карбоксиундеканоиламино)-4-нитрофенокси)валериановая кислота;
4-(2-(11-карбоксиундеканоиламино)-5-аминофенокси)бутановая кислота;
4-(2-(11-карбоксиундеканоиламино)-5-амино-4-метилфенилтио) бутановая кислота;
4-(2-(12-карбоксидодеканоиламино)-5-трифторметилфенокси)бутановая кислота;
4-(2-(11-карбоксиундеканоиламино)-5-гидроксифенилтио)бутановая кислота;
4-(2-(12-карбоксидодеканоиламино)-4-диметиламинофенокси)бутановая кислота;
4-(2-(11-карбоксиундеканоиламино)-5-этиламинофенокси)бутановая кислота;
3-(2-(12-карбоксидодеканоиламино)фенокси)-3-метилпропионовая кислота;
3-(2-(11-карбоксидодеканоиламино)фенилтио)-2-хлорпропионовая кислота;
4-(2-(10-карбоксидеканоиламино)фенилтио)-3-метоксибутановая кислота;
4-(2-(9-карбоксинонаноиламино)фенилтио)-3-этоксибутановая кислота;
4-(2-(12-карбоксидодеканоиламино)-4-метил-3-пиридилокси)бутановая кислота;
4-(2-(11-карбоксиундеканоиламино)-4-метил-3-пиридилокси)бутановая кислота;
4-(2-(10-карбоксидеканоиламино)-5-метил-3-пиридилокси)бутановая кислота;
4-(2-(9-карбоксинонаноиламино)-5-гидрокси-3-пиридилокси)бутановая кислота;
4-(2-(12-карбоксидодеканоиламино)-6-диметиламино-3- пиридилокси)бутановая кислота;
4-(2-(11-карбоксидеканоиламино)-3-пиридилтио)бутановая кислота;
4-(2-(10-карбоксидеканоиламино)-6-метилсульфонил-3- пиридилокси)бутановая кислота;
4-(2-(9-карбоксинонаноиламино)-5-хлор-3-пиридилтио)бутановая кислота;
4-(2-(12-карбоксидодеканоиламино)-5-метилпиридилтио)бутановая кислота;
4-(2-(11-карбоксиундеканоиламино)-5-метилсульфонил-3- пиридилтио)бутановая кислота;
4-(2-(11-карбоксиундеканоиламино)-6-метил-3-пиридилтио)бутановая кислота;
4-(2-(11-карбоксиундеканоиламино)-4,6-диметил-3- пиридилокси)бутановая кислота;
4-(2-(12-карбоксидодеканоиламино)-5-метилтио-3- пиридил)бутановая кислота;
4-(2-(11-карбоксиундеканоиламино)пиридилокси)бутановая кислота;
4-(2-(10-карбоксидеканоиламино)-5-метокси-3-пиридилокси)бутановая кислота;
4-(2-(9-карбоксинонаноиламино)-4-фтор-6-метил-3- пиридилокси)бутановая кислота;
4-(2-(12-карбоксидодеканоиламино)-5-метиламино-3- пиридилокси)бутановая кислота;
4-(2-(11-карбоксидеканоиламино)-4-фенил-3-пиридилтио)бутановая кислота;
4-(2-(10-карбоксидеканоиламино)-5-метил-3-пиридилтио)бутановая кислота;
4-(2-(9-карбоксинонаноиламино)-6-метокси-3-пиридилтио)бутановая кислота;
4-(2-(12-карбоксидодеканоиламино)-6-трифторметил-3- пиридилокси)бутановая кислота;
5-(2-(11-карбоксиундеканоиламино)-4-метил-3-тиенилокси)валериановая кислота;
4-(2-(11-карбоксиундеканоиламино)-4-метил-3-тиенилтио)бутановая кислота;
4-(2-(12-карбоксидодеканоиламино)-5-метил-3-тиенилтио)бутановая кислота;
4-(2-(11-карбоксиламино)-4-метил-3-тиенилтио)бутановая кислота;
4-(2-(10-карбоксидеканоиламино)-5-метил-3-тиенилтио)бутановая кислота;
4-(2-(9-карбоксинонаноиламино)-4-гидрокси-3-тиенилокси)бутановая кислота;
4-(2-(12-карбоксидеканоиламино)-4-метилтио-3-тиенилокси)бутановая кислота;
4-(2-(11-карбоксидеканоиламино)-4-метилтио-3-тиенилокси)бутановая кислота;
4-(2-(10-карбоксидеканоиламино)-4-метилсульфонил-3-тиенилокси)бутановая кислота;
4-(2-(9-карбоксинонаноиламино)-4-метилсульфонил-3-тиенилокси)бутановая кислота;
4-(2-(12-карбоксидодеканоиламино)-5-трифторметил-3-тиенилокси)бутановая кислота;
5-(2-(11-карбоксиундеканоиламино)-5-хлор-3-тиенилокси)валериановая кислота;
4-(2-(11-карбоксиундеканоиламино)-4-метил-5-фенил- 3-тиенилокси)бутановая кислота;
4-(2-(11-карбоксиундеканоиламино)-5-диметиламино- 3-тиенилокси)бутановая кислота;
4-(2-(11-карбоксиундеканоиламино)-3-тиенилокси)бутановая кислота;
4-(2-(20-фосфоноэйкозаноиламино)фенокси)бутановая кислота;
4-(2-(19-фосфонононадеканоиламино)фенокси)бутановая кислота;
4-(2-(17-сульфогептадеканоиламино)фенокси)бутановая кислота;
4-(2-(16-сульфиногексадеканоил-N-метиламино)фенокси)бутановая кислота;
4-(2-(15-тиосульфатопентадеканоиламино)фенокси)бутирамида натровая соль;
4-(2-(14-фосфонотетрадеканоил-N-метиламино)фенокси)бутановая кислота;
4-(2-(12-сульфододеканоиламино)фенокси)бутановая кислота;
4-(2-(11-сульфоиундеканоиламино)фенокси)бутановая кислота;
4-(2-(10-сульфодеканоиламино)фенокси)бутановая кислота;
4-(2-(9-тиосульфатононаноиламино)фенокси)бутановой кислоты натровая соль;
4-(2-(8-тиосульфатооктаноиламино)фенокси)бутановой кислоты натровая соль;
4-(2-(7-сульфиногептаноиламино)фенокси)бутановая кислота;
4-(2-(6-фосфоногексаноиламино)фенокси)бутановая кислота;
4-(2-(19-сульфонононадеканоиламино)фенилтио)бутановая кислота;
4-(2-(18-сульфонооктадеканоиламино)фенилтио)бутановая кислота;
4-(2-(17-тиосульфотогептадеканоил-N-этиламино)фенилтио)бутановая кислота;
4-(2-(16-фосфононогексадеканоиламино)фенилтио)бутановая кислота;
4-(2-(14-сульфинотетрадеканоиламино)фенилтио)бутановая кислота;
4-(2-(12-тиосульфатододеканоиламино)фенилтио)бутановой кислоты натровая соль;
4-(2-(10-сульфинодеканоиламино)фенилтио)бутановая кислота;
4-(2-(9-карбоксинонаноиламино)фенилтио)бутансульфокислота;
4-(2-(8-карбоксиоктаноиламино)фенилтио)бутансульфокислота;
4-(2-(7-карбоксигептаноиламино)фенилтио)бутантиосульфокислота;
4-(2-(20-карбоксиэйкозаноиламино)фенокси)бутанфосфиновая кислота;
4-(2-(19-карбоксинонадеканоиламино)фенокси)бутансульфокислота;
4-(2-(18-карбоксиоктадеканоил-N-бутиламино)фенокси) бутансульфокислота;
4-(2-(17-карбоксигептадеканоиламино)фенокси)бутанфосфиновая кислота;
4-(2-(15-карбоксипентадеканоиламино)фенокси)бутанфосфиновая кислота;
4-(2-(14-карбокситетрадеканоиламино)фенокси)бутансульфокислота;
4-(2-(13-карбокситридеканоиламино)фенокси)бутансульфокислота;
4-(2-(12-карбоксидодеканоиламино)фенокси)бутантиосульфокислоты натровая соль;
4-(2-(10-карбоксидеканоиламино)фенокси)бутанфосфиновая кислота;
4-(2-(9-карбоксинонаноиламино)фенокси)бутансульфокислота;
4-(2-(8-карбоксиоктаноиламино)фенокси)бутансульфиновая кислота;
4-(2-(7-карбоксигептаноиламино)фенокси)бутантиосульфокислоты натровая соль;
4-(2-(20-карбоксиэйкозаноиламино)фенилтио)бутанфосфиновая кислота;
4-(2-(19-карбоксинонадеканоил-N-метиламино)фенилтио)бутансульфокислота;
4-(2-(18-карбоксиоктадеканоиламино)фенилтио)бутансульфокислота;
4-(2-(17-карбоксигептадеканоиламино)фенилтио)бутансульфокислота;
4-(2-(16-карбоксигексадеканоиламино)фенилтио)бутантилсульфокислоты натровая соль;
4-(2-(14-карбокситетрадеканоил-N-пропиламино)фенилтио)бутанфосфиновая кислота;
4-(2-(13-карбокситридеканоиламино)фенилтио)бутансульфокислота;
4-(2-(12-карбоксидодеканоиламино)фенилтио)бутансульфокислота;
4-(2-(11-карбоксиундеканоиламино)фенилтио)бутантиосульфокислоты натровая соль;
4-(2-(9-карбоксинонаноиламино)фенилтио)бутансульфокислота;
4-(2-(8-карбоксиоктаноиламино)фенилтио)бутансульфокислота;
4-(2-(7-карбоксигептаноиламино)фенилтио)бутансульфокислота;
4-(2-(6-карбоксигексаноиламино)фенилтио)бутантиосульфокислоты натровая соль;
3-(2-(15-карбоксиизогексадеканоиламино)фенокси) изобутанфосфиновая кислота;
3-(2-(14-карбокситетрадеканоиламино)фенокси)изобутановая кислота;
5-(2-(13-карбокситридеканоиламино)фенокси)пентансульфокислота;
5-(2-(12-фосфонододеканоиламино)фенокси)валерамид;
5-(2-(11-сульфоундеканоиламино)валериановая кислота;
5-(2-(10-сульфинодеканоил-N-метиламино)фенокси)валериановая кислота;
5-(2-(9-тиосульфатононаноиламино)фенокси)валериановой кислоты натровая соль;
6-(2-(9-фосфононаноиламино)фенокси)капроновая кислота;
6-(2-(7-сульфоизооктаноил-N-метиламино)фенокси)капроновая кислота;
7-(2-(7-сульфиногептаноил-N-этиламино)фенокси)энантовая кислота;
7-(2-(6-тиосульфатогексаноиламино)фенокси)энантовой кислоты амид;
7-(2-(5-фосфоноизогексаноиламино)фенокси)энантовая кислота;
2-(2-(11-сульфоундеканоиламино)фенокси)уксусная кислота;
2-(2-(10-сульфодеканоил-N-пропиламино)фенокси)уксусная кислота;
3-(2-(9-сульфинононаноиламино)фенокси)пропионовая кислота;
3-(2-(12-тиосульфатододеканоиламино)фенилтио)пропионамида натровая соль;
3-(2-(11-фосфоноундеканоиламино)фенилтио)пропионовая кислота;
3-(2-(11-сульфоундеканоиламино)-4-метилфенилтио)изобутановая кислота;
3-(2-(12-сульфинододеканоиламино)фенилтио)изобутирамид;
5-(2-(11-тиосульфоундеканоил-N-бутиламино)фенилтио)валериановой кислоты натровая соль;
5-(2-(10-фосфонодеканоиламино)фенилтио)валериановая кислота;
5-(2-(12-фосфонододеканоиламино)фенилтио)пентансульфокислота;
5-(2-(11-карбоксидеканоиламино)фенилтио)пентансульфиновая кислота;
5-(2-(10-фосфонодеканоиламино)фенилтио)пентантиосульфокислота;
6-(2-(12-фосфонододеканоиламино)фенилтио)гексанфосфиновая кислота;
4-(2-(11-сульфиноундеканоиламино)-4-метилфенокси)бутантиосульфокислоты натровая соль;
4-(2-(12-сульфододеканоиламино)-6-метилфенокси)бутансульфокислота;
4-(2-(11-сульфодеканоиламино)-3-хлорфенилтио)бутансульфиновая кислота;
4-(2-(10-сульфодеканоиламино)-4-метилфенокси)бутансульфокислоты натровая соль;
4-(2-(12-сульфододеканоиламино)-6-метилфенокси)бутанфосфиновая кислота;
5-(2-(11-сульфиноундеканоиламино)-3-метилфенилтио)пентансульфокислота;
4-(2-(11-сульфиноундеканоиламино)-3-метилсульфонилфенокси)бутансульфиновая кислота;
4-(2-(11-сульфиноундеканоиламино)-4-метилсульфонилфенилтио)бутансульфокислота;
4-(2-(12-сульфинододеканоиламино)-5-этилфенокси)бутанфосфиновая кислота;
4-(2-(10-сульфинодеканоиламино)-3,5-диметилфенокси)бутансульфокислота;
4-(2-(9-тиосульфатононаноиламино)-4-фторфенокси)бутановой кислоты натровая соль;
4-(2-(10-тиосульфатодеканоиламино)-4-гидроксифенилтио)бутанфосфиновой кислоты натровая соль;
4-(2-(9-фосфонононаноиламино)-3,5-диметилфенилтио)бутановая кислота;
5-(2-(11-сульфоундеканоиламино)-4-нитрофенокси)валериановая кислота;
4-(2-(11-сульфиноундеканоиламино)-5-амино-3-метилфенокси)бутановая кислота;
4-(2-(11-тиосульфатоундеканоиламино)-5-амино-4- метилфенилтио)бутановой кислоты натровая соль;
4-(2-(12-фосфинододеканоиламино)-4-диметиламинофенокси)бутановая кислота;
4-(2-(10-сульфодеканоиламино)фенокси)бутановая кислота;
3-(2-(9-сульфинононаноиламино)фенокси)пропионовая кислота;
3-(2-(12-тиосульфатододеканоиламино)фенилтио)-3-метилпропионовой кислоты натровая соль;
3-(2-(11-фосфоноундеканоиламино)тиенилокси)-2-хлорпропионовая кислота;
4-(2-(9-сульфононаноиламино)тиенилокси)-3-этоксибутановая кислота;
4-(2-(12-сульфинододеканоиламино)фенокси)-2-фторбутановая кислота;
7-(2-(11-тиосульфатоундеканоиламино)фенокси)-6-аминоэнантовой кислоты натровая соль;
5-(2-(11-фосфоноундеканоиламино)-3-метилфенокси)-4-оксо- валериановая кислота;
4-(2-(12-сульфододеканоиламино)фенокси)бут-2-еновая кислота;
4-(2-(11-сульфинодеканоиламино)фенокси)бут-2-еновая кислота;
4-(2-(10-тиосульфатодеканоиламино)фенокси)-4-метилен- валериановой кислоты натровая соль;
4-(2-(9-фосфононаноиламино)фенокси)-4-фтор-2-бутановая кислота;
4-(2-(11-сульфо-3-метилбутаноиламино)тиенилокси)бутановая кислота;
4-(2-(11-сульфино-3-хлорбутаноиламино)тиенилокси)бутановая кислота;
4-(2-(9-тиосульфато-3-метоксинонаноиламино)тиенилокси)бутановой кислоты натровая соль;
4-(2-(4-фосфино-2-этоксибутаноиламино)фенокси)бутановая кислота;
4-(2-(14-сульфо-14-фтор-2-ацетамидотетрадеканоиламино)-3- метилфенокси)бутановая кислота;
4-(2-(13-сульфино-2-оксотридеканоиламино)-4-метилтиофенокси)бутановая кислота;
4-(2-(12-тиосульфатододеканоил-3-енамино)фенокси)бутановая кислота;
4-(2-(11-фосфоноундодеканоил-7-енамино)фенокси)бутановая кислота;
4-(2-(4-сульфо-2-фтор-2-бутеноиламино)фенокси)бутановая кислота;
4-(2-(12-сульфинододеканоиламино)-4-метил-3-пиридилокси)бутановая кислота;
4-(2-(11-тиосульфатоундеканоиламино)-4-метил-3-пиридилокси)бутановая кислота;
4-(2-(10-фосфинодеканоиламино)-5-метил-3-пиридилокси)бутановая кислота;
4-(2-(11-сульфинодеканоиламино)-4-нитро-3-пиридилтио)бутановая кислота;
4-(2-(10-тиосульфатодеканоиламино)-6-метилсульфонил-3- пиридилокси)бутановой кислоты натровая соль;
4-(2-(9-фосфинононаноиламино)-5-хлор-3-пиридилтио)бутановая кислота;
4-(2-(11-сульфоундеканоиламино)-5-метил-3-пиридилтио)бутановая кислота;
4-(2-(11-сульфоундеканоиламино)-6-метил-3-пиридилтио)бутановая кислота;
4-(2-(11-тиосульфатоундеканоиламино)-4,6-диметил-3- пиридилокси)бутановой кислоты натровая соль;
4-(2-(12-фосфонододеканоиламино)-5-метилтио-3- пиридилокси)бутановая кислота;
4-(2-(10-сульфодеканоиламино)-5-метокси-3-пиридилокси)бутановая кислота;
4-(2-(9-сульфинононаноиламино)-4-фтор-6-метил-3- пиридилокси)бутановая кислота;
4-(2-(12-тиосульфатододеканоиламино)-5-метиламино-3- пиридилокси)бутановой кислоты натровая соль;
4-(2-(11-фосфоноундеканоиламино)-4-фенил-3-пиридилтио)бутановая кислота;
4-(2-(9-сульфинононаноиламино)-6-метокси-3-пиридилтио) бутановая кислота;
4-(2-(12-сульфинододеканоиламино)-6-трифторметил-3- пиридилокси)бутановая кислота;
4-(2-(11-тиосульфатоундеканоиламино)-4-метил-3- тиофенилокси)валериановой кислоты натровая соль;
4-(2-(11-фосфиноундеканоиламино)-4-метил-3-тиофенилокси)бутановая кислота;
4-(2-(12-сульфододеканоиламино)-5-метил-3-тиофенилтио) бутановая кислота;
4-(2-(11-сульфиноундеканоиламино)-4-метил-3-тиофенилтио)бутановая кислота;
4-(2-(10-тиосульфатодеканоиламино)-5-метил-3-тиенилтио)бутановой кислоты натровая соль;
4-(2-(11-сульфодеканоиламино)-4-метилтио-3-тиенилокси)бутановая кислота;
4-(2-(10-сульфинодеканоиламино)-4-метилсульфонил-3-тиенилокси)бутановая кислота;
4-(2-(9-тиосульфатононаноиламино)-4-метилсульфонил-3- тиенилокси)бутановой кислоты натровая соль;
4-(2-(12-фосфонододеканоиламино)-5-трифторметил-3- тиенилокси)бутановая кислота;
4-(2-(11-сульфоундеканоиламино)-4-метил-5-фенил-3- тиенилокси)бутановая кислота;
4-(2-(12-тиосульфододеканоиламино)-5-диметиламино-3- тиенилокси)бутановой кислоты натровая соль;
4-(2-(11-фосфоноундеканоиламино)-4-амино-3-тиенилокси)бутановая кислота;
Предпочтительными соединениями изобретения являются:
4-(2-(11-карбоксиундеканоиламино)фенокси)бутановая кислота;
4-(2-(11-карбоксиундеканоиламино)фенилтио)бутановая кислота;
4-(2-(9-карбоксинонаноиламино)фенокси)бутановая кислота;
4-(2-(10-карбоксидеканоиламино)фенокси)бутановая кислота;
4-(2-(12-карбоксидодеканоиламино)фенокси)бутановая кислота;
4-(2-(13-карбокситридеканоиламино)фенокси)бутановая кислота;
4-(2-(15-карбоксипентадеканоиламино)фенокси)бутановая кислота;
4-(2-(11-карбоксиундеканоиламино)-4-метилфенокси)бутановая кислота;
4-(2-(11-карбоксиундеканоиламино)-5-метилфенокси)бутановая кислота.
В изобретение также включены в качестве ингибиторов 5α- редуктазы соединения следующей формулы
где A представляет собой 1,2-дизамещенное ароматическое кольцо, предпочтительно бензольное кольцо;
заместитель D представляет собой OH, NH2, NHRc, ORc;
заместитель X представляет собой O, S, SO, SO2;
заместитель R представляет собой атом водорода, C1-C4-алкил, фенил или замещенный фенил, атом галогена, гидроксигруппу, карбоксильную группу, цианогруппу, C1- C4-алкоксигруппу, C1-C4-алкилтиогруппу, C1-C4-алкилсульфинильную группу, C1- C4-алкилсульфонильную группу, нитро-группу, аминогруппу, C1-C4-моно- или ди-алкиламиногруппу;
заместители R' и R'' независимо друг от друга представляют собой атом водорода, атом галогена, C1-C4-алкил или C1- C4-алкоксигруппу, аминогруппу, или оксогруппу, когда фрагменты CH-R' или CHR'' в указанной формуле становятся группой -C=O;
заместитель Ra представляет собой H или C1-C4-алкил;
заместители Rb и Rc независимо друг от друга представляют собой C1-C12-алкил, фенил, фенил C1- C4-алкил;
n = 0 - 2;
y = 1 - 6;
z = 6 - 20, и
фрагменты (CH)y-R' и (CH)z-R'' могут независимо друг от друга представлять собой замещенные или незамещенные алкильные радикалы или алкенильные радикалы, содержащие по меньшей мере одну алкеновую связь,
а также их фармацевтически приемлемые соли.
Соединения изобретения представляют собой ингибиторы тестостерон -5α- редуктазного фермента человека.
Соединения, подпадающие под объем изобретения, представлены приведенными выше формулами.
При описании формул использовались следующие понятия.
Заместитель X в приведенной выше общей формуле представляет собой O или S, предпочтительно, когда оба заместителя X являются атомами кислорода, то есть конечное соединение имеет структуру катехола.
"C1-C4-алкил" означает линейный или разветвленный алкил, например метил, этил, н-пропил, изопропил, циклопропил, н-бутил, изобутил, втор-бутил, трет. -бутил, а "C1-C12-алкил" означает алкильную группу, содержащую до 12 атомов углерода, например Н-октил, трет.-децил, н-додецил.
"Фенил C1-C4-алкил" означает бензило, 2-фенетил и им подобные заместители.
"C1-C4-алкоксигруппа" означает линейную или разветвленную алкоксигруппу, например метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет.-бутокси.
Под "галогеном" понимают атом фтора, хлора, брома или йода.
"Замещенный фенил" означает фенил, замещенный одним или несколькими C1-C4-алкилами, C1- C4-алкоксигруппами, атомами галогена и др., как это определено выше, примерами таких заместителей являются о, м и р-метоксифенил, 2,4-диметоксифенил, 2-хлор-4-этоксифенил, 3,5-диметоксифенил, 2,4-дихлорфенил, 2-бром-4-метилфенил, о-фторфенил и др.
Понятие "галогеналкил" алкил включает C1- C4-алкильные группы, описанные выше, замещенные одним или несколькими атомами "галогена", определенными выше, например трифторметильную группу, 2,2-дихлорэтильную и др.
Заместитель "C1-C4-алкилтио" означает C1-C4-алкил, описанный выше, замещенный по меньшей мере одной двухвалентной тиогруппой (-S-), в том числе, метилтио, этилтио, изопропилтио, н-бутилтио, и им подобные группы.
Заместитель "C1-C4- алкилсульфинил" означает C1-C4-алкильную группу, описанную выше, замещенную по меньшей мере одной -SO-группой, например метилсульфинил, этилсульфинил, изопропилсульфинил и др.
Заместитель "C1-C4-алкилсульфонил" означает C1-C4-алкильную группу, описанную выше, замещенную по меньшей мере одной сульфогруппой -SO2-, например метилсульфонил, этилсульфонил, изопропилсульфонил, н-бутилсульфонил и др.
Заместитель "C1-C4-моно или диалкиламино" означает аминогруппу, замещенную одной или несколькими C1- C4-алкильными группами, описанными выше, например метиламино, этиламино, н-бутиламино, трет.-бутиламино, N,N-диметиламино, N,N-диэтиламино, метил-трет.-бутиламино и др.
Заместитель R или заместители у бензольного кольца могут присутствовать с первой стадии процесса, например, такие как фенил, метил, метокси, циано, трифторметил, карбометокси (например, как в случае о-нитрофенола 1-исходного продукта в схеме A), или могут быть введены позднее с помощью обычных реакций, например, такие заместители как хлор путем хлорирования, нитрогруппа путем нитрования, или путем превращения исходной или введенной группы, например, превращением нитрогруппы в аминогруппу при каталитическом восстановлении, с последующим алкилированием аминогруппы до моно- или диалкиламиногруппы. Аминогруппа может быть подвергнута диазотированию с получением гидроксигруппы, которая может быть затем прометилирована до метоксигруппы. Аналогично, гидроксигруппа может быть превращена в тиольную группу по методике, аналогичной методике, описанной в J. Org. Chem., 31, pp. 3980 - 3984, (1966) Ньюменом и Карнесом и в J. Org. Chem., 31, pp. 410, (1966) Квотом и Эвансом. Полученные тиолы могут быть проалкилированы до алкилтиопроизводных, которые могут быть, в свою очередь, окислены до соответствующих сульфоксидов и сульфонов. Предпочтительными заместителями являются атом водорода, C1-C4-алкил, C1-C4-алкокси и фенил. Такие реакции и их последовательности являются обычными в данной области и для любого квалифицированного в данной области специалиста будет очевидно, каким образом провести изменение бензольного кольца, чтобы ввести в него заместители, описанные выше.
Под названием "их фармацевтически приемлемые соли и эфиры" понимают соли и эфиры, полученные по кислотной группе конечного продукта, которые могут быть использованы в качестве лекарственной системы для человека и в число которых входят: соли натровые, калиевые, кальциевые, аммониевые, соли замещенного аммония, четвертичные аммонийные соли, и эфиры - этиловый эфир, ацетураты, бесилаты, эдетаты, фенпропионаты, ацетаты, памоаты и эфиры, которые выполняют функцию пролекарственных препаратов, которые гидролизуются в теле под действием физиологической среды с образованием исходной кислоты, например, пивалоилаты, то есть пивоксетил и пивоксил, а также эфиры Канебо и им подобные соединения.
Остаток (CH)yR', где y принимает значения 1 - 6, предпочтительно 3, может содержать по меньшей мере один заместитель R', определенный выше, и может представлять собой, например, -CH2-; -CH2-CH2-; -CH2-CH2-CH2-;



и им подобные заместители.
В заместителе (CH)yR' также может присутствовать алкеновая связь, например, в случае таких заместителей, как -CH2-CH=CH-; -CH2-CH=CH-CH2-; -CH2-CH=CH-; -(CH2)3-CH=CH- и им подобных заместителей.
Остаток (CH)zR'', где z принимает значения 6 - 20, предпочтительно 8 - 14, может содержать по меньшей мере один заместитель R'', определенный выше, и может представлять собой алкил; например, (CH2)n-COOH, где n предпочтительно составляет 8 - 14, и др. подобные заместители.
В заместителе (CH)zR'' также может присутствовать алкеновая связь, например, в случае таких заместителей, как -(CH2)4-CH=CH-(CH2)4- и им подобных заместителей.
Предпочтительно, если один из заместителей R' или R'' представляет собой H, и особенно предпочтительно, когда оба заместителя (CH)yR' и (CH)zR'' являются алкилами.
Предпочтительные соединения настоящего изобретения, подпадающие под приведенную выше общую формулу, имеют следующее строение

где заместители R, R', R'', y, z и Rb принимают значения, определенные выше.
Особенно предпочтительны соединения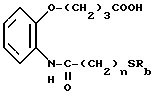

где n = 8 - 14;
заместитель Rb представляет собой метил, этил, циклопропил, изопропил, н-пропил, трет.-бутил, фенил или бензил.
Указанные соединения изобретения могут быть получены в соответствии с реакционными схемами A-3, B-3, C-3, представленными в конце описания.
Как видно из схемы A-3, о-нитрофенол 1, этил-4-бромбутират 2 и безводный K2CO3, например, в сухом ацетоне, кипятят, например в течение 12 - 100 ч, или выдерживают при комнатной температуре в течение длительного времени в атмосфере азота, получая при этом 4-(2-нитрофенокси)бутират 3 (стадия A).
Раствор соединения 3, например, в этилацетате подвергают каталитическому гидрированию при комнатной температуре в атмосфере водорода под давлением 40 фунтов/кв. дюйм в присутствии в качестве катализатора 5%-ного Pd/C, получают этил 4-(2-аминофенокси)-бутират 4, стадия (B).
Стадия (С) включает взаимодействие 12-бромдодекановой кислоты 5 с изопропилмеркаптаном в подходящем растворителе, например в диметоксиэтане, при 80 - 86oC с образованием кислоты 6.
На стадии (D) монокислота 6 взаимодействует с амином 4 и N,, N,-дициклогексилкарбодиимидом (DCC), например при комнатной температуре в сухом метиленхлориде, возможно в присутствии 4-диметиламинопиридина, с образованием амида 7.
На стадии (E) эфиро-амид 7 деэтерифицируют, например, с помощью 2,5 н. NaOH в водно-метанольном растворе, до монокислоты 8.
Монокислота 8 может быть обработана с помощью NaJO4 в смеси ацетон/вода при комнатной температуре в течение 4 - 24 ч с получением соответствующего сульфоксида 8а. Кроме того, соединение 8 может быть обработано с помощью мета-хлорбензойной кислоты в (CHCl2) при температуре приблизительно 0 - 25oC в течение 1 - 24 ч с получением соответствующего сульфона 8б.
На стадии (F) эфир 7 обрабатывается аммиаком в метаноле при комнатной температуре в течение, например, 1 - 7 дней с получением амида 9.
На схеме B-3 приведен синтез сульфоаналогов заявляемых соединений.
На стадии (G) орто-аминофенол реагирует с бромэфиром 2 в условиях, аналогичных условиям стадии A, с образованием тиоэфира 11.
На стадии (H) тиоэфиры 11 реагируют с алкилтиоалкановой кислотой в условиях, аналогичных условиям, используемым на стадии D в случае DCC, с образованием ацилированного эфира 12.
На стадии (I) эфир 12 подвергается гидролизу до свободной тиокислоты 13, которая обладает 5α- редуктазной активностью, описанной выше.
Как видно из схемы C-3, соединение 13 может быть в дальнейшем окислено до сульфоксида на Стадии Ja, начиная с тиосоединения 14, с получением сульфоксида 15, который может быть гидролизован в условиях, аналогичных условиям на стадии I, до активной кислоты 16.
Аналогичным способом соединение 14 может быть превращено в сульфон-эфир 17, который может быть затем гидролизован в условиях, аналогичных условиям Стадии I, до соответствующей кислоты 18.
Аналогично, сера в о-нитробензолтиоле, который используется в качестве исходного продукта, аналогичного соединению 1, может быть связана с образованием алкилтиоэфира, соответствующего соединению 3, которое может быть окислено до соответствующего сульфоксида или сульфона, с последующим восстановлением нитрогруппы до аминогруппы и затем связана с подходящим реагентом, например с соединением 6, с образованием линейного амида, содержащего неокисленный атом серы, аналогичного соединению 7. Дополнительная модификация состоит в том, что сульфурирующий агент вначале окисляют до соответствующего сульфоксида и сульфона, затем связывают с аминогруппой, например, соединения 11, с получением, например, соединения 13, содержащего только окисленный атом серы в амидной цепочке.
Очевидно, что в схеме A-3 другие нитрофенолы могут быть использованы вместо соединения 1 с целью получения соединений, подпадающих под объем изобретения, и в число таких нитрофенолов входят: 2-нитрофенол, 2-нитро-6-метилфенол, 2-нитро-5-метилфенол, 2-нитро-4-метилфенол, 2-нитро-3-метилфенол, 2-нитро-4-фенилфенол, 2-нитро-5-фенилфенол, 2-нитро-4-хлорфенол, 2-нитро-4-трифторметилфенол, 2-нитро-4-метоксифенол, 2-нитро-6-этоксифенол и им подобные соединения.
Исходные материалы, добавляемые к соединению 10 для проведения реакционных схем B-3 и C-3 являются коммерчески доступными и легко могут быть получены по методикам, известным из предшествующего уровня, и в их число входят все указанные выше соединения, где SH-группа замещает OH-группу в орто-положении к нитрогруппе.
Другими исходными соединениями, используемыми в качестве соединений 2 как в схеме A-3, так и в схеме B-3, являются: Br-CH2-COOMe, Cl-CH2CH2CH2COOCH(CH3)3, Br-CH2CH2CH2CH2COOMe, Br-CH2CH2CH2CH2CH2COOEt,
Br-CH2CH2CH2CH2 CH2CH2COOCH2CH2CH2CH3, Br-CH2CH(CH3)-COOMe, Br-CH2CH(CH3)CH2COOEt, Br-CH2CH2CH2COOMe, Br-CH2CH(CH3)CH2COOCH(CH3)2,
Cl-CH2CH(OCH2CH3)CH2COOMe, Br-CH2CH(F)CH2COOMe и им подобные соединения. Другими исходными соединениями, используемыми в качестве кислоты 6 для проведения ацилирования аминогруппы в соединениях 4 или 11, являются следующие соединения: MeS-(CH2)6COOH, MeS-(CH2)7COOH, (CH3)2CHS-(CH2)8COOH,
EtS-(CH2)9COOH, CH3CH2CH2S(CH2)10COOH, MeS-(CH2)12COOH, EtS-(CH2)13COOH,
CH3CH2CH2S(CH2)14COOH, (CH3)2CHS(CH2)15COOH, CH3(CH2)3S(CH2)16COOH,
(CH3)2CHCH2S(CH2)17COOH, CH3CH2CH2S(CH2)18COOH, (CH3)2CHS(CH2)19COOH,
EtS-(CH2)20COOH, MeS-CHCH3-(CH2)10COOH, (CH3)2CHSCH2CH2CH(CH3)CH2COOH,
MeSCH2CH2CH(Cl)CH2COOH, EtS-CH2CH(OCH3)(CH2)7COOH, CH3CH2CH2SCH2CH(OCH2CH3) CH2CH2COOH, CH3(CH2)7SCH2COOH, (CH3)2(CH2)5SCH2COOH, CH3(CH2)9SCH2COOH,
CH3(CH2)11SCH2COOH и им подобные соединения.
Типичными соединениями изобретения являются, но не ограничиваются только ими, следующие соединения:
4-(2-(20-изопропилтиоэйкозаноиламино)фенокси)бутановая кислота;
4-(2-(19-метилтиононадеканоиламино)фенокси)бутановая кислота;
4-(2-(18-этилтиооктадеканоиламино)фенокси)бутановая кислота;
4-(2-(17-изопропилтиогептадеканоиламино)фенокси)бутановая кислота;
4-(2-(16-метилтиогексадеканоиламино)фенокси)бутановая кислота;
4-(2-(15-метилсульфинилпентадеканоиламино)фенокси)бутановая кислота;
4-(2-(14-метилсульфинилтетрадеканоиламино)фенокси)бутановая кислота;
4-(2-(13-н.-пропилтиотридеканоиламино)фенокси)бутановая кислота;
4-(2-(12-н.-бутилсульфинилдодеканоиламино)фенокси)бутановая кислота;
4-(2-(11-втор.-бутилтиоундеканоиламино)фенокси)бутановая кислота;
4-(2-(10-фенилтиодеканоиламино)фенокси)бутановая кислота;
4-(2-(10-бензилтиодеканоиламино)фенокси)бутановая кислота;
4-(2-(10-изо-бутилсульфонилдеканоиламино)фенокси)бутановая кислота;
4-(2-(9-трет.-бутилтиононаноиламино)фенокси)бутановая кислота;
4-(2-(8-этилсульфонилоктаноиламино)фенокси)бутановая кислота;
4-(2-(7-изо-пропокситиогептаноиламино)фенокси)бутановая кислота;
4-(2-(6-метилтиогексаноиламино)фенокси)бутановая кислота;
4-(2-(20-этилсульфонилэйкозаноиламино)фенилтио)бутановая кислота;
4-(2-(19-изопропилтиононадеканоиламино)фенилтио)бутановая кислота;
4-(2-(18-метилтиооктадеканоиламино)фенилтио)бутановая кислота;
4-(2-(17-этилтиогептадеканоиламино)фенилтио)бутановая кислота;
4-(2-(16-изо-пропилтиогексадеканоиламино)фенилтио)бутановая кислота;
4-(2-(15-метилтиопентадеканоиламино)фенилтио)бутановая кислота;
4-(2-(14-метилсульфинилтетрадеканоиламино)фенилтио)бутановая кислота;
4-(2-(13-н.-метилсульфинилтридеканоиламино)фенилтио)бутановая кислота;
4-(2-(12-н.-пропилтиододеканоиламино)фенилтио)бутановая кислота;
4-(2-(11-втор.-бутилсульфинилундеканоиламино)фенилтио)бутановая кислота;
4-(2-(10-втор.-бутилтиодеканоиламино)фенилтио)бутановая кислота;
4-(2-(10-фенилтиодеканоиламино)фенилтио)бутановая кислота;
4-(2-(10-бензилтиодеканоиламино)фенилтио)бутановая кислота;
4-(2-(9-изо.-бутилсульфионилнонаноиламино)фенилтио)бутановая кислота;
4-(2-(8-трет.-бутилтиооктаноиламино)фенилтио)бутановая кислота;
4-(2-(7-этилсульфинилгептаноиламино)фенилтио)бутановая кислота;
4-(2-(6-изопропилтиогексаноиламино)фенилтио)бутановая кислота;
4-(2-(16-метилсульфинилгексадеканоиламино)фенокси)бутановая кислота;
4-(2-(15-метилсульфонилизогексадеканоиламино)фенокси)бутановая кислота;
4-(2-(14-н.-пропилтиотетрадеканоиламино)фенокси)изобутановая кислота;
4-(2-(13-н.-бутилсульфинилтридеканоиламино)фенокси)валериановая кислота;
4-(2-(12-втор.-бутилтиододеканоиламино)фенокси)валериановая кислота;
4-(2-(11-изобутилсульфонилизодеканоиламино)фенокси)валериановая кислота;
4-(2-(11-трет.-бутилтиоундеканоиламино)валериановая кислота;
4-(2-(10-этилсульфинилдеканоиламино)валериановая кислота;
4-(2-(9-изопропилтиононаноиламино)фенокси)валериановая кислота;
4-(2-(9-трет.-бутилтиононаноиламино)фенокси)бутановая кислота;
6-(2-(9-метилтиононаноиламино)фенокси)капроновая кислота;
6-(2-(8-этилтиооктаноиламино)фенокси)капроновая кислота;
6-(2-(7-изопропилтиоизооктаноиламино)фенокси)капроновая кислота;
7-(2-(7-метилгептаноиламино)фенокси)энантовая кислота;
7-(2-(6-метилсульфинилгексаноиламино)фенокси)энантовая кислота;
7-(2-(5-метилсульфонилизогексаноиламино)фенокси)энантовая кислота;
2-(2-(12-н.-пропилтиододеканоиламино)фенокси)уксусная кислота;
2-(2-(11-н.-бутилсульфинилундеканоиламино)фенокси)уксусная кислота;
2-(2-(10-втор.-бутилтиодеканоиламино)фенокси)уксусная кислота;
3-(2-(9-изо-бутилсульфонилнонаноиламино)фенокси)пропионовая кислота;
3-(2-(2-трет.-бутилтиододеканоиламино)фенилтио)пропионовая кислота;
3-(2-(11-этилсульфинилундеканоиламино)фенилтио)пропионовая кислота;
4-(2-(11-изопропилтиоундеканоиламино)фенилтио)бутановая кислота;
4-(2-(11-метилтиоундеканоиламино)-4-метилтиофенокси)бутановая кислота;
5-(2-(11-изопропилтиоундеканоиламино)фенилтио)валериановая кислота;
5-(2-(10-метилтиодеканоиламино)фенилтио)валериановая кислота;
5-(2-(9-метилсульфинилнонаноиламино)фенилтио)валериановая кислота;
5-(2-(12-метилсульфинилдодеканоиламино)фенилтио)валериановая кислота;
5-(2-(11-н.-пропилтиодеканоиламино)фенилтио)валериановая кислота;
5-(2-(10-н.-бутилсульфинилдеканоиламино)фенилтио)валериановая кислота;
6-(2-(9-втор.-бутилтиононаноиламино)фенокси)капроновая кислота;
6-(2-(12-изо.-бутилсульфонилдодеканоиламино)фенилтио)капроновая кислота;
6-(2-(11-трет.-бутилтиоундеканоиламино)фенилтио)капроновая кислота;
7-(2-(11-этилсульфинилундеканоиламино)-3-метилфенилтио)энантовая кислота;
7-(2-(11-изопропилтиоундеканоиламино)-4-метилфенилтио)энантовая кислота;
7-(2-(12-метилтиододеканоиламино)фенокси)энантовая кислота;
4-(2-(11-фенилтиоундеканоиламино)-4-метилфенокси)бутановая кислота;
4-(2-(10-бензилтиоундеканоиламино)-3-метилфенокси)бутановая кислота;
4-(2-(9-метилтиононаноиламино)-5-метилфенокси)бутановая кислота;
4-(2-(12-метилсульфинилдодеканоиламино)-3-фенилтио)бутановая кислота;
4-(2-(10-н.-пропилтиоундеканоиламино)-4-метилфенокси)бутановая кислота;
4-(2-(9-н. -бутилсульфинилнонаноиламино)-5-фторметилфенилтио) бутановая кислота;
4-(2-(12-втор. -бутилтиододеканоиламино)-6-метилфенокси)бутановая кислота;
5-(2-(11-изобутилсульфонилундеканоиламино)-3-метилфенилтио)валериановая кислота;
4-(2-(11-трет. -бутилтиоундеканоиламино)-3-метилсульфонилфенокси) бутановая кислота;
4-(2-(11-этилсульфинилундеканоиламино)-4-метилсульфонил- фенилтио)бутановая кислота;
4-(2-(12-изопропилтиододеканоиламино)-5-этилфенокси)бутановая кислота;
4-(2-(11-метилтиоундеканоиламино)-4-фенилфенокси)бутановая кислота;
4-(2-(10-этилтиододеканоиламино)-3,5-диметилфенокси)бутановая кислота;
4-(2-(9-изопропилтиононаноиламино)-4-фтор-фенокси)бутановая кислота;
4-(2-(12-метилтиододеканоиламино)-5-трифторметилфенокси)бутановая кислота;
4-(2-(11-изопропилтиоундеканоиламино)фенокси)бутановая кислота;
4-(2-(11-этилтиоундеканоиламино)фенилтио)бутановая кислота;
4-(2-(9-изопропилтиононаноиламино)фенокси)бутановая кислота;
4-(2-(10-изо.-пропилтиододеканоиламино)фенокси)бутановая кислота;
4-(2-(12-изо.-пропилтиододеканоиламино)фенокси)бутановая кислота;
4-(2-(13-бутилтиотридеканоиламино)фенокси)бутановая кислота;
4-(2-(15-трет.-бутилтиопентадеканоиламино)фенокси)бутановая кислота;
5-(2-(11-изопропилтиоундеканоиламино)фенокси)валериановая кислота;
4-(2-(11-этилсульфинилундеканоиламино)фенокси)бутановая кислота;
4-(2-(11-изопропилсульфонилундеканоиламино)-4-метилфенокси) бутановая кислота;
4-(2-(11-этилсульфинилундеканоиламино)-5-метилфенокси)бутановая кислота.
Все соединения, описанные выше в изобретении и полученные в соответствии со способами, приведенными выше, как уже говорилось, могут быть использованы для лечения ДГПЖ в сочетании с альфа-адренергическим блокатором путем приема орально, парентерально или путем местного применения.
В данном изобретении блокатор αI- адренергического рецептора и ингибитор 5α- редуктазы могут быть назначены в сочетании или путем раздельного применения, или в виде одной комбинированной фармацевтической рецептуры при оральном или парентеральном введении. Предпочтительно блокатор αI- адренергического рецептора и ингибитор 5α- редуктазы применяются орально в виде отдельных препаратов.
Количество каждого использующегося компонента определяется в соответствии с клиническим анализом этиологии и серьезности болезни, состояния пациента и его возраста, эффективности каждого компонента и т.д.
Препарат αI блокатора обычно назначается в соответствии с последним справочником Physician's Desk Reference (PDR), который публикуется medical Economics Co., Inc. of Oradell^ NJ 07649. Интервалы доз, указанные в данном описании, взяты из PDR44 (публ. 1990). Например, теразозин назначается в дозе приблизительно от 1 до 10 мг один (q.d.) раз в день, тогда как празолин назначается дважды в день (b.i.d.).
Препарат ингибитора 5α- редуктазы назначается в дозах приблизительно 5 мг в день при приеме один раз в день (q.d.).
В предпочтительном воплощении изобретения αI- блокатор представляет собой теразозин, который назначается для орального применения мужчинам в виде одной дневной дозы около 5-10 мг, а ингибитор 5α- редуктазы представляет собой финастерид, который назначается для орального применения в виде одной дневной дозы около 5 мг.
Блокатор αI- адренергического рецептора и ингибитор 5α- редуктазы могут быть объединены в одной дозе в форме, приемлемой для орального или парентерального применения. Для орального применения удобными формами являются таблетки, капсулы или caplets. Такие препараты, используемые в изобретении, обычно получают с добавлением обычного фармацевтического наполнителя, например лактозы, подвергнутой распылительной сушке, и стеарата магния, в виде таблеток или капсул, предназначенных для орального применения. Одно или несколько активных веществ, с или без добавления вспомогательных активных соединений, могут быть получены в виде таблеток или драже путем смешения твердого, измельченного носителя, такого как цитрат натрия, карбонат кальция или дикальцийфосфат, и связующего вещества, например такого, как поливинилпирролидон, желатин или производные целлюлозы, при добавлении при необходимости смазочного вещества, такого как стеарат магния, лаурилсульфат натрия, "карбонакс" или полиэтиленгликоль. Конечно, в препараты, предназначенные для орального применения для улучшения вкусовых качеств могут быть добавлены соответствующие вещества.
В качестве других форм применения можно использовать закрытые капсулы, например, из твердого желатина, а также закрытые мягкие желатиновые капсулы, содержащие размягчитель или пластификатор, например глицерин. Закрытые капсулы содержат активный ингредиент в форме гранулята, например смесь наполнителя. Такого как лактоза, сахароза, маннитол, крахмал, например картофельный или амилопектиновый, производные целлюлозы или высокодиспергированную кремниевую кислоту. В мягких капсулах активное вещество предпочтительно растворено или суспендировано в подходящей жидкости, такой как растительное масло или жидкий полиэтиленгликоль.
Активные компоненты, используемые в соответствии с изобретением, могут быть также рецептурированы в препарате для одноразового использования в день или в препарате с постоянным выделением с помощью обычных методик, известных в данной области.
Вместо орального применения активные соединения могут быть использованы парентерально. В таких случаях используется раствор активного вещества, например в кунжутном (сезамовом) масле или в оливковом масле.
При проведении описанного выше лечения по описанному режиму, симптомы ДГПЖ, в том числе увеличение объема предстательной железы, никтурия, повышенная нерешительность, уменьшение мочевого потока, уменьшаются.
Для определения результата лечения предстательной железы измеряются концентрации тестостерона (Т), дигидротестостерона (ДГТ) и кислотной фосфатазы предстательной железы (КФ) в кровяной плазме, а также объем предстательной железы. Уменьшение концентрации ДГТ и АФ и восстановление объема предстательной железы свидетельствуют об успешном проведении лечения. Концентрация указанных выше компонентов в кровяной плазме может быть измерена стандартными методами, известными квалифицированным в данной области специалистам (см. , например, работу Р. Нери и М.Монахана, Invest & Urology, 1972, 10, 123-130 для АФ и работу Е.Неймлея и Д.Л.Лориакса, Z Klin. Biochem. 1972, 4, 164 для радиоиммунологического определения Т).
Объем предстательной железы измеряется путем ректальной оценки и/или путем трансректального ультразвукового исследования. Объективная оценка результата лечения также производится физическими методами, которые хорошо известны квалифицированным в данной области специалистам, например, с помощью изобретения, полученного с использованием ядерного магнитного резонанса, а также путем физического обследования.
При использовании условий, аналогичных условиям, описанным выше, клинические испытания по влиянию сочетания финастерида и теразозина, покажут даже более эффективное влияние на смягчение симптомов ДГПЖ у пациента, которое будет выше, чем влияние любого отдельного соединения.
Способ получения соединений изобретения, который был описан выше для общего случая, дополнительно иллюстрируется следующими примерами, которые, однако, не следует рассматривать как ограничивающие объем изобретения.
Часть 1
Пример 1. Метил-3-оксо-4-аза -5α- андрост-1-ен -17β- карбоксилат
Суспензию 83,7 г метил-3-оксо-4-аза -5α- андрост-1-ен -17β- карбоксилата (Rasmusson Johnston and Arth, Пат. США 4377584, 22 марта 1983) и 126,5 г бензолселенового ангидрида в 2,09 л хлорбензола кипятили 2 ч. Конденсирующий холодильник заменяли на перегонную колонку и из смеси медленно удаляли воду, образовавшуюся в ходе реакции (2 ч). Раствор упаривали и получали 198 г влажного осадка. Остаток в виде раствора в дихлорметане промывали насыщенным водным раствором NaHCO3 и насыщенным раствором NaCl, затем сушили и упаривали. Получали 172,4 г. Полученный продукт хроматографировали на 2,56 кг силикагеля (элюент - вначале дихлорметан (5 л), а затем смесь дихлорметан/ацетон, 4:1). Желаемый продукт вымывали 8 л и получали 53,4 г продукта, который промывали диэтиловым эфиром и сушили, получали 49,5 г указанного соединения, т. пл. 278-280oC. Аналогичным образом следующие соединения были превращены в их соответствующие 1,2-ненасыщенные производные: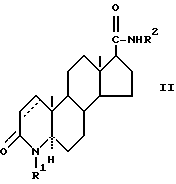
1a R = CONHC(CH3)3 252-254oC;
1b R = CONHO(CH3)2CH2C(CH3)3 224-226oC.
Пример 2. Метил 4-метил-3-оксо-4-аза -5α- андрост-1-ен -17β- карбоксилат
Суспензию 25 г продукта примера 1 и 2,25 г гидрида натрия в 500 мл сухого диметилформамида перемешивали в атмосфере азота в течение 15 мин. По каплям добавляли метилиодид (1 мл) и полученную смесь перемешивали в течение 30 мин при комнатной температуре. Затем добавляли еще 5 мл метилиодида и смесь выдерживали при 50oC в течение 2 ч. После охлаждения смесь разбавляли водой до 2 л. Отделяли твердый осадок, получали 25,4 г продукта, т.пл. 159-161oC.
Аналогичным способом следующие соединения были превращены в соответствующие 4-метилпроизводные:
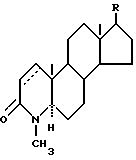
2a R = CONHC(CH3)2CH2C(CH3)3, андростен 148-150oC;
2b R = CONHC(CH3)3, -1-андростен 153-155oC;
2c R = CONHC(CH3)2CH3O(CH3)3, -1-андростен 168-170oC.
Пример 3. S-(2-пиридил)-4-метил-3-оксо-4-аза-5α- андрост-1-ен -17β- карбоксилат
Суспензию 25 г продукта примера 2 в 125 мл метанола обрабатывали раствором KOH (*12,5 г) в 12,5 мл воды. После кипячения в течение 4 ч реакционную массу подкисляли с помощью 6NHCl и затем разбавляли водой. Отделяли сырую кислоту (23,32 г) и сушили, получали продукт с т.пл. 300oC.
Неочищенную сухую кислоту (23 г), трифенилфосфин (36,4 г) и 2,2,-дипиридилсульфит (30,4 г) суспендировали в 138 мл толуола при перемешивании в течение 3 ч при комнатной температуре. Реакционную массу хроматографировали на колонке с 4,5 кг силикагеля (элюент этилацетат/ацетон, 9:1), получали 2,4 г продукта, т.пл. 218-220oC.
Дальнейшее элюирование ацетоном приводило к выделению 5,2 г побочного продукта присоединения метанола S-(2-Пиридил)- 1α- метокси-4-метил-3-оксо-4-аза -5α- андрост-1-ен -17β- карбоксилата, т.пл. 221-223oC.
3A. По аналогичной методике продукт примера 1 превращали в S-(2-пиридил)-3-оксо-4-аза -5α- андрост-1-ен -17β- карбоксилат, т.пл. 230-232oC.
3B. По аналогичной методике метил 3-оксо-4-аза -5α- андрост-1-ен -17β- карбоксилат превращали в S-(2-пиридил)- 3-оксо-4-аза- 5α- андрост -1-ен -17β- тиокарбоксилат, т.пл. 232 - 234oC.
Пример 4. N-трет. -бутил 4-метил-3-оксо-4-аза -5α- андрост-1-ен -17β- карбоксамид
Безводный трет. -бутиламин добавляли к суспензии 2,5 г пиридилтиоэфира примера 3 в 70 мл тетрагидрофурана. Через 60 мин полученный раствор упаривали, остаток хроматографировали на 125 г силикагеля (элюент этилацетат/дихлорметан, 20:1), получали 1,5 г продукта, т.пл. 152 - 154oC.
При повторении реакции с использованием другого амина и пиридилтиоэфира получали следующие соединения:
4b N-трет. -бутил 3-оксо-4-аза -5α- -андрост-1-ен -17β- карбоксамид, т. пл. 275 - 276oC.
4c N-(2,4,4-приметил-2-пентил 3-оксо-4-аза -5α- андрост-1- ен -17β- карбоксамид, т.пл. 168-170oC
Пример 5. 5-оксо-3,5-секоэтиан-3,20-диовая кислота
К раствору 200 г 3-оксо-4-этиен -17β- овой кислоты в 375 л трет.-бутанола при 80oC добавляли раствор 198,4 г карбоната натрия в 474 мл воды. Затем добавляли теплый (65oC) раствор 948,5 г метапериодата натрия и 6,96 г перманганата в 5,5 г воды с такой скоростью, чтобы температура реакционной смеси сохранялась на уровне 80oC. Затем смесь кипятили в течение 1 ч и
выдерживали при комнатной температуре в течение ночи. Неорганические соли отфильтровывали и осадок на фильтре промывали 225 мл воды. Для уменьшения количества присутствующего йода добавляли 5%-ный водный раствор бисульфита натрия. Трет.-бутанол удаляли в вакууме, а водный остаток подкисляли концентрированной соляной кислотой. Отделившуюся смолу экстрагировали дихлорметаном и промывали 5%-ным водным раствором бисульфита натрия, затем сушили и упаривали до бесцветного остатка (214 г). При суспендировании остатка в эфире получали кристаллический продукт, который промывали гексаном, выход 152 г. т.пл. 169-192oC.
Пример 5B. 3-оксо-4-аза-5-этиен-20-овая кислота
Суспензию 64,7 г диовой кислоты со стадии 5 в 350 мл этиленгликоля обрабатывали 80 мл жидкого аммиака. Полученный раствор нагревали со скоростью 3o/мин до 180oC и выдерживали при этой температуре в течение 15 мин. После охлаждения добавляли 1 л воды и смесь подкисляли 10%-ной соляной кислотой до pH 1,5. Продукт выделяли и промывали водой, а затем сушили на воздухе. Получали 57,5 г продукта, т.пл. 310oC.
Пример 5C. 3-оксо-4-аза-5 α- этиен-2O-овая кислота
Раствор 136 г 5-кислоты примера: Б в 16,32 мл уксусной кислоты гидрировали при 60oC в присутствии платинового катализатора (16,32 г PtO2) при давлении 40 фунтов/кв.дюйм в течение 3 ч. Катализатор удаляли, раствор концентрировали и получали 128,2 г сырого продукта. Продукт промывали 3 л воды, затем сушили на воздухе. Получали 125 г белого твердого продукта, т.пл. 310oC.
Этот продукт также получали омылением метил-3-оксо-4-аза-5-андростан -17β- карбоксилата (метил-3-оксо-4-аза -5α- этиен -17β- оата) в 7%-ном растворе гидроксида калия в метаноле с последующим подкислением.
Пример 5D. N-(2,4,4-триметил-2-пентил)-3-оксо-4-аза -5α- андростан- 17β- карбоксамид
Раствор 5 г продукта примера 50, 3,35 г дициклогексилкарбодиимида и 3,18 г 1-гидроксибензотриазола в 500 мл дихлорметана перемешивали при комнатной температуре в течение ночи. Твердый продукт отфильтровывали и фильтрат обрабатывали 2,4,4-триметил-2-пентиламином (трет.-оксиламин). Полученный раствор выдерживали при комнатной температуре в течение 64 ч.
Небольшое количество твердого продукта отделяли, а раствор промывали последовательно 10%-ным водным раствором гидроксида натрия, 10%-ной соляной кислотой и насыщенным водным раствором хлорида натрия. Органический слой сушили, концентрировали и пропускали через 240 г силикагеля (элюент ацетон/дихлорметан, 3:7), получали 5,5 г продукта, т.пл. 250-251oC.
Пример 5E. Повторяли пример 5D с использованием трет.-бутиламина вместо 2,4,4-триметил-2-пентиламина и получали N-(трет. -бутил)-3-оксо-4-аза- 5α- андростан - 17β- карбоксамид, т.пл. 274-276oC.
Пример 6. Синтез 17β- (N-1-адамантилкарбамоил)-4-аза- 5α- индрост-1-ен--3-она
Суспендировали 100 г 17-метилового эфира (0,305 ммоль) примера 1 в 3,0 мл ТГФ (высушенного над молекулярными ситами 3А) и затем добавляли 183,0 мг 1-адамантанамина (1,2 ммоль). Суспензию охлаждали до 5-10oC и затем добавляли 590 кмл 2,0 М раствора Et Mg Br в ТГФ. Полученную смесь перемешивали в течение 10 мин, а затем кипятили 1-2 ч в атмосфере азота. Смесь охлаждали до 0oC и затем добавляли насыщенный раствор NH4Cl (приблизительно 10 мл). Органический слой экстрагировали тремя объемами метиленхлорида.
Органические слои объединяли, промывали дважды водой, трижды насыщенным раствором хлорида натрия и сушили MgSO4, после чего фильтровали и упаривали в вакууме досуха. Остаток кристаллизовали в этилацетате и получали 75,0 мг продукта. Перекристаллизовывали из метанола и сушили при 110oC в течение 2 ч/0,1 мм, получали продукт, т.пл. 305-306oC.
Молекулярный вес (FAB) - M+ = 451;
Вычислено = 451
Элементный анализ: для C29H42N2O2
Вычислено, %: C 77,28; H 9,40; N 6,21;
Найдено, %: C 76,84; H 9,73, N 5,93.
Пример 7. Синтез 17β- (N-2-адамантилкарбамоил)-4-аза- 5α- андрост-1-ен-3-она
По методике, описанной в примере 6, но с использованием 2-адамантанамина (получен при нейтрализации в воде гидрохлорида с последующими экстракцией и выделением) вместо 2-адамантанамина, и при кипячении в течении 7 ч вместо 1-2 ч получали названное соединение, т.пл. 284 - 285oC.
Пример 8. Синтез 17β- (N-1-адамантилкарбамоил)-4-аза- 5α- андростан-3-она
100 мг адамантильного производного, полученного в примере 6, растворяли в 5,0 мл сухого ТГФ. Добавляли 300 мл 5%-ного Pd/C и смесь гидрировали в течение 6 ч при комнатной температуре и давлении 40 фунтов/кв. дюйм. Смесь фильтровали через целиты, осадок на фильтре промывали ТГФ (3 раза) и растворитель упаривали в вакууме, получали 97,0 мг сырого продукта. В спектре ЯМР отсутствовал сигнал олефиновых протонов. Сырой продукт наносили на колонку с 15,0 г силикагеля и элюировали смесью метиленхлорид/ацетон, 1:1.
Собирали фракции, в которых по данным ТСХ содержался один продукт, получали 77,98 мг. Спектр ЯМР соответствовал предложенной структуре. Перекристаллизация из этилацетата давала 65,59 мг названного продукта, т.пл. 323-324oC.
Элементный анализ для C29H44N2O2• 1/4H2O
Вычислено,%: C 76,18; H 9,81; N 6,13;
Найдено, %: C 75,91; H 9,93; N 6,06.
Пример 9. Синтез 17β- (N-1-адамантилкарбамоил)-4-метил-4-аза -5α- андрост-1-ен-3-она
120 мг тиопиридилового эфира примера 3 суспендировали в 20 мл сухого ТГФ и к суспензии добавляли 175 мг 1-адамантанамина (атмосфера азота). Реакцию проводили при комнатной температуре в течение 16 ч в атмосфере азота. Контроль за ходом реакции осуществляли с помощью тонкослойной хроматографии на двуокиси кремния, элюент ацетон/гексан, 1:1. Продукт выделяли с помощью ТСХ на пластинах 20 см х 20 см х 1000 мкм двуокиси кремния, элюент ацетон/гексан, 1:1. Продукт кристаллизовали этилацетатом, получали 50,0 мг чистого соединения, т.пл. 202-205oC.
Молекулярный вес (FAB) -M+ = 465;
Вычислено = 465.
Перекристаллизация давала 19,14 мг чистого продукта, т.пл. 202-202,5oC.
Элементный анализ для C30H44N2O2 •H2O
Вычислено,%: C 74,44; H 9,60; N 5,80;
Найдено,%: C 74,32; H 9,47; N 5,89.
Пример 10. Гидролиз 4-метил-3-оксо-4-аза -5α- андростан -17β- карбоксилата
Исходный продукт примера 1 17β- андростанкарбоксилат гидролизовали с помощью 7%-ного раствора KOH в изопропаноле или в метаноле, с последующей обработкой кислотой. Получали соответствующую кислоту, которую использовали в примере 11.
Пример 11. N-(1-адамантил)-3-оксо-4-аза -5α- андростан -17β- карбоксамид
Раствор 5,0 г продукта примера 10, 3,35 г дициклогексилкарбодиимида и 3,18 г 1-гидроксибензтриазола в 500 мл дихлорметана перемешивали при комнатной температуре в течение ночи. Твердый продукт отфильтровывали и фильтрат обрабатывали 1-адамантамином. Полученный раствор выдерживали при комнатной температуре в течение 64 ч, фильтровали и фильтра промывали последовательно 10%-ным водным раствором гидроксида натрия, 10%-ной соляной кислотой и насыщенным водным раствором хлорида натрия. Органический слой сушили MgSO4, концентрировали и пропускали через 240 г силикагеля (элюент ацетон/дихлорметан, 3:7), получали 5,5 г продукта, т.пл. 323-324oC.
Пример 12. Синтез бензтриазол-1-ил-3-оксо-4-метил-4-аза -5α- андрост-1-ен -17β- карбоксилата
Суспензию 83,7 г метил-3-оксо-4-метил-4-аза -5α- андростан- 17β- карбоксилата (см. Расмуссон и др., J.Med.Chem., 1986, 29, pp. 2298-2315) гидролизовали 7%-ным метанольным раствором KOH, подкисляли и получали соответствующую 17β- карбоновую кислоту.
Кислоту легко превращали в бензтриазол-1-ил-3-оксо- 4-метил-4-аза- -5α- андрост-1-ен- -17β- карбоксилат, описывали в примере 13.
Активированный эфир (бензтриазоильное производное) очищали с помощью ТСХ (4 пластины, 20 х 20 см х 1000 мкм двуокиси кремния), элюент MeOH/CHCl3, 4: 96. Выделенный продукт промывали эфиром и получали активированный эфир, т. пл. 198-200oC (разл.).
Пример 13. Синтез 17β- (N-1-адамантилкарбамоил)-4-метил-4-аза -5α- андростан-3-она
Растворяли 100,0 мг 4-метил-4-аза-бензтриазольного производного, получение которого описано в примере 12, в 20,0 мл метиленхлорида. К прозрачному раствору добавляли 127 мг 1-адамантамина. Реакционную массу перемешивали в течение ночи при комнатной температуре в атмосфере азота.
Кристаллизация из этилацетата после фильтрования через Teflon Acrodisk CR давала 26,32 мг продукта, т.пл. 210-217oC. Продукт дополнительно очищали на колонке с 1 г силикагеля (EM силикагель), элюент ацетон/гексан, 1:1 перекристаллизовывали из этилацетата, получали 21,75 мг названного продукта в виде белых иголочек, т. пл. 203-205oC.
Элементный анализ для C30H46N2O2• 1,5H2O:
Вычислено,%: C 73,58; H 9,68; N 5,62;
Найдено,%: C 73,15; H 9,30; N 5,67.
Пример 14. Диастериомерный синтез 17β- (N-экзо-2-норборнанилкарбамоил)-4-аза -5α- андрост-1-ен-3-она
В 3,0 мл сухого ТГФ в атмосфере азота растворяли 100,0 мг соответствующего 4-H-тиопиридилового эфира примера 3, полученного по методике примера 3, но с использованием 4-H-метилового эфира примера 1 (см. Расмуссон и др., J. Med. Chem. , 1986, 29, pp. 2298-2315). К прозрачному раствору добавляли 477 мкл (±) -рацемата экзо-2-аминонорборана. Реакционную массу выдерживали в течение 16 ч при комнатной температуре в атмосфере азота и упаривали в вакууме. Остаток растворяли в хлороформе и промывали 2,5 н. соляной кислотой (три раза), водой (три раза) и насыщенным раствором хлорида натрия (три раза), сушили MgSO4, фильтровали и упаривали в вакууме досуха. Получали 56,3 мг рацемической диасрериомерной смеси.
Сырой продукт хроматографировали с использованием ТСХ (2 пластины, 20 см х 20 см х 50 мкм силикагеля), элюент хлороформ/ацетон, 70:30, получали 43,4 мг названного продукта. После перекристаллизации из этилацетата получали 30 мг продукта, т.пл. 245-245,9oC.
Спектр ЯМР (CDCl3) соответствовал предложенной структуре.
Масс-спектр (FAB):
Вычислено: для C26H38N2O2: m/e 411;
Найдено: 411.
Элементный анализ для C26H38N2O2 •H2O:
Вычислено,%: C 72,82; H 9,40; N 6,58;
Найдено,%: C 73,21; H 9,20; N 6,25.
Пример 15. Синтез 17β- (N-1-адамантилметилкарбамоил)-4-аза -5α- андрост-1-ен-3-она
В 2,0 мл сухого ТГФ суспендировали 200,0 мг 4-H-тиопиридилового аза-стероида, использовавшегося в примере 14.
К полученной суспензии добавляли 400 мкл 1-аминометиленадамантана с помощью шприца при комнатной температуре в атмосфере азота. Через несколько минут получали прозрачный желтый раствор, а через 0,5 ч образовывался осадок. Реакционную массу выдерживали в атмосфере азота в течение ночи, разбавляли метиленхлоридом, промывали дважды 10%-ным раствором гидроксида натрия, дважды водой, а затем дважды 10%-ной соляной кислотой и снова дважды водой и дважды насыщенным раствором хлористого натрия.
Органический слой сушили сульфатом магния, фильтровали, упаривали в вакууме и получали продукт, спектр ЯМР которого соответствовал предложенной структуре. После перекристаллизации из этилацетата получали 149,0 мг продукта, т.пл. 255-257oC (разл.).
Масс-спектр (FAB):
Вычислено: m/e 411;
Найдено: 411.
Пример 16 Синтез 17β- (N-2-адамантилкарбамоил)-4-аза -5α- андростан-3-он
Смесь 1,09 г 17β- (N-2-адамантилкарбамоил)-4-аза -5α- андрост-1-ен-3-она (пример 10), 150 мл этанола и 1,0 г 30%-ного Pd/C гидрировали в течение ночи при встряхивании и при давлении 45 фунтов/кв. дюйм. Суспензию фильтровали для отделения катализатора и фильтрат упаривали досуха, получали серый остаток. Этот остаток хроматографировали на колонке с 200 мг силикагеля (элюент ацетон/метиленхлорид), получали 1,0 г твердого продукта, т.пл. 294-296oC.
Элементный анализ для C29H44N2O2 • 0,2H2O:
Вычислено, %: C 76,33; H 9,80; N 6,14;
Найдено, %: C 76,23; H 9,86; N 5,92.
Масс-спектр (электронный удар) -М, вес 452.
Пример 17. Синтез 17β- (N-2-адамантилкарбамоил)-4-метил-4-аза -5α- андрост-1-ен-3-она
Суспензию 500 мг 17β- (N-2-адамантилкарбамоил)-4-аза -5α- андрост-1-ен-3-она, полученного в примере 16, 10 мл ДМФА, высушенного над ситами и 140 мг NaH перемешивали при 170oC в атмосфере азота в течение 18 ч. Охлаждали до комнатной температуры и затем по каплям при перемешивании добавляли 0,4 мл метилиодида и реакционную массу перемешивали при 50oC в течение 3 ч. Затем реакционную массу охлаждали до комнатной температуры и добавляли 15 мл воды. Смесь экстрагировали метиленхлоридом (3 х 20 мл). Органические слои объединяли, промывали рассолом, сушили и упаривали. Получали белый кристаллический остаток. После перекристаллизации их смеси этилацетат/метиленхлорид получали чистый белый твердый продукт, т.пл. 246-248oC.
Элементный анализ для C30H44N2O2 • 0,3H2O:
Вычислено,%: C 76,65; H 9,56; N 5,96;
Найдено,%: C 76,50; H 9,75; N 5,84.
Масс-спектр: Молекулярный вес 464.
Пример 18. Синтез 17β- (N-2-адамантилкарбамоил)-3-оксо-4-метил-4-аза -5α- андростана
17β- - (N-2-адамантилкарбамоил)-4-метил-4-аза -5α- андрост-1-ен-3-он (200 мг), полученного в примере 17, добавляли к 25 мл абсолютного этанола, содержащего 200 мг 30%-ного Pd/C (катализатор гидрирования). Суспензию встряхивали в течение ночи при давлении водорода 40 фунтов/кв.дюйм. Суспензию фильтровали и фильтрат упаривали досуха. Остаток перекристаллизовывали из горячего этилацетата, получали белый кристаллический продукт, т.пл.113-115oC.
Элементный анализ для C32H45N2O3 • 0,5EtOAc:
Вычислено,%: C 75,25; H 9,86; N 5,48;
Найдено,%: C 75,07; H 9,52; N 5,28.
Масс-спектр: Молекулярный вес 466 (для несольватированной молекулы).
Пример 19. Синтез 17β- (N-метил-N-2-адамантилкарбамоил)-4-метил-4-аза -5α- андрост-1-ен-3-она
17β- (N-2-адамантилкарбамоил)-4-аза -5α- андрост-1-ен-3-он (5,0 г) и 1,5 г гидрида натрия в 100 мл сухого ДМФА перемешивали в атмосфере сухого азота в течение 3 ч при 40oC. Реакционную массу охлаждали до комнатной температуры и по каплям добавляли приблизительно 4 мл метилиодида. Перемешивали при комнатной температуре в течение 1 ч. Реакционную массу затем охлаждали на ледяной бане и добавляли большое количество воды - приблизительно 250 мл. Водную смесь экстрагировали метиленхлоридом (3 х 100 мл), органические слои объединяли, промывали водой, рассолом, упаривали досуха и получали сырой продукт. Высокоэффективная жидкостная хроматография полученного продукта (силикагель, элюент ацетон/метиленхлорид, 10: 1), дает два пика, имеющие время удерживания 3 CV(B) и 3,8 CV(A). Пик(А) был идентифицирован как 4-метилированный продукт примера 15. Второй пик продукта (В) был идентифицирован как 4-метилированный 17β- (N-2-адамантилкарбамоильный аналог, то есть необходимое соединение: т.пл. 163-165oC.
Элементный анализ для C31H46N2O2:
Вычислено,%: C 77,77; H 9,68; N 5,86;
Найдено,%: C 77,29; H 9,79; N 5,77
Масс-спектр: Молекулярный вес 478.
Пример 20. Синтез 17β- (N-метил-N-2-адамантилкарбамоил)-4-аза-4-метил-андростан-3-она
Сырую реакционную смесь примера 19 (4,6 г) растворяли в 200 мл этанола, содержащего 1,0 г 30%-ного Pd/C, и гидрировали при давлении водорода 40-45 фунтов/кв. дюйм при комнатной температуре в течение ночи. Смесь фильтровали, остаток промывали этанолом. Этанольный раствор упаривали досуха и получали сырой продукт. После перекристаллизации из смеси метиленхлорид/ диэтиловый эфир/гексан получали 800 мг чистого монометилового эфира эндростанового соединения примера 16, т.пл. 113 - 115oC. Второй и третий выходы продукта, получаемые при перекристаллизации, объединяли с маточным раствором и подвергали ВЭЖХ, как и в примере 17. Получали диметилированное производное названного соединения, т.пл. 180 - 182oC.
Элементный анализ для C31H48N2O2:
Вычислено,%: C 77,45; H 10,06; N 5,83;
Найдено,%: C 77,26; H 9,87; N 5,82.
Масс-спектр: Молекулярный вес 478.
Пример 21. N-трет.-бутил андрост -3,5-диен- -17β- карбоксамид-3-карбоновая кислота
(a) N-трет.-бутил андрост -3,5-диен-3-бром -17β- карбоксамид
К раствору щавелевой кислоты (0,0011 моль, 0,1 г) и оксалилбромида (0,0211 моль, 3 мл) в 15 мл толуола, высушенного над молекулярными ситами, добавляли в течение 1 ч 1 г (0,003 моль) андрост -4-ен-3-он -17β- карбоновой кислоты. Реакционную массу перемешивали при комнатной температуре в течение 2 ч и затем концентрировали в вакууме. Избыток оксалилбромида удаляли путем азеотропной отгонки с толуолом в вакууме. Получаемое коричневое масло растворяли в толуоле, охлаждали до 0oC и по каплям в течение 15 мин добавляли 10 мл трет.-бутиламина (7,0 г) в 30 мл толуола. После окончания прибавления реакционную массу перемешивали при 0oC в течение 15 мин, а потом выдерживали при -20oC в течение 19 ч. Затем реакционной массе давали нагреться до комнатной температуры и перемешивали ее при 25oC еще 1 ч. Летучие продукты удаляли в вакууме. Остаток обрабатывали смесью хлороформ/вода, встряхивали и образовавшиеся слои разделяли. Водный слой дважды экстрагировали хлороформом. Хлороформенные экстракты объединяли, дважды промывали водой и сушили безводным сульфатом магния. Сырой продукт очищали быстрой хроматографией на силикагеле, элюент - 20%-ный этилацетат в гексане.
Получали 1,06 г названного соединения в виде белого твердого вещества.
(б) N-Трет.-бутил андрост-3,5-диен -17β- карбоксамид-3-карбоновая кислота
К раствору N-трет.-бутил андрост-3,5-диен-3-бром -17β- карбоксамида (0,5 г, 0,00115 моль) в 5 мл тетрагидрофурана, охлажденного до -78oC (баня сухой лед/ацетон) в атмосфере аргона, добавляли по каплям 1,5 мл (0,00375 моль) 2,5 М раствора н.-бутиллития в гексане. Реакционную массу перемешивали при этой температуре в течение 1 ч и затем в течение 45 мин в реакционную массу пропускали диоксид углерода через колонку, наполненную концентрированной серной кислотой. Реакционной смеси давали нагреться до комнатной температуры и разбавляли водой, водной соляной кислотой и хлороформом. Полученную смесь встряхивали и слои затем разделяли. Водный слой экстрагировали дважды хлороформом. Объединенные органические экстракты дважды промывали водой, один раз рассолом и затем сушили безводным сульфатом магния. Растворитель упаривали в вакууме и получали 0,6 г сырого твердого продукта. Продукт суспендировали в гексане и выделяли белый твердый продукт (0,43 г). После перекристаллизации из ацетонитрила получали названное соединение, т.пл. 247-250oC.
Часть 2.
Пример 1. Метил 3-оксо-4-аза -5α- андрост-1-ен -17β- карбоксилат
Суспензию метил 3-оксо-4-аза -5α- андростан-17-карбоксилата (Rasmusson Johnston and Arth Пат. США 4377584, 22 марта 1983) и 126,6 г бензолселенового ангидрида в 2,09 л хлорбензола кипятили 2 ч. Конденсирующий холодильник заменяли на перегонную колонку и из смеси медленно удаляли воду, образовавшуюся в ходе реакции (2 ч.). Раствор упаривали и получали 198 г влажного осадка. Остаток в виде раствора в дихлорметане промывали насыщенным водным раствором NaHCO3 и насыщенным раствором NaCl, затем сушили и упаривали. Получали 172,4 г. Полученный продукт хроматографировали на 2,56 кг силикагеля (элюент - вначале дихлорметан (5 л), а затем смесь дихлорметан/ацетон, 4:1). Желаемый продукт вымывали 8 л и получали 53,4 г продукта, который промывали диэтиловым эфиром и сушили, получали 49,5 г указанного соединения, т.пл. 278 - 280oC.
Пример 2. S-(2-пиридил)-3-оксо-4-аза -5α- андрост-1-ен- -17β- тиокарбоксилат
Суспензию 25,0 г вышеуказанного продукта примера 1 омыляли с помощью раствора 12,5 г KOH в 150 мл смеси метанол-вода 5:1 при кипячении в атмосфере азота в течение 4 ч. Смесь охлаждали до 25oC и подкисляли до pH < 2. При перемешивании добавляли 175 мл воды и получали осадок, который выделяли и промывали водой.
После сушки вес продукта составил 25 г, т.пл. 313 - 315oC (разл.).
Неочищенную сухую кислоту (23,0 г) суспендировали в 210 мл толуола и к полученной суспензии добавляли трифенилфосфин (56,0 г) и 2,2'-дипиридилдисульфид (48,3 г) и смесь перемешивали при 24oC в течение ночи в атмосфере азота. Реакционную смесь наносили на колонку с силикагелем (1,3 кг) и элюировали смесью ацетон/метиленхлорид, 1:1. Полученный после хроматографирования желаемый тиоэфир промывали эфиром, получали 36,8 г названного продукта, т. пл. 232-235oC.
Пример 3. 22-метил-4-аза-21-нор -5α- хол-1-ен-3,20-дион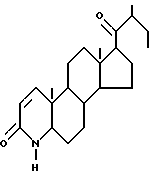
К раствору 7,2 г S-(2-пиридил)-3-оксо-4-аза -5α- андрост-1-ен -17β- тиокарбоксилата в 288 мл тетрагидрофурана при -78oC добавляли 33,6 мл 1,3 М раствора S-бутилмагнийхлорида. Через 30 мин выдерживания раствора при -78oC раствору давали нагреться до комнатной температуры и обрабатывали насыщенным водным раствором хлористого натрия. Продукт экстрагировали метиленхлоридом и промывали насыщенным водным раствором хлористого натрия, сушили и концентрировали. Остаток пропускали через колонку с 430 г силикагеля (элюент метиленхлорид/ацетон, 9:1). Получали 4,5 г продукта, т.пл. 246 - 249oC.
При повторении реакции с использованием реагентов получали продукт (см. таблицу)
Пример 4. 22-метил-4-аза-21-нор -5α- хол-1-ен-3,20-дион
альтернативный путь
Раствор 22-метил-4-аза-21-нор -5α- холан- 3,20-диона и 29,49 г бензолселенового ангидрида в 552 мл хлорбензола кипятили с отгонкой воды в течение 4 ч. Смесь концентрировали и остаток растворяли в метиленхлориде. Полученный раствор промывали 10%-ным водным раствором гидроксида натрия, затем 10%-ной соляной кислотой и насыщенным водным раствором хлористого натрия, сушили и упаривали. Получали 45 г желтого остатка. После хроматографирования на 1,5 кг силикагеля (элюент этилацетат) получали 10,6 г продукта, т.пл. 248 - 251oC.
При использовании в качестве исходного соединения 23-метил-4-аза-21-нор -5α- холан-3,20-диона получали 23-метил-4-аза-21-нор -5α- хол-1-ен-3,20- диод, т.пл. 283 - 286oC.
Пример 5. 17β- (фенилкарбонил)-4-аза -5α- андрост-1-ен-3-он
К суспензии 43 г S-(2-пиридил)-3-оксо-4-аза-5α- андрост-1-ен -17β- тиокарбоксилата в 500 мл безводного тетрагидрофурана (ТГФ) при -78oC и при перемешивании добавляли раствор 157 мл 2 н. раствора фенилмагнийбромида в течение 60 мин и перемешивали при этой температуре еще 60 мин. Затем температуру смеси повышали до -30oC и реакцию гасили с помощью 10%-ной соляной кислоты, поддерживая температуру ниже -20oC. После того как температура смеси поднималась до 0oC, к смеси добавляли 2000 мл воды и экстрагировали 4000 мл метиленхлорида несколькими порциями. Затем органический слой промывали последовательно водой, 1 н. раствором гидроксида натрия, водой и насыщенным водным раствором хлористого натрия, после чего сушили сульфатом магния и концентрировали в вакууме. Получали 37,5 г сырого продукта. После перекристаллизации из смеси метиленхлорид/этилацетат получали указанный фенилкетон (30,4 г, выход 77%), т.пл. 290 - 291oC.
Пример 6. 17β- 4-фторфенилкарбонил-4-аза -5α- андрост-1-ен-3-он
При повторении примера 5 с п-фторфенилмагнийбромидом в качестве реактива Гриньяра получали указанное соединение, т.пл. 315 - 315,5oC.
Пример 7. 17β- (циклогексилкарбонил)-4-аза -5α- андрост-1-ен-3-он
К суспензии 34,8 г тиопиридилового эфира примера 2 в 700 мл безводного ТГФ добавляли при -65oC 130 мл 2 М эфирного раствора циклогексилмагнийхлорида в течение 20 мин. Реакционную массу перемешивали при -70oC в течение 60 мин, после чего давали ей нагреться до -10oC и перемешивали при этой температуре еще 60 мин. Смесь разбавляли 500 мл метиленхлорида и затем по каплям добавляли воду. Образующиеся фазы разделяли и органический слой последовательно промывали водой, 1 н. раствором гидроксида натрия, снова водой и насыщенным раствором хлористого натрия. Органический слой обесцвечивали с помощью активированного угля, фильтровали и концентрировали в вакууме, полученный остаток перекристаллизовывали из этилацетата. Выделяли 28,2 г названного соединения, т.пл. 271,5 - 277oC.
Пример 8. Соединение примера 7 также может быть получено по следующей методике.
К смеси 150 г метил 3-оксо-4-аза- -5α- андрост-1-ен -17β- карбоксилата в 2800 мл безводного ТГФ при перемешивании при температуре ниже 0oC добавляли 678 мл 2 н. эфирного раствора циклогексилмагнийхлорида. Раствор кипятили 6 ч. После охлаждения до температуры менее 10oC реакционную смесь подкисляли 10%-ной соляной кислотой и экстрагировали метиленхлоридом. Органический слой промывали последовательно водой, насыщенным раствором бикарбоната натрия и насыщенным раствором хлористого натрия, после чего сушили безводным сульфатом магния и упаривали. Получали 163 г сырого циклогексилкетона. После перекристаллизации из смеси метиленхлорид/этилацетат получали 131 г чистого продукта, т.пл. 269 - 270oC.
Элементный анализ:
Вычислено, %: N 3,61; C 77,37; H 9,74;
Найдено,%: N 3,61; C 77,37; H 10,13.
Пример 9. 17β- (циклопентилкарбонил)-4-аза -5α- андрост-1-ен-3-он
При повторении методики примера 7 или 8 с использованием в качестве реагента циклопентилмагнийхлорида получали указанное соединение, т.пл. 272 - 273oC.
Элементный анализ:
Вычислено, %: N 3,66; C 76,25; H 9,60;
Найдено,%: N 3,78; C 74,89; H 9,54.
Пример 10. 17β- (циклобутилкарбонил)-4-аза -5α- андрост-1-ен-3-он
При повторении методики примера 7 или 8 с использованием в качестве реагента циклобутилмагнийхлорида получали указанное соединение, 288 - 289oC.
Элементный анализ:
Вычислено, %: N 3,94; C 77,71; H 9,36;
Найдено,%: N 3,87; C 78,06; H 9,61.
Пример 11. Синтез 17β- (4-фенилбензоил)-4-аза -5α- андрост-1-ен-3-она
К суспензии 258,0 мг сухих активированных магниевых стружек в 5 мл сухого ТГФ добавляли 932 мг 4-бромбифенила в 5 мл сухого ТГФ (атмосфера азота). Реакцию проводили на ультразвуковой бане при температуре 24 - 30oC. К хорошо перемешиваемой смеси по каплям добавляли 30 мл 1,2-дибромэтана (атмосфера азота). Реакционную массу выдерживали в течение 1-1,5 ч при 28oC (атмосфера азота). Концентрация реактива Гриньяра составляла 4,0 ммоль в 10 мл сухого ТГФ.
Стероид из примера 2 (205,0 мл, 0,5 ммоль тиопиридилового эфира) суспендировали в 2 мл сухого ТГФ, охлаждали до -80oC и к полученной суспензии с помощью шприца добавляли полученный ранее реактив Гриньяра (3,8 мл) за 5-10 мин (атмосфера азота). Реакционную массу выдерживали при -80oC (атмосфера азота) в течение 1 ч и затем еще 1 ч при -10oC (атмосфера азота). Раствор разбавляли 10,0 мл метиленхлорида и гасили реакцию насыщенным водным раствором хлорида аммония до pH 4. Органический слой отделяли, промывали 3 раза водой, 3 раза - насыщенным раствором хлорида натрия, сушили сульфатом магния. Фильтровали и упаривали в вакууме, получали 156,2 мг сырого продукта. Перекристаллизация из этилацетата давала 98,58 мг названного продукта, т.пл. 290-290,5oC.
Элементный анализ для C31H35NO2:
Вычислено,%: N 3,09; C 82,08; H 7,78;
Найдено,%: N 3,06; C 81,84; H 8,01.
Масс-спектр (FAB):
Вычислено для С31H35NO2: 453;
Найдено: 453.
Пример 12. 17β- (3-фенилбензоил)-4-аза -5α- андрост-1-ен-3-он
К суспензии 258,0 мл сухих активированных магниевых стружек в 8 мл сухого ТГФ добавляли 932 мг 3-бромбифенила в 2 мл сухого ТГФ (атмосфера азота). Реакцию проводили на ультразвуковой бане при 24-30oC. К хорошо перемешиваемой смеси по каплям добавляли 30 мкл 1,2-дибромэтана (атмосфера азота). Реакционную массу выдерживали в течение 1-1,5 ч при 28oC (атмосфера азота). Концентрация реактива Гриньяра составляла 4,0 ммоль в 10 мл сухого ТГФ.
Стероид из примера 2 (205,0 мл, 0,5 ммоль тиопиридилового эфира) суспендировали в 2 мл сухого ТГФ, охлаждали до -80oC и к полученной суспензии с помощью шприца добавляли полученный ранее реактив Гриньяра (3,8 мл) за 5-10 мин (атмосфера азота). Реакционную массу выдерживали при -80oC (атмосфера азота) в течение 1 ч и затем еще 1 ч при -10oC (атмосфера азота). Раствор разбавляли 10,0 мл метиленхлорида и гасили реакцию насыщенным водным раствором хлорида аммония до pH 4. Органический слой отделяли, промывали 3 раза водой, 3 раза - насыщенным раствором хлорида натрия, сушили сульфатом магния. Фильтровали и упаривали в вакууме. Получали 122,84 мг сырого продукта, который очищали на колонке с 20,0 г силикагеля (элюент хлороформ/ацетон, 70: 30. Получали 117,0 мг названного продукта, т.пл. 184 - 185oC.
Элементный анализ для C31H35NO2:
Вычислено,%: N 3,09; C 82,08; H 7,78;
Найдено,%: N 2,98; C 82,28; H 8,04.
Масс-спектр (FAB):
Вычислено для C31H35NO2: 453;
Найдено: 453.
Пример 13. Синтез 17β- (4-метилтиобензоил)-4-аза -5α- андрост-1-ен-3-она
К суспензии 250,0 мг сухих активированных магниевых стружек в 8 мл сухого ТГФ добавляли 812 мг 3-бромфенола в 2 мл сухого ТГФ (атмосфера азота). Реакцию проводили на ультразвуковой бане при 24-30oC. К хорошо перемешиваемой смеси по каплям добавляли 30 мкл 1,2-дибромэтана (атмосфера азота). Реакционную массу выдерживали в течение 1-1,5 ч при 28oC (атмосфера азота). Концентрация реактива Гриньяра составляла 4,0 ммоль в 10 мл сухого ТГФ.
Стероид из примера 2 (205,0 мл тиопиридилового эфира) суспендировали в 2 мл сухого ТГФ, охлаждали до -80oC и к полученной суспензии с помощью шприца добавляли полученный ранее реактив Гриньяра за 5-10 мин (атмосфера азота). Реакционную массу выдерживали при -80oC (атмосфера азота) в течение 1 ч и затем еще 1 ч при -10oC (атмосфера азота). Раствор разбавляли 10 мл метиленхлорида и гасили реакцию насыщенным водным раствором хлорида аммония до pH 4. Органический слой отделяли, промывали 3 раза водой, 3 раза - насыщенным раствором хлорида натрия, сушили сульфатом магния. Фильтровали и упаривали в вакууме, получали 105,0 мг сырого продукта.
Полученный продукт очищали с помощью ТСХ (одна пластина, 20 см х 20 см х 20 см х 1000 мкл силикагеля, элюент метиленхлорид/ацетон, 80:20). Кристаллизацией из этилацетата получали 105,0 мг названного продукта, т.пл. 286 - 287oC.
Масс-спектр (FAB):
Вычислено для C26H33NO2S: 424;
Найдено: 424.
Пример 14. Синтез 17β- (4-метилсульфинилбензоил) и 17β- (4-метилсульфонилбензоил)-4-аза -5α- андрост-1-ен-3-она
А. Окисление.
В 2,5 мл метиленхлорида растворяли 19,91 мг метилтиопродукта примера 13, раствор охлаждали до 0 - (-2oC) и обрабатывали раствором 9,6 мг м-хлорнадбензойной кислоты в 1,0 мл метиленхлорида в течение 4 мин. Затем реакционную массу перемешивали при температуре 0 - (-2oC) в течение 1 ч, разбавляли 10 мл метиленхлорида. Органические слои промывали последовательно 2,5%-ным раствором бикарбоната натрия и насыщенным раствором хлористого натрия. Органический слой сушили сульфатом магния и упаривали в вакууме. Получали 17 мг продукта. После кристаллизации из этилацетата получали 11,8 мг названного соединения в виде твердого продукта с т.пл. 313-313,5oC (разл.).
Элементный анализ для C26N33NO3S • 1/4 H2O
Вычислено,%: N 3,15; C 70,31; H 7,60;
Найдено,%: N 3,00; C 70,47; H 7,70.
Масс-спектр (FAB):
Вычислено для C26H33NO3S: 440;
Найдено: 440.
Сульфон.
В качестве побочного продукта реакции с помощью хроматографии выделено 15% соответствующего сульфона - 17β- (4-метилсульфонилбензоил)производное. После перекристаллизации из этилацетата получали твердый продукт с т.пл. 279-279,5oC.
Элементный анализ для C26N33NO4S • 1/4 H2O
Вычислено,%: C 67,87; H 7,28; N 3,04;
Найдено,%: C 67,96; H 6,72; N 2,95.
Пример 15. Синтез 17β- (4-ацетоксиметилтиобензоил)-4-аза -5α- андрост-1-ен-3-она
Растворяли 165 мкл трифторуксусного ангидрида в 780 мкл уксусного ангидрида и выдерживали 5 ч при комнатной температуре.
К 300 мкл полученного выше раствора смеси ангидридов при перемешивании добавляли 34,15 мг чистого сульфоксида примера 14. Через несколько мин добавляли 54,0 мкл 2,6-литидина и полученную реакционную массу перемешивали 17 ч при комнатной температуре в атмосфере азота.
Жидкие ангидриды удаляли в вакууме и образовавшийся остаток экстрагировали хлороформом 4 раза. Хлороформенные экстракты промывали разбавленной соляной кислотой, трижды 5%-ным раствором бикарбоната натрия, трижды водой и, наконец, насыщенным раствором хлористого натрия, затем сушили сульфатом магния и упаривали растворитель досуха. Получали 42,1 мг сырого продукта.
Полученный неочищенный продукт со стадии A очищали хроматографией на силикагеле, элюент хлороформ/ацетон, 95:5, а затем кристаллизовали из этилацетата, получали 17,8 мг названного соединения в виде кристаллического продукта, т.пл. 235 - 236oC (разл.).
Элементный анализ для C28H35NO4S • 1/4 Н2O:
Вычислено,%: C 68,57; H 7,40; N 2,86;
Найдено,%: C 69,02; H 7,39; N 2,73.
Масс-спектр (FAB): вычислено для C28Н35NO4S:
Найдено: 482.
Спектр ЯМР соответствовал предложенной структуре.
Пример 16. Синтез 17β- (4-меркаптобензоил)-4-аза -5α- андрост-1-ен-4-она
В 3,0 мл изопропанола суспендировали 40,0 мг ацетоксиметилтио-производного примера 15. Реакционную смесь в течение нескольких минут продували азотом и вакуумировали. К приготовленной смеси добавляли с помощью шприца 40,0 мг карбоната калия в 2,0 мл воды (свободной от кислорода), затем давали температуре реакционной смеси подняться до 80oC при легком кипячении при небольшом пониженном давлении в течение 10 мин, а затем в атмосфере азота в течение 1 ч. Через 1 ч реакционная масса становилась прозрачным желтым раствором. После охлаждения до температуры 0-5oC реакционную массу обрабатывали 2,5 н. раствором соляной кислоты (атмосфера азота) и 4 раза экстрагировали метиленхлоридом. Органические слои промывали 4 раза водой, 3 раза - насыщенным рассолом, сушили сульфатом магния и упаривали в вакууме досуха. Получали 36,9 мг продукта. Полученный продукт растворяли в 2 мл хлороформа, фильтровали через Teflon (Acrodisk CR) и очищали с помощью препаративной ВЭЖХ на силикагеле (элюент метиленхлорид/ацетон, 60:40). Кристаллизовали из этилацетата, получали 20,7 мг чистого названного соединения, т.пл. 285 - 286oC.
Элементный анализ для C25H31NO2S • 1/2 H2O:
Вычислено,%: C 72,19; H 7,69; N 3,24;
Найдено,%: C 71,82; H 7,43; N 3,26.
Масс-спектр: найдено 410.
Пример 17. Синтез 17β- (4-диметиламинобензоил)-4-аза -5α- андрост-1-ен-3-она
К суспензии 291,0 мг сухих активированных магниевых стружек в 8 мл сухого ТГФ добавляли 800 мг 4-бром-N, N-диметиланилина в 2 мл сухого ТГФ (атмосфера азота). Реакцию проводили на ультразвуковой бане при 24-30oC. К хорошо перемешиваемой смеси по каплям добавляли 30 мкл 1,2-дибромэтана (атмосфера азота). Реакционную массу выдерживали в течение 1-1,5 ч при 28oC (атмосфера азота). Концентрация реактива Гриньяра составляла 4,0 ммоль в 10 мл сухого ТГФ.
Стероид из примера 2 (205,0 мл тиопиридилового эфира) суспендировали в 2 мл сухого ТГФ, охлаждали до -80oC и к полученной суспензии с помощью шприца добавляли полученный ранее реактив Гриньяра (3,8 мл, 3 эквивалента) за 5-10 мин (атмосфера азота). Реакционную массу выдерживали при -80oC (атмосфера азота) в течение 1 ч и затем еще 1 ч при -10oC (атмосфера азота). Раствор разбавляли 10,0 мл метиленхлорида и гасили реакцию насыщенным водным раствором хлорида аммония до pH 4. Органический слой отделяли, промывали 3 раза водой, 3 раза - насыщенным раствором хлорида натрия, сушили сульфатом магния. Фильтровали и упаривали в вакууме, получали 115,3 мг сырого продукта. Кристаллизацией из этилацетата получали 124,5 мг названного продукта, т.пл. 268,5 - 269oC.
Масс-спектр (FAB):
Вычислено для C27H36N2O2 421;
Найдено 421.
Спектр ПМР (CDCl3) соответствовал предложенной структуре.
Пример 18. Общая методика получения силилзащищенных производных
Фенол или его производные (1,0 моль) или спирт (1,0 моль) добавляли к 1,5 л сухого метиленхлорида. К полученному прозрачному раствору добавляли 3,0 моль имидазола (атмосфера азота). Раствор охлаждали до 0oC и по каплям добавляли 2,0 моль трет.-бутилдиметилхлорсилана в 300 мл сухого метиленхлорида. В конце добавления реагента наблюдалось образование осадка. Реакционную массу прекращали охлаждать и выдерживали при комнатной температуре в атмосфере азота в течение ночи. Фильтровали, промывали осадок холодным метиленхлоридом, растворитель упаривали в вакууме и получали сырой продукт. Полученный продукт легко очищали путем фильтрования через силикагель (элюент метиленхлорид, из расчета 1 г метиленхлорида на 100 г силикагеля). По такой методике получали силильные производные фенолов и спиртов с 99%-ной чистотой.
Пример 19. Спектр 17β- (4-гидроксибензоил)-4-аза -5α- андрост-1-ен-3-она
К суспензии 1,22 г сухих активированных магниевых стружек в 20,0 мл сухого ТГФ добавляли 5,6 г 1-бром-4-(трет.-бутилдиметилсилокси)бензола (получен из п-бромфенола по общей методике, описанной выше) в 2 мл сухого ТГФ (атмосфера азота). Реакцию проводили на ультразвуковой бане при температуре 24-30oC. К хорошо перемешиваемой смеси по каплям добавляли 150-200 мкл 1,2-дибромэтана (атмосфера азота). Реакционную массу выдерживали в течение 1-1,5 ч при 28oC (атмосфера азота). Концентрация реактива Гриньяра составляла 19,5 ммоль в 30,0 мл сухого ТГФ.
Стероид из примера 2 (1,02 г, 2,49 ммоль) суспендировали в 20 мл сухого ТГФ, охлаждали до -80oC и к полученной суспензии с помощью шприца добавляли полученный ранее реактив Гриньяра (3,8 мл, 3 эквивалента) за 5-10 мин (атмосфера азота). Реакционную массу выдерживали при -80oC (атмосфера азота) в течение 1 ч и затем еще 1 ч при -10oC (атмосфера азота). Раствор разбавляли 10,0 мл метиленхлорида и гасили реакцию насыщенным водным раствором хлорида аммония до pH 4. Органический слой отделяли, промывали 3 раза водой, 3 раза - насыщенным раствором хлорида натрия, сушили сульфатом магния. Фильтровали и упаривали в вакууме, получали продукт желтого цвета. Кристаллизацией из этилацетата получали 607 мг названного продукта, т.пл. 248-249oC.
Элементный анализ для C31H45NO3Si
Вычислено,%: C 73,32; H 8,93; N 2,75;
Найдено,%: C 73,27; H 8,99; N 2,75.
Масс-спектр (FAB):
Найдено 508;
Вычислено 508.
В. Десилирование.
Продукт со стадии А (1,3 г) растворяли в 20,0 мл сухого ТГФ. Полученный раствор охлаждали до -5oC и добавляли 437 мкл ледяной уксусной кислоты (атмосфера азота). К холодному раствору (-5oC) с помощью шприца по каплям добавляли 3,0 мл тетра-н.-бутиламмонийфторида (атмосфера азота). Реакционную массу перемешивали при этих условиях в течение 0,5 - 2 ч, затем выливали ее в 2-фазную смесь этилацетат/насыщенный раствор бикарбоната натрия, охлажденную до 0oC. Водный слой отделяли и дополнительно экстрагировали этилацетатом (3 раза) и метиленхлоридом (2 раза).
Органические слои объединяли, промывали 3 раза водой, 1 раз - насыщенным раствором хлорида натрия и сушили сульфатом магния, фильтровали и упаривали досуха. Продукт перекристаллизовывали из этилацетата, получали 842,3 мг названного продукта, т.пл. 296-297oC.
Элементный анализ для C25H31NO3 • 1/3 H2O
Вычислено,%: C 75,15; H 7,98; N 3,51;
Найдено,%: C 75,13; H 7,71; N 3,54.
Масс-спектр (FAB): Найдено 394; Вычислено 394.
Пример 20. Синтез 17β- (3,5-диметил-4-гидроксибензоил)-4-аза -5α- андрост-1-ен-3-она
А. Получение реактива Гриньяра.
К суспензии 260 мг сухих активированных магниевых стружек в 6,0 мл сухого ТГФ добавляли 628,0 г 1-бром-3,5-диметил-4-(трет.-бутил-диметилсилокси)бензола (получен из 4-бром-2,6-диметилфенола по общей методике, описанной выше) в 4 мл сухого ТГФ (атмосфера азота). Реакцию проводили на ультразвуковой бане при 24-30oC. К хорошо перемешиваемой смеси по каплям добавляли 150 - 200 мкл 1,2-дибромэтана (атмосфера азота). Реакционную массу выдерживали в течение 1 - 1,5 ч при 28oC (атмосфера азота). Концентрация реактива Гриньяра составляла 2,0 ммоль в 10,0 мл сухого ТГФ.
Стероид из примера 2 (205,0 мг, 0,5 ммоль) суспендировали в 3 мл сухого ТГФ, охлаждали до -80oC и к полученной суспензии с помощью шприца добавляли полученный ранее реактив Гриньяра (7,5 мл, 1,5 эквивалента) за 5 - 10 мин (атмосфера азота). Реакционную массу выдерживали при -80oC (атмосфера азота) в течение 1 ч и затем еще 1 ч при температуре -10oC (атмосфера азота).
Гасили реакцию 1 н. соляной кислотой и затем разбавляли хлороформом. Органические слои объединяли, промывали 3 раза водой, 3 раза - насыщенным раствором хлорида натрия, сушили сульфатом магния. Фильтровали и упаривали в вакууме, получали продукт, который покрывали эфиром, выделяли 121,7 мг.
Полученный продукт растворяли в смеси хлороформ/ацетон, 70:30, фильтровали через Teflon (Acrodisk CR) и очищали с помощью препаративной ВЭЖХ на силикагеле (элюент хлороформ/ацетон, 70:30).
Основной продукт перекристаллизовывали из этилацетата, получали 52,0 мг продукта, т. пл. 245 - 245,5oC.
Элементный анализ для C33H49NO3Si
Вычислено, %: C 73,96; H 9,23; N 2,61;
Найдено, %: C 74,06; H 9,23; N 2,64.
Масс-спектр (FAB):
Найдено 536;
Вычислено 536.
B. Снятие силильной защиты.
Растворяли 54,0 мг продукта со стадии A в 1,3 мл сухого ТГФ. Прозрачный раствор охлаждали до 0oC и добавляли 29 мкл ледяной уксусной кислоты с помощью шприца (атмосфера азота). Затем к приготовленному раствору с помощью шприца по каплям добавляли 172 мкл тетра-н.-бутиламмонийфторида (атмосфера азота). Реакционную массу выдерживали при этих условиях в течение 1,5 ч, затем выливали ее в смесь лед/насыщенный раствор бикарбоната натрия/этилацетат и перемешивали несколько минут. Слои отделяли, водный слой экстрагировали 3 раза этилацетатом и 3 раза хлороформом.
Объединенные органические экстракты промывали 3 раза водой, а затем 3 раза - насыщенным хлористым натрием, сушили сульфатом магния, фильтровали и упаривали досуха в вакууме, получали 52,2 мг продукта.
Полученный продукт кристаллизовали из этилацетата, получали 22,5 мг указанного соединения, т. пл. 305 - 306oC.
Элементный анализ для C27H35NO3•H2O:
Вычислено, %: C 73,77; H 8,49; N 3,10;
Найдено, %: C 73,62; H 7,90; N 3,44.
Масс-спектр (FAB):
Найдено 422;
Вычислено 422.
Пример 21. Синтез 17β- (4-метоксибензоил)-4-аза -5α- андрост-1-ен -3-она
К суспензии 258,0 мг сухих активированных магниевых стружек в 8,0 мл сухого ТГФ добавляли 748,0 мг n-броманизола в 2 мл сухого ТГФ (атмосфера азота). Реакцию проводили на ультразвуковой бане при 24 - 30oC. К хорошо перемешиваемой смеси по каплям добавляли 30 мкл 1,2-дибромэтана (атмосфера азота). Реакционную массу выдерживали в течение 1 - 1,5 ч при 28oC (атмосфера азота). Концентрация реактива Гриньяра составляла 4,0 ммоль в 10,0 мл сухого ТГФ.
Стероид из примера 2 (205,0 мг, 0,5 ммоль) суспендировали в 2 мл сухого ТГФ, охлаждали до -78oC и к полученной суспензии с помощью шприца добавляли полученный ранее реактив Гриньяра (3,75 мл, 14 миллиэквивалентов) за 5 - 10 мин (атмосфера азота). Реакционную массу выдерживали при -80oC (атмосфера азота) в течение 1 ч и затем еще 1 ч при -10oC (атмосфера азота).
Реакционную массу разбавляли хлороформом и гасили реакцию 1 н. соляной кислотой и затем органические слои отделяли, промывали 2 раза водой, затем насыщенным раствором хлорида натрия, сушили сульфатом магния. Фильтровали и упаривали в вакууме, получали продукт, который промывали эфиром, кристаллизовали из этилацетата, выделяли 110 мг продукта, т. пл. 305 - 306oC.
Дополнительную очистку осуществляли с помощью ТСХ (пластина, 20 см х 20 см х 1000 мкм), элюент хлороформ/ацетон, 70:30. После перекристаллизации из этилацетата получали 78,56 мг названного продукта, т. пл. 305 - 306oC (разл. ).
Масс-спектр (FAB):
Найдено 408;
Вычислено 408.
Пример 22. Синтез 17β- (3-гидроксибензоил)-4-аза -5α- андрост- 1-ен-3-она
A. Реактив Гриньяра.
К суспензии 230,0 мг сухих активированных магниевых стружек в 2,0 мл сухого ТГФ добавляли 722,4 мг 1-бром-3-(трет. -бутилдиметилсилокси)бензола (получен из 3-бромфенола по общей методике, описанной выше) в 8 мл сухого ТГФ (атмосфера азота). Реакцию проводили на ультразвуковой бане при температуре 24 - 30oC. К хорошо перемешиваемой смеси по каплям добавляли 20 мкл 1,2-дибромэтана (атмосфера азота). Реакционную массу выдерживали в течение 1 - 1,5 ч при 28oC (атмосфера азота). Концентрация реактива Гриньяра составляла 2,52 ммоль в 10,0 мл сухого ТГФ.
Стероид из примера 2 (205 мг, 0,5 ммоль) суспендировали в 2 мл сухого ТГФ, охлаждали до -78oC и к полученной суспензии с помощью шприца добавляли полученный ранее реактив Гриньяра (6,0 мл, 1,5 миллиэквивалента) за 5 - 10 мин (атмосфера азота). Реакционную массу выдерживали еще 1 ч при -10oC (атмосфера азота). Реакционную массу при 0 - -5oC гасили 1 н. соляной кислотой и разбавляли хлороформом. Органический слой промывали 3 раза водой, 3 раза - насыщенным раствором хлорида натрия, сушили сульфатом магния. Фильтровали и упаривали в вакууме, получали продукт, который очищали на колонке с силикагелем, элюент хлороформ/ацетон, 70:30. Получали 58,0 мг силильного производного, 17β- (3-трет.-бутилдиметилсилилбензоил) -4-аза- 5α- андрост-1-ен-3-он.
B. Десилирование.
Силильное производное (57,6 г) растворяли в 3,0 мл сухого ТГФ. Полученный раствор охлаждали до 0oC и с помощью шприца добавляли 20 мкл ледяной уксусной кислоты (атмосфера азота). К холодному раствору (-5oC) с помощью шприца по каплям добавляли 130,0 мкл тетра-н.-бутиламмонийфторида (атмосфера азота). Реакционную массу перемешивали при этих условиях в течение 1 ч затем выливали ее в смесь этилацетат/насыщенный раствор бикарбоната натрия, охлажденную до 0oC.
Органические слои объединяли, промывали 3 раза водой, 1 раз - насыщенным раствором хлорида натрия и сушили сульфатом магния, фильтровали и упаривали досуха, получали 57,11 мг сырого продукта. Продукт очищали с помощью ТСХ (одна пластина, 20 см х 20 см х 250 мкм силикагеля), элюент хлороформ/ацетон, 70: 30. Получали 44,5 мг названного соединения. После перекристаллизации из этилацетата получали 29,30 мг продукта, т. пл. 279 - 280oC.
Элементный анализ для C25H31NO3 •8H2O:
Вычислено, %: C 73,60; H 8,06; N 3,43;
Найдено, %: C 73,26; H 8,22; N 3,28.
Масс-спектр (FAB):
Найдено 394;
Вычислено 394.
Пример 23. Синтез 17β- (4-гидроксиметилбензоил)-4-аза -5α- андрост-1-ен-3-она
A. Получение раствора реактива Гриньяра
К суспензии 100,0 мг (4 ммоль) сухих активированных магниевых стружек в 5,0 мл сухого ТГФ добавляли 753,0 мг 1-бром -4-(трет.бутилдиметилсилилоксиметил)бензола (получен из 4-бромфенола по общей методике, описанной выше) (атмосфера азота). Реакцию проводили на ультразвуковой бане при 24 - 30oC. К хорошо перемешиваемой смеси по каплям добавляли 20 мкл 1,2-дибромэтана (атмосфера азота). Реакционную массу выдерживали в течение 2 ч при 28oC (атмосфера азота). Концентрация реактива Гриньяра составляла 2,5 ммоль в 5,0 мл сухого ТГФ.
B. Реакция Гриньяра
Стероид из примера 2 (205 мг, 0,5 ммоль) суспендировали в 2 мл сухого ТГФ, охлаждали до -78oC и к полученной суспензии с помощью шприца добавляли полученный ранее реактив Гриньяра (3,0 мл, 3,75 миллиэквивалента) за 5 - 10 мин (атмосфера азота). Реакционную массу выдерживали еще 1 ч при -10oC (атмосфера азота). Прозрачную реакционную массу при температуре 0 - (-5oC) гасили насыщенным раствором хлорида аммония и разбавляли метиленхлоридом. Органический слой отделяли и промывали 3 раза водой, 3 раза - насыщенным раствором хлорида натрия, сушили сульфатом магния. Фильтровали и упаривали в вакууме, получали продукт, который кристаллизовали из этилацетата, выход силилированного продукта 137 мг.
Масс-спектр (FAB):
Вычислено для C30H41NO3Si: 521,75;
Найдено 522.
С. Десилирование
Продукт со стадии B (23,67 мг) растворяли в 0,5 мл сухого ТГФ и 0,5 мл метанола и охлаждали до 0oC (атмосфера азота). К охлажденному раствору добавляли 10 мкл концентрированной серной кислоты (98%) и перемешивали в течение 45 мин при 0oC в атмосфере азота. К холодному раствору (0oC) медленно добавляли насыщенный раствор бикарбоната натрия и хлороформ. Реакционную массу экстрагировали хлороформом трижды. Органические слои промывали 3 раза водой, 3 раза - насыщенным раствором хлорида натрия и сушили сульфатом магния, фильтровали и упаривали досуха, получали 10,18 мг сырого продукта. После очистки с помощью ТСХ на пластинах, элюент хлороформ/ацетон, 1:1 и продукт кристаллизовали атилацетатом. Получали 6,0 мг названного соединения, т. пл. 318 - 320oС.
Элементный анализ для C26H33NO3•1/3 H2O:
Вычислено, %: C 75,41; H 7,94; N 3,38;
Найдено, %: C 75,61; H 7,84; N 3,12.
Масс-спектр (FAB):
Найдено 408;
Вычислено 408.
Пример 24. Синтез 17β- (4-карбоксибензоил)-4-аза -5α- андрост-1- ен-3-она
A. Окисление
В 2,63 мл ледяной уксусной кислоты растворяли 90,2 мг продукта примера 23 и к полученному прозрачному раствору добавляли 69,0 мг CrO3 (предварительно сушили над P2O5 при комнатной температуре в вакууме в течение 2 дней). Реакционную массу перемешивали ночь, разбавляли водой и оставляли в холодильнике на ночь. Затем реакционную массу фильтровали и фильтрат и промывные жидкости экстрагировали в течение ночи с использованием экстрактора жидкость-жидкость (вода-этилацетат) в условиях кипячения. Органический слой сушили сульфатом магния, фильтровали и упаривали в вакууме. Полученный остаток растворяли в горячем метаноле, фильтровали и упаривали в вакууме, получали 32,0 мг продукта.
Масс-спектр (FAB):
Найдено 422;
Вычислено для C26H33NO4 422.
B. Очистка.
Полученную выше кислоту очищали путем растворения продукта в 1 н. растворе гидроксида натрия. Прозрачный раствор экстрагировали 3 раза этилацетатом. Водный основной раствор охлаждали и подкисляли 1 н. соляной кислотой, которую добавляли по каплям при перемешивании pH 4. Реакционную массу выдерживали для вызревания в течение 1 ч при 0oC, затем фильтровали и остаток промывали холодной водой. Сушили в течение ночи при 100oC в вакууме (менее 0,2 мм).
Выход названного продукта - свободной кислоты - составил 9,85 мг.
Масс-спектр (FAB):
Найдено 422;
Вычислено для C26H33NO4 422.
C. Натровая соль указанной кислоты.
4,9 мг полученной выше кислоты B растворяли в 2,0 мл горячего метанола. К прозрачному раствору добавляли 11,6 мкл 1 н. водного раствора гидроксида натрия. К полученному раствору после упаривания метанола в вакууме добавляли воду до достижения pH 7,21. Водный раствор сушили вымораживанием, получали 6,3 мг натровой соли указанной кислоты.
Пример 25. Синтез 17β- (4-гидроксиэтилбензоил)-4-аза -5α- эндрост-1-ен-3-она
A. Получение раствора реактива Гриньяра
К суспензии 252 мг сухих активированных магниевых стружек в 10,0 мл сухого ТГФ добавляли 1,26 г (4 ммоль) 1-бром-4-(трет.-бутилдиметилсилилоксиэтил)бензола (получен из 2-(n-бромфенил)этанола по общей методике, описанной выше) (атмосфера азота). Реакцию проводили на ультразвуковом вибраторе. K хорошо перемешиваемой смеси по каплям добавляли 20 мкл 1,2-дибромэтана (атмосфера азота) в качестве катализатора реакции. Реакционную массу выдерживали в течение 3,5 - 4 ч (атмосфера азота). Концентрация реактива Гриньяра составляла 4 ммоль в 10,0 мл сухого ТГФ.
B. Реакция Гриньяра.
Стероид из примера 2 (205 мг, 0,5 ммоль) суспендировали в 2 мл сухого ТГФ, охлаждали до -80oC и к полученной суспензии с помощью шприца добавляли полученный ранее реактив Гриньяра (3,75 мл, 1,5 миллиэквивалента) за 5 - 10 мин (атмосфера азота). Реакционную массу выдерживали при температуре -80oC в течение 1 ч и еще 1 ч при -10oC (атмосфера азота). Прозрачную реакционную массу при температуре 0 - (-5oC) гасили насыщенным раствором хлорида аммония и разбавляли метиленхлоридом. Органический слой отделяли и промывали 3 раза водой, 3 раза - насыщенным раствором хлорида натрия, сушили сульфатом магния. Фильтровали и упаривали в вакууме досуха, получали продукт, который кристаллизовали из этилацетата, выход силированного продукта 152 мг, т. пл. 233 - 234oC.
Элементный анализ для C33H49NO3Si•1/4 H2O:
Вычислено, %: C 73,55; H 9,18; N 2,59;
Найдено, %: C 73,45; H 8,94; N 3,21.
Масс-спектр (FAB):
Вычислено для C30H41NO3Si 521,75;
Найдено 522.
С. Десилирование
Продукт со стадии B (70,8 мг) растворяли в 1,45 мл сухого ТГФ и 1,45 мл метанола и охлаждали до 0 - 5oC (атмосфера азота). К охлажденному раствору добавляли с помощью шприца 29 мкл концентрированной серной кислоты и перемешивали в течение 45 мин в атмосфере азота. Реакционную массу при 0oC осторожно гасили насыщенным раствором бикарбоната натрия и экстрагировали трижды метиленхлоридом. Органические слои промывали 3 раза водой, затем - насыщенным раствором хлорида натрия и сушили сульфатом магния, фильтровали и упаривали в вакууме, получали 43,0 мг сырого продукта. Полученный продукт наносили на колонку с силикагелем и элюировали смесью ацетон/метиленхлорид, 1: 1. Выделенный продукт кристаллизовали безводным метанолом, получали 20,0 мг названного соединения, т. пл. 292 - 293oC (разл.).
Элементный анализ для C27H35NO3•1/4 H2O
Вычислено, %: C 75,31; H 8,25; N 3,25;
Найдено, %: C 75,49; H 8,29; N 3,45.
Масс-спектр (FAB):
Найдено 422;
Вычислено 422.
Пример 26. Синтез 17β- (4-карбоксиметилбензоил)-4-аза -5α- андрост-1-ен-3-она
A. Окисление.
В 1 мл ледяной уксусной кислоты растворяли 13,0 мг продукта примера 25 и к полученному прозрачному раствору добавляли 10,0 мг CrO3 (предварительно сушили над P2O5 при комнатной температуре в вакууме в течение 2 дней). Реакционную массу перемешивали ночь при комнатной температуре, а затем 48 ч при 0oC. Добавляли 7,0 мл воды и оставляли реакционную массу на ночь в холодильнике для кристаллизации. Затем отфильтровывали продукт, промывали холодной водой и сушили в вакууме при 110oC (давление менее 1 мм).
Высушенный продукт растворяли в 1 н. растворе гидроксида натрия и основный раствор экстрагировали 3 раза метиленхлоридом. Органический слой отделяли, а водный основный раствор охлаждали и подкисляли 1,5 н. соляной кислотой. Отфильтровывали осадок, промывали его водой и сушили в течение ночи при 100oC в вакууме (менее 0,1 мм). Выход названного продукта составил 7,0 мг.
Масс-спектр (FAB):
Найдено 436;
Вычислено для C27H33NO4 436.
Пример 27. Синтез 17β- (3,4-дигидроксибензоил)-4-аза- -5α- андрост-1-ен-3-она
A. Реакция Гриньяра
К суспензии 258,5 мг сухих активированных магниевых стружек в 10,0 мл сухого ТГФ добавляли 482 мг 1-бром-1,2-метилендиоксибензола (исходный продукт коммерчески доступен, Aldrich Chemical).
Реакцию проводили на ультразвуковой водяной бане при 24 - 30oC. К хорошо перемешиваемой смеси по каплям добавляли 40 мкл 1,2-дибромэтана (атмосфера азота) в качестве катализатора реакции. Реакционную массу выдерживали в течение 1,5 - 2 ч при 28oC (атмосфера азота). Концентрация реактива Гриньяра составляла 3,75 ммоль в 10,0 мл сухого ТГФ.
Стероид из примера 2 (410 мг, 1,0 ммоль) суспендировали в 4 мл сухого ТГФ, охлаждали до -80oC и к полученной суспензии с помощью шприца добавляли полученный ранее реактив Гриньяра (8,0 мл, 3,04 миллиэквивалента) за 5 - 10 мин (атмосфера азота). Реакционную массу выдерживали при -80oC в течение 1 ч и еще 1 ч при -10oC (атмосфера азота). Реакционную массу разбавляли метиленхлоридом и гасили 1 н. соляной кислотой.
Органические слои отделяли, промывали 3 раза водой, 3 раза - насыщенным раствором хлорида натрия, сушили сульфатом магния, фильтровали и упаривали в вакууме досуха, получали продукт, который очищали на 50,0 г силикагеля, элюент метиленхлорид/ацетон, 1:1. Получали 347 мг продукта.
Масс-спектр (FAB):
Вычислено 422;
Найдено 422.
После кристаллизации полученного продукта из этилацетата получали 11,39 мг продукта, т.пл. 324 - 325oC.
Элементный анализ для C26H31NO4•3/4 H2O
Вычислено, %: C 71,78; H 7,53; N 3,22;
Найдено, %: C 71,90; H 7,54; N 3,25.
Масс-спектр (FAB):
Вычислено для C26H31NO4 422;
Найдено 422.
B. Расщепление метилендиоксилановой группы
В 25 мл 1,2-дихлорэтана растворяли 70,0 мг продукта стадии A (комнатная температура, атмосфера азота). Раствор охлаждали до -10oC и по каплям добавляли 1,03 мл BBr3 (1,0 М раствор в дихлорметане). Реакционную массу выдерживали при комнатной температуре в течение 3,5 - 4 ч (атмосфера азота). Затем реакционную массу охлаждали до -10oC и гасили 10,0 мл метанола в течение 10 мин при 0oC, затем температуру постепенно поднимали до комнатной. Реакционную массу упаривали досуха в вакууме. Остаток экстрагировали трижды этилацетатом. Органические слои промывали трижды водой, дважды насыщенным раствором бикарбоната натрия и, наконец, раствором хлористого натрия, сушили сульфатом магния, фильтровали и упаривали в вакууме. Сырой продукт очищали хроматографированием на 2 пластинах с силикагелем (20 см х 20 см 20 см х 250 мкм), элюент ацетон/метиленхлорид, 1:1. После перекристаллизации из этилацетата получали 5,0 мг названного продукта, т.пл.222 - 222,5oC.
Элементный анализ для C25H31NO4•1/2 H2O
Вычислено, %: C 71,78; H 7,66; N 3,35;
Найдено, %: C 71,71; H 7,71; N 3,33.
Масс-спектр (FAB):
Вычислено для C25H31NO4 410;
Найдено 410.
Пример 28. Синтез 17β- (2-метоксибензоил)-4-аза -5α- андрост-1-ен -3-она
A. Реакция Гриньяра.
К суспензии 258,0 мг сухих активированных магниевых стружек в 8,0 мл сухого ТГФ добавляли 771,0 мг о-броманизола в 2,0 мл сухого ТГФ (атмосфера азота). Реакцию проводили на ультразвуковой водяной бане при температуре 24 - 30oC. К хорошо перемешиваемой смеси по каплям добавляли 30 мкл 1,2-дибромэтана (атмосфера азота) в качестве катализатора реакции. Реакционную массу выдерживали в течение 2 ч при 28oC (атмосфера азота). Концентрация реактива Гриньяра составляла 4 ммоль в 10,0 мл сухого ТГФ.
Стероид из примера 2 (205 мг) суспендировали в 8 мл сухого ТГФ, охлаждали до -79oC и к полученной суспензии с помощью шприца добавляли полученный ранее реактив Гриньяра (4,0 мл, 1,6 миллиэквивалента) за 5 - 10 мин (атмосфера азота). Реакционную массу выдерживали при -80oC в течение 1 ч и еще 1 ч при температуре -10oC (атмосфера азота). Реакционную массу разбавляли метиленхлоридом и гасили 1 н. соляной кислотой.
Органические слои отделяли, промывали 3 раза водой, 3 раза - насыщенным раствором хлорида натрия, сушили сульфатом магния. Фильтровали и упаривали в вакууме досуха, получали продукт, который кристаллизовали из этилацетата. Получали 124,5 мг продукта, т.пл. 228 - 230oC. После очистки на колонке с силикагелем, элюент хлороформ/ацетон, 70:30, получали 83,0 мг чистого соединения, т.пл. 241 - 241,5oC.
Элементный анализ для C26H33NO3
Вычислено,%: C 76,91; H 8,19; N 3,45;
Найдено,%: C 76,36; H 8,26; N 3,35.
Масс-спектр (FAB):
Вычислено для C26H33NO3 406;
Найдено 406.
B. Расщепление метоксигруппы
В 5,0 мл сухого метиленхлорида в атмосфере азота растворяли 12,7 мг (0,03 ммоль) продукта стадии A. К прозрачному раствору при -79oC по каплям с помощью шприца добавляли 50 мкл (1 ммоль/мл) BBr3 в метиленхлориде. Реакцию интенсивно перемешивали при комнатной температуре в течение ночи. На следующий день получали прозрачный желтый раствор. Далее реакционную массу охлаждали до 0-2oC и добавляли воду для гидролиза избытка BBr3. Органическую фазу промывали трижды разбавленным раствором гидроксида натрия, трижды водой и трижды разбавленной соляной кислотой, после чего снова трижды промывали водой, трижды насыщенным раствором хлористого натрия, сушили сульфатом магния. Фильтровали и фильтрат упаривали в вакууме досуха. Сырой продукт кристаллизовали из этилацетата, получали 7,0 мг чистого 17β- (2-гидроксиметилбензоил)-4-аза -5α- андрост-1-ен-3-она.
Масс спектр:
Вычислено для C25H31NO2 394;
Найдено 394.
Пример 29. 17b-(α- гидроксибензил)-4-аза -5α- андрост-1-ен-3-он
Суспендировали 570 мг 17β- бензоил-4-аза -5α- андрост-1-ен-3-она (получен из тиопиридилового эфира примера 2 и коммерчески доступного фенилмагнийбромида по методике, аналогичной методике примера 5, с получением 17β- бензоилпроизводного, т.пл. 295 - 296oC, кристаллизация из этилацетата) в 80 мл безводного изопропанола. К суспензии добавляли 500 мл NaBH4 (в пять порций). После добавления всего боргидрида натрия осторожно добавляли 20 мл сухого ТГФ таким образом, что реакционная смесь становилась прозрачным раствором. Реакционную массу выдерживали при комнатной температуре в течение ночи. Затем реакцию осторожно останавливали с помощью 1 н. соляной кислоты, и перемешивали в атмосфере азота при комнатной температуре еще 1 ч. Затем реакционную массу разбавляли водой, трижды экстрагировали хлороформом. Органические экстракты объединяли, промывали трижды водой, трижды насыщенным раствором хлористого натрия и сушили сульфатом натрия, фильтровали и упаривали. Получали белый твердый продукт, 495,0 мг.
Сырой продукт кристаллизовали из этилацетата, получали 349,5 мг продукта. Дополнительная очистка на колонке с силикагелем, элюент хлороформ/ацетон, 70:30, давала чистое названное соединение, 221 мг, т.пл. 296 - 297oC.
Элементный анализ для C25H33NO2
Вычислено,%: C 79,17; H 8,78; N 3,70;
Найдено,%: C 79,24; H 8,85; N 3,48.
Масс-спектр (FAB):
Вычислено для C25H33NO2 380;
Найдено: 380.
Пример 30. 17β- гидроксиметил-4-аза -5α- андрост-1-ен-3-он
В 40 мл сухого ТГФ при комнатной температуре в атмосфере азота растворяли 500,0 мг S-2-пиридил-3-оксо-4-аза- -5α- андрост-1-ен-3-она (пример 2). Раствор охлаждали до -78oC (атмосфера азота) и медленно при интенсивном перемешивании с помощью шприца добавляли 5,5 мл 1 М раствора дибутилалюминийгидрида в ТГФ. Реакционную массу выдерживали при (-76) - (-78)oC 0,5 ч. Температуру постепенно повышали до комнатной и дополнительно выдерживали 2 - 2,5 ч. Реакцию останавливали с помощью 2 н. соляной кислоты при температуре 0 - 5oC, а затем разбавляли хлороформом. Органические слои отделяли, промывали водой трижды, затем насыщенным раствором хлористого натрия, сушили сульфатом магния. Фильтровали и упаривали в вакууме, получали 216,0 мг сырого продукта.
Сырой продукт очищали на колонке с 20,0 г силикагеля, элюент хлороформ/ацетон, 70:30.
Получали 126,3 мг чистого названного соединения, т.пл. 271 - 271,5oC.
Масс-спектр (FAB):
Вычислено для C19H29NO2 304;
Найдено 304.
Спектр ЯМР в CDCl3 соответствовал предложенной структуре.
Пример 31. 17β- формил-4-аза -5α- андрост-1-ен-3-он
В сухую колбу на 100,0 мл загружали 1,3 мл оксалилхлорида (2 М раствор в метиленхлориде) и 50 мл сухого метиленхлорида (атмосфера азота). Полученный раствор охлаждали до -78oC и с помощью шприца по каплям добавляли 338 мкл ДMCO. Смесь перемешивали при этих условиях 30 мин и с помощью шприца добавляли заранее полученный раствор спирта примера 15, то есть 17β- гидроксиметил-4-аза -5α- андрост-1-ен-3-она (256,9 мг в 15 мл сухого метиленхлорида, атмосфера азота). Реакционную массу выдерживали при -78oC в течение 1 ч, затем добавляли быстро сухой триэтиламин. Температуру реакции медленно при перемешивании поднимали до комнатной, полученной желтый раствор выливали в 50,0 мл холодной воды. Органический слой промывали насыщенным раствором бикарбоната натрия, затем насыщенный раствор хлористого натрия сушили сульфатом магния, упаривали в вакууме, получали 172,4 мг сырого продукта. После очистки на колонке с 60,0 г силикагеля, элюент хлороформ/ацетон, 70:30, получали чистый продукт. После кристаллизации из этилацетата получали 37,7 мг названного соединения, т.пл. 258 - 259oC.
Пример 32. Синтез диастериомерных 17β-(α- гидроксибензил)-4-аза -5α- андрост-1-ен-3-онов
Растворяли 26,3 мг полученного ранее формильного производного (пример 31) в 7,0 мл сухого ТГФ (атмосфера азота). Полученный раствор охлаждали до -78oC, и по каплям с помощью шприца добавляли 131 мкл фенилмагнийбромида (Aldrich) (0,393 миллиэквивалента) в сухом ТГФ. Реакционную массу выдерживали в течение 1 ч при температуре -78oC, а затем 1 ч при комнатной температуре.
Реакцию останавливали с помощью 2,5 н. соляной кислоты при 0 - 5oC, а затем разбавляли хлороформом. Органический слой отделяли, промывали трижды водой, трижды - насыщенным раствором хлористого натрия, сушили сульфатом магния, фильтровали и упаривали в вакууме досуха. Получали 28,6 мг сырого продукта. Данные ЯМР спектра и данные ВЭЖХ свидетельствуют, что полученный продукт представляет собой смесь двух диастериомеров. Сырой продукт фильтровали через Teflon и очищали ВЭЖХ на колонке WHitman Portisil 10, элюент хлороформ/ацетон, 70: 30. Масс-спектр (FAB) содержит пики M++1 для обоих изомеров, причем массовая единица соответствует 380. Изомер, который элюируется быстрее, с т.пл. 289 - 289,5oC, кристаллизовали из этилацетата, получали чистый продукт, содержащий по данным ТСХ одно соединение.
Элементный анализ для C25H33NO2•1/4 H2O
Вычислено,%: C 78,39; H 8,81; N 3,65;
Найдено,%: C 78,11; H 8,65; N 3,58.
Изомер, который элюируется медленнее, с т.пл. 300 - 301oC, по данным ТСХ также содержал одно соединение. В спектре ЯМР (CDCl3) изомера, элюируемого быстрее, наблюдается сигнал протонов CH3-группы при C-18, который сдвинут в более слабое поле (0,89 м.д.) в сравнении с соответствующим сигналом другого изомера (0,69 м.д.). Бензильный протон первого изомера также сдвинут (4,5 м. д. относительно 4,95 м.д.). Сигнал олефинового протона при C-1 также смещен для первого изомера (6,81 м. д. ) в сравнении с сигналом протона другого изомера (6,62 м. д. ). Из этих данных видно, что два изомера обладают существенно различными физическими свойствами.
Часть 3.
Пример 1. Получение 4-(2-(11-карбоксиундеканоиламино)фенокси)бутановой кислоты
Стадия A: Этил-4-(2-нитрофенокси)бутират (3)
К раствору 2-нитрофенола (1,4 г, 10 ммоль) и этил-4-бромбутирата (2,1 г, 1,57 мл, 11 ммоль) в 35 мл сухого ацетона добавляли при перемешивании 2 г (14,5 ммоль) безводного измельченного карбоната калия. Полученную окрашенную смесь нагревали в атмосфере азота и кипятили до тех пор, пока не исчезла окраска, обусловленная фенолят-ионом, и смесь не становилась желтой. Смесь охлаждали, фильтровали и упаривали, получали масло, которое очищали быстрой хроматографией (силикагель), элюент этилацетат/гексан или метиленхлорид), получали 2,4 г (96%) соединения (3) в виде маслянистой жидкости.
При использовании замещенных орто-нитрофенолов вместо 2-нитрофенола и при использовании вместо 4-бромбутирата других галоид-эфиров, были получены соответствующие 2-нитрофеноксиалканоаты.
Стадия B: Этил 4-(2-аминофенокси)бутират (4)
Раствор соединения 3 (1,27 г, 5,0 ммоль) в 15 мл этилацетата, содержащий 200 мг 5%-ного палладия на угле, выдерживали в атмосфере водорода (40 фунтов/кв. дюйм) при комнатной температуре до прекращения поглощения водорода. Затем смесь фильтровали и упаривали в вакууме, получали 1,0 г соединения 4 в виде масла/низкоплавкого твердого продукта.
Стадия C: 12-(Изопропилтио)додекановая кислота (6)
Смесь 12-бромдодекановой кислоты 5 (0,558 г, 2,0 ммоль) и изопропилтиолата натрия (1,1 г, 11,1 ммоль) в 1,2-диметоксиэтане деаэрировали (азотом) и нагревали до 85oC (температура бани). Выдерживали при этой температуре в течение 72 ч. Реакционную смесь охлаждали и фильтровали. Полученный осадок растворяли в воде и фильтровали. Полученный раствор при перемешивании подкисляли разбавленной соляной кислотой, выдерживали для вызревания, фильтровали, полученный остаток промывали хорошо водой и сушили. Получали соединение 6 (0,54 г) в виде белого твердого продукта.
При использовании других галокислот вместо 2-бромдодекановой кислоты получены соответствующие (изопропилтио)-кислоты.
Аналогично при использовании других меркаптосолей вместо изопропилтиолата натрия получены другие соответствующие (алкилтио)алкановые кислоты.
Примерами кислот, которые получены по этой методике, являются, но не ограничиваются только ими: 8-(изопропилтио)октановая кислота, 10-(изопропилтио)декановая кислота, 10-(этилтио)декановая кислота, 11-(трет.-бутилтио)ундекановая кислота, 14-(н.-пропилтио)тетрадекановая кислота, 9-(метилтио)нонановая кислота.
Стадия D: Этил 4-(2-(12-(изопропилтио)додеканоиламино)фенокси)бутират (7)
К раствору соединения 4 (0,25 г, 1,14 ммоль) и соединения 6 (0,274 г, 1,0 ммоль) в сухом метиленхлориде (10 мл) при комнатной температуре добавляли 4-диметиламинопиридин (0,122 г, 1,0 ммоль), а затем добавляли за 1 мин раствор N,N-дициклогексилкарбоксидиимида (0,22 г, 1,06 ммоль) в метиленхлориде (1 мл). Через 2 дня смесь фильтровали и упаривали в вакууме, остаток очищали быстрой хроматографией на силикагеле, элюент 15 - 20%-ный раствор этилацетата в гексане. Получали соединение 7 (0,22 г) в виде масла, которое быстро кристаллизовалось.
Стадия E: 4-(2-(12-(изопропилтио)додеканоиламино)фенокси)бутановая кислота (8)
К раствору эфира (7) (0,124 г, 0,258 ммоль) в метаноле (10 мл) добавляли при перемешивании и при комнатной температуре в атмосфере азота 2,5 н. раствор гидроксида натрия (0,6 мл). Метанол (2 х 2 мл) использовался для получения прозрачной смеси, после чего реакцию выдерживали до тех пор, пока данные ТСХ свидетельствовали о наличии непрореагировавшего эфира. Смесь фильтровали, упаривали в вакууме, полученный остаток перемешивали с 30 мл воды. После вызревания смесь фильтровали (осадок представлял собой натровую соль продукта - 100 мг), фильтрат при перемешивании подкисляли разбавленной соляной кислотой, выдерживали, фильтровали, промывали водой, получали продукт 8 (0,02 г) в виде белого твердого продукта, т.пл. 82 - 84oC, начало размягчения при 66oC.
Обработка соединения 8 NaIO4, как в случае стадии Ia, будет приводить к соответствующему сульфоксиду, а обработка соединения 8 м-хлорнадбензойной кислотой, как в стадии Ib, будет давать соответствующий сульфон.
Стадия F: 4-(2-(12-(изопропилтио)додеканоиламино)фенокси)бутирамид (9)
К раствору соединения 7 (20 мг, 0,041 ммоль) в метаноле (10 мл) при перемешивании добавляли метанол, насыщенный аммиаком (5 мл), и перемешивали при комнатной температуре до окончания реакции (данные ТСХ, отсутствие или небольшое количество соединения D). После упаривания реакционной массы и препаративной ТСХ (силикагель, элюент 3% метанол/метиленхлорид) получали соединение 9 (11 мг) в виде воскообразного твердого продукта.
Стадия G: Этил 4-(2-аминофенилтио)бутират (11)
К деаэрированному (азотом) раствору 2-аминотиофенола 10 (1,25 г, 10 ммоль) и этил 4-бромбутирата (2,1 г, 11 ммоль) в 40 мл сухого 1,2-диметоксиэтана при перемешивании добавляли 8,3 г твердого измельченного безводного карбоната калия, полученную смесь деаэрировали трижды азотом и перемешивали при комнатной температуре до окончания реакции (данные ТСХ). Смесь фильтровали, фильтрат упаривали, а полученный остаток очищали быстрой хроматографией на силикагеле (85 г), элюент 15% этилацетат/гексан, получали 1,8 г соединения 11 в виде светло-бежевого масла.
Стадия H: Этил 4-(2-(10-(изопропилтио)деканоиламино)фенилтио)бутират (12)
При проведении методики, описанной для стадии D, с использованием соединения 11 и 10 - (изопропилтио)декановой кислоты получали соединение 12.
Стадия I: 4-(2-(10-(изопропилтио)деканоиламино)фенилтио)бутановая кислота (13)
При гидролизе в условиях, описанных на стадии E, получали соединение 13.
Стадия J: 4-(2-(11-(этилсульфинил)ундеканоиламино)фенокси)бутановая кислота
При обработке эфиров или кислот метапериодатом натрия (стадия Ja) в подходящем растворителе (например, в смеси ацетон/вода) получали соответствующие сульфоксиды. Обработка метахлорнадбензойной кислотой (стадия Jb) приводит к соответствующему сульфону. Например, если этил 4-(2-(11-(этилтио)ундеканоиламино)фенокси)бутират 14 (0,045 г, 0,1 ммоль) в ацетоне (10 мл) реагирует с метапериодатом натрия (0,072 г, 0,33 мл) в воде (2 мл) при комнатной температуре получали соответствующий сульфоксид 15. Гидролиз по методике стадии E приводит к соединению 16, представляющему собой неокрашенный твердый продукт. Кроме того, обработка соединения 14 м-хлорнадбензойной кислотой приводит к сульфону 17, который при гидролизе в условиях стадии E дает кислоту 18.
Способ получения новых соединений настоящего изобретения, уже описанный для общего случая, может быть дополнительно проиллюстрирован следующими примерами, которые не должны рассматриваться в качестве примеров, ограничивающих объем изобретения.
Пример 1. Синтез 4-(2-(11-карбоксиундеканоилокси)фенокси)бутановой кислоты (8)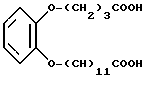 (7)
(7)
A. Этил 4-(2-бензилоксифенокси)бутират (3)
К раствору 2-бензилоксифенола 1 (4,0 г, 20 ммоль) и этил 4-бромбутирата 2 (5,6 г, 28,7 ммоль) в сухом ацетоне (100 мл) при перемешивании добавляли безводный измельченный карбонат калия (6,0 г, 44 ммоль) и полученную смесь кипятили в атмосфере азота до окончания реакции (данные ТСХ). Реакционную массу отфильтровывали, фильтрат упаривали и остаток очищали быстрой хроматографией (силикагель, элюент 15% этилацетат/гексан), получали 3,0 г продукта 3 в виде прозрачного масла.
При замене 4-бромбутирата другими галоэфирами получали соответствующие эфиро-эфиры. Аналогично, при использовании вместо указанного в методике фенола других замещенных 2- бензилоксифенолов, получали соответствующие 2-замещенные эфиры. При замене на 2-бензилокси или 2- бензилтио-тиофенола 2-гидроксиоксифенола получали соответствующие тиоэфир-эфиры.
B. Этил-4-(2-гидроксифенокси)бутират (4)
Смесь соединения 3 (1,57 мг, 7% ммоль), этанола (50 мл), ледяной уксусной кислоты (7 капель) и 10%-ного палладия на угле выдерживали при комнатной температуре в атмосфере водорода (40 фунтов/кв. дюйм) до окончания поглощения водорода. Реакционную массу фильтровали, концентрировали, получали соединение 4 в виде масла.
C. Этанол 4-(2-(11-карбометокси)ундеканоилфенокси)бутират (6)
При взаимодействии соединения 4 (0,224 г, 1,0 ммоль) и метил 12-бромдодеканоата 5 (0,32 г, 1,1 ммоль) с карбонатом калия в ацетоне по методике примера А получали соединение 6 (0,3 г) в виде бесцветного масла.
При использовании в данной методике вместо метил 12- бромдодеканоата других гало-эфиров получали соответствующие диэфиры.
D. 4-(2-(11-карбоксиундецилокси)фенокси)бутановая кислота (7)
При перемешивании к раствору соединения 6 (0,102 г, 0,23 ммоль) в метаноле (4 мл) и в воде (3 капли) по каплям добавляли 2,5 N раствор гидроксида натрия (0,55 мл, 1,37 ммоль), добавляли еще 2 мл метанола для получения прозрачного раствора. По окончании реакции (данные ТСХ, 2% метанол в метиленхлориде (10 мл) с добавлением 4 капель ледяной уксусной кислоты) метанол упаривали в вакууме, остаток перемешивали с водой (10 мл), полученный раствор фильтровали, фильтрат подкисляли 2 н. соляной кислотой. Отфильтровывали осадок, промывали его водой и сушили. Получали соединение 7 (88 мг) в виде белого твердого продукта, т. пл. соединения при 95oC, расплавление при 105oC (не точно; A.O.Spencer Hot Stage).
Элементный анализ для C22H34O6
Вычислено, %: C 66,98; H 8,69;
Найдено, %: C 67,32; H 8,45.
Спектры ЯМР и масс-спектры всех соединений 1-7 соответствовали предложенному строению.
4-(2-(11-карбоксиундецилокси)фенилсульфинил)бутановая кислота
При обработке тиоэфиров, например соединения 7А в схеме C в виде эфира или кислоты, метапериодатом натрия в подходящем растворителе получали соответствующий сульфоксид. Аналогично, при взаимодействии тиоэфиром с м-хлорнадбензойной кислотой получали соответствующий сульфон. Например, при взаимодействии 4-(2-(11- карбоксиундецилокси)фенилтио)бутановой кислоты 7А (0,41 г, 1,9 ммоль) в ацетоне (25 мл) с метапериодатом натрия (0,72 г, 3,3 ммоль) в воде при комнатной температуре получали сульфоксид 7B. При обработке этого же соединения избытком м-хлорнадбензойной кислоты в метиленхлориде получали соответствующий сульфон.
Спектры ЯМР и масс-спектры всех соединений 3-16 соответствовали предложенному строению.
Пример 1. Получение 4-(2-(11-карбоксиундеканоиламино)фенокси)бутановой кислоты
Стадия A: Этил-4-(2-нитрофенокси)бутират (3)
К раствору 2-нитрофенола 1 (1,4 г, 10 ммоль) и этил-4-бромбутирата (2,1 г, 1,57 мл, 11 ммоль) в 35 мл сухого ацетона добавляли при перемешивании 2 г (14,5 ммоль) безводного измельченного карбоната калия. Полученную окрашенную смесь нагревали в атмосфере азота и кипятили до тех пор, пока не исчезала окраска, обусловленная фенолят-ионом, и смесь не становилась желтой. Смесь охлаждали, фильтровали и упаривали, получали масло, которое очищали быстрой хроматографией (силикагель, элюент этилацетат/гексан или метиленхлорид), получали 2,4 г (96%) соединения (3) в виде маслянистой жидкости.
Стадия B: Этил-4-(2-аминофенокси)бутират (4)
Раствор соединения 3 (1,27 г, 5,0 ммоль) в 15 мл этил-ацетата, содержащий 200 мг 5%-ного палладия на угле, выдерживали в атмосфере водорода (40 фунтов/кв. дюйм) при комнатной температуре до прекращения поглощения водорода. Затем смесь фильтровали и упаривали в вакууме, получали 1,0 г соединения 4 в виде масла/низкоплавкого твердого продукта.
Стадия C: Додекандиовой кислоты монометиловый эфир
Диэтилдодеканоат 5 (34,4 г, 0,12 ммоль) обрабатывали октагидратом гидроксида бария (19,2 г, 0,06 ммоль) в метаноле (240 мл) по методике, описанной в статье J. Org. Syn. Coll. Vol. 111, p. 635, получали 24,8 г соединения 6 в виде белого твердого продукта.
Стадия D: Додекандиовой кислоты монометиловый эфир монохлорангидрид (7)
Смесь монокислоты 6 (10 г, 0,041 моль) и тионилхлорида (12,1 г, 0,166 моль) кипятили 5 ч, избыток тионилхлорида удаляли в вакууме, растворяя несколько раз в бензоле и упаривая досуха, получали 10,8 г названного соединения 7 в виде воскообразного продукта.
Стадия E: Этил-4-(2-(11-карбометоксиундеканоиламино)фенокси)бутират (8)
К охлажденному льдом раствору 0,89 г (4,0 ммоль) амина 4 и сухого триэтиламина (1,2 мл) в сухом эфире (40 мл) при перемешивании по каплям добавляли в течение 4 мин раствор хлорангидрида кислоты 7 (1,04 г, 4,6 мл) в 20 мл сухого эфира. Полученную смесь перемешивали при охлаждении в течение 20 мин, а затем при комнатной температуре в течение ночи. Реакционную массу фильтровали от хлорангидрата триэтиламина, эфирный фильтрат упаривали в вакууме, полученный остаток хроматографировали на колонке с 82 г силикагеля, элюент 20% этилацетат/гексан, получали 1,49 г (выход 85%) соединения 8 в виде воскообразного продукта.
В этой реакции эфир/триэтиламин могут быть заменены на метиленхлорид/пиридин. То же соединение может быть получено при прямом соединении кислоты 6 с таким же амином с использованием известных связывающих реагентов, таких как дициклогексилкарбодиимид, N,N-диметиламинопиридин и т.д.
Стадия F: 4-(12(11-карбоксиундеканоиламино)фенокси)бутановая кислота (9)
К раствору соединения 8 (1,0 г, 2,22 ммоль) в метаноле (100 мл) при перемешивании добавляли 1 мл воды, а затем по каплям добавляли раствор 2,5 н. раствора гидроксида натрия (4,0 мл). Стенки реакционной колбы промывали 10 мл метанола и полученную смесь перемешивали в атмосфере азота до окончания реакции (исчезновение моно - или диэфира, данные ТСХ). Метанол упаривали в вакууме, остаток обрабатывали 100 мл воды при перемешивании, фильтровали (промывали 20 мл воды), полученный фильтрат при перемешивании подкисляли 2 н. соляной кислотой, которую добавляли по каплям. Отфильтровывали образовавшийся осадок, промывали водой дважды и сушили. Получали 0,87 г (выход 96%) соединения 9 в виде мелоподобного продукта. Согласно данным ТСХ (силикагель, элюент 10 мл 2%-ного метанола в метиленхлориде, содержащие 4 капли ледяной уксусной кислоты) продукт содержал одно соединение, т. пл. 128,5-130oC.
Элементный анализ:
Вычислено,%: C 64,84; H 8,16; N 3,44;
Найдено, %: C 64,90; H 8,34; N 3,33.
Стадия G: Этил 4-(2-амино-3-метилфенилтио)бутират (11)
К деаэрированному (азотом) раствору 2-аминотиофенола 10 (1,25 г, 10 ммоль) и этил 4-бромбутирата (2,14 г, 11 ммоль) в сухом 1,2-диметоксиэтане (40 мл) при перемешивании добавляли 8,3 г твердого измельченного безводного карбоната калия, полученную смесь диаэрировали трижды азотом и перемешивали при комнатной температуре до завершения реакции (данные ТСХ). Смесь фильтровали и концентрировали, полученный остаток подвергали быстрому хроматографированию на силикагеле (85 г) с использованием 15% этилацетата в гексане в качестве элюента. Получали 1,8 г соединения 11 в виде светло-бежевого масла.
Стадия H: 4-(2-(11-карбоксиундеканоиламино)фенилтио)бутановая кислота (13)
При ацилировании амина 11 хлорангидридом кислоты 7 по методике, описанной в стадии E, с последующим гидролизом получаемого диэфира (этил-4-(2-(11-карбометоксиундеканоиламино)фенилтио)бутирата 12) на стадии I по методике стадии F получали названное соединение 13, т.пл. 113,5-115oC.
Следующие соединения данной серии были дополнительно получены по описанной выше методике:
14) 4-(2-(9-карбоксинонаноиламино)фенокси)бутановая кислота, т. пл. 121,5-124,5oC.
15) 4-(2-(10-карбоксидеканоиламино)фенокси)бутановая кислота, т. пл. 110-111,5oC.
16) 4-(2-(12-карбоксидодеканоиламино)фенокси)бутановая кислота, т.пл. 116-119oC.
17) 4-(2-13-(карбокситридеканоиламино)фенокси)бутановая кислота, т.пл. 128-129,5oC.
18) 4-(2-(15-карбоксипентадеканоиламино)фенокси)бутановая кислота, т.пл. 121-125oC.
19) 4-(2-(11-карбоксиундеканоиламино)фенокси)валериановая кислота, т.пл. 112-113,5oC.
20) 4-(2-(11-карбоксиундеканоиламино)-3-метилфенокси)бутановая кислота, т.пл. 134,5-136,5oC.
21) 4-(2-(11-карбоксиундеканоиламино)-4-метилфенокси)бутановая кислота, т.пл. 99,5-100,5oC.
22) 4-(2-(11-карбоксиундеканоиламино)-5-метилфенокси)бутановая кислота, т.пл. 109,5-113oC.
Стадия I: Бензил 2-нитрофениловый эфир (23)
При взаимодействии 2-нитрофенола 1 с бензилбромидом в условиях, описанных в стадия A, получали названное соединение в виде масла золотистого цвета.
Стадия K: Бензил 2-аминофениловый эфир (24)
Раствор бензил 2-нитрофенилового эфира 23 (1,15 г, 5,0 ммоль) в этаноле (25 мл), насыщенном безводным аммиаком, перемешивали в атмосфере азота (давление 40 фунтов/кв.дюйм) в присутствии никеля Ренея (2 г) до окончания реакции (данные ТСХ, исчезновение исходного нитросоединения). Смесь фильтровали и с помощью сухого азота отдували от избытка аммиака. После удаления этанола при комнатной температуре вакуумной отгонкой получали 1,0 г соединения 24 в виде сильно окрашенного остатка, который использовали без дополнительной обработки в следующей реакции. Это же соединение может быть получено при осторожном восстановлении в этаноле или в этилацетате с использованием в качестве катализатора палладия на угле, но этот процесс сопровождается незначительным избыточным восстановлением.
Стадия L: N-трифторацетил-2-бензилоксианилин (25)
К смеси амина 24 (5,0 ммоль) и сухого диэтилового эфира (30 мл) при перемешивании добавляли безводный карбонат натрия (6,9 г, 57 ммоль) и полученную смесь охлаждали на ледяной бане. К охлажденной смеси по каплям в течение 2 мин добавляли трифторуксусный ангидрид (1,5 мл, 10,6 ммоль), реакционная смесь становилась желтовато-красной. Через 2 ч убирали охлаждающую баню и реакционную массу перемешивали при комнатной температуре в течение ночи, затем фильтровали, фильтрат концентрировали в вакууме и получали 1,3 г названного соединения 25 в виде светло-бежевого остатка (с красно-коричневой окраской по краям).
Стадия M: N-метил-2-бензилоксианилин (27)
Хорошо перемешиваемый раствор соединения 25 (0,295 г, 1,0 ммоль), метилиодида (0,25 мл, 4,0 ммоль) и безводного ацетона (5,0 мл) помещали в масляную баню, предварительно нагретую до 59oC, и выдерживали при этой температуре 2 мин. Затем в одну порцию добавляли порошок безводного гидроксида калия (0,225 г, 4,0 ммоль), температуру бани поднимали до 65oC. Наблюдалось комкование некоторого количества KOH. Через 15 мин реакционную массу вынимали из бани, охлаждали и удаляли летучие компоненты. При перемешивании к полученному остатку N-метил-N-трифторацетил-2-бензилоксианилина 26 добавляли метанол (7 мл), затем воду (1 мл) и снова метанол (1 мл) (для промывки стенок). После перемешивания в течение ночи при комнатной температуре метанол упаривали в вакууме, остаток обрабатывали эфиром и водой, соли разделяли, органический слой промывали водой, насыщенным раствором хлористого натрия и сушили сульфатом натрия. После фильтрования эфирный раствор упаривали и получали названное соединение 27 (0,212 г) в виде масла. По данным спектров ЯМР, масс-спектра и ТСХ продукт содержал незначительное количество диметильного производного.
Стадия N: N-(11-(карбометокси)ундеканоил)-N-метил-2- бензилоксианилин (28)
К охлажденному льдом раствору соединения 27 (0,21 г, 1,0 мл) в сухом метиленхлориде (10 мл), содержащем безводный пиридин (0,3 мл) при перемешивании по каплям в течение 1 мин добавляли соединение 7 (0,27 г, 1,03 ммоль) в 5 мл метиленхлорида (небольшое количество метиленхлорида использовали для промывки). После перемешивания в течение 30 мин смеси давали нагреться до комнатной температуры для завершения реакции. Затем реакционную массу промывали 1 раз 1 н. соляной кислотой, сушили сульфатом натрия и фильтровали. После быстрой хроматографии (силикагель, элюент 20% этилацетат/гексан) получаемого остатка выделяли названное соединение 28 (0,3 г) в виде бесцветного масла.
Стадия O: N-(11-(карбометокси)ундеканоил)-N-метил-2- гидроксианилин (29)
Раствор соединения 28 (0,11 г, 0,25 ммоль) в метаноле (11 мл), содержащем 10%-ный палладий на угле (30 мг), встряхивали в атмосфере водорода (давление 40 фунтов/кв. дюйм) до окончания реакции (данные ТСХ, отсутствие Y). Отфильтрованный раствор концентрировали в вакууме, получали названное соединение 29, которое немедленно использовали на стадии P.
Стадия P: Этил 4-(2-N-(11-кабометоксиундеканоил)-N-метиламино)фенокси)бутират (30)
К раствору соединения 29 (0,087 г, 0,25 ммоль) и этил 4-бромбутирата (0,1145 мл, 0,80 ммоль) в безводном ацетоне (10 мл) при перемешивании добавляли безводный измельченный карбонат калия (0,45 г, 3,2 ммоль) и полученную смесь грели при мягком кипении в атмосфере азота в течение 24 ч. Смесь охлаждали, фильтровали, упаривали и подвергали быстрому хроматографированию (силикагель, элюент 20% этилацетат/гексан), получали 80 мг названного соединения 30 в виде бесцветного масла.
Стадия Q: 4-(2-N-(11-кабометоксиундеканоил)-N-метиламино)фенокси)бутановая кислота (31)
При гидролизе соединения 30 (0,055 г, 0,118 ммоль), аналогично его N-дезметиловому аналогу (стадия F) с последующим подкислением и экстракцией полученного масла метиленхлоридом, получали названное соединение 31 (51 мг) в виде бесцветного масла.
Стадия R: Этил 4-(2-(11-бромундеканоиламино)фенокси)бутират (32)
К раствору соединения 4 (2,60 г, 11 ммоль) 11-бромундекановой кислоты (2,65 г, 10 ммоль) в безводном метиленхлориде (90 мл) добавляли 4-(диметиламино)пиридин (1,22 г, 10 ммоль), а затем N,N-дициклогексилкарбодиимид (2,3 г, 11 ммоль) (промывка 4 х 5 мл метиленхлорида). Осадок дициклогексилмочевины появлялся через 4 мин. По окончании реакции (данные ТСХ) смесь фильтровали, фильтрат концентрировали в вакууме и остаток экстрагировали эфиром. Объединенные экстракты промывали один раз 1 н. соляной кислотой, 1 раз насыщенным раствором хлористого натрия, сушили сульфатом натрия и упаривали или с эфиром, или с хлористым метиленом до полного удаления дициклогексилмочевины. После упаривания последнего раствора получали названный продукт 32 (2,35 г) в виде масла, которое легко превращалось в воскообразный продукт.
Попытки провести очистку колоночной хроматографией, описанной выше (силикагель, элюент 20% этилацетат/гексан) приводили к получению загрязненного продукта, при значительном снижении выхода.
Стадия S: Диэтил 10-(N-((2-(3-карбоэтокси)пропилокси)фенил)карбоксамидо)децилфосфонат (33)
Смесь соединения 32 (0,252 г, 0,5 ммоль) и триэтилфосфита (ТЭФ) при перемешивании выдерживали в атмосфере азота при 180oC (температура бани) в течение 8 ч, охлаждали, удаляли избыток ТЭФ в вакууме и остаток подвергали быстрому хроматографированию (силикагель, элюент этилацетат). Получали соединение 33 (0,13 г) в виде бесцветного масла.
Стадия T: Расщепление фосфонатного эфира 33 с помощью бромтриметилсилана (методика - J. C.S.Chem. Comm. 1979, p. 139) приводило к 10-(N-((2-(3-карбоэтокси)фенокси)фенил)карбоксамидо)децилфосфиновой кислоте 34.
Стадия U: Дальнейший гидролиз соединения 34 по методике примера Г приводил к соответствующей ди-кислоте, 10-(N-((2-(3-карбокси)фенокси)фенил)карбоксамидо)децилфосфиновой кислоты 35.
Стадия V: 10-(N-((2-(3-карбоэтокси)пропилокси)фенил)карбоксамидо)деканизотиуроний бромид (36)
Раствор соединения 32 (0,047 г, 0,1 ммоль) в этаноле (2 мл) при перемешивании обрабатывали тиомочевиной (0,010 г, 0,13 ммоль) в условиях, аналогичных условиям, описанным для стадии W. После упаривания реакционной смеси получали названное соединение 36 (содержало небольшое количество тиомочевины), которое медленно кристаллизовалось при стоянии. Растирание с сухим хлороформом и последующие фильтрование и концентрирование приводили к продукту в виде густого воска.
Стадия W: 10-(N-((2-(3-карбоэтокси)пропилокси)фенил)карбоксамидо)декантиосульфат натрия (37)
К раствору соединения 32 (0,047 г, 0,1 ммоль) в этаноле (2,0 мл) при перемешивании медленно добавляли воду (10 капель), а затем тиосульфат натрия (0,035 г, 0,14 ммоль) и реакционную массу нагревали в атмосфере азота на масляной бане (температура бани приблизительно 90oC) до окончания реакции (данные ТСХ). Смесь охлаждали и упаривали этанол и воду. Получали белый остаток, экстрагирование которого хлороформом и фильтрование от неорганических примесей приводило к продукту 37 (49 мг) в виде глазури, которая со временем превращалась в воскообразный твердый продукт. Полученный продукт имел хорошую растворимость в воде.
Окисление соединения 36 или 37 по методике, описанной Шоуваллом Д.С. и др. - J.Org. Chem. - 1962, 27, p.2853, или Циглером С. и др. J.Org. Chem. - 1951, p.621, приводило к соответствующей сульфокислоте 38.
Стадия X: Этил 4-(2-нитропирид-3-илокси)бутират (40)
Данное соединение получали из этил 4-бромбутирата 2 и 2-нитро-3-пиридинола 39 по методике стадии А. После быстрой хроматографии (силикагель, элюент 1,5% метанол/метиленхорид) для удаления следов исходного фенола необходима промывка эфирного раствора продукта разбавленным раствором бикарбоната натрия. Получали соединение 40 в виде светло-желтого масла, выход 76%.
Стадия V: Этил 4-(2-аминопирид-2-илокси)бутират (41)
Данное соединение получали при восстановлении соединения 40 по методике, описанной для стадии B. Амин 41 был получен в виде воскообразного твердого продукта.
Стадия Z: Этил 4-(2-(11-карбометоксиундеканоиламино)пирил-3-илокси)бутират (42)
При взаимодействии соединений 41 и 7 по методике, описанной для стадии E, получали названное соединение 42, гидролиз которого приведет к соответствующей дикислоте 4-(2-(11-карбоксиундеканоиламино)пирид-3-илокси)бутановой кислоте 43.
Стадия AA: N-(11-карбометоксиундеканоил)-2-гидроксианилин (44)
К смеси 2-аминофенола (0,24 г, 2,2, ммоль) и безводного метиленхлорида (25 мл) при перемешивании добавляли сухой пиридин (0,66 мл) и полученную смесь охлаждали на ледяной бане. В течение 1 мин добавляли раствор соединения 7 (0,525 г, 2,0 ммоль) в метиленхлориде (2 мл) (промывка 2 х 1,5 мл метиленхлорида) и смесь перемешивали при охлаждении. Через 30 мин охлаждение убирали и перемешивали в течение ночи при комнатной температуре. Смесь фильтровали, растворитель упаривали в вакууме и остаток прокачивали для удаления следов пиридина. Соединение 44 использовали без дополнительной обработки на следующей стадии.
Стадия BB: 4-(2-(11-карбометоксиундеканоиламино)фенокси)бутиронитрил (45)
При взаимодействии соединения 44 и 4-бромбутиронитрила по методике, описанной для стадии A, получали соединение 45 в виде воскообразного твердого продукта. При взаимодействии соединения 44 с этил 4-бромбутиратом по методике стадии A получали соединение 8.
Стадия CC: 4-(2-(11-карбометоксиундеканоиламино)фенокси)бутирамид (46)
К раствору соединения 45 (11 мг, 0,027 ммоль) в метиленхлориде (3 мл) добавляли при перемешивании активированный диоксид магния (100 мл) и полученную суспензию перемешивали при комнатной температуре. Через несколько дней к реакционной смеси добавляли некоторое дополнительное количество метиленхлорида и диоксида магния (100 мг) для завершения реакции. Операцию повторяли еще раз. По окончании реакции (данные ТСХ, отсутствие исходного нитрила) реакционную массу фильтровали, катализатор хорошо промывали чистым метиленхлоридом, фильтрат концентрировали, получали указанный продукт 46 в виде воскообразного твердого продукта.
Описанные выше новые чистые соединения имели спектры ЯМР и масс-спектры, соответствующие предложенной структуре. Все значения температур плавления получены на А.О. Spencer hot stage и не являются точными.
Часть 4
Пример 1. 17β- бензоил-андрост-3,5-диен-3-карбоновая кислота
Данное соединение получено при взаимодействии 17β- карбометокси-андрост-3,5-диен-3-защищенной карбоновой кислоты, например, в ТГФ с фенилмагнийбромидом в стандартных условиях реакции Гриньяра. Получали названное соединение, т.пл. 222 - 225oC,
Справочный пример 1. Синтез 4-(4-изобутилбензилокси)-2,3-диметилбензальдегида
Смесь 4-гидрокси-2,3-диметилбензальдегида (220 мг), 4-изобутилбензилбромида (341 мг), карбоната калия (1,38 г) и этилметилкетона (10 мл) кипятили в течение 6 ч. После охлаждения реакционную массу разбавляли этилацетатом, раствор промывали разбавленной соляной кислотой, водой, сушили и упаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент гексан/этилацетат, 10:1), получали названное соединение (383 мг) со следующими физическими свойствами:
ТСХ: Rf 0,48 (гексан/этилацетат, 5:1);
Спектр ЯМР, δ м.д.: 7,64 (1H, д.), 7,32 (1H, д), 7,16 (1H, д), 5,12 (2H, с), 2,60 (3H, с), 2,48 (2H, д), 2,24 (3H, с), 1,94 - 1,80 (1H, м), 0,90 (6H, д).
Справочный пример 2. Синтез 4-(4-изобутилбензилокси)-2,3-диметилбензойной кислоты
Раствор альдегида, полученного в справочном примере 1, (380 мг) в ацетоне (5 мл) охлаждали льдом. К раствору медленно добавляли реагент Джонса (2,67 н. , 2 мл) и перемешивали в течение 1,5 ч при комнатной температуре. Реакцию останавливали путем добавления изопропилового спирта. Кристаллический осадок промывали гексаном, сушили и очищали колоночной хроматографией на силикагеле (элюент гексан/этилацетат), получали названное соединение (328 мг) со следующими физическими свойствами.
ТСХ: Rf 0,36 (гексан/этилацетат, 2:1).
Спектр ЯМР, δ м.д.: 7,80 (1H, д), 7,33 (1H, д), 7,15 (1H, д). 6,90 (1H, д), 5,09 (2H, с), 2,58 (3H, с), 2,48 (2H, д), 2,26 (3H, с), 0,91 (6H, д).
Справочный пример 3. Синтез 4-[2-[4-(4-изобутилбензилокси)-2,3-диметилбензоиламино]фенокси]бутановой кислоты этилового эфира
Оксалилхлорид (2 мл) по каплям добавляли к раствору карбоновой кислоты, полученной в справочном примере 2, (325 мг) в метиленхлориде (2 мл). Полученный раствор перемешивали в течение 1 ч и упаривали. К охлажденной льдом смеси этил 4-(2-аминофенокси)бутаноата (232 мг), пиридина (1 мл) и метиленхлорида (15 мл) при перемешивании по каплям добавляли полученный раствор. Смесь перемешивали 30 мин при той же температуре и 1 ч при комнатной температуре. Реакционную массу промывали водой, сушили и упаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент гексан/этилацетат, 5: 1), получали названное соединение (383 мг) со следующими физическими свойствами:
ТСХ:Rf 0,5 (гексан/этилацетат, 3:1).
Спектр ЯМР, δ м.д.: 8,58-8,48 (1H, м), 8,05 (1H, с), 7,34 (1H, д), 7,16 (1H, д), 7,08-6,96 (2H, м), 6,09-6,80 (2H, м), 5,07 (2H, с), 4,14-3,96 (4H, м), 2,49 (2H, д), 2,48 (2H, д), 2,44 (3H, с), 1,18 (3H, т), 0,91 (6Н, д).
Справочный пример 4. Синтез 4-[2-[4-(4-изобутилбензилокси)-2,3-диметилбензоиламино]фенокси]бутановой кислоты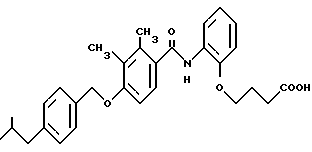
К раствору эфира, полученного в справочном примере 3, (380 г) в диметоксиэтане (8 мл) добавляли 1 н. раствор гидроксида лития (3 мл). Смесь перемешивали в течение 30 мин при 50oC, по окончания реакции раствор нейтрализовали разбавленной соляной кислотой и экстрагировали этилацетатом. Экстракт сушили и упаривали. Остаток перекристаллизовывали из гексана, получали указанное соединение (317 мг) со следующими физическими свойствами:
ТСХ: Rf 0,26 (гексан/этилацетат, 1:1), т.пл. 143oC.
Справочный пример 5. По методике, аналогичной методикам примеров 1, 2, 3 и 4, получена 4-[2-[4-[1-(4-изобутилфенил)этокси)-2,3-диметилбензоиламино] фенокси]бутановая кислота следующей формулы
где заместитель R представляет собой остаток формулы
Справочный пример 6. (-)-4-[2-[4-[1-(4-изобутилфенил)этокси)- 2,3-диметилбензоиламино]фенокси]бутановая кислота
Соединение, полученное в предыдущем справочном примере 5, (403 мг) и хинконидина (2,36 г) растворяли при нагревании в ацетоне (70 мл). Полученный раствор выдерживали до образования кристаллов. Кристаллы отфильтровывали, перекристаллизовывали из ацетона четыре раза. Полученные белые кристаллы растворяли в хлороформе. Раствор промывали разбавленной соляной кислотой. Маслянистый слой промывали водой, сушили и упаривали, получали названное соединение со следующими физическими свойствами:
Внешний вид: белые кристаллы:
Угол оптического вращения: [α]-39,6° (c=1, CHCl3).
Справочный пример 7. Натровая соль (-)-4-[2-[4-[1-(4-изобутилфенил)этокси)-2,3-диметилбензоиламино] фенокси]бутановая кислота
Соединение, полученное в справочном примере 6, растворяли в метаноле и добавляли мольный эквивалент раствора гидроксида натрия, упаривали и получали указанное соединение со следующими физическими свойствами:
ИК-спектр: 3050, 1750, 1580, 1560, 1510, 1445, 1260, 1090, 1020, 740 см-1.
Рецептурный пример. Следующие компоненты были смешаны обычными способами и сформированы в 100 таблеток, каждая из которых содержала 50 мг активного ингредиента, г:
4-[2-[4-[1-(4-изобутилфенил] этокси)-2,3-диметилбензоиламино]фенокси]бутановая кислота - 5
Кальций глюконатцеллюлоза (дезинтегрирующее средство) - 0,2
Стеарат магния (смазывающее средство) - 0,1
Микрокристаллическая целлюлоза - 4,7
Примеры фармацевтических композиций
Пример 1. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 1 мг теразозина и 5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо-4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 2. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 2 мг теразозина и 5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо-4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 3. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 5 мг теразозина и 5 мг финастерида (17β- -(N-трет.- бутилкарбамоил)-3-оксо-4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 4. Композиция для перорального приема
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 10 мг теразозина и 5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо-4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 5. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 1 мг доксазозина и 5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо-4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 6. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 3 мл доксазозина и 5 мг финастерида (17β- N-трет.-бутилкарбамоил)-3-оксо-4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 7. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 4 мг доксазозина и 5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3- оксо-4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 8. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 8 мг доксазозина и 5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо- 4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 9. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 1 мг доксазозина и 2,5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо-4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 10. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 2 мг доксазозина и 2,5 мг финастерида (17β- (N- трет.-бутилкарбамоил)- 3-оксо-4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 11. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 4 мг доксазозина и 2,5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3- оксо-4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 12. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 1 мг празозина и 5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3- оксо-4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 13. Композиция для перорального введения.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 5 мг празозина и 5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо-4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получит общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 14. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 10 мг празозина и 5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3- оксо-4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 15. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 20 мг празозина и 5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо -4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 16. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 1 мг празозина и 2,5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3- оксо-4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 17. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 5 мг празозина и 2,5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо- 4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 18. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 10 мг празозина и 2,5 финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо-4- аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 19. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 5 мг алфузозина и 5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3- оксо-4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 20. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение настоящего изобретения, 7,5 мг алфузозина и 5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо-4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 21. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение настоящего изобретения, 10 мг алфузозина и 5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо- -4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 и 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 22. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 2,5 мг алфузозина и 2,5 мг финастерида (17β- (N-трет. -бутилкарбамоил)-3-оксо -4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 23. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 5 мг алфузозина и 2,5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо-4- аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 24. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 1 мг индорамина и 5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо-4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 25. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 5 мг индорамина и 5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо- 4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 26. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 10 мг индорамина и 5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо- 4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 27. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 20 мг индорамина и 5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо- 4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 28. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 40 мг индорамина и 5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо-4- аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 29. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 1 мг индорамина и 2,5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо- 4-аза- -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 30. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 5 мг индорамина и 2,5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо- 4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 31. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 10 мг индорамина и 2,5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3- оксо-4-аза- -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 32. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 20 мг индорамина и 2,5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3- оксо-4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 33. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 1 мг буназозина и 5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо-4- аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 34. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 5 мг буназозина и 5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо-4- аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 35. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 10 мг буназозина и 5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо- 4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 36. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 20 мг буназозина и 5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо- 4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 37. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 40 мг буназозина и 5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3- оксо-4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 38. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 1 мг буназозина и 2,5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо- 4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 39. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 5 мг буназозина и 2,5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо- 4-аза-5α- андрост-1-ен- 3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 40. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 10 мг буназозина и 2,5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо- 4-аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.
Пример 41. Композиция для перорального приема.
В качестве конкретного варианта осуществления композиции для перорального приема, содержащей соединение изобретения, 20 мг буназозина и 2,5 мг финастерида (17β- (N-трет.-бутилкарбамоил)-3-оксо-4- аза -5α- андрост-1-ен-3-она) соединяли с достаточно мелко измельченной лактозой, чтобы получить общее количество от 580 до 590 мг для заполнения твердой желатиновой капсулы 0 размера.



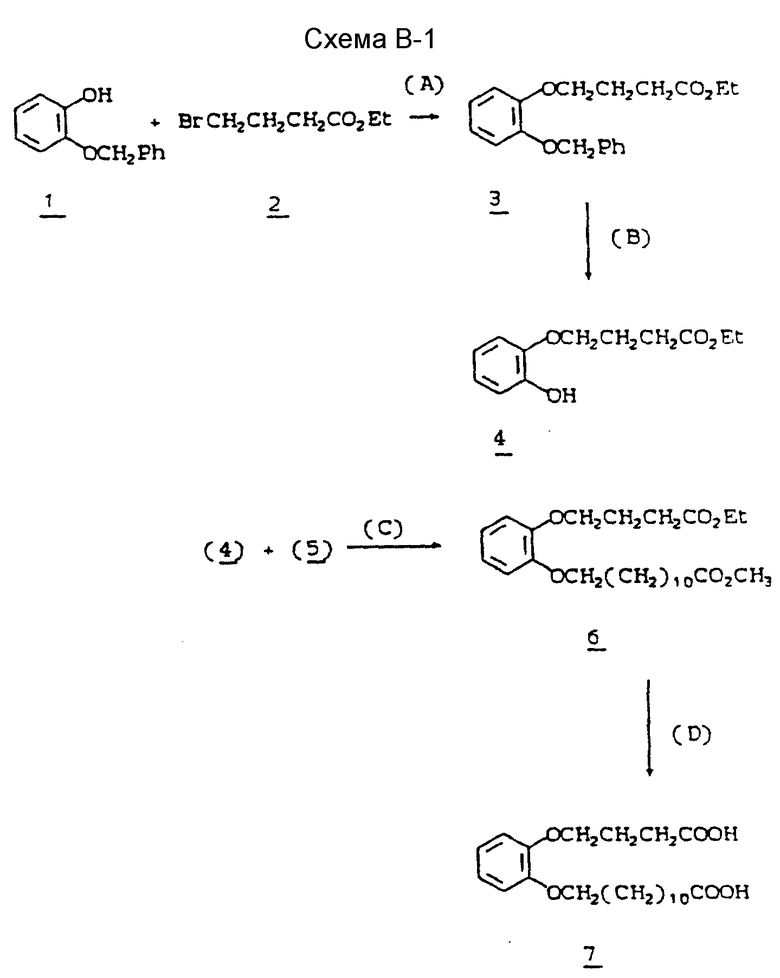
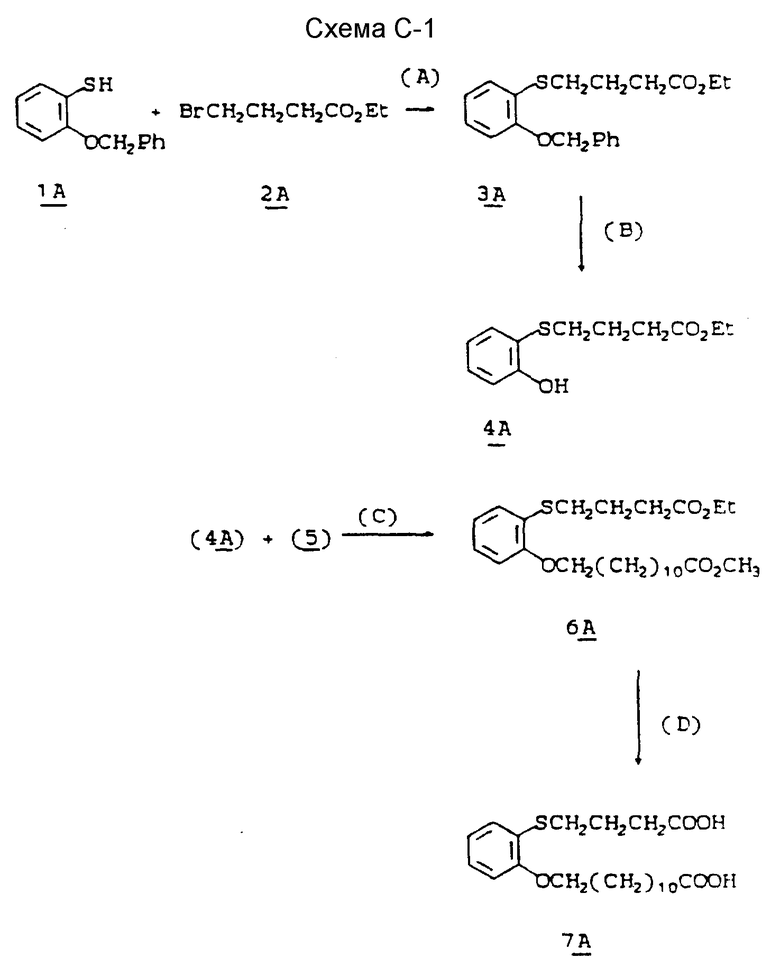
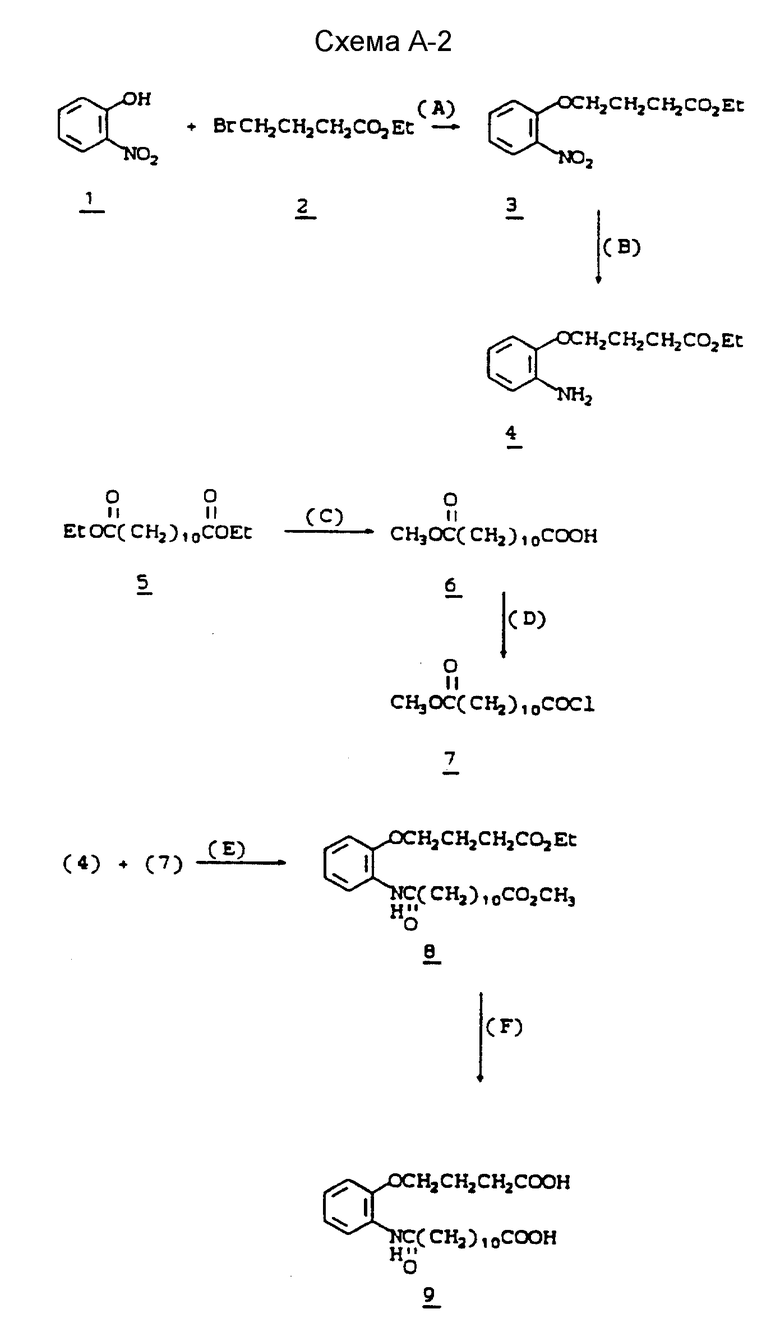




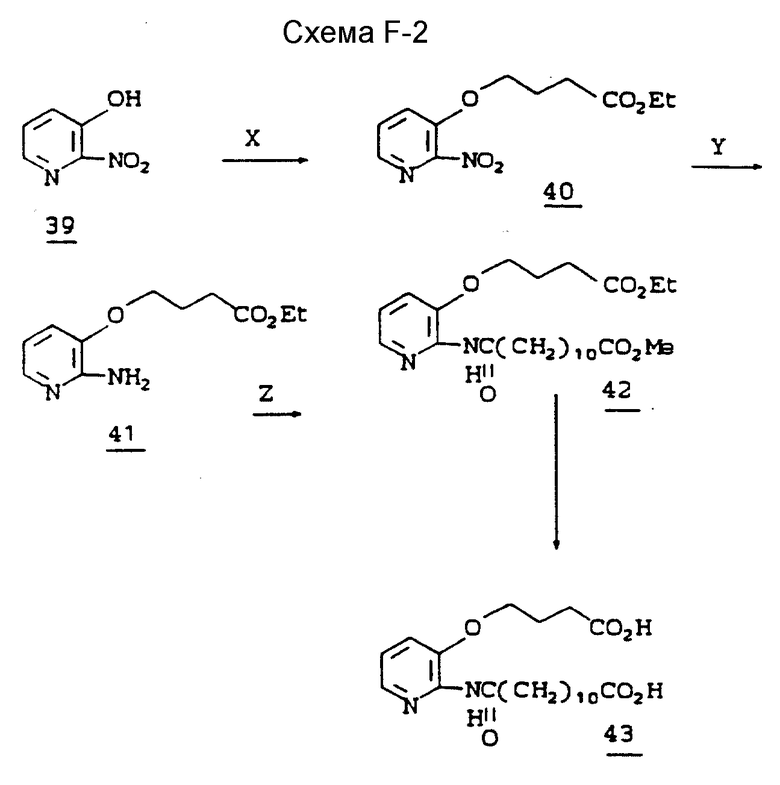




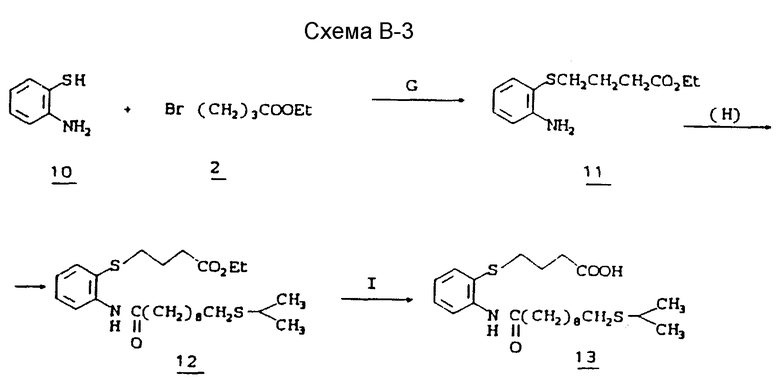



Изобретение предназначено для лечения доброкачественной гиперплазии предстательной железы. При лечении пациентам вводят около 5 мг ингибитора 5α-редуктазы в сочетании с 1 - 10,0 мг в день блокатора α1-адренергического рецептора. Фармацевтическая композиция для лечения этого заболевания включает 2,5 - 5,0 мг ингибитора 5α-редуктазы и 0,5-10,0 мг блокатора α1-адренергического рецептора в фармацевтически приемлемом носителе. Ингибиторы 5α-редуктазы выбирают из 17β-замещенного 4-азастероида, 17β-замещенных неазастероидов, 17β-ацил-3 карбоксиандрост-3,5 диенов, производных бензоиламинофеноксибутановой кислоты, конденсированных бенз(тио)амидов, циннамоиламидов, ароматических 1,2 -диэфиров или тиоэфиров, ароматических ортоациламинофеноксиалкановых кислот, ортотиоалкилациламинофеноксиалкановых кислот или их фармацевтически приемлемых солей и эфиров. Сочетанное использование двух активных ингредиентов приводит к достижению большего терапевтического эффекта. 2 с. и 13 з.п. ф-лы.
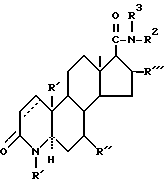
где пунктирная линия представляет собой двойную связь, если она присутствует;
заместители R1 и R3 независимо друг от друга - водород, метил или этил;
R2 - углеводородный радикал, выбираемый из числа линейного или разветвленного замещенного или незамещенного алкила, циклоалкила, или аралкила с 1 - 12 атомами углерода или моноциклического арила, возможно содержащего 1 или более низших алкильных заместителей с 1 - 2 атомами углерода и/или один или более заместителей из числа атомов галогена,
R' - водород или метил;
R'' - водород или β-метил,
R''' - водород, α- или β-метил,
и его фармацевтически приемлемые соли или эфиры.
где пунктирная линия представляет собой двойную связь, если таковая присутствует в молекуле;
R выбирается из водорода, метила и этила;
R2 представляет собой (а) моновалентный радикал, выбираемый из числа линейного или разветвленного алкила или циклоалкила, содержащих 1 - 12 атомов углерода, которые могут быть замещены одним или несколькими C1-C2-алкилами или атомами галогена; (б) аралкильный радикал, выбираемый из бензила или фенетила; (в) полициклический ароматический радикал, который может быть замещен одной или несколькими группами OH, группами, защищающими OH-группу, группами -OC1-C4-алкил, C1-C4-алкилами, атомами галогена или нитрогруппами; (г) моноциклический ароматический радикал, который может быть замещен одним или несколькими заместителями из числа: (1) - OH, -OC1-C4-алкила, C1-C4-алкила, -(CH2)mOH, -(CH2)n, COOH, в том числе группы, защищающие OH-группу, где m = 1 - 4, а n = 1 - 3, при условии, что C1-C4-алкил присутствует только тогда, когда присутствует один из указанных кислородсодержащих радикалов; (2) - SH, -SC1-C4-алкила, -SOC1-C4-алкила, -SO2N(C1-C4-алкила)2, C1-C4-алкил -(CH2)mSH, -S-(CH2)n -O-COCH3, где m = 1 - 4, n = 1 - 3, при условии, что C1-C4-алкил присутствует только тогда, когда присутствует один из указанных серусодержащих радикалов;
(3) N(R3)2-группа, которая может быть защищена, где заместитель R3 представляет собой H или C1-C4-алкил, когда моноарильный радикал также может быть замещен C1-C4-алкилом, и (д) гетероциклических радикалов, выбранных из числа 2- или 4-пиридила, 2-пирролила, 2-фурила или тиофенила;
заместители R', R'' и R''' каждый выбирают из числа атома водорода и метила,
а также их фармацевтически приемлемые соли.
где в кольце А содержится до двух двойных связей;
кольца В, С и D содержат оптимальные двойные связи, которые указаны пунктирной линией, при условии, что кольца А, В и С не содержат соседних двойных связей и кольцо D не содержит C16-C17-двойной связи, когда заместитель R3 представляет собой два заместителя или двухвалентный заместитель;
Z - (CH2)n, где n = 0 или 2, при условии, что заместитель Z - (CH)n, если он находится в соседнем положении к двойной связи;
Х представляет H, Cl, F, Br, J, CF3 или C1-C6-алкил;
Y представляет H, CF3, Cl, F, или CH3, при условии, что заместитель Y представляет собой водород, если отсутствует C5-C6- двойная связь;
R1 - H или C1-C8-алкил;
R2, если он присутствует, представляет H или CH3, при условии, заместитель R2 отсутствует, если атом углерода, к которому он присоединяется, является ненасыщенным;
R3 представляет собой
(1) α-водородный атом, или α-гидроксильную группу, или α-ацетоксигруппу и/или (а) группу формулы
W - связь или C1-C12-алкилиден;
R4 представляют собой (I) водород, (II) гидроксигруппу, (III) C1-C8-алкил, (IV) гидрокси - C1-C8-алкил, (V) C1-C8-алкокси, (VI) NR5 R6, где R5 и R6 каждый независимо друг от друга выбирают из водорода, C1-C8-алкила, C3-C6-циклоалкила, фенила; или заместители R5 и R6 вместе с атомом азота, к которому они присоединены, образуют 5 - 6-членное насыщенное кольцо, (VII) OR7, где R7 - водород, щелочной металл, C1-C8-алкил, бензил или (б) - Alk - OR8, где Alk представляет C1-C12-алкилиден, R8 представляет собой (I) фенил - C1-C6-алкилкарбонил, (II) C5-C10-циклоалкилкарбонил, (III) бензоил, (IV) C1-C8-алкоксикарбонил, (V) аминокарбонил или C1-C8-алкилзамещенный аминокарбонил, (VI) атом водорода или (VII) C1-C8-алкил;
(2) = CH-W-COR4 или = CH -W- COR8, где W - связь C1-C12-алкилидена, R4 и R8 принимают указанные значения, а R8 также является водородом или C1-C20-алкилкарбонильной группой;
(3) группу формулы
где прерванная связь замещает 17β-водородный атом;
(4) α-водородный атом или группу HNCOR9, где R9 - C1-C12-алкил или N R5 R6 - группа, где R5 и R6 принимают указанные значения;
(5) α- водородный атом или цианогруппу,
(6) α- водородный атом, или тетразолил, или
(7) кетогруппу;
или их фармацевтически приемлемую соль, за исключением соединений, в которых:
(I) кольцо В содержит C5- C6-двойную связь, R1 - CH3, а R3 является кетогруппой, метоксикарбонилом или ацетилом; или
(II) кольцо А-нор содержит C3-C4 - двойную связь, а R3 - ацетокси или ацетил;
(III) R1 - CH3, а R3 является ацетоксигруппой или ацетилом или
(IV) кольцо А-нор содержит C3-C4 - двойную связь, а R1 - метил; или
(V) кольцо В содержит C3-C4 - двойную связь, а R3 является β-гидроксигруппой.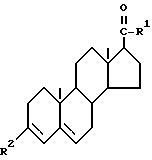
где R1 представляет собой (а) C1-C6 - линейный или разветвленный алкил; C3-C12-циклоалкил, который может быть замещен C1-C4-алкоксигруппой или C1-C4-линейным/разветвленным алкилом; C7-C12-арил или C7-C13-аралкил, которые могут быть замещены одним или несколькими заместителями из числа -OH, -OC1-C4-алкила, C3-C4-алкила, -(CH2)mOH, -(CH2)n, COOH, включая защищенную OH-группу, где m = 1 - 4, а n = 1 - 3; (б) C1-C6 - линейный или разветвленный алкил; C3-C12-циклоалкил, который может быть замещен C1-C4-алкоксигруппой или C1-C4-линейным/разветвленным алкилом; C6-C12-арил или C7-C13-аралкил, которые могут быть замещены одним или несколькими заместителями из числа -OH, -OC1-C4-алкила, C1-C4-алкила, -(CH2)mOH; -(CH2)n,
COOH, включая защищенную OH-группу, где m = 1 - 4, а n = 1 - 3;
R2 выбирается из COOH, SO3H, PO(OH)2, PH(O) OH.
где R' - атом водорода или алкил, содержащий от 1 до 4 атомов углерода;
А - кислород, сера или сульфильная (SO) группа;
R1 оба представляют собой метил или хлор, или оба R1 и атомы углерода бензольного кольца, к которому присоединены два заместителя R1, вместе образуют циклопентановое, циклогексановое или бензольное кольца;
R2 представляет остатки формул
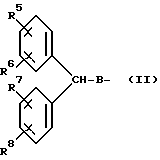
или
где В - кислород, сера или остаток формулы NR11 где R11 - водород или алкил, содержащий 1 - 4 атомов углерода;
R3 - R8 независимо друг от друга - алкил, содержащий 1 - 4 атомов углерода, галоген, трифторметильная или циклобутилметильная группа;
m = 0 или 1;
n = 1 - 5;
R9 - водород, алкил, содержащий 1 - 5 атомов углерода, или группа формулы

или
где R12 - R15 независимо друг от друга - водород, алкил, содержащий 1 - 4 атомов углерода, галоген, трифторметильная или циклобутилметильная группа, а 1 = 1 - 4, целое число;
R10 представляет группу формул
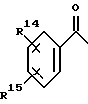
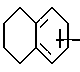
R12 - R15 независимо друг от друга - водород, алкил, содержащий 1 - 4 атомов углерода, галоген, трифторметильная или циклобутилметильная группа;
l1 = 1 - 4, целое число;
а также их нетоксичные соли.
где R2 и R3 каждый независимо друг от друга - или метильная группа, при условии, что (I) если заместитель R2 представляет метильную группу, R3 - водород, (R1)n представляет группу, выбранную из группы, включающей 3-пентильную, 4-пентильную, 4-неопентильную группы, 4-(2-этилбутил)-и 4-(2-метилфенил), или (II) если R2 - водород, R3 - метильная группа, (R1)n - 3-пентильная группа,
а также их нетоксичные соли.
где А представляет собой одинарную связь или группу, выбираемую из метилена, этилена, триметилена, тетраметилена, винилена, пропенилена, бутенилена, бутадиенилена или этинилена, возможно замещенных одной, двумя или тремя линейными или разветвленными алкильными группами, содержащими 1 - 10 атомов углерода и/или фенильной (ыми) группой(ами);
В - 4 - 8-членное гетероциклическое кольцо, содержащее один, два или три гетероатома, выбранных из группы, включающей атомы кислорода, азота и серы, при этом указанное кольцо может быть возможно замещено заместителями из оксо-, тиоксо- и/или гидроксигрупп, включая кольца формул
Т - кислород или сера;
R1 представляет собой остаток формул


(IV) линейный или разветвленный алкил, алкенил или алкинил, содержащие 1 - 20 атомов углерода,
где заместители R5 и R6 независимо друг от друга - водород или галоген, или разветвленный или линейный алкил, алкенил или алкинил, содержащие 1 - 20 атомов углерода, которые могут быть незамещенными или замещенными по одному, двум, трем, четырем или пяти атомам углерода атомами кислорода, серы, галогена, азота, бензольными кольцами, тиофеновыми кольцами, нафталоновыми кольцами, карбоциклическими кольцами, содержащими 4 - 7 атомов углерода, карбонильными группами, карбонилоксигруппами, гидроксильными группами, карбоксигруппами, азидогруппами и/или нитрогруппами;
R2 - водород или линейный или разветвленный алкил, содержащий 1 - 6 атомов углерода;
R3 - водород, галоген, гидроксигруппа, нитрогруппа, группа общей формулы COOR7, где R7 - водород или линейный или разветвленный алкил, содержащий 1 - 6 атомов углерода; линейная или разветвленная алкокси- или алкилтиогруппа, содержащая 1 - 6 атомов углерода;
R4 представляет группу общей формулы
-V-(CH2)n -COO R8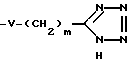
или
V - кислород или сера;
R8-водород или линейный или разветвленный алкил, содержащий 1 - 6 атомов углерода;
n и m = 1 - 10
p и q = 0 или 1 - 10, целое число,
а также их нетоксичные соли.
где А - 1,2-дизамещенное ароматическое кольцо, выбираемое из числа: (а) бензола; 1,2-замещенного нафталина; (б) 5 - 6-членного гетероароматического кольца, содержащего 1 - 2 атома азота, 1 атом серы или кислорода, или их сочетание; D и E независимо друг от друга представляют собой - COOH, -CONH2, -CONHRв, COORв, SO2OH, SO3(OH), SO2NH2, -SSO2ONа, -PH(O)(OH), -P(O)(OH)2;
X - O, S, SO или SO2;
R - водород, C1-C4-алкил, фенил или замещенный фенил, атом галогена, галогеналкил гидроксигруппа, карбоксильная группа, цианогруппа, C1-C4-алкоксигруппа, C1-C4-алкилтиогруппа, C1-C4-алкильсульфинильная группа,
C1-C4-алкилсульфонильная группа, нитрогруппа, аминогруппа, C1-C4-моно- или ди-алкиламиногруппа;
R' и R'' независимо друг от друга - водород, галоген, C1-C4-алкил или C1-C4-алкоксигруппа, аминогруппа или оксогруппа, где фрагменты CH-R' или CHR'' в указанной формуле становятся группой -C=0;
Rа представляет собой H или C1-C4-алкил;
Hb - C1-C12-алкил, фенил или фенил C1-C4-алкил;
y = 1 - 6;
z = 6 - 20;
(CH)y - R' и (CH)z R'' могут независимо друг от друга представлять замещенные или незамещенные алкильные радикалы или алкенильные радикалы, содержащие по меньшей мере одну алкеновую связь;
и их фармацевтически приемлемые соли и эфиры.
гле А - 1,2-дизамещенное ароматическое кольцо;
D - OH, NH2, NHRс, ORс;
X - O, S, SO, SO2;
R - водород, или C1-C4-алкил, фенил или замещенный фенил, галоген, галоалкил, гидроксигруппа, карбоксильная группа, цианогруппа, C1-C4-алкоксигруппа, C1-C4-алкилтиогруппа, C1-C4-алкилсульфинильная группа, C1-C4-алкилсульфонильная группа, нитрогруппа, аминогруппа, C1-C4- моно- или ди-алкиламиногруппа;
R' и R'' независимо друг от друга - водород, галоген C1-C4-алкил или C1-C4-алкоксигруппу, аминогруппа или оксогруппа, когда фрагменты CH-R' или CH-R'' в указанной формуле становятся группой -C=0;
Rа - H или C1-C4-алкил;
Rb и Rc независимо друг от друга - C1-C12-алкил, фенил, фенил-C1-C4-алкил;
n = 0 - 2;
y = 1 - 6;
z = 6 - 20;
фрагменты (CH)y-R' и (CH)Z- R'' могут независимо друг от друга представлять замещенные или незамещенные алкильные радикалы или алкенильные радикалы, содержащие по меньшей мере одну алкеновую связь;
и их фармацевтически приемлемые соли и эфиры.
где А - 1,2-дизамещенное ароматическое кольцо;
D - OH, NH2, NHRc, ORc;
X - O, S, SO, SO2;
R - водород, C1-C4-алкил, фенил или замещенный фенил, галоген, галоалкилгидроксигруппа, карбоксильная группа, цианогруппа, C1-C4-алкоксигруппа, C1-C4-алкилтиогруппа, C1-C4-алкилоульфинильная группа, C1-C4-алкилсульфонильная группа, нитрогруппа, аминогруппа, C1-C4- моно- или ди-алкиламиногруппа,
R' и R'' независимо друг от друга - водород, галоген, C1-C4-алкил или C1-C4-алкоксигруппа, аминогруппа или оксогруппа;
фрагменты CH-R' или CH-R'' в указанной формуле становятся группой -C=C;
Rа - H или C1-C4-алкил;
Rb и Rc независимо друг от друга - C1-C12-алкил, фенил, фенил- C1-C4-алкил;
n = 0 - 2;
y = 1 - 6;
z = 6 - 20;
(CH)y и (CH)Z- R'' могут независимо друг от друга представлять замещенные или незамещенные алкильные или алкенильные радикалы, содержащие по меньшей мере одну алкеновую связь;
и их фармацевтически приемлемые соли и эфиры.
Приоритет по пунктам:
20.03.91 по пп.1, 3, 4, 6, 8, 10, 12 - 15;
11.03.92 по пп.2, 5, 7, 9 и 11.
| US 4760071 А, 1988. |
Авторы
Даты
1999-02-10—Публикация
1992-03-19—Подача