Изобретение относится к фармацевтическим композициям, а точнее к фармацевтическим композициям на основе ингибиторов ИЛ-1.
Ингибиторы интерлейкина-1, как описано в патенте США N 5075 222, находят свое применение для лечения опосредованных ИЛ-1 заболеваний. Такие ингибиторы также известны как антагонисты рецептора ИЛ-1 (ИЛ-1 ра). К опосредованным ИЛ-1 заболеваниям относятся ревматоидный артрит (РА), воспалительная болезнь кишечника (ВБК), сепсис, септический синдром, остеопороз, ишемическая болезнь, болезнь "трансплантант против хозяина", повреждения, вызванные реперфузией, астма, инсулиновый диабет, миелогенный и другие типы лейкоза, псориаз и кахексия. Эти и другие воспалительные заболевания характеризуются образованием цитокинов, в том числе ИЛ-1.
Цитокины - это внеклеточные белки, которые модифицируют активность клеток, в особенности тех клеток, которые находятся в непосредственной близости от участков синтеза и высвобождения цитокинов. Многие цитокины образуются клетками макрофагально/моноцитарного ряда. Например, ревматоидный артрит представляет собой аутоиммунное заболевание, которое характеризуется течением хронического воспалительного процесса, первоначально затрагивающего синовиальную оболочку периферических суставов, как описано Harris, N.Enfl. J. Med. 322-1277 (1990). Существенное большинство мононуклеарных клеток, содержащихся в суставной жидкости больных РА, составляют активированные моноциты/макрофаги и Т-лимфоциты.
Традиционная терапия РА и ВБК подразумевает использование индометацина и других нестероидных противовоспалительных препаратов и салицилатов. Кроме того, показано, что для лечения РА могут быть успешно применены антагонисты рецептора ИЛ-1. Сепсис и септический шок лечат с помощью вазоактивных средств, антибиотиков, стимуляторов β- рецепторов, включая изопретенол и допамин, а также блокаторов α- рецепторов, например феноксибензамина и фентоламина. Для лечения остеопороза используются эстрогены, витамин D и фтор. Классическая терапия ишемической болезни основана на применении антикоагулянтов и соединений, подавляющих активность тромбоцитов. Для лечения астмы используется широкий спектр терапевтических средств, включая α- и β- адренергические стимуляторы для расширения дыхательных путей, метилксантины для улучшения оттока слизи из дыхательных путей, глюкокортикоиды для уменьшения воспаления, хромолин натрия для подавления дегрануляции тучных клеток и антихолинергетики для расширения бронхов.
Применение всех указанных препаратов создает различные проблемы. Например, даже при использовании современных лекарственных средств показатель смертности от септического шока составляет 40 - 50%. Таким образом, существует необходимость разработки новых терапевтических препаратов, например, на основе антагонистов рецепторов ИЛ-1 для лечения указанных состояний. Кроме того, необходимо создать рецептуру таких лекарственных средств для их использования соответствующим образом.
В заявке на Австралийский патент N 9173636 и в заявке на Канадский патент Т 2039458 раскрывается возможность применения антагонистов рецептора ИЛ-1 для терапии перечисленных выше заболеваний, опосредованных ИЛ-1. Используемый препарат ИЛ-1 ра представляет собой раствор, содержащий также 1 мМ фосфата натрия (pH 7,0), 150 мМ NaCl и 0,1 мМ ЭДТФ (этилендиаминтетрауксусной кислоты). В этой композиции действующее начало остается стабильным при хранении в холодильнике (4o-8oC) в течение только двух недель. Поскольку необходимо пересылать и длительно хранить препараты ИЛ-1 ра для лечения ИЛ-1-опосредованных заболеваний, существует потребность в разработке более стабильных композиций.
Полисорбат 80, также известный как моноолеат полиоксиэтилена или Твин 80, представляет собой неионный биологический детергент или сурфактант, используемый в разнообразных целях, в том числе для эмульгирования, диспергирования и стабилизации. Кроме того, неионные сурфактанты, такие как полисорбат 80, добавляются к некоторым белковым составам для снижения агрегации и денатурации, так же как и для увеличения стабильности. Полисорбат 80 используется для стабилизации различных соединений. В Патенте США N 4156777 описан способ получения соединений глюкопиранозо-нитромочевины при использовании в качестве стабилизатора полисорбата 80. В Патенте США N 4816 459 также раскрывается применение полисорбата 80 в качестве стабилизатора тетразолил-замещенных пиридо [1,2-a] пиримидинов. В Патенте США N 5032574 описано применение полисорбата 80 для солюбилизации или диспергирования активного ингредиента в составе фармацевтической композиции на основе антимикробного пептида мол. м. 3700 Да, а в Патенте США N 50373378 показано использование полисорбата 80 в качестве эмульгирующего фактора продуктов коллагена. Однако трудно предвидеть, какой эффект окажет определенный стабилизирующий компонент на устойчивость того или иного белка. Например, взаимодействие стабилизирующего агента с белком может вызывать деградацию белка раньше, чем скажется желаемое действие данного агента, направленное на уменьшение разрушения белка.
Соответственно, существует необходимость в идентификации соединений, стабилизирующих ингибиторы ИЛ-1. Настоящее изобретение решает эту проблему и имеет определенные преимущества.
Предложены композиции, содержащие ингибиторы интерлейкина-1, буферные растворы, неионные поверхностно-активные вещества (ПАВ) или усилители вязкости, причем данные композиции могут использоваться в качестве стабильных препаратов определенной рецептуры. Указанные композиции могут быть применены внутрисуставно, внутривенно, внутримышечно, подкожно, внутрикожно, интратекально, интравентрикулярно (ЦНС), перорально, а также в виде аппликаторов, суппозитариев, вдыхаемых аэрозолей и с помощью клизм.
Изобретение относится к фармацевтическим композициям, содержащим ингибитор ИЛ-1 и неионное ПАВ или усилитель вязкости.
Показано, что ИЛ-1 ра чувствительны к перемешиванию. В ампулах с очищенным и перемещенным концентратором ИЛ-1 ра образуются преципитаты, которые не соответствуют установленным стандартам по внешнему виду и однородности структуры. Для предотвращения преципитации, приводящей к образованию нежелательных агрегатов, были разработаны модифицированные составы композиций.
Одно из воплощений изобретения относится к фармацевтическим композициям, содержащим ингибиторы ИЛ-1, в особенности ИЛ ра, и неионное ПАВ. Последний представляет собой поверхностно-активный агент, солюбилизирующая способность которого определяется последовательностью этиленоксидных групп. При добавлении в растворитель ПАВ изменяет его свойства в значительно большей степени, чем ожидается в соответствии с его концентрацией. Гидрофильность неионных ПАВ обеспечивается за счет образования водородных связей с молекулами воды. Атомы кислорода и гидроксильные группы быстро образуют прочие водородные связи, в то время как эфиры и амидные группы менее эффективно вступают в такого рода взаимодействия. Образование водородных связей обеспечивает солюбилизацию в нейтральной и щелочной среде. В сильно кислой среде атомы кислорода захватывают протоны и приобретают квази-катионные свойства. Каждый атом кислорода вносит вклад в процесс растворимости в воде. Таким образом, для солюбилизации неионного ПАВ в водной среде необходимо более одного атома кислорода. Неионные ПАВ совместимы с ионными и амфотерными. Поскольку полиокситиленовая группа за счет этиленоксида может легко вступать в реакцию с любой органической молекулой, содержащей активный атом водорода, широкий спектр соединений может быть солюбилизирован путем оксилирования (Encuclopedia of Chemical Technology, 3 rd Ed. Vol. 22 p. 360).
Кроме того, ПАВ способствует уменьшению агрегации и денатурации белков. Под агрегацией здесь понимается образование комплексов из многих белковых молекул (например, так происходит при объединении различных белков в структуру, напоминающую клубок или сгусток). Денатурация означает утрату вторичной и третичной структуры белка, которая обычно коррелирует с потерей биологической активности. При уменьшении агрегации физическая деградация белка, обусловленная изменениями поверхностного заряда, также снижается. Считается, что неионные ПАВ блокируют поверхность раздела воздух-жидкость, что предотвращает денатурацию белка на этой поверхности. Кроме того, использование неионных ПАВ позволяет соответствующей композиции подвергаться воздействию поверхностных сил смещения без денатурации белка. Помимо этого содержание ПАВ композиции могут быть использованы в виде аэрозольных препаратов (как в случае легочных заболеваний) или с помощью безигольных инъекторов.
К подходящим неионным ПАВ, используемым в фармацевтических композициях в соответствии с данным изобретением, относятся, например, блок-сополимеры этиленоксида и пропиленоксида, блок-сополимеры пропиленоксида и этиленоксида, сорбитанмонолаурат, сложный эфир сорбита, сложный эфир жирной кислоты полиглицирина, кокамид DEA лаурилсульфат, алканоламид, стеарит полиоксиэтилен пропилен гликоля, лауриновый эфир полиоксиэтилена, цетиловый эфир полиоксиэтилена, полисорбат, моностеарат глицерина, дистеарат глицерина, монопальмитат сорбита, сорбитанмоноолеат полиоксиэтилена, сорбитанмонолаурат полиоксиэтилена и моностеарат пропиленгликоля. Исследования устойчивости к перемешиванию показали, что структура перемешанной композиции на основе ИЛ-1 ра, введенного в буфер, содержащий 0,1% полисорбата 80 (Твин-80), соответствует контрольной (неперемешанная композиция на основе ИЛ-1 ра с добавлением 0,1% полисорбата-80), в то время как в перемешанной композиции, содержащей ИЛ-1 ра без добавления полисорбата 80, образуются ярко выраженные преципитаты. Степень преципитации определяли путем внесения 150 мл исследуемых растворов в лунки 96-луночного планшета и последующего измерения мутности раствора при 450 нм. Эти исследования послужили основанием для использования составов, содержащих полисорбат 80. Кроме того, были исследованы и другие ПАВ на их способность стабилизировать в отношении перемешивания, как описано в приведенных ниже примерах.
Все исследуемые композиции обнаружили устойчивость к физической деградации и преципитации под действием перемешивания. Кроме того, было обнаружено, что при увеличении концентрации ингибитора ИЛ-1 до 0,1% следует использовать и пропорционально более высокое количество неионного ПАВ для стабилизации композиции. В этих целях наиболее предпочтительно использование полисорбитата 80 в концентрации 0,1% (по весу).
Другое воплощение изобретения подразумевает получение фармацевтических композиций, содержащих ингибитор ИЛ-1, в особенности ИЛ-1 ра, и усилитель вязкости. Последний представляет собой соединение, функционирующее как сгущающий агент и приводящее к увеличению вязкости композиции. Предполагается, что усилитель вязкости предотвращает взаимодействие молекул ИЛ-1 ра друг с другом или поверхностью раздела воздух-жидкость, что обуславливает физическую деградацию.
К усилителям вязкости, которые могут быть использованы в соответствии с настоящим изобретением, относятся, например, полиэтиленгликоль (ПЭГ), гидроксилпропил целлюлоза и каррагеновая смола. В экспериментальных исследованиях определяли способность ПЭГ предотвращать преципитацию и агрегацию. Показано, что ПЭГ эффективное препятствует преципитации при его использовании в концентрации около 2%.
Кроме того, фармацевтические композиции, полученные согласно настоящему изобретению, содержат буфер для поддержания pH на необходимом биологическом уровне. С этой целью могут быть использованы любые нетоксичные буферные растворы. К ним относятся, например, фосфатные буферы, а также цитратные и ацетатные.
После приготовления фармацевтическую композицию можно хранить в стерильных условиях в виде раствора, суспензии, геля, эмульсии, в твердой форме, а также в виде дегидратированного или лиофилизированного порошка.
Такая композиция сохраняется в готовой к употреблению форме или же требует восстановления непосредственно перед применением. Предпочтительно композиции хранят в холодильнике при обычной температуре или замораживают, при этом композиции на основе ИЛ-1 ра важно хранить и применять при соблюдении значений pH, близких к физиологическим. Нежелательно хранение и использование композиции при высоких (более 8) и низких pH (менее 5).
Композиции, содержащие ИЛ-1 ра, преимущественно используют внутрисуставно, подкожно, внутрикожно, интратекально, интравентрикулярно (ЦНС), внутримышечно, внутривенно, перорально, а также в виде аппликаторов, вдыхаемых аэрозолей и с помощью клизм. Для достижения и подержания желаемого уровня ИЛ-1 ра в организме могут быть применены повторные дозы. Все указанные методы введения препаратов обеспечивают достижение определенной концентрации ИЛ-1 ра в кровотоке или в других тканях и жидкостях организма. Например, считается, что поддержание циркулирующих в плазме крови концентраций ИЛ-1 ра менее чем 0,01 нг/мл указывает на неэффективность композиции, в то время как длительное поддержание циркулирующей концентрации ИЛ-1 ра, превышающей 100 мкг/мл плазмы, свидетельствует о том, что применение композиции сопряжено с нежелательными побочными эффектами.
Как отмечается выше, некоторые композиции на основе ИЛ-1 ра предполагается использовать перорально. При этом желательно, чтобы они имели кишечное или полимерное покрытие. Такие препараты ИЛ-1 ра могут содержать или не содержать носителей, обычно используемых для приготовления твердых дозированных форм. Предпочтительно выбрать покрытие таким образом, чтобы активное начало композиции высвобождалось в желудочно-кишечном тракте, когда биологическое действие лекарства максимально, а пресистемная деградация сведена к минимуму. Ожидается, что биологическая активность уменьшается в результате пресистемной деградации, поэтому дозы, предназначенные для орального применения, должны превышать указанные ранее. Композиции могут содержать дополнительные компоненты для усиления абсорбции ИЛ-1 ра. Кроме того, могут использоваться растворители, вкусовые и ароматические добавки, низкоплавящиеся воска, растительные масла, любриканты, суспензирующие агенты, компоненты, обеспечивающие дезинтеграцию таблеток, и связывающие вещества.
Предпочтительная подкожная доза для лечения ИЛ-1-опосредованного артрита должна обеспечивать концентрацию ИЛ-1 ра в крови между 1 и 1000 нг/мл. Соответственно предпочтительно, чтобы первоначальные дозы создавали циркулирующий уровень ИЛ-1 ра в плазме крови, превышающий 10 нг/мл, а затем последующие дозы следует применять с частотой, позволяющей поддерживать циркулирующую концентрацию ИЛ-1 ра на уровне 10 нг/мл плазмы или выше. Частота введения препаратов зависит от фармакокинетических параметров, определяющих абсорбцию подкожно введенного ИЛ-1 ра из соответствующей композиции. Она может составлять 1-10 раз в день или реже, чем каждый день, в случае применения поддерживающих дозированных форм или обеспечивающих высвобождение активного начала в определенное время.
Предпочтительная доза для лечения опосредованной ИЛ-1 ВБК составляет 0,5-50 мг на 1 кг веса больного при использовании 10-10 раз в день или реже. Более предпочтительная доза составляет 1-10 мг на 1 кг веса больного, которую применяют 3-5 раз в день. Частота применения зависит от фармакокинетических параметров, определяющих абсорбцию ИЛ-1 ра из соответствующей композиции. При использовании для лечения ИЛ-1-опосредованной ВБК введение ИЛ-1 может осуществляться с помощью клизмы в форме соответствующим образом подобранной композиции.
Предпочтительная доза для лечения ИЛ-1-опосредованного септического шока составляет 10-120 мг на 1 кг веса больного ежедневно при постоянных 24-часовых внутривенных инфузиях. Более предпочтительная доза составляет 1-2 мг на 1 кг веса больного ежечасно при постоянных внутривенных инфузиях.
Предпочтительная доза для лечения ИЛ-1-опосредованной ишемии и реперфузионного повреждения составляет 1-50 мг на 1 кг веса больного ежечасно. Более предпочтительно начальное применение пилюль (15-50 мг ИЛ-1 ра на 1 кг веса больного) с последующими почасовыми инъекциями около 5-20 мл препарата на 1 кг веса больного. Частота введения препарата зависит от фармакокинетических параметров абсорбции ИЛ-1 ра из соответствующей композиции.
Независимо от способа применения необходимая доза определяется в соответствии с весом тела больного и его кожной поверхностью. Дальнейшее уточнение вычислений, необходимых для определения подходящей терапевтической дозы каждой из указанных выше композиций, представляет собой стандартную процедуру и может осуществляться специалистом в данной области исследований, не выходит за рамки обычно решаемых задачи и не требует специальных экспериментов. Указанные дозы могут быть установлены с помощью соответствующих методов при учете фармакокинетических данных и результатов исследований "доза - ответ".
Следует отметить, что описанные здесь составы на основе ИЛ-1 ра могут быть использованы и в ветеринарии, и понятие "больной" не следует ограничивать только человеком. В этом случае применяют те же самые дозы препарата, как описано выше.
Приведенные ниже примеры подтверждают эффективность указанных составов, которые можно приготовить, протестировать и убедиться в том, что они удовлетворяют тем требованиям, которые предъявляются к ним в соответствии с настоящим изобретением.
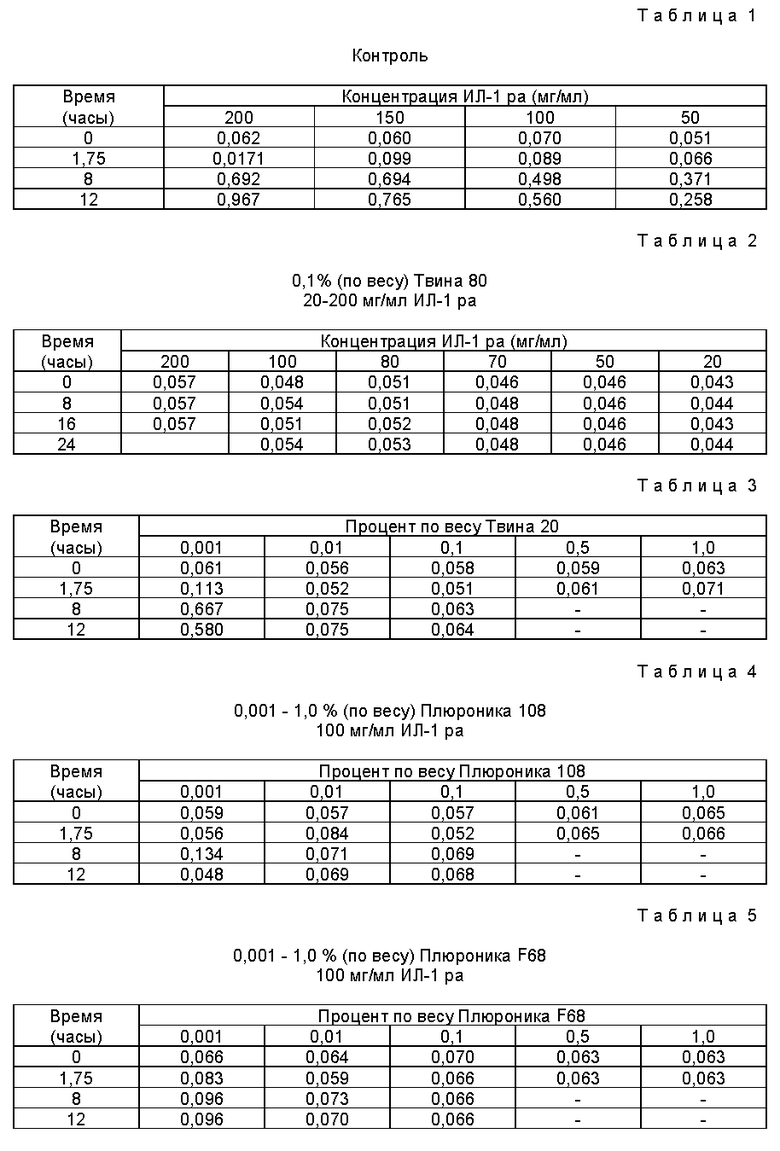
Контролем в описанных ниже экспериментах служит измерение оптической плотности растворов рекомбинантного ИЛ-1 ра (рИл-1 ра) человека в различных концентрациях после различных периодов перемешивания при 405 нм. Результаты исследований приведены в табл. 1.
Пример 1. Приготовление состава A.
Приготовление 10 мМ ЭДТА. 0,93 г ЭДТА помещают в 250-мл взвешенную бутылку. Добавляют в нее 200 г стерильной воды для инъекций. Содержимое бутылки перемешивают и доводят pH до 6,5 ± 0,02, добавляя NaOH до тех пор, пока вес бутылки не составит 250 г.
Приготовление буфера. 900 г стерильной воды для инъекций помещают в 1-л взвешенную бутылку. Затем добавляют 8,20 г NaCl (Sigma, St. Louis, MO), 2,86 г двузамещенного цитрата натрия (Sigma, St. Louis, MO) и 0,058 г однозамещенного цитрата натрия (Sigma, St. Louis, MO). К полученной смеси добавляют 50 10 мМ ЭДТА, приготовленной как описано выше. Содержимое бутылки перемешивают до растворения всех твердых компонентов. Доводят pH до 6,5 ± 0,02, добавляя NaOH до тех пор, пока вес бутылки не составит 1000 г.
Приготовление состава. Очищенный концентрат рИЛ-1 ра вынимают из холодильника на -70oC и оттаивают при комнатной температуре. Очищенный концентрат рИЛ-1 ра получают в соответствии с процедурой, описанной Hageman et al. в заявке PCT N 91/08285, которая приведена здесь в качестве ссылки. Препарат рИЛ-1 ра концентрируют до 190-250 мг/мл в 10 мМ цитрате натрия, 140 мМ хлориде натрия, 0,5 мМ ЭДТА при pH 6,5. Указанную концентрацию получают с помощью буфера, приготовленного как описано выше. Исследуют различные концентрации препарата, в том числе 200 мг/мл, 100 мг/мл, 80 мг/мл, 70 мг/мл, 50 мг/мл и 20 мг/мл. Твин 80 (Spectrum, Lot D1014) добавляют до конечной концентрации 0,01% (по весу). В рамках настоящего изобретения используются концентрации Твин 80, составляющие 0,01% - 1,0%.
Стабильность состава A. Стабильность приготовленного состава определяют путем перемешивания различных концентраций препарата в течение различных периодов времени. После перемешивания состава в течение определенного времени определяют оптическую плотность раствора при 405 нм с помощью кинетического ридера микроплат (Molecular Devices).
Состав считается стабильным, когда его оптическая плотность при 405 нм составляет величину менее 0,15. Когда оптическая плотность при 405 нм составляет 0,15 или превышает эту величину, раствор выглядит мутным за счет присутствия твердых частиц и данная композиция считается нестабильной. Результаты исследований приведены в табл. 2. В описанном эксперименте показано, что 0,1%-ная концентрация Твина 80 обеспечивает устойчивость к перемешиванию составов на основе ИЛ-1 ра при его содержании 20-200 мг/мл.
Клинические исследования. Вторая фаза испытаний ИЛ-1 ра, входящего в композиции A, проводилась в 63 медицинских центрах восьми стран. Больных отбирали случайным образом ("дважды вслепую"), контрольной группе давали плацебо. В испытании принимали участие 901 больной септическим синдромом и признаками гипотензии и/или дисфункции периферических органов. Пациентов случайным образом относили к одной из трех групп: первая принимала плацебо, вторая - ИЛ-1 ра (почасовая инфузия 1,0 мг/кг веса тела в течение 72 часов и затем доза в 100 мг) и третья группа - ИЛ-1 ра (почасовая инфузия 2,0 мг/кг веса тела в течение 72 часов и затем доза в 100 мг).
Среди 901 произвольно отобранных больных 296 получали ИЛ-1 ра (1,0 мг/кг веса тела каждый час), 293 также получали ИЛ-1 ра (2,0 мг/кг веса тела каждый час) и 302 человека получали плацебо. Ретроспективный анализ полученных результатов показывает, что ИЛ-1 ра обеспечивает преимущественное выживание на фоне увеличения предсказанного риска смертности для больных с септическим синдромом. Риск смертности вычисляют при использовании модели предсказанного риска, основанной на базе данных, полученных на фазе III клинических испытаний. Модель действенной и эффективной для предсказания смертности при назначении плацебо на фазе III испытаний. Данные относительно предсказанного риска смертности оказалась справедливыми для 892 из 893 больных. Результаты исследований показывают, что ИЛ-1 ра обеспечивает статистически достоверное преимущество выживания у больных с предсказанным риском смертности ≥ 24% (p= 0,032). У этих больных ИЛ-1 ра снижал смертность на 22% по сравнению с плацебо.
Пример 2. Приготовление состава Б.
ЭДТА и буфер готовят, как описано в примере 1.
Состав готовят, как описано в примере 1, за исключением того, что используют только одну концентрацию ИЛ-1 ра, а именно 100 мг/мл. В качестве неионного ПАВ применяют Твин 20 (Spectrum).
Результаты исследований приведены в табл. 3. Эксперимент показывает, что Твин 20 в концентрации 0,01-1,0% (по весу) обеспечивает устойчивость композиций на основе ИЛ-1 ра к перемешиванию.
Пример 3. Приготовление состава B.
ЭДТА и буфер готовят, как описано в примере 1.
Состав готовят, как описано в примере 1, за исключением того, что используют только одну концентрацию ИЛ-1 ра, а именно 100 мг/мл. В качестве неионного ПАВ применяют Плюроник 108 (Pluronic 108, BASE). Результаты приведены в табл. 4. Эксперимент показывает, что Плюроник 108 в концентрации 0,01-1,0% (по весу) обеспечивает устойчивость композиций на основе ИЛ-1 ра к перемешиванию.
Пример 4. Приготовление состава Г.
ЭДТА и буфер готовят, как описано в примере 1.
Состав готовят, как описано в примере 1, за исключением того, что используют только одну концентрацию ИЛ-1 ра, а именно 100 мг/мл. В качестве неионного ПАВ используют Плюроник F68 (BASF). Результаты исследований приведены в табл. 5. Эксперимент показывает, что Плюроник F68 в концентрации 0,01-1,0% (по весу) обеспечивает устойчивость композиций на основе ИЛ-1 ра к перемешиванию.
Пример 5. Приготовление состава D.
ЭДТА и буфер готовят, как описано в примере 1.
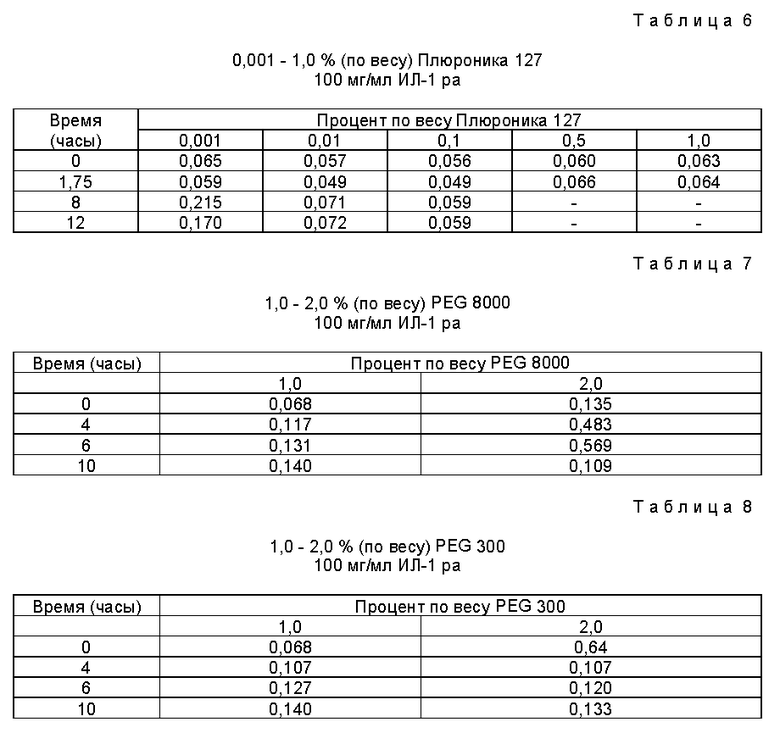
Состав готовят, как описано в примере 1, за исключением того, что используют только одну концентрацию ИЛ-1 ра, а именно 100 мг/мл. В качестве неионного ПАВ используют Плюроник 127 (BASF). Результаты исследований приведены в табл. 6. Эксперимент показывает, что Плюроник 127 в концентрации 0,01-1,0% (по весу) обеспечивает устойчивость композиций на основе ИЛ-1 ра к перемешиванию.
Пример 6. Приготовление состава E.
ЭДТА и буфер готовят, как описано в примере 1.
Состав готовят, как описано в примере 1, за исключением того, что используют только одну концентрацию ИЛ-1 ра, а именно 100 мг/мл. В качестве неионного ПАВ используют полиэтиленгликоль 8000 (PEG 8000, Spectrum). Результаты исследований приведены в табл. 7. Эксперимент показывает, что PEG 8000 в концентрации 0,01-1,0% (по весу) обеспечивает устойчивость композиций на основе ИЛ-1 ра к перемешиванию.
Пример 7. Приготовление состава Ж.
ЭДТА и буфер готовят, как описано в примере 1.
Состав готовят, как описано в примере 1, за исключением того, что используют только одну концентрацию ИЛ-1 ра, а именно 100 мг/мл. В качестве неионного ПАВ используют полиэтиленгликоль 300 (PEG 300, Spectrum). Результаты исследований приведены в табл. 8. Эксперимент показывает, что PEG 300 в концентрации 1,0% (по весу) обеспечивает устойчивость композиций на основе ИЛ-1 ра к перемешиванию.
Данное изобретение не ограничивается описанными примерами, в которых отражены определенные возможности реализации изобретения. Различные модификации изобретения, очевидные для специалистов в данной области исследований, не выходят за его пределы.
Композиция предназначена для лечения опосредованных ИЛ-1 заболеваний (ревматозный артрит, воспалительная болезнь кишечника, сепсис, остеопороз и др. ). I-й вариант: ингибитор рецептора интерлейкина ИЛ-1 и неионогенное поверхностно-активное вещество при массовом соотношении от 100 : 1 до 10000 : 1. II-й вариант: 4,9 мас. ч. ингибитора ИЛ-1, 0,006 мас.ч. лимонной кислоты, 0,9 мас.ч. цитрата натрия, 0,82 мас.ч. хлорида натрия и 0,019 мас.ч. неионного поверхностно-активного вещества. III-й вариант: 19,0 мас.ч, ингибитора ИЛ-1, 0,006 мас.ч. лимонной кислоты, 0,82 мас.ч. хлорида натрия и 0,019 мас. ч. неионного поверхностно-активного вещества. Изобретение позволяет получить стабильные и однородные по структуре препараты без образования нежелательных агрегатов. Они могут быть применены внутрисуставно, интравентрикулярно, перорально, подкожно, в виде суппозиториев и пр. 3 с. и 7 з.п. ф-лы, 8 табл.
| Автоматический огнетушитель | 0 |
|
SU92A1 |
Авторы
Даты
1999-02-20—Публикация
1993-09-17—Подача