Изобретение относится к новым белкам, обозначенным как Mpl-лиганды или MGDF, которые стимулируют рост мегакариоцитов и усиливают дифференцировку или созревание мегакариоцитов, что неизбежно ведет к увеличению числа тромбоцитов. Кроме того, изобретение относится к способам получения данных белков в гомогенной форме из природных источников и методам генетической инженерии.
С другой стороны, настоящее изобретение тесно связано с новым классом MGDF-производных, в которых молекула MGDF соединена с водорастворимым полимером. Описаны также способы получения подобных производных. Кроме того, в настоящем изобретении описаны MGDF-производные, в которых молекула MGDF соединена с одной или более полиэтиленгликолевыми ("ПЭГ") группами, а также методы их получения.
Изобретение затрагивает по меньшей мере две широкие области исследований. Первая из них - развитие мегакариоцитов с последующим образованием тромбоцитов, а вторая - свойства полипептида, входящего в семейство рецепторов факторов роста, обозначенного как Mpl-рецептор, и его лигандов. Каждая из указанных областей исследований будет более подробно рассмотрена ниже.
А. Образование тромбоцитов из мегакариоцитов
Тромбоциты крови - это циркулирующие клетки, которые играют важную роль в предотвращении кровопотери и свертывании крови. Мегакариоциты являются клеточным источником тромбоцитов и происходят из общей костно-мозговой клетки предшественника, которая дает начало всем росткам кроветворения. Эта общая клетка-предшественник известна как плюрипотентная стволовая клетка или PPSC.
Иерархия мегакариоцитарных клеток-предшественников была определена на основе времени появления и размера мегакариоцитарных (МК) колоний, образующихся в системах культивирования in vitro в ответ на воздействие соответствующих ростовых факторов. Бурст-образующая мегакариоцитарная клетка (BFU-MK) является наиболее примитивной мегакариоцитарной клеткой-предшественником. Считается, что BFU-MK дает начало многочисленным колониеобразующим мегакариоцитам (CPU- MK), представляющим собой более дифференцированные МК клетки-предшественники.
По мере того, как МК клетки проходят последовательную дифференцировку, они утрачивают способность к митозу, но приобретают способность к эндоредупликации. Эндоредупликация (или эндомитоз) - это феномен ядерного деления в отсутствие деления клетки. Эндоредупликация неизбежно приводит к образованию полиплоидных МК клеток. Дальнейшее созревание МК приводит к приобретению цитоплазматических органелл и компонентов мембраны, характерных для тромбоцитов.
Тромбоциты образуются из зрелых МК посредством малоизученного процесса, который, как считают, является следствием физической фрагментации МК. Возможны и другие механизмы. Обнаружение в мегакариоцитах протяженных мембранных структур привело к формированию модели образования тромбоцитов, согласно которой разделяющая мембранная система отделяет образующиеся тромбоциты внутри клетки. Другая модель образования тромбоцитов основывается на том факте, что мегакариоциты образуют длинные цитоплазматические отростки, примерно соответствующие по диаметру размеру тромбоцита. Предположительно, от этих отростков и отрываются тромбоциты под действием тока крови в костном мозге и/или в легких. Эти цитоплазматические отростки были названы Бекером и ДеБрюном протромбоцитами, чтобы подчеркнуть их предполагаемую роль предшественников в процессе формирования тромбоцитов. CM.Becker and DeBruyn, Amer.J.Anat. 145: 183 (1976).
На фиг. 1 представлены различные клетки-предшественники, участвующие в развитии мегакариоцитов и тромбоцитов. Крайняя левая клетка на фиг. 1 - PPSC, правее от нее - BFU-MK, за которой следует CFU-MK. Клетка, претерпевающая эндоредупликацию и расположенная сразу же справа от PPSC, представляет собой зрелую мегакариоцитарную клетку. В результате эндомитоза эта клетка становится полиплоидной. Далее справа представлена структура с длинными цитоплазматическими отростками, образующимися из полиплоидного ядра зрелой мегакариоцитарной клетки. В крайней правой части фиг. 1 изображены многочисленные тромбоциты, образовавшиеся путем фрагментации цитоплазматических отростков.
Далее перечислены некоторые важные публикации, имеющие отношение к изложенному описанию созревания мегакариоцитов и образования тромбоцитов:
1. Williams, N and Levine, R.F., British Journal of Haematology 52: 173-180 (1982).
2. Levin, J., Molecular Biology and Differentiation of Megakaryocytes, pub. Wiley-Liss, Inc.: 1-10 (1990).
3. Gewirtz, A. M. The Biology of Hematopoiesis, pub.Wiley- Liss, Inc.: 123-132 (1990).
4. Han, Z.C., et al., Int.J.Hematol. 54: 3-14 (1991).
5. Nieuwenhuis, H, K. and Sixma, J., New Eng.J. of Med. 327: 1812-1813 (1992).
6. Long.M., Stem Cells 11: 33-40 (1993).
В. Регуляция образования тромбоцитов
Большое количество данных, полученных в различных лабораториях, указывает на то, что образование тромбоцитов регулируется гуморальными факторами. Сложность этого биологического процесса первоначально недооценивалась, но в настоящее время стало очевидно, что ряд человеческих ростовых факторов обладает такой способностью.
Регуляция роста мегакариоцитов происходит на нескольких клеточных уровнях. Некоторые цитокины усиливают образование тромбоцитов посредством увеличения пула клеток-предшественников. Другая группа гуморальных ростовых факторов служит факторами созревания, действуя на более дифференцированные клетки и ускоряя эндоредупликацию. Кроме того, в регуляции этих процессов имеются две независимые петли обратной связи.
Несколько групп неспецифических гематопоэтических ростовых факторов оказывают важное воздействие на созревание МК.
Гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), интерлейкин-3 (IL-3), IL-6, IL-11, фактор подавления лейкоза (LIF) и эритропоэтин (ЕРО) независимо и индивидуально ускоряют созревание МК in vitro, о чем судят по размеру МК, их числу и плоидности. Воздействие LIF, IL-6 и IL-11 на созревание МК частично (LIF и IL-6) или полностью (IL- 11) дополняет таковое действие IL-3. Данные приведенных ниже публикаций дают основание считать, что для усиления созревания МК in vivo может быть необходимо сочетание цитокинов.
Далее перечислены некоторые основные публикации, посвященные регуляции образования мегакариоцитов и тромбоцитов.
7. Hoffman, R. et al. Blood Cells 13: 75-86 (1987).
8. Murphy, M. J. , Hematology/Oncology Clinics of North America 3 (3): 465-478 (1988).
9. Hoffman, R., Blood 74 (4): 1196-1212 (1989).
10. Mazur, E. M. and Cohen, J.L., Clin.Pharmacol.Ther., 46(3): 250-256 (1989).
11. Gewirtz, A. M. and Calabretta. B., Int.J.Cell Cloning 8: 267-276 (1990).
12. Williams, N., Progress in Growth Factor Research 2: 81-95 (1990).
13. Gordon, M.S. and Hoffman, R., Blood 80 (2): 302- 307 (1992).
14. Hunt, P. et al., Exp.Hematol.21: 372-381 (1993).
15. Hunt, P. et al., Exp.Hematol.21: 1295-1304 (1993).
Сообщалось также о том (см. ссылку 16), что человеческая апластическая сыворотка содержит мегакариоцитарную колониестимулирующую активность, отличную от IL-3, гранулоцитарного колониестимулирующего фактора и факторов, присутствующих в кондиционированной среде лимфоцитов. Однако обусловливающие эту активность молекулы не выделены и не охарактеризованы до настоящего времени.
16. Mazur.E.M., etal. Blood 76:290-297 (1990).
С. Рецептор Mpl
Миелопролиферативный лейкозный вирус (MPLV) - это дефектный по репликации ретровирус мышей, вызывающий у инфицированных им млекопитающих острый лейкоз. Показано, что экспрессируемый MPLV ген состоит из фрагмента гена, кодирующего ретровирусный поверхностный белок, соединенного с последовательностью, родственной рецепторам цитокинов, включая рецепторы GM-CSF, G-CSF и ЕРО.
Экспрессия указанного гена MPLV в мышиных клетках- предшественниках различных типов приводит к быстрому приобретению независимости от ростовых факторов, которые в норме необходимы для пролиферации и конечного созревания. Кроме того, тот факт, что в некоторых культурах костно-мозговых клеток, трансформированных MPLV, обнаруживаются мегакариоциты, указывает на связь между геном MPLV и ростом и дифференцировкой мегакариоцитов.
В настоящее время показано, что вирусный ген MPLV (обозначенный как v-Mpl) имеет гимолог в клетках млекопитающих, который назван клеточным геном Mpl (или c-Mpl). С использованием проб на основе v-Mpl удалось проклонировать кДНК, соответствующую человеческому c-Mpl гену. См. опубликованную заявку РСТ 92/07074 (публ.30 апреля 1992). Анализ последовательностей показал, что белок, кодируемый геном c-Mpl, принадлежит к высококонсервативному суперсемейству рецепторов цитокинов, также как и гомологичный продукт гена v-Mpl.
Вывод о функциональной роли клеточного гена c-Mpl в гематопоэзе основывается на данных о том, что его экспрессия обнаруживается в костном мозге, селезенке и эмбриональной печени нормальных мышей, но не в других тканях. В частности, c-Mpl экспрессируется в мегакариоцитах. Показано также, что человеческий c-Mpl экспрессируется в CD34-положительных клетках, включая очищенные мегакариоциты и тромбоциты. CD34 - это антиген, характерный для ранних кроветворных клеток-предшественников. Кроме того, обработка CD34-положительных клеток синтетическими олигонуклеотидами, антисмысловыми по отношению к c-Mpl мРНК, значительно подавляет колониеобразующую способность CFU-MK мегакариоцитарных предшественников, но не оказывает эффекта на эритроидные и гранулоцитарно-макрофагальные предшественники.
Приведенные результаты свидетельствуют о том, что c-Mpl кодирует молекулу клеточной поверхности, обозначенную как Mpl-рецептор. Связывание лиганда активирует рецептор и, вероятно, приводит к образованию и/или развитию мегакариоцитов.
Опубликованная заявка PCT 92/07074 относится к последовательности белка, кодируемого геном cMpl как человека, так и мыши. Продукт этого гена, который, как упоминалось, является рецептором, состоит по меньшей мере из трех областей или доменов: внеклеточного домена, трансмембранного домена и внутриклеточного (или цитоплазматического) домена. Соединенные вместе, эти домены составляют интактный рецептор Mpl. В упомянутой публикации PCT также говорится о растворимой форме рецептора, которая в значительной степени соответствует внеклеточному домену зрелого белка c-Mpl. Внутриклеточный домен содержит гидрофобную область, и при соединении ее через трансмембранный домен с внеклеточным доменом весь белок становится нерастворимым. С другой стороны, когда внеклеточный домен продукта гена c-Mpl отделен от трансмембранного и внутриклеточного доменов, белок становится растворимым, поэтому внеклеточная форма белка обозначена как "растворимая" форма рецептора.
Ниже перечислены основные публикации, посвященные рецепторам v-Mpl и c-Mpl и их генам.
17. Wendling. F., et al., Leukemia 3 (7): 475-480 (1989).
18. Wendling. F., et al., Blood 73 (5): 1161-1167 (1989).
19. Souyri. M.,et al., Cell 63: 1137-1147 (1990).
20. Vigon. l., Proc.Natl.Acad.Sci USA 89: 5640-5644 (1992).
21. Skoda. R.C., et al. The EMBO Journal 12 (7): 2645-2653 (1993).
22. Ogawa. M., Blood 81 (11): 2844-2853 (1993).
23. Methia. N., et al. Blood 82 (5): 1395-1401 (1993).
24. Wendling. F., et al. Blood 80: 246a (1993).
D. Потребность в агенте, способном стимулировать образование тромбоцитов
Имеются сообщения о том, что переливание тромбоцитов производят все в большем числе случаев в медицинских центрах Северной Америки, Западной Европы и Японии. см. Gordon, M.S. и Hoffman, R., Blood 80 (2): 302-307 (1992). Это в значительной степени обусловлено усовершенствованием медицинских методов и распространением новых технологий в сердечной хирургии, а также пересадок костного мозга, сердца и печени. Увеличение доз химиопрепаратов при терапии раковых больных и распространение HIV- 1 инфекции также внесли свой вклад в возрастающую потребность в тромбоцитах.
Переливание тромбоцитов несет с собой возможность распространения многих заболеваний, передающихся с кровью, а также возможность аллоиммунизации. Кроме того, получение очищенных тромбоцитов - процедура дорогостоящая и все более частое ее применение ведет к возрастанию общих медицинских расходов. Поэтому существует острая необходимость в новых усовершенствованных методах получения тромбоцитов для переливания людям.
Далее приведены некоторые примеры экспериментальных подходов к увеличению образования тромбоцитов.
В патенте США N 5,032,396 описана способность интерлейкина-7 (IL-7) стимулировать образование тромбоцитов. Интерлейкин-7, известный также как лимфопоэтин-1, это лимфопоэтический ростовой фактор, стимулирующий рост предшественников T- и B-клеток в костном мозге. В опубликованной заявке PCT 88/03747 (подана 19 октября 1988) и в заявке на Европейский патент 88309977.2 (подана 24 октября 1988) описаны ДНК, векторы и необходимые способы для получения IL-7 млекопитающих методами генетической инженерии. Данные, представленные в патенте США, свидетельствуют о том, что IL-7 может увеличивать число циркулирующих тромбоцитов у нормальных и сублетально облученных мышей.
В патенте США N 5,087,448 показано, что мегакариоциты и тромбоциты млекопитающих можно стимулировать к пролиферации при помощи интерлейкина-6 (IL-6). Рекомбинантный человеческий IL-6 представляет собой гликопротеин с мол. массой 26,000, обладающий несколькими биологическими активностями. Представленные в этом патенте данные указывают на то, что IL-6 увеличивает образование мегакариоцитарных колоний в тестах in vitro.
Ни в одном из процитированных патентов не упоминаются Mpl-лиганды, описанные в настоящем изобретении.
Несмотря на упомянутые достижения, потребность в новых стимуляторах мегакариоцитов и/или тромбоцитов у млекопитающих остается весьма острой.
Е. Предпосылки получения химически модифицированного MGDF
Белки для терапевтического применения в настоящее время доступны в значительных количествах и приемлемых формах в основном благодаря достижениям технологии рекомбинантных ДНК. Химические модификации таких белков могут эффективно предотвращать физический контакт протеолитических ферментов с собственно белковым каркасом, тем самым препятствуя деградации. При определенных условиях могут проявиться и такие преимущества, как увеличение стабильности и времени циркуляции терапевтического белка и уменьшение его иммуногенности. Однако, необходимо подчеркнуть, что эффект модификации в отношении каждого конкретного белка трудно предсказать. Френсисом опубликована обзорная статья, посвященная модификации белков, в том числе и слитных: Focus on Growth Factors 3:4-10 (May, 1992) (опубликовано Mediscript, Mountview Court, Friern Barnet Lane, London N20, OLD UK).
Полиэтиленгликоль ("ПЭГ", "пэг" или PEG) - одно из химических веществ, применяемых для приготовления фармакологических форм терапевтических белков. Например, Адаген-R, препарат пэгированной аденозиндезаминазы, рекомендован для лечения острого комбинированного иммунодефицита; пэгированная супероксиддисмутаза проходит клинические испытания для лечения повреждений головы; пэгированный альфа-интерферон прошел фазу 1 клинических испытаний для лечения гепатита; пэгированная глюкоцереброзидаза и пэгированный гемоглобин находятся на стадии доклинических испытаний. Для некоторых белков показано, что прикрепление полиэтиленгликоля защищает от протеолиза (Sada et at., J. Fermentation Bioengineering 71: 137:139 (1991)), и известны методы присоединения полиэтиленгликоля. См. Патент США N 4,179,337, Davis et al., "Неиммуногенные полипептиды", выданный 18 декабря 1979, и Патент США N 4,002,531, Royer "Модификация ферментов полиэтиленгликолем и продукты этого процесса", выданный 11 января 1977. В качестве обзора см. Abuchowski et al., in Enzymes as Drugs (J.S.Holcerberg and J.Roberts, eds.pp. 367-383 (1981)).
Для модификации белков используют и другие водорастворимые полимеры, такие как кополимер полиэтиленгилколь/пропиленгликоль, карбоксиметилцеллюлоза, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, кополимер этилен/малеиновый ангидрид и полиаминокислоты (как гомополимеры, так и случайные сополимеры).
Ряд подходов был использован для присоединения молекул полиэтиленгликоля к белку. Обычно молекулы полиэтиленгликоля присоединяют к белку посредством одной из активных групп белка. Подходящими для такого присоединения являются аминогруппы, например аминогруппы остатков лизина или аминогруппы N-конца. Например, Ройер (Патент США N.4,002,531) использовал восстанавливающее алкилирование для присоединения молекул полиэтиленгликоля к ферменту. В Европейском патенте N 0539167 на "Имидаты ПЭГа и их белковые производные", опубликованном 28 апреля 1993 г., Райт описывает пептиды и органические соединения со свободной аминогруппой (группами), модифицированными имидатными производными ПЭГа или другими водорастворимыми органическими полимерами. В Патенте США No 4,904,584, выданном 27 февраля 1990 г., Шоу описывает модификацию остатков лизина в белках для присоединения молекул полиэтиленгликоля через реактивные аминогруппы.
Один из терапевтических белков, который был химически модифицироваи, это - гранулоцитарный колониестимулирующий фактор, "G-CSF". См.EP N 0401384, ЕР N 0473268 и ЕР N 0335423.
Другим примером служит пэгированный IL-6 (см. Европейский патент N 0442724, озаглавленный "Модифицированный hlL-6", а также родственную заявку U. S. 07/632,070, в которой описаны молекулы полиэтиленгликоля, присоединенные к IL-6. В Европейском патенте, N 0154316, опубликованном 11 сентября 1985, описано взаимодействие лимфокина с альдегидом полиэтиленгликоля.
Возможность модификации MGDF неизвестна, поскольку она определяется специфическими структурными параметрами каждого конкретного белка. Кроме того, непредсказуемо воздействие такой модификации на биологические свойства отдельного белка. В силу многочисленных клинических применений MGDF, описанных в настоящей заявке, было бы желательно получить производное этого белка с измененными свойствами. Подобные молекулы могли бы иметь увеличенное время полужизни и/или усиленную активность in vivo, наряду с другими свойствами.
Пэгирование белка обычно приводит к образованию смеси молекул химически модифицированного белка. Например, молекулы белка с пятью остатками лизина и свободной аминогруппой на N-конце при пэгировании по описанному методу могут образовать гетерогенную смесь, в которой некоторые молекулы белка будут иметь шесть присоединенных молекул ПЭГа, некоторые - пять, некоторые - четыре или три, или две, или одну, или вообще ни одной. При этом полиэтиленгликолевые группы могут быть присоединены к различным молекулам белка в различных участках.
Часто желательно получить гомогенный продукт, содержащий по существу всего одну или небольшое число (2-3) форм модифицированного белка, отличающихся числом и/или локализацией полиэтиленгликолевых групп. Однако, при некоторых терапевтических показаниях могут быть желательны или пригодны смеси моно-, ди-и/или три-пэгированных форм.
Непостоянство смеси от партии к партии является недостатком при разработке терапевтического пэгированного белка. В этом случае важна предсказуемость биологической активности. Например, показано, что при неселективной конъюгации супероксиддисмутазы с полиэтиленгликолем отдельные фракции модифицированного фермента оказываются полностью неактивными (P.McGoff et al., Chem. Pharm. Bull. 36: 3079-3091 (1988)). См.также Rose et al. Bioconjugate Chemistry 2: 154-159 (1991), которыми показано селективное прикрепление линкерной группы карбоксигидразида к С-концу карбоксильной группы белкового субстрата (инсулина). Если терапевтический белок непостоянен по составу от партии к партии, предсказуемость его свойств недостижима. Отдельные молекулы полиэтиленгликоля в определенных участках могут быть прикреплены слабее, чем в других, что может приводить к диссоциации ПЭГа и белка. Очевидно, если молекулы ПЭГа случайным образом присоединены к белку и диссоциируют также случайно, фармакокинетику терапевтического белка точно предсказать невозможно.
Также весьма желательным было бы получить такое производное MGDF, в котором бы отсутствовало соединительное звено между полимером и белком. Одна из проблем, связанных с применением описанных выше методов, состоит в том, что обычно требуется некое соединительное звено между белком и молекулой полиэтиленгликоля. Это соединительное звено может быть антигеном, что также является недостатком при разработке терапевтического препарата белка.
Методы без участия соединительных групп описаны Fransis et al., в кн. "Стабильность белковых фармацевтических препаратов: пути деградации in vivo и стратегия стабилизации белков" (Ed.Ahern., Т. and Manning,М.С.) Plenum, New York, 1991). См. также Delgado et al., "Соединение ПЭГа с белком путем активации с трезил-хлоридом, применения в иммуноаффинных клеточных препаратах и Fisher et al., ред. Разделение с использованием систем с водной фазой. Применение в клеточной биологии и биотехнологии. Plenum Press, N.Y., 1989, стр.211-213, где описано использование трезил-хлорида, что приводит к отсутствию соединительных групп между полиэтиленгликолем и белком. Данный метод трудно применить для получения терапевтических препаратов, поскольку использование трезил-хлорида приводит к образованию токсичных побочных продуктов.
Chamow et al.,. Bioconjugate Chem. 5: 133-140 (1994) описали модифицирование CD-иммуноадгезина альдегидом моно-метокси полиэтиленгликоля ("MePEG") посредством восстановительного алкилирования. Авторы сообщают, что 50% CD4-lg было модифицировано MePEG при селективной реакции по альфа-аминогруппе N-конца (см.цит.источник, стр.137). Авторы также сообщают, что способность модифицированного CD4-lg связываться in vivo с белком gp 120 уменьшалась в зависимости от степени связывания с MePEG.
Таким образом, имеется потребность в производных MGDF, в частности в пэгированном MGDF. Существует также необходимость разработки способов получения подобных производных.
В настоящем изобретении заявлены новые полипептиды, специфически усиливающие рост и/или развитие мегакариоцитов ("Mpl-лиганды" или "MGDFs"), которые, по существу, свободны (т.е. очищены) от других белков (т.е. белков млекопитающих в случае Mpl- лигандов, получаемых из соответствующих источников). Эти белки могут быть выделены из клеток, продуцирующих факторы естественным образом или в силу индукции другими факторами. Они могут также быть получены методами генетической инженерии. Кроме того, Mpl- лиганды могут быть синтезированы химическими методами или получены при комбинировании описанных подходов.
Заявленные в настоящем изобретении Mpl-лиганды могут быть получены в нативном виде из клеток и тканей млекопитающих. В разделе Примеров настоящей заявки описаны два Mpl-лиганда, выделенные из апластической плазмы собак. Однако, как описано в других Примерах настоящей заявки, близкородственные Mpl-лиганды присутствуют в апластической плазме человека и свиньи. Примечательно, что активность человеческого, свиного и собачьего Mpl-лиганда специфически подавляется растворимой формой мышиного Mpl-рецептора, что свидетельствует о сильном сходстве этих Mpl-лигандов как в отношении структуры, так и в отношении функции.
Mpl-лиганды человека, свиньи и других млекопитающих могут быть выделены из природных источников методами, описанными в настоящей заявке (см. Пример 10). Таким образом, настоящее изобретение включает в себя Mpl-лиганды млекопитающих, т. е. собаки, свиньи, человека, мыши, лошади, овцы и кролика. Особенно предпочтительными являются Mpl-лиганды собаки, свиньи и человека.
Кроме того, гены, кодирующие Mpl-лиганды человека, были клонированы из библиотек эмбриональных почки и печени. Эти гены просеквенированы, как описано в разделе Примеров настоящей заявки. Показано, что две полипептидные последовательности человека обладают активностью в клеточных тестах (см. Пример 4). Они отличаются по длине, однако идентичны в значительной части своих аминокислотных последовательностей. Одинаковые участки имеют гомологию с эритропоэтином. Mpl-лиганды обозначаются и как факторы роста и развития мегакариоцитов (MGDFs); все указания на Mpl-лиганды имеют такое же отношение и к MGDFs, и наоборот. "Полипептид MGDF" означает полипептид, обладающий способностью специфически стимулировать или ингибировать рост и/или развитие мегакариоцитов. Примеры подобных полипептидов приведены в настоящей заявке.
Описанные в настоящем изобретении Mpl-лиганды проявляют специфическую активность по отношению к мегакариоцитарному ростку кроветворения, усиливая созревание и/или пролиферацию мегакариоцитов, как это показано в Примерах 2 и 4 далее. Термин "специфически" означает, что биологическая активность полипептидов проявляется в значительной степени в отношении мегакариоцитов, нежели в отношении клеток других типов. Те факторы, которые обладают стимулирующим воздействием на мегакариоциты, имеют in vivo активность, стимулирующую образование тромбоцитов. Происходит это посредством стимуляции созревания и дифференцировки мегакариоцитов.
Два предпочтительных Mpl-лиганда собачьего происхождения имеют молекулярные массы около 25 кД и 31 кД, как определено электрофорезом в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) в невосстанавливающих условиях. Оба белка были очищены по одной и той же методике, приведенной в разделе Примеров.
Два предпочтительных лиганда человеческого происхождения, MGDF-1 и MGDF-2, состоят соответственно из 332 и 173 аминокислот и не включают 21 аминокислоту предполагаемого сигнального пептида.
Другим аспектом настоящего изобретения являются процессы выделения и очистки указанных Mpl-лигандов или их фрагментов из природных источников, предпочтительно цельной крови, сыворотки или плазмы млекопитающих. В качестве исходного материала наиболее предпочтительны апластические кровь, сыворотка или плазма. Они могут быть получены с использованием процедуры облучения млекопитающих, например, дозой около 400-800 рад с помощью кобальта-60, что делает данных животных апластичными. Подобная процедура хорошо известна, как видно из публикаций, процитированных в Примере 1. В случае человека апластические кровь, сыворотка или плазма могут быть получены от пациентов, проходящих радиотерапию, например, при онкологических заболеваниях.
Затем апластические кровь, сыворотка или плазма подвергаются процессу очистки. Заявленный в настоящем изобретении процесс очистки состоит из нескольких ключевых этапов: аффинной хроматографии с пектином и аффинной хроматографии с Mpl-рецептором. Каждый из этих этапов дает приблизительно 300-500-кратную очистку 25 кД и 31 кД белков из апластической плазмы собаки. Другим стандартные методы очистки белков могут быть использованы вместе с указанными для дальнейшей очистки Mpl-лигандов, как это описано ниже.
Другим аспектом настоящего изобретения являются полинуклеотиды, кодирующие белок Mpl-лиганда млекопитающих. Такие последовательности ДНК могут включать выделенные последовательности ДНК, которые направляют экспрессию белков Mpl-лигандов млекопитающих, как это описано далее. Эти последовательности ДНК могут также включать 5' и 3' некодирующие последовательности млекопитающих, ланкирующие кодирующие последовательности Mpl-лигандов. Кроме того, последовательности ДНК могут кодировать аминотерминальный сигнальный пептид. Подобные последовательности могут быть получены любым из известных методов, включая полный или частичный химический синтез. Кодоны могут быть оптимизированы для экспрессии в определенном хозяине (например, E.coli или клетках CHO).
В настоящем изобретении также заявлены рекомбинантные молекулы ДНК, каждая из которых представляет собой векторную ДНК, соединенную с последовательностями ДНК, кодирующими Mpl-лиганд млекопитающих. В этих рекомбинантных молекулах ДНК Mpl- лиганда функционально соединена с регуляторной последовательностью, обеспечивающей репликацию и экспрессию Mpl-лиганда в определенных клетках- хозяевах. Клетки-хозяева (например, бактерий, насекомых, млекопитающих, дрожжей или растений), трансформированные такими молекулами ДНК с целью экспрессии рекомбинантного белка Mpl-лиганда, также являются предметом данного изобретения.
Молекулы ДНК и трансформированные клетки, заявленные в настоящем изобретении, могут быть использованы для получения рекомбинантного белка Mpl-лиганда млекопитающих или его фрагментов. Клеточную линию, трансформированную последовательностями ДНК, кодирующими Mpl-лиганд или его фрагмент (или упомянутыми выше рекомбинантными молекулами ДНК) в функциональной ассоциации с подходящими регуляторными последовательностями, культивируют в соответствующих условиях, обеспечивающих экспрессию рекомбинантной ДНК. В этом процессе многие клеточные линии могут быть использованы в качестве клеток-хозяев для экспрессии белка. Предпочтительными для получения Mpl-лиганда являются клеточные линии млекопитающих (например, клетки CHO) и бактериальные клетки (например, E.coli).
Для получения Mpl-лиганда в клетках E.coli предпочтительно, чтобы на N-конце экспрессируемого белка находились остатки Met и Lys, поскольку в этом случае выход продукта экспрессии обычно выше. Человеческий MGDF насчитывает 165 аминокислот (т.е. Met-2 Lys-1 [1-163] MGDF (при отсчете с первой аминокислоты зрелого белка). После очистки продукта, экспрессированного в таких бактериальных клетках, как E.coli, терминальные Met-Lys остатки могут быть удалены обработкой какой- либо дипептидазой (например, катепсином С).
Экспрессированный белок Mpl-лиганда затем выделяют из клеток-хозяев, клеточного лизата или культуральной среды одним из обычных методов. Кондиционированная среда может быть подвергнута тем же этапам очистки (или их модификациям) Mpl-лиганда, что и апластическая плазма.
Другим предметом настоящего изобретения являются рекомбинантные Mpl-лиганды. Эти белки, по существу, свободны от других биологических структур животного происхождения, в особенности белков. Заявленные в настоящем изобретении Mpl-лиганды характеризуются одной или более физической, биохимической, фармакологической или биологической активностями. Данные активности описаны в заявке.
В настоящем изобретении также заявлен химически модифицированный MGDF, состоящий из собственно белка MGDF, соединенного по меньшей мере с одним водорастворимым полимером, а также методы получения и применения таких композиций. В частности, заявлен такой химически модифицированный MGDF, в котором посредством реакции с полиэтиленгликолем к MGDF присоединяется ПЭГ. Подобное соединение может быть достигнуто такими описываемыми ниже реакциями пэгирования, как ацилирование или алкилирование. Ацилирование или алкилирование с ПЭГом могут проводиться в таких условиях, при которых конечный продукт будет монопэгирован или полипэгирован. При полипэгировании обычно происходит прикрепление ПЭГа к эпсилонаминогруппам остатков лизина, при этом также возможно пэгирование N-конца белка. При монопэгировании предпочтительно происходит присоединение ПЭГа к альфа-аминогруппе N-конца белка. Выход и гомогенность продукта реакции монопэгирования могут быть увеличены посредством такого восстанавливающего алкилирования, при котором селективно модифицируется альфа-аминогруппа N-конца белка MGDF, тем самым обеспечивая избирательное прикрепление водорастворимого полимера к N-концу белка. Такой подход позволяет получать преимущественно гомогенные препараты конъюгата полимер/MGDF-белок, так же как и (в случае использования ПЭГа) препараты пэгированного белка MGDF, в которых полиэтиленгликоль непосредственно соединен с белком.
В настоящем изобретении также заявлены фармацевтические препараты (композиции), содержащие терапевтически эффективное количество очищенного природного или рекомбинантного Mpl-лиганда, который может быть модифицирован таким водорастворимым полимером, как полиэтиленгликоль, вместе с фармацевтически приемлемым носителем, растворителем или буфером. Данные фармацевтические препараты могут быть использованы для лечения таких болезненных состояний или расстройств, которые характеризуются недостатком мегакариоцитов и/или тромбоцитов, также как и недостатком Mpl-лиганда in vivo. Они могут также использоваться профилактически для компенсации ожидаемой потери мегакариоцитов или тромбоцитов (например, при хирургических операциях).
Таким образом, заявленные в настоящем изобретении Mpl- лиганды могут применяться для лечения апластических анемий, например, для усиления образования тромбоцитов у больных (скажем, у больных СПИДом или у больных, подвергнутых химиотерапии опухолей). Mpl- лиганд может быть использован для лечения таких нарушений кроветворения, как тромбоцитопения. Mpl-лиганд может стать частью сочетанной терапии больных, перенесших трансплантацию костного мозга. Ими могут быть люди или другие млекопитающие. Mpl-лиганд, полученный от одного биологического вида, может применяться для больных другого биологического вида.
Другим предметом настоящего изобретения является способ лечения других патологических состояний, характеризующихся недостатком тромбоцитов, путем введения больному терапевтически эффективного количества описанного выше фармацевтического препарата. Подобные терапевтические методы могут предусматривать введение одновременно с Mpl-лигандом или последовательно эффективного количества по меньшей мере одного мегакариоцитарного колониестимулирующего фактора, цитокина (например, EPO), растворимого Mpl-рецептора, гематопоэтина, интерлейкина, ростового фактора или антител.
В настоящем изобретении заявлены также антитела (поликлональные, моноклональные, гуманизированные или рекомбинантные), а также фрагменты антител, полученные (т.е. реагирующие) против Mpl- лиганда млекопитающих или его фрагмента. Соответственно, в настоящее изобретение включены клетки, способные секретировать такие антитела (т.е. гибридомы в случае моноклональных антител), методы получения таких антител и их применения в диагностических и терапевтических целях.
Другим предметом настоящего изобретения является способ определения Mpl-лиганда в жидкостях организма. При этом могут быть использованы антитела, специфически распознающие Mpl-лиганд, как в "сэндвич" -варианте, так и сами по себе. Подобный подход может быть использован для определения необходимости введения больному Mpl-лиганда и/или выявления у данного больного недостаточности тромбоцитов. Реагенты для постановки подобных тестов могут быть собраны в набор, включающий положительный и отрицательный контроли, антитела и другие стандартные компоненты таких наборов.
Другие аспекты и преимущества заявленного изобретения станут очевидными из последующего подробного описания вариантов его осуществления.
Многочисленные преимущества настоящего изобретения будут более очевидны при рассмотрении следующих чертежей:
Фиг.1 отражает развитие и созревание мегакариоцитов и тромбоцитов.
Фиг.2 показывает, что растворимый мышиный Mpl-рецептор практически полностью подавляет способность плазмы облученных собак ("апластическая собачья" или "АРК9") индуцировать развитие мегакариоцитов. Тест на развитие мегакариоцитов описан в примере 2.
Фиг. 3 показывает, что активность АРК9, обогащенная аффинной хроматографией с лектином и аффинной хроматографией с Mpl- рецептором ("Mpl-лиганд"), стимулирует рост клеток 1А6.1, и что растворимый мышиный Mpl-рецептор блокирует этот рост.
Фиг. 4 приводит обзор этапов очистки 25 кД и 31 кД форм Mpl-рецептора собаки из апластической плазмы собаки.
Фиг.5 показывает очистку Mpl-лиганда обратно-фазовой хроматографией высокого разрешения (RP-HPLC). Во фракции 21 содержится высокоочищенный 31 кД Mpl- лиганд; фракция 22 содержит смесь 31 кд и 25 кД Mpl-лиганда; фракция 23 содержит высокоочищенный 25 кД Mpl-лиганд.
Фиг. 6 показывает сравнение активностей Mpl-лиганда во фракциях, полученных RP-HPLC (колонка C4) и содержащих 25 кД и/или 31 кД белки Mpl-лиганда.
Фиг. 7 отражает количество мегакариоцитов, образовавшихся в культурах CD34-положительных клеток периферической крови, стимулированных APK9, Mpl-лигандом и различными другими факторами.
Фиг. 8 отражает общее количество лимфоцитов, образовавшихся в культурах CD34-положительных клеток периферической крови, стимулированных APK9, Mpl-лигандом и различными другими факторами.
Фиг. 9 отражает процент мегакариоцитов, образовавшихся в культурах CD34-положительных клеток периферической крови, стимулированных APK9, Mpl-лигандом и различными другими факторами.
Фиг. 10 показывает, что IL-3 человека не участвует в индуцированном Mpl-лигандом развитии мегакариоцитов.
Фиг. 11 представляет последовательности кДНК и предсказанные аминокислотные последовательности MGDF-1 и MGDF-2 человека.
Фиг. 12 представляет последовательность кДНК и предсказанную аминокислотную последовательность MGDF-3 человека.
Фиг. 13 демонстрирует сравнение MGDF-1 и MGDFs (Mpl-лигандов) собачьего (А) и мышиного (В) происхождения.
Фиг. 14 показывает пример ацилирования MGDF с использованием N-гидроксисукцинимидил (NHS) активных эфиров монометокси-полиэтиленгликоля для получения полипэгированного продукта.
Фиг. 15 показывает пример неспецифического восстановительного алкилирования MGDF с использованием альдегидов монометокси-полиэтиленгликоля для получения полипэгированного продукта.
Фиг. 16 показывает пример сайт-специфического восстановительного алкилирования MGDF по альфа-аминогруппе N- терминального остатка с использованием альдегидов моно- метоксиполиэтиленгликоля для получения, по существу, монопэгированного продукта.
Фиг. 17 демонстрирует HPLC анализ на основании исключения по размерам (SEC HPLC) конъюгатов MePEG-MGDF, полученных с применением активированных производных MePEG с мол. весом 20 кД:
A. поли-MePEG-MGDF-конъюгат, полученный путем ацилирования MGDF NHS-эфиром MePEG (PEG11);
Б. поли-MePEG-MGDF-конъюгат, полученный путем алкилирования MGDF MePEG альдегидом (PEG 20);
В. поли-MePEG-MGDF-конъюгат, полученный путем алкилирования MGDF альдегидом MePEG (PEG 16).
Фиг. 18 показывает количество тромбоцитов у мышей, получавших рекомбинантный MGDF человека: незакрашенные звездочки - MGDF 22-353, полученный в клетках CHO; незакрашенные кружки - непэгированный MGDF 22-184, полученный в E.coli (т.е. MGDF 1-163); закрашенные кружки - пэгированный MGDF 22-184, полученный в E.coli.
Фиг.19 демонстрирует схему очистки r-HuMGDF.
Фиг.20 на модели мышей показывает влияние r-HuMGDF (E.coli 1-163) на количество тромбоцитов. В день 0 мышам Batb/c интраперитонеально однократно вводили карбоплатин (1,25 мг/мышь). Контрольной группе мышей вводили растворитель вместо карбоплатина. Через 24 часа животным, обработанным карбоплатином, подкожно вводили растворитель или 100 мкг/кг r-HuMGDF. Инъекции проводили ежедневно до конца эксперимента (n=10 для каждой группы; в каждой временной точке кровь брали у пяти животных).
Фиг.21 показывает воздействие r-HuMGDF (E.coli 1-163) на количество тромбоцитов у облученных мышей. В день 0 мыши Balb/c получали однократную дозу 500 рад гамма-облучения (цезиевый источник). Контрольная группа мышей облучению не подвергалась. Через 24 часа облученным животным подкожно вводили растворитель или 100 мкг/кг r-HuMGDF. Инъекции проводили ежедневно до конца эксперимента (n=8 для каждой группы; в каждой временной точке кровь брали у пяти животных).
Фиг. 22 показывает воздействие r-HuMGDF (E.coli 1-163) на количество тромбоцитов у мышей, подвергавшихся комбинированному воздействию облучения и карбоплатина. В день 0 мыши Balb/c получали однократную дозу 500 рад гамма-облучения (цезиевый источник) и однократную дозу карбоплатина (1,25 мг/мышь). Через 24 часа обработанным животным подкожно вводили растворитель или 100 мкг/кг r-HuMGDF. Инъекции проводили ежедневно до конца эксперимента (n= 8 для каждой группы). Большинство животных, не получавших r-HuMGDF, не выжило. В контрольной группе выжило 1 животное из восьми. В опытной группе выжило 8 животных из 8.
Фиг. 23 показывает воздействие r-HuMGDF (E.coli 1-163) на вызванную облучением тромбоцитопению у макаков резус. Обезьяны получали дозу облучения 700 cGy, Со-80. В течение 18 дней спустя 24 часа после облучения животным вводили подкожно r-HuMGDF (n= 3) или сывороточный альбумин человека (n=9) (каждый в дозе 25 мкг/кг/день). Анализ клеток крови проводили при помощи электронного анализатора. Каждый значок представляет среднее значение (+/- среднее отклонение).
Фиг. 24 показывает эффект пэгированного и гликозилированного r-HuMGDF на количество тромбоцитов у мышей, обработанных карбоплатином и облучением. Мыши были подвергнуты комбинированному воздействию карбоплатина и облучения, как это описано в эксперименте, представленном на фиг.22. Подкожные введения указанного препарата r-HuMGDF (50 мкг/кг/день) производили ежедневно в течение всего эксперимента, начиная с 24 часов после исходной обработки. Подсчет клеток крови проводили в указанные дни с помощью электронного счетчика клеток (Sysmex, Baxter).
Фиг. 25 демонстрирует последовательность синтетического рекомбинантного MGDF человека (аминокислоты 1-163), имеющего кодоны, оптимизирующие экспрессию в E.coli.
Дополнительные аспекты и преимущества изобретения станут более ясными для специалистов, работающих в данной области исследований, из приведенного ниже описания, которое раскрывает практические возможности использования изобретения.
Новые факторы, усиливающие рост мегакариоцитов млекопитающих, и/или факторы, продуцируемые тромбоцитами, обозначенные как Mpl-лиганды и полученные согласно настоящему изобретению, представляют собой гомогенные белки, практически свободные от других подобных белку соединений. Предпочтительно, чтобы целевые белки были на 90% свободны от других белков, более предпочтительно, чтобы на 95% и совсем предпочтительно, чтобы целевые белки были примерно на 98% и более свободны от других белков. Указанные белки могут быть получены в большом количестве с помощью рекомбинантной технологии таким образом, что конечный продукт представляет собой обладающие высокой степенью чистоты активные Mpl-лиганды, которые успешно могут быть использованы в терапии. Альтернативно, такие белки могут быть получены в гомогенной форме из апластической крови млекопитающих, плазмы или сыворотки, а также из клеточных линий млекопитающих, секретирующих или экспрессирующих Mpl-лиганд.
Более того, Mpl-лиганд или его активные фрагменты могут быть химически синтезированы. В целом, под термином "Mpl-лиганды", используемом в настоящем изобретении, подразумеваются как сами Mpl-лиганды, так и их активные фрагменты и варианты, которые более детально описаны ниже.
Два предпочтительных Mpl-лиганда собаки имеют молекулярную массу около 25 кД и 31 кД, определенную электрофорезом в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) в невосстанавливающих условиях. Оба белка очищают согласно одной методике, которая более подробно описана в приведенных далее примерах. Так, например, оба Mpl- лиганда связывают лектин зародышей пшеницы и иммобилизуют Mpl- рецептор. Белок размером 25 кД имеет следующую аминокислотную последовательность:
Ala-Pro-Pro-Ala-Xaa-Sap-Pro-Arg-Leu-Leu-Asn-Lys-Met-Leu- Arg-Asp-Ser-His-Val-Leu-His-Xaa-Arg-Leu-Xaa-Gln-Xaa-Pro- Asp-Ile-Tyr (SEQ ID N0:1).
Белок размером 31 кД имеет следующую аминокислотную последовательность: Ala-Pro-Pro-Ala-Xaa-Asp-Pro-Arg-Leu-Leu-Asn-Lys-Met-Leu- Arg-Asp-Ser-His-Val-Leu-His (SEQ ID N0:2).
Аминокислоты "Xaa" в последовательностях SEQ ID N0: 1 и 2 точно не определены, однако предположительно являются цистеином, серином, треонином или (менее вероятно) триптофаном. Из приведенных выше последовательностей видно, что лиганд размером 31 кД содержит по крайней мере часть лиганда размером 25 кД. В частности, первая 21 аминокислота белка 31 кД точно совпадает с первой 21 аминокислотой белка 25 кД. Это обстоятельство и в особенности тот факт, что оба белка проявляют активность в исследованиях свойств Mpl-лигандов, описанных в настоящем изобретении, позволяют сделать вывод о том, что оба белка очень тесно связаны между собой как по структуре, так и по функциям. Вероятно, что белковая форма размером 31 кД отличается от белка размером 25 кД структурой C-терминальной последовательности, а также иным характером гликозилирования и/или другим характером сплайсинга гена, кодирующего белки. В дополнение к описанным выше последовательностям в процессе секвенирования 25-кД полосы до конечной стадии очистки (при использовании обратнофазовой HPLC) была определена другая последовательность. Было показано, что указанная последовательность ассоциирована с полосой 25 кД в невосстанавливающих условиях, но не в восстанавливающих условиях, позволяя предположить, что она является результатом расщепления на два фрагмента (например, с помощью протеазы) 25-кД белка, причем эти фрагменты удерживаются вместе дисульфидной связью. Указанная последовательность имеет следующую структуру: Thr-Gln-Lys- Glu-Gln-Thr-Lys-Ala-Gln-Asp-Val-Leu-Gly-Ala- Val-Ala-Leu (SEQ ID N0:3).
Несмотря на то, что локализация последовательности SEQ ID N0:3 в пределах последовательности 25-кД белка неизвестна, аналогия с другими цитокинами, такими как эритропоэтин, позволяет предположить, что указанная последовательность расположена вблизи 114-й аминокислоты белка размером 25 кД. Следует отметить, что вероятна (однако не доказана) локализация последовательности SEQ ID N0: 3 и в пределах белка размером 31 кД, при том, что она опять же начинается вблизи аминокислоты 114. Информация о данной последовательности более подробно обсуждается в Примере 7.
Благодаря первоначальным экспериментам по очистке лигандов собаки, описанным выше, был клонирован ген, кодирующий лиганд. В результате была определена полная аминокислотная последовательность указанного лиганда собаки, которая приведена на фиг.13А. На основании данных о молекулярной массе, предсказано, что лиганды собаки размером 25 кД и 31 кД являются C-терминальными процессированными формами лиганда полной длины, чья последовательность приведена на фиг.13А. В дополнение к этому получен Mpl- лиганд мыши, имеющий последовательность, приведенную на фиг.13В. Такие очищенные лиганды также могут быть охарактеризованы согласно специфической активности, проявляемой в исследовании мегакариоцитов человека (Пример 2), которая составляет по крайней мере 5,7 миллиардов мегакариоцитарных единиц/мл. Мегакариоцитарную единицу определяют как количество материала, из которого можно получить столько мегакариоцитов, сколько из 1 мкл контрольного АРК9 стандарта, как это показано при описании исследования в Примере 2.
Кроме того, такие очищенные лиганды могут быть охарактеризованы согласно специфической активности, проявляемой в исследовании Mpl-зависимого роста клеток (Пример 4), которая составляет по крайней мере 6,9 миллиардов единиц клеточного роста/мг. Единицу клеточного роста определяют как количество лиганда, необходимого для роста 200 клеток 1А6.1 в исследовании, описанном в Примере 4. В Таблице 1 (см. в конце описания) указаны дополнительные специфические показатели активности очищенных Mpl-лигандов собаки, полученных согласно данному изобретению.
Суммируя приведенную выше информацию, в качестве примеров могут быть охарактеризованы некоторые Mpl-лиганды на основании одного или более биохимических и биологических свойств:
(а) такие Mpl-лиганды выделены из апластической плазмы;
(б) такие Mpl-лиганды имеют молекулярную массу около 25 кД или 31 кД, как определено методом электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) в невосстанавливающих условиях;
(в) Mpl-лиганды содержат следующие аминокислотные последовательности: SEQ ID N0:1 в случае белка мол. массы 25 кД; или SEQ ID N0:2 в случае белка мол. массы 31 кД;
(г) Mpl-лиганды дополнительно содержат аминокислотную последовательность SEQ ID N0:3 (особенно важно в случае белка мол. массы 25 кД);
(д) Mpl-лиганды связывают лектин зародышей пшеницы;
(е) Mpl-лиганды связывают иммобилизованный растворимый Mpl-рецептор мыши;
(ж) активность Mpl-лигандов может ингибироваться in vitro растворимым Mpl-рецептором и
(з) Mpl-лиганды связываются с анионообменной колонкой при pH около 8-9.
Биологическая активность предпочтительных Mpl-лигандов, полученных согласно настоящему изобретению, подтверждена их способностью специфически стимулировать рост и развитие мегакариоцитов в исследовании усиления роста клеток, которое описывается в Примере 2. В указанном эксперименте Mpl-лиганды стимулируют дифференцировку CD34+ клеток периферической крови человека (то есть CD34-клеток, выделяемых иммуноадсорбцией) на протяжении 8 дней культивирования. Мегакариоциты идентифицируют окрашиванием с помощью специфических антител к антигену тромбоцитов и подсчитывают под микроскопом. Кроме того, Mpl-лиганд стимулирует рост фактор-зависимой клеточной линии 1А6.1. В отсутствие Mpl-лиганда клетки погибают. Число клеток в культуре, содержащей Mpl-лиганд, определяют через 2 дня. Mpl-лиганды, описанные выше, обладают специфической активностью, приведенной в Таблице 1 (см. ранее).
Источниками Mpl-лигандов служат апластическая кровь млекопитающих, плазма крови или сыворотка. Однако, источники таких лигандов не ограничиваются указанными и могут включать другие жидкости тела млекопитающих, клетки, полученные из таких жидкостей и т.д. Очистка нативных Mpl- лигандов при выделении из указанных выше источников основана на двух основных процедурах:
(а) аффинной хроматографии при использовании лектина, преимущественно агглютинина зародышей пшеницы; и
(б) аффинной хроматографии с иммобилизованным Mpl- рецептором.
Дополнительные процедуры могут включать дальнейшую очистку белка. К ним относятся, например, ионообменная хроматография, гельфильтрационная хроматография и обратно-фазовая хроматография.
Методика очистки, в действительности используемая для выделения Mpl-лиганда из апластической плазмы крови собаки, включает следующие стадии (см. Пример 7):
(а) лектин-аффинную хроматографию (особенно предпочтительна хроматография при использовании агглютинина из зародышей пшеницы);
(б) аффинная хроматография при использовании растворимого Mpl-рецептора (Mpl-Х) (особенно предпочтительно использование иммобилизованного Mpl-X мыши);
(в) ионообменная хроматография (катион- или анион-обменная хроматография, в особенности при использовании колонки Mono Q);
(г) гельфильтрационная хроматография в условиях, вызывающих диссоциацию (предпочтительно при использовании Superdex 200 и SDS); и
(д) обратно-фазовая хроматография (предпочтительно при использовании C4-колонки).
Гомогенный Mpl-лиганд млекопитающих, в том числе лиганд человека, может быть получен из апластической крови, сыворотки, плазмы или других источников Mpl- лиганда человека, например клеток или тканей при использовании описанной выше методики очистки. Необходимые этапы очистки не обязательно следуют в указанном порядке, однако приведенная последовательность соответствующих этапов является предпочтительной. Методики культивирования клеток или тканей, которые могут являться источником Mpl-лиганда, хорошо известны специалистам в данной области исследований и могут быть применены, например, для увеличения количества исходного материала.
Mpl-лиганд или же один или более его пептидных фрагментов могут быть получены и с помощью технологии рекомбинантных ДНК. Для получения последовательности ДНК определенного Mpl-лиганда лиганд-содержащий материал концентрируют и обычно обрабатывают протеазой, такой как трипсин. Образовавшиеся в результате энзиматического расщепления фрагменты выделяют и секвенируют с помощью подходящего метода. Альтернативно, как показано в приведенных ниже примерах, интактный очищенный белок может быть секвенирован впрямую в той степени, которая достижима при данном доступном количестве белка, а затем секвенированная область может быть аналогичным образом использована для получения триптических фрагментов, согласно следующей методике. Синтезируют олигонуклеотидные пробы, используя генетический код для предсказания всех возможных последовательностей генов, кодирующих аминокислотные последовательности секвенированных фрагментов (или фрагмента). Предпочтительно, чтобы в качестве проб использовались некоторые вырожденные последовательности. Ген Mpl-лиганда идентифицируют при использовании указанных проб для скрининга геномной библиотеки млекопитающих или других источников. В противоположность этому, мРНК из клеток, являющихся источником Mpl-лиганда, может использоваться для получения библиотеки кДНК, которую скринируют с помощью проб для идентификации кДНК, кодирующей полипептид Mpl-лиганда. Более того, для наращивания кДНК-последовательности может быть использована полимеразная цепная реакция (ПЦР), в которой задействованы соответствующие праймеры.
Используя соответствующие пробы для скрининга геномной библиотеки, получают ДНК-клон. Для получения клона, содержащего полноразмерную копию гена Mpl-лиганда, пробы на основе полученной последовательности ДНК могут быть использованы для повторного скрининга библиотеки и гибридизации с полноразмерной последовательностью Mpl-лиганда.
кДНК Mpl-лиганда человека может быть также получена путем субклонирования полноразмерного геномного клона человека в векторе экспрессии, последующего переноса его в COS-клетки, получения библиотеки кДНК из указанных трансфицированных COS-клеток и скрининга кДНК Mpl-лиганда путем гибридизации. После идентификации полной последовательности кДНК, она сама или какой-либо ее участок, кодирующий активный фрагмент Mpl-лиганда, может быть встроен в любой из большого числа известных векторов экспрессии для получения системы экспрессии Mpl-лиганда или одного или более фрагментов.
При таком использовании рекомбинантной технологии предпочтительно получают ДНК-последовательности, определяющие синтез полипептидов Mpl-лиганда. Настоящее изобретение также относится к указанным последовательностям, которые свободны от ДНК-последовательностей, кодирующих другие белки (т.е. к изолированным последовательностям), и обеспечивают экспрессию полипептидов Mpl- лиганда с активностью Mpl-лиганда (т.е. полипептидов, вызывающих рост и/или развитие мегакариоцитов). Указанные ДНК- последовательности включают такие последовательности, которые кодируют весь или какой-либо фрагмент Mpl-лиганда, и такие последовательности, которые гибридизуются, предпочтительно в жестких гибридизационных условиях, с кДНК-последовательностями [см. Maniatis et al., Molecular Cloning (A Laboratory Manual), Cold Spring Harbor Laboratory (1982), PP.387-389].
Обычно гибридизацию в жестких условиях проводят в 4 х SSC при 62-67oC с последующими отмывками в 0,1 х SSC при 62-67oC. Альтернативно, гибридизацию в жестких условиях проводят в 45 - 55%-ном формамиде, 4 х SSC при 40-45oC. ДНК-последовательности, которые гибридизуются с последовательностями Mpl-лиганда в мягких условиях и кодируют пептиды Mpl-лиганда, имеющие биологические свойства Mpl-лиганда, также кодируют новые полипептиды Mpl-лиганда, заявленные в настоящем изобретении. Обычно гибридизацию в мягких условиях проводят в 4 х SSC при 40-45oC или в 30-40%-ном формамиде при 40- 45oC. Например, ДНК-последовательность, которая имеет участки существенной гомологии (скажем, области гликозилирования или дисульфидных связей) с последовательностями Mpl-лиганда и кодирует белок, обладающий одним или более видами биологической активности Mpl-лиганда, явным образом кодирует полипептид Mpl-лиганда, даже если такая ДНК-последовательность и не будет гибридизоваться с последовательностью (последовательностями) Mpl-лиганда в жестких условиях.
Аллельные варианты (имеющие природное происхождение изменения оснований в генетических структурах организмов, образующих данную популяцию, которые не обязательно приводят к замене аминокислоты) ДНК-последовательностей, кодирующих пептидные последовательности Mpl-лиганда, тоже включены в объем настоящего изобретения, так же, как и аналоги и производные этих последовательностей. Аналогичным образом, ДНК-последовательности, которые кодируют полипептиды Mpl-лиганда, но различаются некоторыми кодонами вследствие вырожденности генетического кода, а также различные варианты последовательности ДНК Mpl-лиганда, которые обусловлены точечными мутациями или индуцированными модификациями для усиления активности, увеличения времени полужизни или повышения выхода полипептида, кодируемого такими модифицированными последовательностями, также включены в объем настоящего изобретения.
В результате процедуры клонирования, описанной ниже в Примере 11, определяют последовательность кДНК и последовательность аминокислот белков человека MGDF-1, MGDF-2 и MGDF-3, которые приведены здесь в материалах заявки. MGDF-1 представлен аминокислотами 22-353 (фиг.11) и содержит 332 аминокислоты. MGDF-2 представляет собой отщепленный участок MGDF-1 и содержит аминокислоты 22-195, как показано на фиг.11. MGDF-2 соответственно состоит из 174 аминокислот. MGDF-3 представлен аминокислотами 22-289 (фиг. 12) и содержит 268 аминокислот. При описании каждого из MGDF имеется в виду, что последовательность сигнального пептида (аминокислоты 1-21 на фиг.11 и 12) также является частью заявленных в настоящем изобретении полипептидов, однако для проявления активности, определяющей рост и развитие мегакариоцитов, предпочтительно удаление сигнального пептида. В целом, данные о MGDFs можно суммировать следующим образом:
MGDF-1 аминокислоты 22-353 фиг.11
MGDF-2 аминокислоты 22-195 фиг.11
MGDF-3 аминокислоты 22-289 фиг.12
В описанных экспериментах MGDF-1 и MGDF-2 проявляют активность, в то время как MGDF-3 неактивен.
Основываясь на приведенных здесь сведениях об активности, можно предположить, что MGDF человека экспрессируется in vivo как практически неактивный или менее активный полипептид-предшественник, содержащий различные C-терминальные аминокислоты. При отщеплении C-терминальных аминокислот (так же как и сигнального пептида) процессированная форма (формы) полипептида приобретает активность или становится более активной. Принимая во внимание изложенное выше предположение, считается, что для проявления активности MGDF-1 необходим процессинг (например, расщепление
протеазой). То обстоятельство, что MGDF-1, от которого отщеплен определенный участок (т.е. MGDF-2), является активным, подтверждает данное предположение.
Кондиционированная среда клеток 293 почки человека (Invitrogen), трансфицированных геном MGDF-1, проявляет соответствующую активность в экспериментах на клетках, описанных ниже в Примере 4. С другой стороны, в иных клеточных линиях, например, клетках 32D, активность MGDF-1 не обнаруживается. Предположительно это может объясняться способностью клеток 293 процессировать полипептид MGDF-1, возможно путем отщепления определенного участка, так что молекула, в действительности проявляющая активность, представляет собой такую процессированную форму, в то время как клетки 32D не способны к процессингу MGDF-1.
С точки зрения изложенной выше гипотезы, различные активные молекулы могут образовываться в результате отщепления определенных участков от последовательности, приведенной здесь как последовательность MGDF-1 (фиг.11). К консервативным особенностям, свойственным цитокинам, таким как эритропоэтин (ЕРО), относятся четыре альфа-спирали и четыре цистеина. При изучении расположения молекул цистеина (эволюционно консервативных и функционально необходимых элементов) оказалось, что Cys 172 в последовательности MGDF-1 является наиболее терминальным по сравнению с молекулами цистеина в других последовательностях. Соответственно, предпочтительными вариантами MGDF-1 являются такие, которые образуются при отщеплении от MGDF-1 C-терминальных участков, начиная с аминокислоты в положении 173 и до аминокислоты в положении 353 (в сочетании с отщеплением сигнального пептида). Предпочтительно, чтобы в последовательности MGDF-1 произошло отщепление в районе 50-я - 185-я аминокислоты, особенно предпочтительно, в районе 90-я - 172-я аминокислоты, начиная с C-конца последовательности. Как отмечалось, длина сигнального пептида составляет 21 аминокислоту, однако, сигнальный пептид может содержать 23 аминокислоты, исходя из последовательности MGDF-1. Соответственно, полипептиды, родственные заявленным, но начинающиеся с 24-й аминокислоты (см. фиг.11 или 12), тоже подлежат рассмотрению.
Ниже приведены некоторые особенно предпочтительные варианты MGDF-1, которые могут проявлять активность (т.е. способность усиливать рост мегакариоцитов и/или тромбоцитов или же ингибировать/стимулировать активность природного рецептора):
MGDF-4 аминокислоты 22-172 фиг.11
MGDF-5 аминокислоты 22-177 фиг.11
MGDF-6 аминокислоты 22-191 фиг.11
MGDF-7 аминокислоты 22-198 фиг.11
MGDF-8 аминокислоты 22-265 фиг.11
MGDF-11 аминокислоты 22-184 фиг.11
В некоторых клонах аминокислоты 133-136 в последовательности MGDF-1 отсутствовали, поэтому последовательности, соответствующие указанным выше, но в которых указанные аминокислоты утрачены (и номер C-терминальной аминокислоты уменьшен на 4), также могут проявлять активность.
В одном клоне, имеющем кодон терминации в положении 192, вместо остатка Thr в положении 191 обнаружен остаток Ala, как это отражено на фиг.11. Таким образом, в объем изобретения включены варианты молекул MGDF, в которых вместо Thr в положении 191 находится Ala.
MGDF-3 образуется при удалении последовательности, называемой здесь IVS-5 (Промежуточная последовательность-5), поскольку эта последовательность сплайсируется в пределах пятого экзона. Так как 5'-конец IVS-5 входит в состав кодона, удаление этой последовательности приводит к сдвигу рамки считывания в оставшейся последовательности MGDF, который происходит в положении 160 в направлении к концу молекулы MGDF-3.
Для самого MGDF-3 не обнаружено биологической активности при трансфекции клеток 293 и тестирования соответствующей кондиционированной среды в экспериментах на клетках, как это описано в Примере 4. Очевидно, что в отличие от MGDF-1, клетки 293 не способны процессировать MGDF-3 с образованием активной формы. Тем не менее, на основании теории отщепления, описанной выше в отношении MGDF-1, отщепление C-терминальных аминокислот (например, в положении 40-102) от MGDF-3 может обеспечить его активность. Предпочтительно отщепление 50- 90 аминокислот. Двумя особенно предпочтительными вариантами MGDF-2 являются следующие:
MGDF-9 22-179 фиг.12
MGDF-10 22-190 фиг.12
Во всех описанных Mpl-лигандах, включая указанные выше MGDFs, на N-терминальном участке может находиться остаток метионина, особенно в том случае, когда такие полипептиды экспрессируются в бактериальных клетках-хозяевах. Полипептиды Mpl-лиганда могут быть получены и с помощью известных методик химического синтеза. Такие методики хорошо известны специалистам в данной области исследований. Синтетические полипептиды Mpl-лиганда, имея первичную, вторичную, третичную структуру и конформационные свойства полипептидов Mpl-лиганда, полученных другими способами, могут обладать и сходными с ними биологическими свойствами. Так, они могут заменить биологически активные и иммунологически активные природные, очищенные полипептиды Mpl-лиганда при терапевтическом и иммунологическом применении.
Модификации пептидов или последовательностей ДНК, кодирующих Mpl-лиганд, могут быть получены любым специалистом в данной области исследований с помощью известных методик. Такого рода модификации последовательностей Mpl-лиганда могут включать перестановки, инсерции или делеции выборочных аминокислотных остатков в кодирующих последовательностях. Методы осуществления мутагенеза с целью получения таких перестановок, инсерций или делеций хорошо известны специалистам в данной области исследований [см., например Патент США N 4 518 584]. Предпочтительные пептиды могут быть получены с помощью протеолитических ферментов или путем направленного химического синтеза. Такие варианты Mpl-лиганда и полинуклеотидов включены в объем настоящего изобретения.
Специфические мутации в последовательностях полипептида Mpl- лиганда могут включать модификации в сайте гликозилирования (например, сериновом, треониновом или аспарагиновом). Отсутствие гликозилирования или только частичное гликозилирование являются результатом замены или делеции аминокислоты в аспарагин-связанном сайте гликозилирования или каком-либо другом сайте, модифицированном путем добавления О- связанного углевода. Аспарагин-связанный сайт гликозилирования содержит последовательность трипептида, которая специфически распознается соответствующим клеточным ферментом гликозилирования. Такая трипептидная последовательность может быть последовательностью Asn-Xaa-Thr или Asn-Xaa-Ser, где Xaa может быть любой аминокислотой, кроме Pro. Различные замены или делеции аминокислот в одном или обоих первых или третьих положениях аминокислот в распознаваемом сайте гликозилирования (и/или аминокислотная делеция во втором положении) приводят к отсутствию гликозилирования по модифицированной трипептидной последовательности. Экспрессия таких измененных нуклеотидных последовательностей приводит к образованию продуктов, которые не гликозилированы по данному сайту.
Дополнительные аналоги/производные MGDF
Другие аналоги или производные последовательностей MGDF (Mpl-лиганды), которые могут сохранять MGDF (Mpl-лиганд)- активность (частично или полностью), могут быть получены специалистом в данной области исследований с помощью указанных здесь методов. Такие модифицированные продукты тоже включены в объем данного изобретения. Более точно, настоящее изобретение охватывает и композиции на основе химически модифицированного MGDF, а также способы приготовления и использования таких композиций. Настоящее описание показывает, что возможна модификация MGDF с усилением его активности. Один аспект изобретения заключается в получении MGDF-продукта, содержащего MGDF-белок, связанный по крайней мере с одним водорастворимым полимером. С другой стороны, изобретение относится к MGDF- продукту, при том что указанный MGDF-белок связан по крайней мере с одной молекулой полиэтиленгликоля. Кроме того, изобретение относится к MGDF-белку, связанному по крайней мере с одной молекулой полиэтиленгилколя посредством ацильной или алкильной связи.
Пэгирование MGDF может осуществляться с помощью любой реакции, известной из уровня техники, см., например, Focus on Growth Factors 3(2): 4-10 (1992); EP 0154316; EP 0401384 и другие цитируемые здесь публикации, относящиеся к пэгированию. Предпочтительно, чтобы пэгирование осуществлялось посредством реакции ацилирования или реакции алкилирования с реактивной молекулой полиэтиленгликоля (или же молекулой аналогичного водорастворимого полимера). Предпочтительные варианты получения пэгированных продуктов подробно описаны ниже.
Ацилирование
Соединение с полиэтиленгликолем путем ацилирования в основном заключается в осуществлении реакции между активным эфиром полиэтиленгликоля (PEG) и MGDF-белком. Любую известную или полученную впоследствии реактивную молекулу PEG можно использовать для пэгирования MGDF. Предпочтительным активированным эфиром PEG является PEG, этерифицированный с образованием N- гидроксисукцинимида ("NHS"). Таким образом, в контексте настоящего изобретения термин "ацилирование" считается включающим без ограничений следующие типы связей MGDF с водорастворимым полимером (PEG): амидную, карбаматную, уретановую и подобные им. Cм. Bioconjugate Chem. 5: 133-140 (1994). Условия реакции присоединения PEG могут быть выбраны из любых известных или открыты позднее, однако в любом случае следует избегать использования таких температур, растворителей или значений pH, которые способны инактивировать MGDF-продукты, подлежащие модификации. Условия реакции, обычно применяемые для присоединения PEG к MGDF, описаны ниже. Например, реакция с NHS-эфиром монометокси-PEG приведена на фиг.14.
Присоединение PEG путем ацилирования обычно приводит к образованию MGDF-продукта, связанного с несколькими молекулами PEG, причем аминогруппы эпсилон-лизина соединены с PEG посредством ацильной связывающей группы. Предпочтительно, чтобы соединяющая связь была амидной. Также предпочтительно, чтобы получаемый продукт, по существу, был связан только (>95%) с одной, двумя или тремя молекулами PEG. Однако, некоторые продукты с более высокой степенью пэгирования (в реакцию вступило максимальное число аминогрупп эпсилон-лизина и одна альфа-аминогруппа на аминотерминальном участке MGDF) в норме могут образоваться, причем их количество зависит от специфических условий реакции. При необходимости из реакционной смеси могут быть выделены очищенные пэгированные продукты, а также не вступившие в реакцию соединения при использовании стандартных методов очистки, в том числе диализа, высаливания, ультрафильтрации, ионообменной хроматографии, гельфильтрационной хроматографии и электрофореза.
Алкилирование
Соединение с PEG путем алкилирования обычно заключается в осуществлении реакции между терминальным альдегидным производным PEG и белком, таким как MGDF, в присутствии восстанавливающего агента. Как и в случае ацилирования, подробные условия реакции алкилирования описываются ниже.
Соединение с PEG путем алкилирования также может приводить к образованию MGDF-продукта, связанного с несколькими молекулами PEG. Например, реакция алкилирования MGDF в восстанавливающих условиях, которая приводит к образованию MGDF-продукта, связанного с несколькими молекулами PEG, приведена на фиг. 15. Кроме того, можно изменять условия реакции так, что присоединение PEG будет происходить только по альфа-аминогруппе N-терминального участка молекул MGDF (т.е. будут образовываться MGDF-продукты, связанные с одной молекулой PEG). Например, реакция алкилирования MGDF в восстанавливающих условиях, которая приводит к образованию MGDF-продукта, связанного с одной молекулой PEG, приведена на фиг. 16. При "монопэгировании", так же как и при "полипэгировании", PEG-группы предпочтительно соединяются с белком посредством -CH2-NН-группы. Благодаря наличию группы -CH2-, такой тип связи называют "алкильной" связью.
Получение производных MGDF, соединенных с одной молекулой PEG, посредством восстановительного алкилирования основано на неодинаковой реактивности различных типов первичных аминогрупп (лизин в противоположность N-терминальным аминогруппам), пригодных для получения указанных производных MGDF. Реакцию проводят при таком значении pH (см. ниже), которое позволяет использовать различия pKa между остатками эпсилон-аминогрупп лизина и альфа- аминогруппами N-терминального участка белка. Благодаря такому подходу, контролируется присоединение к белку водорастворимого полимера, содержащего реакционно-способную группу, такую как альдегидная. Конъюгация с полимером происходит преимущественно на N- концевых участках белка, и значительных модификаций других реактивных групп, таких как боковые группы аминогрупп лизина, не происходит. Один важный аспект настоящего изобретения заключается в получении, по существу, гомогенного препарата конъюгированного с монополимером MGDF-белка (т.е. MGDF-белка, к которому молекула полимера прикреплена практически только в одном (>95%) определенном месте). Более точно, если используется полиэтиленгликоль, настоящее изобретение также относится к пэгированному MGDF-белку, утратившему возможные антигенные группы и содержащему молекулу полиэтиленгликоля, непосредственно связанную с MGDF-белком.
Таким образом, предпочтительный аспект изобретения заключается в получении пэгированного MGDF, причем PEG-группы(а) прикреплены(а) к молекуле белка посредством ацильной или алкильной группы. Как указано выше, такие продукты могут быть монопэгированными (например, содержащими 2-6, предпочтительно 2-5 -PEG-групп). PEG-группы прикрепляются к белку в основном посредством альфа- или эпсилон-аминокислотных групп, однако не исключается возможность того, что PEG- группы могут быть присоединены к любой аминогруппе белка, которая обладает достаточной реакционной способностью, чтобы связываться с PEG в подходящих условиях проведения реакции.
Полимерные молекулы, используемые в реакциях ацилирования и алкилирования, могут быть выбраны из водорастворимых полимеров или их смесей. В случае водорастворимого полимера белок, к которому он прикреплен, не будет преципитировать в водной среде, такой как физиологическая жидкость. Выбранный полимер следует модифицировать таким образом, чтобы он содержал одну реакционно-способную группу, такую как активный эфир в случае ацилирования или альдегид в случае алкилирования. Предпочтительно, чтобы степень полимеризации могла контролироваться, как это описано в настоящем изобретении. Предпочтительным реакционно-способным PEG-альдегидом является пропиональдегид полиэтиленгликоля, который стабилен в воде, или моно C1-C1-алкокси или арилокси его производные (см. Патент США N 5,252, 714). Полимер может быть линейным или разветвленным. При использовании для терапевтических целей конечного продукта предпочтительно, чтобы полимер был фармацевтически приемлемым. Водорастворимый полимер может быть выбран из группы, содержащей, например, полиэтиленгликоль, монометоксиполиэтиленгликоль, декстран, поли(N-винилпирролидон) полиэтиленгликоль, гомополимеры пропиленгликоля, сополимер полипропилен оксида/этилендиоксида, полиоксиэтилированные полиолы (например, глицерин) и поливиниловый спирт. Для реакции ацилирования, полимер(ы) выбирают таким образом, чтобы он (они) имел(и) одну реакционно-способную эфирную группу. Для реакций алкилирования в восстанавливающих условиях полимер(ы) выбирают таким образом, чтобы он(они) имел(и) одну реакционно-способную альдегидную группу. В целом, водорастворимый полимер не следует выбирать из природных гликозильных остатков, поскольку эти остатки обычно более удобно присоединять к белку путем экспрессии в клетках млекопитающих. Полимер может быть любой молекулярной массы.
Особенно предпочтительно использование в качестве водорастворимого полимера полиэтиленгликоля (PEG, ПЭГ). Как отмечается в настоящем описании, для получения производных различных белков может быть использована любая форма PEG, например моно-(C1-C10) алкокси или арилокси-полиэтиленгликоль.
Как отмечалось ранее, под MGDF также понимают любую из его форм, описываемых здесь. Например, это могут быть гликозилированные или негликозилированные формы MGDF, а также белки, имеющие полную длину или же образовавшиеся в результате расщепления исходного продукта. Ниже приведены предпочтительные MGDF-белки, на основании которых могут быть получены различные производные (в каждом случае номера аминокислот соответствуют таковым на фиг. 11):
MGDF-1 аминокислоты 22-353 фиг.11
MGDF-2 аминокислоты 22-195 фиг.11
MGDF-4 аминокислоты 22-172 фиг.11
MGDF-11 аминокислоты 22-184 фиг.11
MGDF-12 аминокислоты 27-353 фиг.11
MGDF-13 аминокислоты 27-195 фиг.11
MGDF-14 аминокислоты 27-172 фиг.11
MGDF-15 аминокислоты 27-184 фиг.11
Указанные MGDF-белки могут быть негликозилированы, дегликозилированы, предпочтительно, негликозилированы. Они могут быть получены в рекомбинантных бактериальных (например, E. coli) системах или в клетках млекопитающих (например, CHO).
Ниже приведены наиболее предпочтительные производные MGDF, полученные химическим путем (в каждом случае они моно или полипэгированы, т.е. например, содержат 2-4 молекулы PEG, присоединенные посредством ацильной или алкильной группы):
пэгиpoвaнный MGDF-11
пэгированный MGDF-4
пэгированный MGDF-2
В целом, получение производных MGDF химическим путем может происходить в любых подходящих условиях для вступления в реакцию биологически активного соединения с активированной молекулой полимера. Методы получения пэгированного MGDF обычно включают следующие стадии: (а) прохождение реакции между полипептидом MGDF и полиэтиленгликолем (например, реакционно-способным эфиром или альдегидным производным PEG) в условиях, когда MGDF соединяется с одной или более PEG-группами, и (б) выделение продукта (продуктов) реакции. В целом, оптимальные реакционные условия для ацилирования определяются от случая к случаю на основе известных параметров и желаемого результата. Например, чем больше соотношение PEG: белок, тем больше выход (в процентах) полипэгированного продукта.
Восстановительное алкилирование для получения, по существу, гомогенного конъюгата монополимер/MGDF-белок обычно включает следующие стадии: (а) прохождение реакции между MGDF- белком с реакционно-способным PEG в условиях восстановительного алкилирования при pH, обеспечивающем селективную модификацию альфа-аминогруппы на амино-терминальном участке MGDF-белка; и (б) выделение продукта (продуктов) реакции.
Для получения, по существу, гомогенного конъюгата монополимер/MGDF-белок условия реакции восстановительного алкилирования должны обеспечивать избирательное связывание водорастворимого полимера с N-терминальным участком MGDF. Такие условия обычно основаны на различиях pKa между аминогруппами лизина и альфа-аминогруппой на N-терминальном участке (pKa представляет собой значение pH, при котором 50% аминогрупп протонированы, а 50% - нет). pH также влияет на используемое соотношение полимера и белка. В целом, при более низком pH требуется избыток полимера по отношению к белку (т.е., чем меньше реакционно-способных N-терминальных альфа-аминогрупп, тем большее количество полимера нужно для достижения оптимального результата). Если значение pH более высокое, не требуется большого соотношения полимер : белок (доступно большее количество реакционноспособных групп, так что требуется меньше полимерных молекул). Для целей настоящего изобретения значение pH обычно составляет 3-9, предпочтительно 3-6.
Другой важный аспект - это молекулярная масса полимера. В целом, чем больше мол. масса полимера, тем меньшее число его молекул способно соединиться с белком. Для оптимизации данных параметров следует учитывать степень ветвления полимера. Как правило, при большей мол. массе (большей степени ветвления) выше отношение полимер : белок. Для рассматриваемых здесь реакций соединения PEG с белком мол. масса PEG в среднем составляет около 2 кД - 100 кД (понятие "около" соответствует +/-1 кД). Предпочтительно, чтобы средняя мол. масса PEG составляла около 5 кД- 50 кД, особенно предпочтительно - около 12 кД-25 кД. Отношение водорастворимый полимер : MGDF-белок, в основном, составляет 1: 1-100:1, предпочтительно (для полипэгирования) 1:1- 20: 1 и (для монопэгирования) 1:1-5:1.
При использовании указанных выше условий, восстановительное алкилирование будет обеспечивать избирательное присоединение полимера к любому MGDF-белку, имеющему альфа- аминогруппу на амино-терминальном участке, и способствовать получению, по существу, гомогенного препарата монополимера, конъюгированного с MGDF-белком. Понятие "монополимер, конъюгированный с MGDF-белком", относится к соединению, содержащему молекулы PEG-белка, связанные с одной молекулой полимера. Такой конъюгат предпочтительно будет содержать молекулу полимера, расположенную на N-терминальном участке, но не на боковых аминогруппах лизина. Полученный препарат, предпочтительно, более чем на 90% состоит из монополимера, конъюгированного с MGDF- белком, и предпочтительнее - более чем на 95%, при этом остаются молекулы, не вступившие в реакцию (молекулы белка, на взаимодействие с которыми не хватило полимера). В приведенных ниже примерах показано получение препарата, по крайней мере на 90% состоящего из конъюгата монополимера и белка и на 10% состоящего из не вступившего в реакцию белка. Такой конъюгат является биологически активным.
Для проведения восстановительного алкилирования, восстанавливающий агент должен быть стабильным в водном растворе и предпочтительно обладать способностью к восстановлению только Шиффовых оснований, образовавшихся на начальных этапах восстановительного алкилирования. Предпочтительные восстанавливающие агенты могут быть выбраны из группы, содержащей борогидрид натрия, цианоборогидрид натрия, диметиламинборан, триметиламинборан и пиридинборан. Особенно предпочтительным восстанавливающим агентом является цианоборогидрид.
Другие параметры осуществления реакции, такие как растворитель, время реакции, температура и т.д., а также степень очистки продуктов могут определяться от случая к случаю на основе опубликованной информации, касающейся получения производных белков при использовании водорастворимых полимеров (см. приведенные в настоящем описании ссылки). Более подробно указанные реакции изложены в примерах, приведенных ниже.
Для получения смеси белка, конъюгированного с полимером, может быть выбран метод ацилирования и/или алкилирования, причем преимущество описанного здесь подхода заключается в том, что можно приготовить смесь с заданным относительным содержанием монополимер/белок. Таким образом, при необходимости получают смесь различных белков, связанных с различным числом молекул полимера (ди-, три-, тетра- и т.д.), в сочетании с конъюгатом монополимер/белок, полученным при использовании изложенных здесь методов, причем указанная смесь характеризуется заданным содержанием конъюгата монополимер/белок.
В приведенных ниже примерах раскрывается способ получения химически модифицированного MGDF и MGDF, соединенного с PEG посредством ацилирования или алкилирования. Соответственно другие аспекты изобретения связаны с данными соединениями.
В целом, многие болезненные состояния могут быть скорригированы путем применения заявленных конъюгатов MGDF с полимером. Однако, такие конъюгаты могут обладать модифицированной активностью, как увеличенной, так и уменьшенной, а также другими свойствами по сравнению с неизмененными молекулами.
Еще один аспект настоящего изобретения относится к фармацевтическим композициям на основе химически модифицированных MGDF-белков. Такие фармацевтические композиции могут содержать и какой-либо из немодифицированных MGDF-белков.
По мере проведения дополнительных исследований появится информация о подходящих дозах указанных препаратов для лечения различных заболеваний у разных больных, и средний специалист в данной области исследований, учитывая медицинские показания, возраст и общее состояние пациента, сможет подобрать соответствующую дозу. В целом, доза может составлять от 0,01 мкг/кг веса тела (в расчете на массу белка, не имеющего химических модификаций) до 300 мкг/кг веса тела (рассчитанную аналогичным образом). Предпочтительная доза, в целом, может составлять от 5 мкг/кг веса тела до 100 мкг/кг веса тела, особенно предпочтительна доза от 10 мкг/кг веса тела до 75 мкг/кг.
Настоящее изобретение относится также к способу получения MGDF-полипептидов (полипептидов MGDF-лиганда) или их активных фрагментов. Один из заявленных способов включает встраивание кДНК, кодирующей полипептид Mpl-лиганда, в вектор экспрессии для получения системы экспрессии Mpl-лиганда. Отобранные клетки-хозяева трансфицируют данным вектором и культивируют. Способ, заявленный в настоящем изобретении, таким образом, включает культивирование подходящих клеток или клеточной линии, трансфицированных ДНК- последовательностью, кодирующей или экспрессирующей полипептид Mpl-лиганда под контролем известных регуляторных последовательностей. К регуляторным последовательностям относятся фрагменты промотора, терминатора и другие подходящие последовательности, которые направляют/контролируют экспрессию белка в соответствующих клетках-хозяевах. Затем продукт экспрессии выделяют и очищают от культуральной среды (или от клеток в случае внутриклеточной экспрессии) любым пригодным методом, известным специалисту в данной области исследований. Кроме того, для получения заявленных полипептидов/полинуклеотидов могут быть использованы способы, описанные в Патенте США N 5,272,071.
Подходящие клетки или клеточные линии могут быть клетками млекопитающих, например клетками яичников китайского хомячка (CHO) или 3Т3. Методы выбора подходящих клеток-хозяев, их трансформации и культивирования, амплификации, скрининга, выделения и очистки целевого продукта известны из уровня техники, см. , например, Gething and Sambrook, Nature 293: 620-625 (1981) или Kaufman et al., Mol.Cell.Biol. 5(7): 1750-1759 (1985) или Howley et al., Патент США 4 419 446. К другим подходящим клеточным линиям млекопитающих относятся линии клеток обезьяны COS-1, COS-7 и CV-1. В приведенных ниже примерах используются клетки млекопитающих, в том числе линии клеток приматов и грызунов, в частности, трансформированные клеточные линии. Могут быть использованы также нормальные диплоидные клетки, клеточные штаммы, полученные in vitro при культивировании первичных тканей, а также первичные эксплантаты. Клетки могут быть генетически дефектными по селективному маркеру или содержать доминантно функционирующий селективный ген. К другим подходящим клеточным линиям млекопитающих относятся (но не ограничиваются указанными) HeLa, клетки L-929 мыши, 3Т3-линии, полученные от мышей Swiss, Balb/c или NIH, а также клетки хомячка BHK или HaK.
Подходящими клетками-хозяевами для целей настоящего изобретения являются также бактериальные клетки. Например, специалистам в биотехнологии хорошо известны различные штаммы E.coli (например, HB101, DH5-alfa, DH10 и MC1061), которые могут использоваться в качестве клеток-хозяев. Кроме того, при осуществлении заявленного способа могут быть применены различные штаммы В. subtilis, Pseudomonas spp., Bacillus spp., Streptomyces spp. и подобные им.
Для экспрессии заявленных полипептидов в качестве клеток-хозяев можно использовать и различные штаммы дрожжей, известные специалистам в данной области исследований. При необходимости для осуществления заявленного способа в качестве клеток-хозяев возможно использование клеток насекомых, см., например Miller et al., Genetic Engineering 8: 277-298 (1986) и приведенные в настоящем описании ссылки.
Настоящее изобретение также относится к рекомбинантным молекулам или векторам для использования в способе экспрессии новых полипептидов Mpl-лиганда. Указанные векторы содержат ДНК-последовательности Mpl-лиганда, которые сами по себе или в сочетании с другими последовательностями кодируют полипептиды Mpl-лиганда (как с сигнальным пептидом, так и без него), заявленные в настоящем изобретении, или их активные фрагменты. Альтернативно, векторы, содержащие модифицированные последовательности, как описано выше, также включены в объем изобретения и применяются для получения полипептидов Mpl-лиганда. Вектор, используемый для осуществления способа, содержит выбранные регуляторные последовательности, функционально связанные с ДНК-кодирующими последовательностями, полученными согласно настоящему изобретению, и способен направлять экспрессию таких последовательностей в клетках-хозяевах.
Для экспрессии белков в COS-клетках особенно предпочтительным является вектор pXM [Y.C.Yang et al., 47: 3-10 (1986)]. Другим вектором, удобным для экспрессии белков в клетках млекопитающих, например, клетках CHO, служит вектор pEMC2B1. Описанные здесь векторы для экспрессии белков в клетках млекопитающих могут быть получены известными способами. Составляющие векторов, например, репликоны, селективные маркерные гены, энхансеры, промоторы и т.д. , могут быть получены из природных источников или синтезированы с помощью известных подходов, см., например, Kaufman et al., J. Mol. Biol. 159: 511-521 (1982); и Kaufman, Proc. Natl. Acad. Sci. USA 82: 689-693 (1985). Альтернативно, ДНК -вектор может содержать целый геном или часть генома бычьего вируса папилломы [Lusky et al., 36: 391-401 (1984)] и реплицироваться в клеточных линиях, например клетках C127 мыши, как стабильный эписомальный элемент. Перенос таких векторов в соответствующие клетки-хозяева приводит к экспрессии в этих клетках полипептидов Mpl-лиганда.
Для целей настоящего изобретения могут быть использованы и другие подходящие векторы, предназначенные для экспрессии белков в клетках млекопитающих, насекомых, дрожжей, грибов и бактерий.
Болезненные состояния, которые подлежат коррекции с помощью заявленных композиций и способов их применения, в целом, являются состояниями с недостаточностью мегакариоцитов/тромбоцитов, или же возникновение такой недостаточности ожидается в будущем (например, при планируемых хирургических операциях). Указанные состояния обычно развиваются в результате недостаточности (хронической или преходящей) активного Mpl-лиганда in vivo. Обычным названием недостаточности тромбоцитов является тромбоцитопения, поэтому заявленные композиции и способы их применения относятся к лечению тромбоцитопении.
Тромбоцитопения (недостаточность тромбоцитов) может быть вызвана различными причинами, в том числе, химиотерапией, лекарственной терапией, радиационной терапией, хирургическими вмешательствами, случайной кровопотерей и другими заболеваниями. Примерами болезненных состояний, при которых наблюдается тромбоцитопения и которые могут быть корригированы в соответствии с настоящим изобретением, являются апластическая анемия, идиопатическая тромбоцитопения, метастазирующие опухоли, приводящие к тромбоцитопении, системная красная волчанка, спленомегалия, синдром Фанкони, недостаточность витамина B12, недостаточность фолиевой кислоты, аномалия Мэя-Хегглина, синдром Вискотта-Олдрича и пароксизмальная ночная гемоглобинурия. Кроме того, к тромбоцитопении приводит лечение СПИДа некоторыми препаратами (например, AZT). Определенные нарушения в заживлении ран также могут быть обусловлены увеличением числа тромбоцитов.
При ожидаемой недостаточности тромбоцитов, например в результате будущих хирургических операций, Mpl-лиганд, заявленный в настоящем изобретении, может быть применен в течение периода времени, составляющего от нескольких дней до нескольких часов до возникновения потребности в тромбоцитах. В случае острых состояний, например, при внезапных и больших кровопотерях, Mpl- лиганд может быть введен вместе с заменяющей кровью или очищенными тромбоцитами.
Заявленные Mpl-лиганды могут быть использованы и для стимуляции определенных типов клеток, отличных от мегакариоцитов, если показано, что такие клетки экспрессируют Mpl-рецептор. Состояния, ассоциированные с клетками, экспрессирующими Mpl- рецептор, ответственный за эффект стимуляции посредством Mpl- лиганда, также рассматриваются в объеме настоящего изобретения.
MGDF-молекулы, которые сами по себе не проявляют активности в описываемых здесь экспериментах, могут оказаться полезными в качестве модуляторов (например, стимуляторов или ингибиторов) Mpl- рецепторов in vitro.
Для лечения указанных выше заболеваний заявленные полипептиды могут быть применены самостоятельно или в сочетании с другими цитокинами, растворимым Mpl-рецептором, гематопоэтическими факторами, интерлейкинами, ростовыми факторами или антителами.
В соответствии с этим, еще один аспект настоящего изобретения заключается в получении терапевтических композиций для лечения приведенных заболеваний. Такие композиции содержат терапевтически эффективное количество полипептида Mpl-лиганда или его активного фрагмента в комплексе с фармацевтически приемлемым носителем. Носитель может представлять собой воду для инъекций, предпочтительно дополненную другими компонентами для получения растворов, которые могут вводиться млекопитающим. При терапевтическом использовании Mpl-лиганд может быть применен в виде композиции, содержащей очищенный белок, конъюгированный с одним или более физиологически приемлемыми носителями, растворителями или разбавителями. Нейтральный буферный раствор или раствор, смешанный с сывороточным альбумином, являются примерами подходящих носителей. Предпочтительно, продукт приготавливают в лиофилизированной форме при использовании соответствующих растворителей (например, сахарозы). Могут быть использованы и другие обычные носители, разбавители или растворители, например Трис-буфер (pH 8,0) и ацетатный буфер (pH 5,0), которые иногда содержат сорбитол. Заявленные композиции могут вводиться парентерально. Альтернативно, композиции могут быть применены внутривенно или подкожно. При системном применении для целей настоящего изобретения терапевтические композиции могут быть приготовлены в апирогенной форме в виде водного раствора, пригодного для парентерального введения. Способы приготовления таких фармацевтически пригодных растворов белка в соответствии с необходимым pH, изотоническими свойствами, стабильностью хорошо известны специалистам в данной области исследований.
Дозировка и режим введения препаратов при осуществлении способа лечения описанных выше заболеваний подбираются практикующим врачом с учетом различных факторов, изменяющих действие лекарств, таких как возраст, состояние больного, характер его питания, вес тела, пол, тяжесть какой-либо инфекции, время применения и другие клинические факторы. В целом, ежедневно следует применять около 0,1-1000 мкг белка Mpl-лиганда или его фрагмента на 1 кг веса тела.
Композиции и полипептиды, заявленные в настоящем изобретении, при осуществлении способов лечения могут быть использованы как сами по себе, так и в сочетании с другими цитокинами, растворимым Mpl- рецептором, гематопоэтическими факторами, интерлейкинами, ростовыми факторами или антителами при корригировании заболеваний, характеризующихся симптомами, отличными от тромбоцитарной недостаточности. Ожидается, что Mpl-лиганд будет действительно полезен при лечении некоторых форм тромбоцитопении в сочетании с такими мощными стимуляторами гематопоэза, как IL-3 или GM-CSF. Кроме того, вместе с Mpl-лигандом могут быть применены и другие факторы стимуляции мегакариоцитов, например, мег-КСФ (meg-CSF), фактор стволовых клеток (SCF), лейкоз-ингибирующий фактор (LIF), онкостатин М (OSM) или иные соединения, обладающие мегакариоцитстимулирующей активностью. Дополнительными примерами цитокинов или гематопоэтических факторов для указанной сочетанной терапии служат альфа-IL-1, бета-IL-1, IL-2, IL-3, IL-4, II-5, IL- 6, II-11, колониестимулирующий фактор-1 (CSF-1), GM-CSF, гранулоцитарный колониестимулирующий фактор (G-CSF), ЕРО, альфа- интерферон (альфа-ИФН, IFN), бета-ИФН или гамма-ИФН. Может оказаться целесообразным одновременное или последовательное введение совместно с указанными соединениями растворимого Mpl- рецептора млекопитающих, который, по-видимому, способствует разрушению мегакариоцитов с образованием тромбоцитов, как только мегакариоциты созреют. Таким образом, введение Mpl-лиганда (для увеличения количества зрелых мегакариоцитов) с последующим применением растворимого Mpl-рецептора (для инактивирования лиганда и разрушения зрелых мегакариоцитов с образованием тромбоцитов), по-видимому, будет действительно эффективным для стимуляции образования тромбоцитов. Дозы, указанные выше, могут быть скорригированы в зависимости от того, какие дополнительные компоненты входят в состав фармацевтической композиции. Эффективность лечения контролируют соответствующими методами. Кроме того, заявленные новые полипептиды используются для получения антител. Таким образом, в объем изобретения включены антитела, взаимодействующие с Mpl-лигандом, полученным согласно настоящему изобретению, и активные фрагменты данных антител. Антитела могут быть поликлональными, моноклональными, рекомбинантными, химерными, одноцепочечными и/или биспецифическими и т.д. Фрагментом антитела может быть любой фрагмент, взаимодействующий с Mpl-лигандом, такой как Fab, Fab' и т.д. В объем настоящего изобретения также включены гибридомы, полученные при использовании Mpl-лиганда или его фрагмента в качестве антигена для иммунизации животных, с последующим слиянием клеток животных (например, клеток селезенки) с определенной опухолевой клеточной линией. В результате слияния, осуществляемого известными методами, получают бессмертные клеточные линии, продуцирующие антитела. Способы получения гибридом и антитела, направленные к целому полипептиду Mpl-лиганда или его отдельным участкам, также включены в объем настоящего изобретения.
Антитела могут использоваться в терапии, например для ингибирования связывания Mpl-лиганда с рецептором. Антитела, связанные с соответствующей меткой, могут найти применение и в диагностике in vivo и in vitro, для выявления Mpl-лиганда в жидкостях организма.
Приведенные ниже Примеры наиболее полно раскрывают данное изобретение. Кроме того, в них отражены предпочтительные варианты осуществления изобретения без ограничения его объема. Стандартные методики для осуществления экспериментов, описанных в приведенных ниже Примерах, а также подходящие альтернативные методики, изложены в широко известных руководствах по молекулярной биологии, например, Sambrook et al., Molecular Cloning, Второе издание, Cold Spring Harbor Laboratory Press (1987) и Ausubel et al., (Eds), Current Protocols in Molecular Biology, Greene associates/Wiley Interscience, New York (1990).
Пример 1. Апластическая плазма собаки
Гепаринизированную апластическую плазму собаки ("АРК9") или нормальную плазму собаки ("NK9") получали, как описано в приведенных ниже публикациях, с той разницей, что доза облучения реципиентов составляла 450 рад:
1. Mazur.E. and South, К. Exp.Hematol. 13:1164-1172 (1985).
2. Arriada, M., South, К., Cohen, J.L, and Mazur, E.M. Blood 69:486-492 (1987).
3. Mazur.E., Basilico, D., Newton, J.L., Cohen, J.L, Garland, C., Sohl, P.A., and Narendran, A. Blood 76:1771-1782 (1990).
Пример 2. Определение мегакариоцитов человека
АРК9 и фракционированная АРК9 были проверены на способность стимулировать развитие мегакариоцитов человека из CD34+ клеток- предшественников. CD34+ клетки получали из клеток периферической крови, как описано (Hokom, М.Н., Choi.E., Nichol, J.L, Hornkohl,A., Arakawa.T., and Hunt, P. Molecular Biology of Haematopoiesis 3: 15-31,1994), и инкубировали в культуральной среде следующего состава: среда Дальбекко в модификации Исков (IMDM; GIBCO, Grand Island, NY) с 1% смеси глютамин-пеннициллин- стрептомицин (Irvine Scientific, Santa Ana, CA), 10% гепаринизированная, свободная от тромбоцитов человеческая плазма AB. Также добавляли 2-меркаптоэтанол (10-4 М), пируват (110 мкг/мл), холестерин (7,8 мкг/мл), аденозин, гуанин, цитидин, уридин, тимидин, 2-дезоксицитозин, 2-дезоксиаденозин, 2- дезоксигуанозин (каждый по 10 мкг/мл, Sigma); человеческий рекомбинантный инсулин (10 мкг/мл); человеческий трансферрин (300 мкг/мл), соевые липиды (1%, Boehringer Mannheim, Indianapolis, IN); человеческий рекомбинантный основной фактор роста фибробластов (2 нг/мл, Genzyme, Cambridge, MA); человеческий рекомбинантный эпидермальный ростовой фактор (15 нг/мл), ростовой фактор, полученный из тромбоцитов (10 нг/мл, Amgen,Inc., Thousand Oaks, CA).
CD34+ клетки засевали в концентрации 200000/мл культуральной среды, в конечном объеме 15 мкл в ячейки планшетов Теразаки (Vanguard, Inc., Neptune, NJ). Клетки инкубировали в течение 8 дней во влажной атмосфере с 5% CO2 при 37oC, затем фиксировали прямо в планшетах 1% глутаровым альдегидом и инкубировали со смесью моноклональных антител (anti-GPIb, anti GPIIb, (Bio design) и anti GPIb (Dako, Carpinteria, CA). Иммунную реакцию выявляли при помощи системы стрептавидин-бета- галактозидаза (HistoMark, Kirkegaard and Perry). Мегакариоциты, выявляемые в виде синих колоний, подсчитывали на инвертированном фазовом микроскопе с увеличением 1000x. Результаты представляли в виде среднего числа мегакариоцитов на лунку +/- стандартная ошибка определения (SEM). В некоторых случаях данные представляли в "мегакариоцитарных единицах/мл", при этом та степень, в которой данный тестируемый образец индуцировал развитие мегакариоцитов, была нормализована относительно использованного в опыте положительного контроля - APK9. Одну единицу определяли как то количество материала, которое приводило к образованию такого же числа мегакариоцитов, что и 1 мкл стандарта APK9. Активность приписывали Mpl-лиганду если она могла быть блокирована 5-10 мкл/мл MPL-X (растворимым Mpl-рецептором).
Показано, что APK9 содержит фактор(ы), который стимулирует развитие мегакариоцитов человека в данной системе. CD34+ клетки, инкубированные с 10% NK9 в течение 8 дней, показали пренебрежимо малое количество окрашенных синим мегакариоцитов, тогда как те же клетки, инкубированные 8 дней с 10% APK9, дали очень большое число окрашенных мегакариоцитов.
На фиг.2 видно, что возрастающие концентрации Mpl-X, добавленного к культуральной системе человеческих мегакариоцитов, в возрастающей степени блокируют развитие мегакариоцитов. При концентрациях Mpl-X больше 5 мкг/мл наступает полное подавление. В данном опыте CD34+ клетки стимулировали 5% APK9. Это указывает на тот факт, что активность, взаимодействующая с Mpl-X (предположительно Mpl-лиганд), необходима для развития мегакариоцитов человека и в APK9 присутствует собственно Mpl-лиганд.
Были получены и другие подтверждения того, что в APK9 присутствует активность Mpl- лиганда, необходимого для развития мегакариоцитов человека. APK9 (135 мл) разбавили в 6 раз средой Исков и нанесли на аффинную колонку Mpl-X. Несвязавшийся материал был собран и сконцентрирован до первоначального объема перед постановкой теста. Связавшийся материал элюировали 10 мл 1 М NaCl, 20% собранного пула подвергли диафильтрации и затем сконцентрировали в 4 раза. CB34+ клетки, которые инкубировали в среде без добавок APK9, не дали начала мегакариоцитам. Клетки, инкубированные с 5% APK9 (того же образца, что наносили на колонку), дали 48 +/- 8 мегакариоцитов на ячейку. Клетки, инкубированные с несвязавшимся материалом (в концентрации 10%), не образовали мегакариоцитов. Клетки, инкубированные с 10% элюата, дали счет 120 +/- 44 мегакариоцитов на ячейку. Активность в наносимом на колонку образце и активность в элюате практически полностью подавлялись 5 мкг/мл Mpl-X.
Пример 3. Трансфекция Mpl-рецептора мыши или человека в мышиную клеточную линию
A. Mpl-рецептор мыши
Полноразмерная кДНК Mpl-рецептора мыши была субклонирована в вектор экспрессии, содержащий транскрипционный промотор, полученный из LTR вируса саркомы мышей Молони. 5 мкг данного конструкта и 1 мкг плазмиды pWLNeo, несущей селективный маркер (Stratagene), были ко-электропорированы в клетки IL-3-зависимой мышиной линии (32D, клон 23; Greenberger et al., PNAS 80: 2931- 2936 (1983)). Клетки культивировали в течение пяти дней для восстановления после электропорации, затем переводили на селективную среду, содержащую 800 мкг/мл Генетецина (G418, Sigma) и 1 нг/мл IL-3. Затем выжившие клетки разделяли на два пула по 200000 клеток в каждом и подращивали для анализа. Шесть популяций клеток были проверены на поверхностную экспрессию Mpl- рецептора методом проточной цитофлуориметрии (FACS) с использованием поликлональной кроличьей антипептидной сыворотки. Одна из популяций была отобрана для сортировки в протоке с применением той же сыворотки. Одноклеточные клоны исходной клеточной линии были получены путем подращивания клеток на среде с 10% APK9 и Генетецином. После селекции в присутствии APK9 в течение 35 дней клетки поддерживали культивированием в присутствии 1 нг/мл мышиного IL-3. Один из субклонов, 1A6.1, был использован для выполнения основной работы.
B. Mpl-рецептор человека
Полноразмерные последовательности Mpl-рецептора человека (Vigon.l., et al. , PNAS 89: 5640 - 5644 (1992)) были субклонированы в вектор экспрессии, содержащий транскрипционный промотор вируса саркомы мышей Молони (тот же вектор, что и в случае мышиного рецептора). Шесть мкг данного конструкта и 6 мкг амфотропного ретровирусного упаковочного конструкта (Landau, N.R., Littman, D. R. , J.Virology 66: 5110-5113 (1992)) были трансфецированы в три миллиона клеток 293 с использованием набора для трансфекции клеток млекопитающих на основе CaPO4 (Stratagene). Те же клетки были ретрансфецированы после 2 дней культивирования и еще раз ретрансфецированы спустя 4 дня. Через день после последней трансфекции клетки 293 кокультивировали с клетками IL-3-зависимой мышиной линии (32D, клон 23; Greenberger et al., PNAS 80: 2831- 2936 (1983)). После 24 часов кокультивации клетки 32D отделяли и фракционировали в градиенте BSA (Path-o-cyte; Miles Inc.). Затем клетки подращивали в присутствии 1 нг/мл мышиного IL-3 и отбирали на способность расти в пристутствии 20% АРК9. Клетки сортировали проточной цитофлуориметрией (FACS) на поверхностную экспрессию рецептора с помощью поликлональной кроличьей антипептидной сыворотки. Именно эти клетки далее использовали в опытах.
Пример 4. Определение Mpl-лиганда при помощи клеток 1A6.1
Клетки 1A6.1 отмывали от присутствующего в среде IL-3 и засевали (1000 клеток/ 15 мкл конечного объема/ячейку) в планшеты Теразаки в среде альфа-MEM (Gibco) с 10% эмбриональной телячьей сыворотки (FCS), Генетецином (800 мкг/мл), 1% пенициллином-стрептомицином (Gibco) в 1:1 последовательных разведениях тестируемых образцов. После 48 часов культивирования микроскопически определяли количество жизнеспособных клеток на ячейку. За единицу активности принимали такую активность, которая приводила к обнаружению 200 жизнеспособных клеток на ячейку. Активность приписывалась Mpl-лиганду, если она полностью подавлялась включением в определение 5-10 мкг/мл Mpl-X. Активность Mpl-лиганда в усредненных единицах APK9 составляла 4400 +/- 539 единиц/мл апластической плазмы. Если не указано специально, единицы активности Mpl-лиганда определяли в опытах с использованием клеток 1A6.1.
Определения с клетками, трансфицированными геном Mpl-рецептора человека (Пример 3B), проводили точно так же, как и с клетками 1A6.1.
Пример 5. Mpl-лиганд присутствует в апластической плазме или сыворотке мыши, собаки, свиньи и человека
Mpl-лиганд присутствует в апластической плазме или сыворотке мыши, собаки, свиньи и человека (Таблица 2). Плазму собирали у мышей BDF1 до облучения и спустя 12 дней после облучения дозой 500 рад. Плазму проверяли в тесте на клетках 1A6.1, и была обнаружена активность 2000 единиц/мл, которая практически полностью ингибировалась Mpl-X (10 мкг/мл). Плазма облученных мышей была также положительна в тесте на мегакариоцитах человека, и ее активность составляла 1833 ед/мл. У собак плазму собирали до облучения и 10 дней спустя после облучения в дозе 450 рад. Плазму проверяли в тесте на клетках 1A6.1 и в тесте на мегарикариоцитах человека. В обоих определениях была обнаружена активность, которая полностью ингибировалась Mpl-X (10 мкг/мл). У свиней плазму собирали до облучения и через 10 дней после облучения (650 рад). Плазму проверяли в тесте на клетках 1A6.1 и тесте на мегакариоцитах человека. В обоих определениях обнаружена активность лиганда (подавляемая Mpl-X в концентрации 10 мкг/мл), сравнимая с таковой, обнаруживаемой в апластической плазме собаки. Были также получены сыворотки от апластических пациентов. Этот материал получали от больных, перенесших трансплантацию костного мозга. Сыворотки шести пациентов были проверены в тесте на клетках 1A6.1 и обнаружена активность 903 ед/мл, 88% которой было обусловлено Mpl-лигандом (подавлялась 10 мкг/мл Mpl-X). Сыворотки 14 пластических пациентов были также проверены в тесте на мегакариоцитах человека. В целом, они показали существенную активность, 941 ед/мл, которая полностью подавлялась 10 мкг/мл Mpl-X. Данные, полученные с применением мышиного IL-3, включены, чтобы показать специфичность теста на клетках 1A6.1. Хотя этот рекомбинантный цитокин индуцирует рост данной клеточной линии, его активность не блокируется 10 мкг/мл Mpl-X.
Пример 6. Mpl-лиганд стимулирует рост клеток 1A6.1 и развитие мегакариоцитов человека
Mpl-лиганд (обогащенный по меньшей мере в 100000 раз после хроматографии на пектине и аффинной хроматографии; см.Пример 7) стимулирует рост клеток 1A6.1 и развитие мегакариоцитов человека из 34+ клеток периферической крови в зависимости от дозы. Активность обусловлена именно Mpl-лигандом, поскольку, как показано на фиг.2 и 3, эта активность в обоих определениях может быть полностью блокирована Mpl-X.
Заявителями было также показано, что фракционированные при помощи проточной цитофлуориметрии (FACS) 34+ клетки периферической крови при инкубировании с Mpl-лигандом (в данном случае - 100 ед/мл в течение 9 дней) развиваются в фенотипически нормальные, зрелые мегакариоциты. Таким образом показано, что очищенный Mpl- лиганд оказывает тот же самый эффект на мегакариоциты, что и неочищенная APK9. Кроме того, в данном эксперименте использовали очищенные CD34+ клетки (100% CD34+), а не обогащенные, в которых доля CD34+ клеток обычно составляет 30- 50%.
Пример 7. Очистка Mpl-лиганда собаки
1. Резюме
Были очищены белки (25 кД и 31 кД), которые проявляли активность, приписываемую лиганду Mpl-рецептора. Белки выделены из плазмы облученных собак по схеме, включающей аффинную хроматографию на агглютинине зародышей пшеницы (WGA), аффинную хроматографию на Mpl-рецепторе, анионобменную хроматографию, гель- фильтрационную хроматографию и C4 HPLC с обращенной фазой, см. фиг.46, на которой представлена данная схема очистки.
Mpl-лиганды с молекулярной массой 25 кД и 31 кД были очищены по существу до гомогенности и было показано, что они состоят из аминокислотных последовательностей, описанных в настоящем изобретении.
II. Методы
А. Осветление плазмы
Замороженную плазму (всего около 20 литров), полученную от облученных собак (см. Пример 1), оттаивали в течение ночи при 4oC; оттаивание плазмы в больших бутылях проводили при комнатной температуре в течение нескольких часов, а затем - в холодной комнате. Нерастворимый материал удаляли центрифугированием в течение 6 часов при 11,000 g. Плазму разводили фосфатным буферным раствором, pH 7,3, содержащим 0,01% азида натрия (PBS/азид), и фильтровали через 1,2 мкм фильтр. Процедура осветления обычно приводила к двукратному разведению исходного материала.
Б. Аффинная хроматография на агглютинине зародышей пшеницы
Все операции проводили при 4oС. Осветленную плазму (две партии) наносили на колонку с иммобилизованным агглютинином зародышей пшеницы (1 литр, 10 х 12 см, EY Laboratories), уравновешенную PBS/азидом. После нанесения образца несвязавшийся материал смывали с колонки PBS/азидом и колонку промывали 0,5 М NaCl в 20 мМ TrisHCl, pH 8. Активность Mpl-лиганда, связавшуюся с WGA-колонкой, элюировали 0,35 М N-ацетилглюкозамином (GleNAc), 0,5 М NaCl, 20 мМ Tris-HCl, pH 8. Активности Mpl-лиганда не было обнаружено в проточных или промывочных фракциях.
В. Аффинная хроматография на Mpl-X рецепторе
Использованный растворимый мышиный Mpl-рецептор (Mpl-X) соответствовал целому экстраклеточному домену Mpl-рецептора минус Тrp в положении 483 (см. Vigon, et аl., 8: 2607-2615(1993)). Для оптимизации связывания Mpl-лиганда с Mpl-X рецептором на аффинной колонке, элюированный с WGA-колонки материал концентрировали с использованием мембранного ультрафильтра (порог отсечения по молекулярному весу 10,000, YM-10, Amicon) и концентрацию NaCl доводили до 0,2 М последующим разведением. Концентрированный материал с WGA-колонки наносили на 20-миллилитровую колонку с m- Mpl-X (растворимый мышиный Mpl-Х рецептор)/цианбромид- активированная Сефароза (2,6 х 4,2 см, 1,5 мг m-Npl-X на мл смолы) при скорости потока 0,9 мл/мин. Колонку промывали PBS/азидом при скорости потока 1,5 мл/мин, а затем высокосолевым буфером (405 мл), состоящим из 10 мМ Tris-HCl, 1 М NaCl, 1 мМ CHAPS, pH 8,0. Связавшийся Mpl-лиганд элюировали с колонки буфером следующего состава: 20 мМ CAPS, 1 М NaCl, 5 мМ CHAPS, pH 10,5. Собирали соответствующие фракции. Для нейтрализации pH к каждой фракции добавляли Tris.
SDS-PAGE и поглощение при 280 нм показали наличие в профиле элюции с аффинной колонки с Mpl-X рецептором раннего белкового пика во фракциях 1-4 при том, что основная активность Mpl-лиганда элюировала после фракции 5.
Г. Moно-Q-анионобменная хроматография
Наиболее очищенные фракции с нескольких аффинных колонок с Mpl-X рецептором объединяли, концентрировали и диализовали против 20 мМ Tris-HCl, 5 мМ CHAPS, pH 8,7 до конечного объема 58,5 мл. Концентрацию белка в смеси оценивали по поглощению при 280 нм, и она составляла 0,12 мг/мл (приблизительно 7 мг общего белка). Смесь наносили при скорости потока 0,5 мл/мин на колонку Mono-Q HR 5/5 (Pharmacia), уравновешенную 20 мМ Tris-HCl, 5 мМ CHAPS, pH 8,7. Элюцию проводили линейным градиентом до 0,36 М NaCl в том же буфере в течение 27 минут. Затем колонку в течение 6 минут промывали градиентом до 0,54 m NaCl и окончательную промывку проводили 0,9 М NaCl. Собирали фракции по 1 мл.
Профиль элюции с колонки Mono-Q показал, что в проточных и промывочных фракциях не содержится Mpl-лиганда и вообще сколько-нибудь значительного количества белка. Значительная активность Mpl-лиганда элюировалась во фракциях 5-7 на начальных этапах градиента NaCl. "Плечо" активности наблюдалось во фракциях 8-10, за которыми следовал главный пик, представленный фракциями 11-15. В активных фракциях имелась явная полоса 25 кД (по SDS-PAGE в невосстанавливающих условиях). Интенсивность полосы прямо соответствовала активности Mpl-лиганда во фракциях. Эта полоса отсутствовала во фракциях 3 и 4 (нет активности). Она была выражена во фракциях 5 и 6 (пик активности в тестах на клетках 1A6.1) и аналогично, интенсивно окрашиваемая полоса присутствовала во фракциях 11-14 (пик активности в тестах на клетках 1A6.1). Полоса была слабой в объединенных фракциях 15 и 16, что соответствовало значительно более низкой активности фракции 16.
Д. Опыты по элюции из геля
Опыты по элюции из геля были проведены с аликвотами фракций Mono Q 5 и 6 или 13 и 14. В этих экспериментах были приготовлены смеси фракций 5 и 6 (по 6 мкл каждой) или 13 и 14 (по 7,5 мкл каждой), смешаны с буфером для нанесения образцов на SDS-PAGE и нанесены на 12% SDS-гели. По завершении электрофореза, представляющие интерес полосы (1 мм) вырезали и разрезали на маленькие кусочки бритвенным лезвием. Кусочки геля переносили в 1,5-мл центрифужные пробирки, содержащие 0,5 мл PBS/5 мМ CHAPS и осторожно перемешивали при 4oC в течение ночи. На следующий день пробы центрифугировали, отбирали аликвоты, и пробы подвергали диафильтрации против среды Искова с добавлением BSA в качестве белка-носителя. Диафильтрованные пробы служили для дальнейших определений.
Результаты показывают наличие двух пиков активности Mpl-лиганда. Один пик соответствует области геля 25 кД, а другой пик активности Mpl-лиганда соответствует области 31 кД.
Е. Гель-Фильтрация на Superdex 200
Фракции 13-16 с анионобменной колонки Mono Q и две эквивалентные фракции второго фракционирования на Mono Q объединяли и концентрировали с применением мембранного ультрафильтра (Centricon-10, Amicon). Додецилсульфат натрия (SDS) добавляли до конечной концентрации 0,1% и образец наносили на колонку Superdex 200 HR 10/30 (Pharmacia). Колонку уравновешивали 50 MMTris, 0,1% SDS, pH 7,5 при скорости потока 0,3 мл/мин и комнатной температуре. Фракции собирали каждую минуту. Большая часть содержащегося в образце белка элюировала во фракциях 32-40, тогда как активность Mpl-лиганда обнаруживалась во фракциях 42-46. Анализ фракций методом SDS-PAGE показал наличие явной полосы 25 кД в активных фракциях.
Ж. C4 хроматография высокого разрешения с обращенной фазой
Фракции 43-46 с колонки Superdex 200 объединяли с фракцией 42 и концентрировали с помощью мембранного ультрафильтра (Microcon, Amicon). Концентрированную смесь наносили на 1 х 100 мм C4 колонку с обращенной фазой (SynChropack RP-4). Колонку уравновешивали раствором 0,04% TFA в воде (буфер А); буфер В имел следующий состав: 0,035% TFA в 80% ацетонитриле. После нанесения образца проводили линейный градиент буфера B до 45% в течение 4 минут. Затем следовал линейный градиент до 75% буфера В в течение 40 минут. Скорость потока устанавливали 75 мкл/мин. Результаты очистки фракции 42 представлены на фиг. 5. Явные пики активности Mpl-лиганда наблюдались во фракциях 21-23. Эти фракции анализировали электрофорезом в 14%-ном геле полиакриламида в восстанавливающих и невосстанавливающих условиях. Фракция 21 состояла из единственной полосы 31 кД; фракция 23 состояла из единственной широкой полосы 25 кД; и фракция 22 содержала обе полосы - 25 кД и 31 кД. Других значительных полос видно не было. Примечательно, что предварительные эксперименты по элюции из геля дали основания ассоциировать активность Mpl-лиганда именно к этим двум областям молекулярного веса. Единственная высокомолекулярная минорная полоса наблюдалась во всех фракциях в невосстанавливающих гелях, но ее не удавалось обнаружить в восстанавливающих гелях.
З. Анализ N-терминальных последовательностей 25 кД и 31 кД Mpl-лигандов
Анализ N-терминальной последовательности был выполнен на содержащих активность фракциях C4 RP-HPLC. Установленные последовательности данных белков приведены выше. В дополнение к главной последовательности, соответствующей полосе 25 кД (по меньшей мере 90% используемого образца), секвенирование обнаружило две минорные последовательности, которые были ассоциированы с минорной дополнительной полосой, описанной ранее в разделе "З". Сравнение с известными последовательностями показало, что минорные последовательности представляют собой тяжелую цепь и каппа-цепь иммуноглобулинов собаки. При необходимости эти минорные загрязнения могут быть удалены дополнительным этапом очистки, предпочтительно, дополнительной гель-фильтрацией.
И. Сравнение активности Mpl-лиганда из очищенных фракций C4
Данные, представленные на фиг.6, показывают, что активности, присутствующие во фракциях 22 и 23 хроматографии C4 RP-HPLC, по существу, эквивалентны. Фракция 22 содержит смесь полос 25 кД и 31 кД, а фракция 23 - только полосу 25 кД. Аликвоты каждой фракции разводили 1:45000. Разведенные фракции практически в равной степени стимулировали рост клеток 1A6.1 (фракция 22 - 5400 клеток на ячейку, фракция 23 - 6000 клеток на ячейку). Разведенные фракции инкубировали с возрастающими концентрациями Mpl-X. Фракции были в равной степени чувствительны к ингибированию Mpl-X, активность обеих фракций полностью блокировалась Mpl-X в концентрации 7-1,4 мкг/мл. Это служит указанием на то, что активный белок(белки) каждой фракции - это разновидности Mpl- лиганда с одинаковой биологической активностью.
Пример 8. Сравнение действия Mpl-лиганда на развитие мегакариоцитов с действием других факторов
Показано, что ряд рекомбинантных факторов и органических соединений, таких как форбол-миристил-ацетат (PMA), оказывают влияние на рост и развитие мегакариоцитов. Изучали воздействие этих факторов на CD34-положительные клетки периферической крови. Рекомбинантный интерлейкин 3 человека (IL-3, 1 нг/мл), фактор роста стволовых клеток (SCF, 50 нг/мл), Интерлейкин 6 (IL-6, 25 нг/мл), эритропоэтин (EPO, 1 ед/мл), фактор ингибирования лейкоза (LIF, 10 нг/мл) и гранулоцитарно-факрофагальный колониестимулирующий фактор (GM-CSF, 25 нг/мл, Amgen, Inc.); интерлейкин 11 (IL-11, 25 нг/мл, R+D Systems, minneapolis, MN); форбол-миристил-ацетат (PMA, 10-10 М, Sigma) добавляли к
культурам как указано. Mpl-лиганд использовали в концентрации 275 единиц на мл, APK9 использовали в концентрации 5% (эквивалент 220 единиц/мл). При использовании факторов в комбинации их концентрация была равна таковой при индивидуальном использовании. После 8 дней культивирования клетки фиксировали в ячейках и окрашивали на мегакариоциты (n=6 ячеек на каждый вариант) или подсчитывали общее число клеток (n=3 ячеек на каждый вариант). Данные представлены средним числом +/- стандартная ошибка.
На фиг.7 показано, что APK9 и Mpl-лиганд приводили к образованию наибольшего числа мегакариоцитов на ячейку. IL-3 также приводил к развитию мегакариоцитов, особенно в сочетании с SCF IL- 6, IL-11 или EPO оказывали незначительный эффект на количество образовывавшихся мегакариоцитов при индивидуальном воздействии или в сочетании с IL-3. PMA, LIF и GM-CSF имели слабое воздействие. На фиг. 8 приведены данные того же эксперимента, показывающие общее число клеток в ячейках ("клеточность"). APR9 и Mpl-лиганд слабо изменяли этот показатель, а II-3 и SCF проявляли умеренное воздействие. Сочетание SCF и IL-3 оказывало самый сильный эффект. Данные, приведенные на фиг.7 и фиг.8, были использованы для вычисления процента мегакариоцитов на ячейку, как показано на фиг.9. Очевидно, что фактором, приводящим к образованию самого высокого процента мегакариоцитов на ячейку, является Mpl-лиганд, активный компонент APK9. Это указывает на специфичность Mpl- лиганда по отношению к мегакариоцитам.
Пример 9. Мегакариоцит-стимулирующая активность Mpl- лиганда не зависит от IL-3 человека
Mpl-лиганд стимулирует развитие мегакариоцитов человека при его добавлении в культуральную среду, как это описано в Примере 2. Хотя IL-3 не является компонентом культуральной среды, он может присутствовать в необнаружимо малых количествах в нормальной человеческой плазме, входящей в состав среды. Однако, если IL-3 и присутствует, он не участвует в мегакариопоэзе, обусловленном Mpl- лигандом. Это видно из фиг.10. IL-3 в концентрации 2 нг/мл имеет активность в тесте на мегакариоциты человека, равную 14900 мегакариоцитарных единиц/мл. Эта активность на 97% подавляется anti-IL-3 (3,3 мкг/мл; Genzyme, Cambridge, MA). Mpl-лиганд в концентрации 8203 мегакариоцитарных единиц/мл не подавлялся anti-IL-3.
Пример 10. Анализ Mpl-лиганда свиньи
1. Резюме
Белки из плазмы облученной свиньи с активностью Mpl-лиганда были охарактеризованы с помощью WGA-аффинной хроматографии, аффинной хроматографии на Mpl-рецепторе, ионобменной хроматографии и C4 хроматографии высокого давления с обращенной фазой (HPLC). Активность также характеризовали путем элюции из срезов SDS- полиакриламидного геля (см. табл. A).
Пример 11. Клонирование Mpl-лиганда человека (MGDF человека)
Ниже приведены два использованных подхода:
1. Первый пример клонирования
А. Получение пробы MGDF человека
Ряд дегенеративных ПЦР-праймеров был сконструирован на основе последовательности амино-конца белка собаки. Для амплификации гена MGDF из геномной ДНК человека использовали различные пары праймеров. После 40 циклов амплификации с использованием смысловых праймеров 5' GCN CCN CCN HCN TGY GA 3' (SEQ ID N0: 4), кодирующих пять первых аминокислот белка собаки (SEQ ID N0: 1) и антисмыслового праймера: 5' GCA RTG YAA CAC RTG NGA RTC 3' (SEQ ID N0: 5), кодирующего аминокислоты с 16 по 21 последовательности SEQ ID N0: 1, продукт ПЦР был разогнан в геле 2,0%-ной агарозы в буфере TBE. Полоса, соответствующая фрагменту 63 пары оснований, была вырезана из геля и реамплифицирована с тем же самым набором праймеров. Продукт ПЦР клонировали в векторе PCR II (Invitrogen, San Diego). Ряд колоний был проскринирован при помощи секвенирования ДНК. Плазмидную ДНК, кодирующую пептид, сходный с белком MGDF собаки, использовали для получения радиоактивной пробы в последующем скрининге кДНКовых библиотек. Аминокислотная последовательность, кодируемая фрагментом гена, была следующей: Ala-Pro-Pro-Ala-Cys-Asp-Leu-Arg-Val-Leu-Ser- Lys-Leu-Leu-Arg-Asp-Ser-His-Val-Leu-His (SEQ ID N0: 6).
Фрагмент агарозного геля, содержащий MGDF человека, использовали для получения пробы посредством "горячей" ПЦР. Типичная реакционная смесь ПЦР объемом 100 мкл содержала следующие компоненты:
Матричная ДНК - 2-3 мкл
5' Праймер (SEQ ID N0:4) - 1 мкл, 20 пМ
3'Праймер (SEQ ID N0:5) - 1 мкл, 20 пМ
10 x буфер - 10 мкл
dATP (0,1 мМ) - 2 мкл
dTTP (10 мМ) - 2 мкл
dGTP (10 мМ) - 2 мкл
dCTP (0,1 мМ) - 2 мкл
dCTP, P32 (10 мкКи/мкл) - 5 мкл
dATP, P32 (10 мкКи/мкл) - 5 мкл
Taq ДНК-полимераза - 0,5 мкл, 2,5 единиц
Вода - 77 мкл
Общий объем - 100 мкл
Условия амплификации были следующими: начальный нагрев 94oC, 2 мин; отжиг - 53oC, 30 сек; наращивание - 72oC, 30 сек; денатурация - 94oC, 30 сек.
Было выполнено 40 циклов амплификации на приборе Perkin Elmer GeneAmp System 9600.
Продукт очищали на колонке (push column) (Stratagene, San Diego). В сцинтилляционном счетчике просчитывали 1 мкл пробы. Те пробы, которые содержали 1-3 миллиона импульсов на мл, добавляли к гибридизационной смеси.
Б. Конструирование библиотеки эмбриональной печени
У фирмы Clontech laboratories была куплена полиA+PHK эмбриональной печени человека. Около 4 мкг PHK использовали для синтеза кДНК, в котором для праймирования служил случайный гексамер, 5' GTA CGC GTT СТА GAN NNN NNT 3' (SEQ ID N0: 7), соединенный с олигонуклеотидом, содержащим сайт рестрикции Xba 1.
Для получения двунитчатой кДНК применяли протокол Gibco- BRL. Адаптер Eco RI-Bstxl (Invitrogen, San Diego) лигировали с двунитчатой кДНК и затем рестрицировали ферментом Xba 1.
Отбор кДНК по размеру осуществляли на колонке S500 Sephacryl (Life Technologies, Inc. ). Молекулы кДНК, имеющие размер более 400 пар оснований, лигировали с вектором для экспрессии в клетках млекопитающих v19.8 (Martin, F. , Cell 63: 203-211 (1990)), предварительно рестрицированным ферментами EcoRI и Xba 1. Трансформировали компетентные клетки 1E.coli ODH10 и полученную библиотеку делили на 7 пулов по 100000 клонов кДНК в каждом.
В. Скрининг библиотеки в фаге лямбда
Библиотека эмбриональной печени человека в фаге лямбда gt11 с титром 650 миллионов бляшкообразующих единиц/мл была куплена у фирмы Clontech. Около 2-х миллионов бляшек было проскринировано с пробой, полученной ПЦР (см. выше). Гибридизацию проводили в течение 15 часов при 56oC в 6 x SSC, 5х растворе Денхардта, 0,1% SDS, 100 мкг/мл однонитчатой ДНК спермы лосося.
Проводили многочисленные раунды скрининга. ДНК из единичных бляшек амплифицировали и для идентификации истинно положительных бляшек данную ДНК гибридизовали с внутренним праймером 5' AGT ТТА CTG AGG ACT CGG AGG 3' (SEQ ID N0: 8), кодирующим аминокислоты с 7-й по 13-ю последовательности SEQ ID N0: 6.
Г. 3'-Праймированная быстрая амплификация концов кДНК (RACE)
Полиаденилированная РНК из человеческой эмбриональной почки и человеческой эмбриональной печени была куплена у Clonetech. Один микрограмм PHK подвергали обратной транскрипции с использованием в качестве праймера олигонуклеотида 5' TTC GGC CGG ATA GGC CTT TTT TTT TTT TTT 3' (SEQ ID N0: 9).
Набор для синтеза кДНК Gibco-BRL (Life Technologies,Inc. Cat.# 18267-013) использовали для получения первой нити кДНК. Общий объем составлял 30 мкл. Реакцию останавливали добавлением 500 мМ ЕДТА до конечной концентрации 10 мМ и смесь замораживали при -20oC.
Для начала ПЦР использовали в качестве матрицы 0,5 мкл кДНК. Праймер SEQ ID N0: 9 и конкурентный олигонуклеотид 5' TTC GGC CGG ATA GGC CTT TTT TTT TTT TT-P 3' (SEQ ID N0: 10) использовали как антисмысловые праймеры, тогда как олигонуклеотид 5' TGC GAC CTC CGA GTC CTC AD 3' (SEQ ID N0: 11), кодирующий аминокислоты с 5-й по 11-ю последовательности SEQ ID N0: 6, использовали в качестве смыслового праймера. Сорок циклов амплификации было проведено по следующему протоколу: 94oC, 30 сек; 65oC, 30 сек; 72oC, 30 сек; после начальной 2-х минутной инкубации при 94oC. Для амплификации использовали прибор Perkin Elmer GeneAmp System 9600.
Закрепление ("nesting") проводили с применением смыслового праймера 5' GAG ТСС TCA GTA AAC TGC TTC GT 3' (SEQ ID N0: 12), кодирующего аминокислоты с 8-й по 14-ю последовательности SEQ ID N0: 6, при том, что последовательности SEQ ID N0: 9 и SEQ ID N0: 10 служили антисмысловыми праймерами. Было проведено сорок циклов амплификации с отжигом при 65oC. Продукты ПЦР фракционировали электрофорезом в 0,8% геле агарозы и фотографировали в ультрафиолете. Были видны полосы в районе 0,8 - 1,2 килобаз.
Затем продукты ПЦР клонировали в вектор PCR II (Invitrogen). Отбирали индивидуальные колонии и выделяли плазмиды с помощью наборов Qiagen (Cat. # 12143 и 12145). Двунитчатое секвенирование было проведено с использованием векторных праймеров. Последовательности анализировали с помощью различных типов программного обеспечения GCG.
Д. Наращивание цепи ДНК с помощью 3' и 5'- праймеров
Для получения последовательности полноразмерного гена MGDF было проведено наращивание цепи ДНК с помощью 3'- и 5'- праймеров с использованием в качестве матриц различных рулов библиотеки эмбриональной печени. Для амплификации 5'-праймера кДНК использовали в качестве матрицы около 20 нг кДНК из каждого пула. Использовали MGDF-специфический антисмысловой праймер 5' GGA GTC ACG AAG CAG TT AC 3' (SEQ ID N0: 13), кодирующий аминокислоты с 12-й по 17-ю последовательности SEQ ID N0: 6, и 5' векторный v19.8 смысловой праймер 5' CCT TTA CTT СТА GGC CTG 3'' (SEQ ID N0: 14). Амплификацию проводили в течение 30 циклов с отжигом при 53oC. Закрепление проводили в течение 30 циклов с антисмысловым праймером 5' GAG GTC АСА AGC AGG AGG A 3' (SEQ ID N0: 15) (кодирует аминокислоты с 1-й по 6-ю последовательности SEQ ID N0: 6) и векторным праймером SEQ ID N0: 14.
Для наращивания цепи с 3' концов кДНК MGDF использовали антисмысловой векторный праймер 5' GGC ATA GTC CGG GAC GTC G 3' (SEQ ID N0: 16) и MGDF-специфический праймер 5' TTC ТСС TGC TTG TGA CCT С 3' (SEQ ID N0: 17), кодирующий аминокислоты с 1-й по 6-ю последовательности SEQ ID N0: 6. Амплификацию проводили в течение 30 циклов с отжигом при 58oC.
Амплификацию закрепления ("nesting amplification") проводили в течение 30 циклов с использованием MGDF-праймера SEQ ID N0: 12 и векторного праймера SEQ ID N0: 16. Специфические полосы были обнаружены в пулах 1, 7 и 8, которые затем клонировали в вектор PCR II. Плазмидную ДНК из отдельных колоний очищали и секвенировали.
Е. Выделение полноразмерных клонов MGDF человека
Многие из исходных клонов утрачивали часть амино-конца MGDF, поскольку часть последовательности MGDF использовалась для праймирования и закрепления. Праймер 5' CCA GGA AGG ATT CAG GGG А 3' (SEQ ID N0: 18), последовательность которого была получена в опытах по наращиванию 5'-праймера, как описано выше, использовали как смысловой праймер. Векторный праймер SEQ ID N0: 16 служил антисмысловым праймером. Проводили 35 циклов амплификации с отжигом при 58oC. MGDF-специфический праймер 5' CAA CAA TGC GAC CGC CAG CCA GAC АСС CCG 3' (SEQ ID N0: 19), содержащий сайт рестрикции Sal 1, и векторный праймер (SEQ ID N0: 15) использовали для закрепления ("nesting") в течение 35 циклов. Продукт ПЦР клонировали в векторе PCR II и секвенировали.
II. Второй пример клонирования
А. Клонирование N-концевой кДНК MGDF собаки
Дегенерированные олигонуклеотидные праймеры были сконструированы на основе N-терминальной последовательности аминокислот MGDF собаки, описанной в предыдущих разделах. Данные праймеры использовали в полимеразной цепной реакции (ПЦР) для амплификации последовательностей кДНК, кодирующих MGDF.
Тотальную PHK выделяли из образцов почек собаки гуанидин-изотиоцианатным методом по Chomzynski and Sacchi (Biochem. 162: 156-159 (1987)). Первую нить кДНК получали со случайным праймер-адаптором 5' GGC CGG ATA GGC CAC TCN NNN NNT 3' (SEQ ID N0: 20) с использованием обратной транскриптазы Mo-MuLV и использовали в качестве матрицы в последующих полимеразных цепных реакциях. ПЦР проводили в объеме 0,5 мкл с ~ 50 нг кДНК, с использованием праймера A 5' GCN CCN CCN GCN TGY GA 3' (SEQ ID N0: 4), праймера смысловой цепи, кодирующего аминокислоты 1-6 последовательности SEQ ID N0: 1, а также праймера В 5' GCA RTG NAG NAC RTG NGA RTC 3' (SEQ ID N0: 5) или же праймера С 5' GCA RTG YAA NAC RTG NGA RTC 3' (SEQ ID N0: 21), которые являются праймерами антисмысловой цепи, кодирующими аминокислоты 16-21 последовательности SEQ ID N0: 1, с тремя дополнительными нуклеотидами на 5'-конце для повышения стабильности при гибридизации. ПЦР с Taq полимеразой проводили в течение 35-45 циклов до тех пор, пока полосы продукта не становились четко различимы при электрофорезе в гелях агарозы. Для первых двух циклов ПЦР отжиг проводили при 37oC в течение двух минут, для последующих циклов ПЦР отжиг проводили при 50oC в течение одной минуты. В каждой реакции наблюдали множественные полосы продукта. Фрагменты геля, содержащие полосы ожидаемого размера (66 пар оснований), извлекали с помощью пастеровской пипетки и проводили реамплификацию с той же самой парой праймеров. ДНК-продукты клонировали в вектор PCR II (Invitrogen) согласно рекомендациям производителя. Три клона были секвенированы и показано, что они кодируют в одной рамке считывания ожидаемые последовательности MGDF собаки, остатки 1-21. Таким образом, была получена уникальная кДНК MGDF собаки, представляющая область от третьего нуклеотида кодона 6 до третьего нуклеотида кодона 15. Один из указанных клонов служил матрицей для получения меченой кДНК-пробы MGDF собаки.
Б. Конструирование кДНК-овой библиотеки из эмбриональной печени человека
PHK выделяли из человеческой эмбриональной печени (International Institute for the Advancement of Medicine, Exton, PA) путем лизиса ткани в 5,5 М гуанидинизотиоцианате и очистки центрифугированием в CsTFA (Pharmacia). Полиаденилированную PHK получали с использованием олиго (dT)25 дайнабидс (Dynal, согласно указаниям производителя). Двунитчатую кДНК получали из указанной PHK с использованием плазмидной системы Superscript для синтеза кДНК (Life Technologies, Inc. ) с единственным исключением, состоящим в использовании отличного адаптера: 5' TTG GTG TGC ACT TGT G 3' (SEQ ID N0: 22) и 5' CAC AAG TGC АСА ACC CC 3' (SEQ ID N0: 23). После отбора по размеру данная кДНК была направленно встроена по сайтам Bst XI NotI в вектор для экспрессии в клетках млекопитающих pBCB (pBCB получена на основе плазмиды Rc/CMV, Invitrogen, состоящей из скелета pUC19, промотора CMV и сайта полиаденилирования BGH). Лигированную ДНК вводили электропорацией в клетки электрокомпетентного бактериального штамма 10В (Life Technologies, Inc.).
В. Скрининг на MGDF кДНК-овой библиотеки эмбриональной печени человека
Библиотеку человеческой эмбриональной печени, фиксированную в виде реплик на фильтрах, гибридизовали с радиоактивным ПЦР- продуктом кДНК N-конца MGDF (5х SSPE, 2х раствор Денхардта, 0,05% пирофосфат натрия, 0,5% SDS, 100 мкг/мл лизат дрожжевой тРНК и 100 мкг/мл денатурированная ДНК спермы лосося) при 64oC в течение 18 часов. Фильтры отмывали при 64oC в 5х SSPE, 0,5% SDS и экспонировали с рентгеновской пленкой в течение ночи. Были выделены и проанализированы два различных клона, гибридизовавшихся с указанной пробой.
Г. Экспрессия кДНК-овых клонов MGDF человека
Очищенной ДНК кДНКовых клонов MGDF трансфицировали клетки линии 293 EBNA (Invitrogen). 1,5 мкг ДНК смешивали с 7,5 мкл Липофектамина (Life Technologies, Inc. ) в 100 мкл среды ДМЕМ без сыворотки. После 20 минут инкубации при комнатной температуре смесь ДНК-Липофектамин добавляли к 5 х 105 клеток/лунку (24- луночные планшеты Greiner) в 400 мкл ДМЕМ, 1% сыворотки (Fetal Clone II) и инкубировали при 37oC 6 часов. Затем к клеткам добавляли по 500 мкл ДМЕМ с 20% сыворотки (Fetal Clone II). Через 72 часа собирали кондиционированную среду и центрифугировали через 0,22-микронный центрифужный фильтр. Кондиционированную среду проверяли на биологическую активность MGDF.
III. Описание и активность клонов MGDF человека
С применением описанной выше стратегии клонирования были получены клоны кДНК человека, представленные на фиг.11 (MGDF-1 и MGDF-2; SEQ ID NOS: 24, 25 и 26, 27) и фиг.12 (MGDF-3: SEQ ID NOS: 28, 29). Каждая из представленных на чертежах последовательностей содержит сигнальную последовательность аминокислот 1-21, так что в каждом случае зрелый белок начинается с аминокислоты 22.
Результаты определения активности с использованием описанных в Примере 4A клеточных тестов представлены ниже в Таблицах 3 и 4. В Таблице 3 кондиционированную среду клеток 293, трансфицированных каждым из конструктов, собирали после двух дней культивирования и проверяли в тесте на клетках 1A6.1 (32D/mur-MPL+) +/-10 мкг/мл mur-MPL-X. В Таблице 4 кондиционированную среду клеток 293, трансфицированных каждым из конструктов, собирали после четырех дней культивирования и проверяли в тесте на клетках 32D/mur-MPL+ (Пример 3A) и клетках 32D/hu-MPL+ (Пример 3B). Как можно видеть из этих данных, MGDF-1 и MGDF-2 человека, но не MGDF-3, активны в отношении клеточных линий, экспрессирующих Mpl человека и мыши. Клеточная линия, экспрессирующая рецептор Mpl человека, более чувствительна к MGDF-1 и MGDF-2 человека, чем клеточная линия, экспрессирующая Mpl- рецептор мыши.
Из представленных в Таблице 5 результатов видно, что активность человеческого MGDF-1 и MGDF-2 по отношению к клеткам 32D/hu-MPL+ (Пример 3B) почти полностью подавляется растворимым человеческим mpl-рецептором (hu-MPL-X). Hu-MPL-X присутствует в кондиционированной среде клеток CHO, продуцирующих этот белок. Эта кондиционированная среда была сконцентрирована в 120 раз и затем добавлена к культурам до концентрации 6,6%. Кондиционированная среда контрольных клеток CHO в данном определении не проявляла никакого эффекта. Определение проводили, как описано в Примере 4B с тем исключением, что жизнеспособные клетки определяли после трех дней культивирования.
Определение мегакариоцитов человека
MGDF-1 и MGDF-2, но не MGDF-3 индуцировали образование мегакариоцитов из CD34-положительных клеток периферической крови. Эксперимент, представленный в Таблице 6, проводили, как описано в Примере 2 с тем исключением, что CD34-положительные клетки периферической крови отбирали без элютриации и культуру использовали после семи дней роста. Кондиционированную среду от каждого 293 EBNA MGDF конструкта использовали в конечной концентрации 20% +/-30 мкг/мл mur-MPL-X. Контрольную плазму APK9 использовали в конечной концентрации 6%.
Пример 12.
В данном примере описывается синтез 12 различных пэгированных молекул MGDF, а именно - ПЭГ9 - ПЭГ12 и ПЭГ14 - ПЭГ21. В каждом случае молекула MGDF, которую соединяли с ПЭГом, представляла собой MGDF-11, полученную с помощью E. coli (аминокислоты 22-184, пронумерованные от начала сигнального пептида, или же аминокислоты 1-63, пронумерованные от начала зрелого пептида). Подробные сведения обо всех пэгированных соединениях приведены ниже в таблицах 7 -10.
12.1. Получение поли-MePEG-MGDF путем ацилирования MGDF с активированными MePEG-производными
Получение поли-MePEG (20 кД) - MGDF-конъюгата (ПЭГ11)
Охлажденный (4oC) раствор MGDF (2,5 мг/мл) в 0,1 М BICINE- буфере, pH 8, добавляют к 10-кратному молярному избытку твердого сукцинимидилпропионата MePEG (мол. масса 20 кД) (Shearwater Polymers, Inc.). Полимер растворяют при осторожном перемешивании, и далее реакцию проводят при комнатной температуре.
Степень модификации белка в процессе реакции контролируют с помощью HPLC, учитывая размер молекул (size exclusion SEC), при использовании колонки Superdex 200 HR 10/30 (Pharmacia Biotech). Элюцию проводят 0,1 М натрий-фосфатным буфером при pH 6,9 и скорости потока 0,7 мл/мин.
Исследование реакционной смеси путем SEC HPLC через 30 минут показывает, что в ней не остается свободного белка. В этой временной точке концентрацию белка в реакционной смеси уменьшают до 1 мг/мл добавлением стерильной воды, а pH смеси доводят до 4 с помощью нескольких капель 0,5 М уксусной кислоты.
MePEG-MGDF-конъюгат отделяют от избытка MGDF и других побочных продуктов реакции путем ионобменной хроматографии при использовании SP Sepharose HP (Pharmacia Biotech) в качестве ионобменой смолы.
Реакционную смесь наносят на колонку (2,5 мг/мл ионобменной смолы) и не вступивший в реакцию MePEG элюируют стартовым буфером А (3 объема колонки, 20 мМ фосфата натрия, pH 7,2, 15% глицерина). Затем элюируют MePEG-MGDF-конъюгат с помощью линейного градиента (от 0% до 30%) конечного буфера В (10 объемов колонки) (1 М NaCl в буфере А). Элюат исследуют при 280 нм. Фракции, содержащие полиMePEG-MGDF-конъюгат, объединяют, концентрируют и стерилизуют фильтрованием.
Очищенный поли-MePEG-MGDF-конъюгат анализируют с помощью SEC HPLC при использовании гель-фильтрационных колонок TSK-GEL 64000SWXL и 62000SWXL, объединенных в серии. Белки выявляют по поглощению в ультрафиолете при 280 нм. В качестве маркеров молекулярной массы глобулярных белков используют гель-фильтрационные стандарты BIO-RAD.
Как можно видеть на фиг.17A, с помощью SEC HPLC в препарате выявляются два основных компонента (в примерном соотношении 2 к 1), причем их точки элюции соотносятся с глобулярными белками мол. массы 370.9 кД и 155.0 кД соответственно (см. также приведенную ниже Табл.8).
Конъюгаты PEG9, PEG10 и PEG12, полученные путем ацилирования MGDF с сукцинимидированными эфирами MePEGs мол. массы 6-50 кД, исследуют аналогичным образом. Основные параметры реакций, используемых для получения соответствующих препаратов, приведены в Таблице 7.
Результаты исследований полученных конъюгатов с помощью SEC HPLC приведены в Таблице 8.
12.2 Получение поли-MePEG-MGDF-конъюгатов путем алкилирования MGDF с альдегидами MePEG в восстановительных условиях
Получение поли-MePEG (20 кД)-MGDF-конъюгата (PEG20)
К охлажденному (4oC), перемешанному раствору MGDF (2 мл, 2,5 мг/мл) в 100 мМ фосфате натрия, pH 5, содержащему 20 мМ NaCNBH3, добавляют 10-кратный молярный избыток монометокси- полиэтиленгликолевого альдегида (MePEG) (средняя мол. масса 20 кД), и перемешивание реакционной смеси продолжают при той же температуре.
Степень модификации белка в процессе реакции контролируют с помощью SEC HPLC при использовании колонки Superdex HR 10/30 (Pharmacia Biotech). Элюцию проводят 0,1 М натрий- фосфатным буфером при pH 6,9 и скорости потока 0,7 мл/мин.
Через 16 ч исследование реакционной смеси методом SEC HPLC показыает, что более чем 90% первоначального количества белка модифицировано. В это время концентрация белка в реакционной смеси устанавливают на 1 мг/мл, разбавляя ее стерильной водой, а pH доводят до 4 добавлением 0,5 М уксусной кислоты.
MePEG-MGDF-конъюгат отделяют от избытка MePEG и других побочных продуктов реакции путем ионобменной хроматографии при использовании SP Sepharose HP (Pharmacia Biotech) в качестве ионобменной смолы.
Реакционную смесь наносят на колонку (2,5 мг/мл смолы), и не вступивший в реакцию MePEG элюируют стартовым буфером А (3 объема колонки, 20 мМ фосфата натрия, pH 7,2, 15% глицерина). Затем MePEG-MGDF-конъюгат элюируют с помощью линейного градиента (от 0% до 30%) конечного буфера В (10 объемов колонки) (1 М NaCl в буфере А). Элюат исследуют при 280 нм. Фракции, содержащие поли-MePEG- MGDF-конъюгат, объединяют, концентрируют и стерилизуют фильтрованием.
Очищенный поли-MePEG-MGDF-конъюгат анализируют с помощью SEC HPLC при использовании гель-фильтрационных колонок TSK-GEL 64000SWXL и 62000 SWXL, объединенных в серии. Белки выявляют по поглощению в ультрафиолете при 280 нм. В качестве маркеров молекулярной массы глобулярных белков используют гель- фильтрационные стандарты BIO-RAD.
Как можно видеть на фиг.17B, с помощью SEC HPLC в препарате выявляется два основных компонента (52% и 47% от общего количества белка), причем их точки элюции соотносятся с глобулярными белками мол. массы 359.4 кД и 159.3 кД соответственно (см. также приведенную ниже Табл.8).
Конъюгаты PEG18, PEG19 и PEG21, полученные путем восстановительного алкилирования MGDF с альдегидами MePEG мол. массы 6-25 кД, исследуют аналогичным образом. Основные параметры реакций, используемых для получения соответствующих препаратов, приведены в Таблице 7.
Результаты исследований полученных конъюгатов с помощью SEC HPLC приведены в Таблице 8.
12.3. Получение конъюгатов MGDF с монометоксиполиэтиленгликолем путем его соединения с альфа- аминоостатком на N-терминальном участке MGDF
Получение MOHO-PEG (20 кД)-MGDF-конъюгата (PEG16)
К охлажденному (4oС), перемешанному раствору MGDF (2 мл, 2,5 мг/мл) в 100 мМ фосфате натрия, pH 5, содержащему 20 мМ NaCNBH3, добавляют 5-кратный молярный избыток монометокси-полиэтиленгликолевого альдегида (MePEG) (средняя мол. масса 20 кД), и перемешивание реакционной смеси продолжают при той же температуре.
Степень модификации белка в процессе реакции контролируют с помощью SEC HPLC при использовании колонки Superdex 200 HR 10/30 (Pharmacia Biotech). Элюцию проводят 0,1 М натрий- фосфатным буфером при pH 6,9 и скорости потока 0,7 мл/мин.
Через 16 ч исследование реакционной смеси методом SEC HPLC показывает, что более чем 90% первоначального количества белка модифицировано. В это время концентрацию белка в реакционной смеси уменьшают на 1 мг/мл, разбавляя ее стерильной водой, а pH доводят до 4 добавлением 0,5 М уксусной кислоты.
Моно-MePEG(20 кД)-MGDF-конъюгат отделяют от избытка MePEG и других побочных продуктов реакции путем ионобменной хроматографии при использовании SP Sepharose HP (Pharmacia Biotech) в качестве ионобменной смолы.
Реакционную смесь наносят на колонку (2,5 мг/мл смолы) и не вступивший в реакцию MePEG элюируют стартовым буфером А (3 объема колонки, 20 мМ фосфата натрия, pH 7,2, 15% глицерина).
Затем MePEG-MGDF-конъюгат элюируют с помощью линейного градиента (от 0% до 25%) конечного буфера В (20 объемов колонки) (1 М NaCl в буфере А). Элюат исследуют при 280 нм. Фракции, содержащие поли-MePEG-MGDF-конъюгат, объединяют, концентрируют и стерилизуют фильтрованием.
Гомогенность моно-MePEG-MGDF-конъюгата подтверждают гельэлектрофорезом в полиакриламидном геле в присутствии SDS при использовании 4-20% градиентного геля фирмы NOVEX. Выявляют одну главную полосу, соответствующую белку с мол. массой 46,9 кД.
Очищенный поли-MePEG-MGDF-конъюгат анализируют с помощью SEC HPLC при использовании гель-фильтрационных колонок TSK-GEL 64000SWXL и 62000 SWXL, объединенных в серии. Белки выявляют по поглощению в ультрафиолете при 280 нм. В качестве маркеров молекулярной массы глобулярных белков используют гель- фильтрационные стандарты BIO-RAD.
Как можно видеть на фиг.17C, с помощью SEC HPLC в препарате выявляется один основной компонент, причем его точка элюции соответствует глобулярному белку мол. массы 181.1 кД (см. также Табл.9).
Moно-MePEG-MGDF-конъюгаты PEG14, PEG15 и PEG17, полученные путем восстановительного алкилирования MGDF с альдегидами MePEG мол. массы 6-25 кД, исследуют аналогичным образом. Основные параметры реакций, используемых для получения соответствующих препаратов, приведены в Таблице 7.
Результаты исследований полученных конъюгатов с помощью SEC HPLC приведены в Таблице 9.
12.4. Получение DiMePEG (12 кД)-MGDF-конъюгатов путем алкилирования MGDF с альдегидом метокси-полиэтилегликоля (PEG20) в восстанавливающих условиях
Описанная ниже методика приводит к получению очищенного соединения, называемого здесь PEG22.
5-кратный избыток альдегида метоксиполиэтиленгликоля (MePEG, например, OHC-(CH2)2-O-(CH2-CH2O)n-CH3; где n повторяется столько раз, чтобы мол. масса составляла около 12 кД) (Shearwater Polymers) добавляют к 2,5 мг/мл раствора MGDF (полученного в E.coli, 1-163) в 100 мМ ацетата натрия, pH 5, охлажденного до 5oC. После 10-минутного перемешивания добавляют соответствующее количество цианоборогидрида натрия (Aldrich), чтобы его концентрация в реакционной смеси составила 20 мМ.
Полученную смесь перемешивают в течение 16 ч при температуре 5oC. По окончании указанного периода времени концентрацию MGDF устанавливают на уровне 1 мг/мл путем добавления в достаточной степени очищенной воды. Затем смесь фильтруют через вакуумный фильтр с размером пор 0,2 мкм. По указанной методике получают 90 мг реакционного продукта. К смеси, содержащей реакционный продукт, добавляют небольшие количества растворов 1,0 М одноосновного фосфата и 1 N гидроксида натрия, чтобы получить раствор, содержащий 10 мМ фосфата при pH 6,8.
Конъюгат очищают на катионобменной колонке. Готовят 40-мл колонку, заполненную SP-Сефарозой для хроматографии высокого разрешения, длиной 7,5 см. Колонку уравновешивают соответствующим буфером (10 мМ фосфат, pH 6,8, 15% глицерина). Колонку загружают 2,2 мг/мл смолы при скорости потока 0,15 объемов колонки (CV) в минуту. Затем колонку промывают уравновешивающим буфером до достижения нулевой точки отсчета. Колонку элюируют линейным градиентом от буфера А (10 объемов колонки, 20 мМ фосфат, pH 7,2, 15% глицерина) к буферу В (буфер А и 0,3 М NaCl). Скорость потока поддерживается на уровне 0,15 CV. Элюат исследуют при 280 нм.
Полиакриламидные гели, содержащие SDS, разделяют на фракции, и те из них, которые содержат конъюгат DiPEG, объединяют и фильтруют через ячейку с размером пор 0,2 мкм.
Пример 13. Биологическая активность пэгированных молекул MGDF
A. PEG-9 - PEG-12 и PEG-14 - PEG-21
Количество тромбоцитов у мышей, обработанных рекомбинантным MGDF человека, отражено на фиг.18. Полученный в клетках CHO MGDF (22-353) (открытые звездочки), не-пэгированный MGDF, полученный в E.coli (22-184) (незакрашенные кружки), и пэгированный MGDF, полученный в E.coli (22-184) (закрашенные кружки) в концентрациях, указанных в описании чертежей выше, вводили подкожно нормальным мышам Balb/c раз в день в течение 5 дней. Через 24 часа после последнего введения брали контрольные образцы крови из небольшого бокового разреза хвостовой вены. Анализы клеток крови проводили при помощи электронного анализатора клеток крови Sysmex (Baxter Dignostics. Inc. Irvine, CA). Приведены средние данные по четырем животным +/- стандартное отклонение. Данная обработка не оказывала влияния на другие параметры клеток крови, такие как общее количество красных и белых клеток крови.
Другие формы рекомбинантного MGDF человека тестировали, как описано выше. Количество тромбоцитов у мышей, получавших 50 мкг/кг/день или 10 мкг/кг/день указанной формы r-HuMGDF, приведено в Таблице 10. Представленные значения являются средними по четырем животным, и стандартные ошибки даны курсивом.
Б.ПЭГ-22
Результаты, полученные с ПЭГ-22, представлены на фиг.24. Примечательно, что нормализация количества тромбоцитов с ПЭГ-22 наступала на несколько дней раньше, чем с полноразмерным полученным в CHO MGDF ПЭГ-16 или ПЭГ-17.
Пример 14. Экспрессия рекомбинантного MGDF человека (1- 163) в E.coli
Для экспрессии r-HuMGDF в E.coli с использованием оптимальных кодонов E. coli была химически синтезирована последовательность, кодирующая первые 163 аминокислоты зрелого белка. Кроме того, последовательности ДНК, кодирующие аминокислоты Метионин и Лизин, были добавлены к 5'-концу гена. Таким образом, белок r-HuMGDF, состоящий из 165 аминокислот, начинался с Met-Lys. Последовательность этого гена приведена на фиг.25.
Синтез гена r-HuMGDF (1-163) проводили в несколько этапов. Во-первых, с использованием оптимальных кодонов E.coli были химически синтезированы комплементарные олигонуклеотиды (длиной 60-70 пар оснований), представляющие фрагменты, прилегающие к гену. Во время этого синтеза кодоны для аминокислот Метионина и Лизина были помещены на 5'-конец зрелого гена и стоп-кодон был помещен на 3'-конец гена. Кроме того, сайты узнавания ферментов рестрикции Xbal и Hindlll были помещены в близости к 5' и 3' концам гена соответственно, и синтетический сайт связывания рибосом был помещен на соответствующем расстоянии выше от начального Метионина. Во-вторых, были сгибридизованы олигонуклеотиды, комплементарные каждому фрагменту гена. В-третьих, эти индивидуальные синтетические фрагменты гена были амплифицированы в полимеразной цепной реакции. В-четвертых, амплифицированные фрагменты субклонировали в соответствующий вектор. В-пятых, верифицировали последовательности субклонированных фрагментов. В-шестых, индивидуальные фрагменты лигировали вместе и субклонировали в соответствующий вектор, восстанавливая полноразмерный ген r-HuMGDF (1-163). Наконец, верифицировали последовательность восстановленного гена.
Синтетический фрагмент r-HuMGDF гена, фланкированный сайтами рестрикции Xbal и HindIII с 5' и 3' концов соответственно, содержал сайт связывания рибосом, инициирующий кодон ATG, последовательность, кодирующую зрелый белок Met-Lys r-HuMGDF, и стоп-кодон.
Указанный фрагмент был клонирован по сайтам Xbal и Hind III в лактозоиндуцируемый вектор экспрессии pAMG11. Вектор pAMG11 - это низкокопийная плазмида с началом репликации, полученным из pR100. Экспрессирующая плазмида pAMG11 может быть получена из плазмиды pCFM1656 (депонирована 24 февраля 1994 в Американской коллекции культур клеток, АТСС # 69576) путем ряда направленных замен оснований при перекрывании олигонуклеотидов в полимеразной цепной реакции. Начиная с сайта Bglll (в плазмиде пара оснований # 180) непосредственно в 5'- направлении к промотору репликации плазмиды PcopB и далее по направлению к репликативным генам плазмиды, замены пар оснований были таковые (см. табл. B).
Экспрессия r-HuMGDF, клонированного в pAMG11, направляется синтетическим лактозоиндуцируемым промотором, подобным Ps4, который имеет следующую последовательность:
5'GACGTCTCATAATTTTTAAAAAATTCATTTGACAAATGCTAA- - ATTCTTGATTAATATTCTCAATTGTGAGCTCACAATTTATCGAT3' (SEQ ID N0: 34).
Промотор Ps4 подавляется лактозным репрессором (LacI), продуктом гена lac E.coli.
Затем плазмидой pAMG11-r-HiMGDF трансформировали клетки E.coli штамма К-12, имеющие laclq-аллель. Аллель laclq представляет собой такую мутацию промотора lacI, которая усиливает экспрессию LacI, что приводит к более строгому контролю экспрессии белка со стороны промотора Ps4. Таким образом в клетках данного штамма в отсутствие лактозы экспрессия r-HuMGDF подавлена LacI. При добавлении лактозы связывание LacI-белка с операционным сайтом на промоторе Ps4 снижается и начинается транскрипция r-HuMGDF с Ps4. Вспользованные в данном примере клетки-хозяева E.coli депонированы под номером ANNC # 69717 30 ноября 1994 г.
Клетки E.coli ATCC # 69717 трансформировали плазмидой pAMG11-r-HuMGDF и выращивали согласно следующему протоколу. Штамм E. coli инокулировали в бульон Лурии и инкубировали при 30oC приблизительно 12 часов. Затем клетки асептически переносили в ферментор, который содержал среду следующего состава: 20 г/л дрожжевого экстракта; 3.4 г/л лимонной кислоты; 15 г/л K2HPO4; 15 мл Dow P2000; 5 г/л глюкозы; 1 г/л MgSO4 • 7H2O. Первая фаза процесса культивирования (batch- phase) продолжалась до тех пор, пока культура не достигала оптической плотности 5.0 +/- 1.0 при 600 нм. Затем начиналась фаза подпитки (fed-batch) с подачи первой подпитывающей среды (700 г/л глюкозы; 6,75 г/л MgSO4 • 7H2O). Скорость подпитки регулировали каждые два часа согласно установленному графику. Подача второй подпитывающей среды (129 г/л триптиказного пептина; 258 г/л дрожжевого экстракта) начиналась при достижении культурой оптической плотности 20-25 при 600 нм. Подачу второй подпитывающей среды поддерживали на постоянном уровне, тогда как подача первой подпитывающей среды продолжала меняться. Температуру во время всего процесса ферментации поддерживали около 30oC. Значение pH в культуре поддерживали около 7 добавлением кислоты или щелочи. Желаемый уровень растворенного кислорода поддерживали, изменяя скорость перемешивания и скорости подачи воздуха и кислорода в ферментор. Когда оптическая плотность культуры достигала 57-63 при 600 нм, начинали подачу третьей подпитывающей среды. Третью подпитывающую среду (300 г/л лактозы) вводили в ферментор с постоянной скоростью тока; добавление первой подпитывающей среды в этот момент прекращали, а скорость подачи второй подпитывающей среды устанавливали на другом постоянном уровне. Ферментацию продолжали приблизительно десять часов с начала добавления третьей подпитывающей среды. По окончании ферментации культуру охлаждали до 15 +/-5oC. Клетки собирали центрифугированием. Полученную пасту фасовали и хранили при температуре ниже -60oC.
Очистку рекомбинантного MGDF, полученного в E.coli, как описано выше, проводили следующим образом. 1800 г клеточной пасты суспендировали приблизительно в 18 литрах 10 мМ раствора ЭДТА и пропускали через гомогенизатор высокого давления при 15,000 psi. Суспензию разрушенных клеток центрифугировали и осадок ресуспендировали в 10 литрах 10 мМ ЭДТА. Суспензию центрифугировали и полученный при 200 g осадок солюбилизировали в 2 литрах буфера следующего состава: 10 мМ Tris, 8M гуанидин гидрохлорид; 10 мМ дитиотрейтол, pH 8,7. Объем данного раствора медленно доводили до 200 литров добавлением следующего раствора: 10 мМ CAPS; 3М мочевина; 30% глицерин; 3 мМ цистамин; 1 мМ цистеин, pH 10,5. Разбавленный раствор медленно перемешивали при комнатной температуре в течение 16 часов и pH доводили до 6,8. Затем раствор с доведенным pH осветляли и наносили на 2-х литровую колонку СМ Sepharose, уравновешенную 10 мМ фосфат натрия, 1,5 М мочевина, 15% глицерин, pH 6,8. После загрузки колонку промывали 10 мМ фосфат натрия, 15% глицерин, pH 7,2. MGDF элюировали градиентом хлорида натрия от 0 до 0,5 М, 10 мМ фосфат натрия, pH 7,2.
Элюат концентрировали и заменяли буфер на 10 мМ фосфат натрия, pH 6,5 при помощи мембраны с порогом отсечения по молекулярному весу 10,000. Концентрированный раствор (около 2 мг/мл) обрабатывали катепсином С (молярное соотношение 500 к 1) в течение 90 минут при подходящей температуре. Затем раствор наносили на 1,2-литровую колонку SP High Performance Sepharose, уравновешенную 10 мМ фосфат натрия, 15% глицерин, pH 7,2. MGDF элюировали градиентом хлорида натрия от 0,1 до 0,25 М, 10 мМ фосфат натрия, pH 7,2.
К элюату с колонки SP High Performance Sepharose добавляли сульфат аммония до концентрации 0,6 М. Затем элюат наносили на 1,6-литровую колонку с Phenyl Toyopearl, уравновешенную 10 мМ фосфат натрия, 0,6 М сульфат аммония, pH 7,2. Пик MGDF элюировали градиентом сульфата аммония от 0,6 до 0 М, 10 мМ фосфат натрия, pH 7,2.
Элюат с Phenyl Toyopearl концентрировали и заменяли буфер на 10 мМ Tris, 5% сорбитол, pH 7,5 при помощи мембраны с порогом отсечения по молекулярному весу 10,000.
Пример 15. Биологические свойства r-HuMGDF (E.coli 1-163) in vivo
Биологическую эффективность r-HuMGDF (E.coli 1-163), полученного как описано выше в Примере 14, оценивали на грызунах. Нормальным самкам мышей Balb/c в течение пяти последовательных дней вводили подкожно возрастающие дозы r-HuMGDF. Дозы варьировали от 15 мкг/кг/день до 1500 мкг/кг/день. Спустя 24 часа после последнего введения проводили подсчет клеток крови с использованием электронного счетчика клеток (Sysmex, Baxter). Наблюдалось линейное возрастание количества тромбоцитов, параллельное логарифмическому возрастанию концентрации цитокина. В данной системе при дозе 1500 мкг/кг/день количество тромбоцитов возрастало до 300% по отношению к исходному. Другие показатели клеток крови, такие как количество красных и белых клеток или гематокрит, не менялись в ходе данной обработки.
Крысам вводили подкожно r-HuMGDF (E.coli 1-163) в дозах 300 мкг/кг/день в течение 6 дней, затем у них брали тромбоциты и определяли способность последних агрегировать в ответ на ADP. Показано, что тромбоциты обработанных животных практически неотличимы от тромбоцитов контрольных животных по чувствительности к агонисту тромбоцитов, ADP.
Оценивали также способность r-HuMGDF коррегировать тромбоцитопению, обусловленную химиотерапией и/или облучением. В данных опытах использовали карбоплатин, химиотерапевтический агент, способный вызывать у человека глубокую тромбоцитопению. В начале опыта мышам Balb/c вводили подкожно по 1,25 мг карбоплатина. Спустя 24 часа начинали ежедневные инъекции 100 мкг/кг/день r-HuMGDF (E.coli 1-163) или, в контроле, растворителя. К девятому дню количество тромбоцитов падало до 15% от нормального у мышей, получавших один растворитель, но оставалось в пределах нормы у мышей, получавших r-HuMGDF (см.фиг.20). В опытах с облучением мыши получали однократную дозу в 500 рад гамма-облучения (цезиевый источник). Эта сублетальная доза приводила к снижению числа тромбоцитов на 90% к 11-му дню. Количество тромбоцитов не возвращалось к нормальному до 21-го дня. При введении облученным мышам с 1-го по 20-й день ежедневно по 100 мкг/кг/день r-HuMGDF (E.coli 1-163) уменьшение числа тромбоцитов было менее резким и возвращение к их нормальному числу более быстрым, нежели у мышей, получавших один растворитель (фиг. 21). Для проверки r-HuMGDF на модели острой и пролонгированной тромбоцитопении, была применена комбинация карбоплатина и облучения (фиг.22). В этом случае количество тромбоцитов снижалось до крайне низких уровней (3-5% от нормы) и большинство животных (7/8) не переживали такой обработки. Однако, когда животным подкожно ежедневно вводили по 100 мкг/кг/день r-HuMGDF в течение всего эксперимента, тромбоцитопения в значительной степени коррегировалась, возврат к исходному числу тромбоцитов происходил быстрее и все получавшие r- HuMGDF животные (8/8) выживали.
r-HuMGDF проверяли также на макаках резус. Нормальным макакам резус вводили подкожно препарат r-HuMGDF в дозах 2,5 или 25 мкг/кг/день в течение десяти дней (дни 0-9). В группе, получавшей низкую дозу, количество тромбоцитов возросло до 400% от нормы к 12-му дню, а в группе, получавшей высокую дозу, увеличение составило 700% также к 12-му дню. По окончании инъекций количество тромбоцитов возвращалось к норме к 25-30-му дню. Данная обработка не влияла на количество белых и красных клеток крови.
r-HuMGDF был также проверен на модели приматов с острой тромбоцитопенией (фиг.23). Облучение животных (700 рад, цезиевый источник) приводило к снижению числа тромбоцитов до 1-2% от нормы к 15-му дню. На 35-40-й день число тромбоцитов возвращалось к норме. У облученных животных, которым вводили r-HuMGDF (25 мкг/кг/день), количество тромбоцитов снижалось только до 10% от нормы и в среднем не опускалось ниже 20,000/мл, значения, при котором начинают трансфузию тромбоцитов людям, страдающим тромбоцитопенией. Возврат к нормальному числу тромбоцитов также происходил более быстро у животных, получавших r-HuMGDF, и наступал на 20-й день.
Приведенные данные экспериментов in vivo на грызунах и приматах полностью поддерживают концепцию о том, что r-HuMGDF (E.coli 1-163) является мощным терапевтическим агентом, способным значительно влиять на встречающиеся в клинике тромбоцитопении.
Пример 16. Метод получения r-HuMGDF (1-332) в культуре клеток CHO
Гликозилированный r-HuMGDF 1-332 продуцируется трансфицированными клетками CHO, экспрессирующими кДНК MGDF 1-332 под регуляцией подходящего промотора и соединенный с геном, кодирующим амплифицируемый селективный маркер, DHFR. Подходящим промотором для экспрессии MGDF в клетках CHO является промотор SR- alfa, см. Mol.Cell.Biol. 8: 466- 472 (1988) и патент WO 91/13160 (1991). Подходящим вектором для экспрессии MGDF в клетках является pDSR-alfa2, см. WO 90/14363 (1990). Клеточные линии CHO могут продуцировать секретируемый MGDF в количестве 10-20 мг/л в стандартной культуральной среде, но уровень продукции может быть повышен от 25 до 100 мг/л. При продукции MGDF в типичной клеточной линии культура может быть "разогнана" пассажами в суспензии или на культуральных флаконах (в случае субстрат- зависимого роста) с использованием культуральной среды, состоящей из равных количеств среды Игла в модификации Дальбекко (DMЕМ) и среды Хэма F12 (DMEM/F12, Gibco) с добавлением от 5 до 10% эмбриональной телячьей сыворотки (FBS) или диализованной эмбриональной телячьей сыворотки и метотрексата (MTX) (при необходимости; обычная концентрация MTX составляет 200-600 нМ) для поддержания селективного давления. В среду должны быть дополнительно добавлены не-необходимые аминокислоты (NEAA's) и глутамин. Суспензионные культуры могут быть наращены в пределах концентраций 1-4 • 105 клеток/мл (посевная концентрация) до приблизительно 1 миллион клеток/мл. При достижении максимальной концентрации клеток производят пассаж культуры путем разбавления до больших объемов и достижения посевной концентрации.
При получении MGDF в роллерных флаконах, подходящий объем и плотность клеток в суспензионной культуре должны быть подобраны с использованием спиннерных флаконов с магнитными мешалками, помещенных в термостатированные условия (37+/-1oC), или же с использованием автоматической контролируемой системы с биореактором. Роллерные флаконы (например, флаконы фирмы Falcon площадью 850 см2) должны засеваться клетками с посевными дозами от 1,5 до 3 • 107 клеток на флакон в таком количестве ростовой среды (DMEM/F12 с 5-10% FBC, 1xNEAA и 1х глутамин), которое обеспечивало бы образование слитого монослоя на 3-4-й день культивирования (150-300 мл). Ростовая среда должна быть забуферена бикарбонатом натрия до pH 6,9-7,2 и уравновешена двуокисью углерода до парциального давления 60-90 мм ртутного столба. Флаконы должны быть заполнены смесью 10% CO2 в воздухе, и культуры инкубируют при 37+/-1oC на роллерных аппаратах при скорости вращения около одного оборота в минуту в течение 3-4 дней. При достижении монослоя коллерные культуры должны быть переведены на бессывороточную производственную среду. При этом старую ростовую среду сливают или отсасывают, культуры промывают изотоническим буфером, например фосфатным буферным раствором Дальбекко (D-PBS), 50-100 мл на флакон, затем добавляют соответствующий объем забуференной бикарбонатом бессывороточной среды DMEM/F12 (1: 1) (200-300 мл на флакон) с добавлением NEAA, глутамина и сульфата меди (1-20 мкМ) для минимизации ковалентной агрегации. Флаконы заполняют газовой смесью (10% CO2 в воздухе) и инкубируют 6 +/-1 дней при 37oC на роллерных аппаратах (~ 1 об/мин) или же до такого момента, когда в результате метаболизма клеток уровень глюкозы в среде опустится ниже 0,5 г/л и/или значение pH опустится ниже 6,6. Кондиционированную среду сливают или отсасывают из флаконов и заменяют свежей бессывороточной производственной средой указанного выше состава для получения дополнительных сборов. Так может продолжаться до тех пор, пока клетки не смогут более переносить бессывороточные условия и не начнут сползать с роллерных флаконов.
Собранную кондиционированную среду очищают микрофильтрацией через фильтры с размером пор 0,45 или 0,2 мкм (Sartorius Sartobran рН или Pall). Профильтрованную кондиционированную среду охлаждают до 4oC и хранят непродолжительное время при этой температуре или немедленно концентрируют и диализуют против буфера с низкой ионной силой с использованием тангенциальной ультрафильтрационной системы (например, Filtron YM-50). Ультрафильтрацию и диафильтрацию необходимо проводить при 4oC, чтобы минимизировать деградацию белка. До хроматографической очистки кондиционированная среда должна быть диализована против буферного раствора (например, 10 мМ фосфат калия, pH 6,8).
Качество продукта, содержащегося в кондиционированной среде, лучше всего контролировать при помощи SDS-PAGE в невосстанавливающих условиях с последующим Вестерн- блоттингом, который может выявить количества агрегированного, мономерного и протеолитически деградированного MGDF в образцах.
Другой метод получения MGDF в клетках CHO состоит в адаптации клеточной линии, экспрессирующей MGDF, к бессывороточной среде, такой как Gibco S-SFM II. Клетки могут быть адаптированы серийными пассажами на среде, содержащей минимум сыворотки или не содержащей ее совсем. Если клеточная линия будет устойчиво расти на такой среде и продуцировать адекватные количества секретируемого MGDF, культивирование может продолжаться путем серийных пассажей, в возрастающих объемах, затем клетки переносят в подходящий производственный сосуд (автоматический контролируемый биореактор) и культуре дают пролиферировать до достижения максимальной плотности, при которой клетки еще жизнеспособны, при оптимальных ростовых условиях (pH, питательные вещества, температура, кислород, разрушение клеток). В точке оптимальной продукции (которую определяют экспериментально, замеряя количество и качество продукта) культуру собирают из биореактора, клетки удаляют из кондиционированной среды микронной глубинной фильтрацией или субмикронной тангенциальной микрофильтрацией. В случае глубинной микронной фильтрации среда должна быть в последующем осветлена субмикронной конечной фильтрацией для концентрации и диализа, как это описано выше.
Несмотря на то, что заявленное изобретение описано выше как в целом, так и в отношении конкретных вариантов осуществления, следует понимать, что модификации изобретения на основе приведенного описания могут быть воспроизведены любым специалистом в данной области исследований. Таким образом, заявленные пункты формулы в действительности охватывают все варианты изобретения, входящие в его объем.
Кроме того, публикации и другие информационные источники, приведенные для оценки уровня техники и лучшего понимания описания изобретения, в особенности для более подробного освещения практических вопросов, включены в материалы заявки в качестве ссылок.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТРОМБОПОЭТИН | 1994 |
|
RU2245365C2 |
| ПОЛИЭТИЛЕНГЛИКОЛЕВОЕ ПРОИЗВОДНОЕ ПОЛИПЕПТИДОВ НЕЙРОТРОФИЧЕСКОГО ФАКТОРА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1995 |
|
RU2136694C1 |
| АНАЛОГ ПРИРОДНОГО ФАКТОРА РОСТА КЕРАТИНОЦИТОВ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, РЕКОМБИНАНТНАЯ МОЛЕКУЛА НУКЛЕИНОВОЙ КИСЛОТЫ, КОДИРУЮЩАЯ АНАЛОГ, ЭКСПРЕССИОННЫЙ ВЕКТОР, ШТАММ E.COLI, ТРАНСФОРМИРОВАННЫЙ ВЕКТОРОМ, СПОСОБ ПОЛУЧЕНИЯ АНАЛОГА И СПОСОБ СТИМУЛИРОВАНИЯ ОБРАЗОВАНИЯ НЕФИБРОБЛАСТНЫХ ЭПИТЕЛИАЛЬНЫХ КЛЕТОК | 1995 |
|
RU2198180C2 |
| СРЕДСТВА И СПОСОБ ПОЛУЧЕНИЯ ГЕМОПОЭТИЧЕСКОГО БЕЛКА | 1994 |
|
RU2233881C2 |
| АНАЛОГ ЭРИТРОПОЭТИНА | 1994 |
|
RU2159814C2 |
| НОВЫЙ ЦИТОКИН ZALPHA11-ЛИГАНД | 2000 |
|
RU2258710C2 |
| ДЕГРАДИРОВАННОЕ АНТИТЕЛО, ЯВЛЯЮЩЕЕСЯ АГОНИСТОМ TPO | 2001 |
|
RU2287534C2 |
| ПОЛИПЕПТИД ТРОМБОПОЭТИН (ТРО), ДНК, КОДИРУЮЩАЯ ПОЛИПЕПТИД ТРО (ВАРИАНТЫ), СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДА (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ (ВАРИАНТЫ), АНТИТЕЛО К ПОЛИПЕПТИДУ ТРО | 1995 |
|
RU2194074C2 |
| НОВЫЙ ЛИГАНД РЕЦЕПТОРА ЦИТОКИНА ZCYTOR17 | 2003 |
|
RU2490276C2 |
| СПОСОБ И КОМПОЗИЦИИ ДЛЯ ИММУНОМОДУЛЯЦИИ | 2015 |
|
RU2736495C2 |




















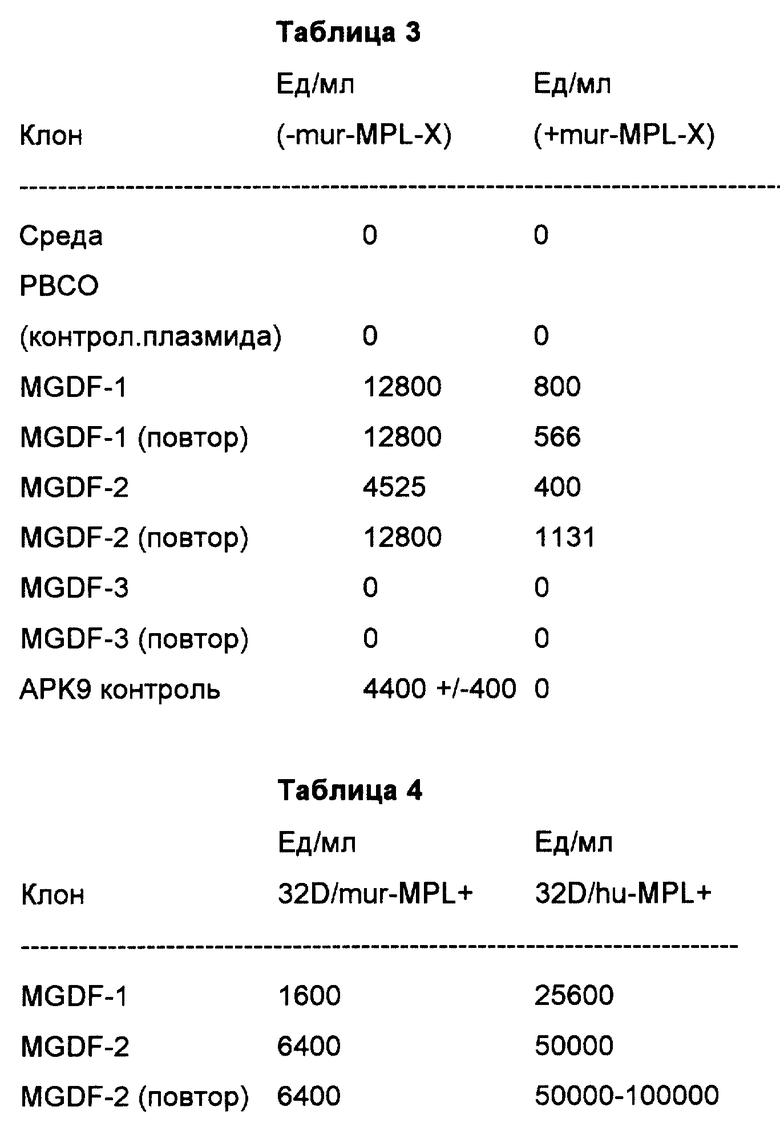


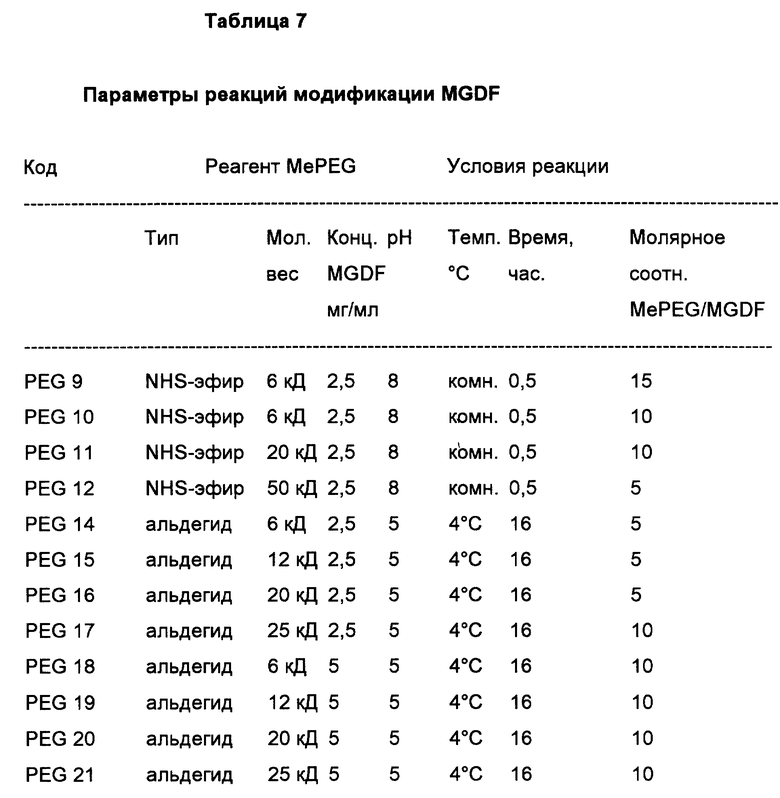
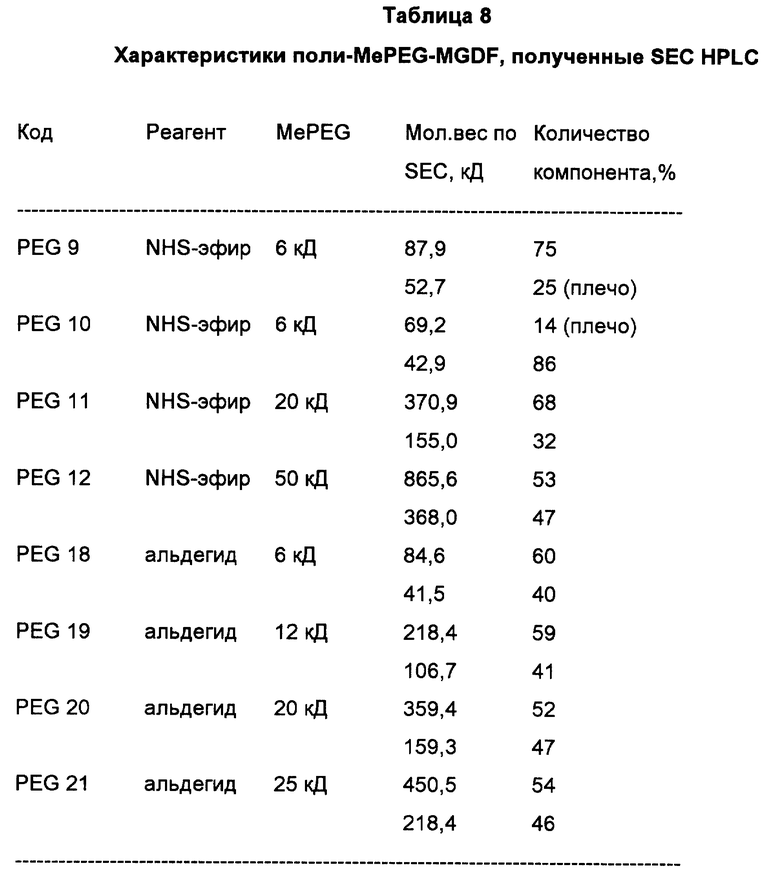
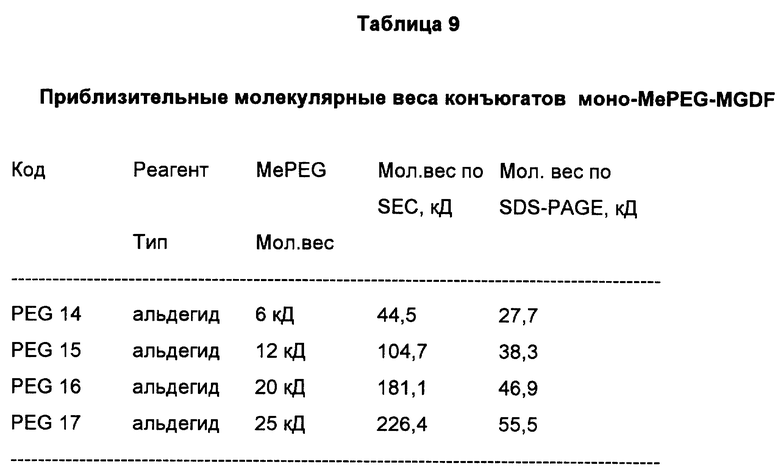
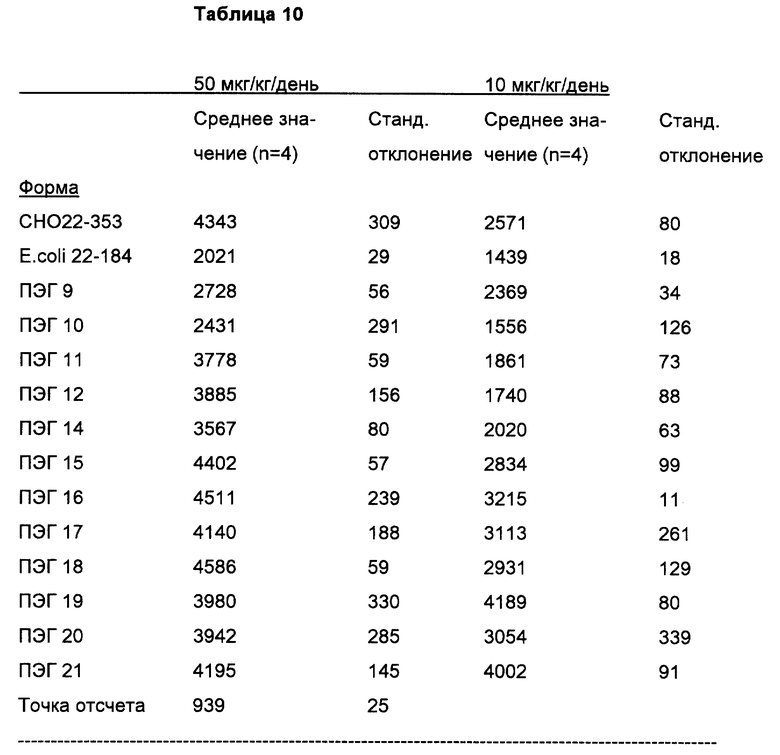






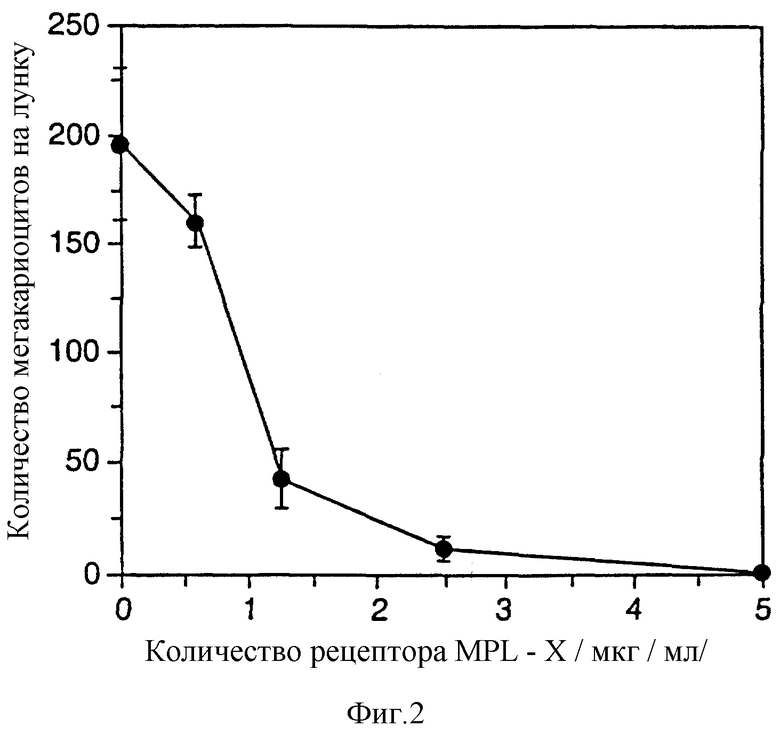
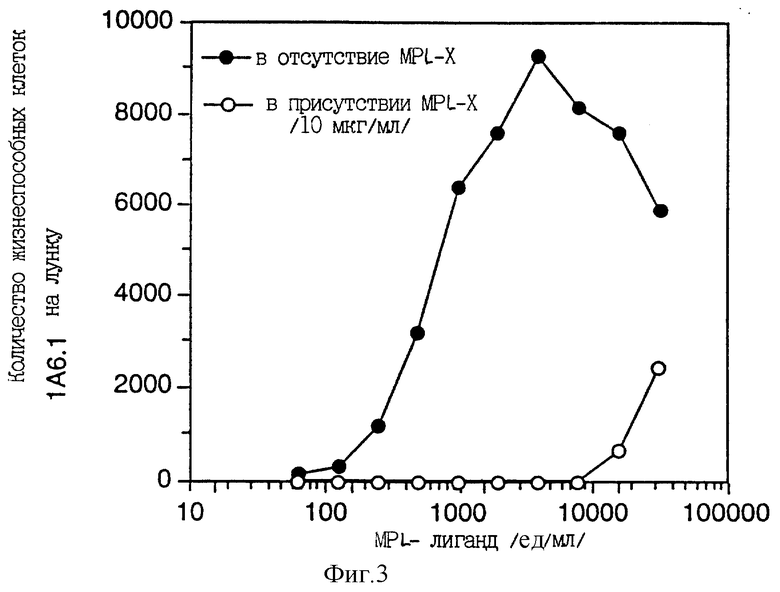

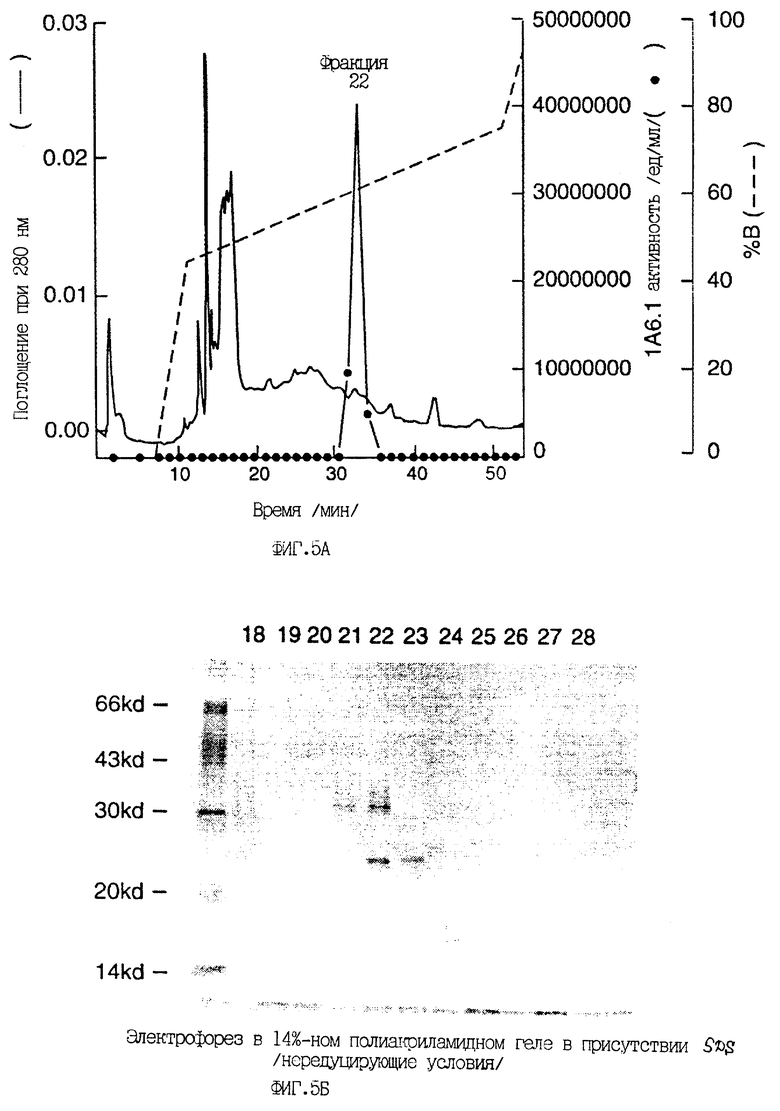

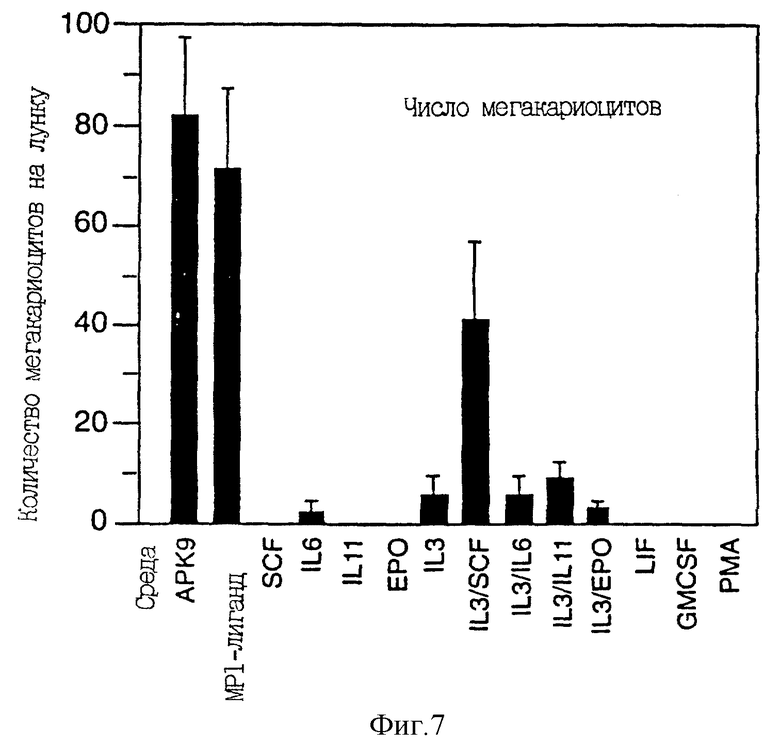
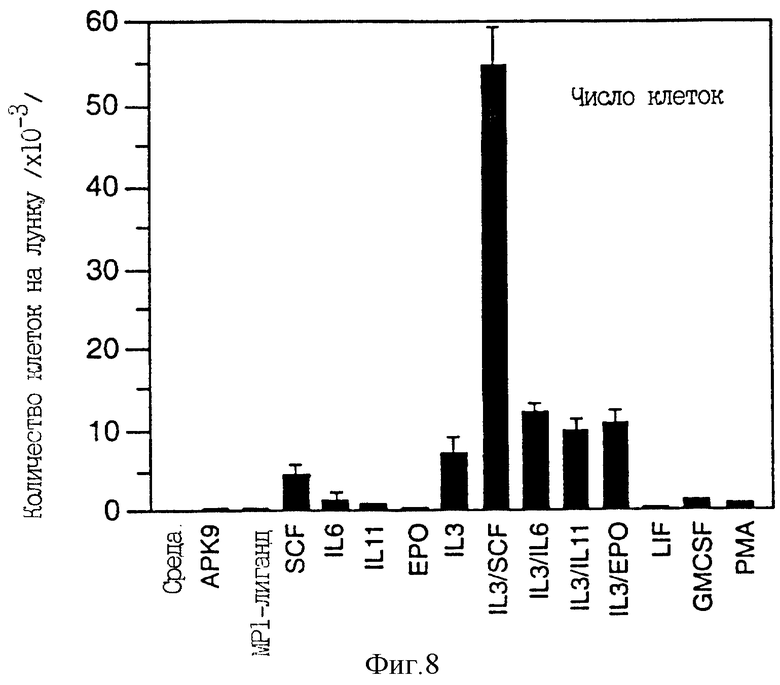
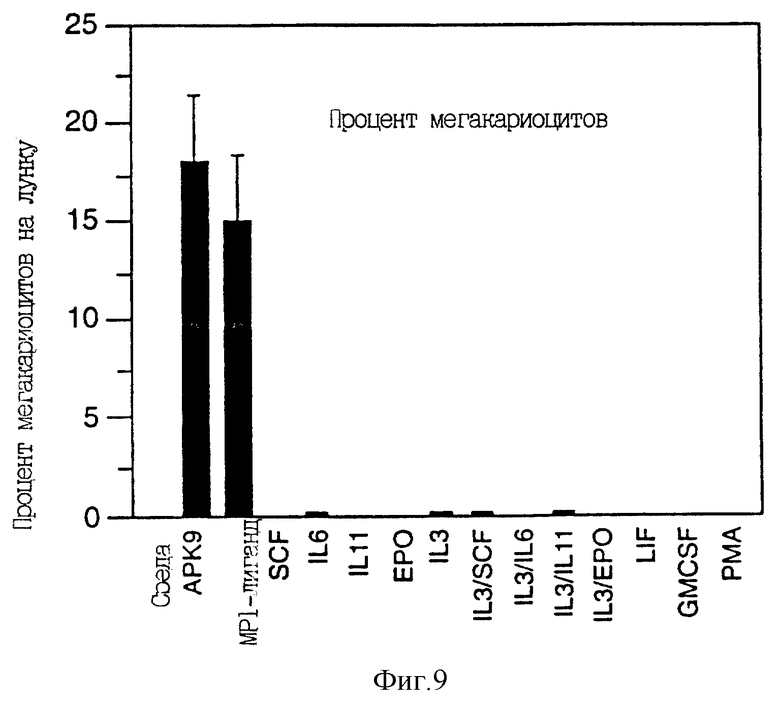







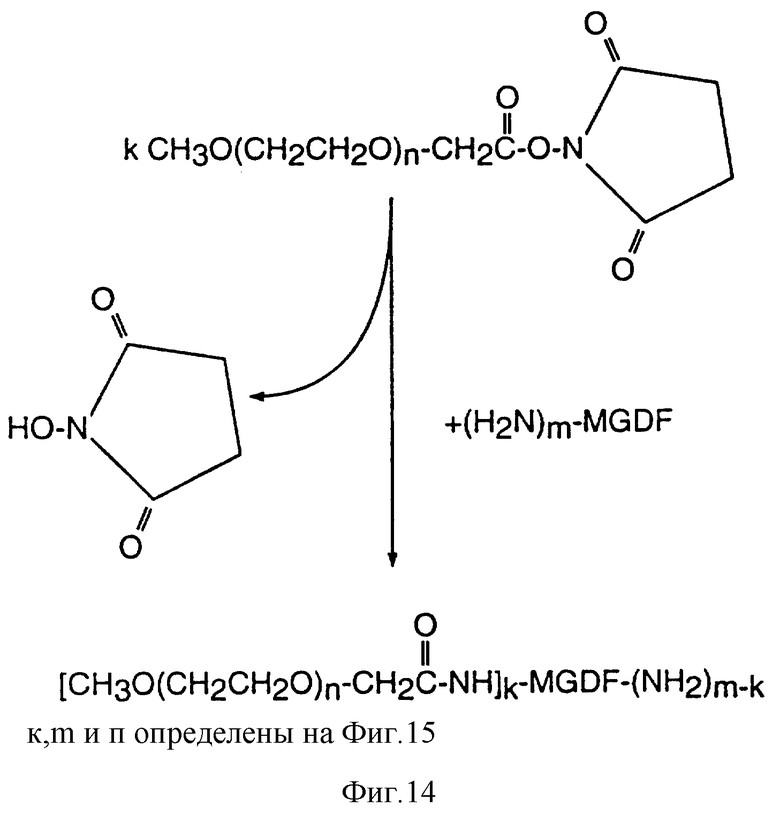
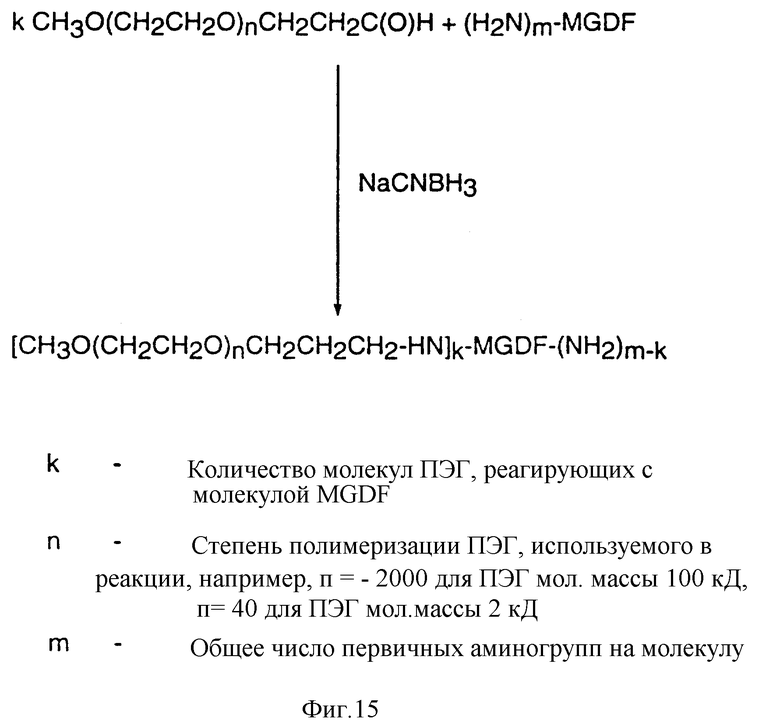
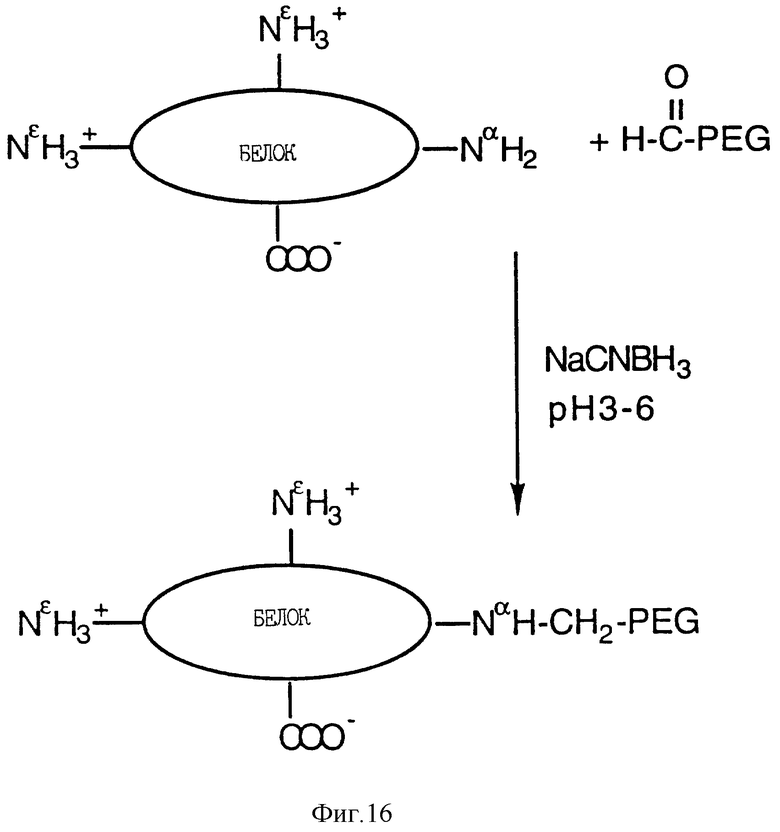


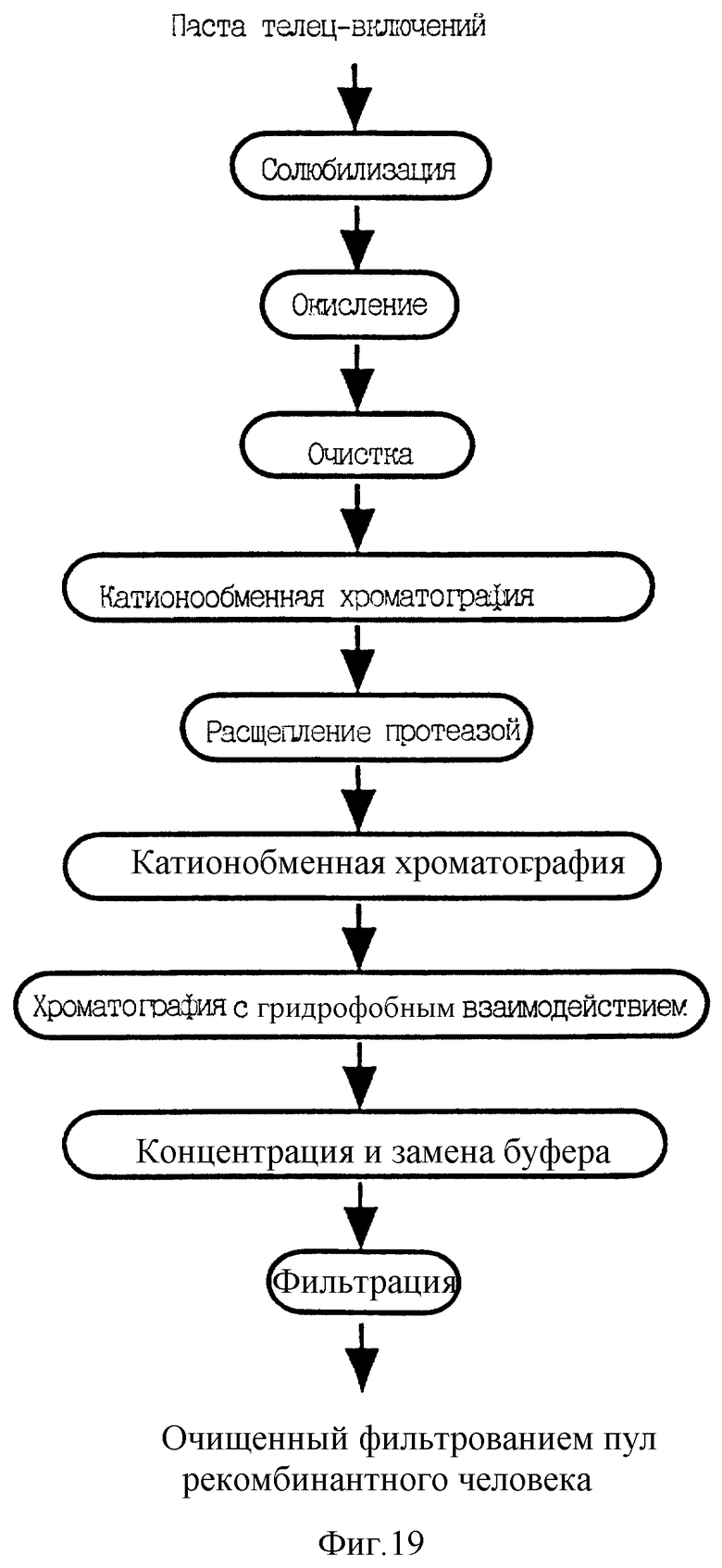
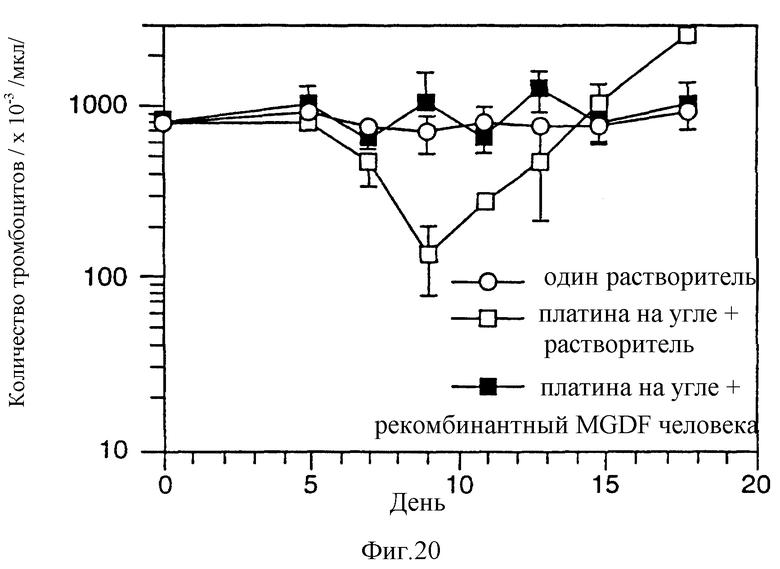
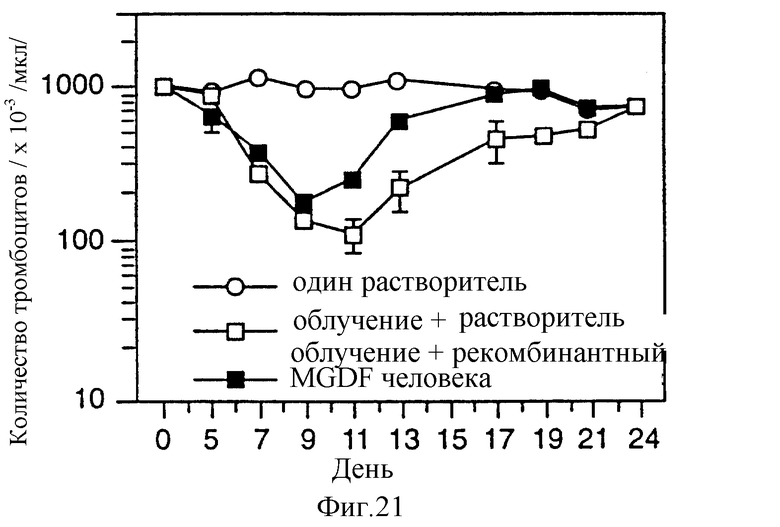
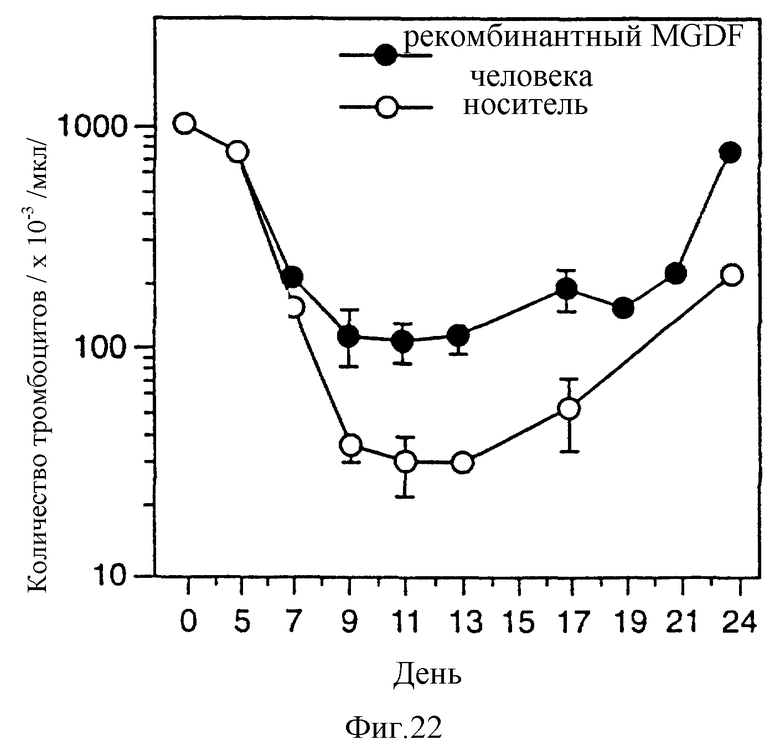

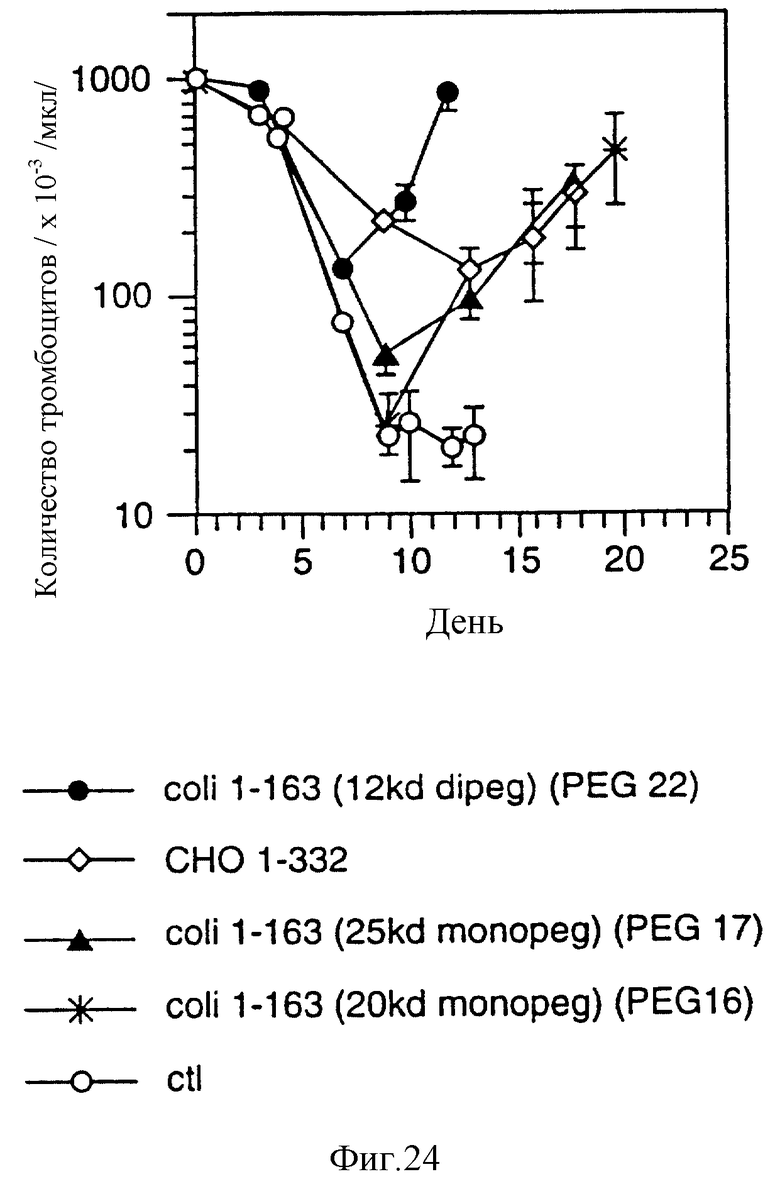

Изобретение относится к области медицины и биотехнологии, а именно к новым белкам, являющимся факторами роста и развития мегакариоцитов (MGDFs; в основном обозначенных как Mp1-лиганды), биологическая активность которых заключается в стимулировании роста мегакариоцитов и их дифференцировки или созревания, что в конечном счете приводит к образованию тромбоцитов. Изобретение относится также к производным MGDF, содержащим молекулы MGDF, соединенные с водорастворимыми полимерами, такими как полиэтиленгликоль, и к способам получения таких производных. Кроме того, изобретение относится к способам получения MGDFs в форме гомогенных препаратов из природных источников, а также к способам получения MGDFs из млекопитающих (включая человека) с помощью рекомбинантной генно-инженерной технологии. Преимущество изобретения заключается в том, что указанные белки имеют терапевтическое применение вследствие их увеличенной стабильности и времени их циркуляции, а химическая модификация данных белков препятствует их деградации. 16 с. и 23 з.п.ф-лы, 25 ил., 12 табл.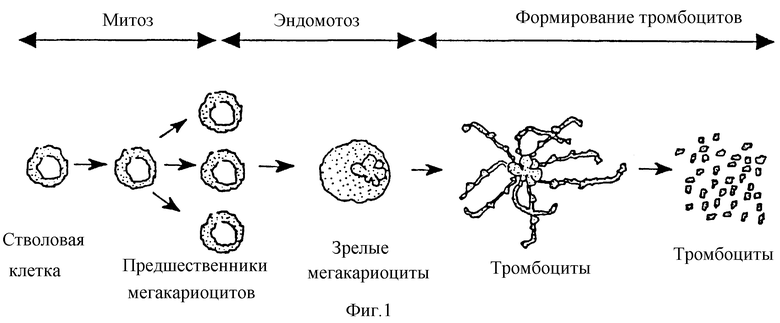
Приоритет по пунктам:
31.05.94 по пп.1-3, 35-39;
12.10.94 по пп.4-34.
| Способ иммобилизации белковых молекул | 1978 |
|
SU681837A1 |
| ТЕРМОМАГНИТНЫЙ ГАЗОАНАЛИЗАТОР | 0 |
|
SU399777A1 |
| Пожарный двухцилиндровый насос | 0 |
|
SU90A1 |
| Огнетушитель | 0 |
|
SU91A1 |
| US 5087448 A, 11.02.1992 | |||
| US 5178856 A, 12.01.1993 | |||
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| US 5032396 A, 16.07.1991 | |||
| US 5264209 A, 23.11.1993 | |||
| Critical Reviews in Drug Caerier Systems | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| C.Delgodo et al | |||
| The uses and properties of PEG - linked proteins | |||
| pp | |||
| Трансляция, предназначенная для телефонирования быстропеременными токами | 1921 |
|
SU249A1 |
Авторы
Даты
2000-11-10—Публикация
1995-03-30—Подача