Настоящее изобретение относится к технологии рекомбинантной ДНК и белковой инженерии. Конкретно, методологии рекомбинантной ДНК были применены для получения полилептидных аналогов фактора роста кератиноцитов (KGF), сильного митогена роста нефибробластных эпителиальных клеток, характеризующихся тем, что аналоги обладают повышенной устойчивостью по сравнению с таковой KGF-предшественника.
Предпосылки создания изобретения
Сложный процесс образования и восстановления ткани опосредуется рядом белковых факторов, иногда называемых факторами роста мягких тканей. Эти молекулы обычно высвобождаются одним типом клеток и действуют, влияя на пролиферацию других типов клеток (Rubin et al. (1989), Proc. Natl. Acad. Sci. USA, 86:802-806). Некоторые факторы роста мягких тканей секретируются определенными типами клеток и влияют на пролиферацию, дифференцировку и/или созревание чувствительных клеток в процессе развития многоклеточных организмов (Finch et al. (1989), Science, 24:752-755). Помимо их роли в процессе развития организмов, некоторые из них имеют значение для продолжительного здоровья и сохранения более зрелых систем. Например, у млекопитающих есть много систем, в которых происходит быстрый "кругооборот" клеток. Такие системы включают кожу и желудочно-кишечный тракт, каждый из которых состоит из эпителиальных клеток. В эту группу факторов роста мягких тканей входит семейство белков факторов роста фибробластов (FGF).
На сегодня известно 8 членов семейства FGF, которые обладают родственными первичными структурами: основный фактор роста фибробластов, bFGF (Abraham et al. (1986), EMBO J., 5:2523-2528); кислый фактор роста фибробластов, aFGF (Jaye et al. (1986), Science, 233:541-545); int-2 генный продукт, int-2 (Dickson and Peters (1987), Nature, 326:833); hst/kFGF (Delli-Bovi et al. (1987), Cell, 50:729-737 and Yoshida et al. (1987), Proc. Natl. Acad. Sci. USA, 84: 7305-7309); FGF-5 (Zhan et al. (1987), Mol. Cell. Biol, 8: 3487-3495); FGF-6 (Marics et al. (1989), Oncogene, 4:335-340); фактор роста кератиноцитов (Finch et al. (1989), Science, 24:752-755) и гисактофилин (Habazzettl et al. (1992), Nature, 359:855-858).
Среди семейства белков FGF фактор роста кератиноцитов (KGF) является уникальным эффектором пролиферации нефибробластных эпителиальных клеток, происходящих из мезенхимных тканей. Термин "природный KGF" относится к природному человеческому (hKGF) или рекомбинантному (rKGF) полипептиду (с или без сигнальной последовательности), что отражено аминокислотной последовательностью, представленной в SEQ ID NO:2, или его аллельному варианту. [Если не указано иначе, нумерация аминокислот в описанных ниже молекулах соответствует таковой для зрелой формы природной молекулы (т.е. минус сигнальная последовательность), что изображено аминокислотами от 32 до 194 в SEQ ID NO: 2].
Природный KGF может быть выделен из естественных "человеческих" источников (hKGF) или получен с помощью рекомбинантной ДНК (rKGF) (Finch et al. (1989), supra; Rubin et al. (1989), supra; Ron et al. (1993), The Journal of Biological Chemistry, 268(4):2984-2988 и Yan et al. (1991), In Vitro Cell. Dev. Biol., 27A:437-438).
Известно, что природный KGF является относительно неустойчивым в водной среде и что он претерпевает химический и физический распад, приводящий к потере биологической активности вследствие процессинга и хранения (Chen et al. (1994), Pharmaceutical Research, 11:1582-1589). Природный KGF также склонен к объединению (агрегации) при повышенных температурах и становится неактивным в кислых условиях (Rubin et al. (1989), Proc. Natl. Acad. Sci. USA, 86: 802-806). Агрегация природного KGF в водном растворе приводит к дезактивированному белку. Это является невыгодным, так как такая потеря активности делает его непрактичным для хранения водных составов белков природного KGF в течение длительного времени или для введения белка в течение длительных периодов. Более того, является особенно проблематичным приготовление фармацевтических составов, так как известно, что агрегированные белки являются иммуногенными (Cleland et al. (1993), Crit. Rev. Therapeutic Drug Carrier Systems, 10:307-377; Robbins et al. (1987), Diabetes, 36:838-845 и Pinckard et al. (1967), Clin. Exp. Immunol., 2:331-340).
Природный KGF содержит пять остатков цистеина, а именно аминокислоты 1, 15, 40, 102 и 106 (Finch et al. (1989), Science, 24:752-755). Хотя сообщалось о цистеиновом составе природного KGF, не сообщалось о роли, которую играли остатки цистеина в активности (например, в особенности биологической активности) и третичной структуре (например, склонности к образованию нежелательных меж- и внутримолекулярных дисульфидных связей). Таким образом, в предыдущей технике нет сведений, даже если они известны, о том, что остатки цистеина существенны или участвуют в образовании нежелательных дисульфидных связей, что делает белок чувствительным к агрегации и/или неустойчивости.
Чтобы попытаться улучшить или другим способом изменить одну или более характеристик нативного KGF, можно применить белковую инженерию. Технология рекомбинантной ДНК была применена для модификации последовательностей природного KGF. Ron et al. (1993), J. Biol. Chem., 268(4):2984-2988 сообщил о модифицированных KGP полипептидах, у которых удалены 3, 8, 27, 38 или 49 аминокислот на N-конце. Полипептиды с удаленными 3, 8 или 27 N-концевыми остатками сохраняли способность связываться с гепарином; другие же нет. Также сообщалось, что полипептиды с отсутствующими 3 и 8 остатками являются полностью активными, тогда как форма с удаленными 27 остатками была в 10-20 раз менее активна в качестве митогена, а формы, у которых отсутствуют 38 или 49 аминокислот, не обладали митогенной активностью. Устойчивость модифицированных KGF полипептидов не обсуждалась и о ней ничего не сообщалось.
Опубликованная РСТ патентная заявка No 90/08771, supra, также сообщала о получении химерного белка, в котором примерно первые 40 N-концевых аминокислот зрелой формы природного KGF были соединены с С-концевой частью (примерно 140 аминокислот) aFGF. Сообщалось, что химера нацелена на кератиноциты, как KGF, но в ней отсутствует чувствительность (предрасположенности) к гепарину, что характерно для aFGF, но не KGF. Устойчивость химеры не обсуждалась и о ней не сообщалось.
Таким образом, в литературе не сообщалось о модифицированной молекуле KGF, имеющей значительно более высокую устойчивость по сравнению с природным KGF. Более того, в литературе не приводилось достаточных доводов или доказательств успешного получения молекул KGF с такими желательными (заданными) характеристиками.
Обычно влияние на биологическую активность любой замены аминокислот в белке меняется в зависимости от ряда факторов, включая трехразмерную структуру белка, и касается или нет модификации участка рецепторного связывания первичной последовательности белка. Так как ни трехразмерная структура, ни участок рецепторного связывания первичной структуры природного KGF не были опубликованы, знание предыдущей техники не позволяет делать обобщение о влиянии модификаций аминокислот на природный KGF на основе влияния модификаций аминокислот даже на обычные классы белков.
Целью настоящего изобретения является получение аналогов полипептидов и молекул нуклеиновых кислот, кодирующих такие аналоги, которые проявляют повышенную устойчивость (например, при типичных рН, термических и/или других условиях хранения) по сравнению с природным KGF.
Сущность изобретения
Настоящее изобретение предлагает новые, биологически активные полипептидные аналоги KGF. Для целей согласно данному изобретению термин "KGF" включает природный KGF и белки, характеризующиеся пептидной последовательностью, практически такой же, что и пептидная последовательность природного KGF, которая сохраняет остатки цистеина, соответствующие Cys1 и Cys15 природного KGF (Cys32 и Cys46 SEQ ID NO:2), и которая сохраняет всю или часть биологической активности природного KGF, в особенности пролиферацию нефибробластных эпителиальных клеток. Когда делаются ссылки на фиг.4,7-24 и 37-50 и определенное положение аминокислоты, то первому члену последовательности присваивается номер остатка 0. Под "характеризующийся пептидной последовательностью, практически такой же, что и пептидная последовательность природного KGF" понимается пептидная последовательность, которая кодируется последовательностью ДНК, способной гибридизоваться с нуклеотидами от 201 до 684 SEQ ID NO:1, предпочтительно в жестких условиях гибридизации.
Определение положения соответствующей аминокислоты между двумя аминокислотными последовательностями может быть сделано выстраиванием (выравниванием и сравнением) двух последовательностей с целью получить максимальное число совпадений остатков, включая сдвиг амино и/или карбоксильных концов, вводя щели, если требуется, и/или удаляя остатки, присутствующие в "кандидате" в качестве инсертов. Поиски баз данных, секвенирование и манипуляции можно осуществлять, используя одну из хорошо известных и привычно употребляемых программ анализа гомологии/идентичности последовательностей (например, Pearson and Lipman (1988), Proc. Natl. Acad. Sci. U.S.A., 85: 2444-2448; Altschul et al. (1990), J. Mot. Biol., 215:403-410; Lipman and Pearson (1985), Science, 222: 1435 или Devereux et al. (1984), Nuc. Acids Res., 12:387-395).
Жесткие условия в контексте гибридизации являются жесткими условиями (объединяющими), касающимися соли, температуры, органических растворителей и других параметров, обычно контролируемых в реакциях гибридизации. Примерными жесткими условиями гибридизации является гибридизация при 4•SSC при 62-67oС с последующим промыванием в 0.1•SSC при 62-67oС примерно в течение часа. Или же примером жестких условий гибридизации является гибридизация в 45-55% формамиде, 4•SSC при 40-45oС (См. Т. Maniatis et al. Molecular Cloning (A Laboratory Manual); Cold Spring Harbor Laboratory (1982), стр.387-389].
Таким образом, белки включают аллельные вариации, или делецию(и), замену(ы) или инсерцию(и) аминокислот, включая фрагменты, химерные или гибридные молекулы природного KGF. Один пример KGF включает изменение заряда полипептида, в котором один или более аминокислотных остатков 41-154 природного KGF (предпочтительно остатки Arg41, Gln43, Lys55, Lys95, Lys128, Asn137, Gln138, Lys139, Arg144, Lys147, Gln152, Lys153 или Thr154) удалены или заменены нейтральным остатком или отрицательно заряженным остатком, выбранным с целью воздействовать на белок с пониженным положительным зарядом (как раскрыто в заявке, являющейся совместной собственностью U.S.S.N. 08/323,337, поданной 13 октября 1994 г.), конкретно включающий R(144)Q, KGF, имеющий замену аргинина на глутамин в положении аминокислоты 144 природного KGF. Другой пример KGF включает белки, полученные заменой, по крайней мере, на одну аминокислоту с более высоким потенциалом петлеобразования, по крайней мере, одной аминокислоты в петлеобразующем участке Asn115-His116-Tyr117-Asn118-Thr119 природного KGF (как раскрыто в находящейся в общей собственности заявке U.S.S. N. 08/323,473, поданной 13 октября 1994 г.), конкретно включающий H(116)G, KGF, имеющий замену гистидина на глицин в положении 116 аминокислоты природного KGF. Еще один дополнительный пример включает белки с одной или более аминокислотными заменами, делениями или присоединениями на участке 123-133 (аминокислоты 154-164 SEQ ID NO:2) природного KGF; эти белки могут проявлять агонистическую или антагонистическую активность. Удивительным является то, что, как было открыто, когда молекула KGF (т.е. молекула-предшественник) содержит остатки, соответствующие (как определено описанными выше методами) Cys1 и Cys15 природного KGF (цистеиновым остаткам 32 и 46 SEQ ID NO:2), модифицируется заменой соответствующих цистеинов, то образующийся в результате KGF аналог обладает повышенной устойчивостью по сравнению с молекулой-предшественником. Предпочтительно, помимо повышенной устойчивости, чтобы данное изобретение было направлено на те аналоги, которые полностью проявляют биологическую активность (т.е., по меньшей мере, практически одинаковое рецепторное связывание или сродство) по сравнению с природным KGF.
В другом аспекте изобретения описаны молекулы очищенной и выделенной нуклеиновой кислоты, кодирующей различные биологически активные полипептидные аналоги KGF. В одном воплощении изобретения такие нуклеиновые кислоты представляют собой молекулы ДНК, клонированные в векторы биологически функциональной плазмиды или вируса. В другом воплощении изобретения конструкции нуклеиновой кислоты могут затем применяться для того, чтобы стабильно трансформировать прокариотическую или эукариотическую клетку-хозяина. Еще в одном воплощении данное изобретение включает процесс, в котором или прокариотическая (предпочтительно Е. coli) или эукариотическая клетка-хозяин, стабильно трансформированная молекулой нуклеиновой кислоты, выращивается в условиях соответствующей питательной среды так, чтобы была возможна экспрессия KGF аналога. После экспрессии образовавшийся рекомбинантный полипептид может быть выделен и очищен.
Дополнительный аспект согласно данному изобретению касается фармацевтических составов, содержащих терапевтически эффективное количество аналогового KGF и приемлемый фармацевтический носитель. Такие рецептуры будут полезны при лечении больных, страдающих заболеваниями и поражениями эпителия.
В этом направлении другой аспект относится к способам стимулирования роста эпителиальных клеток с помощью введения больному терапевтически эффективного количества аналога KGF. В одном воплощении изобретения нефибробластные эпителиальные клетки представляют собой клетки, пролиферация которых стимулируется. Такие эпителиальные клетки включают различные клетки придатков, клетки поджелудочной железы, клетки печени, эпителий слизистой оболочки дыхательных путей и желудочно-кишечного тракта.
Краткое описание фигур
Фигуры 1 изображают нуклеотидную (SEQ ID NO:1) и аминокислотную (SEQ ID NO:2) последовательности природного KGF (нуклеотиды, кодирующие зрелую форму природного KGF, изображены основаниями от 201 до 684 SEQ ID NO:1, а зрелую форму KGF, изображены аминокислотными остатками от 32 до 194 SEQ ID NO:2).
Фигуры 2A, 2В и 2С изображают карты плазмиды pCFM1156, pCFM1656 и pCFM3102 соответственно.
Фигура 3 изображает нуклеотидную (SEQ ID NO:3) и аминокислотную (SEQ ID NO: 4) последовательности конструкции RSH-KGF.
Фигура 4 показывает нуклеотидную (SEQ ID NO: 5) и аминокислотную (SEQ ID NO:6) последовательности конструкции, содержащейся в плазмиде с геном KGF.
Фигура 5 показывает химически синтезированные OLIGO (олигонуклеотиды) (от OLIGO# 6 до OLIGO#11; SEQ ID NO:12-17 соответственно), применяемые для того, чтобы заменить последовательность ДНК между сайтом KpnI и сайтом EcoRI (от положения аминокислоты 46 до 85 SEQ ID NO:6) в конструкции, содержащейся в плазмиде с геном KGF, чтобы продуцировать конструкцию в плазмиде с геном KGF (dsd).
Фигура 6 изображает химически синтезированные OLIGO (олигонуклеотиды) (от OLIGO# 12 до OLIGO#24; SEQ ID NO:18-30 соответственно), применяемые для синтеза KGF (оптимизированного по кодону).
Фигура 7 изображает нуклеотидную (SEQ ID NO:31) и аминокислотную последовательности (SEQ ID NO:32) C(1,15)S, аналога KGF с заменами цистеина на серии в аминокислотных положениях 1 и 15 природного KGF.
Фигура 8 изображает нуклеотидную (SEQ ID NO:33) и аминокислотную последовательности (SEQ ID NO: 34) ΔN3/C(15)S, аналога KGF с делецией первых трех аминокислот на N-конце и заменой цистеина на серии в аминокислотном положении 15 природного KGF.
Фигура 9 изображает нуклеотидную (SEQ ID NO:35) и аминокислотную (SEQ ID NO: 36) последовательности ΔN3/C(15)-, аналога KGF, имеющего делению из первых 3 аминокислот на N-конце и делению цистеина в аминокислотном положении 15 природного KGF.
Фигура 10 изображает нуклеотидную (SEQ ID NO: 37) и аминокислотную (SEQ ID NO: 38) последовательности ΔN8/C(15)S, аналога KGF, имеющего делению из первых 8 аминокислот на N-конце и замену цистеина на серин в аминокислотном положении 15 природного KGF.
Фигура 11 изображает нуклеотидную (SEQ ID NO:39) и аминокислотную (SEQ ID NO: 40) последовательности ΔN8/C(15)-, аналога KGF, имеющего делению из первых 8 аминокислот на N-конце и делению цистеина в аминокислотном положении 15 природного KGF.
Фигура 12 изображает нуклеотидную (SEQ ID NO:41) и аминокислотную (SEQ ID NO: 42) последовательности ΔN15, аналога KGF, имеющего делецию из первых 15 аминокислот на N-конце природного KGF.
Фигура 13 изображает нуклеотидную (SEQ ID NO:43) и аминокислотную (SEQ ID NO: 44) последовательности ΔN16, аналога KGF, имеющего делецию первых 16 аминокислот на N-конце природного KGF.
Фигура 14 изображает нуклеотидную (SEQ ID NO:45) и аминокислотную (SEQ ID NO: 46) последовательности ΔN17, аналога KGF, имеющего делецию первых 17 аминокислот на N-конце природного KGF.
Фигура 15 изображает нуклеотидную (SEQ ID NO:47) и аминокислотную (SEQ ID NO: 48) последовательности ΔN18, аналога KGF, имеющего делецию первых 18 аминокислот на N-конце природного KGF.
Фигура 16 изображает нуклеотидную (SEQ ID NO:49) и аминокислотную (SEQ ID NO: 50) последовательности ΔN19, аналога KGF, имеющего делецию первых 19 аминокислот на N-конце природного KGF.
Фигура 17 изображает нуклеотидную (SEQ ID NO:51) и аминокислотную (SEQ ID NO: 52) последовательности ΔN20, аналога KGF, имеющего делецию первых 20 аминокислот на N-конце природного KGF.
Фигура 18 изображает нуклеотидную (SEQ ID NO:53) и аминокислотную (SEQ ID NO: 54) последовательности ΔN21, аналога KGF, имеющего делецию первых 21 аминокислот на N-конце природного KGF.
Фигура 19 изображает нуклеотидную (SEQ ID NO:55) и аминокислотную (SEQ ID NO: 56) последовательности ΔN22, аналога KGF, имеющего делецию первых 22 аминокислот на N-конце природного KGF.
Фигура 20 изображает нуклеотидную (SEQ ID NO:57) и аминокислотную (SEQ ID NO: 58) последовательности ΔN23, аналога KGF, имеющего делецию первых 23 аминокислот на N-конце природного KGF.
Фигура 21 изображает нуклеотидную (SEQ ID NO:59) и аминокислотную (SEQ ID NO: 60) последовательности ΔN24, аналога KGF, имеющего делецию первых 24 аминокислот на N-конце природного KGF.
Фигура 22 изображает нуклеотидную (SEQ ID NO:61) и аминокислотную (SEQ ID NO:62) последовательности C(1,15)S/R(144)E, аналога KGF, имеющего замены цистеина на серин в положениях аминокислот 1 и 15 и замену аргинина на глутаминовую кислоту в положении 144 аминокислоты природного KGF.
Фигура 23 изображает нуклеотидную (SEQ ID NO:63) и аминокислотную (SEQ ID NO:64) последовательности C(1,15)S/R(144)Q, аналога KGF, имеющего замены цистеина на серин в положениях 1 и 15 аминокислот и замену аргинина на глутамин в аминокислотном положении 144 природного KGF.
Фигура 24 изображает нуклеотидную (SEQ ID NO:65) и аминокислотную (SEQ ID NO: 66) последовательности ΔN23/R(144)Q, аналога KGF, имеющего делецию первых 23 аминокислот на N-конце и замену аргинина на глутамин в положении 144 аминокислоты природного KGF.
Фигура 25 изображает количество остающегося растворимым белка при хранении природного KGF и C(1,15)S в 20 мМ фосфате натрия, 0.15 М NaCl, pH 7.0 при 37oС в течение 27 часов.
Фигура 26 изображает количество остающегося растворимым белка при хранении природного KGF, ΔN15 и C(1,15)S в 50 мМ NaPO4, 0.15 M NaCl, pH 7.0 при 37oС в течение 27 часов.
Фигура 27 показывает количество растворимого белка природного KGF, C(1,15)S, C(1,15)S/R(144)E и C(1,15)S/R(144)Q, определенного методом вытеснительной ВЭЖХ по размеру частиц, в зависимости от времени термостатирования при 37oС.
Фигура 28 показывает расчетную температуру (Тm) в зависимости от pH природного KGF, C(1,15)S, C(1,15)S/R(144)Q и C(1,15)S/R(144)E.
Фигура 29 представляет собой типичный график митогенной активности C(1,15)S, определенной измерением включения [3H]-тимидина в процессе синтеза ДНК и сравнением его со стандартной кривой природного KGF.
Фигура 30 представляет собой типичный график митогенной активности ΔN15, определенной измерением включения [3H] -тимидина в процессе синтеза ДНК и сравнением его со стандартной кривой природного KGF.
Фигура 31 изображает типичный график митогенной активности ΔN23, определенной измерением включения [3H]-тимидина в процессе синтеза ДНК и сравнением его со стандартной кривой природного KGF.
Фигура 32 представляет собой типичный график митогенной активности ΔN23/R(144)Q, определенной измерением включения [3Н]-тимидина в процессе синтеза ДНК и сравнением его со стандартной кривой природного KGF.
Фигура 33 представляет собой типичный график митогенной активности C(1,15)S/R(144)Q, определенной измерением включения [3Н]-тимидина в процессе синтеза ДНК и сравнением его со стандартной кривой природного KGF.
Фигура 34 изображает типичный график митогенной активности C(1,15)S/R(144)E, определенной измерением включения [3Н]-тимидина в процессе синтеза ДНК и сравнением его со стандартной кривой природного KGF.
Фигура 35 изображает действие природного KGF, KGF-a, ΔN15, C(1,15)S и ΔN23 на химический состав сыворотки.
Фигура 36 изображает нуклеотидную (SEQ ID NO:77) и аминокислотную (SEQ ID NO: 78) последовательности C(1,15,40)S, аналога KGF, имеющего замену цистеина на серин в положениях аминокислот 1, 15 и 40 природного KGF.
Фигура 37 изображает нуклеотидную (SEQ ID NO:79) и аминокислотную (SEQ ID NO: 80) последовательности C(1,15,102)S, аналога KGF, имеющего замену цистеина на серин в положениях аминокислот 1, 15 и 102 природного KGF.
Фигура 38 изображает нуклеотидную (SEQ ID NO:81) и аминокислотную (SEQ ID NO:82) последовательности C(1,15,102,106)S, аналога KGF, имеющего замену цистеина на серин в положениях аминокислот 1, 15, 102 и 106 природного KGF.
Фигура 39 изображает нуклеотидную (SEQ ID NO:83) и аминокислотную (SEQ ID NO: 84) последовательности ΔN23/N(137)E, аналога KGF, имеющего делецию первых 23 аминокислот на N-конце и замену аспарагина на глутаминовую кислоту в положении 137 аминокислоты природного KGF.
Фигура 40 изображает нуклеотидную (SEQ ID NO:85) и аминокислотную (SEQ ID NO: 86) последовательности ΔN23/K(139)E, аналога KGF, имеющего делецию первых 23 аминокислот на N-конце и замену лизина на глутаминовую кислоту в положении 139 аминокислоты природного KGF.
Фигура 41 изображает нуклеотидную (SEQ ID NO:87) и аминокислотную (SEQ ID NО: 88) последовательности ΔN23/K(139)Q, аналога KGF, имеющего делецию первых 23 аминокислот на N-конце и замену лизина на глутамин в положении 139 аминокислоты природного KGF.
Фигура 42 изображает нуклеотидную (SEQ ID NO:89) и аминокислотную (SEQ ID NO: 90) последовательности ΔN23/R(144)A, аналога KGF, имеющего делецию первых 23 аминокислот на N-конце и замену аргинина на аланин в положении 144 аминокислоты природного KGF.
Фигура 43 изображает нуклеотидную (SEQ ID NO:91) и аминокислотную (SEQ ID NO: 92) последовательности ΔN23/R(144)E, аналога KGF, имеющего делецию первых 23 аминокислот на N-конце и замену аргинина на глутаминовую кислоту в положении 144 аминокислоты природного KGF.
Фигура 44 изображает нуклеотидную (SEQ ID NO:93) и аминокислотную (SEQ ID NO: 94) последовательности ΔN23/R(144)L, аналога KGF, имеющего делецию первых 23 аминокислот на N-конце и замену аргинина на лейцин в положении 144 аминокислоты природного KGF.
Фигура 45 изображает нуклеотидную (SEQ ID NO:95) и аминокислотную (SEQ ID NO: 96) последовательности ΔN23/K(147)E, аналога KGF, имеющего делецию первых 23 аминокислот на N-конце и замену лизина на глутаминовую кислоту в положении 147 аминокислоты природного KGF.
Фигура 46 изображает нуклеотидную (SEQ ID NO:97) и аминокислотную (SEQ ID NO: 98) последовательности ΔN23/K(147)Q, аналога KGF, имеющего делецию первых 23 аминокислот на N-конце и замену лизина на глутамин в положении 147 аминокислоты природного KGF.
Фигура 47 изображает нуклеотидную (SEQ ID NO:99) и аминокислотную (SEQ ID NO: 100) последовательности ΔN23/К(153)Е, аналога KGF, имеющего делецию первых 23 аминокислот на N-конце и замену лизина на глутаминовую кислоту в положении 153 аминокислоты природного KGF.
Фигура 48 изображает нуклеотидную (SEQ ID NO:101) и аминокислотную (SEQ ID NO: 102) последовательности ΔN23/K(153)Q, аналога KGF, имеющего делецию первых 23 аминокислот на N-конце и замену лизина на глутамин в положении 153 аминокислоты природного KGF.
Фигура 49 изображает нуклеотидную (SEQ ID NO:103) и аминокислотную (SEQ ID NO: 104) последовательности ΔN23/Q(152)E/K(153)E, аналога KGF, имеющего делецию первых 23 аминокислот на N-конце и замену глутамина на глутаминовую кислоту в положении 152 аминокислоты природного KGF и лизина на глутаминовую кислоту в положении 153 аминокислоты природного KGF.
Фигура 50 изображает действие ΔN23 на вызванный стрептозотоцином диабет у крыс Sprague-Dawley.
Подробное описание изобретения
В соответствии с данным изобретением получены новые аналоги KGF. В настоящее время найдено, что четыре цистеиновых остатка природного KGF (Cys1 и Cys15, Cys102 и Cys106) участвуют в образовании двух дисульфидных мостиков. Cys40 не участвует в образовании внутримолекулярной дисульфидной связи. Следовательно, KGF содержит две малых дисульфидных петли, разделенных почти 90 аминокислотами. Ясно, что определение того, какие остатки цистеина участвуют в дисульфидных мостиках, позволяет определить, какие цистеиновые остатки свободны, чтобы образовывать нежелательные межмолекулярные сшивания или внутримолекулярные связи, которые приводят к тому, что белок приобретает нежелательную третичную структуру (например, конформацию, которая уменьшает активность белка).
Удивительным является то, что, как было показано, модификация KGF с помощью делеций или замен аминокислотными остатками остатков цистеина, соответствующих положениям 1 и 15 KGF (положения 32 и 46 SEQ ID NO:2) дает аналог KGF со значительно повышенной устойчивостью (то есть уменьшаются проблемы, вызванные неподходящим раскручиванием, образованием межмолекулярных дисульфидных связей и агрегированием белковых молекул). Например, аналоги KGF обычно при очистке дают с большим выходом растворимый, правильный складчатый белок. Более того, после очистки он более устойчив в отношении рН, температуры и т. д. по сравнению с устойчивостью молекулы-предшественника. Хотя теоретически это не объяснено, полагают, что Cys1 и Cys15 KGF, помимо образования внутримолекулярного дисульфидного мостика и N-концевой дисульфидной петли, при определенных условиях также существуют в виде свободных цистеинов, которые способны образовывать межмолекулярные дисульфидные мостики, приводя к нестабильности белка и образованию агрегированных молекул. Более того, было обнаружено, что делеция N-концевой дисульфидной петли не является важной для рецепторного связывания или митогенной активности.
Так как это употребляется в данном изобретении "KGF-аналог" или "полипептидный аналог KGF" означают любой из описанных природных и искусственных полипептидов, отличающихся по структуре от KGF вследствие модификации пептидной последовательности, соответствующей 24 аминокислотам N-конца KGF (аминокислоты от 32 до 55 SEQ ID NO:2), в которой Cys1 и Cys15 KGF (аминокислоты от 32 до 46 SEQ ID NO:2) заменены или удалены. Способ, каким остатки цистеина заменены или удалены, не важен и включает, например, включение полипептидных аналогов или одну или более делеций аминокислот и/или замены. Следовательно, данное изобретение представляет семейство новых белков - факторов роста кератиноцитов. Эго семейство содержит несколько групп белков.
Одна группа KGF аналогов включает молекулы, в которых остатки цистеина в положениях 1 и 15 KGF заменены на аминокислоты, включающие такие, которые не встречаются в природных белках. Стратегия получения аналогов с заменами включает применение сайт-направленного мутагенеза (Но et al. (1989), Gene, 77: 51-59; Innis et at. "PRC Protocols", Academic Press, Inc., San Diego, CA). [KGF аналоги, содержащие аминокислотные замены, обозначают остатком, обнаруженным в этом положении в зрелом белке (минус сигнальная последовательность), изображенном в SEQ ID NO:2, далее идет положение этой аминокислоты в скобках и новая аминокислота, Например, аналог, включающий замену цистеина на серин в аминокислотном положении 15 KGF (положение 46 SEQ ID NO:2), обозначает "C(15)S"]. Предпочтительно, чтобы цистеин заменялся на нейтральные аминокислоты, такие как глицин, валин, аланин, лейцин, изолейцин, тирозин, фенилаланин, гистидин, триптофан, серин, треонин и метионин, при этом серин, треонин и аланин являются предпочтительными из-за их химического сходства с цистеином. В Примере 1 подробно рассказывается о получении C(1,15)S с использованием синтеза частичного гена (в сочетании с другими рекомбинантными методами) с последующей рекомбинантной экспрессией в стабильно трансформированном бактериальном хозяине.
Другая группа аналогов KGF включает молекулы, у которых из KGF удалены цистеиновые остатки в положениях 1 и 15. Для получения таких аналогов KGF может применяться различная стратегия, такая как N-терминальное усечение и сайт-специфические делеции, или их сочетание. "N-терминальное (концевое) усечение" относится к такой модификации KGF, при которой удалены от 1 до 24 N-концевые аминокислотные остатки KGF (аминокислоты от 32 до 55 SEQ ID NO: 2), включая Cys1 и Cys15. [Аналоги KGF с усечением аминокислот обозначаются в виде остатка, удаленного в этом положении зрелого белка (минус сигнальная последовательность), изображенного в SEQ ID NO:2, начиная с сайта делении, и количества удаленных остатков. Например, аналог KGF с N-терминальным усечением 24 остатков KGF (остатки 1-55 SEQ ID NO:2) будет обозначаться "ΔN24" аналог] . Конкретно входят в эту группу ΔN23 аналоги природного KGF, в которых один или более аминокислотных остатков 41-154 (аминокислоты 72-185 SEQ ID NO:2), конкретно включающие аминокислотные остатки 123-133 (аминокислоты 154-164 SEQ ID NO:2), удалены или заменены нейтральным остатком и отрицательно заряженным остатком, отобранным с целью воздействовать на белок с пониженным положительным зарядом. Предпочтительными, остатками для модификации являются Arg41, Gln43, Lys55, Lys95, Lys128, Asn137, Gln138, Lys139, Arg144, Lys147, Gln152, Lys153 или Thr154, при этом более предпочтительными являются Gln138, Lys139, Arg144, Lys147, Gln152 или Lys153, а наиболее предпочтительным является Arg144. Также в эту группу входят ΔN23 аналоги природного KGF с петлеобразующими модификациями на участке петлеобразования Asn115-His116-Tyr117-Asn118-Thr119 (аминокислоты 146-150 SEQ ID NO: 2), предпочтительно включающими модификацию с изменением заряда аминокислотного остатка 116, более предпочтительна замена на Gly в положении 116. Далее в эту группу ΔN23 аналогов природного KGF входят таковые с одной или более аминокислотными заменами, делециями или присоединениями на участке 123-133 (аминокислоты 154-164 SEQ ID NO:2) природного KGF.
В Примере 1 подробно описано получение систематических усечений N-конца, проводимых с применением синтеза частичного гена в сочетании с другими рекомбинантными методами с последующей рекомбинантной экспрессией в стабильно трансформированном бактериальном хозяине. Такие поясняющие примеры усечений N-конца включают от ΔN15 до ΔN24. Более того, в Примере 3 подробно описывается экспрессия в культуральных клетках млекопитающих ДНК, кодирующей природный KGF и гликозилированные изоформы с гетерогенным N-концом, очистка предпочтительной гликозилированной изоформы, имеющей N-терминальное усечение аминокислот 1-23 зрелой формы природного KGF.
Напротив, сайт-специфическая делеция относится к модификации KGF, в которой один или более аминокислотных остатков (например, Cys1 или Cys15) удаляются. Когда конкретно удалены Cys1 или Cys15 KGF, аналог короче KGF на одну аминокислоту. [KGF аналоги, имеющие делецию аминокислот, обозначают по остатку, находящемуся в этом положении в зрелом белке (минус сигнальная последовательность), изображенном на SEQ ID NO:2, далее следует положение этой аминокислоты в скобках и знак "минус". Например, аналог из этой группы, имеющий делению цистеина в положении 15 KGF (положение 36 SEQ ID NO:2), обозначается "С(15)-"]. Сайт-специфические делеции могут быть проведены с использованием сайт-направленного мутагенеза, как описано выше.
Также входят в эту группу аналоги, в которых Cys1 и Cys15 KGF удалены усечением или делецией. Например, представитель KGF аналогов имеет усечение первых трех остатков на N-конце (Cys-Asn-Asp) KGF или усечение первых восьми аминокислот (Cys-Asn-Asp-Met-Thr-Pro-Glu-Gln) KGF вместе с делецией цистеина в положении 15 аминокислоты KGF (эти аналоги обозначаются ΔN3/C(15)- и ΔN8/C(15)- соответственно). Так как остаток метионина находится в природном KGF в четвертом и пятом положении аминокислоты, не требуется дополнительного метионинового кодона, чтобы стала возможной надлежащая инициация трансляции.
Еще одна группа включает молекулы, в которых остатки цистеина в положениях 1 и 15 KGF замещены с помощью усечения или замены. Например, представителями KGF аналогов являются ΔN3/C(15)S и ΔN8/C(15)S. Такие аналоги имеют усечение первых трех аминоконцевых остатков KGF или делецию первых восьми аминоконцевых остатков KGF вместе с заменой цистеина в аминокислотном положении 15 на другую аминокислоту, например серин.
Когда KGF аналоги получают биологическим путем, т.е. они являются продуктами клеточной экспрессии в противоположность продуктам синтеза в твердом состоянии, производными, полученными из природных продуктов с помощью протеолиза или энзимов и т.д., нуклеиновые кислоты, кодирующие такие полипептиды, будут иметь один или более нуклеотидов, отличных по сравнению с нуклеотидной последовательностью природного KGF. Такие полинуклеотиды могут экспрессировать и образующийся полипептид может очищаться любым из технологических методов рекомбинантной ДНК, известных специалистам.
Последовательности ДНК, кодирующей аналоги KGF, полностью или частично могут, среди прочих, иметь включение кодонов, "предпочтительных" для экспрессии в выбранных "клетках-хозяевах" (например, "колоны для экспрессии в Е. coli"); наличие сайтов расщепления рестриктазами и наличие дополнительных инициационных (начальных), терминирующей или промежуточной нуклеотидных последовательностей (например, инициационный метиониновый кодон для экспрессии в Е. coli клетках) для облегчения построения легко экспрессируемых векторов.
Настоящее изобретение также предоставляет рекомбинантные молекулы или векторы для применения в способе экспрессии полипептидов. Такие векторы могут представлять собой ДНК или РНК и могут быть по природе кольцевыми (циклическими), линейными, одноцепочечными или двухцепочечными и могут быть природными или собранными из ряда компонентов, природных или синтетических.
Известно много примеров таких экспрессирующих векторов. Компоненты векторов, например репликоны, маркерные гены, энхансеры, промоторы, и тому подобное, могут быть получены из природных источников или синтезированы известными методами. В каждом случае экспрессирующие векторы, применимые в данном изобретении, должны содержать, по крайней мере, один элемент, контролирующий экспрессию, функционально ассоциированный с внедренной молекулой нуклеиновой кислоты, кодирующий полипептидный аналог KGF. Этот контролирующий элемент ответственен за регулирование экспрессии полипептида при участии молекул нуклеиновых кислот по данному изобретению. Применяемые контролирующие элементы включают, например, lac систему, trp систему, операторы и промоторы из фага λ, промотор гликолитических дрожжей, промотор гена кислой фосфатазы дрожжей, фактор α-спаривания дрожжей и промоторы, полученные из аденовируса, вируса Эпштейна-Барра, полиомы, обезьяньего вируса, а также таковые различных ретровирусов. Однако многие другие векторы и контролирующие элементы, подходящие для прокариотической и эукариотической экспрессии, известны в технике и могут применяться в практической деятельности по данному изобретению.
Примеры соответствующих клонирующих векторов прокариот могут включать плазмиды из Е. coli (например, pBR322, col Е1, pUC и F-фактор), при этом предпочтительными плазмидами являются pCFM1156 (ATCC 69702), pCFM1656 (ATCC 69576) и pCFM3102 (описанные в разделе "Примеры", ниже). Другие подходящие экспрессирующие векторы, многочисленные типы которых, известные в практике экспрессии в клетках млекопитающих, насекомых, дрожжей, грибов и бактерий, также могут быть применены для этой цели. Трансфекция этих векторов в соответствующую клетку-хозяина может вызвать экспрессию полипептидов - аналогов KGF.
Микроорганизмы-хозяева, применимые по данному изобретению, могут быть как прокариотическими, так и эукариотическими. Соответствующие прокариотические хозяева включают различные Е. coli (например, FM5, НВ101, DH5α, DH10 и МС1061), штаммы Pseudomonas, Bacillus, Streptomyces, при этом Е. coli является предпочтительным. Соответствующие эукариотические клетки-хозяева включают дрожжи и другие грибки, клетки насекомых, растительные клетки и животные клетки, такие как COS (например, COS-1 и COS-7) и CV-1 клеточной линии обезьян, линии 3Т3, образованные из Swiss, Balb-c или NIH клеток, HeLa и L-929 мышиные клетки, и СНО, ВНК и НаК клетки хомяка. В зависимости от того, что выступает в роли хозяина, рекомбинантные полидептиды, продуцированные в соответствии с этим (с данным изобретением), могут быть гликозилированы животными (млекопитающими) или другими эукариотическими углеводами или могут быть не гликозилированы.
Предпочтительный способ получения может меняться в зависимости от многих факторов и соображений; оптимальная для данной ситуации методика получения будет очевидна для опытного специалиста после минимального количества экспериментов. Конечный продукт экспрессии может быть затем очищен до состояния, близкого гомогенному, с применением известных в технике методик. Типичная методика получения с помощью прокариотических клеток включает разрушение клеточных стенок под высоким давлением или другими способами: центрифугирование или фильтрование с целью удаления осколков (остатков) клеток с последующей ионообменной хроматографией надосадочной жидкости или фильтрата и, наконец, хроматография на гидрофобном носителе. Если аналог экспрессирует в нерастворимом виде, другая методика очистки включает сначала растворение телец включения, содержащих аналоги, с последующей ионообменной хроматографией, затем развертывание (раскручивание) белка и, наконец, хроматографию на гидрофобном носителе. Примеры методик очистки раскрыты в заявке общего обладания U.S.S.N. 08/323,339, поданной 13 октября 1994 г.). В целом U.S.S.N. 08/323,339 раскрывает способ очистки факторов роста кератиноцитов, заключающийся в: а) получении раствора, содержащего KGF; b) связывании KGP из раствора по пункту (а) с катионообменной смолой; с) элюции KGF раствором элюата с катионообменной смолой; d) или пропускании элюирующего раствора по пункту (с) через соответствующую колонку для вытеснительной хроматографии по молекулярному весу или в процессе хроматографирования раствора элюата по пункту (с) на гидрофобном носителе; е) регенерации KGF с колонки для вытеснительной хроматографии по молекулярному весу или с гидрофобного носителя.
Конечно, аналоги могут быть легко обследованы с целью оценки их физических свойств. В разделе Примеров приведены различные хорошо известные методы анализа стабильности, хотя специфический анализ, применяемый для испытания аналога, не является необходимым. Более того, уровень (величина) биологической активности (например, рецепторное связывание и/или сродство, митогенная активность, активность клеточной пролиферации и/или активность in vivo) может быть также определен различными методами, некоторые из которых представлены в разделе Примеров. Многие методы анализа хорошо известны и могут быть применены для быстрого обследования KGF аналогов с целью определения, обладают ли они или нет приемлемой биологической активностью. Один такой метод анализа специфически проверяет KGF аналоги на способность связываться с KGF рецептором (KGFR) с помощью конкурентного 125I-KGF связывания (Bottaro et al. (1990), J. Biol. Chem., 265:12767-12770; Ron et al. (1993), J. Biol. Chem., 268:2984-2988). Альтернативный способ анализа взаимодействий KGFR/KGF аналога включает применение таких методов, как (анализ) определение действительного (реального) времени биоспецифического взаимодействия (BIA) (Felder et al. (1993), Molecular and Cellular Biology, 13:1449-1455). Кроме этого, для определения способности аналогов KGF стимулировать синтез ДНК может быть применен митогенный анализ (Rubin et al. (1989), supra). Наконец, анализы клеточной пролиферации могут быть применены для определения способности KGF аналогов стимулировать пролиферацию клеток (Falco et al. (1988), Oncogene, 2:573-578). Используя любую из вышеупомянутых аналитических систем, можно быстро обследовать аналоги KGF на их биологическую активность.
В предпочтительном варианте воплощения изобретения данное изобретение касается (относится, описывает) тех аналогов KGF, которые сохраняют полную (т. е. , по меньшей мере, практически такую же) in vitro и in vivo биологическую активность природного KGF. Примерами аналогов KGF с такими свойствами, определенными с помощью одного или более вышеприведенных анализов, являются C(1,15)S, ΔN3/C(15)S, ΔN3/C(15)-, ΔN8/C(15)S, ΔN8/C(15)-, ΔN15, ΔN16, ΔN17, ΔN18, ΔN19, ΔN20, ΔN21, ΔN22, ΔN23, ΔN24 или ΔN23/R(144)Q.
Аналоги KGF могут быть дополнительно модифицированы так, что в их составе будут дополнительные химические остатки, обычно не входящие в пептид. Такие производные остатки (частицы) могут повышать растворимость, абсорбцию, период биологического полураспада и тому подобные свойства KGF аналога. Или же частицы (остатки) могут устранять или уменьшать нежелательные побочные эффекты белка и тому подобное. Частицы (остатки), способные опосредовать такие эффекты, раскрыты, например, в REMINGTON'S PHARMACEUTICAL SCIENCES, 18th ed. , Mack Publishing Co., Easton, PA (1990). Ковалентные модификации могут быть введены в молекулу реакцией нацеленных аминокислотных остатков пептида с образующим органические производные агентом, который способен реагировать с отобранными боковыми цепями или концевыми остатками (Т.Е. Creighton (1983), PROTEINS: STRUCTURE AND MOLECULE PROPERTIES, W.H. Freeman and Co. , San Francisco, pp. 79-86). Полиэтиленгликоль ("PEG") является одним из химических соединений, примененных для приготовления терапевтических белковых продуктов. Было показано, что присоединение остатков полиэтиленгликоля предохраняет некоторые белки от протеолиза, Sada et al. (1991), J. Fermentation Bioengineering, 71:137-139, и способы присоединения некоторых остатков полиэтиленгликоля доступны. См. Патент США 4,179,337, Davis et al., "Non-Immunogenic Polypeptides", выдан 18 декабря 1979 г.; и Патент США 4,002,531, Royer, "Modifying enzymes with Polyethylene Glycol and Product Produced Thereby", выдан 11 января 1977. Обзор см. Abuchowski et al., в Enzymes as Drugs. (Holcerberg and Roberts (eds.) pp.367-383 (1981)). Различные способы были использованы для присоединения молекул полиэтиленгликоля к белку. Обычно молекулы полиэтиленгликоля связываются с белком с помощью реакционноспособной группы, находящейся в белке. Аминогруппы, такие как таковые остатков лизина или на N-конце, удобны (применимы) для такого присоединения. Например, Royer (Патент США 4,002,531, см. выше) утверждает, что для присоединения молекул полиэтиленгликоля к энзиму было применено восстановительное алкилирование. ЕП 0 539 167, опубликованный 28 апреля 1993 г., Wright, "Peg Imidates and Protein Derivates Thereof" утверждает, что пептиды и органические соединения со свободной(ыми) аминогруппой(ами) модифицируются имидатами PEG или соответствующих растворимых в воде органических полимеров. Пат. США 4,904,584, Shaw, выдан 27 февраля 1990 г., относит модификацию ряда остатков лизина в белках за счет присоединения молекул полиэтиленгликоля с помощью реакционноспособных аминогрупп.
Еще в одном варианте воплощения данное изобретение описывает однократное введение единицы: медицинской рецептуры, которая может быть безопасно введена парентерально или орально для лечения заболевания у теплокровных животных (таких как человек). Такие медицинские рецептуры могут быть в форме лиофилизованного или иным способом дегидратированного терапевтического или диагностического средства, которое может быть воссоздано прибавлением физиологически приемлемого растворителя. Растворителем может быть любая среда, такая как стерилизованная вода, физиологический раствор, раствор глюкозы или других водных углеводов (например, полиолов, таких как маннит, ксилит или глицерин), который способен растворять сухую композицию, совместим с выбранным путем введения и не действует отрицательно на активное начало и на применяемые стабилизаторы воссоздания. В специфическом (конкретном) воплощении настоящее изобретение предлагает набор для однократного введения дозы лекарства. Набор содержит как первую упаковку с сухим белком, так и вторую упаковку с водной рецептурой, содержащей стабилизатор воспроизведения. Что касается концентрации белка в растворе, объема раствора в каждой упаковке и вместимости (всех) упаковок (взаимосвязанные параметры, которые могут соответственным образом модифицироваться в зависимости от заданной концентрации активного начала в единице конечной дозы), то они могут меняться в интервале, хорошо известном специалистам.
KGF аналоги по данному изобретению могут быть применены как терапевтические и диагностические агенты, так и как реагенты для исследования. Таким образом, аналоги KGF могут быть применены для in vitro и/или in vivo диагностических проб с целью количественного определения KGF в образце ткани или органа или определения и/или выделения клеток, которые экспрессируют KGFR (Bottaro et al. (1990), J. Biol. Chem., 265:12767-12770; Ron et al. (1993), J. Biol. Chem., 268:2984-2988). При анализе тканей или органов радиоактивность в результате связывания 125I-KGF аналога с KGFR меньше по сравнению со значением на стандартной кривой связывания 125I-KGF аналога вследствие связывания немеченого природного KGF с KGFR. Подобным образом 125I-KGF аналог может быть применен для определения наличия KGFR в различных типах клеток.
Данное изобретение также рассматривает применение аналога KGF для получения антител против пептида, эти антитела также связаны с природным KGF. В данном воплощении изобретения антитела являются по происхождению моноклональными или поликлональными и получаются с применением KGF аналога. Образующиеся антитела связываются преимущественно с природным KGF, предпочтительно когда этот белок находится в своей природной (биологически активной) конформации. Эти антитела могут быть применены для определения или очистки природного KGF.
Более того, данное изобретение рассматривает использование аналогов KGF для открытия KGF-связывающих молекул с высоким и низким сродством, имеющих терапевтическое применение, например, для эффективной доставки KGF или в качестве ингибитора активности KGF. Терапевтическая устойчивость аналогов KGF важна для идентификации таких связывающих молекул в физиологических условиях (т. е. при 37oС), так как их сродство к KGF может сильно зависеть от температуры и может быть непредсказуемо, исходя из сродства при 4oС.
Для применения in vivo KGF аналоги могут составляться в рецептуре с добавками. Такие добавки включают буферы, носители, стабилизаторы, наполнители, консерванты, тонизирующие агенты, антиоксиданты и тому подобное (например, агенты, коррелирующие вязкость, или (сухие) разбавители). Выбор специфических добавок зависит от формы хранения (т.е. жидкая или лиофилизованная) и способа введения аналога KGF. Соответствующие рецептуры, известные в технике, можно найти в REMINGTON'S PHARMACEUTICAL SCIENCES (последнее издание), Mack Publishing Company, Easton, PA.
Аналоги KGF могут применяться в терапевтически действенных количествах для тканей, специфически характеризующихся как имеющие поражение или имеющие клинический недостаток нефибробластных эпителиальных клеток. Области, в которых аналоги KGF могут с успехом применяться, включают, но не ограничиваются этим: стимуляцию, пролиферацию и дифференцировку придаточных структур, таких как фолликулы волос, потовые железы, сальные железы у больных с ожогами и другими поражениями всего или части слоя; ускоренная реэпителизация повреждений, вызванных врожденным буллезным эпидермолизом, который является дефектом сращивания (плотного соединения) эпидермиса с расположенной ниже дермой, приводит часто к открытым болезненным водяным пузырям (волдырям), которые могут вызвать сильное болезненное состояние; предотвращение вызванного химиотерапией облысения и лечение характерного для мужчин облысения или ускоренной потери волос у мужчин и женщин; лечение язвы желудка и двенадцатиперстной кишки; лечение воспалительных заболеваний пищеварительного тракта, таких как болезнь Крона (поражающая первоначально тонкую кишку) и язвенный колит (поражающий первоначально толстую кишку); предотвращение или снижение токсичности в кишках во время облучения и химиотерапии вследствие лечения (например, предварительного или последующего) с целью защиты или регенерации клеток или для того и другого; стимуляция образования слизи в желудочно-кишечном тракте; стимулирование пролиферации и дифференцировки пневмоцитов II типа, что может помочь при лечении или предотвращении таких заболеваний, как гиалиново-мембранная болезнь новорожденных (т.е. синдром нарушения дыхания у младенцев и бронхо-легочная дисплазия); стимуляция пролиферации и дифференцировки эпителия бронхиол и/или альвеол при остром и хроническом (поражении) заболевании легких или недостаточности вследствие нарушения дыхания (включая высокое содержание кислорода), эмфиземе, применением поражающих легкие химиотерапевтических средств; травме при искусственном дыхании и других, поражающих легкие обстоятельствах; повышение функции печени с целью лечения или предотвращения цирроза печени, внезапного поражения печени, поражения, вызванного острым вирусным гепатитом и/или токсическими поражениями печени; стимуляция регенерации клеток роговицы (корнеальных), например, при лечении корнеального поражения (абрации); стимуляция регенерации эпителиальных клеток с целью лечения прогрессирующего заболевания десен; стимуляция регенерации эпителиальных клеток барабанных перепонок при лечении болезни среднего уха и лечение или предотвращение случаев сахарного диабета или в качестве вспомогательного средства при трансплантации клеток островков (инсуляторных).
Больному, нуждающемуся в пролиферации нефибробластных эпителиальных клеток, можно вводить эффективное количество KGF аналога. "Эффективное количество" представляет собой такое количество KGF аналога, которое требуется, чтобы добиться заданной (нужной) реакции у больного, подвергаемого лечению, и, таким образом, определяется обычно лечащим врачом. Факторы, влияющие на количество вводимого аналога KGF, включают возраст и общее состояние больного, заболевание, подвергаемое лечению, и т.д. Типичные дозы лежат в интервале от 0,001 мг/кг веса тела до 500 мг/кг веса тела.
Аналог KGF может безопасно вводиться парентерально (например, via IV, IТ, IM, SC или IP путем), перорально или наружно теплокровным животным (таким как человек). Аналоги KGF могут применяться путем однократного или многократного введения в зависимости от заболевания и состояния больного. В некоторых случаях аналог KGF может вводиться как дополнение к другой терапии и также с другими фармацевтическими препаратами.
Следующие примеры включены, чтобы полнее проиллюстрировать настоящее изобретение. Понятно, что в представленных методиках могут быть сделаны модификации без отхода от духа данного изобретения.
ПРИМЕРЫ
Стандартные способы для многих процедур, описанных в следующих примерах, или соответствующие альтернативные процедуры приведены в широко известных учебниках по молекулярной биологии, таких как, например, Molecular Cloning, Second Edition, Sambrook et al., Cold Spring Harbor Laboratory Press (1987) и Current Protocols in Molecular Biology, Ausabel et al., Green Publishing Associates/Wiley-Interscience, New York (1990).
Пример 1: Получение ДНК, кодирующей KGF и аналоги KGF
Клонирование полноразмерного гена KGF человека (кодирующего полипептид с последовательностью природного KGF) было проведено как с помощью полимеразной цепной реакции (PCR) РНК из животной клетки, так и с помощью PCR синтезированных химически (E. coli, оптимизированных по кодону) олигонуклеотидов ("OLIGO"). Обе процедуры описаны ниже:
Была осуществлена PCR амплификация с применением РНК, выделенной из клеток, о которых известно, что они продуцируют полипептид. Сначала клетки из клеточной линии фибробластов человека AG1523A (полученных из Human Genetic Mutant Cell Culture Repository Institute For Medical Research, Camden, New Jersey) разрушали с помощью гуанидинтиоцианата с последующей экстракцией (в соответствии со способом Chomyzinski et al. (1987), Anal. Biochem., 172: 156). Используя стандартный протокол обратной транскриптазы для тотальной РНК, получили кДНК KGF. PCR (PCR#1) амплификацию гена KGF проводили, применяя KGF в качестве матрицы кДНК KGF, и праймеры OLIGO#1 и OLIGO#2, которые кодируют последовательности ДНК непосредственно на 5' и 3' концах гена KGF [Model 9600 Thermocycler (Perkin-Elmer Cetus, Norwalk, CT); 28 циклов; каждый цикл состоит из денатурации в течение одной минуты при 94oС, гибридизации (отжиге) в течение двух минут при 60oС и элонгации в течение трех минут при 72oС]. Малую аликвоту PCR#1 продукта затем использовали в качестве матрицы для второй PCR (PCR#2) амплификации KGF, идентичной по условиям циклов описанным выше, за исключением того, что гибридизацию проводят при 50oС. Для экспрессирующего клонирования гена KGF загруженные (вставленные) PCR праймеры были использованы для создания соответствующих сайтов рестрикции по обоим концам гена KGF. Для модифицикации ДНК KGF продукта из PCR#2 с целью включения MluI и BamHI сайтов рестрикции на 5' и 3' концах гена были применены OLIGO# 3 и OLIGO#4 соответственно [PCR#3; 30 циклов; каждый цикл состоит из одной минуты при 94oС (денатурация); двух минут при 60oС для гибридизации и трех минут при 72oС для элонгации]. Эта ДНК была соответствующим образом разрезана с помощью MluI и BamHI, экстрагирована фенолом и высаждена этанолом. Затем она вновь была суспендирована и
лигирована (с применением Т4 лигазы) в плазмиду pCFM1156 (Фигура 2А), которая содержала "RSH" сигнальную последовательность с целью создания конструкции RSH-KGF (фигура 3).
Продукты лигирования были преобразованы (по способу Hanahan (1983), J. Mol. Biol., 166:557) в штамм FM5 Е. coli (ATCC:53911) и помещены в LB+kanamycin при 28oС. Было отобрано несколько трансформантов и выращено в малом количестве жидких культур, содержащих 20 μг/мл канамицина. Плазмиду RSH-KGF отделили от клеток каждой культуры и ДНК секвенировали. Из-за внутреннего сайга NdeI в гене KGF невозможно было непосредственное клонирование последовательности природного гена в заданный экспрессирующий вектор с упомянутыми сайтами рестрикции NdeI и BamHI. Это было выполнено с помощью лигирования трех частей. Плазмиду RSH-KGF разрезали уникальными сайтами рестрикции BsmI и SstI, и фрагмент ДНК ~3 kpb (содержащий 3' конец гена KGF) выделяли с последующим электрофорезом на 1% агарозном геле. Проводили PCR (PCR# 4), как описано для PCR#3, за исключением замены OLIGO#3 на OLIGO#5. ДНК KGF продукт затем разрезали NdeI и BsmI и выделяли фрагмент ДНК 311 pb с последующим электрофорезом на 4% агарозном геле. Третий отрезок лигирования представлял собой фрагмент ДНК 1.8 kpb pCFM1156, разрезанной NdeI и SstI с последующим электрофорезом на 1% агарозном геле. После лигирования (Т4), трансформации, (селекции) отбора с помощью канамицина и секвенирования ДНК, как описано выше, был отобран клон, содержащий конструкцию, изображенную на Фигуре 4, и плазмиду, обозначенную KGF. Из-за внутреннего сайта связывания рибосомы, которая продуцирует усеченный продукт, последовательность ДНК KGF между уникальными сайтами KpnI и EcoRI была замещена на химически синтезированные OLIGO (от OLIGO#6 до OLIGO#11) с целью свести к минимуму применения внутреннего сайта инициации (Фигура 5) (см. последовательность 1 в конце описания).
OLIGO были фосфорилированы Т4 полинуклеотидкиназой и затем денатурированы при нагревании. Однонитевые (ss) OLIGO образовывали фрагмент ds ДНК при медленном снижении температуры до комнатной. Затем была применена Т4 лигаза для ковалентного связывания внутренних липких концов и целого фрагмента ds OLIGO с KGF плазмидой, разрезанной KpnI и EcoRI. Новая плазмида обозначена KGF(dsd).
Полностью Е. coli оптимизированный по кодону ген KGP был конструирован с помощью PCR амплификации химически синтезированных OLIGO от #12 до #24 (см. последовательность 2).
OLIGO от #12 до #24 были замыслены так, чтобы последовательность полной ДНК, кодирующей природный KGF, была представлена OLIGO либо нити "Ватсон", либо нити "Крик" и PCR амплификация даст последовательность заданной двухнитевой ДНК (Фигура 6) [PCR#5, Model 9600 thermocycler (Perkin-Elmer Cetus); 21 цикл, причем каждый цикл состоит из денатурации при 94oС в течение 31 секунды, гибридизации при 50oС в течение 31 секунды и элонгации при 73oС в течение 31 секунды; после 21 цикла PCR была завершена после конечной стадии элонгации в течение 7 минут]. После PCR амплификации фрагмент ДНК был разрезан XbaI и BamHI и фрагмент 521 pb был лигирован в экспрессирующую плазмиду pCFM1156, разрезанную теми же энзимами. PCR#5 использовала внешние праймеры (100 пмоль/100 μл r•n) OLIGO#12 и OLIGO#13 и 1 μл/100 μл r•n KGF матрицы, полученной лигированием (с помощью Т4 лигазы) от OLIGO#14 до OLIGO#19 (от OLIGO# 15 до OLIGO#18 были фосфорилированы Т4 полинуклеотидкиназой) с использованием от OLIGO#20 до OLIGO#24 в качестве вспомогательных олигонуклеотидов (Jayaraman et at. (1992), Biotechniques, 12:392) для лигирования. Была построена конструкция KGF (оптимизированный по кодону).
Все описанные здесь аналоги KGF составлены частично из последовательностей ДНК, обнаруженных в KGF (dsd), или KGF (оптимизированном по кодону), или из их комбинации. Последовательности дополнительно модифицированы внедрением в соответствующие сайты рестрикции последовательностей ДНК, которые кодируют аминокислоты (особенного) конкретного аналога KGF, полученного с применением одного или более вышеописанных методов синтеза фрагмента ДНК. Любой из аналогов может быть получен полностью (во всей полноте) с помощью вышеописанных методов. Однако, как часть общего OLIGO дизайна, где можно, применялись Е. coli, оптимизированные в отношении кодона, хотя наличие Е. coli, оптимизированных по кодону, в любом из изученных генов в части или в целом незначительно увеличило выход белка, который можно было получить из культуральных бактериальных клеток. Фигуры от 7 до 24 и от 37 до 50 представляют соответствующие примеры конструкций нуклеотидной и аминокислотной последовательности конкретного аналога KGF: C(1,15)S (Фигура 7); ΔN3/C(15)S (Фигура 8); ΔN3/C(15) (Фигура 9); ΔN8/C(15)S (Фигура 10); ΔN8/C(15) (Фигура 11); ΔN15 (Фигура 12); ΔN16 (Фигура 13); ΔN17 (Фигура 14); ΔN18 (Фигура 15); ΔN19 (Фигура 16); ΔN20 (Фигура 17); ΔN21 (Фигура 18); ΔN22 (Фигура 19); ΔN23 (Фигура 20); ΔN24 (Фигура 21); C(1,15)S/R(144)E (Фигура 22); C(1,15)S/R(144)Q (Фигура 23); DN23/R(144)Q (Фигура 24); C(1,15,40)S (Фигура 36); C(1,15,102)S (Фигура 37); С(1,15,102,106)S (Фигура 38); DN23/N(137)E (Фигура 39); DN23/K(139)E (Фигура 40); DN23/K(139)Q (Фигура 41); DN23/R(144)A (Фигура 42); DN23/R(144)E (Фигура 43); DN23/R(144)L (Фигура 44); DN23/K(147)E (Фигура 45); DN23/K(147)Q (Фигура 46); DN23/K(153)E (Фигура 47); DN23/K(153)Q (Фигура 48) и DN23/Q(152)/K(153)E (Фигура 49). Все конструкции аналогов KGF, описанные здесь, представляли собой подтвержденную последовательность ДНК.
Пример 2: Продуцирование в Е. coli
А. Экспрессия аналогов KGF
При клонировании генов аналогов KGF были применены три различных экспрессирующих плазмиды. Они представляли собой pCFM1156 (АТСС 69702), pCFM1656 (АТСС 69576) и pCFM3102 (Фигуры 2А, 2В и 2С соответственно). Плазмида р3102 может быть получена из плазмиды pCFM1156 путем ряда сайт-направленных основных изменений с помощью PCR перекрывающегося олигонуклеотидного мутагенеза. Начиная с сайта BglII (плазмида pCFM1656 bp #180) непосредственно 5 -конца до промотора плазмидной репликации, РсорB, и до генов плазмидной репликации, изменения пар оснований, см. в последовательности 3.
-конца до промотора плазмидной репликации, РсорB, и до генов плазмидной репликации, изменения пар оснований, см. в последовательности 3.
Как видно, pCFM1156, pCFM1656 и pCFM3102 очень похожи друг на друга и содержат много одинаковых сайтов рестрикции. Плазмиды выбирали исходя из удобства, и компоненты векторов ДНК могут быть легко изменены в целях новых конструкций. Хозяин, применявшийся для общего (всего) клонирования, представлял собой штамм FM5 Е. coli (ATCC:53911) и трансформации проводили (по способу Hanahan (1983), supra) или с помощью электроэлюции с применением Gene PulserТм аппарата для трансфекции (BioRad Laboraties, Inc., Hercules, CA) в соответствии с инструкциями производителя.
Сначала был инициирован малый свежевыращенный инокулят заданных рекомбинантных клеток Е. соli, содержащий заданную конструкцию на одном из трех pCFM векторов, переносом 0.1 мл соответствующего штамма исходного продукта, замороженного в глицерине, в 2 л сосуд, содержащий 500 мл бульона Лурия. Культуру встряхивали (трясли) при 30oС в течение 16 часов, после чего культуру перенесли в 15 л ферментер, содержащий 8 л партию стерильной среды (Tsai, et al. (1987), J. Industrial Microbiol., 2:181-187).
Ферментацию с периодической подпиткой начали с Подпитки # 1 в качестве среды (Tsai, et al. (1987), supra). Когда OD600 достигло 35, индуцировали экспрессию заданного аналога KGF быстрым подъемом температуры культуры до 42oС с целью денатурировать CI (белок) - репрессор. Вместо Подпитки 1 дали Подпитку 2, начальная скорость прибавления ее составляла 300 мл/час. Подпитка 2 содержала 175 г/л триптиказпептона, 87.5 г/л дрожжевого экстракта и 260 г/л глюкозы. Через один час при 42oС температуру культуры снизили до 36oС и затем эту температуру поддерживали в течение 6 часов.
Затем ферментацию прекратили и клетки собирали центрифугированием в пластиковые емкости, помещенные внутри 1 л сосудов в центрифуге. Клетки высаждали центрифугированием при 400 об/мин в течение 60 минут, после чего надосадочную жидкость удаляли и клеточную пасту замораживали при -90oС.
После экспрессии различных аналогов KGF в Е. coli природные KGF, C(1,15)S, C(1,15)S/R(144)E, C(1,15)S/R(144)Q, ΔN15, ΔN23 и ΔN23/R(144)Q белки очищали, используя следующие приемы. Клеточную пасту после ферментации с высокой плотностью клеток суспендировали при 4oС в 0.2 М NaCl, 20 мМ NaPO4, pH 7.5 в виде 10-20% раствора (вес в объеме), используя смеситель с высоким сдвигом. Взвешенные клетки затем лизировали, трижды пропуская раствор через гомогенизатор (APV Gaulin, Inc., Everett, MA). Вытекающий гомогенат охлаждали до 4-8oС, применяя соответствующий теплообменник. Примеси удаляли, центрифугируя лизат в центрифуге J-6BТM (Beckman Instruments, Inc., Brea, СА), снабженной ротором JS 4.2 со скоростью 4200 об/мин в течение 30-60 минут при 4oС. Надосадочные жидкости осторожно декантировали и наносили на предварительно подготовленную колонку на 450 мл (5 см • 23 см) со смолой S-Sepharose Fast FlowТM (Pharmacia), уравновешанной 0.2 М NaCl, 20 мМ NaPO4, pH 7.5 при 4oС. Далее колонку промывали пятью ее объемами (2250 мл) 0.4 М NaCl, 20 мМ NaPO4, pH 7.5 при 4oС. Заданный белок элюировали, промывая колонку 5 л 0.5 М NaCl, 20 мМ NaPO4, pH 7.5. Собирали фракции по 50 мл и в вытекающей жидкости постоянно контролировали А280. Фракции, в которых по А280 обнаруживали наличие элюированного материала, анализировали затем с помощью SDS-PAGE на 14% геле для подтверждения наличия заданного полипептида.
Затем фракции, содержащие белки, представляющие интерес, объединяли и разбавляли равным объемом дистиллированной воды. Затем разбавленный образец наносили на предварительно подготовленную колонку на 450 мл (5 см • 23 см) с S-Sepharose Fast Flow, уравновешенной 0.4 М NaCl, 20 мМ NaPO4, pH 6.8 при 4oС. Колонку промывали 2250 мл 0.4 М NaCl, 20 мМ NaPO4, pH 6.8 и белок элюировали, применяя 20 объемов колонки, в линейном градиенте концентрации от 0.4 М NaCl, 20 мМ NaPO4, pH 6.8 до 0.6 М NaCl, 20 мМ NaPO4, pH 6.8. Опять собирали фракции по 50 мл при постоянном контроле A280 в вытекающей жидкости. Фракции, содержащие белок (определяемый 14% SDS-PAGE), объединяли с последующим концентрированием через YM-10 мембрану (молекулярный вес сечения мембраны 10 000) в 350 мл сосуде с перемешиванием (Amicon, Inc., Mayberry, MA) до объема 30-40 мл.
Концентрат затем наносили на предварительно сделанную колонку 1300 мл (4.4•85 см) со смолой Superdex-75ТМ (Pharmacia), уравновешенной с колоночным буфером, содержащим 1X PBS (физиологический раствор, "забуференный" фосфатом, Дальбекко, "D-PBS", не содержащий кальция и магния) или 0.15 М NaCl, 20 мМ NaPO4, pH 7.0. После нанесения образца на колонку белок элюировали гель-фильтрацией, используя буфер для колонки. Затем собирали фракции по 10 мл и таковые, содержащие аналог (обнаруженный с помощью 14% SDS-PAGE), объединяли. Обычно концентрация белка была примерно 5-10 мг/мл в конечном объеме. Все вышеописанные операции проводили при 4-8oС, если не указано иначе.
Альтернативная операция очистки была применена для очистки природного KGF, C(1,15)S и ΔN23. Процедура включает следующие стадии и, если не указано иначе, температура растворов и материалов поддерживалась 23±5oС.
По завершении стадии бактериальной ферментации клеточную культуру охлаждали до 4-8oС и клетки собирали центрифугированием или подобным образом. Исходя из ожидаемого выхода белка на единицу веса клеточной пасты и нужного количества очищенного белка, суспендировали соответствующее количество клеточной пасты в пятикратном (по весу) количестве раствора мягкого буфера 20 мМ NaPO4, 0.2 М NaCl, pH 7.5. Клетки диспергировали до гомогенного раствора, используя смеситель с высоким сдвигом. Температуру дисперсии клеточной пасты поддерживали при 4-8oС во время гомогенизации.
Затем клетки лизировали под давлением, например, дважды пропуская дисперсию клеточной пасты через гомогенизатор клеток с подходящим размером сечения. Гомогенат сохраняли охлажденным при 5±3oС. Для осветления клеточного лизата применяли устройство для объемного фильтра, снабженное фильтром с достаточной площадью поверхности, уравновешенным соответствующим объемом 0.2 М NaCl, 20 мМ NaPO4, pH 7.5. Уравновешивание и осветление (чистка) проводились при 5±3oС. Прежде чем проводить очистку, применяли соответствующее количество подходящего ускорителя фильтрования, чтобы предварительно покрыть фильтр и тщательно смешать с лизатом, после чего лизат осветляли, пропуская раствор через фильтрованный аппарат. Фильтр промывали 0.2 М NaCl, 20 мМ NaPO4, рH 7.5. Фильтрат и промывные воды собирали в охлажденный сосуд подходящей емкости, при этом температура везде поддерживалась ниже 10oС.
После фильтрования лизат пропускали через предварительно подготовленную колонку с SP-Sepharose Fast Flow с соотношением, по крайней мере, 1 мл смолы на 2 г клеточной пасты. Колонку с SP-Sepharose Fast Flow уравновешивали с холодным (5±3oС) 0.2 М NaCl, 20 мМ NaPO4, pH 7.5. Температуру колонки поддерживали при температуре ниже 10oС. Отфильтрованный лизат (5±3oС) затем (загружали) наносили на ионообменную колонку, при этом поглощение элюата при 280 нм (A280) постоянно проверяли. После нанесения образца колонку промывали холодным 0.2 М NaCl, 20 мМ NaPO4, pH 7.5 с последующим промыванием 0.3 М NaCl, 20 мМ NaPO4, pH 7.5 при 23±5oC.
Чтобы элюировать заданный белок, применяли хроматографию в линейном градиенте концентрации от 0.2-1 М NaCl, 20 мМ NaPO4, pH 7.5. Весь продукт собирали в нескольких фракциях в зависимости от А280 элюата. После элюции эти фракции объединяли и объем замечали.
Чтобы окислить свободные сульфгидрильные группы, осуществляли стадию окисления. В случае белков с измененными частицами цистеина, по сравнению с природным KGF, окисляющий агент (например, цистаминдигидрохлорид или другой пригодный окислитель, например цистин, окисленный глутатион или двухвалентную медь) добавляли до конечной концентрации 1-20 мМ и доводили pH до 7-9.5, при этом в случае применения цистаминдигидрохлорида предпочтительно pH 9.0±0.3. Окисление проводили при 10-30oС в течение соответствующего времени. В случае природного KGF белка окисление проводили, добавляя соответствующее количество (NH4)2SO4, такое как 1-2 М (NH4)2SO4, доводя pH до 7,5±0,5 и поддерживая температуру при 23±5oС в течение необходимого периода времени.
После окисления рН раствора доводили до между 6.5 и 9.5. Если необходимо, к раствору добавляли твердый (NH4)2SO4 до конечной концентрации 2 М. Чтобы удалить частицы, раствор пропускали через соответствующие осветляющие фильтры.
Отфильтрованный окисленный продукт затем подвергали хроматографии на гидрофобном носителе (HIC). Носитель в HIC представлял собой смолу Butyl-650M ToyopearlTM (Tosohaas, Inc., Montgomeryville, PA). Раствор, содержащий белок, наносили на колонку, которую предварительно уравновешивали 2 М (NH4)2SO4, 0.15 М NaCl, 20 мМ NaPO4, pH 7.0. После нанесения образца колонку промывали 2 М (NH4)2SO4, 0.15 М NaCl, 20 мМ NaPO4, pH 7.0. Заданный белок затем элюировали, применяя хроматографию в понижающемся линейном градиенте концентрации (NH4)2SO4 от 2.0 М в 0.15 М NaCl, 20 мМ NaPO4, pH 7.0. Когда заданный белок начал элюировить, что видно по увеличению A280 элюата, собирали фракции. Затем аликвоту каждой фракции анализировали SDS-PAGE. Затем фракции, содержащие заданный белок, объединяли, тщательно перемешивали и определяли общий объем, а также концентрацию белка в нем.
Объединенный HIC элюат, содержащий белок, концентрировали и заменяли буфер для элюции. Обычно белки концентрировали до 5.0-10.0 мг/мл. Проводили ультрафильтрование, используя ультрафильтрационную систему, снабженную системой кассет PTGC PelliconТM (Millipore, Inc., Bedford, MA) с мембраной с подходящим уровнем отсечения.
После концентрирования образец был подвергнут диафильтрации против соответствующего буфера. То, что было удержано (ретентат) на стадии концентрирования, подвергали диафильтрации против 0.15 М NaCl, 20 мМ NaPO4, рН 7.0 до тех пор, пока электропроводность ретентата не стала составлять примерно 5% электропроводности раствора 0.15 М NaCl, 20 мМ NaPO4, рН 7.0.
Кроме того, чтобы удалить осадки и бактериальный эндотоксин, который может присутствовать, концентрированный, диафильтрованный, содержащий белок образец пропускали через 0.1 мм фильтр PosidyneФ (Pall, Inc., Cortland, NY). После определения концентрации белка в растворе и исходя из нужной концентрации конечной массы продукта раствор разбавляли 0.15 М NaCl, 20 мМ фосфата натрия, рН 7.0 до заданной конечной концентрации. Затем проводили завершающее асептическое фильтрование через 0.22 мм фильтр и полученная масса продукта переносилась в емкости с противопожарной защитой на хранение (при примерно 5oС) для дальнейшего применения (для рецептур).
В. Анализ
Анализ проводили, применяя Е. coli, - полученные природный KGF; C(1,15)S; C(1,15)S/R(144)Q; DN15; DN23 и DN23/R(144)Q.
Токсичность
Исследования полипептидов на токсичность показали, что они не являются токсичными.
Конформационная устойчивость
Полипептиды сравнивали по их устойчивости при хранении, температуре перехода термического раскручивания (Тm) и устойчивости в широком интервале рН.
Устойчивость при хранении
Фигура 25 сравнивает природный KGF и С(1,15)S после хранения в 2 мМ NaPO4, 0.15 NaCl, рН 7.0 при 37oС в течение 27 часов. C(1,15)S содержал значительно более высокое содержание растворимого белка в сравнении с природным KGF.
На Фигуре 26 сравнивается устойчивость природного KGF, ΔN15 (не показано) и C(1,15)S в PBS и в 50 мМ NaPO4, 0.15 NaCl, pH 7.0 после хранения при 37oС в течение 18 часов. Регенерация растворимого белка значительно выше в насыщенном растворе фосфата, чем в PBS. ΔN15 так же, как и C(1,15)S проявил значительно повышенную устойчивость по сравнению с природным KGF. ΔN15 и C(1,15)S также дали ~100% возврат (регенерацию) в насыщенном фосфате, как ожидалось по результатам с природным KGF.
Однако был проведен единичный предварительный опыт по сравнению устойчивости при хранении С(1,15,40)S и C(40)S (который кодируется основаниями от 201 до 684 SEQ ID NO:1, за исключением того, что Ser40 кодируется AGA); и С(1,15,102)S и C(102)S (который кодируется основаниями от 201 до 684 SEQ ID NO:1, за исключением того, что Ser102 кодируется AGA). Результаты (не показаны) указывают на низкую устойчивость (т.е. меньше растворимого белка после хранения при 37oС). Однако количество растворимого, правильно скрученного С(1,15,40)S белка, который очищался от культуральной среды, было больше, чем таковое C(40)S; это предполагает, что С(1,15,40)S может, в действительности, быть более устойчивым и что результаты примера сравнения недоказательны, неубедительны. Данное изобретение предпочтительно включает аналог KGF, имеющий замены, иные, нежели в Cys40, Cys102, Cys106, и более предпочтительно, исключает С(1,15,40)S, C(1,15,102)S и С(1,15,102,106)S.
Способность природного KGF, C(1,15)S, ΔN23, C(1,15)S/R(144)E, C(1,15)S/R(144)Q и ΔN23/R(144)Q предотвращать образование агрегированных молекул при повышенных температурах также была изучена. Образцы, содержащие 0.5 мг/мл белка, были приготовлены в D-PB8. Аликвоты 0.5 мл каждого образца были помещены в стеклянные пробирки 1-типа на 3 мл. Пробирки закрывали резиновыми пробками и закрепляли сверху 13 мм запирающими алюминиевыми колпачками. Затем эти пробирки помещали в термостат при 37oС. Через заранее определенные временные интервалы пробирки вынимали и анализировали потерю (уменьшение) растворимого белка. Видимые осадки (частицы) удаляли центрифугированием по 250 мл каждого образца через 0.22 мм Spin-ХФ фильтровальную установку (Costar, Cambridge, MA). Растворимый белок в отфильтрованном растворе анализировали соответствующим образом вытеснительной хроматографией HPLC по размеру. Количество растворимого белка определяли, интегрируя площадь HPLC пика и изображая графически результат, как функцию времени термостатирования при 37oС. Результаты для природного KGF, С(1,15)S, C(1,15)S/R(144)E и C(1,15)S/R(144)Q и ΔN23/R(144)Q приведены на Фигуре 26 (данные для ΔN23 и ΔN23/R(144)Q не показаны).
По этим кинетическим кривым затем оценивали период полураспада - потери половины растворимого, мономерного белка. Таблица 1 показывает период полураспада для оставшегося после хранения при 37oС растворимого KGF для этих белков.
Как видно из Таблицы 1 и Фигуры 27, природный KGF образовывал агрегированные молекулы быстрее всего с периодом потери половины растворимости (полураспада) 0.6 дней. C(1,15)S/R(144)Q, ΔN23/R(144)Q и C(1,15)S/R(144)E проявили значительное повышение периода полураспада - потери половины растворимости - до 13.3, 22.3 и 38 дней соответственно.
Термическое раскручивание
Термическое раскручивание контролировали методом кругового дихроизма (CD) при 230 нм, применяя J-720ТМ спектрополяриметр (Jasco, Inc., Easton, MD), снабженный системой контроля температуры РТС-343 типа Пельтье. Для CD анализа готовили отдельные образцы, содержащие 0.1 мг/мл анализируемого полипептида в D-PBS (Life Technologies, Inc., Grand Island, NY). Около 2.5 мл каждого образца помещали во флуоресцентную кювету (Hellma Cells, Inc., Jamaica, NY) из прямоугольных пластинок кварца SuprasilТМ длиной 10 мм (Heraeus Quarzschmelze, GmbH, Hanau, Germany). Кювету затем помещали в систему температурного контроля Peltier в спектрополяриметре. Термическое раскручивание проводили со скоростью 50oС/час. За изменениями эллиптичности следили при 230 нм, чтобы показать развертывание. Тm каждого образца оценивали, определяя температуру, при которой 50% белковых молекул в растворе были развернутыми (ракрученными) (Biophysical Chemistry, Cantor and Schimmel (eds), W. H. Freeman and Co. San Francisco (1980). Определенные Tm для каждого из трех белков перечислены в Таблице 2.
Как показывают эти результаты, у С(1,15)S и ΔN15 Тm повышена на 1oС по сравнению с природным KGF. У ΔN23 Тm повышена еще на один градус. Однако замена R144Q на C(1,15)S/R(144)Q или ΔN23 увеличивает Тm больше чем на 6oС и больше чем на 7oС по сравнению с природным KGF. Более того, C(1,15)S/R(144)E больше чем на 9oС более устойчив, чем природный KGF.
pH
Устойчивость в кислой среде C(1,15)S/R(144)Q и C(1,15)S/R(144)E также сравнивали с таковой природного KGF, доводя D-PBS до различных значений рН добавлением концентрированных HCl или NaOH. Примерно 2.35 мл D-PBS с различными значениями рН смешивали со 100 мл раствора 2.45 мг/мл KGF-белка в кварцевой кювете. Эти образцы термически развертывали со скоростью 50oС/час и контролировали методом CD при 230 нм. Фигура 28 показывает Тm как функцию рН для природного KGF, C(1,15)S, C(1,15)S/R(144)Q и C(1,15)S/R(144)E. В исследуемом интервале рН C(1,15)S, C(1,15)S/R(144)Q и C(1,15)S/R(144)E всегда имели более высокую Тm, чем природный KGF.
In vitro биологическая активность
In vitro митогенную активность определяли так же, как функцию концентрации белка и половины максимальных концентраций, измеряя потребление [3H] -тимидина клетками Balb/MK (по способам Rubin et al. (1989), supra). Обычно отношение концентраций каждого из аналогов KGF определяли, применяя in vitro биологический анализ. Каждый KGF аналог затем разбавляли и анализировали (на) биологическую активность, используя Balb/MK митогенный анализ. Сначала образцы разбавляли в среде для биопроб, состоящей на 50% из приготовленной потребителем минимальной поддерживающей среды Игла ( MEM), 50% приготовленного потребителем F12, 5 мг/мл трансферрина, 5 нг/мл селенита натрия, 0.0005% HSA и 0.005% Tween 20. Образцы KGF затем помещали в 96-луночные планшеты Falcon Primeria, засеянные клетками Balb/MK. В ходе синтеза ДНК измеряли [3H] -тимидин и преобразовывали в концентрацию (находили концентрацию) природного KGF на входе сравнением со стандартной кривой природного KGF. Результаты представлены на Фигурах от 29 до 34. Как видно из Фигур, анализируемые аналоги KGF, описанные на Фигурах от 28 до 33, имеют активность, сравнимую с природным KGF.
MEM), 50% приготовленного потребителем F12, 5 мг/мл трансферрина, 5 нг/мл селенита натрия, 0.0005% HSA и 0.005% Tween 20. Образцы KGF затем помещали в 96-луночные планшеты Falcon Primeria, засеянные клетками Balb/MK. В ходе синтеза ДНК измеряли [3H] -тимидин и преобразовывали в концентрацию (находили концентрацию) природного KGF на входе сравнением со стандартной кривой природного KGF. Результаты представлены на Фигурах от 29 до 34. Как видно из Фигур, анализируемые аналоги KGF, описанные на Фигурах от 28 до 33, имеют активность, сравнимую с природным KGF.
Пример 3: Продуцирование в клеточной культуре млекопитающих
Этот пример описывает экспрессию, выделение и характеристику двух биологически активных форм рекомбинантного KGF (rKGF), полученных в экспрессирующей системе млекопитающих.
Ген KGF человека был выделен PCR амплификацией кДНК, полученной из фибробластных клеток нормальной дермы человека (Clonetec, Inc., San Diego, CA). После получения кДНК с помощью ревертазы для амплификации гена KGF была применена PCR (полимеразная цепная реакция). Для амплификации гена из кДНК были использованы OLIGO#25 и OLIGO#26, a OLIGO#27 и OLIGO#28 были применены, чтобы поместить сайты рестрикции Hind III и Bgl II по концам фрагмента второй PCR амплификацией, как показано на Фигурах 1а и 1б (последовательность 4 см. в конце текста).
После клонирования и подтверждения последовательности ДНК была использована ДНК KGF гена. Амплификацию провели, применяя OLIGO#29 и OLIGO#30 (последовательность 5 см. в конце текста).
Смысловой праймер OLIGO#29 содержал сайт XbaI и консенсусная последовательность трансляции Козака (5'-ССАСС-3') "выше" (upstream) стартового кодона, ATG. Антисмысловой праймер OLIGO#30 включал SalI сайт клонирования и дополнительный терминирующий кодон. После 18 циклов PCR амплификации (30 с денатурации при 94oС, 40 с гибридизации (обжига) при 55oС и 40 с элонгации при 73oС) продукт гидролитически расщепляли XbaI и SalI и лигировали с подобным же образом гидролизованной ДНК pDSRα2 (по методикам Bourdrel et al. (1993), Protein Exp. and Purif., 4:130-140 и Lu et al. (1992), Arch. Biochem. Biophys. , 298:150-158). Это привело к плазмиде KGF/pDSRα2, которая поместила ген KGF человека между последовательностями SV40 раннего промотора и α-FSH полиаденилирования. Были выбраны два клона и секвенирование ДНК подтвердило конструкцию заданного вектора.
Две микрограммы ДНК KGF/pDSRα2 были затем переведены в линейную форму с помощью RvuI. Клетки яичников китайского хомячка (СНО), посеянные на день раньше в чашках для культивирования 0.8•106 клеток/60 мм, были подвергнуты трансфекции обработанной ДНК с применением стандартного метода осаждения фосфатом кальция (Bourdrel et al., supra). Через две недели были отобраны индивидуальные колонии и перенесены в 24-луночные планшеты. Кондиционированные среды считаются бессывороточными, когда клетки сольются, и их аликвоты анализируют с помощью вестерн-блотирования, применяя реактив поликлональной кроличьей антисыворотки против E. coli - экспрессируемого KGF человека.
Вестерн-блотирование осуществляли, пропуская образцы через 12.5% (вес/объем) SDS полиакриламидные гели с последующим электроблотированием в течение 1 часа при 400 мА на нитроцеллюлозные мембраны, применяя аппарат для переноса в полусухом виде (Hoefer Scientific Instruments, San Francisco, CA). 20 мМ Tris, 150 мМ глицина, 20% метанола служили в качестве буфера для переноса. Нитроцеллюлозные листы были блокированы термостатированием с 10% нормальной козьей сывороткой в PBS. В качестве первичного антитела применяли кроличью антисыворотку, полученную против Е. coli-продуцированного KGF. Для употребления ее разбавляли 1/10 000 в 1% нормальной козьей сыворотке в PBS и термостатировали с заблокированными нитроцеллюлозными листами в течение 12 часов при комнатной температуре, после чего избыток антитела удаляли трижды, по 30 мин отмывая в PBS. Затем нитроцеллюлозные мембраны термостатировали в 100 мл 1% нормальной козьей сыворотки в PBS, содержащем VectastainТМ биотинилированную козью антикроличью IgG (вторичное антитело, Vector Labs. Burlingame, CA) в течение 30 минут при комнатной температуре. После трех десятиминутных отмываний в PBS термостатировали в течение 30 минут при комнатной температуре в 100 мл 1% раствора нормальной козьей сыворотки, содержащей стрептавидин и биотинилированную пероксидазу, приготовленный в соответствии с рекомендациями изготовителя (Vector Labs). После трех промываний в PBS KGF-материал перекресной реакции визуализовали термостатированием в смеси 60 μл 30% (вес/объем) Н2О2 в 100 мл PBS и 50 мг 4-хлорнафтола в 20 мл метанола. Реакцию прекращали, выливая через 10 минут в воду.
Анализ блотов показал, что KGF-специфическое антитело, ассоциировано с тремя отличными полосами белков, причем две близки по молекулярному весу примерно к 25-29 kDa, а одна достигает молекулярного веса примерно в 17 kDa по сравнению с ожидаемым молекулярным весом примерно 18.8 для зрелого белка из 163 аминокислот. Кроме того, несколько высоко экспрессирующих клонов, секретирующих более чем 2.0 мг rKGF на литр, судя по вестерн-анализу, было отобрано и помещено во вращающиеся бутыли (по методу Lu et al., supra) с целью получения больших объемов бессывороточной кондиционированной среды для очистки KGF катионообменной хроматографией и гель-фильтрацией, как показано ниже.
KGF из 3 л бессывороточной кондиционированной среды очищали, помещая среду непосредственно на катионообменную колонку (5•24 см), заполненную 450 мл сульфоэтильной S-Sepharose Fast Flow (Pharmacia), предварительно уравновешенную с 20 мМ фосфата натрия, рН 7.5. После промывания пятью объемами колонки 20 мМ фосфата натрия, 0.2 М NaCl, рН 7.5, rKGF элюировали, применяя 20 объемов колонки в линейном градиенте концентрации от 0.2 до 1.0 М NaCl в 20 мМ фосфата натрия, рН 7.5. Собирали фракции по 50 мл при постоянном контроле A280. Белок KGF обнаруживали, анализируя аликвоты каждой фракции SDS-PAGE. SDS-PAGE проводили в электрофоретической системе (Novex, San Diego, CA), применяя готовые 14% трисглициновые гели (по методу Laemmli (1970), Nature, 227:680-685). Образцы смешивали с невосстанавливающимся образцом SDS буфера, не нагревая перед нанесением. Белки определяли, окрашивая либо Кумасси синим, либо серебром. Два поздно элюируемых пика, по-видимому, содержали полосы белка, соответствующие 25-29 kDa и 17 kDa, определенные по вестерн-блоту. Фракции, содержащие каждый из этих пиков, по отдельности концентрировали до объема менее 1 мл и подвергали гель-фильтрации.
Для гель-фильтрации применяли колонки со смолой Superdex-75ТМ (HR 10/30, Pharmacia), предварительно уравновешенные с PBS, рН 7.2, и калиброванные по следующим известным стандартам молекулярных весов (BioRad, San Francisco, CA): тироглобулин (670 kDa), g-глобулин (158 kDa), овальбулин (44 kDa), миоглобин (17 kDa) и витамин В-12 (1.4 kDa). Эти стадии очистки дают примерно 2000-кратную очистку rKGF, при этом включается специфический материал 17 kDa и 30 kDa, как таковой, определяемый окрашиванием серебром.
На примере материала с более высоким молекулярным весом rKGF элюировался как основной симметричный пик (по А280), который был назван KGF-a. Анализом SDS-PAGE меньшего количества этого материала, 3 μг/дорожка вместо 6 μг/дорожки, были разрешены две полосы с разницей молекулярных весов 1-2 kDa. На примере материала с более низким молекулярным весом, названного KGF-b, гель-фильтрация дала белковый препарат с ожидаемой подвижностью. Как для KGF-a, так и для KGF-b, общий выход после очистки был примерно 30-40%.
Были также проанализированы аминокислотные последовательности KGF-a и KGF-b. Эти анализы проводили на автоматическом секвенаторе (Модель 477А или 470А, Applied Biosystem, Inc., Foster City, СА), снабженном 120А непрерывным РТН-аминокислотным анализатором и системой сбора данных Model 900A (по методу Lu et al. (1991), J. Biol. Chem., 266:8102-8107). Секвенирование Эдмана показало в KGF-a основную N-концевую последовательность X1-N-D-M-T-P-E-Q-M-A-T-N-V-X2-X3-S- (SEQ ID NO: 75). Минорная последовательность, начиная с третьей N-концевой аминокислоты, аспартиковой кислоты, также присутствовала в 1.6% всех белковых последовательностей. Х1, Х2 и Х3 не были отнесены из-за отсутствия фенилтиогидантоинил (РТН) аминокислотных сигналов при секвенировании. N-концевая аминокислотная последовательность KGP, предсказанная исходя из последовательности кДНК, указывает, что X1 и Х3 представляют собой остатки Cys и Х2 означает аспарагин. Отсутствие X1 и Х3 показывает, что эти цистеины могут образовывать дисульфидные мостики. Исходя из последовательности согласованного N-связанного гликозилирования Asn-X-Ser, отсутствие предсказанного остатка Asn, соответствующего Х2, указывает, что это есть сайт потенциального N-связанного гликозилирования.
Интересно, что N-концевое секвенирование KGF-b показало N-концевую аминокислотную последовательность S-Y-D-Y-M-E-G-G-D-I-R-V- (SEQ ID NO:76), это говорит, что именно N-концевая процессированная (усеченная) форма KGF расщеплялась протеолитически по Arg23-Ser24 пептидной связи.
Для дополнительной характеристики очищенных KGF-а и KGF-b белок подвергали действию гликозидаз (нейраминидазы, О-гликаназы и/или N-гликаназы), применяя известные методики (Sasaki et al. (1987), J. Biol. Chem., 262:12059-12076); Takeuchi et al. (1988), J. Biol. Chem., 263:3657-3663); Zsebo at al. (1990), Cell, 63: 195-201). Эти данные указывают, что KGF-a содержит N- и O-соединенные углеводы, хотя форма KGF-a с более низким молекулярным весом, возможно, содержит только N-связанный сахар. Обработка гликозидазой не вызвала уменьшения молекулярного веса KGF-b, это указывает на то, что молекула не является гликозилированной.
Гликозилированный образец KGF-a дополнительно охарактеризован масс-спектроскопией эндопротеиназ Glu-C-пептидов, описанных выше. Выяснение углеводной структуры гликопептида эффузионным методом масс-спектрометрического анализа было успешно применено к другим белкам (Huddleston et al. (1993), Anal. Сhem. , 65: 877-884; Carr et al. (1993), Prot. Sci., 2:183-196). Как подтверждено выделением негликозилированного полипептида, Thr22, по-видимому, является частично гликозилированным. Аналогичный масс-спектрометрический анализ Asn14 позволил предположить микрогетерогенность при гликозилировании с би-, три- и тетраантенными структурами с меняющимися степенями сиалилирования.
В таблице 3А суммированы данные о концентрации KGF, стимулирующей [3H] -тимидиновое включение кератиноцитов с половиной максимальной скорости (по методу Rubin et al. (1989), supra). Взаимодействие KGF рецептором изучали, используя препараты мембран из выделенного KGF рецептора, приготовленные из кератиноцитов эпидермы мышей Balb/MK (по методике, описанной Massague (1983), J. Biol. Chem. , 258:13614-13620). Конкретно, различные формы KGF разбавляли 50 мМ Tris-HCl, pH 7.5, содержащим 0.2% бычьего сывороточного альбумина так, чтобы интервал концентраций был от 0.8 нг до 100 нг на 50 μл. Они термостатировались по отдельности с препаратом мембраны (75 нг/мл) и 125I-меченым E. соli-образованным KGF (1.5 нг). Рецептурное связывание и эксперименты с конкурентными процессами проводили при 4oС в течение 16 часов, после чего образцы вынимали, центрифугировали и дважды промывали вышеуказанным разбавленным буфером для удаления несвязанного и неспецифически связанного меченого KGF. Образцы затем считали на остаточную радиоактивность. Конкурентные кривые рецепторного связывания между образцами KGF и меченым KGF были построены как график соотношения (процента) неконкурентности к концентрации каждого образца KGF. Таблица 3В суммирует концентрацию KGF, необходимую, чтобы достигнуть 60% неконкурентности против меченого Е. соli-образованного KGF, выраженную в нг/мл.
Как показано на таблице 3А, KGF-a и KGF-b стимулируют сравнимое [3H]-тимидиновое включение, при этом скорость, равная половине максимальной, стимулируется примерно 30 нг/мл любого аналога. Таким образом, укорочение (усечение) не уменьшает биологической активности молекулы. Однако два аналога имеют активность примерно в 3 раза ниже, чем Е. coli-образованный полноразмерный KGF. Как показано на таблице 3В, эксперименты по неконкурентности с помощью радиорецепторного анализа показали, что Е. coli-образованный KGF, KGF-a и KGF-b обладают сходной активностью рецепторного связывания.
Пример 4: In vivo биологический анализ полипептидов KGF, продуцированных в Е. сoli и клеточной культуре млекопитающих
Было показано, что однократная доза KGF подкожно приводит к зависящему от дозы повышению сывороточного холестерина у мышей в течение 24 часов. Природный KGF, KGF-a, C(1,15)S, ΔN15 и ΔN23 также оценивались с точки зрения способности повышать содержание холестерина в сыворотке в зависимости от дозы.
Каждая подопытная группа содержала пять женских особей мышей Balb/c (18-20 г), полученных из CRL. Белок разбавляли 0.9% физиологическим раствором, чтобы конечный объем инъекции был равен 100 μл/мышь. Каждой мыши вводили однократно подкожную инъекцию в следующих дозах (Табл. 4).
Через 24 часа после инъекции мышей умерщвляли и обескровливали через кардиальный прокол. Образцы крови обрабатывали для определения сывороточного холестерина.
Как показано на Фигуре 34 было найдено, что каждый испытуемый KGF аналог повышает холестерин в сыворотке в зависимости от дозы. Далее, не обнаружено видимой разницы биоактивности между любыми испытуемыми KGF аналогами.
In vivo модель диабета
Химически-индуцированные (вызванные) модели сахарного диабета у различных видов животных традиционно использовались для изучения заболевания и его лечения. Стрептозотоцин вызывает диабет у мыши, крысы, хомяка, собаки и обезьяны, хотя больше всего практикуются исследования на крысах и мышах. Jonod et al., Proc. Soc. Exp., Pio. Med. 126:210-205 (1967); Rerup, Pharm. Pev. 22: 485-518 (1970); Rossini et al., P.N.A.S. 74:2485-2489 (1977) и Ar'Rajab and Ahren, Pancreas 8:50-57 (1977). У крыс дозы стрептозотоцина от 45 до 70 мг/кг в виде однократной дозы внутривенно вызывают стойкое заболевание. Дозы ниже 45 мг/кг вызывают (кратко)временное болезненное состояние, которое обратимо. В течение одного дня после введения стрептозотоцина индуцируется состояние гипергликемии. Содержание инсулина в крови остается существенно неизменным по сравнению с нормальными крысами; однако общее содержание инсулина и С-пептида в поджелудочной железе резко уменьшается. Крысы проявляют классические признаки и симптомы диабета у людей: повышенное содержание глюкозы в крови (гипергликемия), глюкозы в моче (глюкозурия), повышенная жажда (полидипсия), повышенное выделение мочи (полиурия), повышенный аппетит (гиперфагия).
Исследования, описанные в этом открытии, проводились с моделью диабета, вызванной стрептозотоцином у крыс Sprague-Dawley. Мужские особи крыс весом 200-260 грамм применялись в исследованиях. Диабет вызывали однократной внутривенной инъекцией стрептозотоцина в количестве 50 мг стрептозотоцина в буфере цитрата натрия на 1 кг веса тела. Недиабетические контрольные крысы получали однократную внутривенную инъекцию буфера цитрата натрия в целях контроля. KGF вводили ежедневно в виде подкожной инъекции. Доза KGF была от 3 до 5 мг/кг/день в зависимости от эксперимента. В первом эксперименте KGF-терапию начали за два дня до индуцирования диабета и продолжали после индуцирования диабета, всего восемь инъекций. Во втором и третьем экспериментах KGF-терапию начали через день после индукции диабета стрептозотоцином. В четвертом эксперименте семидневный курс KGF-терапии был начат семь дней спустя после введения стрептозотоцина, и животные продолжали его еще 12 недель. Во всех экспериментах, кроме четвертого, в качестве конечных показателей при анализе использовалось содержание глюкозы в крови, содержание глюкозы в моче и диурез. Кроме того, в некоторых экспериментах определяли потребление воды, содержание С-пептидов в моче или общее содержание инсулина и С-пептидов в поджелудочной железе. В четвертом эксперименте единственным анализируемым конечным показателем было содержание глюкозы в крови. Из-за того, что большая часть инсулина удаляется (изымается) из кровотока печенью, определение концентраций периферического инсулина отражает скорее события постгепатического метаболизма (обмен веществ после печени), нежели секрецию инсулина из поджелудочной железы. Поэтому в качестве периферического маркера секреции инсулина часто используют определение С-пептида. С-пептид образуется при процессинге проинсулина в инсулин. Инсулин и С-пептид секретируются бета-клетками в эквимолярных соотношениях и только малое количество С-пептида экстрагируется печенью.
В этом исследовании изучалось действие KGF на вызванный стрептозотоцином диабет у крыс Sprague-Dawley. В день 0 группы крыс были подвергнуты действию либо 45, либо 50 мг/кг стрептозотоцина (STZ). После этого ежедневно контролировалось содержание глюкозы в крови не натощак с целью определения тяжести инсуляторного поражения (поражения островковых клеток). На 5 день получавшие SIZ животные помещались в одну из двух групп (20/группа) в зависимости от величины (размера) гипергликемии. Определяющим (разделяющим) значением было содержание глюкозы в крови 300 мг/мл. Группа не получавших SIZ животных служила в качестве контрольной. На 7 день 10-и животным из каждой группы с гипергликемией начали давать ΔN23 (3 мг/кг/день) или PBS в виде подкожной инъекции и давали всего в течение 7 дней. Ежедневно, или через день, или через неделю контролировали содержание глюкозы в крови; данные представлены на Фигуре 51. Нужно отметить, что у получавших SIZ животных из обеих групп, принимавших ΔN23, наблюдались значительные спады содержания глюкозы в крови в течение периода приема ΔN23. Важно, что среднее падение содержания глюкозы в крови, наблюдавшееся у получавших SIZ животных, из группы с начальным содержанием глюкозы в крови <300 мг/дл стабилизировалось около 150 мг/дл, тогда как падение содержания глюкозы в крови, наблюдавшееся в группе с его начальным значением <300 мг/дл было только (кратко)временным. Нужно отметить, что шкала не является линейной относительно дней.
Хотя данное изобретение было описано как в общем, так и для предположительных вариантов воплощения, в свете списанного выше понятно, что специалистам могут встретиться другие вариации и модификации.





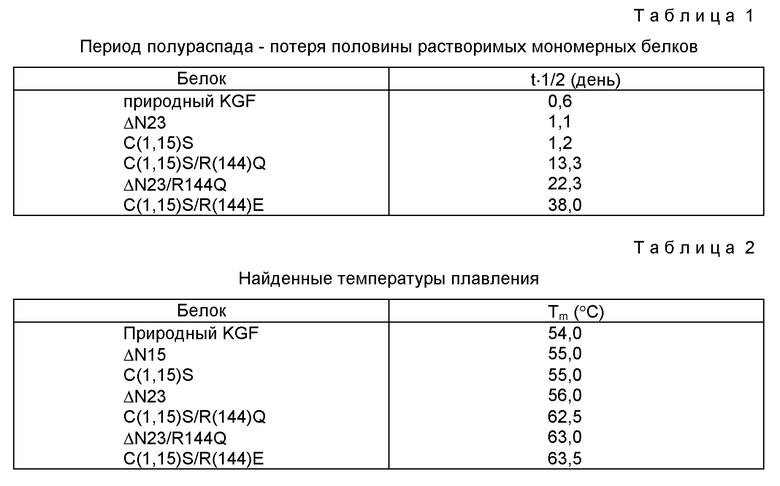

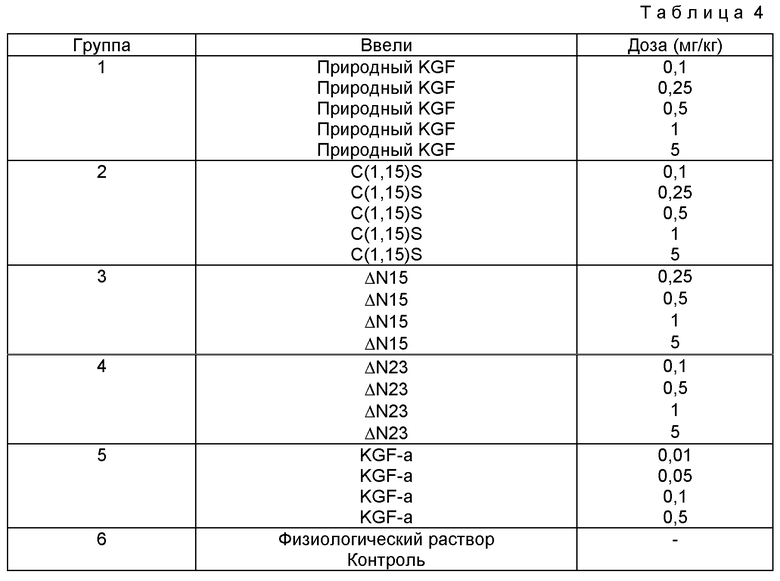


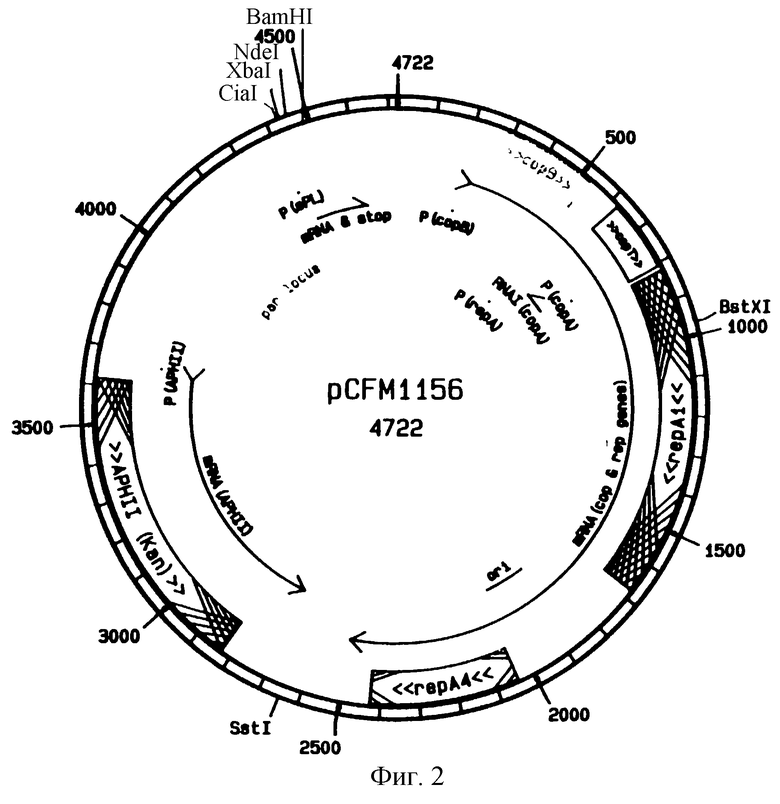


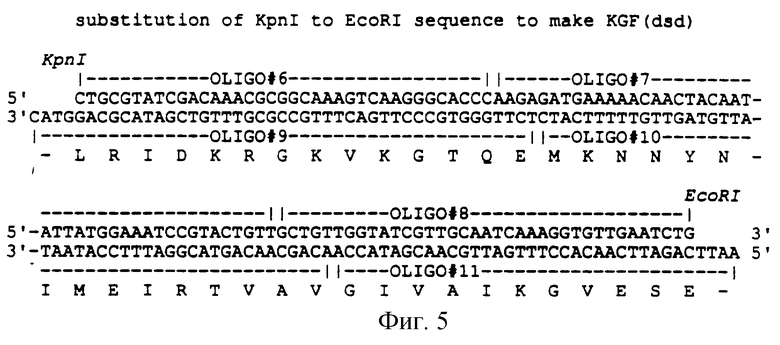





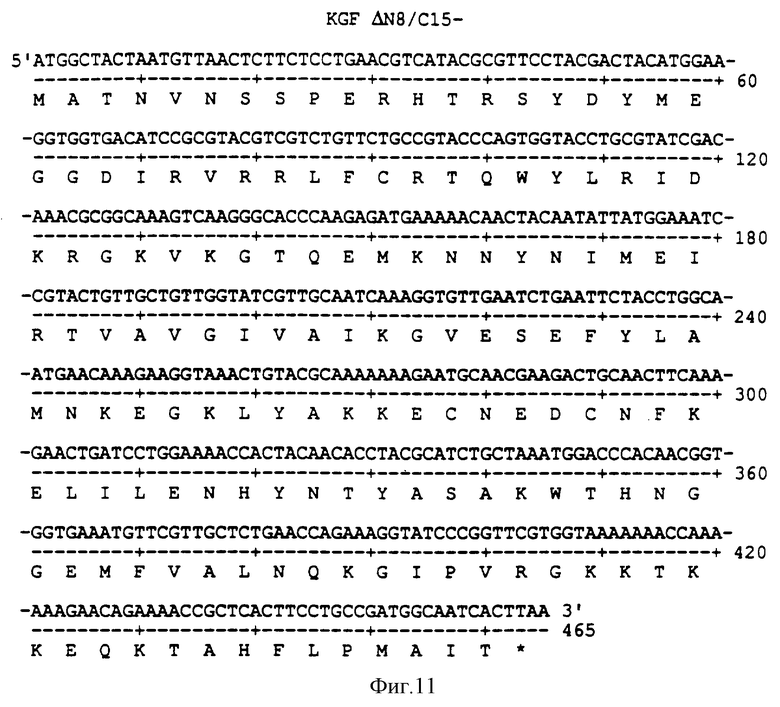
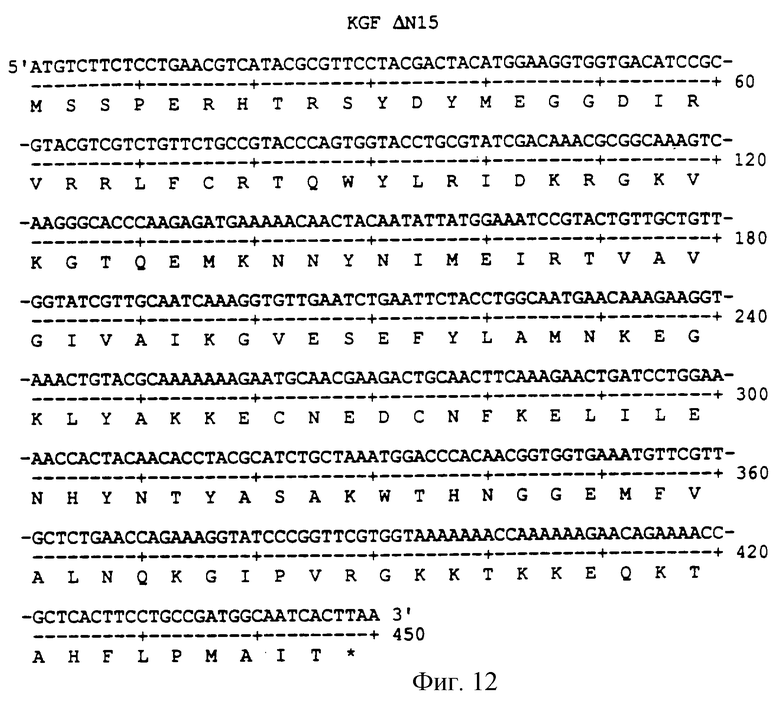

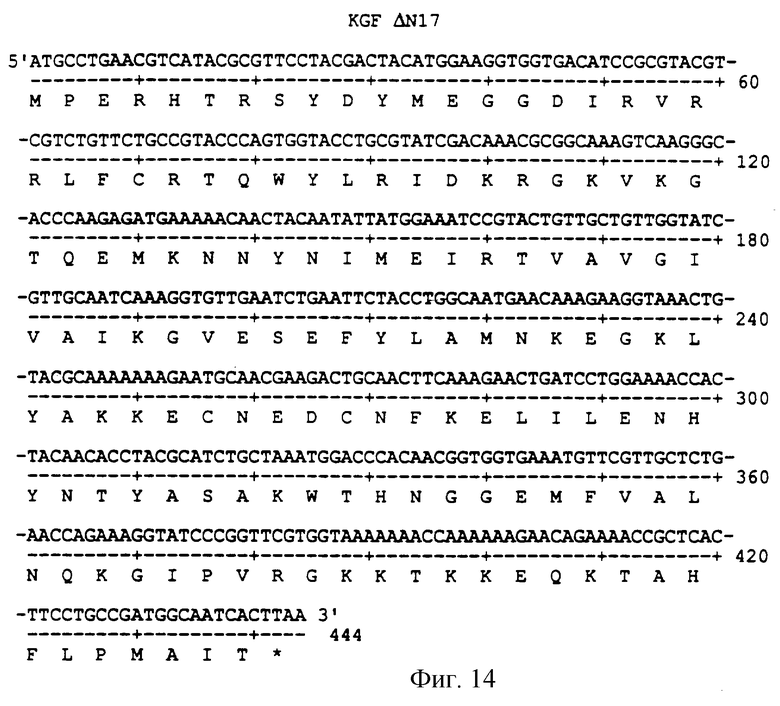
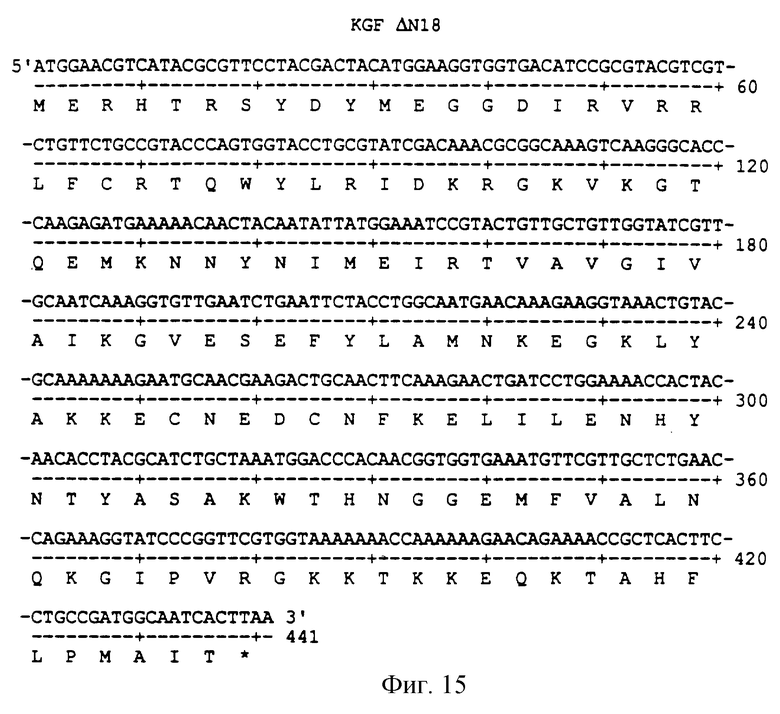
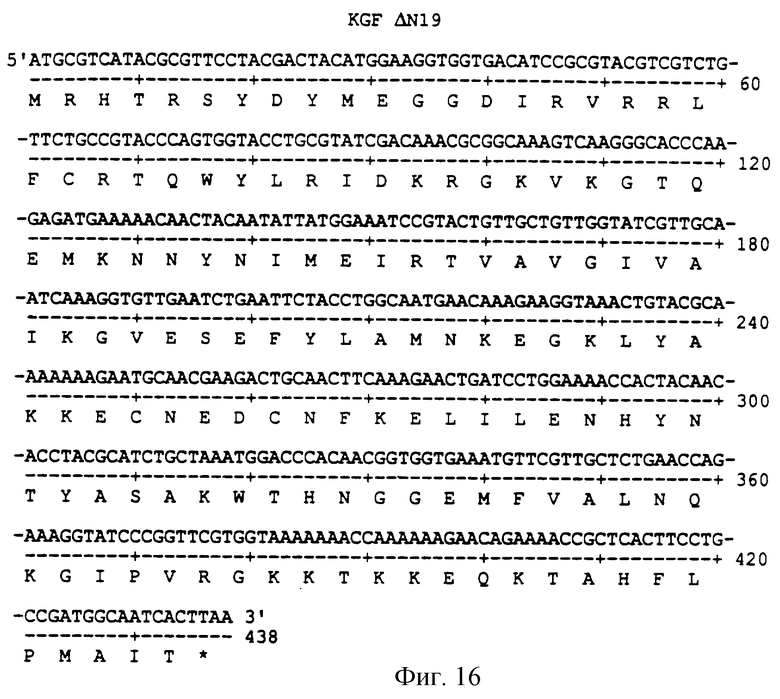

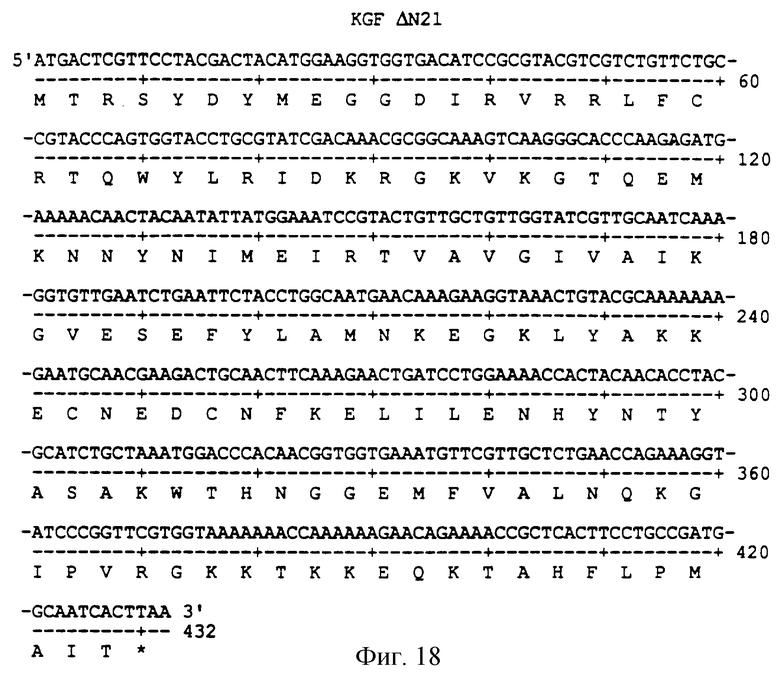
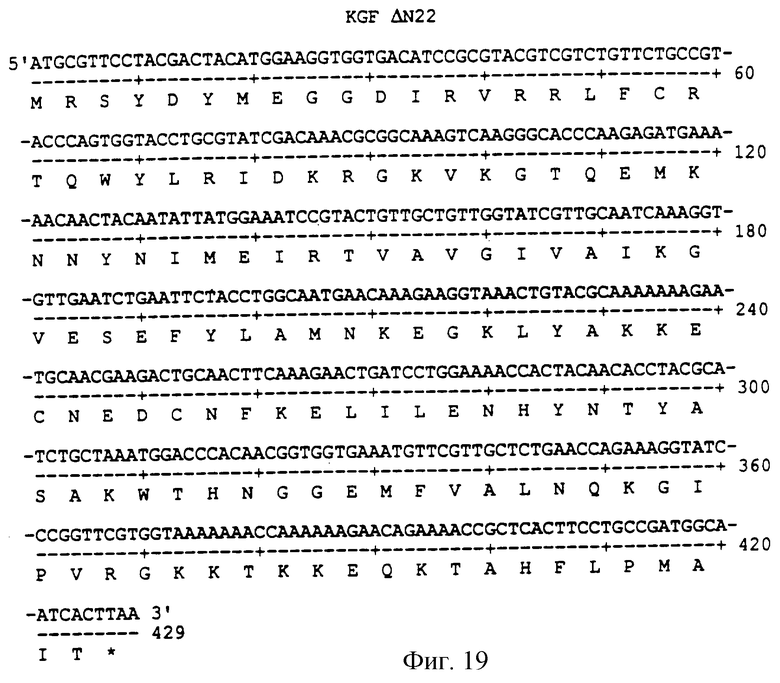
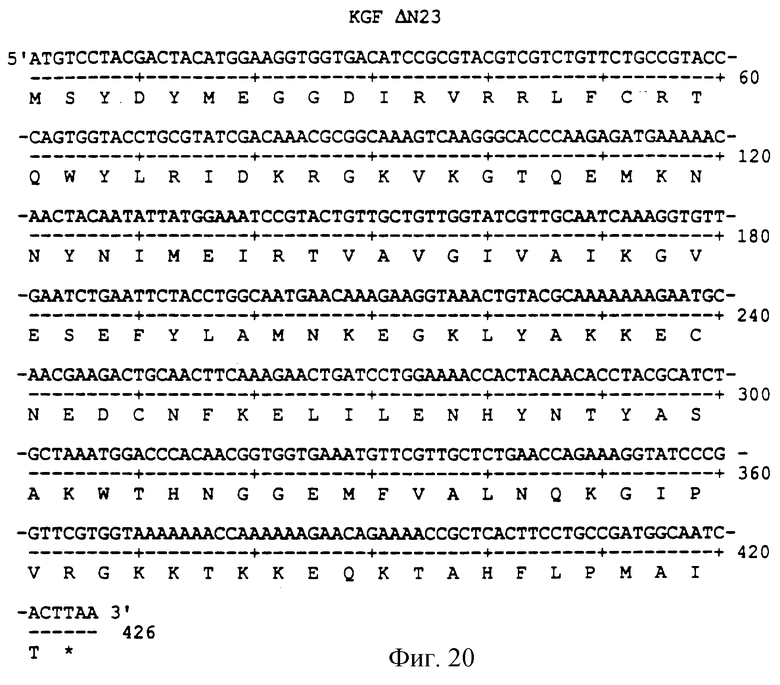
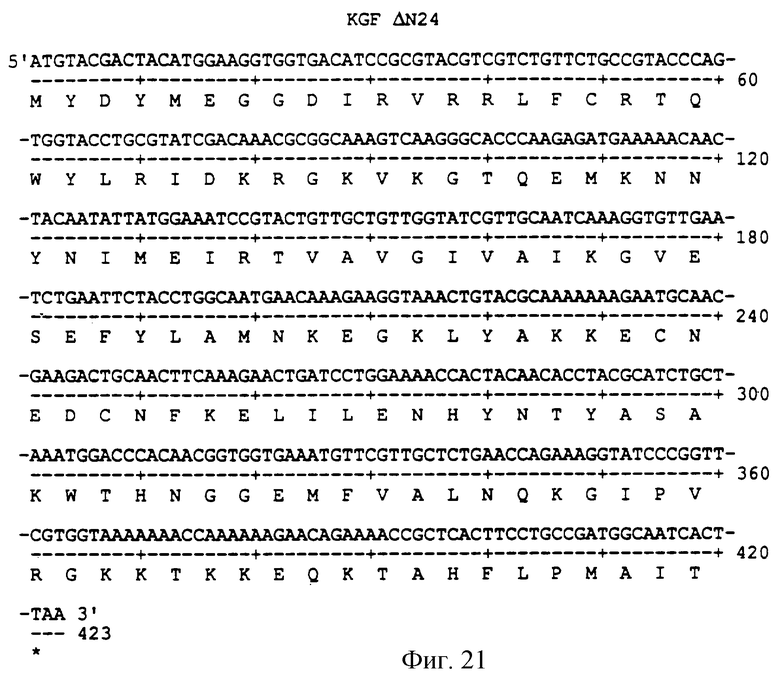


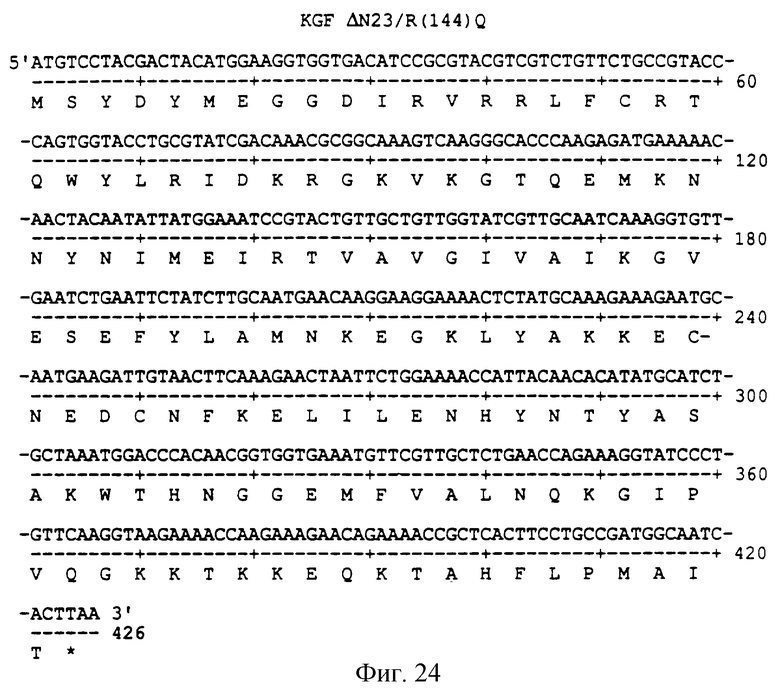
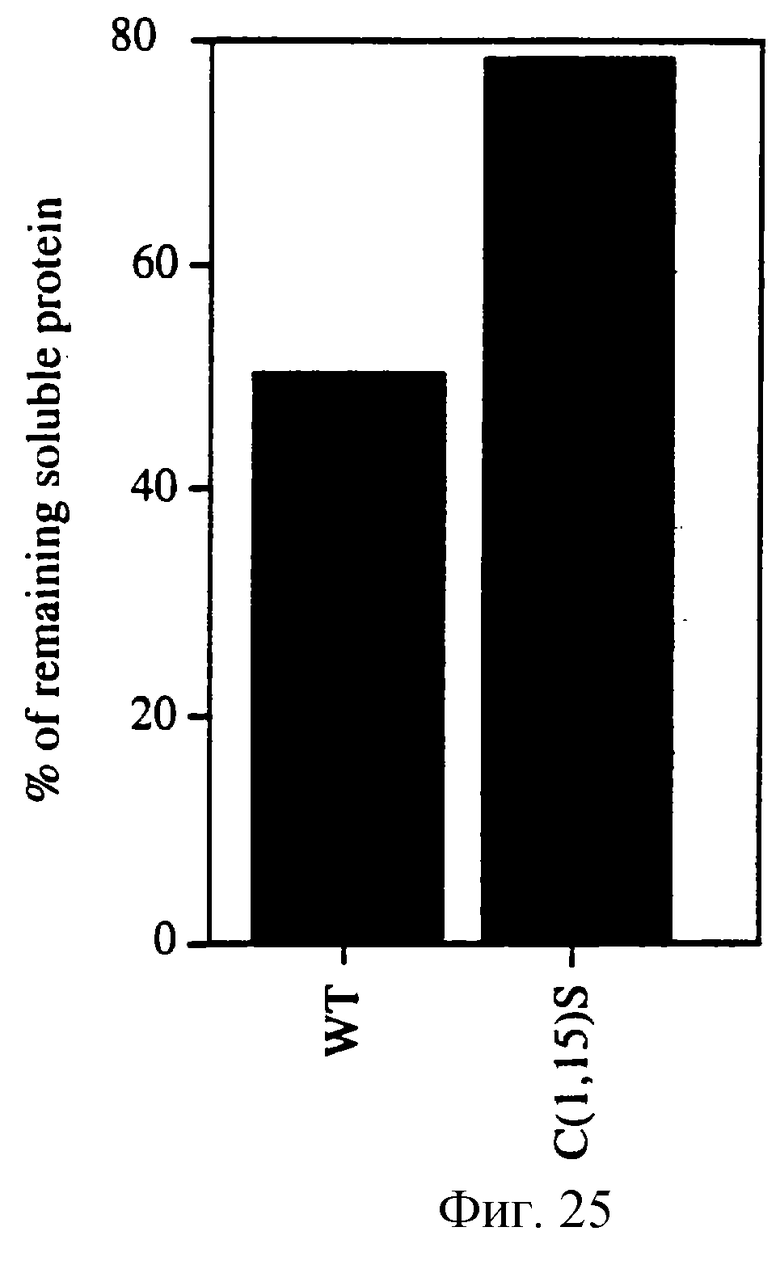

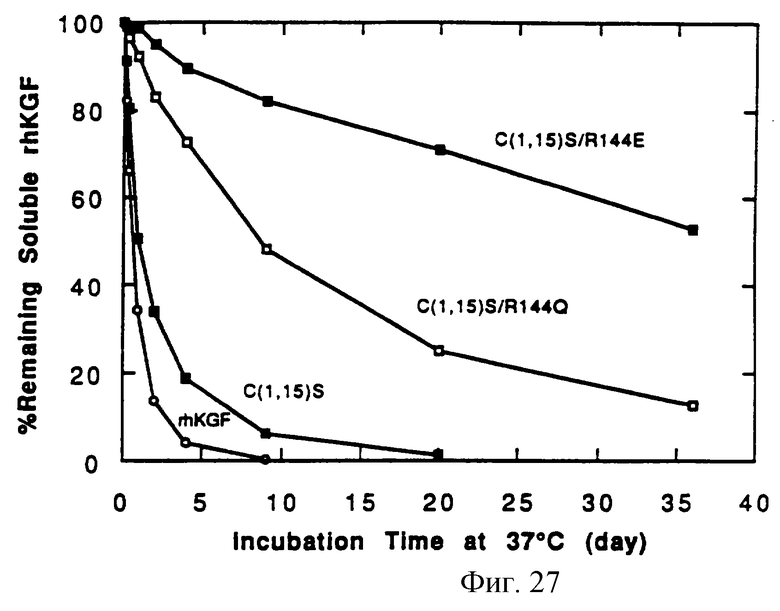
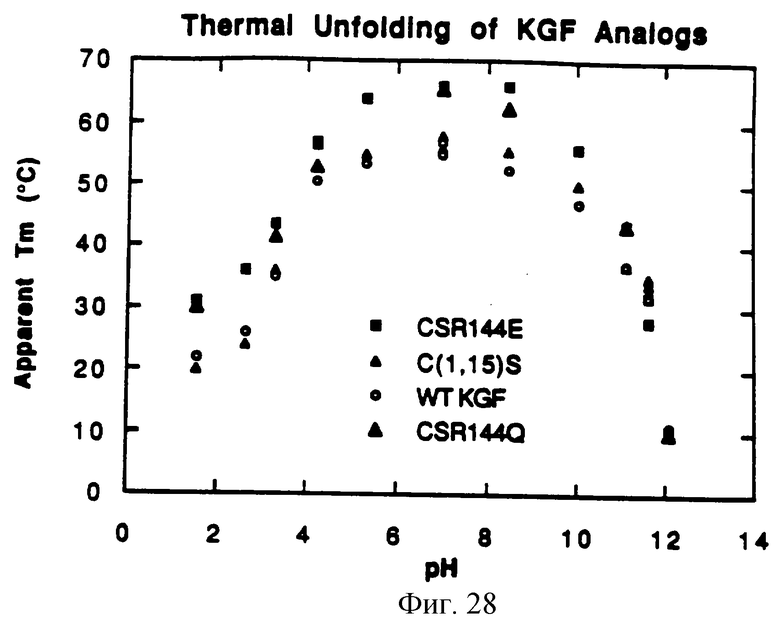
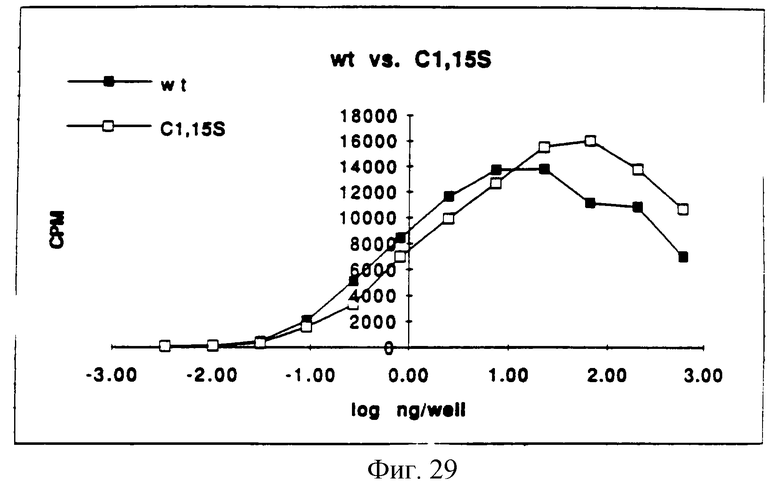

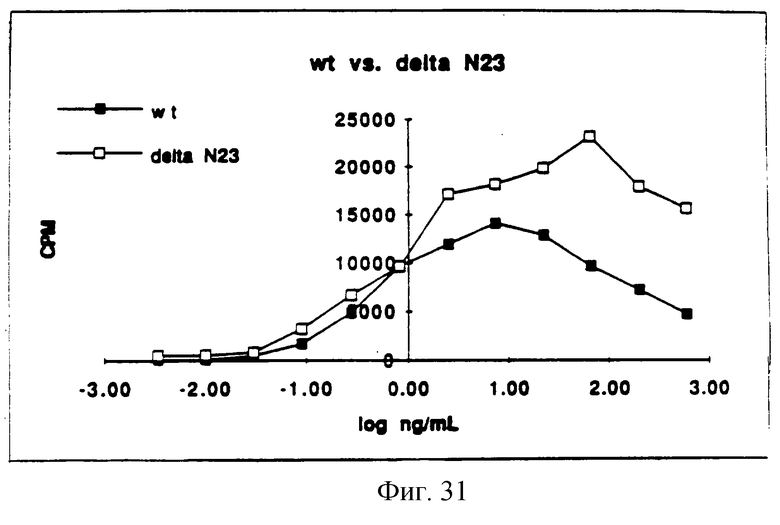
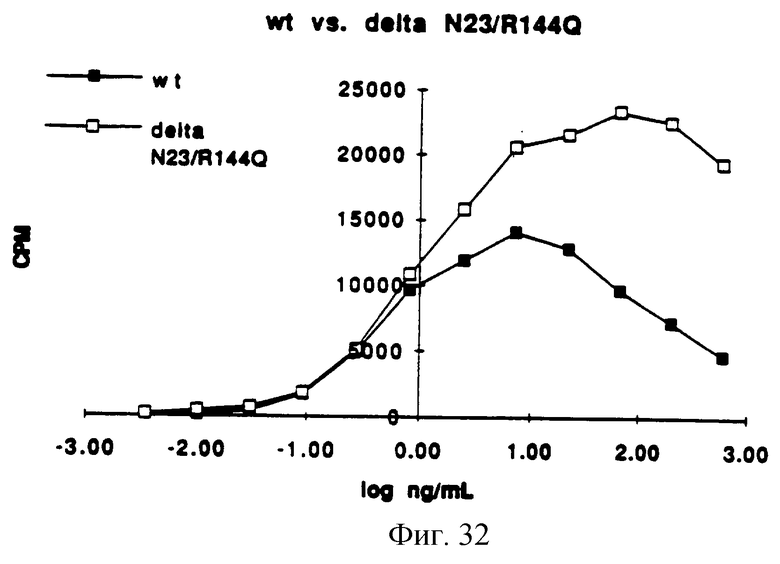
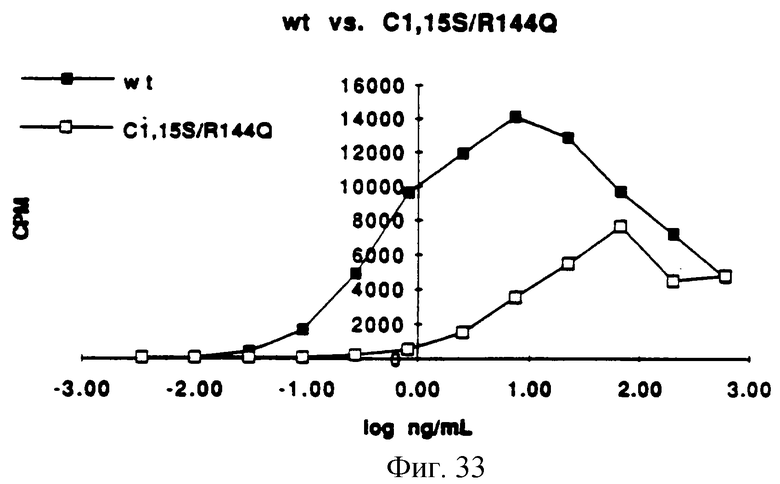
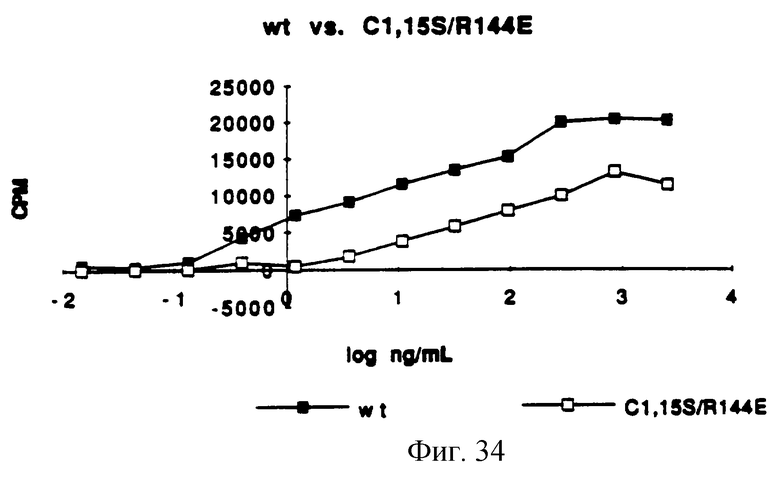
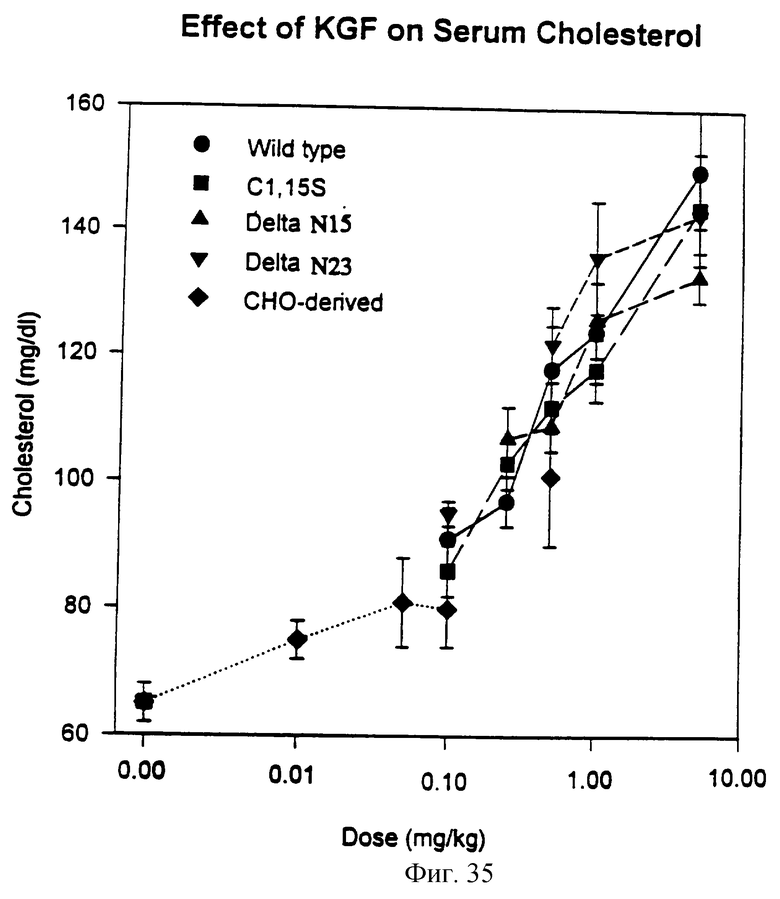



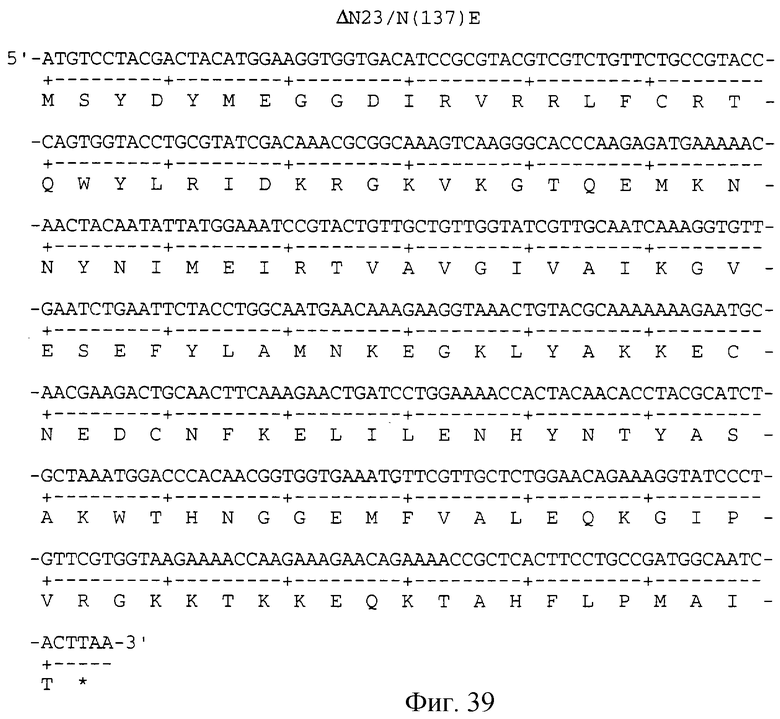






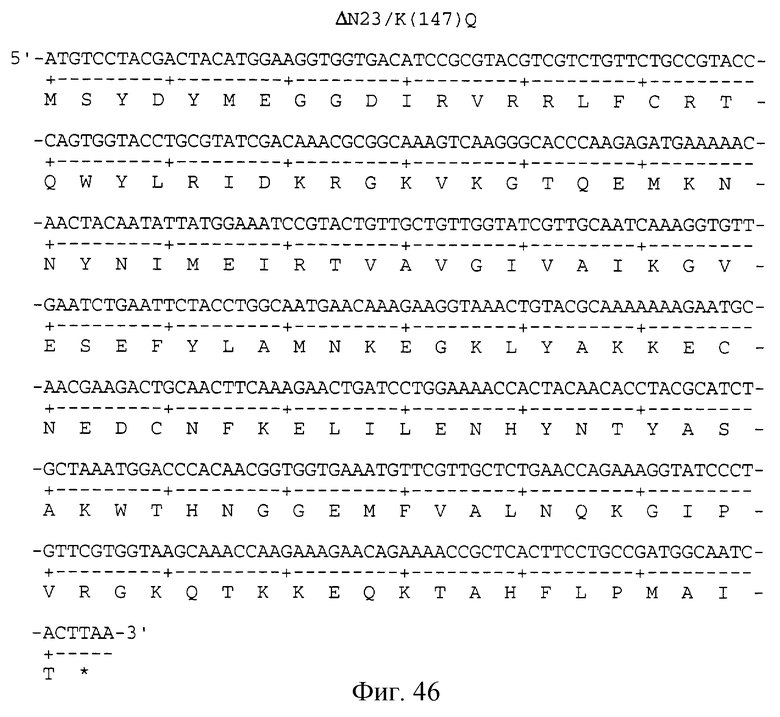
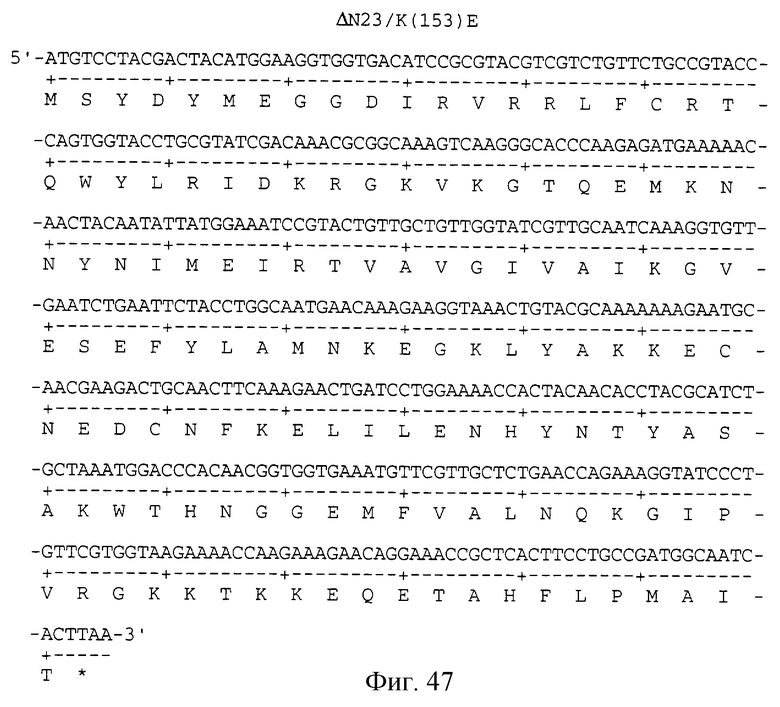


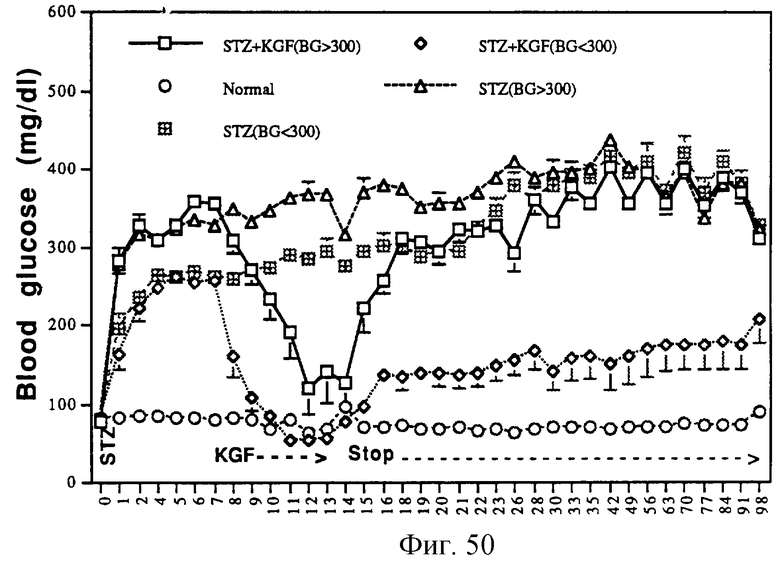
Изобретение относится к биотехнологии, к генной и белковой инженерии и может быть использовано для получения аналога фактора роста кератиноцитов (KGF). Аналог KGF получают путем модификации одной или нескольких аминокислот в области 32-55 аминокислот в последовательности SEQ ID NO:2. Остаток цистеина в положениях 32 и 46 делетируют или заменяют другой аминокислотой. Экспрессионный вектор, содержащий рекомбинантную нуклеиновую кислоту, кодирующую аналог KGF, трансформируют в клетки E.coli. Трансформированный штамм E.coli культивируют и получают аналог KGF. Аналог KGF используют в фармацевтической композиции для стимулирования роста эпителиальных клеток. Изобретение позволяет получать аналоги KGF, проявляющие повышенную устойчивость при хранении. 7 с. и 25 з.п. ф-лы, 50 ил., 5 табл.
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PG 21, КОДИРУЮЩАЯ β - ИНТЕРФЕРОН ЧЕЛОВЕКА В РАСТЕНИЯХ | 1993 |
|
RU2035513C1 |
| RON et al., Expression of biologically active rKGF, J | |||
| Biologic | |||
| Chemistry, 1993, v.268, № 4, p.2984-2988 | |||
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Устройство для отбора образцов текучих грунтов | 1973 |
|
SU510662A1 |
| L.A.BARE et al., Effect of cystein substitutions on the mifogenic activity and stability of rKGF, Bioch | |||
| Bioph | |||
| Res | |||
| Comm., 1994, v.205, p.872-879 | |||
| Пожарный двухцилиндровый насос | 0 |
|
SU90A1 |
Авторы
Даты
2003-02-10—Публикация
1995-10-12—Подача