Изобретение относятся к производному индолин-2-она, проявляющему избирательный антагонизм по отношению к гастрин-рецепторам без вызывания побочных эффектов, присущих антагонизму по отношению к ССК-A-рецепторам, и пригодному для лечения и предупреждения заболеваний пищеварительных органов, таких (заболеваний) как пептические язвы, гастриты, рефлюкс-эзофагиты и синдром Золлингера-Эллисона, и для лечения опухолей, образующихся в пищеварительной системе. Соединения проявляют также избирательный антагонизм к ССК-B-рецепторам и пригодны для лечения связанных о ССК нарушений в системе регуляции аппетита, усиления и продления анальгезии, наркотической или ненаркотической, вызывания анестезии или анальгезии и лечения и предупреждения симптомов психотических расстройств, включая навязчивое чувство страха и паники.
Гастрин является типичным гормоном пищеварительного тракта, подобным ССК, секретину и т.д. Известно, что гастрин ускоряет секрецию желудочной кислоты и пепсина, а также ускоряет рост клеток слизистой оболочки желудка и, в частности, гистаминсекреторных клеток. Хотя секрецию желудочной кислоты стимулируют гистамин, ацетилхолин и гастрин, все же из этих внутренних веществ наиболее сильнодействующим является гастрин. Известные в настоящее время лекарственные средства для регуляции секреции желудочной кислоты включают антагонисты мускаринрецепторов, такие как Пирензепин, антагонисты гистамин H2-рецепторов, такие как Циметидин, и ингибиторы H+-K+ АТФазы (аденозинтрифосфатазы), такие как Омепразол. Однако уже были сообщения, что эти лекарственные средства при поддерживаемом введении вызывают гипергастринемию вследствие сильного ингибирующего действия на секрецию желудочной кислоты, а высокий уровень гастрина вызывает повышение содержания гистамина в слизистой оболочке желудка. В этих сообщениях было также оказано, что прерывание введения этих лекарственных средств влечет за собой усиление секреции кислоты, называемое обратным действием, и высокую частоту рецедивов.
Недавно было продолжено исследование гастрина, в результате чего было найдено объяснение участия гастрина в различных заболеваниях. Поэтому возникло предположение, что избирательный антагонист гастринрецепторов был бы пригоден для лечения и предупреждения заболеваний, вызванных нарушениями связанных с гастрином физиологических функций, т.е. заболеваний пищеварительных органов, в частности пептических язв, гастритов, рефлюкс-эзофагитов и синдрома Золлингера-Эллисона, предупреждения рецедива после лечения антагонистом H2-рецепторов или ингибитором H+-K+ АТФазы или лечения и предупреждения опухолей, образующихся в желудочно-кишечном тракте.
Недавно было сообщено о нескольких антагонистах гастринрецепторов. Например, известны производные аминокислоты (глутаминовой), такие как Проглумид, и производные бензодиазепина, такие как L-365260 (выложенная заявка N 238069/88 на патент Японии). Проглумид проявляет очень низкую активность связывания с гастринрецепторами. L-365260, проявляя высокую активность связывания с гастринрецепторами, не оказывает сильного ингибирующего действия на секрецию желудочной кислоты при введении in vivo.
С другой стороны, ССК широко распределен по пищеварительной и центральной нервной системам. Известно, что ССК действует в периферийных областях главным образом через ССК-A-рецепторы, ускоряя панкреатическую секрецию, моторику желудочно-кишечного тракта и сокращения желчного пузыря, замедляя опорожнение желудка и ускоряя рост некоторых видов опухолевых клеток. Известно также, что ССК участвует в регуляции аппетита, аналгезии посредством наркотика и появлении симптомов психотических расстройств, включая нарушение в центральной нервной системе, проявляющееся в неврозе страха и паники, через ССК-B-рецепторы. Поэтому ожидается, что лекарственные средства, оказывающие избирательное антагонистическое действие по отношению к ССК-B-рецепторам, должны быть полезны для лечения связанных с ССК расстройств в системе регуляции аппетита, усиления и продления аналгезии, наркотической или ненаркотической, вызывания анестезии или аналгезии и лечения и предупреждения симптомов психотических расстройств, включая расстройства, проявляющиеся в неврозе страха и паники.
Хотя производные аминокислоты (глутаминовой), такие как Проглумид, представлены в сообщениях как антагонисты ССК-B-рецепторов, но их активность связывания с ССК-B-рецепторами очень низка.
Задачей настоящего изобретения является создание соединения, проявляющего избирательный антагонизм по отношению к гастринрецепторам без побочных эффектов, приписываемых антагонизму к ССК-A-рецепторам, с угнетением секреции желудочной кислоты in vivo и пригодного для лечения и предупреждения заболеваний пищеварительных органов, таких (заболеваний) как пептические язвы, гастриты, рефлюкс-азофагиты и синдром Золлингера-Эллисона, и для лечения опухоли, образующейся в пищеварительной системе, а также проявляющего избирательный антагонизм к ССК-B-рецепторам без побочных эффектов, приписываемых антагонизму к ССК-A-рецепторам, и пригодного для лечения связанных с ССК нарушений в системе регуляции аппетита, усиления и продления аналгезии, наркотической или ненаркотической, вызывания анестезии или аналгезии и лечения и предупреждения симптомов психотических расстройств, включая расстройство, проявляющееся в неврозе страха и паники, и промежуточного продукта, пригодного для синтеза упомянутого соединения.
В данном изобретении провели обширные исследования с целью создания избирательного антагониста гастринрецепторов и избирательного антагониста ССК-B-рецепторов. В результате они обнаружили, что вышеупомянутая цель может быть достигнута с помощью соединения, представленного формулой (I)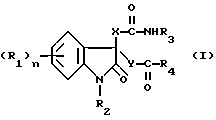
где R1 представляет атом галогена, низшую алкильную группу, низшую алкоксигруппу, гидроксильную группу, нитрогруппу, алкоксикарбонильную группу или карбоксильную группу;
R2 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную низшую алкенильную группу или замещенную или незамещенную арильную группу;
R3 представляет замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную циклоалкильную группу, или замещенную или незамещенную арильную группу;
R4 представляет замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную арильную группу, -OR5 или -NR6R7, где R5, R6 и R7 могут быть одинаковыми или различными, и каждый представляет атом водорода, замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную циклоалкильную группу, замещенную или незамещенную арильную группу, замещенную или незамещенную пиридильную, пиримидильную, индолильную или индолинильную группу или низшую алкоксигруппу;
или R6 и R7, взятые вместе, образуют -(CH2)m- или -(CH2)lNR8(CH2)k- (где k, l и m, каждый, равны целому числу от 1 до 8; и R8 представляет атом водорода или низшую алкильную группу);
X и Y могут быть одинаковыми или различными, и каждый представляет -CH2-, -NH- или -O-;
n равно целому числу от 0 до 4,
или его солью.
Предпочтительными являются соединения общей формулы (I), где
R1 представляет атом галогена или низшую алкильную группу;
R2 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную низшую алкенильную группу или замещенную или незамещенную арильную группу;
R3 представляет замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную циклоалкильную группу, или замещенную или незамещенную арильную группу;
R4 представляет замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную арильную группу, -OR5 или -NR6R7, где R5, R6 и R7 могут быть одинаковыми или различными, и каждый представляет атом водорода, замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную арильную группу, замещенную или незамещенную пиридильную, пиримидильную, индолильную или индолинильную группу или низшую алкоксигруппу; или R6 и R7, взятые вместе, образуют -(CH2)m- или -(CH2)lNR8(CH2)k- (где k, 1 и m, каждый, равны целому числу от 1 до 8; и R8 представляет атом водорода или низшую алкильную группу);
X представляет -CH2-, -NH- или -O-; Y представляет -CH2- или -NH-;
и n равно 0 или 1.
Также предпочтительными являются соединения общей формулы (I), где
R1 представляет атом галогена, низшую алкильную группу или нитрогруппу;
R2 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную низшую алкенильную группу или замещенную или незамещенную арильную группу;
R3 представляет замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную циклоалкильную группу, или замещенную или незамещенную арильную группу;
R4 представляет замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную арильную группу, -OR5 или -NR6R7, где R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу или замещенную или незамещенную циклоалкильную группу;
и R6 и R7 могут быть одинаковыми или различными, и каждый представляет атом водорода, замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную арильную группу, замещенную или незамещенную пиридильную, пиримидильную, индолильную или индолинильную группу или низшую алкоксигруппу.
Более предпочтительными являются соединения общей формулы (I), где
R1 представляет метильную группу;
R2 представляет замещенную или незамещенную низшую алкильную группу;
R3 представляет замещенную или незамещенную арильную группу;
R4 представляет -NR6R7, где R6 и R7 могут быть одинаковыми или различными, и каждый представляет атом водорода, замещенную или незамещенную арильную группу или замещенную или незамещенную пиридильную, пиримидильную, индопильную или индолинильную группу;
X и Y могут быть одинаковыми или различными, и каждый представляет -CH2- или -NH-;
и n равно 0 или 1.
Кроме того, предпочтительными являются соединение или его соль общей формулы (I), где
R2 представляет низшую алкильную группу, низшую алкильную группу, имеющую две алкоксигруппы или -O-Z-O- группу (где Z представляет замещенную или незамещенную низшую алкиленовую группу) на одном атоме углерода, низшую алкильную группу, имеющую низшую алкильную эфирную группу, или низшую алкильную группу, имеющую гетероциклическую группу;
R3 представляет арильную группу, арильную группу, имеющую низшую алкильную группу, или арильную группу, имеющую низшую алкоксигруппу;
R4 представляет -NR6R7, где R6 и R7 одинаковые или различные, и каждый представляет атом водорода, арильную группу, арильную группу, имеющую низшую алкильную группу, арильную группу, имеющую низшую алкокси группу или арильную группу, имеющую гидроксильную группу;
X и Y могут быть одинаковыми или различными, каждый, представляет -CH2- или -NH-;
и n равно 0.
Из них более предпочтительными являются соединение или его соль общей формулы (I), где
R2 представляет низшую алкильную группу, имеющую две алкоксигруппы или -O-Z-O- группу (где Z представляет замещенную или незамещенную низшую алкиленовую группу) на одном атоме углерода;
R3 представляет фенильную группу, фенильную группу, имеющую низшую алкильную группу или фенильную группу, имеющую низшую алкоксигруппу;
R4 представляет -NR6R7, где R6 представляет атом водорода и R7 представляет фенильную группу, фенильную группу, имеющую низшую алкильную группу, фенильную группу, имеющую низшую алкоксигруппу или фенильную группу, имеющую гидроксильную группу;
X представляет -NH-;
Y представляет -CH2-;
и n равно 0.
Более предпочтительны соединение или его соль общей формулы (I), где R2 представляет группу формулы (III)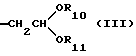
где R10 и R11, каждый, представляют замещенную или незамещенную низшую алкильную группу,
или группу формулы (IV)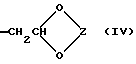
где Z представляет замещенную или незамещенную низшую алкиленовую группу.
Например, предпочтительны соединение или его соль общей формулы (I), где R2 представляет 2,2-диэтоксиэтильную группу; R3 представляет 4-метилфенильную группу; R4 представляет -NR6R7, где R6 представляет атом водорода и R7 представляет 4-метилфенильную группу; Х представляет -NH-; Y представляет -CH2-; и n равно 0.
Также предпочтительны соединение или его соль общей формулы (I), где R2 представляет 2,2-диэтоксиэтильную группу; R3 представляет 4-метилфенильную группу; R4 представляет -NR6R7, где R6 представляет атом водорода и R7 представляет 4-(N,N-диметиламино)фенильную группу; X представляет -NH-; Y представляет -CH2-; и n равно 0.
Соединения или их соkи могут быть в виде оптически активных изомеров.
Кроме того, предложено производное индолин-2-она формулы (II), которое может использоваться в синтезе соединения общей формулы (I)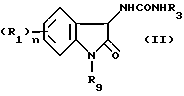
R1 представляет атом галогена, низшую алкильную группу, низшую алкоксигруппу, гидроксильную группу, нитрогруппу, алкоксикарбонильную группу или карбоксильную группу;
R3 представляет замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную циклоалкильную группу, или замещенную или незамещенную арильную группу;
n равно целому числу от 0 до 4;
R9 представляет группу формулы (III)
где R10 и R11, каждый, представляет незамещенную низшую алкильную группу, или его соль.
Предложено также производное индолин-2-она формулы (V), которое может использоваться в синтезе соединения общей формулы (I)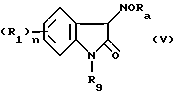
R1 представляет атом галогена, низшую алкильную группу, низшую алкоксигруппу, гидроксильную группу, нитрогруппу, алкоксикарбонильную группу или карбоксильную группу;
R9 представляет группу формулы (III)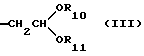
где R10 и R11, каждый, представляют незамещенную низшую алкильную группу;
Ra представляет низшую алкильную группу или аралкильную группу;
и n равно целому числу от 0 до 4;
или его соль.
Из оптически активных соединений формулы (I) или их солей предпочтительными являются (+)-соединения.
Соединения в соответствии с настоящим изобретением являются новыми соединениями, о которых ничего не было сказано ни в какой литературе, и могут быть синтезированы, например, следующим образом (см. схему 1 в конце описания).
где R1, R3 и n - такие же, как указанные выше; R12 представляет низшую алкильную группу; R'2 представляет замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную низшую алкенильную, группу, замещенную или незамещенную низшую алкинильную группу, замещенную или незамещенную арильную группу или замещенную или незамещенную гетероциклическую группу; и X представляет атом галогена или трифторметансульфонилоксигруппу (см. схему 2 в конце описания),
где R1, R'2, R3, X и n - такие же, как указанные выше; и R13 представляет низшую алкильную группу (см. схему 3 в конце описания),
где R1, R'2, R3, R13 и n - такие же, как указанные выше; R' представляет низшую алкильную группу; и R14 представляет замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную циклоалкильную группу, замещенную или незамещенную арильную группу или замещенную или незамещенную гетероциклическую группу (см. схему 4 в конце описания),
где R1, R'2, R3, R13 и n - такие же, как указанные выше; и R15 и R16 (которые могут быть одинаковыми или разными) каждый представляет атом водорода, замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную циклоалкильную группу, замещенную или незамещенную арильную группу, замещенную или незамещенную гетероциклическую группу, низшую алкоксигруппу или замещенную или незамещенную аминогруппу; или R15 и R16 вместе образуют - -(CH2)m - или -(CH2)lNR8(CH2)k, где k, l и m каждый представляет целое число от 1 до 8; и R8 представляет атом водорода или низшую алкильную группу (см. схему 5 в конце описания),
где R1, R'2, R3, R13, R15, R16 и n - такие же, как указанные выше; и Ra предпочтительно представляет замещенную или незамещенную низшую алкильную группу, еще более предпочтительно замещенную или незамещенную метильную группу и наиболее предпочтительно метильную или бензильную группу (см. схему 6 в конце описания),
где R1, R'3, R15, R16 и n - такие же, как указанные выше; R26 представляет низшую алкильную группу; R17 представляет низшую алкильную группу или низшую гидроксиалкильную группу; R18 и R19 каждый представляет низшую алкильную группу или взятые вместе образуют алкиленовую группу; R20 представляет низшую алкильную группу или низшую меркаптоалкильную группу; R22 и R23 каждый представляет низшую алкильную группу или взятые вместе образуют алкиленовую группу; и R24 и R25 каждый представляет низшую алкильную группу или взятые вместе образуют алкиленовую группу (см. схему 7 в конце описания),
где R1, R'2, R3, R15, R16 и n - такие же, как указанные выше; R'' представляет низшую алкильную группу, первичную аминогруппу, вторичную аминогруппу или алкоксигруппу; и R21 * представляет оптически активную группу (см. схему 8 в конце описания),
где R1, R'2 и n - такие же, как указанные выше.
Производное (5) димочевины может быть получено реакцией замещения между ацетальной частью ацетального промежуточного соединения (4) и производным мочевины, как показано в схеме 1. Промежуточное соединение (4) может быть получено двумя реакциями, а именно алкилированием и реакцией образования ацеталя, причем, как показано в схеме 1, может быть осуществлена любая из них.
Производное изатина, которое может быть использовано в качестве исходного материала в этом процессе, является известным соединением и имеется в продаже или может быть легко синтезировано традиционным способом, различные производные мочевины тоже имеются в продаже или могут быть легко синтезированы традиционным способом (J. Heterocyclic. Chem. т. 19, стр. 1453 (1982)).
Производное (5) димочевины предпочтительно может быть получено следующим образом. Производное (1) изатина растворяют или суспендируют в инертном растворителе, таком как сухой N,N-диметилформамид, сухой диметилсульфоксид или сухой тетрагидрофуран, и добавляют к раствору или суспензии необходимое количество основания, такого как гидрид или алкоксид металла, предпочтительно гидрид натрия или трет-бутоксид калия, при температуре в пределах от температуры охлаждения льдом до комнатной температуры. После перемешивания смеси в течение некоторого времени при температуре в пределах от температуры охлаждения льдом до комнатной температуры к ней добавляют эквимолекулярное количество (или немного больше) по отношению к производному (1) изатина галогенида, после чего смесь перемешивают в течение 1 - 15 часов при комнатной температуре или при нагреве. После завершения реакции удаляют растворитель, выпаривая его под пониженным давлением. К остатку добавляют воду, и смесь экстрагируют подходящим растворителем, таким как хлороформ или этилацетат, осушают и концентрируют под пониженным давлением. Полученный неочищенный продукт очищают подходящим способом, и в результате получают N-замещенный изатин (3).
Затем N-замещенный изатин (3) и достаточное количество подходящего триалкилортоформиата растворяют или суспендируют в подходящем спирте, и к раствору или суспензии добавляют достаточное количество кислотного катализатора, например, моногидрата пара-толуолсульфокислоты, камфарсульфокислоты или серной кислоты, после чего нагревают в течение 4 - 48 часов при перемешивании. Реакционную смесь концентрируют под пониженным давлением, и к остатку добавляют основание, например насыщенный водный гидрокарбонат натрия, с последующей экстракцией подходящим растворителем, таким как хлороформ или этилацетат. Экстракт осушают и концентрируют под пониженным давлением. Полученный неочищенный продукт очищают подходящим способом, и получают в результате ацетальное промежуточное соединение (4).
В соответствии с другим вариантом ацетальный промежуточный продукт (4) может быть получен путем проведения вышеупомянутых двух реакций в противоположном порядке, т. е. через промежуточное соединение (2), показанное на схеме 1. Этот процесс предпочтителен в том случае, когда реакция синтезирования N-замещенного изатина (3) требует нагрева.
Взятый по отношению к ацетальному промежуточному соединению (4) избыток (предпочтительно 2-3 моль на моль ацетального промежуточного соединения (4)) кислоты Льюиса, такой как безводный хлорид алюминия, этиловый эфират трифторида бора или бромид цинка, предпочтительно безводный хлорид алюминия, растворяют в инертном растворителе, таком как сухой тетрагидрофуран, дихлорметан, толуол или сухой диоксан, предпочтительно сухой тетрагидрофуран. К полученному раствору добавляют последовательно раствор ацетального промежуточного соединения (4) в сухом тетрагидрофуране и т.д. и производное мочевины в избытке (предпочтительно в количестве 2 моль на моль ацетального промежуточного соединения (4)) при температуре в пределах от температуры охлаждения льдом до комнатной температуры с последующим нагревом в течение 1-8 часов при перемешивании. После окончания реакции к реакционной смеси добавляют подходящий органический растворитель, такой как этилацетат, и смесь промывают водой, осушают и концентрируют под пониженным давлением. Остаток очищают подходящим способом, и в результате получают производное (5) димочевины.
Производное (10) диамида может быть получено путем диалкилирования положения 3 имеющегося в продаже 2-оксиндола (6) с последующим алкилированием положения 1 и затем превращением сложного эфира в амид, как показано в схеме 1 реакции.
Производное (10) диамида может быть получено предпочтительно следующим образом. 2-Оксиндол (6) растворяют в инертном растворителе, таком как сухой диметилсульфоксид, сухой N, N-диметилформамид или сухой тетрагидрофуран, предпочтительно сухой диметилсульфоксид, и к полученному раствору добавляют раствор эквимолекулярного количества основания, такого как гидроксид или алкоксид металла, предпочтительно гидроксид натрия или трет-бутоксид калия, при температуре в пределах от температуры охлаждения льдом до комнатной температуры с последующим перемешиванием при температуре в пределах от температуры охлаждения льдом до комнатной температуры в течение нескольких минут. Затем к полученной смеси добавляют эквимолекулярное количество подходящего сложного эфира бромуксусной кислоты с последующим перемешиванием при комнатной температуре в течение нескольких десятков минут. Затем к реакционной смеси добавляют эквимолекулярное количество такого же самого основания, которое было использовано выше, и эквимолекулярное количество, такого же как было использовано выше, эфира бромуксусной кислоты с последующим перемешиванием при комнатной температуре в течение нескольких десятков минут. После окончания реакции к остатку добавляют воду, и смесь экстрагируют подходящим растворителем, таким как диэтиловый эфир. Экстракт осушают и концентрируют под пониженным давлением. Поскольку полученный неочищенный продукт содержит 1-замещенное производное, его очищают подходящим способом , таким как хроматография на колонках с силикагелем, что дает в результате 3,3-бис(алкоксикарбонилметил)индолин-2-он (7) и 1,3,3-трис(алкоксикарбонилметил)индолин-2-он.
3,3-Бис(алкоксикарбонилметил)индолин-2-он (7) растворяют или суспендируют в инертном растворителе, таком как сухой N,N-диметилформамид, сухой диметилсульфоксид или сухой тетрагидрофуран, и к полученному раствору или суспензии добавляют необходимое количество основания, такого как гидрид или алкоксид металла, предпочтительно гидрид натрия или трет-бутоксид калия, при температуре в диапазоне от температуры охлаждения льдом до комнатной температуры с последующим перемешиванием в течение нескольких минут при температуре в пределах от температуры охлаждения льдом до комнатной температуры. К полученной смеси добавляют подходящий галогенид в эквимолекулярном количестве (или немного более) по отношению к соединению (7), после чего ее перемешивают в течение 1-15 часов при комнатной температуре или при нагреве. После окончания реакции удаляют растворитель путем выпаривания под пониженным давлением. К остатку добавляют воду, и смесь экстрагируют подходящим растворителем, таким как хлороформ или этилацетат, осушают и концентрируют под пониженным давлением. Полученный неочищенный продукт может быть либо очищен подходящим способом с получением 1-замещенного-3,3-биc(алкоксикарбонилметил)индолин-2-она (8), либо использован в последующей реакции без дополнительной очистки.
1-Замещенный 3,3-бис(алкоксикарбонилметил)индолин-2-он (8) растворяют в растворителе, равномерно смешивающемся с водой, таком как этанол или метанол, и к раствору добавляют водный раствор умеренно избыточного основания, такого как гидроксид калия, гидроксид натрия или карбонат калия, при комнатной температуре, после чего смесь перемешивают 1-24 часа при комнатной температуре или при нагревании. После окончания реакции реакционную смесь концентрируют под пониженным давлением. Концентрат растворяют в воде и промывают подходящим органическим растворителем, таким как хлороформ, водный слой подкисляют, например, 2 н. хлористоводородной кислотой и затем экстрагируют подходящим органическим растворителем, таким как этилацетат, получая в результате 1-замещенный 3,3-бис(гидроксикарбонилметил)индолин-2-он (9). Полученный неочищенный продукт может быть использован в последующей реакции либо без очистки, либо после очистки подходящим способом.
1-Замещенный 3,3-бис(гидроксикарбонилметил)индолин-2-он (9) превращают в амидное соединение традиционным способом, чтобы в результате получить диамидное соединение (10). Например, 1-замещенный 3,3-бис(гидроксикарбонилметил)индол-2-он (9) растворяют в инертном растворителе, таком как сухой N,N-диметилформамид или дихлорметан, и к раствору добавляют в качестве конденсирующего агента дициклогексилкарбодиимид или 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорид в количестве 2-4 моль на моль соединения (9). Затем к полученной смеси предпочтительно добавляют при комнатной температуре 0-4 моль 1-гидроксибензотриазола или 4-диметиламинопиридина в качестве активирующего агента и 2-4 моль амина (и то, и другое на моль соединения (9)). Смесь перемешивают при комнатной температуре в течение 6-24 часов. К реакционной смеси, взятой в том виде, в каком она получена, или после концентрации под пониженным давлением, добавляют разбавленную хлористоводородную кислоту. Продукт экстрагируют подходящим органическим растворителем, и органический слой промывают подходящим основанием, таким как насыщенный водный раствор гидрокарбоната натрия, осушают и концентрируют. Концентрат очищают подходящим способом, и в результате получают диимидное соединение (10).
Как показано в схеме 3, монокарбамат (13) может быть получен путем осуществления альдольной реакции N-замещенного производного (3) изатина в качестве исходного материала, превращения продукта реакции в амидное соединение и реакции полученного третичного спирта (12) с изоцианатом с использованием катализатора.
Получение производного (13) монокарбамата предпочтительно может быть осуществлено следующим образом. Получают литиевый энолят эфира уксусной кислоты путем смешивания литиевой соли вторичного амина, такой как диизопропиламид лития или гексаметилдисилазид лития, с эфиром уксусной кислоты при эквимолекулярном соотношении в растворителе, который не оказывает вредного влияния на реакцию, таком как сухой тетрагидрофуран, сухой диэтиловый эфир или сухой диоксан (предпочтительно сухой тетрагидрофуран), с перемешиванием в атмосфере азота при низкой температуре в течение нескольких минут. К полученному реакционному раствору добавляют 0,5 моль N-замещенного изатина (3) на моль литиевого энолята при низкой температуре с последующим перемешиванием при низкой температуре в течение нескольких десятков минут, и реакционную смесь вливают в воду для быстрого прекращения реакции. Продукт экстрагируют подходящим органическим растворителем, и экстракт осушают и концентрируют, что дает в результате промежуточный продукт (11) в виде сложного эфира. Этот неочищенный продукт (11) может быть использован в последующей реакции либо без очистки, либо после очистки подходящим способом.
Растворяют амин в растворителе, не оказывающем вредного влияния на реакцию, таком как сухой тетрагидрофуран, сухой диэтиловый эфир или сухой диоксан (предпочтительно сухой тетрагидрофуран), и к раствору добавляют в атмосфере азота при низкой температуре эквимолекулярное количество алкиллития (предпочтительно н-бутиллития) с последующим перемешиванием при низкой температуре в течение нескольких минут. К полученному раствору добавляют 0,5 моль промежуточного продукта (11) на моль амина, и смесь перемешивают при низкой температуре в течение нескольких десятков минут. Реакционную смесь вливают в воду для резкого прекращения реакции, и продукт экстрагируют подходящим органическим растворителем. Экстракт осушают и концентрируют, и концентрат очищают подходящим способом, получив в результате амидное промежуточное соединение (12).
Амидное промежуточное соединение (12) и избыток изоцианата растворяют в инертном растворителе, таком как сухой тетрагидрофуран, дихлорметан, ацетонитрил или толуол (предпочтительно сухой тетрагидрофуран), и к раствору добавляют небольшую часть (относительно соединения (12)) кислоты или основания, например, тетраалкоксида титана, этилового эфирата трифторида бора, диацетата дибутилолова или диизопропилэтиламина (предпочтительно диацетата дибутилолова), с последующим перемешиванием в течение 10 - 24 часов при комнатной температуре или при нагреве, реакционную смесь промывают водой, экстрагируют подходящим растворителем, осушают и концентрируют. Концентрат очищают подходящим способом, и получают в результате монокарбамат (13).
Соединения (19) мономочевины могут быть получены любым из способов, проиллюстрированных в схемах 4 и 5 реакций.
Некоторые промежуточные уреидосоединения (15), показанные в схеме 4 известны и могут быть синтезированы с использованием в качестве исходного материала производного (1) изатина в соответствии со способом, описанным в патентах (публикации N 6710/92 и N 6711/92 патентов Японии). К полученному промежуточному соединению (15) присоединяют эфир уксусной кислоты, и полученный в результате этого сложный эфир гидролизуют для получения карбоновой кислоты (17). Положение 1 соединения (17) избирательно алкилируют для получения соединения (18), которое затем превращают в монокарбамидное соединение (19) путем амидирования. Алкилирование и последующее амидирование карболовой кислоты (17) могут быть осуществлены в одну стадию.
Промежуточное уреидосоединение (23) в схеме 5 может быть синтезировано с использованием в качестве исходного материала N-замещенного изатина (3) в соответствии со способом, описанным в патентах (публикации N 6710/92 и N 6711/92 японских патентов). В соответствии с другим вариантом оно может быть получено путем превращения производного (1) изатина в алкилоксим или аралкилокси (20), например, метилоксим или бензилоксим, алкилирования положения 1, гидрирования оксима и затем перевода продукта в мочевину. N-Замещенный изатин (3) может также быть синтезирован путем алкилирования 1-положения исходного индола (32) для получения 1-замещенного индола (33), после чего индольное кольцо окисляют, например гипохлоритом, и получают соединение (34), которое затем гидролизуют так, как показано в схеме 8. В случае введения в 1-положение громоздкой группы, такой как вторичная алкильная группа, 2,2-диалкоксиэтильная группа или 2,2-диалкилэтильная группа, предпочтительным является ход реакции через алкилоксим или аралкилоксим (20) или тот ход, который включает окисление 1-замещенного индола (33). К полученному таким образом уреидоинтермедиату (23) присоединяют эфир уксусной кислоты, и полученный в результате того сложный эфир гидролизуют и получают карбоновую кислоту (18), которую затем превращают в соединение (19) мономочевины путем амидирования. В соответствии с другим вариантом можно к соединению (23) непосредственно присоединять ацетамидное производное, в результате чего будет получено соединение (19). Большинство производных (25) бромацетамида, которые могут быть использованы в этой реакции, являются известными соединениями и могут быть легко синтезированы путем смешения бромацетилбромида и амина в присутствии основания.
Соединение (19) мономочевины предпочтительно может быть получено в соответствии со схемой 4 следующим образом. Производное (1) изатина растворяют в инертном растворителе, таком как этанол или метанол, и к раствору добавляют эквимолекулярное или избыточное молярное количество (относительно соединения (1)) гидроксиламингидрохлорида или гидроксиламинсульфата и такое же количество основания, такого как водный раствор ацетата натрия, после чего смесь перемешивают в течение 1-10 часов при комнатной температуре или при охлаждении льдом. Реакционную смесь концентрируют, и концентрат очищают надлежащим способом, в результате чего получают оксимпроизводное (14). Оксимпроизводное (14) перемешивают в инертном растворителе, таком как этанол, метанол или уксусная кислота, в присутствии подходящего катализатора, такого как палладий на угле, родий на угле, оксид платины или никель Ренея, в атмосфере водорода при давлении 1-6 атмосфер и при комнатной температуре. После удаления катализатора путем фильтрования фильтрат концентрировали, и получили в результате промежуточное аминосоединение. Поскольку это соединение подвержено окислению на воздухе, его предпочтительно направляют на следующую стадию реакции без дополнительной очистки. Неочищенный продукт растворяют в инертном растворителе, таком как дихлорметан, хлороформ, N,N-диметилформамид или ацетонитрил, и к полученному раствору добавляют эквимолекулярное или немного избыточное количество (относительно амина) изоцианата при температуре в пределах от температуры охлаждения льдом до комнатной температуры с последующим перемешиванием при температуре в пределах от температуры охлаждения льдом до комнатной температуры в течение 1 - 10 часов. Продукт реакции очищают подходящим способом, и получают в результате промежуточное уреидосоединение (15).
Промежуточное уреидосоединение (15) растворяют в инертном растворителе, таком как сухой N,N-диметилформамид, сухой диметилсульфоксид или сухой тетрагидрофуран (предпочтительно сухой диметилсульфоксид), и к полученному раствору добавляют раствор эквимолекулярного количества (относительно промежуточного соединения (15)) основания, такого как гидрид или алкоксид металла (предпочтительно гидрид, натрия или трет-бутоксид калия), в сухом диметилсулфоксиде при температуре в пределах от температуры охлаждения льдом до комнатной температуры, после чего смесь перемешивают при температуре в пределах от температуры охлаждения льдом до комнатной температуры в течение 10-30 минут. Затем к смеси добавляют эфир бромуксусной кислоты в эквимолекулярном количестве по отношению к промежуточному соединению (15), и перемешивают ее при комнатной температуре в течение нескольких десятков минут. После окончания реакции к реакционной смеси добавляют воду, и смесь экстрагируют подходящим растворителем, таким как диэтиловый эфир. Экстракт осушают и концентрируют под пониженным давлением, а остаток очищают подходящим способом, в результате чего получают сложноэфирное соединение (16).
Сложный эфир (16) перемешивают в растворителе, однородно смешивающемся с водой, таком как этанол или метанол, вместе с водным раствором умеренного избытка основания, такого как гидроксид калия, гидроксид натрия или карбонат калия, при комнатной температуре в течение 1-24 часов. После окончания реакции реакционную смесь концентрируют под пониженным давлением. Концентрат растворяют в воде и промывают подходящим органическим растворителем, таким как хлороформ. Водный слой подкисляют 2 н. хлористоводородной кислотой и затем экстрагируют подходящим органическим растворителем, таким как этилацетат, в результате чего получают карбоновую кислоту (17). Полученный неочищенный продукт может быть использован в последующей реакции в том виде, как он есть, или после очистки подходящим способом.
Карбоновую кислоту (17) растворяют в растворителе, не оказывающем вредного влияния на реакцию, таком как сухой диметилсульфоксид или сухой тетрагидрофуран (предпочтительно сухой диметилсульфоксид), и к раствору добавляют раствор 2 моль (на моль карбоновой кислоты (17)) основания, такого как гидрид или алкоксид металла (предпочтительно гидрид натрия или трет-бутоксид калия), в сухом диметилсульфоксиде при комнатной температуре с последующим перемешиванием смеси при комнатной температуре в течение 10-30 минут. К смеси добавляют галогенид в эквимолекулярном количестве относительно карбоновой кислоты (17), после чего смесь перемешивают при комнатной температуре в течение нескольких десятков минут. После окончания реакции в реакционную смесь добавляют воду, и экстрагируют смесь подходящим растворителем, таким как диэтиловый эфир. Экстракт осушают и концентрируют под пониженным давлением, в результате чего получают 1-алкильное соединение (18). Полученный неочищенный продукт может быть использован в последующей реакции таким, как он есть, или после очистки подходящим способом.
1-Алкильное соединение (18) растворяют в инертном растворителе, таком как сухой N, N-диметилформамид или дихлорметан, и к раствору добавляют 1-4 моль (на моль 1-алкильного соединения(18)) конденсирующего агента, такого как дициклогексилкарбодиимид или 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорид. К раствору еще добавляют последовательно 0-4 моль 1-гидроксибензотриазола или 4-диметиламинопиридина в качестве активирующего агента и 1-4 моль амина (и то, и другое на моль 1-алкильного соединения (18)) при комнатной температуре. Смесь перемешивают при комнатной температуре в течение 1-24 часов.
В соответствии с другим вариантом 1-алкильное соединение (18) растворяют в инертном растворителе, таком как хлороформ или дихлорметан, и к раствору добавляют эквимолекулярное количество или немного более (относительно 1-алкильного соединения (18)) основания, такого как 4-диметиламинопиридин, триэтиламин, пиридин или их смесь, и эквимолекулярное количество галогенирущего агента (предпочтительно тионилхлорида) при температуре от 0oC до комнатной температуры. После перемешивания смеси в течение периода времени от 30 минут до 2 часов к ней добавляют эквимолекулярное количество или немного более (относительно 1-алкильного соединения (18)) основания, такого как 4-диметиламинопиридин, триэтиламин, пиридин или их смесь, и эквимолекулярное количество или небольшой избыток амина, после чего смесь перемешивают при комнатной температуре или при охлаждении льдом в течение периода времени от 30 минут до 4 часов.
К реакционной смеси, взятой в том виде, как она получена, или после концентрации под пониженным давлением, добавляют разбавленную хлористоводородную кислоту, и смесь экстрагируют подходящим органическим растворителем. Органический слой промывают подходящим основанием, таким как насыщенный водный раствор гидрокарбоната натрия, осушают и концентрируют. Остаток очищают подходящим способом и получают в результате соединение (19) мономочевины.
Минокарбамидное соединение (19) может быть также получено из карбоновой кислоты без выделения соединения (18). Карбоновую кислоту (17) растворяют в растворителе, не оказывающем вредного влияния на реакцию, таком как сухой N, N-диметилформамид, сухой диметилсульфоксид или сухой тетрагидрофуран (предпочтительно сухой диметилоульфоксид). К раствору добавляют при комнатной температуре раствор 2 моль (на моль карбоновой кислоты (17)) основания, такого как гидрид или алкоксид металла (предпочтительно гидрид натрия или трет-бутоксид калия), в сухом диметилсульфоксиде с последующим перемешиванием смеси при комнатной температуре в течение 10-30 минут. К смеси еще добавляют галогенид в эквимолекулярном количестве относительно карбоновой кислоты (17), после чего перемешивают смесь при комнатной температуре в течение нескольких десятков минут. После окончания реакции к реакционной смеси добавляют 1-3 моль (на моль карбоновой кислоты (17)) конденсирующего агента, такого как дициклогексилкарбодиимид или 1-этил-3-(3-диметиламинопропил)-карбодиимидгидрохлорид. После этого к смеси предпочтительно добавляют 0-3 моль (на моль 1-алкильного соединения (18)) 1-гидроксибензотриазола или 4-диметиламинопиридина в качестве активирующего агента и затем добавляют еще 1-3 моль (на моль 1-алкильного соединения (18)) амина с последующим перемешиванием при комнатной температуре в течение 6-24 часов, к реакционной смеси добавляют воду и экстрагируют смесь подходящим растворителем, таким как диэтиловый эфир. Экстракт осушают, концентрируют под пониженным давлением и очищают подходящим способом, получив в результате соединение (19) мономочевины.
Получение соединения (19) мономочевины по схеме 5 предпочтительно может быть осуществлено следующим образом. Прежде всего, получают промежуточное уреидосоединение (23) с алкилированным 1-положением, используя в качестве исходного материала N-замещенный изатин (3), который синтезируют способом, показанным в схеме 8, или путем алкилирования производного (1) изатина, так же как получают промежуточное уреидосоединение (15) в соответствии со схемой 4. В соответствии с другим вариантом промежуточное соединение (23) может быть получено следующим образом. Производное (1) изатина растворяют или суспендируют в инертном растворителе, таком как этанол или метанол, и к раствору или суспензии добавляют эквимолекулярное или избыточное молярное количество (относительно соединения (1)) O-алкилгидроксиламина или O-аралкилгидроксиламина, такого как O-метил- или бензилгидроксиламингидрохлорида, и водный раствор избыточного основания, такого как ацетат натрия, и смесь перемешивают при комнатной температуре в течение 1-10 часов. Реакционную смесь концентрируют и очищают подходящим способом, в результате чего получают алкилоксим- (например, метилоксим-) или аралкилоксим- (например, бензилоксим-) производное (20). Затем эквимолекулярное количество или немного более (относительно производного (20)) основания, такого как гидрид натрия или трет-бутоксид калия, растворяют или суспендируют в инертном растворителе, таком как сухой N, N-диметилформамид, сухой диметилсульфоксид или сухой тетрагидрофуран. К раствору или суспензии добавляют при комнатной температуре или при охлаждении льдом алкилоксим- или аралкилоксимпроизводное (20). После перемешивания при той же самой температуре в течение периода времени в интервале от 30 минут до 1 часа к смеси добавляют эквимолекулярное количество или немного более (относительно соединения (20)) галогенида с последующим дополнительным перемешиванием при комнатной температуре или при нагреве в течение 1-15 часов. После окончания реакции выпаривают растворитель под пониженным давлением, к остатку добавляют воду, и смесь экстрагируют подходящим растворителем. Экстракт осушают и концентрируют под пониженным давлением. Полученный неочищенный продукт очищают подходящим способом и получают в результате N-замещенное соединение (21), которое гидрируют и вводят в химическое взаимодействие с изоцианатом так же, как при получении промежуточного уреидосоединения (15), показанном в схеме 4, и получают в результате промежуточное уреидосоединение (23) с алкилированным положением 1.
Полученное таким образом промежуточное соединение (23) подвергают реакции присоединения эфира уксусной кислоты и реакции гидролиза сложного эфира, как показано на фиг. 5, так же, как при получении карбоновой кислоты (17), показанном в схеме 4, чтобы получить общее для обоих путей реакция промежуточное соединение (18), которое превращают в монокарбамидное соединение (19) таким же образом, как в схеме 4.
В соответствии с другим вариантом соединение (19) мономочевины может быть получено из промежуточного уреидосоединения (23) в одну стадию так, как описано ниже. Промежуточное уреидосоединение (23) растворяют в инертном растворителе, таком как сухой N,N-диметилформамид, сухой диметилсульфоксид или сухой тетрагидрофуран (предпочтительно сухой диметилсульфоксид). К раствору добавляют раствор эквимолекулярного количества (относительно промежуточного соединения (23)) основания, такого как гидрид или алкокcид металла (предпочтительно гидрид натрия или трет-бутоксид калия), в осушенном диметилсульфоксиде при температуре в пределах от температуры охлаждения льдом до комнатной температуры, после чего смесь перемешивают при температуре в пределах от температуры охлаждения льдом до комнатной температуры в течение 10-30 минут. К раствору добавляют также эквимолекулярное количество или немного более (относительно промежуточного уреидосоединения (23)) производного (25) бромацетамида с последующим перемешиванием смеси при комнатной температуре в течение нескольких десятков минут. После окончания реакции к реакционной смеси добавляют воду, и смесь экстрагируют подходящим растворителем, таким как диэтиловый эфир. Экстракт осушают и концентрируют под пониженным давлением. Остаток очищают подходящим способом, и получают в результате соединение (19) мономочевины.
N-Замещенный изатин (3) в соответствии со схемой 8 может быть получен предпочтительно следующим образом. Индол (32) растворяют в растворителе, не оказывающем вредного влияния на реакцию, таком как сухой N,N-диметилформамид, сухой диметилсульфоксид или сухой тетрагидрофуран (предпочтительно сухой диметилсульфоксид), и к полученному раствору добавляют раствор эквимолекулярного количества или избытка (относительно индола (32)) в сухом диметилсульфоксиде при комнатной температуре, после чего смесь перемешивают при комнатной температуре в течение времени от 10 минут до 1 часа. Затем к смеси добавляют эквимолекулярное или избыточное молярное количество (относительно индола (32)) галогенида, после чего смесь перемешивают при комнатной температуре или при нагреве в течение времени от нескольких десятков минут до 10 часов. После окончания реакции добавляют к реакционной смеси воду, и затем экстрагируют смесь подходящим растворителем, таким как диэтиловый эфир. Экстракт осушают и концентрируют под пониженным давлением, получая в результате 1-замещенный индол (33). Полученный неочищенный продукт может быть использован в последующей реакции или может быть очищен подходящим способом. Затем 1-замещенный индол (33) и, в качестве протонного источника, избыток дигидрофосфата калия или дигидрофосфата натрия суспендируют в подходящем растворителе, таком как этилацетат, и к полученной суспензии добавляют водный раствор избыточного гипохлорита натрия при комнатной температуре или при охлаждении льдом с последующим перемешиванием при этой температуре в течение 5-30 минут. После окончания реакции реакционную смесь промывают последовательно водой и основанием, осушают и концентрируют, в результате чего получают двухлористое соединение (34). Полученный неочищенный продукт может быть использован в последующей реакция или может быть очищен подходящим способом. Двухлористое соединение (34) растворяют в подходящем растворителе, таком как диметилсульфоксид, и к полученному раствору добавляют по каплям избыточное основание, пригодное для гидролиза, например, водный раствор гидроксида натрия, после чего смесь перемешивают в течение времени от 10 минут до 1 часа. К смеси медленно добавляют кислоту, например, концентрированную хлористоводородную, в избытке по отношению к ранее добавленному основанию, после чего смесь перемешивают при комнатной температуре в течение нескольких часов. Добавляют к реакционной смеси этилацетат, и промывают ее последовательно водой и основанием. Органический слой осушают и концентрируют, получая в результате N-замещенный изатин (3). Полученный неочищенный продукт может быть использован как промежуточный продукт в схеме 5 либо без очистки, либо после очистки подходящим способом.
Те из соединений (19) мономочевины, которые содержат ацетальную группу или аминогруппу в заместителе в положении 1, могут быть получены способами, показанными в схемах 4 и 5 реакций. Кроме того, монокарбамидное соединение (19), содержащее ацеталь в 1-заместителе, т.е. монокарбамидное соединение (28), может быть получено путем ацетального обмена с другим ацетальным соединением или путем гидролиза другого ацетального соединения с целью получения альдегида (27), который затем превращают в ацеталь (28). Монокарбамидное соединение (19), содержащее аминогруппу в 1-заместителе, т.е. монокарбамидное соединение (29), может быть получено путем проведения восстановительной реакции аминирования альдегида (27).
Монокарбамидное соединение (28), содержащее ацеталь в 1-заместителе, предпочтительно может быть получено следующим образом. Ацетальное соединение (26), полученное способом, показанным в схеме 4 или 5, растворяют в спирте для ацетального обмена и перемешивают в течение времени от 6 часов до 2 дней при нагреве в присутствии подходящей кислоты, такой как паратолуолсульфокислота, серная кислота или камфарсульфокислота, в качестве катализатора. Реакционную смесь концентрируют, и к концентрату добавляют подходящее основание, например, водный раствор гидрокарбоната натрия, с последующей экстракцией подходящим органическим растворителем. Экстракт осушают и концентрируют под пониженным давлением. Остаток очищают подходящим способом, и получают в результате соединение (28). В соответствии с другим вариантом соединение (26) растворяют или суспендируют в инертном растворителе, таком как ацетон, спирт, вода или их смесь, и к раствору или суспензии добавляют достаточное количество подходящей кислоты, такой как паратолуолсульфокислота, серная кислота или камфарсульфокислота, после чего полученную смесь перемешивают при комнатной температуре или при нагреве в течение 1-18 часов. Реакционную смесь концентрируют, добавляют к концентрату подходящее основание, например, водный раствор гидрокарбоната натрия, смесь экстрагируют подходящим органическим растворителем, и экстракт осушают и концентрируют под пониженным давлением, что дает в результате альдегид (27). Этот неочищенный продукт может быть использован в последующей реакции без очистки или после очистки подходящим способом. Альдегид (27) и подходящий одноатомный или двухатомный спирт в избытке над альдегидом (27) растворяют или суспендируют в инертном растворителе, предпочтительно толуоле или бензоле, и перемешивают в присутствии подходящего кислотного катализатора, такого как пара-толуолсульфокислота, серная кислота или камфарсульфокислота, в течение 6-48 часов при нагреве с азеотропным удалением при этом полученной воды вместе с растворителем, реакционную смесь промывают подходящим основанием, таким как водный раствор гидрокарбоната натрия, осушают и концентрируют. Концентрат очищают подходящим способом и получают в результате ацеталь (28).
Монокарбамидное соединение (28), содержащее аминогруппу в 1-заместителе, предпочтительно может быть получено следующим образом. Альдегид (27) и эквивалент или избыток амина или его водного раствора растворяют в инертном растворителе, таком как метанол. После нейтрализации раствора подходящей кислотой, такой как уксусная, трифторуксусная или хлористоводородная кислота, к раствору добавляют эквивалент или избыток (относительно соединения (27)) гидрирующего агента, такого как цианборогидрид натрия, с последующим перемешиванием при комнатной температуре в течение 4-48 часов. Реакционную смесь концентрируют, добавляют к концентрату воду, и смесь экстрагируют подходящим органическим растворителем. Экстракт осушают и концентрируют, а остаток очищают подходящим способом, в результате чего получают аминосоединение (29).
Монокарбамидное соединение (30), содержащее тиоацеталь в 1-заместителе, предпочтительно может быть получено следующим образом. Ацеталь (26), полученный способом, показанным в схеме 4 или 5, растворяют в инертном растворителе, таком как сухой тетрагидрофуран, ацетонитрил или дихлорметан, (предпочтительно дихлорметан). К раствору добавляют при комнатной или низкой температуре меркаптан в количестве 2 моль на моль соединения (26) или в избытке над соединением (26) и 2 эквивалента (относительно ацеталя (26)) подходящей кислоты Льюиса, такой как этиловый эфират трифторида бора, после чего полученную смесь перемешивают при комнатной температуре в течение времени от 10 минут до двух часов. Реакционную смесь концентрируют, добавляют к концентрату подходящее основание, такое как 1 н. гидроксид натрия, и полученную смесь экстрагируют подходящим органическим растворителем, экстракт осушают и концентрируют под пониженным давлением, и остаток очищают подходящим способом, получив в результате соединение (30).
Каждый энантиомер монокарбамидного соединения (19) может быть получен путем стереоспецифического связывания оптически активного эфира уксусной кислоты с рацемическим промежуточным уреидосоединением (23) для получения соединения (31), которое перекристаллизовывают, чтобы получить одиночный диастереомер, и этот диастереомер гидролизуют, и полученную в результате карбоновую кислоту превращают в амид, как показано в схеме 7. Одиночный диастереомер соединения (31) может быть также получен путем приготовления смеси диастереомеровсоединения (31) неизбирательным присоединением оптически активного эфира уксусной кислоты к рацемическому промежуточному уреидосоединению (23) или этерификацией рацемического промежуточного соединения (18) в виде карбоновой кислоты с последующим разделением смеси путем перекристаллизации из подходящего растворителя.
Каждый энантиомер монокарбамидного соединения (19) согласно схеме 7 предпочтительно может быть получен следующим образом. Промежуточное уреидосоединение (23) растворяют в растворителе, не оказывающем вредного влияния на реакцию (предпочтительно сухой тетрагидрофуран или сухой диоксан), в атмосфере азота, и к полученному раствору добавляют при низкой температуре эквивалент (относительно соединения (23)) соединения лития, такого как алкиллитий, амид лития или алкоксид (алкоголят) лития, после чего полученную смесь перемешивают при низкой температуре в течение 1-30 минут. Кроме того, к смеси добавляют при низкой температуре эквивалент (относительно соединения (23)) оптически активного эфира бромуксусной кислоты, предпочтительно L- или D-ментилбромацетата, с последующим перемешиванием при температуре в пределах от -10oC до комнатной температуры в течение 4-24 часов. Добавляют к реакционной смеси воду, и экстрагируют смесь подходящим органическим растворителем. Экстракт осушают и концентрируют, а остаток перекристаллизовывают 1-5 раз из подходящего растворителя, такого как диэтиловый эфир, диизопропиловый эфир, гексан, спирт, вода или их смесь, и в результате получают одиночный диастереомер соединения (31). Оптическую чистоту соединения (31) можно проанализировать путем высокоэффективной жидкостной хроматографии, по спектру ядерного магнитного резонанса высокого разрешения и т.п. Затем одиночный диастереомер соединения (31) гидролизуют так же, как при получении карбоновой кислоты (17) в схеме 4, и в результате получают общее для обоих ходов реакции оптически активное промежуточное соединение (18), которое затем переводят в оптически активное монокарбамидное соединение (19) таким же образом, как в схеме 4.
Далее настоящее изобретение будет проиллюстрировано более подробно на примерах, но следует понимать, что эти примеры никак не ограничивают настоящее изобретение.
Ссылочный пример 1
3,3-Диметоксииндолин-2-он
В 500 мл метанола растворяли 14,7 г изатина и 10,6 г триметилортоформиата, и к полученному раствору добавляли 100 мг пара-толуолсульфокислоты. Смесь нагревали с обратным холодильником в течение 7 часов, после чего ее концентрировали. К остатку добавляли хлороформ, и промывали смесь насыщенным водным раствором гидрокарбоната натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Полученный неочищенный продукт очищали путем хроматографии на колонке с силикагелем (элюент: хлороформ/этилацетат = 10/1), и в результате получили 14,7 г (76%) указанного в заголовке соединения в виде масла.
Rf = 0,38 (хлороформ/метанол = 20/1)
ИК (CCl4) 1735, 1629, 1475 см-1
ЯМР (CDCl3) δ: 8,16 (шир., 1H), 7,42 - 7,26 (м, 2H), 7,07 (ддд, J = 1,0, 7,3, 7,8 Гц, 1H), 6,88 (д, J = 7,8 Гц, 1H), 3,58 (c, 6H)
МС (m/e): 193 (M+), 165, 162, 120, 92
Ссылочный пример 2
3,3-Диэтокосииндолин-2-он
В 500 мл этанола растворяли 14,7 г изатина и 10,6 г триэтилортоформиата, и к полученному раствору добавляли 100 мг камфарсульфокислоты. Смесь нагревали с обратным холодильником в течение 12 часов, после чего ее концентрировали. К остатку добавляли хлороформ, и промывали смесь насыщенным водным раствором гидрокарбоната натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Полученный продукт очищали путем хроматографии на колонке с силикагелем (хлороформ/этилацетат = 10/1), что дало в результате 20,4 г (92%) указанного в заголовке соединения в виде масла.
Rf= 0,50 (хлороформ/метанол = 20/1)
ЯМР (CDCl3) δ: 8,40 (шир., 1H), 7,46 - 6,81 (м, 4H), 4,09 - 3,53 (м, 4H), 1,26 (т, J = 7 Гц, 6H).
Ссылочный пример 3
N-Бензилизатин
Раствор 44 г изатина в 200 мл N,N-диметилформамида добавляли по каплям к суспензии 16,0 г гидрида натрия (60%) в 100 мл N,N-диметилформамида при 0oC в струе азота. После перемешивания смеси при указанной температуре в течение 30 минут добавляли к ней раствор 61,5 г бензилбромида в 100 мл N,N-диметилформамида. Всю смесь перемешивали 1 час и затем концентрировали. К остатку добавляли хлороформ, и полученную смесь промывали насыщенным водным раствором гидрокарбоната натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Полученный неочищенный продукт промывали гексаном и перекристаллизовывали из этанола, получив в результате 47,3 г (67%) указанного в заголовке соединения в виде красных игольчатых кристаллов.
Rf = 0,22 (н-гексан/этилацетат = 5/1)
ЯМР (CDCl3 δ: 7.59 - 8,27 (м, 7H), 7,11 - 7,04 (м, 1H), 6,75 (д, J = 7,8 Гц, 1H), 5,93 (с, 2H).
Ссылочный пример 4
1-Бензил-3,3-диметоксииндолин-2-он
Указанное в заголовке соединение получали таким же образом, как в ссылочном примере 1, за исключением того, что исходным материалом был N-бензилизатин.
Rf = 0,33 (н-гексан/этилацетат = 5/1)
ЯМР (CDCl3) δ: 7,41 (д, J = 6,8 Гц, 1H), 7,28 - 7,19 (м, 6H), 7,04 (т, J = 7,8 Гц, 1H), 6,70 (д, J = 7,8 Гц, 1H), 4,86 (с, 2H), 3,60 (с, 6H).
МC (m/е): 283 (M+), 252, 210, 192, 132, 91
Ссылочный пример 5
3,3-Диметокси-5-нитроиндолйн-2-он
Указанное в заголовке соединение получали так же, как в ссылочном примере 1, за исключением того, что исходным материалом был 5-нитроизатин.
Rf = 0,32 (хлороформ/метанол = 20/1)
ЯМР (CDCl3) δ: 8,32, (с, 1H), 7,36 - 7,26 (м, 2H), 7,01 (д, J = 9,2 Гц, 1H), 3,62 (с, 6H).
МС (m/е): 238 (M+), 210, 180, 165
Ссылочный пример 6
3,3-Диметокси-1-фенилиндолин-2-он
Указанное в заголовке соединение получали так же, как в ссылочном примере 1, за исключением того, что исходным материалом был N-фенилизатин.
Rf = 0,38 (н-гексан/этилацетат = 5/1)
ЯМР (CDCl3) δ: 7,60 - 6,72 (м, 9H), 3,64 (с, 6H).
МС (m/е): 269 (M+), 241, 208, 195, 180, 166
Ссылочный пример 7
1-Аллил-3,3-диметоксииндолин-2-он
Раствор 3,86 г 3,3-диметоксииндолин-2-она в 30 мл N,N-диметилформамида добавляли по каплям к суспензии 1,2 г гидрида натрия (60%) в 40 мл N,N-диметилформамида при 0oC в струе азота. После перемешивания смеси при указанной температуре в течение 30 минут к ней добавляли 2,60 мл аллилбромида. Полученную смесь перемешивали 1 час и затем концентрировали. К остатку добавляли хлороформ, и полученную смесь промывали водным раствором хлорида натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Полученный неочищенный продукт очищали путем хроматографии на колонке с силикагелем (хлороформ/гексан = 1/1), что дало в результате 4,19 г (90%) указанного в заголовке соединения.
Rf = 0,85 (хлороформ/метанол = 20/1)
ЯМР (CDCl3) δ: 7,52 - 6,71 (м, 4H), 6,20 - 5,55 (м, 1H), 5,41 - 5,00 (м, 2H), 4,30 (д, J = 5 Гц, 2H), 3,57 (с, 6H).
Ссылочный пример 8
3,3-Диметокси-1-(2,2-диметоксиэтил)индолин-2-он
Раствор 34,3 г 3,3-диметоксииндолин-2-она в 400 мл N,N-диметилформамида добавляли по каплям к суспензии 8,56 г гидрида натрия (60%) в 100 мл N,N-диметилформамида при 0oC в струе азота. После перемешивания смеси при указанной температуре в течение 30 минут к ней добавляли 36,2 г диметилацеталя бромацетальдегида. Полученную смесь перемешивали при 80oC в течение 1 дня и затем концентрировали. К остатку добавляли этилацетат, и полученную смесь промывали водным раствором хлорида натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Полученный неочищенный продукт перекристаллизовывали из смеси изопропиловый спирт/гексан, что дало 25,1 г (50%) указанного в заголовке соединения.
Rf = 0,43 (н-гекоан/этилацетат = 2/1)
ЯМР (CDCl3) δ: 7,51 - 6,90 (м, 4H), 4,59 (т, J = 5,5 Гц, 1H), 3,77 (д, J = 5,5 Гц, 2H), 3,55 (c, 6H), 3,40 (с, 6H).
Ссылочный пример 9
1-(2.2-Диэтоксиэтил)-3,3-диметоксииндолин-2-он
Указанное в заголовке соединение получали так же, как в ссылочном примере 8, за исключением того, что в качестве реагента использовали диэтиловый ацеталь бромацетальдегида.
Rf = 0,71 (хлороформ/метанол = 20/1)
ЯМР (CDCl3) δ: 7,48 - 6,70 (м, 4H), 4,66 (т, J = 5 Гц, 1H), 3,78 - 3,28 (м, 6H), 3,52 (с, 6H), 1,12 (т, J = 7 Гц, 6H).
МС (m/e): 309 (M+), 232, 178, 132, 103
Ссылочный пример 10
3,3-Диэтокси-1-(2,2-Диэтоксиэтил)индолин-2-он
Указанное в заголовке соединение получали так же, как в ссылочном примере 8, за исключением того, что использовали в качестве исходного материала 3,3-диэтоксииндолин-2-он и в качестве реагента диэтилацеталь бромацетальдегида.
ЯМР (CDCl3) δ: 7,39 - 7,26 (м, 2H), 7,09 - 7,01 (м, 2H), 4,71 (т, J= 5,4 Гц, 1H), 3,95 - 3,67 (м, 8H), 3,57 - 3,43 (м, 2H), 1,22 (т, J = 7,4 Гц, 6H), 1,12 (т, J= 7,4 Гц, 6H).
Ссылочный пример 11
3,3-Ди-н-пропокси-1-(2,2-ди-н-пропоксиэтил)индолин-2-он
К раствору 7,18 г 3,3-диметокси-1-(2,2-диметоксиэтил)- индолин-2-она в 200 мл н-пропанола добавляли 0,1 г камфарсульфокислоты, и полученную смесь нагревали с обратным холодильником в течение 4 дней. Реакционную смесь концентрировали, добавляли к остатку дихлорметан, и полученную смесь промывали насыщенным водным раствором гидрокарбоната натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Остаток очищали путем хроматографии на колонке с силикагелем (гексан/этилацетат = 10/1), и в результате получили 9,35 г (93%) указанного в заголовке соединения в виде бесцветного масла.
ЯМР (CDCl3) δ: 7,45 - 6,85 (м, 4H), 4,67 (т, J = 5 Гц, 1H), 3,85 - 3,18 (м, 10H), 1,82 - 1,16 (м, 8H), 1,10 - 0,67 (м, 12H).
MC (m/e): 393 (M+), 334, 232, 162, 131, 89.
Пример 1
1-Бензил-3,3-бис(N'-(4-метилфенил)уреидо)индолин-2-он
К раствору 0,80 г безводного хлорида алюминия в 20 мл сухого тетрагидрофурана добавляли последовательно раствор 0,57 г 1-бензил-3,3-диметоксииндолин-2-она в 10 мл сухого тетрагидрофурана и 0,60 г пара-толилмочевины при 0oC в атмосфере азота, и полученную смесь нагревали с обратным холодильником в течение 2 часов. К реакционной смеси добавляли этилацетат, и полученную смесь промывали дважды водным раствором хлорида натрия. Органический слой осушали над безводным сульфатом натрия и затем концентрировали. Остаток очищали путем хроматографии на колонке с силикагелем (хлороформ/этилацетат = 4/1), и получили в результате 0,24 г (23%) 1-бензил-3,3-бис(N'-(4-метилфенил)уреидо)индолин-2-она в виде белого порошка.
Rf = 0,49 (хлороформ/метанол = 20/1).
ЯМР (ДМСО-d6) δ: 8,71 (с, 2H), 7,82 (д, J = 7,8 Гц, 1H), 7,44 - 7,13 (м, 17H), 6,76 (д, J = 7,8 Гц, 1H), 4,96 (с, 2H), 2,21 (с, 6H).
FAB МС : 520 (M+H)+, 370, 263, 237, 147, 107.
Пример 2
3,3-Бис(N'-(4-метилфенил)уреидо)-5-нитроиндолин-2-он
Указанное в заголовке соединение получали так же, как в примере 1, за исключением замены 1-бензол-3,3-диметоксииндолин-2-она, использованного в примере 1 в качестве исходного материала, 3,3-диметокси-5-нитроиндолин-2-оном.
ЯМР (ДМСО-d6) δ: 11,32 (шир., 1H), 8,69 (c, 2H), 8,64 (д, J = 2,4 Гц, 1H), 8,18 (дд, J = 2,4, 8,8 Гц, 1H), 7,38 (с, 2H), 7,29 - 6,99 (м, 9H), 2,21 (с, 6H).
Примеры 3 - 7
Следующие ниже соединения получали так же, как в примере 1, за исключением замены 1-бензил-3,3-диметоксииндолин-2-она, использованного в примере 1 в качестве исходного материала, на 3,3-диметоксииндолин-2-он, имеющий иной заместитель в положении 1.
Пример 3
1-Аллил-3,3-бис(N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (ДМСО-d6) δ: 8,70 (с, 2H), 7,83 (д, J = 6,8 Гц, 7,27 - 6,89 (м, 13H), 5,90 - 5,81 (м, 1H), 5,38 (д, J = 16,1 Гц, 1H), 5,20 (д, J = 8,8 Гц, 1H), 4,37 (шир., 2H), 2,21 (с, 6H).
Пример 4
3,3-Бис(N'-(4-метилфенил)уреидо)-1-фенилиндолин-2-он
Rf = 0,37 (CHCl3/AcOEt = 5/1).
ЯМР (ДМСО-d6) δ: 8,74 (с, 2H), 7,91 (д, J = 6,3 Гц, 1H), 7,65 - 7,01 (м, 17H), 6,68 (д, J = 7,8 Гц, 1H), 2,21 (с, 6H).
Пример 5
1-(2,2-Диметоксиэтил)-3,3-бис(N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (ДМСО-d6) δ: 8,72 (с, 2H), 7,84 (д, J = 7,3 Гц, 1H), 7,26 - 6,98 (м, 13H), 4,63 (т, J = 4,9 Гц, 1H), 3,81 (д, J = 4,9 Гц, 2H), 3,36 (с, 6H), 2,20 (с, 6H).
Пример 6
3,3-Бис(N'-(4-метилфенил)уреидо)-1-(2,2-ди-н-пропоксиэтил)индолин-2-он
Rf = 0,29 (CHCl3/MeOH = 20/1).
ЯМР (CDCl3) δ: 7,82 (шир., 2H), 7,63 (д, J = 7,3 Гц, 1H), 7,26 (т, J = 4,4 Гц, 1H), 7,11 (д, J = 8,3 Гц, 4H), 7,03 - 6,91 (м, 2H), 6,89 (д, J = 8,3 Гц, 4H), 6,68 (шир. , 2H), 4,76 (т, J = 5,4 Гц, 1H), 3,85 (д, J = 5,4 Гц, 2H), 3,69 - 3,42 (м, 4H), 2,20 (с, 6H), 1,52 (кв, J = 7,3 Гц, 4H), 0,82 (т, J = 7,3 Гц, 6H).
Пример 7
(RS)-1-(2-Этокси-2-метоксиэтил)-3,3-бис(N'-(4-метилфенил)уреидо) индолин-2-он
ЯМР (CDCl3) δ: 7,79 (шир., 2H), 7,76 (д, J = 8,2 Гц, 1H), 7,26 - 6,82 (м, 13H), 4,77 (т, J = 5,6 Гц, 1H), 3,87 - 3,53 (м, 4H), 3,41 (с, 3H), 2,16 (с, 6H), 1,13 (т, J = 7,1 Гц, 3H).
Пример 8
3,3-Бис(N'-(4-метилфенил)уреидо)индолин-2-он
К раствору 12,0 г безводного хлорида алюминия в 150 мл сухого тетрагидрофурана добавляли последовательно раствор 5,79 г изатин-3,3-диметилацеталя в 150 мл сухого тетрагидрофурана и 9,0 г пара-толилмочевины при 0oC в среде азота, и полученную смесь нагревали с обратным холодильником в течение 40 минут. Добавляли к реакционной смеси этилацетат, и полученную смесь промывали дважды водным раствором хлорида натрия. Органический слой осушали над безводным сульфатом натрия и затем концентрировали. К остатку добавляли 150 мл диэтилового эфира, и нерастворимое вещество удаляли путем фильтрации. Фильтрат концентрировали и перекристаллизовывали из ацетона, получив в результате 4,61 г (36%) указанного в заголовке соединения в виде белого порошка.
Rf = 0,38 (хлороформ/этилацетат = 1/2).
ЯМР (ДМСО-d6) δ: 10,57 (c, 1H), 8,68 (c, 2H), 7,77 (д, J = 7,8 Гц, 1H), 7,21 - 7,14 (м, 7H), 7,02 - 6,79 (м, 6H), 2,21 (c, 6H).
FAB MC: 430 (M+H)+, 280, 147.
ИК (KBr) 3350, 1730, 1675, 1652, 1607, 1548, 1515, 1314, 1242 см-1.
Пример 9
3,3-Бис(N'-фенилуреидо)индолин-2-он
Указанное в заголовке соединение получали так же, как в примере 8, за исключением того, что в качестве исходного материала вместо пара-толилмочевины, использованной в примере 8, использовали фенилмочевину. Выход: 28%.
Rf = 0,31 (хлороформ/этилацетат = 1/2).
ЯМР (ДМСО-d6) δ: 10,61 (с, 1H), 8,80 (с, 2H), 7,78 (д, J = 7,8 ГЦ, 1H), 7,33 - 7,16 (м, 11H), 6,94 - 6,79 (м, 4H).
Пример 10
1-(2,2-Диэтоксиэтил)-3,3-бис(N'-(4-метилфенил)уреидо)индолин-2-он
К раствору 4,00 г безводного хлорида алюминия в 30 мл сухого тетрагидрофурана добавляли последовательно раствор 3,37 г N-(2,2-диэтоксиэтил)изатин-3,3-диэтилацеталя в 30 мл сухого тетрагидрофурана и 3,01 г пара-толилмочевины при 0oC в атмосфере азота, и полученную смесь нагревали с обратным холодильником в течение 2 часов. Добавляли к реакционной смеси этилацетат, и полученную смесь промывали дважды безводным раствором хлорида натрия. Органический слой осушали над безводным сульфатом натрия и затем концентрировали. Остаток хроматографировали на силикагеле (хлороформ/метанол = 50/1) и перекристаллизовывали из диэтилового эфира, что дало в результате 0,744 г (14%) указанного в заголовке соединения в виде белого порошка.
Rf = 0,44 (хлороформ/метанол = 20/1).
ЯМР (CDCl3) δ: 7,79 (шир., 2H), 7,76 (д, J = 8,2 Гц, 1H), 7,26 - 6,82 (м, 13H), 4,77 (т, J = 4,9 Гц, 1H), 3,82 - 3,57 (м, 6H), 2,16 (c, 6H), 1,13 (т, J = 7,1 Гц, 1H).
Примеры 11 - 21
Следующие ниже соединения получали так же, как в примере 10, за исключением замены пара-толилмочевины, использованной в примере 10, на различные арилмочевины.
Пример 11
1-(2,2-Диэтоксиэтил)-3,3-бис(N'-(4-метоксифенил)уреидо)индолин-2-он
Rf = 0,33 (CHCl3/MeOH = 20/1).
ЯМР (CDCl3) δ:/ 7,73 (шир., 2H), 7,70 (д, J = 7,3 Гц, 1H), 7,28 (т, J = 7,8 Гц, 1H), 7,12 (д, J = 9,2 Гц, 4H), 7,08 - 6,96 (м, 2H), 6,67 (шир., 2H), 6,64 (д, J = 9,2 Гц, 4H), 4,77 (т, J = 4,8 Гц, 1H), 3,86 (д, J= 4,8 Гц, 2H), 3,81 - 3,49 (м, 4H), 3,68 (с, 6H), 1,12 (т, J = 7,3 Гц, 6H).
Пример 12
1-(2,2-Диэтоксиэтил)-3,3-бис(N'-(4-метоксикарбонилуреидо)индолин-2-он
Rf = 0,15 (CHCl3/MeOH = 20/1).
ЯМР (CDCl3) δ: 8,17 (c, 2H), 7,83 (д, J = 7,8 Гц, 1H), 7,63 (д, J = 8,3 Гц, 4H), 7,33 - 7,17 (м, 7H), 7,10 - 6,97 (м, 2H), 4,84 (т, J = 4,9 Гц, 1H), 3,81 (с, 6H), 3,85 - 3,60 (м, 6H), 1,16 (т, J = 6,8 Гц, 6H).
Пример 13
3,3-Бис(N'-(4-цианфенил)уреидо)-1-(2,2-диэтокcиэтил)индолин-2-он
Rf = 0,16 (CHCl3/MeOH = 20/1).
ЯМР (ДМСО-d6) 9,30 (c, 2H), 7,84 (д, J = 7,4 Гц, 1H), 7,67 - 7,46 (м, 10H), 7,29 (т, J = 7,4 Гц, 1H), 7,12 (д, J = 7,8 Гц, 1H), 7,01 (т, J = 7,8 Гц, 1H), 4,73 (т, J = 5,4 Гц, 1H), 3,80 (д, J = 5,4 Гц, 2H), 3,73 - 3,49 (м, 4H), 1,08 (т, J = 7,4 Гц, 6H).
Пример 14
1-(2,2-Диэтоксиэтил)-3,3-бис(N'-(4-фторфенил)уредидо)индолин-2-он
Rf = 0,22 (CHCl3/MeOH = 20/1)
ЯМР (CDCl3) δ: 7,88 (с, 2H), 7,79 (д, J = 6,8 Гц, 1H), 7,31 (т, J = 6,8 Гц, 1H), 7,17 - 6,97 (м, 8H), 6,75 (т, J = 8,8 Гц, 4H), 4,79 (т, J = 5,3 Гц, 1H), 3,85 (д, J = 5,3 Гц, 2H), 3,79 - 3,56 (м, 4H), 1,13 (т, J = 7,8 Гц, 6H).
Пример 15
1-(2,2-Диэтоксиэтил)-3,3-бис(N'-(3-фторфенил)уреидо)индолин-2-он
Rf = 0,27 (CHCl3/MeOH = 20/1)
ЯМР (CDCl3) δ: 8,01 (с, 2H), 7,82 (д, J = 7,3 Гц, 1H), 7,35 - 6,90 (м, 10H), 6,82 (д, J = 7,3 Гц, 1H), 6,57 (т, J = 7,3 Гц, 2H), 4,82 (т, J = 4,8 Гц, 1H), 3,88 (д, J = 4,8 Гц, 2H), 3,83 - 3,60 (м, 4H), 1,15 (т, J = 6,8 Гц, 6H).
Пример 16
1-(2,2-Диэтоксиэтил)-3,3-бис(N'-(4-нитрофенил)уреидо)индолин-2-он
Rf = 0,21 (CHCl3/MeOH = 20/1).
ЯМР (CDCl3-ДМСО-d6) δ: 9,24 (c, 2H), 8,07 (д, J = 9,5 Гц, 4H), 7,95 (д, J = 6,3 Гц, 1H), 7,50 (д, 9,5 Гц, 4Н), 7,45 (с, 2Н), 7,30 (т, J = 7,8 Гц, 1Н), 7,12 - 7,02 (м, 2H), 4,82 (т, J = 5,4 Гц, 1H), 3,91 (д, J = 5,4 Гц, 2H), 3,81 - 3,65 (м, 4H), 1,17 (т, J = 6,8 Гц, 6H).
Пример 17
1-(2,2-Диэтоксиэтил)-3,3-бис(N'-(4-трифторметилфенил)уреидо) индолин-2-он
Rf = 0,29 (CHCl3)/MeOH = 20/1).
ЯМР (CDCl3) δ: 8,03 (шир., 2H), 7,86 (д, J = 7,8 Гц, 1H), 7,46 - 6,95 (м, 13H), 4,84 (т, J = 5,4 Гц, 1H), 3,90 - 3,61 (м, 6H), 1,27 - 1,12 (м, 6H).
Пример 18
1-(2,2-Диэтоксиэтил)-3,3-бис(N'-(2-фторфенил)уреидо)индолин-2-он
Rf = 0,35 (н-гексан/этилацетат = 2/1)
ЯМР (CDCl3) δ: 7,89 - 7,82 (м, 3H), 7,71 (с, 2H), 7,28 (т. J = 6,1 Гц, 1H), 7,18 (шир., 2H), 7,10 - 6,98 (м, 2H), 6,89 - 6,78 (м, 6H), 4,82 (т, J = 5,3 Гц, 1H), 3,91 (д, J = 5,3 Гц, 2H), 3,82 - 3,71 (м, 2H), 3,67 - 3,58 (м, 2H), 1,13 (т, J = 6,9 Гц, 6H).
Пример 19
3,3-Бис(N'-(2-цианфенил)уреидо)-1-(2,2-диэтоксиэтил)индолин-2-он
Rf = 0,25 (н-гексан/этилацетат = 2/1)
ЯМР (CDCl3-ДMCO-d6) δ: 8,79 (с, 2H), 8,30 (с, 2H), 8,17 (д, J = 8,3 Гц, 2H), 7,98 (д, J = 5,6 Гц, 1H), 7,49 - 7,38 (м, 4H), 7,27 (дт, J = 1,3, 6,3 Гц, 1H), 7,09 - 6,95 (м, 4H), 4,79 (т, J = 5,3 Гц, 1H), 3,89 (д, J = 5,3 Гц, 2H), 3,79 - 3,73 (м, 2H), 3,63 - 3,53 (м, 2H), 1,17 (т, J = 6,9 Гц, 6H).
Пример 20
3,3-Бис(N'-(4-бромфенил)уреидо)-1-(2,2-диэтоксиэтил)индолин-2-он
Rf = 0,48 (CHCl3/MeOH = 20/1).
ЯМР (CDCl3-ДMCO-d6) δ: 8,65 (с, 2H), 7,84 (д, J = 7,3 Гц, 1H), 7,30 - 7,25 (м, 10H), 7,10 - 6,96 (м, 3H), 4,79 (т, J = 5,3 Гц, 1H), 3,88 (д, J = 5,3 Гц, 2H), 3,81 - 3,48 (м, 4H), 1,17 - 1,12 (м, 6H).
Пример 21
3,3-Бис(N'-(3-бромфенил)уреидо)-1-(2,2-диэтоксиэтил)индолин-2-он
Rf = 0,48 (CHCl3/MeOH = 20/1).
ЯМР (CDCl3) δ: 7,99 (шир., 2H), 7,82 (д, J = 7,7 Гц, 1H), 7,57 (с, 2H), 7,33 - 7,24 (м, 3H), 7,09 - 6,93 (м, 6H), 6,96 - 6,80 (м, 2H), 4,86 (т, J = 5,0 Гц, 1H), 3,88 (д, J = 5,0 Гц, 2H), 3,84 - 3,62 (м, 4H), 1,19 - 1,12 (м, 6H).
Ссылочный пример 12
3,3-Бис(этоксикарбонилметил)индолин-2-он
К раствору 1,33 г оксиндола в 20 мл сухого диметилсульфоксида добавляли 10 мл 1М раствора трет-бутоксида калия в сухом диметилсульфоксиде при комнатной температуре в атмосфере азота, после чего смесь перемешивали в течение 10 минут. К полученной смеси добавляли по каплям 1,11 мл этилбромацетата, после чего перемешивали смесь при той же самой температуре в течение 20 минут. Еще добавляли к смеси 10 мл 1М раствора трет-бутоксида калия в сухом диметилсульфоксиде, после чего перемешивали смесь в течение 10 минут. К полученной смеси добавляли по каплям 1,11 мл этилбромацетата. Полученную смесь перемешивали при той же самой температуре в течение 20 минут. Реакционную смесь обрабатывали водным раствором хлорида натрия и экстрагировали диэтиловым эфиром. Слой диэтилового эфира осушали над безводным сульфатом магния и концентрировали. Остаток очищали путем хроматографии на колонке с силикагелем (гексан/этилацетат = 2/1), получив в результате 0,79 г (26%) указанного в заголовке соединения.
Rf = 0,22 (гексан/этилацетат = 2/1).
ЯМР (CDCl3) δ: 7,87 (с, 1H), 7,30 - 7,18 (м, 2H), 7,04 - 6,86 (м, 2H), 4,03 - 3,91 (м, 4H), 3,03 (д, J = 16,1 Гц, 2H), 2,88 (д, J = 16,1 Гц, 2H), 1,07 (т, J = 7,3 Гц, 6H).
МС (m/е): 305 (M+), 232, 186, 174, 146, 130.
Ссылочный пример 13
3,3-Бис((1,1-диметилэтокси)карбонилметил)индолин-2-он
Указанное в заголовке соединение получали так же, как в ссылочном примере 12, за исключением того, что в качестве исходного материала использовали трет-бутилбромацетат вместо этилбромацетата, использованного в ссылочном примере 12.
Rf = 0,29 (гексан/этилацетат = 2/1).
ЯМР (CDCl3) δ: 9,03 (шир., 1H), 7,42 - 6,80 (м, 4H), 2,83 (с, 4H), 1,19 (с, 18H).
МС (m/e): 361 (M+), 249, 204, 191, 145.
Ссылочный пример 14
3,3-Бис(гидроксикарбонилметил)индолин-2-он
К раствору 0,73 г 3,3-бис(этоксикарбонилметил)индолин-2-она в 40 мл этанола добавляли раствор 1,25 г гидроксида калия (85%) в 5 мл воды при комнатной температуре, и полученную смесь перемешивали при указанной температуре в течение 15 часов, после чего концентрировали. Концентрат растворяли в воде, промывали хлороформом, регулировали до pH 2 10%-ной хлористоводородной кислотой и концентрировали. К остатку добавляли этилацетат, и отфильтровывали нерастворимые вещества, фильтрат концентрировали и очищали путем хроматографии на колонке LH-20 (элюент:метанол). Выход: 86%.
Rf = 0,27 (хлороформ/метанол = 1/1).
ЯМР (ДМСО-d6) δ: 12,14 (шир., 2H), 10,35 (с, 1H), 7,27 (д, J = 7,2 Гц, 1H), 7,17 - 7,09 (м, 1H), 6,92 - 6,76 (м, 2H), 2,88 (д, J = 16,0 Гц, 2H), 2,64 (д, J = 16,0 Гц, 2H).
Пример 22
3,3-Бис((4-метилфенил)карбамоилметил)индолин-2-он
К раствору 0,25 г 3,3-бис(гидрокоикарбонилметил)индолин-2-она и 1,24 г дициклогексилкарбодиимида в 30 мл N,N-диметилформамида добавляли последовательно 0,92 г 1-гидроксибензотриазола и 0,64 г пара-толуидина при комнатной температуре. Полученную смесь перемешивали при комнатной температуре 12 часов и концентрировали, к остатку добавляли этилацетат, и полученную смесь промывали последовательно разбавленной хлористоводородной кислотой и насыщенным водным раствором гидрокарбоната натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Неочищенный продукт хроматографировали на колонке с силикагелем (хлороформ/метанол = 50/1) и затем перекристаллизовывали из бензола, получив в результате 0,54 г (63%) указанного в заголовке соединения в виде белого порошка.
ЯМР (ДМСО-d6) δ: 10,32 (c, 1H), 9,77 (с, 2H), 7,33-6,81 (м, 12H), 3,09 (д, J = 14,9 Гц, 2H), 2,72 (д, J = 14,9 Гц, 2H), 2,21 (с, 6H).
МС (m/е): 427 (M+), 321, 293, 172, 159, 107.
Пример 23
1-Бензил-3,3-бис((4-метилфенил)карбамоилметил)индолин-2-он
К суспензии 0,05 г гидрида натрия (60%) в 5 мл N,N-диметилформамида добавляли по каплям раствор 0,36 г 3,3-бис((1,1-диметилэтокси)карбонилметил)индолин-2-она в 5 мл N,N-диметилформамида при 0oC в струе азота. После перемешивания смеси при указанной температуре в течение 30 минут к ней добавляли 0,12 мл бензилбромида. Всю смесь перемешивали 1 час и затем концентрировали. К концентрату добавляли хлороформ, и смесь промывали водным раствором хлорида натрия. Водный раствор осушали над безводным сульфатом натрия и концентрировали, получив в результате 1-бензил-3,3-бис((1,1-диметилэтокси)карбонилметил)индолин-2-он.
Rf = 0,66 (гексан/этилацетат = 2/1).
ЯМР (CDCl3) δ: 7,35 - 6,50 (м, 9H), 4,89 (с, 2H), 3,04 - 2,78 (м, 4H), 1,17 (с, 18H).
Полученный описанным выше образом 1-бензил-3,3-бис((1,1- диметилэтокси)карбонилметил)индолин-2-он растворяли в 15 мл этанола, и к раствору добавляли раствор 0,66 г гидроксида калия (85%) в 2 мл воды при комнатной температуре. Полученную смесь нагревали с обратным холодильником в течение 5 часов, после чего концентрировали. Остаток растворяли в воде, промывали хлороформом и регулировали до pH 2 10%-ной хлористоводородной кислотой. Полученный продукт экстрагировали этилацетатом, и органический слой осушали над безводным сульфатом натрия и концентрировали. Остаток растворяли в 10 мл хлороформа, и к полученному раствору добавляли последовательно 0,62 г дициклогексилкарбодиимида, 0,46 г 1-гидроксибензотриазола и 0,32 г пара-толуидина, после чего смесь перемешивали при комнатной температуре в течение 5 часов. Полученный осадок отфильтровывали, и фильтрат промывали последовательно разбавленной хлористоводородной кислотой и насыщенным водным раствором гидрокарбоната натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Неочищенный продукт очищали путем хроматографии на колонке с силикагелем (гексан/этилацетат = 1/1), и получили в результате 0,29 r (57%) указанного в заголовке соединения в виде белого порошка.
Rf = 0,26 (гексан/этилацетат = 1/1).
ЯМР (CDCl3) δ: 9,83 (с, 2H), 7,46 - 6,61 (м, 17H), 4,92 (с, 2H), 3,20 (д, J = 15,1 Гц, 2H), 2,83 (д, J = 15,1 Гц, 2H), 2,21 (с, 6H).
МС (m/е): 517 (M+), 411, 383, 369, 262, 107, 91.
Примеры 24 - 26
Следующие далее соединения получали так же, как в примере 23, за исключением того, что бензилбромид, использованный в примере 23, заменяли на различные алкилгалогениды.
Пример 24
1-Метил-3,3-бис((4-метилфенил)карбамоилметил)индолин-2-он
Rf = 0,16 (н-гексан/этилацетат = 1/1).
ЯМР (ДМСО-d6) δ: 9,77 (с, 2H), 7,31 - 6,88 (м, 12H), 3,16 (с, 3H), 3,11 (д, J = 15,1 Гц, 2H), 2,74 (д, J = 15,1 Гц, 2H), 2,21 (с, 6H).
МС (m/е): 441 (M+), 335, 307, 186, 107.
Пример 25
3,3-Бис((4-метилфенил)карбамоилметил)-1-(фенилкарбонилметил) индолин-2-он
Rf = 0,41 (н-гексан/этилацетат = 1/1).
ЯМР (ДМСО-d6) δ: 9,91 (с, 2H), 8,14 (д, J = 7,3 Гц, 2H), 7,73 - 6,86 (м, 15H), 5,35 (с, 2H), 3,30 (д, J = 16,1 Гц, 2H), 2,78 (д, J = 16,1 Гц, 2H), 2,22 (c, 6H).
МС (m/е): 545 (M+), 439, 411, 333, 290, 107.
Пример 26
3,3-Бис((4-метилфенил)карбамоилметил)-1-(2-пиридилметил) индолин-2-он
ЯМР (ДМСО-d6) δ: 9,83 (с, 2H), 8,55 (д, J = 4,9 Гц, 1H), 7,66 - 7,50 (м, 2H), 7,38 - 7,01 (м, 11H), 6,89 (т, J = 7,3 Гц, 1H), 6,68 (д, J= 7,8 Гц, 1H), 4,98 (с, 2H), 3,20 (д, J = 15,1 Гц, 2H), 2,84 (д, J= 15,1 Гц, 2H), 2,21 (с, 6H).
МС (m/е): 518 (M+), 412, 384, 237, 107, 92.
Ссылочный пример 15
(RS)-1-Бензил-3-(этоксикарбонилметил)-3-гидроксииндолин-2-он
К раствору 2,4 мл 1,1,1,3,3,3-гексаметилдисилазана в 10 мл сухого тетрагидрофурана добавляли по каплям 6,4 мл 1,59 М гексанового раствора н-бутиллития при -78oC в атмосфере азота, после чего смесь перемешивали при указанной температуре в течение 10 минут. К смеси медленно добавляли 0,976 мл этилацетата с последующим перемешиванием при -78oC в течение 30 минут. Затем к смеси добавляли раствор 2,00 г 1-бензилизатина в 10 мл сухого тетрагидрофурана, после чего перемешивали смесь при указанной температуре в течение 1 часа. Добавляли к реакционной смеси воду, и продукт экстрагировали этилацетатом. Органический слой осушали над безводным сульфатом натрия, и получили в результате 2,23 г (81%) указанного в заголовке соединения.
ЯМР (CDCl3) δ: 7,45 - 6,55 (м, 9H), 4,84 (с, 2H), 4,12 (кв, J = 6,9 Гц, 2H), 2,97 (с, 2H), 1,40 (шир., 1H), 1,13 (т, J = 6,9 Гц, 3H).
Ссылочный пример 16
(RS)-1-Бензил-3-гидрокои-3-((4-метилфенил)аминокарбонилметил) индолин-2-он
К раствору 0,254 г пара-толуидина в 10 мл сухого тетрагидрофурана добавляли по каплям 1,3 мл 1,59 М гексанового раствора н-бутиллития при -78oC в атмосфере азота, после чего полученную смесь перемешивали при указанной температуре в течение 10 минут. К смеси добавляли раствор 0,299 г 1-бензил-3-(этоксикарбонилметил)-3-гидроксииндолин-2-она в 5 мл сухого тетрагидрофурана при -78oC с последующим перемешиванием при указанной температуре в течение 30 минут. Добавляли к реакционной смеси воду, и полученный продукт экстрагировали хлороформом. Органический слой осушали над безводным сульфатом натрия и концентрировали. Остаток очищали путем хроматографии на колонке с силикагелем (гексан/этилацетат = 5/1), получив в результате 0,161 г (44%) указанного в заголовке соединения.
ЯМР (CDCl3) δ: 8,38 (с, 1H), 7,47 - 6,92 (м, 12H), 6,67 (д, J = 8,6 Гц, 1H), 5,38 (с, 1H), 4,88 (д, J = 16,0 Гц, 1H), 4,74 (д, = 16,0 Гц, 1H), 3,06 (д, J = 14,9 Гц, 1H), 2,69 (д, J = 14,9 Гц, 1H), 2,29 (c, 3H).
Пример 27
(RS)-1-Бензил-3-((4-метилфенил)аминокарбонилметил)- 3-((4-метилфенил)аминокарбонилокси)индолин-2-он
К раствору 0,155 г 1-бензил-3-гидрокси-3-((4-метилфенил) аминокарбонилметил)индолин-2-она и 0,097 мл пара-толилизоцианата в 10 мл сухого тетрагидрофурана добавляли 10 мг диацетата дибутилолова при комнатной температуре в атмосфере азота, и полученную смесь перемешивали при указанной температуре в течение 18 часов. Добавляли к реакционной смеси воду, и полученный продукт экстрагировали дихлорметаном. Органический слой осушали над безводным сульфатом натрия и концентрировали. Остаток очищали путем хроматографии на колонке с силикагелем (гексан/этилацетат = 3/1), получив в результате 0,178 г (89%) указанного в заголовке соединения.
ЯМР (CDCI3) δ: 9,42 - 9,12 (шир., 1H), 7,60 - 6,88 (м, 17H), 6,68 (д, J = 7,8 Гц, 1H), 5,04 (д, J = 14,8 Гц, 1H), 4,94 (д, J = 14,8 Гц, 1H), 3,14 (д, J = 15,2 Гц, 1H), 2,99 (д, J = 15,2 Гц, 1H), 2,28 (с, 3H), 2,21 (с, 3H).
Ссылочный пример 17
1-Бензил-3-(гидроксиимино)индолин-2-он
К суспензии 7,11 г N-бензилизатина в 75 мл этанола добавляли раствор 3,84 г гидроксиламингидрохлорида и 3,84 г ацетата натрия в 500 мл воды. Смесь перемешивали при комнатной температуре в течение 1 часа и затем концентрировали. Остаток промывали водой и перекристаллизовывали из этанола, получив в результате 6,11 г (81%) указанного в заголовке соединения в виде желтых кристаллов.
Rf = 0,33 (хлороформ/метанол = 20/1).
ЯМР (ДМСО-d6) δ: 13,51 (шир., 1H), 8,00 (д, J = 7,3 Гц, 1H), 7,39 - 7,26 (м, 6H), 7,10 - 6,96 (м, 2H), 4,94 (c, 2H).
MC (m/e): 252 (M+), 235, 207, 91.
Ссылочный пример 18
(RS)-3-(N'-(4-Метилфенил)уреидо)индолин-2-он
К суспензии 73,6 г изатина в 1,2 л этанола добавляли раствор 64,1 г гидроксиламингидрохлорида и 64,1 г ацетата натрия в 500 мл воды. Смесь перемешивали при комнатной температуре в течение 30 минут и концентрировали. Остаток промывали водой и перекристаллизовывали из этанола, получив в результате 51,3 г (64%) 3-(гидроксиимино)индолин-2-она в виде желтых кристаллов.
Rf = 0,41 (хлороформ/метанол = 10/1).
ЯМР (CDCI3/ДМCO-d6) δ: 12,52 (с, 1H), 7,39 - 6,81 (м, 4H).
MC (m/e): 162 (M+), 145, 117.
Суспензию 4,86 г 3-(гидроксиимино)индолин-2-она и 100 мг 5% Rh/C в 300 мл этанола перемешивали при комнатной температуре в атмосфере водорода в течение 1 дня. Реакционную смесь фильтровали через Церит, и фильтрат концентрировали. Концентрат растворяли в 300 мл дихлорметана, и к раствору добавляли 4,16 мл пара-толилизоцианата при 0oC. Смесь перемешивали при указанной температуре 2 часа, после чего образовался осадок. Осадок собирали путем фильтрации и промывали этанолом, в результате чего получили 7,59 г (90%) указанного в заголовке соединения.
ЯМР (ДМСО-D6) δ: 10,30 (c, 1H), 8,61 (c, 1H), 7,27 - 6,77 (м, 9H), 4,95 (д, J = 7,3 Гц, 1H), 2,21 (с, 3H).
МС (m/е): 281 (M+), 174, 148, 132, 107.
Ссылочный пример 19
(RS))-3-((4-Метилбензил)карбониламино)индолин-2-он
Раствор 4,86 г 3-(гидроксиимино)индолин-2-она и 100 мг 5% Rh/C в 300 мл этанола перемешивали при комнатной температуре в атмосфере водорода в течение 1 дня. Реакционную смесь фильтровали через Церит, и фильтрат концентрировали. Концентрат растворяли в 50 мл N, N-диметилформамида, и к раствору добавляли последовательно 5,15 г дициклогексил-карбодиимида, 3,83 г 1-гидроксибензотриазола и 3,75 г пара-толилуксусной кислоты. Смесь перемешивали при той же самой температуре в течение 12 часов, в результате чего образовался осадок. Осадок отфильтровывали, и фильтрат концентрировали. Концентрат разводили этилацетатом и промывали последовательно разбавленной хлористоводородной кислотой и насыщенным водным раствором гидрокарбоната натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Остаток очищали путем хроматографии на колонке с силикагелем (хлороформ/метанол = 40/1), и в результате получили 1,01 г (18%) указанного в заголовке соединения.
Rf = 0,32 (хлороформ/метанол = 20/1).
ЯМР (ДМСО-d6) δ: 10,39 (с, 1H), 8,80 (д, J = 8,3 Гц, 1H), 7,21 - 7,02 (м, 6H), 6,91 (дд, J = 1,0, 6,3 Гц, 1H), 6,79 (д, J = 6,3 Гц, 1H), 5,08 (д, J = 8,3 Гц, 1H), 3,44 (с, 2H), 2,27 (с, 3H).
МС (m/е): 280 (M+), 262, 148, 132, 105.
Ссылочный пример 20
(RS)-1-Бензил-3-(метилкарбониламино)индолин-2-он
Суспензию 2,52 г 1-бензил-3-(гидроксиимино)индолин-2-она и 100 мг 5% Rh/C в 200 мл метанола перемешивали в атмосфере водорода при комяатной температуре в течение 1 дня. Реакционную смесь фильтровали через Церит, и фильтрат концентрировали. Остаток растворяли в 200 мл дихлорметана, и к раствору последовательно добавляли при комнатной температуре 2,79 мл триэтиламина и 0,85 мл ацетилхлорида. Смесь перемешивали при указанной температуре в течение 1 часа и затем промывали последовательно разбавленной хлористоводородной кислотой и насыщенным водным раствором гидрокарбоната натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Перекристаллизация остатка из смеси хлороформа и гексана дала 1,28 г (45%) указанного в заголовке соединения.
Rf = 0,30 (хлороформ/метанол = 20/1).
ЯМР (ДМСО-d6) δ: 8,79 (д, J = 7,8 Гц, 1H), 7,41 - 7,13 (м, 7H), 6,98 (дд, J = 6,8, 7,8 Гц, 1H), 6,76 (д, J = 7,3 Гц, 1H), 5,22 (д, J = 7,8 Гц, 1H), 4,97 (д, J = 15,8 Гц, 1H), 4,81 (д, J = 15,8 Гц, 1H), 1,92 (с, 3H).
Ссылочный пример 21
1-(2,2-Диэтоксиэтил)изатин
Раствор 31,8 г изатина в 300 мл сухого диметилсульфоксида добавляли по каплям к суспензии 25,4 г трет-бутоксида калия в 200 мл сухого диметилсульфоксида при 10oC в струе азота. После перемешивания смеси при указанной температуре в течение 30 минут к ней добавляли 39 мл диэтилацеталя бромацетальдегида, после чего перемешивали ее при 70oC в течение 6 часов. Реакционную смесь вливали в разбавленную хлористоводородную кислоту и экстрагировали диэтиловым эфиром. Органический слой осушали над безводным сульфатом магния и концентрировали. Остаток очищали путем хроматографии на колонке с силикагелем (хлороформ/ этилацетат = 20/1), и в результате получили 31,4 г (55%) указанного в заголовке соединения в виде красного порошка.
Rf = 0,83 (хлороформ/метанол = 20/1).
ЯМР (CDCl3) δ: 7,75 - 6,95 (м, 4H), 4,71 (т, J = 5 Гц, 1H), 3,89 - 3,40 (м, 6H), 1,16 (т, J = 7 Гц, 6H).
Пример 28
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(4-метилфенил)уреидо)индолин-2-он
Раствор 5,38 г гидроксиламингидрохлорида и 5,38 г ацетата натрия в 40 мл воды добавляли к суспензии 11,1 г 1-(2,2-диэтоксиэтил)изатина в 100 мл этанола. Смесь перемешивали при комнатной температуре в течение 1 часа, после чего концентрировали. Концентрат разводили хлороформом и промывали водным раствором хлорида натрия. Слой хлороформа осушали над безводным сульфатом натрия и концентрировали, а остаток перекристаллизовывали из этилацетата, и получили в результате 7,10 г (61%) 1-(2,2-диэтоксиэтил)-3-(гидроксиимино) индолин-2-она в виде желтых кристаллов.
Rf = 0,32 (хлороформ/метанол = 20/1).
ЯМР (CDCl3/ДМСО-d3) δ: 12,85 (с, 1Н), 8,09 (д, J = 7,8 Гц, 1H), 7,39 - 7,31 (м, 1H), 7,08 - 7,01 (м, 2Н), 4,70 (т, J = 5,4 Гц, 1H), 3,84 (д, J = 5,4 Гц, 2Н), 3,82 - 3,43 (м, 4Н), 1,14 (т, J = 6,8 Гц, 6Н).
Суспензию 30 г 1-(2,2-диэтоксиэтил)-3-(гидроксиимино)индолин-2-она и 200 мг 5% Rh/C в 1,5 л этанола перемешивали в атмосфере водорода при комнатной температуре в течение 2 дней. Реакционную смесь фильтровали через Церит, и фильтрат концентрировали. Остаток растворяли в 600 мл дихлорметана, и к полученному раствору добавляли при 0oC раствор 15,0 мл пара-толилизоцианата в 200 мл дихлорметана. Смесь перемешивали при этой температуре в течение 1 часа, после чего концентрировали. Полученный неочищенный продукт промывали диэтиловым эфиром, получив в результате 30,8 г (72%) указанного в заголовке соединения в виде белого порошка.
ЯМР (ДМСО-d6) δ: 8,63 (с, 1H), 7,33 - 7,16 (м, 4H), 7,12 - 6,87 (м, 5H), 5,05 (д, J = 7,4 Гц, 1H), 4,77 - 4,63 (м, 1H), 3,84 (дд, J = 5,7, 14,6 Гц, 1H), 3,77 - 3,40 (м, 5H), 2,22 (c, 3H), 1,08 (т, J = 7,4 Гц, 3H), 1,06 (т, J = 7,4 Гц, 3H).
Примеры 29 - 32
Следующие ниже соединения были получены так же, как в примере 28, за исключением того, что 1-(2,2-диэтоксиэтил)изатин, использованный в качестве исходного материала в примере 28, заменяли различными производными изатина.
Пример 29
(RS)-1-Бензил-3-(N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (ДМСО-d6) δ: 8,70 (с, 1H), 7,39 - 7,00 (м, 13H), 6,78 (д, J = 7,3 Гц, 1H), 5,13 (д, J = 7,3 Гц, 1H), 4,90 (с, 2H), 2,21 (с, 3H).
МС (m/е): 371 (M+), 238, 147, 107, 91.
Пример 30
(RS)-3-(N'-(4-Метилфенил)уреидо)-1-фенилиндолин-2-он
ЯМР (ДМСО-d6) δ: 8,76 (с, 1H), 7,61 - 6,99 (м, 13H), 6,71 (д, J = 7,3 Гц, 1H), 5,20 (д, J = 7,3 Гц, 1H), 2,22 (с, 3H).
МС (m/е): 357 (M+), 250, 223, 194, 180, 106.
Пример 31
(RS)-1-(2,2-Диэтоксиэтил)-5-метил-3-(N'-(4-метилфенил)уреидо) индолин-2-он
ЯМР (ДМСО-d6) δ: 8,62 (с, 1H), 7,25 (д, J = 8,3 Гц, 2H), 7,06 - 6,86 (м, 6H), 5,03 (д, J = 7,8 Гц, 1H), 4,71 - 4,66 (м, 1H), 3,81 (дд, J = 5,4, 14,2 Гц, 1H), 3,72 - 3,29 (м, 5H), 2,27 (с, 3H), 2,21 (с, 3H), 1,07 (т, J = 6,8 Гц, 3H), 1,06 (т, J = 6,8 Гц, 3H).
МС (m/е): 411 (M+), 365, 232, 103
Пример 32
(RS)-5-Бром-1-(2,2-диэтоксиэтил)-3-(N'-(4-метилфенил)уреидо) индолин-2-он
ЯМР (ДМСО-d6) δ: 8,74 (с, 1H), 7,48 - 7,15 (м, 4H), 7,10 - 6,88 (м, 4H), 5,03 (д, J = 7,4 Гц, 1H), 4,72 - 4,60 (м, 1H), 3,90 - 3,37 (м, 6H), 2,21 (с, 3H), 1,07 (т, J = 6,4 Гц, 6H).
Примеры 33 - 41
Следующие ниже соединения были получены так же, как в примере 28, за исключением того, что пара-толилизоцианат, использованный в примере 28 в качестве реагента, заменяли различными изоцианатами.
Пример 33
(RS)-3-(N'-(4-Хлорфенил)уреидо)-1-(2,2-диэтоксиэтил)индолин-2-он ЯМР (ДМСО-d6) δ: 8,97 (с, 1H), 7,40 (д, J = 9,4 Гц, 2H), 7,29 - 6,96 (м, 7H), 5,06 (д, J = 7,3 Гц, 1H), 4,72 - 4,67 (м, 1H), 3,84 (дд, J = 5,4, 14,1 Гц, 1H), 3,70 - 3,41 (м, 5H), 1,13 - 1,03 (м, 6H).
МС (m/е): 419, 417 (M+), 374, 371, 153, 103.
Пример 34
(RS)-2-(2,2-Диэтоксиэтил)-3-(N'-(4-метоксифенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 7,37 (д, J = 7,3 Гц, 1H), 7,26 - 7,01 (м, 6H), 6,76 (д, J = 8,8 Гц, 2H), 5,80 (д, J = 7,8 Гц, 1H), 5,19 (д, J = 7,8 Гц, 1H), 4,70 - 4,65 (м, 1H), 3,91 (дд, J = 5,4, 14,6 Гц, 1H), 3,73 - 3,43 (м, 5H), 3,70 (c, 3H), 1,66 - 1,12 (м, 6H).
MC (m/e): 413 (M+), 367, 218, 103.
Пример 35
(RS)-3-(N'-Циклогексилуреидо)-1-(2,2-диэтоксиэтил)индолин-2-он
ЯМР (CDCl3) δ: 7,39 (д, J = 7,8 Гц, 1H), 7,27 (дд, J = 7,3, 7,8 Гц, 1H), 7,08 - 7,01 (м, 2H), 5,18 - 5,05 (м, 3H), 4,71 - 4,65 (м, 1H), 3,92 (дд, J = 5,4, 14,1 Гц, 1H), 3,80 - 3,42 (м, 6H), 2,02 - 1,88 (м, 2H), 1,78 - 1,51 (м, 4H), 1,48 - 1,02 (м, 10H).
MC (m/e): 389 (M+), 343, 218, 103.
Пример 36
(RS)-3-(N'-(2-Хлорфенил)уреидо)-1-(2,2-диэтоксиэтил)индолин-2-он
ЯМР (CDCl3-ДМСО-d3) δ: 8,25 (дд, J = 1,5, 6,8 Гц, 1H), 8,05 (с, 1H), 7,66 (д, J = 7,3 Гц, 1H), 7,41 - 7,00 (м, 6H), 6,91 (дт, J = 1,5, 7,8 Гц, 1H), 5,23 (д, J = 7,3 Гц, 1H), 4,75 - 4,69 (м, 1H), 3,95 (дд, J = 5,4, 14,1 Гц, 1H), 3,82 - 3,42 (м, 5H), 1,16 (т, J = 7,3 Гц, 3H), 1,15 (т, J = 6,8 Гц, 3H).
MC (m/e): 419, 417 (M+), 373, 371, 103
Пример 37
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(4-фторфенил)уреидо)индолин-2-он
ЯМР (ДМСО-d6) δ: 8,81 (с, 1H), 7,42 - 6,95 (м, 9H), 5,07 (д, J = 7,8 Гц, 1H), 4,70 (дд, J = 3,4, 5,4 Гц, 1H), 3,85 (дд, J = 5,4, 14,1 Гц, 1H), 3,74 - 3,34 (м, 5H), 1,074 (т, J = 6,8 Гц, 3H), 1,067 (т, J = 6,8 Гц, 3H).
MC (m/e): 401 (M+), 355, 218, 202, 146, 103, 75.
Пример 38
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-фенилуреидо)индолин-2-он
ЯМР (ДМСО-d6) δ: 8,78 (с, 1H), 7,39 - 6,86 (м, 10H), 5,07 (д, J = 7,3 Гц, 1H), 4,70 (дд, J = 4,9 Гц 5,4 Гц, 1H), 3,84 (дд, J = 5,4, 14,1 Гц, 1H), 3,70 - 3,41 (м, 5H), 1,07 (т, J = 6,8 Гц, 3H), 1,06 (т, J = 6,8 Гц, 3H).
MC (m/e): 383 (M+), 337, 202, 174, 119, 103, 75.
Пример 39
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(3-метоксифенил)-уреидо)индалин-2-он
ЯМР (CDCl3) δ: 7,65 (с, 1H), 7,40 - 7,00 (м, 6H), 6,79 (д, J = 9,3 Гц, 1H), 6,53 (дд, J = 2,4, 8,3 Гц, 1H), 6,07 (д, J = 7,8 Гц, 1H), 5,17 (д, J = 7,3 Гц, 1H), 4,69 (дд, J = 5,4, 5,9 Гц, 1H), 3,92 (дд, J = 5,4, 14,1 Гц, 1H), 3,79 - 3,45 (м, 5H), 3,70 (с, 3H), 1,14 (т, J = 7,3 Гц, 3H), 1,13 (т, J = 7,3 Гц, 3H).
МС (m/е): 413 (M+), 367, 218, 202, 174, 103, 75.
Пример 40
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-этилуреидо)индолин-2-он
ЯМР (CDCl3) δ: 7,40 - 7,01 (м, 4H), 5,26 - 5,15 (м, 3H), 4,68 (дд, J = 5,4, 5,4 Гц, 1H), 3,91 (дд, J = 5,4, 14,6 Гц, 1H), 3,77 - 3,65 (м, 3H), 3,56 - 3,45 (м, 2H), 3,30 - 3,17 (м, 2H), 1,15 (т, J = 7,3 Гц, 3H), 1,14 (т, J = 6,8 Гц, 3H), 1,13 (т, J = 7,3 Гц, 3H).
МС (m/е): 335 (M+), 289, 218, 189, 146, 131, 117, 103, 75.
Пример 41 (RS)-3-(N'-(4-Этоксикарбонилфенил)уреидо)-1-(2,2- диэтоксиэтил)индолин-2-он
ЯМР (CDCl3) δ: 8,07 (с, 1H), 7,77 (д, J = 8,8 Гц, 2H), 7,41 - 7,06 (м, 6H), 6,36 (шир., 1H), 5,15 (д, J = 6,8 Гц, 1H), 4,73 (дд, J = 4,9, 4,9 Гц, 1H), 4,31 (кв, J = 7,3 Гц, 2H), 3,99 (дд, J = 4,9, 14,1 Гц, 1H), 3,86 - 3,48 (м, 5H), 1,36 (т, J = 7,3 Гц, 3H), 1,15 (т, J = 6,8 Гц, 3H), 1,14 (т, J = 6,8 Гц, 3H).
Ссылочный пример 22
3-(Бензилоксиимино)-7-метилиндолин-2-он
К суспензии 4,91 г 7-метилизатина в 100 мл этанола добавляли раствор 5,59 г О-бензилгидроксиламингидрохлорида и 3,29 г ацетата натрия в 40 мл воды при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 3 часов и концентрировали. Концентрат разводили хлороформом и промывали водой. Органический слой осушали над безводным сульфатом натрия и концентрировали. Перекристаллизация неочищенного продукта из бензола дала 5,40 г (68%) указанного в заголовке соединения.
Rf = 0,46 (хлороформ/метанол = 10/1).
ЯМР (ДМСО-d6) δ: 10,81 (c, 1H), 7,69 (д, J = 7,8 Гц, 1H), 7,43 - 7,34 (м, 5H), 7,20 (д, J = 7,8 Гц, 1H), 6,93 (т, J = 7,8 Гц, 1H), 5,45 (с, 2H), 2,19 (с, 3H).
МС (m/е): 266 (M+), 249, 131, 91.
Ссылочный пример 23
(RS)-7-Метил-3-(N'-(4-метилфенил)уреидо)индолин-2-он
Суспензию 1,30 г 3-(бензилоксиимино)-7-метилиндолин-2-она и 50 мг 5% Pd/C в 500 мл метанола перемешивали в атмосфере водорода при комнатной температуре в течение 2 дней. Реакционную смесь фильтровали через Церит, и фильтрат концентрировали. Остаток растворяли в 20 мл дихлорметана, и к полученному раствору добавляли при 0oC 0,67 г пара-толилизоцианата. Смесь перемешивали при указанной температуре в течение 2 часов, после чего концентрировали. Концентрат промывали диэтиловым эфиром, получив в результате 1,00 г (69%) указанного в заголовке соединения.
Rf = 0,51 (гексан/этилацетат = 2/1).
ЯМР (ДМСО-d6) δ: 10,36 (с, 1H), 8,60 (с, 1H), 7,31 - 6,79 (м, 8H), 4,96 (д. J = 7,8 Гц, 1H), 2,21 (с, 3H), 2,20 (с, 3H).
МС (m/е): 295 (M+), 188, 162, 107.
Пример 42
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(3-метилфенил)уреидо)индолин-2-он
К суспензии 5,0 г изатина в 200 мл этанола добавляли раствор 9,75 г O-бензилгидроксиламингидрохлорида и 4,18 г ацетата натрия в 50 мл воды при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 3 часов и концентрировали, концентрат разводили этилацетатом и затем промывали водой. Органический слой осушали над безводным сульфатом натрия и концентрировали. Перекристаллизация неочищенного продукта из этанола дала 6,06 г (71%) 3-(бензилоксиимино)индолин-2-она в виде желтых кристаллов.
Rf = 0,49 (дихлорметан/метанол = 100/3).
ЯМР (CDCl3) δ: 9,70 - 9,40 (шир., 1H), 7,85 (д, J = 7,4 Гц, 1H), 7,50 - 6,70 (м, 3H), 7,34 (с, 5H), 5,46 (с, 2H).
К суспензии 0,35 г гидрида натрия (60%) в 20 мл N,N-диметилформамида добавляли по каплям раствор 2,00 г 3-(бензилоксиимино)индолин-2-она в 20 мл N, N-диметилформамида при 0oC в струе азота. После перемешивания полученной смеси при комнатной температуре в течение 1 часа к ней добавляли 1,40 мл диэтилацеталя бромацетальдегида, и полученную смесь перемешивали в течение 12 часов при 70oC. Реакционную смесь концентрировали, и остаток разводили этилацетатом и промывали водным раствором хлорида натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Полученный неочищенный продукт очищали путем хроматографии на колонке с силикагелем (хлороформ/метанол = 100/1), и в результате получили 2,20 г (76%) 3-(бензилоксиимино)-1- (2,2-диэтоксиэтил)индолин-2-она.
Rf = 0,27 (дихлорметан/метанол = 100/1).
ЯМР (CDCl3) δ: 8,00 - 7,80 (м, 1H), 7,60 - 6,80 (м, 3H), 7,38 (с, 5H), 5,51 (с, 2H), 4,71 (т, J = 5,4 Гц, 1H), 4,00 - 3,20 (м, 6H), 1,14 (т, J = 7,2 Гц, 6H).
Суспензию 2,20 г 3-(бензилоксиимино)-1-(2,2-диэтоксиэтил)индолин-2-она и 100 мг 5% Pd/C в 50 мл метанола перемешивали в атмосфере водорода при комнатной температуре в течение 2 дней. Реакционную смесь фильтровали через Церит, и фильтрат концентрировали. Остаток растворяли в 20 мл дихлорметана, и к полученному раствору добавляли при 0oC 0,89 мл мета-толилизоцианата. Полученную смесь перемешивали при комнатной температуре в течение 2 часов, после чего концентрировали. Концентрат перекристаллизовывали из диэтилового эфира, получив в результате 1,13 г (47%) указанного в заголовке соединения.
Rf = 0,14 (гексан/этилацетат = 2/1).
ЯМР (CDCl3) δ: 8,69 (с, 1H), 8,29 (с, 1H), 7,29 - 6,94 (м, 7H), 6,72 (д, J = 6,8 Гц, 1H), 5,05 (д, J = 7,8 Гц, 1H), 4,70 (дд, J = 4,4, 5,4 Гц, 1H), 3,81 (дд, J = 5,4, 14,1 Гц, 1H), 3,70 - 3,29 (м, 5H), 2,22 (c, 3H), 1,074 (т, J = 6,8 Гц, 3H), 1,067 (т, J = 6,8 Гц, 3H).
Пример 43
(RS)-1-(2,2-Диэтоксиэтил)-5-фтор-5-(N'-метилфенил)уреидо)индолин-2-он
Указанное в заголовке соединение получали так же, как в примере 42, за исключением того, что в качестве исходного материала вместо изатина, использованного в примере 42, использовали 5-фторизатин.
ЯМР (CDCl3) δ: 7,20 - 6,82 (м, 8H), 6,10 (д, J = 6,9 Гц, 1H), 5,09 (д, J = 6,9 Гц, 1H), 4,71 - 4,66 (м, 1H), 4,02 - 3,64 (м, 6H), 2,25 (с, 3H), 1,17 - 1,09 (м, 6H).
Пример 44
(RS)-1-(2,2-Этоксиэтил)-5-метокси-3-(N'-(4-метилфенил)уреидо) индолин-2-он
Указанное в заголовке соединение получали так же, как в примере 42, за исключением того, что в качестве исходного материала вместо изатина, использованного в примере 42, использовали 5-метоксиизатин.
ЯМР (CDCl3) δ: 7,46 (шир., 1H), 7,17 (д, J = 8,2 Гц, 2H), 7,11 - 6,93 (м, 4H), 6,78 (дд, J = 2,6, 8,2 Гц, 1H), 5,97 (д, J = 6,9 Гц, 1H), 5,14 (д, J = 6,9 Гц, 1H), 4,69 - 4,64 (м, 1H), 3,90 (дд, J = 5,3, 14,2 Гц, 1H), 3,76 (с, 3H), 3,74 - 3,64 (м, 3H), 3,54 - 3,42 (м, 2H), 2,25 (с, 3H), 1,16 - 1,10 (м, 6H).
Примеры 45 - 52
Следующие ниже соединения были получены так же, как в примере 42, за исключением того, что пара-толилизоцианат, использованный в качестве реагента в примере 42, заменяли различными соединениями изоцианата.
Пример 45
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(2-метилфенил)уреидо)индолин-2-он
ЯМР (ДМСО-d6) δ: 7,91 (с, 1H), 7,74 (д, J = 7,8 Гц, 1H), 7,37 - 6,84 (м, 8H), 5,12 (д, J = 7,3 Гц, 1H), 4,70 (дд, J = 5,4, 5,4 Гц, 1H), 3,84 (дд, J = 5,4, 14,6 Гц, 1H), 3,70 - 3,26 (м, 5H), 2,20 (c, 3H), 1,07 (т, J = 7,3 Гц, 3H), 1,06 (т, J = 7,3 Гц, 3H).
Пример 46
(RS)-3-(N'-(3-Хлорфенил)уреидо)-1-(2,2-диэтоксиэтил)индолин-2-он
ЯМР (ДМСО-d6) δ: 9,03 (с, 1H), 7,63 (с, 1H), 7,30 - 6,89 (м, 8H), 5,06 (д, J = 7,8 Гц, 1H), 4,70 (дд, J = 3,4, 5,4 Гц, 1H), 3,86 (дд, J = 5,4, 14,6 Гц, 1H), 3,71 - 3,30 (м, 5H), 1,09 (т, J = 7,3 Гц, 3H), 1,08 (т, J = 7,3 Гц, 3H).
Пример 47
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(2-метоксифенил)уреидо)индолин-2-он
ЯМР (ДМСО-d6) δ: 8,14 (c, 1H), 8,00 (д, J = 7,8 Гц, 1H), 7,67 (д, J = 7,8 Гц, 1H), 7,30 - 6,76 (м, 7H), 5,12 (д, J = 7,8 Гц, 1H), 4,70 (дд, J = 4,9, 5,4 Гц, 1H), 3,85 (c, 3H), 3,88 - 3,29 (м, 6H), 1,08 (т, J = 6,8 Гц, 3H), 1,07 (т, J = 6,8 Гц, 3H).
Пример 48
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(4-нитрофенил)уреидо)индолин-2-он
ЯМР (ДМСО-d6) δ: 9,61 (с, 1H), 8,11 (д, J = 9,3 Гц, 2H), 7,61 (д, J = 9,3 Гц, 2H), 7,34 - 6,97 (м, 5H), 5,01 (д, J = 7,3 Гц, 1H), 4,70 (дд, J = 2,9, 5,4 Гц, 1H), 3,86 (дд, J = 5,4, 14,1 Гц, 1H), 3,71 - 3,42 (м, 5H), 1,08 (т, J = 7,3 Гц, 6H).
Пример 49
(RS)-3-(N'-(4-Цианфенил)уреидо-1-(2,2-диэтоксиэтил)индолин-2-он
ЯМР (ДИСО-d6) δ: 9,36 (c, 1H) 7,70 - 7,53 (м, 5H), 7,30 - 7,21 (м, 2H), 7,09 - 6,96 (м, 2H), 5,09 (д, J = 7,3 Гц, 1H), 4,70 (дд, J = 3,4, 5,4 Гц, 1H), 3,86 (дд, J = 5,4, 14,1 Гц, 1H), 3,71 - 3,41 (м, 5H), 1,08 (т, J = 7,3 Гц, 3H), 1,07 (т, J = 7,3 Гц, 3H).
Пример 50
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(3-трифторметилфенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 8,04 (с, 1H), 7,55 (с, 1H), 7,39 - 7,03 (м, 7H), 6,62 (д, J = 6,8 Гц, 1H), 5,06 (д, J = 6,8 Гц, 1H), 4,73 (дд, J = 4,9, 4,9 Гц, 1H), 3,98 - 3,46 (м, 6H), 1,14 (т, J = 6,8 Гц, 3H), 1,13 (т, J = 6,8 Гц, 3H).
Пример 51
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(3-фторфенил)уреидо)индолин-2-он
ЯМР (ДМСО-d6) δ: 9,05 (с, 1H), 7,42 - 6,96 (м, 8H), 6,68 (дт, J = 2,4, 8,3 Гц, 1H), 5,07 (д, J = 7,8 Гц, 1H), 4,70 (дд, J = 4,9, 5,4 Гц, 1H), 3,85 (дд, J = 5,4, 14,1 Гц, 1H), 3,70 - 3,30 (м, 5H), 1,08 (т, J = 7,3 Гц, 3H), 1,06 (т, J = 7,3 Гц, 3H).
Пример 52
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(4-трифторметилфенил)уреидо)индолин-2-он
Rf = 0,28 (н-гексан/этилацетат = 1/1).
ЯМР (ДМСО-d6) δ:/ 9,26 (с, 1H), 7,61 - 6,97 (м, 9H), 5,09 (д, J = 7,8 Гц, 1H), 4,70 (дд, J = 4,9, 5,4, Гц, 1H), 3,86 (дд, J = 5,4, 14,1 Гц, 1H), 3,74 - 3,42 (м, 5H), 1,07 (т, J = 7,3 Гц, 5H).
Пример 53
(RS)-1,3-Бис(этоксикарбонилметил)-3-(N'-(4-метилфенил)уреидо) индолин-2-он (53a) и (RS)-3-(этоксикарбонилметил)-3-(N'-(4-метилфенил) уреидо)индолин-2-он (53b)
К раствору 2,81 г (RS)-3-(N'-(4-метилфенил)уреидо)индолин-2-она в 80 мл сухого диметилсульфоксида добавляли 10 мл 1М раствора трет-бутоксида калия в сухом диметилсульфоксиде при комнатной температуре в атмосфере азота. После перемешивания в течение 1 часа к полученной смеси добавляли по каплям 1,11 мл этилбромацетата с последующим перемешиванием смеси при той же самой температуре в течение 1 часа. Реакционную смесь обрабатывали водным раствором хлорида натрия и экстрагировали диэтиловым эфиром. Слой диэтилового эфира осушали над безводным сульфатом магния и концентрировали. Концентрат очищали путем хроматографии на колонке с силикагелем (хлороформ/метанол = 40/1), и получили в результате 0,68 г (15%) (RS)-1,3-бис(этоксикарбонилметил)- 3-(N'-(4-метилфенил)уреидо)индолин-2-она;
Rf = 0,57 (хлороформ/метанол = 20/1).
ЯМР (ДМСО-d6) δ: 8,97 (с, 1H), 7,24 - 6,94 (м, 9H), 4,59 (д, J = 16,1 Гц, 1H), 4,51 (д, J = 16,1 Гц, 1H), 4,17 - 4,00 (м, 4H), 2,89 (д, J = 15,1 Гц, 1H), 2,53 (д, J = 15,1 Гц, 1H), 2,18 (с, 3H), 1,22 (т, J = 6,8 Гц, 3H), 1,11 (т, J = 7,3 Гц, 3H),
МС (m/e): 453 (М+), 408, 346, 320, 233, 107,
и 1,64 г (45%) (RS)-3-(этоксикарбонилметил)-3-(N'-(4-метилфенил) уреидо)индолин-2-она:
Rf = 0,22 (хлороформ/метанол = 20/1).
ЯМР (ДМСО-d6) δ: 10,39 (с, 1H), 8,79 (с, 1H), 7,24 - 6,77 (м, 9H), 3,99 (кв, J = 6,8 Гц, 2H), 2,84 (д, J = 14,6 Гц, 1H), 2,63 (д, J = 14,6 Гц, 1H), 2,18 (с, 3H), 1,06 (т, J = 6,8 Гц, 3H).
МС (m/е): 367 (M+), 321, 206, 133, 107.
Пример 54
(RS)-3-(N'-(4-Метилфенил)уреидо-1,3-бис(фенилкарбонилметил) индолин-2-он (54a) и (RS)-3-(N'-(4-метилфенил)уреидо)-3- (фенилкарбонилметил)индолин-2-он (54b)
Два указанных в заголовке соединения были получены так же, как в примере 53, за исключением того, что этилбромацетат, использованный в примере 53, заменяли на 2-промацетофенон. (RS)-3-(N'-(4-Метилфенил)уреидо)-1,3-бис(фенилкарбонилметил) индолин-2-он.
Rf = 0,73 (хлороформ/метанол = 20/1)
ЯМР (ДМСО-d6) δ: 9,01 (с, 1H), 8,14 (д, J = 6,8 Гц, 2H), 7,85 (д, J = 6,8 Гц, 2H), 7,67 - 6,88 (м, 15H), 5,37 (с, 2H), 3,63 (д, J = 15,1 Гц, 1H), 3,42 (д, J = 15,1 Гц, 1H), 2,19 (с, 3H),
МС (m/е): 517 (M+), 410, 367, 262, 150, 105.
(RS)-3-(N'-(4-Метилфенил)уреидо)-3-(фенилкарбонилметил)индолин-2-он (54b)
Rf = 0,33 (хлороформ/метанол = 20/1).
ЯМР (ДМСО-d6) δ: 10,41 (с, 1H), 8,81 (с, 1H), 7,88 (д, J = 7,3 Гц, 2H), 7,65 - 7,44 (м, 3H), 7,30 - 6,77 (м, 9H), 3,68 (д, J = 16,5 Гц, 1H), 3,44 (д, J = 16,5 Гц, 1H), 2,19 (c, 3H).
МС (m/е): 399 (M+), 381, 338, 266, 249, 107.
Пример 55
(RS)-3-(Гидроксикарбонилметил)-3-(N'-(4-метилфенил)уреидо)индолин-2-он
Раствор 300 мг гидроксида калия (85%) в 2 мл воды добавляли к раствору 0,35 г (RS)-3-(этоксикарбонилметил)-3-(N'-(4-метилфенил) уреидо)индолин-2-она в 10 мл этанола при комнатной температуре, и полученную смесь перемешивали 4 часа, после чего концентрировали. Концентрат разводили водой и промывали хлороформом. Водный слой регулировали до pH 3 путем добавления 2 н. хлористоводородной кислоты и экстрагировали этилацетатом. Органический слой осушали над безводным сульфатом натрия и концентрировали. Полученный неочищенный продукт перекристаллизовывали из изопропилового спирта, и получили в результате 0,088 г (27%) указанного в заголовке соединения.
Rf = 0,16 (хлороформ/метанол = 2/1).
ЯМР (ДМСО-d6) δ: 12,70 (шир., 1H), 10,36 (с, 1H), 8,88 (с, 1H), 7,26 - 6,75 (м, 9H), 2,77 (д, J = 16,1 Гц, 1H), 2,49 (д, J = 16,1 Гц, 1H), 2,18 (с, 3H).
МС (m/е): 339 (M+), 321, 160, 133, 107.
Пример 56
(RS)-1,3-Бис(гидроксикарбонилметил)-3-(N'-(4-метилфенил)уреидо) индолин-2-он
Указанное в заголовке соединение получали (выход: 75%) так же, как в примере 55, за исключением того, что (RS)-3-(этоксикарбонилметил)- 3-(N'-(4-метилфенил)уреидо)индолин-2-он, использованный в примере 55, заменяли на (RS)-1,3-бис(этоксикарбонилметил)-3-(N'-(4-метилфенил)уреидо)индолин-2-он.
Rf = 0,17 (хлороформ/метанол = 1/1).
ЯМР (ДМСО-d6) δ: 12,71 (шир., 2H), 9,07 (с, 1H), 7,31 - 6,93 (м, 9H), 4,42 (д, J = 17,5 Гц, 1H), 4,37 (д, J = 17,5 Гц, 1H), 2,82 (д, J = 14,9 Гц, 1H), 2,37 (д, J = 14,9 Гц, 1H), 2,18 (с, 3H).
МС (m/е): 379 (M+ - 18), 335, 133, 107.
Пример 57
(RS)-3-(4-Метилфенил)аминокарбонилметил-3-(N'-(4- метилфенил)уреидо)индолин-2-он
К раствору 0,150 г (RS)-3-(гидроксикарбонилметил)-3-(N'-(4- метилфенил)уреидо)индолин-2-она и 0,103 г дициклогексилкарбодиимида в 10 мл N,N-диметилформамида добавляли последовательно 0,074 г 1-гидроксибензотриазола и 0,052 г паратолуидина. Полученную смесь перемешивали при комнатной температуре в течение 18 часов, после чего концентрировали. Остаток разводили этилацетатом и промывали последовательно разбавленной хлористоводородной кислотой и насыщенным водным раствором гидрокарбоната натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Неочищенный продукт очищали путем хроматографии на колонке с силикагелем (хлороформ/метанол = 20/1), получив в результате 0,083 г (44%) указанного в заголовке соединения в виде белого порошка.
Rf = 0,11 (хлороформ/метанол = 20/1).
ЯМР (ДМСО-d6) δ: 10,37 (c, 1H), 9,89 (c, 1H), 9,15 (с, 1H), 8,29 (с, 1H), 7,51 - 6,80 (м, 12H), 2,75 (д, J = 14,1 Гц, 1H), 2,50 (д, J = 14,1 Гц, 1H), 2,25 (с, 3H), 2,18 (с, 3H).
МС (m/е): 428 (M+), 410, 321, 295, 147, 133, 107.
Примеры 58 - 59
Следующие ниже соединения были получены так же, как в примере 57, за исключением того, что в качестве исходного материала вместо пара-толуидина, использованного в примере 57, использовали различные амины.
Пример 58
(RS)-3-(N'-(4-Метилфенил)уреидо-3-(N-(N'-метилпиперазинил) карбонилметил)индолин-2-он
ЯМР (CDCl3) δ: 9,12 (шир., 1H), 7,50 (с, 1H), 7,38 - 7,15 (м, 2H), 7,15 - 6,70 (м, 7H), 3,60 (шир., 2H), 3,30 - 2,95 (м, 2H), 2,98 (д, J = 14,5 Гц, 1H), 2,75 (д, J = 14,5 Гц, 1H), 2,57 - 1,80 (шир., 7H), 2,22 (с, 3H).
Пример 59
(RS)-3-(N'-(4-Метилфенил)уреидо)-3-((N-пиперидил)карбонилметил) индолин-2-он
ЯМР (ДМСО-d6) δ: 10,31 (с, 1H), 9,11 (с, 1H), 7,45 (с, 1H), 7,40 - 7,05 (м, 4H), 7,05 - 6,74 (м, 4H), 3,48 (шир., 2H), 3,27 - 3,00 (шир., 2H), 2,71 (д, J = 15,1 Гц, 1H), 2,64 (д, J = 15,1 Гц, 1H), 2,18 (с, 3H), 1,70 - 1,12 (шир., 6H).
Ссылочный пример 24
(RS)-3-(Этоксикарбонилметил)-3-((4-метилбензил)карбониламино) индолин-2-он
К раствору 0,72 г (RS)-3-((4-метилбензил)карбониламино)индолин-2-она в 20 мл сухого диметилсульфоксида добавляли 3 мл 1М раствора трет-бутоксида калия в сухом диметилсульфоксиде при комнатной температуре в атмосфере азота, после чего смесь перемешивали в течение 30 минут. К смеси добавляли по каплям 0,37 мл этилбромацетата с последующим перемешиванием смеси при той же самой температуре в течение 30 минут. Реакционную смесь обрабатывали водным раствором хлорида натрия и экстрагировали диэтиловым эфиром. Слой диэтилового эфира осушали над безводным сульфатом магния и концентрировали. Остаток очищали путем хроматографии на колонке с силикагелем (хлороформ/метанол = 40/1), получив в результате 0,30 г (32%) указанного в заголовке соединения.
Rf = 0,36 (хлороформ/метанол = 20/1).
ЯМР (ДМСО-df) δ: 10,35 (с, 1H), 8,63 (с, 1H), 7,16 - 7,05 (м, 6H), 6,88 - 6,71 (м, 2H), 3,82 (кв, J = 6,8 Гц, 2H), 3,40 (д, J = 12,7 Гц, 13), 3,32 (д, J = 12,7 Гц, 1H), 2,95 (д, J = 14,6 Гц, 1H), 2,74 (д, J = 14,6 Гц, 1H), 2,25 (с, 3H), 0,96 (т, J = 6,8 Гц, 3H).
МС (m/е): 366 (M+), 322, 233, 218, 146, 132, 105.
Ссылочный пример 25
(RS)-1-Бензил-3-этоксикарбонилметил-3-(метилкарбониламино)индолин-2-он
К раствору 0,84 г (RS)-1-бензил-3-(метилкарбониламино)индолин-2-она в 15 мл сухого диметилсульфоксида добавляли 3 мл 1М раствора трет-бутоксида калия в сухом диметилсульфоксиде при комнатной температуре в атмосфере азота с последующим перемешиванием в течение 10 минут. К раствору добавляли по каплям 1,11 мл этилбромацетата с последующим перемешиванием при той же самой температуре в течение 30 минут. Реакционную смесь вливали в водный раствор хлорида натрия и экстрагировали диэтиловым эфиром. Слой диэтилового эфира осушали над безводным сульфатом магния и концентрировали. Остаток очищали путем хроматографии на колонке с силикагелем (хлороформ/этилацетат = 3/1), и получили в результате 0,83 г (76%) указанного в заголовке соединения в виде бесцветного масла.
Rf = 0,21 (хлороформ/этилацетат = 5/1).
ЯМР (CDCl3) δ: 7,58 (с, 1H), 7,43 - 7,11 (м, 7H), 6,96 (т, J = 7,3 Гц, 1H), 6,66 (д, J = 7,8 Гц, 1H), 5,02 (д, J = 16,1 Гц, 1H), 4,92 (д, J = 16,1 Гц, 1H), 4,21 (кв, J = 7,3 Гц, 2H), 2,99 (д, J = 15,1 Гц, 1H), 2,50 (д, J = 15,1 Гц, 1H), 2,02 (с, 3H), 1,25 (т, J = 7,3 Гц, 3H),
МС (m/е) 366 (M+), 307, 278, 238, 91.
Пример 60
(RS)-3-((4-Метилбензил)карбониламино)-3-((4-метилфенил) аминокарбонилметил)индолин-2-он
К раствору 0,29 г (RS)-3-(этоксикарбонилметил)-3-((4- метилбензил)карбониламино)индолин-2-она в 10 мл этанола добавляли 2 мл водного раствора 0,16 г гидроксида калия (85%) при комнатной температуре, и полученную смесь перемешивали 4 часа, после чего концентрировали. Концентрат разводили водой и промывали хлороформом. Водный слой регулировали до pH 2 добавлением 2 н. хлористоводородной кислоты и экстрагировали этилацетатом. Органический слой осушали над безводным сульфатом натрия и концентрировали, получив в результате (RS)-3-(гидроксикарбонилметил)-3-((4-метилбензил)карбониламино) индолин-2-он.
Rf = 0,24 (хлороформ/метанол = 2/1).
ЯМР (ДМСО-d6) δ: 12,32 (шир., 1H), 10,32 (с, 1H), 8,59 (с, 1H), 7,19 - 7,05 (м, 6H), 6,88 - 6,71 (м, 2H), 3,40 (д, J = 15,1 Гц, 1H), 3,28 (д, J = 15,1 Гц, 1H), 2,89 (д, J = 15,1 Гц, 1H), 2,62 (д, J = 15,1 Гц, 1H), 2,23 (с, 3H).
МС (m/e): 388 (M+), 294, 205, 146, 132, 105.
Полученный описанным выше образом (RS)-3-(гидроксикарбонил)-3-((4-метилбензил)карбониламино)индолин-2-он растворяли в 20 мл N,N-диметилформамида, и к полученному раствору добавляли последовательно 0,248 г дициклогексилкарбодиимида, 0,184 г 1-гидроксибензотриазола и 0,128 г пара-толуидина. Полученную смесь перемешивали при комнатной температуре в течение 12 часов, после чего концентрировали. Концентрат разводили этилацетатом, промывали последовательно разбавленной хлористоводородной кислотой и насыщенным водным раствором гидрокарбоната натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Полученный неочищенный продукт очищали путем хроматографии на колонке с силикагелем (хлороформ/метанол = 40/1), и в результате получили 0,273 г (81%) указанного в заголовке соединения в виде белого порошка.
Rf = 0,28 (хлороформ/метанол = 20/1).
ЯМР (ДМСО-d6) δ: 10,36 (с, 1H), 9,81 (с, 1H), 8,68 (с, 1H), 7,31 (д, J = 8,3 Гц, 2H), 7,14 - 7,04 (м, 8H), 6,85 - 6,73 (м, 2H), 3,45 (д, J = 15,2 Гц, 1H), 3,35 (д, J = 15,2 Гц, 1H), 2,86 (д, J = 14,1 Гц, 1H), 2,58 (д, J = 14,1 ГЦ, 1H), 2,26 (с, 3H), 2,23 (с, 3H).
МС (m/е): 427 (M+), 322, 293, 279, 172, 149, 107.
Пример 61
(RS)-1-Бензил-3-метилкарбониламино-3-((4-метилфенил) аминокарбонилметил)индолин-2-он
Указанное в заголовке соединение было получено так же, как в примере 60, за исключением того, что в качестве исходного материала вместо (RS)-3-(этоксикарбонилметил)-3-((4-метилбензил) карбониламино)индолин-2-она, использованного в примере 60, использовали (RS)-1-бензил-3-этоксикарбонилметил-3-(метилкарбониламино) индолин-2-он.
Rf = 0,43 (хлороформ/метанол = 10/1).
ЯМР (CDCl3) δ: 8,23 (с, 1H), 7,56 (с, 1H), 7,42 - 7,12 (м, 11H), 6,95 (т, J = 7,3 Гц, 1H), 6,67 (д, J = 7,8 Гц, 1H), 4,95 (c, 2H), 3,04 (д, J = 14,1 Гц, 1H), 2,33 (с, 3H), 2,25 (д, J = 14,1 Гц, 1H), 1,96 (с, 3H).
МС (m/е): 427 (M+), 293, 262, 237, 107, 91.
Пример 62
(RS)-1-Бензил-3-((4-метилфенил)аминокарбонилметил)-3- (N'-(4-метилфенил)уреидо)индолин-2-он
К раствору 0,404 г (RS))-3-(гидроксикарбонилметил)-3-(N'-(4- метилфенил)уреидо)индолин-2-она в 20 мл сухого диметилсульфоксида добавляли 2,5 мл 1М раствора гидрида натрия в сухом диметилсульфоксиде при комнатной температуре в атмосфере азота. После перемешивания полученной смеси в течение 15 минут к ней добавляли 0,19 мл бензилбромида с последующим перемешиванием при той же самой температуре в течение 30 минут. Реакционную смесь вливали в водный, раствор хлорида натрия и экстрагировали диэтиловым эфиром. Слой диэтилового эфира осушали над безводным сульфатом магния и концентрировали, получив в результате (RS)-1-бензил-3-(гидроксикарбонилметил)-3-(N'-(4-метилфенил)уреидо) индолин-2-он.
Rf = 0,41 (хлороформ/метанол = 2/1).
(RS)-1-Бензил-3-(гидроксикарбонилметил)-3-(N'-(4-метилфенил) уреидо)индолин-2-он растворяли в 15 мл сухого N,N-диметилформамида, и к полученному раствору добавляли последовательно 0,080 г 1-гидроксибензотриазола, 0,1 мл диизопропилэтиламина, 0,111 г 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорида и 0,065 г пара-толуидина. Полученную смесь перемешивали 6 часов и концентрировали. Rонцентрат разводили этилацетатом и промывали последовательно разбавленной хлористоводородной кислотой и насыщенным водным раствором гиброкарбоната натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Неочищенный продукт очищали путем хроматографии на колонке с силикагелем (хлороформ/этилацетат = 4/1), и в результате получили 0,350 г (57%) указанного в заголовке соединения в виде белого порошка.
ЯМР (ДМСО-d6) δ: 9,93 (с, 1H), 9,16 (с, 1H), 7,51 (с, 1H), 7,53 - 6,70 (м, 17H), 4,94 (с, 2H), 2,90 (д, J = 14,8 Гц, 1H), 2,57 (д, J = 14,8 Гц, 1H), 2,26 (c, 3H), 2,19 (с, 3H).
Примеры 63 - 70
Следующие далее соединения были получены так же, как в примере 62, за исключением того, что вместо бензилбромида, использованного в примере 62, в качестве исходного материала использовали различные алкилгалогениды.
Пример 63
(RS)-3-((4-Метилфенил)аминокарбонилметил)-3-(N'-(4- метилфенил)уреидо)-1-(фенилкарбонилметил)индолин-2-он
ЯМР (ДМСО-d6) δ: 10,18 (с, 1H), 9,28 (с, 1H), 8,19 (с, 1H), 7,85 - 6,80 (м, 17H), 5,57 (д, J = 8,6 Гц, 1H), 5,36 (д, J = 8,6 Гц, 1H), 2,90 (д, J = 15,4 Гц, 1H), 2,65 (д, J = 15,4 Гц, 1H), 2,82 (с, 3H), 2,20 (с, 3H).
Пример 64
(RS)-1-(Этоксикарбонилметил)-3-((4-метилфенил) аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (ДМСО-d6) δ: 10,08 (с, 1H), 9,24 (с, 1H), 7,74 (с, 1H), 7,46 (д, J = 7,2 Гц, 2H), 7,40 - 6,88 (м, 10H), 4,78 - 4,46 (м, 2H), 4,16 (кв, J = 7,2 Гц, 2H), 2,90 (д, J = 14,8 Гц, 1H), 2,57 (д, J = 14,8 Гц, 1H), 2,26 (с, 3H), 2,18 (с, 3H), 1,26 (т, J = 7,2 Гц, 3H).
Пример 65
(RS)-3-((4-Метилфенил)аминокарбонилметил)-(N'-(4- метилфенил)уреидо)-1-(2-пиридилметил)индолин-2-он
ЯМР (ДМСО-d6) δ: 9,96 (с, 1H), 9,21 (с, 1H), 8,30 (с, 1H), 7,80 - 6,70 (м, 16H), 5,00 (с, 2H), 2,86 (д, J = 14,3 Гц, 1H), 2,59 (д, J = 14,3 Гц, 1H), 2,50 (c, 3H), 2,25 (c, 3H).
Пример 66
(RS)-3-((4-Метилфенил)аминокарбонилметил)-3-(N'-(4- метилфенил)уреидо)-1-(2-фенилэтил)индолин-2-он
ЯМР (ДМСО-d6) δ: 9,90 (с, 1H), 9,13 (с, 1H), 7,56 (с, 1H), 7,45 - 6,85 (м, 17H), 4,98 - 4,77 (шир., 2H), 2,99 - 2,80 (шир., 2H), 2,81 (д, J = 14,2 Гц, 1H), 2,48 (д, J = 14,2 Гц, 1H), 2,26 (с, 3H), 2,17 (с, 3H).
Пример 67
(RS)-1-Метил-3-((4-метилфенил)аминокарбонилметил)- 3-(N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (ДМСО-d6) δ: 9,88 (c, 1H), 9,12 (с, 1H), 7,54 (c, 1H), 7,39 (д, J = 8,2 Гц, 2H), 7,31 - 6,95 (м, 10H), 3,17 (c, 3H), 2,80 (д, J = 14,6 Гц, 1H), 2,52 (д, J = 14,6 Гц, 1H), 2,25 (с, 3H), 2,18 (с, 3H).
Пример 68
(RS)-3-((4-Метилфенил)аминокарбонилметил)-3-(N'-(4- метилфенил)уреидо)-1-(4-пиридилметил)индолин-2-он
ЯМР (ДМСО-d6) δ: 9,92 (с, 1H), 9,18 (с, 1H), 8,51 (д, J = 6,0 Гц, 2H), 7,65 (с, 1H), 7,50 (д, J = 5,8 Гц, 2H), 7,40 (д, J = 9,8 Гц, 2H), 7,28 - 6,86 (м, 9H), 6,75 (д, J = 7,2 Гц, 1H), 5,03 (д, J = 16,6 Гц, 1H), 4,93 (д, J = 16,6 Гц, 1H), 2,90 (д, J = 14,6 Гц, 1H), 2,63 (д, J = 14,6 Гц, 1H), 2,26 (с, 3H), 2,20 (с, 3H).
Пример 69
(RS)-1-(Метоксиметил)-3-((4-метилфенил)аминокарбонилметил)- 3-(N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (ДМСО-d6) δ: 9,90 (с, 1H), 9,14 (с, 1H), 7,61 (с, 1H), 7,39 (д, J = 7,6 Гц, 2H), 7,45 - 6,86 (м, 10H), 5,11 (c, 2H), 3,34 (с, 3H), 2,84 (д, J = 14,0 Гц, 1H), 2,56 (д, J = 14,0 Гц, 1H), 2,25 (с, 3H), 2,17 (с, 3H).
Пример 70
(RS)-3-((4-Метилфенил)аминокарбонилметил)-3-(N'-(4-метилфенил) уреидо)-1-(2,2-ди-н-пропилэтил)индолин-2-он
ЯМР (CDCl3) δ: 8,62 (с, 1H), 7,40 - 6,78 (м, 14H), 3,71 (дд, J = 7,4, 13,7 Гц, 1H), 3,52 (дд, J = 6,9, 13,7 Гц, 1H), 2,97 (д, J = 14,3 Гц, 1H), 2,62 (д, J = 14,3 Гц, 1H), 2,29 (с, 3H), 2,19 (с, 3H), 1,93 (шир., 1H), 1,50 - 1,10 (шир., 8H), 0,98 - 0,70 (шир., 6H).
Пример 71
(RS)-1-(2,2-Диэтоксиэтил)-3-((4-метилфенил)аминокарбонилметил)- 3-(N'-(4-метилфенил)уреидо)индолин-2-он
К раствору 0,397 г (RS)-1-(2,2-диэтоксиэтил)-3-(N'-(4- метилфенил)уреидо)индолин-2-она в 4 мл сухого диметилсульфоксида добавляли 1 мл 1М раствора трет-бутоксида калия в сухом диметилсульфоксиде при комнатной температуре в атмосфере азота с последующим перемешиванием в течение 30 минут. К полученной смеси добавляли по каплям раствор 0,228 г N-пара-толил-2-бромацетамида в 2 мл сухого диметилсульфоксида, после чего смесь перемешивали при той же самой температуре в течение 30 минут. Реакционную смесь вливали в водный раствор хлорида натрия и экстрагировали диэтиловым эфиром. Слой диэтилового эфира осушали над безводным сульфатом магния и концентрировали. Остаток очищали путем хроматографии на колонке с силикагелем (гексан/этилацетат = 2/1), и в результате получили 0,35 г (65%) указанного в заголовке соединения.
Rf = 0,21 (гексан/этилацетат = 2/1).
ЯМР (CDCl3) δ: 8,33 (с, 1H), 7,33 - 6,91 (м, 14H), 4,77 (дд, J = 4,4, 5,6 Гц, 1H), 4,03 (дд, J = 5,6, 14,1 Гц, 1H), 3,82 - 3,48 (м, 5H), 2,97 (д, J = 14,6 Гц, 1H), 2,57 (д, J = 14,6 Гц, 1H), 2,30 (с, 3H), 2,22 (с, 3H), 1,16 (т, J = 6,8 Гц, 3H), 1,11 (т, J = 6,8 Гц, 3H).
МС (m/е): 544 (M+), 498, 437, 365, 103, 75.
Пример 72
(RS)-7-Метил-3-((4-метилфенил)аминокарбонилметил)-3-(N'-(4- метил(фенил) уреидо)индолин-2-он
Указанное в заголовке соединение было получено (выход: 30%) так же, как в примере 71, за исключением того, что в качестве исходного материала вместо (RS)-1-(2,2-диэтоксиэтил)-3-(N'-(4- метилфенил)уреидо)индолин-2-она, использованного в примере 71, использовали 7-метил-3-(N'-(4-метилфенил)уреидо)индолин-2-он.
Rf = 0,21 (хлороформ/метанол = 20/1).
ЯМР (CDCl3) δ: 9,10 (шир., 1H), 8,61 (шир., 1H), 7,42 (шир., 1H), 7,26 - 6,73 (м, 12H), 3,06 (д. J = 14,5 Гц, 1H), 2,56 (д, J = 14,5 Гц, 1H), 2,24 (с, 3H), 2,19 (с, 3H), 2,03 (с, 3H).
МС (m/е): 442 (М+), 424, 381, 335, 161, 107.
Пример 73
(RS)-3-((4-Метилфенил)аминокарбонилметил)-3-(N'-(4-метилфенил) уреидо)-1-фенилиндолин-2-он
Указанное в заголовке соединение получали (выход: 57%) так же, как в примере 71, за исключением того, что в качестве исходного материала вместо (RS)-1-(2,2-диэтоксиэтил)-3-(N'-(4-метилфенил) уреидо)индолин-2-она, использованного в примере 71, использовали 3-(N'-(4-метилфенил)уреидо)-1-фенилиндолин-2-он.
Rf = 0,40 (хлороформ/метанол = 20/1).
ЯМР (ДМСО-d6) δ: 9,97 (c, 1H), 9,12 (с, 1H), 7,63 - 6,95 (м, 17H), 6,71 (д, J = 7,8 Гц, 1H), 2,95 (д, J = 14,1 Гц, 1H), 2,75 (д, J = 14,1 Гц, 1H), 2,25 (с, 3H), 2,19 (с, 3H).
МС (m/е): 504 (M+), 397, 365, 224, 132, 107.
Примеры 74 - 77
Следующие далее соединения были получены так же, как в примере 71, за исключением того, что в качестве исходного материала брали использованный в примере 71 (RS)-1-(2,2-диэтоксиэтил)-3-(N'-(4- метилфинил)уреидо)индолин-2-он, имеющий измененный заместитель в его положении 5.
Пример 74
(RS)-1-(2,2-Диэтоксиэтил)-5-метил-3-((4-метилфенил)аминокарбонилметил)- 3-(N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 8,25 (с, 1H), 7,32 (д, J = 8,3 Гц, 3H), 7,11 - 3,93 (м, 10H), 6,84 (c, 1H), 4,78 (дд, J = 4,4, 5,9 Гц, 1H), 3,99 (дд, J = 5,9, 14,6 Гц, 1H), 3,81 - 3,54 (м, 5H), 2,94 (д, J = 14,6 Гц, 1H), 2,54 (д, J = 14,6 Гц, 1H), 2,30 (с, 3H), 2,24 (с, 3H), 2,23 (с, 3H), 1,17 (т, J = 6,8 Гц, 3H), 1,12 (т, J = 6,8 Гц, 3H).
МС (m/е): 558 (M+), 512, 451, 406, 379, 306, 103.
Пример 75
(RS)-1-(2,2-диэтоксиэтил)-5-фтор-3-((4-метилифенил)аминокарбонилметил)- 3-(N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 8,61 (с, 1H), 7,35 - 6,86 (м, 13H), 4,72 (дд, J = 4,5, 5,4 Гц, 1H), 3,96 (дд, J = 5,4, 14,6 Гц, 1H), 3,74 - 3,44 (м, 5H), 2,95 (д, J = 14,6 Гц, 1H), 2,65 (д, J = 14,6 Гц, 1H), 2,27 (c, 3H), 2,19 (c, 3H), 1,12 (т, J = 6,8 Гц, 3H), 1,09 (т, J = 6,8 Гц, 3H).
Пример 76
(RS)-1-(2,2-Диэтоксиэтил)-5-метокси-3-((4-метилфенил)- аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)индолин-2-он
Rf = 0,20 (н-гексан/этилацетат = 2/1)
ЯМР (CDCl3)δ: 8,35 (c, 1H), 7,34 - 6,75 (м, 13H), 4,76 (дд, J = 4,3, 6,1 Гц, 1H), 3,99 (дд, J = 6,1, 14,5 Гц, 1H), 3,79 - 3,48 (м, 5H), 3,67 (c, 3H), 2,97 (д, J = 14,8 Гц, 1H), 2,61 (д, J = 14,8 Гц, 1H), 2,29 (c, 3H), 2,22 (c, 3H), 1,16 (т, J = 6,9 Гц, 3H), 1,12 (т, J = 6,9 Гц, 3H).
Пример 77
(RS)-5-Бром-1-(2,2-диэтоксиэтил)-3-((4-метилфенил)- аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 8,23 (c, 1H), 7,45 - 6,85 (м, 13H), 4,73 (дд, J = 3,9, 5,9 Гц, 1H), 3,98 (дд, J = 5,9, 14,8 Гц, 1H), 3,83 - 3,40 (м, 5H), 2,94 (д, J = 14,6 Гц, 1H), 2,56 (д, J = 14,6 Гц, 1H), 2,29 (с, 3H), 2,21 (с, 3H), 1,15 (т, J = 6,8 Гц, 3H), 1,11 (т, J = 7,0 Гц, 3H).
Примеры 78 - 95
Следующие ниже соединения были получены так же, как в примере 71, за исключением того, что в качестве исходного материала использовали (RS)-1-(2,2-диэтоксиэтил)-3-(N'-(4-метилфенил)уреидо)индолин-2-он, использованный в примере 71, но с его фрагментом (4-метилфенид)уреидо, замененным различными замещенными уреидами.
Пример 78
(RS)-3-(N'-(4-Хлорфенил)уреидо)-1-(2,2-диэтоксиэтил)-3- ((4-метилфенил)аминокарбонилметил)индолин-2-он
Rf = 0,33 (н-гексан/этилацетат = 1/1).
ЯРМ (CDCl3) δ: 8,43 (с, 1H), 7,54 (c, 1H), 7,31 - 7,24 (м, 4H), 7,12 - 6,97 (м, 9H), 4,78 (дд, J = 4,4, 5,8 Гц, 1H), 4,03 (дд, J = 5,8, 14,6 Гц, 1H), 3,84 - 3,48 (м, 5H), 3,03 (д, J = 14,6 Гц, 1H), 2,65 (д, J = 14,6 Гц, 1H), 2,28 (с, 3H), 1,19 - 1,07 (м, 6H).
Пример 79
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(4-метокcифенил)-уреидо-3- ((4-метилфенил)аминокарбонилметил)индолин-2-он
Rf = 0,23 (н-гексан/этилацетат = 1/1).
ЯРМ (CDCl3) δ: 8,33 (c, 1H), 7,33 - 6,95 (м, 12H), 6,67 (д, J = 8,8 Гц, 2H), 4,76 (дд, J = 4,5, 5,9 Гц, 1H), 4,04 (дд, J = 5,9, 14,1 Гц, 1H), 3,79 - 3,48 (м, 5H), 3,70 (с, 3H), 2,95 (д, J = 14,6 Гц, 1H), 2,56 (д, J = 14,6 Гц, 1H), 2,29 (с, 3H), 1,15 (т, J = 6,9 Гц, 3H), 1,10 (т, J = 6,8 Гц, 3H).
МС (m/е): 560 (М+), 514, 365, 217, 103
Пример 80
(RS)-1-(2,2-Диэтоксиэтил)-3-((4-метилфенил)аминокарбонилметил) -3-(N'-циклогексилуреидо)индолин-2-он
Rf = 0,25 (н-гексан/этилацетат = 2/1).
ЯМР (CDCl3) δ: 8,4 (c, 1H), 7,38 - 6,93 (м, 9H), 6,80 (c, 1H), 4,80 - 4,75 (м, 1H), 4,12 (дд, J = 5,8, 14,6 Гц, 1H), 3,78 - 3,34 (м, 6H), 2,94 (д, J = 14,6 Гц, 1H), 2,45 (д, J= 14,6 Гц, 1H), 2,31 ( c, 3H), 1,95 - 1,48 (м, 6H), 1,38 - 0,92 (м, 10H).
MC (m/е): 536 (М+), 490, 462, 391, 103.
Пример 81
(RS)-1-(2,2-Диэтоксиэтил)-3-((4-метилфенил)аминокарбонилметил) -3-(N'-(3-метилфенил)уреидо)индолин-2-он
ЯРМ (CDCl3) δ: 8,39 (с, 1H), 7,34 - 6,97 (м, 13H), 6,75 (д, J = 6,8 Гц, 1H), 4,79 (дд, J = 4,4, 5,9 Гц, 1H), 4,01 (дд, J = 5,9, 14,4 Гц, 1H), 3,84 - 3,46 (м, 5H), 2,98 (д, J = 14,6 Гц, 1H), 2,59 (д, J = 14,6 Гц, 1H), 2,30 (c, 3H), 2,19 (c, 3H), 1,16 (т, J = 6,8 Гц, 3H), 1,11 (т, J = 6,8 Гц, 3H),
MC (m/e): 544 (М+), 498, 470, 437, 365, 292, 157, 103, 75.
Пример 82
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(4-фторфенил)уреидо)-3- ((4-метилфенил)аминокарбонилметил)индолин-2-он
ЯМР (ДМСО-d6) δ: 9,27 (c, 1H), 7,62 (c, 1H), 7,40 -6,86 (м, 13H), 4,71 (дд, J = 4,6, 5,6 Гц, 1H), 3,86 (дд, J = 5,6, 14,2 Гц, 1H), 3,70 - 3,35 (м, 5H), 2,84 (д, J = 15,2 Гц, 1H), 2,50 (д, J = 15,2 Гц, 1H), 2,24 (с, 3H), 1,11 (т, J = 6,4 Гц, 3H), 1,07 (т, J = 6,4 Гц, 3H).
МC (m/e): 548 (М+), 502, 365, 292, 158, 103, 75.
Пример 83
(RS)-3-(N'-(2-Хлорфенил)уреидо)-1-(2,2-диэтоксиэтил)-3- ((4-метилфенил)aминокарбонилметил)индолин-2-он
ЯМР (ДМСО-d6) δ: 9,85 (c, 1H), 8,63 (c, 1H), 8,15 (с, 1H), 7,83 (д, J = 7,3 Гц, 1H), 7,38 - 6,88 (м, 11H), 4,70 (дд, J = 4,9, 5,4 Гц, 1H), 3,84 (дд, J = 5,4, 13,7 Гц, 1H), 3,70 - 3,37 (м, 5H), 2,97 (д, J= 14,6 Гц, 1H), 2,61 (д, J = 14,6 Гц, 1H), 2,23 (c, 3H), 1,07 (т, J= 7,3 Гц, 6H).
МС (м/е): 564 (M+), 490, 365, 292, 173, 103, 75.
Пример 84
(RS)-1-(2,2-Диэтоксиэтил)-3-((4-метилфенил)аминокарбонилметил)-3-(N'-фенилуреидо)индолин-2-он
ЯРМ (CDCl3) δ: 8,58 (c, 1H), 7,46 (c, 1H), 7,31 - 6,84 (м, 14H), 4,77 (дд, J = 3,9, 5,9 Гц, 1H), 4,00 (дд, J = 5,9, 14,1 Гц, 1H), 3,82 - 3,46 (м, 5H), 2,99 (д, J = 14,6 Гц, 1H), 2,67 (д, J = 14,6 Гц, 1H), 2,27 (с, 3H), 1,13 (т, J = 7,3 Гц, 3H), 1,10 (т, J = 7,3 Гц, 3H).
МС (m/e): 530 (M+), 365, 292, 217, 158, 103, 75.
Пример 85
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(3-метоксифенил)-уреидо)-3- ((4-метилфенил)аминокарбонилметил)индолин-2-он
ЯРМ (CDCl3) δ: 8,24 (c, 1H), 7,35 - 6,91 (м, 12H), 6,73 (д, J = 7,3 Гц, 1H), 6,50 (дд, J = 2,4, 7,8 Гц, 1H), 4,79 (дд, J = 3,9, 6,3 Гц, 1H), 3,98 (дд, J = 6,3, 14,1 Гц, 1H), 3,86 - 3,52 (м, 5H), 3,67 (c, 3H), 2,98 (д, J = 14,6 Гц, 1H), 2,54 (д, J = 14,6 Гц, 1H), 2,30 (c, 3H), 1,18 (т, J = 6,8 Гц, 3H), 1,10 (т, J = 6,8 Гц, 3H).
MC (m/е): 560 (M+), 365, 350, 292, 217, 149, 103, 75.
Пример 86
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-этилуреидо)-3-((4-метилфенил) аминокарбонилметил)индолин-2-он
ЯМР (CDCl3) δ: 7,97 (c, 1H), 7,37 - 6,88 (м, 9H), 4,79 (дд, J = 3,9, 6,3 Гц, 1H), 4,57 (шир., 1H), 4,09 (дд, J = 6,3, 14,6 Гц, 1H), 3,74 - 3,52 (м, 5H), 3,11 - 3,05 (м, 2H), 2,94 (д, J = 14,6 Гц, 1H), 2,44 (д, J = 14,6 Гц, 1H), 2,32 (с, 3H), 1,18 (т, J = 7,3 Гц, 3H), 1,14 (т, J = 6,8 Гц, 3H), 1,02 (т, J = 7,3 Гц, 3H).
MC (m/е): 482 (М+), 416, 408, 216, 103, 75.
Пример 87
(RS)-3-(N'-(4-Этоксикарбонилфенил)уреидо)-1-(2,2-диэтоксиэтил) -3-((4-метилфенил)аминокарбонилметил)индолин-2-он
ЯМР (CDCl3) δ: 8,16 (шир., 1H), 7,79 (д, J = 8,8 Гц, 2H), 7,49 - 6,97 (м, 12H), 4,81 (дд, J = 4,9, 6,3 Гц, 1H), 4,30 (кв, J = 7,3 Гц, 2H), 4,02 (дд, J = 6,3, 15,1 Гц, 1H), 3,89 - 3,57 (м, 5H), 3,02 (д, J = 14,6 Гц, 1H), 2,57 (д, J = 14,6 Гц, 1H), 2,30 (с, 3H), 1,34 (т, J = 7,3 Гц, 3H), 1,19 (т, J = 6,8 Гц, 3H), 1,12 (т, J = 7,3 Гц, 3H).
МC (m/е): 602 (M+), 365, 146, 120, 103, 75.
Пример 88
(RS)-1-(2.2-Диэтоксиэтил)-3-((4-метилфенил)аминокарбонилметил) -3-(N'-(2-метилфенил)уреидо)индолин-2-он
ЯМР (ДМСО-d6) δ: 9,86 (c, 1H), 8,28 (с, 1H), 7,80 (с, 1H), 7,52 (д, J = 8,3 Гц, 1H), 7,39 - 6,79 (м, 11H), 4,71 (дд, J = 4,9, 5,4 Гц, 1H), 3,85 (дд, J = 5,4, 14,1 Гц, 1H), 3,70 - 3,37 (м, 5H), 2,93 (д, J = 14,6 Гц, 1H), 2,55 (д, J = 14,6 Гц, 1H), 2,25 (c, 3H), 2,17 (c, 3H), 1,10 (т, J = 6,8 Гц, 3H), 1,07 (т, J = 6,8 Гц, 3H).
Пример 89
(RS)-3-(N'-(3-Хлорфенил)уpeидo)-1-(2,2-диэтоксиэтил)-3- ((4-метилфенил)аминокарбонилметил)индолин-2-он
ЯМР (ДМСО-d6) δ: 9,97 (c, 1H), 9,49 (c, 1H), 7,76 (с, 1H), 7,54 (с, 1H), 7,41 (д, J = 8,3 Гц, 2H), 7,24 - 6,89 (м, 9H), 4,75 (дд, J = 4,3, 5,9 Гц, 1H), 3,86 (дд, J = 5,9, 14,2 Гц, 1H), 3,76 - 3,51 (м, 5H), 2,84 (д, J = 15,2 Гц, 1H), 2,09 (д, J = 15,2 Гц, 1H), 2,26 (c, 3H), 1,14 (т, J = 6,8 Гц, 3H), 1,08 (т, J = 6,8 Гц, 3H).
Пример 90
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(2-метоксифенил)-уреидо) -S-((4-метилфенил)аминокарболинметил)индолин-2-он
ЯМР (МДСО-d6), δ: 9,80 (шир., 1H), 8,44 (c, 1H), 7,95 (с, 1H), 7,79 (д, J = 8,3 Гц, 1H), 7,35 - 6,71 (м, 11H), 4,70 (дд, J = 5,0, 5,0 Гц, 1H), 3,92 - 3,42 (м, 6H), 3,84 (c, 3H), 2,94 (д, J = 14,4 Гц, 1H), 2,60 (д, J = 14,4 Гц, 1H), 2,23 (с, 3H), 1,08 (т, J = 7,3 Гц, 6H).
MC (m/e): 560 (M+), 514, 392, 365, 173, 158, 130, 103, 75.
Пример 91
(RS)-1-(2,2-Диэтоксиэтил)-3-((4-метилфенил)аминокарбонилметил) -3-(N'-(4-нитрофенил)уреидо)индолин-2-он
ЯМР (ДМСО-d6) δ: 10,03 (д, J = 10,2 Гц, 2H), 8,04 (т, J = 9,3 Гц, 3H), 7,53 - 6,89 (м, 10H), 4,74 (дд, J = 5,3, 5,9 Гц, 1H), 3,89 (дд, J = 5,9, 14,2 Гц, 1H), 3,72 -3,50 (м, 5H), 2,86 (д, J = 15,1 Гц, 1H), 2,51 (д, J = 15,1 Гц, 1H), 2,26 (с, 3H), 1,13 (т, J = 6,8 Гц, 3H), 1,09 (т, J = 7,3 Гц, 3H).
Пример 92
(RS)-3-(N'-(4-Циафенил)уреино)-1-(2,2-диэтоксиэтил)-3-(2,2- ((4-метилфенил)аминокарбонилметил)индолин-2-он
ЯРМ (CDCl3) δ: 8,05 (c, 1H), 7,89 (c, 1H), 7,57 (c, 1H), 7,37 - 6,98 (м, 12H), 4,82 (дд, J = 3,9, 6,3 Гц, 1H), 4,07 (дд, J = 6,3, 15,2 Гц, 1H), 3,87 - 3,54 (м, 5H), 3,09 (д, J = 14,6 Гц, 1H), 2,58 (д, J = 14,6 Гц, 1H), 2,30 (c, 3H), 1,20 (т, J = 7,3 Гц, 3H), 1,14 (т, J = 7,3 Гц 3H).
Пример 93
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(3-трифторметилфенил) уреидо)-3-((4-метилфенил)аминокарбонилметил)индолин-2-он
ЯМР (CDCl3) δ: 8,32 (c, 1H), 7,62 (д, J = 4,4 Гц, 2H), 7,43 (c, 1H), 7,34 - 6,97 (м, 11H) , 4,81 (дд, J = 3,9, 5,9 Гц, 1H), 3,96 - 3,57 (м, 6H), 3,07 (д, J = 14,6 Гц, 1H), 2,62 (д, J = 14,6 Гц, 1H), 2,29 (c, 3H), 1,19 (т, J = 6,8 Гц, 3H), 1,09 (т, J = 7,3 Гц, 3H).
Пример 94
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(3-фторфенил)уреидо)-3- ((4-метилфенил)аминокарбонилметил)идолин-2-он
ЯМР (CDCl3) δ: 8,46 (c, 1H), 7,68 (c, 1H), 7,35 - 6,93 (м, 11H), 6,79 (д, J = 7,8 Гц, 1H), 6,55 (расщ. т, J = 8,8 Гц, 1H), 4,79 (дд, J = 3,9, 5,9 Гц, 1H), 3,98 (дд, J = 5,9, 14,4 Гц, 1H), 3,88 - 3,49 (м, 5H), 3,04 (д, J = 14,6 Гц, 1H), 2,66 (д, J = 14,6 Гц, 1H), 2,28 (c, 3H), 1,16 (т, J = 7,3 Гц, 3H), 1,11 (т, J = 7,3 Гц, 3H).
Пример 95
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(4-трифторметилфенил)уреидо)-3- ((4-метилфенил)aминокарбонилметил)индолин-2-он
Rf = 0,43 (н-гексан/этилацетат = 1/1).
ЯМР (ДMCO-d6) δ: 9,99 (c, 1H), 9,71 (c, 1H), 7,84 (с, 1H), 7,48 - 6,89 (м, 12H), 4,74 (дд, J = 3,2, 5,8 Гц, 1H), 3,88 (дд, J = 5,8, 13,6 Гц, 1H), 3,72 - 3,51 (м, 5H), 2,86 (д, J = 13,7 Гц, 1H), 2,51 (д, J = 13,7 Гц, 1H), 2,26 (c, 3H), 1,13 (т, J = 7,3 Гц, 3H), 1,09 (т, J = 7,3 Гц, 3H).
Пример 96
(RS)-3-((4-Метилфенил)аминокарбонилметил)-3-(N'-(4-метилфенил) уреидо)-1-(2,2-дипропоксиэтил)илдолин-2-он
К раствору 0,411 г (RS)-1-(2,2-диэтоксиэтил)-3-((4-метилфенил) аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)индолин-2-она в 50 мл н-пропанола добавляли 10 мг пара-толуолсульфокислоты, и полученную смесь нагревали с обратным холодильником в течение 2 часов. Реакционную смесь концентрировали, и остаток очищали путем хроматографии на колонке с силикагелем (гексан/этилацетат = 3/1), получив в результате 0,394 г (91%) указанного в заголовке соединения.
Rf = 0,64 (гексан/этилацетат = 1/1).
ЯМР (CDCl3) δ: 8,55 (с, 1H), 7,35 - 6,80 (м, 14H), 4,74 (дд, J = 4,4, 5,4 Гц, 1H), 3,99 (дд, J = 5,4, 14,6 Гц, 1H), 3,75 (дд, J = 4,4, 14,6 Гц, 1H), 3,68 - 3,32 (м, 4H), 2,95 (д, J = 14,6 Гц, 1H), 2,62 (д, J = 14,6 Гц, 1H), 2,29 (с, 3H), 2,20 (с, 3H), 1,62 - 1,38 (м, 4H), 0,91 - 0,70 (м, 6H).
Пример 97
(RS)-1-(Формилметил)-3-((4-метилфенил)аминокарбонилметил)-3- (N'-(4-метилфенил)уреидо)индолин-2-он
К раствору 4,32 г (RS)-1-(2,2-диэтоксиэтил)-3-((4-метилфенил) аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)индолин-2-она в 50 мл ацетона добавляли 5 мл 2 н. хлористоводородной кислоты, и полученную смесь перемешивали при комнатной температуре в течение 2 часов, реакционную смесь вливали в воду, и образовавшийся при этом осадок собирали путем фильтрации и промывали диэтиловым эфиром, получив в результате 2,94 г (79%) указанного в заголовке соединения.
ЯМР (ДМСО-d6) δ: 10,03 (c, 1H), 9,66 (c, 1H), 7,70 (c, 1H), 7,43 (д, J = 8,2 Гц, 2H), 7,28 - 6,81 (м, 11H), 4,76 (д, J = 18,0 Гц, 1H), 4,58 (д, J = 18,0 Гц, 1H), 2,87 (д, J = 14,8 Гц, 1H), 2,58 (д, J = 14,6 Гц, ), 2,26 (c, 3H), 2,18 (с, 3H).
Пример 98
(RS)-3-((4-Метилфенил)аминокарбонилметил)-3-(N'(4-метилфенил) уреидо-1-((2,5-диоксациклопентил)метил)индолтн-2-он
К раствору 0,294 г (RS)-1-(формилметил)-3-((4-метилфенил) аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)индолин-2-она в 50 мл толуола добавляли 0,5 мл этиленгликоля и 10 мг паратолуолсульфокислоты. Полученную смесь нагревали с обратным холодильником в течение 6 часов с азеотропным при этом удалением полученной воды вместе с толуолом. Реакционную смесь промывали насыщенным водным раствором гидрокарбоната натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Остаток очищали путем хроматографии на колонке с силикагелем (гексан/этилацетат = 2/1), и получили в результате 0,220 г (68%) указанного в заголовке соединения.
ЯМР (ДМСО-d6) δ: 9,94 (с, 1H), 9,15 (с, 1H), 7,62 (c, 1H), 7,41 (д, J = 8,2 Гц, 2H), 7,27 - 7,01 (м, 7H), 6,99 - 6,85 (м, 3H), 5,15 - 5,03 (м, 1H), 4,05 - 3,63 (м, 6H), 2,83 (д, J = 14,3 Гц, 1H), 2,47 (д, J = 14,3 Гц, 1H), 2,25 (с, 3H), 2,17 (д, 3H).
Примеры 99 - 101
Следующие далее соединения были получены так же, как в примере 98, за исключением того, что этиленгликоль, использованный в примере 98, заменяли на различные спирты.
Пример 99
(RS)-1-(2,2-Дибензилоксиэтил)-3-((4-метилфенил) аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)индолиа-2-он
ЯМР (ДМСО-d6) δ: 9,90 (с, 1H), 9,11 (с, 1H), 7,60 (с, 1H), 7,45 - 6,85 (м, 22H), 5,03 (дд, J = 5,1, 6,8 Гц, 1H), 4,71 (д, J = 11,7 Гц, 2H), 4,61 (д, J = 11,7 Гц, 2H), 4,10 - 3,83 (м, 2H), 2,84 (д, J = 14,8 Гц, 1H), 2,51 (д, J = 14,8 Гц, 1H), 2,25 (с, 3H), 2,17 (с, 3H).
Пример 100
(RS)-1-(2,2-Диметоксиэтил)-3-((4-метилфенил) аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (ДМСО-d6) δ: 9,96 (с, 1H), 9,15 (c, 1H), 7,63 (c, 1H), 7,41 (д, J = 8,2 Гц, 2H), 7,30 - 7,00 (м, 7H), 7,00 - 6,80 (м, 3H), 4,63 (дд, J = 4,3, 5,9 Гц, 1H), 3,91 (дд, J = 5,9, 14,3 Гц, 1H), 3,69 (дд, J = 4,3, 14,3 Гц, 1H), 3,36 (c, 3H), 3,34 (c, 3H), 2,86 (д, J = 14,3 Гц, 1H).
Пример 101
(RS)-3-((4-Meтилфeнил)aминoкapбoнилмeтил)-3-(N'-(4-метилфенил) уреидо)-1-((2,6-диокса-3,5-диметилциклогексил)метил)индолин-2-он
ЯМР (CDCl3) δ: 8,46 (c, 1H), 7,33 - 6,80 (м, 14H), 4,83 (дд, J = 4,9, 4,9 Гц, 1H), 4,12 (дд, J = 4,9, 14,3 Гц, 1H), 3,78 (дд, J = 4,9, 14,3 Гц, 1H), 3,62 (шир., 2H), 2,99 (д, J = 14,6 Гц, 1H), 2,68 (д, J = 14,6 Гц, 1H), 2,26 (с, 3H), 2,19 (с, 3H), 1,50 - 0,95 (м, 8H).
Пример 102
(RS)-1-(2-Метиламино)этил-3-((4-метилфенил)аминокарбонилметил) -3-(N'-(4-метилфенил)уреидо)индолин-2-он
К раствору 0,439 г (RS)-1-(формилметил)-3-((4-метилфенил) аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)-индолин-2-она в 15 мл метанола добавляли 1 мл 40%-ного водного раствора метиламина при комнатной температуре. После регулирования полученной смеси до pH 7 трифторуксусной кислотой к смеси добавляли 0,30 г цианборогидрида натрия. Полученную смесь перемешивали при комнатной температуре в течение 1 дня и затем концентрировали, концентрат разводили этилацетатом и промывали водным раствором хлорида натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Неочищенный продукт очищали путем хроматографии на колонке с силикагелем (гексан/этилацетат = 1/1), и в результате получили 0,39 г (90%) указанного в заголовке соединения.
ЯМР (CDCl3), для гидрохлорида) δ: 9,10 - 8,75 (шир., 1H), 7,95 - 7,50 (шир. , 2H), 7,30 - 6,55 (м, 12H), 4,15 -3,70 (шир., 2H), 3,10 - 2,38 (шир., 7H), 2,24 (шир. c, 3H), 2,16 (шир. с, 3H).
Пример 103
(RS)-3-((4-Метилфенил)аминокарбонилметил)-3-(N'-(4-метилфенил) уреидо)-1-(2-(1-пиперидил)этил)индолин-2-он
Указанное в заголовке соединение получали (выход: 63%) так же, как в примере 102, за исключением того, что использованный в примере 102 метиламин заменяли пиперидином.
ЯМР (CDCl3) δ: 9,10 (с, 1H), 8,04 (c, 1H), 7,73 (с, 1H), 7,40 - 6,70 (м, 12H), 4,10 (шир., 2H), 3,10 (шир., 8H), 2,23 (шир., 3H), 2,20 (шир., 3H).
Пример 104 (RS))-1-(2-Диметиламиноэтил)-3-((4-метилфенил) аминокарбонилметил)-3-(N'- (4-метилфенил)уреидо)индолин-2-он
Указанное в заголовке соединение получали так же, как в примере 102, за исключением того, что использованный в примере 102 метиламин заменяли диметиламином.
ЯМР (ДМСО-d6) δ:/ 9,92 (с, 1H), 9,13 (с, 1H), 7,57 (с, 1H), 7,40 (д, J = 8,4 Гц, 2H), 7,30 - 6,86 (м, 10H), 3,99 - 3,58 (м, 2H), 3,60 - 3,10 (м, 1H), 2,82 (д, J = 14,6 Гц, 1H), 2,70 - 2,35 (м, 2H), 2,28 (с, 6H), 2,25 (с, 3H), 2,18 (с, 3H).
Пример 105
(RS)-3-((4-Метилфенил)аминокарбонилметил)-3-(N'-(4-метилфенил) уреидо)-1-(2,2-бис(метилтио)этил)индолин-2-он
Избыток метилмеркаптана барботировали через раствор 0,538 г (RS)-1-(2,2-диэтoкcиэтил)-3-((4-мeлфeнил)aминoкарбонилметил)-3- ((4-метилфенил)уреидо)индолин-2-она в 30 мл дихлорметана при -10oC, и добавляли к раствору 0,30 мл этилэфирата трифторида бора с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь разбавляли дихлорметаном и промывали последовательно 1 н. водным раствором гидроксида натрия и водой. Органический слой осушали над безводным сульфатом натрия и концентрировали. Остаток промывала смесью гексан/этилацетат = 1/1, что дало в результате 0,495 г (91%) указанного в заголовке соединения.
Rf = 0,48 (гексан/этилацетат = 1/1).
ЯМР (ДМСО-d6) δ: 10,02 (c, 1H), 9,19 (c, 1H), 7,65 (c, 1H), 7,52 - 6,83 (м, 12H), 4,30 -3,94 (м, 2H), 3,85 (дд, J = 6,4, 14,2 Гц, 1H), 2,86 (д, J = 14,2 Гц, 1H), 2,54 (д, J = 14,2 Гц, 1H), 2,25 (с, 3H), 2,20 (с, 3H), 2,17 (с, 3H), 2,13 (с, 3H).
Пример 106
(RS)-1-(2,2-Бис(этилтио)этил)-3-((4-метилфенил) aминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)индолин-2-он
К раствору 0,512 г (RS)-1-(2,2-диэтоксиэтил)-3-((4-метилфенил) аминокарбонилметил)-3-(N'-(4-метилфенил)ypeидо)индолин-2-она в 30 мл дихлорметана добавляли последовательно 0,8 мл этилмеркаптана и 0,30 мл этилового эфирата трифторида бора при комнатной температуре, и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь промывали 1 н. водным раствором гидроксида натрия, и органический слой осушали над безводным сульфатом натрия и концентрировали. Остаток промывали смесью гексан/этилацетат = 1/1, и в результате получили 0,542 г (100%) указанного в заголовке соединения.
Rf = 0,62 (н-гексан/этилацетат = 1/1).
ЯРМ (ДМСО-d6) δ: 10,00 (с, 1H), 9,17 (с, 1H), 7,64 (с, 1H), 7,43 (д, J = 8,2 Гц, 2H), 7,30 - 6,78 (м, 10H), 4,38 - 4,26 (м, 1H), 4,14 - 3,79 (м, 2H), 2,86 (д, J = 14,8 Гц, 1H), 2,75 (кв, J = 7,3 Гц, 2H), 2,69 (кв, J = 7,3 Гц, 2H), 2,38 (д, J = 14,8 Гц, 1H), 2,26 (с, 3H), 2,17 (с, 3H), 1,23 (т, J = 7,3 Гц, 3H), 1,17 (т, J = 7,3 Гц, 3H).
Пример 107
(RS)-3-(Этоксикарбонилметил)-1-(2,2-диэтоксиэтил)-3-(N'- (4-метилфенил)уреидо)индолин-2-он
К раствору 7,50 г (RS)-1-(2,2-диэтоксиэтил)-3-(N'- (4-метилфенил)уреидо)индолин-2-она в 100 мл сухого диметилсульфоксида добавляли 20 мл 1М раствора трет-бутоксида калия в сухом диметилсульфоксиде при комнатной температуре в атмосфере азота, после чего полученную смесь перемешивали в течение 30 минут. К полученной смеси добавляли по каплям раствор 2,30 мл этилбромацетата в 20 мл сухого диметилсульфоксида, после чего смесь перемешивали при той же самой температуре в течение 30 минут. К смеси добавляли водный раствор хлорида натрия, и полученную в результате этого смесь экстрагировали диэтиловым эфиром. Слой диэтилового эфира осушали над безводным сульфатом магния и концентрировали. Остаток очищали путем хроматографии на колонке о силикагелем (гексан/этилацетат = 3/1), и в результате получили 8,21 г (90%) указанного в заголовке соединения.
ЯМР (CDCl3) δ: 7,34 - 7,24 (м, 2H), 7,19 - 6,95 (м, 7H), 6,76 (c, 1H), 4,76 (дд, J = 4,6, 5,9 Гц, 1H), 4,16 - 3,95 (м, 3H), 3,89 - 3,50 (м, 5H), 2,93 (д, J = 15,4 Гц, 1H), 2,59 (д, J = 15,4 Гц, 1H), 2,26 (с, 3H), 1,23 - 1,10 (м, 9H).
Пример 108
(RS)-1-(2,2-Диэтоксиэтил)-3-(гидроксикарбонилметил)-3-(N'- (4-метилфенил)уреидо)индолин-2-он
К раствору 8,21 г (RS)-3-(этоксикарбонилметил)-1- (2,2-диэтоксиэтил)-3-(N'-(4-метилфенил)уреидо)индолин-2-она в 100 мл метанола добавляли 30 мл водного раствора 2,0 г гидроксида калия (85%) при комнатной температуре, после чего полученную смесь перемешивали в течение 6 часов. Полученную реакционную смесь концентрировали, и концентрат разводили водой и затем промывали хлороформом. Полученный водный слой регулировали до pH 2 добавлением 2 н. хлористоводородной кислоты и экстрагировали хлороформом, а органический слой осушала над безводным сульфатом натрия и концентрировали, получив в результате 6,63 г (86%) указанного в заголовке соединения.
ЯМР (CDCl3) δ: 7,74 (c, 1H), 7,35 - 6,70 (м, 10H), 4,73 (дд, J = 4,4, 5,9 Гц, 1H), 4,01 (дд, J = 5,9, 14,6 Гц, 1H), 3,86 - 3,38 (м, 5H), 2,90 (д, J = 15,9 Гц, 1H), 2,65 (д, J = 15,9 Гц, 1H), 2,18 (с, 3H), 1,13 (т, J = 6,8 Гц, 3H), 1,08 (т, J = 6,8 Гц, 3H).
Пример 109
(RS)-1-(2,2-Диэтоксиэтил)-3-((N-метил)-(N-фенил)-амино) карбонилметил)-3-(N'-(4-метилфенил)уреидо)индолин-2-он
В 50 мл дихлорметана растворяли 0,360 г (RS )-1-(2,2- этоксиэтил)-3-(гидроксикарбонилметил)-3-(N'-(4-метилфенил)уреидо) индолин-2-она, и к полученному раствору добавляли последовательно 0,180 г 4-диметиламинопиридина, 0,180 г 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорида и 0,095 мл N -метиланилина. Полученную смесь перемешивали в течение 8 часов, после чего ее концентрировали. Остаток разводили этилацетатом и промывали последовательно разбавленной хлористоводородной кислотой и насыщенным водным раствором гидрокарбоната натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Неочищенный продукт очищали путем хроматографии на колонке с силикагелем (гексан/этилацетат 2/1), и получили в результате 0,278 г (65%) указанного в заголовке соединения в виде белого порошка.
ЯМР (CDCl3) δ: 7,83 (с, 1H), 7,39 - 6,83 (м, 12H), 6,63 (шир., 2H), 4,55 (дд, J = 5,4, 5,8 Гц, 1H), 3,87 (дд, J = 5,8, 14,2 Гц, 1H), 3,75 - 3,28 (м, 5H), 3,24 (с, 3H), 2,64 (д, J = 14,6 Гц, 1H), 2,27 (д, J = 14,6 Гц, 1H), 2,24(c, 3H), 1,06 (т, J = 6,8 Гц, 3H), 1,03 (т, J = 6,8 Гц, 3H).
Примеры 110 - 137
Следующие ниже соединения были получены так же, как в примере 109, за исключением того, что в качестве исходного материала вместо N-метиланилина, использованного в примере 109, использовали различные амины. Пример 110 (RS )-1-(2,2-Диэтоксиэтил)-3-( (4-метокcикарбонилфенил)-аманокарбонилметил)-3-(N'-(4-метилфенил) уреидо)индолин-2-он
ЯМР (CDCl3) δ: 9,03 (с, 1H), 7,89 (д, J = 8,8 Гц, 2H), 7,49 (д, J = 8,8 Гц, 2H), 7,48 - 7,26 (м, 4H), 7,26 - 6,82 (м, 6H), 4,76 (дд, J = 4,4, 6,0 Гц, 1H), 3,99 (дд, J = 6,0, 14,3 Гц, 1H), 3,89 (с, 3H), 3,89 - 3,40 (м, 5H), 3,01 (д, J = 15,2 Гц, 1H), 2,75 (д, J= 15,2 Гц, 1H), 2,19 (с, 3H), 1,12 (т, J = 7,0 Гц, 3H), 1,09 (т, J= 6,8 Гц, 3H).
Пример 111
(RS)-1-(2,2-Диэтоксилэтил)-3-((3-метилфенил)аминокарбонилметил) -3-(N'-(4-метилсфенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 8,51 (c, 1H), 7,35 - 6,86 (м, 14H), 4,77 (дд, J = 4,4, 5,9 Гц, 1H), 4,01 (дд, J = 5,9, 13,7 Гц, 1H), 3,85 - 3,40 (м, 5H), 2,98 (д, J = 14,3 Гц, 1H), 2,64 (д, J = 14,3 Гц, 1H), 2,27 (с, 3H), 2,20 (с, 3H), 1,14 (т, J = 7,4 Гц, 3H), 1,10 (т, J = 6,8 Гц, 3H).
Пример 112
(RS)-1-(2,2-Диэтоксиэтил)-3-((2-метилфенил)аминокарбонилметил) -3-(N'-(4-метилфенил)уреидо)индoлин-2-oн
ЯМР (ДМСО-d6) δ: 9,43 (c, 1H), 9,04 (c, 1H), 7,56 (c, 1H), 7,34 - 6,80 (м, 12H), 4,77 - 4,65 (м, 1H), 3,86 (дд, J = 5,7, 13,1 Гц, 1H), 3,76 - 3,40 (м, 5H), 2,89 (д, J = 14,3 Гц, 1H), 2,62 (д, J = 14,3 Гц, 1H), 2,18 (c, 3H), 2,06 (c, 3H).
Пример 113
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(4-метилфенил)-уреидо-3- (н-пропиламинокарбонилметил)индолин-2-он
ЯМР (CDCl3) δ: 7,41 (с, 1H), 7,34 - 6,90 (м, 9H), 6,28 (шир., 1H), 4,78 (дд, J = 4,4 Гц, 5,8 Гц, 1H), 4,00 (дд, J = 5,8, 13,7 Гц, 1H), 3,89 - 3,44 (м, 5H), 3,17 (шир., 2H), 2,83 (д, J = 14,8 Гц, 1H), 2,36 (д, J = 14,3 Гц, 1H), 2,23 (c, 3H), 1,47 (кв, J = 7,4 Гц, 2H), 1,18 (т, J = 7,4 Гц, 3H), 1,11 (т, J = 7,4 Гц, 3H), 0,86 (т, J = 7,4 Гц, 3H).
Пример 114
(RS)-3-((4-Хлорфенил)аминокарбонилметил)-1-(2,2-диэтоксиэтил) -3-(N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 8,79 (c, 1H), 7,40 - 6,80 (м, 14H), 4,74 (дд, J = 4,4, 5,4 Гц, 1H), 3,98 (дд, J = 5,4, 14,2 Гц, 1H), 3,80 - 3,35 (м, 5H), 2,98 (д, J = 14,5 Гц, 1H), 2,72 (д, J = 14,6 Гц, 1H), 2,19 (с, 3H), 1,11 (т, J = 7,4 Гц, 3H), 1,09 (т, J = 6,8 Гц, 3H).
Пример 115
(RS)-1-(2,2-Диэтоксиэтил)-3-((4-метоксифенил)аминокарбонилметил) -3-(N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 7,40 - 6,60 (м, 15H), 4,75 (дд, J = 4,8,) 5,8 Гц, 1H), 3,99 (дд, J = 5,8, 14,1 Гц, 1H), 3,88 - 3,40 (м, 5H), 3,64 (c, 3H), 2,86 (д, J = 15,2 Гц, 1H), 2,58 (д, J = 15,2 Гц, 1H), 2,27 (с, 3H), 1,17 (т, J = 6,8 Гц, 3H), 1,13 (т, J = 7,4 Гц, 3H).
Пример 116
(RS)-3-((3-Этоксикарбонилпропил)аминокарбонилметил)- 1-(2,2-диэтоксиэтил)-3-(N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 7,40 - 6,70 (м, 10H), 6,40 (шир., т, J = 5,7 Гц, 1H), 4,78 (дд, J = 4,4, 6,3 Гц, 1H), 4,18 - 3,90 (м, 3H), 3,86 - 3,47 (м, 5H), 3,38 - 3,20 (м, 2H), 2,78 (д, J = 14,2 Гц, 1H), 2,37 (д, J = 14,2 Гц, 1H), 2,25 (c, 3H), 1,90 - 1,75 (м, 2H), 1,33 - 1,05 (м, 11H).
Пример 117
(RS)-1-(2,2-Диэтoкcиэтил)-3-(мeтoксиaмиинокарбoнилмeтил)-3-(N' -(4-метилфенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 7,33 - 6,80 (м, 9H), 6,68 (с, 1H), 6,62 (c, 1H), 4,76 (дд, J = 4,4, 5,8 Гц, 1H), 3,98 (дд, J = 5,8, 14,2 Гц, 1H), 3,86- 3,40 (м, 5H), 3,66 (с, 3H), 2,91 (д, J = 15,0 Гц, 1H), 2,57 (д, J = 15,0 Гц, 1H), 2,28 (c, 3H), 1,17 (т, J = 6,8 Гц, 3H), 1,13 (т, J = 6,8 Гц, 3H).
Пример 118
(RS)-(2,2-Диэтоксиэтил)-3-((4-метоксикарбонилметилфенил) аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)-индолин-2-он
ЯМР (CDCl3) δ: 8,42 (c, 1H), 7,41 (д, J = 8,4 Гц, 2H), 7,28 - 6,80 (м, 12H), 4,78 (дд, J = 3,9, 5,7 Гц, 1H), 4,02 (дд, J = 5,7, 14,3 Гц, 1H), 3,86 - 3,40 (м, 5H), 3,69 (с, 3H), 3,58 (c, 2H), 2,94 (д, J = 14,6 Гц, 1H), 2,55 (д, J = 14,6 Гц, 1H), 2,23 (с, 3H), 1,16 (т, J = 7,0 Гц, 3H), 1,11 (т, J = 6,8 Гц, 3H).
Пример 119
(RS)-1-(2,2-Диэтоксиэтил)-3-((2,2-диэтоксиэтил) аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 7,35 -6,81 (м, 9H), 6,80 (c, 1H), 6,20 (шир., 1H), 4,77 (дд, J= 4,4 Гц, 6,2 Гц, 1H), 4,49 (т, J = 4,8 Гц, 1H), 4,00 (дд, J = 6,2, 14,2 Гц, 1H), 3,84 -3,20 (м, 11H), 2,85 (д, J = 14,6 Гц, 1H), 2,30 (д, J = 14,6 Гц, 1H), 2,24 (с, 3H), 1,30 - 0,95 (м, 12H).
Пример 120
(RS)-1-(2,2-Диэтоксиэтил)-3-((4-гексилфенил)аминокарбонилметил) -3-(N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 8,28 (c, 1H), 7,36 - 6,75 (м, 14H), 4,76 (дд, J = 4,3, 5,7 Гц, 1H), 3,99 (дд, J = 5,7, 13,7 Гц, 1H), 3,85 - 3,40 (м, 5H), 2,96 (д, J = 14,3 Гц, 1H), 2,59 (д, J = 14,3 Гц, 1H), 2,53 (т, J = 7,4 Гц, 2H), 2,22 (c, 3H), 1,70 - 1,42 (м, 2H), 1,42 - 0,97 (м, 12H), 0,87 (т, J = 5,7 Гц, 3H).
Пример 121
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(4-метилфенил)-уреидо)-3- ((4-нитрофенил)аминокарбонилметил)индолин-2-он
ЯМР (CDCl3) δ: 9,45 (с, 1H), 8,05 (д, J = 9,0 Гц, 2H), 7,58 (д, J = 9,0 Гц, 2H), 7,38 - 7,15 (м, 3H), 7,10 - 6,80 (м, 7H), 4,77 (дд, J = 4,4, 5,8 Гц, 1H), 4,01 (дд, J = 5,8, 14,6 Гц, 1H), 3,79 - 3,40 (м, 5H), 3,06 (д, J = 15,0 Гц, 1H), 2,80 (д, J = 15,0 Гц, 1H), 2,20 (с, 3H), 1,14 (т, J = 6,8 Гц, 3H), 1,10 (т, J = 7,2 Гц, 3H).
Пример 122
(RS)-1-(2,2-Диэтоксиэтил)-3-((3,4-диметилфенил) аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 8,44 (c, 1H), 7,30 - 6,85 (м, 13H), 4,77 (дд, J = 4,4, 5,7 Гц, 1H), 3,99 (дд, J = 5,7, 14,9 Гц, 1H), 3,85 - 3,43 (м, 5H), 2,97 (д, J = 15,2 Гц, 1H), 2,60 (д, J = 15,2 Гц, 1H), 2,21 (с, 3H), 2,19 (с, 3H), 2,16 (с, 3H), 1,15 (т, J = 6,8 Гц, 3H), 1,10 (т, J = 6,8 Гц, 3H).
Пример 123
(RS)-3-((3-Хлорфенил)аминокарбонилметил)-1-(2,2-диэтоксиэтил) -3-(N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 8,64 (с, 1H), 7,58 (с, 1H), 7,35 - 6,84 (м, 13H), 4,76 (дд, J = 4,4, 5,7 Гц, 1H), 4,02 (дд, J = 5,7, 13,7 Гц, 1H), 3,81 - 3,40 (м, 5H), 2,99 (д, J = 14,6 Гц, 1H), 2,72 (д, J = 14,6 Гц, 1H), 2,21 (с, 3H), 1,14 (т, J = 6,8 Гц, 3H), 1,10 (т, J = 6,8 Гц, 3H).
Пример 124
(RS)-1-(2,2-Диэтоксиэтил)-3-((4-фторфенил)аминокарбонилметил)-3- (N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 8,60 (с, 1H), 7,42 - 6,83 (м, 14H), 4,74 (дд, J = 4,3, 5,7 Гц, 1H), 3,98 (дд, J = 5,7, 14,3 Гц, 1H), 3,80 - 3,40 (м, 5H), 2,95 (д, J = 14,3 Гц, 1H), 2,67 (д, J = 14,3 Гц, 1H), 2,21 (с, 3H), 1,14 (т, J = 7,2 Гц, 3H), 1,10 (т, J = 7,4 Гц, 3H).
Пример 125
(RS)-3-((4-Аминофенил)аминокарбонилметил)-1-(2,2-диэтоксиэтил) -3-(N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 8,38 (с, 1H), 7,35 - 6,80 (м, 12H), 6,53 (д, J = 8,2 Гц, 2H), 4,76 (дд, J = 4,4, 5,9 Гц, 1H), 4,01 (дд, J = 5,9, 13,7 Гц, 1H), 3,85 - 3,40 (м, 5H), 2,91 (д, J = 14,6 Гц, 1H), 2,56 (д, J = 14,6 Гц, 1H), 2,20 - 1,70 (шир. , 2H), 2,19 (с, 3H), 1,14 (т, J = 7,0 Гц, 3H), 1,09 (т, J = 7,4 Гц, 3H).
Пример 126
(RS)-3-(Бензиламинокарбонилметил)-1-(2.2-диэтоксиэтил)-3-(N' -(4-метилфенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 7,40 - 6,84 (м, 15H), 6,63 (т, J = 5,4 Гц, 1H), 4,75 (дд, J = 4,4, 5,7 Гц, 1H), 4,33 (д, J = 5,4 Гц, 2H), 3,98 (дд, J = 5,7 Гц, 14,3 Гц, 1H), 3,84 - 3,39 (м, 5H), 2,86 (д, J = 14,6 Гц, 1H), 2,44 (д, J = 14,6 Гц, 1H), 2,22 (с, 3H), 1,13 (т, J = 6,8 Гц, 3H), 1,08 (т, J = 7,4 Гц, 3H).
Пример 127
(RS)-1-(2,2-Диэтоксиэтил)-3-((4-гидроксифенил) аминокарбонилметил)-3-(N'-(4-метил(фенил)уреидо)индолин-2-он
ЯМР (ДМСО-d6) δ: 9,72 (с, 1H), 9,09 (с, 1H), 9,07 (c, 1H), 8,13 (c, 1H), 7,67 (с, 1H), 7,33 - 6,83 (м, 9H), 6,68 (д, J = 8,8 Гц, 1H), 4,81- 4,69 (м, 1H), 3,88 (дд, J = 5,7, 14,3 Гц, 1H), 3,80 - 3,40 (м, 5H), 2,80 (д, J = 14,0 Гц, 1H), 2,44 (д, J = 14,0 Гц, 1H), 2,19 (с, 3H), 1,16 (т, J = 7,4 Гц, 3H), 1,11 (т, J = 7,4 Гц, 3H).
Пример 128 (RS)-1-(2,2-Диэтоксиэтил)-3-((4-трифторметилфенил)- аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 8,87 (с, 1H), 7,56 (дд, J = 8,8 Гц, 2H), 7,48 (д, J = 8,8 Гц, 2H), 7,27 (т, J = 7,8 Гц, 2H), 7,18 - 6,85 (м, 8H), 4,77 (дд, J = 4,6 Гц, 5,7 Гц, 1H), 4,01 (дд, J = 5,7, 13,1 Гц, 1H), 3,83 - 3,45 (м, 5H), 2,99 (д, J = 14,8 Гц, 1H), 2,71 (д, J = 14,8 Гц, 1H), 2,22 (с, 3H), 1,15 (т, J = 6,8 Гц, 3H), 1,10 (т, J = 6,8 Гц, 3H).
Пример 129
(RS)-1-(2,2-Диэтоксиэтил)-3-((3-метоксифенил)аминокарбонилметил) -3-(N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 8,35 - 8,14 (м, 1H), 7,34 - 6,90 (м, 12H), 6,90 - 6,63 (м, 2H), 4,78 (дд, 7 = 3,8, 5,7 Гц, 1H), 4,02 (дд, J = 5,7, 13,7 Гц, 1H), 3,77 (с, 3H), 3,85 - 3,45 (м, 5H), 2,97 (д, J = 14,2 Гц, 1H), 2,54 (д, J = 14,2 Гц, 1H), 2,24 (с, 3H), 1,18 (т, J = 6,8 Гц, 3H), 1,12 (т, J = 7,2 Гц, 3H).
Пример 130
(SR)-1-(2,2-Диэтоксиэтил)-3-((4-(N'N-диметиламино)фенил) аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)-индолин-2-он
ЯМР (CDCl3) δ: 8,31 (с, 1H), 7,33 - 6,85 (м, 12H), 6,61 (д, J = 8,8 Гц, 2H), 4,78 (дд, J = 3,9, 5,7 Гц, 1H), 4,00 (дд, J = 5,7 Гц, 14,3 Гц, 1H), 3,85 - 3,40 (м, 5H), 2,94 (д, J = 14,6 Гц, 1H), 2,89 (с, 6H), 2,55 (д, J = 14,6 Гц, 1H), 2,22 (с, 3H), 1,16 (т, J = 6,8 Гц, 3H), 1,11 (т, J = 7,4 Гц, 3H).
Пример 131
(RS)-1-(2,2-Диэтоксиэтил)-3-((4-(N-трифторметилкарбонил- N-метиламино)фенил)аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо) индолин-2-он
ЯМР (CDCl3) δ: 8,83 (с, 1H), 7,54 (д, J = 8,6 Гц, 2H), 7,36 - 7,17 (м, 3H), 7,16 - 6,87 (м, 9H), 4,78 (дд, J = 4,3, 5,9 Гц, 1H), 4,01 (дд, J = 5,9 Гц, 14,2 Гц, 1H), 3,82 - 3,50 (м, 5H), 3,29 (c, 3H), 2,95 (д, J = 14,8 Гц, 1H), 2,66 (д, J = 14,8 Гц, 1H), 2,22 (c, 3H), 1,15 (т, J = 6,9 Гц, 3H), 1,10 (т, J = 6,9 Гц, 3H).
Пример 132
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(4-метилфенил)-уреидо)-3- ((2-пиримидинил)аминокарбонилметил)индолин-2-он
ЯМР (CDCl3) δ: 8,42 (д, J = 5,0 Гц, 2H), 7,79 (шир., 1H), 7,46 - 6,80 (м, 11H), 4,84 (дд, J = 4,4, 5,9 Гц, 1H), 4,04 (дд, J= 5,9 Гц, 14,2 Гц, 1H), 3,88 (дд, J = 4,4, 14,2 Гц, 1H), 3,81 - 3,47 (м, 4H), 3,16 (шир., 2H), 2,20 (c, 3H), 1,18 (т, J = 7,0 Гц, 3H), 1,14 (т, J = 7,2 Гц, 3H).
Пример 133
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(4-метилфенил)-уреидо)-3- (фениламинокарбонилметил)индолин-2-он
ЯМР (CDCl3) δ: 8,49 (с, 1H), 7,42 (д, J = 7,8 Гц, 2H), 7,35 - 6,86 (м, 13H), 4,77 (дд, J = 4,4, 5,9 Гц, 1H), 4,00 (дд, J = 5,9, 14,1 Гц, 1H), 3,85 - 3,40 (м, 5H), 2,97 (д, J = 14,6 Гц, 1H), 2,64 (д, J = 14,6 Гц, 1H), 2,21 (с, 3H), 1,14 (т, J = 7,3 Гц, 3H), 1,10 (т, J = 7,3 Гц, 3H).
Пример 134
(RS)-1-(2,2-Диэтоксиэтил)-3-((4-(N, N-диэтиламино)фенил) аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)-индолин-2-он
ЯМР (CDCl3) δ: 8,18 (с, 1H), 7,38 - 6,77 (м, 12H), 6,55 (д, J = 9,4 Гц, 2H), 4,78 (дд, J = 4,4, 5,8 Гц, 1H), 4,02 (дд, J = 5,8 Гц, 14,2 Гц, 1H), 3,85 - 3,41 (м, 5H), 3,29 (кв, J = 6,8 Гц, 4H), 2,95 (д, J = 14,6 Гц, 1H), 2,53 (д, J = 14,6 Гц, 1H), 2,21 (c, 3H), 1,22 - 0,92 (м, 12H).
Пример 135
(RS)-1-(2,2-Диэтоксиэтил)-3-((4-трифторметилкарбониламино) фенил)аминокарбонилметил)-3-(N'-(4-метилфенил)-уреидо)индолин-2-он
ЯМР (CDCl3) δ: 8,88 (с, 1H), 3,27 (с, 1H), 7,43 - 7,12 (м, 7H), 7,12 - 6,77 (м, 7H), 4,78 (дд, J = 3,9, 5,8 Гц, 1H), 4,03 (дд, J = 5,8, Гц, 14,6 Гц, 1H), 3,84- 3,39 (м, 5H), 2,95 (д, J = 14,8 Гц, 1H), 2,72 (д, J = 14,8 Гц, 1H), 2,19 (с, 3H), 1,14 (т, J = 7,0 Гц, 3H), 1,10 (т, J = 6,8 Гц, 3H).
Пример 136
(RS)-1-(2,2-Диэтоксиэтил)-3-(((1-трифторметилкарбонил)индолин- 5-ил)аминокарбонилметил)-3-(N'-(4-метилфенил)-уреидо)индолин-2-он
ЯМР (CDCl3) δ: 8,99 (с, 1H), 8,01 (д, J = 8,3 Гц, 1H), 7,54 (с, 1H), 7,40 - 6,80 (м, 11H), 4,79 (дд, J = 3,8, 5,9 Гц, 1H), 4,22 - 3,94 (м, 3H), 3,88 - 3,41 (м, 5H), 3,13 -2,86 (м, 3H), 2,77 (д, J = 15,1 Гц, 1H), 2,19 (с, 3H), 1,15 (т, J = 3,8 Гц, 3H), 1,10 (т, J = 6,8 Гц, 3H).
Пример 137
(RS)-1-(2,2-Диэтоксиэтил)-3-((5-индолиламино)карбонилметил)-3- (N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 8,72 (с, 1H), 8,27 (c, 1H), 7,58 (с, 1H), 7,46 (с, 1H), 7,33 (с, 1H), 7,24 - 6,72 (м, 11H), 6,32 (c, 1H), 4,79 - 4,67 (м, 1H), 3,99 (дд, J = 5,5, 14,6 Гц, 1H), 3,84 - 3,38 (м, 5H), 2,87 (д, J = 14,6 Гц, 1H), 2,49 (д, J = 14,6 Гц, 1H), 2,13 (c, 3H), 1,08 (т, J = 6,8 Гц, 3H), 1,05 (т, J = 6,8 Гц, 3H).
Пример 138
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(4-метилфенил)-уреидо)-3-((5- метилпиридо-2-ил)аминокарбонилметил)индолин-2-он
К раствору 0,223 г (RS)-1-(2,2-диэтоксиэтил)-3- (гидроксикарбонилметил)-3-(N'-(4-метилфенил)уреидо)индолин-2-она в 15 мл дихлорметана добавляли последовательно 0,140 г 4-диметиламинопиридина и 0,040 мл тионилхлорида при 0oC, после чего полученную смесь перемешивали при 0oC в течение 30 минут. К смеси добавляло еще 0,070 г 4-диметиламинопиридина и 0,130 г 6-амино-3-пиколина при 0oC. Полученную смесь перемешивали при комнатной температуре в течение 1 часа а затем промывали водным раствором хлорида натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Неочищенный продукт очищали путем хроматографии на колонке с силикагелем (гексан/этилацетат = 2/1), и в результате получили 0,169 г (73%) указанного в заголовке соединения.
ЯМР (CDCl3) δ: 9,01 (с, 1H), 7,98 (д, J = 8,8 Гц, 1H), 7,93 (с, 1H), 7,46 (дд, J = 2,6, 8,8 Гц, 1H), 7,30 - 6,87 (м, 10H), 4,77 (дд, J = 4,4, 6,2 Гц, 1H), 3,97 (дд, J = 6,2, 14,2 Гц, 1H), 3,87 - 3,42 (м, 5H), 3,06 (д, J = 14,2 Гц, 1H), 2,57 (д, J = 14,2 Гц, 1H), 2,25 (с, 3H), 2,23 (с, 3H), 1,14 (т, J = 7,4 Гц, 3H), 1,14 (т, J = 7,4 Гц, 3H), 1,11 (т, J = 7,2 Гц, 3H).
Примеры 139 - 145
Следующие ниже соединения получали так же, как в примере 138, за исключением того, что вместо 6-амино-3-пиколина, использованного в примере 138, использовали различные амины.
Пример 139
(RS)-3-((2-Хлорфенил)аминокарбонилметил)-1-(2,2-диэтоксиэтил) -3-(N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 8,15 (д, J = 8,0 Гц, 1H), 7,89 (с, 1H), 7,35 - 6,35 (м, 13H), 4,78 (дд, J = 4,4, 5,8 Гц, 1H), 4,02 (дд, J = 5,8 Гц, 14,3 Гц, 1H), 3,85 - 3,40 (м, 5H), 3,10 (д, J = 14,6 Гц, 1H), 2,62 (д, J = 14,6 Гц, 1H), 2,24 (с, 3H), 1,14 (т, J = 7,0 Гц, 3H), 1,12 (т, J = 7,2 Гц, 3H).
Пример 140
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(4-метилфенил)-уреидо)-3- ((4-пиридиламино)карбонилметил)индолин-2-он
ЯМР (CDCl3) δ: 9,68 (с, 1H), 8,32 (д, J = 5,8 Гц, 2H), 7,73 (с, 1H), 7,45 - 6,80 (м, 11H), 4,77 (дд, J = 4,5, 5,7 Гц, 1H), 4,02 (дд, J = 5,7 Гц, 14,3 Гц, 1H), 3,85 - 3,40 (м, 5H), 2,99 (д, J = 15,0 Гц, 1H), 2,74 (д, J = 15,0 Гц, 1H), 2,20 (с, 3H), 1,14 (т, J = 7,0 Гц, 3H), 1,10 (т, J = 7,4 Гц, 3H).
Пример 141
(RS)-1-(2,2-Диэтоксиэтил)-3-((2-метоксифенил)аминокарбонилметил) -3-(N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 8,22 (дд, J = 1,4 Гц, 7,8 Гц, 1H), 7,88 (с, 1H), 7,40 - 6,75 (м, 13H), 4,78 (дд, J = 4,4, 5,8 Гц, 1H), 4,03 (дд, J = 5,8 Гц, 13,7 Гц, 1H), 3,74 (с, 3H), 3,90 - 3,43 (м, 5H), 3,12 (д, J = 14,6 Гц, 1H), 2,53 (д, J = 14,6 Гц, 1H), 2,21 (с, 3H), 1,15 (т, J = 7,4 Гц, 3H), 1,12 (т, J = 6,8 Гц, 3H),
Пример 142
(RS)-1-(2,2-Диэтоксиэтил)-3-((2-гидрокси-4-метилфенил) аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)-индолин-2-он
ЯМР (CDCl3) δ: 8,57 (с, 1H), 8,65 - 8,20 (шир., 1H), 7,32 - 7,15 (м, 3H), 7,15 - 6,79 (м, 8H), 6,73 (с, 1H), 6,57 (д, J = 8,4 Гц, 1H), 4,73 (дд, J = 4,9, 5,7 Гц, 1H), 4,01 (дд, J = 5,7, 14,3 Гц, 1H), 3,80- 3,43 (м, 5H), 2,87 (д, J = 14,3 Гц, 1H), 2,72 (д, J = 14,3 Гц, 1H), 2,21 (с, 3H), 2,19 (с, 3H), 1,11 (т, J = 6,8 Гц, 3H), 1,08 (т, J = 7,4 Гц, 3H).
Пример 143
(RS)-1-(2,2-Диэтоксиэтил)-3-((2-метоксипиридо-5-ил)- аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 8,61 (с, 1H), 8,11 (д, J = 2,4 Гц, 1H), 7,65 (дд, J = 3,0 Гц, 8,8 Гц, 1H), 7,35 - 6,79 (м, 10 H), 6,61 (д, J = 8,8 Гц, 1H), 4,76 (дд, J = 3,0, 5,7 Гц, 1H), 4,00 (дд, J = 5,7 Гц, 14,3 Гц, 1H), 3,87 (с, 3H), 3,87 - 3,38 (м, 5H), 2,96 (д, J = 14,3 Гц, 1H), 2,68 (д, J = 14,3 Гц, 1H), 2,20 (с, 3H), 1,13 (т, J = 7,2 Гц, 3H), 1,09 (т, J = 7,0 Гц, 3H).
Пример 144
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(4-метилфенил)-уреидо)-3- ((2-пиридил)аминокарбонилметил)индолин-2-он
ЯМР (CDCl3) δ: 8,97 (шир.,с, 1H), 8,14 (д, J = 4,9 Гц, 1H), 8,08 (д, J = 7,9 Гц, 1H), 7,65 (т, J = 7,3 Гц, 1H), 7,35 - 6,85 (м, 11H), 4,77 (дд, J = 4,3, 5,9 Гц, 1H), 3,99 (дд, J = 5,9 Гц, 14,2 Гц, 1H), 3,90 - 3,47 (м, 5H), 3,10 (д, J = 14,8 Гц, 1H), 2,61 (д, J = 14,8 Гц, 1H), 2,23 (с, 3H), 1,14 (т, J = 6,9 Гц, 3H), 1,11 (т, J = 7,3 Гц, 3H).
Пример 145
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(4-метилфенил)-уреидо-3- ((3-пиридил)аминокарбонилметил)индолин-2-он
ЯМР (CDCl3) δ: 9,21 (с, 1H), 8,61 (д, J = 2,6 Гц, 1H), 8,23 (д, J = 4,6 Гц, 1H), 7,90 (д, J = 7,9 Гц, 1H), 7,64 (с. 1H), 7,38 - 6,94 (м, 10H), 4,77 (дд, J = 4,3, 5,9 Гц, 1H), 4,03 (дд, J = 5,9 Гц, 14,5 Гц, 1H), 3,85 - 3,45 (м, 5H), 3,01 (д, J = 14,8 Гц, 1H), 2,74 (д, J = 14,8 Гц, 1H), 2,20 (с, 3H), 1,13 (т, J = 6,9 Гц, 3H), 1,09 (т, J = 7,3 Гц, 3H).
Пример 146
(RS)-3-(Этоксикарбонилметил)-1-(2,2-диэтоксиэтил)-3-(N'- (3-метоксифенил)уреидо)индолин-2-он
Указанное в заголовке соединение получали так же, как в примере 107, за исключением того, что в качестве исходного материала вместо (RS)-1-(2,2-диэтоксиэтил)-3-(N'-(4-метилфенил)уреидо)индолин-2-она, использованного в примере 107, использовали (RS)-1-(2,2-диэтоксиэтил)-3-(N'-(3-метоксифенил)уреидо)индолин-2-он.
ЯМР (CDCl3) δ: 7,32 - 6,90 (м, 9H), 6,56 (дд, J = 1,8, 8,2 Гц, 1H), 4,79 - 4,75 (м, 1H), 4,11 (кв, J = 6,3 Гц, 2H), 4,01 (дд, J = 6,0, 14,2 Гц, 1H), 3,82 - 3,65 (м, 5H) 3,73 (с, 3H), 2,93 (д, J = 15,2 Гц, 1H), 2,55 (д, J = 15,2 Гц, 1H), 1,20 - 1,05 (м, 9H).
Пример 147
(RS)-1-(2,2-Диэтоксиэтил)-3-(гидроксикарбонилметил)- 3-(N'-(3-метоксифенил)уреидо)индолин-2-он
Указанное в заголовке соединение получали так же, как в примере 108, за исключением того, что в качестве исходного материала вместо (RS)-3-(этоксикарбонилметил)-1-(2,2-диэтоксиэтил)-3- (N'-(4-метилфенил)уреидо)индолин-2-она, использованного в примере 108, брали (RS)-3-(этоксикарбонилметил)-1-(2,2-диэтоксиэтил)-3-(N' -(3-метоксифенил)-уреидо)индолин-2-он.
ЯМР (CDCl3) δ: 7,85 (с, 1H), 7,29 - 7,20 (м, 3H), 7,06 - 6,92 (м, 5H), 6,69 (д, J = 8,9 Гц, 1H), 6,48 (дд, J = 2,2, 8,3 Гц, 1H), 4,77 - 4,74 (м, 1H), 4,04 (дд, J = 6,1, 14,5 Гц, 1H), 3,79 - 3,49 (м, 5H), 3,61 (с, 3H), 2,90 (д, J = 15,8 Гц, 1H), 2,70 (д, J = 15,8 Гц, 1H), 1,17 - 1,08 (м, 6H).
Пример 148
(RS)-1-(2,2-Диэтоксиэтил)-3-((4-метоксифенил) аминокарбонилметил)-3-(N'-(3-метоксифенил)уреидо)индолин-2-он
К раствору 0,50 г (RS)-1-(2,2-диэтоксиэтил)-3- (гидрокcикарбонилметил)-3-(N'-(3-метоксифенил)уреидо)индолин-2-она в 50 мл дихлорметана добавляли последовательно 0,140 г 4-диметиламинопиридина и 0,090 мл тионилхлорида при 0oC, после чего полученную смесь перемешивали при 0oC в течение 30 минут. К смеси добавляли еще 0,140 г 4-диметиламинопиридина и 0,190 г 4-метоксианилина при 0oC. Полученную смесь перемешивали при комнатной температуре в течение 1 часа и затем промывали водным раствором хлорида натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Неочищенный продукт очищали путем хроматографы на колонке с силикагелем (гексан/этилацетат = 2/1), и в результате получили 0,54 г (88%) указанного в заголовке соединения.
Rf = 0,76 (дихлорметан/метанол = 10/1).
ЯМР (CDCl3) δ: 3,51 (c, 1H), 7,45 - 6,44 (м, 14H), 4,78 (дд, J = 4,4, 5,9 Гц, 1H), 3,98 (дд, J = 5,9, 14,2 Гц, 1H), 3,84 - 3,47 (м, 5H), 3,74 (c, 3H), 3,63 (c, 3H), 2,97 (д, J = 14,8 Гц, 1H), 2,63 (д, J = 14,8 Гц, 1H), 1,15 (т, J = 6,9 Гц, 3H), 1,09 (т, J = 6,9 Гц, 3H).
Примеры 149 - 158
Следующие далее соединения были получены так же, как в примере 148, за исключением того, что вместо 4-метоксианилина, использованного в примере 148, использовали различные амины.
Пример 149
(RS)-3-((4-Хлорфенил)аминокарбонилметил)-1-(2,2-диэтоксиэтил)-3- (N'-(3-метоксифенил)уреидо)индолин-2-он
Rf = 0,76 (дихлорметан/метанол = 10/1).
ЯМР (CDCl3) δ: 8,80 (с, 1H), 7,55 (с, 1H), 7,33 - 6,90 (м, 11H), 6,67 (д, J = 9,2 Гц, 1H), 6,45 (дд, J = 2,0, 8,2 Гц, 1H), 4,76 (дд, J = 4,0, 5,6 Гц, 1H), 3,99 (дд, J = 5,6, 14,2 Гц, 1H), 3,79 - 3,49 (м, 5H), 3,61 (с, 3H), 2,99 (д, J = 14,8 Гц, 1H), 2,71 (д, J = 14,8 Гц, 1H), 1,13 (т, J = 6,9 Гц, 3H), 1,09 (т, J = 6,9 Гц, 3H).
Пример 150
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(3-метоксифенил)-уреидо)-3- ((2-метилфенил)аминокарбонилметил)индолин-2-он
Rf = 0,25 (дихлорметан/метанол = 100/3).
ЯМР (CDCl3) δ: 8,85 (с, 1H), 7,76 (с, 1H), 7,46 -7,43 (м, 1H), 7,25 - 6,95 (м, 10H), 6,69 (д, J = 7,9 Гц, 1H), 6,44 (д, J = 8,3 Гц, 1H), 4,75 (дд, J = 4,3, 5,9 Гц, 1H), 3,97 (дд, J = 5,9, 14,5 Гц, 1H), 3,81- 3,44 (м, 5H), 3,61 (c, 3H), 3,00 (д, J = 14,9 Гц, 1H), 2,75 (д, J = 14,9 Гц, 1H), 2,14 (с, 3H), 1,10 (т, J = 6,6 Гц, 3H), 1,07 (т, J = 6,6 Гц, 3H).
Пример 151
(RS)-1-(2,2-Диэтоксиэтил)-3-((3-метоксифенил) аминокарбонилметил)-3-(N'-(3-метоксифенил)уреидо)индолин-2-он
Rf = 0,06 (дихлорметан/метанол = 100/3).
ЯМР (CDCl3) δ: 8,72 (с, 1H), 7,62 (с, 1H), 7,30 - 6,92 (м, 10H), 6,69 (д, J = 9,2 Гц, 1H), 6,61 (дд, J = 2,3, 8,2 Гц, 1H), 6,43 (дд, J = 2,3, 7,9 Гц, 1H), 4,75 (дд, J = 4,3, 5,9 Гц, 1H), 3,94 (дд, J = 5,9, 14,2 Гц, 1H), 3,80 - 3,43 (м, 5H), 3,67 (c, 3H), 3,59 (с, 3H), 3,00 (д, J = 14,9 Гц, 1H), 2,69 (д, J = 14,9 Гц, 1H), 1,12 (т, J = 6,9 Гц, 3H), 1,07 (т, J = 6,9 Гц, 3H).
Пример 152
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(3-метоксифенил)-уреидо-3- ((3-метилфенил)аминокарбонилметил)индолин-2-он
Rf = 0,25 (Дихлорметан/метанол = 100/3).
ЯМР (CDCl3) δ: 8,66 (с, 1H), 7,57 (с, 1H), 7,28 - 6,87 (м, 11H), 6,68 (д, J = 7,9 Гц, 1H), 6,44 (д, J = 8,2 Гц, 1H), 4,76 (дд, J = 4,3, 5,9 Гц, 1H), 3,96 (дд, J = 5,9, 14,5 Гц, 1H), 3,81 - 3,42 (м, 5H), 3,60 (c, 3H), 3,00 (д, J = 14,9 Гц, 1H), 2,69 (д, J = 14,9 Гц, 1H), 2,22 (с, 3H), 1,13 (т, J = 6,9 Гц, 3H), 1,08 (т, J = 6,9 Гц, 3H).
Пример 153
(RS )-1-(2,2-Диэтоксиэтил)-3-((2-метоксифенил) аминокарбонилметил)-3-(N'-(3-метоксифенил)уреидо)индолин-2-он
Rf = 0,10 (дихлорметан/метанол = 100/3).
ЯМР (CDCl3) δ: 8,20 (д, J = 7,9 Гц, 1H), 7,90 (с, 1H), 7,73 (с, 1H), 7,42 (с, 1H), 7,30 (д, J = 7,3 Гц, 1H), 7,22 (т, J = 8,2 Гц, 1H), 7,09 - 6,71 (м, 8H), 6,44 (д, J = 6,6 Гц, 1H), 4,78 (дд, J = 4,3, 5,9 Гц, 1H), 4,00 (дд, J = 5,9, 14,2 Гц, 1H), 3,83 - 3,49 (м, 5H), 3,70 (с, 3H), 3,60 (с, 3H), 3,17 (д, J = 14,5 Гц, 1H), 2,57 (д, J = 14,5 Гц, 1H), 1,14 (т, J = 6,9 Гц, 3H), 1,10 (т, J = 6,9 Гц, 3H).
Пример 154
(RS)-1-(2,2-Диэтоксиэтил)-3-((4-фторфенил) аминокарбонилметил)-3-(N'-(3-метоксифенил)уреидо)индолин-2-он
Rf = 0,16 (дихлорметан/метанол = 100/3).
ЯМР (CDCl3) δ: 8,70 (с, 1H), 7,65 (с, 1H), 7,31 - 6,84 (м, 11H), 6,68 (д, J = 7,9 Гц, 1H), 6,44 (д, J = 6,6 Гц, 1H), 4,75 (дд, J = 4,3, 5,6 Гц, 1H), 3,96 (дд, J = 5,6, 14,2 Гц, 1H), 3,80 - 3,45 (м, 5H), 3,59 (с, 3H), 3,00 (д, J = 14,9 Гц, 1H), 2,73 (д, J = 14,9 Гц, 1H), 1,11 (т, J = 6,9 Гц, 3H), 1,07 (т, J = 6,9 Гц, 3H).
Пример 155
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(3-метоксифенил)-уреидо-3- (н-пропиламинокарбонилметил)индолин-2-он
Rf = 0,09 (дихлорметан/метанол = 100/3)
ЯМР (CDCl3) δ: 7,84 (с, 1H), 7,44 (с, 1H), 7,31 - 6,96 (м, 6H), 6,76 (д, J = 8,6 Гц, 1H), 6,55 (т, J = 5,6 Гц, 1H), 6,44 (дд, J = 2,3, 8,3 Гц, 1H), 4,79 (дд, J = 4,3, 6,3 Гц, 1H), 3,98 (дд, J = 6,3, 14,2 Гц, 1H), 3,86 - 3,50 (м, 5H), 3,63 (c, 3H), 3,17 - 3,06 (м, 2H), 2,89 (д, J = 14,5 Гц, 1H), 2,50 (д, J = 14,5 Гц, 1H), 1,40 (м, 2H), 1,17 (т, J = 7,3 Гц, 3H), 1,09 (т, J = 6,9 Гц, 3H), 0,81 (т, J = 7,3 Гц, 3H).
Пример 156
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(3-метоксифенил)-уреидо-3-((4- (N,N-диметиламинофенил)аминокарбонилметил)индолин-2-он
Rf, = 0,21 (дихлорметан/метанол = 100/3).
ЯМР (CDCl3) δ: 8,58 (с, 1H), 7,78 (с, 1H), 7,37 (с, 1H), 7,26 - 6,90 (м, 8H), 6,67 (д, J = 7,9 Гц, 1H), 6,54 (д, J = 8,9 Гц, 2H), 6,41 (д, J = 9,9 Гц, 1H), 4,79 - 4,73 (м, 1H), 3,96 (дд, J = 5,9, 14,2 Гц, 1H), 3,84 - 3,45 (м, 5H), 3,58 (с, 3H), 2,97 (д, J = 14,5 Гц, 1H), 2,83 (c, 6H), 2,65 (д, J = 14,5 Гц, 1H), 1,12 (т, J = 6,9 Гц, 3H), 1,07 (т, J = 6,9 Гц, 3H).
Пример 157
(RS)-1-(2,2-Диэтоксиэтил)-3-((4-метоксикарбонилфенил) аминокарбонилметил)-3-(N'-(3-метоксифенил)уреидо)-индолин-2-он
Rf = 0,27 (дихлорметан/метанол = 100/3).
ЯМР (CDCl3) δ: 9,10 (с, 1H), 7,88 (c, 1H), 7,83 (д, J = 8,6 Гц, 2H), 7,46 (д, J = 8,6 Гц, 2H), 7,32 - 7,17 (м, 3H), 7,01 - 6,90 (м, 4H), 6,68 (д, J = 7,9 Гц, 1H), 6,42 (дд, J = 2,3, 8,3 Гц, 1H), 4,75 (дд, J = 4,3, 5,9 Гц, 1H), 3,95 (дд, J = 5,9, 14,2 Гц, 1H), 3,85 (c, 3H), 3,80 - 3,44 (м, 5H), 3,56 (с, 3H), 3,05 (д, J = 15,2 Гц, 1H), 2,74 (д, J = 15,2 Гц, 1H), 1,09 (т, J = 6,9 Гц, 3H), 1,06 (т, J = 6,9 Гц, 3H).
Пример 158
(RS)-1-(2,2-диэтоксиэтил)-3-(N'-(3-метоксифенил)-уреидо)-3- ((5-метилпиридо-2-ил)аминокарбонилметил)индолин-2-он
Rf = 0,24 (дихлорметан/метанол = 100/3).
ЯМР (CDCl3) δ: 9,48 (с, 1H), 7,93 (д, J = 8,3 Гц, 1H), 7,79 (с, 1H), 7,73 (с, 1H), 7,41 - 6,90 (м, 8H), 6,71 (д, J = 7,9 Гц, 1H), 6,46 (д, J = 8,3 Гц, 1H), 4,78 - 4,75 (м, 1H), 3,90 (шир, 2H), 3,72 - 3,45 (м, 4H), 3,62 (с, 3H), 3,10 (д, J = 14,5 Гц, 1H), 2,61 (д, J = 14,5 Гц, 1H), 2,21 (с, 3H), 1,13 (т, J = 7,3 Гц, 3H), 1,07 (т, J = 7,3 Гц, 3H).
Пример 159
(RS)-1-(формилметил)-3-(N'-(3-мексифенил)уреидо)-3- ((4-метилфенил)аминокарбонилметил)индолин-2-он
К раствору 1,61 г (RS)-1-(2,2-диэтоксиэтил)-3-(N'- (3-метоксифенил)уреидо)-3-((4-метилфенил)аминокарбонилметил) индолин-2-она в 40 мл ацетона добавляли 10 мл воды и 1 мл концентрированной хлористоводородной кислоты, и полученную смесь нагревали с обратным холодильником в течение 2 часов. Реакционную смесь вливали в воду, и образовавшийся при этом осадок собирали путем фильтрации и промывали диэтиловым эфиром, получив в результате 1,11 г (79%) указанного в заголовке соединения.
ЯМР (ДМСО-d6) δ: 10,06 (с, 1H), 9,66 (с, 1H), 9,32 (с, 1H), 7,75 (с, 1H), 7,44 (д, J = 8,3 Гц, 2H), 7,28 - 6,82 (м, 8H), 6,82 (д, J = 8,3 Гц, 1H), 6,44 (дд, J = 2,0, 7,8 Гц, 1H), 4,77 (д, J = 18,5 Гц, 1H), 4,60 (д, J = 18,5 Гц, 1H), 3,66 (с, 3H), 2,89 (д, J= 14,6 Гц, 1H), 2,60 (д, J = 14,1 Гц, 1H), 2,26 (с, 3H).
Пример 160
(RS)-3-(N'-(3-Метоксифенил)уреидо)-1-(2-(N, N-диметиламино) этил)-3-((4-метилфенил)аминокарбонилметил)-индолин-2-он
К раствору 0,386 г (RS)-1-(формилметил)-3-(N'-(3- метоксифенил)уреидо)-3-((4-метилфенил)аминокарбонилметил)- индолин-2-она в 50 мл метанола добавляли 0,8 г диметиламиногидрохлорида при комнатной температуре, и затем к полученной смеси добавляли 1,0 г цианборогидрида натрия. Смесь перемешивали при комнатной температуре в течение 1 дня, после чего ее концентрировали. Концентрат разводили дихлорметаном и промывали водным раствором хлорида натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Неочищенный продукт промывали дихлорметаном, и в результате получили 0,107 г (26%) указанного в заголовке соединения.
ЯМР (CDCl3) δ: 10,21 (с, 1H), 9,26 (с, 1H), 7,62 (с, 1H), 7,32 - 6,84 (м, 10H), 6,79 (д, J = 8,3 Гц, 1H), 6,44 (дд, J = 1,9, 7,8 Гц, 1H), 3,94 - 3,59 (м, 2H), 3,65 (с, 3H), 2,82 (д, J = 14,6 Гц, 1H), 2,62 - 2,08 (м, 3H), 2,25 (c, 9H).
Пример 161
(RS)-1-(2,2-Диэтоксиэтил)-3-((4-(N-метиламино)-фенил) аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)-индолин-2-он
К раствору 0,475 г (RS)-1-(2,2-диэтоксиэтил)-3- ((4-трифторметилкарбонил-N-метиламино)фенил)аминокарбонилметил)-3- (N-(4-метилфенил)уреидо)индолин-2-она в 50 мл метанола добавляли 10 мл водного раствора 0,50 г карбоната калия при комнатной температуре, и полученную смесь перемешивали в течение 1 дня, после чего концентрировали. Полученный остаток разводили водой и экстрагировали дихлорметаном. Органический слой осушали над безводным сульфатом натрия и концентрировали. Неочищенный продукт перекристаллизовывали из хлороформа, и получили в результате 0,26 г (65%) указанного в заголовке соединения.
ЯМР (ДМСО-d6) δ:/ 9,67 (с, 1H), 9,16 (с, 1H), 7,68 (с, 1H), 7,27 - 7,06 (м, 7H), 6,98 - 6,89 (м, 3H), 6,47 (д, J = 8,8 Гц, 2H), 5,49 (кв, J = 5,9 Гц, 1H), 4,76 - 4,67 (м, 1H), 3,86 (дд, J = 5,6, 13,8 Гц, 1H), 3,76 - 3,46 (м, 5H), 2,76 (д, J = 14,2 Гц, 1H), 2,64 (д, J = 5,9 Гц, 3H), 2,41 (д, J = 14,2 Гц, 1H), 2,17 (c, 3H), 1,12 (т, J = 6,9 Гц, 3H), 1,07 (т, J = 5,0 Гц, 3H).
Пример 162
(RS)-1-(2,2-Диэтоксиэтил)-3-((5-индолинил)аминокарбонилметил) -3-(N'-(4-метилфенил)уреидо)индолин-2-он
Указанное в заголовке соединение получали так же, как в примере 161, за исключением того, что в качестве исходного материала вместо (RS)-1-(2,2-диэтоксиэтил)-3-((4-(N- трифторметилкарбонил-N-метиламино)фенил)аминокарбонилметил)-3-(N- (4-метилфенил)уреидо)индолин-2-она, использованного в примере 161, брали (RS)-1-(2,2-диэтоксиэтил)-3-(((1-трифторметилкарбонил) индолин-5-ил)аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо) индолин-2-он.
ЯМР (ДМСО-d6) δ: 9,67 (с, 1H), 9,15 (с, 1H), 7,68 (с, 1H), 7,36 - 6,86 (м, 10H), 6,41 (д, J = 8,6 Гц, 1H), 5,35 (с, 1H), 4,77 - 4,67 (м, 1H), 3,85 (дд, J = 5,9, 14,2 Гц, 1H), 3,76 - 3,24 (м, 7H), 2,87 (т, J = 8,3 Гц, 2H), 2,75 (д, J = 14,2 Гц, 1H), 2,42 (д, J = 14,2 Гц, 1H), 2,17 (с, 3H), 1,11 (т, J = 6,9 Гц, 3H), 1,07 (т, J = 6,9 Гц, 3H).
Пример 163
(RS)-1-(2,2-Диэтоксиэтил)-3-((4-гидроксикарбонилфенил) аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)-индолин-2-он
К раствору 0,588 г (RS)-1-(2,2-диэтоксиэтил)-3-((4- метоксикарбонилфенил)аминокарбонилметил)-3-(N'-(4-метилфенил) уреидо)индолин-2-она в 30 мл метанола добавляли 5 мл водного раствора 0,20 г гидроксида калия (85%) при комнатной температуре. Полученную смесь перемешивали в течение 1 дня, после чего концентрировали. Концентрат разводили водой и промывали хлороформом. Водный слой регулировали до pH 2 посредством 2 н. хлористоводородной кислоты и экстрагировали этилацетатом. Органический слой осушали над безводным сульфатом натрия и концентрировали. Полученный неочищенный продукт очищали путем хроматографии на колонке с силикагелем (гексан/этилацетат = 1/1), и в результате получили 0,56 г (98%) указанного в заголовке соединения.
ЯМР (ДМСО-d6) δ: 12,95 - 12,45 (шир., 1H), 10,33 (c, 1H), 9,05 (с, 1H), 7,89 (д, J = 8,4 Гц, 2H), 7,64 (д, J = 8,4 Гц, 2H), 7,48 (с, 1H), 7,30 - 6,83 (м, 8H), 4,76 - 4,66 (м, 1H), 3,86 (дд, J = 5,7, 13,7 Гц, 1H), 3,78- 3,40 (м, 5H), 2,94 (д, J = 14,6 Гц, 1H), 2,58 (д, J = 14,6 Гц, 1H), 2,18 (c, 3H), 1,11 (т, J = 6,8 Гц, 3H), 1,08 (т, J = 6,8 Гц, 3H).
Пример 164
(RS)-1-(2,2-Диэтоксиэтил)-3-((4-гидроксикарбонилметилфенил) аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)-индолин-2-он
Указанное в заголовке соединение получали таким же образом, как в примере 163, за исключением того, что в качестве исходного материала вместо (RS)-1-(2,2-диэтоксиэтил)-3- ((4-метоксикарбонилфенил)аминокарбонилметил)-3- (N'-(4-метилфенил) уреидо)индолин-2-она, использованного в примере 163, использовали (RS)-1-(2,2-диэтоксиэтил)3-((4-метоксикарбонилметилфенил) аминокарбонилметил)-3-(N'- (4-метилфенил)уреидо)индолин-2-он.
ЯМР (CDCl3) δ: 8,73 (с, 1H), 7,55 - 7,37 (шир., 1H), 7,32- 6,77 (м, 14H), 4,85 - 4,74 (м, 1H), 4,08 (дд, J = 5,7, 14,3 Гц, 1H), 3,85 - 3,35 (м, 7H), 2,95 (д, J = 15,2 Гц, 1H), 2,64 (д, J = 15,2 Гц, 1H), 2,17 (с, 3H), 1,15 (т, J = 6,4 Гц, 3H), 1,11 (т, J = 6,8 Гц, 3H).
Пример 165
Указанное в заголовке соединение получали так же, как в примере 163, за исключением того, что в качестве исходного материала вместо (SR)-1-(2,2-диэтоксиэтил)-3-((4-метоксикарбонилфенил) аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)индолин-2-она, использованного в примере 163, использовали (RS)-3-(N'- (4-этоксикарбонилфенил)уреидо)-1-(2,2-диэтоксиэтил)-3-((4- метилфенил)аминокарбонилметил)-индолин-2-он.
Rf = 0,05 (н-гексан/этилацетат = 1/1).
ЯМР (ДМСО-d6) δ: 9,97 (с, 1H), 9,64 (с, 1H), 7,84 (с, 1H), 7,75 (д, J = 8,3 Гц, 2H), 7,44 - 6,89 (м, 11H), 4,75 (дд, J = 4,0, 5,4 Гц, 1H), 3,88 (дд, J = 5,4, 13,2 Гц, 1H), 3,74 - 3,22 (м, 5H), 2,86 (д, J =15,1 Гц, 1H), 2,51 (д, J = 15,1 Гц, 1H), 2,27 (с, 3H), 1,14 (т, J = 7,3 Гц, 3H), 1,10 (т, J = 7,3 Гц, 3H).
Пример 166
(RS)-3-(N'-(4-Аминофенил)уреидо)-1-(2,2-диэтоксиэтил)-3- ((4-метилфенил)аминокарбонилметил)индолин-2-он
Суспензию 0,62 г (RS)-1-(2,2-диэтоксиэтил)-3-((4-метилфенил) аминокарбонилметил)-3-(N'-(4-нитрофенил)уреидо)-индолин-2-она и 20 мг 5% Pd/C в 100 мл этанола перемешивали при комнатной, температуре в течение 12 часов в атмосфере водорода. Реакционную смесь фильтровали через Церит, и фильтрат концентрировали. Полученный остаток очищали путем хроматографии на колонке с силикагелем (гексан/этилацетат = 1/1), и в результате получили 0,33 г (57%) указанного в заголовке соединения.
ЯМР (CDCl3) δ: 8,31 (c, 1H), 7,33 - 6,94 (м, 11H), 6,62 (с, 1H), 6,50 (д, J = 8,3 Гц, 2H), 4,75 (дд, J = 4,4, 5,9 Гц, 1H), 4,00 (дд, J = 5,9, 14,1 Гц, 1H), 3,79 - 3,52 (м, 7H), 2,92 (д, J = 14,6 Гц, 1H), 2,51 (д, J = 14,6 Гц, 1H), 2,30 (c, 3H), 1,16 (т, J = 7,3 Гц, 3H), 1,10 (т, J = 7,3 Гц, 3H).
Пример 167
(RS)-1-(2,2-Диэтоксиэтил)-3-(N'-(4-диметиламинофенил)уреидо)-3- ((4-метилфенил)аминокарбонилметил)индолин-2-он
К раствору 0,148 г (RS)-3-(N'-(4-аминофенил)уреидо)- 1-(2,2-диэтоксиэтил)-3-((4-метилфенил)аминокарбонилметил)- индолин-2-она в 20 мл метанола добавляли последовательно 0,1 мл водного раствора формалина и 0,104 г цианборогидрида натрия. Полученную смесь нейтрализовали 2 н. хлористоводородной кислотой, и добавляли к смеси Молекулярные сита 4А, после чего смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь фильтровали через Церит, и фильтрат концентрировали. Концентрат разводили этилацетатом и промывали насыщенным водным раствором гидрокарбоната натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Полученный неочищенный продукт очищали путем хроматографии на колонке с силикагелем (гексан/этилацетат = 1/1), и в результате получили 0,120 г (77%) указанного в заголовке соединения.
Rf = 0,11 (гексан/этилацетат = 1/1).
ЯМР (CDCl3) δ: 8,32 (c, 1H), 7,35 - 6,54 (м, 13H), 6,41 (с, 1H), 4,76 (дд, J = 3,9, 6,3 Гц, 1H), 3,99 (дд, J = 6,3, 13,7 Гц, 1H), 3,81 - 3,53 (м, 5H), 2,91 (д, J = 15,1 Гц, 1H),2,89 (c, 6H), 2,51 (д, J = 15,1 Гц, 1H), 2,31 (с, 3H), 1,16 (т, J= 6,3 Гц, 3H), 1,11 (т, J = 6,3 Гц, 3H).
Примеры 168 - 170
Следующие далее соединения были получены так же, как в примере 71, за исключением того, что использовали (RS)-1-(2,2-диэтоксиэтил)-3-(N'-(4-метилфенил)уреидо)индолин- 2-он, использованный в примере 71, но с фрагментом (4-метилфенил) уреидо, замененным на различные замещенные уреиды, в качестве исходного материала, а N-пара-толил-2-брома-цетамид, использованный в примере 71 в качестве реагента, заменяли на различные производные бромацетамида.
Пример 168
(RS)-3-((4-Хлорфенил)аминокарбонилметил)-3-(N'-(4- хлорфенил)уреидо)-1-(2,2-диэтоксиэтил)индолин-2-он
Rf = 0,29 (н-гексан/этилацетат = 1/1).
ЯМР (CDCl3) δ: 8,51 (с, 1H), 7,44 - 7,00 (м, 14H), 4,78 (дд, J = 4,9, 5,4 Гц, 1H), 4,04 (дд, J = 5,4, 14,2 Гц, 1H), 3,83 - 3,48 (м, 5H), 2,99 (д, J = 14,6 Гц, 1H), 2,68 (д, J = 14,6 Гц, 1H), 2,00 - 1,08 (м, 6H).
Пример 169
(RS)-3-((4-Хлорфенил)аминокарбонилметил)-1-(2,2-диэтоксиэтил)-3- (N'-(4-метоксифенил)уреидо)индолин-2-он
ЯМР (ДМСО-d6) δ: 10,14 (с, 1H), 8,98 (с, 1H), 7,57 - 6,70 (м, 13H), 4,72 (дд, J = 4,3, 5,9 Гц, 1H), 3,84 (дд, J = 5,9, 14,4 Гц, 1H), 3,71 - 3,50 (м, 5H), 3,66 (с, 3H), 2,88 (д, J = 14,8 Гц, 1H), 2,52 (д, J = 14,8 Гц, 1H), 1,11 (т, J = 7,8 Гц, 3H), 1,08 (т, J = 7,3 Гц, 3H).
Пример 170
(RS)-1-(2,2-Диэтоксиэтил)-3-((4-фторфенил)аминокарбонилметил) -3-(N'-(4-фторфенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 8,40 (с, 1H), 7,42 - 6,78 (м, 14H), 4,78 (дд, J = 4,3, 5,9 Гц, 1H), 4,02 (дд, J = 5,9, 14,5 Гц, 1H), 3,81 - 3,52 (м, 5H), 2,98 (д, J = 14,5 Гц, 1H), 2,63 (д, J = 14,5 Гц, 1H), 1,17 (т, J = 6,9 Гц, 3H), 1,12 (т, J = 6,9 Гц, 3H).
Ссылочный пример 26
L-Ментилбромацетат и D-ментилбромацетат
К раствору 83,4 г бромуксусной кислоты и 78,1 г L- (или D-) ментола в 1 л толуола добавляли 300 мг пара-толуолсульфокислоты, и полученную смесь нагревали с обратным холодильником в течение 6 часов с азеотропным удалением при этом полученной воды вместе с толуолом. Реакционную смесь промывали насыщенным водным раствором гидрокарбоната натрия, и органический слой осушали над безводным сульфатом натрия и концентрировали. Остаток перегоняли под пониженным давлением, и в результате получили 128 г (93%) указанного в заголовке соединения.
ЯМР (CDCl3) δ: 4,73 (дт, J = 5, 10 Гц, 1H), 3,79 (с, 2H), 2,20 - 0,80 (м, 9H), 0,89 (д, J = 7 Гц, 6H), 0,79 (д, J = 7 Гц, 3H).
Пример 171
3-(RS)-1-(2,2-Диэтоксиэтил)-3-(L-ментокси)карбонилметил-3- (N'- -(4-метилфенил)уреидо)индолин-2-он и одиночный диастереомер 1-(2,2-диэтоксиэтил)-3-(L-ментокси)карбонилметил-3-(N'- (4-метилфенил)уреидо)индолин-2-она (вторая фракция ВЭЖХ)
3-(RS)-1-(2,2-Диэтоксиэтил)-3-(L-ментокси)карбонилметил-3- (N'- (4-метилфенил)уреидо)индолин-2-он получали так же, как в примере 71, за исключением того, что в качестве реагента вместо N-пара-толил-2-бромацетамида, использованного в примере 71, использовали L-ментилбромацетат. Полученный продукт анализировали с помощью высокоэффективной жидкостной хроматографии.
Условия ВЭЖХ:
Колонка: УМС-Раск CN A-514 (6 мм (диаметр) х 30 см)
Проявляющий растворитель: гексан/изопропиловый спирт = 100/1
Расход: 1,0 мл/мин
Детектирование: УФ 254 нм
Первая фракция: 53 части (время удерживания = 38 мин)
Вторая фракция: 47 частей (время удерживания = 42 мин).
Диастереомерную смесь перекристаллизовывали дважды из диизопропилового эфира, и в результате получили одиночный диастереомер 1-(2,2-диэтоксиэтил)-3-(L-ментокси)карбонилметил-3-(N'- (4-метилфенил)уреидо)индолин-2-она в виде игольчатых кристаллов.
ЯМР (CDCl3) δ: 7,33 - 7,18 (м, 3H), 7,18- 6,91 (м, 5H), 6,87 (с, 2H), 4,76 (дд, J = 4,4, 5,5 Гц, 1H), 4,69 (дт, J = 3,8, 10,8 Гц, 1H), 3,97 (дд, J = 5,5, 13,1 Гц, 1H), 3,88 - 3,45 (м, 5H), 2,96 (д, J = 13,2 Гц, 1H), 2,51 (д, J = 13,2 Гц, 1H), 2,26 (с, 3H), 1,88 - 0,99 (м, 9H), 1,16 (т, J = 7,0 Гц, 3H), 1,12 (т, J = 7,4 Гц, 3H), 0,88 (д, J = 6,2 Гц, 3H), 0,78 (д, J = 7,4 Гц, 3H), 0,70 (д, J = 6,8 Гц, 3H).
Полученный продукт анализировали с помощью высокоэффективной жидкостной хроматографии.
Условия ВЭЖХ:
Колонка: УМС-Раск CN A-514 (6,0 мм (диаметр) х 30 см)
Проявляющий растворитель: гексан/изопропиловый спирт = 100/1
Расход: 1,0 мл /мин
Детектирование: УФ 254 нм
Фракция: время удерживания = 42 мин
Пример 172
Одиночный диастереомер 1-(2,2-диэтоксиэтил)-3-(L- ментокси)карбонилметил-3-(N'-(4-метилфенил)уреидо)индолин-2-она (первая фракция ВЭЖХ)
К раствору 10,4 г (RS)-1-(2,2-диэтоксиэтил)-3-(N'-(4-метилфенил) уреидо)индолин-2-она в 500 мл сухого тетра-гидрофурана медленно добавляли 52,5 мл 0,5М раствора трет-бутоксида лития (полученного из н-бутиллития и трет-бутанола) в сухом тетрагидрофуране при комнатной температуре в атмосфере азота, и полученную смесь перемешивали при этой температуре в течение 30 минут. К смеси добавляли по каплям раствор 8,10 г L-ментилбромацетата в 30 мл сухого тетра-гидрофурана при 0oC, после чего полученную смесь перемешивали при 0oC в течение 8 часов. Реакционную смесь вливали в водный раствор хлорида натрия и экстрагировали этилацетатом. Органический слой осушали над безводным сульфатом натрия и концентрировали. Остаток очищали путем колоночной хроматографии на силикагеле (гексан/этилацетат = 3/1) и затем перекристаллизовывали из метаноловой воды, получив в результате 7,55 г (48%) указанного в заголовке соединения.
Условия ВЭЖХ:
Колонка: УМС-Раск CN A-514 (6,0 мм (диаметр) х 30 см)
Проявитель: гексан/изопропиловый спирт = 100/1
Расход: 1,0 мл/мин
Детектирование: УФ 254 нм
Фракция: время удерживания = 33 мин
Rf = 0,44 (гексан/этилацетат = 2/1).
ЯМР (CDCl3) δ: 7,41 - 6,91 (м, 8H), 6,88 (с, 1H), 6,73 (с, 1H), 4,75 (М, J = 4,6, 5,7 Гц, 1H), 4,64 (дт, J = 4,1, 11,1 Гц, 1H), 3,95 (дд, J = 5,7, 14,6 Гц, 1H), 3,89 -3,45 (м, 5H), 3,03 (д, J = 15,1 Гц, 1H), 2,61 (д, J = 15,1 Гц, 1H), 2,26 (с, 3H), 1,98 - 1,80 (шир., 1H), 1,80 - 1,55 (шир., 3H), 1,55 - 1,30 (шир., 1H), 1,30 - 0,75 (шир., 4H), 1,17 (т, J = 6,8 Гц, 3H), 1,11 (т, J = 7,0 Гц, 3H), 0,88 (д, J = 6,5 Гц, 3H), 0,83 (д, J = 7,0 Гц, 3H), 0,64 (д, J = 6,8 Гц, 3H).
Пример 173
Одиночный диастереомер 1-(2,2-диэтоксиэтил)-3-(D-ментокси) карбонилметил-3-(N'-(4-метилфенил)уреидо)индолин-2-он (первая фракция ВЭЖХ)
Указанное в заголовке соединение получали так же, как в примере 172, за исключением того, что использованный в примере 172 L-ментилбромацетат заменяли D-ментилбромацетатом.
Условия BЭЖХ:
Колонка: УМС-Раск CN A-514 (6,0 мм (диаметр) х 30 см)
Проявляющий растворитель: гексан/изопропиловый спирт = 100/1
Расход: 1,0 мл/мин
Детектирование: УФ 254 нм
Время удерживания: 38 минут
Rf = 0,44 (гексан/этилацетат = 2/1).
ЯМР (CDCl3) δ: 7,41 - 6,91 (м, 8H), 6,88 (с, 1H), 6,73 (с, 1H), 4,75 (дд, J = 4,6, 5,7 Гц, 1H), 4,64 (дт, J = 4,1, 11,1 Гц, 1H), 3,95 (дд, J= 5,7, 14,6 Гц, 1H), 3,89 - 3,45 (м, 5H), 3,03 (д, J = 15,1 Гц, 1H), 2,61 (д, J = 15,1 Гц, 1H), 2,26 (с, 3H), 1,98 - 1,80 (шир., 1H), 1,80 - 1,55 (шир., 3H), 1,55 - 1,30 (шир., 1H), 1,30 - 0,75 (шир., 4H), 1,17 (т, J = 6,8 Гц, 3H), 1,11 (т, J = 7,0 Гц, 3H), 0,88 (д, J = 6,5 Гц, 3H), 0,83 (д, J = 7,0 Гц, 3H), 0,64 (д, J= 6,8 Гц, 3H).
Пример 174
(+)-1-(2,2-Диэтоксиэтил)-3-(4-метилфенил)аминокарбонилметил-3- (N'-(4-метилфенил)уреидо)индолин-2-он
(1) (+)-1-(2,2-Диэтоксиэтил)-3-гидроксикарбонилметил-3-(L- (4-метилфенил)уреидо)индолин-2-он
К раствору 5,30 г (3-(+)-1-(2,2-диэтоксиэтил)-3-(L- ментокси)карбонилметил-3-(N'-(4-метилфенил)уреидо)индолин-2-она в 150 мл метанола добавляли 30 мл водного раствора 1,00 г гидроксида калия (85%) при комнатной температуре. Полученную смесь нагревали с обратным холодильником в течение 3 часов и концентрировали. К остатку добавляли воду, и смесь промывали хлороформом, водный слой регулировали до pH 2 посредством 2 н. хлористоводородной кислоты и экстрагировали этилацетатом. Органический слой промывали водным раствором хлорида натрия, осушали над безводным сульфатом натрия и концентрировали, получив в результате 2,8 г указанного в заголовке соединения.
ЯМР (CDCl3) δ: 7,74 (с, 1H), 7,35 - 6,70 (м, 10H), 4,73 (дд, J = 4,4, 5,9 Гц, 1H), 4,01 (дд, J = 5,9, 14,6 Гц, 1H), 3,86 - 3,38 (м, 5H), 2,90 (д, J = 15,9 Гц, 1H), 2,65 (д, J = 15,9 Гц, 1H), 2,18 (с, 3H), 1,13 (т, J = 6,8 Гц, 3H), 1,08 (т, J = 6,8 Гц, 3H)
(2) (+)-1-(2,2-Диэтоксиэтил)-3-(4-метилфенил)аминокарбонилметил -3-(N'-(4-метилфенил)уреидо)индолин-2-он
В 100 мл дихлорметана растворяли 2,8 г (+)-1-(2,2-диэтоксиэтил) -3-гидроксикарбонилметил-3-(N'-(4-метилфенил)-уреидо)индолин-2-она и 1,20 г 4-диметиламинопиридина, и к полученному раствору последовательно добавляли 1,90 г 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорида и 1,10 г пара-толуидина. Полученную смесь перемешивали 18 часов и концентрировали, концентрат развозили этилацетатом, промывали последовательно разбавленной хлористоводородной кислотой и насыщенным водным раствором гидрокарбоната натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Неочищенный продукт очищали путем хроматографии на колонке с силикагелем (гексан/этилацетат = 2/1), и в результате получили 3,90 г (81%) указанного в заголовке соединения в виде белого порошка. Полученное соединение было оптически чистым, как было установлено путем анализа высокоэффективной жидкостной хроматографией с использованием оптически активной колонки (CHIRALCEL OD производства ф. "Daicel Chemical Industries, Ltd."
Rf = 0,21 (гексан/этилацетат = 2/1).
ЯМР (CDCl3) δ: 8,33 (с, 1H), 7,33 - 6,91 (м, 14H), 4,77 (дд, J = 4,4, 5,6 Гц, 1H), 4,03 (дд, J = 5,6 14,1 Гц, 1H), 3,82 - 3,48 (м, 5H), 2,97 (д, J= 14,6 Гц, IH), 2,57 (д, J = 14,6 Гц, 1H), 2,30 (с, 3H), 2,22 (с, 3H), 1,16 (т, J = 6,8 Гц, 3H), 1,11 (т, J = 6,8 Гц, 1H).
[α]
Пример 175
(-)-1-(2,2-Диэтоксиэтил)-3-(4-метилфенил)аминокарбонил- метил-3-(N'-(4-метилфенил)уреидо)индолин-2-он
К раствору 1,26 г одиночного диастереомера 1-(2,2-диэтоксиэтил) -3-(L-ментокси)карбонилметил-3-(N'-(4-метилфенил)уреидо)индолин-2-она (первая фракция ВЭЖХ) в 20 мл этанола добавляли 10 мл водного раствора 0,07 г гидроксида калия (85%) при комнатной температуре, и полученную смесь перемешивали при 70oC в течение 1 часа, после чего ее концентрировали. К остатку добавляли воду, и полученную смесь промывали хлороформом. Водный слой регулировали до pH 2 добавлением 2 н. хлористоводородной кислоты и экстрагировали этилацетатом. Органический слой осушали над безводным сульфатом натрия и концентрировали, получив в результате 0,88 г (-)-1-(2,2-диэтоксиэтил)-3-гидроксикарбонилметил-3-(N'-(4-метилфенил) уреидо)индолин-2-она. Полученный продукт растворяли в 50 мл дихлорметана, и к полученному раствору последовательно добавляли 0,52 г 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорида и 0,29 г пара-толуидина. Полученную смесь перемешивали 18 часов, разводили этилацетатом и промывали последовательно разбавленной хлористоводородной кислотой и насыщенным водным раствором гидрокарбоната натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Полученный неочищенный продукт очищали путем хроматографирования на колонке с силикагелем (гексан/этилацетат = 2/1), что дало в результате 0,90 г (90%) указанного в заголовке соединения в виде белого порошка. Полученное соединение было оптически чистым, как показал анализ путем высокоэффективной жидкостной хроматографии с использованием оптически активной колонки (CHIRALCEL OD производства ф. "Daicel Chemical Industries, Ltg".
Результаты измерений Rf и ЯМР были одинаковыми с результатами для соединения примера 174.
[α]
Примеры 176 - 181
Следующие ниже соединения были получены так же, как в примере 174, за исключением того, что пара-толуидин, использованный в примере 174 в качестве реагента, заменяли различными аминами или спиртами.
Пример 176
(+)-1-(2,2-Диэтоксиэтил)-3-(4-иодфенил)аминокарбонилметил-3-(N'- (4-метилфенил)уреидо)индолин-2-он
ЯМР (CDCl3) δ: 8,60 (с, 1H), 7,55 (д, J = 8,8 Гц, 2H), 7,32 - 6,94 (м, 11H), 6,84 (с, 1H), 4,77 (дд, J = 4,4, 6,3 Гц, 1H), 4,00 (дд, J = 6,3, 10,4 Гц, 1H), 3,82 - 3,46 (м, 5H), 2,96 (д, J = 14,8 Гц, 1H), 2,65 (д, J = 14,8 Гц, 1H), 2,23 (с, 3H), 1,20 - 1,07 (м, 6H).
Пример 177
(+)-1-(2,2-Диэтоксиэтил)-3-(2-бромэтокси)карбонилметил-3-(N'- (4-метилфенил)уреидо)индолин-2-он
Rf = 0,14 (н-гексан/этилацетат = 2/1).
ЯМР (CDCl3) δ: 7,31 - 7,22 (м, 2H), 7,16 - 6,98 (м. 6H), 6,61 (с, 1H), 6,52 (с, 1H), 4,73 (дд, J = 4,9, 5,9 Гц, 1H), 4,38 (т, J = 6,3 Гц, 2H), 3,97 (дд, J = 5,9, 8,3 Гц, 1H), 3,84 - 3,51 (м, 5H), 3,42 (т, J = 6,3 Гц, 2H), 2,28 (c, 3H), 1,17 (т, J = 7,3 Гц, 3H), 1,13 (т, J = 7,8 Гц, 3H),
NC (m/e): 563, 561 (M+), 517, 515, 438, 158, 103
Пример 178
(+)-1-(2,2-Диэтоксиэтил)-3-(2-иодэтокои)карбонилметил-3-(N'- (4-метилфенил)уреидо)индолин-2-он
Rf = 0,14 (н-гексан/этилацетат = 2/1).
ЯМР (CDCl3) δ: 7,31 - 6,98 (м, 8H), 6,50 (с, 2H), 4,75 (дд, J = 4,9, 5,8 Гц, 1H), 4,34 (дт, J = 1,5, 6,9 Гц, 2H), 3,96 (дд, J = 5,8, 14,2 Гц, 1H), 3,85 - 3,52 (м, 5H), 3,19 (т, J = 6,9 Гц, 2H), 2,93 (д, J = 15,1 Гц, 1H), 2,64 (д, J = 15,1 Гц, 1H), 2,29 (с, 3H), 1,17 (т, J = 7,3 Гц, 3H), 1,13 (т, J = 7,3 Гц, 3H),
MC (m/e): 609 (M+), 563, 535, 414, 103.
[α]
Пример 179
(+)-1-(2,2-Диэтоксиэтил)-3-(N'-(4-метилфенил)уреидо)- 3-(5-метилпиридо-2-ил)аминокарбонилметил)индолин-2-он
Данные по ЯМР были одинаковыми с данными для соединения примера 138.
[α]
Пример 180
(+)-1-(2,2-Диэтоксиэтил)-3-((4(N, N-диметиламино)-фенил) аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)индолин-2-он
Данные по ЯМР были одинаковыми с данными для соединения примера 130.
[α]
Пример 181
(+)-1-(2,2-Диэтоксиэтил)-3-((2-метоксипиридо-5-ил)- аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)индолин-2-он
Данные по ЯМР были одинаковыми с данными для соединения примера 143.
[α]
Примеры 182 - 184
Следующие ниже соединения были получены так же, как в примере 175, за исключением того, что в качестве реагента вместо пара-толуидина, использованного в примере 175, использовали различные амины.
Пример 182
(-)-1-(2,2-Диэтоксиэтил)-3-(N'-(4-метилфенил)уреидо)- 3-((5-метилпиридо-2-ил)аминокарбонилметил)индолин-2-он
Данные по ЯМР были одинаковыми с данными для соединения примера 138.
[α]
Пример 183
(-)-1-(2,2-Диэтокоиэтил)-3-((4-(N,N -диметиламино)-фенил) аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)индолин-2-он
Данные по ЯМР были одинаковыми с данными для соединения примера 130.
[α]
Пример 184
(-)-1-(2,2-Диэтоксиэтил)-3-((2-метоксипиридо-5-ил)- аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)индолин-2-он
Данные по ЯМР были одинаковыми с данными для соединения примера 143.
[α]
Пример 195
(3RS)-1-(2,2-Диэтоксиэтил)-3-(L-ментокси)карбонилметил-3-(N'- (3-метоксифенил)уреидо)индолин-2-он
К раствору 0,207 г (RS)-1-(2,2-диэтоксиэтил)-3-(N'- (3-метоксифенил)уреидо)индолин-2-она в 4 мл сухого диметилсульфоксида добавляли 0,5 мл 1М раствора трет-бутоксида калия в сухом диметилсульфоксиде при комнатной температуре в атмосфере азота. После перемешивания смеси в течение 30 минут к ней добавляли по каплям раствор 0,166 г L-ментилбромацетата в 2 мл сухого диметилсульфоксида, после чего смесь перемешивали при указанной температуре в течение 30 минут. Реакционную смесь вливали в водный раствор хлорида натрия и экстрагировали диэтиловым эфиром. Слой диэтилового эфира осушали над безводным сульфатом магния и концентрировали. Остаток очищали путем колоночной хроматографии на силикагеле (гексан/этилацетат = 3/1), и в результате получили 0,170 г (56%) указанного в заголовке соединения. Как было установлено в результате анализа путем высокоэффективной жидкостной хроматографии, продукт состоял из обоих диастереомеров в отношении приблизительно 1: 1.
Условия ВЭЖХ:
Колонка: УМС-Раск CN A-514 (6,00 мм (диаметр) = 30 см)
Проявитель: гексан/изопропиловый спирт = 100/1
Расход: 1,0 мл/мин
Детектирование: УФ 254 нм
Фракции: 56 частей (время удерживания = 47 мин) 44 части (время удерживания = 52 мин)
Rf = 0,36 (гексан/этилацетат = 2/1).
ЯМР (CDCl3) δ: 7,30 - 7,20 (м, 2H), 7,16 - 6,92 (м, 5H), 6,79 - 8,75 (м, 2H), 6,57 - 6,52 (м, 1H), 4,80 - 4,75 (м, 1H), 4,72 - 4,62 (м, 1H), 3,99 - 3,51 (м, 6H), 3,71 (c, 3H), 3,01 (д, J = 14,8 Гц, 0,5H), 2,96 (д, J = 15,2 Гц, 0,5H), 2,62 (д, J = 15,2 Гц, 0,5H), 2,54 (д, J = 14,8 Гц, 0,5H), 1,83 - 1,71 (шир. , 1H), 1,65 - 1,59 (м, 4H), 1,42 - 0,57 (м, 3H), 1,21 - 1,09 (м, 6H), 0,89 (д, J = 6,9 Гц, 1,5H), 0,88 (д, J = 6,9 Гц, 1,5H), 0,82 (д, J = 6,9 Гц, 1,5H), 0,77 (д, J = 6,9 Гц, 1,5H), 0,70 (д, J = 6,9 Гц, 1,5H), 0,64 (д, J = 6,9 Гц, 1,5H).
Пример 186
Одиночный диастереомер 1-(2,2-диэтоксиэтил)-3-(L-ментокси) карбонилметил-3-(N'-(3-метоксифенил)уреидо)индолин-2-он (первая фракция ВЭЖХ)
Повторяли ту же самую процедуру, что и в примере 172, за исключением того, что в качестве исходного материала использовали (RS)-1-(2,2-диэтоксиэтил)-3-(N'-(3-метоксифенил)уреидо)индолин-2-он. Неочищенный продукт перекристаллизовывали из диизопропилового эфира, и в результате получили указанное в заголовке соединение в виде игольчатых кристаллов с выходом 32%. В результате анализа путем высокоэффективной жидкостной хроматографии было подтверждено, что продукт состоит из одиночного диастереомера.
Условия ВЭЖХ:
Колонка: УМС-Раск CN A-514 (6,0 мм (диаметр) х 30 см)
Проявитель: гексан/изопропиловый спирт = 100/1
Расход: 1,0 мл/мин
Детектирование: УФ 254 нм
Время удерживания: 47 мин
Rf = 0,36 (гексан/этилацетат = 2/1).
ЯМР (CDCl3) δ: 7,29 - 7,24 (м, 2H), 7,15 - 7,09 (м, 2H), 6,70 (т, J = 7,6 Гц, 1H), 6,95 - 6,91 (м, 2H), 6,79 - 6,73 (м, 2H), 6,53 (дд, J = 2,0, 7,2 Гц, 1H), 4,77 (дд, J = 5,3, 5,9 Гц, 1H), 4,75 - 4,61 (м, 1H), 3,93 (дд, J = 5,9, 15,9 Гц, 1H), 3,85 (дд, J = 5,3, 15,9 Гц, 1H), 3,73 -3,54 (м, 4H), 3,70 (c, 3H), 1,91 (шир., 1H), 1,87 (шир., 1H), 1,67 (м, 4H), 1,36 -0,71 (м, 3H), 1,19 (т, J = 6,9, Гц, 3H), 1,11 (т, J = 6,9 Гц, 3H), 0,88 (д, J = 6,9 Гц, 3H), 0,83 (д, J = 7,3 Гц, 1H), 0,66 (д, J = 7,0 Гц, 3H).
Пример 187
Одиночный диастереомер 1-(2,2-диэтоксиэтил)-3-(D-ментокси) карбонилметил-3-(N'-(3-метоксифенил)уреидо)индолин-2-он (первая фракция ВЭЖХ)
Повторяли ту же самую процедуру, что и в примере 172, за исключением того, что в качестве исходного материала использовали (RS)-1-(2,2-диэтоксиэтил)-3-(N'-(3-метоксифенил)уреидо)индолин-2-он, а используемый в качестве реагента L -ментилбромацетат заменяли D-ментилбромацетатом. Перекристаллизация неочищенного продукта из диизопропилового эфира дала указанное в заголовке соединение в виде игольчатых кристаллов с выходом 32%. Анализ путем высокоэффективной жидкостной хроматографии подтвердил, что соединение состоят из одиночного диастереомера. Поскольку соединение является энантиомером соединения примера 186, то данные по ВЭЖХ и ЯМР одинаковы с данными этого последнего соединения.
Пример 183
(+)-1-(2,2-диэтоксиэтил)-3-(4-метилфенил)аминокарбонилметил-3-( N'-(3-метоксифенил)уреидо)индолин-2-он
К раствору 2,57 г одиночного диастереомера 1-(2,2-диэтоксиэтил)-3-(L-ментокси)карбонилметил-3-(N'- (3-метоксифенил)уреидо)индолин-2-она (первая фракция ВЭЖХ) в 150 мл этанола добавляли 50 мл водного раствора 0,60 г гидроксида калия (85%) при комнатной температуре. Полученную смесь нагревали с обратным холодильником в течение 1 часа, после чего концентрировали. К остатку добавляли воду, и полученную смесь промывали хлороформом, водный слой регулировали до pH 2 посредством 2 н. хлористоводородной кислоты и экстрагировали этилацетатом. Органический слой осушали над безводным сульфатом натрия и концентрировали, получив в результате 1,90 г (+)-1-(2,2-диэтоксиэтил)-3-гидроксикарбонилметил-3- (N'-(3-метоксифенил)уреидо)индолин-2-она.
В 30 мл дихлорметана растворяли 0,5 г (+)-1-(2,2- диэтоксиэтил)-3-гидроксикарбонилметил-3-(N'-(3-метоксифенил)уреидо) индолин-2-она, и к полученному раствору последовательно добавляли 0,22 г 1-этил-3-(3-диметиламинопропил)-карбодиимидгидрохлорида и 0,20 г пара-толуидина. После перемешивания реакционной смеси в течение 9 часов ее разбавляли этилацетатом и промывали последовательно разбавленной хлористоводородной кислотой и насыщенным водным раствором гидрокарбоната натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Неочищенный продукт очищали путем хроматографии на колонке с силикагелем (гексан/этилацетат = 2/1), получив в результате 0,49 г указанного в заголовке соединения в виде белого порошка.
Rf = 0,21 (гексан/этилацетат = 2/1).
ЯРМ (CDCl3) δ: 8,15 (c, 1H), 7,35 - 7,23 (м, 6H), 7,13 - 6,91 (м, 6H), 6,73 (д, J = 7,3 Гц, 1H), 6,50 (дд, J = 2,4, 7,8 Гц, 1H), 4,79 (дд, J = 4,4, 5,9 Гц, 1H), 3,98 (дд, J = 5,9, 14,1 Гц, 1H), 3,86 - 3,52 (м, 5H), 3,67 (c, 3H), 2,98 (д, J = 14,6 Гц, 1H), 2,54 (д, J = 14,6 Гц, 1H), 2,30 (c, 3H), 1,18 (т, J = 6,8 Гц, 3H), 1,10 (т, J = 6,8 Гц, 3H).
[α]
Пример 189
(-)-1-(2,2-Диэтоксиэтил)-3-(4-метилфенил)аминокарбонилметил-3- (N'-(3-метоксифенил)уреидо)индолин-2-он
К раствору 1,89 г одиночного диастереомера 1-(2,2-диэтоксиэтил) -3-(D-ментокси)карбонилметил-3-(N'-(3-метоксифенил)уреидо)индолин -2-она (первая фракция ВЭЖХ) в 100 мл этанола добавляли 30 мл водного раствора 0,46 г гидроксида калия (85%) при комнатной температуре, и полученную смесь перемешивали при 80oC в течение 2 часов, после чего ее концентрировали. К концентрату добавляли воду, и полученную смесь промывали хлороформом. Водный слой регулировали до pH 2 добавлением 2 н. хлористоводородной кислоты и экстрагировали этилацетатом. Органический слой осушали над безводным сульфатом натрия и концентрировали, получив в результате 1,76 г (-)-1-(2,2-диэтоксиэтил)-3-гидроксикарбонилметил-3-(N'- (3-метоксифенил)уреидо)индолин-2-она.
В 30 мл дихлорметана растворяли 0,50 г (-)-1-(2,2-диэтоксиэтил) -3-гидроксикарбонилметил-3-(N'-(3-метоксифенил)уреидо)индолин-2-она, и к полученному раствору последовательно добавляли 0,22 г 1-этил-3-(3-диметиламинопропил)-карбодиимидгидрохлорида и 0,20 г пара-толуидина. После перемешивания в течение 9 часов реакционную смесь разбавляли этилацетатом и промывали последовательно разбавленной хлористоводородной кислотой и насыщенным водным раствором гидрокарбоната натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Неочищенный продукт очищали путем колоночной хроматографии на силикагеле (гексан/этилацетат = 2/1), и получили в результате 0,46 г указанного в заголовке соединения в виде белого порошка. Поскольку соединение является энантиомером соединения, полученного в примере 188, то данные по ЯМР одинаковы с данными для этого последнего соединения.
[α]
Примеры 190 - 191
Следующие ниже соединения были получены так же, как в примере 188, за исключением того, что в качестве реагента вместо пара-толуидина, использованного в примере 188, использовали различные амины.
Пример 190
(+)-1-(2.2-Диэтоксиэтил)-3-(N'-(3-метоксифенил)уреидо)-3- ((5-метилпиридо-2-ил)аминокарбонилметил)индолин-2-он
Данные по Rf и ЯМР были одинаковыми с данными для соединения примера 158.
[α]
Пример 191
(+)-1-(2,2-Диэтоксиэтил)-3-(N'-(3-метоксифенил)уреидо-3- ((4-(N,N-диметиламинофенил)аминокаобонилметил)-индолин-2-он
Данные по Rf и ЯМР были одинаковыми с данными для соединения примера 156.
[α]
Примеры 192 - 193
Следующие далее соединения были получены так же, как в примере 189, за исключением того, что вместо пара-толуидина, использованного в примере 189, в качестве реагента использовали различные амины.
Пример 192
(-)-1-(2,2-Диэтоксиэтил)-3-(N'-(3-метоксифенил)уреидо-3- ((5-метилпиридо-2-ил)аминокарбонилметил)индолин-2-он
Данные по Rf и ЯМР были одинаковыми с данными для соединения, полученного в примере 158.
[α]
Пример 193
(-)-1-(2,2-Диэтоксиэтил)-3-(N'-(3-метокоифенил)уреидо)-3-((4- N,N-диметиламино)фенил)аминокарбонилметил)-индолин-2-он
Данные по Rf и ЯМР были одинаковыми с данными для соединения, полученного в примере 156.
[α]
Пример 194
(+)-1-(2,2-Диэтоксиэтил)-3-((4-(N, N-диметиламино)-фенил) аминокарбонилметил)-3-(N'-(4-метилфенил)уреидо)-индолин-2-он гидросульфат калия
Соединение, полученное в примере 180, смешивали с 1 эквивалентом гидросульфата калия, и полученную смесь перекристаллизовывали из метанола, получив в результате указанное в заголовке соединение в виде игольчатых кристаллов.
Температура плавления: 180oC (разложение).
ЯМР (ДМСО-d6) δ: 9,98 (шир., 1H), 9,13 (с, 1H), 7,57 (с, 1H), 7,46 (д, J = 8,2 Гц, 2H), 7,25 - 6,80 (м, 11H), 4,75 - 4,69 (м, 1H), 3,85 (дд, J = 5,8, 14,6 Гц, 1H), 3,77 - 3,44 (м, 5H), 2,83 (д, J = 14,1 Гц, 1H), 2,51 (с, 6H), 2,47 (д, J = 14,1 Гц, 1H), 2,18 (с, 3H), 1,11 (т, J= 7,3 Гц, 3H), 1,07 (т, J = 6,8 Гц, 3H).
[α]
Ссылочный пример 27
1-(2,2-Диэтоксиэтил)индол
К раствору 12 г индола в 100 мл диметилсульфоксида добавляли 6,5 г гидрида натрия при комнатной температуре. Полученную смесь перемешивали при той же самой температуре в течение 1 часа, и к смеси добавляли 20 мл диэтилацеталя бромацетальдегида, после чего перемешивали смесь еще при 50oC в течение 1 часа. После охлаждения реакционную смесь вливали в воду, и продукт экстрагировали диэтиловым эфиром. Органический слой осушали над безводным сульфатом магния и концентрировали, получив в результате 23 г указанного в заголовке соединения.
ЯМР (CDCl3) δ: 7,60 (д, J = 6,9 Гц, 1H), 7,39 (д, J = 9,1 Гц, 1H), 7,26 - 7,03 (м, 3H), 6,48 (д, J = 3,4 Гц, 1H), 4,64 (т, J = 5,1 Гц, 1H), 4,20 (д, J = 5,1 Гц, 2H), 3,79 - 3,47 (м, 2H), 3,42 - 5,24 (м, 2H), 1,12 (т, J = 7,3 7,3 Гц, 6H).
Ссылочный пример 28
1-(2,2-Диэтоксиэтил)-3,3-дихлориндолин-2-он
К суспензии 23 г 1-(2,2-диэтоксиэтил)индола и 31 г дигидрофосфата калия в 1 л этилацетата добавляли 700 мл 5%-ного водного раствора гипохлорита натрия при охлаждении льдом с последующим перемешиванием при указанной температуре в течение 10 минут. Полученную смесь промывали последовательно водой и водным раствором карбоната калия. Органический слой осушали над безводным сульфатом натрия и концентрировали под пониженным давлением, получив в результате 31 г указанного в заголовке соединения.
Rf = 0,50 (гексан/этилацетат = 3/1)
ЯМР (CDCl3) δ: 7,61 (д, J= 8,2 Гц, 1H), 7,40 - 7,30 (м, 1H), 7,22 - 6,98 (м, 2H), 4,74 (т, J = 5,4 Гц, 1H), 3,84 (д, J = 5,4 Гц, 2H), 3,86 - 3,67 (м, 2H), 3,60 - 3,40 (м, 2H), 1,14 (т, J = 7,3 Гц, 6H).
Ссылочный пример 29
1-(2,2-Диэтоксиэтил)изатин
К раствору 31 г (1-(2,2-диэтоксиэтил)-3,3-дихлориндолин-2-она в 200 мл диметилсульфоксида добавляли по каплям 50 мл водного раствора 14,5 г гидроксида натрия так, чтобы температура реакции не могла превышать 20oC, после чего смесь перемешивали при той же температуре в течение 45 минут. К смеси медленно добавляли 15,5 мл концентрированной хлористоводородной кислоты с последующим перемешиванием при комнатной температуре в течение 1,5 часов. К реакционной смеси добавляли этилацетат, и полученную смесь последовательно промывали водой и водным раствором гидрокарбоната натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали, получив в результате 25 г указанного в заголовке соединения.
Rf = 0,83 (хлороформ/метанол = 20/1).
ЯМР (CDCl3) δ:/ 7,75 - 6,95 (м, 4H), 4,71 (т, J = 5 Гц, 1H), 3,89 - 3,40 (м, 6H), 1,16 (т, J = 7 Гц, 6H).
Пример 195
(RS)-1-(2,2-Этоксиэтил)-3-(N'-(4-метилфенил)уреидо)-индолин-2-он
В 3,8 л метанола растворяли 176 г изатина при нагреве, и к полученному раствору добавляли раствор 100 г О-метилгидроксиламингидрохлорида и 136 г тригидрата ацетата натрия в 400 мл воды. Полученную смесь перемешивали при комнатной температуре в течение 10 минут, после чего концентрировали. К остатку добавляли воду, и полученную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия, осушали над безводным сульфатом натрия и концентрировали, получив в результате 192 г (91%) 3-метоксииминоиндолин-2-она. Полученный неочищенный продукт использовали в последующей реакции без очистки.
ЯМР (CDCl3) δ: 9,36 (шир., 1H), 7,94 (д, J = 7,6 Гц, 1H), 7,34 (дт, J = 1,3, 7,6 Гц, 1H), 7,05 (дт, J = 1,0, 7,6 Гц, 1H), 6,92 (д, J = 7,6 Гц, 1H), 4,31 (с, 3H).
К суспензии гидрида натрия (полученного путем промывки 50 г (60% маслянистого гидрида натрия гексаном) в 1 л N,N- диметилформамида добавляли по каплям раствор 176 г 3-метоксииминоиндолин-2-она в 3 л N,N-диметилформамида при 0oC в струе азота. К полученной смеси добавляли 1 л N,N-диметилформамида и 330 мл диэтилацеталя бромацетальдегида, и смесь нагревали до 70oC, и перемешивали ее при этой температуре в течение 45 часов. Реакционную смесь концентрировали, и концентрат разводили этилацетатом и промывали водным раствором хлорида натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали, получив в результате 284 г (97%) 1-(2,2-диэтоксиэтил)-3-метоксииминоиндолин-2-она.
ЯМР (CDCl3) δ: 7,93 (д, J = 7,8 Гц, 1H), 7,36 (дт, J = 1,5, 7,8 Гц, 1H), 7,08 - 7,00 (м, 2H), 4,70 (т, J = 5,4 Гц, 1H), 4,29 (с, 3H), 3,85 (д, J = 5,4 Гц, 2H), 3,79 - 3,43 (м, 4H), 1,14 (т, J = 7,3 Гц, 6H).
К раствору 0,51 г 1-(2,2-диэтоксиэтил)-3-метоксииминоиндолин -2-она в 30 мл этанола добавляли 50 мг 5% Pd/C и 1 мл 2 н. хлористоводородной кислоты, и полученную суспензию перемешивали при комнатной температуре в течение 18 часов в атмосфере водорода. Реакционную смесь фильтровали через Церит, и фильтрат концентрировали. Остаток суспендировали в 30 мл толуола, и к полученной суспензии добавляли 0,25 мл триэтиламина и 0,27 мл пара-толилизоцианата с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали и промывали водой, получив в результате 0,55 г указанного в заголовке соединения.
ЯМР (ДМСО-d6) δ: 8,63 (с, 1H), 7,33 - 7,16 (м, 4H), 7,12 - 7,16 (м, 4H), 5,05 (д, J = 7,4 Гц, 1H), 4,77 - 4,63 (м, 1H), 3,84 (дд, J = 5,7, 14,6 Гц, 1H), 3,77 - 3,40 (м, 5H), 2,22 (с, 3H), 1,08 (т, J = 7,4 Гц, 3H), 1,06 (т, J = 7,4 Гц, 3H).
Пример 196
(+)-3-(пара-Бромбензилокси)карбонилметил-1-(2,2-диэтоксиэтил)-3- (N'-(4-метилфенил)уреидо)индолин-2-он
В 10 мл диметилсульфоксида растворяли 0,336 г (+)-1-(2,2-диэтоксиэтил)-3-гидроксикарбонилметил-3-(N'-(4-метилфенил) уреидо)индолин-2-она. К полученному раствору добавляли последовательно 0,108 г 4-диметиламинопиридина, 0,170 г 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорида и 0,166 г 4-бромбензилового спирта. Полученную смесь перемешивали 18 часов, после чего концентрировали. Концентрат разводили диэтиловым эфиром и последовательно промывали разбавленной хлористоводородной кислотой и насыщенным водным раствором гидрокарбоната натрия. Органический слой осушали над безводным сульфатом натрия и концентрировали. Неочищенный продукт очищали путем хроматографии на колонке с силикагелем (гексан/этилацетат = 2/1), что дало в результате 0,219 г (48%) указанного в заголовке соединения в виде белого порошка.
ЯМР (CDCl3) δ: 7,45 (д, J = 8,8 Гц, 2H), 7,30 - 6,80 (м, 10H), 6,71 (c, 1H), 6,60 (с, 1H), 5,05 (д, J = 12,7 Гц, 1H), 5,00 (д, J = 12,7 Гц, 1H), 4,73 (дд, J = 4,9, 5,9 Гц, 1H), 3,93 (дд, J = 5,9, 14,6 Гц, 1H), 3,83 - 3,30 (м, 5H), 2,97 (д, J = 15,1 Гц, 1H), 2,65 (д, J = 15,1 Гц, 1H), 2,28 (с, 3H), 1,15 (т, J= 7,3 Гц, 3H), 1,10 (т, J = 7,3 Гц, 3H).
Пример 197
3-(+)-1-(2,2-Диэтоксиэтил)-3-(N'-(4-метилфенил)уреидо)-3- ((IR-1-метилпропокси)карбонилметил)индолин-2-он
Указанное в заголовке соединение получали так же, как в примере 196, за исключением того, что в качестве реагента вместо использованного в примере 196 4-бромбензилового спирта использовали R-2-бутанол.
ЯМР (CDCl3) δ: 7,30 - 7,20 (м, 2H), 7,13 - 6,92 (м, 6H), 6,89 (с, 1H), 6,79 (с, 1H), 4,87 - 4,70 (м, 2H), 3,95 (дд, J = 5,9, 14,1 Гц, 1H), 3,83 - 3,46 (м, 5H), 2,95 (д, J = 15,1 Гц, 1H), 2,56 (д, J = 15,1 Гц, 1H), 2,26 (с, 3H), 1,55 - 1,37 (м, 2H), 1,21 -1,00 (м, 9H), 0,81 (т, J = 8,1 Гц, 3H).
Пример 198
(+)-1-формилметил-3-(4-метилфенил)аминокарбонилметил-3- (N'-(4-метилфенил)уреидо)индолин-2-он.
К раствору 0,227 г (+)-1-(2,2-диэтоксиэтил)-3-(4-метилфенил) аминокарбонилметил-3-(N'-(4-метилфенил)уреидо)индолин-2-она в 5 мл ацетона добавляли 5 мл 6 н. хлористоводородной кислоты, после чего полученную смесь нагревали с обратным холодильником в течение 10 минут. Реакционную смесь концентрировали, и остаток разводили этилацетатом и промывали дважды водным раствором хлорида натрия. Органический слой осушали над безводным сульфатом магния и концентрировали, получив в результате 0,183 г указанного в заголовке соединения в виде неочищенного продукта.
ЯМР (CDCl3) δ: 9,59 (с, 1H), 8,12 (с, 1H), 7,42 (с, 1H), 7,31 - 6,84 (м, 12H), 6,57 (д, J = 7,6 Гц, 1H), 4,62 (д, J = 18,8 Гц, 1H), 4,29 (д, J = 18,8 Гц, 1H), 2,90 (д, J = 15,9 Гц, 1H), 2,58 (д, J = 15,9 Гц, 1H), 2,25 (с, 3H), 2,18 (с, 3H),
Пример 199
(+)-1-формилметил-3-гидроксикарбонилметил-3-(N'-(4-метилфенил) уреидо)индолин-2-он
Указанное в заголовке соединение получали так же, как в примере 198, за исключением того, что в качестве исходного материала вместо (+)-1-(2,2-диэтоксиэтил)-3-(4-метилфенил) аминокарбонилметил-3-(N'-(4-метилфенил)уреидо)индолин-2-она, использованного в примере 198, использовали (+)-1-(2,2-диэтоксиэтил)- 3-гидроксикарбонилметил -3-(N'-(4-метилфенил)уреидо)индолин-2-он.
ЯМР (ДМСО-d6) δ: 9,61 (с, 1H), 8,95 (с, 1H), 7,33 - 6,94 (м, 10H), 4,68 (д, J = 18,5 Гц, 1H), 4,54 (д, J = 18,5 Гц, 1H), 2,87 (д, J = 15,8 Гц, 1H), 2,56 (д, J = 15,8 Гц, 1H), 2,17 (с, 3H),
Пример 200
3-(+)-1-формилметил-3-(L-ментокси)карбонилметил-3- (N'-(4-метилфенил)уреидо)индолин-2-он
Указанное в заголовке соединение получали так же, как в примере 198, за исключением того, что в качестве исходного материала вместо (+)-1-(2,2-диэтоксиэтил)-3-(4-метилфенил)аминокарбонилметил-3-(N'- (4-метилфенил)уреидо)индолин-2-она, использованного в примере 198, использовали (+)-1-(2,2-диэтоксиэтил)-3-(L-ментокси)карбонилметил-3- (N'-(4-метилфенил)уреидо)индолин-2-он.
ЯМР (CDCl3) δ: 9,72 (с, 1H), 7,33 - 6,68 (м, 10H), 4,75 - 4,61 (м, 2H), 4,47 (д, J = 17,8 Гц, 1H), 2,99 (д, J = 15,4 Гц, 1H), 2,63 (д, J = 15,4 Гц, 1H), 2,26 (с, 3H), 1,92 - 1,84 (шир., 1H), 1,71 - 1,59 (шир., 3H), 1,43 - 1,38 (шир., 1H), 1,30 - 1,14 (шир., 4H), 0,89 (д, J = 3,6 Гц, 3H), 0,82 (д, J = 6,9 Гц, 3H), 0,64 (д, J = 6,9 Гц, 3H).
Пример 201
(+)-1-(2-Гидроксииминоэтил)-5-(4-метилфенил) аминокарбонилметил-3-(N'-(4-метилфенил)уреидо)индолин-2-он
В 1 мл метанола растворяли 0,050 г (+)-1-формилметил-3- (4-метилфенил)аминокарбонилметил-3-(N'-(4-метилфенил)- уреидо)индолин-2-она, и к полученному раствору добавляли раствор 0,021 г гидроксиламингидрохлорида и 0,021 г ацетата натрия в 1 мл воды. Полученную смесь перемешивали при комнатной температуре в течение 1 часа и концентрировали. К остатку добавляли воду, и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия, осушали над безводным сульфатом натрия и концентрировали. Остаток очищали путем колоночной хроматографии на силикагеле (дихлорметан/этилацетат = 1/1), и в результате получили 0,045 г указанного в заголовке соединения.
Rf = 0,18 (дихлорметан/зтилацетат = 2/1).
ЯМР (CDCl3-ДМСО-d6) δ: 10,09 (шир., 0,5H), 9,62 (шир., 0,5H), 8,69 (шир. , 0,5H), 7,57 (шир., 0,5H), 7,43 - 7,38 (м, 1H), 7,30 - 7,14 (м, 5H), 7,06- 6,77 (м, 9H), 4,71 - 4,52 (м, 1,5H), 4,30 - 4,18 (м, 0,5H), 2,89 (д, J = 14,5 Гц, 0,5H), 2,85 (д, J = 14,5 Гц, 0,5H), 2,51 - 2,40 (м, 1H), 2,26 (с, 3H), 2,19 (c, 3H).
Структурные формулы соединений, полученных в предшествующих примерах, показаны в представленных ниже таблицах А и В.
Ссылочный пример 30
(RS)-5-Этоксикарбонил-(3-метилтио)индолин-2-он
К раствору 4-этоксикарбониланилина (7,28 г) в дихлорметане (150 мл) последовательно добавляют раствор трет-бутил гипохлорита (5 мл) в дихлорметане (20 мл) и раствор этил(метилтио)ацетата (5,6 мл) в дихлорметане (20 мл) при -65oC. После перемешивания смеси в течение 1 часа при той же температуре, добавляют по каплям раствор триэтиламина (6,1 мл) в дихлорметане (20 мл) и смесь перемешивают в течение ночи при комнатной температуре. Затем туда добавляют воду (50 мл) и органический слой отделяют и концентрируют в вакууме. К остатку добавляют эфир (150 мл) и 2н. соляную кислоту (20 мл), смесь перемешивают в течение ночи при комнатной температуре. Осажденный твердый продукт собирают фильтрацией с получением 5,27 г указанного в заголовке соединения (выход 48%).
ЯМР (CDCl3) δ: 8,59 (ушир. с, 1H), 8,08 (с, 1H), 8,02 (д, J = 7,3 Гц, 1H), 6,95 (д, J= 7,3 Гц, 1H), 4,39 (кв, J = 5,9 Гц, 2H), 4,31 (с, 1H), 2,06 (с, 3H), 1,40 (т, J = 5,9 Гц, 3H).
Ссылочный пример 31
5-Этoкcикapбoнил-(3-мeтoкcииминo)индoлин-2-oн
К раствору трет-бутоксида калия (2,36 г) в тетрагидрофуране (170 мл) добавляют (RS)-5-этоксикарбонил-(3-метилтио)индолин-2-он (5,26 г) при 0oC. Смесь перемешивают в течение 6 часов при 0oC и в течение ночи при комнатной температуре в открытой системе. Реакционную смесь выливают в разбавленную соляную кислоту и смесь экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния и концентрируют с получением 5,1 г 5-этоксикарбонилизатина в виде сырого продукта. 5-Этоксикарбонилизатин (5,1 г) растворяют в этаноле (150 мл) и добавляют раствор гидрохлорида О-метилгидроксиламина (31 г) и тригидрат ацетата натрия (38 г) в воде (150 мл). Смесь перемешивают в течение 1 часа при комнатной температуре и концентрируют. К остатку добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают последовательно насыщенным водным раствором бикарбоната натрия и водным раствором хлорида натрия, затем сушат над безводным сульфатом магния и концентрируют. Остаток очищают путем колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = 2/1) с получением 5 г указанного в заголовке соединения.
ЯМР (CDCl3) δ: 9,08 (ушир. с, 1H), 8,58 (с, 1H), 8,11 (д, J = 8,3 Гц, 1H), 6,97 (д, J = 8,3 Гц, 1H), 4,39 (кв, J = 6,8 Гц, 2H), 4,36 (с, 1H), 1,40 (т, J = 6,8 Гц, 3H).
Ссылочный пример 202
5-Этоксикарбонил-1-(2,2-диэтоксиэтил)-3-метоксиимино)- индолин-2-он
К суспензии гидрида натрия (60% масло, 125 мг) в N,N- диметилформамиде (50 мл) добавляют по каплям раствор 5- этоксикарбонил-(3-метоксиимино)индолин-2-она (620 мг) в N,N- диметилформамиде (30 мл) при 0oC в токе азота. После перемешивания смеси в течение 3 часов при комнатной температуре, добавляют диэтилацеталь бромацетальдегида (0,49 мл), и смесь нагревают до 70oC и перемешивают в течение 5 часов. Реакционную смесь охлаждают на ледяной бане и туда добавляют водный раствор хлорида натрия. Продукт экстрагируют эфиром и органический слой сушат над безводным сульфатом магния и концентрируют. Остаток очищают путем колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = 10/1) с получением 530 мг указанного в заголовке соединения (выход 54%).
ЯМР (CDCl3) δ: 8,57 (д, J = 2,0 Гц, 1H), 8,10 (дд, J = 2,0, 8,3 Гц, 1H), 7,13 (д, J= 8,3 Гц, 1H), 4,68 (т, J = 5,3 Гц, 1H), 4,39 (кв, J = 7,3 Гц, 2H), 4,35 (с, 3H), 3,89 (д, J = 5,3 Гц, 2H), 3,80 - 3,69 (м, 2H), 3,57 - 3,46 (м, 2H), 1,41 (т, J = 7,3 Гц, 3H), 1,13 (т, J = 7,3 Гц, 6H).
Ссылочный пример 203
(RS)-5-Этоксикарбонил-1-(2,2-диэтоксиэтил)-3-(N'-(3-метоксифенил) уреидо)индолин-2-он
К раствору 5-этоксикарбонил-1-(2,2-диэтоксиэтил)-(3-метоксиимино)индолин-2-она (0,53 г) в метаноле (100 мл) добавляют 5% палладий на угле (50 мг) и полученную суспензию перемешивают в течение 3 часов при комнатной температуре в атмосфере водорода. Реакционную смесь фильтруют через целит и фильтрат концентрируют. Остаток растворяют в дихлорметане (30 мл) и добавляют 3- метоксифенилизоцианат (0,21 мл) при 0oC. Смесь перемешивают в течение 1,5 часов при комнатной температуре. Реакционную смесь концентрируют с получением твердого продукта, который затем промывают эфиром с получением 0,44 г указанного в заголовке соединения (выход 63%).
ЯМР (CDCl3) δ: 8,02 (д, J = 7,6 Гц, 1H), 8,01 (с, 1H), 7,38 (с, 1H), 7,14 - 7,06 (м, 2H), 6,96 (т, J = 2,0 Гц, 1H), 6,78 (дд, J = 2,0, 8,3 Гц, 1H), 6,54 (дд, J = 2,0, 8,3 Гц, 1H), 6,13 (д, J = 7,3 Гц, 1H), 5,06 (д, J = 7,3 Гц, 1H), 4,69 (т, J = 5,3 Гц, 1H), 4,35 (кв, J = 6,9 Гц, 2H), 3,96 (дд, J = 5,3, 14,2 Гц, 1H), 3,81 (дд, J = 5,0, 14,2 Гц, 1H), 3,76 - 3,68 (м, 2H), 3,70 (с, 3H), 3,58 - 3,48 (м, 2H), 1,38 (т, J = 6,9 Гц, 3H), 1,14 (т, J = 6,9 Гц, 3H), 1,12 (т, J = 6,9 Гц, 3H).
Пример 204
(RS)-5-Этоксикарбонил-1-(2,2-диэтоксиэтил)-3-(N'- (3-метоксифенил)уреидо)-3-((4-метилфенил)аминокарбонилметил) индолин-2-он
К раствору (RS)-5-этоксикарбонил-1-(2,2-диэтоксиэтил)-3-(N'-(3- метоксифенил)уреидо)индолин-2-она (0,4 г) в диметилсульфоксиде (30 мл) добавляют раствор трет-бутоксида калия (0,105 г) в диметилсульфоксиде (6 мл) при комнатной температуре в атмосфере азота. После перемешивания смеси в течение 10 минут добавляют по каплям раствор N-п-тoлил-2-бpoмaцeтaмидa (0,22 г) в диметилсульфоксиде (6 мл). Смесь перемешивают в течение 30 минут при комнатной температуре, выливают в водный раствор хлорида натрия и экстрагируют эфиром. Эфирный слой сушат над безводным сульфатом магния и концентрируют. Остаток очищают путем колоночной хроматографии на силикагеле с получением 0,44 г указанного в заголовке соединения (выход 54%).
ЯМР (CDCl3) δ: 8,06 - 7,99 (м, 3H), 7,33 - 6,90 (м, 9H), 6,69 (д, J = 7,9 Гц, 1H), 6,48 (д, J = 7,9 Гц, 1H), 4,76 (т, J = 5,3 Гц, 1H), 4,27 (кв, J = 6,9 Гц, 2H), 3,97 (дд, J = 5,9, 14,3 Гц, 1H), 3,87 (дд, J = 4,0, 14,3 Гц, 1H), 3,72 - 3,56 (м, 4H), 3,65 (с, 3H), 2,99 (д, J = 14,2 Гц, 1H), 2,60 (д, J = 14,2 Гц, 1H), 2,28 (с, 3H), 1,29 (т, J = 6,9 Гц, 3H), 1,16 (т, J = 7,3 Гц, 3H), 1,09 (т, J = 7,3 Гц, 3H).
Пример 205
(RS)-1-(2,2-Диэтоксиэтил)-5-гидроксикарбонил-3-(N- (3-метоксифенил)уреидо)-3-((4-метилфенил)аминокарбонилметил) индолин-2-он
К раствору (RS)-5-этоксикарбонил-1-(2,2-диэтоксиэтил)-3-(N'-(3- метоксифенил)уреидо)-3-((4-метилфенил)аминокарбонилметил)индолин -2-она (0,318 г) в этаноле (10 мл) добавляют 1н. гидроксид калия (1 мл) и воду (2 мл) при комнатной температуре и смесь перемешивают при нагревании с обратным холодильником в течение 2 часов. После концентрирования реакционной смеси в вакууме остаток разбавляют водой и, чтобы сделать раствор кислым, добавляют 2н. соляную кислоту. Продукт экстрагируют этилацетатом, органический слой сушат над безводным сульфатом магния и концентрируют. Остаток очищают путем колоночной хроматографии на силикагеле с получением 0,275 г указанного в заголовке соединения (выход 91%).
ЯМР (CDCl3) δ: 9,54 (с, 1H), 8,80 (с, 1H), 8,01 (д, J = 1,3 Гц, 1H), 7,97 (дд, J = 1,7, 8,3 Гц, 1H), 7,64 (с, 1H), 7,39 (д, J = 8,3 Гц, 2H), 7,14 - 6,99 (м, 5H), 6,80 (д, J = 7,9 Гц, 1H), 6,41 (дд, J = 2,3, 8,3 Гц, 1H), 4,78 (т, J = 4,6 Гц, 1H), 3,96 (дд, J = 5,9, 14,2 Гц, 1H), 3,85 (дд, J = 4,3, 14,2 Гц, 1H), 3,78 - 3,53 (м, 4H), 3,68 (с, 3H), 2,96 (д, J = 14,2 Гц, 1H), 2,60 (д, J = 14,2 Гц, 1H), 2,29 (с, 3H), 1,18 (т, J = 6,9 Гц, 3H), 1,11 (т, J = 6,9 Гц, 3H).
Ссылочный пример 32
5-Бензилокси-1-(2,2-диэтоксиэтил)индол
К раствору 5-бензилоксииндола (5 г, 95%) в N,N-диметилформамиде (50 мл) медленно прибавляют гидрид натрия (60% масло, 880 мг) в токе азота и смесь перемешивают в течение 2 часов. Добавляют диэтилацеталь бромацетальдегида (3,5 мл) и смесь нагревают до 70oC и перемешивают в течение 2 часов. Реакционную смесь концентрируют в вакууме. После добавления эфира к остатку смесь промывают последовательно охлажденной водой и водным раствором хлорида натрия. Органический слой сушат над безводным сульфатом магния и концентрируют. Остаток очищают путем колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = 20/1) с получением 5,66 г указанного в заголовке соединения (выход 78%).
ЯМР (CDCl3) δ: 7,49 - 7,23 (м, 6H), 7,14 (дд, J = 2,3, 9,2 Гц, 2H), 6,95 (дд, J = 2,3, 8,6 Гц, 1H), 6,39 (д, J = 2,3 Гц, 1H), 5,09 (с, 2H), 4,63 (т, J = 5,3 Гц, 1H), 4,16 (д, J = 5,3 Гц, 2H), 3,70 - 3,62 (м, 2H), 3,39 - 3,30 (м, 2H), 1,13 (т, J = 7,3 Гц, 6H).
Ссылочный пример 33
5-Бензилокси-1-(2,2-диэтоксиэтил)изатин
К суспензии 5-бензилокси-1-(2,2-диэтоксиэтил)индола (5,32 г) и дигидрофосфата натрия (4,7 г) в этилацетате (200 мл) добавляют водный раствор гипохлорита натрия (5%, 110 мл) при охлаждении на льду, и смесь перемешивают в течение 10 минут при той же температуре. Смесь промывают последовательно водой и водным раствором карбоната калия. Органический слой сушат над безводным сульфатом магния и концентрируют в вакууме с получением 7 г 5-бензилокси-3,3-дихлор-1- (2,2-диэтоксиэтил)-индолин-2-он.
К раствору 5-бензилокси-3,3-дихлор-1-(2,2-диэтоксиэтил) индолин-2-она (7 г) в диметилсульфоксиде (30 мл) по каплям добавляют 2н. водный раствор гидроксида натрия (28 мл) при 0oC и смесь перемешивают в течение 1 часа при той же температуре. Медленно добавляют концентрированную соляную кислоту (4 мл) и смесь перемешивают в течение 3 часов при комнатной температуре. К реакционной смеси добавляют этилацетат и смесь промывают последовательно водой и водным раствором бикарбоната натрия. Органический слой сушат над безводным сульфатом магния и концентрируют. Остаток очищают путем колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = 5/1) с получением 1,3 г указанного в заголовке соединения (выход из 5-бензилокси-1-(2,2- диэтокси-этил)индола 22%).
ЯМР (CDCl3) δ: 7,41 - 7,33 (м, 5H), 7,21 - 7,17 (м, 2H), 7,05 (д, J = 8,9 Гц, 1H), 5,05 (с, 2H), 4,67 (т, J = 5,3 Гц, 1H), 3,80 (д, J = 5,3 Гц, 2H), 3,81 - 3,70 (м, 2H), 3,60 - 3,49 (м, 2H), 1,16 (т, J = 6,9 Гц, 6H).
Ссылочный пример 34
5-Бензилокси-1-(2,2-диэтоксиэтил)-(3-гидроксиимино)индолин-2- он
5-Бензилокси-(1-(2,2-диэтоксиэтил)изатин (1,8 г) растворяют в этаноле (50 мл) и к нему добавляют раствор гидрохлорида гидроксиламина (0,338 г) и тригидрат ацетата натрия (0,663 г) в воде (10 мл). Смесь перемешивают в течение 6 часов при комнатной температуре и концентрируют. После добавления воды к остатку смесь экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния и концентрируют с получением 1,8 г указанного в заголовке соединения (выход 98%). Этот сырой продукт используют в последующей реакции без очистки.
ЯМР (CDCl3) δ: 7,79 (с, 1H), 7,46 - 7,30 (м, 6H), 6,99 (д, J = 1,7 Гц, 2H), 5,05 (с, 2H), 4,69 (т, J = 5,3 Гц, 1H), 3,83 (д, J = 5,3 Гц, 2H), 3,80 - 3,69 (м, 2H), 3,57 - 3,46 (м, 2H), 1,14 (т, J = 6,9 Гц, 6H).
Пример 206
(RS)-1-(2,2-Диэтоксиэтил)-5-гидрокси-3-(N'-(3-метилфенил)- уреидо)индолин-2-он
К раствору 5-бензилокси-1-(2,2-диэтоксиэтил)-(3-гидроксиимино) индолин-2-она (1,68 г) в этилацетате (80 мл) добавляют 5% палладий на угле (50 мг) и полученную суспензию перемешивают в течение 2 дней при комнатной температуре в атмосфере водорода. Реакционную смесь фильтруют через целит и фильтрат концентрируют. Остаток растворяют в дихлорметане (50 мл) и добавляют 3- метилфенилизоцианат (0,65 мл) при 0oC. Смесь перемешивают в течение 1 часа при комнатной температуре. Реакционную смесь концентрируют и остаток очищают путем колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = 2/1) с получением 0,64 г указанного в заголовке соединения (выход 36%).
ЯМР (CDCl3) δ: 8,58 (с, 1H), 8,18 (с, 1H), 7,29 (с, 1H), 7,19 - 7,07 (м, 2H), 6,97 (с, 1H), 6,84 (д, J = 8,6 Гц, 1H), 6,78 - 6,70 (м, 2H), 6,53 (д, J = 7,6 Гц, 1H), 5,23 (д, J = 7,3 Гц, 1H), 4,70 (т, J = 5,3 Гц, 1H), 3,92 (дд, J = 5,3, 14,2 Гц, 1H), 3,79 - 3,45 (м, 5H), 2,29 (с, 3H), 1,16 (т, J = 7,3 Гц, 3H), 1,14 (т, J = 6,9 Гц, 3H).
Ссылочный пример 35
(RS)-5-трет-Бутилдиметилсилилокси-1-(2,2-диэтоксиэтил)-3-(N'-(3- метилфенил)уреидо)индолин-2-он
К раствору (RS)-1-(2,2-диэтоксиэтил)-5-гидрокси-3-(N'- (3-метилфенил)уреидо)индолин-2-она (0,24 г) и имидазола (0,13 г) в N,N-диметилформамиде (20 мл) добавляют трет-бутил-диметилсилилхлорид (0,3 г) при комнатной температуре и смесь перемешивают в течение 4 часов при комнатной температуре. Реакционную смесь выливают в водный раствор хлорида натрия и смесь экстрагируют эфиром. Органический слой сушат над безводным сульфатом магния и концентрируют. Остаток очищают путем колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = 3/1) с получением 0,26 г указанного в заголовке соединения (выход 71%).
ЯМР (CDCl3) 7,76 (с, 1H), 7,11 (с, 1H), 7,02 (д, J = 5,4 Гц, 2H), 6,91- 6,87 (м, 2H), 6,72 (дд, J = 2,4, 8,3 Гц, 2H), 6,37 (д, J = 7,8 Гц, 1H), 5,09 (д, J = 7,3 Гц, 1H), 4,67 (т, J = 5,4 Гц, 1H), 3,91 (дд, J = 4,9, 14,1 Гц, 1H), 3,77 - 3,43 (м, 5H), 2,18 (с, 3H), 1,12 (т, J = 6,8 Гц, 3H), 1,11 (т, J = 7,3 Гц, 3H), 0,96 (с, 9H), 0,16 (с, 6H).
Пример 207
(RS)-1 -(2,2-Диэтоксиэтил)-5-гидрокси-3-(4-метилфенил)- аминокарбонилметил-3-(N'-(3-метилфенил)уреидо)индолин-2-он
К раствору (RS)-5-трет-бутилдиметилсилилокси-1- (2,2-диэтоксиэтил)-3-(N'-(3-метилфенил)уреидо)индолин-2-она (0,26 г) в диметилсульфоксиде (10 мл) добавляют раствор трет-бутоксида калия (0,054 г) в диметилсульфоксиде (5 мл) при 0oC в атмосфере азота. После перемешивания смесь в течение 1 минуты добавляют по каплям раствор N-п-толил-2-бромацетамида (0,12 г) в диметилсульфоксиде (5 мл). После перемешивания смеси в течение 1 часа при комнатной температуре реакционную смесь выливают в водный раствор хлорида натрия и смесь дважды экстрагируют эфиром. Объединенный эфирный слой сушат над безводным сульфатом магния и концентрируют.
Остаток растворяют в этаноле и к нему добавляют концентрированную серную кислоту (0,3 мл). Смесь перемешивают в течение ночи при комнатной температуре. Реакционную смесь нейтрализуют насыщенным водным раствором бикарбоната натрия и концентрируют в вакууме. К остатку добавляют этилацетат и смесь промывают последовательно водой и водным раствором хлорида натрия. Органический слой сушат над безводным сульфатом магния и концентрируют. Остаток очищают путем колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = 3/1) с получением 0,19 г указанного в заголовке соединения (выход 71%).
ЯМР (CDCl3) δ: 9,62 (с, 1H), 8,49 (с, 1H), 8,47 (д, J = 8,3 Гц, 1H), 7,56 (с, 1H), 7,46 (д, J = 6,8 Гц, 2H), 7,20 (с, 1H), 7,10 - 7,01 (м, 4H), 6,88 - 6,86 (м, 2H), 6,70 (дд, J = 1,9, 8,3 Гц, 2H), 4,79 (т, J = 4,9 Гц, 1H), 3,97 (дд, J = 5,9, 13,6 Гц, 1H), 3,79 - 3,53 (м, 5H), 2,93 (д, J = 14,6 Гц, 1H), 2,58 (д, J = 14,6 Гц, 1H), 2,30 (с, 3H), 2,22 (с, 3H), 1,19 (т, J = 7,3 Гц, 3H), 1,14 (т, J = 7,3 Гц, 3H).
Ссылочный пример 36
(RS)-4-Этоксикарбонил-(3-метилтио)индолин-2-он
К раствору 3-этоксикарбониланилина (9 г) в дихлорметане (200 мл) последовательно добавляют раствор трет-бутилгипохлорита (6,2 мл) в дихлорметане (20 мл) и раствор этил(метилтио)ацетата (6,9 мл) в дихлорметане (20 мл) при -65oC. После перемешивания смеси в течение 1 часа при той же температуре к реакционной смеси добавляют по каплям раствор триэтиламина (7,5 мл) в дихлорметане (20 мл) и полученную смесь перемешивают в течение ночи при комнатной температуре. К ней добавляют воду (50 мл) и органический слой отделяют и концентрируют в вакууме. Остаток растворяют в смеси растворителей эфира и N, N-диметилформамида и добавляют 2н. соляную кислоту (25 мл). Смесь перемешивают в течение ночи при комнатной температуре. Осажденный твердый продукт собирают фильтрацией и перекристаллизовывают из эфира/метанола с получением 6,13 г указанного в заголовке соединения (выход 44%).
ЯМР (CDCl3) δ: 9,02 (ушир. с, 1H), 7,65 (дд, J = 1,0, 7,9 Гц, 1H), 7,34 (дт, J = 0,7, 7,9 Гц, 1H), 7,09 (д, J = 7,9 Гц, 1H), 4,71 (с, 1H), 4,48 - 4,36 (м, 2H), 2,00 (с, 3H), 1,43 (т, J = 7,3 Гц, 3H).
Ссылочный пример 37
(RS)-3-Ацетокси-4-этоксикарбонил-(3-метилтио)индолин-2-он
К раствору (RS)-4-этоксикарбонил-(3-метилтио)индолин-2-она (5,2 г) в дихлорметане (20 мл) добавляют тетраацетат свинца (20 г) при комнатной температуре и смесь перемешивают в течение 4 часов при комнатной температуре. Реакционную смесь выливают в этиленгликоль для отделения дихлорметанового слоя и этиленгликолевый слой вновь экстрагируют дихлорметаном. Объединенный дихлорметановый слой промывают водным раствором хлорида натрия, сушат над безводным сульфатом магния и концентрируют с получением 7,7 г указанного в заголовке соединения. Сырой продукт используют в последующей реакции без очистки.
ЯМР (CDCl3) δ: 7,89 (ушир. с, 1H), 7,57 (дд, J = 1,0, 7,9 Гц, 1H), 7,34 (т, J = 7,9 Гц, 1H), 7,03 (дд, J = 1,0, 7,9 Гц, 1H), 4,41 (дкв, J = 2,3, 7,3 Гц, 2H), 2,40 (с, 3H), 2,19 (с, 3H), 1,43 (т, J = 7,9 Гц, 3H).
Ссылочный пример 38
4-Этоксикарбонил-(3-метоксиимино)индолин-2-он
К раствору (RS)-3-ацетокси-4-этоксикарбонил-(3-метилтио)- индолин-2-она (7,7 г) в тетрагидрофуране (200 мл) добавляют уксусную кислоту (350 мл) и воду (100 мл) при комнатной температуре и смесь перемешивают при нагревании с обратным холодильником в течение 2 часов. После охлаждения смеси до комнатной температуры к реакционной смеси добавляют гидрохлорид О-метилгидроксиламина (5 г) и смесь перемешивают в течение 4 часов при комнатной температуре. Реакционную смесь выливают в воду и смесь экстрагируют этилацетатом. Органический слой промывают водным насыщенным раствором бикарбоната натрия, сушат над безводным сульфатом магния и концентрируют. Остаток очищают путем колоночной хроматографии на силикагеле (элюируя хлороформом/этилацетатом = 10/1) с получением 2,86 г указанного в заголовке соединения (смесь геометрических изомеров, выход 56%).
ЯМР (CDCl3) δ: 9,47 (ушир. с, 0,5H), 9,06 (ушир. с, 0,5H), 7,40 (т, J = 7,6 Гц, 0,5H), 7,36 (т, J = 7,9 Гц, 0,5H), 7,22 (дд, J = 1,0, 7,9 Гц, 0,5H), 7,15 (дд, J = 1,0, 7,9 Гц, 0,5H), 7,04 (дд, J = 0,7, 7,9 Гц, 0,5H), 6,99 (дд, J = 0,7, 7,9 Гц, 0,5H), 4,39 (кв, J = 7,3 Гц, 1H), 4,33 (кв, J = 7,3 Гц, 1H), 4,26 (с, 1,5H), 4,24 (с, 1,5H), 1,40 (т, J = 7,3 Гц, 1,5H), 1,36 (т, J = 7,3 Гц, 1,5H).
Пример 208
4-Этоксикарбонил-1-(2,2-диэтоксиэтил)-(3-метоксиимино)- индолин-2-он
К суспензии гидрида натрия (60% масло, 250 мг) в N,N- диметилформамиде (60 мл) добавляют по каплям раствор 4- этоксикарбонил-(3-метоксиимино)индолин-2-она (1,49 г) в N,N- диметилформамиде (50 мл) при 0oC в токе азота и смесь перемешивают в течение 2 часов при комнатной температуре. К смеси добавляют диэтилацеталь бромацетальдегида (0,95 мл) и смесь нагревают до 60oC и перемешивают в течение ночи. Реакционную смесь концентрируют в вакууме и к остатку добавляют воду. Смесь экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния и концентрируют. Остаток очищают путем колоночной хроматографии на силикагеле (элюируя гексаном/этилацетатом = 4/1) с получением двух геометрических изомеров (менее полярного, 863 мг выход 39%; и полярного, 517 мг, выход 24%).
ЯМР (CDCl3) менее полярный; δ: 7,37 (т, J = 7,9 Гц, 1H), 7,18 (дд, J = 1,0, 7,9 Гц, 1H), 7,15 (дд, J = 1,0, 7,9 Гц, 1H), 4,64 (т, J = 5,3 Гц, 1H), 4,39 (кв, J = 7,3 Гц, 2H), 4,24 (с, 3H), 3,83 (д, J = 5,3 Гц, 2H), 3,79 - 3,68 (м, 2H), 3,56 - 3,45 (м, 2H), 1,40 (т, J = 7,3 Гц, 3H), 1,14 (т, J = 7,3 Гц, 6H).
полярный; δ: 7,41 (т, J = 7,9 Гц, 1H), 7,20 (дд, J = 1,0, 7,9 Гц, 1H), 7,14 (дд, J = 1,0, 7,9 Гц, 1H), 4,68 (т, J = 5,3 Гц, 1H), 4,32 (кв, J = 7,3 Гц, 2H), 4,23 (с, 3H), 3,87 (д, J = 5,3 Гц, 2H), 3,80 - 3,69 (м, 2H), 3,57 - 3,46 (м, 2H), 1,35 (т, J = 7,3 Гц, 3H), 1,14 (т, J = 7,3, 6H).
Пример 209
(ПRS)-4-Этоксикарбонил-1-(2,2-диэтоксиэтил)-3-(N'-(3-метилфенил) уреидо)индолин-2-он
К раствору 4-этоксикарбонил-1-(2,2-диэтоксиэтил)- (3-метоксиимино)индолин-2-она (полярный, 0,49 г) в этилацетате (60 мл) добавляют 5% палладий на угле (30 мг) и полученную суспензию перемешивают в течение ночи при комнатной температуре в атмосфере водорода. Затем атмосферу водорода заменяют атмосферой азота, добавляют 3-метилфенилизоцианат (0,2 мл) при 0oC и смесь перемешивают в течение 1 часа при комнатной температуре. К реакционной смеси добавляют диметилсульфоксид (10 мл) и смесь фильтруют через целит. К фильтрату добавляют этилацета и смесь промывают водным раствором хлорида натрия. Органический слой сушат над безводным сульфатом магния и концентрируют. Перекристаллизация остатка из эфира дает 0,39 г указанного в заголовке соединения (выход 62%).
ЯМР (CDCl3) δ: 7,64 (дд, J = 1,7, 7,3 Гц, 1H), 7,38 - 7,29 (м, 2H), 7,12 - 6,95 (м, 4H), 6,82 (д, J = 7,6 Гц, 1H), 6,23 (д, J = 5,9 Гц, 1H), 4,93 (д, J = 6,3 Гц, 1H), 4,74 (т, J = 5,3 Гц, 1H), 4,32 (дкв, J = 2,6, 6,9 Гц, 2H), 3,97 (дд, J = 5,6, 14,2 Гц, 1H), 3,87 (дд, J = 4,9, 14,2 Гц, 1H), 3,82 - 3,49 (м, 4H), 2,25 (с, 3H), 1,35 (т, J = 7,3 Гц, 3H), 1,15 (т, J = 6,9 Гц, 3H), 1,13 (т, J = 6,9 Гц, 3H).
Пример 210
(RS)-4-Этоксикарбонил-1-(2,2-диэтоксиэтил)-3-(4-метилфенил)- аминокарбонилметил-3-(N'-(3-метилфенил)уреидо)индолин-2-он
К раствору (RS)-4-этоксикарбонил-1-(2,2-диэтоксиэтил)-3-(N'-(3- метилфенил)уреидо)индолин-2-она (0,23 г) в диметилсульфоксиде (5 мл) добавляют раствор трет-бутоксида калия (0,061 г) в диметилсульфоксиде (5 мл) при 0oC в атмосфере азота. После перемешивания смеси в течение 5 минут добавляют по каплям раствор N-п-толил-2-бромацетамида (0,13 г) в диметилсульфоксиде (5 мл). После перемешивания смеси в течение 30 минут при комнатной температуре реакционную смесь выливают в водный раствор хлорида натрия и полученную смесь экстрагируют эфиром. Органический слой сушат над безводным сульфатом магния и концентрируют. Остаток очищают путем колоночной хроматографии на силикагеле с получением 0,23 г указанного в заголовке соединения (выход 74%).
ЯМР (CDCl3) δ: 9,75 (ушир. с, 1H), 8,89 (ушир. с, 1H), 8,30 (ушир. с, 1H), 7,58 - 6,97 (м, 10H), 6,68 (д, J = 8,4 Гц, 1H), 4,63 (т, J = 4,7 Гц, 1H), 4,31 (кв, J = 6,9 Гц, 2H), 3,81 - 3,50 (м, 6H), 2,79 (д, J = 14,2 Гц, 1H), 2,32 (д, J = 14,2 Гц, 1H), 2,21 (с, 3H), 2,17 (с, 3H), 1,30 (т, J = 6,9 Гц, 3H), 1,05 (т, J = 6,9 Гц, 6H).
Пример 211
(RS)-1-(2,2-Диэтоксиэтил)-4-гидроксикарбонил-3-(4-метилфенил)- аминокарбонилметил-3-(N'-(3-метилфенил)уреидо)индолин-2-он
К раствору (RS)-4-этоксикарбонил-1-(2,2-диэтоксиэтил)-3-(4- метилфенил)аминокарбонилметил-3-(N'-(3-метилфенил)уреидо)индолин -2-она (0,23 г) в метаноле (5 мл) добавляют 1н. гидроксид калия (2 мл) при комнатной температуре, и смесь перемешивают при нагревании с обратным холодильником в течение 3 часов. После концентрирования реакционной смеси в вакууме остаток разбавляют водой. Чтобы сделать раствор кислым, добавляют 2н. соляную кислоту. Смесь экстрагируют этилацетатом и органический слой сушат над безводным сульфатом магния и концентрируют. Остаток очищают путем колоночной хроматографии на силикагеле с получением 0,073 г указанного в заголовке соединения (выход 34%).
ЯМР (ДМСО-d6) δ: 8,98 (ушир. с, 1H), 7,37 - 6,95 (м, 12H), 6,63 (д, J = 6,6 Гц, 1H), 4,62 (т, J = 5,0 Гц, 1H), 3,83 (дд, J = 4,6, 14,2 Гц, 1H), 3,70 - 3,40 (м, 5H), 2,53 (д, J = 8,6 Гц, 1H), 2,21 (д, J = 8,6 Гц, 1H), 2,19 (с, 3H), 2,15 (с, 3H), 1,07 (т, J = 6,9 Гц, 3H), 0,98 (т, J = 6,9 Гц, 3H).
Ссылочный пример 39
(RS)-3-Ацетокси-5-изобутоксикарбонил-(3-метилтио)индолин-2-он
Указанное в заголовке соединение получают по способу ссылочных примеров 36 и 37, за исключением того, что в качестве исходного продукта используют 2-метилпропиловый эфир 4-аминобензойной кислоты (выход 32%).
ЯМР (CDCl3) δ: 8,31 (ушир. с, 1H), 8,04 (дд, J = 2,0, 8,3 Гц, 1H), 7,99 (д, J = 2,0 Гц, 1H), 6,92 (д, J = 8,3 Гц, 1H), 4,09 (д, J = 6,8 Гц, 2H), 2,42 (с, 3H), 2,23 - 1,94 (м, 1H), 2,17 (с, 3H), 1,02 (д, J = 6,8 Гц, 6H).
Ссылочный пример 40
5-Изобутоксикарбонилизатин
К раствору (RS)-3-ацетокси-5-изобутоксикарбонил-(3-метилтио)- индолин-2-она (14,1 г) в диметилсульфоксиде (100 мл) добавляют трифторуксусную кислоту (20 мл) и воду (2 мл) при комнатной температуре и смесь перемешивают в течение 2 часов при 100oC. Затем смеси дают охладиться до комнатной температуры, реакционную смесь концентрируют. Остаток очищают путем перекристаллизации из этилацетата/гексана с получением 6,1 г указанного в заголовке соединения (выход 58%).
ЯМР (CDCl3) δ: 9,12 (ушир. с, 1H), 8,33 (д, J = 8,0 Гц, 1H), 8,28 (с, 1H), 7,10 (д, J = 8,0 Гц, 1H), 4,12 (д, J = 7,6 Гц, 2H), 2,18 - 2,00 (м, 1H), 1,03 (д, J = 7,2 Гц, 6H).
Ссылочный пример 41
5-Изобутоксикарбонил-(3-метоксиимино)индолин-2-он
К раствору 5-изобутоксикарбонилизатина (6,0 г) в метаноле добавляют гидрохлорид О-метилгидроксиламина (2 г) и ацетат натрия (3,4 г) и смесь перемешивают в течение 4 часов при комнатной температуре. Реакционную смесь выливают в воду и экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором бикарбоната натрия, сушат над безводным сульфатом магния и концентрируют с получением 6,63 г указанного в заголовке соединения (выход 99%).
ЯМР (ДMCO-d6) δ: 11,19 (ушир. с, 1H), 8,36 (д, J = 1,7 Гц, 1H), 8,02 (дд, J = 1,7, 8,3 Гц, 1H), 7,00 (д, J = 8,3 Гц, 1H), 4,24 (с, 3H), 4,05 (д, J = 6,6 Гц, 2H), 2,14 - 1,90 (м, 1H), 0,96 (д, J = 6,8 Гц, 6H).
Ссылочный пример 42
(RS)-5-Изобутоксикарбонил-3-(N'-(3-метилфенил)уреидо)индолин- 2-он
К раствору 5-изобутоксикарбонил-(3-метоксиимино)индолин-2-она (3,1 г) в N,N-диметилформамиде (50 мл) добавляют 5% палладий на угле (30 мг) и полученную суспензию перемешивают в течение ночи при комнатной температуре в атмосфере водорода, затем атмосферу водорода заменяют на атмосферу азота. Добавляют 3-метилфенилизоцианат (1,4 мл) и смесь перемешивают в течение 1 часа при комнатной температуре. Реакционную смесь фильтруют через целит. К фильтрату добавляют этилацетат и смесь промывают водным раствором хлорида натрия. Органический слой сушат над безводным сульфатом магния и концентрируют. Остаток очищают путем колоночной хроматографии на силикагеле с получением 3,75 г указанного в заголовке соединения (выход 88%).
ЯМР (ДМСО-d6) δ: 10,73 (ушир. с, 1H), 8,81 (ушир. с, 1H), 7,87 (д, J = 8,3 Гц, 1H), 7,73 (с, 1H), 7,22 (с, 1H), 7,13 - 7,03 (м, 3H), 6,91 (д, J = 8,3 Гц, 1H), 6,77 - 6,68 (м, 1H), 4,95 (д, J = 7,4 Гц, 1H), 4,11 - 3,90 (м, 2H), 2,21 (с, 3H), 2,09 - 1,88 (м, 1H), 0,95 (д, J = 6,6 Гц, 6H).
Пример 212
(RS)-5-Изобутоксикарбонил-3-трет-бутоксикарбонилметил-3-(N'- (3-метилфенил)уреидо)индолин-2-он
К раствору (RS)-5-изобутоксикарбонил-3-(N'-(3-метилфенил)- уреидо)индолин-2-она (1,55 г) в N,N-диметилформамиде (7 мл) добавляют раствор трет-бутоксида калия (0,456 г) в N,N- диметилформамиде (5 мл) при комнатной температуре в атмосфере азота. После перемешивания смеси в течение 5 минут смесь охлаждают до -60oC и добавляют по каплям трет-бутилбромацетат (0,6 мл). После перемешивания смеси в течение 30 минут реакционную смесь выливают в водный раствор хлорида натрия и смесь экстрагируют эфиром. Органический слой сушат над безводным сульфатом магния и концентрируют. Остаток очищают путем колоночной хроматографии на силикагеле с получением 1,07 г указанного в заголовке соединения (выход 53%).
ЯМР (CDCl3) δ: 9,29 (ушир. с, 1H), 7,95 (ушир. с, 1H), 7,78 (дд, J = 1,5, 8,3 Гц, 1H), 7,05 (дд, J = 7,8, 7,8 Гц, 1H), 6,98 - 6,73 (м, 6H), 4,03 (д, J = 6,8 Гц, 2H), 2,99 (д, J = 14,6 Гц, 1H), 2,64 (д, J = 14,6 Гц, 1H), 2,22 (с, 3H), 2,16 - 1,95 (м, 1H), 1,37 (с, 9H), 1,00 (д, J = 6,8 Гц, 6H).
Пример 213
(RS)-5-Изобутоксикарбонил-3-гидроксикарбонилметил-3-(N'-(3- метилфенил)уреидо)индолин-2-он
К (RS)-5-изобутоксикарбонил-3-трет-бутоксикарбонилметил-3-(N'- (3-метилфенил)уреидо)индолин-2-ону (0,88 г) добавляют трифторуксусную кислоту (20 мл) при комнатной температуре и смесь перемешивают в течение 1 часа при той же температуре. Реакционную смесь концентрируют в вакууме с получением 0,79 указанного в заголовке соединения.
ЯМР (ДМСО-d6) δ: 12,72 (ушир. с, 1H), 10,80 (с, 1H), 8,94 (с, 1H), 7,89 - 7,77 (м, 1H), 7,88 (с, 1H), 7,29 - 6,85 (м, 5H), 6,69 (д, J = 6,9 Гц, 1H), 4,01 (д, J = 6,0 Гц, 2H), 2,86 (д, J =15,4 Гц 1H), 2,58 (д, J = 15,4 Гц, 1H), 2,18 (с, 3H), 2,11 - 1,88 (м, 1H), 0,96 (д, J = 6,3 Гц, 6H).
Пример 214
(RS)-Бензил-5-изобутоксикарбонил-3-(4-метилфенил) аминокарбонилметил-3-(N'-(3-метилфенил)уреидо)индолин-2-он
К раствору (RS)-5-изобутоксикарбонил-3-гидроксикарбонил- метил-3-(N'-(3-метилфенил)уреидо)индолин-2-она (0,112 г) в диметилсульфоксиде (5 мл) добавляют раствор (1М, 0,5 мл) гидрида натрия в диметилсульфоксиде при комнатной температуре в атмосфере азота. После перемешивания смеси в течение 5 минут к ней добавляют бензилбромид (0,035 мл). После перемешивания смеси в течение 30 минут при той же температуре смесь выливают в водный раствор хлорида натрия, и экстрагируют эфиром. Эфирный слой сушат над безводным сульфатом магния и концентрируют с получением (RS)-1- бензил-5-изобутоксикарбонил-3-гидроксикарбонилметил-3-(N'- (3-метилфенил)уреидо)индолин-2-она.
Rf = 0,25 (гексаном/этилацетатом = 1/1)
(RS)-1-Бензил-5-изобутоксикарбонил-3-гидроксикарбонилметил-3- (N'-(3-метилфенил)уреидо)индолин-2-он растворяют в ацетонитриле (20 мл). Затем к нему последовательно добавляют гидрохлорид 1-этил-3-(3- диметиламинопропил)карбодиимида (0,06 г) и п-толуидин (0,035 г). Смесь перемешивают в течение ночи и концентрируют. Остаток разбавляют этилацетатом и промывают разбавленной соляной кислотой и водным раствором хлорида натрия. Органический слой сушат над безводным сульфатом натрия и концентрируют. Полученный сырой продукт очищают путем колоночной хроматографии на силикагеле (элюируя хлороформом/этилацетом = 2/1) с получением 0,115 г указанного в заголовке соединения (выход 78%).
ЯМР (CDCl3) δ: 8,05 (с, 1H), 8,00 - 7,85 (м, 2H), 7,53 - 7,18 (м, 8H), 7,18 - 6,88 (м, 6H), 6,85 - 6,69 (м, 2H), 5,10 (д, J = 15,4 Гц, 1H), 4,96 (д, J = 15,4 Гц, 1H), 3,97 (д, J = 6,3 Гц, 2H), 3,08 (д, J = 14,6 Гц, 1H), 2,57 (д, J = 14,6 Гц, 1H), 2,29 (с, 3H), 2,20 (с, 3H), 2,08 - 1,88 (м, 1H), 0,90 (д, J = 6,8 Гц, 6H).
Пример 215
(RS)-1-Бензил-5-гидроксикарбонил-3-(4-метилфенил) аминокарбонилметил-3-(N'-(3-метилфенил)уреидо)индолин-2-он
К раствору (RS)-1-бензил-5-изобутоксикарбонил-3-(4-метилфенил) аминокарбонилметил-3-(N'-(3-метилфенил)уреидо)индолин-2-она (0,092 г) в метаноле (20 мл) добавляют 2н. гидроксид калия (1 мл) и воду (2 мл) при комнатной температуре и смесь перемешивают при нагревании с обратным холодильником в течение 3 часов. Затем реакционную смесь концентрируют в вакууме, остаток разбавляют водой и добавляют 2н. соляную кислоту, чтобы сделать раствор кислым. Смесь экстрагируют этилацетатом и органический слой сушат над безводным сульфатом натрия и концентрируют. Остаток очищают путем колоночной хроматографии на силикагеле с получением 0,080 г указанного в заголовке соединения (выход 94%).
ЯМР (CDCl3) δ: 8,60 (ушир. с, 1H), 8,15 (с, 1H), 7,86 - 6,42 (м, 18H), 4,94 (ушир. с, 2H), 3,33 - 2,60 (м, 2H), 2,08 (с, 3H), 1,98 (с, 3H).
Пример 216
Индивидуальные диастереомеры 5-изобутоксикарбонил-3-(H'-(3-метилфенил)уреидо)-3-[(1S, 2R)-2-фенил -2-гидрокси-1-метилэтил- аминокарбонилметил] индолин-2-она
(RS)-5-изобутоксикарбонил-3-гидроксикарбонилметил-3-(N'-(3- метилфенил)уреидо)индолин-2-он (4,81 г) растворяют в дихлорметане (100 мл) и последовательно добавляют (1S, 2R)-норефедрин (2,48 г) и гидрохлорид 1-этил-3-(3-диметиламино-пропил)карбодиимида (3,14 г). Смесь перемешивают в течение ночи. После перемешивания промывают водным раствором хлорида натрия, органический слой сушат над безводным сульфатом натрия и концентрируют. Полученный сырой продукт очищают путем колоночной хроматографии на силикагеле (элюируя хлороформом/уксусной кислотой/изопропанолом = 50/3/1) с получением двух индивидуальных диастереомеров (менее полярного, 1,72 г, выход 27%; и полярного, 1,58 г, выход 25%).
менее полярный: ЯМР (CDCl3) δ: 9,61 (ушир. с, 1H), 7,95 (с, 1H), 7,88 - 7,58 (м, 2H), 7,58 - 6,27 (м, 12H), 5,17 - 4,89 (м, 1H), 4,41 - 3,72 (м, 4H), 3,09 - 2,69 (м, 1H), 2,65 - 1,56 (м, 6H), 1,05 - 0,37 (м, 9H).
полярный: ЯМР (CDCl3) δ: 9,58 (ушир. с, 1H), 7,92 (с, 1H), 7,79 (д, J = 8,5 Гц, 1H), 7,68 (с, 1H), 7,50 (с, 1H), 7,31 - 6,47 (м, 11H), 4,91 - 4,73 (м, 1H), 4,40 - 3,75 (м, 1H), 3,98 (д, J = 6,5 Гц, 2H), 2,81 - 2,40 (м, 2H), 2,11 (с, 3H), 2,22 - 1,85 (м, 2H), 0,94 (д, J = 6,3 Гц, 6H), 0,76 (д, J = 6.3 Гц, 3H).
Ссылочный пример 43
Индивидуальный диастереомер 5-изoбvтoкcикapбoнил-3-(N'-(3- метил-фенил)уреидо)-3-[[(4R,5S)-5-фенил-4-метилоксазолин-2-ил] - метил]индолин-2-она
К раствору индивидуального диастереомера 5-изобутокси- карбонил-3-(N'-(3-метилфенил)уреидо)-3-[(1S, 2R)-2-фенил-2-гидрокси-1- метилэтиламинокарбонилметил] индолин-2-она (пример 216-полярный, 1,57 г) в дихлорметане (50 мл) добавляют тионилхлорид (0,6 мл) при комнатной температуре и смесь перемешивают в течение 30 минут при комнатной температуре. Реакционную смесь выливают в насыщенный водный раствор бикарбоната натрия и смесь экстрагируют хлороформом. Водный слой вновь экстрагируют хлороформом. Объединенный органический слой сушат над безводным сульфатом натрия и концентрируют. Полученные кристаллы промывают эфиром с получением 1,14 г указанного в заголовке соединения (выход 75%).
ЯМР (CDCl3) δ: 8,46 (ушир. с, 1H), 8,08 (с, 1H), 7,97 (д, J = 8,5 Гц, 1H), 7,85 - 7,74 (м, 1H), 7,46 - 7,24 (м, 6H), 7,17 - 7,00 (м, 3H), 6,95 - 6,76 (м, 2H), 5,04 (д, J = 9,1 Гц, 1H), 4,31 - 3,98 (м, 3H), 2,95 - 2,84 (м, 2H), 2,24 (с, 3H), 2,17 - 1,96 (м, 1H), 1,52 (д, J = 6,0 Гц, 3H), 1,00 (д, J = 6,3 Гц, 6H).
Пример 217
Оптически активный изомер 5-изобутоксикарбонил-3-гидрокси- карбонилметил-3-(N'-(3-метилфенил)уреидо)индолин-2-она
К раствору индивидуального диастереомера 5-изобутокси- карбонил-3-(N'-(3-метилфенил)уреидо)-3-[[(4R,5S)-5-фенил-4-метил- оксазолин-2-ил]метил]индолин-2-она (синтезирован в ссылочном примере 43, 1,11 г) в ацетоне (100 мл) добавляют 2н. соляную кислоту (7 мл) при комнатной температуре и смесь перемешивают в течение 2 часов при той же температуре. После перемешивания концентрируют в вакууме, остаток растворяют в метаноле (300 мл) и к нему добавляют 5% палладий на угле (100 мг). Полученную суспензию перемешивают в течение 3 часов при комнатной температуре в атмосфере водорода. Реакционную смесь фильтруют через целит и фильтрат концентрируют. К остатку добавляют этилацетат и смесь последовательно промывают разбавленной соляной кислотой и водным раствором хлорида натрия. Органический слой сушат над безводным сульфатом натрия и концентрируют. Остаток очищают путем колоночной хроматографии на силикагеле с получением 0,39 г указанного в заголовке соединения (выход 44%).
ЯМР (ДМСО-d6) δ: 12,72 (ушир. с, 1H), 10,80 (с, 1H), 8,94 (с, 1H), 7,89 - 7,77 (м, 1H), 7,88 (с, 1H), 7,29 - 6,85 (м, 5H), 6,69 (д, J = 6,9 Гц, 1H), 4,01 (д, J = 6,0 Гц, 2H), 2,86 (д, J = 15,4 Гц, 1H), 2,58 (д, J = 15,4 Гц, 1H), 2,18 (с, 3H), 2,11 - 1,88 (м, 1H), 0,96 (д, J = 6.3 Гц, 6H).
Пример 218
Оптически активный изомер 1-бензил-5-изобутоксикарбонил-3-(4- метилфенил)аминокарбонилметил-3-(N'-(3-метилфенил)уреидо)- индолин-2-она
37 мг (выход 51%) указанного в заголовке соединения синтезируют по способу примера 214, за исключение использования в качестве исходного продукта оптически активного изомера 5- изобутоксикарбонил-3-гидроксикарбонилметил-3-(N'-(3-метилфенил)- уреидо)индолин-2-она (синтезируют в примере 217, 57 мг).
ЯМР (CDCl3) δ: 8,05 (с, 1H), 8,00 - 7,85 (м, 2H), 7,53 - 7,18 (м, 8H), 7,18 - 6,88 (м, 6H), 6,85 - 6,69 (м, 2H), 5,10 (д, J = 15,4 Гц, 1H), 4,96 (д, J = 15,4 Гц, 1H), 3,97 (д, J = 6,3 Гц, 2H), 3,08 (д, J = 14,6 Гц, 1H), 2,57 (д, J = 14,6 Гц, 1H), 2,29 (с, 3H), 2,20 (с, 3H), 2,08 - 1,88 (м, 1H), 0,90 (д, J = 6,8 Гц, 6H).
Пример 219
(+)-1-Бензил-5-гидроксикарбонил-3-(4-метилфенил) аминокapбoнилмeтил-3-(N'-(3-мeтилфeнил)уpeидo)индoлин-2-oн
К раствору оптически активного изомера 1-бензил-5- изобутоксикарбонил-3-(4-метилфенил)аминокарбонилметил-3-(N'-(3- метилфенил)уреидо)индолин-2-она (синтезирован в примере 218, 16 мг) в метаноле (10 мл) добавляют 2н. гидроксид калия (2 мл) при комнатной температуре и смесь перемешивают при нагревании с обратным холодильником в течение 1 часа. Реакционную смесь концентрируют в вакууме. Полученный остаток разбавляют водой и, чтобы сделать раствор кислым, добавляют 2н. соляную кислоту. Полученный твердый продукт собирают фильтрованием с получением 14 мг указанного в заголовке соединения (выход 95%).
ЯМР (CDCl3) δ: 8,60 (ушир. с, 1H), 8,15 (c, 1H), 7,86 - 6,42 (м, 18H), 4,94 (ушир. с, 2H), 3,33 - 2,60 (м, 2H), 2,08 (c, 3H), 1,98 (c, 3H)
[α]
Пример испытания
Испытание на связывание с гастринрецепторами на желудочных железах морской свинки
Приготовление желудочных желез
Желудочные железы морской свинки приготавливали по методу Chang, et al., Biochem. Biophys. Res. Commun, 134, 895 (1986). Отслаивали слизистую оболочку желудка мужской особи морской свинки Хартли. После промывания слизистую оболочку крошили ножницами в буфер А (Eagle's MEM, содержащий 2 мМ L-глутамина и 25 мМ HEPES; pH 7,4). После промывки крошеную ткань инкубировали в буфере А, содержащем 0,025% коллагеназы, 0,01% соевого ингибитора и 0,1% BCA (альбумин бычьей сыворотки), при 37oC в течение 60 минут в атмосфере, содержащей 95% O2 и 5% CO2. С помощью пипетки отделяли желудочные железы от ткани, дважды промывали их буфером А и фильтровали через сетку. После этого железы получили центрифугированием.
Испытание на связывание:
Желудочные железы морской свинки ресуспендировали в буфере В (раствор Хэнка, содержащий 10 мМ HEPES и 0,2% BSA; pH 7,4) (10 мл буфера В на морскую свинку).
К 200 мкл суспензии, содержавшей ресуспендированные отделенные желудочные железы, добавляли 20 мкл 125I-гастрина 1 человека (окончательная концентрация: 22,5 пМ).
Затем туда добавляли 10 мкл испытываемого соединения или растворителя (для общего связывания) или 10 мкМ Пентагастрина (для неспецифического связывания) и буфер В до общего объема 1 мл. Реакционную смесь инкубировали при 25oC в течение 45 минут и затем центрифугировали при 12000 g. Удаляли путем отсасывания супернатант, и измеряли с помощью счетчика гамма-квантов радиоактивность отделенных желудочных желез.
Специфическое связывание гастрина с гастринрецепторами получали из разницы между общим и неспецифическим связываниями. Вычисляли IC50 испытуемого соединения при ингибировании специфического связывания.
Полученные результаты показаны в таблице С.
Пример 2 испытания
Ингибиторное действие на секрецию желудочной кислоты у крыс с наложенной пиролусной (pyrolus) лигатурой
Мужских особей крыс Sprague - Dawley весом примерно 200 г не кормили 24 часа, позволяя при этом пить сколько угодно воды. Брюшную полость вскрывали под анестезией диэтиловым эфиром, налагали пиролусную лигатуру, и полость закрывали. В течение 4 часов крысам не давали пищи и воды, пока они не были усыплены диэтиловым эфиром. Удаляли желудок, и собирали желудочный сок и измеряли его количество. Желудочный сок подвергали центрифугированию при 3000 об/мин, и супернатант титровали до pH 7,0 0,1 н. раствором NaOH, чтобы получить кислотность желудочного сока. Количество выделяемой желудочной кислоты вычисляли путем умножения объема желудочного сока на кислотность, а ингибирование в процентах секреции кислоты получали в соответствии с представленным ниже уравнением. Испытуемое соединение, суспендированное в 3%-ном растворе аравийской камеди, вводили интрадуоденально (в полость двенадцатиперстной кишки) при дозе 2 мл/кг сразу же после наложения пиролусной лигатуры.
Ингибирование (%) = [(Среднее количество выделяемой желудочной кислоты в контрольной группе - Среднее количество выделяемой желудочной кислоты в испытуемой группе) / Среднее количество выделяемой желудочной кислоты в испытуемой группе] х 100.
Полученные результаты показаны в таблице С.
Пример 3 испытания
Испытание на связывание с ССК-В-рецептором в коре головного мозга крыс
Корковую мембранную фракцию крыс приготавливали в соответствии с методом Чанга и др., Proc Natl. Acad. Sci. США, 83, 4923 (1986). Крыс-самцов Sprague - Dawley усыпляли, и, удалив головной мозг, погружали его в 50 мМ буфер Трис-HCl (pH 7,4) при охлаждении льдом, где отделяли кору мозга. Кору головного мозга крошили в том же самом буфере и гомогенизировали с помощью Политрона. Гомогенат центрифугировали при 2500 g, а затем центрифугировали и супернатант при 50000 g. Осадок ресуспендировали в реакционном буферном растворе (10 мМ HEPES, 5 мМ EGTA, 130 мМ NaCl; pH 6,5).
Испытание на связывание
К 150 мкл полученной суспензии коры головного мозга крыс добавляли 20 мкл сульфатированного 125I-CCK-8 (окончательная концентрация: 15 пМ) и 10 мкл испытуемого соединения или растворителя (для общего связывания) или 1 мкМ сульфатированного ССК-8 (для неспецифического связывания), и к полученной смеси добавляли реакционный буферный раствор до общего объема 1 мл. Реакционную смесь инкубировали при 25oC в течение 120 минут, после чего фильтровали через фильтр CF/B (производства Ф. "Уотмен"). С помощью счетчика гамма-квантов измеряли радиоактивность мембранной фракции, адсорбированной на фильтр.
Специфическое связывание с ССК-В-рецепторами получали из разницы между общим связыванием и неспецифическим связыванием. Вычисляли IC50 испытуемого соединения при ингибировании специфического связывания.
Полученные результаты представлены в таблице D.
Представленные в таблице С результаты подтверждают, что соединение в соответствии c настоящим изобретением является превосходным антагонистом гастринрецепторов и оказывает ингибирующее действие на секрецию желудочной кислоты.
Результаты, представленные в таблице D, подтверждают, что соединение в соответствии с настоящим изобретением является превосходным антагонистом ССК-В-рецепторов.
Промышленное применение
Соединения в соответствии о настоящим изобретением проявляют избирательный антагонизм к гаcтринрецепторам, не вызывая побочных эффектов, приписываемых антагонизму к ССК-А-рецепторам, и пригодны для лечения и предупреждения заболеваний органов пищеварения, таких как пептичеcкие язвы, гастриты, рефлюксэзофагиты и синдром Золлингера-Эллисона. Соединения пригодны также для лечения опухолей, образующихся в пищеварительной системе. Соединения проявляет также избирательный антагонизм к ССК-В-рецепторам и пригодны для лечения связанных с ССК нарушений в системе регуляции аппетита, усиления и продления аналгезии (наркотической или ненаркотической), вызывания анестезии или аналгезия и лечения и предупреждения симптомов психотических расстройств, включая невроз страха и паники.
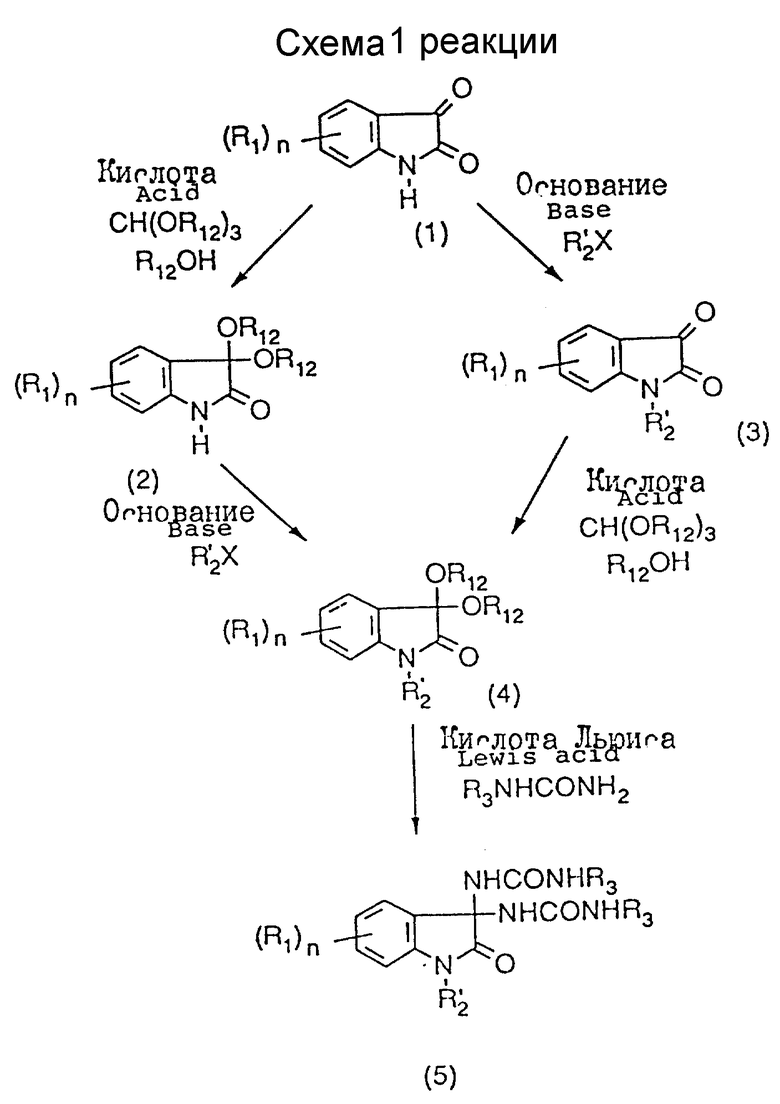
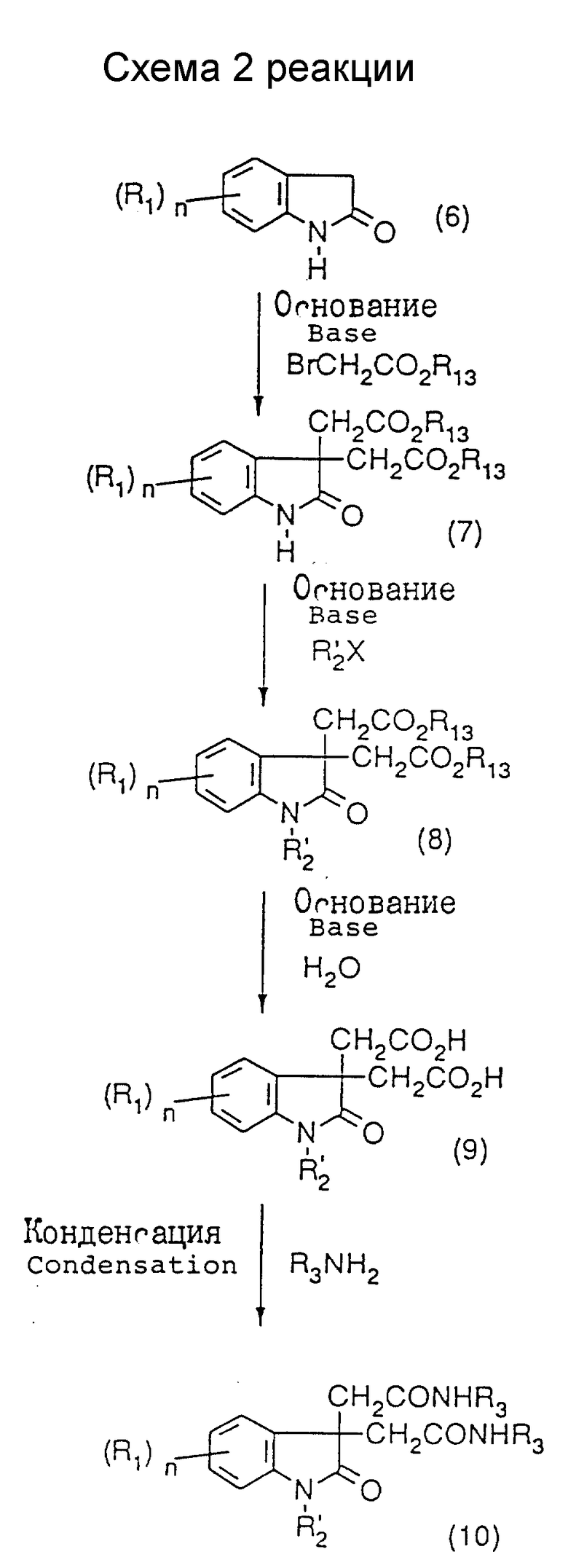
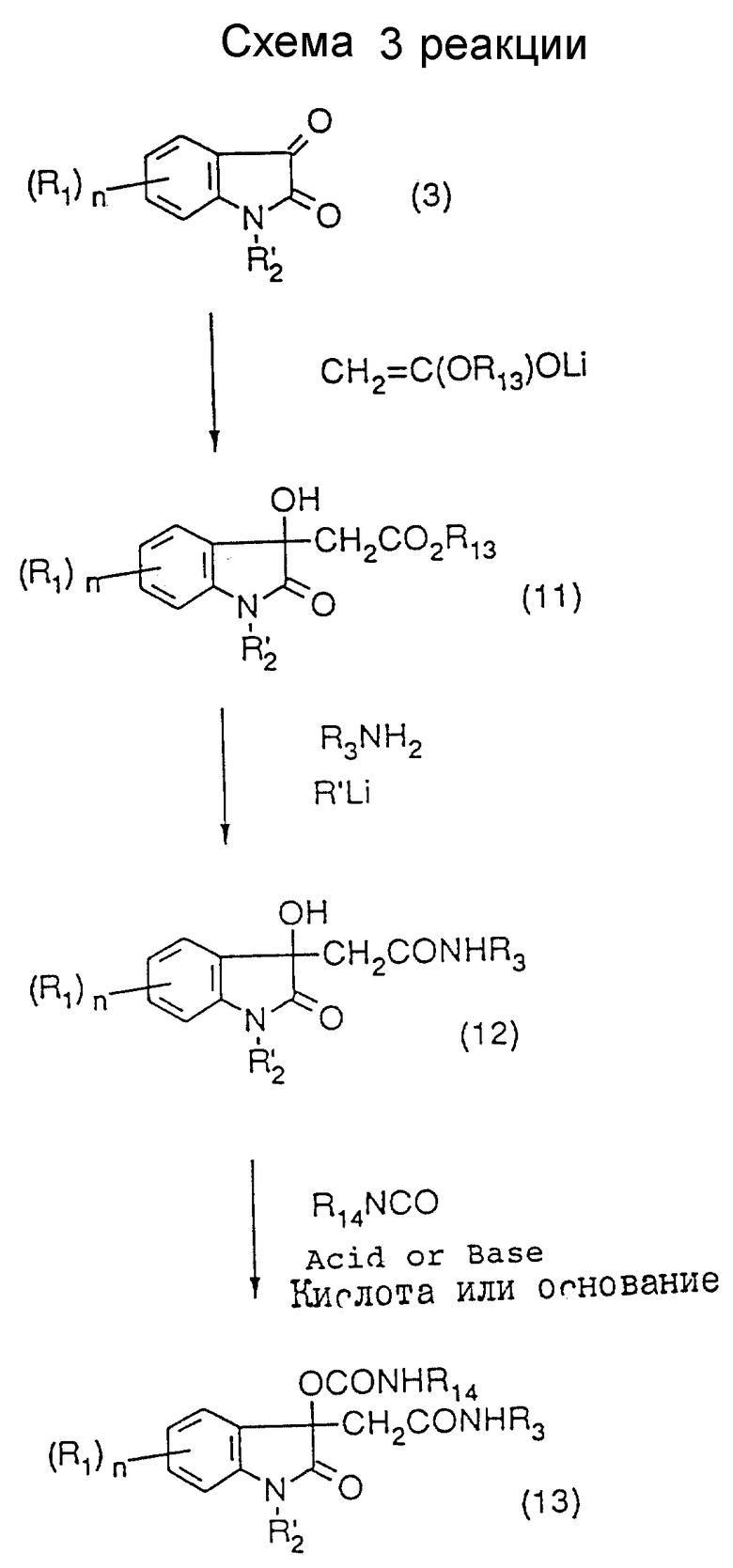

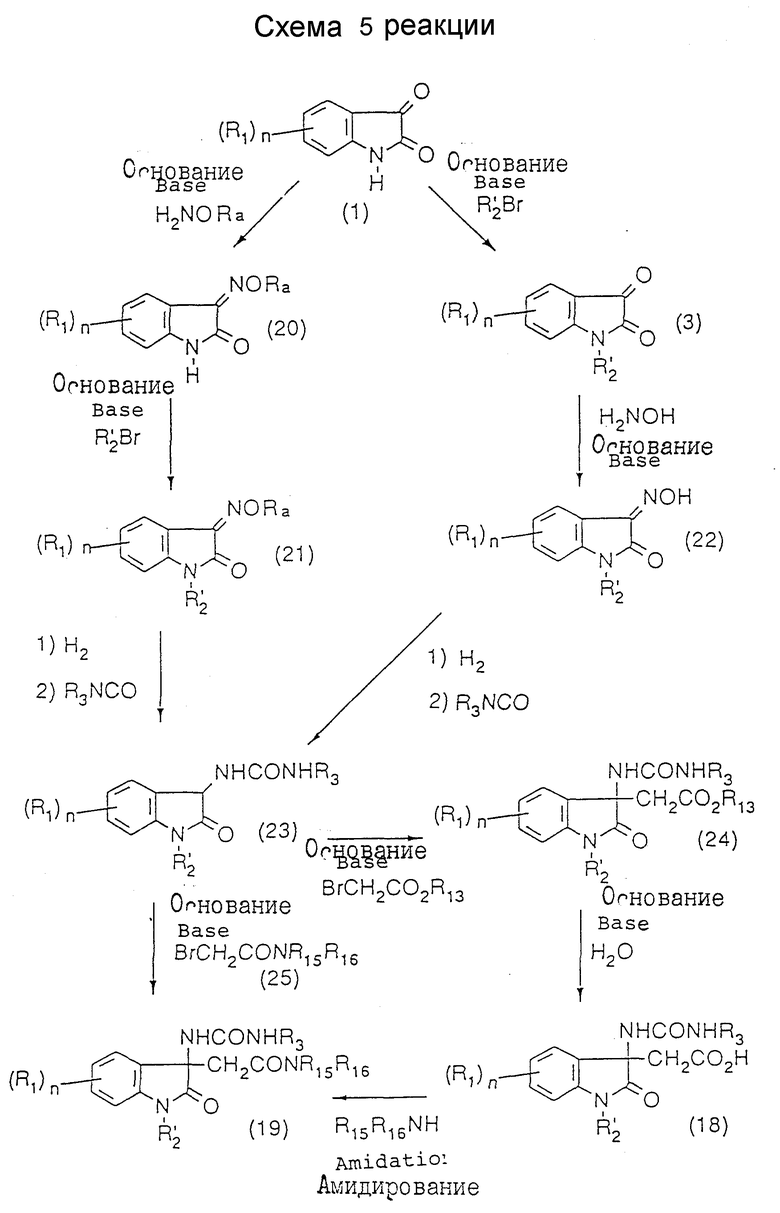
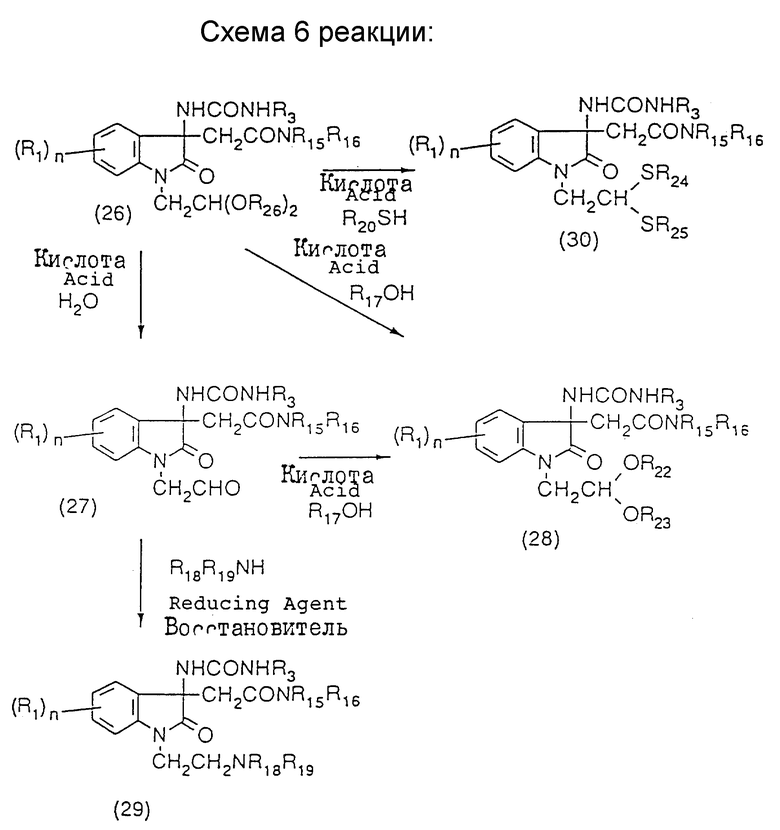
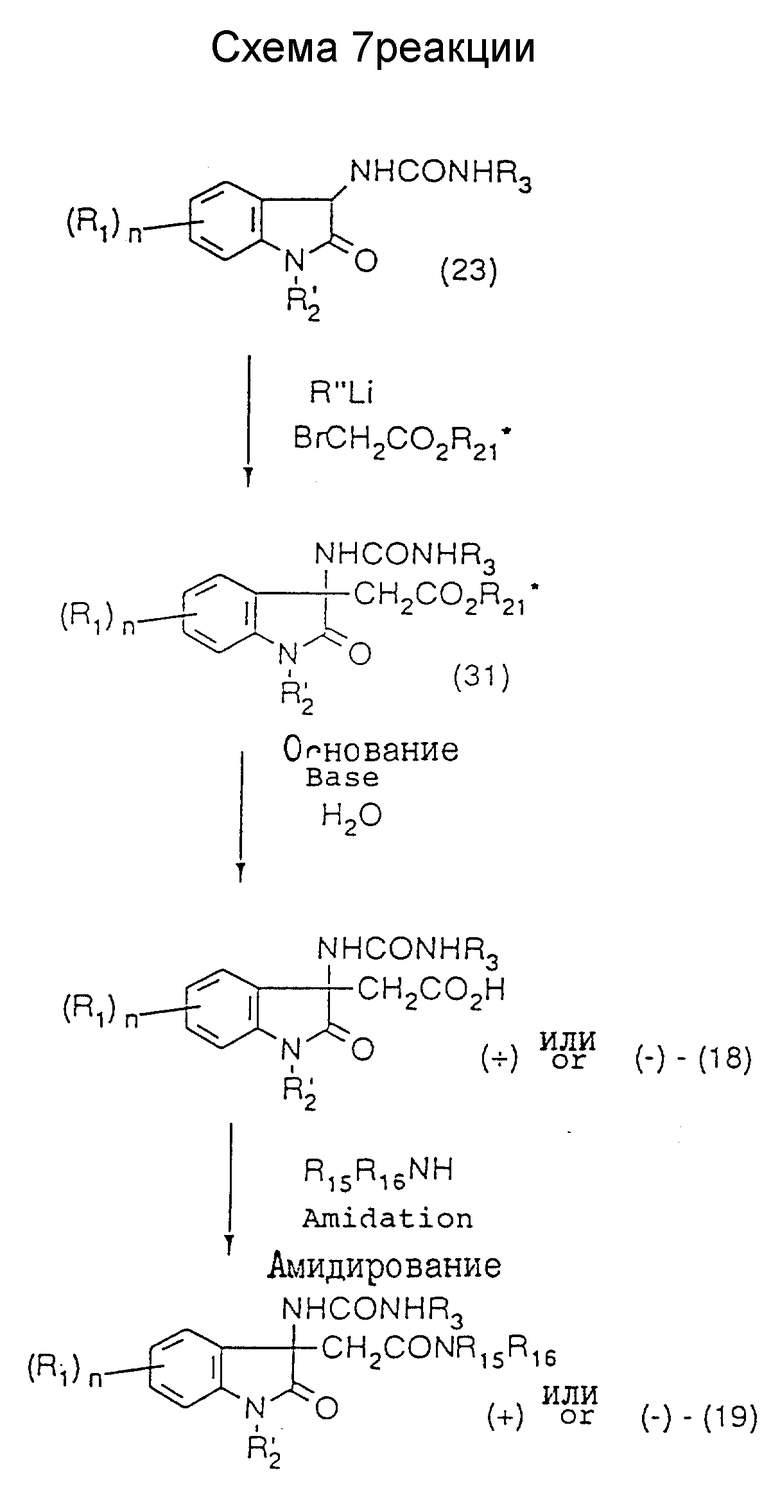
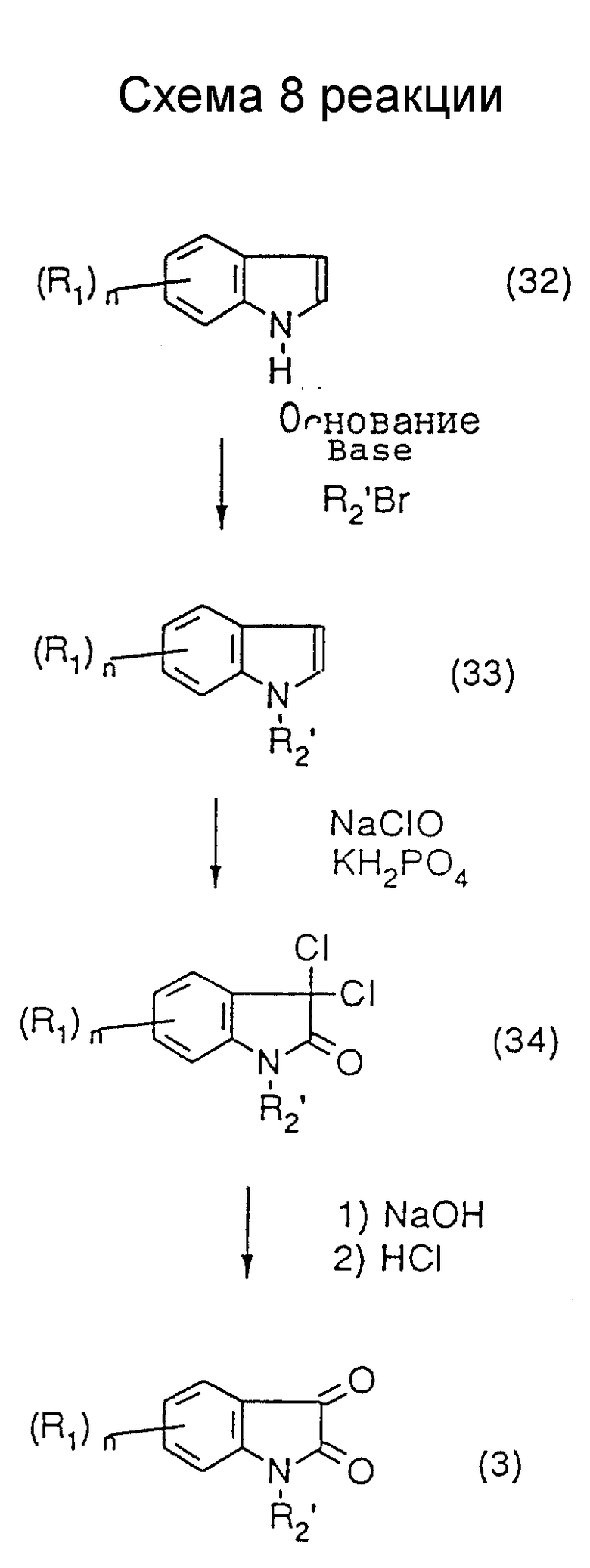
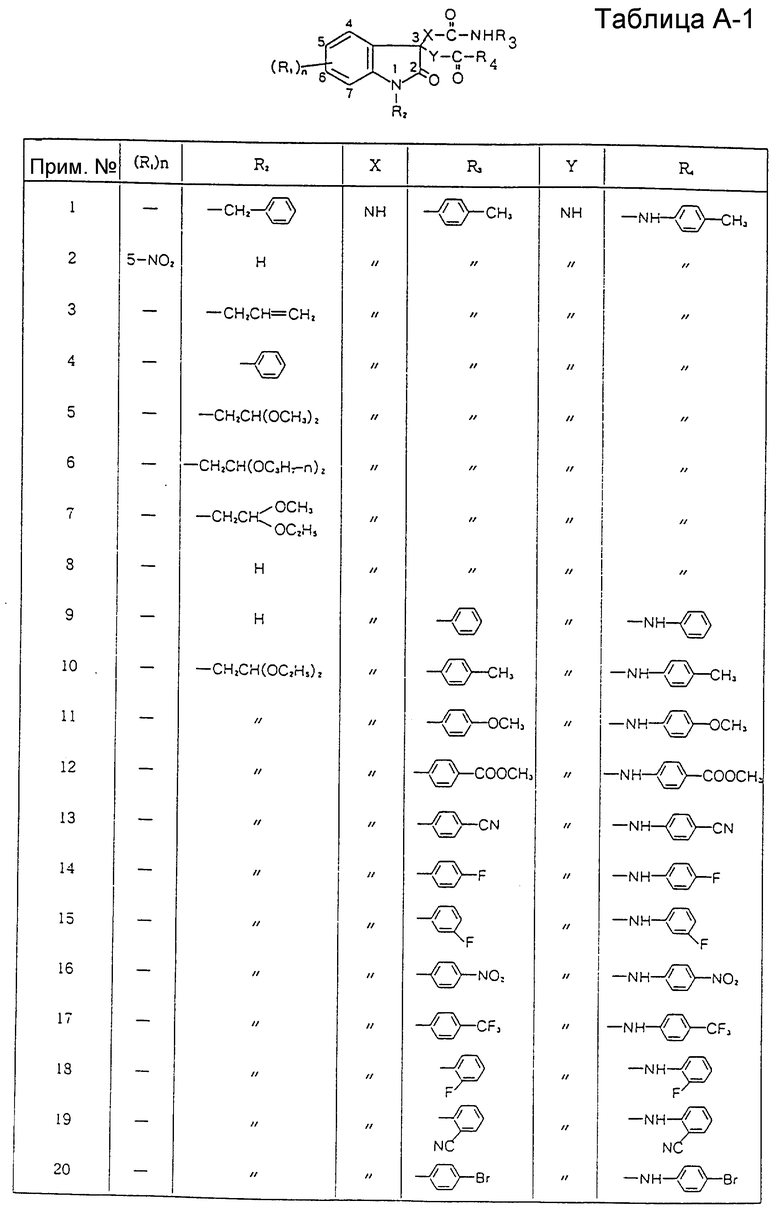
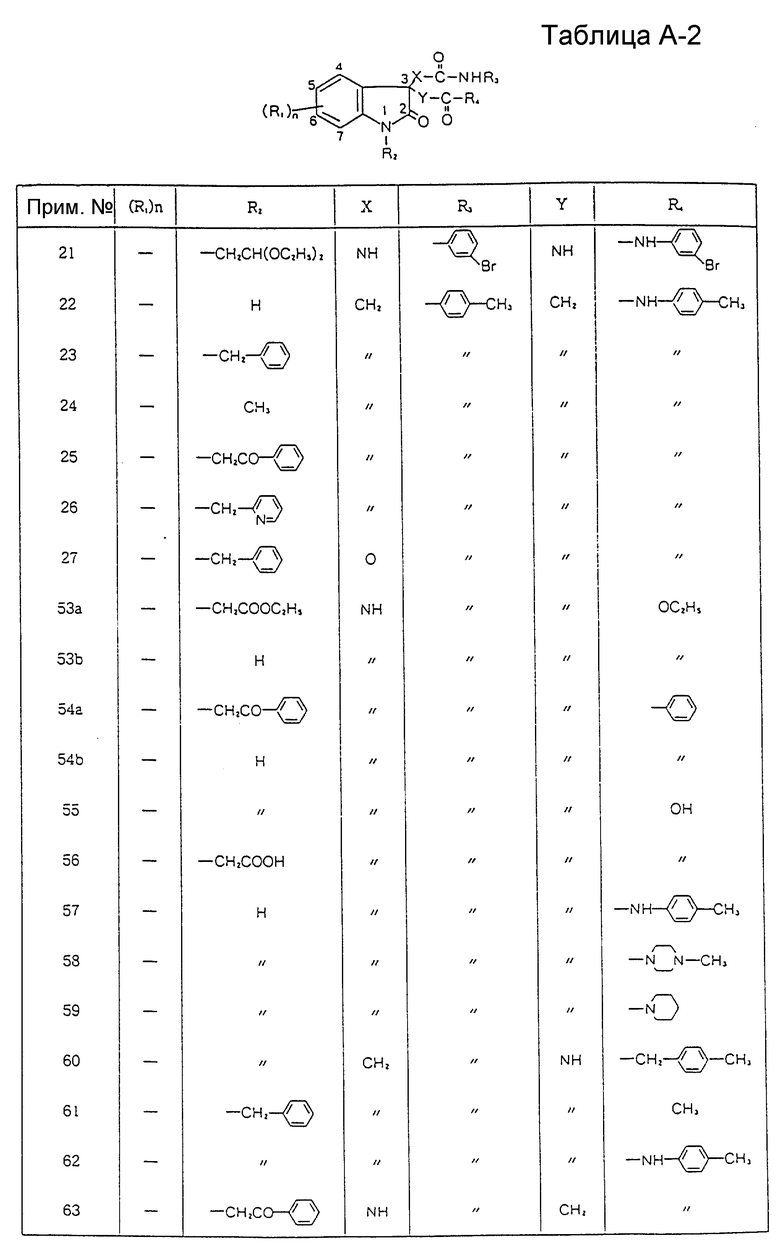
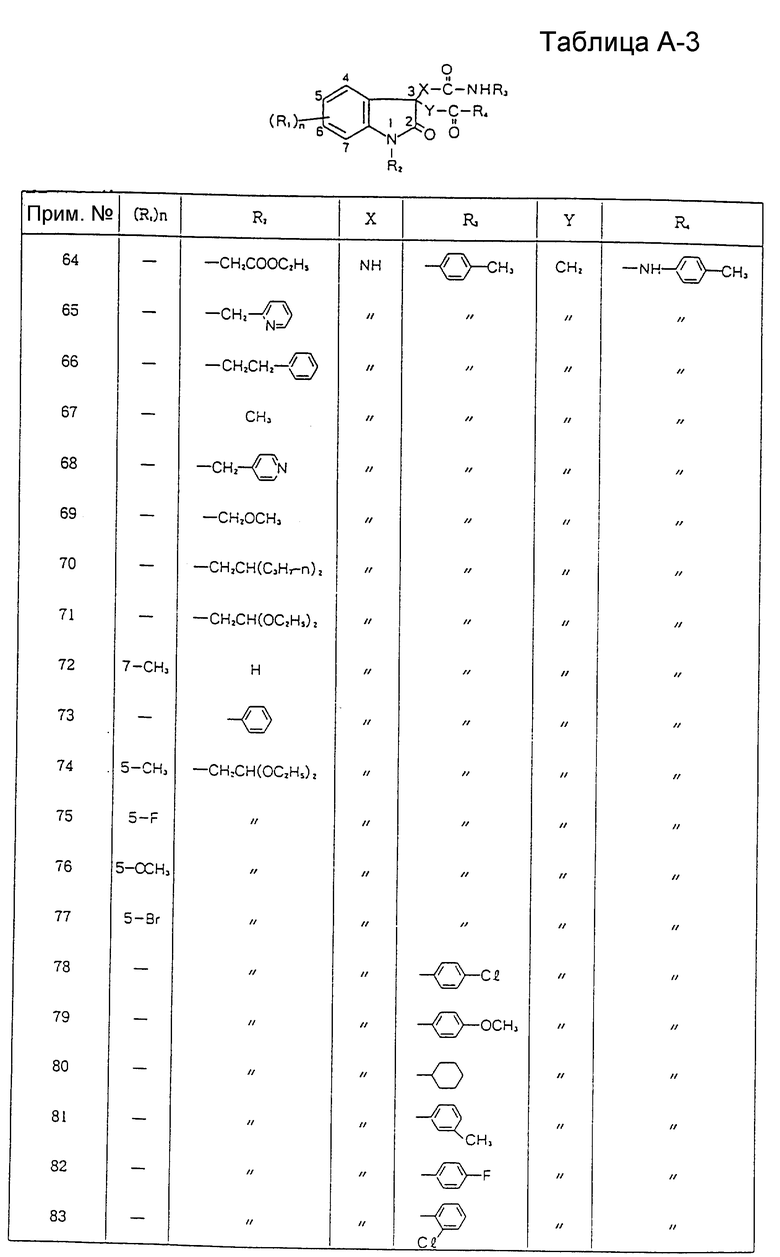
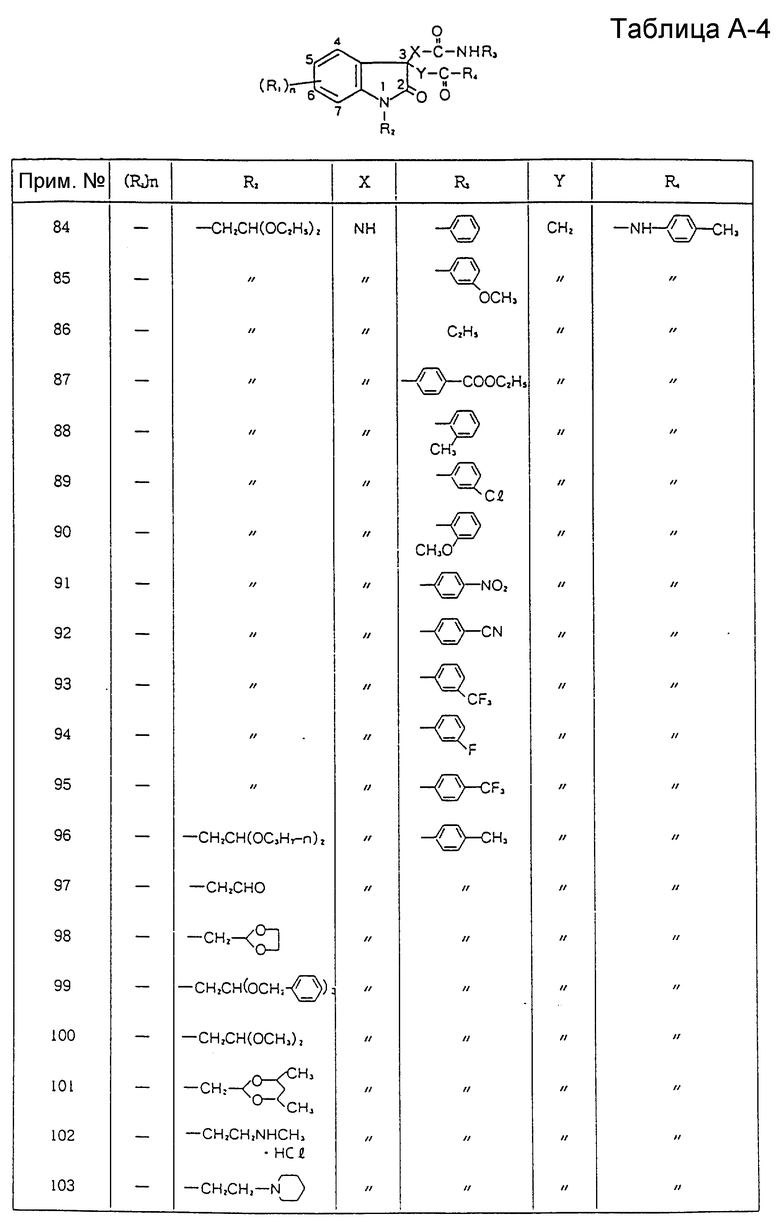
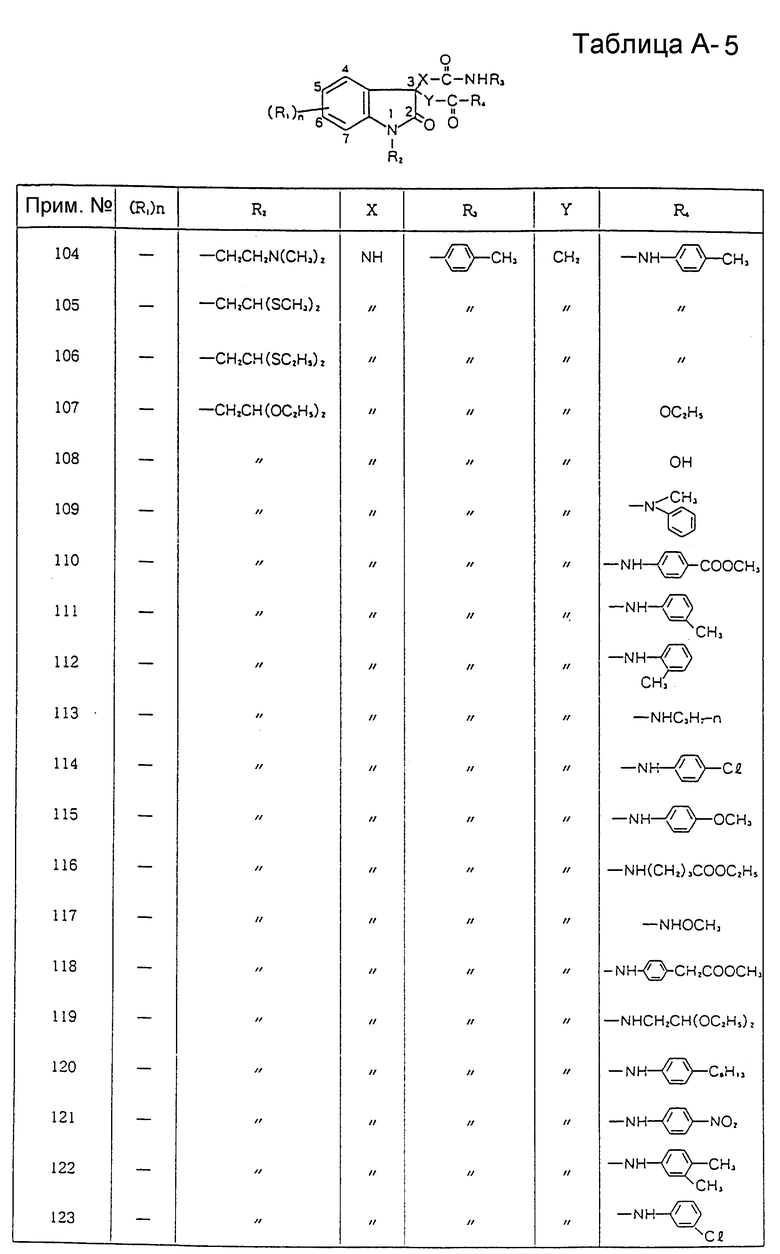
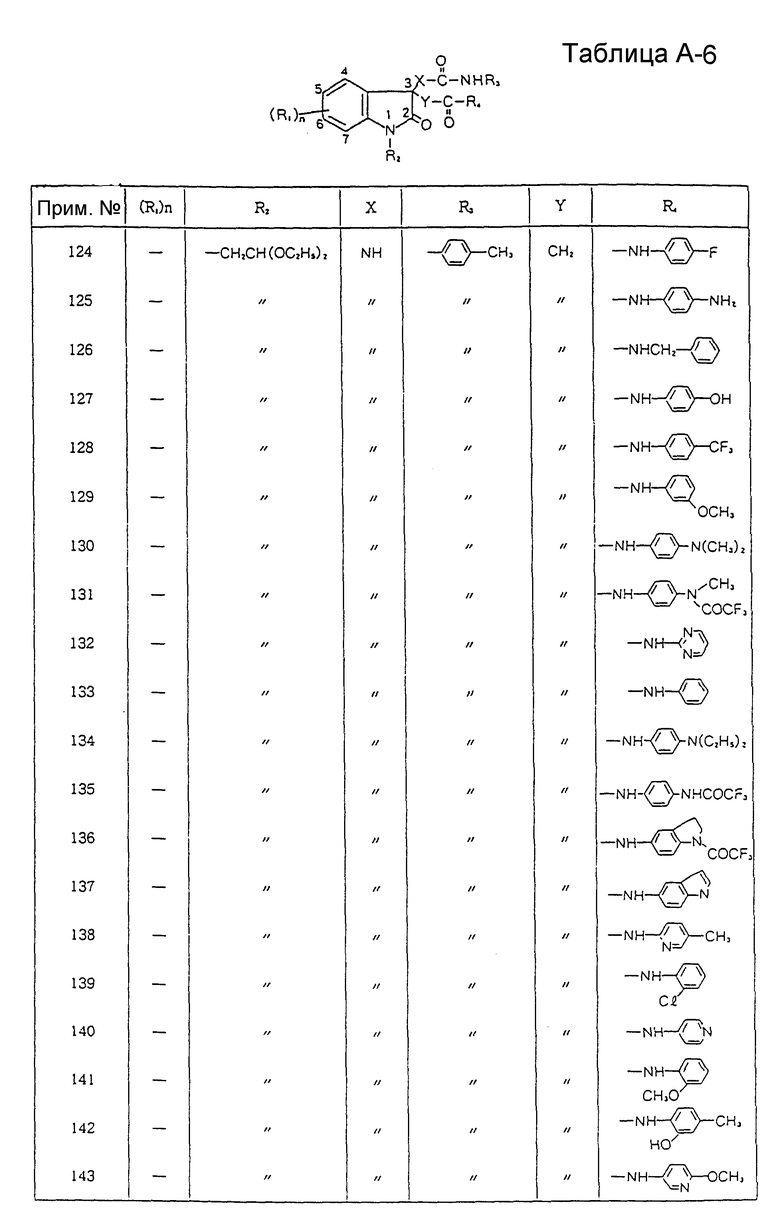
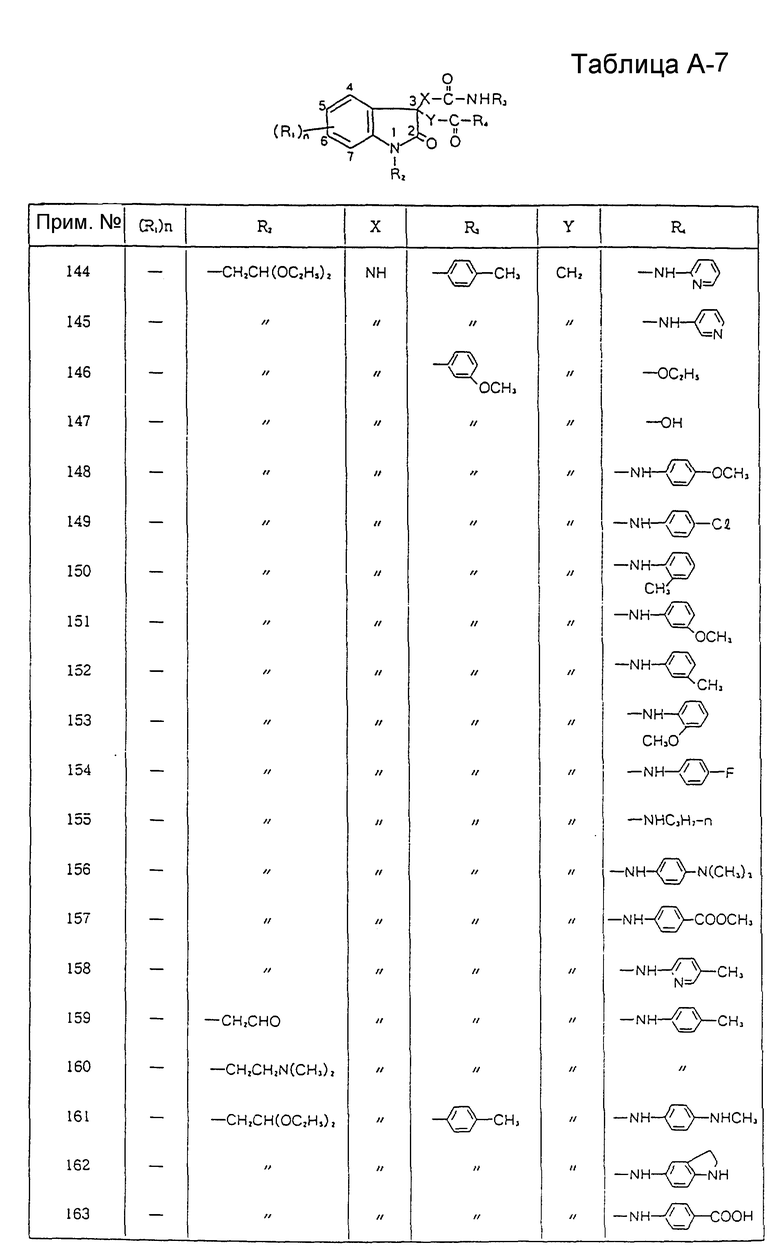
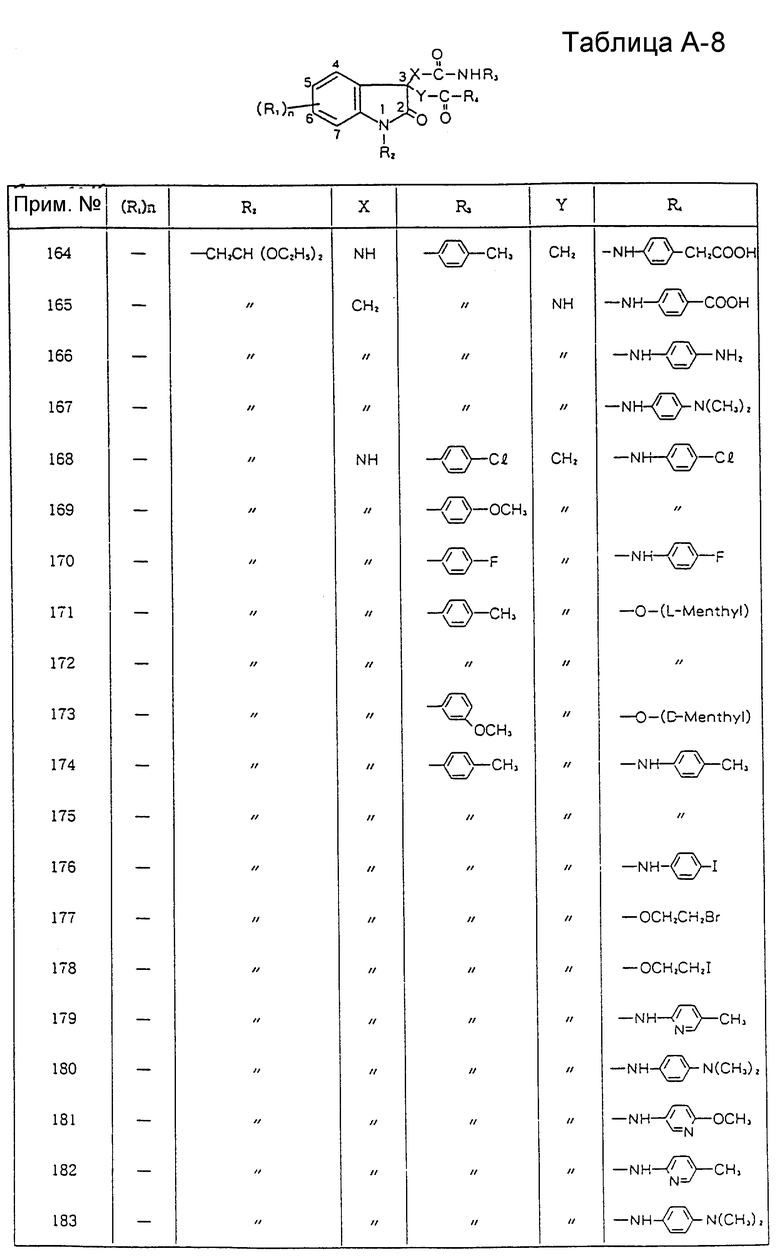
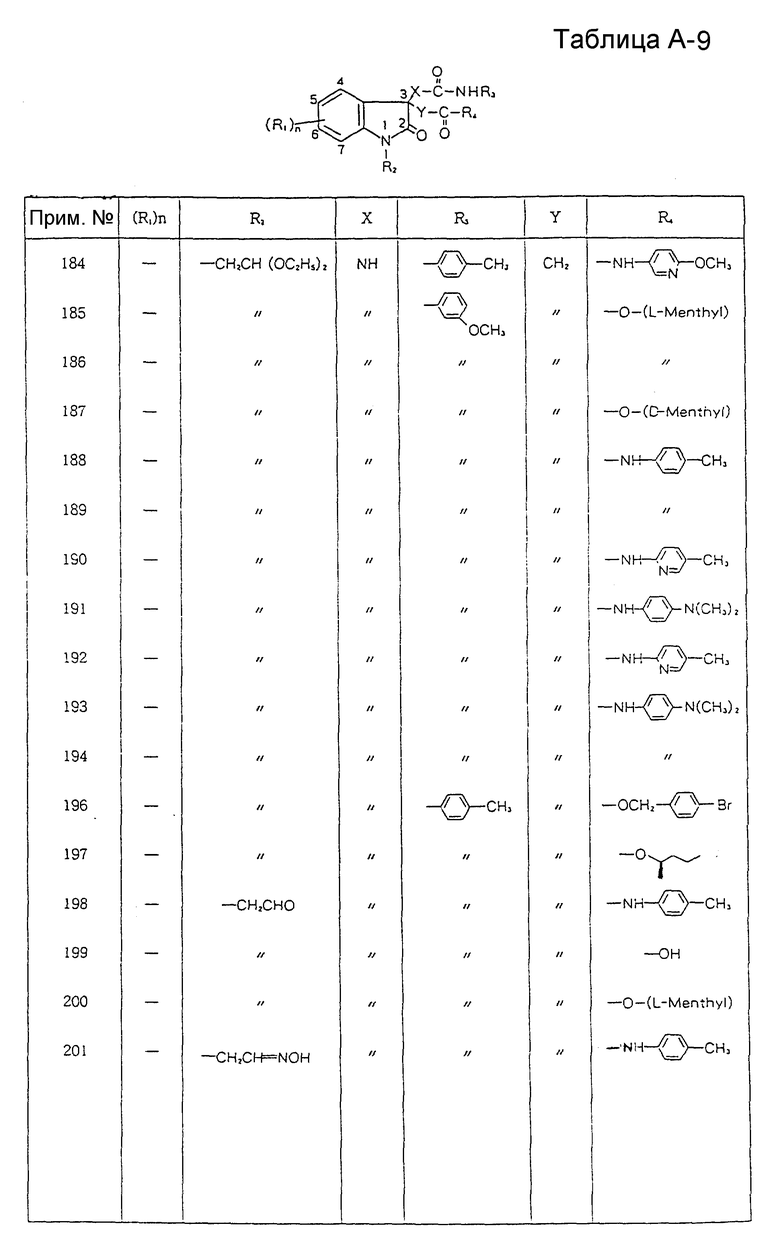
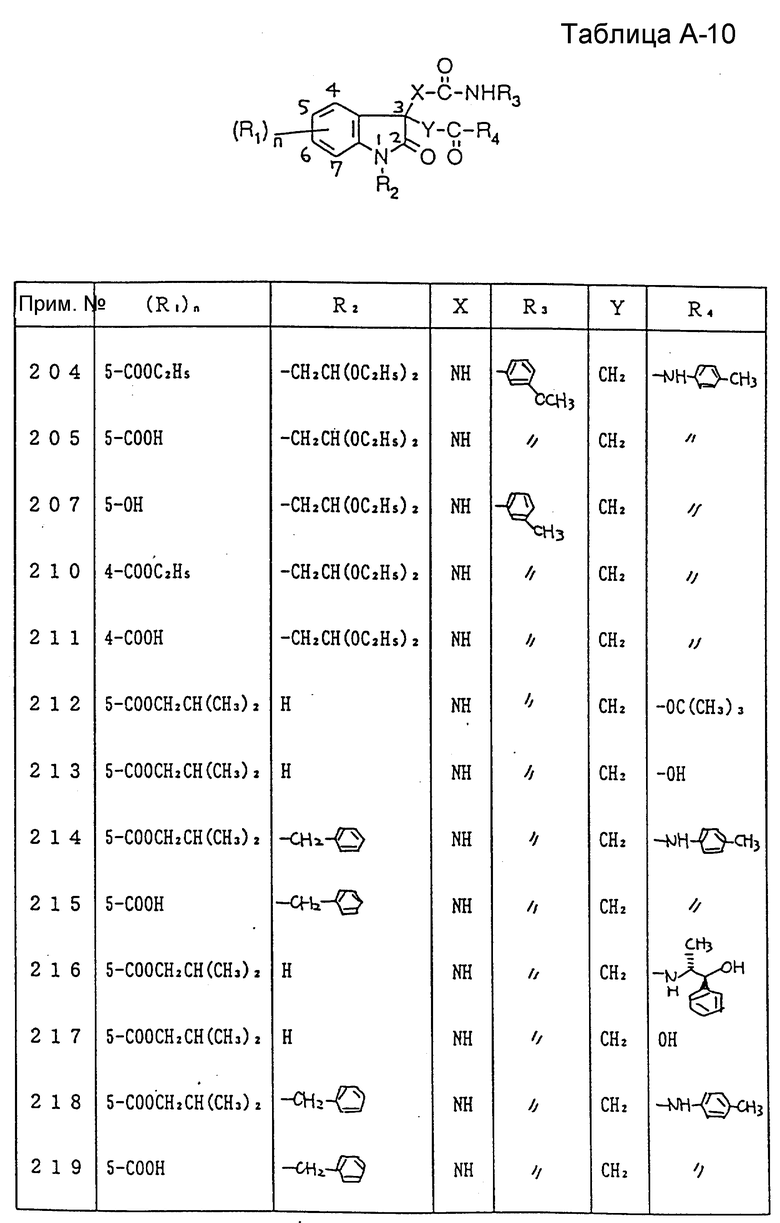

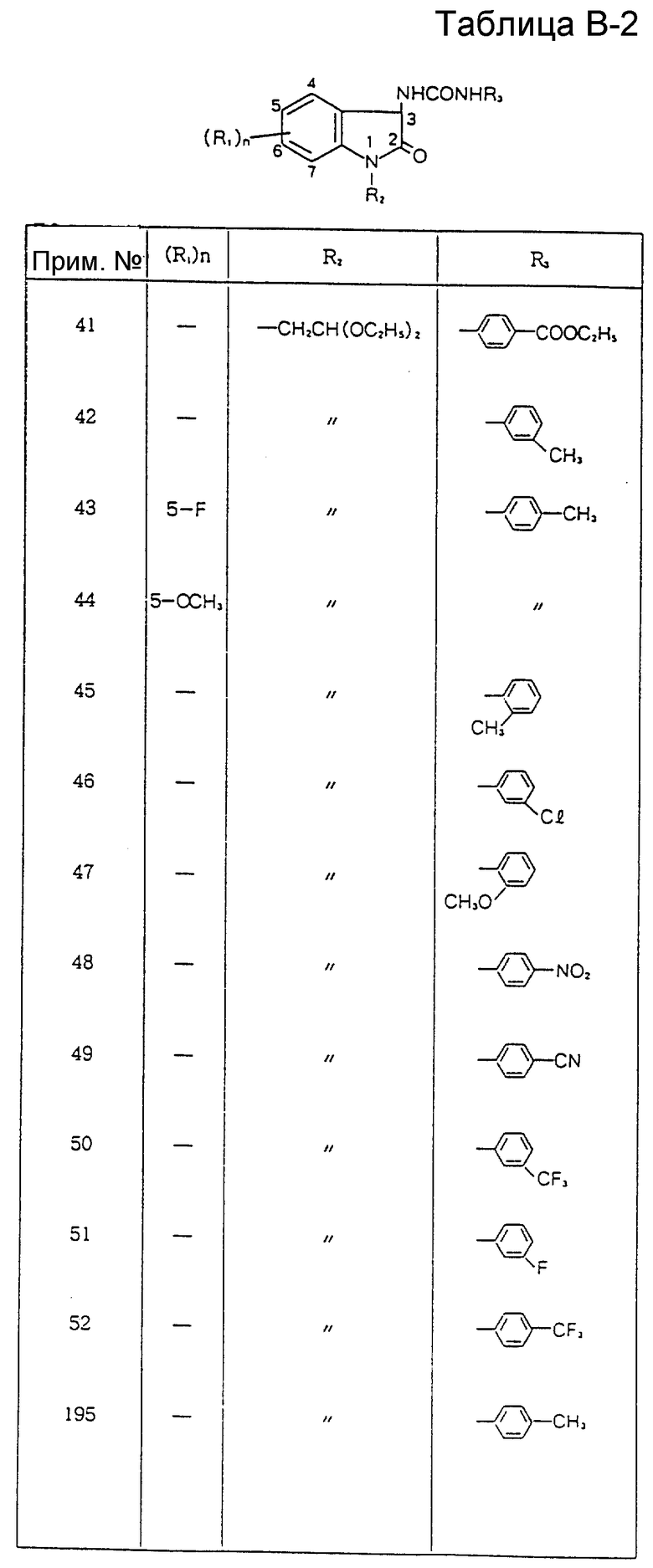
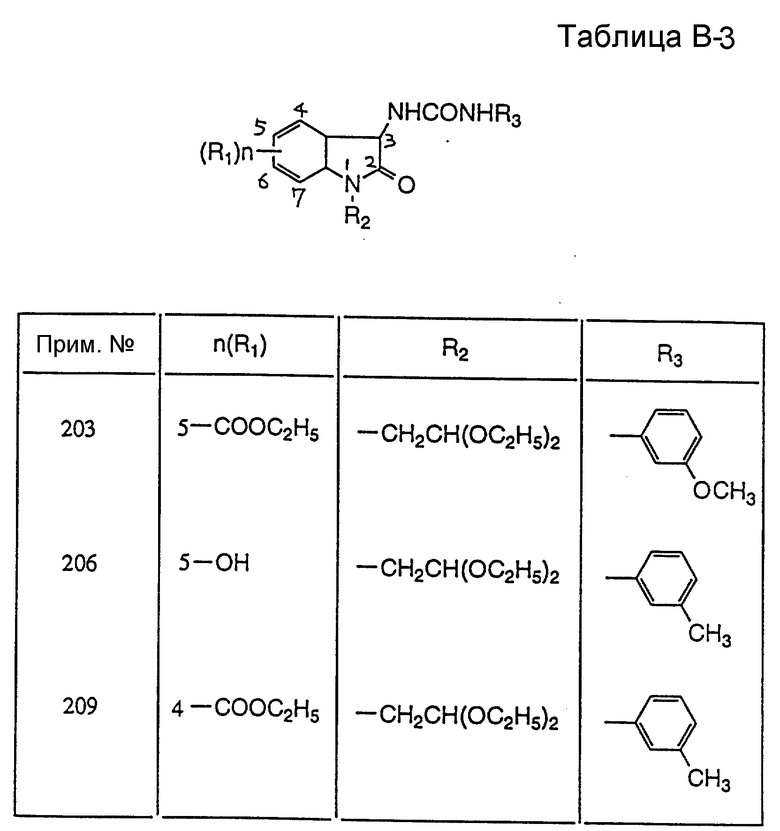
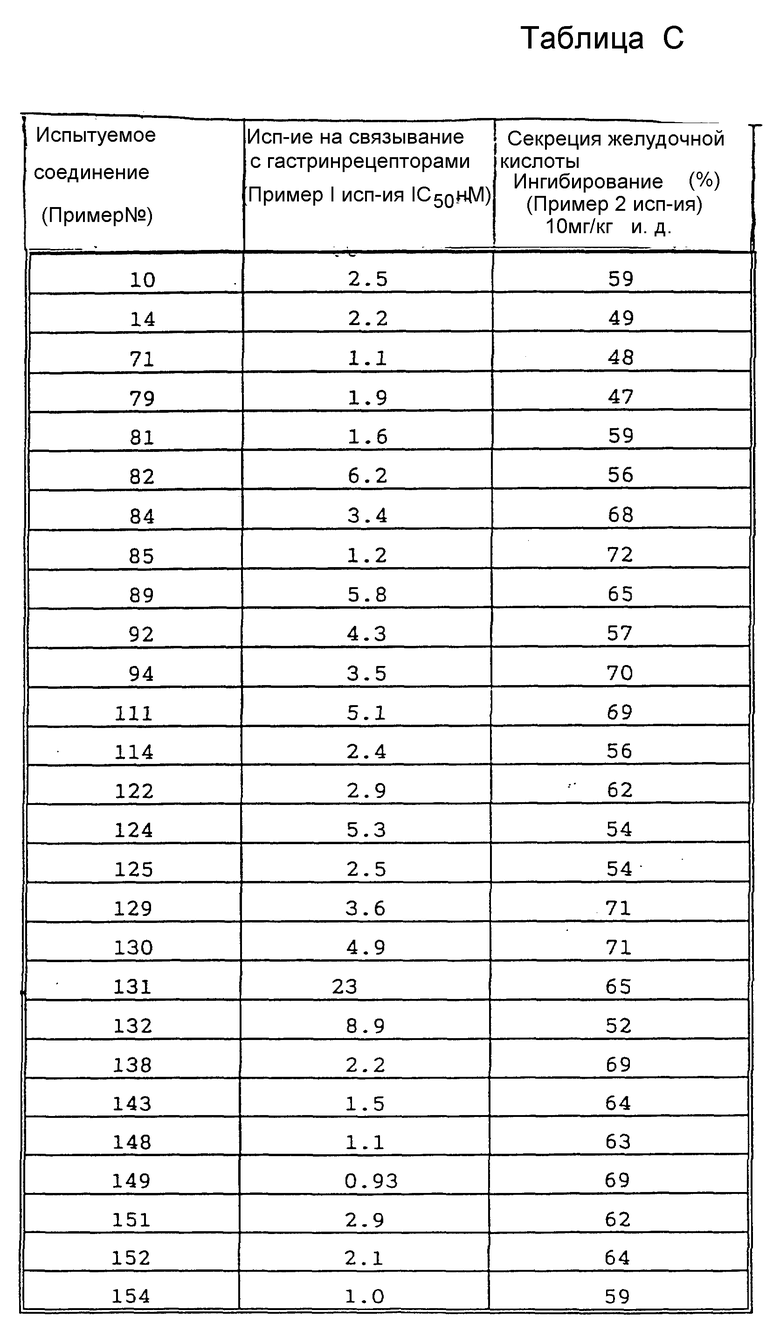
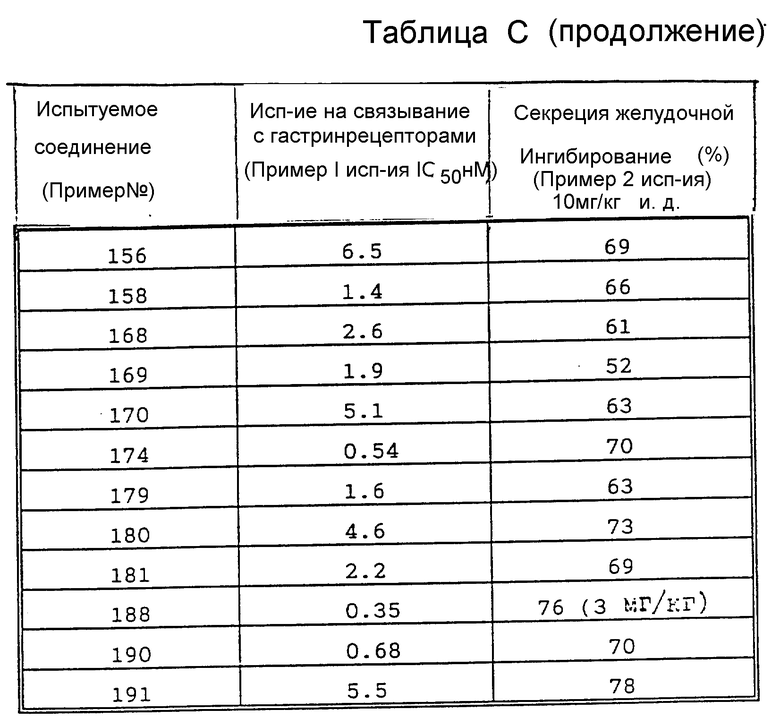
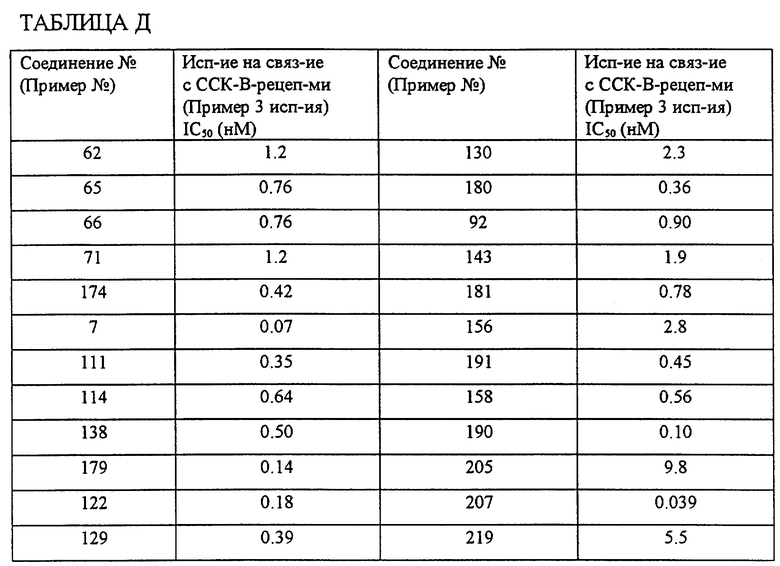
Производные индолина общей формулы 1, где R1 - галоген, низший алкил, низший алкокси, ОН, NO2, алкоксикарбонил, СООН, R2 - Н, замещенный или незамещенный низший алкил, замещенный или незамещенный низший алкенил, замещенный или незамещенный арил; R3 - замещенный или незамещенный низший алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный арил; R4 - замещенный или незамещенный низший алкил, замещенный или незамещенный арил, OR5, -NR6R7, где R5, R6, R7 могут быть одинаковыми или различными и каждый представляет Н, замещенный или незамещенный низший алкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный арил, замещенный или незамещенный пиридил, пиримидил, индолил, индолинил или низшая алкоксигруппа, или R6 и R7 взятые вместе образуют -(CH2)m- или -(CH2)lNR8- (CH2)h (где h, l, m каждый, равны 1-8, R8 - Н, низший алкил), Х и Y могут быть одинаковыми или различными и каждый представляет -СН2-, -NH-, -O-; n = 0-4. Соединения проявляют избирательный антагонизм к гастрин рецепторам. Соединения формулы II и V, где R1, R3, n имеют значения, указанные выше; R9 - группа формулы III: -СН2СН(OR10)(OR11); R10 и R11 - каждый незамещенный или замещенный низший алкил; Ra - низший алкил, аралкил, используют в качестве промежуточных соединений для получения производных индола формулы I. 3 с. и 9 з.п.ф-лы, 8 ил.,13 табл.
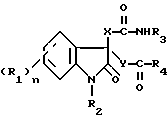
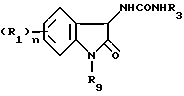
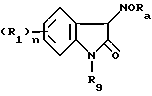
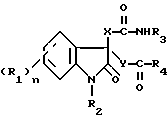
где R1 представляет атом галогена, низшую алкильную группу, низшую алкоксигруппу, гидроксильную группу, нитрогруппу, алкоксикарбонильную группу или карбоксильную группу;
R2 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную низшую алкенильную группу или замещенную или незамещенную арильную группу;
R3 представляет замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную циклоалкильную группу или замещенную или незамещенную арильную группу;
R4 представляет замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную арильную группу, OR5 или -NR6R7, где R5, R6 и R7 могут быть одинаковыми или различными и каждый представляет атом водорода, замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную циклоалкильную группу, замещенную или незамещенную арильную группу, замещенную или незамещенную пиридильную, пиримидильную, индолильную или индолинильную группу или низшую алкоксигруппу или R6 и R7, взятые вместе, образуют -(CH2)m - или (CH2)lNR8 (CH2)k - (где k, l и m, каждый, равны целому числу от 1 до 8 и R8 представляет атом водорода или низшую алкильную группу);
X и Y могут быть одинаковыми или различными и каждый представляет -CH2-, -NH- или -O-;
n равно целому числу от 0 до 4,
или его соль.
R1 представляет атом галогена или низшую алкильную группу;
R2 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную низшую алкенильную группу или замещенную или незамещенную арильную группу;
R3 представляет замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную циклоалкильную группу или замещенную или незамещенную арильную группу;
R4 представляет замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную арильную группу, -OR5 или -NR6R7, где R5, R6 и R7 могут быть одинаковыми или различными и каждый представляет атом водорода, замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную арильную группу, замещенную или незамещенную пиридильную, пиримидильную, индолильную или индолинильную группу или низшую алкоксигруппу или R6 и R7, взятые вместе, образуют -(CH2)m - или (CH2)lNR8 (CH2)k - (где k, l и m, каждый, равны целому числу от 1 до 8 и R8 представляет атом водорода или низшую алкильную группу);
X представляет -CH2-, -NH- или -O-;
Y представляет -CH2-, -NH-;
n = 0 или 1.
R1 представляет атом галогена, низшую алкильную группу или нитрогруппу;
R2 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную низшую алкенильную группу или замещенную или незамещенную арильную группу;
R3 представляет замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную циклоалкильную группу или замещенную или незамещенную арильную группу;
R4 представляет замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную арильную группу, -OR5 или -NR6R7, где R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу или замещенную или незамещенную циклоалкильную группу и R6 и R7 могут быть одинаковыми или различными и каждый представляет атом водорода, замещенную или незамещенную низшую алкильную группу, замещенную или незамещенную арильную группу, замещенную или незамещенную пиридильную, пиримидильную, индолильную или индолинильную группу или низшую алкоксигруппу.
R1 представляет метильную группу;
R2 представляет замещенную или незамещенную низшую алкильную группу;
R3 представляет замещенную или незамещенную низшую арильную группу;
R4 представляет NR6R7, где R6 и R7 могут быть одинаковыми или различными и каждый представляет атом водорода, замещенную или незамещенную арильную группу или замещенную или незамещенную пиридильную, пиримидильную, индолильную или индолинильную группу;
X и Y могут быть одинаковыми или различными и каждый представляет -CH2-, -NH-;
n = 0 или 1.
R3 представляет арильную группу, арильную группу, имеющую низшую алкильную группу, или арильную группу, имеющую низшую алкоксигруппу;
R4 представляет NR6R7, где R6 и R7 одинаковые или различные и каждый представляет атом водорода, арильную группу, арильную группу, имеющую низшую алкильную группу, арильную группу, имеющую низшую алкоксигруппу, или арильную группу, имеющую гидроксильную группу;
X и Y могут быть одинаковыми или различными, каждый представляет -CH2-, -NH-;
n = 0.
R2 представляет низшую алкильную группу, имеющую две алкоксигруппы или -O-Z-O- группу (где Z представляет замещенную или незамещенную низшую алкиленовую группу) на одном атоме углерода;
R3 представляет фенильную группу, фенильную группу, имеющую низшую алкильную группу, или фенильную группу, имеющую низшую алкоксигруппу; ;
R4 представляет NR6R7, где R6 представляет атом водорода и R7 представляет фенильную группу, фенильную группу, имеющую низшую алкильную группу, фенильную группу, имеющую низшую алкоксигруппу, или фенильную группу, имеющую гидроксильную группу;
X представляет -NH-;
Y представляет -CH2-;
n = 0.
R2 представляет группу формулы (III)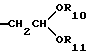
где R10 и R11, каждый, представляют замещенную или незамещенную низшую алкильную группу,
или группу формулы (IV)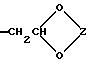
где Z представляет замещенную или незамещенную низшую алкиленовую группу.
10 Производное индолин-2-она по любому из пп.1 - 9, представляющее собой оптически активный изомер.

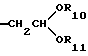

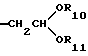
Приоритет по пунктам и признакам:
17.02.93 - по пп.1 - 12, кроме R5, R6, R7 - замещенный или незамещенный циклоалкил;
31.05.93 - по пп.1 - 12, где R5, R6, R7 - замещенный или незамещенный циклоалкил.
| JP, выложенная заявка 238069/88, 1988 Машковский М.Д | |||
| "Лекарственные средства", Москва, Медицина, 1972, ч.2, с.157 - 159, 350, 454, 471. |
Авторы
Даты
1999-03-27—Публикация
1994-02-17—Подача