Данное изобретение относится к соединениям общей формулы I и их фармацевтически приемлемым солям или каждому возможному стереоизомеру и оптическому изомеру их, которые оказывают ингибирующее действие на кальциевые перегрузки в дополнение к сосудорасширяющей активности /антагонизм кальцию/ и ингибирующему действию на липидное переокисление и являются полезными в качестве профилактических или лечебных средств в случае ишемических болезней и гипертензии (артериальной гипертонии).
Процесс повреждений клеток вследствие ишемии в широком смысле подразделяется на две категории: 1/ повреждения, вызываемые снижением уровня внутриклеточного АТР или увеличением внутриклеточной концентрации кальция и проч. при недостаточном доступе кислорода во время ишемии, и 2/ повреждения, вызываемые увеличением притока кальция или продуцирования свободных радикалов, и др., с последующей реперфузией или восстановлением кровяных сосудов после ишемии (Yoshiwara et al., Metabolism and disease, 29, 379 /1992/). В качестве типичных ишемических болезней могут быть приведены сердечнососудистые заболевания, такие как различные формы стенокардии, нестабильная стенокардия и аритмия, вызываемая восстановлением коронарных сосудов с помощью PTCA/PTCR/CABG и др. или цереброваскулярные заболевания, такие как преходящее нарушение мозгового кровообращения; травматические повреждения головы и осложнения после мозговой хирургии. При лечении вариантной стенокардии или нестабильной стенокардии используются нитро соединения, примерами которых являются нитроглицерин и никорандил, и кальциевые антагонисты, примерами которых являются дильтиазем, нифедипин и верапамил, а для облегчения инфаркта миокарда или коронарных реперфузионных повреждений с последующим PTCA/PTCR/CABG и др. исследуется использование ингибиторов 5-липоксигеназы или акцепторов радикалов. В качестве профилактических и лечебных средств для случаев ишемических сосудистомозговых заболеваний исследовались и использовались глицеол (зарегистрированная торговая марка), озагрел, низофенон, тиклопидин, никаравен и др. с целью снижения случаев отека мозга или спазм мозговых сосудов на острой стадии травм мозговых сосудов. На хронической стадии использовались и используются усилители мозгового кровоснабжения, такие как антагонисты кальция, примерами которых являются никардипин, циннаризин и флунаризин, усилители мозгового кровоснабжения (циркуляции) со стимулирующим действием на метаболизм, такие как винпоцетин, ницерголин, пентоксифиллин, и ифенпродил, или церебральные метаболические активаторы, такие как идебенон, GABA, и госпатенат кальция, для того, чтобы увеличить проток крови или улучшить метаболическое состояние в тканях, которые пережили ишемические повреждения.
На основе обширных и интенсивных исследований по поиску эффективных профилактических и лечебных средств для случаев ишемических болезней или гипертензии, которые способны были бы подавлять генерацию активного кислорода и увеличение внутриклеточной концентрации кальция, которые считаются главными причинами ишемических болезней и гипертензии, настоящие изобретатели обнаружили соединения, представленные формулой I, обладающие сосудорасширяющей активностью (кальциевый антагонизм), ингибирующим действием на липидное переокисление и кальциевые перегрузки, и в результате создали настоящее изобретение.
Настоящее изобретение предоставляет соединения общей формулы I.
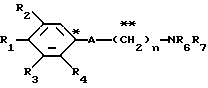
где R1 представляет атом водорода, гидроксильную группу, ацилокси группу, имеющую 1-9 атомов углерода, или низшую алкокси группу, имеющую 1-6 атомов углерода;
R2 и R3 которые могут быть одинаковыми или различными, каждый представляет атом водорода, гидроксильную группу, атом галогена, низшую алкильную группу, имеющую 1-6 атомов углерода, или низшую алкокси группу, имеющую 1-6 атомов углерода;
R4 представляет атом водорода, низшую алкильную группу, имеющую 1-6 атомов углерода;
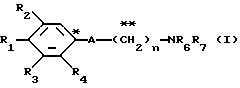
A представляет фрагмент, представленный формулой II.
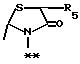
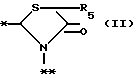
в которой R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1-6 атомов углерода, замещенную или незамещенную низшую алкенильную группу, имеющую 2-6 атомов углерода, замещенную или незамещенную алкокси группу, имеющую 1-6 атомов углерода, замещенную или незамещенную арильную группу или замещенную или незамещенную гетероциклическую группу, или R5 образует 5- или 6-членное кольцо, содержащее два или более атомов кислорода или серы, в случае которого атом углерода, к которому оно присоединено, является спиро атомом; или фрагмент, представленный формулой III
B,
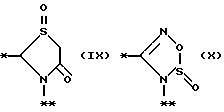
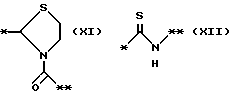
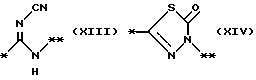
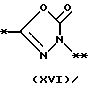
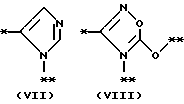
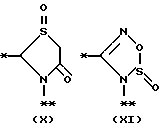
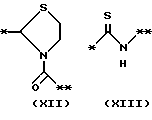
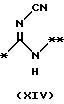
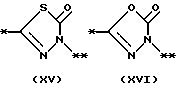
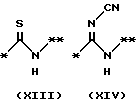
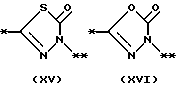
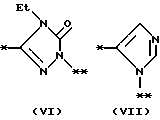
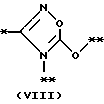
причем B представляет фрагмент, выбранный из группы следующих фрагментов формул IV-XIV.
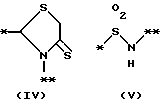
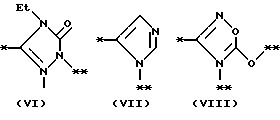
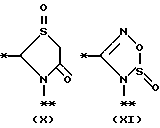
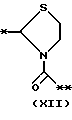
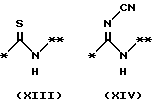
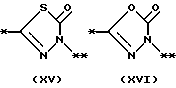
R6 и R7, которые могут быть одинаковыми или различными, каждый представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1-6 атомов углерода, замещенную или незамещенную низшую алкенильную группу, имеющую 2-6 атомов углерода, замещенную или незамещенную арильную группу или необязательно замещенную гетероциклическую группу, при условии, что R6 и R7 одновременно не являются метильными группами, или R6 и R7, взяты вместе с образованием замещенного или незамещенного кольца, которое может быть сконденсированным кольцом;
n = 3, 4, 5 или 6, и их фармацевтически приемлемые соли или возможные стереоизомеры или оптические изомеры их.
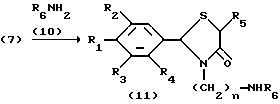
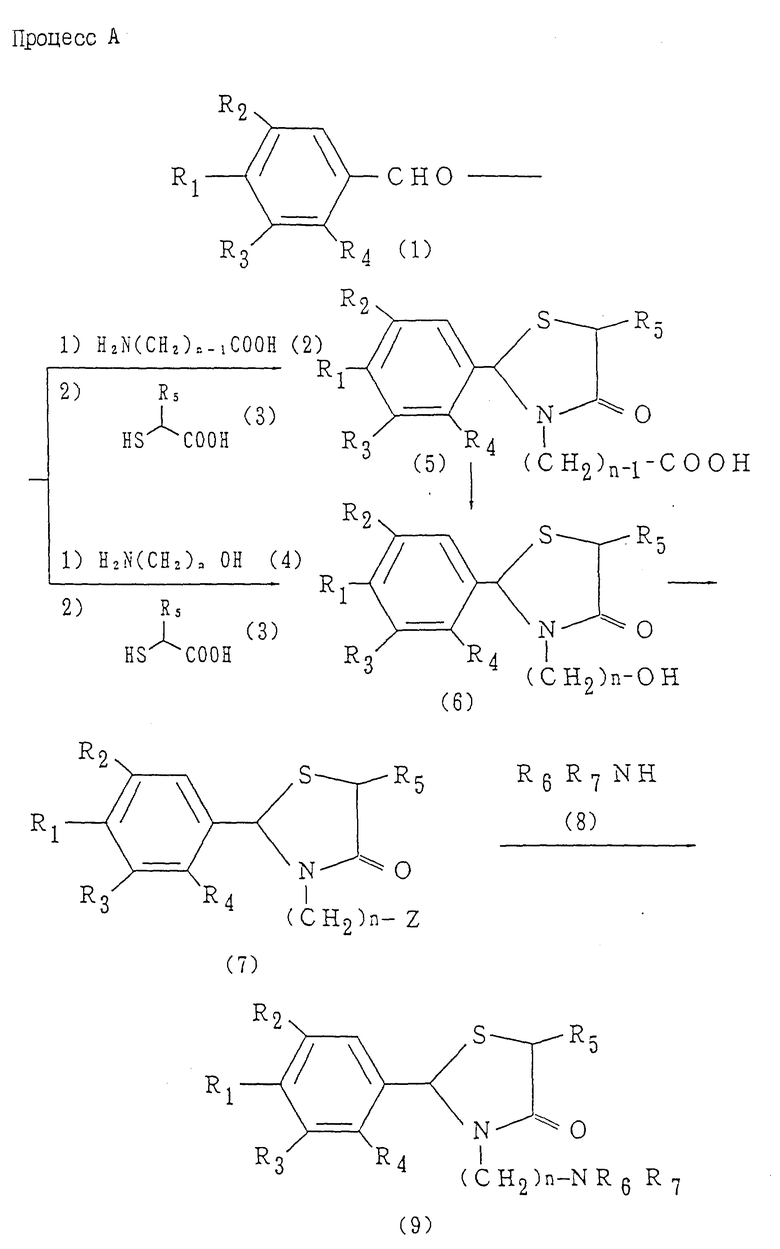
Соединение, представленное формулой I, может быть получено с помощью следующих процессов A-Q (схему процесса A см. в конце описания).
На схеме процесса A R1 представляет атом водорода, гидроксильную группу, ацилокси группу, имеющую 1-9 атомов углерода, или низшую алкокси группу, имеющую 1-6 атомов углерода; R2 и R3, которые могут быть одинаковыми или различными, каждый представляет атом водорода, гидроксильную группу, атом галогена, низшую алкильную группу, имеющую 1-6 атомов углерода, или низшую алкокси группу, имеющую 1-6 атомов углерода; R4 представляет атом водорода, низшую алкильную группу, имеющую 1-6 атомов углерода; R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода, замещенную или незамещенную низшую алкенильную группу, имеющую 2-6 атомов углерода, замещенную или незамещенную арильную группу или замещенную или незамещенную гетероциклическую группу; R6 и R7, которые могут быть одинаковыми или различными, каждый представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1-6 атомов углерода, замещенную или незамещенную алкенильную группу, имеющую 2-6 атомов углерода, замещенную или незамещенную арильную группу или замещенную или незамещенную гетероциклическую группу, при условии, что R6 и R7 не представляют одновременно метильную группу, или R6 и R7 взяты вместе, образуя замещенное или незамещенное кольцо, которое может быть сконденсированным кольцом; n = 2, 3, 4, 5 или 6; Z - атом галогена.
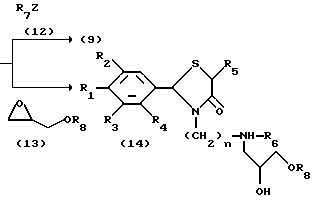
На схеме процесса В R1-R7 и n имеют те же значения, что определены ранее; R8 представляет замещенную или незамещенную арильную группу или замещенную или незамещенную гетероциклическую группу; Z - атом хлора или атом брома.
Процесс C: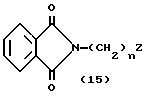
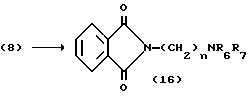
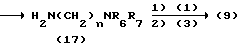
На схеме процесса C R1 - R8, n и Z, имеют те же значения, что определены ранее.
Процесс D.
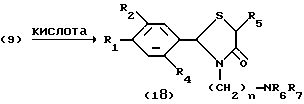
На схеме процесса D R1 - R7 и n имеют те же значения, что определены ранее.
Процесс Е.
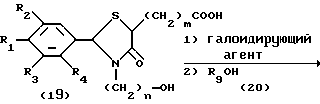
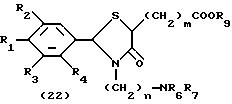
На схеме процесса E R1 - R7, n и Z имеют те же значения, что определены ранее; R9 представляет алкильную группу, имеющую 1-6 атомов углерода: и m= 1-7, целое число.
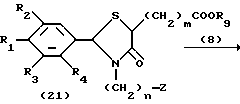
Процесс F.
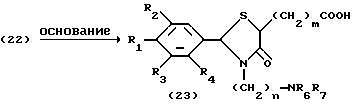
На схеме процесса F R1 - R9, n и m имеют те же значения, что определены ранее.
Процесс G: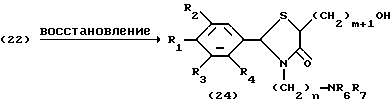
На схеме процесса G R2 - R9, n и m имеют значения, определенные ранее.
Процесс Н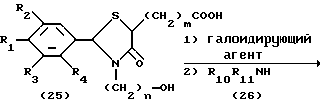
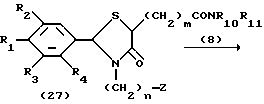
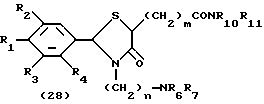
На схеме процесса Н R1 - R7, Z, n и m имеют значенияЮ определенные ранее; и R10 R11, которые могут быть одинаковыми или различными, каждый представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1-6 атомов углерода, замещенную или незамещенную низшую алкенильную группу, имеющую 2-6 атомов углерода, замещенную или незамещенную арильную группу или замещенную или незамещенную гетероциклическую группу, или R10 и R11 взяты вместе, образуя замещенное или незамещенное кольцо, которое может быть сконденсированным кольцом.
Процесс I: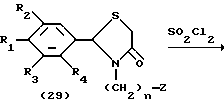
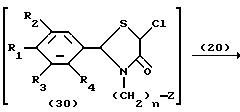
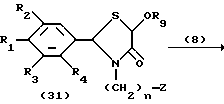
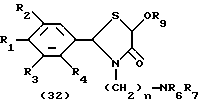
На схеме процесса I R1 - R7, Z и m имеют значения, определенные ранее; и R9 представляет замещенную или незамещенную низшую алкильную группу, имеющую 1-6 атомов углерода.
Процесс J: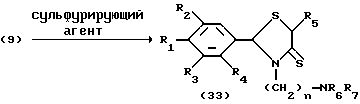
На схеме процесса J R1 - R7 и n имеют значения, определенные ранее.
Процесс K: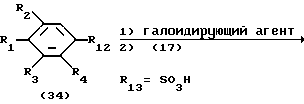
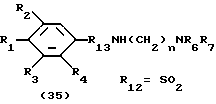
На схеме процесса K R1 - R4, R6, R7 и n имеют значения, определенные выше; R12 представляет карбоксильную группу или сульфонильную группу и R13 представляет карбонильную и сульфонильную группу,
Процесс L: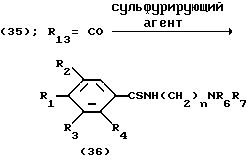
На схеме процесса L R1 - R4, R6 и R7 и n имеют значения, определенные ранее; и R13 - представляет карбонильную группу.
Процесс M: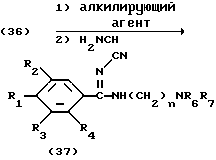
На схеме процесса M R1 - R4, R6, R7 и n имеют ранее указанные значения.
Процесс N: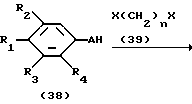
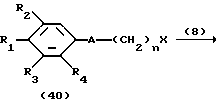
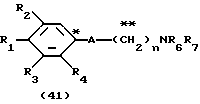
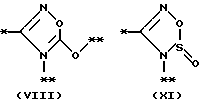
На схеме процесса N R1 - R4, R6, R7 и n имеют значения, определенные ранее; A представляет фрагмент, выбранный из группы следующих фрагментов, представленных формулами VI, VIII, XI, XV и XVI: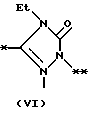
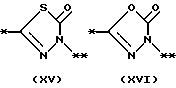
и X - атом хлора или брома.
Процесс О:
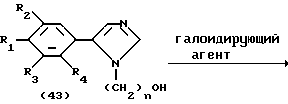
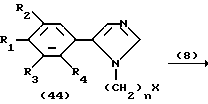
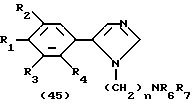
На схеме процесса O R1 - R4, R6 и R7 имеют значения, определенные ранее.
Процесс P: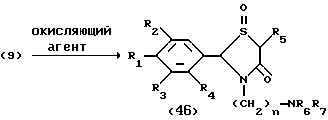
На схеме процесса P R1 - R4 и n имеют ранее указанные значения.
Процесс Q: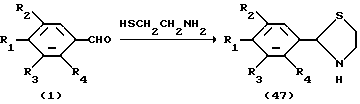
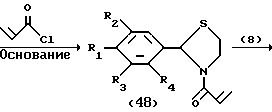
На схеме процесса Q R1 - R4, R6 и R7 имеют значения, определенные ранее.
Условия реакций, подобранные для каждого из процессов A - Q, приведены в табл. I - IX.
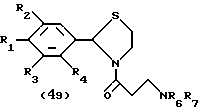
Процесс A:
Условия реакции для каждой стадии процесса A см. в табл.I.
Примечание: *: Рацемическая смесь /5/ может разделяться с использованием оптически активного органического основания, такого как бруцин, цинхонидин, эфедрин или хинин, давая оптически активную форму соединения /5/.
**: Хотя может использоваться любой метод, обычно применяемый для восстановления карбоновой кислоты в спирт, реакция предпочтительно осуществляется с помощью сначала превращения /5/ в смешанный ангидрид с использованием этилхлоркарбоната и др., с последующим восстановлением с помощью боргидрида натрия. Боргидрид натрия используется в количестве от 1 до 30 молярных эквивалентов, предпочтительно 10 молярных эквивалентов.
***: Реакция предпочтительно осуществляется в присутствии иодида калия.
Процесс B:
Условия реакции для каждой стадии процесса B см. в табл.II.
Примечание: *: Реакция предпочтительно осуществляется в присутствии иодида калия,
Процесс C: * Реакция предпочтительно осуществляется в присутствии иодида калия.
Процесс C: /8/--->/16/--->/17/--->/9/
Условия реакции каждой стадии процесса C см. в табл.III.
Процесс D: /9/--->/18/
Условия реакции процесса D.
Стадия: /9/--->/18/
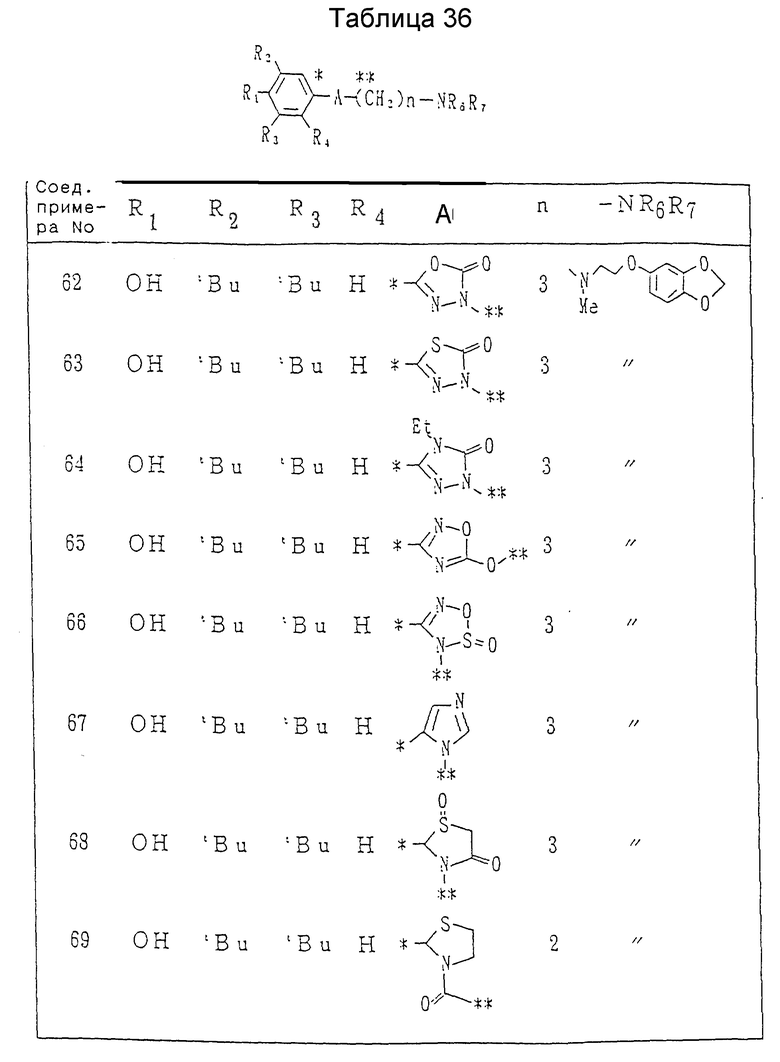
Растворитель: вода или кислота (кислотой предпочтительно является уксусная или соляная кислота).
Температура реакции: -10oC до температуры дефлегмации (предпочтительно 0-50oC).
Время реакции: от 2 до 15 дней (предпочтительно 4-10 дней).
Кислота: неорганическая кислота (предпочтительно 47% бромистоводородная кислота).
Процесс E: /19/--->/21/--->/22/
Условия реакции каждой стадии процесса E см. в табл.IV.
Примечание: *: Реакция предпочтительно осуществляется в присутствии иодида калия.
Процесс F: /22/--->/23/
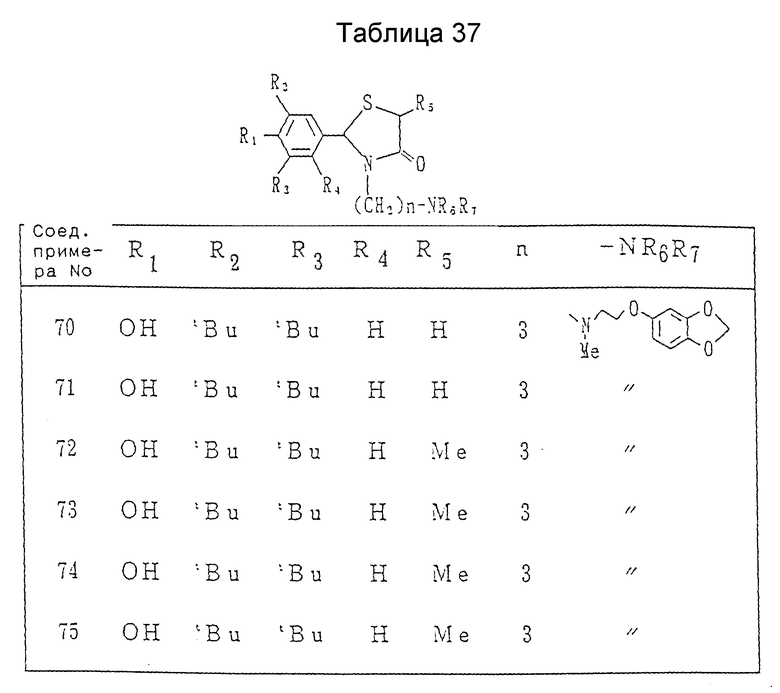
Условия реакции процесса F (/22/--->/23/)
Растворитель: вода или спиртовый растворитель (предпочтительно метанол, содержащий воду, или этанол, содержащий воду).
Температура реакции: -10oC до температуры дефлегмации (предпочтительно от комнатной до температуры дефлегмации).
Время реакции: 1-48 часов (предпочтительно, 6-24 часа)
Основание или кислота: водный раствор неорганического основания, например, гидроокиси натрия или гидроокиси калия или неорганическая кислота, например, серная или соляная кислота.
Процесс G: /22/--->/24/
Условия реакции процесса G [(22)--->(24)]
Растворитель: инертный растворитель (предпочтительно ТГФ, диэтиловый эфир или толуол)
Температура реакции: - 78oC до температуры дефлегмации (предпочтительно от -78oC до комнатной температуры)
Время реакции: 0,1 - 24 часа (предпочтительно 5 часов)
Восстанавливающий агент: литийалюминийгидрид, боргидрид лития, DIBAL комплекс боран-ТГФ, и др.
Процесс H; /25/--->/27/--->/28/
Условия реакции на каждой стадии процесса H см. в табл. V.
Примечание: * Реакция предпочтительно осуществляется в присутствии иодида калия.
Процесс I: /29/--->/30/--->/31/--->/32/
Условия реакции на каждой стадии процесса I см. в табл. VI.
Примечание: *: Реакция предпочтительно осуществляется в присутствии йодистого калия.
Процесс J: /9/--->/33/
Условия реакции процесса J [(9)--->(33)]
Растворитель: инертный растворитель (предпочтительно дихлорметан, хлороформ или ТГФ)
Температура реакции: -10oC - температура дефлегмации (предпочтительно от 0 до 50oC)
Время реакции: 0.5 - 48 часов (предпочтительно 2-10 часов)
Реагент: сульфурирующий агент (предпочтительно пятисернистый фосфор или реагент Лоуссона)
Процесс K: /34/--->/35/
Условия реакции процесса K [(34)--->(35)]
Растворитель: инертный растворитель (предпочтительно ТГФ, диэтиловый эфир, дихлорметан или хлороформ)
Температура реакции: - 10oC до температуры дефлегмации (предпочтительно от 0oC до температуры дефлегмации)
Время реакции: 0,5 - 48 часов (предпочтительно 1-24 часа)
Галоидирующий агент: тионилхлорид, оксалилхлорид, треххлористый фосфор, трехбромистый фосфор, и др. (Примечание: Реакция предпочтительно осуществляется в присутствии каталитического количества ДМФ).
Основание: неорганическое основание или органическое основание (предпочтительно пиридин или триэтиламин)
Процесс L; (35)--->(36)
Условия реакции процесса L [(35)--->(36)]
Растворитель: Инертный растворитель (предпочтительно дихлорметан или хлороформ)
Температура реакции: -10oC - температура дефлегмации (предпочтительно 0 - 50oC)
Время реакции: 0.5 - 48 часов (предпочтительно 2-10 часов)
Сульфурирующий агент: пятисернистый фосфор или реагент Лоуссона
Процесс M; (36)--->(37)
Условия реакции процесса M [(36)--->(37)]
Растворитель: инертный растворитель (предпочтительно, ТГФ)
Температура реакции: -10oC - температура дефлегмации (предпочтительно, от 0oC до температуры дефлегмации)
Время реакции: 0,5 - 48 часов (предпочтительно 5-24 часа)
Основание: неорганическое или органическое основание (предпочтительно гидрид натрия или диизопропиламид лития) \\\ Алкилирующий агент: алкилгалогенид (предпочтительно этилиодид)
Процесс N; /38/--->/40/--->/41/
Условия реакции каждой стадии процесса N см. в табл. VII.
Примечание: * Реакция предпочтительно осуществляется в присутствии йодистого калия.
Процесс O; /42/--->/43/ /44/--->/45/
Условия реакции каждой стадии процесса O см. в табл. VIII.
Примечание: *: Реакция предпочтительно осуществляется в присутствии йодистого калия.
Процесс P: (9)--->(46)
Условия реакции процесса P [(9)--->(46)]
Стадия: (9)--->(46)
Растворитель: органическая кислота (предпочтительно уксусная кислота)
Температура реакции: -5 - 40oC (предпочтительно комнатная температура)
Время реакции: 0,5 - 48 часов (предпочтительно 6 - 12 часов)
Окисляющий агент: перекись водорода или органическая надкислота
Процесс Q: /1/--->/47/ /48/--->/49/
Условия реакции на каждой стадии процесса Q см. в табл. IX.
Соединение формулы I согласно настоящему изобретению содержит один или два асимметричных атома углерода в своей структуре, и чистые стереоизомеры или оптические изомеры могут получаться с помощью методов, известных в технике. Например, каждый энантиомер может отделяться с помощью хроматографии с использованием ВЭЖХ колонки для оптического разделения или с помощью фракционной кристаллизации с использованием оптически активной кислоты, предпочтительно кислого (R)-(-)-1,1'-бинафтил-2,2'-диил-фосфата. Упомянутые выше приемы разделения оптических изомеров применимы не только к конечным продуктам, но также и к промежуточным продуктам, имеющим карбоксильную группу. В последнем случае могут применяться обычно используемые оптически активные основания, такие как бруцин. Аналогичным образом диастереомерные смеси, включающие как цис-, так и транс-стереоизомеры, могут разделяться на индивидуальные оптические изомеры, т.е. цис(+), цис(-) транс(+) и транс(-), с помощью общепринятых методов, известных специалистам в данной области.
Само собой разумеется, что стереоизомеры и оптические изомеры соединений формулы I также включаются в объем настоящего изобретения.
Настоящее изобретение теперь будет проиллюстрировано более подробно со ссылкой на ссылочные примеры, примеры и примеры фармакологических испытаний.
В следующих ниже ссылочных примерах, примерах и таблицах 1-24 включительно данные ЯМР измерялись с помощью JEOL JNM-FX200 или JEOL JNM-270, за исключением случаев, помеченных звездочкой, в которых измерения осуществлялись с использованием Хитачи R-24B (60 МГц).
В указанных выше и представленных далее таблицах используются условные обозначения и сокращения, которые расшифровываются следующим образом: and - и; brs - шир. с. (широкий синглет); d - д. (дублет); Hz - Гц (герц); m - м. (мультиплет); NMR - ЯМР; q - кв. (квартет); quint- квинт. (квинтет); S - с. (синглет); t - т. (триплет).
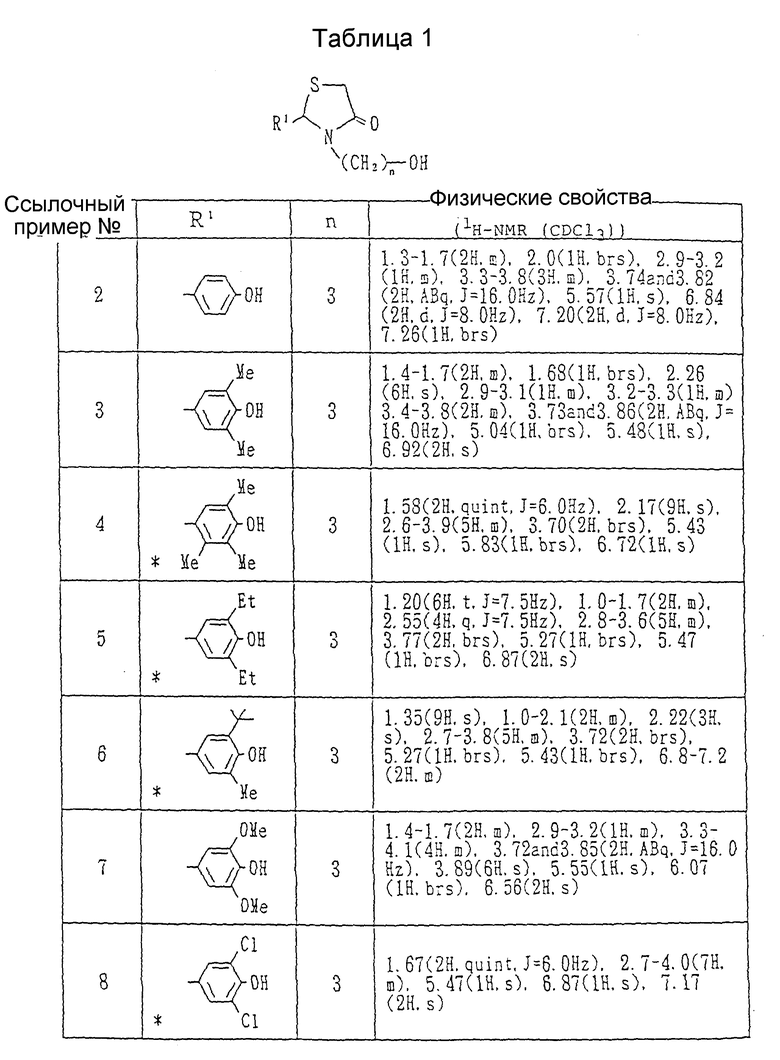
Ссылочный пример 1. Получение 2-(3,5-диизопропил-4-гидроксифенил)-3-(3-гидроксипропил)- 1,3-тиазолидин-4-он,
В бензоле /50 мл/ суспендировались 3,5-диизопропил-4- гидроксибензальдегид /5.00 г/ и 3-аминопропанол /1.82 г/ в атмосфере азота. К реактору подсоединялась ловушка Дина-Старка, и суспензия нагревалась в условиях дефлегмации (с обратным холодильником) в течение 1,5 часов. После оставления смеси охлаждаться добавлялась α- меркаптоуксусная кислота /2.23 г/, затем смесь дополнительно нагревалась с обратным холодильником в течение 2 часов. После удаления бензола с помощью выпаривания к остатку добавлялась вода /50 мл/, и смесь экстрагировалась хлороформом. Органический слой сушился над безводным сульфатом натрия, и растворитель удалялся при пониженном давлении. Остаток очищался на силикагельной хроматографической колонке (элюент; хлороформ-метанол, 99: 1), давая 1.97 г (24%) целевого соединения в виде бесцветного масла, ЯМР (CDCl3, 60 МГц) δ:
1.23 (12H, д. , J=6,6 Гц), 1.0-1.8 (2H, м.), 2.5-3.8(7H, м.), 3.73(2H, шир.с.), 5.50 (2H, шир.с.), 6.92 (2H, с.),
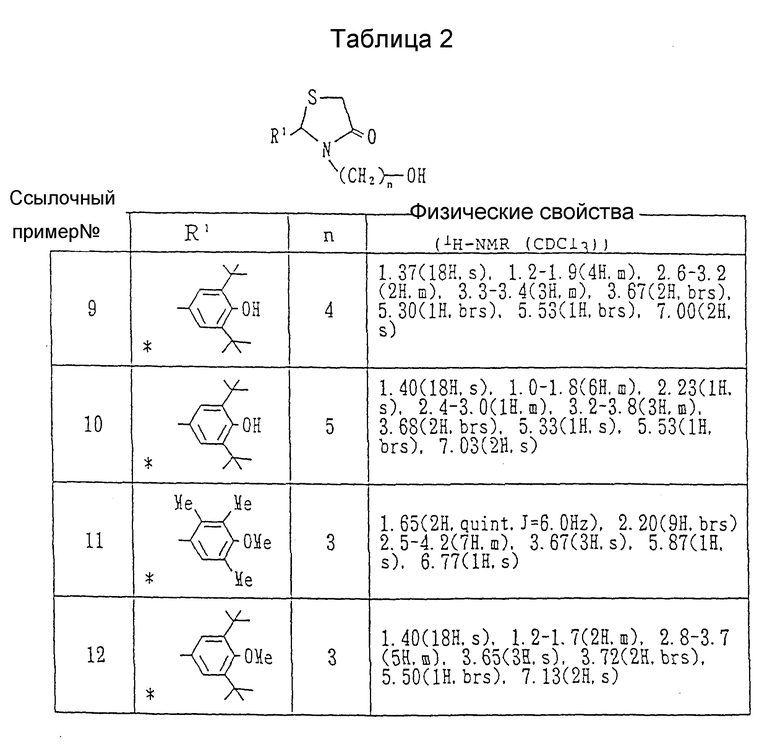
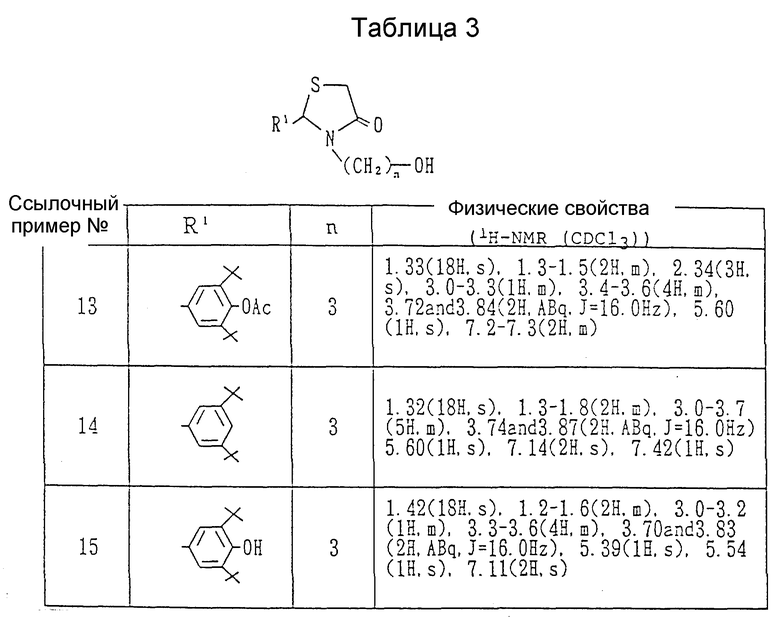
Каждый из спиртов, показанных в Таблицах 1-3, получался в соответствии с процедурой ссылочного примера 1 с использованием в каждом случае соответствующего замещенного бензальдегида и соответствующего ω- аминоалкилового спирта вместо 3,5-диизопропил-4-гидроксибензальдегида и 3-аминопропанола.
Получение 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-(3- гидроксипропил)-1,3-тиазолидин-4-она.
В атмосфере азота в бензоле /500 мл/ суспендировались 3,5-ди-трет-бутил-4-гидроксибензальдегида /50.0 г/ и β- аланин /20.0 г/. К реактору подсоединялась ловушка Дина-Старка, и суспензия нагревалась с обратным холодильником в течение 1 часа. После оставления смеси охлаждаться добавлялась α- меркаптоуксусная кислота /23.6 г/, и смесь дополнительно нагревалась с обратным холодильником в течение 24 часов. После удаления бензола выпариванием к остатку добавлялась вода /500 мл/, и смесь экстрагировалась хлороформом. Органический слой сушился над безводным сульфатом натрия, и растворитель удалялся при пониженном давлении. Остаток очищался с помощью колоночной хроматографии на силикагеле (элюент: хлороформ-метанол, 98:2), давая 54.6 г (67%) 2-(3,5-дитрет-бутил-4-гидроксифенил)- 3-(2-карбоксиэтил)-1,3-тиазолидин-4-она в виде бесцветных кристаллов, т.пл. 164-165oC.
ЯМР /CDCl3, 200 МГц/ δ:
1.42 (18H, с. ), 2.2-2.5(1H, м. ), 2.5-2.8(1H, м.), 3.0-3.3(1H, м.), 3.5-4.0 (3H, м.), 5.33 (1H, с.), 5.64(1H, с.), 7.09 (2H, с.), 8.5 (1H, шир. с.).
К раствору получающегося в результате 2-(3,5-ди-третбутил-4-гидроксифенил)-3-(2-карбоксиэтил)-1,3- тиазолидин-4-она /100 мг/ в тетрагидрофуране /3 мл/ добавлялись по каплям триэтиламин /27 мг/ и этилхлорформиат /28 мг/ при -10oC в атмосфере азота, с последующим перемешиванием при (-10) - (-5)oC в течение 1 часа. К смеси добавлялся боргидрид натрия /100 мг/, смесь перемешивалась при комнатной температуре в течение 3 часов, затем выливалась в смесь льда и воды и экстрагировалась этилацетатом. Органический слой сушился над безводным сульфатом натрия, и растворитель выпаривался при пониженном давлении. Остаток очищался с помощью колоночной хроматографии на силикагеле (элюент: хлороформетанол, 98:2), давая 70 мг (73%) продукта, который был идентичен продукту ссылочного примера 15.
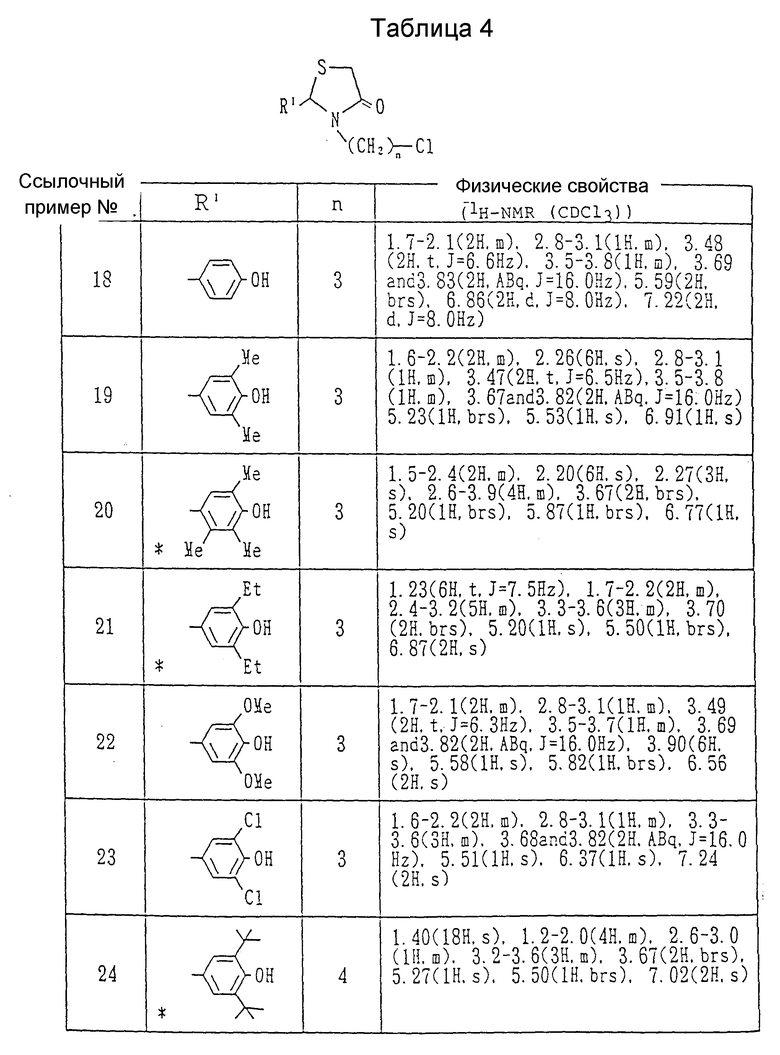
Ссылочный пример 17. Получение 2-(3,5-диизопропил-4-гидроксифенил)-3-(3-хлорпропил)- 1,3-тиазолидин-4-она.
К раствору в дихлорметане /50 мл/ 2-(3.5-диизопропил-4-гидроксифенил)-3-(3-гидроксипропил)-1,3- тиазолидин-4-она /1.97 г/, полученного в ссылочном примере 1, добавлялся тионилхлорид /1.04 г/ в атмосфере азота, затем смесь нагревалась с обратным холодильником в течение 1 часа. Растворитель выпаривался при пониженном давлении, и к остатку добавлялись солевой раствор и хлороформ. Органический слой отделялся и сушился над безводным сульфатом натрия, и растворитель выпаривался при пониженном давлении. Остаток очищался с помощью колоночной хроматографии на силикагеле (элюент: дихлорметан), давая 1.25 г (60%) целевого соединения в виде бледно-желтых, кристаллов, т.пл. 105-106oC,
ЯМР /CDCl3, 60 МГц/ δ:
1.23 (12H, д., J=6,6 Гц), 1.5-2.1 (2H, м.), 2.6-3.8 (6H, м.), 3.67 (2H, шир. с.), 5.20(1H, 1H, с.), 5.50 (1H, шир. с.), 6.88 (2H, с.),
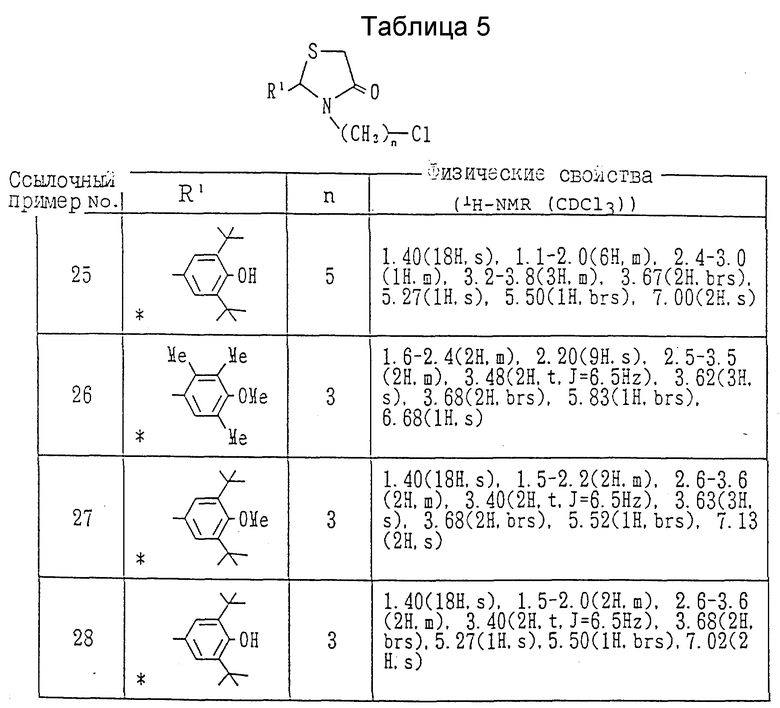
Ссылочные примеры 18-28.
Каждое соединение, показанное в таблицах 4 и 5, получалось согласно процедуре ссылочного примера 17 с использованием в каждом случае соответствующего спирта.
Ссылочный пример 29. Получение 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-(3-бромпропил)-1,3- тиазолидин-4-она,
К раствору 2-(3, 5-ди-трет-бутил-4-гидроксифенил)-3-(3- гидроксипропил)-1,3-тиазолидин-4-она /2.00 г/, полученного в ссылочном примере 15, в диэтиловом эфире /20 мл/ добавлялся трехбромистый фосфор /0.74 г/ в атмосфере азота, затем смесь перемешивалась при комнатной температуре в течение 6 часов. После завершения реакции смесь выливалась в смесь лед-вода /100 мл/, и продукт экстрагировался диэтиловым эфиром. Органический слой промывался солевым раствором и сушился над безводным сульфатом натрия. Растворитель выпаривался при пониженном давлении, и остаток очищался с помощью колоночной хроматографии на силикагеле (элюент: хлороформ), давая 1.31 г (56%)целевого соединения в виде бледножелтых кристаллов. Т.пл. 130-131oC.
ЯМР /CDCl3, 60 МГЦ/ δ:
1,43(18H, с.), 1.6-2.2(2H, м.), 2.6-3.6(2H, м.), 3.28(2H, т., J=6.5 Гц), 3.70(2H, шир. с.), 5.28(1H, с.), 5.53(1H, шир. с.), 7.05(2H, с.)
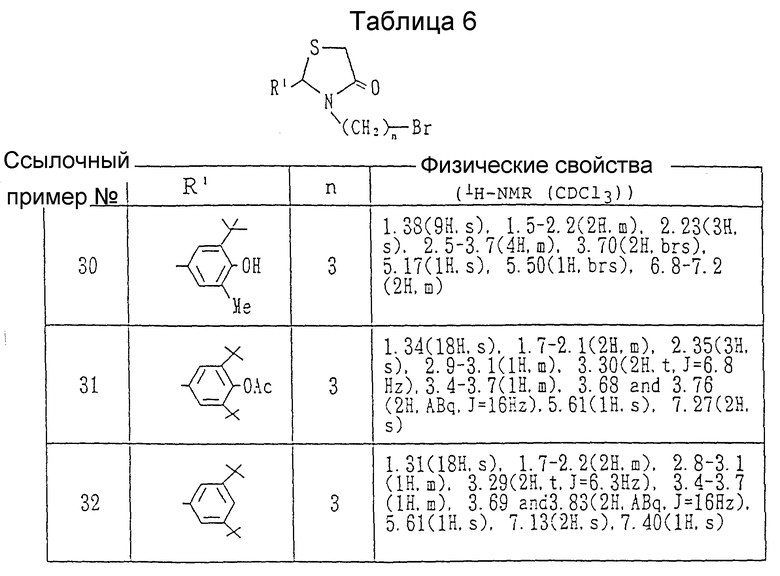
Каждый из бромидов, показанных в таблице 6, получался в соответствии с процедурой ссылочного примера 29 с использованием в каждом случае соответствующего спирта.
Пример 1. Получение 2- (3,5-диизопропил-4-гидроксифенил) -3-[3-[N-метил-N-[2-(3,4-метилендиоксифенокси)этил]амино]пропил]- 1,3-тиазолидин-4-она.
К раствору 2-(3,5-диизопропил-4-гидроксифенил)-3-(3- хлорпропил)-1,3-тиазолидин-4-она /0.50 г/, полученного в ссылочном примере 17, и N-метил-N-[2-(3,4-метилендиоксифенокси)этил] амина /0.30 г/ в диметилформамиде /10 мл/ добавлялись карбонат натрия /0.29 г/ и йодистый калий /0.30 г/ в атмосфере азота, и смесь перемешивалась при 80oC в течение 24 часов. Растворитель удалялся с помощью выпаривания при пониженном давлении, к остатку добавлялась вода /20 мл/, и смесь экстрагировалась хлороформом. Органический слой промывался последовательно водой и солевым раствором, затем сушился над безводным сульфатом натрия. Растворитель выпаривался при пониженном давлении, и остаток очищался с помощью колоночной хроматографии на силикагеле (элюент: хлороформ-метанол 97:3), давая 0.26 г (36%) целевого соединения в виде бледно коричневого масла.
ЯМР (CDCl3, 60 МГц) δ:
1.23(12H, д., J=6,6 гц), 1.4-1.9(2H, м.), 2.17(3H, с.), 2.3-3.8(8H, м.), 3.67(2H, шир.с.), 3.87(2H, т., J= 5.7 Гц), 5.00(1H, шир. с.), 5.57(1H, с.), 5.80(2H, с.), 6.0-6.7(3H, м.), 6.90(2H, с.).
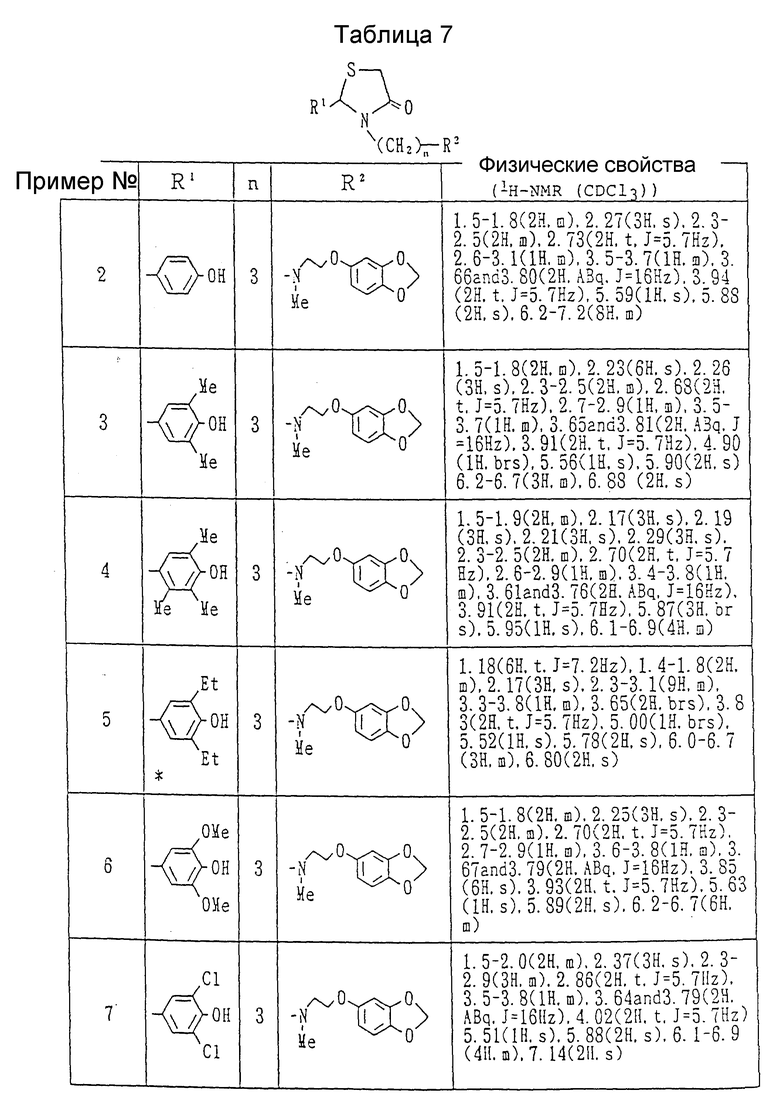
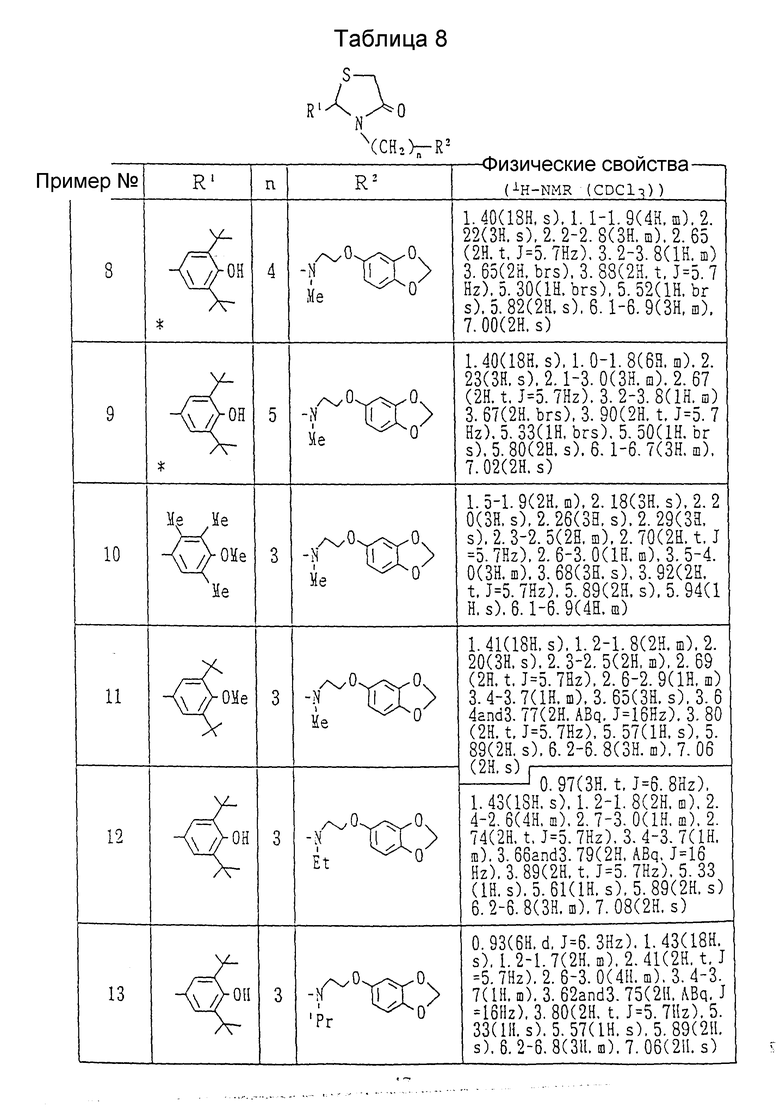
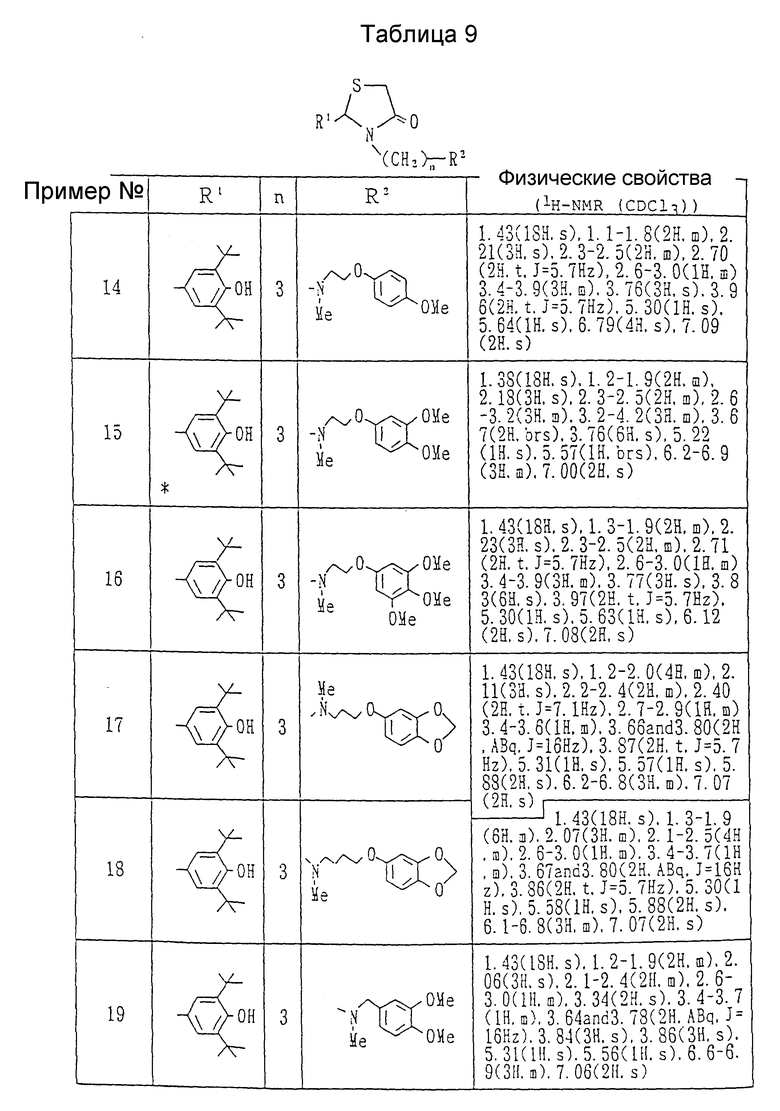
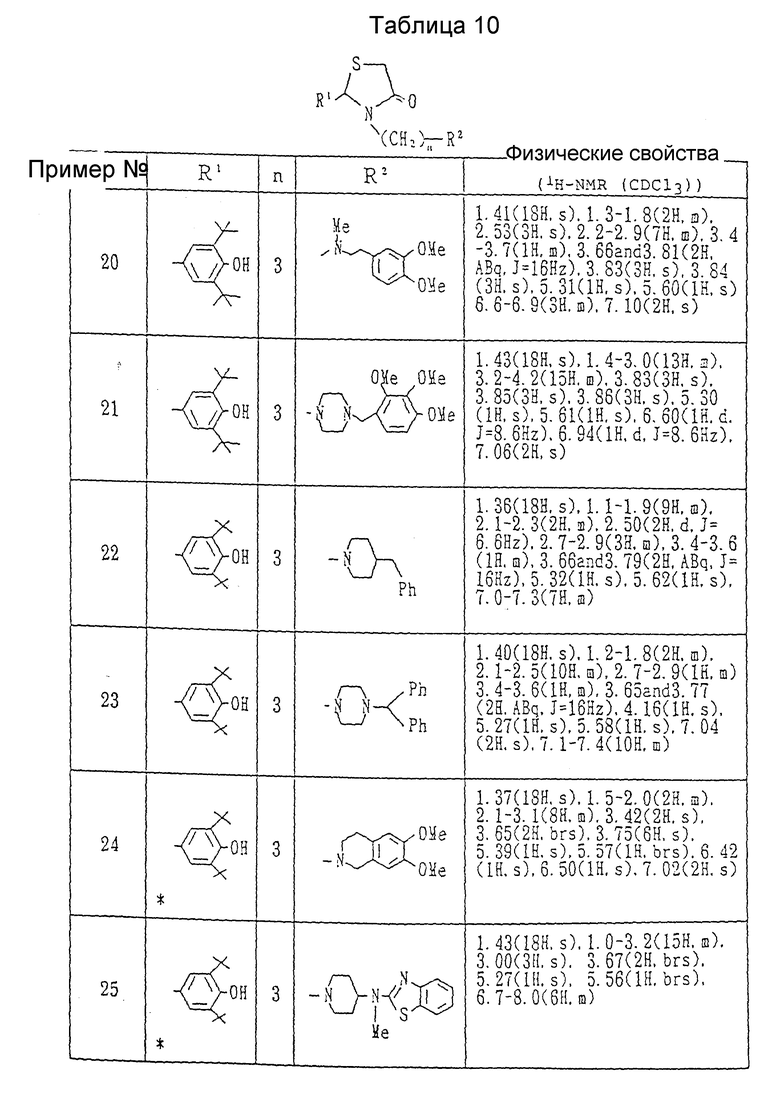
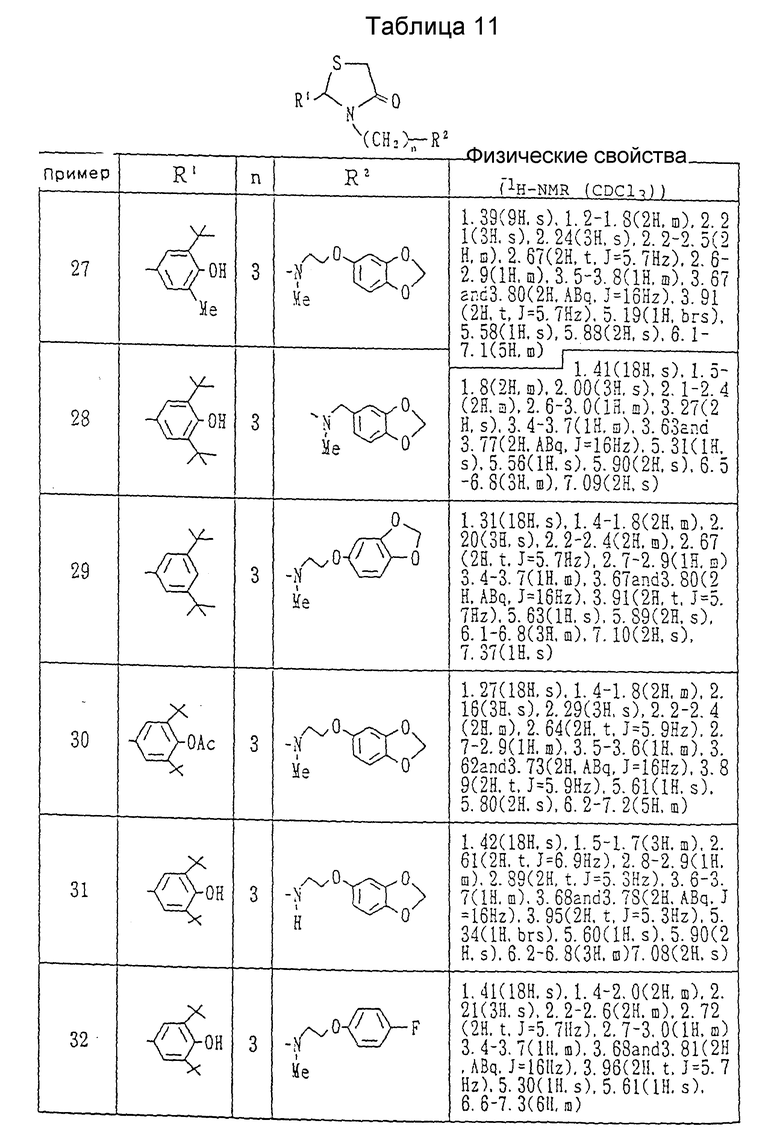
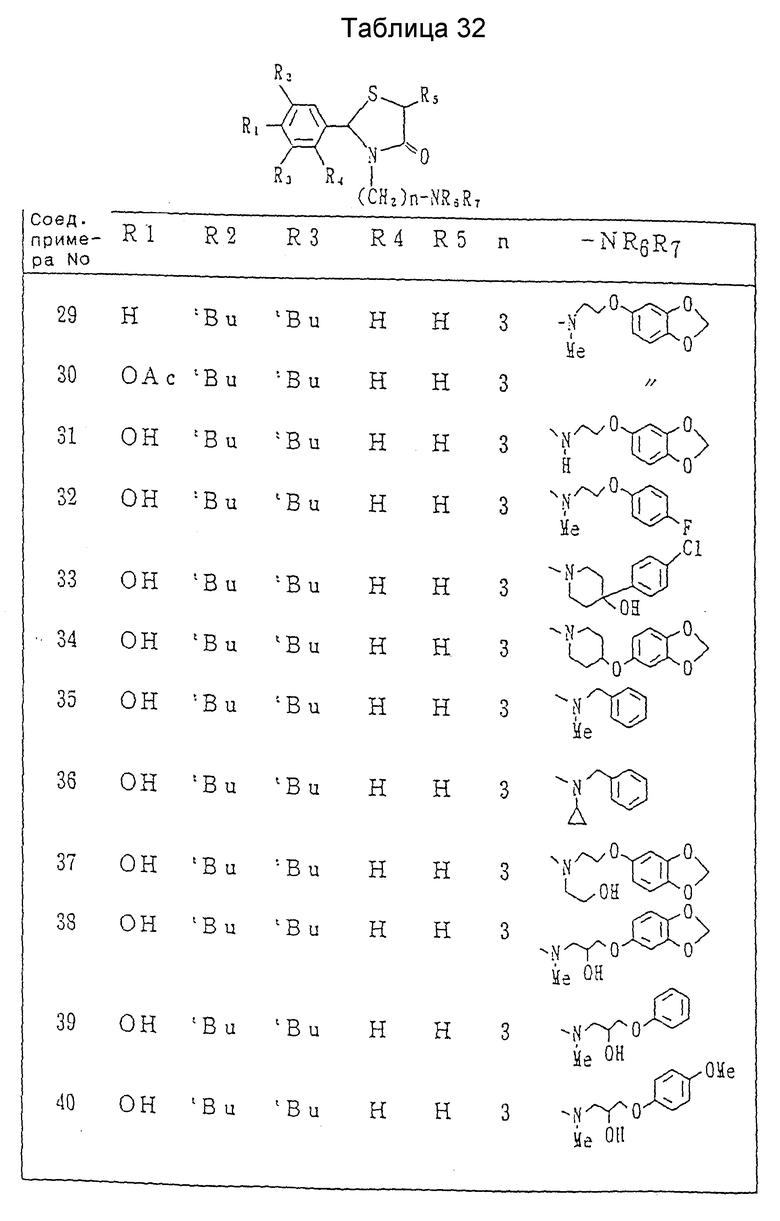
Примеры 2-25. Каждое соединение, показанное в Таблицах 7 - 10, получалось в соответствии с процедурой примера 1, с использованием соответствующего хлорида и соответствующего амина в каждом случае.
Пример 26-A. Получение 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-[3-(N-метил-N- [2-(3,4-метилендиоксифенокси)этил] амино]пропил]- 1,3-тиазолидин-4-она,
К раствору 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-(3- бромпропил)-1,3-тиазолидин-4-она /89.3 мг/, полученного в ссылочном примере 29, и N-метил-N-[2-(3,4-метилендиоксифенокси) этил]амина /48.8 мг/ в ацетоне /5 мл/ добавлялся карбонат калия /34.6 мг/ в атмосфере азота, и смесь нагревалась с обратным холодильником в течение 10 часов. После того, как смесь оставляли охлаждаться, неорганическое вещество удалялось фильтрованием, и фильтрат концентрировали при пониженном давлении. Остаток очищался с помощью колоночной хроматографии на силикагеле (элюент: хлороформ-метанол, 97:3), давая 67.4 мг (60%) целевого соединения в виде бесцветных кристаллов, т.пл. 70-.1oC.
ЯМР (CDCl3, 200 МГц) δ:
1.42 (18H, с. ), 1.4-1.7(2H, м. ), 2.20(3H, с.), 2.3- 2.5(2H, м.), 2.68(2H, т., J=5.9 Гц), 2.7-2.9 (1H, м.), 3.5-3.6 (1H, м.), 3.66 и 3.80 (2H, АВкв. , J= 16.0 Гц), 3.92 (2H, т., J=5.9 Гц), 5.32(1H, с.), 5.66(1H, с.), 5.90(2H, с.), 6.2-6.7(3H, м.), 7.09(2H, с.).
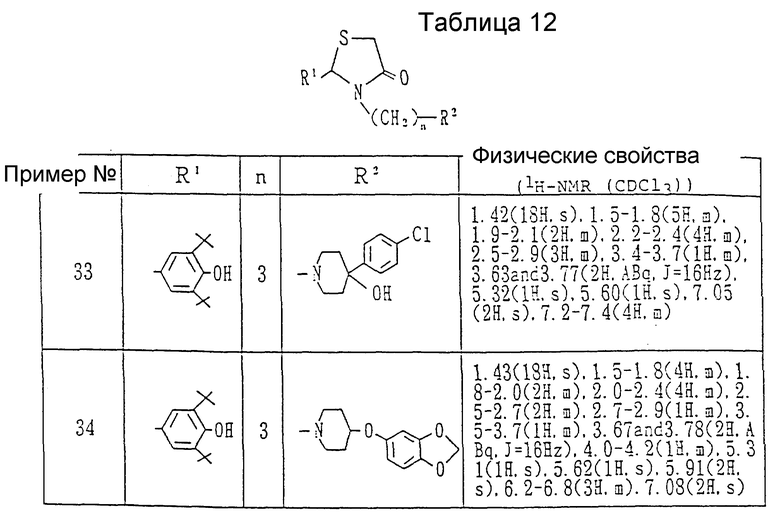
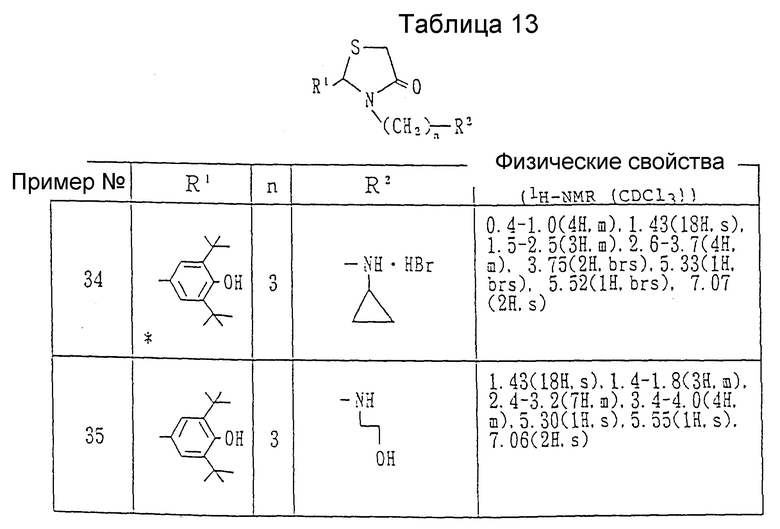
Примеры 27-34. Каждое соединение, показанное в таблицах 11 и 12, получалось в соответствии с процедурой примера 26-A с использованием в каждом случае соответствующего бромида и соответствующего амина.
Ссылочный пример 33. Получение гидробромида 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-[3-(N-метиламино)пропил]- 1,3-тиазолидин-4-она.
Смесь 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-(3-бромпропил)- 1,3-тиазолидин-4-она /1.10 г/, полученного в ссылочном примере 29 у 40%-ного метанольного раствора метиламина /20 мл/ и ацетонитрила /15 мл/ перемешивалась при комнатной температуре в течение 15 часов в атмосфере азота. После завершения реакции растворитель и избыток метиламина удалялись при пониженном давлении. Остаток очищался с помощью колоночной хроматографии на силикагеле (элюент: хлороформ-метанол, 95:5), давая 0.90 г (76%) целевого соединения в виде бледно оранжевых кристаллов. Т.пл. 195-196oC.
ЯМР /CDCl3, 60 МГц/ δ:
1.42 (18H, с. ), 1.6-2.2(2H, м. ), 2.67(3H, с.), 2.6- 3,6(4H, м.), 3.77(2H, шир.с.), 5.33(1H, с.), 5.63 (1H, шир.с.), 7.08 (2H, с.).
Каждое из соединений, показанных в таблице 13, получалось с помощью процедуры ссылочного примера 33 с использованием в каждом случае соответствующего амина вместо метиламина.
В ссылочном примере 35 хроматографическая очистка выполнялась на колонке из силикагеля с использованием смеси хлороформ-метанол, 95:5, содержащей 1% триэтиламин, в качестве элюента.
Пример 26-B. К раствору гидробромида 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-[3- (N-метиламино)пропил] -1,3-тиазолидин-4-она /380 мг/, полученного в ссылочном примере 33, и 2-(3,4-метилендиоксифенокси)этилбромида /260 мг/ в ацетоне /10 мл/ добавлялся карбонат калия /300 мг/, и смесь перемешивалась в течение 10 часов в атмосфере азота. После того, как реакционная смесь оставлялась охлаждаться, нерастворимое вещество удалялось с помощью фильтрования, и фильтрат концентрировался при пониженном давлении. Остаток очищался с помощью хроматографии на силикагельной колонке (элюент: хлороформ-метанол, 97:3), давая 350 мг (64%) того же соединения, что получалось в примере 26-A.
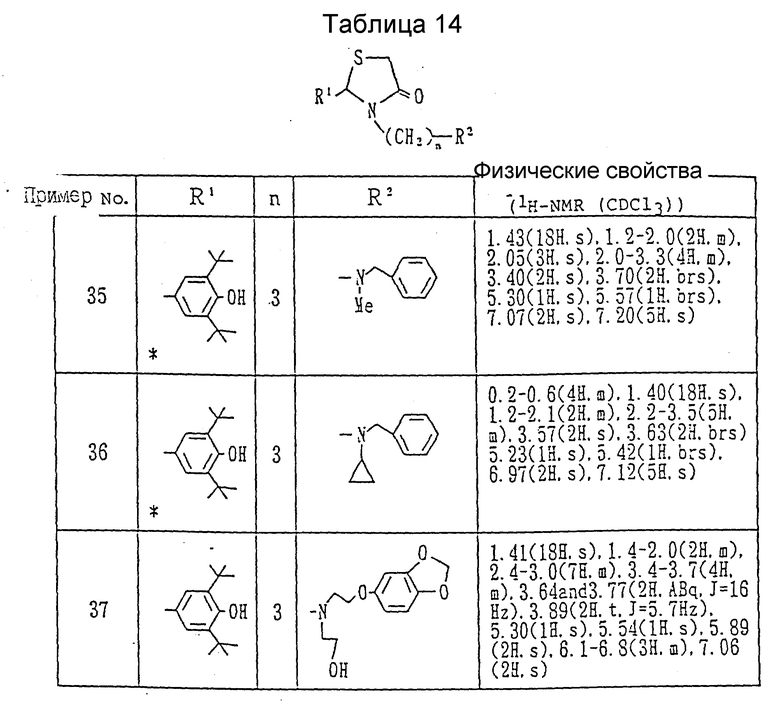
Примеры 35-37 г. Каждое соединение таблицы 14 получалось в соответствии с процедурой примера 26-В при взаимодействии в каждом случае каждого из соединений, показанных в таблице 13, с соответствующим бромидом.
Пример 38. Получение 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-[3- [N-метил-N-[2-гидрокси-3-(3,4-метилендиоксифенокси)пропил] амино] - пропил]-1,3-тиазолидин-4-она.
К раствору 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-[3- (N-метиламино)пропил] -1,3-тиазолидин-4-она /0.50 г/, полученного в ссылочном примере 33, в ацетонитриле /10 мл/ добавлялся 2,З-эпоксипропил-3,4-метилендиоксифениловый эфир /0.26 г/ при комнатной температуре, и смесь нагревалась с обратным холодильником в течение 8 часов. После оставления охлаждаться смесь выливалась в смесь льда и воды и экстрагировалась этилацетатом. Органический слой промывался солевым раствором и сушился над безводным сульфатом натрия. Растворитель выпаривался при пониженном давлении, и остаток очищался с помощью хроматографии на силикагельной колонке (элюент: хлороформметанол, 98:2), давая 0.72 г (95%) целевого соединения в виде бесцветного масла.
ЯМР (CDCl3, 270 МГц) δ:
1.43 (18H, с.), 1.4-1.8 (2H, м.), 2.17(3H, с.), 2.2-2.6(4H, м.), 2.7-3.0(1H, м. ), 3.4-3.7(1H, м.,), 3.67 и 3.80 (2H, АВкв., J=16.0 Гц), 3.8-4.1 (4H, м. ), 5.33(1H, с. ), 5.57(1H, с.), 5.91 (2H, с.), 6.2-6.8 (3H, м.), 7.09(2H, с.).
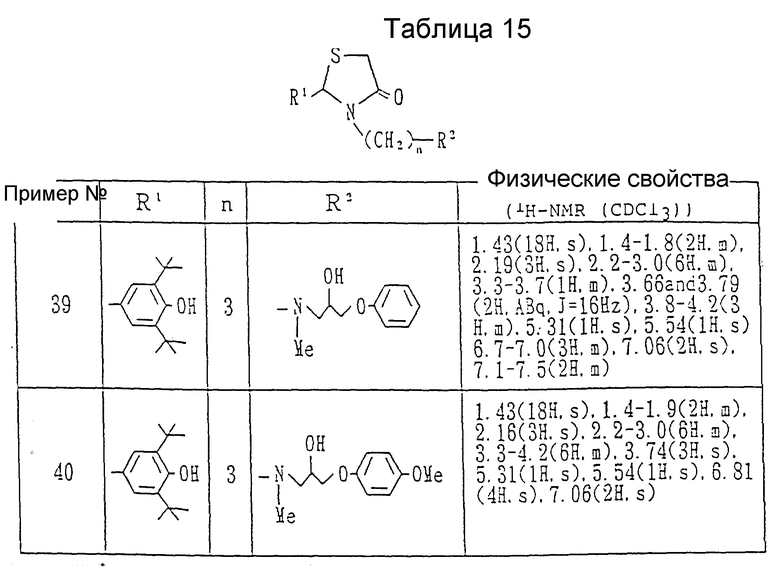
Примеры 39 и 40. Каждое из соединений, показанных в таблице 15, получалось следуя процедуре примера 38, с использованием в каждом случае соответствующего эпоксида.
Ссылочный пример 36. Получение 3-[N-метил-N-[2-(3,4-метилендиоксифенокси)этил]амино]-пропиламина.
В ацетоне (20 мл) суспендировался N-метил-N-[2-(3,4- метилендиоксифенокси)этил]амин /1.0 г/, N-(3-бромпропил)фталимид /1.51 г/, и карбонат калия /0.78 г/, и суспензия нагревалась с обратным холодильником в течение 3 часов. После того, как смесь оставлялась охлаждаться, она фильтровалась для удаления неорганического вещества, и фильтрат концентрировался. Остаток очищался с помощью хроматографии на силикагельной колонке (элюент: хлороформ-метанол, 10:1), давая 1.82 г (93%) N-[3-[N'-метил-N'-/2- (3,4-метилендиоксифенокси)этил]амино]пропил]фталимида в виде коричневого масла.
ЯМР (CDCl3, 60 МГц) δ:
1.5-2.2(2H, м.), 2.28(3H, с.), 2.3-2.9(4H, м.), 3.72(2H, т., J=7.0 Гц), 3.90(2H, J=6.0 Гц), 5.82(2H, с.), 6.0-6.8(3H, м.), 7.4-8.0(4H, м.).
Получающийся в результате N-[3-[N'-метил-N'-[2-(3, 4-метилендиоксифенокси)этил] амино]пропил]фталимид /1.82 г/ растворялся в 40% метанольном растворе метиламина /10 мл/, и смесь перемешивалась при комнатной температуре на протяжении ночи. После завершения реакции растворитель и избыток метиламина удалялись при пониженном давлении. Остаток очищался с помощью хроматографии на силикагельной колонке (элюент: хлороформметанол, 1:1, содержащий 1% триэтиламин), давая 0.74 г (62%) целевого соединения в виде бледно-коричневого масла.
ЯМР (CDCl3), (60 МГц) δ:
1.33(2H, с. ), 1.1-2.1(2H, м.), 2.27(3H, с.), 2.2-3.0(6H, м.), 3.90(2H, т., J=6.0 Гц), 5.77(2H, с.), 6.0-6.8(3H, м.).
Ссылочный пример 37. Получение 2-/N-метил-N- [2-(3,4-метилендиоксифенокси)этил]амино]-этиламина.
Целевое соединение получалось в соответствии с процедурой ссылочного примера 36 с использованием N-(2-бромэтил)фталимида вместо N-(3-бромпропил)фталимида.
ЯМР(CDCl3), (60 МГц) δ:
2.34(3H, с. ), 2.0-3.2(8H, м.), 3.90(2H, т., J=6.0 Гц), 5.85(2H, с.), 6.0-6.9(ЗH, м.).
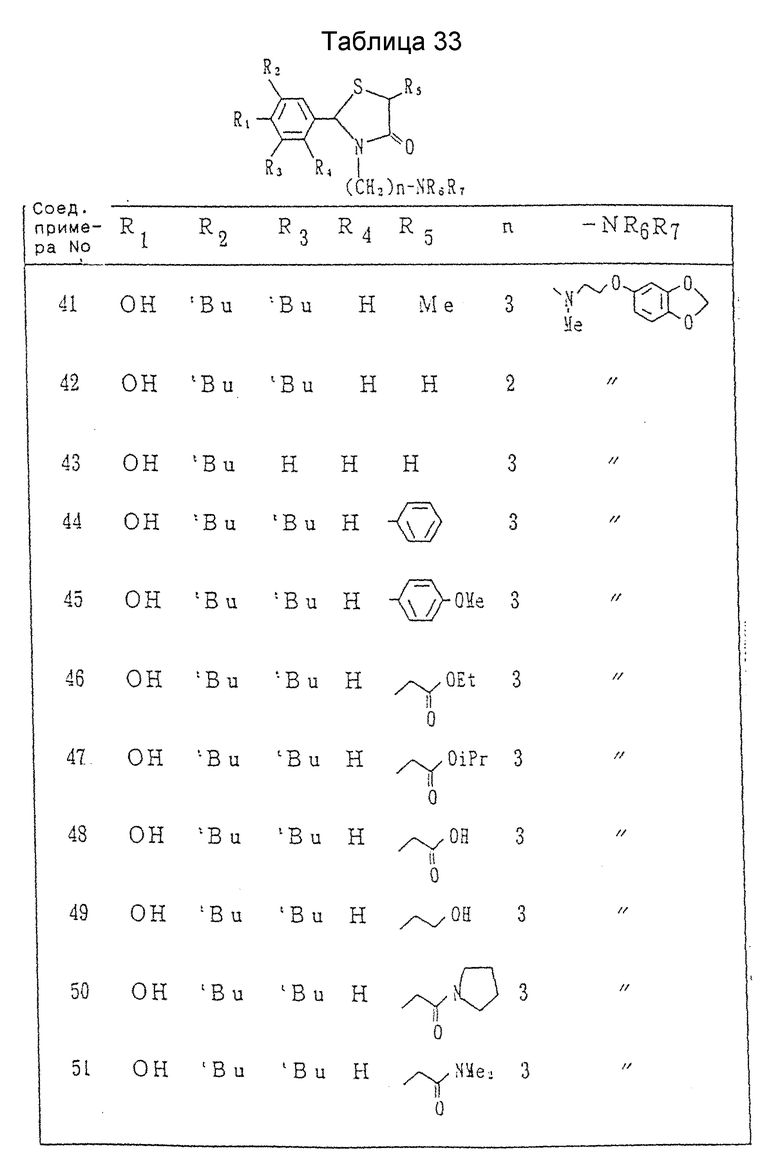
Пример 41 /Способ-A/. Получение 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-[3- [N-метил-N-[2-(3,4-метилендиоксифенокси)этил]амино]пропил]-5- метил-1,3-тиазолидин-4-она.
Целевое соединение получалось в соответствии с процедурой ссылочного примера 1, с использованием 3-[N-метил-N-[2- -(3,4-метилендиоксифенокси)этил]амино]пропиламина и 2-меркаптопропионовой кислоты вместо 3-аминопропанола и d-меркаптоуксусной кислоты.
ЯМР (CDCl3), (270 МГц) δ:
1.42 (18H, с. ), 1.2-1.8(2H, м. ), 1.58(3х2/5H, д., J=6.9 Гц), 1.65 (3х3/5H, д., J=6.9 Гц), 2.20 (3х3/5H, с.), 2.23 (3х2/5H, с.), 2.2-2.5(2H, м. ), 2.6-2.9(3H, м. ), 3.4-3.7(1H, м. ), 3.8-4.1(3H, м.), 5.29(2/5H, с.), 5.30(3/5H, с. ), 5.56 (3/5H, с.), 5.57 (2/5H, шир.с.), 5.90(2H, с.), 6.2- 6.8(3H, м.), 7.05(2х2/5H, с.), 7.11 (2х3/5H, с.).
Пример 42. Получение 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-[2- [N-метил-N-[2-(3,4-метилендиоксифенокси)этил]амино]этил]-1,3- тиазолидин-4-она.
Целевое соединение получалось согласно процедуре ссылочного примера 1 с использованием 2-[N-метил-N-[2-(3, 4-метилендиоксифенокси)-этил]амино]этиламина вместо 3-аминопропанола.
ЯМР (CDCl3), (60 МГц) δ:
1.40(18H, с.), 2.20(3H, с.), 2.5-3.0(5H, м.), 3.3-4.1(3H, м.), 3.65(2H, шир.с.), 5.23(1H, с.), 5.73(1H, с.), 5.82(2H, с.), 6.0-6.8(3H, м.), 7.00(2H, с.).
Пример 43. Получение 2-(3-трет-бутил-4-гидроксифенил)-3-[3-[N-метил-N- [2-(3,4-метилендиоксифенокси)этил]амино]пропил]-1,3- тиазолидин-4-она.
В уксусной кислоте /5 мл/ растворялся 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-[3-[N-метил-N-[2- (3,4-метилендиоксифенокси)этил] амино]-пропил]-1,3-тиазолидин-4-он /0.35 г/, и добавлялась 47% бромистоводородная кислота /5 мл/, затем смесь перемешивалась при комнатной температуре в течение 7 дней. После завершения реакции смесь выливалась в охлажденный льдом 5%-ный водный раствор карбоната натрия и экстрагировалась хлороформом. Органический слой сушился над безводным сульфатом натрия, и растворитель выпаривался при пониженном давлении. Остаток очищался с помощью хроматографии на силикагельной колонке (элюент: хлороформ-метанол, 98:2), давая 0.05 г (16%) целевого соединения в виде бледно коричневого масла.
ЯМР (CDCl3), (200 МГц), δ:
1.37(9H, с. ), 1.2-1.9(2H, м.), 2.26(3H, с.), 2.1-2.5(2H, м.), 2.71(2H, т. , J=5.7 Гц), 2.6-3.0(1H, м.), 3.4-3.8(1H, м.), 3.67 и 3.80(2H, АВкв., J= 16.0 Гц), 3.94(2H, т., J=5.7 Гц), 5.60(1H, с.), 5.82(1H, с.), 5.88(2H, с.), 6.1-7.0(5H, м.), 7.14(1H, с.).
Ссылочный пример 38. 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3- (3-гидроксипропил)-5-метил-1,3-тиазолидин-4-он получался согласно процедуре ссылочного примера 1 с использованием 2-меркаптопропионовой кислоты вместо α- меркаптоуксусной кислоты.
ЯМР (CDCl3), (200 МГц) δ:
1.43(18H, с.), 1.1-1.7(2H, м.), 1.60(3х1/4H, д., J=6.9 Гц), 1.67(3х3/4H, д. , J= 6. , 9 Гц), 3.0-3.3(1H, м. ), 3.3-3.7(4H, м.), 3.9-4.2 (1H, м.), 5.34(1/4H, с.), 5.36(3/4H, с.), 5.49(3/4H, с.), 5.52(1/4H, с.), 7.07(2х1/4H, с.), 7.12 (2х3/4H, с.)
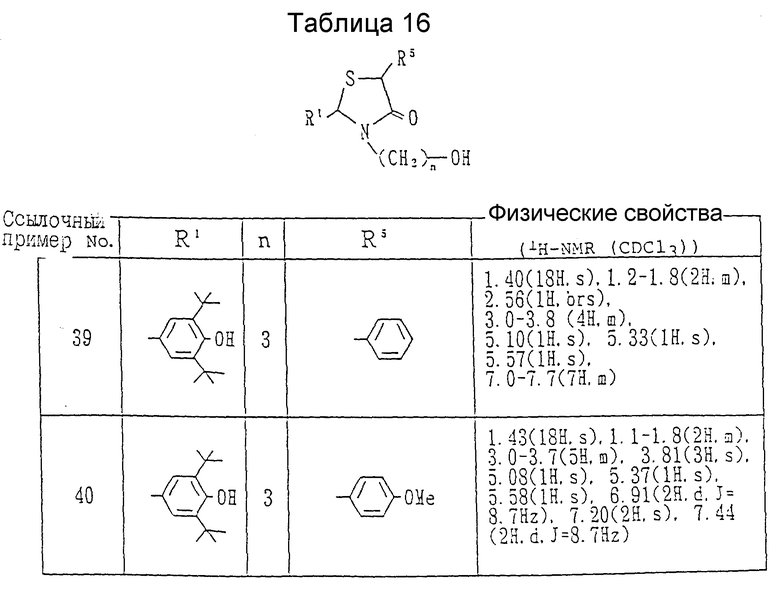
Ссылочные примеры 39 и 40. Каждое соединение, показанное в таблице 16, получалось в соответствии с процедурой ссылочного примера 38 с использованием соответствующей α- меркаптокарбоновой кислоты вместо 2-меркаптопропионовой кислоты в каждом случае.
Ссылочный пример 41. Получение 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-(3- гидроксипропил)-5-карбоксиметил-1,3-тиазолидин-4-она.
В бензоле /200 мл/ суспендировались 3,5-ди-трет-бутил-4-гидроксибензальдегид /23.4 г/ и 3-аминопропанол /9.01 г/ в атмосфере азота. После подсоединения к реактору ловушки Дина-Старка суспензия нагревалась с обратным холодильником в течение 2 часов. После того, как смесь оставлялась охлаждаться, к ней добавлялась тиояблочная кислота /19.52 г/, затем смесь нагревалась с обратным холодильником в течение дополнительного периода 3 часов. Бензол удалялся с помощью выпаривания, и получающееся в результате белое твердое вещество перекристаллизовывалось из содержащего воду метанола, давая 10.5 г (25%) целевого соединения в виде бесцветных кристаллов, т.пл. 227-228oC.
ЯМР (d6-ДМСО) (200 МГц) δ:
1.37(18H, с.), 1.2-1.8(2H, м.), 2.3-2.8(1H, м.), 3.0-3.6(5H, м.), 4.0-4.2(1H, м.), 4.37(1H, шир. с.), 5.73(1H, с.), 7.10(2H, с.), 7.13 (1H, с.).
Ссылочный пример 42. 2-(3,5-Ди-трет-бутил-4-гидроксифенил)-3- (3-хлорпропил)-5-метил-1,3-тиазолидин-4-он получался из 2-(3,5-ди-третбутил-4-гидроксифенил)-3-(3-гидроксипропил)-5-метил-1,3- -тиазолидин-4-она в соответствии с процедурой ссылочного примера 17.
ЯМР (CDCl3) (60 МГц) δ:
1.42(18H, с.), 1.1-2.2(5H, м.), 2.7-4.2(5H, м.), 5.23 (1H, с.), 5.43(1H, шир. с.), 6.97(2H, шир. с.)
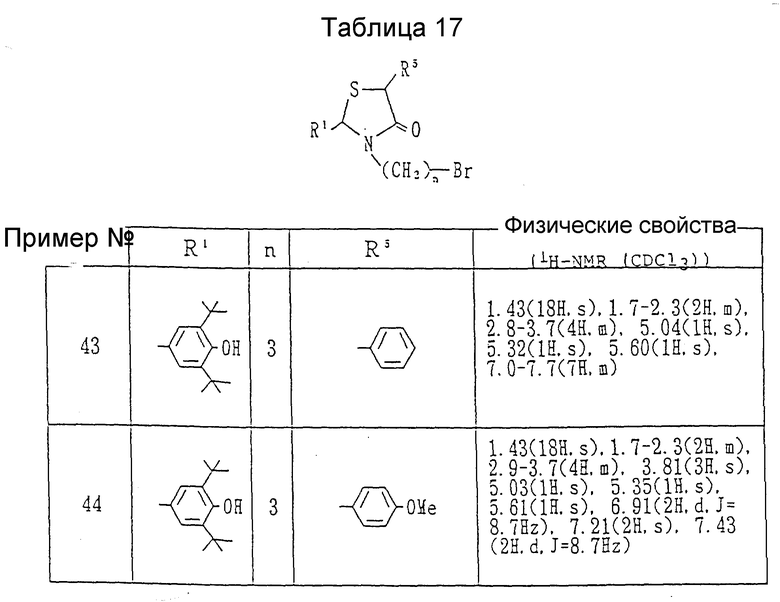
Ссылочные примеры 43 и 44. Каждое из соединений, показанных в таблице 17, получалось соответственно из каждого из соединений ссылочных примеров 39 и 40 в соответствии с процедурой ссылочного примера 29.
Ссылочный пример 45. Получение 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-(3- бромпропил)-5-этоксикарбонилметил-1,3-тиазолидин-4-она.
К суспензии 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3- (3-гидроксипропил)-5-карбоксиметил-1,3-тиазолидин-4-она /2.45 г/ в диэтиловом эфире /30 мл/ суспендировался трехбромистый фосфор /3.45 г/, и смесь перемешивалась при комнатной температуре в течение 3 часов. К смеси добавлялся по каплям этанол /30 мл/ при охлаждении льдом, смесь перемешивалась при комнатной температуре на протяжении ночи. После завершения реакции реакционная смесь выливалась в 100 мл смеси льда и воды, и продукт экстрагировался этилацетатом. Органический слой промывался солевым раствором и сушился над безводным сульфатом натрия. Растворитель удалялся выпариванием при пониженном давлении, и остаток очищался с помощью колоночной хроматографии на силикагеле (элюент: этилацетат: н-гексан, 20:80), а затем перекристаллизовывался из смеси хлороформ/н-гексан, давая 1.50 г (51%) целевого соединения в виде бесцветных кристаллов. Т.пл. 154-155oC.
ЯМР (CDCl3) (200 МГц) δ:
1.26(3H, т., J=7.1 Гц), 1.43 (18H, с.), 1.6-2.2 (2H, м.), 2.6-3.1(2H, м. ), 3.2-3.6(4H, м.), 4.17(2H, кв., J=7.1 Гц), 4.1-4.4(1H, м.), 5.33(1H, с.), 5.53(1H, с.), 7.14 (2H, с.)
Ссылочный пример 46. 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3- (3-бромпропил)-5-изопрооксикарбонилметил-1,3-тиазолидин-4-он получался в виде бесцветных кристаллов в соответствии с процедурой ссылочного примера 45 с использованием изопропилового спирта вместо этанола, т.пл. 170-171oC.
ЯРМ (CDCl3), (200 МГц) δ:
1.24(6H, д., J=5.7 Гц), 1.43(18H, с.), 1.6-2.2(2H, м.), 2.6-3.7(6H, м.), 4.1-4,4(1H, м.), 4.8-5.2(1H, м.), 5.33(1H, с.), 5.53 (1H, с.), 7.14(2H, с.)
Пример 41 /способ-B/. Получение 2. -(3,5-ди-трет-бутил-4-гидроксифенил)-3-[3-[N-метил-N-[2- (3,4-метилендиоксифенокси)этил] амино]пропил]- 5-метил-1,3-тиазолидин-4-она.
Целевое соединение получалось в соответствии с процедурой примера 1 с использованием 2-(3,5-ди-трет-бутил-4-гидроксифенил)- 3-(3-хлорпропил)-5-метил-1,3-тиазолидин-- 4-она, полученного в ссылочном примере 42. Данные анализа полученного соединения были идентичными данным соединения, полученного в примере 41-A.
Примеры 44 и 45. Каждое соединение, показанное в таблице 18, получалось в соответствии с процедурой примеров 26-A с использованием соответствующих соединений, полученных в ссылочных примерах 43 и 44, вместо 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3- (3-бромпропил)-1,3-тиазолидин-4-она.
Пример 46. Получение 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-[3- [N-метил-N-[2-(3,4-метилендиоксифенокси)этил] амино] пропил]- 5-этоксикарбонилметил-1,3-тиазолидин-4-она.
Целевое соединение получалось в виде бесцветных кристаллов при выполнении процедуры примера 26-A, с использованием 2- (3,5-ди-трет-бутил-4-гидроксифенил)-3-(3-бромпропил)-5- этоксикарбонилметил-1,3-тиазолидин-4-она, полученного в ссылочном примере 45, вместо 2-(3,5-дитрет-бутил-4-гидроксифенил)-3-(3-бромпропил)-1,3-тиазолидин- 4-она.
Т.пл. 88-89oC. ЯМР (CDCl3), (200 МГц) δ:
1.26(3H, т. , J=7.1 Гц), 1.41(18H, с.), 1.4-1.9(2H, м.), 2.19(3H, с.), 2.3-2.5(2H, м. ), 2.67(2H, т., J=5.7 Гц), 2.7-3.0(2H, м.), 3.2-3.7(2H, м.), 3.91(2H, т. , J = 5.7 Гц), 4.17(2H, кв., J=7.1 Гц), 4.1-4.4(1H., м.), 5.29(1H, с.), 5.58(1H, с.), 5.89(2H, с.), 6.1-6.8(3H, м.), 7.09(2H, с.).
Пример 47. Согласно процедуре примера 46 с использованием 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-(3-бромпропил)-5-изопропоксисикарбонилметил-1,3-тиазолидин-4-она вместо 2-(3,5-ди-трет-бутил-4- гидроксифенил)-3-(3-бромпропил)-5-этоксикарбонилметил-1,3-тиазолидин- 4-она получался 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-[3-[N-метил-N-[2- (3,4-метилендиоксифенокси)-этил] амино]пропил]-5- изопропоксикарбонилметил-1,3-тиазолидин-4-он в виде бесцветных кристаллов, т.пл. 81-82oC.
ЯМР (CDCl3), (200 МГц) δ:
1.23(6H, д. , J=5.7 Гц), 1.41(18H, с.), 1.4-2.0(2H, м.), 2.20(3H, с.), 2.2-2.5(2H, м.), 2.5-3.0(4H, м.), 3.1- 3.7(2H, м.), 3.93(2H, т., J=5.7 Гц), 4.1-4.4(1H, м.), 4.8-5.2(1H, м.), 5.30(1H, с.), 5.57(1H, с.), 5.89(2H, с.), 6.1-6.8(3H, с.), 7.10(2H, с.)
Пример 48. Получение 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-/3- [N-метил-N-[2-(3,4-метилендиоксифенокси)этил] амино] пропил] -5-карбоксиметил-1,3-тиазолидин-4-она.
В этаноле /5 мл/ растворялся 2-(3,5-ди-трет-бутил-4- гидроксифенил)-3-[3-[N-метил-N-[2-(3,4-метилендиоксифенокси) этил] амино] пропил] -5-этоксикарбонилметил-1,3-тиазолидин-4-он /100 мг/, полученный в примере 46, и добавлялся раствор гидроокиси натрия (200 мл) в 20% содержащему воду этаноле, затем смесь перемешивалась при комнатной температуре на протяжении ночи. После завершения реакции смесь нейтрализовалась 1 норм. соляной кислотой и концентрировалась при пониженном давлении. К остатку добавлялась смесь воды (50 мл) и хлороформа /50 мл/, и смесь перемешивалась. Органический слой отделялся, промывался солевым раствором и сушился над безводным сульфатом натрия. Растворитель выпаривался при пониженном давлении, и остаток растирался с н-гексаном, давая 80 мг (84%) целевого соединения в виде бледно желтого твердого вещества.
ЯМР (CDCl3) (200 МГц) δ:
1.41(18/2H, с. ), 1.42(18/2H, с. ), 1.4-2.4(2H, м.), 2.85 (3/2H, с.), 2.90(3/2H, с.), 2.7-3.8(8H, м.), 4.1-4.7(3H, м.), 5.2-5.4(1H, м.), 5.66(1/2H, шир. с. ), 5.81(1/2H, шир. с.), 5.89 (2H, с.), 6.2-6.7(3H, м.), 7.13(2/2H, с.), 7.14(2/2H, с.).
Пример 49. Получение 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-[3- -[N-метил-N-[2-(3,4-метилендиоксифенокси)этил] амино] пропил] -5- (2-гидроксиэтил)-1,3-тиазолидин-4-она.
К раствору 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3- [3-[N-метил-N-[2-(3,4-метилендиоксифенокси)этил] амино] пропил] -5- этоксикарбонилметил-1,3-диазолидин-4-она /80 мг/, полученного в примере 46, в сухом тетрагидрофуране /5 мл/ добавлялся алюмогидрид лития /20 мг/ при -78oC, и смесь перемешивалась при 0oC в течение 3 часов. К смеси добавлялся содержащий воду тетрагидрофуран /5 мл/ с последующим перемешиванием при данной температуре в течение 1 часа. Смесь нейтрализовалась 1 норм. соляной кислотой, концентрировалась при пониженном давлении. Остаток очищался с помощью хроматографии на силикагельной колонке (элюент: хлороформ-метанол, 95:5), давая 68 мг (86%) целевого соединения в виде бесцветного масла.
ЯМР (CDCl3) (200 МГц) δ:
1.41(18H, с.), 1.3-1.8 (4H, м.), 2.19(3H, с.), 2.2-2.5(3H, м.), 2.67(2H, т. , J=5.7 Гц), 2.7-2.9(1H, м.), 3.4-3.6(1H, м.), 3.8-4.0(2H, м.), 3.91 (2H, т. , J= 5.7 Гц), 4.04 (1H, т. , J=5.7 Гц), 5.33 (1H, с.), 5.60(1H, с.), 5.90(2H, с.), 6.2-6.7(3H, м.), 7.12(2H, с.).
Ссылочный пример 47. Получение 2-(3,5-ди-трет-бутил- 4-гидроксифенил)-3-(3-хлорпропил)-5-(1-пирролидинкарбонилметил) -1,3-тиазолидин-4-она.
К суспензии 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3- (3-гидроксипропил)-5-карбоксиметил-1,3-тиазолидин-4-она /0.61 г/, полученного в ссылочном примере 41, в дихлорметане /20 мл/ добавлялись тионилхлорид /0,38 г/ и каталитическое количество диметилформамида, и смесь нагревалась с обратным холодильником в течение 2 часов. После того, как она оставлялась охлаждаться, смесь добавлялась по каплям к раствору пирролидина /1.02 г/ в дихлорметане /20 мл/ при охлаждении льдом и перемешивалась при данной температуре в течение 1 часа. После завершения реакции реакционная смесь выливалась в смесь льда и воды и экстрагировалась хлороформом. Органический слой промывался последовательно 1 н соляной кислотой и солевым раствором и сушился над безводным сульфатом натрия. Растворитель выпаривался при пониженном давлении и остаток очищался с помощью хроматографии на силикагельной колонке (элюент: хлороформ-метанол, 97:3), а затем перекристаллизовывался из смеси хлороформа и н-гексана, давая 0.65 г (92%) целевого соединения в виде бесцветных кристаллов, т.пл. 193-194oC.
ЯМР (CDCl3) (200 МГц) δ:
1.43 (18H, с. ), 1.4-2.2(6H, м. ), 2.5-3.1(2H, м.), 3.2-3.7(8H, м.), 4.2-4.5(1H, м.), 5.29(1H, с.), 5.53(1H, с.), 7.08 (2H, с.)
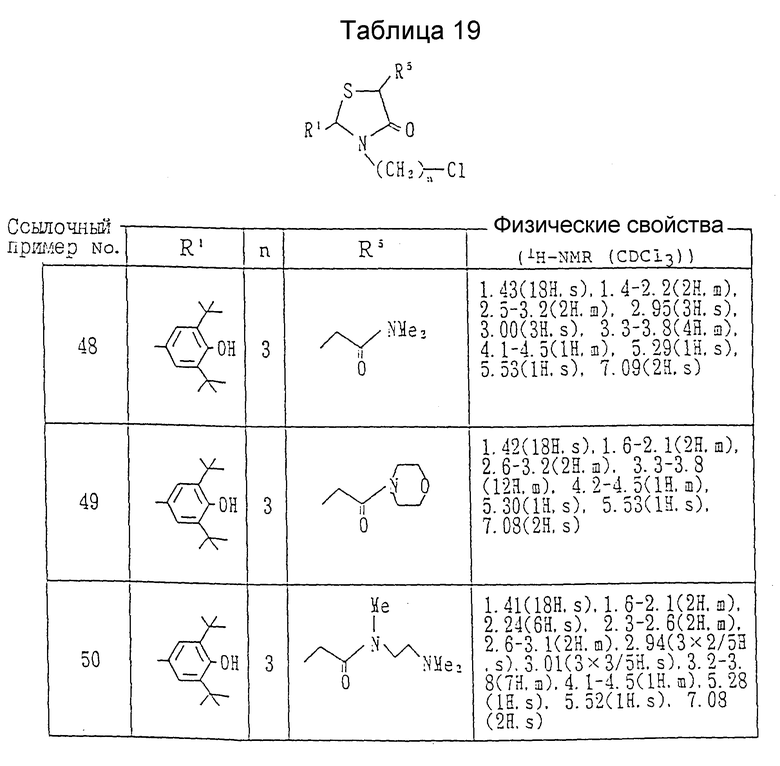
Ссылочные примеры 48 - 50.
Каждое соединение, показанное в таблице 19, получалось в соответствии с процедурой ссылочного примера 47, с использованием в каждом случае соответствующего амина.
Пример 50. Получение 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-[3- [N-метил-N-[2-(3,4-метилендиоксифенокси)этил] амино] пропил] -5- (1-пирролидинкарбонилметил)-1,3-тиазолидин-4-она.
Целевое соединение получалось в виде бледно-коричневого масла в соответствии с процедурой примера 1, с использованием 2-(3,5-ди-третбутил-4-гидроксифенил)-3-(3-хлорпропил)-5-(1-пирролидин- карбонилметил)-1,3-тиазолидин-4-она, полученного в ссылочном примере 47, вместо 2-(3,5-диизопропил-4-гидроксифенил)-3-(3-хлорпропил)-1, 3-тиазолидин-4- -она.
ЯМР (CDCl3) (200 МГц) δ:
1.41(18H, с. ), 1.4-2.1(6H, м.), 2.20(3H, с.), 2.2- 2.5(2H, м.), 2.5-3.1(4H, м. ), 3.2-3.8(6H, м. ), 3.93(2H, т., J=5.7 Гц), 4.2-4.5(1H, м.), 5.29(1H, с.), 5.57(1H, с.), 5.88(2H, с.), 6.1-6.8(3H, м.), 6.9-7.2(2H, м.)
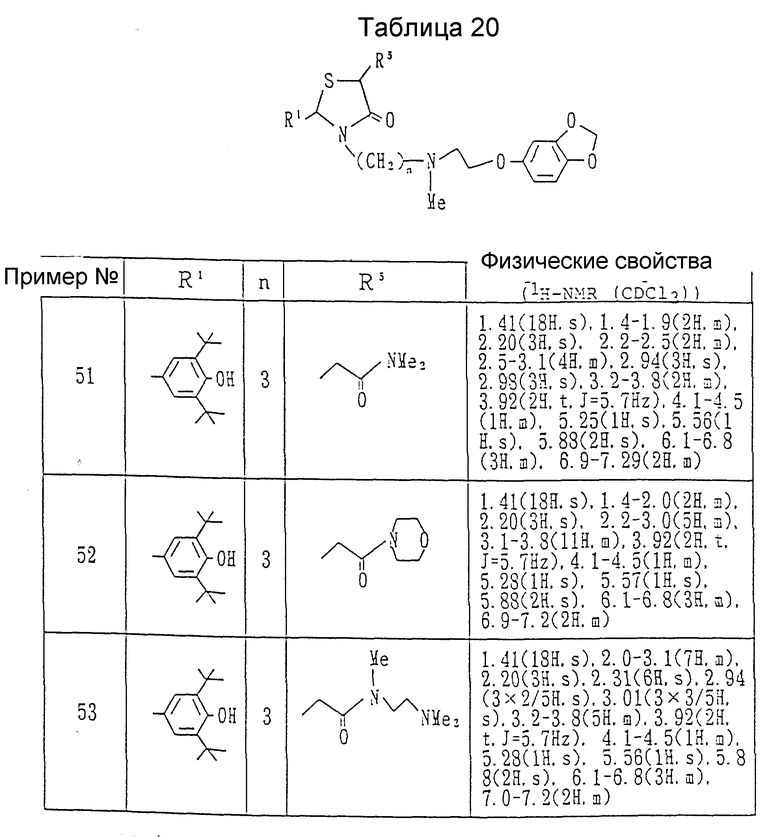
Примеры 51 - 53. Каждое соединение, показанное в таблице 20, получалось согласно процедуре примера 50, с использованием каждого из соединений, полученных в ссылочных примерах 48 - 50, вместо 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-(3-хлорпропил-5-(1- пирролидинкарбонилметил)-1,3-тиазолидин-4-она.
Ссылочный пример 51. Получение 2-(3,5-ди-трет-бутил-4- гидроксифенил)-3-(3-бромпропил)-5-метокси-1,3-тиазолидин-4-она.
К раствору 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-(3- бромпропил)-1,3-тиазолидин-4-она /1.0 г/, полученного в ссылочном примере 29, в дихлорметане /15 мл/ добавлялся по каплям сульфурилхлорид /0.36 г/ при охлаждении смесью льда и воды, и смесь перемешивалась при комнатной температуре в течение 1,5 часов. Растворитель выпаривался при пониженном давлении, и к остатку добавлялся метанол /10 мл/, и смесь перемешивалась при комнатной температуре на протяжении ночи. Смесь концентрировалась при пониженном давлении, и остаток очищался с помощью хроматографии на силикагельной колонке (элюент: хлороформ), давая 0.59 г (48%) целевого соединения в виде бледно-коричневого масла.
ЯМР (CDCl3) (200 МГц) δ:
1.42(18H, с. ), 1.5-2.3(2H, м. ), 2.8-3,6(4H, м.), 3.46(3х2/5H, с.), 3.52(3х3/5H, с.), 5.2-6.1(3H, м.), 7.08(2х2/5H, с.), 7.12(3х3/5H, с.)
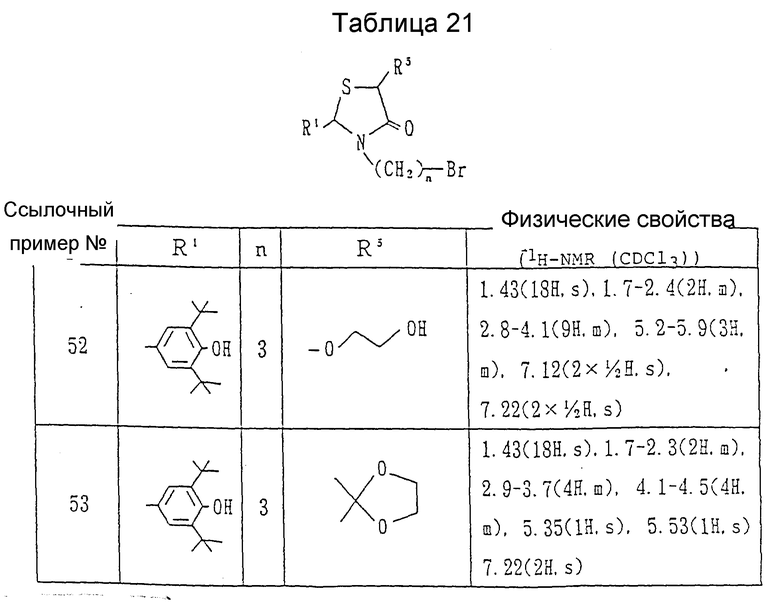
Ссылочные примеры 52 и 53. Каждое из соединений, приведенных в таблице 21, получалось в соответствии с процедурой ссылочного примера 51 с использованием этилен-гликоля вместо метанола.
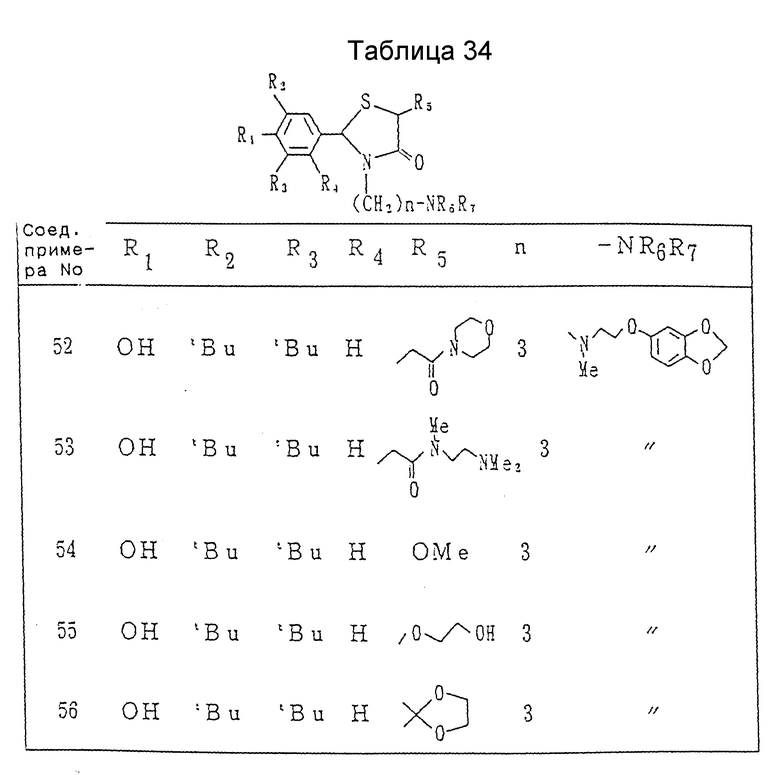
Пример 54. Получение 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-[3- [N-метил-N-[2-(3,4-метилендиоксифенокси)этил] амино] пропил]- 5-метокси-1,3-тиазолидин-4-она.
Целевое соединение получалось в виде бледно-желтого масла в соответствии с процедурой примера 26-A с использованием 2-(3,5-дитрет-бутил-4-гидроксифенил)-3-(3-бромпропил)- 5-метокси-1,3-тиазолидин-4-она, полученного в ссылочном примере 51, вместо 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-(3-бромпропил)-1,3 -тиазолидин-4-она.
ЯМР (CDCl3) (270 МГц) δ:
1.41(18H, с. ), 1.4-1.9(2H, м. ), 2.18(3х2/5H, с.), 2.22(3х3/5H, с.), 2.2-3.1(5H, м. ), 3.46(3х2/5H, с.), 3.51(3х3/5H, с.), 3.5-3.7(1H, м), 3.8-4.1(2H, м.), 5.2-5.8(3H, м.), 5.90(2H, с.), 6.1-6.8(3H, м.), 7.21(2х2/5H, с. ), 7.26(2х3/5H, с.)
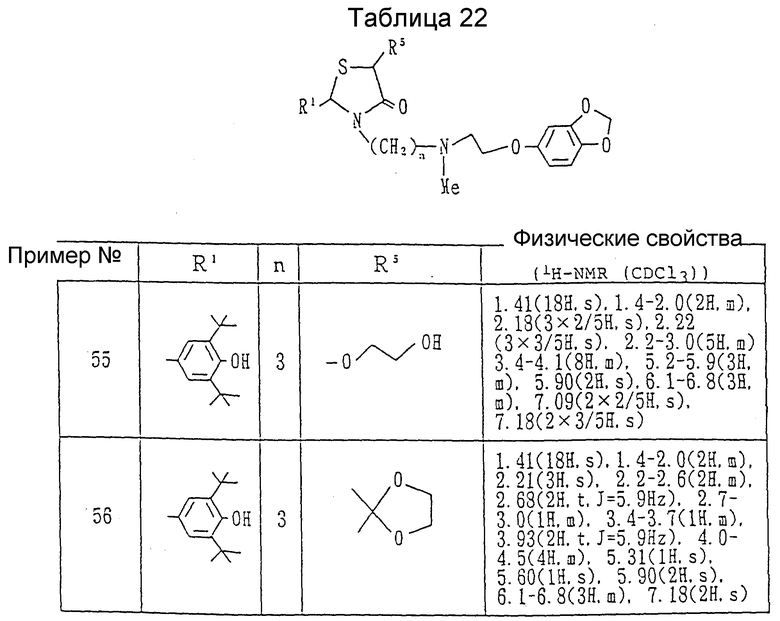
Примеры 55 и 56. Каждое из соединений, показанных в таблице 22, получалось в соответствии с процедурой примера 54, с использованием каждого из соединений, полученных в ссылочных примерах 52 и 53, вместо 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-(3- бромпропил)-5-метокси-1,3-тиазолидин-4-она.
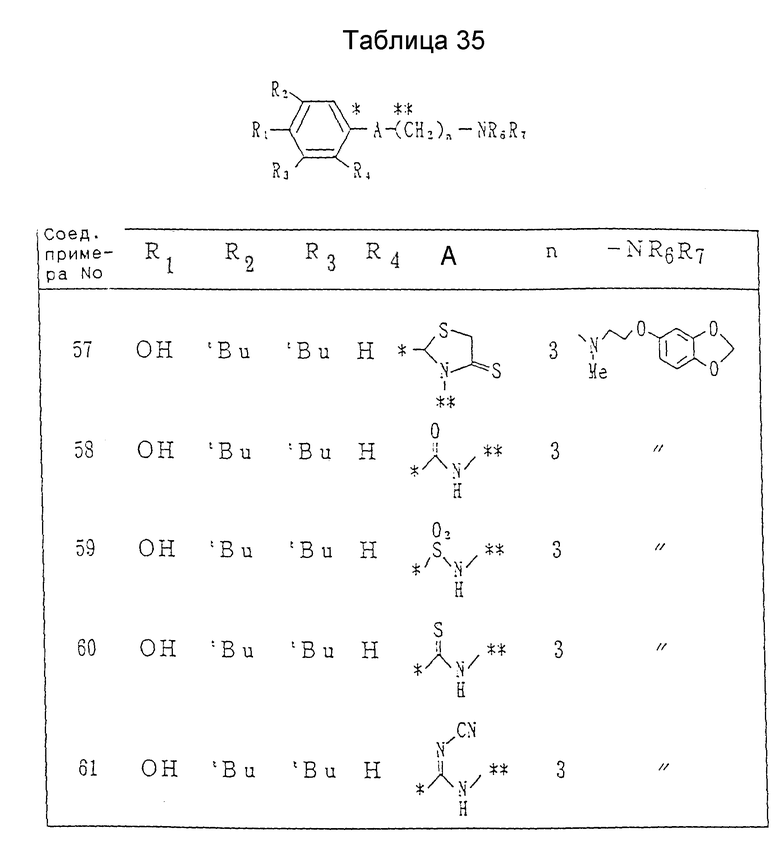
Пример 57. Получение 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-[3- [N-метил-N-[2-(3,4-метилендиоксифенокси)этил] амино] пропил] - 1,3-тиазолидин-4-тиона.
В ТГФ /5 мл/ суспендировались 2-(3,5-ди-трет-бутил-4- гидроксифенил) -3-[3-[N-метил-N-[2- (3,4-метилендиоксифенокси) этил]амино]пропил]-1,3-тиазолидин-4-он /217 мг/ и реагент Лоуссона /194 мг/, и суспензия перемешивалась при комнатной температуре в течение 5 часов. Растворитель выпаривался при пониженном давлении, и к остатку добавлялась вода /20 мл/, затем смесь экстрагировалась хлороформом. Органический слой промывался последовательно водой и солевым раствором и сушился над безводным сульфатом натрия. Растворитель удалялся с помощью выпаривания при пониженном давлении, и остаток очищался с помощью хроматографии на силикагельной колонке (элюент: хлороформ-метанол, 99:1), давая 181 мг (81%) целевого соединения в виде бледно-желтого масла.
ЯМР (CDCl3) (200 МГц) δ:
1.41(18H, с.), 1.3-1.8(2H, м.), 2.20(3H, с.), 2.3- 2.5(2H, м.), 2.70(2H, т. , J= 5.7 Гц), 3.1-3.3(1H, м.), 3.93(2H, т., J=5.7 Гц), 3.9-4.1(1H, м.), 4.26 и 4.40(2H, АВкв., J =16.0 Гц), 5.34(1H, с.), 6.18(2H, с.), 6.04(1H, с. ), 6.2-7.0(3H, м.), 7.07(2H, с.).
Пример 58. Получение N-[3-[N-метил-N-[2-(3,4- метилендиоксифенокси)этил] амино]-пропил]-3,5-ди-трет-бутил-4- гидроксибензамида.
К суспензии 3,5-ди-трет-бутил-4-гидроксибензойной кислоты /1.00 г/ в тетрагидрофуране /17 мл/ добавлялись оксалилхлорид /0.76 г/ и каталитическое количество диметилформамида при 0oC смесь перемешивалась при комнатной температуре в течение 1 часа. Растворитель и избыток оксалилхлорида удалялись при пониженном давлении, и к остатку добавлялся тетрагидрофуран /8 мл/. Полученный раствор добавлялся по каплям к раствору 3-[N-метил-N-[2-(3,4-метилендиоксифенокси)этил]амино]пропиламина /1.01 г/ и триэтиламина /0.41 г/ в тетрагидрофуране /13 мл/ при 0oC, и смесь перемешивалась при комнатной температуре в течение 6 часов. Реакционная смесь выливалась в холодную воду, и продукт экстрагировался хлороформом. Органический слой промывался солевым раствором и сушился над безводным сульфатом натрия. Растворитель выпаривался при пониженном давлении, и остаток очищался с помощью хроматографии на силикагельной колонке (элюент: хлороформ-метанол, 97:3), давая 1,35 г (70%) целевого соединения в виде бледно коричневого масла.
ЯМР (CDCl3) δ:
1.34х1/3H, с. ), 1.43(18х2/3H, с.), 1.7-1,9(2H,м.), 2.41(3H, с.), 2.6-2.7(2H, м.), 2.8-2.9(2H, м.), 3.5-3.6(2H, м.), 3.9-4.1(2H, м.), 5.48(1H, с. ), 5.86(2х2/3H, с. ), 5.88(2х1/3H, с.), 6.1-6.7(3H, м.), 7.64(2х2/3H,с.), 7.79(2х1/3H, с.), 7.8-8.0(1н, шир. с.)
Пример 59. В соответствии с процедурой примера 58 получался 3,5- ди-трет-бутил-4-гидроксибензолсульфонилхлорид из 3,5-ди-трет-бутил-4-гидроксибензолсульфоновой кислоты и тионилхлорида вместо 3,5-ди-трет-бутил-4-гидроксибензойной кислоты и оксалилхлорида, и затем превращался в N-[3-[N-метил-N-(3,4-метилендиоксифенокси)этил]амино]пропил]-3,5-ди- третбутил-4-гидроксибензолсульфонамид, давая бесцветное масло.
ЯМР (CDCl3) (200 МГц) δ:
1.43(18H, с. ), 1.3-1.8(2H, м.), 2.25(3H, с.), 2.51(2H, т., J=6.3 Гц), 2.72(2H, т. J= 6.3 Гц), 3.07(2H, т., J= 6.3 Гц), 3.97(2H, т., J=6.3 Гц), 5.66(1H, с.), 5.90(2H, с.), 6.2-6.7(3H, м.), 7.67(2H, с.)
Пример 60. Получение N-[3-[N-метил-N-[2- (3,4- метилендиоксифенокси)этил]амино]пропил]-3,5-ди-трет-бутил-4- гидроксибензотиоамида.
Целевое соединение получалось в виде бледно-желтых кристаллов в соответствии с процедурой примера 57 при использовании N-[3-[N-метил-N-[2-(3,4-метилендиоксифенокси)этил] амино] пропил] -3,5- ди-трет-бутил-4-гидроксибензола, полученного в примере 58, вместо 2-(3,5-ди-третбутил-4-гидроксифенил)- 3-[3-[N-метил-N-[2-(3,4-метилендиоксифенокси)-этил]амино]пропил]-1,3- тиазолидин-4-она, т.пл. 114-115oC.
ЯМР (CDCl3) (200 МГц) δ:
1.42(18H, с.), 1.6-2.1(2H, м.), 2.21(3H, с.), 2.5-2.9(4H, м.), 3.80(2H, т., J=5.7 Гц), 3.8-4.1(2H, м.), 5.44(1H, с.), 5.82(2H, с.), 5.8-6.7(3H, м.), 7.5-7.8(3H, м.)
Пример 61. Получение N-циано-N'-[3-[N-метил-N-[2-(3,4- метилендиоксифенокси)-этил]амино]пропи]-3,5-ди-трет-бутил-4- гидроксибензамидина.
К раствору N-[3-[N-метил-N-[2-3, 4-метилендиоксифенокси) этил]амино] пропил] -3,5-ди-трет-бутил-4-гидроксибензотиоамида /1.0 г/, полученного в примере 60, в сухом тетрагидрофуране добавлялся гидрид натрия /0.16 г/ при 0oC в атмосфере азота, и смесь перемешивалась при той же температуре в течение 1 часа. К смеси добавлялся этилиодид /0.31 г/ с последующим перемешиванием при комнатной температуре в течение 2 часов. Смесь снова охлаждалась до 0oC, и к ней добавлялся цианамид /0.84 г/ с последующим перемешиванием при комнатной температуре в течение 15 часов. После завершения реакции смесь выливалась в смесь льда и воды, и продукт экстрагировался хлороформом. Органический слой промывался солевым раствором и сушился над безводным сульфатом натрия. Растворитель удалялся выпариванием при пониженном давлении, и остаток очищался с помощью хроматографии на силикагельной колонке (элюент: хлороформ-метанол, 99: 1), давая 0.70 г (69%) целевого соединения в виде бледно-желтых кристаллов, т.пл. 129-130oC.
ЯМР (CDCl3) (200 МГц) δ:
1.45(18H, с. ), 1.6-2.1(2H, м.), 2.20(3H, с.), 2.6-3.0(4H, м.), 3.6-3.8(2H, м.), 3.83(2H, т., J=5.7 Гц), 5.56(1H, с.), 5.84(2H, с.), 5.8-6.8(3H, м.), 7.48(2H, с), 7.48(2H, с.), 8.44(1H, шир.с.).
Ссылочный пример 54. Получение 3-(3-бромпропил)-5-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3,4- оксадиазол/-2(3H)-она.
К раствору 5-(3,5-ди-трет-бутил-4-гидроксифенил)-1, 3,4-оксадиазол-2(3H)-она /0.50 г/ в диметилформамиде /8 мл/ добавлялись карбонат натрия /0.36 г/ и дибромпропан /1.74 г/, с последующим перемешиванием при комнатной температуре в течение 5 часов. После завершения реакции реакционная смесь выливалась в смесь льда и воды, и продукт экстрагировался этилацетатом. Органический слой сушился над безводным сульфатом натрия, и растворитель выпаривался при пониженном давлении. Остаток очищался с помощью хроматографии на силикагельной колонке (элюент: хлороформ), а затем перекристаллизовывался из смеси хлороформа и н-гексана, давая 0.45 г (63%) целевого соединения в виде бесцветных кристаллов. Т.пл. 130-131oC.
ЯМР (CDCl3) (200 МГц) δ:
1.46(18H, с.), 2.1-2,6(2H, м.), 3.46(2H, т., J=6.6 Гц), 3.93(2H, т., J= 6.6 Гц), 5.60(1H, с.), 7.63(2H, с.).
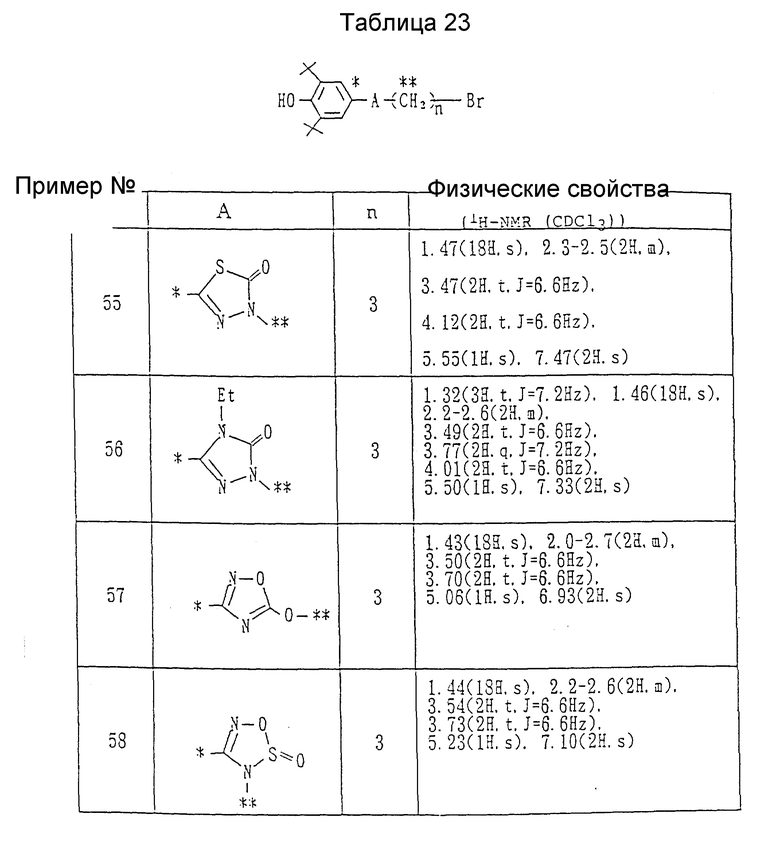
Ссылочные примеры 55 - 58. Каждое из соединений, приведенных в таблице 23, получалось в соответствии с процедурой ссылочного примера 54, с использованием в каждом случае вместо 5-(3,5-ди-трет-бутил-4- гидроксифенил)-1,3,4-оксадиазол-2(3H)-она соответствующего 5-членного гетероциклического соединения.
Пример 62. Получение 5-(3,5-ди-трет-бутил-4-гидроксифенил)-3- [3-[N-метил-N-[2-(3,4-метилендиоксифенокси)-этил] амино] пропил] - 1,3,4-оксадиазол-2/3H/-она.
Целевое соединение получалось в виде бесцветного масла в соответствии с процедурой примера 26-A с использованием 3- (3-бромпропил)-5-(3,5-ди-трет-бутил-4-гидроксифенил)- 1,3,4-оксадиазол-2(3H)-она, полученного в ссылочном примере 54, вместо 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-(3-бромпропил) -1,3-тиазолидин-4-она.
ЯМР (CDCl3) (270 МГц) δ:
1.45(18H, с. ), 1.8-2.2(2H, м.), 2.35(3H, с.), 2.4-3.0(4H, м.), 3.7-4.2(4H, м.), 5.60(1H, с.), 5.88(2H, с.), 6.1-6.8(3H, м.), 7.65(2H, с.).
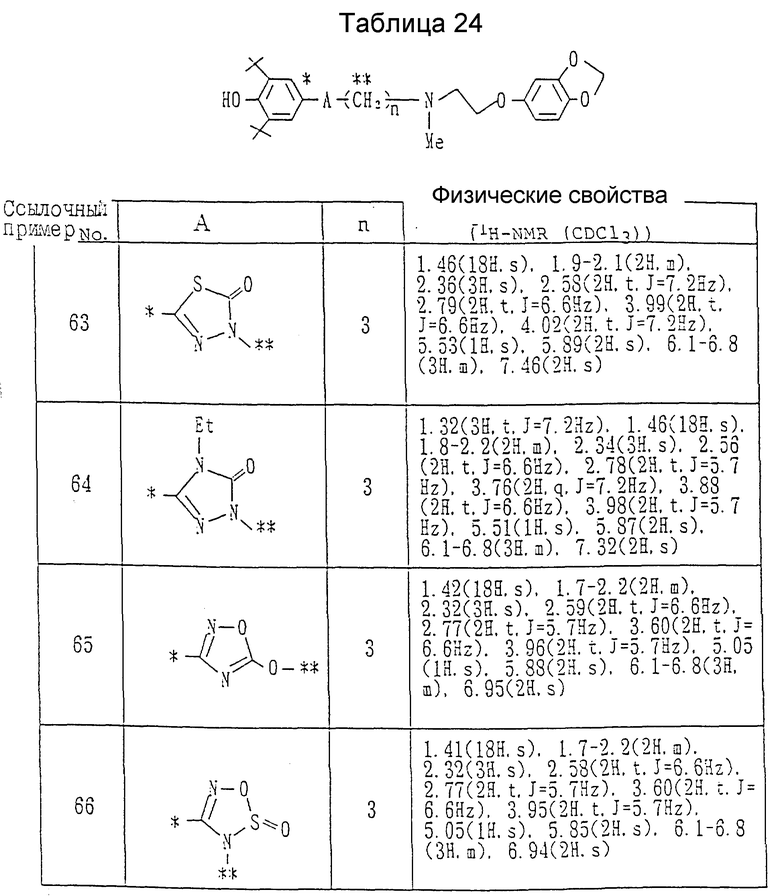
Примеры 63 - 66. Каждое соединение, показанное в таблице 24, получалось в соответствии с процедурой примера 62 с использованием каждого из соединений, приведенных в Таблице 23, вместо 3- (3-бромпропил)-5-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3,4- оксадиазол-2(3H)-она.
Ссылочный пример 59. Получение 5-(3,5-ди-трет-бутил-4- гидроксифенил)-1-(3-гидроксипропил)имидазола,
К раствору 3-гидрокси-N-(3,5-ди-трет-бутил-4-гидроксибензилиден) -пропиламина /1.50 г/ в метаноле /50 мл/ добавлялись тозилметилизоцианат /1.68 г/ и карбонат калия /1.43 г/, и смесь перемешивалась при комнатной температуре в течение 16 часов. После завершения реакции реакционная смесь выливалась в смесь льда и воды и экстрагировалась дихлорметаном. Органический слой сушился над безводным сульфатом натрия, и растворитель выпаривался при пониженном давлении. Получающиеся в результате сырые кристаллы перекристаллизовывались из смеси хлороформа и диэтилового эфира, давая 1.41 г /82%/ целевого соединения в виде бледножелтых кристаллов, т.пл. 166-167oC.
ЯМР (CDCl3) δ:
1.43(18H, с.), 1.5-2.3(3H, м.), 3.53(2H, т., J= = 6.6 Гц), 4.08(2H. т., J=6,6 Гц), 5.30(1H, шир. с.), 6.92(1H, шир. с.), 7.10(2H, с.), 7.50(1H, с.)
Ссылочный пример 60. Получение 5-(3,5-ди-трет-бутил-4- гидроксифенил)-1-(3-хлорпропил)имидазола.
К раствору 5-(3,5-ди-трет-бутил-4-гидроксифенил)-1-(3- гидроксипропил)имидазола /1.20 г/, полученного в ссылочном примере 59, в дихлорметане /30 мл/ добавлялись тионилхлорид /0.65 г/ и каталитическое количество диметилформамид и смесь нагревалась с обратным холодильником в течение 2 часов, После оставления для охлаждения реакционная смесь выливалась в 5% водный раствор карбоната натрия, охлаждаемый смесью льда и воды, и продукт экстрагировался дихлорметаном. Органический слой сушился над безводным сульфатом натрия, и растворитель выпаривался при пониженном давлении. Получающийся в результате сырой продукт перекристаллизовывался из смеси дихлорметана и диэтилового эфира, давая 1.09 г (86%) целевого соединения в виде бледно-желтых кристаллов, т.пл. 178-179oC,
ЯМР (CDCl3) (60 МГц) δ:
1.43(18H, с.), 1.6-2.8(2H, м.), 3.35(2H, т., J=6.6 Гц), 4.15(2H, т., J= 6.6 Гц), 5.45(1H, шир. с), 6.90(1H, с.), 7.05(2H, с.), 7.43(1H, с.)
Пример 67. Получение 5-(3,5-ди-трет-бутил-4-гидроксифенил)-1-[3- [N-метил-N-[2-(3,4-метилендиоксифенокси)этил]амино]пропил]имидазола.
Целевое соединение получалось в виде бесцветного масла в соответствии с процедурой примера 1 с использованием 5-(3, 5-ди-трет-бутил-4-гидроксифенил)-1-(3-хлорпропил)имидазола, полученного в ссылочном примере 60, вместо 2-(3,5-диизопропил-4-гидроксифенил)-3-(3-хлорпропил)-1,3-тиазолидин-4- она.
ЯМР (CDCl3) (200 МГц) δ:
1.43(18H, с. ), 1.5-2.0(2H, м.), 2.16(3H, с.), 2.32(2H, т., J=6,6 Гц), 2.64(2H, т. , J= 5.7 Гц), 3.88(2H, т., J= 5.7 Гц), 3.98(2H, т., J=6.6 Гц), 5.35(1H, шир. с.), 5.87(2H, с.), 6.1-6.8(3H, м.), 6.96(1H, с.), 7.12(2H, с. ), 7.52(1H, с.)
Пример 68. Получение 2- (3,5-ди-трет-бутил-4-гидроксифенил)-3-[3- [N-метил-N-[2-(3,4-метилендиоксифенокси)этил] амино]пропил]- 1,3-тиазолидин-4-она-1-оксида.
К раствору 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-[3- [N-метил-N-[2-(3,4-метилендиоксифенокси)этил]амино]пропил]-1,3- тиазолидин-4-она /0.30 г/, полученного в примере 26-A или 26-B, в уксусной кислоте /5 мл/ добавлялся 35%-ный водный раствор перекиси водорода /0.20 г/, и смесь перемешивалась при комнатной температуре на протяжении ночи. После завершения реакции реакционная смесь добавлялась к смеси этилацетата и 5%-ного водного раствора карбоната натрия и перемешивалась. Органический слой отделялся, сушился над безводным сульфатом натрия. Растворитель выпаривался при пониженном давлении, и остаток очищался с помощью хроматографии на силикагельной колонке (элюент: хлороформ-метанол, 98:2), давая 0.12 г (39%) целевого соединения в виде бесцветного масла. MC (m/z):558(M+)
ЯМР (CDCl3) (200 МГц) δ:
1.41(18H, с.), 1.4-2.0(2H, м.), 2.28(3H, с.), 2.3-2.7(2H, м.), 2.72(2H, т., J=5.7 Гц), 2.9-3.2(1H, м.), 3.37 и 3.69(2H, АВкв., J=16 Гц), 3.8-4.2(3H, м.), 5.40(1H, с.), 5.61(1H, с.), 5.87(2H, с.), 6.1-6.8(3H, м.), 6.94(2H, с.)
Ссылочный пример 61. Получение гидрохлорида 2-(3,5-ди-трет-бутил-4-гидроксифенил)-1,3-тиазолидина.
В смешанном растворителе, состоящем из метанола /100 мл/ и тетрагидрофурана /100 мл/, растворялось 5.0 г 3,5-ди-третбутил-4-гидроксибензальдегида /5.0 г/, и добавлялся раствор 2-аминоэтантиола /1.73 г/ в метаноле /10 мл/. Затем смесь перемешивалась при комнатной температуре в течение 2 часов. После завершения реакции растворитель выпаривался при пониженном давлении, и к остатку добавлялось 200 мл льда и воды. Продукт экстрагировался хлороформом, и органический слой сушился над безводным сульфатом натрия. Растворитель выпаривался при пониженном давлении, и к остатку добавлялась смесь метанол-соляная кислота /5 мл/. Смесь растиралась с диэтиловым эфиром, давая 5.81 г (82%) целевого соединения в виде белого порошка.
ЯМР (CDCl3) (200 МГц) δ:
1.43(18H, с. ), 2.9-3.2(2H, м. ), 3.6-3.8(1H, м.), 3.8-4.0(1H, м.), 5.20(1H, с.), 5.46(1H, с.), 7.2-7.4(2H, м.)
Ссылочный пример 62. Получение 2-(3,5-ди-трет-бутил- 4-гидроксифенил)-3-акрилоил-1,3-тиазолидина.
К суспензии гидрохлорида 2-(3,5-ди-трет-бутил-4-гидроксифенил) -1,3-тиазолидина /1.65 г/, полученного в ссылочном примере 61, в тетрагидрофуране /20 мл/ добавлялся триэтиламин /1.52 г/, и к смеси добавлялся акрилоилхлорид /0.63 г/ при 0oC. Смесь перемешивалась при данной температуре в течение 3 часов. После завершения реакции реакционная смесь выливалась в смесь льда и воды, и продукт экстрагировался хлороформом. Органический слой промывался последовательно 1 норм. соляной кислотой, насыщенным водным раствором бикардоната натрия и солевым раствором, затем сушился над безводным сульфатом натрия. Растворитель выпаривался при пониженном давлении, и остаток очищался с помощью хроматографии на силикагельной колонке (элюент: хлороформ-метанол, 98: 2), давая 0.93 г (54%) целевого соединения в виде бесцветных кристаллов, т. пл. 147-149oC.
ЯМР (CDCl3) (200 МГц) δ:
1.40(18H, с. ), 3.0-3.2(2H, м), 3.8-4.0(1H, м. ), 4.2-4.5(1H, м.), 5.20(1H, шир. с.), 5.5-5.8(1H, м.), 5.9-6.6(3H, м.), 6.98(2H, шир. с.)
Пример 69. Получение 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-[3- [N-метил-N-[2-(3,4-метилендиоксифенокси)этил]амино]пропионил]- 1,3-тиазолидина,
К раствору 2-(3,5-ди-трет-бутил-4-гидроксифенил)-3-акрилоил-1,3- тиазолидина /0.35 г/, полученного в ссылочном примере 62, в хлороформе /5 мл/ добавлялся N-метил-2-(3,4-метилендиоксифенокси)этиламин /0.20 г/, и смесь нагревалась с обратным холодильником в течение 3 часов. После завершения реакции растворитель выпаривался при пониженном давлении, и остаток очищался с помощью хроматографии на силикагельной колонке (элюент: хлороформ-метанол, 98:2), давая 0.41 г 76%) целевого соединения в виде бесцветного масла.
ЯМР (CDCl3) (200 МГц) δ:
1.41(18H, с. ), 2.14(3H, с.), 2.2-2.7(4H, м.), 2.7- 2.9(2H, м.), 2.9-3.2(2H, м.), 3.8-4.1(3H, м.), 4.2-4.4(1H, м.), 5.1-5.3(1H, м.), 5.89(2H, с. ), 6.02(1H, шир. с.), 6.2-7.1(5H, м.)
Пример 70. Получение (+)-2-(3,5-ди-трет-бутил-4-гидроксифенил)-3- [3-[N-метил-N-[2-(3,4-метиленгидоксифенокси)этил] амино] пропил] - 1,3-тиазолидин-4-она.
Соединение, полученное в примере 26-A или 26-B и весящее 400 мг, подвергалось ВЭЖХ с использованием колонки для оптического расщепления (Хирацел OD; 2 см (диаметр) х 25 см) в нескольких десятках раздельных фракций в условиях подвижной фазы н-гексан-изопропиловый спирт, /80:20/, скорость потока 16 мл/мин, и детекционной длине волны 280 нм, и отделялось 180 мг целевого соединения. Удельное вращение гидрохлорида получающегося соединения является следующим: (α)D = +36.14 (EtOH, с=0.332),
Получение (-)-2-(3,5-ди-трет-бутил-4-гидроксифенил)-3- [3-[N-метил-N-[2-(3,4-метилендиоксифенокси)этил]амино]пропил]- 1,3-тиазолидин-4-она.
Соединение, полученное в примерах 26-A или 26-B, весом 400 мг подвергалось ВЭЖХ в виде нескольких десятков раздельных фракций в тех же условиях, что и в примере 70, и получалось 170 мг целевого соединения. Гидрохлорид получающегося в результате соединения имел следующее удельное вращение: (α)D = -36.72 (этанол, с=0.610).
Пример 72. Получение 2,5-транс-2-(3,5-ди-трет-бутил-4- гидроксифенил)-3-[3-[N-метил-[2-(3,4-метилендиоксифенокси)этил] амино] пропил] -5-метил-1,3-тиазолидин-4-она.
Соединение, полученное в примере 41-A или 41-A, весом 500 мг подвергалось ВЭЖХ с использованием силикагельной колонки (УМС-ПакСИЛ SH-043-5,2 см (диаметр) х 25 см) в нескольких десятках раздельных фракций в условиях подвижной фазы хлороформ-изопропанол, /97:3/, скорость потока 12 мл/мин, и детекционной длине волны 280 нм, и выделялось 150 мг целевого соединения. Стереохимия устанавливалась по 1H-ЯМР данным авторов M.R. Johnson и др., (M.R. Johnson, и др., J. Org. Chem. 48, 494 (1983)).
ЯМР (CDCl3) (270 МГц) δ:
1.41(18H, с. ), 1.5-1.9(2H, м.), 1,58(3H, д., J=6.9 Гц), 2.23(3H, с.), 2.3-2.5(2H, м. ), 2.69(2H, т., J=5.6 Гц), 2.7-2.9(1H, м.), 3.5-3.7(1H, м.), 3.94(2H, т. , J = 5.6 Гц), 4.02(1H, д, кв. J=1.7, 6.9 Гц), 5.28(1H, с.), 5.57(1H, д., J=1.7 Гц), 5.90(2H, с.), 6.2-6.8(3H, м.), 7.05(2H, с.)
Пример 73. Получение 2,5-цис-2-(3,5-ди-трет-бутил-4-гидроксифенил)- -3-[3-[N-метил-N-[2-(3,4-метилендиоксифенокси)-этил] амино]пропил] -5-метил-1,3-тиазолидин-4-она.
Соединение, полученное в примере 41-A или 41-B, весом 500 мг подвергалось ВЭЖХ в нескольких десятках фракций в тех же условиях, что в примере 72, и получалось 140 мг целевого соединения. Стереохимия устанавливалась по данным 1H-ЯРМ M. R. Johnson и др. (M.R. Johnson и др., J. Qrg. Chem. 48, 494 (1983)).
ЯМР (CDCl3) (270 МГц) δ:
1.43(18H, с. ), 1.2-2.0(2H, м), 1.65(3H, д., J=6.9 Гц), 2.20(3H, м.), 2.2-2.5(2H, м. ), 2.67(2H, т., J=5,6 Гц), 2.7-3.0(1H, м.), 3.4-3.8(1H, м.), 3.92(2H, т., J=5.6 Гц), 4.02 (1H, кв., J=6.9 Гц), 5.30(1H, с.), 5.55(1H, с. ), 5.91(2H, с.), 6.2-6.8 (3H, м.), 7.12(2H, с.).
Пример 74. Получение (+)-2,5-цис-2-(3,5-ди-трет-бутил-4- гидроксифенил)-3-[3-[N-метил-N-[2-(3,4-метилендиоксифенокси)этил] амино]пропил]-5-метил-1,3-тиазолидин-4-она.
Соединение, полученное в примере 73, подвергалось ВЭЖХ в нескольких десятках раздельных фракций в тех же условиях, что в примере 70, для выделения целевого продукта. Получающееся соединение имело следующие показатели удельного вращения; (α)D = +27,59 (CDCl3, С=1.000).
Пример 75. Получение (-)-2,5-цис-2-(3,5-ди-трет-бутил-4- гидроксифенил)-3-[3-[N-метил-N-[2-(3,4-метилендиоксифенокси)этил] амино]пропил]-5-метил-2,3-тиазолидин-4-она.
Соединение, полученное в примере 73, подвергалось ВЭЖХ в нескольких десятках раздельных фракций в тех же условиях, что в примере 70, для выделения целевого продукта. Получающееся в результате соединение имело следующие показатели удельного вращения: (α)D = -28.39 (CDCl3, с=1.000)
Ниже приводится описание примеров испытаний для того, чтобы продемонстрировать то, что соединения, имеющие формулу I, согласно настоящему изобретению оказывают три вида действий, т.е. ингибирующее действие на липидное переокисление, сосудорасширяющее действие и действие по ингибированию перегрузки кальция.
Пример испытания 1. Ингибирующее действие на липидное переокисление ин витро:
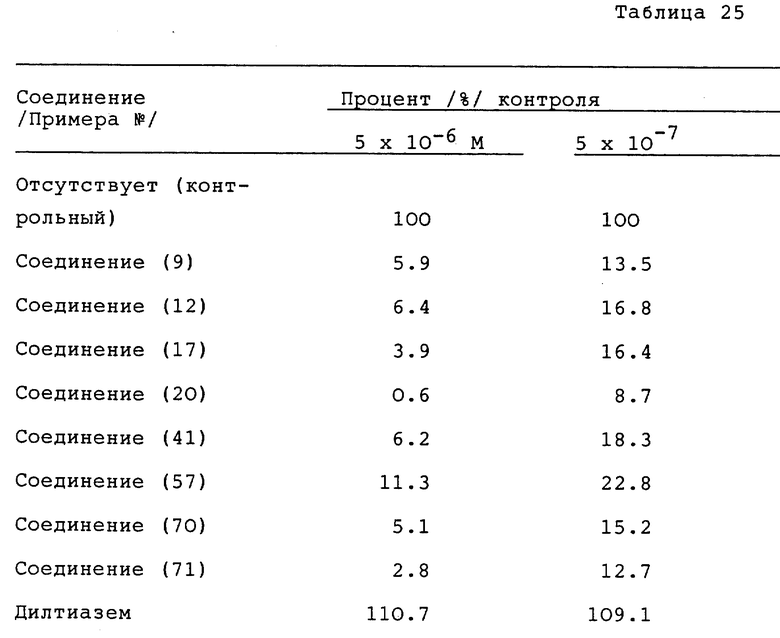
Метод A. Испытываемое соединение добавлялось к LDL кроликов, полученному в соответствии с методом Хавела и др. (Havel R.J. et al., J. Clin, Invest., 34, 1345(1955)), и затем добавлялась липоксигеназа соевых бобов типа IS (SLO) до конечной концентрации 40 мкг/мл. Окисление LDL осуществлялось с помощью инкубирования при 37oC в CO2 инкубаторе в течение 24 часов. Окисленный LDL раствор анализировался с помощью гель-проникающей хроматографии, а интенсивность флуоресценции LDL фракции измерялась при длине волны возбуждения 360 нм и длине волны эмиссии 430 нм. Результаты измерения, выраженные в виде процента контроля или подавления, приведены в таблице 25 (см. в конце описания).
Метод B. Испытуемое соединение добавлялось к LDL кролика, полученного в соответствии с методикой Havel и др. (Havel R.J., et al., J. Clin. Invest., 34, 1345 (1955)), затем добавлялся сульфат меди до конечной концентрации 1 мкМ. Окисление LDL проводилось с помощью встряхивания при 37oC в течение 24 часов. Генерируемый TBARS измерялся по методу Yagi и с использованием флуорометрии (Yagi, K. , Biohem. Med., 15, 212 (1976)). Результаты измерения, выраженные в виде процента подавления, показаны в таблице 26 (см. в конце описания).
Пример испытания 2. Сосудорасширяющее действие ин витро.
Методика.
У самцов крыс Sparague-Dawley (Cry) весом между 350 и 550 г вырезалась грудная аорта и освобождалась от окружающей ее соединительной ткани. Сосуд разрезался на кольца, имеющие ширину 2-3 мм. Получающийся в результате препарат заключался в среду гистологического препарата для регистрации изометрического напряжения (натяжения) в ванне с органом заполненной 10 мл раствора Krebs-Hanseleit (K-H раствор, pH 7.4, 37oC), который продувался смесью 95% O2/5% CO2. Изменения изометрического напряжения регистрировались с помощью изометрического преобразователя (TB-611T, производимого фирмой Нихон Коден Корп.). Перед началом эксперимента препарату сообщалось напряжение вытягивания 2 г, и препарат оставлялся для установления равновесия на 30 минут (K-H раствор заменялся свежим каждые 15 минут). Сначала препарат подвергался предварительному сжатию путем замены раствора в ванне раствором, содержащим 30 мМ K+. После того, как сжатие поддерживалось в течение 20 минут, препарат промывался K-H раствором. Спустя 60 минут (K-H раствор заменялся свежим раствором через каждые 20 минут), сжатие снова индуцировалось таким же образом, как описано выше. После того, как сжатие стабилизировалось, к системе добавлялось испытываемое соединение или дилтиазем кумулятивным образом, с приростами или инкрементами полу log-unit для получения кривой концентрация - ответная реакция.
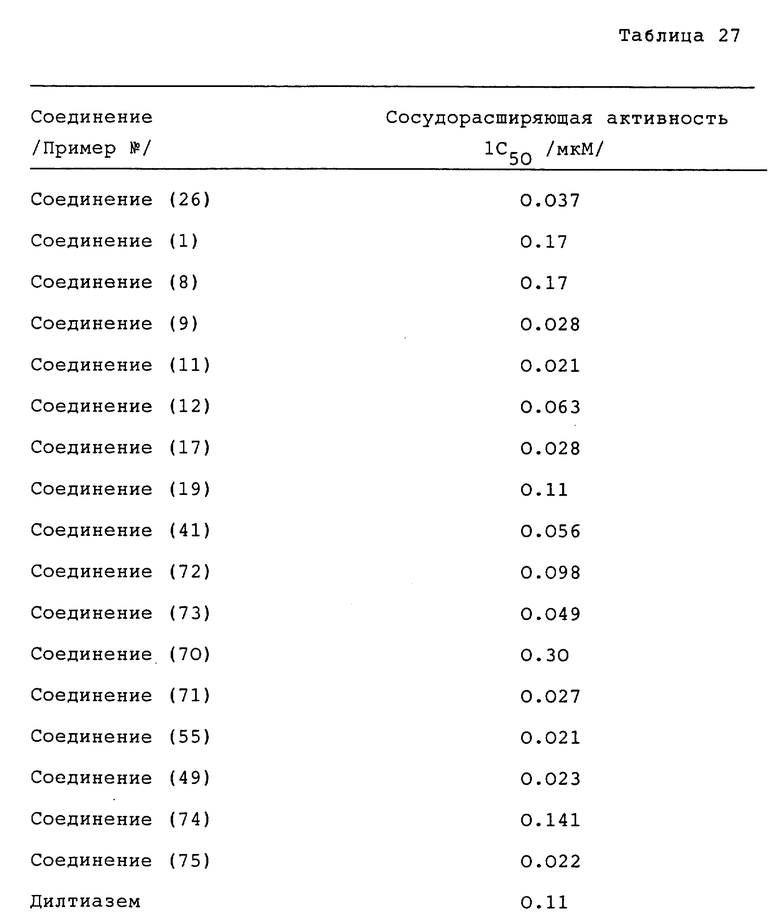
Принимая сжатие при 30 мМ K+ за 100%, получали концентрацию лекарства, при которой сжатие расслабляется до 50% в виде 1C50. Полученные результаты приведены в таблице 27 (см. в конце описания).
Пример испытания 3. Ингибирующее действие на кальциевую перегрузку ин витро, Метод A:
Приготавливались инкубированные миоциты желудочка из сердца самцов крыс Sprogue-Dawley весом 300-500 г, с использованием метода ферментной перфузии. Полученные таким образом палочковидные нормальные миоциты обрабатывались испытываемым соединением или дилтиаземом в течение 30 минут, и добавлялось 100 мкг/мл вератрина. Спустя 5 минут исследовался вид клеток для получения степени выживания и оценки таким образом эффективности соединения. Полученные результаты приведены в таблице 28 (см. в конце описания).
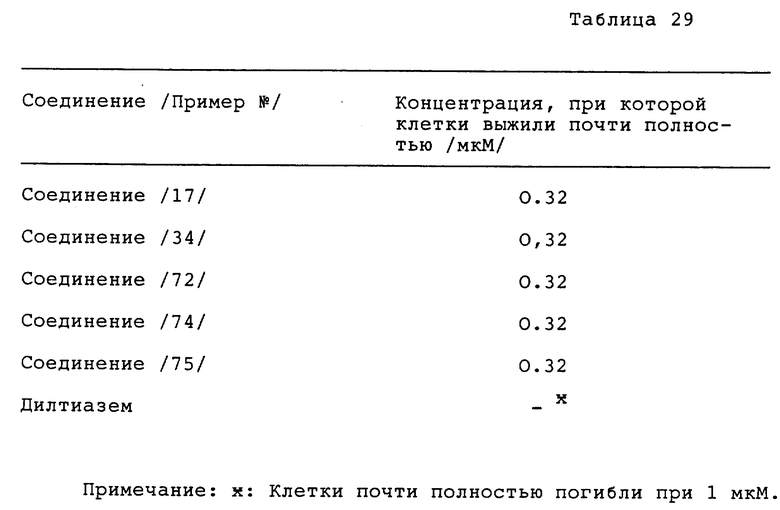
Метод B. Эффективность оценивалась так же, как в случае метода A, за исключением использования 50 мкг/мл вератрина вместо 100 мкг/мл вератрина. Полученные результаты приведены в таблице 29 (см. в конце описания).
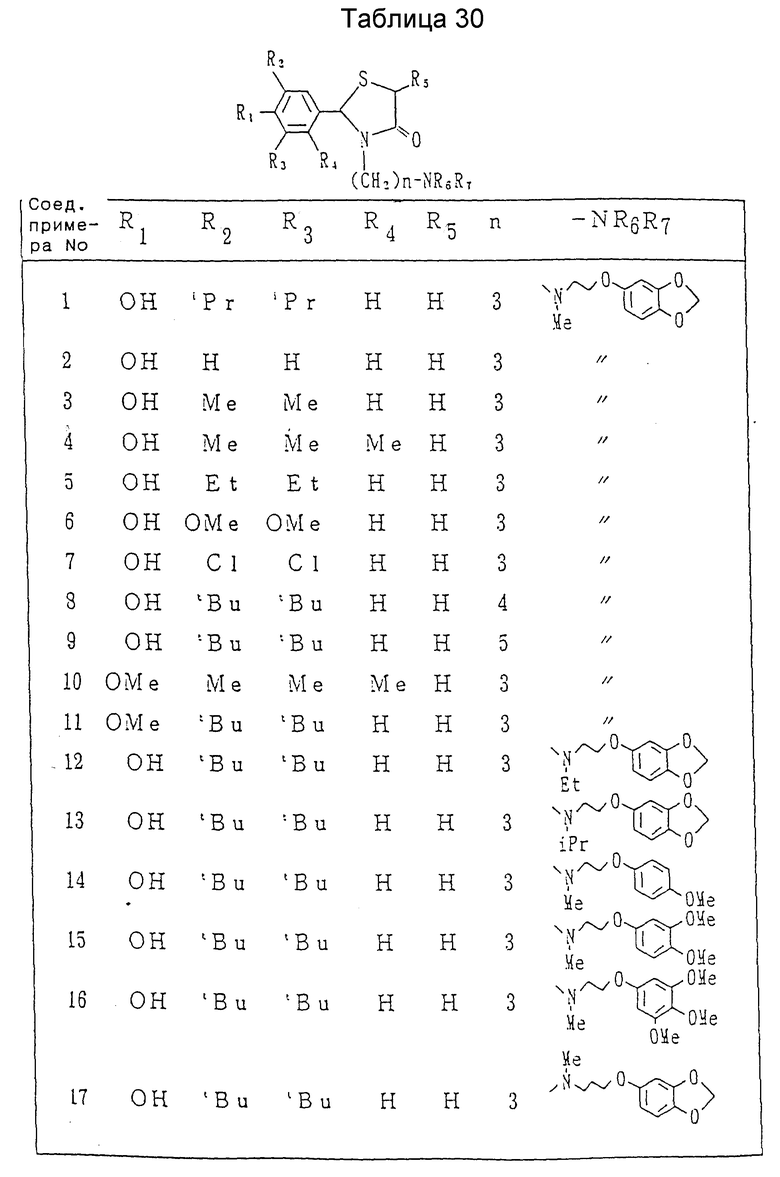
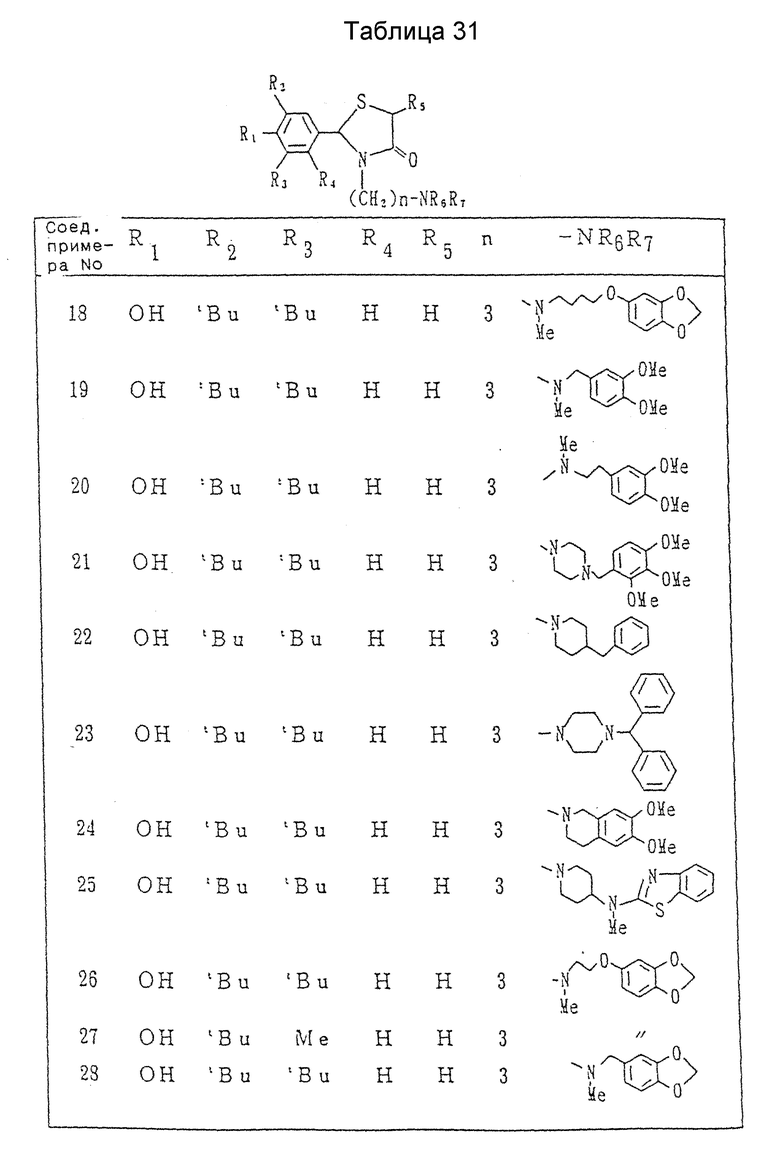
Соединения приведенных ранее примеров показаны в таблицах 30-37 (см. в конце описания).
Промышленная применимость.
Как описано выше, соединение согласно настоящему изобретению оказывает ингибирующее действие на липидное переокисление, сосудорасширяющее действие и ингибирующее действие на перегрузку кальция и могло бы использоваться в качестве профилактического или лечебного средства в случае ишемических болезней и гипертензии.














Соединения, представленные формулой I, в которой R1 - водород, гидроксил, С1-9 - ацилокси группа или низший алкоксил; R2 и R3 - Н, галоген, низший алкил, алкоксил; R4 - Н или низший алкил; А - фрагмент, представленный формулой II; R5 - Н, алкил, алкоксил, фенил, пиролидин, 5-членное кольцо, содержащее два атома кислорода, в случае которого атом углерода, к которому оно присоединено, является спироатомом; или фрагмент представленный формулами III - XVI; R6 и R7 - Н, алкил, арил или гетероциклическая группа; n = 2,3,4,5 или 6, или их возможные стереоизомеры или оптические изомеры, или их фармацевтически приемлемые соли. Соединения формулы I оказывают ингибирующее действие на перегрузку кальция в дополнение к их сосудорасширяющей активности и ингибирующее действие на липидное переокисление и полезны в качестве профилактических или лечебных средств в случаях ишемичееких болезней и гипертонии. 30 з.п. ф-лы, 37 табл.
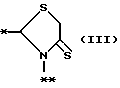
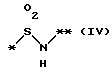
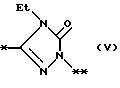
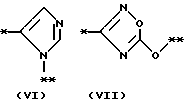
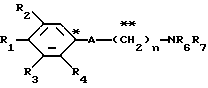
в которой R1 представляет атом водорода, гидроксильную группу, ацилоксигруппу, имеющую 1 - 9 атомов углеродв, или низшую алкоксигруппу, имеющую 1 - 6 атомов углерода;
R2 или R3, которые могут быть одинаковыми или различными, представляют каждый атом водорода, атом галогена, низшую алкильную группу, имеющую 1 - 6 атомов углерода, или низшую алкоксигруппу, имеющую 1 - 6 атомов углерода;
R4 представляет атом водорода или низшую алкильную группу, имеющую 1 - 6 атомов углерода;
A представляет фрагмент общей формулы (II)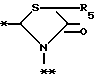
в которой R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную низшую алкоксигруппу, имеющую 1 - 6 атомов углерода; замещенный или незамещенный фенил; замещенный или незамещенный пирролидин или 5-членное кольцо, содержащее два атома кислорода, в случае которого атом углерода, к которому оно присоединено, является спироатомом, или фрагмент формулы (llI)
B,
причем B представляет фрагмент, выбранный из следующей группы фрагментов формул (lV - XVl)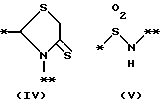
R6 и R7, одинаковые или различные, каждый представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода, замещенную или незамещенную арильную группу или замещенную или незамещенную гетероциклическую группу, при условии, что R6 и R7 оба не являются метильными группами или R6 и R7 взяты вместе, образуя замещенное или незамещенное кольцо, которое может быть сконденсированным кольцом;
n = 2, 3, 4, 5 или 6,
или их возможные стереоизомеры, или оптические изомеры, или их фармацевтически приемлемые соли.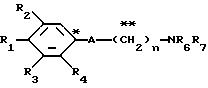
в которой R1 представляет гидроксильную группу, ацилоксигруппу, имеющую 1 - 9 атомов углерода, или низшую алкоксигруппу, имеющую 1 - 6 атомов углерода;
R2 и R3, одинаковые или различные, представляют каждый атом водорода, атом галогена, низшую алкильную группу, имеющую 1 - 6 атомов углерода, или низшую алкоксигруппу, имеющую 1 - 6 атомов углерода;
R4 представляет атом водорода или низшую алкильную группу, имеющую 1 - 6 атомов углерода;
A представляет фрагмент общей формулы (lI)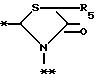
в которой R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную низшую алкоксигруппу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную финильную группу; замещенный или незамещенный пирролидин или 5-членное кольцо, содержащее два атома кислорода, в случае которого атом углерода, к которому оно присоединено, является спироатомом; или фрагмент формулы IlI
B,
в которой B представляет фрагмент, выбранный из следующей группы фрагментов формул IV - XVl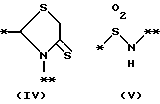
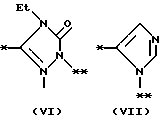
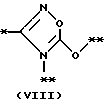
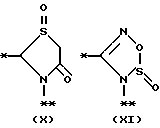
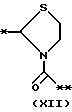
R6 и R7, одинаковые или различные, каждый представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода, замещенную или незамещенную арильную группу или замезенную или незамещенную гетероциклическую группу, при условии, что R6 и R7 оба не являются метильными группами или R6 и R7 взяты вместе, образуя замещенное или незамещенное кольцо, которое может быть сконденсированным кольцом;
n = 2, 3, 4, 5, или 6,
или его возможные стереоизомеры, или оптические изомеры, или его фармацевтически приемлемые соли.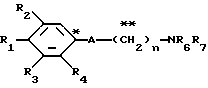
в которой R1 представляет гидроксильную группу, ацилоксигруппу, имеющую 1 - 9 атомов углерода, или низшую алкоксигруппу, имеющую 1 - 6 атомов углерода;
R2 и R3, одинаковые или различные, представляют каждый атом водорода или низшую алкильную группу, имеющую 1 - 4 атомов углерода;
R4 представляет атом водорода или метильную группу;
A - фрагмент общей формулы lI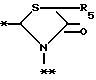
в которой R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную низшую алкоксигруппу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную фенильную группу; замещенный или незамещенный пирролидин или 5-членное кольцо, содержащее два атома кислорода, в случае которого атом углерода, к которому оно присоединено, является спироатомом, или фрагмент формулы Ill
B,
в которой B представляет фрагмент, выбранный из следующей группы фрагментов формул lV - VlIl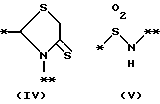
R6 и R7, одинаковые или различные, каждый представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода, замещенную или незамещенную арильную группу или замещенную или незамещенную гетероциклическую группу, при условии, что R6 и R7 оба не являются метильными группами или R6 и R7 взяты вместе, образуя замещенное или незамещенное кольцо, которое может быть сконденсированным кольцом;
n = 2, 3, 4 или 5,
или его возможные стереоизомеры, или оптические изомеры, или его фармацевтические приемлемые соли.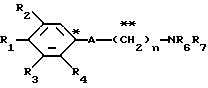
в которой R1 представляет гидроксильную группу, ацилоксигруппу, имеющую 1 - 9 атомов углерода, или низшую алкоксигруппу, имеющую 1 - 6 атомов углерода;
R2 и R3, одинаковые или различные, представляют метильную группу, этильную группу, изопропильную группу или трет-бутильную группу;
R4 представляет атом водорода или метильную группу;
A представляет фрагмент общей формулы (lI)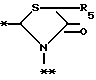
в которой R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную низшую алкоксигруппу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную фенильную группу: замещенный или незамещенный пирролидин или 5-членное кольцо, содержащее два атома кислорода, в случае которого атом углерода, к которому оно присоединено, является спироатомом; или фрагмент формулы
B,
в которой B представляет фрагмент формулы lV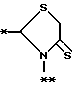
R6 и R7, одинаковые или различные, каждый представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода, замещенную или незамещенную арильную группу или замещенную или незамещенную гетероциклическую группу, при условии, что R6 и R7 оба не являются метильными группами или R6 и R7 взяты вместе, образуя замещенное или незамещенное кольцо, которое может быть сконденсированным кольцом;
n = 2, 3, 4 или 5;
или его возможные стереоизомеры, или оптические изомеры, или его фармацевтически приемлемые соли.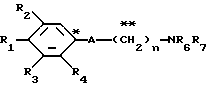
в которой R1 представляет гидроксильную группу, ацилоксигруппу, имеющую 1 - 9 атомов углерода, или низшую алкоксигруппу, имеющую 1 - 6 атомов углерода;
R2 - трет-бутильная группа;
R3 - трет-бутильная группа;
R4 - атом водорода;
A - фрагмент общей формулы lI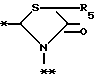
в которой R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную низшую алкоксигруппу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную финильную группу; замезенный или незамещенный пирролидин или 5-членное кольцо, содержащее два атома кислорода, в случае которого атом углерода, к которому оно присоединено, является спироатомом;
R6 и R7, одинаковые или различные, каждый представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода, замещенную или незамещенную арильную группу или замещенную или незамещенную гетероциклическую группу, при условии, что R6 и R7 оба не являются метильными группами или R6 и R7 взяты вместе, образуя замещенное или незамещенное кольцо, которое может быть сконденсированным кольцом;
n = 2, 3, 4 или 5;
или его возможные стереоизомеры, или оптические изомеры, или его фармацевтически приемлемые соли.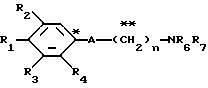
в которой R1 представляет гидрокси- или метоксигруппа;
R2 - трет-бутильная группа;
R3 - трет-бутильная группа;
R4 - атом водорода;
A - фрагмент общей формулы lI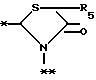
в которой R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную низшую алкоксигруппу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную фенильную группу; замещенный или незамещенный пирролидин или 5-членное кольцо, содержащее два атома кислорода, в случае которого атом углерода, к которому оно присоединено, является спироатомом;
R6 и R7, одинаковые или различные, каждый представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода, замещенную или незамещенную арильную группу или замещенную или незамещенную гетероциклическую группу, при условии, что R6 и R7 оба не являются метильными группами или R6 и R7 взяты вместе, образуя замещенное или незамещенное кольцо, которое может быть скондерсированным кольцом;
n = 2, 3, 4 или 5;
или его возможные стереоизомеры, или оптические изомеры, или его фармацевтически приемлемые соли.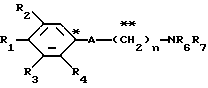
в которой R1 - гидроксильная группа;
R2 - трет-бутильная группа;
R3 - трет-бутильная группа;
R4 - атом водорода;
A - фрагмент общей формулы lI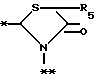
в которой R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную низшую алкоксигруппу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную фенильную группу; замещенный или незамещенный пирролидин или 5-членное кольцо, содержащее два атома кислорода, в случае которого атом углерода, к которому оно присоединено, является спироатомом;
R6 и R7, одинаковые или различные, каждый представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода, замещенную или незамещенную арильную группу или замещенную или незамещенную гетероциклическую группу, при условии, что R6 и R7 оба не являются метильными группами или R6 и R7 взяты вместе, образуя замещенное или незамещенное кольцо, которое может быть сконденсированным кольцом;
n = 2, 3, 4 или 5;
или его возможные стереоизомеры, или оптические изомеры, или его фармацевтически приемлемые соли.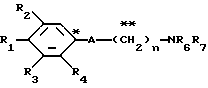
в которой R1 - гидроксильная группа;
R2 - трет-бутильная группа;
R3 - трет-бутильная группа;
R4 - атом водорода;
A - фрагмент общей формулы ll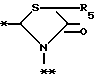
в которой R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную низшую алкоксигруппу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную фенильную группу; замещенный или незамещенный пирролидин или 5-членное кольцо, содержащее два атома кислорода, в случае которого атом углерода, к которому оно присоединено, является спироатомом;
R6 и R7, одинаковые или различные, каждый представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода, замещенную или незамещенную арильную группу или замещенную или незамещенную гетероциклическую группу, при условии, что R6 и R7 оба не являются метильными группами или R6 и R7 взяты вместе, образуя замещенное или незамещенное кольцо, которое может быть сконденсированным кольцом;
n = 3,
или его возможные стереоизомеоы, или оптические изомеры, или его фармацевтически приемлемые соли.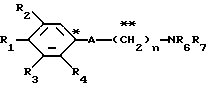
в которой R1 - ацилоксигруппа, имеющая 1 - 9 атомов углерода;
R2 - трет-бутильная группа;
R3 - трет-бутильная группа;
R4 - атом водорода;
A - фрагмент общей формулы ll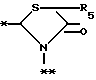
в которой R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную низшую алкоксигруппу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную фенильную группу, замещенный или незамещенный пирролидин или 5-членное кольцо, содержащее два атома кислорода, в случае которого атом углерода, к которому оно присоединено, является спироатомом;
R6 и R7, одинаковые или различные, каждый представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода, замещенную или незамещенную арильную группу или замещенную или незамещенную гетероциклическую группу, при условии, что R6 и R7 оба не являются метильными группами или R6 и R7 взяты вместе, образуя замещенное или незамещенное кольцо, которое может быть сконденсированным кольцом;
n = 2, 3, 4 или 5;
или его возможные стереоизомеры, или оптические изомеры, или их фармацевтически приемлемые соли.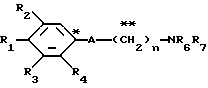
в которой R1 - низшая алкоксигруппа, имеющая 1 - 6 атомов углерода;
R2 - трет-бутильная группа;
R3 - трет-бутильная группа;
R4 - атом водорода;
A фрагмент общей формулы ll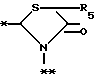
в которой R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную низшую алкоксигруппу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную финильную группу; замещенный или незамещенный пирролидин или 5-членное кольцо, содержащее два атома кислорода, в случае которого атом углерода, к которому оно присоединено, является спироатомом;
R6 и R7, одинаковые или различные, каждый представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода, замещенную или незамещенную арильную группу или замещенную или незамещенную гетероциклическую группу, при условии, что R6 и R7 оба не являются метильными группами или R6 и R7 взяты вместе, образуя замещенное или незамещенное кольцо, которое может быть сконденсированным кольцом;
n = 2, 3, 4 или 5;
или его возможные стереоизомеры, или оптические изомеры, или его фармацевтически приемлемые соли.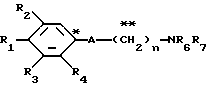
в которой R1 - метоксигруппа;
R2 - трет-бутильная группа;
R3 - трет-бутильная группа;
R4 - атом водорода;
A - фрагмент общей формулы ll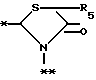
в которой R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную низшую алкоксигруппу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную фенильную группу: замещенный или незамещенный пирролидин или 5-членное кольцо, содержащее два атома кислорода, в случае которого атом углерода, к которому оно присоединено, является спироатомом;
R6 и R7, которые могут быть одинаковыми или различными, каждый представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода, замещенную или незамещенную арильную группу или замещенную или незамещенную гетероциклическую группу, при условии, что R6 и R7 оба не являются метильными группами или R6 и R7 взяты вместе, образуя замещенное или незамещенное кольцо, которое может быть сконденсированным кольцом;
n = 2, 3, 4 или 5;
или его возможные стереоизомеры, или оптические изомеры, или его фармацевтически приемлемые соли.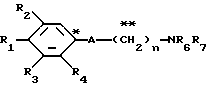
в которой R1 - представляет гидроксильную группу, ацилоксигруппу, имеющую 1 - 9 атомомв углерода, или низшую алкоксигруппу, имеющую 1 - 6 атомов углерода;
R2 - трет-бутильная группа;
R3 - трет-бутильная группа;
R4 - атом водорода;
A - фрагмент общей формулы lI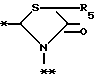
в которой R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную низшую алкоксигруппу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную фенильную группу или 5-членное кольцо, содержащее два атома кислорода, в случае которого атом углерода, к которому оно присоединено, является спироатомом;
R6 и R7, одинаковые или различные, каждый представляет атом водорода или замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода, при условии, что R6 и R7 оба не являются метильными группами или R6 и R7 взяты вместе, образуя замещенное или незамещенное кольцо, которое может быть сконденсированным кольцом;
n = 2, 3, 4 или 5;
или его возможные стереоизомеры, или оптические изомеры, или его фармацевтически приемлемые соли.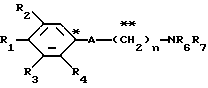
в которой R1 - представляет гидроксильную группу, ацилоксигруппу, имеющую 1 - 9 атомомв углерода, или низшую алкоксигруппу, имеющую 1 - 6 атомов углерода;
R2 - трет-бутильная группа;
R3 - трет-бутильная группа;
R4 - атом водорода;
A - фрагмент общей формулы lI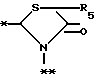
в которой R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную низшую алкоксигруппу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную фенильную группу или 5-членное кольцо, содержащее два атома кислорода, в случае которого атом углерода, к которому оно присоединено, является спироатомом;
R6 и R7, одинаковые или различные, каждый представляет атом водорода или замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода, при условии, что R6 и R7 оба не являются метильными группами или R6 и R7 взяты вместе, образуя замещенное или незамещенное кольцо, которое может быть сконденсированным кольцом;
n = 3;
или его возможные стереоизомеры, или оптические изомеры, или его фармацевтически приемлемые соли.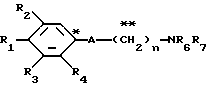
в которой R1 представляет гидроксильную группу, ацилоксигруппу, имеющую 1 - 9 атомомв углерода, или низшую алкоксигруппу, имеющую 1 - 6 атомов углерода;
R2 - трет-бутильная группа;
R3 - трет-бутильная группа;
R4 - атом водорода;
A - фрагмент общей формулы lI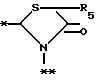
в которой R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную низшую алкоксигруппу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную фенильную группу или 5-членное кольцо, содержащее два атома кислорода, в случае которого атом углерода, к которому оно присоединено, является спироатомом;
R6 и R7, одинаковые или различные, каждый представляет замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода, при условии, что R6 и R7 оба не являются метильными группами или R6 и R7 взяты вместе, образуя замещенное или незамещенное кольцо, которое может быть сконденсированным кольцом;
n = 2, 3, 4 или 5;
или его возможные стереоизомеры, или оптические изомеры, или его фармацевтически приемлемые соли.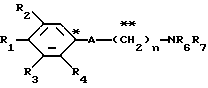
в которой R1 - представляет гидроксильную группу, ацилоксигруппу, имеющую 1 - 9 атомомв углерода, или низшую алкоксигруппу, имеющую 1 - 6 атомов углерода;
R2 - трет-бутильная группа;
R3 - трет-бутильная группа;
R4 - атом водорода;
A - фрагмент общей формулы lI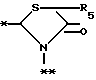
в которой R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную низшую алкоксигруппу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную фенильную группу или 5-членное кольцо, содержащее два атома кислорода, в случае которого атом углерода, к которому оно присоединено, является спироатомом;
R6 и R7, одинаковые или различные, каждый представляет замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода, при условии, что R6 и R7 оба не являются метильными группами или R6 и R7 взяты вместе, образуя замещенное или незамещенное кольцо, которое может быть сконденсированным кольцом;
n = 3,
или его возможные стереоизомеры, или оптические изомеры, или его фармацевтически приемлемые соли.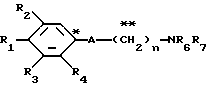
в которой R1 - представляет гидроксильную группу, ацилоксигруппу, имеющую 1 - 9 атомомв углерода, или низшую алкоксигруппу, имеющую 1 - 6 атомов углерода;
R2 - трет-бутильная группа;
R3 - трет-бутильная группа;
R4 - атом водорода;
A - фрагмент общей формулы lI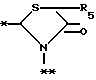
в которой R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную низшую алкоксигруппу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную фенильную группу или 5-членное кольцо, содержащее два атома кислорода, в случае которого атом углерода, к которому оно присоединено, является спироатомом;
R6 представляет замещенную или незамещенную низшую алкильную группу, имеющую 1 - 3 атома углерода;
R7 представляет группу, выбранную из группы, состоящей из 2-(3,4-метилендиоксифенокси)этильной группы, 3-(3,4-метилендиоксифенокси)пропильной группы, 4-(3,4-метилендиоксифенокси)-н-бутильной группы и 3,4-диметоксифенилметильной группы, или
-NR6R7 представляет группу, выбранную из группы, состоящей из 4-(N-2-бензотиазолил-N-метиламино)пиперидильной группы, 4-фенилметилпиперидильной группы, 4-(3,4-метилендиоксифенокси)пиперидильной группы и 4-(2,3,4-триметоксифенилметил)пиперазинильной группы;
n = 2, 3, 4 или 5,
или его возможные стереоизомеры, или оптические изомеры, или его фармацевтически приемлемые соли.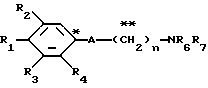
в которой R1 - представляет гидроксильную группу, ацилоксигруппу, имеющую 1 - 9 атомомв углерода, или низшую алкоксигруппу, имеющую 1 - 6 атомов углерода;
R2 - трет-бутильная группа;
R3 - трет-бутильная группа;
R4 - атом водорода;
A - фрагмент общей формулы lI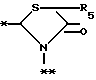
в которой R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную низшую алкоксигруппу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную фенильную группу или 5-членное кольцо, содержащее два атома кислорода, в случае которого атом углерода, к которому оно присоединено, является спироатомом;
R6 представляет замещенную или незамещенную низшую алкильную группу, имеющую 1 - 3 атома углерода;
R7 представляет группу, выбранную из группы, состоящей из 2-(3,4-метилендиоксифенокси)этильной группы, 3-(3,4-метилендиоксифенокси)пропильной группы, 4-(3,4-метилендиоксифенокси)-н-бутильной группы и 3,4-диметоксифенилметильной группы, или
-NR6R7 представляет группу, выбранную из группы, состоящей из 4-(N-2-бензотиазолил-N-метиламино)пиперидильной группы, 4-фенилметилпиперидильной группы, 4-(3,4-метилендиоксифенокси)пиперидильной группы и 4-(2,3,4-триметоксифенилметил)пиперазинильной группы;
n = 3,
или его возможные стереоизомеры, или оптические изомеры, или его фармацевтически приемлемые соли.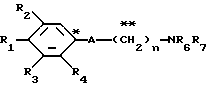
в которой R1 представляет гидроксильную группу, ацилоксигруппу, имеющую 1 - 9 атомомв углерода, или низшую алкоксигруппу, имеющую 1 - 6 атомов углерода;
R2 - трет-бутильная группа;
R3 - трет-бутильная группа;
R4 - атом водорода;
A - фрагмент общей формулы lI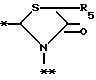
в которой R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную низшую алкоксигруппу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную фенильную группу или 5-членное кольцо, содержащее два атома кислорода, в случае которого атом углерода, к которому оно присоединено, является спироатомом;
R6 представляет метильную или этильную группу;
R7 представляет группу, выбранную из группы, состоящей из 2-(3,4-метилендиоксифенокси)этильной группы, 3-(3,4-метилендиоксифенокси)пропильной группы, 4-(3,4-метилендиоксифенокси)-н-бутильной группы и 3,4-диметоксифенилметильной группы, или
-NR6R7 представляет группу, выбранную из группы, состоящей из 4-(N-2-бензотиазолил-N-метиламино)пиперидильной группы, 4-фенилметилпиперидильной группы, 4-(3,4-метилендиоксифенокси)пиперидильной группы и 4-(2,3,4-триметоксифенилметил)пиперазинильной группы;
n = 2, 3, 4 или 5,
или его возможные стереоизомеры, или оптические изомеры, или его фармацевтически приемлемые соли.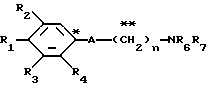
в которой R1 представляет гидроксильную группу, ацилоксигруппу, имеющую 1 - 9 атомомв углерода, или низшую алкоксигруппу, имеющую 1 - 6 атомов углерода;
R2 - трет-бутильная группа;
R3 - трет-бутильная группа;
R4 - атом водорода;
A - фрагмент общей формулы lI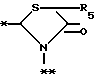
в которой R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную низшую алкоксигруппу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную фенильную группу или 5-членное кольцо, содержащее два атома кислорода, в случае которого атом углерода, к которому оно присоединено, является спироатомом;
R6 представляет метильную или этильную группу;
R7 представляет группу, выбранную из группы, состоящей из 2-(3,4-метилендиоксифенокси)этильной группы, 3-(3,4-метилендиоксифенокси)пропильной группы, 4-(3,4-метилендиоксифенокси)-н-бутильной группы и 3,4-диметоксифенилметильной группы, или
-NR6R7 представляет группу, выбранную из группы, состоящей из 4-(N-2-бензотиазолил-N-метиламино)пиперидильной группы, 4-фенилметилпиперидильной группы, 4-(3,4-метилендиоксифенокси)пиперидильной группы и 4-(2,3,4-триметоксифенилметил)пиперазинильной группы;
n = 3,
или его возможные стереоизомеры, или оптические изомеры, или его фармацевтически приемлемые соли.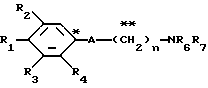
в которой R1 - представляет гидроксильную группу, ацилоксигруппу, имеющую 1 - 9 атомов углерода, или низшую алкоксигруппу, имеющую 1 - 6 атомов углерода;
R2 - трет-бутильная группа;
R3 - трет-бутильная группа;
R4 - атом водорода;
A - фрагмент общей формулы lI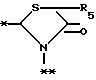
в которой R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную низшую алкоксигруппу, имеющую 1 - 6 атомов углерода; или 5-членное кольцо, содержащее два атома кислорода, в случае которого атом углерода, к которому оно присоединено, является спироатомом;
R6 представляет метильную группу;
R7 - группу, выбранную из группы, состоящей из 2-(3,4-метилендиоксифенокси)этильной группы, 3-(3,4-метилендиоксифенокси)пропильной группы, 4-(3,4-метилендиоксифенокси)-н-бутильной группы и 3,4-диметоксифенилметильной группы, или
-NR6R7 представляет группу, выбранную из группы, состоящей из 4-(N-2-бензотиазолил-N-метиламино)пиперидильной группы, 4-фенилметилпиперидильной группы, 4-(3,4-метилендиоксифенокси)пиперидильной группы и 4-(2,3,4-триметоксифенилметил)пиперазинильной группы;
n = 2, 3, 4 или 5,
или его возможные стереоизомеры, или оптические изомеры, или его фармацевтически приемлемые соли.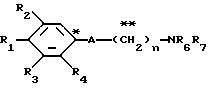
в которой R1 представляет гидроксильную группу, ацилоксигруппу, имеющую 1 - 9 атомов углерода, или низшую алкоксигруппу, имеющую 1 - 6 атомов углерода;
R2 - трет-бутильная группа;
R3 - трет-бутильная группа;
R4 - атом водорода;
A - фрагмент общей формулы lI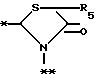
в которой R5 представляет атом водорода, замещенную или незамещенную низшую алкильную группу, имеющую 1 - 6 атомов углерода; замещенную или незамещенную низшую алкоксигруппу, имеющую 1 - 6 атомов углерода; или 5-членное кольцо, содержащее два атома кислорода, в случае которого атом углерода, к которому оно присоединено, является спироатомом;
R6 представляет метильную группу;
R7 - группу, выбранную из группы, состоящей из 2-(3,4-метилендиоксифенокси)этильной группы, 3-(3,4-метилендиоксифенокси)пропильной группы, 4-(3,4-метилендиоксифенокси)-н-бутильной группы и 3,4-диметоксифенилметильной группы, или
-NR6R7 представляет группу, выбранную из группы, состоящей из 4-(N-2-бензотиазолил-N-метиламино)пиперидильной группы, 4-фенилметилпиперидильной группы, 4-(3,4-метилендиоксифенокси)пиперидильной группы и 4-(2,3,4-триметоксифенилметил)пиперазинильной группы;
n = 3,
или его возможные стереоизомеры, или оптические изомеры, или его фармацевтически приемлемые соли.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ получения кислотно-аддитивных солей амидиновых соединений | 1986 |
|
SU1456008A3 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ приготовления мастики для нанесения на хроноленты для царапающего пера | 1941 |
|
SU64445A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| УСТРОЙСТВО для НАМОТКИ СЕКЦИЙ КОНДЕНСАТОРОВ | 0 |
|
SU211670A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| УСТРОЙСТВО УПРАВЛЕНИЯ ДВИГАТЕЛЕМ ПРИВОДА ПОДАЧИ ЭЛЕКТРОДНОЙ ПРОВОЛОКИ | 2001 |
|
RU2205095C2 |
Авторы
Даты
1999-03-10—Публикация
1994-06-23—Подача