Изобретение относится к фармацевтическим композициям, которые содержат определенную липидную систему из по крайней мере двух липидных компонентов, где по крайней мере один из липидных компонентов является алифатическим и полярным, и один неполярным, в которой фармацевтически активным соединением является гепарин, его фрагмент или его производные. Кроме того, композиции содержат водный растворитель в таком количестве, чтобы присутствовали разрозненные липидные частицы, и указанные композиции могут быть применены в различных лекарственных формах, таких как ректальных, оральных, для ротовой полости, подъязычных, трансдермальных и т.д.
Настоящее изобретение основано на определенной липидной системе, описанной в заявке Швеции SE 90031006-6, из по крайней мере двух липидных компонентов, выбранных из классов с различной полярностью, в которой по крайней мере одно из веществ является алифатическим и полярным и одно неполярным.
Алифатическое и полярное соединение является образующим двойной слой, и липидные частицы самопроизвольно образуются из липидной системы, когда она взаимодействует с избыточным количеством воды или содержащими воду растворителями.
Определенным липидным компонентом является липид, чей химический состав известен и управляем. Это будет более детально объяснено далее и в примерах.
Свойство "двуслойного образования" является хорошо известным физическим параметром и может быть легко установлено соответствующими физико-химическими методами (например, метод поверхностного равновесия). А образующиеся дискретные липидные частицы могут быть определены физическими и/или химическими методами, такими как микроскопия на основе поляризованного света, сцинтиграфический анализ или дифракционные методы.
Изменение липидного состава обеспечивает управление механизмом, при помощи которого образуются липидные частицы, и посредством этого скоростью образования липидной частицы, которая будет служить контролирующим фактором как для немедленного, так и для длительного высвобождения захваченных или ассоциированных биоактивных материалов.
Использованы следующие определения:
липиды - основной термин для обозначения природных или синтетических соединений, содержащих ацильные носители, такие как глицерин, сфингозин, холестерин и другие, или их производные, к которым присоединены или могут быть присоединены одна или более жирные кислоты. Сюда также могут входить похожие молекулы, которые содержат большую углеводородную часть.
Липиды, используемые при образовании систем липидных частиц, могут быть подразделены на различные классы липидов, в зависимости от их полярности, а именно:
классы неполярных липидов - имеющие неполярные головные группы или гидрофильную часть, которая настолько мала или так оптически затруднена, что не может взаимодействовать с водой.
Примерами неполярных составных частей являются углеводороды или не набухающие амфифилы, такие как моно-, ди- и триацилглицерины, холестерин, жирные спирты или эфиры холестерина.
Классы полярных липидов - такие как фосфолипиды или гликолипиды, которые обладают поверхностной растворимостью благодаря значительному полярному содержанию. В зависимости от их специфического взаимодействия с водой, они, кроме того, подразделяются на категории набухающих или растворимых амфифилов, соответственно.
Классы амфипатических или амфифильных липидов - такие как фосфолипиды или гликолипиды, обладающие поверхностной активностью.
Классы образующих двойной слой липидов - амфипатические липиды, такие как ФХ (фосфатидилхолин), сфингомиелин, ФИ (фосфатидилиноцитол) или ФЭ (фосфатидилэтаноламин), молекулярная геометрия которых приводит к предпочтительному образованию двуслойных структур в присутствии воды.
Липиды, используемые в системах носителей, согласно настоящему изобретению включают смесь классов липидов, характеризующихся различной полярностью. Полярные липиды, такие как фосфолипиды или гликолипиды, и неполярные липиды, такие как моно-, ди- и триглицериды, являются главными составляющими в системе, хотя с тем же успехом, что и различные классы липидов.
Также могут быть использованы стеролы, такие как холестерин, жирные кислоты, жирные спирты и их эфиры. Эта точно определенная смесь липидов из различных классов, что указаны выше, не может быть смешана с коммерческими продуктами, такими как соевое масло, маисовое масло или соевый лецитин и яичный лецитин. Для получения точно определенных классов липидов коммерческое масло фракционируют и затем подмешивают различные классы липидов, как это объяснено более детально в ниже приведенных примерах. Другим путем получения точно определенных классов липидов является использование энергетически полученных липидов.
Кроме того, в сочетании с вышеуказанными липидами могут быть также использованы производные липидов. Одним из примеров этого служит полиэтиленгликоль, присоединенный к фосфатидилэтаноламину, который показал продление времени циркулирования липосом в кровяном потоке после введения. Другим примером такого производного является пальмитоилкарнитин, который действует как усилитель абсорбции биоактивных веществ в кишечнике.
По подходящему пути инициирования образования системы липидного носителя биоактивное вещество подмешивают к выбранному липиду с последующим подмешиванием липида различной полярности. Это полярное/неполярное изменение может длиться такое количество циклов, сколько необходимо для особого случая, включая ряд липидов с различной полярностью.
Предпочтительным путем введения биоактивного вещества в систему липидного носителя является подмешивание биоактивного вещества к алифатическим липидам с целью создания гомогенной субстанции, где количество амфифильных липидов обычно составляет порядка 1 - 90% по весу. Такой амфифильный липид будет способен к самопроизвольному образованию двойного слоя.
Их примерами являются амфифильные и полярные классы липидов, такие как фосфатидилхолин, фосфатидилглицерин, фосфатидилинозитол или фосфатидилсерин или их смесь.
Задачей системы липидного носителя является не только надлежащий выбор и/или сочетание классов липидов, предназначенных для солюбилизации каждого биоактивного вещества, но также надлежащий выбор распределения жирных кислот, то есть ацильных групп, привязанных к используемым классам липидов.
Варьирование ацильных групп дает различные физико-химические свойства, как будет показано в примерах далее.
На скорость, с которой образуются липидные частицы из системы в данной водной системе, может влиять или воздействовать изменение геометрический формы основного класса липидов, образующего двойной слой, то есть эффективной площади головной группы в зависимости от стерической конформации углеводородного остатка.
Второй путь воздействия и регулирования образования липидных частиц - это изменение структуры, как-то подвижности углеводородной цепи неполярной части липидной системы. Это будет влияние скорости взаимодействия эндогенных амфифильных липидов и экзогенной водной среды.
Подробное описание изобретения
Согласно настоящему изобретению вышеописанная определенная липидная система используется в фармацевтических композициях, которые содержат гепарин, его фрагмент или его производные с водосодержащим растворителем.
Выражение "гепарин" означает любую фракцию или класс гепарина из природных биосинтетических, синтетических или генетически инженеринговых источников, также как и любые производные, то есть эфиры гепарина и "его фрагмент" означает любой низкомолекулярный фрагмент гепарина или его производных, включая химически модифицированные синтетические гепариноподобные олигосахариды.
Во многих непарентеральных лекарственных формах значительные трудности заключаются в преодолении низкой биоабсорбции гепаринов.
Целью настоящего изобретения является разрешение этой проблемы путем гибкой композиции, основанной на упомянутой липидной системе.
Другой целью изобретения является создание композиции, хорошо подходящей для удобных форм продолжительного срока действия лекарств гепарина как альтернативы парентерального лекарства. Такая композиция может быть использована для получения препаратов, подходящих для орального, ректального, полостного, подъязычного, носового, подкожного или другого трансмембранного или трансдермального назначения, путем добавления соответствующих растворителей, раствором или носителей для каждого подходящего способа назначения.
Амфипатическим и полярным соединением предпочтительно является фосфатидилхолин, а неполярый липид предпочтительно выбран из моно-, ди- или триглицеридов.
Количество воды в композиции должно быть таким, чтобы образовывались дискретные липидные частицы.
Это условие должно быть исследовано для каждой липидной системы, потому что реальные параметры образования липидных частиц зависят от природы и состава липидных компонентов и природы биоактивного компонента, предназначенного для системы.
Наиболее важным основанием для выбора компонентов липидной системы является строение липидов и полярность биоактивного лекарства, которое должно быть включено в систему.
Абсорбция может регулироваться изменением длины цепи глицеридов в интервале от шести до восемнадцати атомов углерода, предпочтительно между шестью и двенадцатью атомами углерода. Выбор полярности и выбор различно заряженных групп составов также может влиять на образование липидной частицы.
Липидные частицы могут быть смешанной совокупностью моно-, ди- и многослойных структур, таких как мицеллы, липосомы и структуры более многослойные.
Существует много способов, хорошо известных специалистам, для регулирования совокупности как в части протяженности, так и в части структуры, такие как ультразвуковая обработка, контролируемое замораживанием - оттаиванием перемешивание и ряд других средств.
Необходимость таких средств должна быть рассмотрена отдельно для каждой лекарственной формы и каждого терапевтически активного соединения, входящего в композицию.
На состав совокупности липидных частиц также оказывает влияние выбор липидного материала с точки зрения полярности, длины (длин) углеродной цепи и других факторов, рассмотренных выше.
В предпочтительной композиции согласно изобретению веществом является гепарин или его фрагмент, а липидная система содержит фосфатидилхолин в качестве амфифильного соединения и моноглицерид в качестве неполярного компонента.
Количества амфифильных соединений в композиции могут быть порядка 1 - 90% (по весу) липидной системы, предпочтительно между 1 - 50% (по весу), и, наиболее предпочтительно, между 5 - 50% (по весу), по отношению к липидной системе.
Предпочтительным гепариновым фрагментом является Fragmin®, который является низкомолекулярным гепариновым фрагментом, полученным Kabi Pharmacia из свиного гепарина путем процесса деполимеризации, регулируемого азотистой кислотой, смотри EP 14184.
Fragmin® может быть в виде раствора или суспензии при смешивании или добавлении к другим компонентам композиции. Он также может быть подмешан к свободной от избыточной воды липидной матрице до того, как другие составляющие композиции будут добавлены.
Fragmin® очень охотно растворяется в воде, и такие водные растворы рассматриваются как стабильные.
Свойства Fragmin® делают возможными различные препараты, основанные на определенных липидных системах с добавлением подходящих лекарственных сред.
Такие препараты могут быть предназначены для ректального использования в виде пен, клизм, капсул и суппозиториев или различных препаратов, специально изготовленных для орального, полостного, подъязычного, носового, трансдермального и подкожного назначения или при введении через слизистые мембраны вообще. Предлагаемая согласно изобретению композиция Fragmin® и определенных липидов, также пригодны для изготовления депо-препарата для получения длительного освобождения, например, подкожного лекарственного препарата, или для включения в пористую полимерную матрицу со слизисто-адгезивными свойствами для, например, применения в полости рта.
Препараты используются для лечения или профилактики широкого спектра патологических процессов, таких как тромбоэмболическая болезнь, предынфарктная ангина, коронарные заболевания сердца, воспалительные заболевания, тромбофлебиты, автоиммунные заболевания, артеросклерозы, или для лечения метастаз или ангиогенсвязанных заболеваний.
Любое применение композиций по вышеуказанным путям назначения или для любого вышеуказанного лечения представляется ясным для специалистов данной области.
Общая дозировка Fragmin® в вышеуказанных лекарственных формах может быть, таким образом, очень высокой и ограничивается только биопригодностью и тем, что является терапевтически или клинически приемлемым для лечения, и тем, что хорошо переносится. Примерами клинических доз является 120IU на кг веса тела два раза в день для сильного венозного тромбоза, а для профилактики тромбоза (пациенты с низким риском) 2500 IU в день или 5000IU в день (для пациентов с высоким риском).
Например, относительное количество Fragmin® к липидам может составлять порядка 1 - 200 (по весу), предпочтительно 2 - 30 (по весу).
Однако, повышенные количества как Fragmin®, так и липидов являются возможными, в контакте данного изобретения, при клинической необходимости.
Если количество липидов в композиции будет понижено, повышенный абсорбционный эффект будет уменьшен, что могло бы быть скомпенсировано увеличенным количеством Fragmin® с целью получения тех же уровней в сыворотке после введения.
Широкий спектр концентрации, делающий возможным относительное количество Fragmin® в липиде до 200 (по весу) свидетельствует о возможности подбора компонентов, входящих в композицию, с целью создания подходящих лекарственных форм, приемлемых для различного типа пациентов.
Растворимость и стабильность Fragmin® облегчает подбор состава для подходящей лекарственной формы и, кроме того, есть четкие доказательства того, что он имеет стабилизирующее влияние на совокупность липидных частиц в композиции, вероятно благодаря высокой плотности отрицательного заряда.
Следующие примеры, которые не должны рассматриваться как ограничивающие изобретение, демонстрируют Fragmin® в композициях с липидами, определенных в примерах в соотношении 25% фосфатидилхолина как амфифильного компонента и 75% моноглицерида как неполярного соединения.
Композиции применялись ректально или внутридуоденально in vivo с различными количествами добавленного основного на воде растворителя.
При внутридуоденально используемой композиции содержание воды может варьироваться от 1 до 4 частей по весу по отношению к содержанию липида в композиции.
Относительное количество Fragmin® к липиду около от 2 до 200 (по весу).
Примеры 1 - 5, представленные ниже, иллюстрируют изменение содержания липида в липидной системе в отсутствие биоактивных соединений, в зависимости от выбора липидов и их комбинаций без ограничения объема притязаний.
Примеры 6 - 7 показывают получение композиций, которые содержат определенную липидную систему, состоящую из фосфатидилхолина, эфиров глицерола и Fragmin®, Эти композиции не включают сначала основанный на воде растворитель в количестве, таком, чтобы образование липидной частицы происходило немедленно и самопроизвольно.
Пример 8 показывает модель на животных, используемую в экспериментах следующих примеров, и биопригодность Fragmin® после интрадуоденального или ректального введения в отсутствие липидной системы.
Пример 9 показывает, что интрадуоденальная абсорбция Fragmin® значительно возрастает, когда он включен в липидную систему.
Пример 10 показывает, что внутридуоденальная абсорбция повышается, когда перед введением лекарства добавляется вода извне.
Пример 11 показывает, что внутридуоденальная абсорбция похожим образом увеличивается, когда вода в примере 10 заменяется физиологическим раствором в том же количестве.
Пример 12 показывает, что ректальная абсорбция Fragmin® значительно выше, когда он включен в липидную систему, по сравнению с Fragmin®, растворенным в физиологическом растворе в отсутствие липидной системы.
Пример 13 показывает, что добавление внешней воды или физиологического раствора к липидной системе имеет положительный эффект на ректальную абсорбцию.
Примеры 14 и 15 показывают, что нет необходимости включать Fragmin® в липидную систему перед растворением в воде или физиологическом растворе с целью его абсорбции из двенадцатиперстной кишки или прямой кишки.
Пример 16 иллюстрирует, что испытуемые имеющиеся продажные неочищенные липиды дают более низкую ректальную абсорбцию, чем определенные липиды.
Пример 17 служит сравнением абсорбции различных соотношений Fragmin® и липида и показывает, что ректальная абсорбция высока для широкого спектра концентраций липида и Fragmin®.
Пример 18 служит сравнением абсорбции гепарина и Fragmin® в препаратах, которые содержат липидную систему.
Пример 19 показывает, что после образования композиции раствор может сохраняться длительное время перед употреблением без значительного влияния на абсорбционные свойства.
Примеры 20 - 21 показывают, что активность Fragmin® сохраняется и его абсорбция все еще высока после длительного хранения композиции.
Результаты показывают, что определенная липидная система повышает внутридуоденальную абсорбцию и что наиболее высокая степень внутридуоденальной абсорбции с использованием Fragmin® достигается при наибольшем испытанном содержании воды в композиции. Исследованные концентрации компонентов показали замечательные результаты. Однако может быть возможна оптимизация условий и в дальнейшем.
Причинами повышенной абсорбции может быть то, что получается большая площадь поверхности контактирования между композицией и мембранами кишечника, но также вероятно потому, что совокупность липидных частиц имеет благоприятный структурный состав для степени разбавления.
Липидные частицы также могут защищать лекарство от ферментативного разложения в кишечнике, как в случае, если липидные частицы несут лекарство, так и в случае, если они иным образом присутствуют в растворе. Большое количество данных липидов может блокировать разрушающие Fragmin® ферменты и, в этом случае, Fragmin® может быть хорошо защищен снаружи липидными частицами. Однако, когда количество липидов невелико, может быть выгодным включение Fragmin® в липидные частицы.
Ингибиторы ферментов являются возможной добавкой к предлагаемой по изобретению композиции.
Отмечается также, что абсорбция высока безотносительно того, присутствует ли Fragmin® вначале свободным в растворе или включении в липидные частицы.
Превосходные результаты показаны также после ректального применения композиций Fragmin® с липидной системой в широком интервале содержания воды или физиологического раствора. Эти результаты сравнимы с подкожными инъекциями, которые в настоящее время являются наиболее распространенным путем введения.
Отмечается также, что определенная липидная система выгодно сравнима с продажными липидами в отношении регулирования и стабилизации композиций, а также восстановлении абсорбции.
Отмечается также, что размер образующихся частиц может значительно варьироваться без влияния на замечательные абсорбционные свойства Fragmin®.
Показано, что композиции могут использоваться сразу или после длительного времени после их получения.
Композиции согласно изобретению также позволяют повысить абсорбцию гепарина при применении его с липидной системой.
Определенная липидная система по настоящему изобретению предпочтительная еще и потому, что четко определенное ее содержание позволяет более точно регулировать биологическую абсорбцию и также абсорбцию и солюбилизацию лекарства.
Это значит, что выбор подходящего липидного состава среди классов липидов позволит достигнуть регулирования абсорбции.
Отмечается также, что высокая степень абсорбции может быть достигнута даже, если Fragmin® не включен в липидную систему при ее получении, а добавлен в виде раствора к липидной композиции при перемешивании или ультразвуковой обработке.
В заключение необходимо принять во внимание, что композиции, основанные на определенной липидной системе и гепарине или гепариновых фрагментах, являются неожиданно превосходными в части увеличения абсорбции и обеспечения удобной возможности регулирования скорости абсорбции.
Различные модификации и эквиваленты будут очевидны каждому специалисту и могут быть использованы в соединениях композициях, и способах по настоящему изобретению без отклонения от сущности и объема изобретения, и поэтому понятно, что изобретение не ограничивается особыми примерами и осуществлениями, представленными здесь.
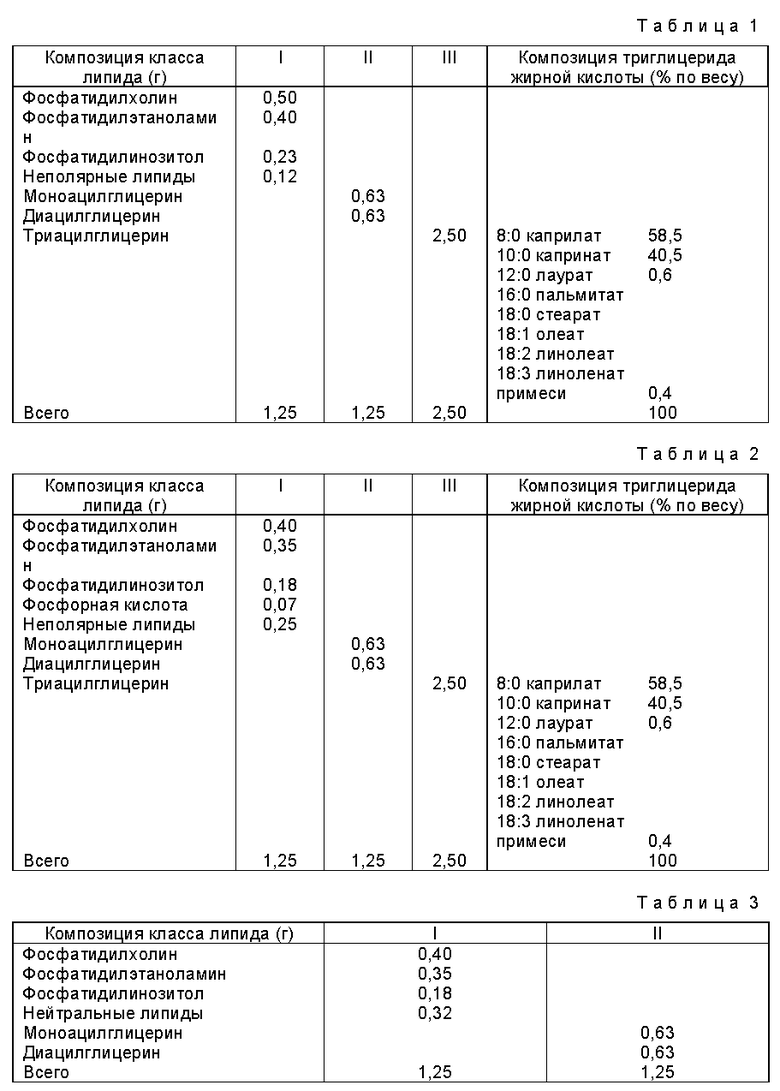
Пример 1
1,25 г фосфолипидов из соевого масла (I) добавляют к 1,25 г смеси глицерида (II) и осторожно перемешивают в течение 12 часов при 60oC. Добавляют 2,50 г триглицерида (III) и всю смесь перемешивают 1 ч при 60oC (см. табл. 1).
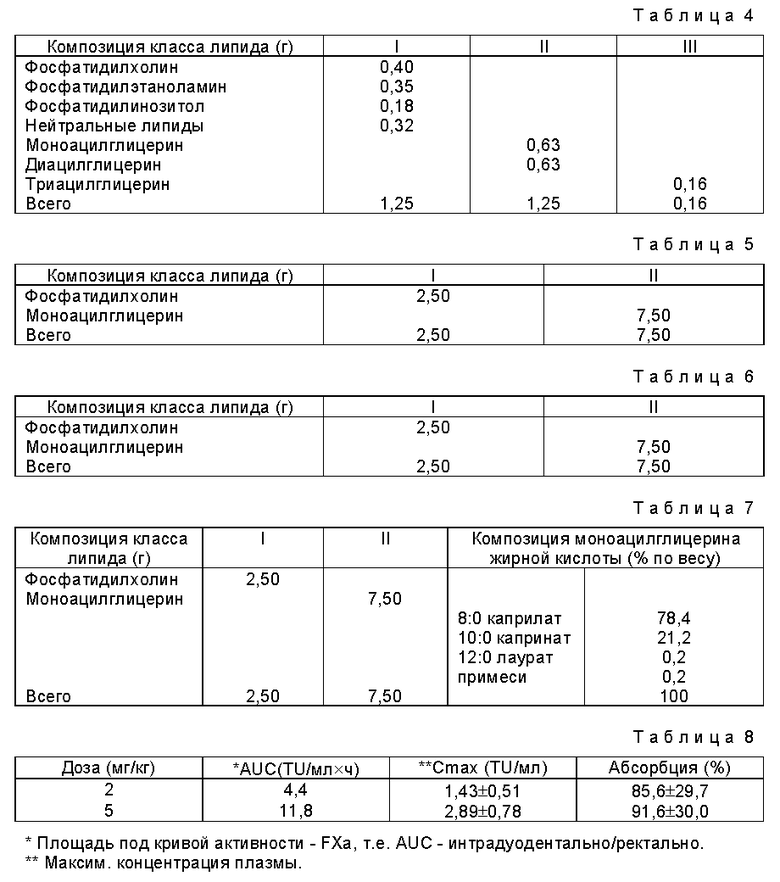
Пример 2
1,25 г фосфолипидов из соевого масла (I) добавляют к 1,25 г смеси глицерида (II) и осторожно перемешивают 12 часов при 60oC. Затем добавляют 2,50 г глицерина и всю смесь перемешивают 1 ч при 60oC (см. табл.2).
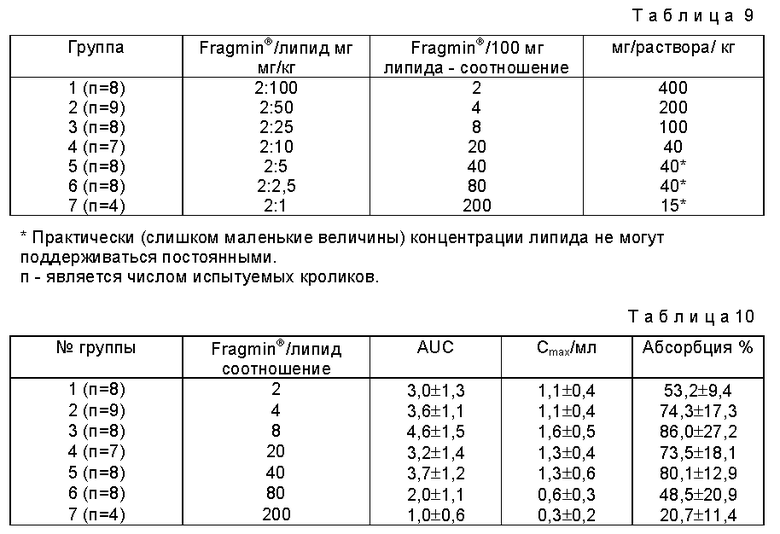
Пример 3
1,25 г фосфолипидов из соевого масла (I) добавляют к 1,25 г смеси глицерида (II) и осторожно перемешивают 12 часов при 60oC. Затем добавляют 2,50 г глицерина и всю смесь перемешивают 1 ч при 60oC (см. табл.3).
Пример 4
1,25 г фосфолипидов из соевого масла (I) добавляют к 1,25 г смеси глицерида (II) и 0,16 г этанола. Всю смесь перемешивают осторожно в течение 6 часов при 60oC. Добавляют 0,16 г триглицерида (III) и всю смесь перемешивают еще в течение часа при повышенной температуре (см. табл.4).
Пример 5
2,50 г фосфатидилзолина из соевого масла (I) и 7,50 г моноглицерида (II) осторожно перемешивают 6 часов при 60oC. Добавляют 1,25 г воды и перемешивание продолжают еще в течение часа при повышенной температуре (см. табл.5).
Пример 6
2,50 г фосфатидилхолина из соевого масла (1) и 7,50 г моноглицерида (II) осторожно перемешивают 6 часов при 60oC. Добавляют раствор Fragmin® (120 мг/воды) и перемешивание продолжают еще час при повышенной температуре (см. табл.6).
Пример 7
2,50 г фосфатидилхолина из соевого масла (1) и 7,50 г моноглицерида (II) осторожно перемешивают при 60oC в течение 6 часов. Добавляют раствор Fragmin® (120 мг/г воды) и перемешивание продолжают еще час при повышенной температуре (см. табл.7).
Распределение размеров липидных частиц, образованных в воде при 37oC, определяют по примеру 15, используя аппаратуру Malvern. Препарат осторожно встряхивали в воде 17 часов и потом центрифугировали и отделяли липидную фазу от водной фазы. Были получены следующие результаты.
Размер - %
<1 мкм - 36
>1 < 2 мкм - 60
Пример 8
Модель на животном
В экспериментах используются новозеландские белые кролики весом 2,5 - 3,5 кг. После поста в течение 12 ч каждое животное было успокоено инъекцией внутривенно Hypnorm 0,1 мл/кг (Janssen Pharmaceuticals, Belgirem) и подкожной инъекцией атропина, 0,5 мг/кг (Kabi Pharmacia, Sweden). Кроликов анестезируют (Mebutal) мебуталом, 20 мг/кг, и выдерживают в течение необходимого времени. Животных брили и осуществляли срединную лапаротомию. Испытуемые соединения были затем введены прямо в двенадцатиперстную кишку, после чего брюшная полость была закрыта. Ректальное введение осуществляют путем шприца, присоединенного к пластиковой трубке, предназначенной для использования в прямой кишке кроликов. Дозировку проверяют взвешиванием шприца и присоединяющих трубок до и после введения испытуемых соединений.
Образцы крови отбирают через 0,25, 0,5, 0,75, 1, 1,5, 2, 2,5, 3, 4, 5, 6, 7, 8, 9 и 10 часов с помощью катетера, вставленного в ушную артерию, и смешивают с цитратом натрия до конечной концентрации 0,04 М. Пробирки выдерживают на льду, а затем центрифугируют при 800g (гравитационная сила) в течение 10 минут. Анти - FXa активность определяют в первичном оценочном исследовании с использованием бычьего FXa (Kobi Pharmacia) и пигментообразующего субстрата S - 2222.
Видимая биологическая доступность Fragmin® после интрадуоценального или ректального введения выражается в виде части площади под кривой активности анти- FXa, то есть (AUC интрадуоденально/ректально) и (AUCS.C.) далее определено как 5,14 ± 0,34 условных единиц на 6 кроликах, получивших подкожно инъекцию Fragmin® в дозе 2 мг/кг.
Биологическая доступность Fragmin® в отсутствии липидов.
Биологическая доступность Fragmin® после интрадуоденального введения в отсутствие липидной системы была исследована на 4 кроликах. Два кролика получали Fragmin® 25 мг/кг в виде порошка, помещенного в желатиновую капсулу, которую помещали в двенадцатиперстную кишку на уровне пиловируса. Оставшиеся два кролика получали Fragmin®, растворенный в физиологическом растворе, который вводили непосредственно в поджелудочную железу, (общая доза 25 мг/кг). Никакой анти- FXa активности не смогли не смогли обнаружить ни у какого из этих животных при наблюдении в течение периода 8 - 10 часов.
Биологическая доступность Fragmin® после ректального введения исследовалась на 3 кроликах. Fragmin® растворяли в физиологическом растворе и вводили прямо в прямую кишку в дозе 10 мг/кг. Двое из этих кроликов не имели обнаруживаемой анти- FXa активности в плазме, но один показал активность 0,2IU/мл в течение 45 минут, что соответствует биологической доступности менее чем 1%.
Заключение. Биологическая доступность Fragmin® в отсутствие повышающих добавок менее чем 1% после интрадуоденального или ректального введения.
Пример 9
Интрадуоденальная абсорбция Fragmin®, включенного в липидную систему согласно примерам 5 - 7, была исследована на 8 кроликах. Fragmin® (липидная система была смешана с водой, взятой в таком количестве, что дискретные индивидуальные липидные частицы образуются за 10 минут до того, как необходимо ввести в двенадцатиперстную кишку. Состав смеси был следующим: 1 часть (по весу) Fragmin®/ липид + 1 часть (по весу) дистиллированной воды. Систему вода/липид энергично встряхивали 5- 10 минут и затем оставляли стоять при комнатной температуре еще 10 минут перед тем, как ввести в двенадцатиперстную кишку. Концентрация Fragmin® была 2% от веса липида. Все кролики получили следующие дозы: Fragmin® 25 мг/кг, липиды 1250 мг/кг и дистиллированная вода 1250 мг/кг. Все кролики в эксперименте обладали обнаруживаемыми уровнями анти- FXa активности в плазме. Максимальная концентрация плазмы (Gmax) достигалась в течение 0,5 - 1,5 часов и составляет от 0,37 IU/мл до 1,76IU/мл. Средняя величина абсорбции в этом эксперименте составляет 4,7 ± 3,0%.
Заключение. Интрадуоденальная абсорбция Fragmin® значительно возрастает при включении в липидную систему по сравнению с отсутствием липидов в системе.
Пример 10
Эксперимент идентичен исследованию, описанному в примере 9, за исключением того, что Fragmin®/ липидная система смешивается с большим количеством воды. Состав смеси был следующим: 1 часть (по весу) Fragmin®/ липид + 4 части (по весу) дистиллированной воды. Концентрация Fragmin® была 2% от веса липиды. Все кролики (п = 9) получали следующие дозы: Fragmin® 25 мг/кг, липиды 1250 мг/кг, и дистиллированная вода 5000 мг/кг (≈ 5 мл). Все кролики в этом эксперименте обладали обнаруживаемыми уровнями анти - FXa активности в плазме. Cmax было достигнуто в пределах 0,75 - 1,5 часов и составляло от 0,75IU/мл до 3,79IU/мл. Средняя величина абсорбции в этом эксперименте была 14,7 ± 5,6%.
Заключение. Интрадуоденальная абсорбция Fragmin® значительно возрастает, когда липидная система (содержащая Fragmin®) ) смешана с водой перед введением в двенадцатиперстную кишку.
Пример 11
Эксперимент идентичен исследованию, описанному в примере 10, за исключением того, что Fragmin®/ липидная система смешивается с 4 частями физиологического раствора вместо того же количества дистиллированной воды. Это проделывают для того, чтобы исследовать, имеет ли какое-нибудь влияние ионная сила системы Fragmin®/ липид/вода на интрадуоденальную абсорбцию Fragmin®. Смесь имела следующий состав: 1 часть (по весу) Fragmin®/ липид + 4 части (по весу) физиологического раствора. Концентрация Fragmin® была 2% от веса липида. Все кролики (п = 10) получали следующую дозу: Fragmin® 25 мг/кг, липиды 1250 мг/кг и физиологический раствор 5000 мг/кг. Все кролики в этом эксперименте обладают обнаруживаемыми уровнями анти-FXa активности в плазме. Cmax было достигнуто в пределах времени 0,75 - 1,5 ч и составляло от 0,62IU/мл до 2,60IU/мл. Средняя величина абсорбции в этом эксперименте составляла 13,4±7,3%.
Заключение. Интрадуоденальная абсорбция Fragmin® значительно возрастает, когда Fragmin®/ липидная система смешана с физиологическим раствором.
Пример 12
Ректальная абсорбция Fragmin®, включенного в липидную систему, была исследована на 5 кроликах. Липидная система, без воды, была введена прямо в прямую кишку в дозе 100 мг/кг, соответствующей дозе Fragmin® 2 мг/кг. Все кролики в этом эксперименте обладают обнаруживаемыми уровнями анти- FXa активности в плазме. Cmax было достигнуто в пределах времени 1,5 - 2,5 ч и составляло от 0,53 IU/мл до 1,98IU/мл. Средняя величина абсорбции в этом эксперименте составляла 67,0 ± 18,2%.
Заключение. Ректальная абсорбция Fragmin®, включенного в липидную систему, без добавления водного раствора ясно выше, чем ректальная абсорбция самого Fragmin®, растворенного в физиологическом растворе.
Пример 13
Добавление внешней воды или физиологического раствора к липидной системе имело положительный эффект на интрадуоденальную абсорбцию (смотри примеры 9, 10 и 11). Этот эксперимент проводят для того, чтобы, изучить, может ли наблюдаться похожий эффект после ректального введения. Систему Fragmin®/ липид смешивают с 4 частями физиологического раствора, как описано в примере 1, за 10 мин перед введением в прямую кишку. Состав смеси был следующий: 1 часть (по весу) Fragmin®/ липидной системы + 4 части (по весу) физиологического раствора. Концентрация Fragmin® была 2% от веса липида. Эта композиция была исследована на 7+7 кроликах при дозировке Fragmin® от 2 до 5 мг/кг, соответственно. Дозировка липида была 100 и 250% мг/кг и количество физиологического раствора было 400 и 1000 мг/кг. Результаты суммированы в табл.8.
Заключение. Ректальная абсорбция Fragmin®, включенного с липидную систему и смешанного с внешней водой, была почти такой же высокой, как и наблюдающаяся после подкожной инъекции, которая в настоящее время является наиболее используемым путем введения Fragmin®. Ректальная абсорбция Fragmin® пропорционально зависит от дозы, то есть 2,5-кратное возрастание дозы приводит к такому же увеличению AUC и Cmax, в то время как скорость абсорбции остается постоянной.
Пример 14
Во всех экспериментах, описанных выше, Fragmin® был включен в липидную систему перед добавлением воды или физиологического раствора в систему. В следующих экспериментах используются точно такие же липидные системы, но без включения Fragmin®. Липидная композиция без Fragmin® в последующем обслуживании будет обозначена как "плацебо липиды".
Интрадуоденальная абсорбция Fragmin®, смешанного с плацебо липидами исследовалась на 7 кроликах. Порошок Fragmin® был растворен в физиологическом растворе до окончательной концентрации 5 мг/мл (0,5%). Четыре части (по весу) этого раствора Fragmin® смешивались с 1 частью (по весу) плацебо липида. Концентрация Fragmin® в этой смеси составляла 2% от веса липида, что соответствовало такому же соотношению Fragmin®/ /липид, что и в примерах 11 - 15. Смесь энергично встряхивали в течение 5 - 10 минут или альтернативно, подвергали ультразвуковой обработке в течение подходящего времени перед тем, как ввести интрадуоденально. Все кролики получали следующие дозы: Fragmin® 25 мг/кг, липиды 1250 мг/кг и дистиллированная вода 5000 мг/кг. Все кролики в этом эксперименте обладали обнаруживаемыми уровнями анти- FXa активности в плазме. Максимальная концентрация в плазме Cmax была достигнута в пределах времени 0,5 - 2,0 часов и составляла от 0,53 IU /мл до 3,55 IU/мл. Средняя величина абсорбции в этом эксперименте составляла 13 ± 8%.
Заключение. Эксперименты показывают, что нет никакой необходимости включения Fragmin® в липидную систему перед добавлением воды, для его абсорбции из двенадцатиперстной кишки. Смесь плацебо липидов и воды физиологического раствора, содержащая растворенный Fragmin®, абсорбируется в такой же степени. Предпочтительные результаты получены как при встряхивании, так и при ультразвуковой обработке композиции.
Пример 15
Ректальная абсорбция Fragmin®, смешанного с плацебо липидами исследовалась на 6 кроликах. Смесь приготавливали так же, как описано в примере 14 и вводили ректально при следующей дозировке: Fragmin® 2 мг/кг, липиды 100 мг/кг и физиологический раствор 400 мг/кг. Все кролики в этом эксперименте обладали обнаруживаемыми уровнями анти- FXa активности в плазме. Cmax достигалась в пределах времени 0,5 - 2,0 ч и составляла 0,59 IU /мл до 1,95 IU/мл. Средняя величина абсорбции составляла 64,2 ± 31%.
Заключение. Этот эксперимент показывает в соответствии с примером 14, что необходимости предварительного включения Fragmin® в липидную систему для абсорбции его из прямой кишки. Смесь плацебо липидов и физиологического раствора, содержащего растворенный Fragmin®, также абсорбируется с высокой степенью в том случае, когда Fragmin® без липидов (сравни с примером 13).
Пример 16
Ректальная абсорбция Fragmin®, смешанного с имеющимися продажными липидами была исследована на 4 кроликах. Были использованы следующие продажные липиды: IMWI TOR MG 742 (от MG Huls AG, содержащий около 50% моноглицеридов и 50% ди- и триглицеридов с ацильными радикалами, в основном полученными из каприловой кислоты и капроновой кислоты) и фосфатидилхолин Zigma PC (P5394 от Sigma, содержащий 84% ФХ, 13% ФЭ и 3% остальные составляющие). Коммерческие липиды были смешаны с физиологическим раствором как описано в примерах 14 и 16 и введены ректально при следующей дозировке: Fragmin® 2 мг/кг, липиды 100 мг/кг и физиологический раствор 400 мг/кг. Двое из 4 кроликов в этом эксперименте не обладают обнаруживаемыми уровнями анти- FXa активности в плазме и двое обладают низкими уровнями, порядка от 0,13 IU /мл до 0,25 IU/мл. Средняя величина на абсорбции в этом эксперименте была 0,7 ± 1,5% (включая случаи с необнаруживаемой абсорбцией).
Заключение. Когда точно определенная липидная система заменяется сырами липидами, из которых она получена очисткой, также наблюдается резкое понижение ректальной абсорбции, что свидетельствует о том, что повышение абсорбции, описанное в ряде примеров выше, является не эффектом липидов вообще, а эффектом определенной липидной системы.
Пример 17
Количество Fragmin® по отношению к количеству липидов в примерах, описанных выше, всегда составляет 2 мг/кг веса тела к 100 мг/кг веса тела. Следующий эксперимент проведен для исследования ректальной абсорбции в зависимости от соотношения Fragmin®/ липид. Одна часть плацедо-липидной системы смешивалась с 4 частями физиологического раствора, содержащего растворенный Fragmin®, как описано в примере 16, но при выдерживании в течение 16 часов периода. Более высокое соотношение Fragmin®/ липид было получено при увеличении количества Fragmin®, растворенного в физиологическом растворе. Следующие составы были исследованы с точки зрения ректальной абсорбции (cм. табл.9)
Были получены следующие результаты (см. табл.10).
Заключение. Все исследованные композиции Fragmin®/ липид давали высокую ректальную абсорбцию, что свидетельствовало о том, что Fragmin® и липиды в описанной системе дают повышение абсорбции по сравнению с Fragmin® без липидов. Липидная композиция обладает усиливающим действием на абсорбцию Fragmin®.
Пример 18
Fragmin® является низкомолекулярным гепариновым фрагментом, полученным из свиного гепарина путем регулируемого азотной кислотой процесса деполимеризации. Некоторые исследования показали, что гепарин слабо (< 1%) абсорбируется после орального или интрадуоденального введения. Задачей данного излучения было исследовать, может ли липидная система повысить ректальную абсорбцию гепарина. Экспериментальная методика была такой же, что описана в примере 14, за исключением того, что Fragmin® был заменен на гепарин. Восемь кроликов получали следующие дозы: гепарин 2 мг/кг, липиды 100 мг/кг и дистиллированная воды 400 мг/кг. Все колики в этом эксперименте обладали обнаруживаемыми уровнями анти- FXa активности в плазме. Максимальная концентрация в плазме (Cmax) достигалась в пределах времени 0,5 - 2,0 часов и составляла от 0,12 IU/мл до 0,53 IU/мл. Средняя величина абсорбции в этом эксперименте была 15,7 ± 8%.
Заключение. Ректальная абсорбция гепарина значительно повышается, когда его раствор подмешан к липидной системе. Степень абсорбции, однако, значительно ниже, чем у Fragmin® по сравнении в тех же условиях. Это свидетельствует о том, что существует величина зависимости или специфического взаимодействия при абсорбции частиц молекул или непосредственно гепарина, что позволяет проектировать и регулировать препараты, которые используются при лечении.
Пример 19
Все образцы, описанные далее, были введены через 10 минут после приготовления композиции Fragmin®/ липид/вода.
3 кролика, которые получали липид/физиологический раствор композицию, содержащую 4% Fragmin® были проверены с целью установления, имеет ли какое-нибудь влияние временной промежуток между приготовлением композиции и ее введением на абсорбцию. Смесь готовили также, как в примере 14, но в дополнение давали ей стоять 16 часов перед тем, как ввести ректально при дозировке: Fragmin® 2 мг/кг, липидов 60 мг/кг и физиологического раствора 200 мг/кг веса тела. Cmax достигалась в течение промежутка времени 0,5 - 2,0 часов и составляла от 0,72 IU/ мл до 1,90 IU/мл при средней 1,12 IU/ мл. Средняя величина абсорбции в этом эксперименте составляла 65%
Заключение. Данные показывают, что после образования, композиция может назначаться после стояния в течение промежутка времени различной длительности без значительного влияния на абсорбционные свойства.
Пример 20
Эксперименты in vitro были проведены с целью изучения влияния липидной композиции на анти - FXa активность Fragmin® в отношении времени хранения. Fragmin® был включен в липидную систему, как указано в примерах выше. Концентрация Fragmin® была 2% от веса липидов. Одна часть (по весу) Fragmin®/ липида и 4 части (по весу) дистиллированной воды перемешаны встряхиванием и затем оставлялись стоять на 6 недель. Активность Fragmin® исследовалась в течение всего этого периода. Начальная активность 85 IU/мг (серия 1) и 78 IU/мг (серия 2), соответственно, и активность после 6 недель была 96 IU/мг (серия 1) и 85 IU/мг (серия 2).
Заключение. Результаты показывают, что активность Fragmin® сохраняется в течение длительного хранения композиции.
Пример 21
Те же операции, как в примере 19, были проведены на 4 кроликах с композицией липид/2%-ный физиологический раствор Fragmin®. Вводимая доза Fragmin® была 2 мг/кг со 100 мг/кг липидов и 200 мг/кг физиологического раствора. Cmax достигалась в течение промежутка времени 0,75 - 1,5 ч и составляла от 0,82 IU/мл до 0,86 IU/мл, со средним значением 0,86 IU/мл.
Средняя величина абсорбции в этом эксперименте была около 48%.
Заключение. Дисперсия была удобна при применении и при использовании рассчитанных количеств и показала повышение абсорбции.
Фармацевтическая композиция включает по крайней мере одно биоактивное соединение, водосодержащий растворитель и липидную систему. Липидная система состоит по крайней мере из двух липидных компонентов. Один из липидных компонентов является алифатическим и полярным, выбранным из фосфатидилхолина и других фосфолипидов, образует двойной слой и присутствует в количестве от 1 до 90 мас.% относительно липидной системы. Другой липидный компонент является неполярным, выбранным из групп моно-, ди- и триглицеридов, имеющих длину цепи с числом атомов углерода от 6 до 18. Биоактивное соединение является гепарином. или его фрагментом, или его производным и присутствует в количестве 1-200 мас.% относительно липидной системы. Водосодержащий растворитель присутствует в количестве, необходимом для образования индивидуальных и дискретных липидных частиц. Новая фармацевтическая композиция с липидной системой обеспечивает высокую биологическую абсорбцию гепаринов, а также создание удобных непарентеральных форм продолжительного срока действия лекарств гепарина. 6 з.п.ф-лы, 10 табл.
| 0 |
|
SU158441A1 | |
| Торфодобывающая машина с вращающимся измельчающим орудием | 1922 |
|
SU87A1 |
Авторы
Даты
1999-04-10—Публикация
1993-03-26—Подача