Настоящее изобретение относится к новым производным пиразола, гербицидам, содержащим их в качестве активных ингредиентов, и к новым промежуточным соединениям, подходящим для получения вышеуказанных производных пиразола.
Предпосылки изобретения и задачи, решаемые изобретением
Гербициды являются очень важными химикалиями для повышения производительного труда при борьбе с сорняками и для повышения производительности сельскохозяйственных и садоводческих продуктов. Поэтому гербициды активно исследовались и разрабатывались в течение многих лет и множество химикалиев используется на практике в настоящее время.
В процессе роста зерновых обычно применяются гербициды на основе триазина, такие как атразин, и гербициды на основе анилидов кислот, такие как алахлор и метохлор. Однако атразин проявляет низкую эффективность на злаковидных сорняках, а алахлор и метохлор проявляют низкую эффективность на широколистных сорняках. Поэтому в настоящее время трудно подавлять одновременно одним гербицидом злаковидные и широколистные сорняки. Кроме того, вышеуказанные гербициды являются нежелательными с точки зрения проблем, связанных с окружающей средой, вызванных требованием высокой дозировки.
Известно далее, что на полях риса-падди растет не только рис-падди, но также и различные сорняки, включая однолетние злаковидные сорняки, такие как петушье просо, однолетние сорняки сыти, такие как зонтичное растение, однолетние широколистные сорняки, такие как монохория, и ротала ветвистая, и многолетние сорняки, такие как стрелолист Sagittaria pygmaea miquel, рдест широколистный, частуха обыкновенная, камыш озерный, игольчатый камыш баранец needleupright clubrush, сыть поздняя Cyperus serotinus rottboell, водный каштан, стрелолист и лабазник шестилепестный. При культивации риса является очень важным эффективное подавление этих сорняков без проявления фитотоксичности по отношению к рису-падди, а также распыление химикалия небольшой дозой в аспекте загрязнения среды. Известно, что химикалии, имеющие высокую гербицидную активность в отношении проса петушьего, обычно проявляют фитотоксичность по отношению к рису-падди, и особенно важной целью остается разработка химического препарата, который проявляет высокую гербицидную активность в отношении петушьего проса, являющегося злаковым сорняком, и обладает превосходной межвидовой избирательностью между рисом-падди и петушьим просом.
Между тем уже известно, что определенные производные 4-бензоилпиразола обладают гербицидной активностью (см. JP-A-63-122672, JP-A-63-122673, JP-A-63-170365, JP-A-63-122672, JP-A-1-52759, JP-A-2-173 и JP-A-2-288866). В качестве коммерчески доступного в настоящее время представлен пиразолат следующей химической формулы.
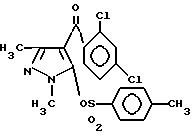
Далее, типичный пример (A) производных 4-бензоилпиразола, описанный в вышеуказанных публикациях (Соед. N 35 в JP-A-2-173) имели следующую формулу.
Соединение (A): Соединение N 35, описанное в JP-A-2-173
Хотя, эти производные 4-бензоилпиразола обладают гербицидной активностью, она не достаточна для практического использования. В частности, они весьма неполноценны по гербицидной активности по отношению к злаковидным сорнякам, таким как петушье просо и щетинник зеленый. Кроме того, при использовании в качестве гербицида на полях падди, вышеуказанные препараты могут проявлять фитотоксичность по отношению к рису-падди, поскольку они имеют низкую избирательность между рисом-падди и злаковидными сорняками.
Авторы настоящего изобретения поэтому предложили производные пиразола, имеющие тиохромановое кольцо, которое уже указывалось в патенте (патентная заявка Японии N 4-185526 и международная патентная публикация W093/18031). Типичные примеры (B) и (C) соединений, содержащихся в описаниях вышеуказанных заявок, следующие.
Соединение (B): Соединение N 66, описанное в международной патентной публикации W093/1803
Соединение (C): Соединение N b-3, описанное в патентной заявке Японии N 4-185526
Однако вышеуказанные соединения обладают высокой гербицидной активностью, в то же время остается необходимость повышения безвредности по отношению к рису-падди.
Настоящее изобретение создано в связи с вышеуказанными обстоятельствами и его объектами являются производное пиразола, которое не проявляет фитотоксичность по отношению к кукурузе и рису-падди и, которое может подавлять при использовании в низких дозах, большое разнообразие сорняков суходольных полей и сорняков полей падди, особенно петушье просо, гербицид, содержащий производное пиразола, и, кроме того, промежуточное соединение для получения производного пиразола.
Описание изобретения
Первым объектом настоящего изобретения является производное пиразола общей формулы (I),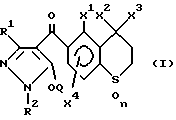
{где:
R1 обозначает атом водорода или C1-C4-алкильную группу;
R2 обозначает C1-C4-алкильную группу;
X1 обозначает атом водорода, атом галогена или C1-C4-алкильную группу; каждый из X2 и X2 обозначают, независимо, C1-C4-алкильную группу;
X4 обозначает атом водорода, атом галогена или C1-C4-алкильную группу, и является заместителем в 7-м положении или в 8-м положении тиохроманового кольца:
Q обозначает атом водорода или группу формулы -A-B
[в которой:
A обозначает -SO2-, -CO- или -CH2CO-; и
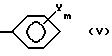
B обозначает C1-C8-алкильную группу, C3-C8-циклоалкильную группу или группу формулу (V),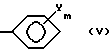
(в которой:
Y обозначает атом галогена, нитрогруппу, C1-C4-алкильную группу, C1-C4-алкоксигруппу или галоген-C1-C4-алкильную группу; и
m обозначает целое число 0, 1 или 2)]; и
n обозначает целое число 0, 1 или 2}, или его соль.
Вторым объектом настоящего изобретения является гербицид, содержащий в качестве активного ингредиента производное пиразола формулы (I) и/или его соль.
Третьим объектом настоящего изобретения является производное ароматической карбоновой кислоты, которое используется для получения вышеуказанного производного пиразола общей формулы (I) и которое представлено общей формулой (II),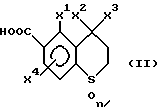
{где X1 обозначает C1-C4-алкильную группу или атом галогена;
каждый из X2 и X3 обозначают, независимо, C1-C4-алкильную группу; и X4 обозначает атом водорода, C1-C4-алкильную группу или атом галогена, и является заместителем в 7-м положении или в 8-м положении тиохроманового кольца), или его соль.
Предпочтительные осуществления изобретения
Новое производное пиразола по настоящему изобретению является соединением формулы (I).

В формуле (I) R1 обозначает атом водорода или C1-C4-алкильную группу, и R2 обозначает C1-C4-алкильную группу. C1-C4-алкильная группа для R1 и R2 включает метил, этил, пропил, такой как н-пропил и изо-пропил, и бутил, такой как н-бутил и изо-бутил.
X1 обозначает атом водорода, атом галогена или C1-C4-алкильную группу. Атом галогена включает фтор, хлор, бром и йод. C1-C4-алкильная группа включает определения, касающиеся R1 и R2.
X1 предпочтительно обозначает C1-C4-алкильную группу, более предпочтительно, метил.
Каждый из X2 и X2 обозначают, независимо, C1-C4-алкильную группу. C1-C4-алкильная группа включает определения, касающиеся R1 и R2.
X4 обозначает атом водорода, атом галогена или C1-C4-алкильную группу. Атом галогена включает определения, касающиеся X1. C1-C4-алкильная группа включает определения, касающиеся R1 и R2. X4 является, предпочтительно, C1-C4-алкильной группой, более предпочтительно, метилом. Положением заместителя является 7-е положение или 8-е положение тиохроманового кольца, предпочтительно, 8-е положение.
Q обозначает атом водорода или группу формулы -A-B, A обозначает -SO2-, -CO- или -CH2CO-, и B обозначает C1-C8-алкильную группу, C3-C8-циклоалкильную группу или группу формулу (V).

C1-C8-алкильная группа в качестве одного члена B включает метил, этил, пропил, бутил, пентил, гексил, гептил или октил, и алкильная группа, имеющая по меньшей мере 3 атома углерода, может быть линейной или разветвленной. C3-C8-циклоалкильная группа в качестве другого члена B включает циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил.
В группе формулы (V), в качестве еще другого члена для B, Y обозначает атом галогена, нитрогруппу, C1-C4-алкильную группу, C1-C4-алкоксигруппу или галоген C1-C4-алкильную группу. Атом галогена включает определения, касающиеся X1 и X4. C1-C4-алкильная группа включает определения, касающиеся R1 и R2. C1-C4-алкоксигруппа включает метокси, этокси, пропокси, необязательно разветвленный, или бутокси, необязательно разветвленный. Галоген C1-C4-алкильная группа включает такую, в которой атом(ы) галогена C1-C4-алкильной группы, включенной в определения, касающиеся R1 и R2, замещена атомом(ами)галогена, включенным в определения, касающиеся X1 и X4. Конкретно, галоген C1-C4-алкильная группа включает -CH2F, -CHF2, -CF3, -CF2CF2, -CHCl3 и -CH2CF3.
m, показывающее число Y, равно целому числу 0, 1 или 2.
Одной предпочтительной комбинацией A и B в группе -A-B является сочетание A, который является -SO2-, и B, который является C1-C8-алкильной группой или фенильной группой, замещенной 1 или 2 атомом(ами) галогена, нитрогруппой(ами), C1-C4-алкильной(ыми) группой(ами) или C1-C4-алкоксигруппой(ами) (группа формулы (V), в которой Y является атомом(ами) галогена, нитрогруппой(ами), C1-C4-алкильной(ыми) группой(ами) или C1-C4-алкоксигруппой(ами) и m равен 0, 1 или 2). Другой предпочтительной комбинацией A и B является сочетание A, который является -CO- или -CH2CO-, и B, который является C1-C8-алкилом или галогензамещенным или незамещенным фенилом (группа формулы (V), в которой Y является атомом(ами) галогена и m равен 0, 1 или 2).
n показывает число атомов кислорода и является целым числом 0, 1 или 2. Таким образом, когда n равен 0, представлен сульфид. Когда n равен 1, представлен сульфоксид. Когда n равен 2, представлен сульфон.
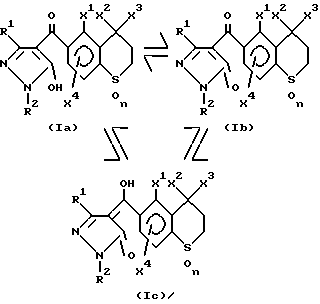
Производные пиразола общей формулы (I), в которой Q обозначает водород, то есть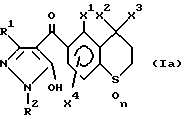
может иметь следующие три структуры, вызванные таутомерией, и производное пиразола по настоящему изобретению включает все такие структуры.
Кроме того, производное пиразола общей формулы (Ia) является кислотным веществом и может быть поэтому легко преобразовано в соль обработкой основанием. Эта соль также является производным пиразола по настоящему изобретению. Вышеуказанное основание особо не ограничено, если оно известно. Например, оно выбрано из органических оснований, таких как амины и анилины, и из неорганических оснований, таких как натриевые соединения и калиевые соединения. Амины включают моноалкиламин, диалкиламин и триалкиламин. Алкильная группа алкиламина является обычно C1-C4-алкильной группой. Анилины включают анилин, моноалкиланилин и диалкиланилин. Алкильная группа алкиланилина является обычно C1-C4-алкильной группой. Натриевые соединения включают гидроксид натрия и карбонат натрия. Калиевые соединения включают гидроксид калия и карбонат калия.
Гербициды по настоящему изобретению содержат новое производное пиразола формулы (I) и/или его соль, в соответствии с настоящим изобретением, в качестве активного ингредиента. Эти соединения используются путем смешения их с жидким носителем, таким как растворитель, или с твердым носителем, таким как минеральный тонко измельченный порошок, и путем получения смеси в виде смачивающегося порошка, концентрата эмульсии, дуста или гранул. При приготовлении препаратов для придания соединениям способности к эмульгированию, диспергированию или растекаемости может быть добавлено поверхностно-активное вещество.
Когда гербицид по настоящему изобретению используют в виде смачивающегося порошка, обычно, для получения композиции смешивают от 10 до 55% по весу производного пиразола и/или его соли, от 40 до 88% по весу твердого носителя и от 2 до 5% по весу поверхностно-активного вещества, и такая композиция может быть использована. Когда гербицид по настоящему изобретению используют в виде способного к эмульгированию концентрата, обычно, способный к эмульгированию концентрат может быть получен смешиванием от 20 до 50% по весу производного пиразола и/или его соли по настоящему изобретению, от 35 до 75% по весу растворителя и от 5 до 5% по весу поверхностно-активного вещества.
С другой стороны, когда гербицид по настоящему изобретению используют в виде дуста, обычно, дуст может быть получен смешиванием от 1 до 15% по весу производного пиразола и/или его соли по настоящему изобретению, от 80 до 97% по весу твердого носителя и от 2 до 5% по весу поверхностно-активного вещества. Далее, когда гербицид по настоящему изобретению используют в виде гранул, гранулы могут быть получены смешиванием от 1 до 15% по весу производного пиразола и/или его соли по настоящему изобретению, от 90 до 97% по весу твердого носителя и от 2 до 5% по весу поверхностно-активного вещества.
Вышеуказанный носитель выбирают из минеральных порошков, и примеры минеральных порошков включают оксиды, такие как диатомовая земля и гашеная известь, фосфаты, такие как апатит, сульфаты, такие как гипс и силикаты, такие как тальк, профиллит, глина, каолин, бентонит, кислый высокосортный гипс, белая сажа, порошкообразный кварц и порошкообразный силикагель. Растворитель выбирают из органических растворителей, и конкретные примеры включают ароматические углеводороды, такие как бензол, толуол и ксилол, хлорированные углеводороды, такие как о-хлортолуол, трихлорэтан и трихлорэтилен, спирты, такие как циклогексанол, амиловый спирт и этиленгликоль, кетоны, такие как изофорон, циклогексанон и циклогексил-циклогексанон, эфиры, такие как бутилцеллозольв, диэтиловый эфир и метилэтилэфир, сложные эфиры, такие как изопропилацетат, бензилацетат и метилфталат, амиды, такие как диметилформамид, и их смеси.
Поверхностно-активное вещество выбирают из анионных поверхностно-активных веществ, неионных поверхностно-активных веществ, катионных поверхностно-активных веществ и амфотерных поверхностно-активных веществ (аминокислота и бетаин).
Гербициды по настоящему изобретению могут содержать в качестве активного ингредиента другой гербицидно-активный компонент, если требуется, в добавление к производному пиразола общей формулы (I) и/или его соли. "Другой" гербицидно-активный компонент включает обычные известные гербициды, такие как гербициды на основе фенокси, на основе дифенилового эфира, на основе триазина, на основе мочевины, на основе карбамата, на основе тиолкарбамата, на основе анилида кислоты, на основе пиразола, на основе фосфорной кислоты, на основе сульфонилмочевины и на основе оксадиазона. "Другой" гербицидно-активный компонент, по существу, выбирают из вышеуказанных гербицидов. Гербицид по настоящему изобретению может использоваться в виде смеси с пестицидом, фунгицидом, регулятором роста растений, удобрением и т.д.
Новое производное пиразола формулы (I), входящее в настоящее изобретение, может быть получено следующим способом.
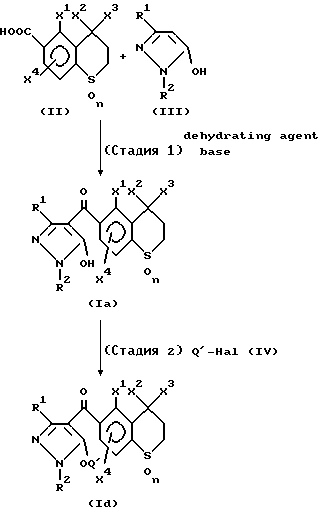
В вышеуказанной реакционной схеме Q1 является группой -A-B, в которой A обозначает -SO2-, -CO- или -CH2CO-, и B обозначает C1-C8-алкильную группу, C3-C8-циклоалкильную группу или группу формулу (V).
(в которой Y является атомом галогена, нитрогруппой, C1-C4-алкильной группой, C1-C4-алкоксигруппой или галоген C1-C4-алкильной группой, и m показывает количество Y и является целым числом 0, 1 или 2), R1, R2, X1, X2, X3 и X4 уже определены выше и Hal является атомом галогена.
Каждая стадия вышеуказанного способа получения будет пояснена далее.
(Стадия 1)
Соединение формулы (II) и соединение формулы (III) подвергают взаимодействию в инертном растворителе в присутствии дегидратирующего агента, например, ДЦК (N,N'-дициклогексилкарбодиимида), КДИ (1,1-карбонилдиимидазола), ЭДК (1-(3-диметиламинопропил)-3-этилкарбодиимида) или тому подобное, и основания с получением производного пиразола формулы (Iа).
Количество соединения формулы (III) составляет, предпочтительно, от 1,0 до 3,0 моль на моль соединения формулы (II). Количество дегидратирующего агента составляет, предпочтительно, от 1,0 до 1,5 моль на моль соединения формулы (II). Вид основания особо не ограничивается, в то же время карбонат калия, карбонат натрия или тому подобное предпочтительно используются в количестве от 0,5 до 2,0 моль на моль вышеуказанного соединения формулы (II). Инертный растворитель особо не ограничивается, в то же время его предпочтительно выбирают из ацетонитрила, трет-амилового спирта, трет-бутилового спирта и трет-пропилового спирта. Температура реакции может быть в области от комнатной температуры до точки кипения растворителя, в то же время предпочтительна в области 80oC. Время реакции составляет от 1 до 48 часов, в то же время обычно оно равно около 8 часам.
(Стадия 2)
Соединение (Ia), полученное на стадии 1, подвергают взаимодействию с Q1- Hal (IV) (в котором Q1 и Hal уже определены выше) в присутствии основания с получением соединения (Id).
На вышеуказанной стадии мольное соотношение соединение (Ia): соединение (IV) составляет, предпочтительно, от 1:1 до 1:3. Кроме того, для выделения галогенида водорода, образующегося в качестве побочного продукта при взаимодействии, предпочтительно использовать основание, такое как карбонат натрия, карбонат калия, триэтиламин или пиридин, в эквимольном соотношении или более, основываясь на исходном продукте формулы (Ia). Температура реакции, предпочтительно, находится в области от комнатной температуры до точки кипения растворителя. Растворитель, используемый в реакции, предпочтительно выбран из ароматических углеводородов, таких как бензол и толуол, эфиров, таких как диэтиловый эфир, кетонов, таких как метилэтилкетон, и галогенированных углеводородов, таких как метиленхлорид и хлороформ. Кроме того, может использоваться двухфазная система вышеуказанных растворителей. В этом случае предпочтительный результат может быть получен при добавлении к реакционной системе катализатора межфазного переноса, такого как краун-эфир или бензилтриэтиламмонийхлорид.
Производное ароматической карбоновой кислоты формулы (II)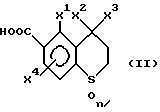
{ где X1 обозначает C1-C4-алкильную группу или атом галогена, каждый из X2 и X3 обозначают, независимо, C1-C4-алкильную группу, X4 обозначает атом водорода, атом галогена или C1-C4-алкильную группу, и положение, в котором находится заместитель X4, является 7-ым или в 8-ым положением, и n показывает число атомов кислорода и является целым числом 0, 1 или 2) используемое при взаимодействии соединения формулы (III), является новым соединением, которое не было описано ранее, и используется в качестве промежуточного продукта производного пиразола по настоящему изобретению.
Конкретные примеры X1, X2, X3 и X4 в вышеуказанной формуле включают такие, которые касаются производного пиразола вышеуказанной формулы (I).
Производное ароматической карбоновой кислоты формулы (II) является кислым веществом и поэтому может быть легко преобразовано в соль путем обработки с основанием. Эта соль включает также производное ароматической кислоты по настоящему изобретению. Вышеуказанное основание особо не ограничивается, если оно известно. Например, его выбирают из органических оснований, таких как амины и анилиды, и из неорганических оснований, таких как соединения натрия и соединения калия. Амины включают моноалкиламин, диалкиламин и триалкиламин. Алкильная группа алкиламинов обычно является C1-C4-алкильной группой. Анилиды включают анилин, моноалкиланилин и диалкиланилин. Алкильная группа алкиланилинов обычно является C1-C4 алкильной группой. Натриевые соединения включают гидроксид натрия и карбонат натрия. Калиевые соединения включают гидроксид калия и карбонат калия.
Производное ароматической карбоновой кислоты формулы (II) получают следующими способами (X), (Y) и (Z).
Эти способы будут подробно объяснены далее.
Способ (X): Синтетический метод, в котором X1 = C1-C4 алкильная группа и X4 = C1-C4 алкильная группа и является заместителем в 8 положении.

В вышеуказанной реакционной схеме X2, X3, n и Hal указаны выше.
2,5-Диалкилтиофенол формулы (a), который является исходным продуктом, получают известным способом (например, New Handbook of Experimental Chemistry, Vol.14, Synthesis and Reaction of Organic Compounds, III, page 1704, Chapter 8.1, Thiols, f. It's Synthesis via Dithiocafbonate, опублик. Maruzen Publishing Co. Japan. 20 февраля 1986).
Исходный продукт формулы (а) и 3-галоген-1,1-диалкилпропен (Hal-CH2-CH = CX2X3) подвергают взаимодействию в инертном растворителе, таком как ацетон, диэтиловый эфир или диметилформамид, в присутствии основания, такого как безводный карбонат калия, гидроксид натрия, гидроксид калия, безводный карбонат натрия или триэтиламин, с получением соединения формулы (b). 3-Галоген-1,1-диалкилпропен и основание используют в количествах от эквивалентных до от 1,0 до 1,5 моль и от 1,0 до 1,5 моль, соответственно, на моль исходного продукта формулы (a). Предпочтительно, температура реакции обычно составляет от 0 до 80oC, и время реакции обычно приблизительно от 1 до 8 часов.
Соединение формулы (b) подвергают замыканию цикла путем прибавления дегидратирующего конденсирующего агента, такого как полифосфорная кислота, серная кислота или пентоксид фосфора, с получением соединения формулы (c) (производное тиохромана). Дегидратирующий конденсирующий агент используют в количествах от эквивалентных до от 1 до 10 моль на моль исходного продукта формулы (b). Предпочтительно, температура реакции обычно составляет от 0 до 100oC, и время реакции обычно приблизительно от 1 до 8 часов.
Соединение формулы (c) подвергают взаимодействию с галогенирующим реагентом, таким как бром, сульфурилхлорид или хлор, в присутствии растворителя, такого как метиленхлорид, хлороформ или тетрахлорид углерода, с получением соединения формулы (d), в котором галоген является заместителем в 6-положении. Предпочтительно, температура реакции обычно составляет от 0 до 80oC, и время реакции обычно приблизительно от 1 до 80 часов.
Соединение формулы (d) подвергают взаимодействию с магнием (Mg) с образованием реактива Гриньяра, и реактив Гриньяра подвергают взаимодействию с диоксидом углерода (СО2) с получением соединения (е) (n = 0, производное сульфида), которое является производным ароматической карбоновой кислоты формулы (II), охватываемое настоящим изобретением, в котором карбоксильная группа является заместителем в 6-м положении. В качестве растворителя, предпочтительно, используют заместитель, выбранный из эфиров, таких как диэтиловый эфир и тетрагидрофуран. Температура реакции предпочтительно составляет от 0 до 70oC, особенно предпочтительно, от 20 до 60oC. Время реакции обычно приблизительно от 1 до 7 часов.
Количество магния (Mg) для получения реактива Гриньяра составляет, предпочтительно, от эквивалентного до от 1,1 до 3,5 моль на моль соединения формулы (d). Предпочтительно, для проведения вышеуказанной реакции Гриньяра в присутствии алкилиодида, такого как метилиодид, или алкилбромида, такого как этилбромида, для мягкого протекания процесса. Количество алкилгалогенида, используемого выше, составляет, предпочтительно, от эквивалентных до от 0,1 до 2,5 моль на моль соединения формулы (d).
Взаимодействие между реактивом Гриньяра и диоксидом углерода (CO2) осуществляют путем продувки газообразного диоксида углерода, получаемого из сухого льда (твердый диоксид углерода) в реактив Гриньяра в растворителе. Кроме того, сухой лед может быть прямо добавлен в реактив Гриньяра для осуществления этой реакции.
Окислительный агент (например, перекись водорода, надуксусная кислота или надметайодат натрия) подвергают взаимодействию с соединением формулы (e) в растворителе (например, уксусная кислота, вода или метанол) с получением соединения (f) (n = 1, производное сульфоксида), которое является производным ароматической карбоновой кислоты формулы (II), охватываемое настоящим изобретением. Когда количество окислительного агента составляет 1 эквивалент по отношению к соединению (e), получают сульфоксид (соединение, в котором n = 1), и когда количество окислительного агента составляет 2 эквивалента по отношению к соединению (e), получают сульфон (соединение, в котором n = 2).
Способ (Y): Синтетический метод, в котором X1 = C1-C4-алкильная группа и X4 = атом водорода или атом хлора.
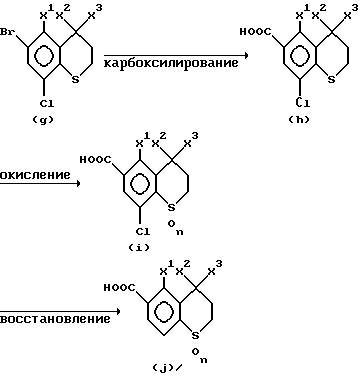
(где X2, X3 и n уже указаны выше.)
4,4,5-Триалкил-6-бром-8-хлортиохроман формулы (g) может быть получен в качестве исходного продукта, например, из соединения формулы (a), в которой X4 = хлор в вышеуказанном способе (X), тем же способом, что и по способу (X). Таким образом, 4,4,5-триалкил-6-бром-8-хлортиохроман формулы (g) соответствует соединению формулы (d), в которой Hal является бромом и X4 является хлором по способу (X).
Соединение формулы (g) подвергают взаимодействию с магнием (Mg) с образованием реактива Гриньяра, и реактив Гриньяра подвергают взаимодействию с диоксидом углерода (CO2) с получением соединения (h) (n = 0, производное сульфида), которое является производным ароматической карбоновой кислоты формулы (II), охватываемое настоящим изобретением, в котором карбоксильная группа является заместителем в 6-м положении. Реакционные условия, такие как растворитель, температура реакции, количество используемого магния, являются такими же, как условия по способу (X).
Затем, окислительный агент подвергают взаимодействию с соединением формулы (h) в растворителе с получением соединения (i) (n = 1, производное сульфоксида / n = 2, производное сульфона), которое является производным ароматической карбоновой кислоты формулы (II). Реакционные условия, такие как вид и количество окислительного агента и растворитель являются такими же, как условия по способу (X).
В заключение соединение формулы (i) восстанавливают порошком цинка или тому подобным в 60% водном этаноле с получением соединения (j), которое является производным ароматической карбоновой кислоты формулы (II), охватываемым настоящим соединением. Предпочтительно, температура реакции обычно находится в области от 20 до 120oC, и время реакции обычно от 1 до 12 часов.
Способ (Z): Общий метод
Производное ароматической карбоновой кислоты формулы (II) может быть также получено на следующих стадиях дополнительно к способам (X) и (Y).

В вышеуказанной схеме X1, X2, X3, X4 и n уже указаны выше.
(Стадии 1 и 2)
Стадии 1 и стадии 2 получения соединения (c') из исходного продукта (a') через соединение (b') являются такими же, что и для получения соединения (c) из соединения (a) по способу (X).
(Стадия 3)
Соединение формулы (c') подвергают взаимодействию с ацетилхлоридом вместе с кислотой Льюиса, такой как хлорид алюминия, хлорид цинка и хлорид железа, или протонная кислота, такая как фтористый водород, серная кислота или фосфорная кислота, в присутствии растворителя, такого как дихлорметан, нитрометан, ацетонитрил или бензол, с получением соединения (k), в котором ацетильная группа находится в 6-м положении. Каждая из кислот Льюиса или протонных кислот используется в количестве от эквивалентного до от 1,0 до 1,5 моль на моль соединения (c'). Предпочтительно, температура реакции обычно составляет от 0 до 80oC, и время реакции обычно приблизительно от 1 до 8 часов.
(Стадия 4)
Окислительный агент (например, перекись водорода, надуксусная кислота или надметайодат натрия) подвергают взаимодействию с соединением (k) (сульфид) в растворителе (например, уксусная кислота, вода или метанол) с получением соединения (1) (n = 1, производное сульфоксида / n = 2, производное сульфона). Когда количество окислительного агента составляет 1 эквивалент по отношению к соединению (k), получают сульфоксид (соединение, в котором n = 1), и когда количество окислительного агента составляет 2 эквивалента по отношению к соединению (k), получают сульфон (соединение, в котором n = 2).
(Стадия 4')
В J. Am. Chem. Soc. 66, page 1,612 (1944), описан способ, по которому метилкетонную группу (ацетильную группу) в 6-положении трихроманового кольца преобразуют в карбоксильную группу без окисления атома серы (S) тиохромана. То есть, метилкетонное производное формулы (k) подвергают взаимодействию с йодом в пиридине и разлагают со щелочью с получением соединения m (n = 0, производное сульфида), которое является производным ароматической карбоновой кислоты формулы (II), охватываемым настоящим изобретением.
(Стадия 5)
Метилкетоновое производное (1) преобразуют в производное ароматической карбоновой кислоты (II) с помощью окислительного агента (например, перманганата, хромовой кислоты, галогена, кислорода или серной кислот).
Примеры
Настоящее изобретение будет объяснено далее подробно со ссылками на примеры далее, при этом настоящее изобретение не будет ограничено этими примерами.
Пример промежуточного получения 1
1,1 -Диоксид-4,4,5,8-тетраметилтиохроман-6-карбоновая кислота, используемая в качестве исходного продукта по препаративному примеру 1, который будет описан далее, была получена путем следующих стадий.
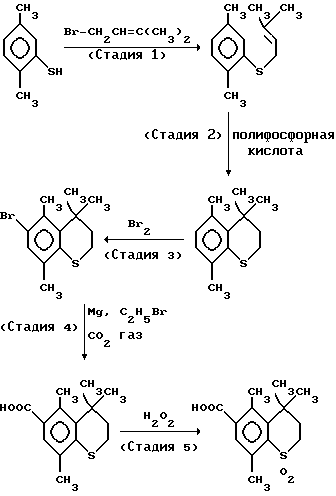
Стадия (1)
Ацетон в количестве 80 мл, 9,1 г (0,06 моль) 1-бром-3-метил-2-бутена и 8,0 г (0,058 моль) безводного карбоната натрия прибавляют к 8,0 г (0,058 моль) 2,5-диметилтиофенола и смесь кипятят с обратным холодильником в течение 1 часа. После взаимодействия образовавшуюся соль удаляют фильтрацией и ацетон отгоняют при пониженном давлении. Затем к оставшемуся осадку прибавляют этилацетат и смесь промывают насыщенным хлоридом натрия и сушат над безводным сульфатом натрия. Далее этилацетат отгоняют при пониженном давлении с получением 12 г (выход 100%) 2-метил-4-(2,5-диметилфенил)тио-2-бутена.
ЯМР (м. д., растворитель: CDCl3, внутренний стандарт: тетраметилсилан): 1,60 (3H, c), 1,70 (3H, c), 2,30 (6H, c), 3,50 (2H, д), 5,15-5,50 (H, м), 6,80-7,10 (3H, м)
Стадия (2)
7,0 грамм (0,034 моль) 2-метил-4-(2,5-диметилфенил)тио-2-бутена прибавляют к 51 г полифосфорной кислоты при перемешивании. Смесь затем перемешивают при комнатной температуре, выливают в ледяную воду и экстрагируют н-гексаном. Органический слой промывают насыщенным водным раствором хлорида натрия и затем сушат над безводным сульфатом натрия. При пониженном давлении отгоняют н-гексан с получением 6,7 г (выход 95%) 4,4,5,8-тетраметилтиохромана.
ЯМР (м. д., растворитель: CDCl3, внутренний стандарт: тетраметилсилан): 1,40(6H,с), 1,95-2,15 (2H,м), 2,20 (3H, с), 2,50 (3H, с), 2,80-3,10 (2H, м), 6,80 (2H, дд)
Стадия (3)
Метиленхлорид в количестве 100 мл прибавляют к 13,2 г (0,064 моль) 4,4,5,8-тетраметилтиохромана, по каплям прибавляют 10,2 г (0,064 моль) брома при комнатной температуре и затем смеси дают возможность взаимодействовать в течение 2 часов. После взаимодействия прибавляют 70 мл 2% водного раствора гидросульфата натрия, удаляют избыток брома и смесь подвергают жидкостному разделению. Органический слой промывают насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Метиленхлорид удаляют при пониженном давлении и полученное маслянистое вещество очищают хроматографией на колонке с силикагелем с получением 15,9 г (выход 87%) 4,4,5,8-тетраметил-6-бромтиохромана.
ЯМР (м. д., растворитель: CDCl3, внутренний стандарт: тетраметилсилан): 1,45 (6H, с), 1,90-2,10 (2H, м), 2,20 (3H, с), 2,50 (3H, с), 2,80-3,00 (2H, м), 7,20 (H, с)
Стадия (4)
2,9 грамма (0,12 моль) магния диспергируют в 100 мл ТГФ (тетрагидрофуран) и по каплям прибавляют 7,4 г (0,068 моль) этилбромида. Затем смеси дают возможность взаимодействовать в течение 10 минут, раствор 9,7 г (0,034 моль) 4,4,5,8-тетраметил-6-бромтиохромана в ТГФ постепенно прибавляют при комнатной температуре. Реакционную смесь кипятят с обратным холодильником в течение 3 часов и затем охлаждают до 10oC, и газообразный диоксид углерода вводят барботированием в течение 1 часа. К реакционной смеси прибавляют 5% хлористоводородную кислоту в количестве 100 мл для растворения непрореагировавшего магния. ТГФ отгоняют при пониженном давлении и прибавляют метиленхлорид для удаления водного слоя. Органический слой экстрагируют 5% водным раствором карбоната калия и прибавляют 5%-ную соляную кислоту для экстракции с установлением pH 1 для образования твердого осадка. Твердый осадок выделяют фильтрацией с получением 7,4 г (выход 88%) 4,4,5,8-тетраметилтиохроман-6-карбоновой кислоты.
ЯМР (м. д., растворитель: CDCl3, внутренний стандарт: тетраметилсилан): 1,50 (6H, с), 1,90-2,10 (2H, м), 2,25 (3H, с), 2,70 (3H, с), 2,90-3,10 (2H, м), 7,55 (H, с)
ИК (таблетка KBr, см-1): 3450-2550, 2980, 2930, 1695.
Т.пл.: 166,0-167,1oC.
Стадия (5)
Уксусную кислоту в количестве 4 мл прибавляют к 5 г (0,02 моль) 4,4,5,8-тетраметилтиохроман-6-карбоновой кислоты. Затем прибавляют 6,9 г (0,06 моль) 30% водной перекиси водорода и смесь нагревают при 80oC в течение 2 часов. К реакционной смеси прибавляют 2% водный раствор гидросульфита натрия в количестве 50 мл для выделения твердого продукта и твердый осадок выделяют фильтрацией с получением 5,1 г (выход 90%) 1,1-диоксида-4,4,5,8-тетраметилтиохроман-6-карбоновой кислоты.
ЯМР (м. д., растворитель: CDCl3, внутренний стандарт: тетраметилсилан): 1,60 (6H, с), 2,25-2,50 (2H, м), 2,65 (3H, с), 2,75 (3H, с), 3,30-3,50 (2H, м), 7,55 (H, с)
ИК (таблетка KBr, см-1): 3500-2550, 3000, 2950, 1630, 1290, 1130.
Т.пл.: 208.8-209,3oC.
Пример промежуточного получения 2
1,1-Диоксид-4,4,5-триметилтиохроман-6-карбоновая кислоты, используемая в качестве исходного продукта по препаративному примеру 2, который будет описан далее, была получена следующими стадиями.

Стадия (1)
0,63 грамма (0,026 моль) магния диспергируют в 20 мл ТГФ и прибавляют 1,89 г (0,0173 моль) этилбромида. После того, как смеси дают возможность взаимодействовать в течение 10 минут, постепенно прибавляют раствор 1,76 г (0,0058 моль) 4,4,5-триметил-6-бром-8-хлор-тиохромана в ТГФ при комнатной температуре. Реакционную смесь кипятят с обратным холодильником в течение 7 часов и затем охлаждают до 10oC и газообразный диоксид углерода вводят барботированием в течение 1 часа. К реакционной смеси прибавляют 5% хлористоводородную кислоту в количестве 30 мл для растворения непрореагировавшего магния. ТГФ отгоняют при пониженном давлении и прибавляют этилацетат для удаления водного слоя. Органический слой экстрагируют насыщенным водным раствором бикарбоната натрия и прибавляют 5%-ную соляную кислоту для экстракции с установлением pH 1 для образования твердого осадка. Твердый осадок выделяют фильтрацией с получением 0,54 г (выход 40%) 4,4,5-триметилтиохроман-8-хлор-6-карбоновой кислоты.
ЯМР (м. д., растворитель: CDCl3, внутренний стандарт: тетраметилсилан): 1,50 (6H, с), 1,90-2,10 (2H, м), 2,60 (3H, с), 2,85-3,10 (2H, м), 7,55 (H, с)
ИК (таблетка KBr, см-1): 3450-2550, 2980, 2930, 1695.
Стадия (2)
Уксусную кислоту в количестве 10 мл прибавляют к 0,82 г (3,0 моль) 4,4,5-триметил-8-хлортиохроман-6-карбоновой кислоты. Затем прибавляют 0,82 г (7,5 ммоль) 30% водной перекиси водорода и смесь нагревают при 80oC в течение 3 часов. Реакционную смесь выливают в 100 мл ледяной воды и экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Этилацетат отгоняют при пониженном давлении с получением 0,88 г (выход 96%) 1,1-диоксида-4,4,5-триметил-8-хлортиохроман-6-карбоновой кислоты.
ЯМР (м. д., растворитель: CDCl3, внутренний стандарт: тетраметилсилан): 1,60 (6H, с), 2,25-2,50 (2H, м), 2,65 (3H, с), 2,75 (3H, с), 3,30-3,50 (2H, м), 7,60 (H, с)
ИК (таблетка KBr, см-1): 3500-2550, 3000, 2950, 1630, 1290, 1130.
Т.пл.: 208,8-209,3oC.
Стадия (3)
0,88 Грамма (2,90 ммоль) 1,1-диоксида-4,4,5-триметил-8-хлор-тиохроман-6-карбоновой кислоты растворяют в 60% водном этаноле, прибавляют 0,55 г (8,70 моль) порошка цинка и смесь нагревают с обратным холодильником в течение 5 часов. После взаимодействия прибавляют 50 мл воды, порошок цинка удаляют фильтрацией и оставшуюся реакционную смесь экстрагируют этилацетатом. Экстракт промывают 1% соляной кислотой и насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Этилацетат отгоняют при пониженном давлении с получением 0,60 г (выход 78%) 1,1-диоксида-4,4,5-триметилтиохроман-6-карбоновой кислоты.
ЯМР (м. д., растворитель: CDCl3, внутренний стандарт: тетраметилсилан): 1,60 (6H, с), 2,30-2,50 (2H, м), 2,75 (3H, с), 3,30-3,50 (2H, м), 7,90 (2H, дд).
Пример промежуточного получения 3
1,1-Диоксид-5,8-дихлор-4,4-диметилтиохроман-6-карбоновая кислота, используемая в качестве исходного продукта по препаративному примеру 2, который будет описан далее, была получена следующими стадиями.
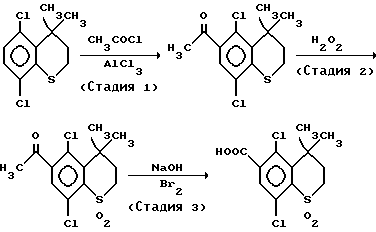
Стадия (1)
1,26 грамма (9,45 ммоль) безводного хлорида алюминия суспендируют в 10 мл метиленхлорида и прибавляют по каплям при охлаждении льдом 5 мл раствора 0,74 г (9,45 ммоль) ацетилхлорида в метиленхлориде. Смесь перемешивают до образования однородной реакционной смеси. Затем прибавляют 5 мл раствора 1,95 г (7,88 ммоль) 5,8-дихлор-4,4-диметилтиохромана в метиленхлориде и смесь перемешивают при комнатной температуре в течение 1 часа. После взаимодействия реакционную смесь выливают в ледяную воду и экстрагируют метиленхлоридом. Органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Метиленхлорид отгоняют при пониженном давлении и полученное маслянистое вещество очищают хроматографией на колонке с силикагелем с получением 1,27 г (выход 56%) 6-ацетил-5,8-дихлор-4,4-диметилтиохромана.
ЯМР (м. д., растворитель: CDCl3, внутренний стандарт: тетраметилсилан): 1,60 (6H,с), 1,95-2,20 (2H,м), 2,55 (3H, с), 2,80-3,10 (2H,м), 7,15 (H, с)
Стадия (2)
Уксусную кислоту в количестве 1 мл прибавляют к 1,22 г (4,22 ммоль) 6-ацетил-5,8-дихлор-4,4-диметилтиохромана. Затем прибавляют 1,43 г (12,66 ммоль) 30% водной перекиси водорода и смесь нагревают при 80oC в течение 2 часов. 2% гидросульфит натрия в количестве 10 мл прибавляют к реакционной смеси для выделения твердого продукта и твердый продукт выделяют фильтрацией с получением 0,96 г (выход 71%) 1,1-диоксида-6-ацетил-5,8-дихлор-4,4-диметилтиохромана.
ЯМР (м. д., растворитель: CDCl3, внутренний стандарт: тетраметилсилан): 1,65 (6H, с), 2,30-2,50 (2H, м), 2,55 (3H, с), 3,35-3,55 (2H, м), 7,30 (H, с)
ИК (таблетка KBr, см-1): 3300-2700, 1700, 1300, 1130.
Т.пл.: 154,3-155,1oC.
Стадия (3)
1,04 Грамма (26,1 ммоль) гидроксида натрия растворяют в 20 мл воды, прибавляют при охлаждении льдом 0,5 мл (8,7 ммоль) брома. Затем прибавляют 0,93 г (2,9 ммоль) 1,1-диоксида-5,8-дихлор-4,4-диметилтиохромана и смесь перемешивают в течение 3 часов и затем нагревают при 100oC в течение 5 часов. После взаимодействия прибавляют этилацетат и смесь подвергают жидкостному разделению. К водному слою прибавляют соляную кислоту до установления pH 1. Водный слой экстрагируют прибавлением этилацетата и органический слой высушивают над безводным сульфатом натрия. Этилацетат отгоняют при пониженном давлении с получением 0,84 г (выход 90%) 1,1-диоксида-5,8-дихлор-4,4-диметилтиохроман-6-карбоновой кислоты.
ЯМР (м. д. , растворитель: дейтерированная вода, внутренний стандарт: тетраметилсилан): 1,70 (6H, с), 2,30-2,50 (2H, м), 3,40-3,60 (2H, м), 7,75 (H, с)
ИК (таблетка KBr, см-1): 3500-2500, 1750, 1300, 1130.
Пример промежуточного получения 4
1,1-Диоксид-5-хлор-4,4,8-триметилтиохроман-6-карбоновая кислота, используемая в качестве исходного продукта по препаративному примеру 29, который будет описан далее, была получена путем следующих стадий.

Стадия (1)
3,2 грамма (24 ммоль) безводного хлорида алюминия суспендируют в 20 мл метиленхлорида и прибавляют по каплям при охлаждении льдом 10 мл раствора 1,9 г (24 ммоль) ацетилхлорида в метиленхлориде. Смесь перемешивают до образования однородной реакционной смеси. Затем прибавляют 10 мл раствора 4,5 г (20 ммоль) 5-хлор-4,4,8-триметилтиохромана в метиленхлориде и смесь оставляют взаимодействовать при комнатной температуре в течение 1 часа. После взаимодействия реакционную смесь выливают в ледяную воду и экстрагируют метиленхлоридом. Органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Метиленхлорид отгоняют при пониженном давлении и полученное маслянистое вещество очищают хроматографией на колонке с силикагелем с получением 3,0 г (выход 56%) 6-ацетил-4-хлор-4,4,8-триметилтиохромана.
Стадия (2)
Уксусную кислоту в количестве 5 мл прибавляют к 3,0 г (11 ммоль) 6-ацетил-5-хлор-4,4,8-триметилтиохромана. Затем прибавляют 3,7 г (33 ммоль) 30% водной перекиси водорода и смесь нагревают при 80oC в течение 2 часов. К реакционной смеси для выделения твердого продукта прибавляют 2% раствор гидросульфита натрия в количестве 20 мл и твердый продукт выделяют фильтрацией с получением 2,8 г (выход 85%) 1,1-диоксида-6-ацетил-5-хлор-4,4,8-триметилтиохромана.
ЯМР (м. д., растворитель: CDCl3, внутренний стандарт: тетраметилсилан): 1,67 (6H, с), 2,30-2,50 (2H, м), 2,56 (3H, с), 2,76 (3H, с), 3,30-3,50 (2H, м), 7,05 (H, с)
Стадия (3)
3,6 Грамма (85 ммоль) гидроксида натрия растворяют в 70 мл воды, прибавляют при охлаждении льдом 1,5 мл (29 ммоль) брома. Затем прибавляют 2,8 г (9,3 ммоль) 1,1-диоксида-6-ацетил-5-хлор-4,4,8-триметилтиохромана и смесь перемешивают в течение 3 часов и затем нагревают при 100oC в течение 5 часов. После взаимодействия прибавляют этилацетат и смесь подвергают жидкостному разделению. К водному слою прибавляют соляную кислоту до установления pH 1. Водный слой экстрагируют прибавлением этилацетата и органический слой высушивают над безводным сульфатом натрия. Этилацетат отгоняют при пониженном давлении с получением 2,1 г (выход 75%) 1,1-диоксида-5-хлор-4,4,8-триметилтиохроман-6-карбоновой кислоты.
ЯМР (м. д. , растворитель: дейтерированный ацетон, внутренний стандарт: тетраметилсилан): 1,70 (6H, с), 2,30-2,50 (2H, м), 2,75 (3H, с), 3,40-3,60 (2H, м), 7,50 (H, с)
Далее описаны препаративные примеры получения нового производного пиразола, являющегося первым объектом настоящего изобретения.
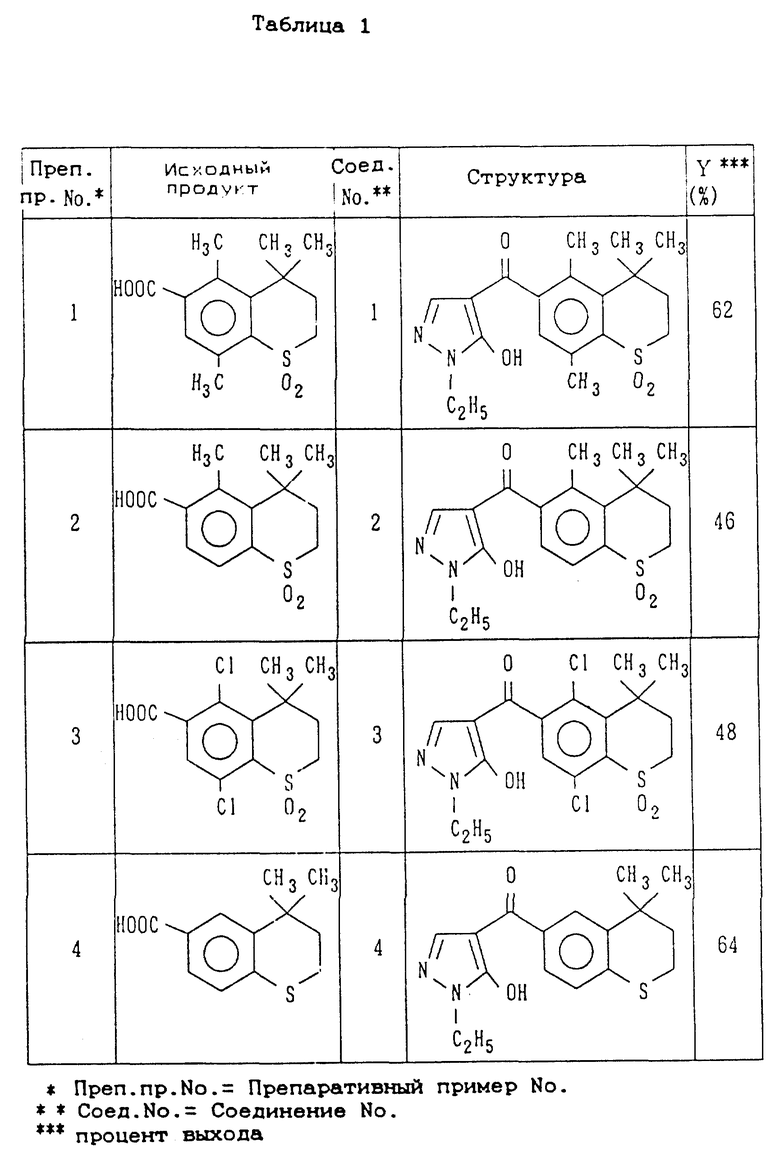
Препаративный пример 1
7,4 Грамма (0,026 моль) 1,1-диоксида-4,4,5,8-тетраметилтиохроман-6-карбоновой кислоты, полученной по примеру промежуточного получения 1, 3,4 г (0,03 моль) 1-этил-5-гидроксипиразола и 6,22 г (0,03 моль) ДЦК (N,N'-дициклокарбодиимида) прибавляют за один раз к 50 мл трет-амилового спирта и смесь перемешивают при комнатной температуре в течение 30 минут. Затем прибавляют 1,8 г (0,013 моль) безводного карбоната калия. Реакционную смесь оставляют взаимодействовать при 80oC в течение 8 часов и затем отгоняют реакционный растворитель при пониженном давлении. Полученный остаток диспергируют в 5% водном растворе карбоната калия и этилацетата для разделения его на два слоя. Далее устанавливают pH водного слоя 5% соляной кислотой, равным 1, для образования твердого осадка и твердый осадок удаляют фильтрацией с получением 6,13 г (выход 62%) 1,1-диоксида-4,4,5,8-тетраметил-6-(1-этил-5-гидроксипиразол-4-ил) карбонил)-тиохромана.
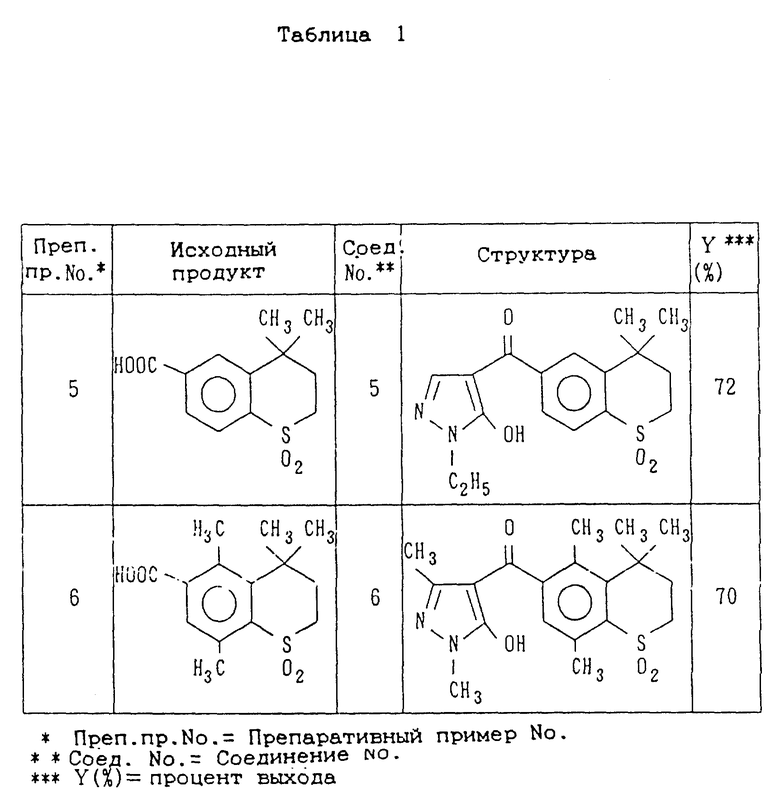
Препаративные примеры 2-5
Соединения, показанные в правой колонке таблице 1, были получены тем же способом, что и по препаративному примеру 1, за исключением того, что вместо 1,1-диоксида-4,4,5,8-тетраметилтиохроман-6-карбоновой кислоты используют неочищенные продукты, представленные в левой колонке табл. 1 (см. в конце описания).
Препаративный пример 6
1,1-диоксида-4,4,5,8-тетраметил-6-(1,3-диметил-5- гидроксипиразол-4-ил)карбонилтиохроман в количестве 0,46 г (выход 70%) был получен тем же способом, что и по препаративному примеру 1, за исключением того, что вместо 1-этил-5-гидроксипиразола используют 1,3-диметил-5-гидроксипиразол.
В таблице 1 представлены неочищенные продукты, используемые по препаративным примерам 1-6, структурные формулы и выходы соединений, полученных в препаративных примерах 1-6. В таблице 2 представлены их физические свойства (см. в конце описания).
Препаративный пример 7
0,7 Грамма (1,9 ммоль) 1,1-диоксида-4,4,5,8-тетраметилтиохроман-6-(1-этил-5-гидроксипиразол- 4-ил)карбонилтиохроман, полученной по препаративному примеру 1, растворяют в 8 мл метиленхлорида. Затем прибавляют раствор 0,51 г (3,8 ммоль) карбоната калия в 5 мл воды и затем 0,43 г (3,8 ммоль) метансульфонилхлорида и 0,05 г (0,2 ммоль) бензилтриэтиламмонийхлорида. Смесь оставляют взаимодействовать при комнатной температуре в течение 2 часов и затем нагревают с обратным холодильником в течение 2 часов. Затем реакционной смеси дают остыть, отделяют метиленхлоридный слой и сушат над безводным сульфатом натрия. Растворитель отгоняют при пониженном давлении и полученное маслянистое вещество очищают хроматографией на колонке с силикагелем с получением 0,41 г (выход 49%) 4,4,5,8-тетраметил-6-(1-этил-5-метансульфонилоксипиразол-4-ил) карбонилтиохроман-1,1-диоксида (соединение 7).
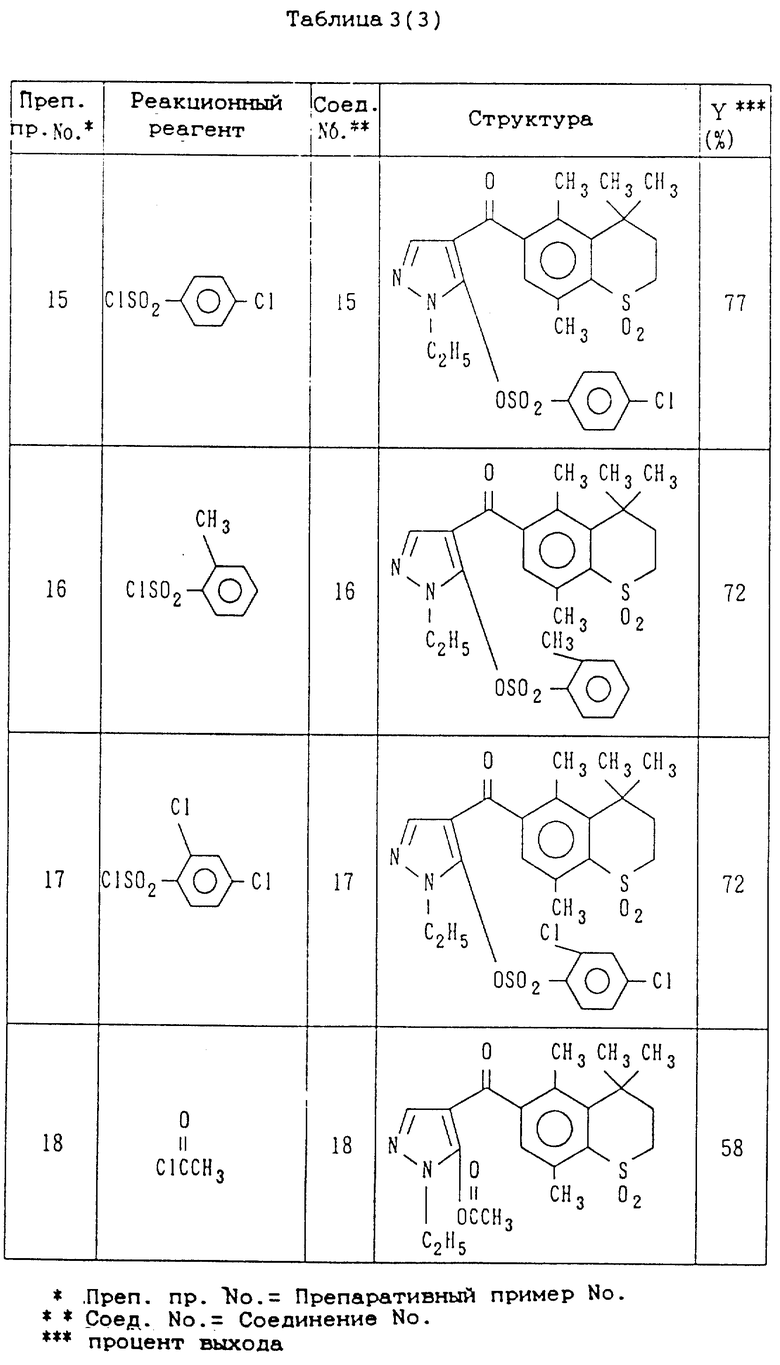
Препаративные примеры 8-17
Соединения, показанные в правой колонке таблицы 3, были получены тем же способом, что и по препаративному примеру 7, за исключением того, что вместо метансульфонилхлорида используют реакционные реагенты, представленные в левой колонке табл. 3 (см. в конце описания).
Препаративный пример 18
0,5 Грамма (1,3 ммоль) 4,4,5,8-тетраметил-6-(1-этил-5- гидроксипиразол-4-ил)карбонилтиохроман-1,1-диоксида, полученного по препаративному примеру 1, растворяют в 10 мл метиленхлорида и прибавляют 0,27 г (2,6 ммоль) триэтиламина и 0,21 г (2,6 ммоль) ацетилхлорида. Смесь оставляют взаимодействовать при комнатной температуре в течение 8 часов. Затем к реакционной смеси прибавляют воду и метиленхлоридный слой отделяют и высушивают над безводным сульфатом натрия. Растворитель отгоняют при пониженном давлении и полученное маслянистое вещество очищают хроматографией на колонке с силикагелем с получением 0,32 г (выход 58%) 4,4,5,8-тетраметил-6-(1-этил-5-ацетоксипиразол-4- ил)карбонилтиохроман-1,1-диоксида (соединение 18).
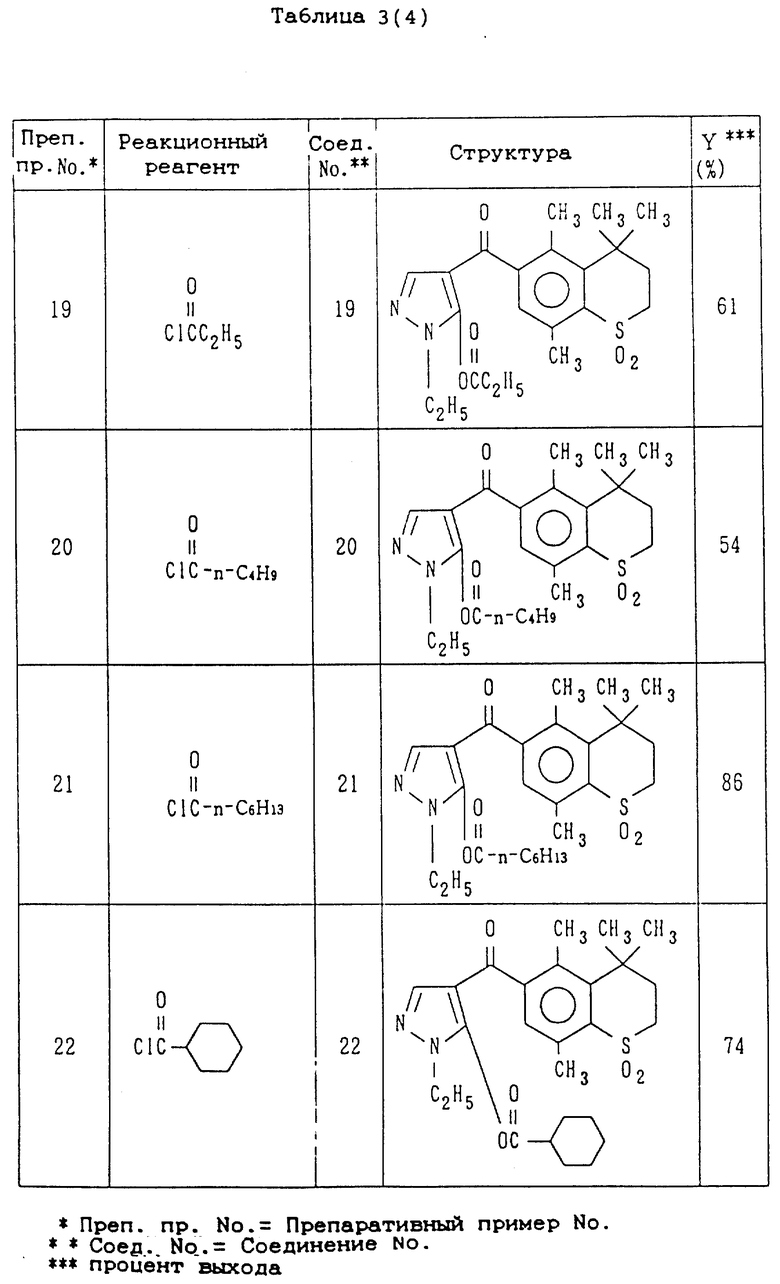
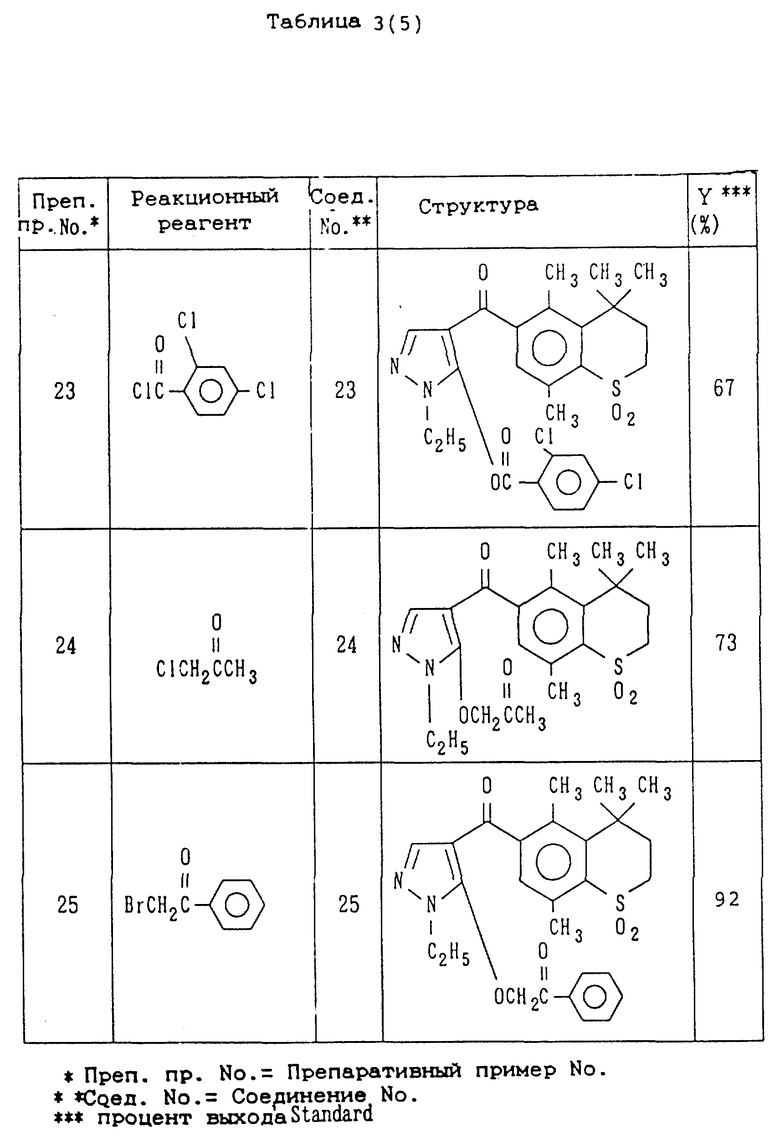
Препаративные примеры 19-23
Соединения 19-23, показанные в правой колонке таблицы 3, были получены тем же способом, что и по препаративному примеру 18, за исключением того, что вместо ацетилхлорида используют реакционные реагенты, представленные в левой колонке таблицы 3.
Препаративный пример 24
0,5 Грамма (1,3 ммоль) 1,1-диоксид-4,4,5,8-тетраметил-6-(1-этил-5-гидроксипиразол-4- ил)карбонилтиохромана, полученного по препаративному примеру 1, растворяют в 10 мл метилэтилкетона и прибавляют 0,14 г (1,4 ммоль) хлорацетона и 0,37 г (2,6 ммоль) карбоната калия. Смесь нагревают с обратным холодильником в течение 4 часов. Растворитель отгоняют при пониженном давлении и к оставшемуся осадку прибавляют этилацетат. Остаток промывают насыщенным водным раствором бикарбоната натрия. Органический слой сушат над безводным сульфатом натрия и затем растворитель отгоняют при пониженном давлении. Полученное маслянистое вещество очищают хроматографией на колонке с силикагелем с получением 0,42 г (выход 73%) соединения 24.
Препаративный пример 25
Соединение 25 в количестве 0,61 г (выход 92%) получают тем же способом, что и по препаративному примеру 24, за исключением того, что вместо хлорацетона используют фенацилбромид.
В таблице 3 представлены структуры и выходы соединений 7-25, полученные по препаративным примерам 7-25. В табл. 4 представлены их физические свойствам (см. в конце описания).
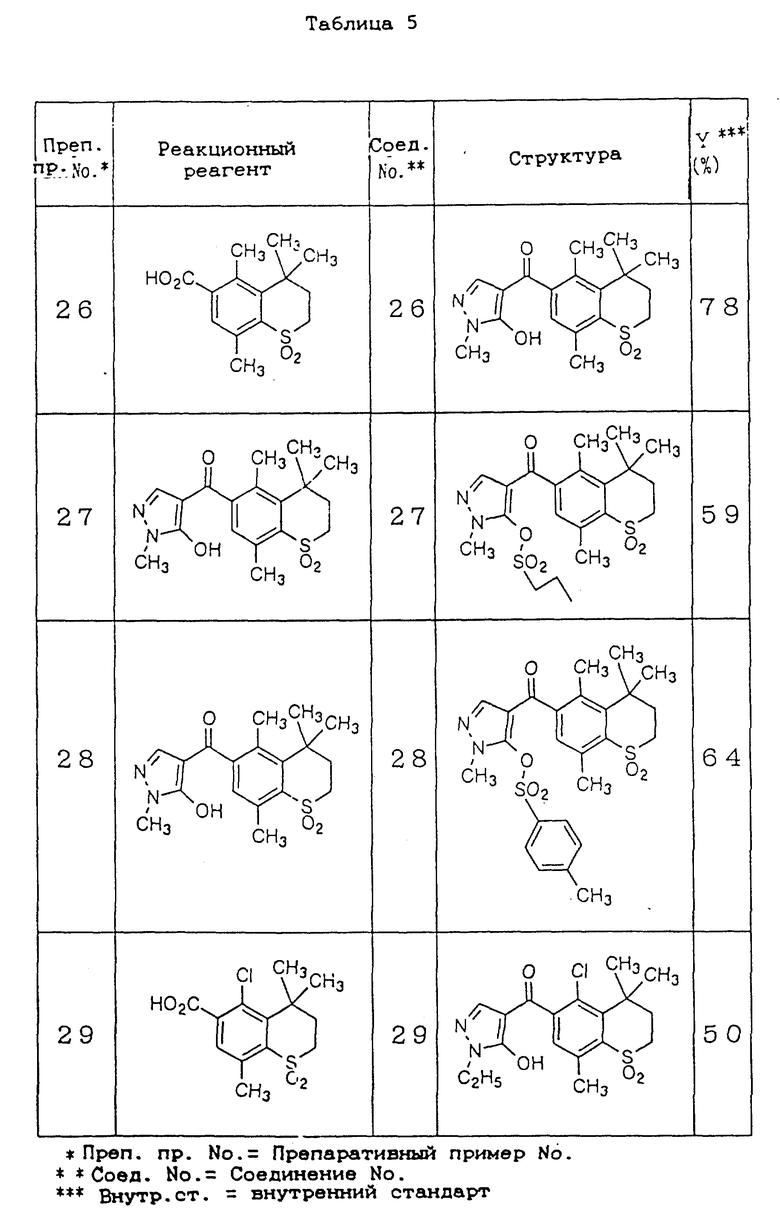
Препаративный пример 26
4,4,5,8-Тетраметил-6-(1-метил-5-гидроксипиразол-4-ил)карбонилтиохроман- 1,1-диоксид (соединение 26) в количестве 1,7 г (выход 78%) получают тем же способом, что и по препаративному примеру 1, за исключением того, что вместо 1-этил-5-гидроксипиразола используют 1-метил-5-гидроксипиразол.
Препаративный пример 27
0,80 Грамма (2,2 ммоль) 4,4,5,8-тетраметил-6-(1-метил-5-гидроксипиразол-4- ил)карбонилтиохроман-1,1-диоксида (соединение 26), полученного по препаративному примеру 26, растворяют в 20 мл метиленхлорида. Затем прибавляют раствор 0,40 г (2,9 ммоль) карбоната калия в 10 мл воды и затем 0,43 г (3,8 ммоль) н-пропансульфонилхлорида и 0,05 г (0,2 ммоль) бензилтриэтиламмонийхлорида. Смесь оставляют взаимодействовать при комнатной температуре в течение 24 часов. После взаимодействия отделяют метиленхлоридный слой и сушат над безводным сульфатом натрия. Затем растворитель отгоняют при пониженном давлении и полученное маслянистое вещество очищают хроматографией на колонке с силикагелем с получением 0,60 г (выход 59%) 4,4,5,8-тетраметил-6-(1-метил-5-н-пропансульфонилоксипиразол-4-ил) карбонилтиохроман-1,1 -диоксида (соединение 27).
Препаративный пример 28
4,4,5,8-Тетраметил-6-(1-метил-5-п-толуолсульфонилоксипиразол-4-ил) карбонилтиохроман-1,1-диоксид (соединение 28) в количестве 0,68 г (выход 64%) получают тем же способом, что и по препаративному примеру 27, за исключением того, что вместо п-пропансульфонилхлорида используют п-толуолсульфонилхлорид.
Препаративный пример 29
5-Хлор-4,4,8-триметил-6-(1-этил-5-гидроксипиразол-4- ил)карбонилтиохроман-1,1-диоксид в количестве 0,52 г (выход 50%) получают тем же способом, что и по препаративному примеру 1, за исключением того, что вместо 1,1-диоксид-4,4,5,8-тетраметилтиохроман-6-карбоновой кислоты используют 1,1-диоксид-5-хлор-4,4,8-триметилтиохроман-6-карбоновой кислоты.
В табл. 5 представлены структуры и выходы соединений 26 - 29, полученные по препаративным примерам 26 - 29 и их свойства (см. в конце описания).
Препаративный пример 30.
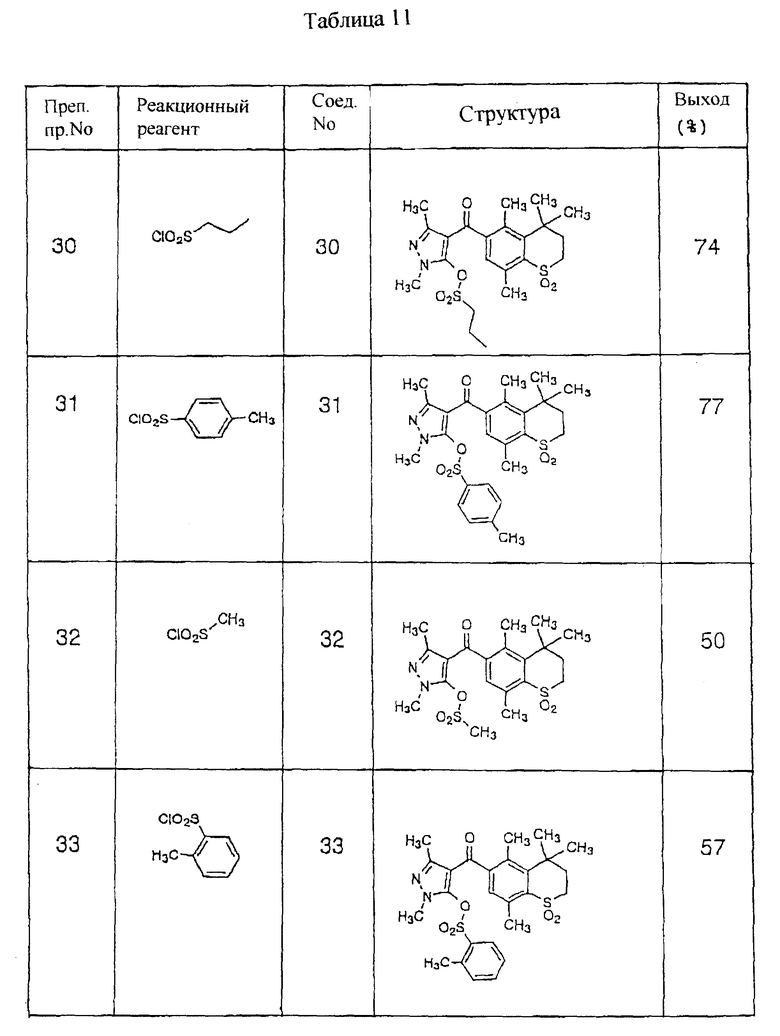
2,7 Грамма (7,1 ммоль) 4,4,5,8-тетраметил-6-(1,3-диметил-5-гидроксипиразол-4-ил) карбонилтиохроман-1,1-диоксида, полученного по препаративному примеру 6, растворяют в 20 мл метиленхлорида и добавляют раствор 1,5 г карбоната калия в 20 мл метиленхлорида. Далее 0,76 г (10,5 ммоль) н-пропансульфонилхлорида растворяют в 10 мл метиленхлорида и добавляют полученный раствор. Затем добавляли 50 мг хлорида бензилтриэтиламмония. Смесь оставляют взаимодействовать при комнатной температуре на 7 часов, а затем отделяют слой метиленхлорида. Слой метиленхлорида сушат над сульфатом натрия и затем при пониженном давлении отгоняли растворитель. Конечное маслянистое вещество промывают смесью растворителей этилацетат/н-гексан (1:2 о/о) с образованием твердого вещества, смесь отфильтровывают, получая 1,26 г (выход 74%) 4,4,5,8-тетраметил-6-(1,3-диметил-5-н-пропансульфонилоксипиразол-4-ил) карбонилтиохроман-1,1-диоксида
(Соединение N 30).
Препаративные примеры 31-33
Соединения 31, 32 и 33, приведенные в правой колонке табл. 7 (см. в конце описания), получают тем же способом, что и по препаративному примеру 30, за исключением того, что вместо н-пропансульфонилхлорида, использованного в препаративном примере 30, применяют реагенты, приведенные в левой колонке табл. 11 (см. в конце описания).
В табл. 11 представлены реагенты, использованные в препаративных примерах 30 - 33 и структурные формулы и выходы соединений, полученных в препаративных примерах 30 - 33. В табл. 12 представлены физические свойства соединений (см. в конце описания).
(6) Биологические испытания (испытание обработки пастбищно-выпасной почвы, гербицидные примеры 27-29 и сравнительный пример 10).
Семена сорняков, таких как большое африканское просо, куриное просо, щетинник зеленый, дурнишник, лимнохарис и щирица тонкая, и семена кукурузы, пшеницы и ячменя высеивали в Вагнеровские горшки 1/5,000-ар, наполненные выпасной почвой, и накрывали выпасной почвой. Затем предварительно определенное количество гербицида, полученного в (1) выше, суспендировали в воде и равномерно разбрызгивали на поверхность почвы. После этого растения выращивали в теплице и на 20-й день после обработки гербицид оценивали на гербицидную активность. Результаты представлены в табл. 13 (см. в конце описания).
Доза каждого гербицида указана как количество активного ингредиента на гектар. Кроме того, измеряли массу после высушивания на воздухе и гербицидное действие и фитотоксичность для кукурузы представлены на основе баллов, описанных ниже.
Гербицидное действие (баллы) и отношение веса оставшейся растительности/необработанной (%), соответственно:
0 - 81 - 100
1 - 61 - 80
2 - 41 - 60
3 - 21 - 40
4 - 1 - 20
5 - 0
Фитотоксичность для зерновых (баллы) и отношение веса оставшейся растительности/необработанной (%), соответственно:
0 - 100
1 - 95 - 99
2 - 90 - 94
3 - 80 - 89
4 - 0 - 79
Далее будут описаны примеры гербицидов, являющиеся вторым объектом изобретения.
Примеры гербицидов
(1) Получение гербицида
97 Частей по весу талька (торговая марка: Zeaklite) в качестве носителя, 1,5 частей по весу алкиларилсульфоновой кислоты (торговая марка: Neoplex, поставляемый фирмой Kao-Atlas К.К.) в качестве поверхностно-активного вещества и 1,5 частей по весу неионного и анионного поверхностно-активного вещества (торговая марка: Sorpol 800A, поставляемый фирмой Toho Chemical Co., Ltd. ) растирают в однородный порошок и смешивают с получением носителя для смачивающегося порошка.
90 Частей по весу вышеуказанного носителя и 10 частей по весу одного соединения, выбранного из соединений по настоящему изобретению, полученного по вышеприведенным препаративным примерам, растирают в однородный порошок и смешивают с получением гербицида. Гербициды для сравнения получают из следующих соединений x, y, A, B и C в количестве 10 частей по весу каждого тем же способом, что указан выше.
Соединение (x): Коммерчески доступный гербицид пиразолат
Соединение (y): Соединение, описанное в JP-A-63-122672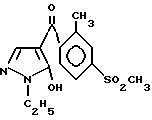
Соединение (A): Соединение N 35, описанное в JP-A-2-173
Соединение (B): Соединение N 66, описанное в международной публикации N WO93/18031
Соединение (C): Соединение N b-3, описанное в Японской патентной заявке N 4-185526
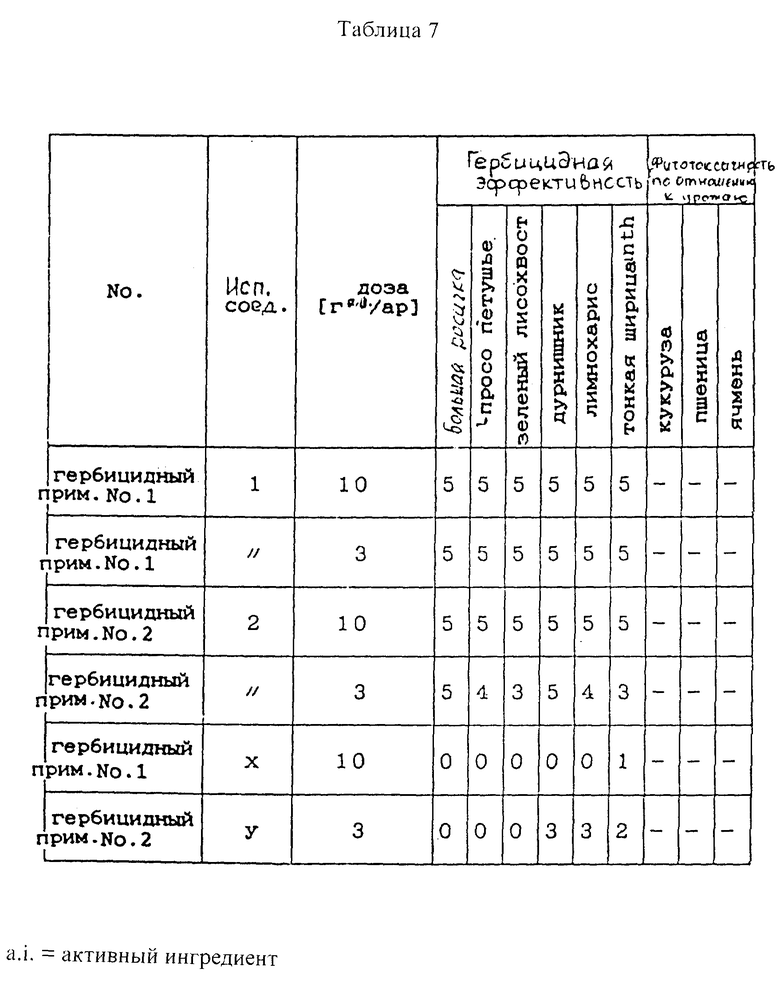
(2) Биологическое исследование (исследование по обработке листвы, гербицидные примеры 1 и 2 и сравнительные примеры 1 и 2)
Семена сорняков, таких как crabgrass, просо петушье, лисохвост, зеленый дурнишник, лимнохарис и тонкая щирица, и семена кукурузы, пшеницы и ячменя высевают в 1/5000 аре горшки Вагнера, наполненные суходольной почвой, и присыпают суходольной почвой. Затем семена проращивают в теплице и когда они вырастают до стадии одного или двух листков, определенное количество гербицида, полученного выше (1), суспендируют в воде и равномерно распыляют на лиственные участки при норме расхода 200 литров/10 ар. После этого растения выращивают в теплице, и спустя 20 дней после обрызгивания гербицид исследуют на гербицидное действие. В таблице 7 показаны результаты (см. в конце описания).
Гербицидное действие и фитотоксичность по отношению к урожаю показана на основе следующих баллов.
Отношение веса оставшейся растительности/необработанной было рассчитано путем (вес оставшейся растительности на обработанном участке/вес оставшейся растительности на необработанном участке) • 100.
Гербицидное действие (баллы) и отношение веса оставшейся растительности/необработанной (%), соответственно:
0 - 81 - 100
1 - 61 - 80
2 - 41 - 60
3 - 21 - 40
4 - 1 - 20
5 - 0
Фитотоксичность (баллы) и отношение веса оставшейся растительности/необработанной (%), соответственно:
- - 100
± - 95 - 99
+ - 90 - 94
++ - 80 - 89
+++ - 0 - 79
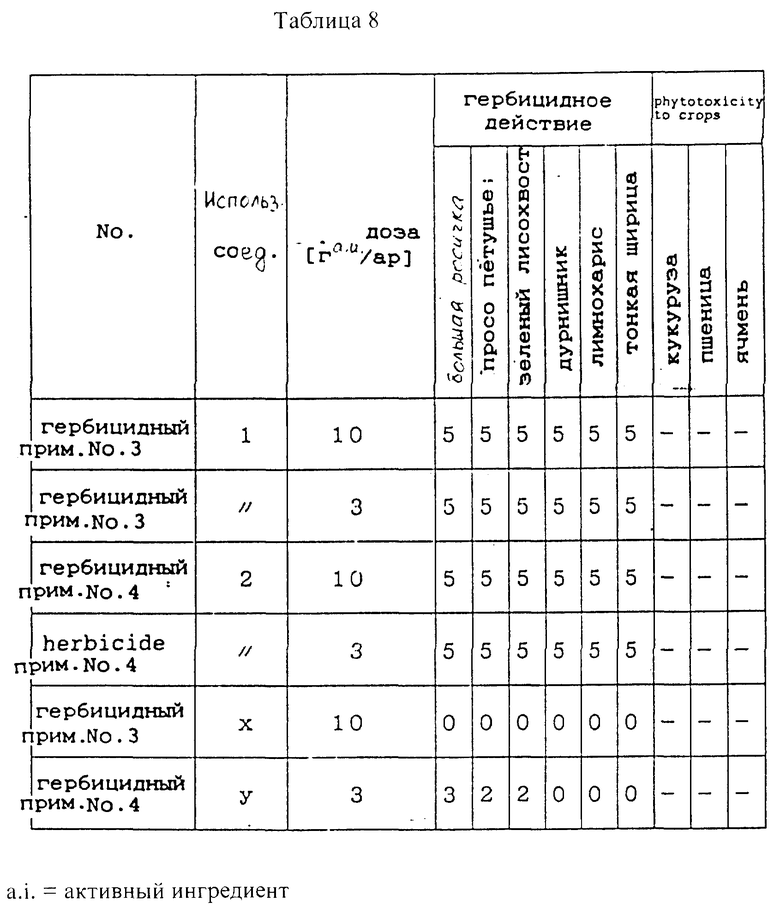
(3) Биологическое исследование (исследование по обработке суходольной почвы, гербицидные примеры 3 и 4 и сравнительные гербицидные примеры 3 и 4)
Семена сорняков, таких как большая росичка, просо петушье, зеленый лисохвост, дурнишник, лимнохарис и тонкая щирица, и семена кукурузы, пшеницы и ячменя высевают в 1/5000 ар горшки Вагнера, наполненные суходольной почвой, и присыпают суходольной почвой. Затем определенное количество гербицида, полученного выше (1), суспендируют и равномерно распыляют на поверхность почвы. После этого семена проращивают в теплице, и спустя 20 дней после обрызгивания гербицид исследуют на гербицидное действие. В табл. 8 показаны результаты (см. в конце описания).
Гербицидное действие и фитотоксичность по отношению к урожаю выражена в соответствии с балльной системой, данной в (2) исследовании по обработке листвы.
(4) Биологическое исследование (исследование по обработке заливной почвы, гербицидные примеры 5-9, сравнительные примеры 5-8 и ссылочные примеры 1 и 2)
1/15500-аре фарфоровый горшочек был наполнен почвой с поля падди, в поверхностный слой почвы высеяли семена проса петушьего и сыти длинной и трансплантруют рис-падди на стадии двух листков. Затем разбавленный раствор определенного количества гербицида, полученного выше (1), равномерно наносят на поверхность воды во время начала роста сорняков, и затем горшочек оставляют в теплице в то время как по существу распыляют воду. Спустя двадцать дней после обработки раствором гербицида исследуют гербицидное действие и фитотоксичность по отношению к рису-падди, и в табл. 9 (см. в конце описания) показаны результаты. Дозировка гербицида представлена в виде количества эффективного ингредиента на 10 ар. Затем определяют высушенные на воздухе веса и гербицидное действие показано далее.
Гербицидное действие (баллы) и отношение веса оставшейся растительности/необработанной (%), соответственно:
0 - 81 - 100
1 - 61 - 80
2 - 41 - 60
3 - 21 - 40
4 - 1 - 20
5 - 0
Фитотоксичность по отношению к рису-падди (баллы) и отношение веса оставшейся растительности/необработанной (%), соответственно:
0 - 100
1 - 95 - 99
2 - 90 - 94
3 - 80 - 89
4 - 0 - 79
(5) Биологическое исследование (исследование по обработке суходольной почвы, гербицидные примеры 10-26 и сравнительный пример 9)
Семена сорняков, таких как большая росичка, просо петушье, зеленый лисохвост, дурнишник, лимнохарис и тонкая щирица, и семена кукурузы, пшеницы и ячменя высевают в 1/5000 ар горшки Вагнера, наполненные суходольной почвой, и присыпают суходольной почвой. Затем определенное количество гербицида, полученного выше (1), суспендируют в воде и равномерно распыляют на поверхность почвы. После этого семена проращивают в теплице, и спустя 20 дней после обрызгивания гербицид исследуют на гербицидное действие и фитотоксичность по отношению к кукурузе. В табл. 10 показаны результаты (см. в конце описания).
Дозировка гербицида представлена в виде количества эффективного ингредиента на гектар. Затем определяют высушенные на воздухе веса и гербицидное действие и фитотоксичность по отношению к кукурузе показано далее.
Гербицидное действие (баллы) и отношение веса оставшейся растительности/необработанной (%), соответственно:
0 - 81 - 100
1 - 61 - 80
2 - 41 - 60
3 - 21 - 40
4 - 1 - 20
5 - 0
Фитотоксичность по отношению к кукурузе (баллы) и отношение веса оставшейся растительности/необработанной (%), соответственно:
0 - 100
1 - 95 - 99
2 - 90 - 94
3 - 80 - 89
4 - 0 - 79э
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ПИРАЗОЛА И СОДЕРЖАЩИЕ ИХ ГЕРБИЦИДЫ | 1994 |
|
RU2154063C2 |
| ПИРИДАЗИНОНОВОЕ ПРОИЗВОДНОЕ И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ ГЕРБИЦИДА | 2007 |
|
RU2440990C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИСТИРОЛА И КАТАЛИТИЧЕСКАЯ СИСТЕМА ДЛЯ ЕГО ПОЛУЧЕНИЯ | 1988 |
|
RU2086563C1 |
| ПРОИЗВОДНЫЕ СУЛЬФАМИДОСУЛЬФОНИЛМОЧЕВИНЫ И СЕЛЕКТИВНАЯ ГЕРБЕЦИДНАЯ КОМПОЗИЦИЯ | 1990 |
|
RU2088583C1 |
| ПРОИЗВОДНЫЕ N-ГЕТЕРОАРИЛНИКОТИНАМИДА, ИНСЕКТИЦИД И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2002 |
|
RU2294329C2 |
| ОГНЕСТОЙКАЯ ПОЛИМЕРНАЯ КОМПОЗИЦИЯ | 1989 |
|
RU2041240C1 |
| ПРОИЗВОДНЫЕ 3-ГАЛОГЕН-3-ГЕТАРИЛКАРБОНОВОЙ КИСЛОТЫ, ГЕРБИЦИДНОЕ СРЕДСТВО | 1994 |
|
RU2146255C1 |
| ПРОИЗВОДНОЕ БЕНЗОЛА, ЗАМЕЩЕННОЕ ГЕТЕРОЦИКЛОМ, И ГЕРБИЦИД | 1997 |
|
RU2162849C2 |
| ПИРРОЛОПИРИДИНЫ ИЛИ ИХ СЕЛЬСКОХОЗЯЙСТВЕННО-ПРИЕМЛЕМЫЕ СОЛИ, ГЕРБИЦИДНАЯ КОМПОЗИЦИЯ И СПОСОБ ПОДАВЛЕНИЯ НЕЖЕЛАТЕЛЬНОЙ РАСТИТЕЛЬНОСТИ | 1994 |
|
RU2135497C1 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ПИРАЗИНА И ГЕРБИЦИДНОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 1995 |
|
RU2155756C2 |








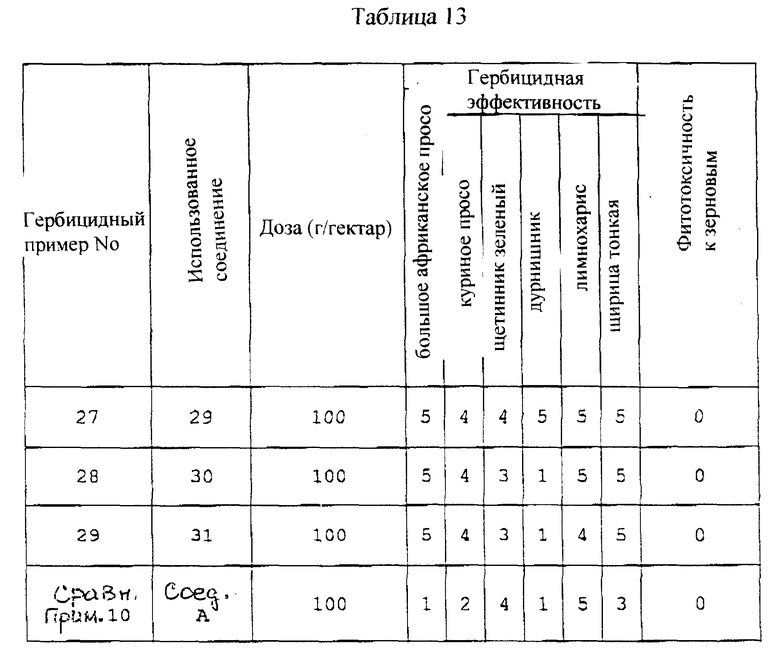
Производные пиразола формулы 1, где R1 - водород или C1-C4-алкил; R2 - С1-C4-алкил; Х1, Х4 - водород, галоген или С1-C4-алкил; каждый из Х2 и Х3 - C1-C4-алкил; Q - водород или группа формулы А-В, А - -SO2-, -СО- или -СН2СО-, В -С1-C8-aлкил, С3-C8-циклоалкил или группа формулы (а), Y - галоген, нитро, алкил или алкокси, m = 0, 1 или 2, n = 0 или 2, или их соли обладают высокой гербицидной активностью, не проявляя фитотоксичность по отношению к кукурузе и рису-падди. 3 с. и 8 з.п. ф-лы, 13 табл.
где R1 обозначает водород или С1-С4-алкильную группу;
R2 обозначает С1-С4-алкильную группу;
Х1 обозначает атом водорода, галогена или С1-С4-алкильную группу;
Х2 и Х3 каждый обозначает независимо С1-С4-алкильную группу;
Х4 обозначает атом водорода, атом галогена или С1-С4-алкильную группу;
Q обозначает атом водорода или группу формулы А-В, в которой А обозначает -SO2-, -СО- или -СН2СО- и В обозначает С1-С8-алкильную группу, С3-С8-циклоалкильную группу или группу формулы V
в которой Y обозначает атом галогена, нитрогруппу, С1-С4-алкильную группу, С1-С4-алкоксигруппу;
m = целое число 0, 1 или 2;
n = 0 или 2,
или их соли.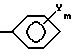
в которой Y обозначает атом галогена, нитрогруппу, С1-С4-алкильную группу или С1-С4-алкоксигруппу,
m = 1 или 2.
в которой Y обозначает атом галогена; m = 0, 1 или 2.
где Х1 обозначает С1-С4-алкильную группу или атом галогена;
Х2 и Х3 каждый обозначает независимо С1-С4-алкильную группу;
Х4 обозначает атом водорода, или С1-С4-алкильную группу, или атом галогена;
n = 0 или 2,
или их соли.
Приоритет по пунктам:
02.08.93 по пп.1, 9 и 10;
11.04.94 по пп.2-8 (уточнение признаков).
| СПОСОБ ИЗВЛЕЧЕНИЯ ЛЕГКОПЛАВКИХ СПЛАВОВ ИЗ ОТХОДОВ | 0 |
|
SU350846A1 |
| ЦИФРОВОЙ ИЗМЕРИТЕЛЬ ШИРИНЫ ДВИЖУЩИХСЯ МАТЕРИАЛОВ | 0 |
|
SU405021A1 |
| Способ получения производного 1-гетероциклил-1Н-имидазол-5-карбоновой кислоты, его соли или стереохимически изомерной формы | 1987 |
|
SU1570648A3 |
Авторы
Даты
1999-07-27—Публикация
1994-08-01—Подача