Изобретение относится к новым диаминовым солям клавулановой кислоты, к содержащим их фармацевтическим композициям, и к применению этих солей для получения клавулановой кислоты и ее солей и сложных эфиров.
Известна /патент Великобритании N 1508977/клавулановая кислота формулы /I/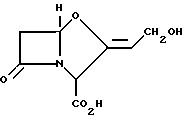
и ее фармацевтически приемлемые соли и сложные эфиры, которые являются антибактериальными агентами, способными повысить эффективность пенициллинов и цефалоспоринов против многих β- лактамазу продуцирующих бактерий.
В патенте США 4650795 раскрыта группа солей первичных аминов клавулановой кислоты, которые дают стабильные фармацевтические композиции.
Из патента EP 26044 известно применение трет-бутиламиновой соли в качестве подходящего промежуточного соединения при получении клавулановой кислоты.
Не опубликованная предварительно EP патентная заявка 562583 раскрывает такое же использование N,N-диизопропилэтилендиаммоний-диклавуланата и N,N-диэтилэтилендиаммоний-диклавуланата, причем оба вторичного, вторичного типа.
Задачей настоящего изобретения являются новые диаминовые соли клавулановой кислоты, которые могут быть использованы в качестве промежуточных соединений при получении клавулановой кислоты и которые позволяют упростить способ ее получения и использовать в фармацеи.
Поставленная задача решается новыми третичными диаминовыми солями клавулановой кислоты, которые обладают улучшенными характеристиками по сравнению с трет-бутиламиновой солью клавулановой кислоты, указанной ранее. Так, например, крупные кристаллы моносоли N,N,N',N'-тетраметил-1,2-диаминоэтанклавуланата можно легко осадить в чистой форме. Поэтому эта соль является весьма подходящим промежуточным соединением при получении клавулановой кислоты.
Новые третичные, третичные диаминовые моносоли формулы IIа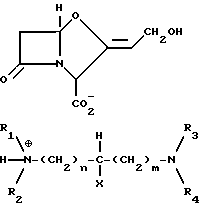
и третичные, третичные диаминовые ди-соли формулы IIb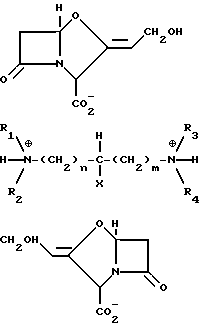
где R1 и R2 каждый представляет (C1-C4) алкильную группу или связанные друг с другом образуют пиперидиногруппу или морфолиногруппу R3 и R4 каждый представляет C1-C4 алкильную группу, или связанные друг с другом образуют пиперидиногруппу; X представляет водород или гидроксигруппу; а m и n каждое независимо равны 0 - 5.
Алкильная группа может быть разветвленной или неразветвленной.
Предпочтительно, чтобы алкильная группа была C1-C4 алкильной группой, например, метилом, этилом, пропилом, изопропилом, бутилом, втор-бутилом, или трет-бутилом и более предпочтительно, метилом.
Предпочтительно, чтобы X был водородом, гидрокси или галоидом, например, бромом или хлором. Наиболее предпочтителен X - водород или гидрокси.
Предпочтительные значения n от 0 до 3, а m - от 0 до 3, более предпочтительно, если X представляет водород или гидрокси. Наиболее предпочтительно, чтобы n=1, m=0, а X водородом, или n=1, m=1, а X гидрокси.
Подходящие инертные заместители включают галоид, гидрокси, C1-C4-алкил, C1-C4-алкокси, C1-C4-ацилокси и C1-C4- этерифицированный карбоксил.
Атом галоида может быть, например, бромом, хлором или фтором, предпочтительно, бромом или хлором.
C1-C4-алкил предпочтительно, является метилом или этилом.
C1-C4-алкокси является, предпочтительно, метоксилом или этоксилом.
C1-C4-ацилокси является, предпочтительно, C1 или C2 ацилоксилом.
C1-C4-этерифицированный карбоксил является предпочтительно, C1 или C2 этерифицированным карбоксилом.
Обычно R1, R2, R3 и R4 имеют три заместителя, или менее, предпочтительно, два заместителя или менее. Наиболее предпочтительно, чтобы R1, R2, R3 и R4 имели по одному заместителю, или вовсе не были бы замещены.
Если R1 и R2 или R3 и R4 связаны друг с другом с образованием кольца, содержащего 4-7 атомов, предпочтительно, чтобы кольцо состояло из атомов углерода и было бы насыщенным. Наиболее предпочтительные R1, R2, R3 и R4 являются метилами.
Обычно амин формулы III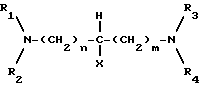 ,
,
из которого можно получить соли формул IIa и IIb, является фармацевтически приемлемым амином.
Предпочтительно соли формул IIa и IIb получать из N,N,N',N'- тетраметил-1,2-диаминоэтана, 1,3-бис(диметиламино)-2-пропанола, N, N,N',N'-тетраметил-1,4-диаминобутана, N,N,N',N'-тетраметил- 1,6-диаминогексана, 1,2-дипиперидиноэтана и дипиперидинометана.
В настоящем изобретении предложен также способ получения соли формулы IIa или IIb, который включает взаимодействия клавулановой кислоты с диамином /III/: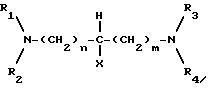
где R1, R2, R3, R4, X, m, и n имеют указанные ранее значения.
Диаминмоноклавуланат образуется в тех случаях, когда количество диамина относительно высоко по сравнению с количеством клавулановой кислоты, а диаминдиклавуланат образуется, когда количество диамина относительно низко по сравнению с количеством клавулановой кислоты или их смеси в промежуточных концентрациях.
Условия образования моно- или диаминовых солей клавулановой кислоты или их смесей могут изменяться в зависимости от используемого диамина.
Концентрацию диамина в реакционной смеси можно изменять, например, меняя pH. При относительно высоких pH /в зависимости от используемых диамина и растворителя/ в растворе будет присутствовать больше монопротонированного диамина IIIa: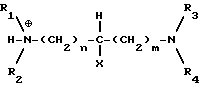
и поэтому будет осаждаться больше моносоли, а при относительно низких pH в растворе будет присутствовать больше дипротонированного диамина IIIb: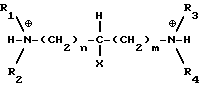
и поэтому будет осаждаться больше дисоли.
Далее настоящее изобретение касается новых диаминовых солей клавулановой кислоты, определенных ранее, в качестве промежуточных соединений при получении клавулановой кислоты и ее фармацевтически приемлемых солей или сложных эфиров.
Предложен также способ получения клавулановой кислоты или ее фармацевтически приемлемых солей или сложных эфиров, который включает превращение диаминовой соли клавулановой кислоты в клавулановую кислоту, путем подкисления, или ее фармацевтически приемлемую соль или сложный эфир, обычно за счет добавления соединения, образующего соответствующую соль или сложный эфир.
Кроме того в настоящем изобретении предложен способ очистки клавулановой кислоты или ее фармацевтически приемлемой соли или сложного эфира, который включает:
i/ контактирование содержащей примеси клавулановой кислоты в органическом растворителе с диамином до образования соли;
ii/ выделение соли, полученной на стадии i/; и
iii/ превращение выделенной соли в клавулановую кислоту путем подкисления, или фармацевтически приемлемую ее соль или сложный эфир, путем добавления соединения, образующего соответствующую соль или сложный эфир. Так, например, клавуланат калия получают добавлением ацетата калия или этилгексаноата калия.
Более удобно получать диаминовые соли клавулановой кислоты в органическом растворителе. Подходящие растворители включают такие негидроксильные растворители, как тетрагидрофуран, диоксан, этилацетат, метилацетат, ацетон, метилэтилкетон и тому подобные растворители или их смеси.
Реакцию можно вести при температурах от около -50oC до 40oC, и более предпочтительно, от около 0oC до 15oC.
В настоящем изобретении предложены также фармацевтические композиции, которые содержат соль формулы IIa и/или IIb и фармацевтически приемлемый носитель.
Подходящие формы композиций настоящего изобретения включают таблетки, капсулы, порошки и стерильные формы, пригодные для инъекций или вливаний. Такие композиции могут содержать такие обычные фармацевтически приемлемые материалы, как разбавители, связующие, красители, вкусовые добавки, консерванты и разрыхлители.
Композиции солей формул IIa и IIb для инъекций и вливаний наиболее подходящи, так как высокие уровни содержания соединения клавулановой кислоты могут находиться в тканях после введения за счет инъекций или вливаний. Поэтому одним из предпочтительных аспектов композиций настоящего изобретения являются соли формул IIa и IIb в стерильной форме.
Композиции в единичных дозах, содержащие соль формулы II, для орального приема, являются предпочтительными.
Приводимые далее примеры иллюстрируют настоящее изобретение. Указанные значения pH основаны на измерениях с электродом Инггольда, тип U402-S7/120 в используемом растворителе.
Пример 1. Сравнение кристаллизации различных диаминовых солей. Раствор клавуланата калия в ледяной воде перемешивают с этилацетатом при охлаждении ледяной водой. С помощью 10% (вес/вес) раствора серной кислоты pH доводят до около 2, водный слой отделяют и дважды экстрагируют этилацетатом. Собранные экстракты сушат над сульфатом магния, фильтруют и промывают этилацетатом, в результате чего получают раствор клавулановой кислоты примерно 2% (вес/вес). Клавулановую кислоту разбавляют равным объемом ацетона, и добавляют диамин.
Полученные результаты представлены в таблице 1. Молярное отношение диамин /клавулановая кислота представлена в последней колонке. Диаминовые соли клавулановой кислоты третичного, третичного типа присутствуют только в предпочтительной кристаллической форме, а не в виде масел.
Пример 2. Получение N,N,N',N'- тетраметил-1,2-диаминоэтан-моноклавуланата из раствора этилацетат/ацетона
Экстракт клавулановой кислоты в сухом этилацетате /828 г, содержащем 18 г клавулановой кислоты на кг, полученный в примере 1/ добавляют за 20 минут к 1 л ацетона, при охлаждении /8oC/ и при поддержании pH 9 за счет N,N,N', N'-тетраметил-1,2-диаминоэтана /ТМЕДА, 19, 18 г молярное отношение 2,2 относительно клавулановой кислоты/. Перемешивание продолжают при 10oC в течение 1 часа. Осадок отфильтровывают и промывают 100 мл ацетона, затем сушат в вакууме при 35oC до получения 20,09 г ТМЕДА -моноклавуланата /крупные кристаллы/. Маточный раствор /1642 г./, содержит около 1,12 г клавулановой кислоты.
ЯМР /ДМСО-d6 - : 2,37 мд, N- CH3 /с, 12H/; 2,70 мд N-CH2 /с, 4H/, 2,95 мд C6 - β H /д, 1H/,; 3,49 мд, C6 - α H /дд, 1H/; 3,99 мд, CH2O /м, 2H/; 4,60 мд, C3 - H /с, 1H/; 4,66 мд; = C-H /т, 1H/; 5,58 мд C5-H /д, 1H/.
К 1 г этого ТМЕДамоноклавуланата добавляют 200 мг смеси этилацетат/ ацетон (1/1 объем/объем), содержащей 1 мл ТМЕДА. После перемешивания в течение 1 часа при комнатной температуре раствор фильтруют, а полученный фильтрат медленно выпаривают, получая крупные кристаллы.
Все параметры получают по методу наименьших квадратов из 20 значений для отражений, измеренных на дифрактометре в следующих условиях эксперимента:
CAD 4 Rf нониус
θ = 30o
Mc - Kα радиация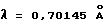
Соль /C14H25N3O5, группы 1 C8H9NO5 и группы 2 C6H16N2; Mb = 315,37/ кристаллизуется в орторомбическую пространственную группу P 212121 при a = 8,268 /1/;
b = 9,929/7/ и c = 20,221 /2/ 
α, β и γ = 90o
R = 0,206 для 2747 отражений
Z = 4
Молекулы связаны сильной водородной связью /2,65/ /1/A/ между N/2/ и O/3/. C/6/-O/2/ и C/6/-O/3/ расстояния составляют 1,20/1 и 1,275 /9aA, соответственно, что указывает на частичный односвязный характер между C/6/ - O/3/. Координаты атомов представлены в таблице II/
Пример 3. Получение N,N,N',N'- тетраметил-1,2-диаминоэтан-моноклавуланата из раствора в этилацетате.
Раствор клавулановой кислоты в этилацетате /75 г, содержащий около 20 г клавулановой кислоты на кг /добавляют за 10 минут к 75 мл этилацетата при 8oC при перемешивании и поддержании pH между 8 и 9 за счет N,N,N',N'-тетраметил-1,2-диаминоэтана/ ТМЕДА, 5, 11 г молярное отношение 8 по отношению к клавулановой кислоте/. Перемешивание продолжают в течение 0,5 часа, и осадок отфильтровывают, промывают этилацетатом и сушат в вакууме при 35oC до получения 2,62 г ТМЕДАмоноклавуланата /крупные кристаллы/. Маточный раствор 155 г содержит 0,03 г клавулановой кислоты ЯМР ДМСО - d6/: 2,38 мл N-CH3 /с, 12H/; 2,70 мд, N-CH2 /с, 4H/; 2,93 мд, C6 - β H /д, 1H/; 3,48 мд C6 α H /дд, 1H/; 3,98 мд CH2OH /м, 2H/; 4,58 мд, C3-H /с, 1H/; 4,65 мд, = C-H /т, 1H/; 6,58 мд /д, 1H/.
Пример 4. Получение N,N,N',N'- тетраметил-1,2-диаминоэтан-ди-клавуланата из раствора этилацетат/ацетона.
Раствор клавулановой кислоты в этилацетате /200 мл, содержащий 1,1 г клавулановой кислоты/ добавляют за 10 минут к 200 мл холодного ацетона /10oC/ при перемешивании, и pH поддерживают между 7,5 и 3 за счет N,N,N', N'-тетраметил-1,2- диаминоэтана /ТМЕДА, 0,64 г при полярном отношении к клавулановой кислоте 1,45/.
Перемешивание продолжают в течение 0,5 часа, осадок отфильтровывают, промывают ацетоном и сушат в вакууме при 35oC до получения 1,24 г ТМЕДА-ди-/клавуланата/ /кристаллы в форме иголок/. В 337 г маточного раствора содержится 0,11 г клавулановой кислоты.
ЯМР /ДМСО-d6/ : 2,45 мд, N-CH3 /с, 12H/; 2,80 мд, N - CH2 /с, 4H/; 2,99 мд / C6- β H /д, 2H/; 3,53 мд C6 - α H /дд, 2H/; 3,99 мд, CH2OH /м, 4H/; 4,69 мд = C-H /т, 2H/; 4,76 мд, C3-H /с, 2H/; 5,61 мд, C 5-H /д, 2H/.
Пример 5.
Получение 1,3-бис/диметиламино/-2-пропанол-моноклавуланата
Раствор клавулановой кислоты в этилацетате /100 г содержащий 20 г клавулановой кислоты на кг /добавляют за 10 минут к 100 мл ацетона при перемешивании при 8oC, поддерживания pH между 8,5 и 8,7 за счет 1,3-бис /диметиламино/-2-пропанола /2,54 г при молярном отношении 1,74 г по отношению к клавулановой кислоте/. Перемешивание продолжают в течение 0,25 часа, осадок отфильтровывают и промывают 50 мл смеси 1/1 ацетона и этилацетат, а затем ацетоном. В результате вакуумной сушки при комнатной температуре получают 1,82 г 1,3 - бис /диметиламино/ 2-пропанолмоноклавуланата степени чистоты 25,6% и в виде свободной кислоты.
ЯМР /ДМСО-d6/ : 2,41 мд, N-CH3 /с, 12H/; 2,50 мд, N - CH2/дАВкв, 4H, J = 12,6 Гц, J = 4,8 Гц/; 2,61 мд, N - CH2/дАВкв, 4H, J = 12,6 Гц, J = 4,8 Гц, 2,94 мд, C6 - β H /д, 1H, J = 16,5 Гц; 3,49 мд, C6 - α H /дд, 1H, J = 16,5 Гц, J = 2,7 Гц/; 3,96 мд CH2OH, CHOH /м, 3H/; 4,58 мд C3-H /C3-H /с, 1H/; 4,64 мд =C-H /т, 1H, J = 6,8 Гц/; 5,57 мд C5-H /д, 1H, J = 2,6 Гц/.
Пример 6
Превращение N,N,N',N'-тетраметил-1,2-диаминоэтанмоноклавуланата в клавуланат калия 30 мл 0,35 M раствора цетата калия /растворитель изопропиловый спирт и вода 1% /вес/объем/ прикапывают к суспензии 2 г N,N,N',N'-тетраметил-1,2-диаминоэтанмоноклавуланата /содержание 68,6%/ в 50 мл изопропанола. Спустя 0,75 часа при перемешивании при комнатной температуре осадок отфильтровывают, промывают 10 мл изопропанола и сушат в вакууме при 35oC, в результате чего получают 1,44 г кристаллического клавуланата калия с содержанием 87% /клавулановой кислоты/ и около 1,5% ацетата калия /ВЭЖХ анализ/. Маточный раствор содержит около 0,06 г клавулановой кислоты.
Пример 7
Превращение N,N,N',N'-тетраметил-1,2-диаминоэтан-диклавуланата в клавуланат калия 4,5 мл 2М растворе 2-этилгексаноата калия в изопропаноле добавляют при перемешивании к раствору 2 г N,N,N',N'-тетраметил-1,2-диаминоэтан-диклавуланата /чистота 75,8% в расчете на свободную кислоту/ в 20 мл изопропанола и 2 мл воды при комнатной температуре. После перемешивания в течение 0,25 часа осадок отфильтровывают и промывают 5 мл изопропанола. После сушки в вакууме при комнатной температуре получают 0,30 г клавуланата калия с чистотой 83,6% в расчете на свободную кислоту.
К маточному раствору добавляют еще 2,5 мл 2М раствор - 2-этилгексаноата калия в изопропаноле, и продолжают перемешивание. Осадок отфильтровывают, промывают 5 мл изопропанола и сушат до получения 0,69 г клавуланата калия с чистотой 82,3% в расчете на свободную кислоту.
Пример 8. Превращение 1,3-бис /диметиламино/-2-пропанол-моноклавуланата в клавуланат калия.
1,6 мл 2 М раствора 2-этилгексаноата калия в изопропаноле добавляют к перемешиваемому раствору 1 г 1,3 - бис /диметиламино/ 2-пропанол-моноклавуланата в 19 мл изопропанола и 1 мл воды при комнатной температуре. После перемешивания в течение 0,25 часа осадок отфильтровывают и промывают 15 мл изопропанола. После сушки в вакууме при комнатной температуре получают 0,38 г клавуланата калия с чистотой 80% в расчете на свободную кислоту.
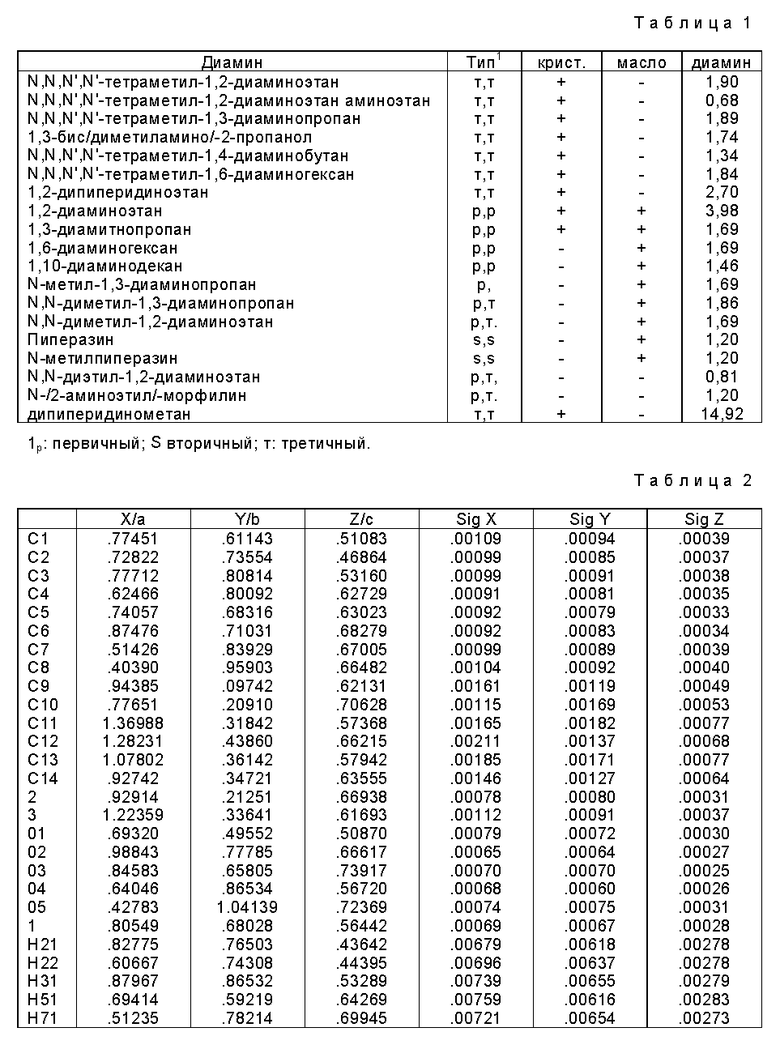
Изобретение относится к новым диаминовым солям клавулановой кислоты формулы (IIa, IIb), где R1 и R2 каждый представляет (С1-C4)алкильную группу или связанные друг с другом образуют пиперидино- или морфолиногруппу, R3 и R4 каждый представляет (С1-C4)алкильную группу или связанные друг с другом образуют пиперидиногруппу, Х представляет собой водород или гидроксигруппу, m и n каждый независимо равен 0-5. Соединение формулы (IIа, IIb) получают взаимодействием клавулановой кислоты с диамином формулы (III) в органическом растворителе. Предложен также способ очистки клавулановой кислоты. Технический результат - упрощение процесса получения ценных продуктов. 4 с. и 8 з.п. ф-лы, 2 табл.
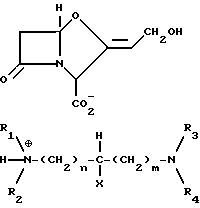
или формулы IIb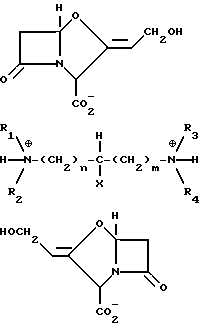
где R1 и R2 каждый представляет (C1-C4)алкильную группу или связанные друг с другом образуют пиперидино- или морфолиногруппу;
R3 и R4 каждый представляет (C1-C4)алкильную группу или связанные друг с другом образуют пиперидиногруппу;
X - водород или гидроксигруппа;
m и n каждый независимо равен 0 - 5.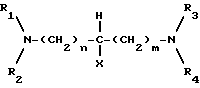
где R1 - R4, X, m и n имеют значения, указанные выше,
в органическом растворителе.
| Способ получения -эфиров 3-тиоэтилиден-7-оксо-4-окса-1-азабицикло (3,2,0) гептан -2-карбоновой кислоты, или ее сложных эфиров, или ее солей | 1977 |
|
SU645583A3 |
| Пропускной строгальный (рейсмассовый) станок | 1931 |
|
SU26044A1 |
Авторы
Даты
1999-08-27—Публикация
1994-03-22—Подача