Настоящее изобретение относится к новому полипептиду, обладающему активностью устойчивой к холоду пируват-ортофосфат дикиназы (которая в дальнейшем обозначается ПФДК), клонированной ДНК, кодирующей этот полипептид, и рекомбинантному вектору, содержащему эту ДНК, с целью получения устойчивых к холоду растений. Настоящее изобретение относится также к растениям, трансформированным с помощью ДНК в соответствии с настоящим изобретением.
Уровень техники.
C4- Растения имеют высокую способность к фотосинтезу в условиях сильного освещения, высокой температуры или низкого уровня CO2. Однако их способность к фотосинтезу сильно понижается при низкой температуре за исключением тех растений, которые адаптировались к условиям низких температур. Хотя ПФДК (ЕС 2.7.9.1. , которая катализирует реакцию, в которой АМФ, фосфоенолпируват и пирофосфат образуются из АТФ, пирувата и ортофосфата) является одним из важных ферментов C4 - пути, ее активность недостаточна в отношении скорости фотосинтеза в ткани листа, так что она является одним из ферментов, которые определяют скорость фиксации CO2 при C4-фотосинтезе. Кроме того, одновременно с открытием этого фермента было обнаружено, что этот фермент является чувствительным к холоду. В случае ПФДК кукурузы активность фермента имеет точку перегиба при 11,7oC. Эта температура совпадает с граничной температурой роста кукурузы. Исходя из этого предполагают, что ПФДК является одной из причин, которые уменьшают скорость фотосинтеза в C4- растениях при низкой температуре. Поэтому с помощью усовершенствования чувствительной к холоду ПФДК может быть понижена граничная температура роста кукурузы. Flaveria brownii, которая является растением, принадлежащим к семейству Compositae, классифицируется как промежуточный C3/C4-тип, и известно, что ее ПФДК значительно не инактивируется при низкотемпературной обработке при 0oC (Burnell JN: А comparative study of the cold-sensitivity of pyruvate. Pi dikinase in Flaveria species.- Plant Cell PhysioL., 31, 295-97 (1990)).
При клонировании гена, кодирующего холодоустойчивую ПФДК Flaveria brownii, и трансформировании растения с этим геном ожидается, что в растение может быть привнесена сопротивляемость холоду.
Раскрытие сущности изобретения
Объектом настоящего изобретения является новый полипептид, обладающий активностью устойчивой к охлаждению ПФДК, клонированная ДНК, кодирующая этот полипептид, и рекомбинантный вектор, содержащий ДНК как средство для сообщения растениям устойчивости к холоду. Другим объектом настоящего изобретения является получение растений, трансформированных с помощью упомянутой выше ДНК в соответствии с настоящим изобретением.
Для успешного осуществления клонирования полного гена ПФДК Flaveria brownii авторы изобретения провели тщательное исследование, в котором определили нуклеотидную последовательность гена и аминокислотную последовательность, которая ею кодируется, идентифицировали область ПФДК-гена, которая сообщает устойчивость к холоду, таким образом завершая настоящее изобретение.
Таким образом, настоящее изобретение обеспечивает получение полипептида, обладающего активностью холодоустойчивой ПФДК, который имеет такую же аминокислотную последовательность, как аминокислотная последовательность 1/6 части всей области последовательности следующих полипептидов (1) и (2) от C-конца, за исключением того, что по крайней мере один аминокислотный остаток из упомянутой 1/6 части области замещается другими аминокислотными остатками:
(1) ПФДК, имеющая аминокислотную последовательность, изображенную на листе последовательностей за NN от 1 до 4,
(2) полипептид, имеющий аминокислотную последовательность, которая имеет гомологию не менее 50% с упомянутой в (1) аминокислотной последовательностью, причем упомянутый полипептид обладает активностью устойчивой к холоду ПФДК.
Настоящее изобретение также обеспечивает получение клонированной ДНК, кодирующей полипептид, обладающий активностью холодоустойчивой ПФДК, в соответствии с настоящим изобретением.
Настоящее изобретение также обеспечивает получение рекомбинантного вектора, содержащего ДНК в соответствии с настоящим изобретением, который может экспрессировать в клетке-хозяине полипептид, обладающий активностью устойчивой к холоду ПФДК. Кроме того, настоящее изобретение обеспечивает получение растения, которое трансформируется с помощью ДНК в соответствии с настоящим изобретением.
С помощью настоящего изобретения был клонирован ген, кодирующий ПФДК, имеющую устойчивость к холоду, и была определена его последовательность. Далее была идентифицирована область гена, которая обеспечивает устойчивость к холоду. Затем путем трансформирования растения, имеющего чувствительную к холоду ПФДК, с помощью гена в соответствии с настоящим изобретением чувствительная к холоду ПФДК может быть заменена на устойчивую к нему ПФДК. Далее путем включения упомянутой выше области, придающей устойчивость к холоду, в соответствующую область чувствительной к холоду ПФДК, чувствительная к холоду ПФДК может быть заменена на холодоустойчивую ПФДК. Благодаря этому можно культивировать растения в районах с холодным климатом, в которых до сих пор растения выращивать было невозможно. Вследствие этого ожидается, что настоящее изобретение внесет большой вклад в сельское хозяйство.
Краткое описание чертежей
Фиг 1. На чертеже схематически изображен метод конструирования вектора экспрессии, содержащего пример гена ПФДК в соответствии с настоящим изобретением;
фиг 2. На чертеже показано изменение активности фермента со временем, когда ПФДК Flaveria brownii, Flaveria bidentis и кукурузы, которые были экспрессированы в Escherichia coli, выдерживали при 0oC;
фиг 3. На чертеже схематически показан метод конструирования вектора экспрессии, содержащего пример гена ПФДК в соответствии с настоящим изобретением.
Фиг. 4-34. Здесь отдельно показаны формулы аминокислотных и нуклеотидных последовательностей для иллюстрации конкретных примеров выполнения настоящего изобретения.
Лучший вариант выполнения изобретения.
С помощью настоящего изобретения был клонирован ген ПФДК, обладающей устойчивостью к холоду Flaveria brownii, и были определены его нуклеотидная и соответствующая ей аминокислотная последовательности. Нуклеотидная и аминокислотная последовательности представлены на фиг. 8 под номером Последовательность N 5. Как детально описано в последующих примерах, эта последовательность была определена путем экстракции тотальной РНК из листьев Flaveria brownii; приготовления библиотеки комплементарной ДНК (к-ДНК) в соответствии с общепринятым методом, выполнения метода гибридизации бляшек с использованием зонда, приготовленного путем соотнесения с областью гена ПФДК Flaveria bidentis и областью гена ПФДК кукурузы, которые имеют высокую степень гомологии; с помощью селекции и клонирования позитивных клонов, и определения последовательности гена дидеокси-методом. Последовательность имеет высокую гомологию с геном ПФДК Flaveria bidentis, принадлежащую тому же роду, и имеет сравнительно большую гомологию с геном ПФДК кукурузы. Кроме того, последовательности N-концевой области, C-концевой области и внутренних областей полученной аминокислотной последовательности являются полностью такими же, как соответствующие последовательности ПФДК Flaveria brownii непосредственно выделенной из зеленых листьев этого растения. Поэтому очевидно, что клонированный ген является геном ПФДК Flaveria brownii Ген ПФДК Flaveria bidentis был секвенирован путем проведения гибридизации бляшек, используя кДНК кукурузы в качестве зонда; клонирования позитивных клонов и определения последовательности гена с помощью дидеокси-метода.
Аминокислотная последовательность, представленная под номером Последовательность N 5, является новой, и 40 аминокислотных остатков ее отличаются от аминокислотной последовательности ПФДК Flaveria bidentis, принадлежащей тому же роду. Около 180 ее аминокислотных остатков отличаются от аминокислотной последовательности ПФДК кукурузы. Таким образом, несмотря на тот факт, что аминокислотная последовательность ПФДК Flaveria brownii, представленная под номером Последовательность N 5, имеет высокую степень гомологии с аминокислотной последовательностью ПФДК Flaveria bidentis, принадлежащей к тому же роду, ПФДК Flaveria bidentis является холодочувствительной, в то время как аналогичный фермент Flaveria brownii является холодоустойчивым. Таким образом, небольшое различие в аминокислотных остатках сообщает важное различие в свойствах. Настоящее изобретение обеспечивает получение клонированного гена ПФДК, который кодирует аминокислотную последовательность N 5. Как упоминалось выше, эта аминокислотная последовательность является новой и обладает заметным влиянием на устойчивость к холоду. Ген в соответствии с настоящим изобретением не ограничивается геном, имеющего нуклеотидную последовательность, показанную под на фиг. 8 под N 5, однако любая нуклеотидная последовательность, которая кодирует эту аминокислотную последовательность, принадлежит к генам, на которые распространяется настоящее изобретение.
Авторы настоящего изобретения попытались идентифицировать ту область гена ПФДК из Flaveria brownii которая показана на фиг. 8 под N 5, которая сообщает устойчивость к холоду. То есть, как описано детально в последующих примерах, ген ПФДК Flaveria brownii был разделен на три области, имеющие примерно одинаковый размер, при помощи ферментов рестрикции, при этом каждая из областей обменивалась с соответствующей областью гена ПФДК кукурузы с образованием химерных генов ПФДК, и исследовалось, обладают ли устойчивостью к холоду ПФДКиназы, которые кодируются полученными химерными генами. В результате было подтверждено, что область, ответственная за устойчивость к холоду, находится в последней трети области гена ПФДК Flaveria brownii. В дальнейшем эта последняя треть области была разделена с помощью фермента рестрикции на две области, имеющие примерно одинаковый размер, и было определено теми же методами, какой фрагмент содержит область, ответственную за устойчивость к холоду. В результате было подтверждено, что функция, сообщающая устойчивость к холоду, закодирована в области, находящейся ниже сайта Xho I гена ПФДК из Flaveria brownii, показанного на фиг. 8 под N 5. Таким образом, было подтверждено, что функция передачи устойчивости к холоду локализована внутри аминокислотной последовательности между 832-ым аминокислотным остатком, аргинином, и 955-ым аминокислотным остатком, валином, в аминокислотной последовательностью, показанной на фиг. 8 под N 5 (аминокислотная последовательность от 832 аминокислотного остатка до 955 аминокислотного остатка в дальнейшем может называться "последовательность, ответственная за устойчивость к холоду").
То есть было доказано, что область, относящаяся к холодоустойчивости ПФДК, локализуется в 1/6 части всей области от C-конца. С другой стороны, нуклеотидная последовательность гена, кодирующая ПФДК из Flaveria bidentis, и соответствующая ей аминокислотная последовательность представлены на фиг. 4, последовательность N 1, а нуклеотидная последовательность гена, кодирующего ПФДК кукурузы и соответствующая ей аминокислотная последовательность представлены на фиг. 5, последовательность N 2 (Jornal of Biochemistry, 263. 11080-83 (1989)). На фиг. 6, последовательность N 3, представлены нуклеотидная последовательность гена, кодирующего ПФДК из Bacteroides symbiosus, которая является бактерией, и соответствующая нуклеотидной аминокислотная последовательность (Biochemistry, 29. 10757-65, (1990)). На Фиг.7, последовательность N 4 представлены нуклеотидная последовательность гена, кодирующего ПФДК Entamoeba histolytica, которая является бактерией, и соответствующая ей аминокислотная последовательность (Molecular and Biochemical Parasitology, 62. 153-56 (1993)). Как описано выше, настоящим изобретением было подтверждено, что область, отвечающая за устойчивость ПФДК к холоду, локализована в 1/6 части всей области от C-конца, и можно получить стабильную к холоду ПФДК путем замещения по крайней мере одного аминокислотного остатка в 1/6 части всей области от C-конца аминокислотной последовательности, показанной на фиг. 4-7 под N 1, 2, 3 или 4. Здесь термин "устойчивость к холоду" означает, что активность фермента после выдерживания фермента при 0oC в течение 20 минут имеет не менее 60% первоначальной активности.
Как упоминалось выше, поскольку область от 832 аминокислотного остатка, аргинина, до 955 аминокислотного остатка, валина, в аминокислотной последовательности, показанной на фиг. 8 под N 5, определяет холодоустойчивость, чувствительные к холоду ПФДКиназы, имеющие аминокислотные последовательности, показанные на Фиг. 4-7 под N 1-4, могут быть превращены в холодоустойчивые ПФДКиназы путем замещения соответствующих областей холодочувствительных ПФДКиназ на аминокислотную последовательность от 832 аминокислотного остатка, аргинина, до 955 аминокислотного остатка, валина, из аминокислотной последовательности, представленной на фиг. 8 под N 5. Этот факт является очень важным благодаря тому, что при его использовании любую из холодочувствительных ПФДКиназ можно превратить в холодоустойчивую. Способ придания ПФДК холодоустойчивости не ограничивается методом, описанным ниже в примерах, в которых последовательность, придающая ПФДК из Flaveria brownii холодоустойчивость, обменивается с соответствующим районом холодочувствительной ПФДК для приготовления химерного гена, но устойчивость к холоду может быть также придана с помощью специфического мутагенеза при замене соответствующего района холодочувствительной ПФДК растения на ту же самую последовательность, как последовательность Flaveria brownii, привносящая устойчивость к холоду. Поэтому любая ДНК, которая кодирует полипептид, обладающий активностью ПФДК, содержащий описанную выше последовательность, ответственную за холодоустойчивость, относится к сфере настоящего изобретения. В частности, ПФДК, в которой 869-ый аминокислотный остаток в аминокислотной последовательности, показанной на фиг. 4 под N 1, замещен на пролин, и ПФДК, в которой 885-ый и 952-ой аминокислотные остатки в аминокислотной последовательности, показанной на фиг. 4 под N 1, замещен на лейцин и валин, соответственно, являются холодоустойчивыми.
ПФДКиназы, которым должна быть сообщена устойчивость к холоду, не ограничиваются теми, которые показаны на фиг. 4-7 под N 1-4, сюда относятся также такие, которые имеют не менее 50% гомологии в последовательностях, показанных на фиг. 4-7 N 1-4. Предпочтительно, чтобы нуклеотидная последовательность гена, кодирующего ПФДК, которой должна быть придана холодоустойчивость, обладала гомологией с геном ПФДК из Flaveria brownii в количестве не менее, чем 48.5%, более предпочтительно не менее 90%.
Специалистам хорошо известно, что имеют место случаи, когда физиологическая активность физиологически активных пептидов сохраняется, даже если аминокислотная последовательность пептида подвергается в небольшой степени модификации, то есть, если одна или несколько аминокислот в аминокислотной последовательности замещается или отсутствует, или если одна или несколько аминокислот добавляется к аминокислотной последовательности. Поэтому полипептиды, имеющие ту же аминокислотную последовательность, как показанная на фиг. 8 под N 5 а также полипептиды, модифицированные вышеуказанным образом, обладающие активностью устойчивой к холоду ПФДК, относятся к области настоящего изобретения, а также полипептиды, имеющие ту же самую аминокислотную последовательность, как показано на фиг. 8 под N 5, содержащие на одну или несколько аминокислот больше или меньше, или замещенные на другие аминокислоты, и которые обладают активностью устойчивой к холоду ПФДК, относятся к сфере настоящего изобретения. Аналогично, ДНК, имеющие те же нуклеотидные последовательности, как показано на фиг. 8 под N 5, а также такие, где один или несколько нуклеотидов добавляются, отсутствуют или замещаются, и которые кодируют полипептиды, обладающие активностью устойчивой к холоду ПФДК, также относятся к области настоящего изобретения.
Модификация ДНК, которая вызывает добавление, утрату или замещение в аминокислотной последовательности, которая ею кодируется, может быть достигнута с помощью направленного мутагенеза, который хорошо известен специалистам (например, Nucleic Acid Research, 10, N 20, 6487-6500, (1982)). В принятой здесь терминологии "одна или несколько аминокислот" означает количество аминокислот, которые могут быть добавлены, утрачены или замещены посредством направленного мутагенеза.
Направленный мутагенез может осуществляться, например, при использовании синтетического олигонуклеотидного праймера, комплементарного однонитевой фаговой ДНК, кроме тех случаев, когда желательная мутация выполняется следующим образом. Она состоит в том, что, при использовании в качестве праймера упомянутого выше синтетического олигонуклеотида, фагом воспроизводится комплементарная цепь, и бактериальные клетки хозяина трансформируются с помощью полученной двухцепочечной ДНК. Культура трансформированных бактериальных клеток засевается в агар, и бляшки формируются из единственной клетки, содержащей фаг. Теоретически 50% новых колоний содержат фаг, имеющий однонитевую цепь, несущую мутацию, а другие 50% колоний содержат фаг, имеющий исходную последовательность. Полученные бляшки затем подвергаются гибридизации с обработанным киназой синтетическим зондом при температуре, при которой зонд гибридизируется с ДНК, имеющей точно такую же последовательность, как ДНК, имеющая нужную мутацию, а не с исходной последовательностью ДНК, которая не является полностью комплементарной зонду. Затем бляшки, в которых наблюдалась гибридизация, собирали, культивировали, и ДНК объединяли.
В дополнение к упомянутому выше направленному мутогенезу методы замещения, удаления или добавления одной или нескольких аминокислот без потери ферментативной активности включают метод, в котором ген обрабатывается мутагеном, и метод, в котором ген избирательно расщепляется, выбранный нуклеотид удаляется, добавляется или замещается, а затем ген сшивается.
Посредством трансформирования растения с помощью гена ПФДК из Flaveria browbii или с помощью ДНК, кодирующей полипептид, содержащий последовательность, придающую холодоустойчивость, и обладающий активностью ПФДК, можно получить устойчивое к холоду растение. К предпочтительным примерам растений, которые должны быть трансформированы, относятся кукуруза, сахарный тростник, просо, ежовник и сорго, но этим список не ограничивается.
Методы трансформирования растений уже были установлены, и предпочтение может быть отдано методу, использующему Agrobacterium tumefaciens. Метод трансформирования растений, использующий Agrobacterium tumefaciens, хорошо известен специалистам. Этим методом могут быть трансформированы как двудольные растения (например, Японская выложенная заявка (Kokai) N 4-330234), так и однодольные растения (WO 94/00977). В качестве альтернативы, можно вводить ДНК в протопласты растений с помощью метода электропорации или подобного широко известного метода. Кроме того, трансформацию можно также проводить путем присоединения ДНК к частицам вольфрама и подобным и имплантировать частицы в зародыши растения. Конкретное осуществление этих методов трансформации описывается в приведенных ниже примерах.
Примеры.
Теперь настоящее изобретение будет более конкретно описано с помощью следующих примеров. Однако, настоящее изобретение приводимыми примерами не ограничивается.
1. Клонирование и секвенирование гена ПФДК из Flaveria brownii.
(1) Приготовление библиотеки кДНК и клонирование полной последовательности кДНК;
(i) Приготовление библиотеки кДНК.
Из зеленых листьев (60 грамм) F. brownii суммарные РНК были выделены с помощью гуанидинхлорид-фенольного метода. Этим методом было получено 26.5 мг РНК после осаждения литием. Затем из 13.2 мг РНК было получено 118.9 мкг пoли(A)+ РНК в соответствии с обычным методом, с использованием колонки, содержащей олиго-dT -целлюлозу типа 7 (выпускается PHARMACIA). Для приготовления библиотеки кДНК использовали выпускаемый PHARMACIA набор TIMESAVER для синтеза кДНК, вектор Lambda ZAPII, выпускаемый STRATAGENE и упаковывающий реагент, привязанный к кДНК клонирующей системе (λ gt10, выпускаемый AMERSHAM. Используя связывающий агент EcoRI/NotI, была приготовлена библиотека кДНК, в которой фрагменты ДНК включены в сайт EcoRI векторов Lambda ZAPII. Размер полученной библиотеки кДНК составлял 415000 бляшкообразующих единиц. В качестве клеток-хозяев использовались XL1-клетки.
(ii) Приготовление зонда.
Используя праймер, имеющий последовательность 5': GACGGCTAAAAAGAGGGT, сконструированный на основе областей ПФДК из Flaveria bidentis и ПФДК кукурузы, которые в значительной степени гомологичны, и R-праймер, имеющий последовательность TATCGAGAAACCTTCTATAC (часть последовательности ПФДК из Flaveria bidentis, комплементарная цепь), размножали обратной транскрипцией в цепной полимеразной реакции (ЦПР) фрагмент ДНК, происходящий из РНК F. brownii, и накопленные фрагменты ДНК были включены в pCRII-вектор, выпускаемый INVITROGEN. Используя полученный вектор в качестве матрицы, а также те же самые праймеры, которые упоминались выше, ДНК была размножена, и продукт ЦПР подвергали электрофорезу, за которым следовало выделение ДНК из геля с использованием Suprec-01, выпускаемым TAKARA SHUZO. С помощью этого процесса может быть получен фрагмент ДНК, имеющий размер 428 комплементарных пар оснований, начиная от 24-ой пары оснований по направлению от N-конца зрелого белка. Для приготовления зонда этот фрагмент был помечен 32P с использованием системы Multiprime для внесения метки в ДНК, выпускаемой AMERSHAM.
(iii) Клонирование всей последовательности кДНК Flaveria brownii.
Библиотеку кДНК подвергли скринингу с помощью метода гибридизации бляшек, используя упомянутый выше фрагмент ДНК в качестве зонда. В качестве фильтра для гибридизации использовали Hybond N+ (AMERSHAM), и гибридизацию проводили в шестикратном SSC-буфере, содержащем 5-кратный раствор Денхальта (Denhalt), 0.1% ДСН (додецилсульфата натрия) и 100 мкг/мл денатурированной ДНК из спермы лосося при 65oC в течение ночи. Промывание проводили 2 х SSC, содержащим 0.1% ДСН, при комнатной температуре в течение 5 минут; и 2 х SSC, содержащим 0.1% ДСН при комнатной температуре в течение 90 минут; и 1 х SSC, содержащим 0.1% ДСН при 68oC в течение 90 минут. Таким путем было получено 28 независимых положительных клонов. Из них 11 бляшек, которые давали сильные сигналы, были собраны и подвергнуты повторному скринингу. Повторный скрининг был выполнен тем же самым способом, как и первый скрининг за исключением того, что время второго промывания составляло 60 минут. В результате из 6 клонов были получены независимые положительные бляшки, происходящие из единственного фага. Чтобы проверить размеры вставленных фрагментов ДНК, была проведена ЦПР с использованием описанного выше R-праймера, а также выпускаемых TAKARA SHUZO в качестве праймеров М 13PrimerM4 (GTTTTCCCAGTCACGAC) и M13PrimerRV (CAGGAAACAGCTATGAC), и с использованием фага в качестве матрицы. В результате 2 клона содержали всю последовательность кДНК. После этого путем вырезания in vivo вставленные фрагменты ДНК были субклонированы в плазмидный вектор pBluescriptIISK(-), выпускаемый STRATAGENE. Полученные при субклонировании рекомбинантные плазмиды были названы р411 и р631.
С помощью описанной выше ЦПР было найдено, что библиотека, приготовленная так, как описано выше, была библиотекой, содержащей достаточно длинные вставки, которые были подходящими для скрининга кДНК. Таким образом для выделения мРНК из Flaveria brownii выгодно использовать описанный выше метод и получать большое количество матричных РНК сразу путем обработки большого количества РНК как описано выше.
Далее, поскольку описанная выше библиотека кДНК содержит несколько достаточно длинных вставок, было возможно легко выполнить скрининг всей последовательности кДНК путем приготовления зонда, полученного при использовании праймера, который гибридизируется с областью по соседству с операторной областью нужного белка.
(2) Определение суммарной нуклеотидной последовательности кДНК и сравнение с соответствующей аминокислотной последовательностью.
Для определения суммарной нуклеотидной последовательности вставленных фрагментов р631 кДНК были приготовлены делеционные мутанты. Делеционные мутанты были приготовлены при использовании Набора для делеции для килопоследовательности, выпускаемого фирмой TAKARA SHUZO. Однако, реакция под действием экзонуклеазы III останавливалась при переносе реакционной смеси в буферный раствор нуклеазы бобов Mung, выдержанный при 65oC. Определение нуклеотидной последовательности было выполнено при использовании плазмиды, очищенной с помощью наборов Qiagen Plasmid Mini Kit (выпускаемого DIAGEN), Taq DyeDeoxy Terminator Cycle Sequencing Kit (выпускаемого ABI) и Applied Biosystems 373A DNA Sequencer (ABI). Обе цепи были секвенированы за исключением некоторых их участков. На основании определенной нуклеотидной последовательности была определена аминокислотная последовательность. Установленная нуклеотидная последовательность и аминокислотная последовательность представлены на фиг. 8 под N 5.
Следует заметить, что при приготовлении вырезанных клонов для секвенирования выделенной кДНК было важно предварительно нагреть буферный раствор нуклеазы бобов Mung до 65oC, поскольку реакция не может быть остановлена просто переносом реакционной смеси в буферный раствор нуклеазы. Далее поскольку последовательность на участке в 600-900 пар оснований от границы между вектором и вставкой не может быть определена с помощью делеции вставки только с расположенного выше конца, было необходимо выполнить делецию с двух концов.
С другой стороны, ПФДК была очищена непосредственно из Flaveria brownii, и была определена ее аминокислотная последовательность с N-конца, C-конца и во внутренних областях. ПФДК была очищена следующим образом. Зеленые листья перемалывались в трехкратном объеме экстрагирующего буфера. После центрифугирования к супернатанту был добавлен сульфат аммония до 30% насыщения, и выпавшие белки удаляли. Сульфат аммония был еще добавлен до 70% насыщения, и выпавшие белки были собраны. Собранные белки наносили на Sephadex G25, выпускаемый PHARMACIA для удаления солей. Полученный таким образом раствор был нанесен на колонку с DEAE-Sepharose (PHARMACIA), и адсорбированные на колонке белки элюировали KCl, используя градиент 50 - 400 мМ. Фракции, обладающие активностью ПФДК, были собраны и сконцентрированы с помощью сульфата аммония при 70% насыщении, за чем следовало обессоливание на сефадексе G25. Полученный раствор был нанесен на колонку с гидроксиапатитом. Адсорбированные белки элюировались фосфатным буфером в градиенте фосфата от 10 мМ до 40 мМ. Фракции, обладающие активностью ПФДК, объединяли и концентрировали с помощью сульфата аммония при 70% насыщении затем обессоливали на сефадексе G25. Полученное вещество подвергали электрофорезу на полиакриламидных пластинках в присутствии додецилсульфата натрия, и полоски ПФДК вырезали. Белки регенерировали из геля с помощью электроэлюции. По этому методу очищенный образец ПФДК был получен в количестве около 5-10 нМ. Очищенная таким образом ПФДК в ДСН-ПААГ электрофорезе проявлялась в виде единственной полоски.
Далее были определены N-концевая, C-концевая и внутренние аминокислотные последовательности полученной таким образом очищенной ПФДК. А именно, аминокислотная последовательность N-концевой области определялась путем переноса белка на мембрану из поливинилиденфторида (PVDF) и затем определения последовательности, используя газофазный аминокислотный секвенатор. Аминокислотная последовательность C-концевого района была определена при гидролизе очищенной ПФДК карбоксипептидазой Y и основываясь на отношении между составом выделившихся аминокислот и временем гидролиза. Аминокислотные последовательности внутренних областей были определены путем установления аминокислотных последовательностей с N-концов пептидов, полученных в результате гидролиза белка протеазой. Детали этого метода следующие. Во-первых, как в случае определения аминокислотной последовательности N-концевой области, ПФДК из зеленых листьев Flaveria brownii была частично очищена и подвергнута обычному ДСН-ПААГ-электрофорезу. Гель окрашивали Кумасси бриллиантовым голубым R250, и полосу ПФДК вырезали. Вырезанный гель уравновешивали с уравновешивающим буферным раствором (125 мМ Трис-HCl-буфер, pH 6.8, 1 мМ ЭДТА, 0.1% ДСН) и вносили в лунку, за чем следовал второй электрофорез в ДСН-ПААГ. Раствор для наслаивания (125 мМ Трис-HCl-буфер, pH 6.8, 1 мМ ЭДТА, 0.1% ДСН, 0.01% бромфенолового синего (БФС), 20% глицерина) и раствор фермента (125 мМ Трис-HCl -буфер, pH 6.8, 1 мМ ЭДТА, 0.1% ДСН, 0.01% БФС, 10% глицерина, 1-5 мкг лизил эндопептидазы или 0.01-0.1 мкг протеазы V8) были добавлены вместе с уравновешенным гелем. После проведения электрофореза в течение некоторого времени, осуществляли гидролиз белка в концентрированном геле (электрическое напряжение было снято, и гель оставили на 45 минут). Затем опять продолжили электрофорез, и полученное вещество перенесли на мембрану PVDF так же, как при определении N-концевой последовательности, и аминокислотная последовательность полученного при гидролизе фрагмента была определена с его N-конца, используя газофазный аминокислотный секвенатор.
Установленная последовательность N-концевого участка, C-концевого участка и внутренних областей белка следующая :
N-концевая последовательность : Asn Pro Val Ser Pro Pro Val (72-78);
C-концевая последовательность: Leu-Ala Ala*-Val Val (948-955);
Внутренние последовательности :
(1) Lys Leu Туг Glu Phe Leu Val Asn Ala Gin Gly-Asp Val Val Ala (349-365);
(2) Gin Leu Leu Ala Pro Pro Ala Met Ser Asn Ala Leu-Thr (592-605);
(3) Leu Thr Ala Asp Thr Gly Met Ser Lys Asp Glu Ile Tyr Ser Arg Ile Glu (721- 738);
(4) Ala- - - Ser Phe Gly Thr Asn Asp Leu Cys Gin Met Val Phe Gly - Ser (844- 862).
В приведенных выше аминокислотных последовательностях "*" означает глутамин, который не может быть определен использованным анализатором, а " - " означает, что результат анализа был неясен. Числа в скобках указывают номер аминокислоты в соответствующей области аминокислотной последовательности, показанной на фиг. 8 под N 5. Хотя части внутренних последовательностей (2) и (4) отличаются от аминокислотной последовательности, показанной на фиг. 8 под N 5, полагают, что это связано с ошибками аминокислотного секвенатора. Хорошо известно, что причиной ошибок довольно часто являются аминокислотные секвенаторы, в то время как секвенаторы ДНК практически не дают ошибок.
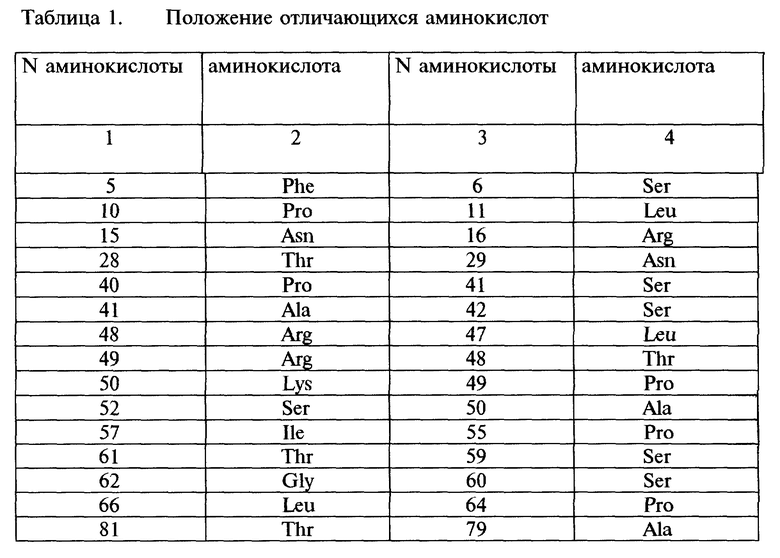
Поскольку аминокислотная последовательность, представленная на фиг. 8 под N 5, хорошо согласуется с частичными аминокислотными последовательностями, непосредственно определенными в описанной выше очищенной ПФДК, было подтверждено, что аминокислотная последовательность, показанная на фиг. 8 под N 5, является аминокислотной последовательностью ПФДК. Аминокислотную последовательность, показанную на фиг. 8 под N 5, сравнивали с аминокислотной последовательностью известных ПФДК Flaveria bidentis и кукурузы. В результате 40 аминокислотных остатков у Flaveria bidentis и около 180 аминокислотных остатков у кукурузы, соответственно, имели отличия на участке последовательности зрелого белка. Далее из описанных выше результатов можно предполагать, что в аминокислотной последовательности, представленной на фиг. 8 под N 5, в зрелом белке не существует аминокислотной последовательности с 1-го по 71-й остаток, но переходный пептид необходим для прохождения через мембраны, который после прохождения через мембраны отщепляется с образованием зрелого белка. Различия между аминокислотными последовательностями зрелых белков из Flaveria brownii и Flaveria bidentis показаны ниже в Таблице 1.
2. Генерация ПФДК Flaveria brownii в E. coli и измерение устойчивости к холоду.
Для того чтобы подтвердить, что устойчивый к холоду фермент действительно продуцируется кДНК, кодирующей ПФДК из Flaveria brownii, выделенной как описано выше, проводили экспрессию в Е. coli следующим образом.
Для того чтобы удалить транзитный пептид и лигировать ДНК с экспрессируемым вектором так, чтобы рамки считывания совпадали, были включены рестрикционные сайты следующим образом. Рекомбинантная плазмида р631 подвергалась гидролизу под действием SacI и рециклизовалась с образованием р631 Sac (та же самая плазмида р631, за исключением того, что ниже расположенная область сайта SacI вырезана). ЦПР проводили, используя р631 Sac в качестве матрицы и праймер 4: GATATCAATCCGGTGTCTCCTCC, содержащий сайт EcoRV, полученный на основании последовательности в области, соседней с операционной областью, и праймер М 13 RV, выпускаемый фирмой TAKARA SHUZO, комплементарный последовательности вектора, размноженный фрагмент был субклонирован в pCRII. Фрагмент, содержащий N-концевую область, был вырезан, используя рестрикционные ферменты EcoRV и SacI. Были лигированы три фрагмента ДНК, то есть, вырезанный таким образом фрагмент ДНК, фрагмент SacI-HindIII из р631 (содержащий оставшуюся часть кДНК, кодирующей ПФДК) и фрагмент, полученный при гидролизе рКК233-2 с помощью Ncol, образованием тупых концов под действием фрагмента Кленоу и последующего гидролиза полученной структуры с помощью HindIII (фиг 1). Вместе с полученной плазмидой был трансформирован MV1184 Е. coli и использован для экспериментов по экспрессии. Один мл прокультивированной среды разбавляли 9 мл свежей среды LB, содержащей 50 мг/л ампициллина, и полученные клетки культивировали при перемешивании в течение 3 часов при 37oC. Затем добавили изопропил-бета-D-тиогалактозид (IPTG) до концентрации 5 мМ, и культивирование продолжали еще в течение 3 часов, затем собирали клетки центрифугированием. Клетки суспендировали в 0.5 мл экстрагирующего буфера (50 мМ Hepes-KOH, pH 7.5, 10 мМ MgSO4 1 мМ ЭДТА, 5 мМ DTT) и добавляли лизоцим до конечной концентрации около 0.5 мг/мл. Суспензию оставили стоять во льду в течение 5 минут и затем обработали с помощью ультразвукового измельчителя (модель UCD-130T, выпускаемая фирмой COSMOBIO) в течение 5 мин дозами по 30 сек каждая, экстрагируя таким образом фермент. Продукт центрифугировали на микроцентрифуге в течение 10 мин, и супернатант нанесли на колонку Sephadex G25, уравновешенную с буфером (50 мМ HEPES-KOH, pH 7.0, 10 мМ MgCl2, 2 мМ EDTA, 10 мМ DDT) для удаления низкомолекулярных веществ. Полученный продукт оставляли при 25oC в течение не менее 30 минут, при этом происходила ассоциация до тетрамера, который затем использовался для измерения активности.
Полученные в клетках Е. coli ПФДКиназы из кодирующих ПФДК кДНК из Flaveria brownii, Flaveria bidentis и кукурузы (сорт Harvest Queen) имели в основном одинаковую подвижность при электрофорезе в системе ДСН-ПААГ как ферменты, происходящие из растений. Хотя молекулярные массы зрелых ферментов, которые, как ожидается из структуры соответствующих кДНК, являются практически одинаковыми, кажущиеся молекулярные массы, определенные с помощью ДСН-ПААГ-электрофореза, значительно различаются. Было доказано, что это происходит благодаря различию в аминокислотном составе, а не из-за процесса делеции белков или модификации после трансляции, например, в результате присоединения углеводных цепей. Устойчивость к холоду каждой ПФДК, полученной в Е. coli, была идентична соответствующему ферменту, происходящему из каждого растения. Так холодоустойчивость ПФДК из Flaveria brownii достигается без дополнительного фактора, специфичного для этого растения, или обработки после трансляции, так что ожидается, что холодоустойчивая ПФДК получается при введении кДНК в кукурузу и ее экспрессировании. На фиг. 2 показано соотношение между временем, которое проходит с момента выдерживания фермента при 0oC, и относительной активностью ПФДК.
В описанной выше методике получения активной ПФДК в Е. coli кДНК, из которой был удален участок, кодирующий транзитный пептид, была вставлена в вектор экспрессии. Для этого было важно точно подогнать сайт, который должен быть вырезан, к сайту, соответствующему N-концевой последовательности фермента, происходящего из этого растения (табл. 2).
В частности, одновременно с выполнением эксперимента по экспрессии кДНК из Flaveria brownii была успешно проведена экспрессия ПФДКиназ из кукурузы и Flaveria bidentis по отношению к вырезаемому сайту в кукурузе в обоих случаях. Так при экспрессии кДНК Flaveria brownii, также сначала ДНК была вырезана у того же самого сайта, с использованием праймера 2, и была предпринята попытка экспрессировать кДНК после конструирования вектора экспрессии, содержащего кДНК. Однако, ПФДК не продуцировалась вовсе. Затем, основываясь на последовательности N-концевого участка фермента, происходящего из листьев, был сконструирован вектор экспрессии, с использованием праймера 3, в котором включенная кДНК содержит дополнительную последовательность, кодирующую фермент, которая увеличена на N-конце на 7 остатков, и экспрессия проводилась с использованием вектора экспрессии. В результате было подтверждено образование ПФДК. Однако, даже с этим вектором экспрессии количество образовавшегося фермента было мало, так что фермент не был получен в количестве, достаточном для измерения его активности. Таким образом, был создан вектор экспрессии, в котором включенная кДНК содержит еще дополнительную последовательность, кодирующую фермент, которая увеличена с N-конца на 1 остаток, с использованием праймера 4. Экспрессию проводили с использованием вектора экспрессии. В результате было получено большое количество ПФДК, и была подтверждена его холодоустойчивость. Нуклеотидные последовательности праймеров 2 и 3 приводятся ниже.
Праймер 2 : CGGTGTCTCCTCCGGATATCACGGCTAAAAAGAG
Праймер 3: TTGATATCCCGGTTGTCTCCTCCGGTA
3. Идентификация области в гене ПФДК из Flaveria brownii, отвечающей за холодоустойчивость.
(1) Химерная ДНК из Flaveria brownii и Flaveria bidentis.
Вектора экспрессии рекомбинировали в соответствии с обычным методом, используя рестрикционные ферменты. В частности, фрагмент EcoRI-HindIII из pKK-brownii обменивался с соответствующим фрагментом pKK-bidentis (плазмида, полученная включением кДНК Flaveria bidentis в рКК 223-2 при конструировании pKK-Zwoww) для получения плазмиды рКК-011. С другой стороны, фрагмент EcoRI-HindIII из рКК- bidentis был обменен с соответствующим фрагментом pKK-brownii, чтобы получить плазмиду рКК-100. Аналогично, фрагменты NdetI-HindIII обменивались для получения рКК-001 и рКК-100. Далее фрагмент XhoI-HindIII из рКК-110 был обменен с соответствующим фрагментом pKK-bidentis для получения рКК-1101, а фрагмент Xho-HindIII из pKK-bidentis обменивался с соответствующим фрагментом pKK-brownii для получения рКК-1110. Для дальнейшей рекомбинации фрагментов XhoI-HindIII, эти фрагменты были связаны с помощью ЦПР (метод связывания ЦПР). В частности, были приготовлены праймеры, комплиментарные нуклеотидной последовательности во фрагменте XhoI-HindIII, последовательность которого является общей в bidentis и brownii, то есть были приготовлены F-звено праймера: GCAGAGATGATGTTGGCAAG и R-звено: CTTGCCAACATCATCTCTGC. Используя фрагмент XhoI-HindIII bidentis или brownii субклонированный в pBluescript SК(-) в качестве матрицы, и используя комбинацию праймеров F-звено/RV или М4/R-звено, была выполнена первая ЦПР. Полученные фрагменты (всего 4 типа) были очищены путем вырезания из геля. Используя смесь фрагмента, кодирующего первую часть brownii и фрагмента, кодирующего последнюю часть bidentis, или смесь фрагмента, кодирующего первую часть bidentis, и фрагмента, кодирующего последнюю часть brownii, в качестве матрицы, и используя праймеры M4/RV, была проведена вторая ЦПР. Накопленные связанные фрагменты подвергали гидролизу Xhol и HindIII, и продукт превращения обменивался с соответствующей областью рКК- bidentis с образованием pKK-link01 и pKK-link10. Другая пара химерных генов была приготовлена, используя сайт PstI между местом рекомбинации при связывании в ЦПР и областью HindIIL To есть, фрагмент XhoI-PstI из рКК- Unk10 и фрагмент PstI-HindIII из рКК- bidentis были включены в сайт XhoI- HindIII из рКК- bidentis (реакция, связывающая три фрагмента) для получения pKK-link101. Аналогично, фрагмент XhoI-PstI из рКК- bidentis и фрагмент PstI-HindIII из рКК- brownii были включены в сайт Xhol- HindIII из рКК- bidentis, чтобы получить pKK-link110.
Сорок положений, в которых аминокислотные остатки отличаются для зрелых ПФДК из Flaveria bidentis и Flaveria brownii, находятся главным образом в их N- и C-концевых областях, но их не так много во внутренних областях, то есть, в активном центре. Таким образом, кДНК были подразделены на три области, а именно на голову, середину и хвост, с использованием сайтов EcoRI и сайты Ndel, которые обычно существуют в обоих генах, и эти фрагменты были, чередуясь, обменены для приготовления химерных генов. При проверке этих химерных генов было определено, какая область отвечает за холодоустойчивость. В результате устойчивость к холоду приобретается, когда белок содержит 1/3 хвостовой области кДНК из Flaveria brownii В противоположность этому, когда белок содержит 1/3 хвостовой области кДНК из Flaveria bidentis, белок является чувствительным к холоду. Затем 1/3 хвостовой области была разделена на два фрагмента с помощью рестрикционного фермента Xhol, и фрагменты были соответственно введены в соответствующие области pKK-bidentis, и была проверена холодоустойчивость. В результате обнаружено, что область, расположенная ниже сайта Xhol (то есть, 1/6 области с C-конца) была необходима и достаточна для достижения холодоустойчивости. Далее химерный ген, содержащий 1/6 хвостовой области (фрагмент Xhol- HindIII, содержащий 7 замещений аминокислотных остатков) был приготовлен методом связывающей ЦПР, и размноженный ген был введен в рКК- bidentis, за чем следовало измерение холодоустойчивости. В результате обнаружено, что химерный фермент pKK-link10, включающий самый конец хвостового района, в котором содержится 4 замещения, был устойчивым к холоду, в то время, как химерный фермент pKK-link01, содержащий первую половину хвостовой части, в которой содержится 3 замещения, был чувствителен к холоду. Затем хвостовая область рекомбинировала при использовании рестрикционного фермента PstI для того, чтобы приготовить химерный ген, имеющий два аминокислотных замещения на ген, и устойчивость к холоду полученных генов была проверена. В результате все химерные гены обнаруживали холодоустойчивость. Таким образом, было предположено, что имеется два или более участков, ответственных за холодоустойчивость.
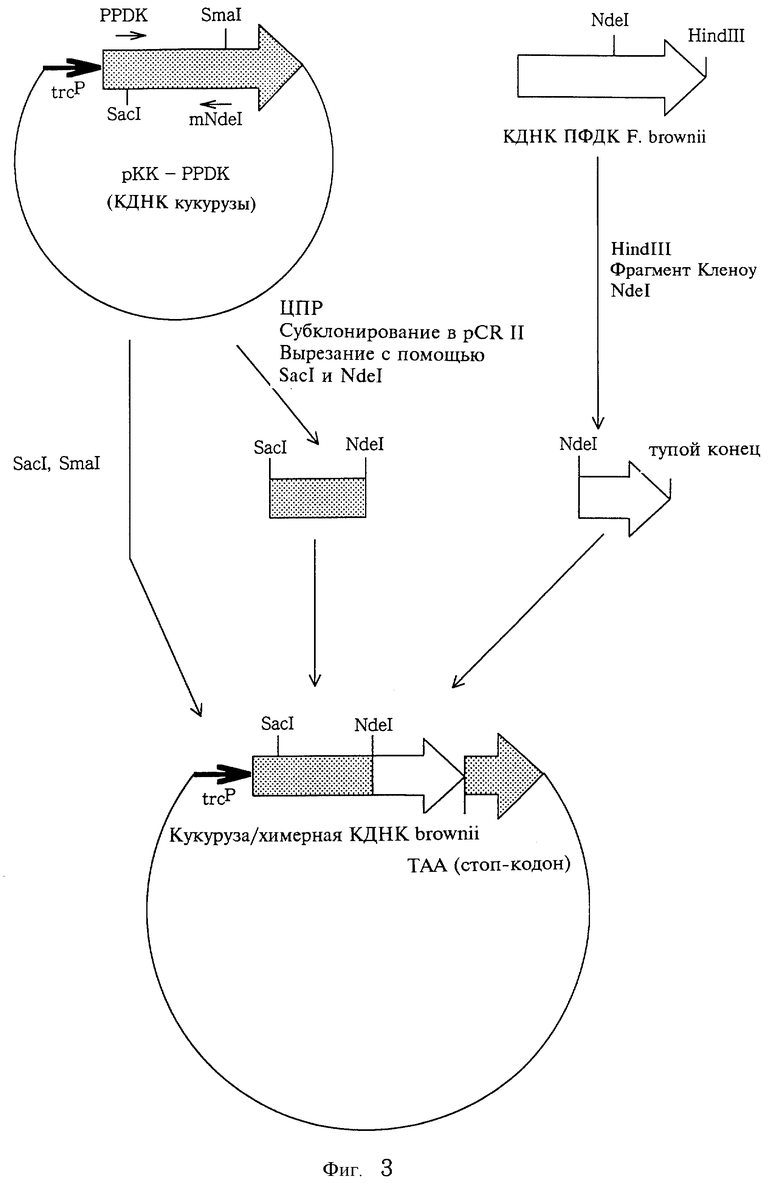
(2) Химерная ДНК из Flaveria brownii и кукурузы.
Используя праймер F-ПФДК: CTCACTGTTCGAAGAGAAGC и праймер mNdeI: CATATGCTCTGTCCGGCATAATC (комплементарная часть цепи), содержащий сайт Ndel в качестве праймеров, и кДНК, кодирующую ПФДК кукурузы в качестве матрицы, была проведена ЦПР, и накопленный фрагмент был субклонирован в pCR II. Этот фрагмент был вырезан из pCR II с помощью SacI и NdeL Этот фрагмент, фрагмент Sacl-Smal (векторный фрагмент) из рКК-ПФДК и фрагмент, полученный при гидролизе кДНК, кодирующей ПФДК К brownii, путем сшивки с помощью фрагмента Кленоу и последующего гидролиза полученной ДНК с помощью Ndel, были соединены в трех связывающих фрагменты реакциях (фиг. 3) с получением pKK-mz/bro(Nde). Была проведена ЦПР с использованием праймера ПФДК-F и праймера mXhoI: CTCGAGGGATCTCAATCATTG (комплементарная цепь) и ПФДК кукурузы в качестве матрицы. Полученный фрагмент был субклонирован в pCR II, и вставка была вырезана с помощью SacI и Xhol из pCR II. Вырезанный фрагмент был лигирован с фрагментом SacI - Xhol (векторный фрагмент) из рКК- mz/bro(Nde) для получения pKK-mz/bro(Xho).
Как химерный фермент, содержащий 1/3 часть C-концевой области (фрагмент NdeI-HindIII) ПФДК из F. brownii в составе ПФДК кукурузы, так и химерный фермент, содержащий 1/6 часть C-концевой области (фрагмент XhoI-HindIII) ПФДК F. brownii в составе ПФДК кукурузы проявляли такую же холодоустойчивость, как F. brownii. Таким образом, поскольку холодоустойчивость могла быть привнесена в ПФДК кукурузы, аминокислотный состав которой значительно отличается от состава F. brownii, полагают, что устойчивость к холоду может быть сообщена ПФДКиназам различных растений путем введения 1/3 хвостовой области или 1/6 C-концевого района. Поскольку полученная таким образом из кукурузы и F. brownii химерная ПФДК содержит транзитный пептид из ПФДК кукурузы как он есть, то, если трансформированное растение имеет затруднение в транспортировке холодоустойчивой ПФДК в хлоропласты, в которых транзитный пептид также происходит из F. brownii, предполагается, что эта проблема должна быть преодолена путем введения этого химерного гена вместо гена, порождаемого F. brownii.
(3) Точечномутировавшие клоны.
Аминокислотные остатки фрагмента XhoI-HindIII в рКК- brownii были заменены один за другим от типа brownii к типу bidentis. Аналогично аминокислотные остатки XhoI-HindIII в рКК- bidentis были заменены один за другим от типа bidentis к типу brownii. Введение мутаций было проведено с помощью субклонирования фрагментов XhoI-HindIII кДНК, кодирующих ПФДК из F. brownii и F. bidentis, в pBluescript IISK(-), а затем путем замещения нуклеотидов по методу Кункеля (Kunkel), используя набор Megalabel и набор Mutan-K, производимых TAKARA SHUZO. Последовательность праймеров, использованных для введения мутаций, показана в Таблице 3. После подтверждения мутантной нуклеотидной последовательности с помощью ДНК-секвенатора эти фрагменты были включены в сайт XhoI-HindIII в pKK-bidentis.
Все ферменты, в которых один аминокислотный остаток в области XhoI-HindIII в рКК-1110, тот, который различен для F. brownii и F. bidentis, был замещен на соответствующий аминокислотный остаток типа bidentis, обладали холодоустойчивостью. Таким образом, полагают, что имеется множество мутаций, которые сообщают устойчивость к холоду (поскольку холодоустойчивость не теряется при замене только одного аминокислотного остатка). Затем были приготовлены ферменты, в которых один аминокислотный остаток в области XhoI-HindIII pKK-bidentis, тот аминокислотный остаток, который различен в F. brownii и F. bidentis, замещался на соответствующий аминокислотный остаток типа brownii и было проверено, приобрели ли ферменты холодоустойчивость. В частности, измерялась активность фермента после обработки его в течение 20 минут при температуре 0oC. В результате при замене Gln869 на Pro фермент приобрел холодоустойчивость (активность после обработки холодом составляет 60-70% первоначальной активности). При замене Ile885 на Leu или Ile952 на Val немного уменьшалась потеря активности при низкой температуре. Принимая во внимание эти результаты и результаты по химерному ферменту pKK-link110, описанному в (1), предположили, что фермент приобретает холодоустойчивость, когда эти мутации сосуществуют. Из этих результатов был сделан вывод о том, что три аминокислотных остатка, а именно Pro869, Leu885 и Val952 определяют наличие холодоустойчивости. Однако, среди этих остатков, определяющих холодоустойчивость у brownii находятся такие, а именно Pro869 и Leu885, которые в ПФДК кукурузы также имеют тип brownii. Поэтому холодоустойчивость не обязательно приобретается благодаря тому факту, что эти остатки имеют тип brownii, но полагают, что эти остатки придают полную устойчивость к холоду в аминокислотной последовательности ПФДКиназ из F. brownii и F. bidentis. Поэтому в тех случаях, когда холодоустойчивость должна быть сообщена ПФДК, происходящих из различных видов, аминокислотная последовательность которых значительно различается от F. brownii и F. bidentis, предпочтительно не вводить точечные мутации, а приготовить химерный ген, в который вводится область, придающая холодоустойчивость, как было выполнено для ПФДК кукурузы.
(4) Трансформация кукурузы геном ПФДК из Flaveria brownii.
В соответствии с методом Гордона-Камма (Gordon-Kamm W.J. et al : The Plant Cell, 2, 603-618 (1990)) или Козиеля (Koziel M.G. et al : BioTechnology , 11, 194-200 (1993)) мелкие частицы золота или вольфрама покрываются pKK-brownii, и покрытые частицы имплантируются в незрелые зародыши кукурузы или суспендированные культуральные клетки. Из этих обработанных клеток выбираются трансформанты, а полученный из трансформантов каллус культивируется в соответствии с обычным методом, за чем следует регенерация растений из каллуса. Метод трансформации не ограничен методом шотган (particle gun method), но методы трансформации, которые могут быть использованы, включают метод электропорации (Rhodes C.A. et al : Science, 240. 204-207 (1988)), метод с полиэтиленгликолем (PEG-метод) (Armstrong C.L. et al: Plant Cell Reports, 9, 335-339 (1990)), метод электропорации тканей (D' Halluin К. et al: The Plant Cell, 4, 1495-1505 (1992)), метод с использованием агробактерий (Agrobacterium) (Hiei Y. & Komari Т., WO 9400977) и подобные. С полученных таким образом растений были собраны и пророщены семена для регенерации растений. ПФДК выделяется из листьев полученных растений, и измеряется ее устойчивость к холоду. Для трансформированных и нетрансформированных растений оценивается влияние температуры на скорость фотосинтеза. Стабильность трансформации гарантируется быстрым развитием растений кукурузы, которые обнаруживают хорошую скорость фотосинтеза при низкой температуре для многих поколений, а также измерением скорости фотосинтеза при различных температурах и измерением холодоустойчивости ПФДКиназ, выделенных из различных растений.
(5) Трансформация Flaveria bidentis геном ПФДК из Flaveria brownii
Промежуточный вектор, содержащий всю последовательность кДНК, показан на фиг. 8 N 5, и репортерный ген, вводится в разоруженную Ti-плазмиду Agrobacterium tumefaciens. Эта операция может выполняться по методу, описанному Драптером (Drapter J. et al. eds., Plant Genetic Transformation and Gene Expression- a laboratory manual, Blackwell Scientific Publications (ISBN 0-632-02172-1)).
С другой стороны, ткань листьев или каллуса Flaveria bidentis инфицируется упомянутыми выше бактериями Agrobacterium tumefaciens. Эта операция может быть выполнена при культивировании ткани или каллуса вместе с Agrobacterium tumefaciens. Инфицированные клетки отбираются на основании устойчивости к действию лекарств. Из выбранных каллусов выращивали целые растения обычными методами. С полученных растений собираются и проращиваются семена для воспроизводства растений. ПФДК выделяется из листьев полученных растений, и определяется ее холодоустойчивость. Для трансформированных и нетрансформированных растений изучается влияние температуры на скорость фотосинтеза. Стабильность трансформации гарантируется быстрым развитием растений кукурузы, которые демонстрируют высокую скорость фотосинтеза при низкой температуре для многих поколений, и измерением скорости фотосинтеза при различных температурах и холодоустойчивости выделенных из растений ПФДКиназ.


















































Изобретение относится к генной инженерии и может быть использовано в сельском хозяйстве для селекции растений. Выделен участок нуклеотидной последовательности гена пируват-ортофосфатдикиназы, ответственный за экспрессию полипептида, обладающего активностью в отношении холодоустойчивости. Введение указанного гена с помощью вектора в растительные клетки с последующей регенерацией из них целых растений позволяет получить растения, устойчивые к холоду. 6 с. и 7 з.п. ф-лы, 34 ил., 2 табл.
Приоритет по пунктам и признакам:
29.07.94 по п.1; при пп.2 и 11, относящиеся к последовательности, показанной на фиг.8; п.3; пп.4 и 6, относящиеся к последовательности аминокислот от 832-го до 955-го аминокислотного остатка в последовательности по фиг.8; пп. 5, 7 - 9; пп.10, 12, 13 в части ссылок на пп.1 - 9, относящихся к последовательности, показанной на фиг.8, и к последовательности аминокислот от 832-го до 955-го аминокислотного остатка упомянутой последовательности по фиг.8;
01.12.94 при пп.2 и 11, относящиеся к последовательности, показанной на фиг. 8, но с добавлением, исключением или замещением одной или более аминокислот или нуклеотидов; пп.4 и 6, относящиеся к последовательности аминокислот от 832-го до 955-го аминокислотного остатка в последовательности по фиг. 8, но с добавлением, удалением или замещением одного или более из упомянутых аминокислотных остатков; пп.10, 12, 13 в части ссылок на пп.2, 4, 6, относящихся к последовательности, показанной на фиг.8 с добавлением, исключением или замещением в ней одной или более аминокислот, и к последовательности от 832-го до 955-го аминокислотного остатка из последовательности по фиг.8 с добавлением, удалением или замещением одного или более указанных аминокислотных остатков.
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| Способ отбора исходного селекционного материала кукурузы на холодостойкость | 1989 |
|
SU1717015A1 |
Авторы
Даты
1999-09-10—Публикация
1995-05-30—Подача