Изобретение относится к новым таксанам, обладающим сильной противоопухолевой активностью, предшественникам этих соединений, композициям, включающим эти соединения, и способам синтеза этих соединений и способам лечения опухолей путем применения этих новых соединений.
В настоящее время Taxol считается одним из самых "лидирующих" соединений в химиотерапии раковых опухолей. Taxol представляет собой сложный дитерпен, выделенный из коры Taxus Brevifolia (тис тихоокеанский). Taxol обладает высокой цитотоксичностью и сильной противоопухолевой активностью по отношению к различным раковым опухолям, лечение которых бело не эффективным при использовании существующих противораковых лекарственных средств. Например, Taxol был одобрен ВОЗ в конце 1992 г. для лечения прогрессирующего рака яичника и в настоящее время проходит II стадию клинических испытаний в отношении рака молочной железы и рака легкого.
Хотя Taxol является важным "лидирующим" соединением в химиотерапии раковых опухолей, он обладает ограниченной растворимостью в водной среде, приводящей к серьезным ограничениям его использования. Известно также, что улучшенные лекарственные средства могут быть производными "лидирующих" соединений природного происхождения. Действительно, французские исследователи открыли новый противораковый агент, видоизменив боковую цепь C-13 g Taxol. Это неприродное соединение, названное "Faxotere", имеет трет-бутоксикарбонил вместо бензоила на амино группе радикала (2R,3S)-фенилизозерина по положению C-13 и гидроксильную группу вместо ацетокси группы при C-10. Taxotere обладает превосходящей по сравнению с Taxol противоопухолевой активностью при лучшей доступности. Taxotere в настоящее время проходит II стадию клинических испытаний в США, Европе и Японии.
Taxol (таксол) и Taxotere (текстотер) имеют следующие химические структуры: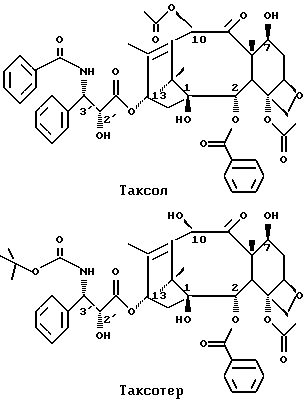
В недавно описанных клинических испытаниях таксола и таксотера указано, что таксол обладает побочными эффектами, такими как нервное заболевание, мышечная боль или нарушения сердечного ритма. Таксотер также обладает побочными эффектами. Например, таксотер вызывает язвы во рту и падение количества белых кровяных телец. Существуют другие вредные побочные эффекты у этих двух лекарственных средств.
Слабая растворимость таксола в воде создает практические проблемы при его фармацевтическим применении. Например, для фармацевтических составов, содержащих таксол, могут требоваться специальные носители. Максимальные дозировки в препаратах таксола также ограничены растворимостью Taxol.
С другой стороны, таксотер имеет несколько лучшую растворимость в воде и, таким образом, лучшие фармакологические свойства, чем таксол, но для этого противоопухолевого средства также существует проблема растворимости.
Обнаружено, что 14-гидрокси-10-деацетилбаккатин III (14-OH-ДАБ)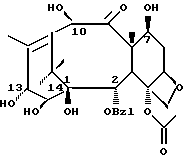
14-гидрокси-10-деацетилбаккатин III обладает значительно большей растворимостью в воде, чем обычный 10-деацетилбаккатин III. 10-деацетилбаккатин III в настоящее время используется для получения таксола и таксотера. Повышенная растворимость 14-OH-ДАБ обусловлена дополнительной гидроксильной группой в положении C-14. Поэтому предполагается, что новые противоопухолевые таксаны, полученные из 14-OH-ДАБ, должны иметь значительно улучшенные водную растворимость и фармакологические свойства при применении в качестве фармацевтических средств. Улучшение фармакологических свойств, как предполагается, связано с модификацией токсичности и спектра активности в отношении различных типов рака. Таким образом, целью изобретения является разработка новых противоопухолевых средств класса таксол или таксотер, имеющих существенные структурные отличия, которые повышают растворимость.
Следующей целью настоящего изобретения является получение ряда новых таксанов, производных от 14-OH-ДАБ, обладающих сильной противоопухолевой активностью с улучшенным терапевтическим профилем. Еще одной целью настоящего изобретения является синтез новых таксанов с высоким выходом при минимальном числе стадий синтеза.
Сущность изобретения
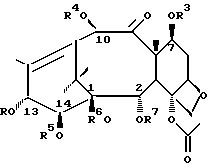
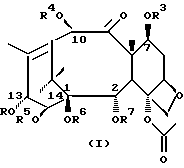
Соединения формулы (I) или формулы (II)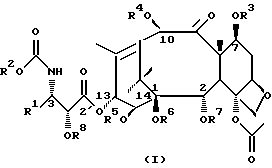
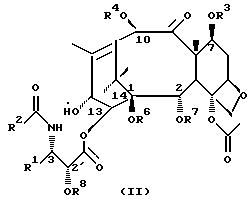
используемые в качестве противоопухолевых средств или их предшественников.
В этих соединениях R1 представляет незамещенный или замещенный линейный или разветвленный алкил, алкенил или алкинил, незамещенный или замещенный арил или гетероарил, незамещенный или замещенный циклоалкил, гетероциклоалкил, циклоалкенил или гетероциклоалкенил,
R2 представляет незамещенный или замещенный линейный или разветвленный алкил, алкенил или алкинил, циклоалкил, гетероциклоалкил, циклоалкенил, гетероциклоалкенил, арил или гетероарил,
или R2 может быть RO-, RS- или RR'N, в которых R представляет незамещенный или замещенный линейный или разветвленный алкил, алкенил или алкинил, циклоалкил, гетероциклоалкил, циклоалкенил, гетероциклоалкенил, арил или гетероарил; R' обозначает водород или R - такой, как определено выше; R и R' могут быть связаны с образованием циклической структуры,
R3 представляет водород, или ацил, или алкил, или алкенил, или алкинил, или незамещенный или замещенный циклоалкил, гетероциклоалкил, циклоалкенил или гетероциклоалкенил или незамещенный или замещенный арил или гетероарил, или защитную группу гидроксила,
R4 представляет водород или ацил, или алкил, алкенил или алкинил, незамещенный или замещенный циклоалкил, гетероциклоалкил, циклоалкенил или гетероциклоалкенил, незамещенный или замещенный арил или гетероарил радикал, или защитную группу гидроксила,
R5 представляет водород или ацил, или алкил, алкенил или алкинил, незамещенный или замещенный циклоалкил, гетероциклоалкил, циклоалкенил или гетероциклоалкенил, незамещенный или замещенный арил или гетероарил, или защитную группу гидроксила,
R6 представляет водород, или ацил, или алкил, алкенил или алкинил, незамещенный или замещенный циклоалкил, гетероциклоалкил, циклоалкенил или гетероциклоалкенил, незамещенный или замещенный арил или гетероарил, или защитную группу гидроксила,
R5 и R6 могут быть связаны с образованием циклической структуры,
R7 представляет ацильную группу,
R8 представляет водород или защитную группу гидроксила.
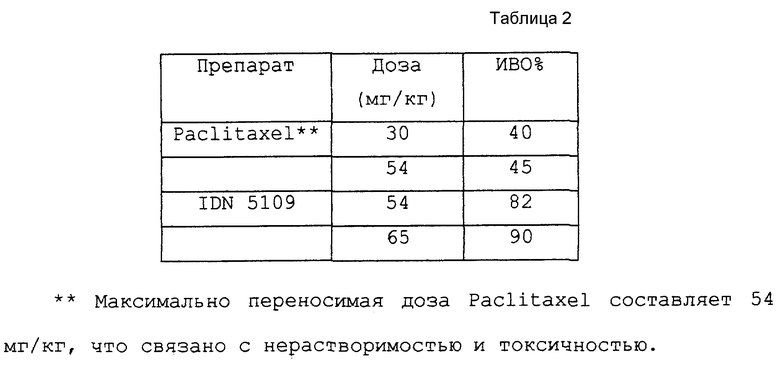
Новые таксаны (I) и (II) синтезированы способами, которые включают реакции взаимодействия в присутствии основания, баккатина формулы (III)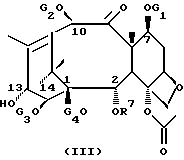
в которой G1, G2 G3 и G4 представляют защитную группу гидроксила или ацил, или алкил, или алкенил, или алкинил, или незамещенный или замещенный циклоалкил, гетероциклоалкил, циклоалкил или гетероциклоалкенил или незамещенный или замещенный арил или гетероарил; G3 и G4 могут быть связаны с образованием циклической структуры, R6 - определен выше,
или формулы (IV)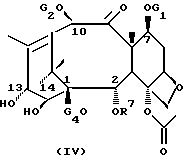
в которой G1, G2, G4 и R6 определены выше,
с β- лактамами формулы (V)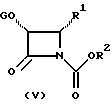
в которой G обозначает защитную группу гидроксила, такую как этоксиэтил (ЭЭ), триэтилсилил (ТЭС) и диметил(третбутил)силил (ТБДМС), и R1 и R2 - определены выше.
Новые таксаны по настоящему изобретению проявляют сильную противоопухолевую активность в отношении раковых клеток молочной железы у человека, крупных клеток легкого, яичника и толстой кишки. Поэтому очень важно разработать новые противораковые лекарственные средства, которые обладали бы меньшими нежелательными побочными эффектами, улучшенными фармакологическими свойствами, и/или спектром активности в отношении различных типов рака, отличных как от Taxol, так и от Taxotere.
Для лучшего понимания настоящего изобретения, а также других и последующих целей изобретения служит следующее описание, а объем изобретения представлен в приложенной формуле изобретения.
Подробное описание изобретения
Новые таксаны формул (I) или (II), как показано выше, используются в качестве противоопухолевых средств или их предшественников. Таксаны по настоящему изобретению обладают сильной противоопухолевой активностью в отношении раковых клеток молочной железы у человека, крупных клеток легкого, яичника и толстой кишки.
Новые таксаны формулы (I) синтезированы модификацией баккатина формулы (III).
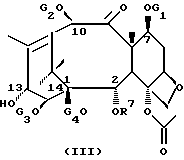
в которой G1, G2, G3, G4 и R7 определены выше.
Новые таксаны формулы (II) синтезированы модификацией баккатина формулы (IV)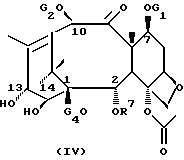
в которой G1, G2, G4 и R7 определены выше.
Предшественники (III) и (IV) легко доступны. Оба баккатина (III) и (IV) могут быть получены химической модификацией 14- β- -гидрокси-10-деацетилбаккатина (14-OH-ДАБ), соединения природного происхождения, обнаруженного в гималайском тисе. Способы выделения 14-OH-ДАБ описаны Appendino и др., в "14 бета-Hydroxy-10-deacetylbaccatin III, а New Taxane from Himalayen Jew" J. Chem. Soc, Perkin Trans 1, 2525-2529 (1992), содержание которого включено здесь в качестве ссылки.
Баккатины (III) и (IV) взаимодействуют с β-лактамами формулы (V)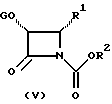
в которой G, R1 и R2 определены выше, с получением новых таксанов (I) и (II) соответственно.
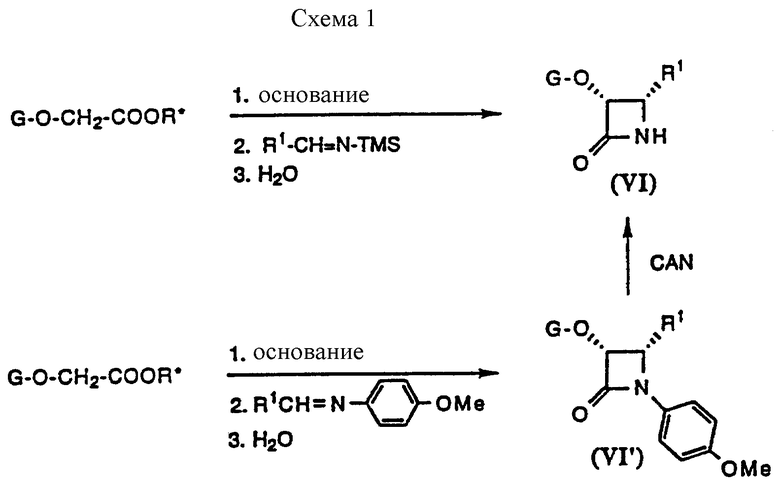
β-лактамы (V) легко получают из β- лактамов (VI), которые несложно получить по методу хиральной енолят-иминной циклоконденсации, разработанному в одной из лабораторий заявителей, как показано на схеме 1. Циклоконденсация описана Ojima, J. et al., Tetrahedron 1992, 48, 6985, Ojima, J. et al., J. Org. Chem. 56, 1681, (1991), и патентной заявке N 07/842,444, поданной 27 февраля 1992, содержание которых включено здесь для отсылки к их приоритету. По этому способу β- лактамы (VI) получают с высоким выходом при чрезвычайно высокой энантиомерной чистоте. Схема 1 (см. в конце описания) иллюстрирует синтез хирального β-лактама. На схеме 1, R* обозначает хиральный вспомогательный радикал, который может быть (-)-транс-2-фенил-1-циклогексилом, (-)-10-дициклогексилсульфамоил-D-изоборнилом или (-)-ментилом, TMS обозначает триметилсилильный радикал; основанием является литий диизопропиламид или литий гексаметилдисилазид; и C и R1 - определены выше. Удаление 4-метокси фенильной группы из N- положения (VI), с получением β- лактамов (VI) осуществляют обработкой церийаммонийнитратом (ЦАН).
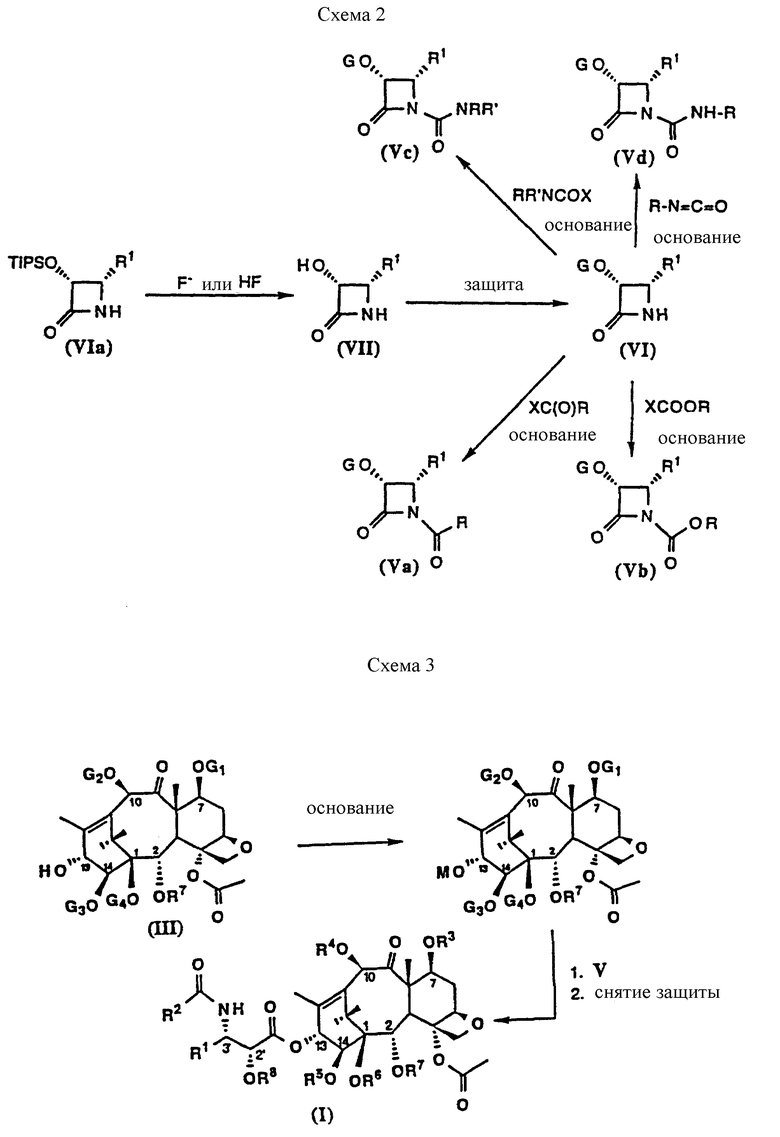
Что касается схемы 2, β- лактамы (VIa), где G представляет триизопропилсилил (TIPS-ТИПС), могут быть преобразованы в 3-гидрокси- β- лактамы (VII), с последующей защитой такими группами, как этоксиэтил (ЭЭ) или триэтилсилил (ТЭС), с получением β- лактамов (VI). Защитные группы могут быть присоединены к гидроксильной группе β- лактамов (VI) способами, которые обычно известны специалистам в данной области. β- лактамы (VI), где G представляет (трет-бутил)диметилсилил (ТБДМС), могут быть напрямую получены путем хиральной енолят-иминной циклоконденсации, описанной выше. β-лактамы (VI) могут взаимодействовать с ацилхлоридами, хлорформиатами и карбамоилхлоридами в присутствии основания с получением β- лактамов (V). β- лактамы (V) могут взаимодействовать с баккатином (III) или (IV).
Схемы 3 и 4 (см. в конце описания) иллюстрируют взаимодействие β- лактамов (V) с баккатинами (III) или (IV) в присутствии основания с последующим снятием защиты, приводящее к новым таксанам (I) или (II), соответственно с высоким выходом.
Получаемые таким образом таксаны представлены формулами (I) и (II), показанными выше. В большинстве случае значения R1-R8 - такие, как определено выше. R1, R2, и R, каждый, независимо, представляет линейный алкильный радикал, содержащий от 1 до 10 углеродных атомов, линейный или разветвленный алкенильный радикал, содержащий от 2 до 10 углеродных атомов, или линейный или разветвленный алкинильный радикал, содержащий от 2 до 10 углеродных атомов, циклоалкильный радикал, содержащий от 3 до 10 углеродных атомов, гетероциклоалкильный радикал, содержащий от 3 до 10 углеродных атомов, циклоалкенильный радикал, содержащий от 3 до 10 углеродных атомов, гетероциклоалкенильный радикал, содержащий от 3 до 10 углеродных атомов, полициклоалкильный радикал, содержащий от 3 до 20 углеродных атомов, арильный радикал, содержащий от 6 до 20 углеродных атомов, гетероарильный радикал, содержащий от 3 до 15 углеродных атомов.
или R2 может также быть RO-, RS- или RR'N-радикалом, в котором R - указан выше,
R' представляет водород или может также быть P, как определено выше, R и R' могут быть связаны с образованием циклической структуры, содержащей от 2 до 10 углеродных атомов.
R3, R4, R5 или R6, каждый, независимо, представляют водород или ацильный радикал, имеющий от 1 до 20 углеродных атомов, или R - такой, как определено выше, или защитная группа гидроксила,
R7 обозначает ациальную группу, имеющую от 1 до 20 углеродных атомов,
R8 обозначает водород или защитную группу гидроксила. Гетероароматические группы могут также включать атомы кислорода, азота и серы. Кроме того, в формулах (I) и (II), приведенных выше, R3 может быть водородом или G1, R4 может также быть водородом или G2, R5 может также быть водородом или G3, R6 может также быть водородом или G4, и R8 может также быть водородом или G, где G, G1, G2, G3 и G4 указаны выше.
Каждый радикал в R1, R2 и R, как указано выше, может необязательно быть замещенным одной или более группой галоген, гидроксил, амино, меркапто, циано, карбокси, алкокси, алкиламино, диалкиламино, алкилтио, алкоксикарбокси, где указанный алкильный радикал содержит от 1 до 15 углеродных атомов, арилокси, арилтио, арилоксикарбонил, в которых указанный арильный радикал содержит от 6 до 20 углеродных атомов, или гетероарилтио, гетероарилоксикарбонил, в которых указанный гетероарильный радикал содержит от 3 до 15 углеродных атомов.
При одном осуществлении
R1 может также представлять алкильный радикал, выбранный из группы, содержащей метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, изопентил, неопентил, гексил, изогексил, гептил, изогептил, октил, изооктил, циклогексилметил, циклогексилэтил, бензил, фенилэтил, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и адамантил, или алкенильный радикал, выбранный из группы, содержащей винил, аллил, 2-фенилэтенил, 2-фурилэтенил, 2-пирролилэтенил, 2-пиридилэтенил, 2-тиенилэтил, или незамещенный или замещенный алкильный радикал, выбранный из группы, содержащей этинил и пропаргил, или арильный радикал, выбранный из группы, содержащей фенил, толил, 4-метоксифенил, 3,4-диметоксифенил, 4-фторфенил, 4-трифторметилфенил, 4-хлорфенил и нафтил, или гетероарильный радикал, выбранный из группы, содержащей фурил, пирролил и пиридил, или циклоалкенильный радикал, выбранный из группы, содержащей циклопентенил, циклогексенил и циклогептенил, или гетероциклоалкильный радикал, выбранный из группы, содержащей оксиранил, пирролидинил, пиперидинил, тетрагидрофурил и тетрагидропиранил, или гетероциклоалкенильный радикал, выбранный из группы, содержащей дигидрофурил, дигидропирролил, дигидропиранил и дигидропиридил,
R2 представляет незамещенный или замещенный алкил, алкенил, алкинил, арил или гетероарил, выбранный из группы, содержащей фенил, толил, 4-трифторфенил, 4-хлорфенил, 4-метоксифенил, бифенил, 1-нафтил, 2-нафтил, изопропил, изобутил, неопентил, гексил, гептил, циклогексил, циклогексилметил, бензил, фенилэтил, фенилэтенил, кротил, аллил, винил, пропаргил, пиридинил, фурил, тиенил, пирролидинил и пиперидинил,
или R2 обозначает RO, RS- или RR'N-, где R представляет незамещенный или замещенный алкильный радикал, выбранный из группы, содержащей метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, изопентил, неопентил, гексил, изогексил, гептил, изогептил, октил, изооктил, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и адамантил, или алкенильный радикал, выбранный из группы, содержащей винил и алкил, или арильный радикал, выбранный из фенила и нафтила, или гетероарильный радикал, выбранный из группы, содержащей фурил, пирролил и пиридил, или циклоалкенильный радикал, выбранный из группы, содержащей циклопентенил, циклогексенил и циклогептенил, или гетероциклоалкильный радикал, выбранный из группы, содержащей оксиранил, тетрагидрофурил, пирролидинил, пиперидинил и тетрагидропиранил, или гетероциклоалкенильный радикал, выбранный из группы, содержащей дигидрофурил, дигидропирролил, дигидропиранил, дигидропиридил, R' обозначает водород или R - такой, как определено, выше, циклический RR'N - обозначает радикал, включающий азиридино, азетидино, пирролидино, пиперидино или морфолино группу, где указанная защитная группа гидроксила выбрана из группы, содержащей метоксиметил, метоксиэтил, 1-этоксиэтил, бензилоксиметил, (β- триметилсилилэтокси)метил, тетрагидропиранил, 2,2,2-трихлорэтоксикарбонил, бензилоксикарбонил, трет-бутоксикарбонил, 9-флуоренилметоксикарбонил, 2,2,2-трихлорэтоксиметил, триметилсилил, триэтилсилил, трипропилсилил, диметилэтилсилил, диметил(трет-бутил)силил, диэтилметилсилил, диметилфенилсилил и дифенилметилсилил,
указанный ацил выбран из группы, содержащей ацетил, хлорацетил, дихлорацетил, трихлорацетил и трифторацетил, пропаноил, бутаноил, пентаноил, гексаноил, гептаноил, циклогексанкарбонил, октаноил, нонаил, деканоил, ундеканоил, додеканоил, бензоил, фенилацетил, нафталинкарбонил, индолацетил, метоксикарбонил, этоксикарбонил, пропоксикарбонил и бутоксикарбонил, и
R5 и R6 образуют циклическую структуру с двумя кислотными атомами скелета указанного таксана, где указанная циклическая структура выбрана из группы, содержащей карбонат, метилацеталь, этилацеталь, пропилацеталь, бутилацеталь, фенилацеталь, диметилкеталь, диэтилкеталь, дипропилкеталь и дибутилкеталь.
По другому осуществлению R1 может обозначать фенил, толил, 4-метоксифенил, 3,4-диметоксифенил, 4-фторфенил, 4-трифторметилфенил, 4-гидроксифенил, 1-нафтил, 2-нафтил, пиридил, фурил, тиенил, пирролил, N-метилпирролил, 2-фенилэтенил, 2-фурилэтенил, 2-пиридилэтенил, 2-тиенилэтенил, 2-фенилэтенил, 2-фурилэтенил, 2-пиридилэтенил, 2-тиенилэтенил, 2-фенилэтил, 2-циклогексилэтил, циклогексилметил, изобутил или циклогексил,
R2 выбран из группы, содержащей фенил, толил, 4-фторфенил, 4-хлорфенил, 4-метоксифенил, бифенил, 1-нафтил, 2-нафтил, изопропил, изобутил, неопентил, гексил, гептил, циклогексил, циклогексилметил, бензил, фенилэтил и фенилэтенил,
или R2 представляет RO-, где R выбран из группы, содержащей метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, изопентил, неопентил, гексил, изогексил, циклогексил, фенил, бензил и 9-флуоренилметил.
или R2 обозначает RR'N-, выбранный из группы, содержащей метиламино, этиламино, пропиламино, изопропиламино, бутиламино, изобутиламино, трет-бутиламино, неопентиламино, циклогексиламино, фениламино или бензиламино, диметиламино, диэтиламино, дипропиламино, дибутиламино, дипентиламино, дигексиламино, дициклогексиламино, метил(трет-бутил)амино, циклогексил(метил)амино, метил(фенил)амино, пирролидино, пиперидино или морфолино группы,
R3 и R4 выбраны из группы, содержащей водород, ацетил, хлорацетил, дихлорацетил, трихлорацетил и трифторацетил, бензоил, фенилацетил, акрилоил и кротил, циннамоилаллил, бензил, метоксиметил, метоксиэтил, 1-этоксиэтил, тетрагидропиранил, 2,2,2-трихлорэтоксикарбонил, бензилоксикарбонил, трет-бутоксикарбонил, 9-флуоренилметоксикарбонил, триметилсилил, триэтилсилил, (трет-бутил)диметилсилил.
R5 выбран из группы, содержащей водород, ацетил, хлорацетил, аллил, бензил, акрилоил и циннамоил и R6 обозначает водород,
где R5 и R6 связаны с образованием циклической структуры, выбранной из группы, содержащей карбонил, пропилиден, бутилиден, пентилиден, фенилметилиден, диметилметилиден, диэтилметилиден, дипропилметилиден, дибутилметилиден, метоксиметилиден, этоксиметилиден, метилен, этилен и пропилен,
R7 выбран из группы, содержащей бензоил и циклогексанкарбонил,
R8 выбран из группы, содержащей водород, 1-этоксиэтил, 2,2,2-трихлорэтоксикарбонил, триметилсилил, триэтилсилил и трет-бутилдиметилсилил.
представители защитных групп гидроксила включают метоксиметил (МОМ), метоксиэтил (МЭМ), 1-этоксиэтил (ЭЭ), бензилоксиметил, ( β-триметилсилилэтокси)метил, тетрагидропиранил, 2,2,2-трихлорэтоксикарбонил (Трок), бензилоксикарбонил (КБЗ), трет-бутоксикарбонил (т-ВОС), 9-флуоренилметоксикарбонил (ФМОК), 2,2,2-трихлорэтоксиметил, триметилсилил, триэтисилил, трипропилсилил, диметилэтилсилил, диметил(трет-бутил)силил, диэтилметилсилил, диметилфенилсилил и дифенилметилсилил, ацетил, хлорацетил, дихлорацетил, трихлорацетил или трифторацетил.
Реакция взаимодействия баккатина (III) и (IV) и β- лактама (V), как показано на схемах 3 и 4, протекает по алкоксиду щелочного металла, расположенному на гидроксильной группе у C-13 баккатина (III) или на гидроксильной группе у C-14 баккатина (IV). Алкоксид легко может быть получен взаимодействием баккатина с основанием щелочного металла.
Характерные основания щелочных металлов включают натрий гексаметилдисилазид, калий гексаметилдисилазид, литий гексаметилдисилазид, натрий диизопропиламид, калий диизопропиламид, литий диизопропиламид, гидрид натрия, в сухом апротонном органическом растворителе. Используемыми апротонными органическими растворителями являются: тетрагидрофуран (ТГФ), диоксан, диэтиловый эфир, диметоксиэтан (ДМЭ), диглим, диметилформамид (ДМФ) или смеси этих растворителей с гексаном, толуолом и ксилолом. Реакцию взаимодействия предпочтительно проводят в интервале температур около от -100oC до 50oC и, более предпочтительно, около от -50oC до 25oC.
Реакцию взаимодействия предпочтительно проводить в атмосфере инертного газа, такого как азот или аргон. Количество используемого в реакции основания предпочтительно составляет около эквивалента по отношению к количеству баккатина, когда применяются такие растворимые основания, как натрий гексаметилдисилазид, калий гексаметилдисилазид, литий гексаметилдисилазид, натрий диизопропиламид, калий диизопропиламид, литий диизопропиламид. Использование незначительного избытка основания не оказывает неблагоприятного воздействия на реакцию. Когда используются гетерогенные основания, такие как гидрид натрия и гидрид калия, предпочтительно использовать 5 - 10 эквивалентов основания по отношению к количеству баккатина.
Реакцию взаимодействия по алкоксиду металла баккатина обычно проводят добавлением раствора β-лактама в сухом апротонном органическом растворителе, как описано выше предпочтительно в области температур около -100oC до 50oC и более предпочтительно, около от -50oC до 25oC. Смесь реагентов перемешивают в течение от 15 минут до 24 часов и течение и завершение реакции можно контролировать известными способами, такими как тонкослойная хроматография (ТСХ). После этого, как лимитирующий реагент полностью израсходован, реакцию прерывают добавлением охлажденного раствора соли. Сырую реакционную смесь обрабатывают, используя стандартные методы выделения, обычно хорошо известные специалисту в данной области с получением соответствующего таксана. Отношение β-лактама к баккатину находится в интервале от 2 : 1 до 1 : 2. Для большей экономичности и эффективности, более предпочтительно, чтобы соотношение составляло около 1 : 1, но это соотношение не является для реакции критическим. Под обработкой подразумевается любой общеизвестный способ, используемый для выделения продукта из реакционной смеси.
Защитные группы гидроксида могут быть затем удалены использованием стандартных методик, которые обычно хорошо известны специалистам в данной области, что дает желаемые производные таксана. Например, 1-этоксиэтильные и триэтилсилильные группы могут быть удалены добавлением 0,5 н. HCl при комнатной температуре в течение 36 часов. Группа Трок может быть удалена добавлением цинка и уксусной кислоты в метаноле при 60oC в течение одного часа без затрагивания других функциональных групп или скелета таксана. Другой способ снятия защиты состоит в обработке триизопропилсилила (ТИПС) или (трет-бутил)диметилсилила (ТБДМС) групп фторид-ионом.
Соединения по настоящему изобретению могут входить в состав фармацевтических препаратов и в виде их фармацевтически приемлемых солей, в частности, в виде нетоксичных фармацевтически приемлемых солей присоединения кислот или приемлемых солей оснований. Эти соли могут быть получены из соединений по изобретению обычными химическими методами.
Обычно, соли получают взаимодействием свободного основания или кислоты со стехиометрическими количествами или с избытком желаемой солеобразующей неорганической или органической кислоты в подходящем растворителе или в разнообразных сочетаниях растворителей. Например, свободное основание может быть растворено в водном растворе соответствующей кислоты и соль выделяют стандартными методами, например, упариванием раствора. Альтернативно, свободное основание может быть растворено в органическом растворителе, таком как низший спирт, диэтиловый эфир, сложный алкиловый эфир или в их смесях, например, метанол, этанол, диэтиловый эфир, этилацетат, раствор этилацетата-диэтилового эфира и тому подобные, после чего его обрабатывают подходящей кислотой для получения соответствующей соли. Соль выделяют, используя стандартные методики выделения, например, фильтрацией желаемой соли при самопроизвольном выделении из раствора, или соль может быть осаждена добавлением растворителя, в котором она нерастворима, и выделена оттуда.
Благодаря своей антинеопластической активности, производные таксана по изобретению могут использоваться при лечении рака. Новые соединения назначаются в виде таблеток, пилюль, порошковых смесей, капсул, инъекций, растворов, суппозиториев, эмульсий, дисперсий, пищевых добавок и других подходящих форм. Фармацевтический состав, содержащий соединение, обычно смешивают с нетоксичным фармацевтическим органическим носителем, обычно около 0,01 мг - 2500 мг, или больше, на единицу дозировки, предпочтительно 50 - 500 мг. Характерными фармацевтически приемлемыми носителями являются, например, маннитол, мочевина, декстрины, лактоза, картофельный и кукурузный крахмалы, стеарат магния, тальк, растительные масла, полиалкиленгликоли, этилцеллюлоза, поли(винилпирролидон), карбонат кальция, этил олеат, изопропилмиристат, бензилбензоат, карбонат натрия, желатин, карбонат калия, кремниевая кислота и другие обычно используемые приемлемые носители. Фармацевтический состав может также содержать нетоксичные вспомогательные соединения, такие как эмульгаторы, консерванты, увлажняющие агенты и тому подобные, например, сорбитан монолаурат, триэтаноламин олеат, полиоксиэтилен моностеарат, глицерил трипальмитат, диоктил натрий сульфосукцинат и тому подобное.
Соединения изобретения могут также быть высушены замораживанием, при желании, объединены с другими фармацевтически приемлемыми наполнителями с целью получения составов, удобных для парентерального, инъекционного введения. Для такого введения состав может снова быть разведен в воде (обычной, в физиологическом растворе) или смеси воды и органического растворителя, такого как пропилен гликоль, этанол и тому подобного.
Вводимая доза, будь то разовая доза, многократная доза или суточная доза, конечно, будет меняться в зависимости от конкретного вводимого соединения по изобретению, в связи с различной активностью соединения, выбранным способом введения, массой реципиента и характером состояния пациента. Величины вводимых доз не имеют определенных ограничений, но для достижения желаемых фармакологических и физиологических эффектов это обычно должно быть эффективное количество, то есть эквивалентное в молярном отношении физиологически активной свободной форме, получаемой из дозированного состава в результате метаболического высвобождения активного лекарственного средства.
Следующие неограничивающие примеры иллюстрируют настоящее изобретение. Полный объем изобретения определен формулой изобретения, следующей за описанием.
Примеры
β-лактамы (VI) получены как показано на схеме 1, способом хиральной енолят-иминной циклоконденсации, в котором силилоксиацетаты (A) подвергались взаимодействию с иминами или альдиминами (B) и (B') в присутствии основания, такого как литий диизопропиламид или литий гексаметилдисилазид. Способы получения исходных соединений (A) и (B) или (B') описаны в примерах 1 - 12. Соединения, используемые в примерах 1 - 12 для получения соединений (A), (B) и (B'), являются коммерчески доступными.
Пример 1. Получение (-)-(1R,2S)-2-фенил-1- циклогексилтриизопропилсилилоксиацетата (A).
Раствор (-)-(1R,2S)-2-фенил-1-циклогексил гидроксиацетата (851 мг, 3,63 ммоль) получают путем этерификации бензилоксиацетилхлорида (-)-(1R,2S)-2-фенил-1-циклогексаном с последующим гидрированием. Затем триизопропилсилилхлорид (840 мг, 4,36 ммоль) и имидазол (618 мг, 9,08 ммоль) в диметилформамиде (ДМФ) (1,7 мл) перемешивают при комнатной температуре 12 - 20 часов. Смесь выливают в пентан (25 мл) и промывают водой и раствором соли. Объединенные органические слои сушат над безводным MgSO4 и концентрируют в вакууме. Сырой продукт очищают на короткой силикагелевой колонке, используя гексан/хлороформ (3/1) в качестве элюента, что дает чистый (-)-(1R,2S)-2-фенил-1-циклогексилтриизопропилсилилоксиацетат (1,35 г, 95% выход) в виде бесцветного масла.
Ниже приведены данные по идентификации вышеприведенного триизопропилсилилокси-ацетата.
[α]
Данные анализа: рассчитано для C23H38O3: C 70,72, H 9,81.
Найдено: C 70,79, H 9,85.
Примеры 2 - 4. Получение N-триметилсилилиминов (B)
N-Триметилсилилальдимины, используемые в способе циклоконденсации, легко могут быть получены взаимодействием литийгексаметилдисилазидом с альдегидами. Типичный способ получения -триметилсилилбензальдимина описан ниже.
К 75 мл безводного ТГФ добавляют 17,29 мл (75 ммоль) гексаметилдисилазана и 30 мл (75 ммоль) N-бутиллития (2,5 М в гексане) при 0oC в атмосфере азота. После перемешивания в течение одного часа добавляют при комнатной температуре 7,65 мл (75 ммоль) бензальдегида и смесь нагревают до кипения с обратным холодильником 3 часа. Затем добавляют шприцом 9,52 мл (75 ммоль) свежеперегнанного триметилсилилхлорида. Смесь нагревают 2 ч при температуре кипения. Во время этого образуется белый осадок. Затем реакционную смесь охлаждают до комнатной температуры и жидкий слой переносят с помощью шприца в перегонную колбу в атмосферу азота. Растворитель упаривают в вакууме, и масляный остаток перегоняют при пониженном давлении (68oC/1 мм Hg), получая чистый N-триметил-силилбензальдимин в виде бледно-желтого масла (10,6 г, 80%), данные по идентификации которого приведены ниже:
1H ЯМР (CDCl3) δ 0,18 (с, 9H), 7,33 - 7,36 (м, 3H), 7,72 - 7,75 (м, 2H), 8,89 (с, 1H). 13C ЯМР (CDCl3) δ - 1,25, 128,34, 128,39, 131,96, 138,70, 168,32
N-триметилсилил(4-метокси)бензальдимин и N-триметилсилил(3,4-диметокси)бензальдимин получают аналогичным способом из 4-метоксибензальдегида и 3,4-диметоксибензальдегида, соответственно, с выходами 78 - 82%. Данные по идентификации иминов приведены немного ниже для каждого из этих соединений.
Пример 3. N-Триметилсилил(4-метокси)бензальдимин
Бледно-желтое масло: Т. кип. 105oC/0,4 мм рт.ст: 1H ЯМР (CDCl3) δ 0,00 (с, 9H), 3,60 (м, 3H), 6,69 (д, J = 8,7 Гц, 2H), 7,50 (д, J = 8,7 Гц, 2H), 8,66 (с, 1H).
Пример 4. N-Триметилсилил(3,4-диметокси)бензальдимин
Бесцветное масло: Т.кип. 140oC/0,2 мм H. 1H ЯМР (CDCl3) δ 0,00 (с, 9H), 3,67 (с, 3H), 3,71 (с, 3H), 6,65 (д, J = 8,2 Гц, 1H), 7,01 (дд, J = 8,2, 1,8 Гц, 1H), 7,22 (д, J = 1,8 Гц, 1H), 8,63 (с, 1H).
Примеры 5 - 12. Получение N-(4-Метоксифенил)альдиминов (B')
Описан типичный способ получения N-(4-метоксифенил) (4-фтор)бензальдимина. К раствору 4,8 г (39 ммоль) п-анизидина в 60 мл дихлорметана добавляют 4,85 г (39 ммоль) 4-фторбензальдегида. Смесь перемешивают над безводным сульфатом магния при комнатной температуре 15 часов. Осушитель отфильтровывают и фильтрат концентрируют в вакууме, получая сырой имин. Сырой имин перекристаллизуют из гексан/дихлорметан, получая 7,69 г (86%) чистого N-(4-метоксифенил)(4-фтор)бензальдимина в виде белых игольчатых кристаллов.
Ниже приведены данные по идентификации этого имина:
Т. пл. 99oC: 1H ЯМР (CDCl3) δ 3,82 (с, 3H), 6,92 (д, J = 8,7 Гц, 2H), 7,13 (т, J = 8,6 Гц, 2H), 7,21 (д, J = 8,7 Гц, 2H), 7,88 (дд, J = 8,6, 5,7 Гц, 2H), 8,39 (с, 1H).
Другие N-(4-метоксифенил)альдимины получены с высоким выходом аналогичным способом. Данные по идентификации этих иминов приведены ниже для каждого из этих соединений.
Пример 6. N-(4-Метоксифенил)бензальдимин
Белый твердый продукт, Т.пл. 71 - 72oC, 1H ЯМР (CDCl3) δ 3,93 (с, 3H), 6,93 (д, J = 8,8 Гц, 2H), 7,23 (д, J = 8,8 Гц, 2H), 7,46 (м, 3H), 7,87 (м, 2H), 8,48 (с, 1H).
Пример 7. N-(4-Метоксифенил) (4-трифторметил)бензальдимин
Белые иглы, т.пл. 124oC, 1H ЯМР (CDCl3) δ 3,81 (с, 3H), 6,91 (д, J = 8,8 Гц, 2H), 7,15 (д, J = 8,8 Гц, 2H), 7,75 (д, J = 8,6 Гц, 2H), 8,10 (д, J = 8,6 Гц, 2H), 8,39 (с, 1H).
Пример 8. N-(4-Метоксифенил)фурфуральдимин
Желтый чешуйки, т. пл. 68 - 70oC, 1H ЯМР (CDCl3) δ 3,82 (с, 3H), 6,54 (дд, J = 3,5, 1,8 Гц, 1H), 6,90 (д, J = 3,5 Гц, 1H), 6,92 (д, J = 8,9 Гц, 2H), 7,26 (д, J = 8,9 Гц, 2H), 7,59 (д, J = 1,8 Гц, 1H), 8,31 (с, 1H).
Пример 9. N-(4-Метоксифенил)-1-фенилпропенальдимин
Желтые лепестки, т. пл. 119 - 121oC, 1H ЯМР (CDCl3) δ 3.81 (с, 3H), 6.90-7.60 (м, 7H), 8,28 (м, 1H) (около 1:1 смесь стереоизомеров).
Пример 10. N-(4-Метоксифенил)-3-(2-фурил)-пропенальдимин
Желтые иглы: т.пл. 71-73oC.
1H ЯМР (CDCl3) δ 3.78 (с, 3H), 6.45 (дд, J = 3.4, 1.6 Гц, 1H), 6.52 (д, J = 3.4 Гц, 1H), 6.87 (д, J = 15.8 Гц, 1H), 6.90 (д, J = 8.9 Гц, 2H), 6.98 (дд, J = 15.8, 8.7 Гц, 1H), 7.18 (д, J = 8.9 Гц, 2H), 7.46 (д, J = 1.6 Гц, 1H), 8.20 (д, J = 8.7 Гц, 1H).
Пример 11. N-(4-Метоксифенил)-3-метилбутанальдимин
Желтое масло: 1H ЯМР (CDCl3) δ 1.02 (д, J = 6.7 Гц, 6H), 2.03 (м, 1H), 2.33 (дд, J = 6.9, 5.3 Гц, 2H), 3.78 (с, 3H), 6.86 (д, J = 8.8 Гц, 2H), 7.03 (д, J = 8.8 Гц, 2H), 7.86 (т, J = 5.3 Гц, 1H).
Пример 12. N-(4-Метоксифенил)циклогексилацетальдимин
Желтое масло: 1H ЯМР (CDCl3) δ 1.00-1.80 (м, 11H), 2.34 (дд, J = 6.7, 5.4 Гц, 2H), 3.79 (с, 3H), 6.86 (д, J = 8.9 Гц, 2H), 7.02 (д, J = 8.9 Гц, 2H), 7.86 (т, J = 5.4 Гц, 1H), ИК (не разбавлен) 3033-2849, 1505, 1244, 1038, 803 см-1.
С целью получения 4-замещенных-2-азатидинонов (VI) и (VI') проведены реакции хиральной енолят-иминной циклоконденсации, показанные на схеме 1. Другие азетидиноны, имеющие различные заместители на R1, получены по следующим аналогичным методикам, приведенным в примерах 13 и 15. Данные идентификации этих азетидинонов показаны в примерах 14 и 16-20, соответственно.
Примеры 13-14. Получение (3R,4S)-3-силилокси-4-замещенных-2-азетидинонов (VI)
Описан типичный способ получения (3R,4S)-3-триизопропилсилилокси-4-фенил-2-азетидинона (VIa). К раствору 645 мкл (4,6 ммоль) диизопропиламина в 10 мл ТГФ, добавляют 1,85 мл (4,6 ммоль, 2,5 М) н-бутиллития при 0oC. Раствор перемешивают 1 ч при 0oC и впоследствии добавляют 1,5 г (3,8 ммоль) (-) ТИПС сложного эфира в 15 мл ТГФ за 1 час (используя трубку) при -78oC. Реакционную смесь перемешивают 2 часа при этой температуре и затем добавляют за 2 ч 817 мг (4,6 ммоль) N-триметилсилилбензальдимина в 15 мл ТГФ при -95oC. Реакционную смесь перемешивают при этой температуре в течение ночи и дают медленно нагреться до комнатной температуры. Реакцию прерывают добавлением насыщенного охлажденного NH4Cl. Водный слой экстрагируют диэтиловым эфиром. Органический слой промывают 3% HCl и раствором соли, сушат над MgSO4 и концентрируют. Сырое масло чистят хроматографически на силикагеле, используя 1:5 EtOAc/гексан в качестве элюента, и получают 1,03 г (84%) (3R,4S)-3-триизопропилсилилокси-4-фенил-2-азетидинона (VIa) в виде белого твердого вещества.
Данные по идентификации (VIa) приведены ниже:
Т.пл. 76-77oC.
[α]
Элементный анализ, рассчитано для C18H29NO2Si: C 67.66, H 9.15, N 4.38. Найдено: C 67.64, H 9.25, N 4.44.
Пример 14. (3R,4S)-3-Триизопропилсилилокси-4-(2-фенил- этенил))-2-азетидинон (VIb)
72%: бесцветная жидкость:
1H ЯМР (300 МГц, CDCl3) δ 0.98-1.02 (м, 21H), 4.36 (дд, J = 4.6, 8.3 Гц, 1H), 5.09 (дд, J = 2.3, 4.6 Гц, 1H), 6.29 (дд, J = 8.3, 16.0 Гц, 1H), 6.59 (д, J = 16.0 Гц, 1H), 6.83 (ушир.с, 7.23-7.39 (м, 5H), 13C ЯМР (75 МГц, CDCl3) δ 11.79, 17.61, 17.66, 58.34, 79.86, 126.05, 126.45, 127.90, 128.56, 134.41, 136.30, 169.69, ИК (не разбавл.) 3262, 3032, 2944, 2865, 1748, 1672, 1623 см-1.
Элементный анализ, рассчитано для C20H31NO2Si: C 69.52, H 9.04, N 4.05. Найдено: C 69.75, H 9.02, N 3.89.
Примеры 15-20. Получение (3R,4S)-1-(4-метоксифенил)-3- силилокси-4-замещенных-2-азетидинонов (VI')
К раствору 2.51 ммоль диизопропиламина в 15 мл ТГФ добавляют 2.51 мл н-бутиллития (2,5 М в ТГФ) при -10oC. Через 30 мин образуется литийдиизопропиламид (ЛДА) и раствор охлаждают до -95oC. Добавляют раствор 2.17 ммоль хирального сложного эфира в 5 мл ТГФ. Через 1 ч добавляют 2.5 ммоль соответствующего имина в 3 мл ТГФ. Смесь перемешивают при -95oC в течение ночи, и протекание реакции контролируют методами ТСХ или 1H ЯМР. Реакцию прерывают добавлением насыщенного охлажденного NH4Cl и ТГФ удаляют с помощью роторного испарителя. Добавляют диэтиловый эфир (10 мл) и водный слой экстрагируют диэтиловым эфиром (10 мл х 3). Высушивание и удаление растворителя дают сырой продукт, который чистят колоночной хроматографией на силикагеле (гексан) этилацетат = 10: 1), получая соответствующий чистый β лактам. Энантиомерный избыток установлен применением ВДЖХ с использованием колонки CHIRAL'CEL OD и смеси н-гексан/изопропиловый спирт (изо-PrOH) (90/10) в качестве элюента.
Пример 15. (3R, 4S)-4-(изобутил)-1-(4-метоксифенил)-3- триизопропилсилилокси-2-азетидинон (VI'-c)
87%: бледно-желтое твердое вещество. Т.пл. 59-60oC: [α]
Элементный анализ, рассчитано для C23H39NO3Si: C 68.10, H 9.70, N 3.45. Найдено: C 68.26, H 9.85, N 3.35.
Пример 16. (3R,4S)-4-(Циклогексилметил)-1-(4-метоксифенил)-3- триизопропилсилилокси-2-азетидинон (VI'-d)
83%: низкоплавкий твердый продукт:
[α]
Элементный анализ, рассчитано для C26H43NO3Si: C 70.06, H 9.72, N 3.14. Найдено: C 69.91, H 9.71, N 3.02.
Пример 17. 1-(4-Метоксифенил)-3-триизопропилсилилокси-4- (4-фторфенил)-2-азетидинон (VI'-f)
Белый твердый продукт: Т.пл. 121-122oC.
[α]
Элементный анализ, рассчитано для C25H34NO3FSi: C 67.69, H 7.72, N 3.16. Найдено: C 67.77, H 7.83, N 3.19.
Пример 18. 1-(4-Метоксифенил)-3-триизопропилсилилокси-4- (4-трифторметилфенил)-2-азетидинон (VI'-g)
Белый твердый продукт: Т.пл. 132-133oC.
[α]
Элементный анализ, рассчитано для C26H34NO3F3Si: C 63.26, H 6.94, N 2.84. Найдено: C 63.36, H 7.13, N 2.88.
Пример 19. 1-(4-Метоксифенил)-3-триизопропилсилилокси- 4-(2-фурил)-2-азетидинон (VI'-h)
Белый твердый продукт, Т.пл. 109-110oC.
[α]
Элементный анализ для C23H33NO4Si:
C 66.47, H 8.00, N 3.37. Найдено: C 66.56, H 8.13, N 3.30.
Пример 20. 1-(4-Метоксифенил)-3-триизопропилсилилокси-4- { 2-(2-фурил)этенил}-2-азетидинон (VI'-i)
Белый твердый продукт. Т.пл. 103,5-105.5oC.
[α]
12.11, 17.70, 17.74, 55.54, 61.94, 77.18, 78.45, 107.88, 108.42, 111.26, 114.54, 118.70, 123.46, 123.82, 142.46, 190.99, ИК (KBr) 2948, 2866, 1743, 1513, 1389, 1246, 1181, 1120 см-1.
Элементный анализ, рассчитано для C25H35NO4Si:
C 67.99, H 7.99, N 3.17. Найдено: C 68.07, H 7.94, N 3.10.
Превращение β-00 лактамовых промежуточных соединений (VI') в β-лактамы (VI), как показано на схеме 1, выполняют способами, описанными в примерах 21-23. Полученные таким образом азетидиноны, (VIc) - (VIj), служат примерами для различных R1 групп. Данные идентификации (VIc) - (VIj) приведены далее для каждого соединения.
Примеры 21-23. Преобразование N-(4-метоксифенил)- β- лактамов (VI') в β- лактамы (VI)
К раствору 0.24 ммоль 1-(4-метоксифенил)- β- лактама в MeCN (20 мл) добавляют за 20 мин при -15oC 0.65 ммоль церийаммонийнитрата (ЦАН) в 10 мл CH3CN и 20 мл воды. После перемешивания в течение 1 часа смесь разбавляют водой (20 мл) и затем экстрагируют этилацетатом (15 х 2). Объединенный органический слой последовательно промывают водой (7 мл), 5% Na2SO4 (10 мл х 2), 5% Na2CO3 (10 мл) и раствором соли (5 мл). Высушивание, удаление растворителя в вакууме и последующее обесцвечивание с помощью активированного угля приводит к сырому продукту. Этот продукт чистят затем колоночной хроматографией на силикагеле, используя гексан/этилацетат, 3/1 в качестве элюента, с получением β- лактама с удаленной N-защитой.
Пример 21. (3R, 4S)-4-(изобутил)-3-триизопропилсилилокси-2-азетидинон (VIc)
83%, желтое масло. [α]
Элементный анализ, рассчитано для C16H33NO2Si: C 64.16, H 11.1, N 4.68. Найдено: C 64.17, H 10.96, N 4.47.
Пример 22. (3R, 4S)-4-(Циклогексилметил)-3-триизопропилсилилокси- 2-азетидинон (VId)
85%, желтое масло, [α]
Элементный анализ, рассчитано для C19H37NO2Si:
C 67.20, H 10.98, N 4.12. Найдено: C 67.40, H 10.79, N 3.98.
Пример 23. Получение (3R,4S)-3-Триизопропилсилилокси-4- (2-циклогексилэтил)-2-азетидинон (VIj)
Смесь (VIb) (100 мг, 0.29 ммоль) в метаноле (10 мл) и 5% Ph-C катализатора (10 мг) гидрируют водородом при 50oC и 800 (800 фунт/кв.дюйм = 56,25 кг/см2) в течение 20 часов. Затем катализатор отделяют фильтрованием и растворитель упаривают в вакууме, остаток чистят на короткой колонке с силикагелем, используя гексан/этилацетат (5/1) в качестве элюента, и получают 95 мг (93% выход) VI в виде бесцветной жидкости: [α]
Элементный анализ, рассчитано для C27H39NO3Si: C 71.48, H 8.66, N 3.09. Найдено: C 71.35, H 8.66, N 3.01.
Преобразования 3-ТИПСО-4-замещенных-2-азетидинонов или β- лактамов VI в β- лактамы VII, как показано на схеме 2, осуществляют согласно способам получения, описанным в примерах 24-28. Данные по идентификации каждого β- лактама (VIIa) - (VIIe) приведены ниже в виде характеристик каждого соединения.
Примеры 24-28. Получение 3-гидрокси-4-замещенных-2-азетидинонов (VII)
К раствору 2.6 ммоль 3-триизопропилсилилокси-4-замещенного-2- азетидинона в 20 мл ТГФ добавляют при комнатной температуре 3.1 ммоль (1М в ТГФ) н-бутилфторида (NBu4F). Через 5 ч растворитель упаривают и сырое масло непосредственно очищают хроматографией на силикагеле, используя EtOAc (гексан элюент, с получением 3-гидрокси-4-замещенного-2-азетидинона.
Пример 24. (3R,4S)-3-Гидрокси-4-фенил-2-азетидинон (VIIa)
100%, белый твердый продукт, т. пл. 189-190oC, [α]
Элементный анализ, рассчитано для C9H9NO2:
C 66.25%, H 5.65%, N 8.58%. Найдено: C 66.42%, H 5.74%, N 8.62%.
Пример 25. (3R,4S)-3-Гидрокси-4-(2-фенилэтенил)-2-азетидинон (VIIb)
82%, белый твердый продукт. т.пл. 143-144oC, [α]
Элементный анализ, рассчитано для C11H11NO2: C 69.83, H 5.86, N 7.40. Найдено: C 69.72, H 5.92, N 7.24.
Пример 26. (3R,4S)-3-Гидрокси-4-(изобутил)-2-азетидинон (VIIc)
94%, белый твердый продукт, Т.пл. 141-142oC, [α]
Элементный анализ, рассчитано для C7H13NO2: C 58.72, H 9.15, N 9.78. Найдено: C 58.55, H 9.41, 9.69.
Пример 27. (3R,4S)-4-(Циклогексилметил)-3-гидрокси-2-азетидинон (VIIo)
92%, белый твердый продукт, т.пл. 147-148oC, [α]
Элементный анализ, рассчитано для C10H17NO2: C 65.54, H 9.35, N 7.64. Найдено: C 65.72, H 9.46, N 7.42.
Пример 28. (3R,4S)-4-циклогексил-3-гидрокси-2-азетидинон (VIIe)
Суспензию 500 мг (3.06 ммоль) 4-фенил-3-гидрокси-2-азетидинон VIa и 15 мг Rh-C в 10 мл метанола нагревают в автоклаве при 90oC и 800 psi (56.25 кг/см2). Через 5 дней давление водорода падает и катализатор фильтруют на целите. Упаривание растворителя дает твердый продукт, который перекристаллизовывают из этилацетата, получая 440 мг (85%) VIe в виде белого твердого продукта: белый твердый продукт, т.пл. 140-140,5oC, [α]
Элементный анализ, рассчитано для C9H15NO2:
C 63.88, H 8.93, N 8.28. Найдено: C 63.70, H 9.00, N 8.06.
Только что полученные β- лактамы (VII) требуют защиты по гидроксильной группе. Защитные группы вводятся способами, описанными в примерах 29-33, при этом образуются β- лактамы (VI), данные по идентификации β- лактамов (VI), защищенных различными группами, приведены ниже после каждого соединения от (VIa-ЭЭ) до (VIe-ЕЕ).
Примеры 29-33. Получение 3-(гидроксизащищенных)-4-замещенных-2- азетидинонов (VI)
К раствору 1,9 ммоль 3-гидрокси-4-замещенного-2-азетидинона в 20 мл ТГФ добавляют при 0oC 3,9 ммоль этилвинилового эфира. После 2 ч при 0oC реакционную смесь разбавляют диэтиловым эфиром и промывают насыщенным NaHCO3. Органический слой сушат над Na2CO3, фильтруют и концентрируют, получая 3-(1-этоксиэтокси)-4-замещенный-2-азетидинон.
Пример 29. (3R,4S)-3-(1-Этоксиэтокси)-4-фенил-2-азетидинон (VIa-ЭЭ)
100%: белый твердый продукт, т.пл. 78-80oC, 1H ЯМР (CDCl3) (0.98 (д, J = 5.4 Гц), 1.05 (д, J = 5.4 Гц, 3H), (1.11 (т, J = 7.1 Гц), 1.12 (т, J = 7,1 Гц, 3H), (3.16-3.26 (м), 3.31-3.42 (м), 3.59-3.69 (м), 2H), (4.47 (д, J = 5.4 Гц), 4.68 (кв, J = 5.4 Гц), 1H), (4.82 (д, J = 4.7 Гц), 4.85 (д, J = 4.7 Гц), 1H), 5.17-5.21 (м, 1H), 6.42 (ушир.д, 1H), 7.35 (м, 5H), ИК (KBr) 3214, 2983, 2933, 1753, 1718, 1456 см-1.
Элементный анализ, рассчитано для C13H17NO3:
C 66.36, H 7.28, N 5.95. Найдено: C 66.46, H 7.11, N 5.88.
Пример 30. (3R, 4S)-3-1(Этоксиэтокси)-4-(2-фенилэтенил)-2- азетидинон (VIb-ЭЭ)
98%, белый твердый продукт, т.пл. 98-99oC, 1H ЯМР (300 МГц, CDCl3) δ (1.17 (т, J = 7,1 Гц), 1.18 (т, J = 7.1 Гц), 3H), (1.26 (д, J = 5.4 Гц), 1.35 (д, J = 5.4 Гц), 3H), (3.44-3.52 (м), 3.60-3.68 (м), 3.75-3.82 (м), 2H), 4.41 (дд, J = 4.9, 8.5 Гц, 1H), (4.81 (кв, J = 5.4 Гц), 4.90 (кв, J = 5.4 Гц), 1H), (5.11 (д, J = 4.9 Гц), 5.11 (д, J = 4.9 Гц), 1H), 6.01 (ушир. с, 1H), (6.27 (дд, J = 8.5, 15.9 Гц), 6.28 (дд, J = 8.5, 15.9 Гц), 1H), (6.61 (д, J = 15.9 Гц), 6.63 (д, J = 15.9 Гц), 1H), 7.27-7.42 (м, 5H), 13C ЯМР (75 МГц, CDCl3) δ 15.04, 20.37, 20.42, 57.22, 57.81, 61.23, 62.22, 78.77, 79.29, 99.50, 99.82, 125.56, 125.79, 126.59, 128.12, 128.65, 134.47, 134.58, 136.15, 168.59, 168.77, ИК (KBr) 3310, 3030, 1963, 1770 см-1.
Элементный анализ, рассчитано для C15H19NO3:
C 68.94, H 7.33, N 5.36. Найдено: C 69.13, H 7.44, N 5.16.
Пример 31. (3R,4S)-3-(1-Этоксиэтокси)-4-(изобутил)-2-азетидинон (VIc-ЭЭ)
100%, бесцветное масло, [α]
Пример 32. (3R,4S)-4-(Циклогексилметил)-3- (1-этоксиэтокси)-2-азетидинон (VIb-ЭЭ)
100%, бесцветное масло, [α]
Элементный анализ, рассчитано для C14H25NO3:
C 65.85, H 9.87, N 5.49. Найдено: C 66.03, H 9.71, N 5.30.
Пример 33. (3R,4S)-4-Циклогексил-3-(1-этоксиэтокси)-2-азетидинон (VIe-ЭЭ)
100%, белый твердый продукт, т.пл. 87-89oC, [α]
Элементный анализ, рассчитано для C13H27NO3:
C 64.70, H 9.61, N 5.80. Найдено: C 64.82, H 9.66, N 5.64.
Защищенные β- лактамы (VI), в которых C представляет защитные группы, указанные в описании, подвергают взаимодействию с ацилхлоридами, хлорформиатами или карбамоилхлоридами в присутствии основания в соответствии со способами получения, описанными в примерах 34-52. Образующиеся β- лактамы, полученные в примерах 34-52, показаны на схеме 2. Данные идентификации β- лактамов (Va)-(Vd), в которых G представляет различные защитные группы, показаны далее в каждом примере, соответствующем конкретному соединению.
Пример 34. Получение 1-ацил-3-(гидрокси-защищенных)-4- замещенных-2-азетидинонов (Va)
Описан типичный способ синтеза (3R,4S)-1-бензоил-3-(этоксиэтокси)- 4-фенил-2-азетидинона (Va-ЭЭ). К раствору VIa-ЭЭ (460 мг, 1.9 ммоль) 4(диметиламино)пиридин ДМАП (5 мг), и триэтиламина (542 мл, 3,9 ммоль) в 20 мл дихлорметана, добавляют, при 0oC и перемешивании, по каплям бензоилхлорид (340 мл, 2.9 ммоль). Охлаждающую баню убирают и смесь перемешивают при 25oC 2 ч. Реакционную смесь промывают насыщенным водным NH4Cl и раствором соли сушат над безводным Na2CO3 и концентрируют в вакууме, получая маслянистый сырой продукт. Сырой продукт чистят на короткой колонке с силикагелем (элюент: EtOAc/гексан = 1/5), получая чистый Va-ЭЭ (611 мг, 92%) в виде бесцветного масла: ИК (не разбавл.) 3064-2933, 1798, 1682, 1450 см-1, 1H ЯМР (CDCl3) δ (1.04 (д, J = 5.4 Гц), 1.14 (д, J = 5.4 Гц)) 3H), 1.11-1.17 (м, 3H), 3.23-3.74 (м, 2H), (4.57 (кв, J = 5.4 Гц), 4.76 (кв, J = 5.4 Гц)) 1H), 5.28 (д, J = 6.2 Гц, 1H), (5.43 (д, J = 6.2 Гц), 5.46 (д, J = 6.2 Гц)) 1H), 7.30-7.65 (м, 8H).
Примеры 35-46. Получение 1-алкокси- и 1-арилоксикарбонил- 3-(гидроксизащищенных)-4-замещенных-2-азетидинонов (Vb)
К раствору 2.2 ммоль 3-(1-этокси)-4-замещенного-2-азетидинона, 5 мг ДМАП, 4.5 ммоль триэтиламина в 20 мл дихлорметана добавляют по каплям при 0oC 3.3 ммоль алкилхлорформиата, растворенного в 5 мл дихлорметана. Реакционную смесь перемешивают в течение ночи при комнатной температуре. Органический слой промывают несколько раз раствором соли, сушат над Na2CO3 и концентрируют. Сырой твердый продукт чистят хроматографически на силикагеле, получая N-защищенный β- лактам.
Пример 35. (3R,4S)-1-Метоксикарбонил-3-(1-этоксиэтокси)-4-фенил- 2-азетидинон (Vb-a-ЭЭ)
62%, бледно-желтое масло, [α]
Элементный анализ, рассчитано для C15H19NO5:
C 61.42, H 6.53, N 4.78. Найдено: C 61.55, H 6.51, N 4.90.
Пример 36. (3R,4S)-1-Этоксикарбонил-3-(1-этоксиэтокси)- 4-фенил-2-азетидинон (Vb-b-ЭЭ)
82%, бесцветное масло, [α]
Элементный анализ, рассчитано для C16H21NO5:
C 62.53, H 6.89, N 4.56. Найдено: C 62.45, H 6.63, N 4.83.
Пример 37. (3R,4S)-1-н-Бутоксикарбонил-3-(1-этоксиэтокси)- 4-фенил-2-азетидинон (Vb-c-ЭЭ)
83%, бесцветное масло, [α]
Элементный анализ, рассчитано для C18H25NO5:
C 64.46, H 7.51, N 4.18. Найдено: C 64.44, H 7.57, N 4.24.
Пример 38. (3R,4S)-1-трет-Бутоксикарбонил-3-(1-этоксиэтокси)-4- фенил-2-азетидинон (Vb-d-ЭЭ)
83%, белый твердый продукт, т.пл. 90-91oC, [α]
Элементный анализ, рассчитано для C18H25NO5:
C 64.46, H 7.51, N 4.18. Найдено: C 64.50, H 7.41, N 4.17.
Пример 39. (3R, 4S)-3-(1-Этоксиэтокси)-1-феноксикарбонил- 4-фенил-2-азетидинон (Vb-e-ЭЭ)
79%, белый твердый продукт, т.пл. 50-52oC, [α]
Элементный анализ, рассчитано для C20H21NO5:
C 67.59, H 5.96, N 3.94. Найдено: C 67.33, H 6.06, N 3.75.
Пример 40. (3R,4S)-3-(1-этоксиэтокси)-4-фенил-1- фенилметоксикарбонил-2-азетидинон (Vb-f-ЭЭ)
44%, белый твердый продукт, т.пл. 58-60oC, [α]
Элементный анализ, рассчитано для C21H23NO5:
C 68.28, H 6.28, N 3.79. Найдено: C 68.07, H 6.43, N 3.72.
Пример 41. (3R,4S)-1-трет-Бутоксикарбонил-4-циклогексил- 3-(1-этоксиэтокси)-2-азетидинон (Vb-g-ЭЭ)
91%, бесцветное масло, [α]
Элементный анализ, рассчитано для C18H31NO5: C 63.32, H 9.15, N 4.10. Найдено: C 63.15, H 8.97, N 3.96.
Пример 42. (3R,4S)-1-трет-Бутоксикарбонил-3-(1-этоксиэтокси)- 4-(2-фенилэтенил)-2-азетидинон (Vb-h-ЭЭ)
86%, бесцветный твердый продукт, т.пл. 69-73oC, 1H ЯМР (300 МГц, CDCl3) δ (1.16 (т, J = 7.1 Гц), 1.18 (т, J = 7.1 Гц), 3H), (1.25 (д, J = 5.4 Гц), 1.36 (д, J = 5.4 Гц), 3H), 1.48 (с, 9H), (3.47 (м), 3.62 (м), 3.80 (м), 2H), 4.68 (дд, J = 5.8, 8.8 Гц, 1H), (4.82 (кв J = 5.4 Гц), 4.91 (кв, J = 5.4 Гц), 1H), (5.09 (д, J = 5.8 Гц), 5.11 (д, J = 5.8 Гц), 1H), (6.23 (дд, J = 8.8, 15.8 Гц), 6.25 (дд, J = 8.8, 15.8 Гц), 1H), (6.72 (д, J = 15.8 Гц), 6.73 (д, J = 15.8 Гц), 1H), 7.27-7.44 (м, 5H), 13C ЯМР (75 МГц, CDCl3) δ 14.98, 20.31, 27.98, 60.24, 60.85, 61.46, 62.36, 63.58, 83.38, 99.63, 99.87, 122.45, 122.63, 126.69, 128.20, 128.61, 136.15, 136.34, 136.38, 147.74, 147.79, 165.33, 165.53, ИК (KBr) 3027, 3020, 2984, 2933, 1809, 1723 см-1.
Элементный анализ, рассчитано для C20H27NO5: C 66.46, H 7.53, N 3.88. Найдено: C 66.60, H 7.50, N 3.87.
Пример 43. (3R, 4S)-1-трет-Бутоксикарбонил-3-(1-этоксиэтокси)- 4-(изобутил)-2-азетидинон (Vb-i-ЭЭ)
80%, желтое масло, [α]
Элементный анализ, рассчитано для C16H29NO5:
C 60.93, H 9.27, N 4.44. Найдено: C 61.19, H 9.41, N 4.37.
Пример 44. (3R, 4S)-1-трет-Бутоксикарбонил-4- циклогексилметил-3-(1-этоксиэтокси)-2-азетидинон (Vb-j-ЭЭ)
93%, желтое масло, [α]
Элементный анализ, рассчитано для C19H33NO5: C 64.20, H 9.36, N 3.94. Найлено: C 64.00, H 9.17, N 4.02.
Примеры 45-50.
Получение 1-(N-монозамещенных-карбамоил)-3-(гидроксизащищенных)- 4-замещенных-2-азетидинонов (Vd)
К раствору 0,5 ммоль 3-(1-гидрокси-защищенного)-4-замещенного- 2-азетидинона (VI) в 6 мл тетрагидрофурана добавляют по каплям при -78oC 0,6 ммоль н-бутиллития (н-BuLi). Через 5 мин добавляют 1 ммоль изоцианата. Реакционную смесь перемешивают 30 мин при -78oC и реакцию прерывают добавлением 2 мл охлажденного насыщенного раствора NH4Cl. Реакционную смесь разбавляют 30 мл диэтилового эфира и органический слой промывают несколько раз раствором соли, сушат над Na2CO3 и концентрируют. Сырой твердый продукт чистят хроматографически на силикагеле, получая соответствующий N-карбамоил β- лактам (Vd).
Пример 45. (3R,4S)-3-(1-Бутокси)-1-фенилкарбамоил-4- фенил-2-азетидинон (Vd-a-ЭЭ)
66%, бледно-желтый твердый продукт, т.пл. 152-155oC, [α]
Элементный анализ, рассчитано для C20H22N2O4: C 67.78, H 6.26, N 7.90. Найдено: C 67.92, H 5.98, N 8.17.
Пример 46. (3R,4S)-1-трет-Бутокси-4-фенил-3-(1,1,1- трихлороэтоксикарбонил)-2-азетидинон (Vb-a-Трок)
Белый твердый продукт, т.пл. 122-124oC, [α]
(c 0.5, CHCl3), 1H ЯМР (250 МГц, CDCl3) δ 1.39 (с, 9H), 4.43 (д, J = 11.7 Гц, 1H), 4.55 (д, J = 11.7 Гц, 1H), 5.28 (д, J = 5.5 Гц, 1H), 5.76 (д, J = 5.5 Гц, 1H), 7.30 (м, 5H), 13C ЯМР (63 МГц, CDCl3) δ 27.81, 60.80, 77.03, 78.76, 84.40, 127.73, 128.58, 129.09, 131.55, 147.71, 152.17, 160.34, ИК (CHCl3) 3016, 2976, 1819, 1771, 1732, 1683, 1244 см-1.
Элементный анализ, рассчитано для C17H18Cl3NO6:
C 46.54, H 4.14, N 3.19. Найдено: C 46.33, H 4.34, N 3.33.
Пример 47. (3R,4S)-3-Ацетил-1-трет-бутоксикарбонил-4-фенил- 2-азетидинон (Vb-a-АЦ)
Белый твердый продукт, т.пл. 63-64oC, [α]
Элементный анализ, рассчитано для C6H19NO5:
C 62.94, H 6.27, N 4.59. Найдено: C 63.17, H 6.14, N 4.52.
Пример 48. (3R,4S)-1-трет-Бутилкарбамоил-3-(1-этоксиэтокси)-4- фенил-2-азетидинон (Vb-b-ЭЭ)
74%, бледно-желтое вязкое масло, [α]
Элементный анализ, рассчитано для C18H26N2O4:
C 64.65, H 7.84, N 8.38. Найдено: C 64.46, H 7.75, N 8.39.
Пример 49. (3R, 4S)-1-Бензилкарбамоил-3-(1-этоксиэтокси)-4- фенил-2-азетидинон (Vb-c-ЭЭ)
50%, бледно-желтое вязкое масло, [α]
Элементный анализ, рассчитано для C21H24N2O4:
C 68.46, H 6.57, N 7.60. Найдено: C 68.30, H 6.66, N 7.51.
Пример 50. (3R, 4S)-3-(1-Этоксиэтокси)-1-этилкарбамоил-4- фенил-2-азетидинон (Vo-d-ЭЭ)
63%, бледно-желтое масло, [α]
Примеры 51-52.
Получение 1-(N, N-дизамещенных-карбамоил)-3-(гидроксизащищенных)- 4-замещенных-2-азетидинонов (Vd)
Описан типичный способ получения (3R,4S)-(-)-1- морфолинкарбонил-3-(1-этоксиэтокси)-4-фенил-2-азетидинона (Vc-b). К раствору 30 мг (0.13 ммоль) 3-(1-этоксиэтокси)-4-фенил-2-азетидинона VIa-ЭЭ в 2 мл CH2Cl2 добавляют 2 мг ДМАП и 0.05 мл триэтиламина при комнатной температуре. Спустя 5 мин добавляют 22.9 мг (0.15 ммоль) морфолинкарбонилхлорида. Реакционную смесь перемешивают 2 ч при комнатной температуре. Реакционную смесь разбавляют 20 мл CH2Cl2 и органический слой промывают дважды раствором соли, сушат над Na2CO3 и концентрируют. Сырой твердый продукт чистят хроматографией на силикагеле, получая чистый VC-b: 87%, бледно-желтое масло, 1H ЯМР (250 МГц, CDCl3) δ (0.90 (д, J = 5.3 Гц), 1.01 (д, J = 5.3 Гц), 3H), (1.04 (т, J = 7.1 Гц), 1.18 (т, J = 7.1 Гц), 3H), 3.20 (м, 4H), (3.28 (м), 3.53 (м), 3.67 (м)), 2H), 3.60 (м, 4H), (4.41 (кв, J = 5.3 Гц), 4.63 (кв, J = 5.3 Гц), (1H), (5.07 (д, J = 5.8 Гц), 5.08 (д, J = 5.8 Гц), (1H), (5.29 (д, J = 5.8 Гц), 5.32 (д, J = 5.8 Гц)), 1H), 7.23-7.27 (м, 5H).
Пример 52. (3R,4S)-(-)-1-(N,N-Диметилкарбамоил)-3- (1-этоксиэтокси)-4-фенил-2-азетидинон (Vc-a)
55%, бесцветная жидкость, 1H ЯМР (250 МГц, CDCl3) δ (0.98 (д, J = 5.4 Гц), 1.10 (д, J = 5.4 Гц), (3H), (1.12 (т, J = 7.1 Гц), 1.13 (т, J = 7.1 Гц), 3H), 3.16 (ушир.с, 6H), (3.37 (м), 3.67 (м)), (2H), (4.47 (кв, J = 5.4 Гц), 4.71 (кв, J = 5.4 Гц)), (1H), (5.11 (д, J = 5.7 Гц), 5.12 (д, J = 5.7 Гц), 1H), 5.34 (т, J = 5.7 Гц), (1H), 7.34 (м, 5H).
Примеры 53-56, приведенные ниже, представляют способы получения баккатинов (III) и (IV) с применением 14-ОН-ДАБ, природного соединения, являющегося коммерчески доступным.
Данные идентификации баккатинов (IIIa), (IIIb), (III-B) и (IVa) приведены в следующих далее примерах.
Пример 53. Получение 7,10-диТрок-14-гидрокси-10-деацетилбаккатин- III-1,14-карбоната (IIIa)
14-Гидрокси-10-деацетилбаккатин III (14-ОН-ДАБ) (910 мг, 1.63 ммоль) растворяют в 18 мл безводного пиридина. Раствор нагревают до 80oC и добавляют 1 мл трихлорэтилхлорформиата. После перемешивания в течение 5 мин добавляют еще 0.4 мл триххлорэтилхлорформиата и смесь перемешивают 30 сек (общее количество трихлорэтилхлорформиата: 1.4 мл, 2.15 г, 9.71 ммоль, приблизительно 6 эквивалентов). Реакционный сосуд вынимают из масляной бани и реакционную смесь контролируют тонкослойной хроматографией (ТСХ) на предмет завершения реакции. Затем для удаления избытка хлорформиата добавляют несколько капель метанола и кусочек льда. Реакционную смесь экстрагируют CHCl3 и экстракт промывают 0.1 н соляной кислотой и насыщенным раствором соли. Затем сушат над безводным MgSO4 и удаляют растворитель, остаток чистят колоночной хроматографией на силикагеле, используя EtOAc (гексан (1:1) в качестве элюента, и получают 1.16 г (75%) IIIa в виде белого твердого продукта. Данные идентификации IIIa показаны ниже: 1H ЯМР (CDCl3) δ 1.20 (с, 3H, H17), 1.28 (с, 3H, H16), 1.88 (с, 3H, H19), 2.08 (с, 1H, H6b), 2.18 (с, 3H, H18), 2.33 (с, 3H, 4-OAc), 2.63 (м, 1H, H6a), 3.75 (ушир.с, 1H, H14), 3.82 (д, J = 7.1 Гц, 1H, H3), 4.20 (д, J = 8.4 Гц, 1H, H20b), 4.34 (д, J = (д, J = 8.4 Гц, 1H, H20a), 4.61 (д, J = 11.8 Гц, 1H, Трок), 4.79 (с, 2H, Трок), 4.91 (д, J = 11.8 Гц, 1H, Трок), 4.97 (ушир.с, 1H, H5), 5.01 (ушир.с, 1H, OH), 5.01 (ушир.с, 1H, H13), 5.59 (дд, J = 7.2, 10.6 Гц, 1H, H7), 6.10 (д, J = 7.1 Гц, 1H, H2), 6.25 (с, 1H, H10), 7.50 (м, 2H), 7.65 (м, 1H), 8.03 (д, 2H), 13C ЯМР (CDCl3) δ 10.80, 15.22, 21.56, 22.21, 25.63, 33.05, 41.28, 46.71, 56.44, 68.93, 71.79, 75.78, 76.00, 76.54, 77.56, 79.03, 79.91, 83.49, 84.09, 88.25, 94.10, 127.87, 129.01, 129.86, 130.92, 134.38, 144.81, 152.76, 153.12, 153.18, 164.73, 170.64, 199.97.
Пример 54. Получение 14-Ацетил-7,10-ДиТрок-14-гидрокси ДАБ (IIIb)
К раствору 594 мг (0.654 ммоль) 7,10-диТрок-14-гидрокси-10-деацетилбаккатина III (IIIa) в 30 мл пиридина добавляют при -10oC 230 мл (3,27 ммоль, 5 эквивал.) ацетилхлорида. Реакционную смесь перемешивают при -10oC 24 ч. Реакционную смесь экстрагируют EtOAc и промывают 0,1 н соляной кислотой и раствором соли. Экстракт сушат над безводным MgSO4 и концентрируют в вакууме, получая сырой продукт. Сырой продукт чистят "флэш" хроматографией на колонке с силикагелем, используя EtOAc (гексан (1:1) в качестве элюента, и получают 402 мг (65%) III в качестве белого твердого продукта с приведенными ниже характеристиками. Т.пл. 225-226oC, 1H ЯМР (CDCl3) δ 1.10 (с, 3H), 1.21 (с, 3H), 1.88 (с, 3H), 2.02 (с, 3H), 2.05 (м, 1H, H6b), 2.19 (с, 3H), 2.38 (с, 3H), 2.64 (м, 1H, H6a), 2.74 (с, 1H, OH), 3.19 (ушир.с, 1H, OH), 3.98 (д, J = 7.3 Гц, 1H, H3), 4.23 (д, J = 8.4 Гц, 1H, H20a), 4.30 (д, J = 8.4 Гц, 1H, H20b), 4.61 (д, J = 11.8 Гц, 1H, Трок), 4.72 (м, 1H, H13), 4.77 (д, J = 7.1 Гц, 1H, Трок), 4.91 (д, J = 11.8 Гц, 1H, Трок), 4.98 (м, 1H, H5), 5.39 (д, J = 5.4 Гц, 1H, H14), 5.62 (дд, J = 7.1, 10.5 Гц, 1H, H7), 5.84 (д, J = 7.3 Гц, 1H, H2), 6.30 (с, 1H, H10), 7.44-7.62 (м, 3H), 8.03-8.06 (м, 2H).
Элементный анализ: рассчитано для C37H40Cl6O16: C 46.61, H 4.23. Найдено: C 46.80, H 4.39.
Пример 55. Получение 14-гидрокси-2-циклогексанкарбонил-2-дебензоил- 10-деацетилбаккатина III (III-B)
Суспензию 14-гидрокси-10-деацетилбаккатина III (500 мг, 0.899 ммоль) и 5% Rh-C катализатора (50 мг) в MeOH (8 мл) и EtOAc (2 мл) гидрируют при 50oC и 900 psi (900 фунт/кв.дюйм = 63.25 кг/см2) водорода 36 ч, после этого реакционную смесь охлаждают до комнатной температуры, выпускают газообразный водород, фильтруют катализатор, и растворители упаривают в вакууме, получая сырой продукт. Сырой продукт чистят колоночной хроматографией на силикагеле, используя EtOAc гексан (1:1) в качестве элюента и получают 498 мг (98%) III-B в виде белого твердого продукта, обладающего приведенными ниже характеристиками: 1H ЯМР (DMSO-d6) δ 0.88 (с, 6H), 1.46 (с, 3H), 1.86 (с, 3H), 2.14 (с, 3H), 1.12-2.24 (м, 13H), 3.59 (м, 2H), 3.93 (д, J = 8.0 Гц, 1H), 3.99 (д, J = 7.0 Гц, 1H), 4.25 (д, J = 8.0 Гц, 1H), 4.36 (м, 1H), 4.39 (с, 1H), 4.76 (д, J = 2.0 Гц, 1H), 4.88 (ушир.д., J = 9.1 Гц, 1H), 4.96 (д, J = 7.1 Гц, 1H), 5.08 (д, J = 2.0 Гц, 1H), 5.29 (д, J = 7.1 Гц, 1H), 5.45 (д, J = 5.2 Гц, 1H), 6.64 (д, J = 6.3 Гц, 1H), 13C ЯМР (DMSO-d6) δ 9.36, 14.51, 21.14, 22.05, 24.82, 25.04, 25.23, 26.40, 28.11, 28.44, 36.41, 42.04, 42.56, 45.78, 57.17, 70.70, 72.21, 73.22, 74.08, 74.54, 75.05, 75.39, 79.80, 83.58, 135.15, 139.11, 169.52, 174.62, 209.87.
Пример 56. Получение 7,10-ДиТрок-14-гидрокси-10-деацетилбаккатина III (IVa)
14-Гидрокси-10-деацетилбаккатин III (14-ОН-ДАБ) (900 мг, 1,61 ммоль) растворяют в 18 мл безводного пиридина. Раствор нагревают до 80oC и добавляют 0,92 мл (1,42 г, 6,44 ммоль, 4 эквивалента) трихлорэтилхлорформиата. После перемешивания в течение 5 мин реакционный сосуд вынимают из масляной бани и реакционную смесь подвергают тонкослойной хроматографии (ТСХ) на предмет завершения реакции. Затем добавляют несколько капель метанола и кусочек льда для удаления избытка хлорформиата. Реакционную смесь экстрагируют CHCl3 и экстракт промывают 0.1 н соляной кислотой и насыщенным раствором соли. После высушивания над безводным MgSO4 и удаления растворителя остаток чистят колоночной хроматографией на силикагеле, используя EtOAc/гексан (1:1) в качестве элюента, и получают 808 мг (55%) IVa в виде белого твердого вещества: 1H ЯМР (CDCl3) δ 1.10 (с, 3H, H17), 1.18 (с, 3H, H16), 1.83 (с, 3H, H19), 2.02 (м, 1H, H6b), 2.14 (с, 3H, H18), 2.30 (с, 3H, 4-OAc), 2.61 (м, 1H, H6a), 3.22 (м, 1H, OH), 3.61 (с, 1H, OH), 3.66 (м, 1H, OH), 3.89 (д, J = 7.1 Гц, H3), 4.01 (м, 1H, H14), 4.18 (д, J = 8.4 Гц, 1H, H20b), 4.28 (д, J = 8.4 Гц, 1H, H20a), 4.60 (д, J = 11.9 Гц, 1H, Трок), 4.73 (м, 1H, H13), 4.77 (с, 2H, Трок), 4.83 (д, J = 11.9 Гц, 1H, Трок), 4.95 (м, 1H, H5), 5.57 (дд, J = 7.1, 10.6, Гц, 1H, H7), 5.79 (д, J = 7.1 Гц, 1H, H2), 6.24 (с, 1H, H10), 7.40-7.60 (м, 3H), 8.02 (ушир.д, 2H).
Примеры 57-62 описывают синтезы таксанов настоящего изобретения сочетанием β- лактамов (V) с баккатинами (III) и (IV), полученными в предыдущих примерах. Реакции сочетания проходят в присутствии основания, как показано в схемах 3 и 4. В примере 57 гидроксильные группы при C7 и C10 защищены, тогда как снятие защиты выполняют в примере 58. В примере 59 в синтезах таксанов 1b и 1c имеют место как присоединение, так и снятие защиты.
Примеры 57-62. Синтезы 7,10-диТрок-10-деацетил-14-гидрокси- Таксол-1,14-карбоната (1a-диТрок)
К раствору баккатина IIIa (86,9 мг, 0,093 ммоль) и N-бензоил- β лактама Va-a-ЭЭ (47,3 мг, 0,14 ммоль) в 3,0 мл ТГФ добавляют натрий гексаметил дисилазид (NaHMDS) 0,13 мл (1,2 экв., 0,85 М раствор в ТГФ) при -40oC за период 30 мин. ТСХ анализ реакционной смеси показал, что к этому времени баккатин IIIa расходуется полностью.
Реакцию прерывают добавлением 10 мл охлажденного насыщенного раствора NH4Cl. Реакционную смесь экстрагируют диэтиловым эфиром (10 мл х 3), затем дихлорметаном (10 мл) и объединенные экстракты промывают раствором соли, сушат над безводным сульфатом натрия и концентрируют, получая сырой продукт. Сырой продукт чистят колоночной хроматографией, используя EtOAc/гексан (1/2) в качестве элюента, получают 95,9 мг 2'-ЭЭ-7,10-диТрок-10-диацетил-14-гидрокси- Таксол-1,14-карбоната в виде белого твердого продукта. Это соединение обрабатывают 0,5 н соляной кислотой в ТГФ при комнатной температуре за 1 ч. Реакционную смесь сушат и чистят хроматографией на силикагеле, используя EtOAc/гексан (2/3) в качестве элюента, получая 65,5 мг (75% общий выход) таксана 1a-диТрок в виде белого твердого продукта, имеющего приведенные ниже характеристики: т.пл. 178-180oC, [α]
Элементный анализ: рассчитано для C52H49NCl6O19: C 51.85, H 4.10, N 1.16. Найдено: C 51.67, H 3.86, N 1.13.
Пример 58. Синтез 10-деацетил-14-гидрокси-Таксол-1,14-карбоната (1a)
Таксан 1a-диТрок (100 мг) обрабатывают Zn-пылью (200 мг) в уксусной кислоте при 40oC в течение нескольких часов. Реакционную смесь фильтруют через стеклянный фильтр и фильтрат концентрируют в вакууме. Остаток повторно растворяют в CH2Cl2 и Zn-соль удаляют фильтрацией, получая сырой продукт. Сырой продукт перекристаллизуют используя EtOAc/гексан (3: 1), что дает чистый таксан 1a (48 мг, 72%) в виде белого порошка: 1H ЯМР (CDCl3) δ 1.21 (с, 3H), 1.27 (с, 3H), 1.78 (с, 3H), 1.85 (м, 1H, H6b), 2.04 (с, 3H), 2.54 (с, 3H, 4-OAc), 2.56 (м, 1H, H6a), 3.80 (д, J = 7.6 Гц, 1H, H3), 3.93 (д, J = 4.4 Гц, 1H, 2'-OH), 4.28 (м, 4H, H20, H7, OH), 4.88 (м, 3H, H5, H14, H2'), 5.16 (с, 1H, H10), 5.93 (м, 1H, H3'), 6.07 (д, J = 7.6 Гц, 1H, H2), 6.44 (д, J = 5.8 Гц, 1H, H13), 7.23-7.60 (м, 12H), 7.73 (ушир.д, 2H), 8.14 (ушир.д, 2H), 13C ЯМР (CDCl3) δ 10.10, 14.22, 14.39, 21.11, 22.17, 22.61, 25.57, 36.67, 41.62, 45.97, 54.71, 57.86, 60.47, 69.43, 71.63, 73.82, 73.99, 74.66, 76.18, 77.27, 79.76, 80.43, 84.13, 88.37, 126.79, 127.40, 127.91, 128.28, 128.59, 129.07, 130.22, 131.98, 133.56, 134.25, 135.76, 136.22, 137.67, 151.89, 165.02, 167.67, 171.09, 172.06, 209.76.
Пример 59. Синтез 13-[(2R, 3S)-3-(трет-бутоксикарбонил)-амино- 2-гидрокси-3-фенилпропаноил] -10-деацетил-14-гидроксибаккатин-III- 1,14-карбоната (1b)
К раствору баккатина IIIa (100 мг, 0.107 ммоль) и N-трет-BOC- β- лактама Vb-d-ЭЭ (52 мг, 0,155 ммоль) в 3,0 мл ТГФ, добавляют NaHMDS 0,12 мл (1,1 экв. , 1,0 М раствор в ТГФ) при -30oC за период 10 мин. ТСХ анализ реакционной смеси показывает, что баккатин IIIa полностью израсходован. Чтобы прервать реакцию, реакционную смесь выливают в 100 мл стакан, содержащий 10 мл охлажденного насыщенного раствора NH4Cl. Реакционную смесь экстрагируют диэтиловым эфиром (10 мл х 3), затем дихлорметаном 910 мл), и объединенные экстракты промывают раствором соли, сушат над безводным сульфатом натрия и концентрируют, получая легкий желтый твердый продукт (170 мл). Сырой продукт чистят колоночной хроматографией на силикагеле, используя EtOAc (гексан 1/1/) в качестве элюента, получают таксан 13-[(2R,3S)-3-(трет-бутоксикарбонил)амино-2-ЭЭО-3- фенилпропаноил-10-диацетил-14-гидроксибаккатин-III-1,14-карбонат (1c-ЭЭ) (118 мг, 88%) в виде белого твердого продукта. Продукт непосредственно используют для следующей стадии, чтобы удалить ЭЭ и Трок защитные группы все сразу.
Сырой таксан 1c-ЭЭ (157 мг) обрабатывают Zn пылью (480 мг) и 2 мл ледяной уксусной кислоты при комнатной температуре в течение 8 часов, затем температуру поднимают до 50oC за 4 часа. Раствор фильтруют и фильтрат выливают в охлажденный льдом насыщенный раствор бикарбоната натрия (20 мл). Раствор экстрагируют дихлорметаном (20 мл), экстракт сушат над безводным MgSO4 и концентрируют, получая белый твердый продукт, который затем чистят колоночной хроматографией на силикагеле, используя EtOAc/гексан (2/1) в качестве элюента, получая таксан 1c (63 мг, 70% общий выход из баккатина IIIa), имеющий приведенные ниже характеристики: Т.пл. 190oC (разл.): [α]
Элементный анализ, рассчитано для C4H51NO16:
C 62.18, H 6.05, N 1.65. Найдено: C 61.91, H 6.33, N 1.61.
Пример 60. Синтез [14-(2R,3S)-3-(N-Бензоил)амино-2-гидрокси-3- фенилпропаноил]-10-деацетил-14-гидроксибаккатина III (IIa)
К раствору баккатина IVa (79,6 мг, 0.09 ммоль) и N-бензоил- β- лактама Va-a-ЭЭ (45,8 мг, 0.14 ммоль) в 3,0 мл ТГФ, добавляют NaHMDS 0,13 мл (1,2 экв. , 0,85 М раствор в ТГФ) при -40oC за период времени 30 мин. ТСХ анализ реакционной смеси показывает, что баккатин при этом расходуется полностью. Реакцию прерывают, смешивая с 10 мл охлажденного насыщенного раствора NH4Cl. реакционную смесь экстрагируют диэтиловым эфиром (10 мл х 3), затем дихлорметаном (10 мл), и объединенные экстракты промывают раствором соли, сушат над безводным сульфатом натрия и концентрируют, получая сырой продукт. Сырой продукт чистят колоночной хроматографией на силикагеле, используя EtOAc/гексан (1:3) в качестве элюента и получают 90,2 мг (82%) 14-[(2R,3S)-3-(N-Бензоил)амино-2-ЭЭО-3-фенилпропаноил] -10- деацетил-14-гидроксибаккатина III (IIa-ЭЭ) в виде белого твердого продукта. Этот защищенный таксан IIa-ЭЭ обрабатывают Zn в уксусной кислоте при 60oC в течение 9 ч. Реакционную смесь фильтруют через стеклянный фильтр и фильтрат концентрируют в вакууме. остаток повторно растворяют в CH2Cl2 и Zn-соль удаляют фильтрацией, получая сырой продукт. Этот сырой продукт чистят колоночной хроматографией на силикагеле, используя EtOAc/гексан (3:1) в качестве элюента, получают 33,7 мг (75%) таксана IIa в виде белого порошка, обладающего приведенными ниже характеристиками: т.пл. 198-202oC. [α]
Элементный анализ, рассчитано для C45H49NO14:
C 65.29, H 5.97, N 1.69. Найдено: C 65.15, H 6.01, N 1.79.
Данный пример включает стадию снятия защиты для получения таксана (IIa) в виде схемы 4.
Пример 61. Синтез 7,10-диТрок-14-[(2R, 3S)-3- (трет-бутоксикарбонил)амино-2-гидрокси-3-фенилпропаноил-10- деацетил-14-гидроксибаккатин III (IIb-диТрок)
К раствору 50 мг (0,055 ммоль) баккатина IVa в 10 мл ТГФ добавляют при -40oC за 10 мин 0,06 мл (0,06 ммоль) NaHMDS. Раствор 25 мг (0,083 ммоль) N-трет-BOC- β-лактама Vb-d-ЭЭ в ТГФ добавляют при -40oC и перемешивают 1 ч. Реакцию прерывают добавлением насыщенного NH4Cl при -40oC. Органический слой отделяют в водный слой экстрагируют этилацетатом. Объединенные органические экстракты сушат над безводным N2CO3 и концентрируют в вакууме. Сырой продукт чистят колоночной хроматографией на силикагеле, используя EtOAc/гексан (1,3) в качестве элюента, и получают 54,2 мг (82%) 7,10-диTroc-14- [(2R,3S)-3-(трет-бутоксикарбонил)амино-2-ЭЭО-3-фенилпропаноил] - 10-деацетил-14-гидроксибаккатина III (IIb-диTroc-EE) в виде белого твердого продукта. Этот защищенный таксан IIb-диТрок-ЭЭ обрабатывают 0,5 н HCl при комнатной температуре в течение 1 ч. Реакционную смесь сушат над безводным Na2CO3 и чистят колоночной хроматографией на силикагеле, используя EtOAc/гексан (1:3) в качестве элюента, и получают 40,0 мг (81%) таксана IIb-диТрок в виде белого порошка: 1H ЯМР (CDCl3) δ 1.19 (с, 3H, H17), 1.24 (с, 3H, H16), 1.45 (с, 9H), 1.85 (с, 3H), 2.03 (м, 1H, H6b), 2.24 (с, 3H, H18), 2.37 (с, 3H, 4-OAc), 2.65 (м, 1H, H6a), 3.01 (д, J = 5.7 Гц, 1H, OH), 4.01 (д, J = 6.8 Гц, 1H, H3), 4.15 (д, J = 8.4 Гц, 1H, H20), 4.32 (д, J = 8.4 Гц, 1H, H20), 4.36 (д, J = 5.6 Гц, 1H, NH), 4.62 (д, J = 11.8 Гц, 1H), 4.79 (с, 2H), 4.92 (д, J = 11.8 Гц, 1H), 4.95-5.02 (м, 3H, H2', H5, OH), 5.18 (д, J = 9.5 Гц, 1H, H13), 5.34 (д, J = 9.5 Гц, 1H, H14), 5.63 (дд, J = 7.2, 10.5 Гц, 1H, H7), 5.71 (д, J = 5.1 Гц, 1H, H3'), 5.84 (д, J = 6.8 Гц, 1H, H2), 6.34 (с, 1H, H10), 7.29-7.60 (м, 8H), 8.12 (ушир.д, 2H), 13C ЯМР (CDCl3) δ 15.33, 22.25, 28.11, 28.17, 28.30, 28.45, 28.50, 33.26, 42.85, 46.82, 55.98, 56.51, 71.88, 73.05, 73.60, 76.22, 76.57, 77.61, 77.67, 77.88, 79.65, 80.01, 81.31, 83.54, 83.60, 94.21, 126.97, 128.29, 128.37, 128.74, 128.92, 130.48, 131.21, 133.67, 138.55, 144.71, 153.07, 153.22, 156.23, 166.22, 171.04, 171.97, 200.88.
Данный пример показывает только сочетание баккатина (IVa) с β- лактамами (Vb-d), защищенными ЭЭ, приводящее к получению защищенного таксана, как показано в схеме 4. В этом примере был получен IIb-диТрок.
Пример 62. Синтез 4-[(2R,3S)-3-(трет-бутоксикарбонил)амино-2- гидрокси-3-фенилпропаноил]-10-деацетил-14-гидроксибаккатина III (IIb)
К раствору 108 мг (0,09 ммоль) IIb-диТрок в 2 мл уксусной кислоты и 3 мл MeOH, добавляют при комнатной температуре 240 мг Zn (активированного). Температуру увеличивают до 60oC и смесь перемешивают 2 ч. Реакционную смесь фильтруют через стеклянный фильтр и фильтрат конденсируют в вакууме. Остаток растворяют в CH2Cl2, цинковую соль удаляют фильтрацией, получая 116 мг сырого продукта. Этот сырой продукт чистят колоночной хроматографией на силикагеле, используя EtOAc/гексан (4: 1) в качестве элюента, получают 48,8 мг (70%) таксана IIb в виде белого порошка: 1H ЯМР (CDCl3) δ 1.15 (с, 3H), 1.16 (с, 3H), 1.45 (с, 9H), 1.73 (с, 3H), 1.81 (м, 1H, H6b), 2.13 (с, 3H), 2.36 (с, 3H), 2.60 (м, 1H, H6a), 3.03 (д, J = 5.7 Гц, 1H, OH), 4.02 (д, J = 6.9 Гц, 1H, H3), 4.17 (д, J = 8.5 Гц, 1H, H20), 4.25-4.34 (м, 4H, H20, H7), 4.83 (д, J = 6.0 Гц, 1H), 4.99 (м, 2H, H2', H5), 5.18 (д, J = 9.5 Гц, 1H, H13), 5.31 (с, 1H, H20), 5.37 (д, J = 9.5 Гц, 1H, H14), 5.67 (д, J = 6.0 Гц, 1H, H3'), 5.83 (д, J = 6.9 Гц, 1H, H2), 7.31-7.56 (м, 8H), 8.12 (ушир.д, 2H).
Данный пример иллюстрирует стадию снятия защиты IIb-диТрок, приводящую к получению таксана IIb, как показано в схеме 4.
Пример 63. Синтез 1,14-карбоната 13-[(2R, 3S)-3-(трет- бутоксикарбонил)амино-2-гидрокси-3-изобутил]-10-ацетил-14- гидроксибаккатина III
К раствору 100 мг 1,14-карбоната 10-ацетил-Tes баккатина III и (3R, 4S)-1-трет-бутоксикарбонил-3-(1-этоксиэтокси)-4-изобутил-2-азетидона (60 мг) в 3,0 мл ТГФ добавляли 0,12 мл NaHMDS (1,1 экв., 1,0 М раствор в ТГФ) в течение 10 мин при -30oC. реакционную смесь выливали в химический стакан емкостью 100 мл, содержащий 10 мл раствора NH4Cl для гашения реакции. Реакционную смесь экстрагировали дихлорметаном. Органическую фазу промывали насыщенным солевым раствором, сушили над Na2SO4 и концентрировали с получением твердого продукта желтого цвета. Этот продукт растворяли в 10 мл метанола, содержащего каталитическое количество безводной HCl для удаления защитных групп Tes и EE. Спустя 20 минут метанольный раствор разбавляли 20 мл H2O и экстрагировали при комнатной температуре метиленхлоридом. Метиленхлоридную фазу концентрировали досуха и твердый продукт кристаллизовали из этанола. Получали 80 мг желаемого соединения, имеющего следующие характеристики:
C44H57NO17 (C 60,21%; H 6,60%; N 1,58%);
т.пл. = 254oC;
[o]D = -59oC в CHCl3;
M+ при mz=871.
Композиция:
IDN 5109 - 30 мг
Полисорбат 80 (Tween80®-ICI) - 0,5 мл
Безводная лимонная кислота (5% раствор в абсолютном спирте) - 0,005 мл
Абсолютный спирт - До объема 1 мл
Способ изготовления 10 мл инъекционного концентрата
1. Растворяют IDN 5109 (300 мг) в 4,9 мл абсолютного спирта при перемешивании на магнитной мешалке в течение 30 минут.
2. Очень медленно добавляют при интенсивном перемешивании 5 мл Tween 80 к фазе 1.
3. Добавляют раствор лимонной кислоты к фазе 2 и завершают растворение при перемешивании по крайней мере в течение 120 минут.
4. Нагревают раствор 3 до температуры 40oC и перемешивают 15 минут до получения прозрачной жидкости.
5. Доводят объем до 10 мл абсолютным спиртом.
6. Фильтруют раствор 5 через фильтр Millipore Millex SR 0.5 мкм (тефлон).
Разбавление.
Разбавляют 1 мл IDN 5109 инъекционного концентрата (30 мг/мл) до 5 мл, 0,9%-ным раствором NaCl.
Полученный раствор (5 мг/мл) физически стабилен при комнатной температуре в течение по крайней мере 8 часов.
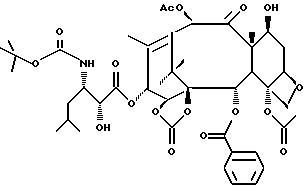
13-(N-boc- β- изобутилизосеринил)-14-гидроксибаккатин-1,14-карбонат.
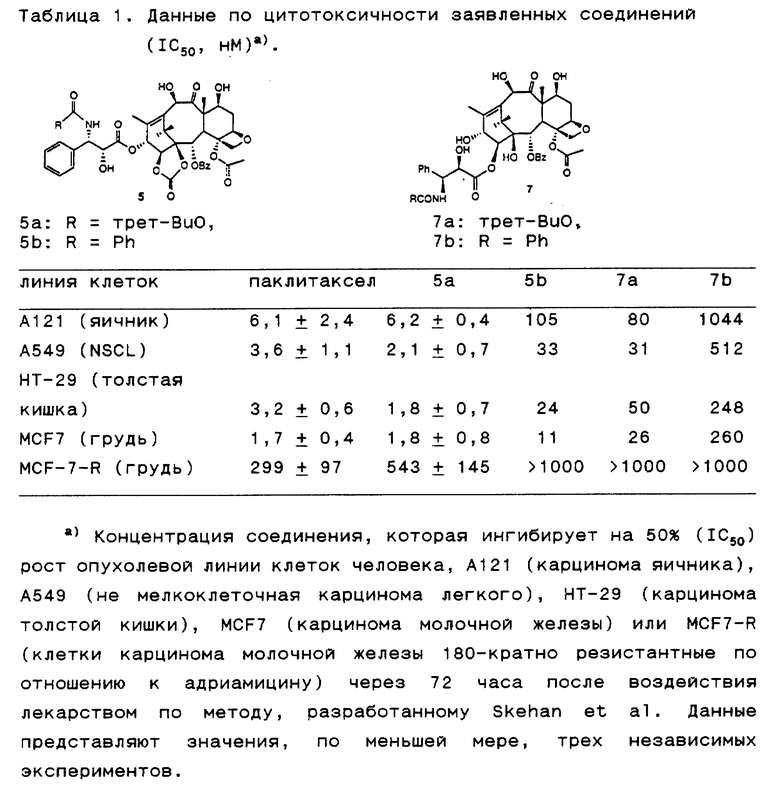
Цитотоксичность заявленных соединений исследовали in vitro в отношении раковых клеточных линий человека. Как показано в таблице 1, исследуемые соединения обладают значительной цитотоксичностью в отношении раковых клеточных линий молочной железы, не мелкоклеточного легкого, яичника и толстой кишки, причем соединение, обозначенное как 5a, проявляет активность выше, чем паклитаксел, в отношении раковых клеточных линий не мелкоклеточного легкого (A549) и толстой кишки (HT-29). Это соединение проявляет также значительную активность в отношении адрианмицин-резистантных клеточных линий рака молочной железы (MCF7-R).
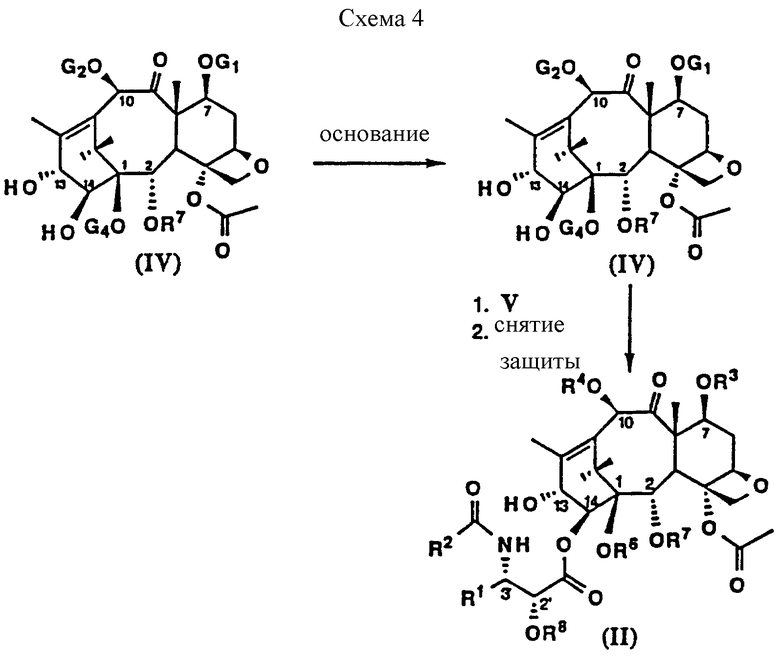
Активность IDN 5109 против подкожн. IGROV-DDP карциномы яичника.
Экспериментальная модель
Карциному яичника человека IGROV-DDP с приобретенной устойчивостью к цисPt трансплантируют подкожно в оба бока мышам с удаленной щитовидной железой и осуществляют внутривенное введение по схеме q4dx4 (Животные получили в целом 4 инъекции (одна инъекция каждые 4 дня)). Эффективность препарата оценивают на 29 день после первого введения как ингибирование веса опухоли (ИВО%) в процентах относительно контрольных мышей (см. табл. 2).
Описываются новые производные таксана общей формулы (I), где значения R, R1-R8 указаны в п.1 формулы, которые могут быть использованы в качестве химиотерапевтических средств или их предшественников. Описывается способ их получения, фармацевтическая композиция на основе соединений формулы (I), а также способ лечения некоторых видов рака с помощью новых соединений. 4 с. и 28 з.п. ф-лы, 2 табл.
где R представляет собой атом водорода или радикал общей формулы А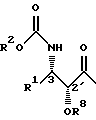
где R1 представляет собой линейный или разветвленный C1-C10 алкильный радикал, линейный или разветвленный C2-C10 алкенильный радикал, фенил или фурил;
R2 представляет собой линейный или разветвленный C1-C10 алкильный радикал или фенил;
R3 представляет собой атом водорода или C1-C20 ацильный радикал;
R4 представляет собой атом водорода или C1-C20 ацильный радикал;
R5 представляет собой атом водорода или радикал общей формулы А;
R6 представляет собой атом водорода;
или R5 и R6 могут быть связаны с образованием циклической структуры;
R7 представляет собой C1-C20 ацильный радикал;
R8 представляет собой атом водорода или гидроксилзащитную группу;
при условии, что R и R5 одновременно не являются радикалом общей формулы А.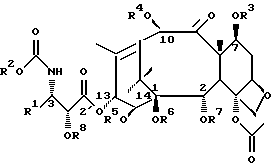
где значения R1, R2, R3, R4, R6, R7 и R8 указаны в п.1;
R5 представляет собой атом водорода, или R5 и R6 могут быть связаны с образованием циклической структуры.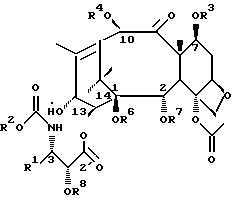
где значения R1, R2, R3, R4, R7 и R8 указаны в п.1, и R6 представляет собой атом водорода.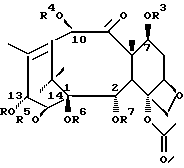
где R представляет собой атом водорода или радикал общей формулы А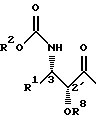
где R1 представляет собой линейный или разветвленный C1-C10 алкильный радикал, линейный или разветвленный C2-C10 алкенильный радикал, фенил или фурил;
R2 представляет собой линейный или разветвленный C1-C10 алкильный радикал или фенил;
R3 представляет собой атом водорода или C1-C20 ацильный радикал;
R4 представляет собой атом водорода или C1-C20 ацильный радикал;
R5 представляет собой атом водорода или радикал общей формулы А;
R6 представляет собой атом водорода;
или R5 и R6 могут быть связаны с образованием циклической структуры;
R7 представляет собой C1-C20 ацильньй радикал;
R8 представляет собой атом водорода или гидроксилзащитную группу;
при условии, что R и R5 одновременно не являются радикалом общей формулы А,
отличающийся тем, что баккатин общей формулы III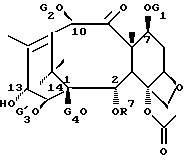
где G'3 представляет собой атом водорода или группу G3;
G1, G2, G3 и G4, независимо, представляет собой ацильный радикал или гидроксилзащитную группу, выбранную из группы, включающей метоксиметил, метоксиэтил, 1-этоксиэтил, бензилоксиметил, β-триметилсилилэтокси)метил, тетрагидропиранил, 2,2,2-трихлорэтоксикарбонил, бензилоксикарбонил, трет-бутоксикарбонил, 9-флуоренилметоксикарбонил, 2,2,2-трихлорэтоксиметил, триметилсилил, трипропилсилил, диметилэтилсилил, диметил(трет-бутил)силил, диэтилметилсилил, дифенилсилил или дифенилметилсилил, где указанный ацильный радикал выбран из группы, включающей ацетил, хлорацетил, дихлорацетил, трихлорацетил, пропаноил, бутаноил, пентаноил, гексаноил, гептаноил, циклогексанкарбонил, октаноил, нонаноил, деканоил, ундеканоил, додеканоил, бензоил, фенилацетил, метоксикарбонил, этоксикарбонил, пропоксикарбонил или бутоксикарбонил;
G3 и G4 могут быть связаны с образованием циклической структуры,
R7 указан выше,
подвергают взаимодействию в присутствии основания с β-лактамом общей формулы V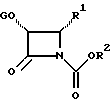
где G представляет собой гидроксилзащитную группу, выбранную из группы, включающей метоксиметил, метоксиэтил, 1-этоксиэтил, бензилоксиметил, (β-триметилсилилэтокси)метил, тетрагидропиранил, 2,2,2-трихлорэтоксикарбонил, бензилоксикарбонил, трет-бутоксикарбонил, 9-флуоренилметоксикарбонил, 2,2,2-трихлорэтоксиметил, триметилсилил, триэтилсилил, трипропилсилил, диметилэтилсилил, диметил(трет-бутил)силил, диэтилметилсилил, диметилфенилсилил, дифенилметилсилил, ацетил, хлорацетил, дихлорацетил, трихлорацетил или трифторацетил;
R1 и R2 указаны выше,
с последующим удалением гидроксилзащитных групп.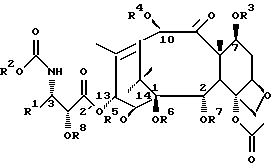
где значения R1, R2, R3, R4, R5, R6, R7 и R8 указаны в п.2, и исходный баккатин имеет общую формулу III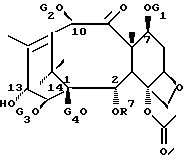
где G1, G2, G3, G4 и R7 указаны в п.12.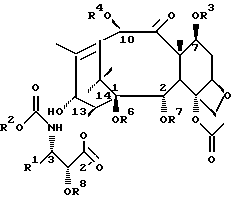
где значения R1, R2, R3, R4, R6, R7 и R8 указаны в п.3,
и исходный баккатин имеет общую формулу IV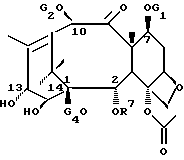
где G1, G2, G4 и R7 указаны выше.
| US 4960790 А 1990 | |||
| US 4876399 А 1989 | |||
| US 4924012 А 1990 | |||
| US 5015722 A 1991 | |||
| US 4857683 A 1989 | |||
| Dr | |||
| Ojima, J | |||
| of Chemistry, т | |||
| Приспособление с иглой для прочистки кухонь типа "Примус" | 1923 |
|
SU40A1 |
| Тепловой измеритель силы тока | 1921 |
|
SU267A1 |
Авторы
Даты
1999-09-20—Публикация
1994-03-24—Подача