Дидемнин В представляет собой макроциклический депсипептид, выделенный из вида морского оболочника. Дидемнин В проявляет мощную противовирусную, иммуносупрессорную и противоопухолевую активность in vitro и in vivo и представляет собой первый морской натуральный продукт, который подвергался клиническому испытанию как средство борьбы с раком в организме человека (Li et al., 1992, Studies in Natural Products Chemistry, 10:241-302; Sakai et al., 1996, J. Med. Chem. 39:2819-2834; Wipf, 1995, Chem. Rev. 95:2115-2134). Дидемнин В относится к дидемнинам, представляющим собой семейство соединений, обладающих мощной способностью ингибировать синтез белка и прогрессирование клеточного цикла и индуцировать более быстрый апоптоз, чем любые другие натуральные продукты, выделенные к настоящему времени (Grubb et al., 1995, Biochem. Biophys. Res. Commun., 215:1130-1136; Johnson et al., 1996, FEBS Lett., 383:1-5; Johnson et al., 1999, Immunol. Cell Biol., 77:242-248; Johnson et al., 1999, J. Cell Biochem., 72:269-278). Другие представители указанного семейства соединений, включая дидемнин М и дегидродидемнин В, зтакже проявляют цитотоксический и цитостатический эффект.
Тамандарин А (называемый также {(2S)Hiv2}дидемнин В) представляет собой натуральное, близкое к дидемнину соединение, которое недавно было выделено из морского оболочника. Тамандарин А проявляет биологическую активность, аналогичную активности, демонстрируемой дидемнином В. Так, например, тамандарин А является мощным ингибитором синтеза белка, роста клеток и онкогенеза. Тамандарин А проявляет in vitro бульшую активность в отношении карциномы поджелудочной железы, чем дидемнин В (Liang et al., 1999, Org. Lett., 1:1319-1322). Серьезным ограничением в использовании тамандарина А как для исследовательских целей, так и для практического применения является ограниченность получения тамандарина А из натуральных источников, а также трудность и высокая стоимость выделения указанного продукта. Имеется потребность в способе синтеза тамандарина А и других аналогов дидемнина (включая аналоги дегидродидемнина).
Несмотря на активность дидемнина В в лабораторных исследованиях, его клиническая эффективность ослабляется наличием побочных эффектов, возникающих при использовании терапевтических доз данного соединения. Как и в случае многих антипролиферативных средств, дидемнин В проявляет относительно узкий терапевтический диапазон. Хотя дидемнин М и дегидродидемнин В обладают улучшенным терапевтическим потенциалом по сравнению с дидемнином В, все еще существует потребность в антипролиферативных средствах, которые бы проявляли меньшую токсичность в терапевтической дозе (например, аналогах дидемнина, обладающих большим терапевтическим индексом).
Настоящее изобретение удовлетворяет указанным выше потребностям.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к аналогам тамандарина и дидемнина, которые содержат в своей структуре остаток дезоксопролина или остаток дегидропролина. В одном варианте осуществления изобретения оно относится к композиции, включающей аналог тамандарина со структурой, описываемой формулой I:
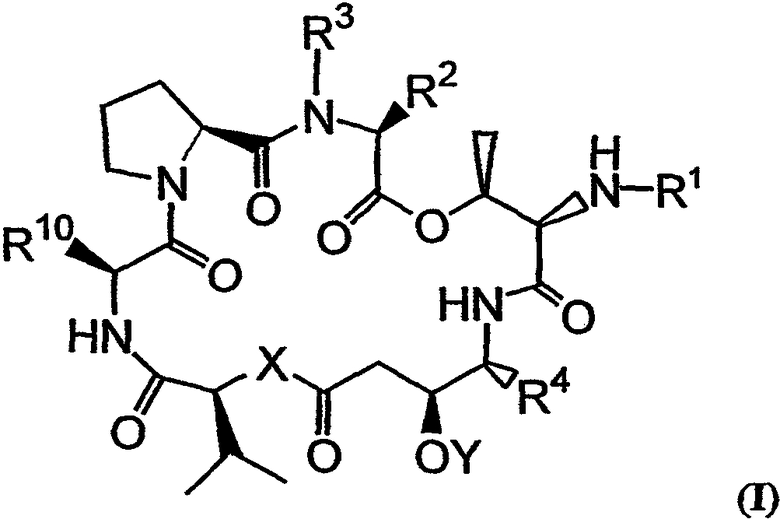
В формуле I R1 выбирают из группы, состоящей из
-Н,
-(трет-бутилоксикарбонил)а,
-лейцина,
-(N-метил)лейцина,
-(N-метил)лейцин-(первый флуорофор)а,
-(N-метил)лейцин-пролина,
-(N-метил)лейцин-пролин-лактата,
-(N-метил)лейцин-пролин-пирувата,
-(N-метил)лейцин-пролин-лактат-(первый флуорофор)а,
-(N-метил)лейцин-пролин-лактат-глутамин-пироглутамата,
-(N-метил)лейцин-пролин-лактат-глутамин-циклопентаноата,
-(N-метил)лейцин-пролин-аланин-лейцин-пироглутамата,
-(N-метил)лейцин-пролин-(N-метил-аланин)-лейцин-пироглутамата,
-(N-метил)лейцин-дезоксопролина,
-(N-метил)лейцин-дезоксопролин-лактата,
-(N-метил)лейцин-дезоксопролин-пирувата,
-(N-метил)лейцин-дезоксопролин-лактат-(первый флуорофор)а,
-(N-метил)лейцин-дезоксопролин-лактат-глутамин-пироглутамата,
-(N-метил)лейцин-дезоксопролин-лактат-глутамин-циклопентаноата,
-(N-метил)лейцин-дезоксопролин-аланин-лейцин-пироглутамата,
-(N-метил)лейцин-дезоксопролин-(N-метил-аланин)-лейцин-пироглутамата,
-(N-метил)лейцин-дегидропролина,
-(N-метил)лейцин-дегидропролин-лактата,
-(N-метил)лейцин-дегидропролин-пирувата,
-(N-метил)лейцин-дегидропролин-лактат-(первый флуорофор)а,
-(N-метил)лейцин-дегидропролин-лактат-глутамин-пироглутамата,
-(N-метил)лейцин-дегидропролин-лактат-глутамин-циклопентаноата,
-(N-метил)лейцин-дегидропролин-аланин-лейцин-пироглутамата и
-(N-метил)лейцин-дегидропролин-(N-метил-аланин)-лейцин-пироглутамата.
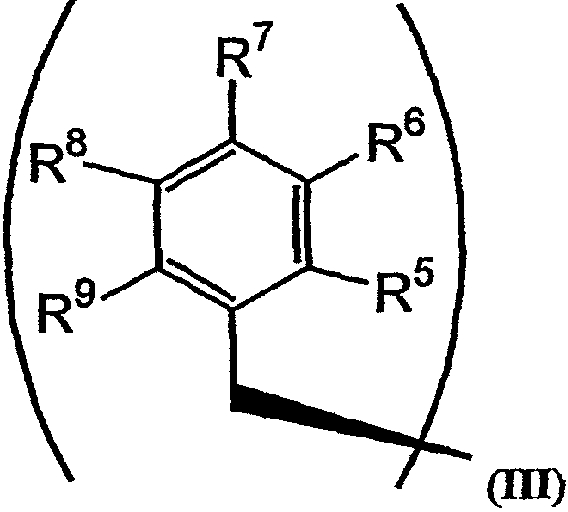
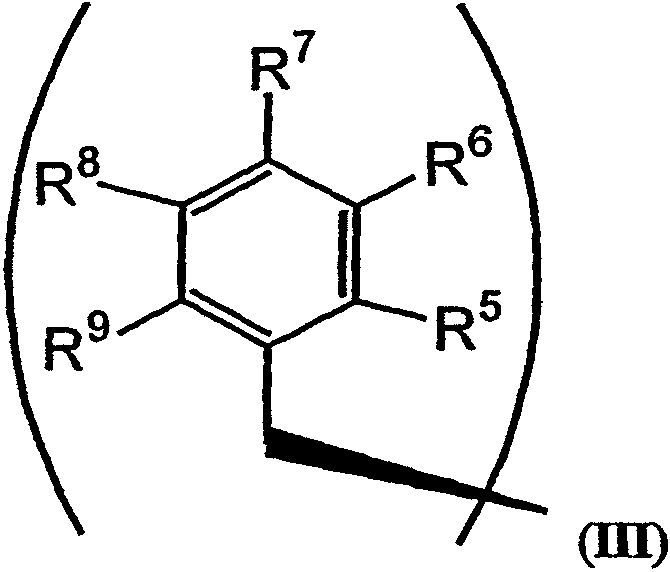
R2 и R3 в формуле I могут представлять собой отдельные группы или они могут вместе обозначать единую группу. В том случае, когда R2 и R3 обозначают отдельные группы, R3 представляет собой либо метильную группу, либо гидридный радикал и R2 выбирают из группы, состоящей из боковой цепи изолейцина, боковой цепи валина, боковой цепи аланина, боковой цепи норлейцина, боковой цепи норвалина, боковой цепи лейцина, боковой цепи гистидина, боковой цепи триптофана, боковой цепи аргинина, боковой цепи лизина, второго флуорофора и заместителя, имеющего структуру формулы III:
В том случае, когда R2 и R3 вместе обозначают единый заместитель, указанный заместитель имеет структуру формулы IV:
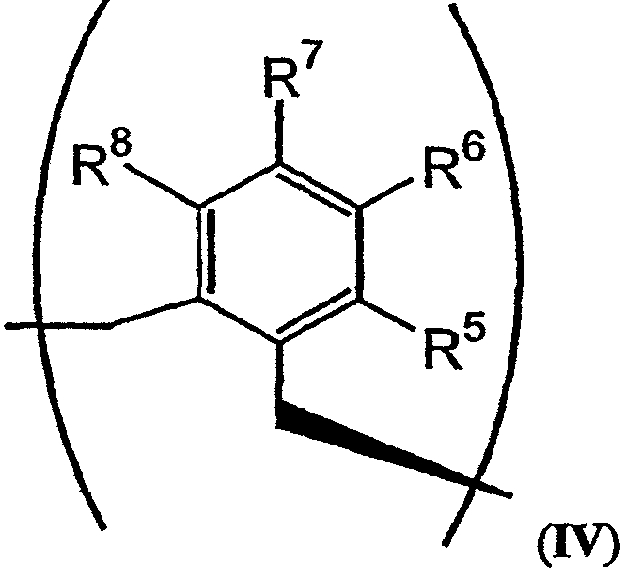
В формулах III и IV каждый из R5, R6, R7, R8 и R9 независимо выбирают из группы, состоящей из -H, -OH, -OCH3, -CO(C6H5), -Br, -I, -F, -Cl, -CH3 и -C2H5.
R4 в формуле I представляет собой либо боковую цепь изолейцина, либо боковую цепь валина. Также в формуле I Х обозначает либо -О-, либо -(NH)-, Y обозначает либо гидридный радикал, либо защитную группу для гидроксила и R10 обозначает либо боковую цепь лейцина, либо боковую цепь лизина. Аналог дидемнина представляет собой аналог, отличный от тамандарина А (то есть {(2S)Hiv2}дидемнина В). В одном варианте каждая группа пролина или лактата, которая присутствует в R1, имеет (S)-стереохимию. В другом варианте каждая группа, способная иметь стереохимические изомеры в R1, присутствует в своей природной форме (то есть в (S)-форме для аминокислотных остатков и лактата). Считается, что циклопентаноат встречается в природе в (S)-стереохимической конфигурации.
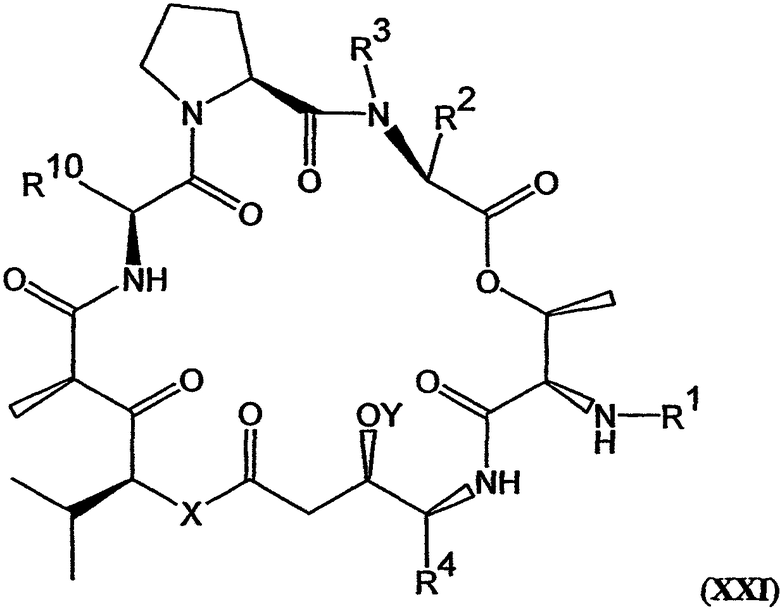
В другом варианте настоящее изобретение относится к композиции, включающей аналог дидемнина, имеющий структуру формулы XXI:
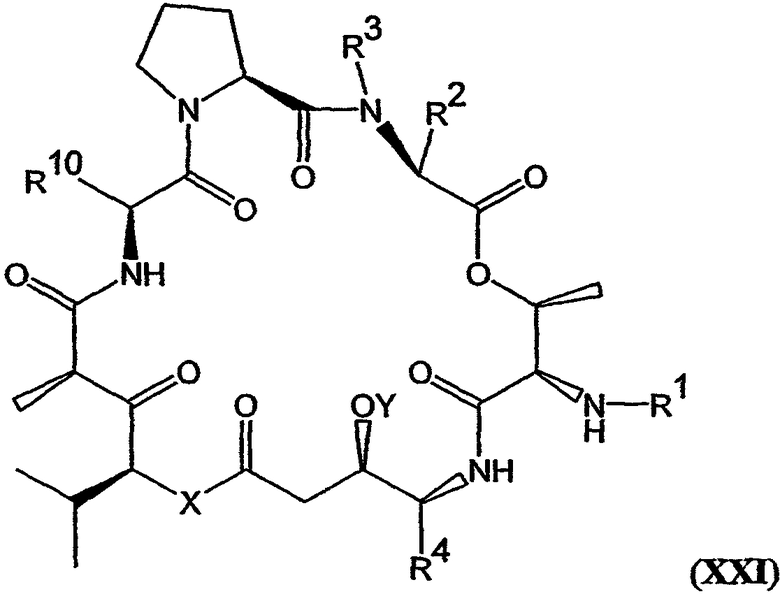
В формуле XXI каждый из R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10 имеет то же значение, что было указано и для формулы I.
В предпочтительных классах дезоксопролиновых аналогов тамандарина и дидемнина, имеющих формулу I и XXI соответственно, R2 имеет структуру формулы III, R3 обозначает метил, R4 обозначает боковую цепь изолейцина, каждый из R5, R6, R8 и R9 обозначает гидридный радикал, R7 обозначает метоксигруппу, R10 обозначает боковую цепь лейцина, Х обозначает -О- и Y обозначает гидридный радикал. Примерами аналогов тамандарина и дидемнина, которые включены в рамки настоящего изобретения, являются соединения 103, 104, 105, 106, 107, 108, 109, 110, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 133, 134, 136, 137, 139, 141, 142, 143, 201, 202, 203 и 204, которые показаны на чертежах.
В одном варианте осуществления настоящего изобретения аналог тамандарина или дидемнина включает фотореактивный заместитель, такой как группа R2, имеющий структуру
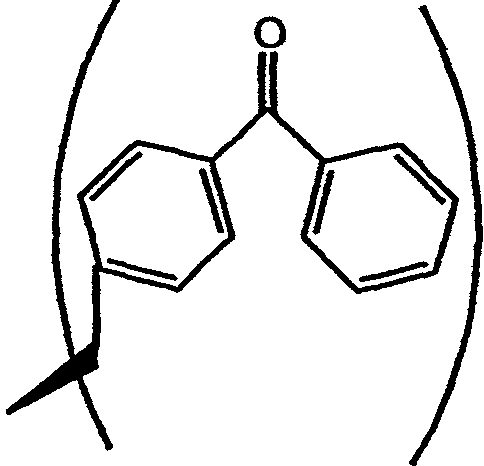
Фотореактивный заместитель может быть непосредственно присоединен к аналогу, либо он может быть присоединен с помощью линкера, содержащего цепь, которая включает от 1 до примерно 13 или более атомов углерода, и необязательно имеющего в цепи вторичную аминную или амидную группу.
В другом варианте осуществления изобретения аналог тамандарина или дидемнина содержит присоединенный флуорофор, такой как аналог, в котором флуорофор присоединен к омега-аминогруппе боковой цепи лизина в R2 или R10. Пример структуры такого флуоресцентного аналога дидемнина показан на фиг.29. Альтернативно, аналог дидемнина может быть присоединен (например, ковалентно) к подложке. В большинстве вариантов осуществления изобретения Y в формулах I и XXI предпочтительно обозначает гидридный радикал.
Настоящее изобретение включает вариант его осуществления, в котором аналог тамандарина или дидемнина может быть активирован (или активность которого может быть повышена) посредством ферментативного расщепления группы, связанной с аналогом. Так, например, настоящее изобретение относится к композициям, которые включают аналог, имеющий структуру, выбираемую из группы, состоящей из приведенных ниже формул (a)-(d).
(a)
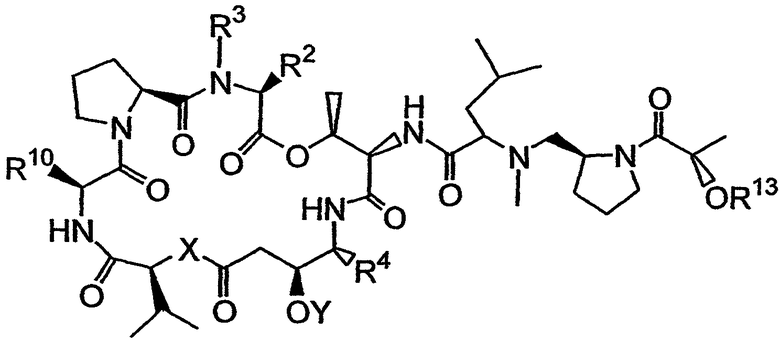
(b)
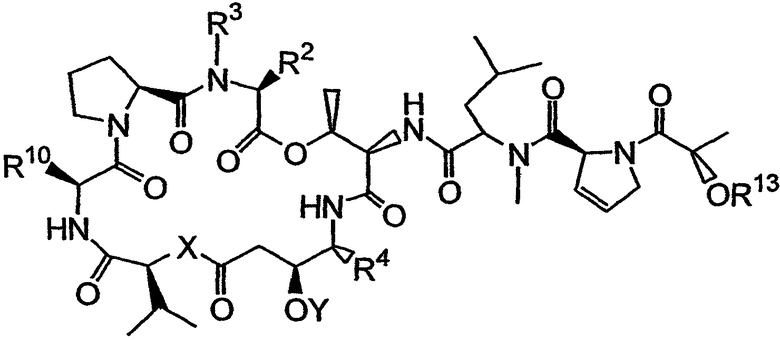
(c)

(d)
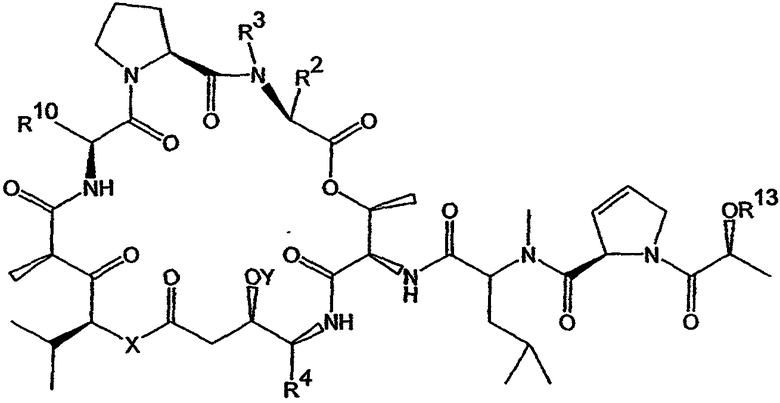
В формулах (a)-(d) R2, R3, R4, R10, X и Y имеют те же самые значения, что были указаны выше для формулы I. R13 обозначает расщепляемую ферментом группу, которая расщепляется ферментом, таким как фермент, выбираемый из группы, состоящей из карбоксипептидазы, бета-лактамазы, бета-галактозидазы, V-амидазы пенициллина, цитозиндезаминазы, нитроредуктазы, щелочной фосфатазы, бета-глюкуронидазы и каталитического антитела. В качестве возможного примера R13 может иметь структуру либо формулы V, либо формулы VI:
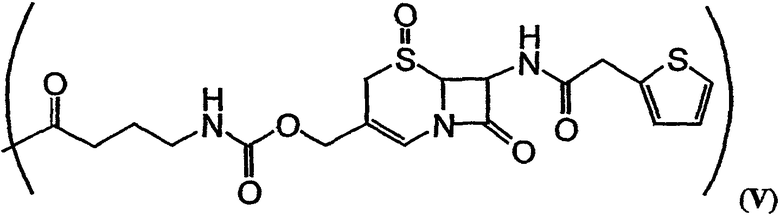
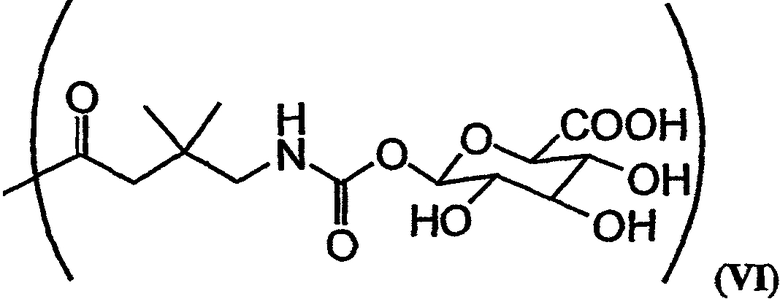
Примеры таких аналогов включают соединение 131 и соединение 132.
Настоящее изобретение также относится к композициям, которые включают фрагмент дидемнина, имеющий структуру формулы VII:
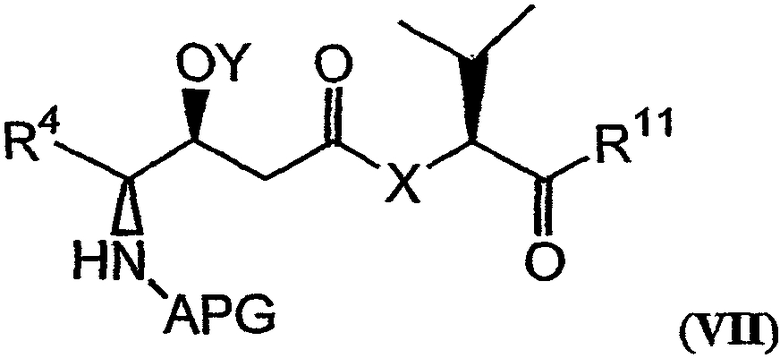
В формуле VII Y обозначает либо гидридный радикал, либо защитную группу для гидроксила, Х обозначает либо -О-, либо -(NH)-, R4 обозначает либо боковую цепь изолейцина, либо боковую цепь валина и APG обозначает защитную группу для амина. R11 может представлять собой любую из групп -OH, -NH2, -O(аллил), -О(пентафторфенил) и заместитель, имеющий структуру формулы VIII:
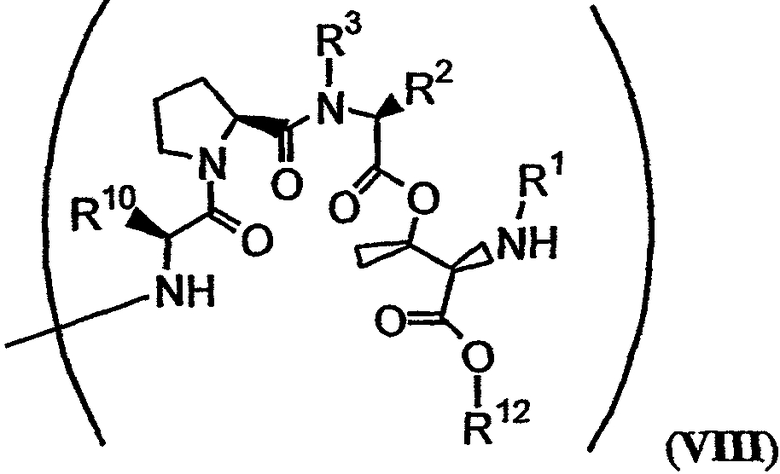
В формуле VIII R1, R2, R3 и R10 имеют те же значения, что были описаны выше для формулы I, и R12 может обозначать либо гидридный радикал, либо -2-(триметилсилил)этоксикарбонильную группу.
Описываемые аналоги тамандарина и дидемнина могут быть введены в композицию вместе с одним или более фармацевтически приемлемыми носителями с получением фармацевтических препаратов. Указанные препараты могут вводиться в клетки млекопитающих, например человека (либо in vitro, либо in vivo), для ингибирования синтеза белка, ингибирования роста, ингибирования пролиферации, ингибирования онкогенеза или усиления апоптоза в клетке, или в одну или более тканей млекопитающего.
Настоящее изобретение также относится к способу получения фрагмента дидемнина. Указанный способ включает связывание первого реагента, имеющего структуру:
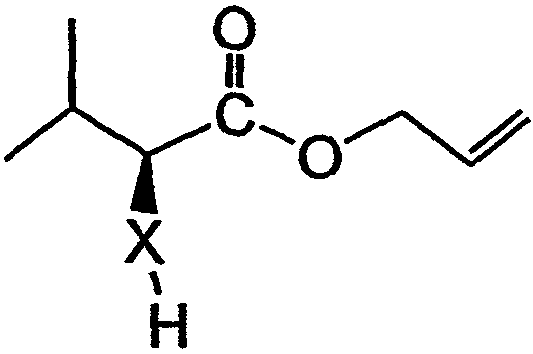
и второго реагента, имеющего структуру:

с получением первого фрагмента дидемнина, имеющего структуру:
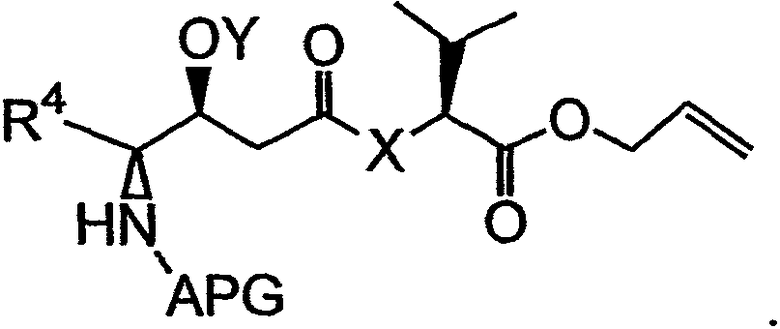
В указанной структуре Х обозначает либо -О-, либо -(NH)-, APG обозначает защитную группу для амина, Y обозначает защитную группу для гидроксила (например, триизопропилсилильную группу) и R4 может обозначать либо боковую группу изолейцина, либо боковую группу валина. Первый фрагмент дидемнина может быть гидролизован с получением второго фрагмента дидемнина, имеющего структуру:
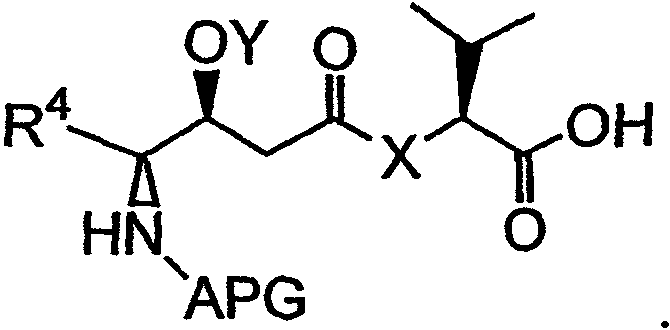
Активатор (ACT) может быть добавлен к карбонильной группе второго фрагмента дидемнина с получением третьего фрагмента дидемнина, имеющего структуру:
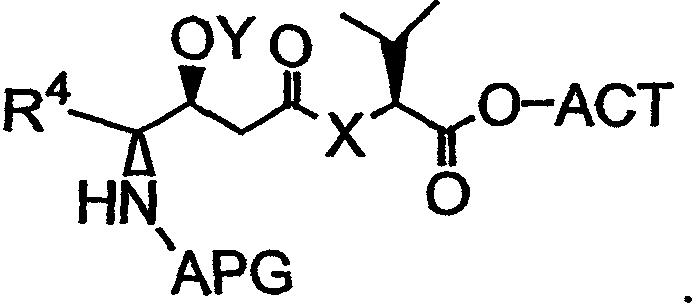
Третий фрагмент дидемнина может быть связан с третьим реагентом, который имеет структуру:
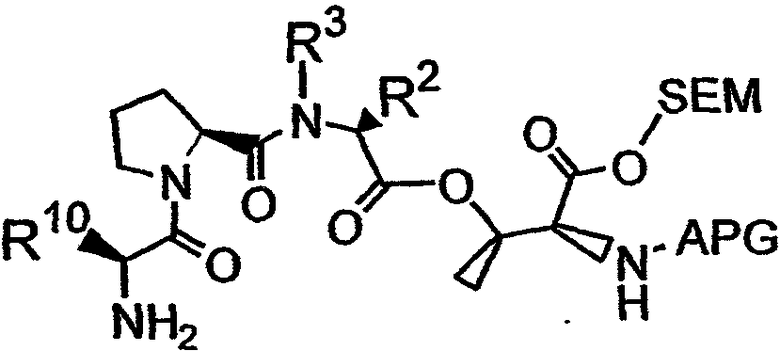
с получением четвертого фрагмента дидемнина, имеющего структуру:
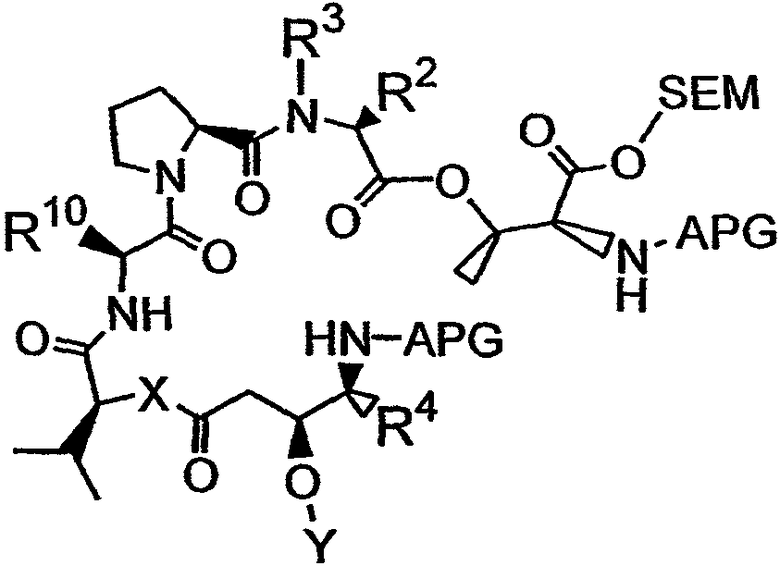
В указанной структуре R2 и R3 имеют те же значения, что были описаны выше для формулы I, APG обозначают защитную группу для амина, SEM обозначает 2-(триметилсилил)этоксикарбонильную группу и R10 обозначает либо боковую цепь лейцина, либо боковую цепь лизина.
Настоящее изобретение также относится к способу получения аналога дидемнина из четвертого фрагмента дидемнина. Указанный способ включает удаление групп SEM и CBZ из четвертого фрагмента дидемнина и циклизацию указанного фрагмента с получением первого аналога дидемнина, имеющего следующую структуру:
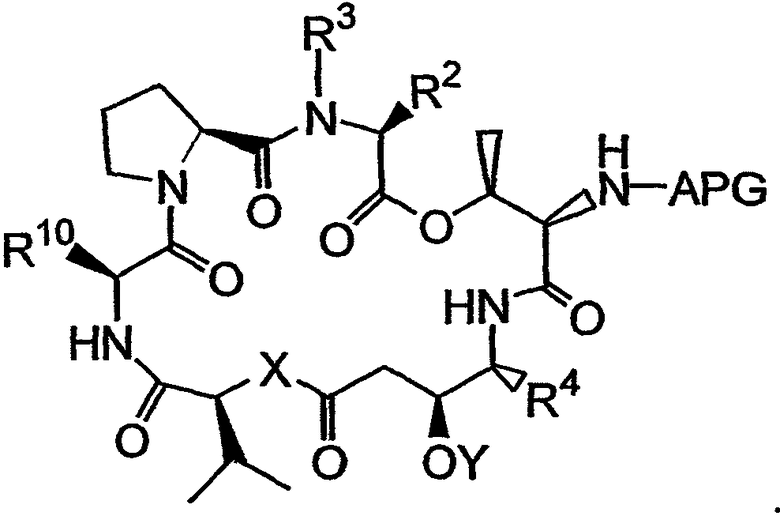
Группа APG (которая может, например, представлять собой карбобензилоксигруппу или трет-бутилкарбонильную группу) может быть удалена из первого аналога дидемнина с получением второго аналога дидемнина, имеющего структуру:
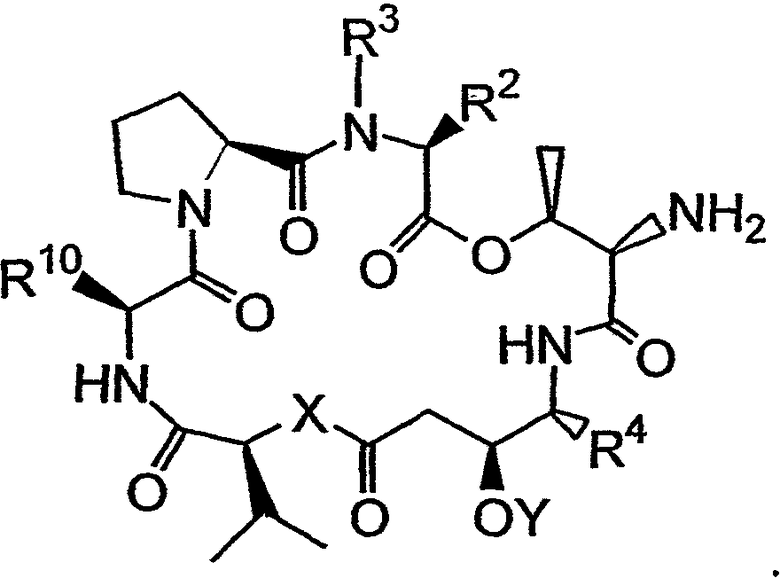
Указанный второй аналог дидемнина может быть связан с четвертым реагентом, имеющим структуру:
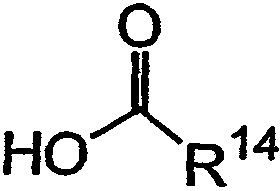
с получением третьего аналога дидемнина, имеющего структуру:
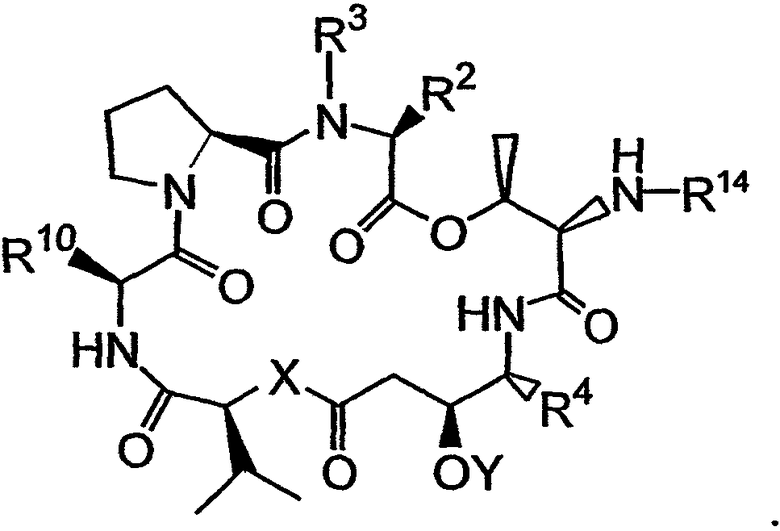
В указанных структурах R14 может представлять собой одну из следующих групп:
-(трет-бутилоксикарбонил),
-лейцин,
-(N-метил)лейцин,
-(N-метил)лейцин-(первый флуорофор),
-(N-метил)лейцин-пролин,
-(N-метил)лейцин-пролин-лактат,
-(N-метил)лейцин-пролин-пируват,
-(N-метил)лейцин-пролин-лактат-(первый флуорофор),
-(N-метил)лейцин-пролин-лактат-глутамин-пироглутамат,
-(N-метил)лейцин-пролин-лактат-глутамин-циклопентаноат,
-(N-метил)лейцин-пролин-аланин-лейцин-пироглутамат,
-(N-метил)лейцин-пролин-(N-метил-аланин)-лейцин-пироглутамат,
-(N-метил)лейцин-дезоксопролин,
-(N-метил)лейцин-дезоксопролин-лактат,
-(N-метил)лейцин-дезоксопролин-пируват,
-(N-метил)лейцин-дезоксопролин-лактат-(первый флуорофор),
-(N-метил)лейцин-дезоксопролин-лактат-глутамин-пироглутамат,
-(N-метил)лейцин-дезоксопролин-лактат-глутамин-циклопентаноат,
-(N-метил)лейцин-дезоксопролин-аланин-лейцин-пироглутамат,
-(N-метил)лейцин-дезоксопролин-(N-метил-аланин)-лейцин-пироглутамат,
-(N-метил)лейцин-дегидропролин,
-(N-метил)лейцин-дегидропролин-лактат,
-(N-метил)лейцин-дегидропролин-пируват,
-(N-метил)лейцин-дегидропролин-лактат-(первый флуорофор),
-(N-метил)лейцин-дегидропролин-лактат-глутамин-пироглутамат,
-(N-метил)лейцин-дегидропролин-лактат-глутамин-циклопентаноат,
-(N-метил)лейцин-дегидропролин-аланин-лейцин-пироглутамат и
-(N-метил)лейцин-дегидропролин-(N-метил-аланин)-лейцин-пироглутамат,
или он может представлять собой одну из указанных групп, соединенных с расщепляемой ферментом группой, которая расщеплена ферментом, таким как один из группы, включающей карбоксипептидазу, бета-лактамазу, бета-галактозидазу, V-амидазу пенициллина, цитозиндезаминазу, нитроредуктазу, щелочную фосфатазу, бета-глюкуронидазу и каталитическое антитело. Если Y обозначает защитную группу для гидроксила, то она в дальнейшем может быть удалена из третьего аналога дидемнина (либо перед, либо после добавления R14) с получением четвертого аналога дидемнина, имеющего структуру:
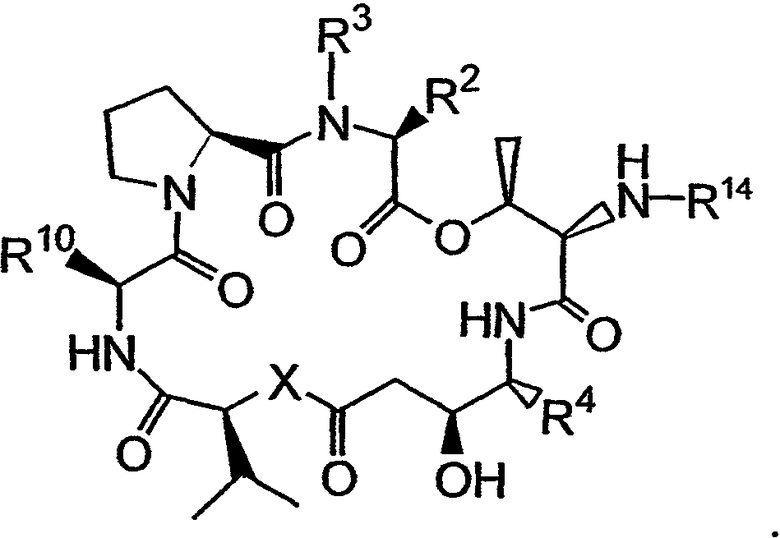
Настоящее изобретение также относится к способу получения дезоксопролинсодержащих аналогов тамандарина и дидемнина. Указанные способы используют известные методики получения аналогов тамандарина и дидемнина и далее они были модифицированы с целью включения дезоксопролинового остатка вместо пролинового остатка в аналог.
Кроме того, настоящее изобретение относится к способу получения дегидропролинсодержащих аналогов тамандарина и дидемнина. Указанные способы включают известные методики получения аналогов тамандарина и дидемнина, и они были модифицированы с целью включения дегидропролинового остатка вместо пролинового остатка в аналог.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1, включающая фиг.1А и 1В, изображает структуру тамандарина А (то есть {(2S)HIV2}дидемнина В). Фиг.1А иллюстрирует структуру (-)тамандарина А (соединение 101). Фиг.1В иллюстрирует структуру диастереомера (соединение 102) (-)тамандарина А. Хиральный центр, по которому различаются две указанные молекулы, обозначен стрелкой.
Фиг.2, включающая фиг.2А и 2В, изображает структуру тамандарина М (то есть {(2S)HIV2}дидемнина М). Фиг.2А иллюстрирует структуру (-)тамандарина М (соединение 103). Фиг.2В иллюстрирует структуру диастереомера (соединение 104) (-)тамандарина М. Хиральный центр, по которому различаются две указанные молекулы, обозначен стрелкой.
Фиг.3, включающая фиг.3А и 3В, изображает структуру тамандарина В (то есть {(2S)HIV2}дидемнина В). Фиг.3А иллюстрирует структуру (-)тамандарина В (соединение 105). Фиг.3В иллюстрирует структуру диастереомера (соединение 106) (-)тамандарина В. Хиральный центр, по которому различаются две указанные молекулы, обозначен стрелкой.
Фиг.4, включающая фиг. 4А, 4В, 4С и 4D, изображает структуру нескольких флуоресцентных аналогов дидемнина тамандаринового типа. Фиг.4А иллюстрирует структуру соединения 107. Фиг.4В иллюстрирует структуру соединения 108. Хиральный центр, по которому различаются соединения 107 и 108, обозначен стрелкой. Фиг.4С иллюстрирует структуру соединения 109. Фиг.4D иллюстрирует структуру соединения 110. Хиральный центр, по которому различаются соединения 109 и 110, обозначен стрелкой.
Фиг.5, включающая фиг. 5А и 5В, изображает класс иммобилизуемых аналогов дидемнина тамандаринового типа. Фиг.5А иллюстрирует структуру аналога дидемнина формулы I, где R10 обозначает боковую цепь лизина. Фиг.5В иллюстрирует структуру аналога дидемнина, представленного на фиг.5А, связанного с твердой подложкой (SS).
Фиг.6, включающая фиг.6А и 6В, изображает другой класс иммобилизуемых аналогов дидемнина тамандаринового типа. Фиг.6А иллюстрирует структуру аналога дидемнина формулы I, где R1 обозначает лейцин. Фиг.6В иллюстрирует структуру аналога дидемнина, представленного на фиг.6А, связанного с твердой подложкой (SS).
Фиг.7 иллюстрирует структуру соединения 115.
Фиг.8 иллюстрирует структуру соединения 116.
Фиг.9 иллюстрирует структуру соединения 117.
Фиг.10 иллюстрирует структуру соединения 118.
Фиг.11 иллюстрирует структуру соединения 119.
Фиг.12 иллюстрирует структуру соединения 120.
Фиг.13 иллюстрирует структуру соединения 121.
Фиг.14 иллюстрирует структуру соединения 122.
Фиг.15 иллюстрирует структуру соединения 123.
Фиг.16 иллюстрирует структуру соединения 124.
Фиг.17 иллюстрирует структуру соединения 125.
Фиг.18 иллюстрирует структуру соединения 126.
Фиг.19 иллюстрирует структуру соединения 127.
Фиг.20 иллюстрирует структуру соединения 128.
Фиг.21 иллюстрирует структуру соединения 129.
Фиг.22 иллюстрирует структуру соединения 130.
Фиг.23 изображает ферментативное расщепление цефалоспориновой группы аналога дидемнина 131 под действием бета-лактамазы с получением соединения 101.
Фиг.24 изображает ферментативное расщепление глюкозидной группы аналога дидемнина 132 под действием бета-глюкуронидазы с получением соединения 101.
Фиг.25, включающая фиг.25А и 25В, изображает пару структур, которые иллюстрируют структурное различие между тамандарином А (101; фиг.25А) и дидемнином В (201; фиг.25В). Макроциклическое ядро соединения 101 отличается от такового у соединения 201 тем, что у соединения 101 оно содержит альфа-гидроксиизовалерилгруппу (Hiv), а у соединения 201 оно содержит альфа-(альфа-гидроксиизовалерил)пропионилгруппу (Hip) в аналогичном положении, что обозначено скобками и пунктирной линией на каждом из чертежей.
Фиг.26, включающая фиг.26А-26Е, изображает способ синтеза с целью получения аналогов дидемнина, приведенных в настоящем описании.
Фиг.27 изображает структуру (-)тамандарина А (то есть {(2S)HIV2}дидемнина В), иллюстрирующую принятую нумерацию, используемую в настоящем описании и в работе Сакаи с соавт. (Sakai et al., 1996, J. Med. Chem., 39:2819-2834) для аналогов дидемнина.
Фиг.28, включающая фиг.28А и 28В, изображает структуру аналога дидемнина дегидротамандаринового типа (то есть {(2S)HIV2}дегидродидемнина В). Фиг.28А иллюстрирует структуру (-)дегидротамандарина (соединение 133). Фиг.28В иллюстрирует структуру диастереомера (-)дегидротамандарина (соединение 134). Хиральный центр, по которому различаются две указанные молекулы, обозначен стрелкой. Положение, по которому данные аналоги дидемнина дегидротамандаринового типа отличаются от аналогов дидемнина тамандаринового типа, обозначено звездочкой.
Фиг.29 иллюстрирует структуру флуоресцентного аналога дидемнина дегидротамандаринового типа. FL обозначает флуорофор.
Фиг.30 иллюстрирует структуру соединения 136.
Фиг.31 иллюстрирует структуру соединения 137.
Фиг.32 изображает аналог дидемнина дегидротамандаринового типа, связанный с твердой подложкой (SS).
Фиг.33 иллюстрирует структуру соединения 139.
Фиг.34 иллюстрирует структуру соединения 140.
Фиг.35, включающая фиг.35А и 35В, изображает структуру дегидротамандарина В, также обозначаемого как {(2S)HIV2, Norsta1}дидемнин В). Фиг.35А иллюстрирует структуру (-)дегидротамандарина В (соединение 141). Фиг.35В иллюстрирует структуру диастереомера (-)дегидротамандарина В (соединение 142). Хиральный центр, по которому различаются две указанные молекулы, обозначен стрелкой.
Фиг.36 иллюстрирует структуру соединения 143.
Фиг.37, включающая фиг.37А и 37В, изображает способ синтеза с целью получения (-)дегидротамандарина (то есть {(2S)HIV2}дегидродидемнина В, соединения 133).
Фиг.38, включающая фиг.38А, 38В и 38С, изображает способ синтеза с целью получения флуоресцентных аналогов дидемнина, приведенных в настоящем описании.
Фиг.39 иллюстрирует структуру предпочтительного дезоксопролинового аналога тамандарина, обозначенного как соединение 201.
Фиг.40 иллюстрирует структуру предпочтительного дезоксопролинового аналога дидемнина, обозначенного как соединение 202.
Каждая из фиг.41, фиг.42 и фиг.43 изображает способ получения групп с дезоксопролинсодержащей боковой цепью для аналогов тамандарина или дидемнина.
Фиг.44 изображает способ получения групп с дегидропролинсодержащей боковой цепью для аналогов тамандарина или дидемнина.
Фиг.45 иллюстрирует структуру предпочтительного дегидропролинового аналога тамандарина, обозначенного как соединение 203.
Фиг.46 иллюстрирует структуру предпочтительного дегидропролинового аналога дидемнина, обозначенного как соединение 204.
Каждая из фиг.47, фиг.48, фиг.49 и фиг.50 изображает способ получения аналогов дидемнина, содержащих фотореактивные группы в боковой цепи.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к аналогам тамандарина и дидемнина, включая аналоги, которые содержат в своей структуре дезоксопролиновый остаток или дегидропролиновый остаток. Настоящее изобретение относится к композициям, включающим такие аналоги, а также способы получения и использования таких аналогов. Указанные аналоги полезны, в том числе для ингибирования синтеза белка, клеточного роста, клеточной пролиферации и онкогенеза. Аналоги согласно настоящему изобретению могут также проявлять противовирусную, противоопухолевую, апоптозиндуцирующую и иммуносупрессорную активность у животных, включая людей.
Настоящее изобретение охватывает композиции, включающие аналог тамандарина, имеющий структуру:
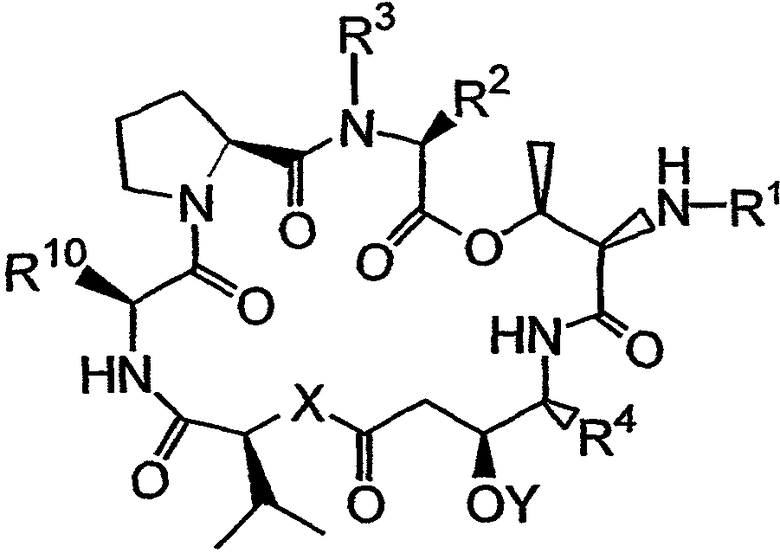
где R1, R2, R3, R4, R10, X и Y имеют значения, приведенные в настоящем описании. Примеры аналогов указанной формулы показаны на чертежах.
Настоящее изобретение также относится к композициям, включающим аналог дидемнина, имеющий структуру:
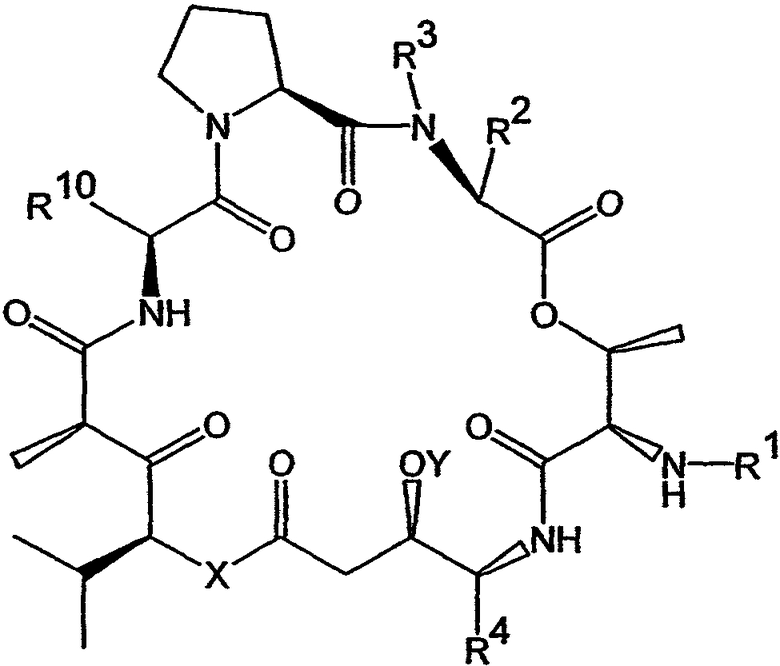
где R1, R2, R3, R4, R10, X и Y имеют значения, приведенные в настоящем описании.
Определения
В контексте настоящего описания каждый из следующих терминов имеет значение, указанное в данном разделе.
В контексте настоящего описания аминокислотные остатки обозначаются полным наименованием, трехбуквенным кодом, соответствующим ему, или однобуквенным кодом, соответствующим ему, как указано ниже:
Глутаминовая кислота
Glu
E
В контексте настоящего описания термин "боковая цепь аминокислоты" относится к группе, включающей все атомы аминокислоты, за исключением атома альфа-углерода, атома водорода, связанного с альфа-углеродом, атомов альфа-карбоксильной группы и альфа-аминогруппы. Так, например, определение "боковая цепь аланина" относится к метильной группе, а определение "боковая цепь валина" относится к 2-пропильной группе.
"Ингибирование" процессов в клетке (например, ингибирование синтеза белка, ингибирование клеточного роста, ингибирование прогрессии клеточного цикла, ингибирование пролиферации клеток или ингибирование онкогенеза) означает снижение (например, по меньшей мере на 10%, 25%, 50%, 75%, 90%, 95% или даже на 100%) скорости осуществления процесса, снижение (например, по меньшей мере на 10%, 25%, 50%, 75%, 90%, 95% или даже на 100%) скорости, с которой процесс инициируется, или того и другого вместе.
"Усиление" процессов в клетке (например, усиление апоптоза) обозначает увеличение (например, по меньшей мере на 10%, 25%, 50%, 75%, 90%, 95% или даже на 100%) скорости, с которой процесс протекает, увеличение (например, по меньшей мере на 10%, 25%, 50%, 75%, 90%, 95% или даже на 100%) скорости, с которой процесс инициируется, или того и другого вместе.
В контексте настоящего описания термин "фармацевтически приемлемый носитель" означает химическую композицию, с которой аналог или фрагмент дидемнина согласно настоящему изобретению может быть объединен, и которая после такого объединения может быть введена субъекту (например, человеку или другому животному).
В контексте настоящего описания термин "физиологически приемлемый(ая)" сложный эфир или соль обозначает форму сложного эфира или соли аналога дидемнина или фрагмента дидемнина согласно настоящему описанию, которая совместима с другими ингредиентами фармацевтической композиции и которая не оказывает вредного воздействия на субъект, которому данная композиция вводится.
В контексте настоящего описания термин "парентеральное введение" фармацевтической композиции включает любой способ введения, который отличается физическим разрывом ткани субъекта и введением фармацевтической композиции через указанный разрыв в ткани. Парентеральное введение, таким образом, включает, не ограничиваясь приведенным списком, введение фармацевтической композиции посредством инъекции композиции, посредством нанесения композиции через хирургический разрез, посредством нанесения композиции через нехирургическую рану, проникающую через ткань, и др. В частности, парентеральное введение может включать, не ограничиваясь приведенным перечнем, подкожную, внутрибрюшинную, внутримышечную, внутригрудинную инъекцию и методику инфузии почечным диализом.
В контексте настоящего описания термин "противовирусная активность" обозначает предупреждение репликации вируса в клетке, предупреждение инфекции клетки вирусом или реверсирование физиологического эффекта инфицирования клетки вирусом. Противовирусный агент в рассматриваемой композиции представляет собой такой агент, который при доставке в клетку проявляет противовирусную активность. Противовирусные агенты хорошо известны и описаны в литературе. В качестве примера можно привести AZT (зидовудин, ретровир® Glaxo Wellcome Inc., Research Triangle Park, NC), представляющий собой противовирусный агент, который, как считается, препятствует репликации ВИЧ в клетках человека.
В контексте настоящего описания группа или остаток "дезоксопролина" представляет собой химическую группу, которая имеет следующую структуру:
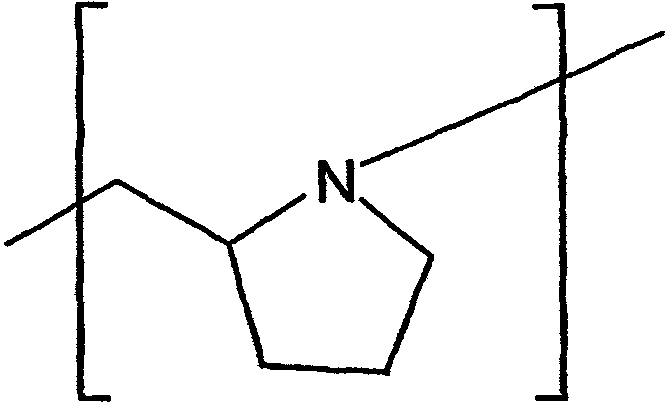
В контексте настоящего описания группа или остаток "дегидропролина" представляет собой химическую группу, которая имеет следующую структуру:
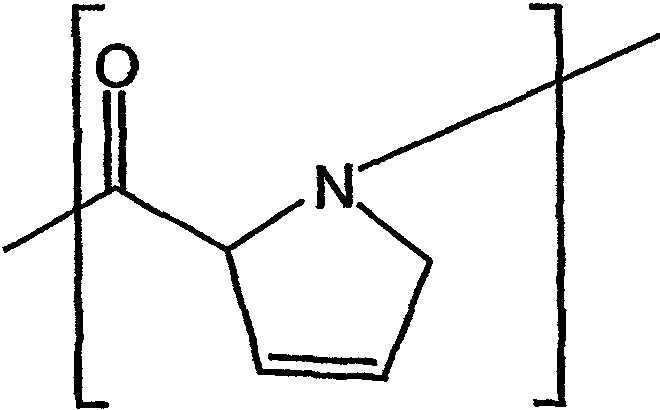
Описание
Настоящее изобретение относится к аналогам тамандарина и дидемнина, включая те из них, которые содержат в своей структуре дезоксопролиновую или дегидропролиновую группу (и, конечно, те, которые не имеют в своей структуре дезоксопролиновой или дегидропролиновой группы). Указанные аналоги проявляют мощные фармакологические свойства при введении в организм человека и других млекопитающих. В качестве примера следует отметить, что указанные соединения могут ингибировать синтез белка и рост и пролиферацию клеток. Указанные соединения могут также усиливать апоптоз в клетках. Приведенные свойства делают данные соединения полезными при лечении множества заболеваний, которые характеризуются одним или несколькими показателями, такими как аберрантный синтез белка, аберрантный клеточный рост, аберрантная пролиферация клеток и аберрантный апоптоз. Примеры таких заболеваний включают онкогенез, рост опухоли, метастазирование опухоли, инфицирование клетки вирусом и репликацию вируса внутри клетки.
В число композиций согласно настоящему изобретению входят те, которые включают аналог тамандарина, имеющий структуру формулы I, или аналог дидемнина, имеющий структуру формулы XXI:
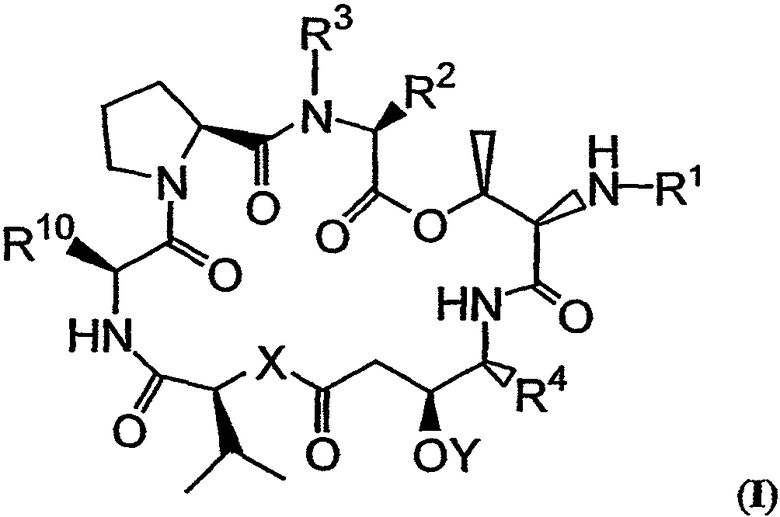
Заместитель R1 в формулах I и XXI может содержать в своей структуре дезоксопролиновую группу и может, например, представлять собой атом водорода или защитную группу для аминогруппы, подходящую для защиты аминокислот. Такие защитные группы известны в технике и в тексте настоящего описания приведены ссылки на них. Примеры подходящих защитных групп можно найти в монографиях: Green and Wutz, 1999, Protecting Groups in Organic Synthesis, Wiley, New York, и Bodansky, 1993, Principles of Peptide Synthesis, Springer, Berlin. Альтернативно, R1 заместитель может представлять собой аминокислотный остаток (например, остаток лейцина) или полипептид, включающий один или более аминокислотных остатков. Примеры таких остатков и полипептидов включают
-(N-метил)лейцин,
-(N-метил)лейцин-(первый флуорофор),
-(N-метил)лейцин-пролин,
-(N-метил)лейцин-пролин-лактат,
-(N-метил)лейцин-пролин-пируват,
-(N-метил)лейцин-пролин-лактат-глутамин-пироглутамат,
-(N-метил)лейцин-пролин-лактат-глутамин-циклопентаноат,
-(N-метил)лейцин-пролин-лактат-лейцин-пироглутамат,
-(N-метил)лейцин-пролин-аланин-лейцин-пироглутамат,
-(N-метил)лейцин-пролин-(N-метил)аланин-лейцин-пироглутамат,
-(N-метил)лейцин-дезоксопролин,
-(N-метил)лейцин-дезоксопролин-лактат,
-(N-метил)лейцин-дезоксопролин-пируват,
-(N-метил)лейцин-дезоксопролин-лактат-глутамин-пироглутамат,
-(N-метил)лейцин-дезоксопролин-лактат-глутамин-циклопентаноат,
-(N-метил)лейцин-дезоксопролин-лактат-лейцин-пироглутамат,
-(N-метил)лейцин-дезоксопролин-аланин-лейцин-пироглутамат,
-(N-метил)лейцин-дезоксопролин-(N-метил)аланин-лейцин-пироглутамат,
-(N-метил)лейцин-дегидропролин,
-(N-метил)лейцин-дегидропролин-лактат,
-(N-метил)лейцин-дегидропролин-пируват,
-(N-метил)лейцин-дегидропролин-лактат-(первый флуорофор),
-(N-метил)лейцин-дегидропролин-лактат-глутамин-пироглутамат,
-(N-метил)лейцин-дегидропролин-лактат-глутамин-циклопентаноат,
-(N-метил)лейцин-дегидропролин-аланин-лейцин-пироглутамат и
-(N-метил)лейцин-дегидропролин-(N-метил-аланин)-лейцин-пироглутамат.
Дополнительные примеры альтернативного заместителя R1 включают пептиды, которые содержат флуорофор (например, родамин или кумарин), аминокислотный остаток, полипептид, ферментативно расщепляемую группу или другую химическую группу, связанную (например, ковалентно соединенную) с подложкой (например, со стеклянной или силикагелевой пластиной, агаровыми или другими полимерными шариками и др.). Флуорофор или ферментативно расщепляемая группа может быть непосредственно связана с аналогом или указанный аналог может быть связан с ними через линкер, включающий от 1 до примерно 13 или более атомов углерода (необязательно включающих одну или более вторичных аминных или амидных групп). В том случае, когда R1 включает N-метил-лейциновый остаток, альфа-атом углерода в указанном остатке может иметь либо (R), либо (S) стереохимическую конфигурацию. Другие аминокислотные остатки в области определения R1 могут иметь либо (R), либо (S) стереохимическую конфигурацию, но они предпочтительно имеют (S) стереохимическую конфигурацию относительно их альфа-углеродного атома. В том случае, когда R1 включает остаток лактата, указанный остаток лактата представляет собой предпочтительно (S)-лактатный остаток. В предпочтительном варианте осуществления изобретения каждый аминокислотный остаток в рамках определения R1, отличный от остатка лейцина (или N-метил-лейцина) (если он присутствует), непосредственно присоединенный к атому азота в кольце формулы I или XXI, имеет (S) стереохимическую конфигурацию.
R3 может представлять собой либо -CH3, либо -Н. Альтернативно, R3 может вместе с R2 образовывать единый заместитель.
Заместитель R2 может представлять собой боковую цепь аминокислоты, такую как боковая цепь изолейцина (то есть 2-бутильная группа, предпочтительно имеющая (R) стереохимическую конфигурацию), боковая цепь валина (то есть 2-пропильная группа), боковая цепь аланина (то есть метильная группа), боковая цепь норлейцина (то есть 1-бутильная группа), боковая цепь норвалина (то есть 1-пропильная группа), боковая цепь лейцина (то есть изобутильная группа, предпочтительно имеющая (S) стереохимическую конфигурацию), боковая цепь фенилаланина (то есть фенилметильная группа), боковая цепь гистидина (то есть 4-метилимидазольная группа), боковая цепь триптофана (то есть 3-метилиндольная группа), боковая цепь тирозина (то есть 4-гидроксифенилметильная группа), боковая цепь аргинина (то есть 4-гуанидинилбутильная группа) и боковая цепь лизина (то есть 4-аминобутильная группа).
Заместитель R2 может включать флуорофор (например, флуорофор, соединенный с одной из боковых цепей аминокислот из числа описанных выше). Кроме того, заместитель R2 может иметь структуру формулы III:
В альтернативном варианте осуществления изобретения R2 и R3 совместно образуют заместитель, имеющий структуру формулы IV:
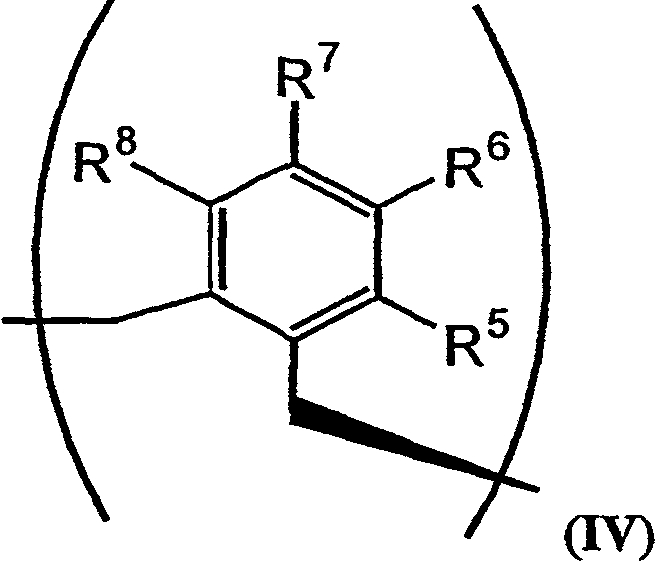
В формулах III и IV каждый из R5, R6, R7, R8 и R9 может независимо представлять собой заместитель, выбранный из группы, состоящей из -H, -OH, -OCH3, -CO(C6H5), -Br, -I, -F, -Cl, -CH3 и -CH2CH3.
R4 может представлять собой боковую цепь изолейцина или боковую цепь валина.
X может представлять собой -O- или -(NH)-.
Y может представлять собой -Н или защитную группу для гидроксила. Примеры защитных групп для гидроксила, которые могут присутствовать в Y, включают алкилзамещенную силильную группу, арилзамещенную силильную группу или силан, замещенный и алкильной, и арильной группами. Примером используемой защитной группы для гидроксила является триизопропилсилильная группа. Другие защитные группы для гидроксила, которые могут использоваться в Y формулы I, приведены в соответствующих руководствах, таких как Green and Wutz, 1999, Protecting Groups in Organic Synthesis, Wiley, New York.
R10 может представлять собой боковую цепь аминокислоты, такую как боковая цепь лейцина или боковая цепь лизина. Альтернативно, R10 может представлять собой аминокислоту или другую химическую группу, которая связывается (например, ковалентно присоединяется) с подложкой (например, с твердой подложкой). Пример подложки, присоединенной к аналогу, имеющему структуру формулы I, изображен на фиг.5В.
Другая группа композиций, охватываемых настоящим изобретением, представляет собой те композиции, которые включают аналог тамандарина, имеющий структуру, выбираемую из группы, состоящей из структур формул (a)-(d), приведенных выше.
Каждый из R2, R3, R4, R10, X и Y в формулах (a)-(d) имеет те же значения, что были указаны для формул I и XXI.
В формулах (a)-(d) R13 может обозначать водород или представлять собой химическую группу, которая может быть расщеплена ферментом (то есть ферментативно расщепляемую группу), или может быть фотореактивной. В контексте настоящего описания ферментативно расщепляемая группа может включать любую химическую группу, которая может быть расщеплена (то есть химически отщеплена) в присутствии специфического фермента. Примеры ферментов, способных к химическому отщеплению ферментативно расщепляемой группы, включают карбоксипептидазы, бета-лактамазу, бета-галактозидазу, V-амидазу пенициллина, цитозиндезаминазу, нитроредуктазу, щелочную фосфатазу, бета-глюкуронидазу и каталитические антитела. Примеры ферментативно расщепляемых групп, которые могут быть включены в приведенное в настоящем описании соединение, включают цефалоспорины, бета-глюкозиды, фосфат, пирофосфат, бета-D-галактозиды, нитробензамидин, цитозин, карбаматы, пептиды и аминокислоты. Альтернативно, R13 может представлять собой ферментативно расщепляемую группу, такую как дипептид, соединенный с глутамин-пироглутаматом, или группу, имеющую структуры формулы V или формулы VI:
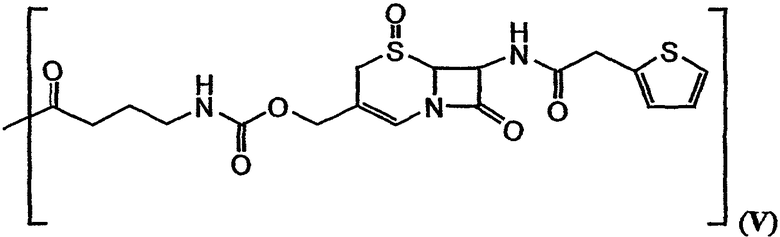
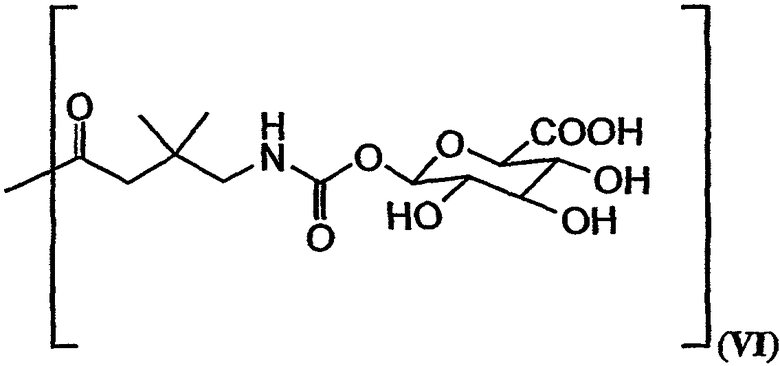
В качестве иллюстрации можно указать, что в соединении 131, изображенном на фиг.23, R13 представляет собой ферментативно расщепляемую группу, имеющую структуру формулы V (то есть цефалоспориновую группу). Цефалоспориновая группа в соединении 131 может быть расщеплена при контакте с ферментом бета-лактамазой с образованием соединения 101. Заместитель R13, имеющий структуру формулы VI, может, например, иметь форму натриевой или калиевой соли.
После расщепления ферментативно расщепляемой группы ферментом полученный аналог дидемнина может проявлять одну или более физиологических активностей из числа указанных в настоящем описании. Аналог тамандарина или дидемнина, имеющий структуру одной из формул (a)-(d), где R13 обозначает ферментативно расщепляемую группу, может необязательно проявлять указанные активности до отщепления ферментативно расщепляемой группы. Однако в предпочтительном варианте осуществления изобретения, аналог проявляет терапевтическую активность только после отщепления от него ферментативно расщепляемой группы.
Как было описано выше, аналог тамандарина или дидемнина, имеющий структуру одной из формул I, XXI и (a)-(d), может быть связан с подложкой. Химическая природа подложки не является решающим фактором. Подложка может по существу представлять собой любой материал, с которым такой аналог может связаться (например, посредством ковалентного присоединения через одну из R10, R2, R3 или R1 групп). Примеры материалов подложки включают связанные силикаты, сшитую агарозу, полиакриламид, декстран и аллилдекстран. Такие материалы подложки могут быть химически модифицированы с использованием реакционноспособных химических групп с целью облегчения ковалентного присоединения аналога к подложке. Химические модификации указанного типа известны в технике и могут, например, включать модификацию подложки цианогенбромидными группами, эпоксидными группами, мезильными группами и карбоксигексильными группами. Методики приготовления подложки и последующего присоединения соединения к подложке известны в технике и могут быть модифицированы любым специалистом в данной области для целей использования с рассматриваемым аналогом дидемнина.
Примеры аналогов дидемнина, имеющих структуру формулы I или формулы XXI, включают соединение 21 и соединения 101-143, некоторые из которых изображены на фиг.1-39.
В соединении 21 R1 обозначает -(трет-бутилоксикарбонил), R2 обозначает боковую цепь О-метил-тирозина (то есть R5, R6, R8 и R9 обозначают, каждый, -Н и R7 обозначает -OCH3), R3 обозначает -СН3, R4 обозначает боковую цепь изолейцина, R10 обозначает боковую цепь лейцина, Х обозначает -О- и Y обозначает -(триизопропилсилил).
Предпочтительные аналоги тамандарина основаны на структуре тамандарина А. В тамандарине А ({(2S)Hiv2}дидемнин В; соединение 101) R1 обозначает -(N-метил-R-лейцин)-пролин-лактат, R2 обозначает боковую цепь О-метил-тирозина (то есть R5, R6, R8 и R9 обозначают, каждый, -Н и R7 обозначает -OCH3), R3 обозначает -СН3, R4 обозначает боковую цепь изолейцина, R10 обозначает боковую цепь лейцина, Х обозначает -О- и Y обозначает -Н.
В тамандарине М ({(2S)Hiv2}дидемнин М; соединение 103) R1 обозначает -(N-метил-R-лейцин)-пролин-лактат-глутамин-пироглутамат, R2 обозначает боковую цепь О-метил-тирозина (то есть R5, R6, R8 и R9 обозначают, каждый, -Н и R7 обозначает -OCH3), R3 обозначает -СН3, R4 обозначает боковую цепь изолейцина, R10 обозначает боковую цепь лейцина, Х обозначает -О- и Y обозначает -Н.
Предпочтительные аналоги дидемнина основаны на структуре дидемнина В. В тамандарине В ({(2S)Hiv2, Norsta1}дидемнин В; соединение 105) R1 обозначает -(N-метил-R-лейцин)-пролин-лактат, R2 обозначает боковую цепь О-метил-тирозина (то есть R5, R6, R8 и R9 обозначают, каждый, -Н и R7 обозначает -OCH3), R3 обозначает -СН3, R4 обозначает боковую цепь валина, R10 обозначает боковую цепь лейцина, Х обозначает -О- и Y обозначает -Н.
В соединении 107 R1 обозначает -(N-метил-R-лейцин)-глицин-(7-диметилкумарин-4-ацетат), R2 обозначает боковую цепь О-метил-тирозина (то есть R5, R6, R8 и R9 обозначают, каждый, -Н и R7 обозначает -OCH3), R3 обозначает -СН3, R4 обозначает боковую цепь изолейцина, R10 обозначает боковую цепь лейцина, Х обозначает -О- и Y обозначает -Н.
В соединении 109 R1 обозначает -(N-метил-R-лейцин)-пролин-лактат-родамин, R2 обозначает боковую цепь О-метил-тирозина (то есть R5, R6, R8 и R9 обозначают, каждый, -Н и R7 обозначает -OCH3), R3 обозначает -СН3, R4 обозначает боковую цепь изолейцина, R10 обозначает боковую цепь лейцина, Х обозначает -О- и Y обозначает -Н.
В соединении 111 R1 обозначает -(N-метил-R-лейцин)-пролин-лактат, R2 обозначает боковую цепь О-метил-тирозина (то есть R5, R6, R8 и R9 обозначают, каждый, -Н и R7 обозначает -OCH3), R3 обозначает -СН3, R4 обозначает боковую цепь изолейцина, R10 обозначает боковую цепь лизина, Х обозначает -О- и Y обозначает -Н.
В соединении 113 R1 обозначает -(N-метил-R-лейцин), R2 обозначает боковую цепь О-метил-тирозина (то есть R5, R6, R8 и R9 обозначают, каждый, -Н и R7 обозначает -OCH3), R3 обозначает -СН3, R4 обозначает боковую цепь изолейцина, R10 обозначает боковую цепь лейцина, Х обозначает -О- и Y обозначает -Н.
В соединении 115 R1 обозначает -(N-метил-R-лейцин)-пролин-лактат, R2 обозначает боковую цепь лизина, R3 обозначает -СН3, R4 обозначает боковую цепь изолейцина, R10 обозначает боковую цепь лейцина, Х обозначает -О- и Y обозначает -Н.
В соединении 123 R1 обозначает -(N-метил-R-лейцин)-пролин-лактат, R2 и R3 совместно образуют тетрагидроизохинолиновый заместитель, имеющий структуру формулы IV, R5, R6 и R8 обозначают, каждый, -Н, R7 обозначает -OCH3, R4 обозначает боковую цепь валина, R10 обозначает боковую цепь лейцина, Х обозначает -О- и Y обозначает -Н.
В соединении 124 R1 обозначает -(N-метил-R-лейцин)-пролин-лактат, R2 обозначает боковую цепь О-метил-тирозина (то есть R5, R6, R8 и R9 обозначают, каждый, -Н и R7 обозначает -OCH3), R3 обозначает -СН3, R4 обозначает боковую цепь изолейцина, R10 обозначает боковую цепь лейцина, Х обозначает -(NH)- и Y обозначает -Н.
В соединении 128 R1 обозначает -(N-метил-R-лейцин)-пролин-лактат-глутамин-циклопентаноат, R2 обозначает боковую цепь О-метил-тирозина (то есть R5, R6, R8 и R9 обозначают, каждый, -Н и R7 обозначает -OCH3), R3 обозначает -СН3, R4 обозначает боковую цепь изолейцина, R10 обозначает боковую цепь лейцина, Х обозначает -О- и Y обозначает -Н.
В соединении 129 R1 обозначает -(N-метил-R-лейцин)-пролин-(N-метил-S-аланин)-лейцин-пироглутамат, R2 обозначает боковую цепь О-метил-тирозина (то есть R5, R6, R8 и R9 обозначают, каждый, -Н и R7 обозначает -OCH3), R3 обозначает -СН3, R4 обозначает боковую цепь изолейцина, R10 обозначает боковую цепь лейцина, Х обозначает -О- и Y обозначает -Н.
В соединении 131 R1 обозначает -(N-метил-R-лейцин)-пролин-лактат, R2 обозначает боковую цепь О-метил-тирозина (то есть R5, R6, R8 и R9 обозначают, каждый, -Н и R7 обозначает -OCH3), R3 обозначает -СН3, R4 обозначает боковую цепь изолейцина, R10 обозначает боковую цепь лейцина, R13 обозначает цефалоспориновую группу, расщепляемую ферментом бета-лактамазой, Х обозначает -О- и Y обозначает -Н.
В соединении 132 R1 обозначает -(N-метил-R-лейцин)-(S)пролин-(S)лактат, R2 обозначает боковую цепь О-метил-тирозина (то есть R5, R6, R8 и R9 обозначают, каждый, -Н и R7 обозначает -OCH3), R3 обозначает -СН3, R4 обозначает боковую цепь изолейцина, R10 обозначает боковую цепь лейцина, R13 обозначает бета-глюкозидную группу, расщепляемую ферментом бета-глюкуронидазой, Х обозначает -О- и Y обозначает -Н.
В соединении 134 R1 обозначает -(N-метил-S-лейцин)-(S)пролин-пируват, R2 обозначает боковую цепь О-метил-тирозина (то есть R5, R6, R8 и R9 обозначают, каждый, -Н и R7 обозначает -OCH3), R3 обозначает -СН3, R4 обозначает боковую цепь изолейцина, R10 обозначает боковую цепь лейцина, Х обозначает -О- и Y обозначает -Н.
В соединении 137 R1 обозначает -(N-метил-R-лейцин)-(S)пролин-пируват, R2 и R3 совместно образуют тетрагидроизохинолиновый заместитель, имеющий структуру формулы IV; R5, R6 и R8 обозначают, каждый, -Н, R4 обозначает боковую цепь изолейцина, R10 обозначает боковую цепь лейцина, Х обозначает -О- и Y обозначает -Н.
В соединении 138 R1 обозначает -(N-метил-R-лейцин)-(S)пролин-пируват, R2 обозначает боковую цепь О-метил-тирозина (то есть R5, R6, R8 и R9 обозначают, каждый, -Н и R7 обозначает -OCH3), R3 обозначает -СН3, R4 обозначает боковую цепь изолейцина, R10 обозначает боковую цепь лизина, ковалентно присоединенную к подложке, Х обозначает -О- и Y обозначает -Н.
В соединении 142 R1 обозначает -(N-метил-S-лейцин)-(S)пролин-пируват, R2 обозначает боковую цепь О-метил-тирозина (то есть R5, R6, R8 и R9 обозначают, каждый, -Н и R7 обозначает -OCH3), R3 обозначает -СН3, R4 обозначает боковую цепь валина, R10 обозначает боковую цепь лейцина, Х обозначает -О- и Y обозначает -Н.
В соединении 143 R1 обозначает -(N-метил-R-лейцин)-(S)пролин-пируват, R2 обозначает боковую цепь О-метил-тирозина (то есть R5, R6, R8 и R9 обозначают, каждый, -Н и R7 обозначает -OCH3), R3 обозначает -СН3, R4 обозначает боковую цепь изолейцина, R10 обозначает боковую цепь лейцина, Х обозначает -(NH)- и Y обозначает -Н.
Структурное сходство дидемнина В и тамандарина А (то есть {(2S)Hiv2}дидемнина В; соединение 101) проиллюстрировано на фиг.25. Главное структурное отличие, отмеченное скобками и пунктирной линией, находится в макроциклической области указанных соединений. Тамандарин А, показанный на фиг.25А, содержит альфа-гидроксиизовалерильную (Hiv) группу, а дидемнин В, показанный на фиг.25В, содержит альфа-(альфа-гидроксиизовалерил)пропионильную (Hip) группу. Более простая макроциклическая структура тамандарина А и любого соединения, имеющего структуру формулы I или формулы XXI, может быть синтезирована легче, чем макроциклическая структура дидемнина В. Соединения, которые имеют структуру либо формулы I, либо формулы XXI, могут быть приготовлены легче (и в основном дешевле), чем соединения, которые являются идентичными, но содержат Hip-группу вместо Hiv-группы.
Другая группа соединений, которые могут проявлять рассматриваемые в данном описании физиологические активности и которые включены в рамки настоящего изобретения, охватывает соединения, которые соответствуют фрагментам аналогов дидемнина, имеющих структуру формулы I или формулы XXI. Фрагменты, которые демонстрируют указанную активность, включают те из них, которые имеют структуру формулы VII:
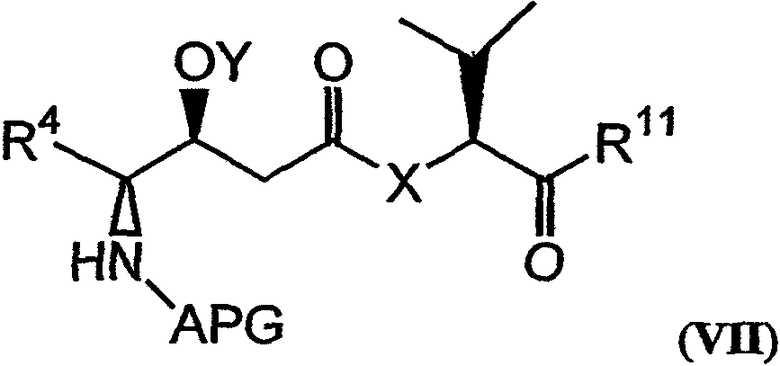
В формуле VII X, Y и R4 имеют значения, описанные для формул I и XXI, и APG обозначает защитную группу для амина. Примеры защитных групп для амина, которые могут присутствовать в активных фрагментах, включают карбобензилокси (CBZ) и трет-бутилоксикарбонильные (BOC) группы. Другие применяемые защитные группы для амина описаны в Green and Wutz, 1999, Protecting Groups in Organic Synthesis, Wiley, New York, и Bodansky, 1993, Principles of Peptide Synthesis, Springer, Berlin.
Заместитель R11 в формуле VII может быть любым из группы -ОН, -NH2, -(O-аллил) и -(О-пентафторфенил). Альтернативно, R11 может представлять собой заместитель, имеющий структуру формулы VIII:
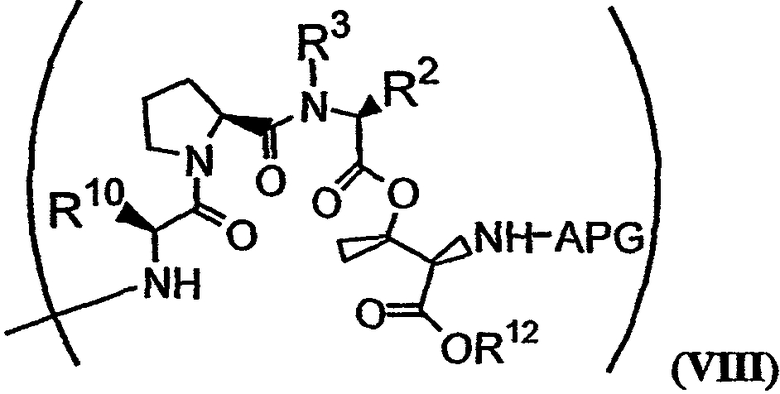
В формуле VIII R2, R3 и R10 имеют значения, описанные для формул I и XXI, и APG обозначает защитную группу для амина, описанную для формулы VII (хотя это необязательно должна быть та же группа APG, что и в формуле VII). R12 может представлять собой либо -Н, либо защитную группу для гидроксила согласно данному описанию. Соединения, имеющие структуру формулы VII, которые могут быть получены и использованы в соответствии с настоящим описанием, включают соединения, обозначенные номерами 6, 17, 19 и 20 на фиг.26.
Способы применения рассматриваемых соединений
Раскрываемые в настоящем описании аналоги дидемнина и тамандарина могут использоваться для воздействия на множество физиологических процессов. Каждый из указанных типов соединений может использоваться для ингибирования синтеза белка. Кроме того, соединения могут использоваться для ингибирования прогрессирования клеточного цикла. Не отдавая предпочтения какой-то конкретной теории действия, следует отметить, что активность настоящих соединений в отношении ингибирования клеточного цикла может быть связана с ингибированием синтеза белка, с ингибированием других видов клеточной активности, связанных с репликацией ДНК или с клеточным делением, или некоторым сочетанием указанных активностей. Такие аналоги тамандарина и дидемнина также индуцируют апоптоз в клетках. Физиологическая активность, свойственная указанным аналогам тамандарина и дидемнина, делает указанные соединения полезными для облегчения множества заболеваний, при которых один или более показателей клеточного роста, пролиферации и выживания являются аберрантными. Примеры таких заболеваний включают рак на всех стадиях (например, онкогенез, рост опухоли и метастазирование) и вирусные инфекции на разных стадиях (например, инфекция клеток вирусными частицами, продукция вирусных частиц внутри клетки и выживание клеток, инфицированных вирусами).
Не отдавая предпочтения какой-то определенной теории действия, следует отметить, что все виды физиологических активностей, которые свойственны рассматриваемым аналогам тамандарина и дидемнина, являются результатом одного или более видов взаимодействия между такими аналогами и по меньшей мере одним клеточным компонентом. Указанное(ые) взаимодействие(ия) ведет(ут) непосредственно или опосредованно к наблюдаемому клеточному ответу. Соответственно, настоящее изобретение относится к применению таких соединений для идентификации одного или большего числа клеточных компонентов, которые вносят вклад в фенотип заболевания индивидуума. Идентификация такого клеточного компонента может указывать эффективный курс лечения для облегчения заболевания. Примеры соединений, применяемых с данной целью, включают аналоги, которые содержат флуоресцентный заместитель (например, при R1 или R2), фотореактивную химическую группу, такую как группа, имеющая структуру:
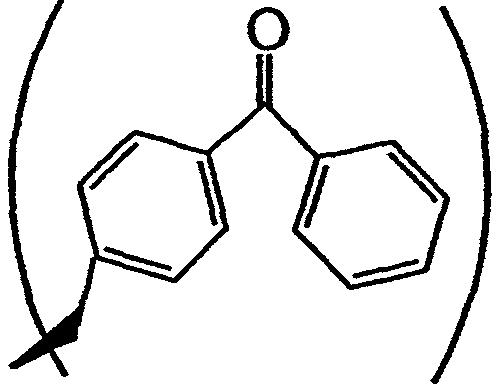
или группу, связанную с подложкой.
Флуоресцирующие и меченные иными обнаруживаемыми метками аналоги тамандарина и дидемнина, рассматриваемые в настоящем описании (равно как и их физиологически активные фрагменты), могут использоваться для идентификации клеток, в которых указанные аналоги и фрагменты могут проявлять свое физиологическое действие. Так, например, могут быть идентифицированы или выделены клетки, которые поглощают флуоресцирующий аналог или связываются с ним. Идентификация или выделение таких клеток могут использоваться для диагностики заболевания, связанного с наличием подобных клеток. Идентификация или выделение таких клеток может также указывать, какой из аналогов тамандарина или дидемнина является эффективным для лечения заболевания, вовлекающего указанные клетки.
Рассматриваемые в настоящем описании аналоги тамандарина и дидемнина могут использоваться с целью оказания антипролиферативного, противоопухолевого, противовирусного и иммуносупрессорного воздействия. Так, например, указанные соединения могут использоваться в фармацевтическом препарате или лекарственном средстве, вводимом пациенту, имеющему заболевание, при котором один или более таких показателей, как синтез белка, рост клеток, пролиферация и выживание являются аберрантными. Такие лекарственные средства могут использоваться для лечения заболеваний, таких как различные виды рака (например, рак молочной железы), вирусные, грибковые, паразитарные и бактериальные инфекции, аутоиммунные заболевания, аллергические состояния, другие гипериммунные расстройства и атеросклероз.
Примеры противоопухолевой активности, которую могут проявлять рассматриваемые в настоящем описании соединения, включают ингибирование онкогенеза, ингибирование метастазирования, ингибирование роста опухолевых клеток, ингибирование пролиферации опухолевых клеток и усиление апоптоза опухолевых клеток. Дегидродидемнин проявляет активность в отношении клеточных линий, выделенных из нескольких типов твердых опухолей человека, включая мелкоклеточный рак легкого и клеточные линии опухоли кишечника, и демонстрирует селективную противоопухолевую активность в отношении мелкоклеточного рака легкого, меланом, рака яичника и рака ободочной и прямой кишки (Depenbrock et al., 1998, Brit. J. of Cancer, 78(6):739-744). Рассматриваемые в настоящем описании аналоги тамандарина и дидемнина проявляют противоопухолевую активность в клетках одной или более указанных линий, а также в клетках соответствующего типа опухоли in vivo. Идентификация эффективности любого конкретного аналога против любого конкретного типа опухоли может быть осуществлена с использованием стандартных методов, включающих использование, например, одной или более из 60 стандартных линий опухолевых клеток, поддерживаемых в Национальном институте рака США в рамках программы скрининга лекарственных средств.
Примеры противовирусной активности, которую могут проявлять рассматриваемые в настоящем описании аналоги тамандарина и дидемнина, включают ингибирование связывания вируса с клеткой-мишенью, ингибирование инфицирования клетки вирусом, ингибирование синтеза компонентов вируса в клетке, ингибирование внутриклеточной сборки вирусных частиц, ингибирование высвобождения вирусных частиц из инфицированной клетки, ингибирование роста клетки, инфицированной вирусом, ингибирование пролиферации клетки, инфицированной вирусом, и индукцию гибели (например, через апоптоз) клетки, инфицированной вирусом. Противовирусная активность рассматриваемых в настоящем описании соединений может, например, использоваться для лечения или профилактики вирусных инфекций млекопитающих и связанных с ними симптомов. В качестве иллюстрации можно указать, что аналоги дидемнина и тамандарина могут использоваться для лечения или профилактики инфекций, вызванных вирусами, такими как вирус лихорадки Скалистых гор, вирус Денге или любой из вирусов лошадиного энцефалита.
Примеры иммуносупрессорной активности, которую могут проявлять рассматриваемые в настоящем описании аналоги тамандарина и дидемнина, включают ингибирование иммунной реакции клетки на иммуноген (например, на инфекционный агент или на трансплантированные клетки или ткань) и ингибирование гуморального иммунного ответа на иммуноген. Примеры заболеваний, при которых желательна иммуносупрессия, включают аутоиммунные заболевания, реакцию отторжения трансплантатов (например, отторжение трансплантата твердой ткани или костного мозга), развитие иммунной реакции на имплантированное устройство (например, на шунт или на сердечный клапан), иммунная гиперчувствительность и анафилаксия.
Рассматриваемые в настоящем описании аналоги тамандарина и дидемнина могут вводиться in vitro в клетку или в ткань (например, в культивируемую клетку или ткань или в клетку или ткань, взятую от одного животного, перед введением в то же или в другое животное). Альтернативно, аналоги могут вводиться в клетку или в ткань in vivo, посредством введения аналога или фармацевтической композиции, включающей указанный аналог, животному (например, млекопитающему, такому как человек), содержащему указанную клетку или ткань.
В одном варианте осуществления способов согласно настоящему изобретению животному вводят рассматриваемый аналог тамандарина или дидемнина, имеющий присоединенную к нему ферментативно расщепляемую группу (например, соединение, имеющее структуру формулы XXI). При отщеплении ферментативно расщепляемой группы соединение трансформируется из неактивной (или менее активной) формы в активную (или в более активную) форму, как показано на фиг. 23 и 24. Таким образом, аналог тамандарина или дидемнина может быть селективно активирован в той точке организма, в которой наблюдается соответствующая ферментативная активность.
Фермент, который используется для расщепления аналога тамандарина или дидемнина, содержащего присоединенную к нему ферментативно расщепляемую группу, может представлять собой фермент, который естественно присутствует в определенном месте организма животного. Альтернативно, фермент может быть введен животному, например, в виде композиции, включающей указанный фермент или нуклеиновую кислоту, кодирующую данный фермент. В качестве другого примера можно указать, что фермент может быть связан (например, ковалентно, с использованием сшивающего агента или посредством экспрессии белка слияния для комплекса фермент-антитело) с антителом, которое специфически связывается с тканью (например, с раковыми клетками, такими как лейкозные клетки или клетки твердой опухоли) в определенном месте организма животного, и комплекс антитело-фермент может быть введен животному. Введение аналога тамандарина или дидемнина, имеющего связанную с ним ферментативно расщепляемую группу, в организм того же животного приводит к предпочтительной активации соединения в ткани или в определенной точке организма. Физиологический эффект соединения может быть при этом локализован в определенной ткани или в определенном месте организма, и любой побочный эффект, определяемый активированным соединением, может быть при этом снижен или минимизирован.
Связанный с подложкой аналог тамандарина или дидемнина может использоваться для идентификации клеток, которые содержат на своей поверхности или в другом месте рецепторные белки, гликопротеины и подобные им агенты, которые способны к взаимодействию или связыванию с аналогом. В качестве примера можно указать на то, что аналог тамандарина или дидемнина, имеющий структуру формулы I или XXI и присоединенный к подложке, может быть посредством такого взаимодействия с конкретным клеточным рецептором использован для идентификации или физического выделения конкретного типа клеток (например, опухолевых клеток), которые характеризуются наличием конкретного рецептора.
Способы получения рассматриваемых в настоящем описании соединений
Настоящее изобретение включает способы получения аналогов дидемнина и их фрагментов, которые рассматриваются в настоящем описании. Способы получения аналогов тамандарина и дидемнина описаны в литературе (например, Harris et al., 1987, Tetrahedron Lett., 28:2837-2840; Harris et al., 1988, Tetrahedron 44:3489-3500; Ewing et al., 1986, Tetrahedron, 42:5863-5868; Ewing, W.R., 1988, Ph.D. Dissertation, University of Pennsylvania, Philadelphia PA; Ewing et al., 1989, Tetrahedron Lett., 30:3757-3760; Li et al., 1990, J. Am. Chem. Soc., 112:7659-7672; Mayer et al., 1994, J. Org. Chem., 59:5192-5205; Mayer et al., 1994, Tetrahedron: Asymmetry, 5:519-522; Xiao et al., 1997, Tetrahedron: Asymmetry, 9:47-53; Pfizenmayer et al., 1998, 8:3653-3656; заявка на патент США, серийный номер 09/545848, зарегистрированная 7 апреля 2000 г.). Содержание каждой из приведенных ссылок и заявок на получение патента включены в настоящее описание в качестве ссылки. Конкретный метод, используемый для получения макроциклов или аналога тамандарина или дидемнина не является определяющим фактором.
Предпочтительно, чтобы используемый метод приводил к стереоселективному синтезу рассматриваемого в настоящем описании соединения. Так, например, синтез (-)тамандарина А ({(2S)Hiv2}дидемнин В; соединение 101) рассматривается в настоящем описании в примере 1.
Что касается способов получения рассматриваемых в настоящем описании аналогов и фрагментов, то заместители R2, R3, R4, R5, R6, R7, R8, R9, R10, X и Y имеют указанные выше значения.
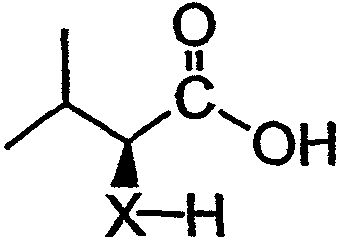
В контексте настоящего описания защита может включать любую реакцию, посредством которой одна или более химических групп ковалентно (но обратимо) присоединяются к одному атому азота, атому кислорода и атому серы в молекуле. Такое присоединение препятствует участию атома или нескольких атомов в нежелательных химических реакциях, например, в осуществлении ковалентного присоединения к другим химическим группам или превращения в доноров или акцепторов либо протонов, либо электронов в отношении других химических групп. При этом присоединяемая химическая группа обозначается как "защитная группа". В качестве примера можно указать, что атом азота в соединении, имеющем структуру формулы IX, таком как D-алло-изолейцин, может быть защищен с использованием реагента, такого как карбобензилоксисукцинимид(CBZ-сукцинимид). Использование указанного реагента в стандартной процедуре приводит к получению защищенного D-алло-изолейцина, то есть N(альфа)-CBZ-D-алло-изолейцина, имеющего структуру соединения 8, показанного на фиг.26А. В соединении 8 CBZ-группа действует как защитная группа для амина, так что при этом атом азота, к которому она присоединяется, не может легко подвергаться дополнительным химическим реакциям. Далее в качестве примера следует указать, что когда Х обозначает -(NH)-, защитная группа для амина (например -N(CZB)-) может использоваться в рассматриваемых реакциях. В качестве альтернативного примера следует указать, что гидроксильная группа в соединении 11 на фиг.26А может быть защищена с использованием реагента, такого как триизопропилсилилтрифлат (TIPSOTf) с получением соединения 12, приведенного на фиг.26А. В указанном соединении Y обозначает триизопропилсилильную (TIPS) группу, которая действует как защитная группа для гидроксила, препятствуя осуществлению химических реакций с атомом кислорода, к которому присоединяется указанная группа.
Процедура осуществления реакций защиты и полная информация о химических группах, которые могут использоваться в качестве защитных групп, могут быть найдены в руководствах, таких как Green and Wutz, 1999, Protecting Groups in Organic Synthesis, Wiley, New York, или Bodansky, 1993, Principles of Peptide Synthesis, Springer, Berlin.
Аналоги и фрагменты дидемнина могут быть получены путем превращения соединений, имеющих структуру формулы IX:
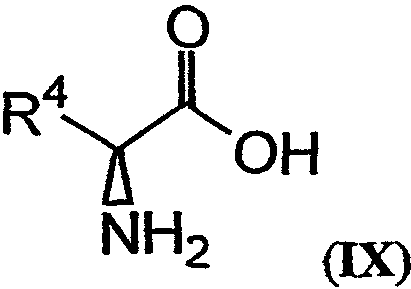
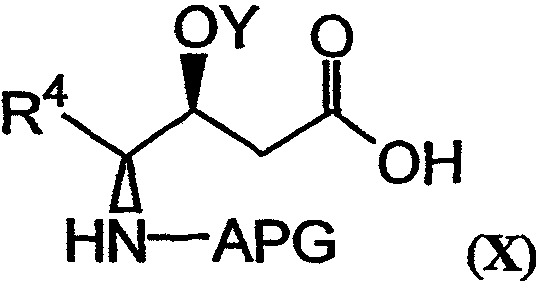
в соединение, имеющее структуру формулы Х:
Такая серия реакций может включать, не ограничиваясь ими, реакцию защиты, реакцию активации, реакцию этерификации и реакцию гидролиза сложного эфира. Аминогруппу формулы IX предпочтительно защищают перед осуществлением реакций этерификации и гидролиза. Конкретный пример получения соединения, имеющего структуру формулы Х, приведен в примере 1. В формулах X-XVIII термин APG относится к защитной группе для амина, такой как карбобензилоксигруппа (CBZ) или трет-бутилоксикарбонильная (BOC) группа. Могут также использоваться альтернативные защитные группы для амина, как указывается в настоящем описании и известно из уровня техники.
Пример реакции активации, включенный в способ получения соединения, имеющего структуру формулы Х, изображен на фиг.26А, реакция В. Активация соединения, такого как соединение 8, может включать реагент, такой как пентафторфенол (PFPOH), с получением соединения 9. Соединение 9 представляет собой пример активированного промежуточного соединения, которое легче подвергается последующим реакциям, таким как этерификация при атоме углерода карбонильной группы в сложноэфирной группе ПФФ. Реакции этерификации, которые не требуют наличия активированного промежуточного соединения, также могут использоваться для получения соединения, имеющего структуру формулы Х.
Любой способ гидролиза сложного эфира, известный в технике, который не включает жесткие условия, способствующие рацемизации, может использоваться для получения соединения, имеющего структуру формулы Х. В качестве примера можно указать, что соединение, имеющее структуру:
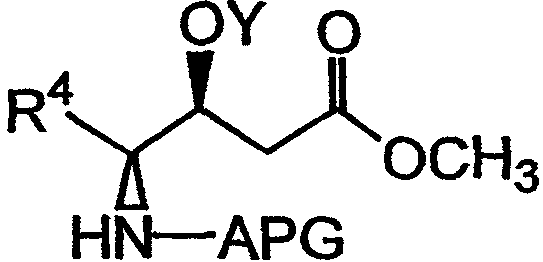
может быть гидролизовано с использованием сильного основания в смеси растворителей, как показано на фиг.26А, реакция F. Реагенты и условия, приемлемые для гидролиза сложного эфира в мягких условиях (то есть в условиях, которые не способствуют рацемизации), могут быть легко подобраны любым специалистом в данной области.
Соединение, имеющее структуру:
может быть этерифицировано, например, аллилбромидом (например, как описано в примере 1) с получением соединения, имеющего структуру формулы XI:
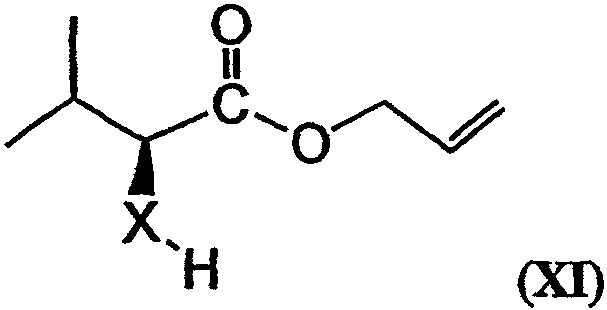
Соединение, имеющее структуру формулы IX, и соединение, имеющее структуру формулы XI, могут быть связаны (например, этерифицированы) с получением соединения, имеющего структуру формулы XII:
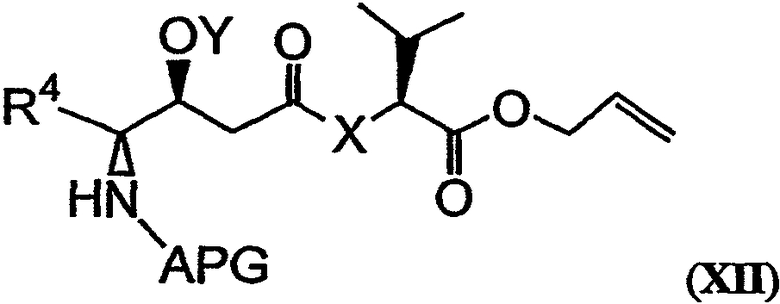
(например, как показано в реакции I на фиг.26В). Необязательно такая реакция может быть проведена с использованием катализатора, реагента связывания или этерифицирующего реагента. Реагенты и условия, используемые для проведения реакции такого типа, известны в технике и показаны в примере 1. Фрагменты дидемнина, имеющие структуру формулы XII, проявляют одну или более фармакологических активностей из числа рассматриваемых в настоящем описании.
Соединение, имеющее структуру формулы XII, может быть гидролизовано с получением соединения, имеющего структуру формулы XIII:
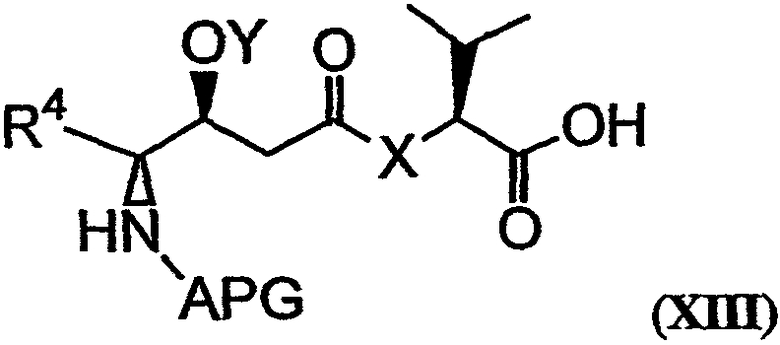
Условия реакции и реагенты, подходящие для проведения гидролиза сложного эфира, хорошо известны из литературы и могут быть без труда применены специалистом в данной области. Пример гидролиза указанного типа представлен на фиг.26В, реакция J. Фрагменты дидемнина, имеющие структуру формулы XIII, проявляют одну или более фармакологических активностей из числа рассматриваемых в настоящем описании.
Карбоксильная группа соединения, имеющего структуру формулы XIII, может быть активирована с получением соединения, имеющего структуру формулы XIV:
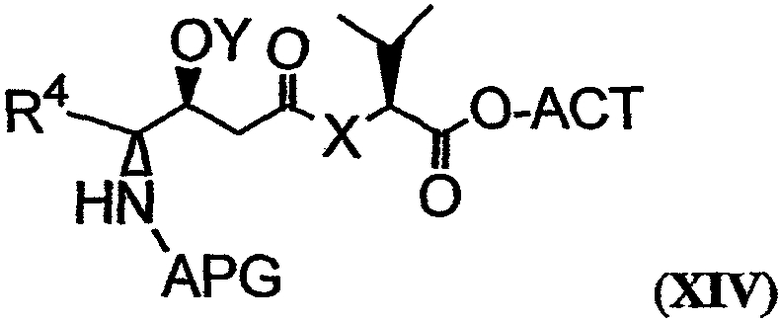
В формуле XIV ACT относится к активирующей группе, такой как пентафторфенильная (ПФФ) группа. Другой пример активирующей группы включает N-гидроксисукцинимидную группу. Химическая активация может быть проведена с использованием реагентов, таких как активирующий реагент, катализатор, донор активирующей группы или подобные им. В качестве примера можно указать, что соединение 6, представленное на фиг.26С, активируется посредством ковалентного присоединения ПФФ группы с получением соединения 19. Процедуры активации соединения раскрываемым в описании способом известны в технике. Фрагменты дидемнина, имеющие структуру формулы XIV, проявляют одну или более фармакологических активностей из числа рассматриваемых в настоящем описании.
Активированное соединение, имеющее структуру формулы XIV, может быть связано с третьим реагентом, имеющим структуру формулы XV:
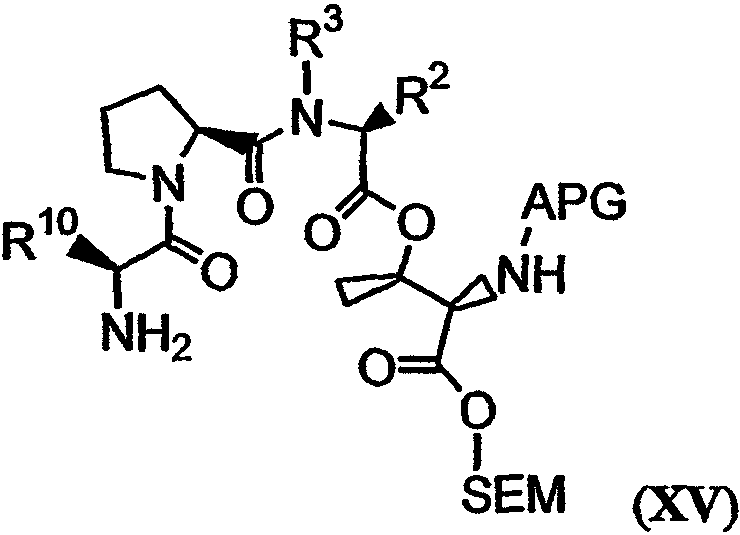
с получением соединения, имеющего структуру формулы XVI:
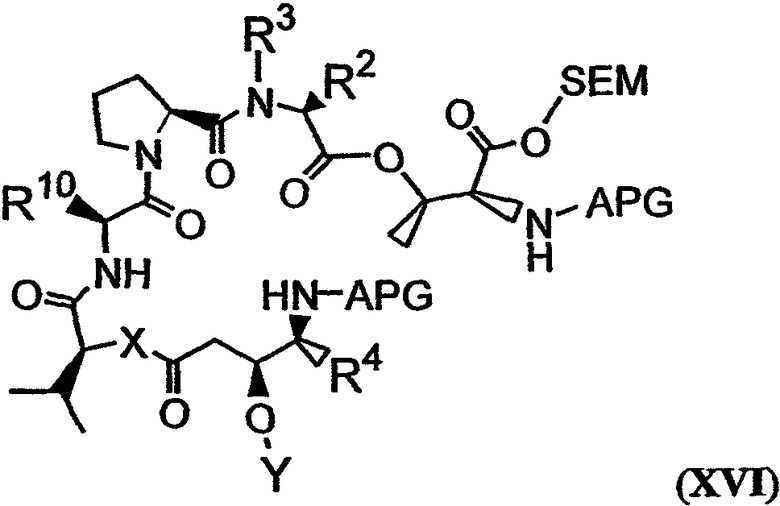
В формулах XV и XVI SEM относится к 2-(триметилсилил)этоксикарбонилу. Пример указанной реакции изображен в реакции М на фиг.26С, в ходе которой соединение 19 связывается с соединением 18 с образованием соединения 20. Реагенты и условия, необходимые для получения защищенного пептида, такого как соединение 18, описаны, например, Li et al., 1990, J. Am. Chem. Soc., 112:7659-7672. Аналоги дидемнина, имеющие структуру формулы XVI, проявляют одну или более фармакологических активностей из числа рассматриваемых в настоящем описании.
Аналог дидемнина, обладающий одной или большим числом рассматриваемых фармакологических активностей, может быть получен при удалении одной из защитных групп для амина и защитной группы для карбонильного гидроксила в соединении со структурой формулы XVI с последующей циклизацией полученного соединения с образованием PSI, имеющего структуру формулы XVII:
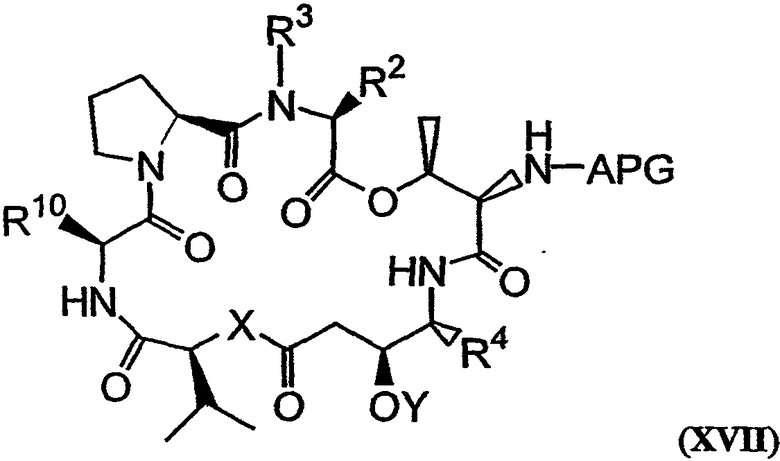
Пример реакций указанного типа показан на стадии N на фиг.26D. Химическое снятие защиты в таком соединении, как соединение, имеющее структуру формулы XVI, может быть осуществлено взаимодействием данного соединения с одним или более реагентами, используемыми для удаления соответствующей защитной группы из указанного соединения. Примеры реакций снятия защиты раскрываются в настоящем описании, например, для соединения 20, как показано на фиг.26D. Другие методики снятия защиты соединений известны в технике и могут быть без труда применены специалистом в данной области для целей снятия защиты в соединении, имеющем структуру формулы XVI. Циклизация лишенного защитных групп соединения, имеющего структуру формулы XVI, может быть осуществлена с использованием любого известного метода, применяемого для макроциклизации пептидов. Так, например, условия макроциклизации могут быть близкими или идентичными тем условиям, которые используются в процессе циклизации, приводящей к получению соединения 21, показанного на фиг.26D и описанного в примере 1. Аналоги дидемнина, имеющие структуру формулы XVII, проявляют один или больше видов терапевтических активностей из числа рассматриваемых в настоящем описании.
Одна или более защитных групп в соединении, имеющем структуру формулы XVII, могут быть удалены с получением соединения, имеющего структуру формулы XVIII:
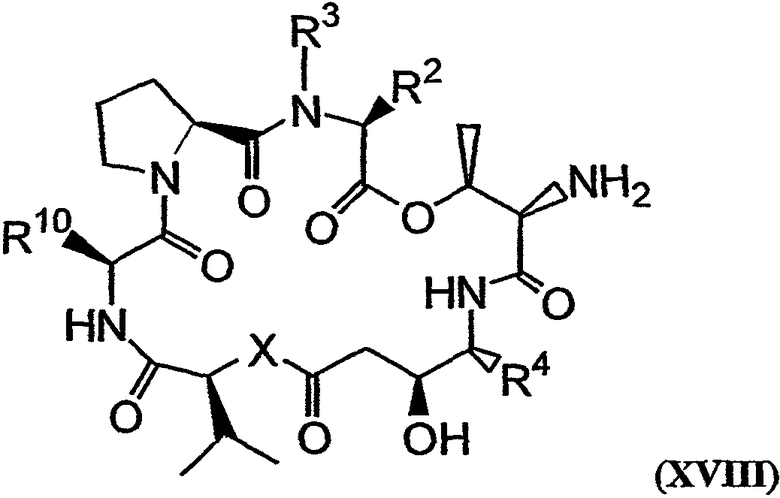
Указанный тип реакции снятия защиты проиллюстрирован реакцией О, показанной на фиг.26Е. Аналоги дидемнина, имеющие структуру формулы XVIII, проявляют одну или более терапевтических активностей из числа рассматриваемых в настоящем описании.
Еще одно активное соединение может быть получено при связывании соединения, имеющего структуру формулы XVIII, и реагента, имеющего структуру формулы XIX:
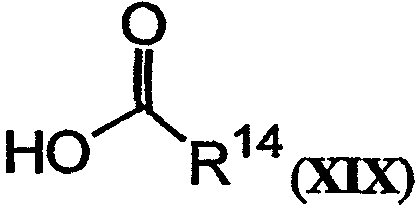
с получением PSI, имеющего структуру формулы XX:
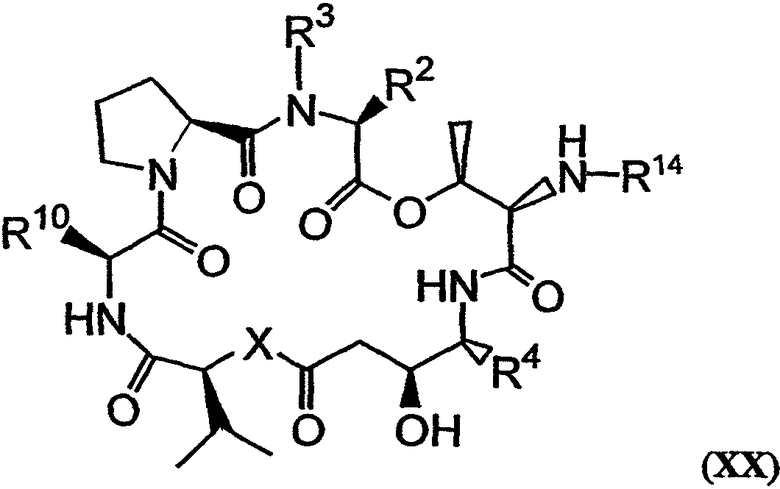
Указанная реакция проиллюстрирована реакцией N, показанной на фиг.26D. R14 может, например, представлять собой любую из групп, описанных выше для R1. Группа, представляющая собой заместитель в R14, может включать ферментативно расщепляемую группу, предпочтительно находящуюся на его отдаленном конце или вблизи него (относительно положения макроцикла). Такая группа может быть расщеплена ферментом, например, карбоксипептидазой, бета-лактамазой, бета-галактозидазой, V-амидазой пенициллина, цитозиндезаминазой, нитроредуктазой, щелочной фосфатазой, бета-глюкуронидазой и каталитическим антителом. Примером группы R14, которая включает ферментативно расщепляемую группу, является -(N-метил)лейцин-(S)пролин-(S)лактат-(S)глутамин-(S)пироглутамат. Другие примеры ферментативно расщепляемых групп также приведены в настоящем описании. В качестве иллюстрации можно указать, что соединения 131 и 132, изображенные на фиг.23 и 24, могут быть получены с использованием приведенных в настоящем описании методов. Аналоги дидемнина и их фрагменты, которые включают присоединенную к ним ферментативно расщепляемую группу и которые в противном случае (без присоединения указанной группы) имеют структуру одной из формул XII-XVIII, после отщепления от них указанной ферментативно расщепляемой группы проявляют один или более видов терапевтических активностей из числа рассматриваемых в настоящем описании.
Вариация заместителей в аналогах дидемнина и их фрагментах может потребовать незначительных модификаций общих методов согласно настоящему описанию. Следует иметь в виду, что изобретение включает такие модификации, поскольку они могут быть легко разработаны любым специалистом со средним уровнем знаний в области химического синтеза.
Аналоги тамандарина и дидемнина могут быть легко получены с помощью способа, который охватывает включение дезоксопролинового остатка или дегидропролинового остатка в боковую цепь аналога тамандарина или дидемнина. Дезоксопролиновый остаток или дегидропролиновый остаток могут использоваться вместо пролинового остатка в любом известном аналоге тамандарина или дидемнина. Особенно подходящими для рассмотрения аналогами тамандарина и дидемнина являются те, в которых дезоксопролиновый остаток или дегидропролиновый остаток связан с макроциклом через лейциновый остаток, имеющий метилированную аминогруппу (то есть аналог тамандарина или дидемнина, содержащий -(N-метил)лейцин-(дезоксо или дегидро)пролин). Несомненно, указанный (дезоксо или дегидро)пролиновый остаток может быть в дальнейшем замещен, например, лактатом, пируватом, лактат-флуорофором, лактат-глутамин-пироглутаматом, лактат-глутамин-циклопентаноатом, аланин-лейцин-пироглутаматом или -(N-метил-аланин)-лейцин-пироглутаматом. Один или более из числа остатков (дезоксо или дегидро)пролина, лактата, глутамина, пироглутамата, циклопентаноата и аланина предпочтительно представляет собой (S)-энантиомер.
Включение дезоксопролинового остатка может быть осуществлено любым известным в технике способом. Примеры способов включения дезоксопролинового остатка рассматриваются в настоящем описании в примере 5 и показаны на фиг.41-43.
В одном варианте осуществления изобретения способ включения дезоксопролинового остатка включает защиту гидроксильной и аминогрупп лейцина, метилирование аминогруппы лейцина и последующее удаление защитной аминогруппы лейцина. Аминогруппу пролина защищают и сложноэфирную функциональную группу пролина восстанавливают до альдегида (например, действием сильного основания, такого как LiBH4, сопряженного с окислением действием окислителя, такого как пиридин-SO3). Восстановительное аминирование (например, в присутствии неводного растворителя, сильного основания и катализатора на основе карбоновой кислоты, например, в присутствии Na(AcO)3BH, AcOH и CH2Cl2) может быть использовано для связывания лейцина, несущего защищенный гидроксил, с пролином, несущим защищенный амин (например, для получения соединения 43, представленного на фиг.43, в рамках одного варианта осуществления изобретения). Восстановительное аминирование может быть, например, проведено по методу, описанному Abdel-Magid et al., 1990, Tetrahedron Lett., 31:5595-5598; Abdel-Magid et al., 1990, Synlett., 537-539.
Полученный лейцин-дезоксопролиновый дипептид может быть в дальнейшем замещен другими группами (например, -лактатом, -пируватом, -лактат-флуорофором, -лактат-глутамин-пироглутаматом, -лактат-глутамин-циклопентаноатом, -аланин-лейцин-пироглутаматом или -(N-метил-аланин)-лейцин-пироглутаматом), с (предпочтительно) или без удаления первичных защитных групп. Указанный лейцин-дезоксопролиновый дипептид (необязательно замещаемый в дальнейшем) может быть присоединен к макроциклу тамандарина или дидемнина в положение, идентифицированное как R1 в формулах I и XXI.
Включение дегидропролинового остатка может быть осуществлено с помощью любого известного в технике способа. Примеры способов включения дегидропролинового остатка рассматриваются в настоящем описании в примере 6 и показаны на фиг.44.
В одном варианте осуществления настоящего изобретения способ включения дегидропролинового остатка охватывает защиту карбоксильной и аминогрупп в 4-гидроксипролинате, мезилирование 4-гидроксильной группы, замену мезилатной группы арилселенильной группой, окислительное удаление арилселенильной группы и снятие защиты карбоксильной группы. Полученная при этом дегидропролиновая группа может быть связана с одним или более дополнительными аминокислотными остатками или органическими кислотами (например, с указанными в настоящем описании, с удалением, если необходимо или желательно, защитных групп для амина) и связана с макроциклом тамандарина или дидемнина, изготовленным или полученным иным образом с помощью известных способов.
Фармацевтические композиции
Настоящее изобретение относится к фармацевтическим композициям, включающим по меньшей мере один из аналогов тамандарина и дидемнина или их физиологически активных фрагментов согласно настоящему описанию. Такие композиции могут включать аналог/фрагмент и фармацевтически приемлемый носитель. В качестве примера следует указать, что фармацевтическая композиция может включать фармацевтически приемлемый носитель и аналог тамандарина или дидемнина, имеющий структуру любой из формул I, XXI и (a)-(d) в качестве активного ингредиента. Другим примером может быть фармацевтическая композиция, включающая фармацевтически приемлемый носитель и одно или более соединений, показанных на чертежах в данном описании.
Такие фармацевтические композиции могут использоваться, например, в рамках рассматриваемых способов для ингибирования одного или более таких параметров, как синтез белка, прогрессирование клеточного цикла, онкогенез, рост и пролиферация клеток. Кроме того, такие композиции могут использоваться в способах согласно настоящему описанию для усиления апоптоза в клетке.
Фармацевтические композиции, которые используются в способах настоящего изобретения, могут вводиться системно в виде пероральных твердых композиций, офтальмологической композиции, суппозитория, аэрозоля, местных или других сходных композиций. В дополнение к активному ингредиенту такие фармацевтические композиции могут включать фармацевтически приемлемые носители и другие известные в технике ингредиенты, которые усиливают и облегчают введение лекарственных средств. Другие возможные композиции, такие как наночастицы, липосомы, нагруженные эритроциты и транспортные системы на иммунологической основе, также могут использоваться для введения активного агента согласно способам настоящего изобретения.
Настоящее изобретение относится к фармацевтическим композициям, которые состоят из активного ингредиента в форме, приемлемой для введения субъекту, или к фармацевтической композиции, которая включает активный агент и один или более фармацевтически приемлемых носителей, один или более дополнительных ингредиентов или некоторые их комбинации. Активный агент может быть представлен в фармацевтической композиции в форме физиологически приемлемого сложного эфира или соли, такой как сочетание его с физиологически приемлемым катионом или анионом, что известно из уровня техники.
Препараты фармацевтических композиций согласно настоящему описанию могут быть получены с помощью любого известного или только что разработанного фармакологического метода. В основном, такие методы изготовления включают стадию приведения активного агента в контакт с носителем или одним или более другими вспомогательными ингредиентами и затем, при необходимости или желательности, формовку или упаковку полученного продукта в желательные стандартные формы, содержащие однократные или многоразовые дозы.
Несмотря на то, что описание рассматриваемых фармацевтических композиций в принципе относится к получению фармацевтических композиций, которые приемлемы для введения внутрь организма человека, любому специалисту со средним уровнем знаний в данной области очевидно, что такие композиции в основном приемлемы и для введения всем видам животных. Модификации фармацевтических композиций, пригодных для введения человеку, нужные для того, чтобы сделать эти композиции пригодными для введения различным животным, хорошо понятны, и любой квалифицированный специалист в области ветеринарной фармакологии может разработать и осуществить такую модификацию путем проведения очень простых экспериментов, если только таковые потребуются. Субъекты, введение которым фармацевтических композиций согласно настоящему изобретению рассматривается в рамках настоящего изобретения, включают, не ограничиваясь приведенным списком, людей и других приматов, а также млекопитающих, включая млекопитающих, в отношении которых это коммерчески оправдано, таких как крупный рогатый скот, свиньи, лошади, овцы, кошки и собаки.
Фармацевтические композиции, которые применяются в способах согласно настоящему изобретению, могут быть приготовлены, упакованы или представлены для продажи в виде композиций, пригодных для перорального, ректального, вагинального, парентерального, местного, легочного, интраназального, трансбуккального, офтальмологического или другого режима введения. Другие рассматриваемые композиции включают переносимые наночастицы, липосомальные препараты, нагруженные эритроциты, содержащие активный агент, и транспортные композиции на иммунологической основе.
Фармацевтическая композиция согласно настоящему изобретению может быть получена, упакована или представлена для продажи в виде объемного препарата, в виде единичной дозированной формы или в виде множества дозированных форм. В контексте настоящего описания "единичная дозированная форма" обозначает дискретное количество фармацевтической композиции, включающее заданное количество активного агента. Количество активного агента в основном равно дозировке активного агента, которая должна вводиться субъекту, или удобной части такой дозировки, такой, например, как одна вторая или одна третья часть такой дозировки.
В дополнение к активному агенту фармацевтическая композиция согласно настоящему изобретению может также включать один или более дополнительных фармацевтически активных агентов, таких, например, как другие агенты для лечения опухолей, другие противоинфекционные средства и им подобные.
С использованием традиционных методик могут быть получены фармацевтические композиции согласно настоящему изобретению с контролируемым или пролонгированным высвобождением.
Препарат фармацевтической композиции согласно настоящему изобретению, пригодный для перорального введения, может быть получен, упакован или представлен для продажи в форме дискретной твердой единичной дозированной формы, включающей, но не ограничивающейся приведенным списком, таблетку, твердую или мягкую капсулу, пакет, пастилку или леденец, каждая из которых содержит заданное количество активного агента. Другие композиции, пригодные для перорального введения, включают, не ограничиваясь приведенным списком, порошковые или гранулярные композиции, водную или масляную суспензию, водный или масляный раствор или эмульсию.
В контексте настоящего описания "масляная" жидкость обозначает такую жидкость, которая включает молекулу углеродсодержащей жидкости и которая характеризуется менее полярными свойствами, чем вода.
Таблетка, включающая активный ингредиент, может быть получена, например, прессованием или формовкой активного агента, необязательно при наличии одного или более дополнительных ингредиентов. Прессованные таблетки могут быть получены прессованием активного агента в подходящем устройстве в свободнотекучей форме, такой как порошковый или гранулированный препарат, необязательно в смеси с одним или более связующим веществом, замасливателем, наполнителем, поверхностно-активным веществом и диспергирующим агентом. Формованные таблетки могут быть получены путем формования в соответствующем устройстве смеси активного агента, фармацевтически приемлемого носителя и количества жидкости, по меньшей мере достаточного для увлажнения смеси. Фармацевтически приемлемые носители, используемые при приготовлении таблеток, включают, не ограничиваясь приведенным списком, инертные разбавители, гранулирующие и дезинтегрирующие агенты, связующие вещества и замасливатели. Известные диспергирующие агенты включают, не ограничиваясь приведенным списком, картофельный крахмал и гликолят натрий-крахмала. Известные поверхностно-активные вещества включают, не ограничиваясь им, лаурилсульфат натрия. Известные разбавители включают, не ограничиваясь приведенным списком, карбонат кальция, карбонат натрия, лактозу, микрокристаллическую целлюлозу, фосфат кальция, гидрофосфат кальция и фосфат натрия. Известные гранулирующие и дезинтегрирующие агенты включают, не ограничиваясь приведенным списком, кукурузный крахмал и альгинат. Известные связующие агенты включают, не ограничиваясь приведенным списком, желатин, аравийскую камедь, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон и гидроксипропилметилцеллюлозу. Известные замасливатели включают, не ограничиваясь приведенным списком, стеарат магния, стеарат, силикагель и тальк.
Таблетки могут быть непокрытыми или могут быть покрыты оболочкой с использованием известных методов, применяемых для достижения задержанного распада формы в желудочно-кишечном тракте субъекта, что позволяет достичь пролонгированного высвобождения и всасывания активного агента. В качестве примера можно указать, что материал, такой как глицерилмоностеарат или глицерилдистеарат, может использоваться для нанесения покрытия на таблетки. Другим иллюстративным примером могут служить таблетки, которые покрывают с использованием способов, описанных в патентах США номер 4256108; 4160452 и 4265874, с образованием таблеток, обеспечивающих высвобождение, контролируемое по осмотическим показателям. Таблетки могут также включать подсластитель, вкусовое вещество, краситель, консервант или некое сочетание указанных ингредиентов с тем, чтобы обеспечить создание фармацевтически приятного на вид и на вкус препарата.
Твердые капсулы, включающие активный агент, могут быть получены с использованием физиологически разлагаемой композиции, такой как желатин. Такие твердые капсулы содержат активный агент и могут также содержать дополнительные ингредиенты, включающие, например, инертный твердый разбавитель, такой как карбонат кальция, фосфат кальция или каолин.
Мягкие желатиновые капсулы, включающие активный агент, могут быть получены с использованием физиологически разлагаемой композиции, такой как содержащая желатин. Такие мягкие капсулы содержат активный агент, который может быть смешан с водной или масляной средой, такой как арахисовое масло, жидкий парафин или оливковое масло.
Жидкие препараты фармацевтической композиции согласно настоящему изобретению, которые приемлемы для перорального введения, могут быть приготовлены, упакованы и представлены для продажи в жидком виде или в виде сухого препарата для последующего восстановления жидкой формы препарата водой или другим приемлемым носителем непосредственно перед использованием.
Жидкие суспензии могут быть получены с использованием традиционных способов получения суспензии активного агента в водном или масляном носителе. Водные носители включают, например, воду и изотонический солевой раствор. Масляные носители включают, например, миндальное масло, масляные сложные эфиры, этиловый спирт, растительные масла, такие как арахисовое масло, оливковое масло, кунжутное или кокосовое масло, фракционированные растительные масла и минеральные масла, такие как жидкий парафин. Жидкие суспензии могут также содержать один или более дополнительных ингредиентов, которые включают, не ограничиваясь приведенным списком, суспендирующие агенты, диспергирующие агенты или смачивающие вещества, эмульгаторы, средства, снимающие раздражение, консерванты, буферы, соли, вкусовые вещества, красители и подсластители. Масляные суспензии могут также включать загуститель. Известные суспендирующие агенты включают, не ограничиваясь приведенным списком, сироп на основе сорбита, гидрогенизированные пищевые жиры, альгинат натрия, поливинилпирролидон, трагантовую камедь, аравийскую камедь и производные целлюлозы, такие как натрийкарбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза. Известные диспергирующие агенты или смачивающие вещества включают, не ограничиваясь приведенным списком, природные фосфатиды, такие как лецитин, продукты конденсации алкиленоксида с жирной кислотой, с длинноцепочечным алифатическим спиртом, с частичным сложным эфиром, полученным из жирной кислоты и гексита, или с частичным сложным эфиром, полученным из жирной кислоты и ангидрида гексита (например, полиоксиэтиленстеаратом, гептадекаэтиленоксицетанолом, моноолеатом полиоксиэтиленсорбита и моноолеатом полиоксиэтиленсорбитана соответственно). Известные эмульгаторы включают, не ограничиваясь приведенным списком, лецитин и аравийскую камедь. Известные консерванты включают, не ограничиваясь приведенным списком, метил-, этил- или н-пропил-пара-гидроксибензоаты, аскорбат и сорбат. Известные подсластители включают, например, глицерин, пропиленгликоль, сорбит, сахарозу и сахарин. Известные загустители, применяемые в масляных суспензиях, включают, например, пчелиный воск, твердый парафин и цетиловый спирт.
Жидкие растворы активного ингредиента в водных или масляных растворителях могут быть получены по существу тем же способом, что и жидкие суспензии, единственная разница состоит в том, что активный ингредиент растворяют, а не суспендируют в растворителе. Жидкие растворы фармацевтической композиции согласно настоящему изобретению могут включать каждый из компонентов, описанных для жидких суспензий, при этом следует понимать, что суспендирующие агенты не обязательно будут помогать растворению активного агента в растворителе. Водные растворители включают, например, воду и изотонический раствор соли. Масляные растворители включают, например, миндальное масло, жирные сложные эфиры, этиловый спирт, растительные масла, такие как арахисовое, оливковое, кунжутное или кокосовое масло, фракционированные растительные масла и минеральные масла, такие как жидкий парафин.
Порошковые и гранулированные препараты фармацевтической композиции согласно настоящему изобретению могут быть получены с использованием известных способов. Такие композиции, которые могут вводиться непосредственно субъекту, используют, например, для формирования таблеток, для заполнения капсул или для получения водной или масляной суспензии или раствора при добавлении к ним водного или масляного носителя. Каждая из таких композиций может также включать один или более диспергирующих агентов или смачивающих веществ, суспендирующий агент и консервант. В такие композиции могут включаться также дополнительные носители, такие как наполнители и подсластители, вкусовые вещества или красители.
Фармацевтическая композиция согласно настоящему изобретению может быть также изготовлена, упакована или представлена для продажи в форме эмульсии масла в воде или эмульсии воды в масле. Масляная фаза может представлять собой растительное масло, такое как оливковое и арахисовое, минеральное масло, такое как жидкий парафин, или их сочетание. Указанные композиции могут также включать один или более эмульгаторов, таких как природные камеди, такие как аравийская камедь или трагантовая камедь, натуральные природные фосфатиды, такие как соевые или лецитиновые фосфатиды, сложные эфиры или частичные сложные эфиры, полученные из комбинации жирных кислот и ангидридов гексита, такие как моноолеат сорбитана, и конденсированные продукты таких частичных сложных эфиров с этиленоксидом, такие как моноолеат полиоксиэтиленсорбитана. Указанные эмульсии могут также содержать дополнительные ингредиенты, включающие, например, подсластители или вкусовые вещества.
Фармацевтическая композиция согласно настоящему изобретению может быть приготовлена, упакована и представлена для продажи в виде композиции, пригодной для ректального введения. Такая композиция может иметь вид, например, суппозитория, удерживающей клизмы и раствора для промывания прямой или ободочной кишки.
Композиции суппозиториев могут быть приготовлены посредством объединения активного агента с нераздражающим фармацевтически приемлемым носителем, который является твердым при обычной комнатной температуре (то есть около 20°С) и который становится жидким при ректальной температуре субъекта (то есть около 37°С у здорового человека). Подходящие фармацевтически приемлемые носители включают, не ограничиваясь приведенным списком, масло какао, полиэтиленгликоли и различные глицериды. Композиции суппозиториев могут также содержать различные дополнительные ингредиенты, включающие, не ограничиваясь ими, антиоксиданты и консерванты.
Препараты удерживающей клизмы или растворы для промывания прямой или ободочной кишки могут быть получены путем объединения активного агента с фармацевтически приемлемым жидким носителем. Как известно из уровня техники, клизменные препараты могут вводиться с использованием устройств доставки, адаптированных к ректальной анатомии субъекта, и могут быть упакованы внутри такого устройства. Клизменные препараты могут также содержать различные дополнительные ингредиенты, которые включают, не ограничиваясь ими, антиоксиданты и консерванты.
Фармацевтическая композиция согласно настоящему изобретению может быть приготовлена, упакована и представлена для продажи в виде композиции, пригодной для вагинального введения. Такая композиция может иметь вид, например, суппозитория, тампона, пропитанного или покрытого вагинально вводимым материалом, препарата для спринцевания или раствора для вагинального промывания.
Способы пропитки или покрытия материала химической композицией известны в технике и включают, не ограничиваясь ими, методы осаждения или связывания химической композиции на поверхности, методы включения химической композиции в структуру данного материала в ходе синтеза указанного материала (то есть такие, как синтез с участием физиологически разлагаемого материала) и методы абсорбции водного или масляного раствора или суспензии в абсорбирующий материал с применением или без применения последующей сушки.
Препараты для спринцевания или препараты для вагинального промывания могут быть приготовлены посредством объединения активного агента с фармацевтически приемлемым жидким носителем. Как известно в технике, препараты для спринцевания могут вводиться с использованием устройства для доставки, адаптированного к вагинальной анатомии субъекта, и могут быть упакованы внутри такого устройства. Препараты для спринцевания могут также содержать различные дополнительные ингредиенты, включающие, но не ограничивающиеся ими, антиоксиданты, антибиотики, противогрибковые средства и консерванты.
Препараты фармацевтических композиций, пригодных для парентерального введения, могут включать активный агент, объединенный с фармацевтически приемлемым носителем, таким как стерильная вода или стерильный изотонический раствор соли. Такие композиции могут быть приготовлены, упакованы или представлены для продажи в форме, пригодной для введения болюсом или для непрерывного введения. Инъецируемые композиции могут быть приготовлены, упакованы или представлены для продажи в виде стандартной дозированной формы, такой как ампулы или контейнеры с множественной дозой, содержащей консервант. Композиции для парентерального введения включают, не ограничиваясь приведенным списком, суспензии, растворы, эмульсии в масляных или водных носителях, пасты и имплантируемые композиции с пролонгированным высвобождением или биоразлагаемые композиции. Такие композиции могут содержать один или более дополнительных ингредиентов, включающих, но не ограничивающихся приведенным списком, суспендирующие, стабилизирующие или диспергирующие средства. В одном варианте осуществления настоящего изобретения в аспекте композиции для парентерального введения активный агент поставляется в сухой (то есть в виде порошка или гранул) форме для последующего восстановления с помощью подходящего растворителя (например, стерильной, не содержащей кислорода воды) перед парентеральным введением восстановленной композиции.
Фармацевтические композиции могут быть приготовлены, упакованы или представлены для продажи в виде стерильной инъецируемой водной или масляной суспензии или раствора. Указанные суспензия или раствор могут быть приготовлены в соответствии с известными в технике методами и могут включать, кроме активного агента, дополнительные ингредиенты, такие как диспергирующие агенты, смачивающие вещества или суспендирующие агенты, указанные в настоящем описании. Такие стерильные инъецируемые композиции могут быть приготовлены с использованием нетоксичного приемлемого для парентерального введения разбавителя или растворителя, например, такого как вода или 1,3-бутандиол. Другие приемлемые разбавители и растворители включают, не ограничиваясь приведенным списком, раствор Рингера, изотонический раствор хлорида натрия и жирные масла, такие как синтетические моно- и диглицериды. Другие парентерально вводимые композиции, которые могут быть использованы, включают те из них, которые содержат активный агент в микрокристаллической форме, в виде липосомного препарата или в качестве компонента биоразлагаемых полимерных систем. Композиции для пролонгированного высвобождения или для имплантации могут включать фармацевтически приемлемые полимерные или гидрофобные материалы, такие как эмульсия, ионообменная смола, слабо растворимый полимер или слабо растворимая соль.
Композиции, пригодные для местного введения, включают, не ограничиваясь приведенным списком, жидкие или полужидкие препараты, такие как линименты, лосьоны, эмульсии масла в воде или воды в масле, такие как кремы, мази или пасты, и растворы или суспензии. Местно вводимые композиции могут, например, содержать от примерно 1 до примерно 10 мас.% активного агента, хотя концентрация активного ингредиента может быть настолько высокой, насколько позволяют пределы растворимости активного агента в растворителе. Композиции для местного введения могут также включать один или более дополнительных ингредиентов из числа приведенных в настоящем описании.
Фармацевтическая композиция согласно настоящему изобретению может быть приготовлена, упакована или представлена для продажи в виде композиции, пригодной для легочного введения через буккальную полость. Такая композиция может включать сухие частицы, которые содержат активный агент и которые характеризуются диаметром в диапазоне от примерно 0,5 до примерно 7 нанометров, предпочтительно в диапазоне от примерно 1 до примерно 6 нанометров. Такие композиции удобны для использования в форме сухого порошка для введения с использованием устройства, включающего сухой резервуар для порошка, в котором поток пропеллента может быть направлен для диспергирования порошка, или с использованием диспенсерного контейнера с самовыталкиванием растворителя/порошка, таким как устройство, включающее активный агент, растворенный или суспендированный в низкокипящем пропелленте в запечатанном контейнере. Предпочтительно такие порошки включают частицы, в которых по меньшей мере 98 мас.% частиц имеют диаметр больше чем 0,5 нанометра и по меньшей мере 95% от числа частиц имеют диаметр менее чем 7 нанометров. Более предпочтительно, когда по меньшей мере 95 мас.% частиц имеет диаметр больше чем 1 нанометр и по меньшей мере 90% от числа частиц имеет диаметр меньше чем 6 нанометров. Сухие порошковые композиции предпочтительно включают твердый тонкоизмельченный разбавитель, такой как сахар, и приспособлены для применения в виде стандартной дозированной формы.
Низкокипящие пропелленты в основном включают жидкие пропелленты, имеющие точку кипения ниже 65°F при атмосферном давлении. В основном, пропеллент может составлять от 50 до 99,9 мас.% от композиции и активный агент может составлять от 0,1 до 20 мас.% от композиции. Указанный пропеллент может также включать дополнительные ингредиенты, такие как жидкое неионное или твердое анионное поверхностно-активное вещество или твердый разбавитель (предпочтительно имеющий размер частиц того же порядка, что и частицы, составляющие активный агент).
Фармацевтические композиции согласно настоящему изобретению, приготовленные для внутрилегочного введения, могут также поставлять активный агент в форме капель раствора или суспензии. Такие композиции могут быть приготовлены, упакованы или представлены для продажи в виде водных или разбавленных спиртовых растворов или суспензий, необязательно стерильных, включающих активный агент, и могут в удобном варианте вводиться с помощью любого небулайзера или пульверизатора. Такие композиции могут также содержать один или более дополнительных ингредиентов, которые включают, не ограничиваясь приведенным списком, вкусовое вещество, такое как натрий-сахарин, летучее масло, забуферивающий агент, поверхностно-активное вещество или консервант, такой как метилгидроксибензоат. Капли, доставляемые с помощью указанного способа введения, имеют среднее значение диаметра в диапазоне от примерно 0,1 до примерно 200 нанометров.
Рассматриваемые в настоящем описании композиции, которые полезны для целей внутрилегочного введения, также используются для интраназальной доставки фармацевтической композиции согласно настоящему изобретению.
Другая композиция, подходящая для интраназального введения, представляет собой крупнозернистый порошок, включающий активное вещество и имеющий средний размер частиц от примерно 0,2 до 500 микрометров. Такую композицию вводят способом, при котором используют нюханье, то есть посредством быстрого вдыхания воздуха через носовую полость из контейнера с порошком, плотно прижатого к ноздрям.
Композиции, подходящие для назального введения, могут, например, включать от приблизительно такого малого количества как 0,1 мас.% до такого высокого содержания как 100 мас.% активного агента и могут также включать один или более дополнительных ингредиентов из числа приведенных в настоящем описании.
Фармацевтическая композиция согласно настоящему изобретению может быть приготовлена, упакована или представлена для продажи в виде препарата, подходящего для трансбуккального введения. Такие композиции могут, например, иметь форму таблеток или леденцов, приготовленных с использованием обычных методов и могущих, например, содержать от 0,1 до 20 мас.% активного агента, и могут включать для баланса растворимую или разлагаемую при пероральном введении композицию и, необязательно, один или более дополнительных ингредиентов из числа приведенных в настоящем описании. Альтернативно, композиции, пригодные для трансбуккального введения, могут содержать порошок или аэрозольную или пульверизационную форму раствора или суспензии, включающую указанный активный ингредиент. Такие порошковые, аэрозольные или пульверизационные композиции при их диспергировании имеют предпочтительно средний размер частиц или капелек в диапазоне от примерно 0,1 до примерно 200 нанометров и могут дополнительно включать один или более дополнительных ингредиентов из числа рассматриваемых в настоящем описании.
Фармацевтическая композиция согласно настоящему изобретению может быть приготовлена, упакована или предложена для продажи в составе препарата, пригодного для внутриглазного введения. Такие композиции могут, например, иметь форму глазных капель, включающих, к примеру, 0,1-1,0 мас.% раствор или суспензию активного вещества в водном или масляном жидком носителе. Такие капли могут также включать забуферивающие вещества, соли или один или более других дополнительных ингредиентов из числа приведенных в настоящем описании. Другие композиции для внутриглазного введения, которые могут быть использованы, включают те из них, которые содержат активное вещество в микрокристаллической форме или в составе липосомного препарата.
В контексте настоящего описания термин "дополнительные ингредиенты" включает, не ограничиваясь приведенным списком, один или более следующих компонентов: наполнители, поверхностно-активные вещества, диспергирующие вещества, инертные разбавители, гранулирующие и дезинтегрирующие вещества, связующие вещества, замасливатели, подсластители, вкусовые вещества, красители, консерванты, физиологически разлагаемые композиции, такие как желатин, водные носители и растворители, масляные носители и растворители, суспендирующие вещества, диспергирующие или смачивающие вещества, эмульгаторы, средства, смягчающие раздражение, буферы, соли, загустители, наполнители, эмульгаторы, антиоксиданты, антибиотики, противогрибковые вещества, стабилизаторы и фармацевтически приемлемые полимерные или гидрофобные материалы. Другие "дополнительные ингредиенты", которые могут быть введены в фармацевтические композиции согласно настоящему изобретению, известны в технике и описаны, например, в монографии Genaro, ed., 1985, Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, PA, которая включена в настоящее описание в качестве ссылки.
Относительные количества активного вещества, фармацевтически приемлемого носителя и любых дополнительных ингредиентов в фармацевтической композиции согласно настоящему изобретению будут меняться в зависимости от природы, размера и вида, а также тяжести состояния субъекта, которого предстоит лечить, и также определяются способом введения композиции. В качестве примера следует указать, что композиция может включать от 0,1 до 100 мас.% активного вещества.
В типичном случае дозировки активного вещества, которые могут вводиться животным, предпочтительно человеку, изменяются от 1 микрограмма до примерно 100 граммов на килограмм веса тела животного. При этом точная вводимая дозировка будет меняться в зависимости от множества факторов, которые включают, не ограничиваясь ими, вид животного и тип болезненного состояния, которое предстоит лечить, возраст животного и способ введения. Предпочтительно доза активного вещества будет изменяться от примерно 1 миллиграмма до примерно 10 граммов на килограмм веса тела животного. Более предпочтительно, доза будет изменяться от примерно 10 миллиграммов до примерно 1 грамма на килограмм веса тела животного. Альтернативно, доза может выражаться в единицах на квадратный метр поверхности тела животного (то есть в миллиграммах или килограммах на квадратный метр, мг/м2 или кг/м2). Предпочтительно указанная дозировка будет варьировать от примерно 0,1 миллиграмма до примерно 5 граммов на квадратный метр поверхности тела животного. Более предпочтительно доза будет варьировать от примерно 1 миллиграмма до примерно 1 грамма на квадратный метр поверхности тела животного.
Частота введения активного вещества животному может составлять несколько раз в день или указанный ингредиент может вводиться реже, например один раз в день, один раз в неделю, один раз в две недели, один раз в месяц, или еще реже, например один раз в несколько месяцев или даже один раз в год или еще реже. Частота введения дозы может быть определена специалистом в данной области и зависит от различных факторов, включающих, не ограничиваясь приведенным списком, тип и тяжесть заболевания, которое предстоит лечить, вид и возраст животного и др.
Ниже настоящее изобретение будет описано со ссылкой на следующие примеры. Указанные примеры даны только в целях иллюстрации, и настоящее изобретение не ограничивается указанными примерами, но охватывает все варианты, которые становятся очевидными после прочтения настоящего описания.
Примеры
В приведенных примерах используются следующие реагенты и методики.
Если особо не оговорено иное, все реакции проводят в инертной атмосфере (например, в атмосфере аргона или азота). Все растворители имеют класс "чистый для анализа" (например, перегнанные растворители, растворители для хроматографии и растворители для обработки реакционных смесей) или класс "чистый для ВЭЖХ" (например, растворители для реакций). Безводный диэтиловый эфир и тетрагидрофуран (ТГФ) перегоняют над натрием с бензофеноном. Температура кипения используемого гексана составляет 38-55°С. Метиленхлорид (СН2Cl2), бензол, толуол и N,N-диметилформамид (ДМФ) перегоняют над гидридом кальция (CaH2). Органические кислоты и основания имеют класс "чистый для анализа". Триэтиламин (Et3N), диизопропилэтиламин (ДИПЭА), морфолин и N-метилморфолин (NMM) перегоняют над гидридом кальция (CaH2). Все другие реагенты, включая диметиламинофенол и диэтил-1,3-ацетондикарбоксилат, имеют наивысшую коммерчески доступную степень чистоты. Аналитическую тонкослойную хроматографию (ТСХ) проводят на пластинах с силикагелем EM Separations Tech/Merck (60-F254) (0,25 миллиметров), предварительно покрытых флуоресцентным индикатором. Визуализацию проводят в ультрафиолетовом свете (254 нанометра), фосфомолибденовой кислотой (7% вес/объем) в 95% этаноле. Температуры плавления (Тпл) определяют с использованием капиллярного аппарата для определения температуры плавления Томаса-Гувера и указывают без поправки. Спектры магнитного резонанса на атомах водорода и углерода (1Н- и 13С-ЯМР соответственно) записывают на спектрометре Bruker AM-500 (500 МГц) с преобразованием Фурье и химические сдвиги выражают в частях на миллион (м.д.) относительно CHCl3 в качестве внутреннего стандарта (7,24 м.д. для 1H и 77,0 для 13C). Множественные сигналы обозначают как синглет (с), дуплет (д), дуплет дуплетов (дд), дуплет триплетов (дт), триплет (т), квартет (к), мультиплет (м) и широкий синглет (шс). Инфракрасный спектр (ИК) получают с использованием спектрофотометра Perkin-Elmer Model 1600 FT-IR. Полосы поглощения характеризуют длиной волны (см-1). Оптическое вращение (в градусах) измеряют с использованием поляриметра Perkin-Elmer Model 341. Масс-спектр высокого разрешения (МСВР) получают с использованием либо VG 70-70HS, либо Micromass AutoSpect. Элементный анализ проводят с использованием анализатора Perkin-Elmer 2400 Series II CHNS/O Analyser. Колоночную флэш-хроматографию проводят с использованием силикагеля Merck silicagel 60 с размером частиц 240-400 меш и с использованием систем растворителей, указываемых конкретно для каждого отдельного эксперимента.
Пример 1
Полный синтез (-)тамандарина А
В данном примере описывается способ синтеза (-)тамандарина А. Данный способ показан также на фиг.26. Способ начинают с синтеза соединения 13, показанного на фиг.26А.
Реакция А на фиг.26А: синтез соединения 8
Раствор, содержащий 5,13 миллилитра (36,9 миллимолей) Et3N добавляют по каплям при 0°С к раствору, содержащему 1,56 грамма (11,9 миллимоля) соединения 7, D-алло-изолейцина, и 50 миллилитров свежеперегнанного CH2Cl2. К полученной смеси добавляют 3,114 грамма (12,5 миллимоля) карбобензилоксисукцинимида (Cbz-сукцинимид). Образовавшуюся реакционную смесь перемешивают при 0°С в течение 1 часа и выдерживают при перемешивании при комнатной температуре в течение ночи. Полученную реакционную смесь концентрируют, разбавляют 20 миллилитрами насыщенного раствора NaHCO3 и дважды промывают аликвотами эфира по 10 миллилитров. Объединенные эфирные фракции экстрагируют 10 миллилитрами насыщенного раствора бикарбоната натрия (NaHCO3). Объединенные водные слои охлаждают до 0°С, подкисляют до рН 2 добавлением по каплям 1 нормального KHSO4 и экстрагируют три раза 20 миллилитрами этилацетата (EtOAc). Этилацетатные слои объединяют, промывают 20 миллилитрами насыщенного раствора NaCl и сушат над безводным сульфатом натрия (Na2SO4). Полученный раствор фильтруют и концентрируют при пониженном давлении с получением 3,13 грамма соединения 8 (выход 99%). Соединение 8 получают в виде бесцветного масла и используют непосредственно на следующей стадии без дополнительной очистки. Соединение 8 характеризуется следующими аналитическими показателями: Rf 0,08 (20:80 этилацетат : гексан); 1H ЯМР (500 МГц, CDCl3) δ 0,86-0,90 (м, 3Н), 0,93-0,97 (м, 3H), 1,20-1,27 (м, 1H) и 1,42-1,47 (м, 1Н), 1,98-2,09 (м, 1H), 4,47-4,50 (дд, J1=9,1 Гц, J2=3,4 Гц, 1H), 5,10 (с, 2H), 5,17-5,19 (д, J=9,1 Гц, 1H), 7,29-7,35 (м, 5H); 13C ЯМР (250 МГц, CDCl3) δ 11,69, 14,35, 26,20, 37,42, 56,96, 67,20, 128,14, 128,24, 128,55, 135,06, 156,42, 177,41; ИК (CHCl3) 2470-3540, 3440, 2980, 2950, 2890, 1720, 1510, 1455, 1405, 1385, 1325-1355, 1230-1280, 1165, 1095, 1040, 1005, 910 см-1.
Реакции В и С на фиг.26А: синтез соединения 10
Раствор, содержащий 3,534 грамма (13,3 миллимоля) соединения 8 (то есть неочищенного Cbz-D-алло-изолейцина) в 50 миллилитрах безводного CH2Cl2, охлаждают на ледяной бане до 0°С. К охлажденному раствору добавляют в форме твердого вещества каждый из следующих компонентов: 2,574 грамма (14,0 миллимолей) пентафторфенола (PEPOH), 3,064 грамма (16,0 миллимолей) 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида (EDAC•HCl) и 0,325 грамма (2,7 миллимоля) 4-диметиламинопиридина (DMAP). Образовавшуюся в результате этого реакционную смесь выдерживают при перемешивании в течение получаса при 0°С и еще дополнительно в течение 4 часов при комнатной температуре. Полученную смесь разбавляют 50 миллилитрами CH2Cl2. Полученный CH2Cl2-слой промывают один раз 25 миллилитрами 10% хлористоводородной кислоты (HCl), один раз 25 миллилитрами 5% раствора NaHCO3 и один раз 25 миллилитрами насыщенного раствора NaCl. Полученный промытый CH2Cl2-слой сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученный сложный эфир пентафторфенола, соединение 9 (5,70 грамма), получают в виде бесцветного масла и используют на следующей стадии без очистки. Соединение 9 характеризуется следующими аналитическими показателями: Rf 0,52 (20:80 этилацетат : гексан); 1Н ЯМР (500 МГц, CDCl3) δ 0,90-1,12 (м, 6Н), 1,29-1,39 (м, 1H) и 1,45-1,52 (м, 1H), 2,05-2,15 (м, 1H), 4,79-4,84 (м, 1H), 5,10 (с, 2H), 5,12-5,14 (д, J=9,1 Гц, 1H), 7,29-7,37 (м, 5H); 13C ЯМР (250 МГц, CDCl3) δ 11,68, 14,25, 26,24 37,64, 57,09 67,45, 128,20, 128,35, 128,59 и 135,95, 136,9, 139,0, 140,0 и 142,0, 156,13, 168,87.
Раствор, содержащий 5,70 грамма соединения 9 и 25 миллилитров безводного ТГФ охлаждают до -78°С. Енолятный раствор, содержащий енолят лития из метилацетата, готовят, охлаждая раствор, содержащий 49,2 миллимоля диальдегида лития и 25 миллилитров безводного ТГФ, в бане с сухим льдом при температуре -78°С, добавляя к указанному раствору с помощью шприца 3,92 миллилитра (49,2 миллимоля) метилацетата и выдерживая полученный раствор при перемешивании при температуре -78°С в течение 1 часа. Полученный таким образом енолятный раствор по каплям добавляют в вышеупомянутый раствор, содержащий соединение 9, и полученную в результате этого смесь выдерживают при перемешивании 0,75 часа при температуре -78°С. Реакцию гасят при -78°С добавлением 50 миллилитров насыщенного раствора водного хлорида аммония (NH4Cl). После остановки реакции реакционную смесь доводят до комнатной температуры и удаляют ТГФ при пониженном давлении. Полученный водный раствор экстрагируют 3 раза аликвотами CH2Cl2 по 25 миллилитров. Объединенные CH2Cl2-слои промывают один раз с использованием 10% раствора хлористоводородной кислоты (HCl), один раз с использованием 25 миллилитров 5% раствора NaHCO3 и один раз с использованием 25 миллилитров насыщенного раствора NaCl. Промытый CH2Cl2-слой сушат в присутствии Na2SO4, фильтруют и концентрируют при пониженном давлении. Реакция приводит к получению желтого масла, которое очищают флэш-хроматографией на колонке. Желтое масло наносят на колонку из силикагеля и элюируют раствором, содержащим EtOAc и гексан в соотношении 10 : 95 соответственно. Полученный при хроматографировании продукт составляет 3,42 грамма бесцветного масла, соответствующего сложному бета-кетоэфиру, соединению 10. Общий выход соединения 10 составляет 80% для обеих реакций В и С. Соединение 10 характеризуется следующими аналитическими показателями: Rf 0,42 (35:65 этилацетат : гексан); 1H ЯМР (500 МГц, CDCl3) δ 0,75-0,79 (м, 3Н), 0,90-0,98 (м, 3H), 1,26-1,30 (м, 1H) и 1,42-1,46 (м, 1H), 1,97-1,99 (м, 1H), 3,53 (с, 2H), 3,72 (с, 3H), 4,56-4,58 (д, J=7,6 Гц, 1H), 5,10 (с, 2H), 5,26-5,28 (д, J=6,4 Гц, 1H), 7,30-7,36 (м, 5H); 13C ЯМР (250 МГц, CDCl3) δ 11,83, 13,79, 26,83, 36,12, 46,56, 52,46, 63,00, 67,19, 128,10, 128,24, 128,56, 136,16, 156,42, 166,96, 201,68; ИК (CHCl3) 3349,1, 2964,4, 1748,3, 1712,9, 1520,6, 1454,8, 1328,2, 1232,1 см-1; МСВР m/z, вычислено для C17H23NO5Na(M+Na+): 344,1498; найдено 344,1490; [α]D 20 -27,85 (c 0,53; CHCl3). Элементный анализ, вычислено для C17H23NO5 (%): C 63,52; H 7,22; N 4,36. Найдено (%): С 63,32; Н 7,15; N 4,24.
Реакция D на фиг.26А: синтез соединения 11
Раствор, содержащий 2,797 грамма (8,7 миллимоля) соединения 10 и 30 миллилитров метанола (MeOH) класса "чистый для ВЭЖХ", охлаждают до -78°С и порциями добавляют 1,644 грамма (30,5 миллимоля) борогидрида калия (KBH4). Полученную смесь вначале перемешивают при -78°С в течение 10 минут. Затем реакционный сосуд нагревают до -20°С и продолжают перемешивание в течение 30 минут, после чего реакционный сосуд нагревают до 0°С и продолжают перемешивание в течение еще 10 минут. Полученную в результате этого смесь гасят при 0°С добавлением по каплям раствора, содержащего ледяную уксусную кислоту до тех пор, пока рН водного слоя реакционной смеси не станет менее рН 6 по лакмусовой бумаге. Полученный в результате этого нейтрализованный двухслойный раствор концентрируют при пониженном давлении и добавляют 50 миллилитров раствора, содержащего EtOAc и Н2О в соотношении 1 : 1. Органический слой отделяют от водного слоя и промывают 10 миллилитрами насыщенного раствора NaCl. Промытый органический слой сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученный при этом неочищенный продукт в количестве 2,786 грамм представляет собой бесцветное масло, которое содержит соединение 11 и его стереоизомер в соотношении 11:1 соответственно. Кристаллизация бесцветного масла из раствора, содержащего эфир и гексан, дает чистое соединение 11 в виде белого кристаллического твердого вещества с 99% выходом. Соединение 11 характеризуется следующими аналитическими показателями: Rf 0,29 (35:65 этилацетат : гексан); 1H ЯМР (500 МГц, CDCl3) δ 0,83-0,85 (м, 3H), 0,89-0,92 (м, 3H), 1,19-1,23 (м, 1H) и 1,32-1,34 (м, 1H), 1,91-1,93 (м, 1H), 2,45-2,51 (дд, J1=16,7 Гц, J2=9,1 Гц, 1H) и 2,58-2,62 (дд, J1=16,7 Гц, J2=2,7 Гц, 1H), 3,12-3,14 (д, J=4,5 Гц, 1H), 3,68 (с, 3H), 3,90-3,91 (м, 1H), 4,62-4,65 (д, J=10,0 Гц, 1H), 5,07-5,08 (д, J=5,1 Гц, 2H), 7,29-7,35 (м, 5H); 13C ЯМР (250 МГц, CDCl3) δ 12,10, 13,64, 27,52, 34,28, 38,74, 52,25, 57,57, 67,39, 69,43, 128,50, 128,61, 128,97 и 136,82, 157,08, 174,09; ИК (CHCl3) 3421, 3316, 2951, 1709, 1537, 1443, 1229 см-1; МСВР m/z, вычислено для C17H25NO5Na(M+Na+): 346,1630; найдено 346,1645; [α]D 20 -10,9 (c 0,595; CHCl3). Элементный анализ, вычислено для C17H25NO5 (%): C 63,12; H 7,80; N 4,33. Найдено (%): С 63,23; Н 7,85; N 4,06.
Реакция E на фиг.26А: синтез соединения 12
Раствор, содержащий 0,8636 грамма (2,67 миллимоля) соединения 11 в виде бесцветного масла и 10 миллилитров CH2Cl2 помещают в атмосферу аргона и охлаждают до 0°С. Добавляют раствор, содержащий 0,778 миллилитра (6,68 миллимоля) 2,6-лутидина с последующим добавлением раствора, содержащего 1,08 миллилитра (4,01 миллимоля) триизопропилсилилтрифлата (i-Pr3SiOTf). Указанную реакционную смесь вначале выдерживают при перемешивании при температуре 0°С в течение 30 минут, после чего эту реакционную смесь выдерживают при комнатной температуре в течение 2 часов. Полученную в результате этого смесь разбавляют 20 миллилитрами CH2Cl2. Указанный CH2Cl2-слой промывают один раз 15 миллилитрами 10% раствора хлористоводородной кислоты (HCl), один раз 15 миллилитрами 5% раствора NaHCO3 и один раз 15 миллилитрами насыщенного раствора NaCl. Полученный в результате промытый CH2Cl2-слой сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Концентрированный остаток очищают флэш-хроматографией на колонке, элюируя растворами, содержащими эфир и гексан в соотношении от 2 : 98 соответственно до 15 : 85 соответственно. Выход после хроматографирования составляет 1,204 грамма (выход 94%) соединения 12 в форме основного изомера в виде бесцветного масла. Соединение 12 характеризуется следующими аналитическими показателями: Rf 0,65 (35:65 этилацетат : гексан); 1Н ЯМР (500 МГц, CDCl3) δ 0,84-0,91 (м, 6H), 0,99-1,05 (м, 21H), 1,12-1,34 (м, 2Н), 1,81-1,84 (м, 1H), 2,54-2,62 (м, 2Н), 3,54 (с, 3Н), 3,73-3,75 (м, 1H), 4,34-4,36 (м, 1H), 4,69-4,71 (д, J=10,5 Гц, 1H), 5,01-5,04 (д, J=12,3 Гц, 1H) и 5,09-5,11 (д, J=12,3 Гц, 1H), 7,28-7,34 (м, 5H); 13C ЯМР (250 МГц, CDCl3) δ 12,50, 12,74, 13,97, 18,08, 27,44, 34,40, 40,45, 51,54, 58,62, 66,67, 70,49, 128,03, 128,08, 128,46 и 136,67, 156,51, 172,00; ИК (CHCl3) 3450, 3359, 2944, 2863, 1728, 1510, 1459, 1434, 1384, 1308, 1232, 1171, 1090 см-1; МСВР m/z, вычислено для C26H45NSiO5Na(M+Na+): 480,3145; найдено 480,3128; [α]D 20 +15,88 (c 0,57; CHCl3). Элементный анализ, вычислено для C17H25NO5 (%): C 65,09; H 9,46; N 2,92. Найдено (%): С 64,80; Н 9,41; N 2,69.
Реакция F на фиг.26А: синтез соединения 13
Раствор, содержащий 1 нормальный NaOH (20 млллилитров, 11 миллимолей) добавляют к раствору, содержащему 0,84 грамма (1,753 миллимоля) соединения 12, 10 миллилитров ТГФ и 10 миллилитров МеОН, охлажденному до 0°С. Указанную реакционную смесь выдерживают при перемешивании в течение 2 часов при 0°С. Затем реакционную смесь продолжают перемешивать при комнатной температуре в течение ночи. Далее указанную реакционную смесь концентрируют при пониженном давлении и разбавляют 10 миллилитрами Н2О. Полученную смесь охлаждают до 0°С на ледяной бане, подкисляют до рН 2 добавлением раствора, содержащего 1 нормальный KHSO4 и экстрагируют 3 раза EtOAc аликвотами по 10 миллилитров. EtOAc-слои объединяют, промывают 10 миллилитрами насыщенного раствора NaCl, сушат над безводным Na2SO4, фильтруют и концентрируют. Указанная реакция дает 0,7709 грамма (выход 95%) соединения 13 в виде белой пены. Соединение 13 используют в последующей реакции без очистки. Соединение 13 характеризуется следующими аналитическими показателями: Rf 0,08 (35:65 этилацетат : гексан); 1H ЯМР (500 МГц, CDCl3) δ 0,86-1,00 (м, 6H), 1,06-1,08 (м, 21H), 1,19-1,24 (м, 1H) и 1,64-1,72 (м, 1H), 1,85-1,92 (м, 1H), 2,50-2,80 (м, 2H), 3,60-3,80 (м, 1H), 4,28-4,33 (м, 1H), 4,86-4,88 (д, J=10,4 Гц, 1H), 5,06-5,22 (м, 2H), 7,29-7,45 (м, 5Н).
Реакция G на фиг.26В: синтез соединения 15
Синтез защищенной формы (2S)-α-гидроксиизовалерил-изостатина (6) изображен на фиг.26В. В реакции G на фиг.26В L-валин (14) растворяют в растворе, содержащем нитрит натрия (NaNO2) и 1 нормальную серную кислоту (H2SO4). Указанную реакцию проводят с использованием стандартного метода, описанного, например, Green and Wutz, 1999, Protecting Groups in Organic Synthesis, Wiley, New York, или Bodansky, 1993, Principles of Peptide Synthesis, Springer, Berlin. Указанная реакция приводит к образованию альфа-гидроксивалина (15).
Реакция Н на фиг.26В: синтез соединения 16
В ходе реакции Н 2,46 грамма (17,78 миллимолей) безводного карбоната калия (K2CO3) и 1,25 грамма (3,4 миллимоля) йодида тетрабутиламмония (Bu4NH4I) добавляют к раствору, содержащему 2 грамма (16,93 миллимоля) альфа-гидроксивалина (15) и 20 миллилитров дважды перегнанного ДМФ, с последующим добавлением по каплям 5,86 миллилитров (67,72 миллимоля) аллилбромида. Полученный раствор перемешивают при комнатной температуре в течение 1 часа. Далее реакционную смесь концентрируют при пониженном давлении, разбавляют 20 миллилитрами Н2О и экстрагируют три раза эфиром аликвотами по 20 миллилитров. Объединенные органические слои промывают один раз 15 миллилитрами 10% раствора хлористоводородной кислоты (HCl), один раз 15 миллилитрами 5% раствора NaHCO3 и один раз 15 миллилитрами насыщенного раствора NaCl. Полученные промытые органические слои сушат в присутствии Na2SO4, фильтруют и концентрируют при пониженном давлении. Указанная реакция дает 2,53 грамма (выход 96%) соединения 16 в виде оранжевого масла. Соединение 16 используют в последующей реакции без очистки. Соединение 16 характеризуется следующими аналитическими показателями: Rf 0,50 (25:75 этилацетат : гексан); 1Н ЯМР (500 МГц, CDCl3) δ 0,71-0,86 (д, J=6,8 Гц, 3Н), 0,92-1,00 (д, J=7,0 Гц, 3H), 2,04-2,10 (м, 1H), 2,65-2,66 (д, J=6,1 Гц, 1H), 4,03-4,05 (дд, J1=5,9 Гц, J2=3,5 Гц, 1H), 4,62-4,70 (м, 2H), 5,24-5,27 (дд, J1=10,4 Гц, J2=1,1 Гц, 1H) и 5,31-5,35 (дд, J1=17,2 Гц, J2=3,5 Гц, 1H), 5,86-5,94 (м, 1H); 13C ЯМР (250 МГц, CDCl3) δ 15,93, 18,76, 32,17, 66,04, 75,03, 119,12, 131,48, 174,62; ИК (CHCl3) 3521-3458, 2964, 2880, 1735, 1646, 1462, 1367, 1257, 1204, 1136, 1073, 1026, 983, 931 см-1.
Реакция I на фиг.26В: синтез соединения 17
Раствор, содержащий 0,6827 грамма (1,47 миллимоля) соединения 13 и 2,5 миллилитра свежеперегнанного толуола помещают в инертную атмосферу и охлаждают до 0°С. К охлажденному раствору соединения 13 по каплям добавляют раствор, содержащий 0,232 грамма (1,47 миллимоля) соединения 16 и 2,5 миллилитра толуола, с последующим добавлением 0,333 грамма (1,61 миллимоля) дициклогексилкарбодиимида (ДЦК) и 0,036 грамма (0,29 миллимоля) ДМАП. Указанную реакционную смесь перемешивают при 0°С в течение 2 часов и оставляют при комнатной температуре на ночь. Указанную реакционную смесь гасят добавлением 2 миллилитров раствора, содержащего МеОН и уксусную кислоту (АсОН) в соотношении 1:2, и EtOAc и перемешивают 20 минут при комнатной температуре. Полученную реакционную смесь концентрируют при пониженном давлении. Остаток, полученный в результате указанной процедуры, растворяют в 10 миллилитрах эфира, что приводит к образованию нерастворимого вещества, которое удаляют фильтрованием. Фильтрат промывают один раз 10 миллилитрами 10% раствора лимонной кислоты, один раз 10 миллилитрами 5% раствора NaHCO3 и один раз 10 миллилитрами насыщенного солевого раствора (то есть насыщенного раствора NaCl). Полученный органический слой сушат над безводным Na2SO4, фильтруют и концентрируют. Полученный в результате этого остаток очищают флэш-хроматографий на колонке, элюируя смесью растворителей, которая включает эфир и гексан в соотношении от 2:98 соответственно до 12:88 соответственно. Концентрирование элюата при пониженном давлении дает 0,5774 грамма (выход 65%) соединения 17 в виде бесцветного масла. Соединение 17 характеризуется следующими аналитическими показателями: Rf 0,55 (20:80 этилацетат : гексан); 1H ЯМР (500 МГц, CDCl3) δ 0,85-1,08 (м, 33H), 1,16-1,19 (м, 1H), 1,34-1,36 (м, 1H), 1,80-1,82 (м, 1H), 2,18-2,21 (м, 1H), 2,68-2,73 (м, 2H), 3,78-3,82 (м, 1H), 4,37-4,42 (м, 1H), 4,55-4,64 (м, 2H), 4,77-4,78 (д, J=4,4 Гц, 1H), 4,86-4,88 (д, J=10,7 Гц, 1H), 5,07 (с, 2H), 5,21-5,23 (дд, J1=9,4 Гц, J2=0,9 Гц, 1H), 5,28-5,32 (дд, J1=17,0 Гц, J2=1,2 Гц, 1H), 5,83-5,87 (м, 1H), 7,27-7,34 (м, 5Н); 13C ЯМР (250 МГц, CDCl3) δ 12,69, 12,93, 14,14, 17,25, 18,12, 18,78, 26,33, 29,98, 34,48, 40,28, 58,15, 66,69, 68,67, 70,66, 76,74, 118,82, 128,01, 128,40, 128,47, 136,75, 131,63, 156,48, 169,13, 170,78; ИК (CHCl3) 3380, 2964, 2867, 1743, 1508, 1463, 1374, 1201, 1129, 994, 882 см-1; МСВР m/z, вычислено для C33H55NSiO7Na(M+Na+): 628,364552; найдено 628,365878. Элементный анализ, вычислено для C33H55NSiO7 (%): C 65,41; H 9,16. Найдено (%): С 65,09; Н 9,05.
Реакция J на фиг.26В: синтез соединения 6
В ходе реакции J тетракис(трифенилфосфин)палладий (Pd(PPh3)4, (0,044 грамма, 0,038 миллимоля) добавляют к раствору, содержащему 0,2315 грамма (0,38 миллимоля) сложного изостатин-Hiv-аллилового эфира, соединение 17, и 3 миллилитра свежеперегнанного ТГФ. К полученной смеси добавляют по каплям свежеперегнанный морфолин (0,33 миллилитра, 3,8 миллимоля). Добавление реагентов проводят в темноте и реакционную смесь перемешивают при комнатной температуре в темноте по меньшей мере 8 часов. Далее реакционную смесь концентрируют при пониженном давлении и разбавляют 5 миллилитрами CH2Cl2. Полученный в результате данной процедуры раствор промывают один раз 5 миллилитрами раствора, содержащего 1 нормальную HCl, и один раз 5 миллилитрами Н2О. Промытый органический слой сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток растворяют в 5 миллилитрах эфира, фильтруют и еще раз концентрируют при пониженном давлении. Остаток, который остается в результате описанных процедур, представляет собой белую пену, соответствующую соединению 6 (0,218 грамма, количественный выход). Соединение 6 используют в последующей реакции без очистки.
Синтез линейного гексапептидного соединения 20 изображен на фиг.26С. Соединение 5 получают, как описано в литературе (Li et al., 1990, J. Am. Chem. Soc., 112:7659-7672).
Реакция К на фиг.26С: синтез соединения 18
Раствор, содержащий 0,6653 грамма (0,74 миллимоля) соединения 5 и 10 миллилитров МеОН, добавляют к суспензии, содержащей 0,1996 грамма 10% палладия на угле (Pd/C), 10 миллилитров МеОН и 10 миллилитров EtOAc. Реакционную смесь встряхивают в аппарате Парра в течение 5 часов при комнатной температуре. Полученную взвесь фильтруют через Целит и Целит промывают избытком растворителя, содержащего МеОН и EtOAc в соотношении 1 : 1. Полученный фильтрат сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением соединения 18 (0,552 грамма, выход 98%). Соединение 18 (то есть лейцилпролил-N,O-диметилтирозин-N-Boc-О-SEM-треонин) получают в виде белого твердого вещества с использованием описанной процедуры и используют в последующей реакции без очистки. Соединение 18 характеризуется следующими аналитическими показателями: Rf 0,03 (40:60 ацетон : гексан); 1H ЯМР (500 МГц, CDCl3) δ -0,001 (с, 9H), 0,64-0,86 (м, 2H), 0,88-0,96 (м, 6H), 1,19-1,21 (д, J=6,3 Гц), 1,33-1,34 (д, J=6,3 Гц, 3H, R1), 1,44 (с, 9H), 1,63-1,92 (м, 3Н), 1,92-2,01, 2,08-2,24 (м, 4Н), 2,73 (с, 3Н), 2,86-2,96 (м), 3,10-3,19 (м, 2H), 3,45-3,72 (м, 4H), 3,75 (с, 3Н), 4,34-4,69 (м, 3Н), 4,78-4,81 (дд, J1=8,0 Гц, J2=3,3 Гц, 1H), 5,01-5,10 (м, 1H), 5,17-5,52 (м), 7,58-7,60 (д, J=9,7 Гц, 3H), 6,77-6,83 (м, 2H), 7,00-7,10 (м, 2H); 13C ЯМР (250 МГц, CDCl3) δ -1,46, 16,87, 17,96, 22,00, 23,19, 23,76, 25,14, 28,16, 29,31, 33,65, 39,31, 47,34, 50,54, 55,37, 55,46, 58,66, 62,25, 68,16, 72,36, 81,15, 89,83, 114,39, 128,75, 128,75, 130,47, 157,04, 158,84, 168,15, 168,95, 169,57, 173,13; ИК (CHCl3) 3285, 2951, 1740, 1709, 1641, 1511, 1448, 1365, 1250, 1161 см-1; МСВР m/z, вычислено для C37H63N4SiO10(M+H+): 751,4314; найдено 751,4343; [α]D 20 -44,68 (c 1,03; CHCl3); элементный анализ, вычислено для C37H62N4SiO10 (%): C 59,17; H 8,33; N 7,46. Найдено (%): С 59,17; Н 8,35; N 7,26.
Реакция L на фиг.26C: синтез соединения 19
В ходе реакции L соединение 6 в количестве, соответствующем общему выходу в реакции J, растворяют в 1 миллилитре свежеперегнанного CH2Cl2 и охлаждают до 0°С. К этому раствору добавляют 0,074 грамма (0,40 миллимолей) PFPOH (пентафторфенола), 0,088 грамма (0,46 миллимоля) EDAC•HCl (1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида) и 0,0093 грамма (0,076 миллимоля) DMAP (4-диметиламинопиридина). Образовавшуюся реакционную смесь перемешивают при 0°С в течение 30 минут. Затем указанную реакционную смесь дополнительно выдерживают 4 часа при комнатной температуре и разбавляют 10 миллилитрами CH2Cl2. Полученный CH2Cl2-слой промывают один раз 5 миллилитрами 10% раствора HCl, один раз 5 миллилитрами 5% раствора NaHCO3 и один раз 5 миллилитрами насыщенного раствора NaCl. Полученный промытый CH2Cl2-слой сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают флэш-хроматографий на колонке, элюируя смесью растворителей, которая включает эфир и гексан в соотношении от 3:97 соответственно до 7:93 соответственно. Концентрирование элюата при пониженном давлении дает 0,2315 грамма бесцветного масла, соответствующего сложному ПФП эфиру, соединению 19 (выход 83% для реакции J на фиг.26В и реакции L на фиг.26С). Соединение 19 характеризуется следующими аналитическими показателями: Rf 0,57 (20:80 этилацетат : гексан); 1H ЯМР (500 МГц, CDCl3) δ 0,86-1,09 (м, 33Н), 1,18-1,20 (м, 1H), 1,27-1,29 (м, 1H), 1,84-1,86 (м, 1H), 2,31-2,36 (м, 1H), 2,69-2,72 (м, 1H), 2,80-2,85 (м, 1H), 3,79-3,82 (м, 1H), 4,38-4,42 (м, 1H), 4,78-4,80 (д, J=10,7 Гц, 1H), 4,97-4,98 (д, J=4,4 Гц, 1H), 5,00-5,06 (м, 2H), 7,25-7,29 (м, 5Н); 13C ЯМР (250 МГц, CDCl3) δ 12,72, 12,95, 14,07, 17,20, 18,09, 18,45, 27,52, 30,19, 34,40, 40,12, 58,17, 65,82, 66,74, 70,47, 127,92, 128,18, 128,33, 136,57, 138,83, 140,06, 140,65, 141,97, 156,56, 165,68, 170,76; ИК (CHCl3) 3480, 2962, 2868, 1793, 1730, 1516, 1464, 1381, 1214, 1094, 995, 880 см-1; МСВР m/z, вычислено для C36H50NF5SiO7Na(M+Na+): 754,3174; найдено 754,3191.
Реакция M на фиг.26C: синтез соединения 20
Раствор, содержащий 0,2855 грамма (0,39 миллимолей) соединения 19 и 1,5 миллилитра CH2Cl2 охлаждают до 0°С на ледяной бане. К этому раствору по каплям добавляют 0,17 миллилитра (0,98 миллимолей) ДИЭА и полученную смесь перемешивают при 0°С в течение 20 минут. К раствору, содержащему соединение 19, добавляют с использованием шприца раствор, содержащий 0,522 грамма соединения 18, 0,0095 грамма (0,078 миллимоля) ДМАП и 1,5 миллилитра CH2Cl2. Полученную смесь перемешивают при 0°С в течение 1 часа и дополнительно выдерживают при комнатной температуре еще 1 час. Реакцию гасят при 0°С добавлением 3 миллилитров насыщенного водного раствора NH4Cl и разбавляют реакционную смесь 10 миллилитрами CH2Cl2. Образовавшуюся смесь разделяют при комнатной температуре. Полученный водный слой экстрагируют 3 раза CH2Cl2 аликвотами по 10 миллилитров и объединенные органические слои промывают один раз 10 миллилитрами 10% раствора HCl, один раз 10 миллилитрами 5% раствора NaHCO3 и один раз 10 миллилитрами насыщенного раствора NaCl. Полученный промытый CH2Cl2-слой сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Эта реакция дает 0,4861 грамма (выход 96%) полностью защищенного гексапептидного предшественника, соединения 20. Полученное с помощью описанной процедуры соединение 20 в виде белой пены используют в следующей реакции без дополнительной очистки. Гексапептид 20 характеризуется следующими аналитическими показателями: Rf 0,47 (05:95 ацетон : CH2Cl2); 1Н ЯМР (500 МГц, CDCl3) δ -0,0008 (с, 9H), 0,73-0,83 (м, 2H), 0,85-0,92 (м, 9H), 0,92-1,08 (м, 21Н), 1,45 (с, 9H), 1,13-2,19 (м, 11Н), 2,43-2,46 (м, 1H) и 2,54-2,58 (м, 1H), 2,64 и 2,88 (с, 3H, RI), 3,09-3,17 (м, 2H), 3,44-3,73 (м, 4Н), 3,75 (с, 3Н), 3,79-3,89 (м, 1H), 4,38-4,45 (м, 1H), 4,21-4,35 (м, 3H), 4,70-4,81 (м, 1H), 4,96-5,06 (м, 3H), 5,18-5,43 (м, 3H) и 8,32-8,34 (д, J=9,0 Гц, 3H), 5,46-5,48 (д, J=6,1 Гц, 1H), 6,74-6,83 (м, 2H), 6,95-7,11 (м, 2H), 7,25-7,38 (м, 5H), 7,75-7,77 (д, J=8,5 Гц) и 8,85-8,87 (д, J=10,1 Гц, 2H); 13C ЯМР (250 МГц, CDCl3) δ -1,45, 11,73, 12,73, 14,47, 16,54, 17,73, 17,99, 18,14, 18,92, 21,40, 23,54, 24,42, 25,13, 28,21, 28,27, 29,20, 29,67, 30,13, 33,59, 34,86, 39,58, 39,73, 46,87, 49,04, 55,13, 55,39, 56,90, 58,94, 62,24, 66,42, 68,12, 70,96, 72,25, 78,71, 80,39, 89,85, 113,92, 114,37, 127,70, 127,76, 127,86, 128,35, 128,45, 128,81, 128,91, 137,01, 130,44, 130,86, 156,39, 158,40, 158,82, 169,20, 169,75, 169,97, 170,58, 171,77, 173,85; ИК (CHCl3) 3275, 2952, 2868, 1735, 1704, 1636, 1511, 1454, 1380, 1365, 1250, 1167, 1110, 1047 см-1; МСВР m/z, вычислено для C67H111N5Si2O16Na(M+Na+): 1320,7462; найдено 1320,7520; [α]D 20 -44,56 (c 1,13; CHCl3). Элементный анализ, вычислено для C67H111N5Si2O16 (%): C 61,95; H 8,62; N 5,40. Найдено (%): С 61,75; Н 8,59; N 5,15.
Циклизация гексапептида 20 с получением соединения 21 изображена на фиг.26D.
Реакция N на фиг.26D: синтез соединения 21
Раствор, содержащий 0,3505 грамма (0,27 миллимоля) соединения 20 и 5 миллилитров CH2Cl2, охлаждают до 0°С и добавляют 0,21 грамма (0,81 миллимоля) эфирного комплекса бромида магния (MgBr2•Et2O). Полученную смесь перемешивают при 0°С в течение 2 часов и выдерживают при комнатной температуре еще в течение 4 часов. Реакционную смесь разбавляют 10 миллилитрами CH2Cl2 и промывают один раз 10 миллилитрами 10% раствора HCl и один раз 10 миллилитрами насыщенного раствора NaCl. Полученный CH2Cl2-слой сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученная в качестве продукта указанной реакции снятия защиты белая пена используется в последующей реакции гидрогенолиза без очистки. Все количество полученной белой пены (0,3195 грамма) растворяют в 10 миллилитрах МеОН и подвергают гидрогенолизу, как описано для получения соединения 18. Указанная реакция гидрогенолиза дает 0,296 грамма белой пены, которую используют для следующего связывания без очистки. Продукт гидрогенолиза растворяют в 27 миллилитрах свежеперегнанного ДМФ и охлаждают до 0°С. К охлажденному раствору добавляют 0,123 грамма (0,32 миллимоля) гексафторфосфата 2-(1Н-9-азобензотриазол-1-ил)-1,1,3,3-тетраметилурония (HATU) и затем прибавляют по каплям 0,141 миллилитра (0,81 миллимоля) ДИЭА. Полученную смесь перемешивают при 0°С в течение 1 часа и затем выдерживают при перемешивании при комнатной температуре еще по меньшей мере 8 часов. Затем эту реакционную смесь концентрируют при пониженном давлении, разбавляют 10 миллилитрами EtOAc и промывают один раз 10 миллилитрами 10% раствора HCl, один раз 10 миллилитрами 5% раствора NaHCO3 и один раз 10 миллилитрами насыщенного раствора NaCl. Полученный CH2Cl2-слой сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Неочищенный остаток, полученный в результате описанной процедуры, очищают флэш-хроматографий на колонке, элюируя смесью растворителей, которая содержит ацетон и гексан в соотношении от 5 : 95 соответственно до 15 : 85 соответственно. Концентрирование полученного элюата при пониженном давлении дает 0,173 грамма защищенного макроцикла, соединения 21, в виде белой пены. Выход соединения 21 составляет 63% для трех реакций, начиная с соединения 20 (то есть реакций снятия защиты, гидрогенолиза и связывания). Соединение 21 характеризуется следующими аналитическими показателями: Rf 0,55 (30:70 ацетон : гексан); 1Н ЯМР (500 МГц, CDCl3) δ 0,78-1,07 (м, 39H), 1,21-1,48 (м, 17H), 1,56-1,92 (м, 4H), 1,95-2,11 (м, 2H), 2,43-2,44 (м, 1H), 3,11-3,17 (м, 1Н), 2,53 (с, 3H), 2,89-3,02 (м, 1H), 3,30-3,34 (м, 1H), 3,49-3,52 (м, 1H), 3,60-3,62 (м, 1H), 3,66-3,70 (м, 1H), 3,77 (с, 3H), 4,14-4,19 (м, 1H), 4,37-4,43 (м, 1H), 4,46-4,48 (д, J=7,6 Гц, 1H), 4,55-4,86 (м, 1H), 4,88-4,91 (м), 7,60-7,66 (м, 4H), 6,82-6,83 (д, J=8,5 Гц, 2H), 7,06-7,07 (д, J=8,5 Гц, 2H), 7,41-7,48 (м, 2H); 13С ЯМР (250 МГц, CDCl3) δ 12,24, 12,66, 14,21, 15,11, 15,61, 17,98, 18,60, 18,74, 19,31, 21,10, 23,92, 25,24, 27,21, 28,42, 30,48, 34,87, 37,92, 39,00, 41,65, 47,10, 48,52, 55,67, 56,16, 57,25, 63,26, 66,33, 68,65, 71,78, 80,46, 81,66, 114,50, 130,31, 130,82, 156,40, 159,01, 169,13, 170,90, 171,34, 172,78, 176,75; ИК (CHCl3) 3330, 2952, 2876, 1735, 1629, 1508, 1447, 1243, 1168, 1024, 843 см-1; МСВР m/z, вычислено для C53H89N5SiO12Na(M+Na+): 1038,6175; найдено 1038,6166.
Завершающая реакция в полном синтезе (-)тамандарина А, 101, изображена на фиг.26Е. Соединение 4 получают по способу, ранее описанному Li et al., (1990), J. Am. Chem. Soc., 112:7659-7672.
Реакция О на фиг.26Е: синтез соединения 22
Раствор, содержащий 167 миллиграмм (0,165 миллимолей) защищенного макроцикла (соединение 21) и 20 мл EtOAc, охлаждают до -30°С. В раствор вводят газообразный HCl и температуру реакционной смеси поддерживают в диапазоне от -10 до -20°С в ходе всего процесса введения HCl. Далее реакционную смесь перемешивают и выдерживают при температуре в диапазоне от -10 до -20°С еще в течение 30 минут. После этого реакционную смесь нагревают до 0°С и выдерживают при 0°С в течение 1 часа. После этого через реакционный сосуд пропускают газообразный N2 в течение по меньшей мере 30 минут, поддерживая температуру сосуда 0°С. Продутый газом раствор нагревают до комнатной температуры и концентрируют при пониженном давлении. Остаток, полученный после концентрирования реакционной смеси, растирают и промывают декантацией аликвотами по 5 миллилитров смеси растворителей, содержащей трет-бутилметиловый эфир и гексан в соотношении 1 : 4 соответственно. Полученное в ходе указанной процедуры твердое вещество отфильтровывают и сушат при пониженном давлении с получением 127,5 миллиграммов (количественный выход) гидрохлоридной соли соединения 22. Соединение 22, получаемое в виде белого твердого вещества, используют в конечной реакции связывания без очистки.
Реакция Р на фиг.26Е: синтез (-)тамандарина А (соединение 101)
Раствор, включающий 63,3 миллиграмма (0,082 миллимоля) соединения 22, 37,7 миллиграмма (0,12 миллимоля) соединения 4 и 0,50 миллилитров CH2Cl2 охлаждают до 0°С на ледяной бане. К этому охлажденному раствору добавляют 53,1 миллиграмма (0,12 миллимоля) гексафторфосфата бензотриазол-1-ил-окси-трис-(диметиламино)фосфония (БОФ) и 0,035 миллилитра (0,32 миллимоля) NMM. Реакционную смесь перемешивают в течение 30 минут при 0°С и затем нагревают до комнатной температуры. Далее реакционную смесь выдерживают при перемешивании при комнатной температуре еще в течение по меньшей мере 8 часов. Полученный раствор разбавляют 2 миллилитрами насыщенного водного раствора NaCl и экстрагируют 10 миллилитрами EtOAc. Экстрагированный органический слой промывают один раз 10 миллилитрами 10% раствора HCl, один раз 10 миллилитрами 5% раствора NaHCO3 и один раз 10 миллилитрами насыщенного раствора NaCl. Промытый органический слой сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученный неочищенный остаток очищают флэш-хроматографий на колонке, элюируя смесью растворителей, которая включает MeOH и CH2Cl2 в соотношении от 2 : 98 соответственно до 5 : 95 соответственно. Указанная процедура дает 0,0471 грамма тамандарина А (соединение 101) в виде желтовато-зеленого твердого вещества. Выход соединения 101 составляет 56% для обеих реакций О и Р и 12% для реакций A-F, I, J и L-P (то есть начиная с D-алло-изолейцина). Тамандарин А (101) характеризуется следующими аналитическими показателями: Rf 0,57 (10:90 MeOH : CH2Cl2); 1H ЯМР (500 МГц, CDCl3) δ 0,86-1,08 (м, 24H), 1,19-2,30 (дд, J1=17,1 Гц, J2=7,9 Гц, 1H), 3,29-3,33 (д, J=17,0 Гц, 1H), 2,62 (с, 3H), 3,14 (с, 3H), 3,16-3,21 (дд, J1=14,4 Гц, J2=11,1 Гц, 1H), 3,41-3,45 (м, 1H), 3,59-3,80 (м, 5Н), 3,82 (с, 3H), 3,90-3,95 (м, 1H), 4,03-4,08 (м, 1H), 4,29-4,30 (м, 1H), 4,37-4,42 (м, 1H), 4,67-4,69 (м, 1H), 4,74-4,77 (м, 1H), 4,89-4,93 (м, 1H), 5,06 (д, J=4,3 Гц, 1H), 5,31-5,35 (к, J1=1,6 Гц, J2=3,3 Гц, 1H), 5,44-5,46 (м, 1H), 6,86-6,88 (д, J=8,3 Гц, 2H), 7,09-7,11 (д, J=8,3 Гц, 2H), 7,37-7,39 (д, J=9,1 Гц, 1H), 7,48-7,50 (д, J=5,1 Гц, 1H), 7,78-7,80 (д, J=9,7 Гц, 1H); 13C ЯМР (250 МГц, CDCl3) δ 11,78, 14,07, 16,52, 17,55, 18,93, 20,28, 20,90, 21,32, 23,47, 23,79, 24,83, 24,90, 25,98, 27,33, 27,96, 28,40, 30,11, 31,26, 33,55, 33,93, 35,73, 38,70, 39,41, 39,65, 46,66, 47,02, 48,28, 54,91, 55,27, 56,71, 56,97, 57,90, 66,07, 66,22, 68,98, 70,70, 78,87, 114,08, 130,07, 130,33, 156,62, 168,52, 169,57, 170,11, 170,35, 170,59, 171,09, 172,67, 173,84, 174,53; ИК (CHCl3) 3330, 2952, 2876, 1735, 1629, 1508, 1447, 1243, 1168, 1024, 843 см-1; МСВР m/z, вычислено для C54H85N7O14Na(M+Na+): 1078,6052; найдено 1078,6044; [α]D 20 -43,93 (c 1,05; CHCl3).
Авторы изобретения считают, что раскрытая выше серия реакций отражает первый стереоселективный синтез (-)тамандарина А.
Пример 2
Биологическая активность тамандарина А
Описанные в настоящем примере эксперименты показывают, что тамандарин А является эффективным ингибитором синтеза белка и противоопухолевым агентом. Первоначальные результаты, показанные в таблице 1, относятся к ингибированию биосинтеза белка (колонка 1), цитотоксичности (колонка 2) и противоопухолевой активности (колонка 3) тамандарина А в сравнении с собственно противоопухолевым соединением - дидемнином В. Результаты в таблице 1 даны в единицах концентрации выбранного соединения.
(NCI-60. Среднее значение)
активность (среднее значение в тесте)
В контексте настоящего описания термин "ИР50" обозначает дозу соединения, которая способна давать 50% ингибирование роста клеток. ИР50 оценивают путем сравнения роста клеток, к которым добавили соединение, с ростом таких же клеток, к которым данное соединение не добавляли.
В контексте настоящего описания термин "LC50" обозначает дозу соединения, которая способна приводить к 50% гибели клеток. LC50 оценивают путем сравнения гибели клеток в популяции клеток, к которой добавляли соединение, с гибелью клеток в популяции таких же клеток, к которой данного соединения не добавляли.
Термин "NCI-60" обозначает панель из 60 линий опухолевых клеток от Национального института рака (NCI, Frederick, MD). Термин "NCI-60. Среднее значение" обозначает среднее значение ИР50 или LC50 для панели, обработанной выбранным соединением.
Приведенные результаты экспериментов in vitro показывают, что тамандарин А демонстрирует активность, сравнимую с дидемнином В, известным противоопухолевым средством. Но тамандарин А значительно менее токсичен в указанных тестах, чем дидемнин В. Приведенное сравнение указывает на полезность тамандарина А и других аналогов дидемнина в качестве фармакологических средств, имеющих противоопухолевую и другие виды активностей, характерных для дидемнина В.
Пример 3
Синтез (-)дегидротамандарина
В данном примере описан способ синтеза (-)дегидротамандарина. Указанный способ включает участие макроциклического соединения 22, которое получают по методу, описанному в примере 1. Метод, описанный в настоящем примере, проиллюстрирован на фиг.37, и он начинается с синтеза соединения 27, изображенного на фиг.37А.
Реакция Q на фиг.37А: синтез соединения 26
К раствору, содержащему 0,1084 грамма (0,33 миллимоля) соединения 25 и 1 миллилитр свежеперегнанного CH2Cl2, добавляют 0,182 г (0,43 миллимоля) периодинана Десс-Мартина. Полученную смесь перемешивают при комнатной температуре в течение 4 часов. Затем реакционную смесь разбавляют 10 миллилитрами эфира и выливают в 6 миллилитров насыщенного раствора NaHCO3, содержащего 5% Na2S2O3. К получившейся двухфазной смеси добавляют еще 10 миллилитровую аликвоту эфира и слои разделяют. Органический слой промывают один раз 10 миллилитрами насыщенного раствора NaHCO3 и один раз 10 миллилитрами воды. Промытый органический слой сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученный в результате данной процедуры остаток очищают флэш-хроматографией на колонке, элюируя смесью растворителей, включающей MeOH и CH2Cl2 в соотношении 5 : 95 соответственно с получением 0,083 грамма очищенного соединения 26 (выход 77%) в виде белой пены. Соединение 26 характеризуется следующими аналитическими показателями: Rf 0,61 (10:90 MeOH:CH2Cl2); 1Н ЯМР (500 МГц, CDCl3) δ 0,86-1,05 (м, 6Н), 1,41-1,54 (м, 1H), 1,70-1,74 (м, 2H), 1,87-1,89 (м, 3Н) и 2,05-2,19 (м, 1H), 2,33 (с, 3Н), 2,97 (с, 2H), 3,59-3,63 (м, 2H), 3,70 (с, 3Н), 4,95-4,98 (т, J=7,97 Гц, 1H), 5,11-5,13 (м, 1H); МСВР m/z, вычислено для C16H26N2O5(M+H+): 327,1920; найдено 327,1912; [α]D 20 +1,14 (c 0,49; CHCl3).
Реакция R на фиг.37А: синтез соединения 27
Раствор, содержащий 0,0678 грамма (0,21 миллимоля) соединения 26, 4 миллилитра перегнанного ТГФ и 4 миллилитра МеОН, охлаждают до 0°С. К этому раствору добавляют 8 миллилитров раствора, содержащего 0,2 молярный LiOH. Реакционную смесь вначале выдерживают при перемешивании при 0°С в течение 1 часа, после чего нагревают реакционную смесь до комнатной температуры и выдерживают при перемешивании по меньшей мере еще в течение 8 часов. Полученную реакционную смесь концентрируют при пониженном давлении, охлаждают до 0°С и подкисляют до рН 3 добавлением 1 нормального раствора KHSO4. Подкисленную смесь экстрагируют 3 раза EtOAc аликвотами по 5 миллилитров. Объединенные EtOAc-слои сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением 0,042 грамма (выход 64%) соединения 27 в виде белого твердого вещества. Соединение 27 характеризуется следующими аналитическими показателями: 1H ЯМР (500 МГц, CDCl3) δ 0,86-1,03 (м, 6H), 1,35-1,50 (м, 1H), 1,70-1,77 (м, 2H), 1,85-1,93 (м, 2H) и 2,07-2,18 (м, 2H), 2,33 (с, 3H), 3,02 (с, 3H), 3,58-3,86 (м, 2H), 4,78-4,81 (м, 1H), 5,08-5,12 (м, 1H); 13C ЯМР (250 МГц, CDCl3) δ 21,26 и 22,55, 23,21, 24,64, 26,36 и 28,17, 31,16, 37,09, 45,70, 56,79, 58,66, 163,32, 173,12, 174,59, 199,07.
Реакция S на фиг.37В: синтез (-) дегидротамандарина (соединение 133)
Раствор, содержащий 19,7 миллиграмма (0,063 миллимоля) соединения 27, 33,4 миллиграмма (0,042 миллимоля) соединения 22 и 0,50 миллилитра CH2Cl2, охлаждают до 0°С на ледяной бане. К указанному охлажденному раствору добавляют 28 миллиграмм (0,063 миллимоля) БОФ и 0,0185 миллилитра (0,17 миллимоля) NMM. Реакционную смесь перемешивают в течение 30 минут при 0°С и оставляют нагреваться до комнатной температуры. Затем реакционную смесь выдерживают при перемешивании при комнатной температуре еще в течение по меньшей мере 8 часов. Полученный раствор разбавляют 2 миллилитрами насыщенного раствора NaCl и экстрагируют 10 миллилитрами EtOAc. Экстрагированный органический слой промывают один раз 5 миллилитрами 10% раствора HCl, один раз 5 миллилитрами 5% раствора NaHCO3 и один раз 5 миллилитрами насыщенного раствора NaCl. Промытый органический слой сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученный неочищенный остаток очищают флэш-хроматографией на колонке, элюируя комбинацией смесей растворителей, которые включают MeOH и CH2Cl2 в соотношении от 2 : 98 соответственно до 10 : 90 соответственно, с получением 18,1 миллиграмма дегидротамандарина (соединение 133) в виде желтовато-белого твердого вещества. Выход соединения 133 составляет 41% для реакций О (то есть снятие защиты соединения 21 с получением соединения 22 в примере 1) и реакции S. Дегидротамандарин А (133) характеризуется следующими аналитическими показателями: Rf 0,48 (10:90 MeOH : CH2Cl2); 1Н ЯМР (500 МГц, CDCl3) δ 0,80-1,00 (м, 24H), 1,16-1,45 (м 11H), 1,51-2,25 (м, 10Н), 2,38-2,48 и 3,19-3,30 (м, 2H), 2,52-2,53 (д, J=6,2 Гц, 3H), 2,57 (с, 3Н), 3,04 и 3,08 (с, 3Н, ротомеры), 3,12-3,16 (м, 1H) и 3,31-3,35 (м, 1H), 3,53-3,72 (м, 5H), 3,77 (с, 3H), 3,81-4,03 (м, 1H), 4,05-4,10 (м, 1H), 4,25-4,26 (м, 1H), 4,61-4,65 (м, 1H), 4,68-4,71 (м, 1Н), 4,85-4,88 (м, 1H), 5,00-5,01 (д, J=4,6 Гц, 1H), 5,15-5,20 (м, 1H), 5,28-5,31 (м, 1H), 6,81-6,83 (д, J=7,5 Гц, 2H), 7,05-7,07 (д, J=8,2 Гц, 2H), 7,28-7,30 (д, J=9,8 Гц, 1H) и 7,33-7,35 (д, J=10,2 Гц, 1H), 7,39-7,40 (д, J=5,5 Гц, 1H), 7,72-7,74 (д, J=9,7 Гц, 1H) и 7,78-7,80 (д, J=9,7 Гц, 1H); 13C ЯМР (500 МГц, CDCl3) δ 11,80, 14,11, 16,52, 17,63, 18,91, 20,87, 21,33, 22,32, 23,53, 24,89 (перекрывание), 24,83, 27,08, 27,35, 27,99, 29,62, 30,13, 31,00, 33,56, 34,04, 35,10, 35,84, 38,90, 39,65, 46,72, 48,29, 48,81, 54,78, 55,27 (перекрывание), 56,91, 57,46, 58,91, 66,10, 68,92, 70,90, 78,94, 114,12, 130,00, 130,36, 158,68, 161,50, 168,43, 169,59, 170,61, 171,00, 172,26, 173,00, 174,52, 197,36; ИК (KBr) 3339, 2960, 2927, 2872, 1736, 1715, 1655, 1633, 1508, 1460, 1438, 1248, 1177, 1085, 1031, 830 см-1; МСВР m/z, вычислено для C54H83N7O14Na(M+Na+): 1076,5896; найдено 1076,5946; [α]D 20 -35,29 (c 0,35; CHCl3).
Пример 4
Синтез флуоресцентных аналогов тамандарина
В данном примере описан способ синтеза флуоресцентного тамандарина, соединения 108. Как и в примере 3, показанный в данном примере способ включает макроциклическое соединение 22, которое может быть получено по методу примера 1. Описанный в настоящем примере метод проиллюстрирован на фиг.38 и он начинается с синтеза соединения 206а, изображенного на фиг.38А.
Реакция Т на фиг.38А: синтез соединения 205а
Раствор, содержащий 10,00 грамм (49,5 миллимолей) диэтил-1,3-ацетондикарбоксилата, 7,12 грамма (51,9 миллимоля) м-диметиламинофенола, 8,56 грамма (62,8 миллимоля) хлорида цинка и 25 миллилитров абсолютного этанола, кипятят с обратным холодильником в течение 13 часов. Реакционную смесь разбавляют 50 миллилитрами EtOAc и промывают 25 миллилитрами Н2О. Полученный в ходе указанной процедуры водный слой экстрагируют три раза EtOAc аликвотами по 50 миллилитров. Объединенные EtOAc-слои сушат над безводным сульфатом магния (MgSO4), фильтруют и концентрируют при пониженном давлении. Полученное твердое неочищенное вещество повторно кристаллизуют из абсолютного этанола с получением 2,64 грамма (выход 20%) соединения 205а в виде оранжевых кристаллов. Соединение 205а характеризуется следующими аналитическими показателями: Тпл 131-132°С; Rf 0,20 (ацетон/гексан, 30:70); 1H ЯМР (500 МГц, CDCl3) δ 1,22 (3Н, т, J=7,1 Гц), 3,01 (6Н, с), 3,64 (2H, с), 4,15 (2Н, к, J=7,2 Гц), 6,02 (1H, с), 6,48 (1H, д, J=2,6 Гц), 6,58 (1H, дд, J1=2,6 Гц, J2=8,9 Гц), 7,37 (1H, д, J=8,9); 13C ЯМР (125 МГц, CDCl3) δ 14,02, 38,16, 40,01, 61,49, 98,28, 108,45, 108,93, 110,63, 125,22, 148,39, 152,91, 155,89, 161,65, 169,01; ИК (KBr) 2907 (в), 1720 (с), 1600 (2), 1534 (м), 1484 (м), 1427 (м), 1405 (с), 1371 (м), 1330 (м), 1232 (м) см-1; МСВР m/z, вычислено для C15H18NO4(M+H): 276,1236; найдено 276,1244. Элементный анализ, вычислено для C15H17NO4 (%): C 65,43; H 6,23; N 5,09. Найдено (%): С 65,26; Н 6,36; N 5,03.
Реакция U на фиг.38А: синтез соединения 205b
Раствор, содержащий 0,46 грамма (11,0 миллимолей) гидрата гидроксида лития (LiOH•H2O) и 25 миллилитров Н2О, добавляют к раствору, содержащему 1,50 грамма (5,5 миллимоля) соединения 205а и 10 миллилитров ТГФ. Реакционную смесь выдерживают при перемешивании при комнатной температуре в течение 2,5 часа. Полученный в результате этого раствор промывают 10 миллилитрами эфира и подкисляют до рН 2. Образовавшийся после подкисления осадок отфильтровывают. Осадок содержит 0,364 грамма соединения 205b в виде желтых кристаллов. Соединение 205b характеризуется следующими аналитическими показателями: Тпл 166-167°С; 1Н ЯМР (500 МГц, CDCl3/ДМСО) δ 3,01 (6Н, с), 3,62 (2H, с), 6,00 (1H, с), 6,44 (1H, д, J=2,3 Гц), 6,58 (1H, дд, J1=2,4 Гц, J2=8,9 Гц), 7,40 (1H, д, J=9,0 Гц); 13C ЯМР (125 МГц, CDCl3/ДМСО) δ 38,42, 40,25, 98,34, 108,89, 109,35, 110,67, 125,84, 149,59, 153,22, 156,15, 162,00, 171,33; ИК (KBr) 2923 (м), 1690 (с), 1619 (с), 1534 (м), 1404 (м), 1248 (м), 1145 (м), 1055 (м) см-1; МСВР m/z, вычислено для C13H14NO4(M+H): 248,0922; найдено 248,0929.
Реакция V на фиг.38А: синтез соединения 206а
Раствор, содержащий 0,364 грамма (1,47 миллимоля) соединения 205b и 5 миллилитров свежеперегнанного CH2Cl2, помещают в атмосферу аргона и охлаждают до 0°С. К этому раствору добавляют 0,282 грамма (1,47 миллимолей) EDAC•HCl (1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида) и 0,035 грамма (0,29 миллимоля) DMAP (4-диметиламинопиридина). Образовавшуюся реакционную смесь перемешивают в течение 10 минут и добавляют 0,246 грамма (1,47 миллимоля) трет-бутилового эфира глицина. Полученную реакционную смесь выдерживают при перемешивании при 0°С в течение 2 часов, затем нагревают до комнатной температуры и дополнительно выдерживают при комнатной температуре еще по меньшей мере 8 часов. Затем реакционную смесь разбавляют CH2Cl2 и промывают один раз 10 миллилитрами 10% раствора HCl и один раз 10 миллилитрами насыщенного раствора NaCl. Объединенные промытые CH2Cl2-слои сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают флэш-хроматографий на колонке, элюируя смесью растворителей, которая включает равное количество EtOAc и CH2Cl2 с получением 0,250 грамма (выход 42%) соединения 206а в виде желтого твердого вещества. Соединение 206а характеризуется следующими аналитическими показателями: 1H ЯМР (500 МГц, CDCl3) δ 1,42 (с, 9H), 3,03 (с, 6H), 3,64 (с, 2H), 3,88 (д, J=5,12 Гц, 2H), 6,05 (с, 1H), 6,48 (шс, 1H), 6,58 (д, J=2,5 Гц, 1H), 6,60 (дд, J1=2,6 Гц, J2=8,9 Гц, 1H), 7,45 (д, J=8,9 Гц, 1H); 13C ЯМР (125 МГц, CDCl3) δ 168,5, 167,8, 161,6, 156,0, 153,1, 149,2, 125,6, 110,5, 109,2, 108,3, 98,3, 82,5, 42,4, 40,3, 40,1, 27,9; ИК (CHCl3) 3450, 1679, 1618, 1530, 1405, 1370, 1230, 1157 см-1; МСВР (CI) m/z, вычислено для C19H24N2O5Na(M+): 360,1685; найдено 360,1686. Элементный анализ, вычислено для C19H24N2O5 (%): C 63,30; H 6,72; N 7,78. Найдено (%): С 62,99; Н 6,60; N 7,52.
Реакция W на фиг.38В: синтез соединения 207а
Раствор, содержащий 0,250 грамма (0,69 миллимоля) Gly-DACA-трет-бутилового сложного эфира, соединение 206а, и CH2Cl2, охлаждают до 0°С и выдерживают 10 минут. К охлажденному раствору добавляют по каплям раствор, содержащий 10% трифторуксусной кислоты (ТФУ). Указанное добавление завершают в течение 10 минут. Полученную в результате этого смесь выдерживают при перемешивании при комнатной температуре по меньшей мере в течение 8 часов. Затем реакционную смесь выпаривают досуха с помощью роторного испарителя и полученный остаток, содержащий 0,033 грамма (0,108 миллимоля) соединения 206b, используют в последующей реакции без дополнительной очистки.
Раствор, содержащий 0,033 грамма (0,108 миллимоля) соединения 206b и CH2Cl2, охлаждают до 0°С. К охлажденному раствору добавляют 0,027 грамма (0,108 миллимолей) БОФ и 0,012 грамма (0,108 миллимоля) NMM. Полученную реакционную смесь перемешивают в течение 30 минут. К перемешиваемой смеси добавляют сложный метиловый эфир N-метил-D-лейцина, после чего реакционную смесь выдерживают при перемешивании при 0°С в течение по меньшей мере 8 часов. Затем реакционную смесь разбавляют CH2Cl2 и промывают один раз 10 миллилитрами 10% раствора HCl и один раз 10 миллилитрами насыщенного раствора NaCl. Объединенные промытые CH2Cl2-слои сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают флэш-хроматографий на колонке, элюируя смесью растворителей, которая включает равное количество EtOAc и CH2Cl2. Выпаривание элюата дает 0,030 грамма (выход 63%) соединения 207а в виде желтого твердого вещества. Соединение 207а характеризуется следующими аналитическими показателями: [α]D 20 +19,08 (c 0,865; CHCl3); 1Н ЯМР (500 МГц, CDCl3) δ 0,87 (J=6,52 Гц, 3H), 0,91 (д, J=6,79 Гц, 3H), 1,40 (м, 1H), 1,69 (м, 2H), 2,85 (с, 3H), 3,01 (с, 6H), 3,63 (с, 2H), 3,67 (с, 3H), 4,06 (м, 2H), 5,22 (дд, J1=10,6 Гц, J2=5,2 Гц, 1H), 6,04 (с, 1H), 6,47 (д, J=2,5 Гц, 1H), 6,57 (дд, J1=2,5 Гц, J2=8,9 Гц, 1H), 6,76 (шс, 1H), 7,42 (д, J=8,9 Гц, 1H); 13C ЯМР (125 МГц, CDCl3) δ 171,7, 168,6, 167,8, 161,6, 155,9, 152,9, 149,1, 125,4, 110,5, 109,1, 108,4, 98,3, 54,7, 52,3, 41,8, 40,1, 39,9, 37,1, 30,0, 24,8, 23,1, 21,3 см-1, МСВР m/z, вычислено для C23H31N3O6(M+Na+): 468,2111; найдено 468,2133.
Реакция X на фиг.38В: синтез соединения 207b
Раствор, содержащий 0,135 грамма (0,304 миллимоля) соединения 207а и ТГФ, охлаждают до 0°С и добавляют раствор, содержащий 0,025 грамма (0,606 миллимоля) LiOH•Н2О в 2 миллилитрах воды. Добавление завершают в течение 5 минут. Полученную смесь выдерживают при перемешивании при 0°С в течение 30 минут и затем нагревают ее до комнатной температуры. Далее реакционную смесь выдерживают при комнатной температуре в течение 1,5 часа и затем дважды промывают с использованием этилового эфира аликвотами по 4 миллилитра. Промытый водный слой выпаривают досуха при пониженном давлении. Полученный остаток, содержащий соединение 207b, растворяют в растворе, содержащем 2 миллилитра воды и 4 миллилитра EtOAc, охлаждают до 0°С и подкисляют до рН 2 добавлением раствора, содержащего 1 нормальный KHSO4. Отделенный водный слой, образовавшийся в результате указанной процедуры, промывают дважды EtOAc аликвотами по 4 миллилитра. Объединенные органические слои сушат над безводным MgSO4, фильтруют и концентрируют досуха при пониженном давлении. Остаток, полученный в ходе описанной процедуры, содержит 0,010 грамм (0,023 миллимоля) соединения 207b и используется в последующей реакции без очистки.
Реакция Y на фиг.38С: синтез соединения 107
Раствор, содержащий 0,010 грамм (0,023 миллимоля) соединения 207b и CH2Cl2, охлаждают до 0°С. К этому охлажденному раствору добавляют 0,010 грамм (0,023 миллимоля) БОФ и 0,010 миллилитров (0,092 миллимоля) NMM. Полученную реакционную смесь выдерживают при перемешивании при 0°С в течение 10 минут и затем добавляют гидрохлоридную соль соединения 22 (0,018 грамма, 0,023 миллимоля). Реакционную смесь выдерживают при 0°С в течение 1 часа и при комнатной температуре в течение еще по меньшей мере 8 часов. Полученный раствор разбавляют 1 миллилитром насыщенного раствора соли и дважды экстрагируют EtOAc аликвотами по 2 миллилитра. Образованный в процессе экстрагирования органический слой промывают один раз 1 миллилитром 10% раствора HCl и два раза водой аликвотами по 1 миллилитру. Промытый органический слой сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают флэш-хроматографий на колонке, элюируя смесью растворителей, которая включает ацетон и гексан в соотношении 30 : 70 соответственно. Выпаривание элюата дает 0,008 грамма (выход 30%) флуоресцентного соединения 107. Соединение 107 характеризуется следующими аналитическими показателями: [α]D 20 -160,1 (c 0,3; CHCl3); 1Н ЯМР (500 МГц, CDCl3) δ 0,73-0,93 (м, 24Н), 1,07-1,74 (м, 15H), 2,04 (м, 2H), 2,14 (с, 3H), 2,15 (м, 2H), 2,31 (м, 2H), 2,53 (с, 4H), 2,84 (с, 2H), 3,03 (с, 6H), 3,17 (шд, J=10,4 Гц, 2H), 3,35 (м, 1Н), 3,57 (м, 2H), 3,68 (с, 2H), 3,78 (с, 3H), 3,99 (шд, 2H), 4,08-4,12 (м, 3H), 4,55-4,56 (м, 1H), 4,78-4,80 (м, 1H), 4,82-5,01 (м, 2H), 5,13-5,14 (шд, 1H), 6,08 (с, 1H), 6,51 (с, 1H), 6,61 (д, J=9,1 Гц, 1H), 6,83 (д, J=8,54 Гц, 2H), 7,07 (д, J=8,35 Гц, 2H), 7,24-7,41 (м, 3H), 7,51 (д, J=8,90 Гц, 1H), 7,81 (д, J=8,65 Гц, 1H); ИК (KBr) 3462, 2953, 2358, 1732, 1658, 1632, 1555, 1538, 1456 см-1; МСВР m/z, вычислено для C64H92N8O16(M+Na+): 1251,6529; найдено 1251,6528.
Пример 5
Синтез группы боковой цепи дезоксопролина и связывание с макроциклом дидемнина
Используют амино-метиленовую одинарную связь для замещения амидной связи между D-лейцином и L-пролином в боковой цепи дидемнина В. Амино-метиленовую связь получают в ходе синтеза восстановительным аминированием, как описано в литературе (Abdel-Magid et al., 1990. Tetrahedron Lett., 31:5595-5598; Abdel-Magid et al., 1990, Synlett., 537-539).
В рамках первого метода синтеза исчерпывающе полное метилирование Cbz-D-лейцина проводят с использованием диметилсульфата, как показано на фиг.41. Cbz-группу удаляют гидрогенолизом с получением свободного амина диметилированного D-лейцина (соединение 40). Полученный амин используют в восстановительном аминировании без очистки. Коммерчески доступный L-пролин вначале этерифицируют с использованием SOCl2 в MeOH и его аминогруппу впоследствии защищают с использованием Boc2O. После очистки сложноэфирную группу восстанавливают в две стадии до альдегида. NaBH4 объединяют с LiCl с образованием in situ LiBH4 и указанное соединение затем используют для восстановления сложного эфира до соответствующего спирта. Окисление SO3-пиридиновым реагентом дает альдегид, обозначаемый как соединение 42, с хорошим выходом. Может быть проведено восстановление сложного эфира до альдегида в одну стадию с использованием DIBAL, но данная реакция зависит от свежести восстановителя и не всегда является достаточно воспроизводимой. Восстановительное аминирование, имеющее место между альдегидом, обозначенным как соединение 40, и свободным амином (соединение 42), дает соединение 43. БОК-группу соединения 43 удаляют с использованием ТФУ/CH2Cl2. Полученный свободный амин связывают с пировиноградной кислотой с помощью БОФ с использованием замещенной ψ(CH2NH) боковой цепи соединения, обозначенного как соединение 44.
Следующая стадия представляет собой гидролиз сложного метилового эфира соединения 44. Однако указанная стадия, как было показано, является нетривиальной. Возможно в связи с наличием стерических пространственных препятствий, сложный метиловый эфир трудно поддается расщеплению при использовании 2 эквивалентов LiOH•2H2O в ТГФ/Н2О. В том случае, когда количество LiOH•2H2O повышается до 10 эквивалентов, сложный метиловый эфир, по всей видимости, гидролизуется, поскольку масс-спектр реакционной смеси не показывает наличия кислотного пика. Но кислота является настолько гидрофильной и содержит внутри такой избыток неорганических солей, что она не может быть экстрагирована каким-либо органическим растворителем. Авторы также попытались осадить кислоту с использованием эфира, но осаждались только неорганические соли. В связи с указанной проблемой очистки авторы решили не использовать метиловый сложный эфир для защиты кислоты. Авторам требовалась защитная группа, которая могла бы сохраниться на всех стадиях синтеза, но не требовала водных условий для ее удаления. Как было показано, бензильная группа достаточно хорошо удовлетворяет указанной цели.
Процедура синтеза была модифицирована в соответствии с тем, что показано на фиг.42. С целью совместимости с бензиловым эфиром аминогруппу лейцина защищают с использованием Boc вместо Cbz. Селективное метилирование аминогруппы дает кислоту, обозначаемую как соединение 46. Свободную кислоту бензилируют с получением сложного бензилового эфира, соединения 47. Вос-защитную группу удаляют с использованием ТФУ. Полученный амин (соединение 48) конденсируют с защищенным пролиналем восстановительным аминированием. Удаление Вос-защитной группы и последующее связывание с пировиноградной кислотой дают соединение 50. Гидрогенолиз используют для удаления бензильной группы и для получения желательной ψ(CH2NH) боковой цепи в виде соединения, представляющего собой свободную кислоту (соединение 51). Связывание боковой цепи свободной кислоты с макроциклом дидемнина дает желательный дезоксопролиновый аналог дидемнина, обозначенный как соединение 12.
Второй дезоксопролиновый аналог дидемнина (обозначенный как соединение 72а) синтезируют с использованием сходной стратегии синтеза, как показано на фиг.43 и более подробно описано ниже.
Бензил-N-Boc-D-лейцинат (соединение 46)
Раствор N-Boc-D-лейцина (1,0 грамм; 4,1 миллимоля) в 20 миллилитрах ДМФ охлаждают до 0°С. Добавляют тонко измельченный Li2CO3 (1,5 грамма; 20,5 миллимоля) и затем бензилбромид (2,43 миллилитра; 20,5 миллимоля). Реакционную смесь перемешивают в течение 6 часов и ход реакции отслеживают с помощью ТСХ. Когда реакция заканчивается, реакционную смесь разбавляют Н2О и три раза экстрагируют EtOAc. EtOAc-экстракты объединяют и промывают насыщенным раствором соли. ДМФ удаляют в вакууме. Неочищенную смесь очищают хроматографией на колонке с использованием в качестве элюирующего раствора смеси 20% ацетон/гексан с получением соединения 46 при выходе 78%. Соединение 46 характеризуется следующими аналитическими показателями: Rf 0,60 (40% ацетон/гексан); [α]D 25 +16 (с=1,0; CHCl3); 1H ЯМР (500 МГц, CDCl3) δ Ha) 0,92 (м, 6H), Hb) 1,48 (с, 9H), Нс) 1,50-1,59 (м, 1H), Hd) 1,60-1,69 (дд, 2H), He) 4,36 (м, 1H), Hf) 4,90 (д, 1H), Hg) 5,11-5,20 (м, 2H), Hh) 7,33 (м, 5Н); 13C ЯМР (125 МГц, CDCl3) δ Ca) 21,8, Ca') 22,7, Cc) 24,7, Cb) 28,2, Cd) 41,6, Се) 52,1, Cg) 66,7, Ci) 79,6, Ch) 128,0, 128,2, 128,4, Cl) 135,5, Cj) 155,3, Ck) 173,2; ИК (чистый) 3367 (ш), 2958 (с), 1732 (с), 1715 (с), 1500 (с), 1455 (м), 1366 (в), 1120 (м) см-1; МСВР m/z, вычислено для C11H23N4O2(M+H): 322,2017; найдено 322,2018.
N-Boc-N-метилбензил-D-лейцинат (соединение 47)
Раствор соединения 46 (1,2 грамма; 3,74 миллимоля) в 200 миллилитрах ТГФ охлаждают до 0°С. Добавляют NaHMDS (1 молярный в ТГФ; 5,6 миллилитра; 5,6 миллимоля) и затем метилйодид (1,0 миллилитр; 18,7 миллимоля). Реакционную смесь перемешивают в течение ночи и ход реакции отслеживают с помощью ТСХ. Когда реакция заканчивается, реакционную смесь разбавляют диэтиловым эфиром. Органический слой промывают 5% HCl, 5% NaHCO3 и насыщенным раствором соли. Полученный раствор сушат над Na2SO4 и концентрируют. Неочищенную смесь очищают хроматографией на колонке с использованием в качестве элюирующего раствора смеси 20% ацетон/гексан с получением соединения 47 при выходе 71%. Соединение 47 характеризуется следующими аналитическими показателями: Rf 0,55 (30% ацетон/гексан); [α]D 25 +20,4 (с=1,2; CHCl3); 1Н ЯМР (500 МГц, CDCl3) δ На) 0,85-0,90 (м, 6H), Нc) и Нd) 1,35-1,65 (м, 3Н), Нb) 1,45 (с, 9H), Не) 2,75 (д, 3Н), Hf) 4,53-4,58 и 4,81-4,88 (св.м, 1Н), Hg) 5,10 (с, 2Н), Hh) 7,15-7,28 (м, 5Н); 13С ЯМР (125 МГц, CDCl3) δ Са) 22,0 и 23,5, Сс) 25,8, Cb) 29,0, Cd) 31,0, Се) 38,0, Cf) 57,0, Cg) 66,1, Ci) 80,2, Ch) 128,0, 128,2, 128,4, Cl) 136,5, Cj) 156,3, Ck) 173,2; ИК (чистый) 2958,3 (м), 1742,7 (с), 1696,8 (с), 1455,6 (с), 1390,7 (с), 1366,6 (с), 1323,5 (с), 1151,3 (с) см-1; МСВР m/z, вычислено для C11H23N4O2(M+H): 336,2174; найдено 336,2178.
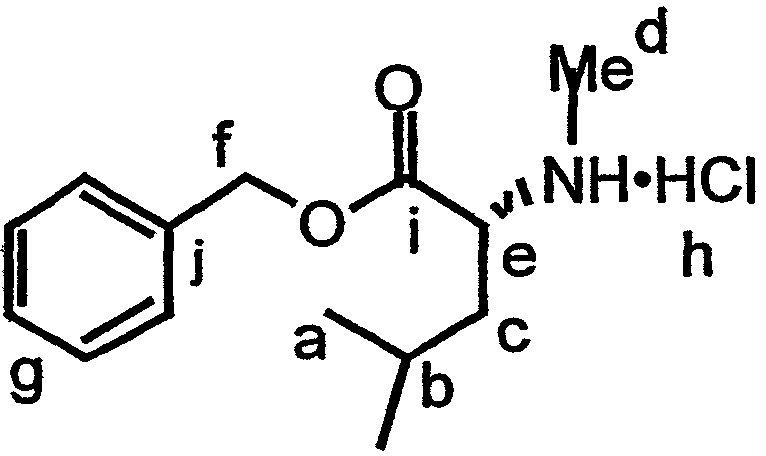
Бензил-N-метил-D-лейцината гидрохлоридная соль (соединение 48)
Соединение 47 (0,1 грамма) растворяют в смеси HCl-диоксан (5 миллилитров) и перемешивают при комнатной температуре. По завершении реакции растворитель удаляют в вакууме. Дважды добавляют толуол и концентрируют. Остаток сушат при пониженном давлении в течение ночи с получением желательной HCl-соли (соединение 48) с выходом 98%. Соединение 48 характеризуется следующими аналитическими показателями: Rf на линии старта (10% МеОН/CH2Cl2); [α]D 25 +48,5 (с=0,2; CHCl3); 1Н ЯМР (500 МГц, CDCl3) δ На) 0,91 (д, 6H), Hb) 1,75 (м, 1Н) Hс) 1,90-1,95 (дд, 2H), Hd) 2,71 (с, 3Н), Не) 3,83 (т, 1H), Hf) 5,20-5,30 (св.м, 2H), Hg) 7,35-7,40 (м, 5H), Hh) 9,85 и 10,15 (ш, 2H); 13С ЯМР (125 МГц, CDCl3) δ Ca) 21,8 и 23,4, Cc) 25,8, Cb) 31,9, Cd) 38,2, Се) 60,1, Cf) 68,8, Cg) 128,4, 128,6, 128,8, Cj) 134,6, Ci) 168,2; ИК (чистый) 2958,3 (м), 1742 (с), 1696 (с), 1455 (с), 1390 (с), 1366 (с), 1323 (с), 1151 (с) см-1; МСВР m/z, вычислено для C11H23N4O2(M+H): 336,2174; найдено 336,2178.
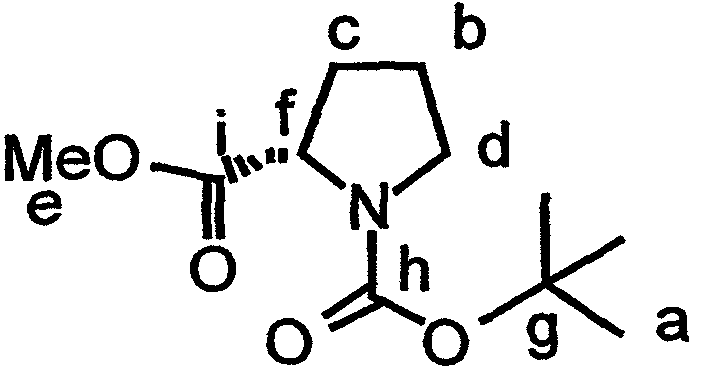
Метил-N-Boc-L-пролинат (соединение 41)
Коммерчески доступный N-Boc-L-пролин (5,0 граммов; 23,2 миллимоля) растворяют в ацетоне (200 миллилитров). Добавляют при 0°С K2CO3 (3,8 грамма; 27,84 миллимоля), после чего добавляют MeI (2,9 миллилитра; 46,4 миллимоля). Эту реакционную смесь перемешивают в течение ночи. Затем реакцию гасят добавлением 5% раствора NaHCO3 и проводят экстракцию эфиром. Объединенные эфирные слои промывают 5% HCl и насыщенным раствором соли и затем концентрируют с получением неочищенного продукта (соединение 41) с выходом 91%. Указанное соединение очищают хроматографией на колонке, элюируя смесью 20% ацетон/гексан. Соединение 41 характеризуется следующими аналитическими показателями: Rf 0,4 (30% ацетон/гексан); [α]D 25 -61,2 (с=0,8; CHCl3); 1Н ЯМР (500 МГц, CDCl3) δ На) 1,45 (с, 9H), Hb) 1,98 (дд, 2H) Нс) 1,88 и 2,22 (м, св.м, 2H), Hd) 3,42-3,58 (м, 2H), Не) 3,74 (с, 3Н), Нf) 4,24 и 4,35 (св.м, 1H); 13C ЯМР (125 МГц, CDCl3) δ Cb) 24,2 и 24,4, Ca) 28,3, Cc) 31,6 и 31,8, Cd) 47,3, Cf) 52,1, Се) 59,7, Cg) 80,1, Ch) 153,8, Ci) 174,0; ИК (чистый) 2975 (м), 1749 (с), 1700 (с), 1396 (с), 1365 (с), 1200 (с), 1161 (с), 1151 (с); МСВР m/z, вычислено для C11H23N4O2(M+H): 230,1391; найдено 230,1389.
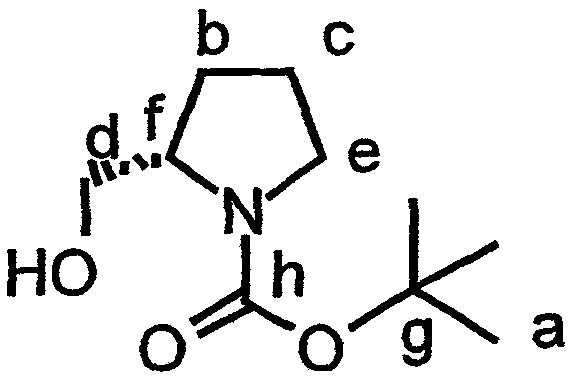
N-Boc-L-пролинол (соединение 41а)
Соединение 41 растворяют в 200 миллилитрах смеси ТГФ/EtOH (1:1). Добавляют порциями при 0°С LiCl (1,8 грамма; 32,7 миллимоля) и NaBH4 (1,2 грамма; 32,7 миллимоля). Эту реакционную смесь перемешивают в течение ночи и ход реакции контролируют с использованием ТСХ; по ходу реакции, при надобности, дополнительно добавляют LiCl и NaBH4. После того как реакция завершается, отделяют образовавшееся белое твердое вещество и промывают эфиром. Растворитель удаляют с использованием роторного испарителя. Полученный остаток нейтрализуют до рН 4 и затем дважды экстрагируют EtOAc. Полученные EtOAc-экстракты объединяют, промывают насыщенным раствором соли и концентрируют. Неочищенный продукт очищают хроматографией на колонке, элюируя смесью 10% ацетон/гексан с получением желательного спирта (соединение 41а) при выходе 83%. Соединение 41а характеризуется следующими аналитическими показателями: Rf 0,30 (30% ацетон/гексан); [α]D 25 -60,0 (с=0,8; CHCl3); 1Н ЯМР (500 МГц, CDCl3) δ На) 1,48 (с, 9Н), Hb) 1,60 и 2,05 (св.м, 2Н) Нс) 1,83-1,98 (дд, 2H), Hd) 3,35 и 3,45 (св.м, 2H), Не) 3,61-3,70 (м, 2H), Hf) 4,03 (м, 1H); 13С ЯМР (125 МГц, CDCl3) δ Cc) 23,8, Ca) 28,4, Cb) 28,9, Cf) 47,3, Се) 59,9, Cd) 67,3, Cg) 80,0, Ch) 156,8; ИК (чистый) 3424 (ш), 2973 (с), 2877 (с), 1695 (с), 1670 (с), 1477 (с), 1406 (с), 1366,2 (с); МСВР m/z, вычислено для C11H23N4O2(M+H): 202,1443; найдено 202,1449.
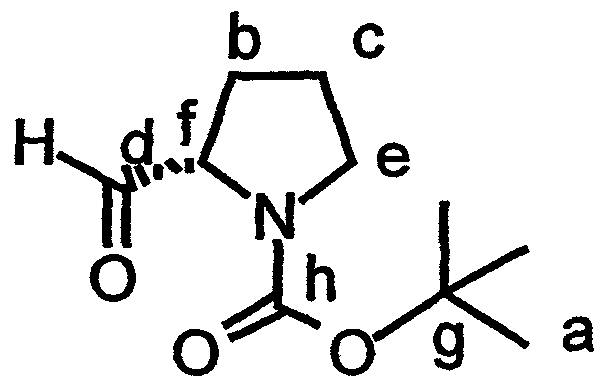
N-Boc-L-пролиналь (соединение 42)
Раствор соединения 41а (2,0 грамма; 9,9 миллимоля) и Et3N в 200 миллилитрах смеси CH2Cl2 охлаждают до -78°С. К предыдущему раствору добавляют SO3-пиридиновый комплекс (4,7 грамма; 29,7 миллимоля) в ДМСО (30 миллилитров). Указанную реакционную смесь нагревают до комнатной температуры и перемешивают в течение ночи, контролируя ход реакции с помощью ТСХ. После завершения реакции реакционную смесь разбавляют диэтиловым эфиром. Органический слой промывают 5% HCl, 5% NaHCO3 и насыщенным раствором соли. Полученный в результате раствор сушат над Na2SO4 и концентрируют. Неочищенную смесь очищают на короткой колонке с получением желательного альдегида (соединение 42) с выходом 81%. Соединение 42 характеризуется следующими аналитическими показателями: Rf 0,55 (30% ацетон/гексан); [α]D 25 +20,4 (с=1,2; CHCl3); 1Н ЯМР (500 МГц, CDCl3) δ На) 1,45 (с, 9Н), Hb) 1,75-1,90 (м, 2Н), Нc) 1,90-2,15 (м, 2H), Hd) 3,20-3,50 (т, 2H), Не) 3,90-4,20 (д, 1H), Hf) 9,72 (д, 1H); 13С ЯМР (125 МГц, CDCl3) δ Cb) 24,0, Cc) 27,3, Ca) 28,9, Cd) 47,5, Се) 65,5, Cg) 80,1, Ch) 154,2, Сf) 200,1.
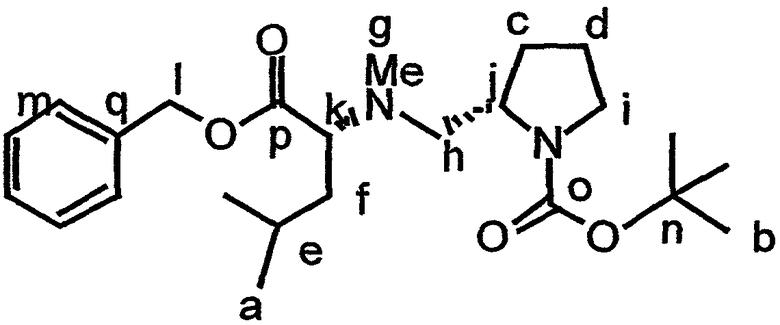
N-Boc-про-ψ(NHCH2)-N-метилбензил-D-лейцинат (соединение 43)
Соединение 42 (0,1 грамма; 0,5 миллимоля) растворяют в CH2Cl2 (8 миллилитров) и при энергичном перемешивании добавляют свободный амин соединения 48 (0,15 грамма; 0,55 миллимоля). При 0°С в качестве катализатора вносят AcOH (0,02 миллилитра; 0,3 миллимоля) и перемешивают в течение 10 минут, после чего добавляют в реакционную смесь NaBH(OAc)3 (0,13 грамма; 0,6 миллимоля). Полученную реакционную смесь перемешивают при комнатной температуре и ход реакции контролируют с использованием ТСХ. После завершения реакции реакционную смесь разбавляют CH2Cl2. Избыток реагентов гасят добавлением по каплям насыщенного раствора NH4Cl. Органический слой промывают 5% HCl, 5% NaHCO3 и насыщенным раствором соли, сушат и концентрируют. Неочищенный продукт очищают флэш-хроматографией, элюируя смесью 20% EtOAc/петролейный эфир с получением желательного амина (соединение 43). Соединение 43 характеризуется следующими аналитическими показателями: Rf 0,50 (30% ацетон/гексан); [α]D 25 -44,0 (с=1,1; CHCl3); 1Н ЯМР (500 МГц, CDCl3) δ Ha) 0,92 (м, 6H), Hb) 1,45 (с, 9Н), Нc), Нd) и Не) 1,50-1,90 (м, 5H), Hf) и Hg) 2,3-2,45 (м, 5Н), Hh1) 2,22-2,90 (м, 1H), Hh2) и Hi) 3,25-3,4 (м, 3H), Hj) и Hk) 3,70-3,95 (м, 2H), Hl) 5,35 (м, 5H), Hm) 7,30 (м, 5H); 13C ЯМР (125 МГц, CDCl3) δ Ca) 22,2, Cd) 23,4, Cc) 25,6, Cb) 28,4, Се) 28,8, Cg) 36,6, Сf) 38,4, Ch) 46,2, Ci) 56,1, Cj) 58,5, Cl) 56,2, Ck) 66,0, Cn) 79,6, Cm) 128,2, Cq) 136,2, Со) 154,1, Ср) 174,2; ИК (чистый) 2955 (с), 2868 (с), 1730 (с), 1693 (с), 1455 (с), 1392 (с), 1364 (с), 1170 (с) см-1; МСВР m/z, вычислено для C24H38N2O4(M+H): 419,2910; найдено 419,2897.
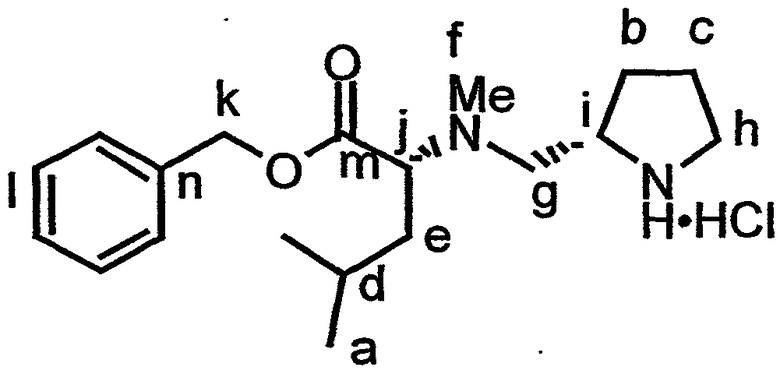
Гидрохлоридная соль L-про-ψ(NHCH2)-N-метилбензил-D-лейцината (соединение 44)
Соединение 43 (0,1 грамма) растворяют в HCl•диоксан (5 миллилитров) и полученный раствор перемешивают при комнатной температуре. По завершении реакции весь растворитель удаляют в вакууме. Дважды добавляют толуол и концентрируют раствор. Остаток сушат при пониженном давлении в течение ночи с получением желательной HCl соли (соединение 44) с выходом 98%. Соединение 44 характеризуется следующими аналитическими показателями: Rf на линии старта (60% этилацетат/петролейный эфир); [α]D 25 +15,3 (с=0,6; CHCl3); 1Н ЯМР (500 МГц, CDCl3) δ На) 0,91-1,10 (д, 6H), Hb), Hc) и Hd) 1,68-2,30 (м, 5H), Не) 2,83 (дд, 2H), Hf) 3,12 (с, 3H), Hg) и Hh) 3,31-3,65 (м, 4H), Hi) и Hj) 4,11-4,30 (м, 2H), Hk) 5,28 (с, 2H), Hk) 7,40 (м, 5H); 13C ЯМР (125 МГц, CDCl3) δ Cc) 20,8, Cb) 23,5, Ca) 25,9, Cd) 26,1, Се) 36,2, Cf) 46,2, Cg) 55,8, Ch) 61,6, Ci) 64,2, Cj) 67,0, Ck) 68,2, Cl) 125,0, 128,0, 128,8, 128,9 и 134,1, Cn) 137,9, Сm) 167,0; ИК (чистый) 2954 (с), 2360 (с), 2338 (с), 1740 (с), 1455 (с), 1389 (с), 1197 (с), 1141 (с) см-1; МСВР m/z, вычислено для C19H30N2O2(M+H): 319,2386; найдено 319,2392.

L-Лактил-про-ψ(NHCH2)-N-метилбензил-D-лейцинат (соединение 50а)
Соединение 44 (20 миллиграмм; 0,063 миллимоля) растворяют в CH2Cl2 (0,5 миллилитров) и добавляют при 0°С молочную кислоту (5,55 миллиграмма; 0,063 миллимоля), после чего добавляют БОФ (28 миллиграмм; 0,063 миллимоля) и NMM (0,035 миллилитра; 0,31 миллимоля). Полученную реакционную смесь перемешивают при 0°С, отслеживая ход реакции по данным ТСХ. После завершения реакции реакционную смесь разбавляют диэтиловым эфиром. Органический слой промывают 5% HCl, 5% NaHCO3 и насыщенным раствором соли. Полученный раствор сушат над Na2SO4 и концентрируют. Неочищенную смесь очищают хроматографией на колонке, элюируя смесью 30% ацетон/гексан с получением соединения 50а с выходом 61%. Соединение 50а характеризуется следующими аналитическими показателями: Rf 0,50 (50% ацетон/гексан); [α]D 25 +21,0 (с=0,2; CHCl3); 1H ЯМР (500 МГц, CDCl3) δ На) 0,82-0,92 (д, 6H), Hb) 1,20 (д, 3Н), Нс) 1,45-1,66 (м, 2Н), Hd) 1,66-1,72 (м, 1H), He) и Hf) 1,76-1,90 (м, 4Н), Hg) и Hh) 2,25-2,45 (м, 5H), Hi), Hj) и Hk) 3,19-3,85 (м, 4H), Hl) 4,10-4,21 (св.м, 1H), Нm) 5,05-5,18 (с, 2H), Hn) 7,12-7,38 (м, 5H); 13C ЯМР (125 МГц, CDCl3) δ Ca) 22,0, Cc) 22,8, Cd) 24,2, Се) 24,8, Cb) 25,4, Сf) 28,1, Cg) 37,8, Ch) 38,6, Cj) 45,8, Сi) 46,2, Ck) 56,0, Сl) 56,8, Cm) 66,0, Cn) 128,8, Со) 136,1, Ср) 173,8, Cq) 174,1; ИК (чистый), 3415 (ш), 2955 (с), 2869 (м), 1729 (с), 1638 (с), 1455 (м), 1379 (м), 1366 (м), 1147 (м), 1126 (м); МСВР m/z, вычислено для C22H34N2O4 (M+Na): 413,2416; найдено 413,2423.
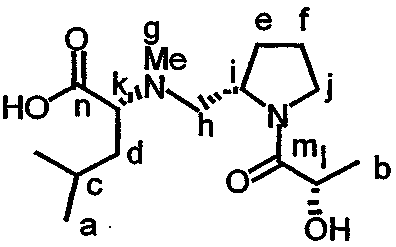
N-Метил-лей-ψ(NHCH2)-лак-про кислота (соединение 51а)
Соединение 50а (20 миллиграмм; 0,063 миллимоля) растворяют в 0,5 миллилитра смеси MeOH/EtOAc (1:1). Полученную смесь добавляют к раствору MeOH и EtOAc (1:1), содержащему катализатор Pd/C (10 миллиграмм). Реакционную смесь встряхивают в гидрогенизаторе Парра в атмосфере Н2 (давление 40 фунтов на квадратный дюйм, по прибору), отслеживая ход реакции по данным ТСХ. По завершению реакции катализатор удаляют фильтрованием. Оставшийся раствор концентрируют в вакууме. Неочищенный продукт (соединение 51а) используют непосредственно на следующей стадии. Соединение 51а характеризуется следующими аналитическими показателями: Rf 0,20 (10% MeOH/CH2Cl2); [α]D 25 +65,0 (с=0,2; CHCl3); 1H ЯМР (500 МГц, CDCl3) δ Ha) 0,82-0,92 (д, 6H), Hb) 1,34 (д, 3H), Hc) 1,45-1,55 (м, 1H), Hd) 1,78-1,91 (м, 2H), He) 1,91-2,0 (м, 2H), Hf) 2,0-2,18 (м, 2H), Hg) 2,81 (с, 3H), Hh) 3,03-3,18 (д, 2H), Hi) 3,45-3,54 (м, 1H), Hj) 3,56-3,68 (т, 2H), Hk) 4,25-4,35 (м, 1H), Hl) 4,40-4,49 (м, 1H); 13C ЯМР (125 МГц, CDCl3) δ Ca) 21,0, Cb) 22,8, Cc) 23,4, Cd) 24,8, Ce) 25,8, Cf) 29,4, Cg) 36,5, Ch) 38,6, Ci) 47,2, Cj) 55,2, Ck) 66,4, Сl) 68,2, Cm) 172,4, Cn) 176,2; ИК (чистый), 3336 (ш), 2957 (с), 2870 (м), 1718 (м), 1627 (с), 1466 (с), 1368 (с), 1250 (м), 1197 (в), 1128 (в); МСВР m/z, вычислено для C15H27N2O4(M+Na): 323,1947; найдено 323,1939.
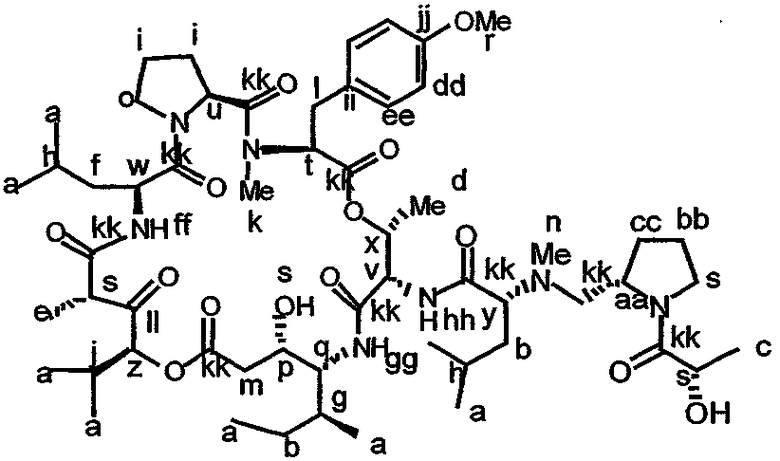
Цикло[N-(N-3,4-дидегидро-L-пролил-N-метил-D-лейцил)-О[[N-[(2S,3S,4S)-4-[(3S,4R,5S)-4-амино-3-гидрокси-5-метилгептаноил]окси-3-оксо-2,5-диметилгексаноил]-L-лейцил]-L-пролил-N,O-диметил-L-тирозил]-L-треонил] (соединение 72а)
Неочищенную кислоту (12,5 миллиграммов; 0,038 миллимоля) объединяют с HCl солью макроцикла (15,0 миллиграммов; 0,019 миллимоля) в CH2Cl2 (0,25 миллилитра) при 0°С. Добавляют HATU (8,2 миллиграмма; 0,020 миллимоля) и ДИЭА (0,026 миллилитра; 4 эквивалента). Полученную реакционную смесь перемешивают при 0°С в течение ночи, отслеживая ход реакции по данным ТСХ. По завершению реакции реакционную смесь разбавляют Et2O и промывают органический слой 5% HCl, 5% NaHCO3 и насыщенным раствором соли. Полученный раствор сушат над Na2SO4 и концентрируют. Неочищенный остаток очищают хроматографией на колонке, элюируя смесью 5% MeOH/CH2Cl2 с получением желательного продукта (соединение 72а) с выходом 72%. Соединение 72а характеризуется следующими аналитическими показателями: Rf 0,40 (10% MeOH/CH2Cl2); [α]D 25 +81,2 (с=0,15; CHCl3); 1H ЯМР (500 МГц, CDCl3) δ Ha) 0,85-0,97 (м, 24H), Hb) 1,17-1,27 (м, 2H), Hc) 1,28-1,39 (с, 3H), Hd) 1,40 (д, 3H), He) 1,43 (д, 3H), Hf) 1,46-1,50 (м, 1H) и 1,61 (т, 1H), Hg) 1,68-1,73 (м, 1H), Hh) 1,74-1,79 (м, 1H), Hi) 1,82-1,88 (м, 2H), 2,02-2,08 (м, 1H) и 2,11-2,17 (м, 2H), Hj) 2,34-2,37 (м, 1H), Hk) 2,57 (с, 3H), Hl) 2,38 (д, 2H), Hm) 3,18 и 3,39 (дд, 1H), Hn) 2,83 (с, 3H), Ho) 3,37-3,57 (м, 2H), Hp) 3,60 (д, 1H), Hq) 3,70-3,73 (м, 1H), Hr) 3,80 (с, 3H), Hs) 4,05-4,14 (м, 3H) и 4,36-4,48 (м, 2H), Ht) 4,27 (к, 1H), Hu) 4,56 (дд, 1H), Hv) 4,65 (дд, 1H), Hв) 4,81 (т, 1H), Hx) 5,19 (д, 1H), Hy) 5,35 (дд, 1H), Hz) 5,42 (дд, 1H), Haa) 5,61 (дд, 1H), Hbb) 5,73-5,75 (м, 1H), Hcc) 6,11 (дд, 1H), Hdd) 6,85 (д, 2H), Hee) 7,08 (д, 2H), Hff) 7,20 (д, 1H), Hgg) 7,54 (д, 1H), Hhh) 7,78 (д, 1H); 13C ЯМР (125 МГц, CDCl3) δ Ca), Cc) 11,7, 14,7, 15,2, 16,3, 16,9, 18,6, 20,1 и 20,9, Cd) 23,3, Ce) 23,7, Cb) 24,8 и 27,2, Ci) 24,9, 25,0 и 33,9, Cf) 27,9, Cg) 31,2, Сh) 31,3, Cj) 33,9, Cl) 36,2, Cm) 38,7, Ck) 38,8, Cn) 41,3, Co) 46,9, Cq) 49,46, Cs) 49,52, 53,0 и 67,9, Cr) 55,3, Cv) 55,4, Cw) 55,5, Cu) 57,2, Cy) 57,6, Ct) 63,9, Caa) 65,9, Cс) 66,4, Cp) 66,5, Cx) 70,4, Cz) 81,5, Cdd) 114,1, Ccc) 124,0, Cbb) 129,1, Cii) 130,0, Cee) 130,3, Cjj) 158,6, Ckk) 168,6, 169,3, 170,5, 170,6, 171,3, 171,5, 172,4, 173,9, Cll) 204,9; ИК (чистый) 3331 (ш), 2956 (с), 2871 (м), 1732 (с), 1638,3 (ш, перекрывание), 1543 (м), 1513 (с), 1448 (м), 1379 (м), 1247 (в), 1167 (в) см-1; МСВР m/z, вычислено для C57H91N7O14 (M+H): 1098,6702; найдено 1098,6726.
Пример 6
Синтез 3,4-дегидропролиновой группы боковой цепи и связывание с макроциклом дидемнина
Синтез 3,4-дегидропролиновой группы начинают с транс-4-гидрокси-L-пролина (соединение 52), который получают по известной из литературы методике (Rueger et al., 1982, Can. J. Chem., 60:2918; см. фиг.44). В первую очередь, кислоту защищают в виде ее сложного этилового эфира. Затем проводят защиту аминогруппы с использованием Boc2O, получая соединение 53. Гидроксильную группу мезилируют с использованием MsCl и пиридина. Мезилат (то есть метилсульфонатную группу соединения 53) замещают бензолселенидом натрия с инверсией стереохимии, получая соединение 54. Окислительное элиминирование группы фенилселена дает соответствующий алкен (соединение 55) с выходом 73%.
Если соединение 54 непосредственно подвергнуть основным условиям элиминирования, то могут быть получены два региоизомера. Но окислительное элиминирование соединения 54 через фенилселен в качестве интермедиата дает только желательный региоизомер. Такая региоселективность может быть связана с тем фактом, что переходное состояние, ведущее к нежелательному изомеру, имеет больший дипольный момент с большей энергией.
Гидролиз сложного этилового эфира (соединения 55) дает свободную дегидропролиновую кислоту (соединение 56), которую связывают со сложным эфиром D-лейцина с получением соединения 57. Гидролиз сложного метилового эфира дает свободную кислоту, которую, используя HATU, связывают с солью макроцикла дидемнина с образованием соединения 58. Защитную Вос-группу удаляют с использованием газообразного HCl и нейтрализуют HCl-соль насыщенным раствором NaHCO3, что приводит к получению последнего аналога, соединения 59.
Ниже дается более подробное описание стадий указанного синтеза.
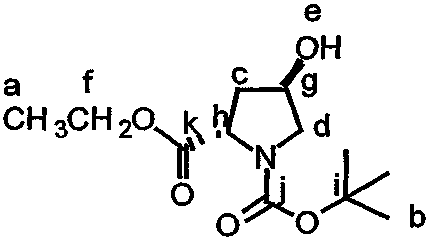
Этил-N-Boc-транс-4-гидроксипролинат (соединение 53)
Гидрохлоридную соль этил-транс-4-гидроксипролината (1,0 грамм; 0,005 моля) растворяют в насыщенном CH2Cl2 (10 миллилитров). Добавляют при 0°С Et3N (2,09 миллилитра; 0,015 моля) и затем Вос2О (2,23 г; 0,01 моля). Реакционную смесь перемешивают в течение ночи. По завершению реакции измеряют значение рН и затем доводят его до 8. Далее реакционную смесь промывают диэтиловым эфиром и эфирный слой отбрасывают. Водный слой подкисляют 1 нормальным KHSO4 до рН 4, после чего три раза экстрагируют этилацетатом. Органические экстракты объединяют, промывают насыщенным раствором соли, сушат и концентрируют. Неочищенную смесь очищают хроматографией на колонке, элюируя смесью 20% ацетон/гексан, с получением желательного продукта (соединение 53) с выходом 71%. Соединение 53 характеризуется следующими аналитическими показателями: Rf 0,50 (40% ацетон/гексан); [α]D 25 +71,3 (с=0,2; CHCl3); 1H ЯМР (500 МГц, CDCl3) δ Ha) 1,07-1,13 (т, 6H), Hb) 1,32-1,36 (м, 9H), Hc) 1,84-2,15 (м, дсв., 2H), Hd) 3,23-3,49 (м, дсв., 2H), He) 3,78-3,95 (ш, 1H), Hf) 3,96-4,09 (м, 2H), Hg) 4,17-4,26 (м, 1H), Hh) 4,27-4,32 (т, 1H); 13C ЯМР (125 МГц, CDCl3) δ Ca) 14,0, Cb) 28,1, Cc) 38,2, Cd) 54,2, Cf) 57,7, Cg) 61,0, Ch) 69,0, Ci) 80,0, Cj) 153,9, Ck) 172,6; ИК (чистый) 3448 (ш), 2978 (с), 2935 (м), 1746 (м), 1702 (с), 1676 (с), 1477 (м), 1402 (с), 1367 (м), 1339 (м) см-1; МСВР m/z, вычислено для C11H23N4O2(M+H): 260,1497; найдено 260,1503.
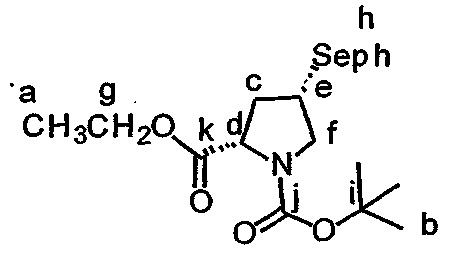
Этил-N-Boc-цис-4-фенилселенил-L-пролинат (соединение 54)
Борогидрид натрия (0,15 грамма; 0,004 моля) добавляют малыми порциями при комнатной температуре к раствору дифенилселенида (0,556 грамма; 0,0018 моля) в EtOH. Смесь перемешивают примерно 5 минут до исчезновения ярко-желтой окраски. Добавляют предварительно приготовленный мезилат (1,0 грамм; 0,003 моля), раствор кипятят с обратным холодильником в течение 2 часов, после чего растворитель удаляют в вакууме. Остаток разбавляют Et2O (5 миллилитров) и органический слой промывают Н2О (10 миллилитров) и насыщенным раствором соли. Полученный органический слой сушат и концентрируют. Неочищенное масло очищают хроматографией на колонке, элюируя смесью 10% ацетон/гексан, с получением продукта (соединение 54) с выходом 85%. Соединение 54 характеризуется следующими аналитическими показателями: Rf 0,53 (30% ацетон/гексан); [α]D 25 -16,4 (с=0,3; CHCl3); 1H ЯМР (500 МГц, CDCl3) δ Ha) 1,21-1,24 (т, 3H), Hb) 1,45 (с, 9H), Hc) 2,05 и 2,68 (дсв., 2H), Hd) 3,40 (м, 1H), He) 3,58 (м, 1H), Hf1) 3,95 (м, 1H), Hf2) и Hg) 4,10-4,28 (м, 2H), Hh) 7,25, 7,55 (м, 5H); 13C ЯМР (125 МГц, CDCl3) δ Ca) 14,0, Cb) 28,2, Cc) 36,1, Cd) 39,8, Ce) 53,6, Cf) 58,8, C) 60,8, Ci) 80,2, Ch) 127,0, 128,2, 134,3, Cj) 152,8, Ck) 171,8; ИК (чистый) 2977,0, 1747,1, 1701,9, 1477,4, 1394,4, 1190,1, 1114,1 (м) см-1; МСВР m/z, вычислено для C18H25NO4Se(M+H): 399,0948; найдено 399,0957.
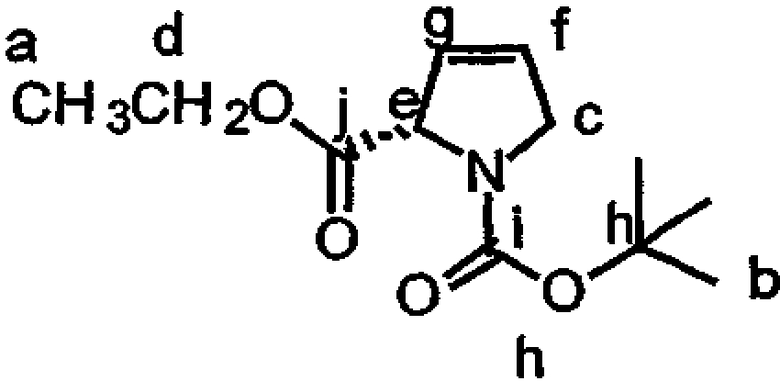
Этил-N-Boc-3,4-дегидро-L-пролинат (соединение 55)
Смесь соединения 54 (0,9 грамма; 2,26 миллимоля) и CH2Cl2 вначале охлаждают до 0°С в ледяной бане. К указанному раствору добавляют по каплям пиридин (0,27 миллилитра; 3,4 миллимоля). Затем постепенно, в течение 5 минут, добавляют раствор 30% водной Н2О2 (0,58 миллилитра). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа и затем разбавляют EtOAc. Органический слой промывают 5% HCl, насыщенным раствором Na2CO3 и насыщенным раствором соли. Полученный раствор сушат и концентрируют. Остаток очищают хроматографией на колонке с получением желательного продукта (соединение 55) с выходом 73%. Соединение 55 характеризуется следующими аналитическими показателями: Rf 0,63 (30% ацетон/гексан); [α]D 25 -32,3 (с=0,3; CHCl3); 1H ЯМР (500 МГц, CDCl3) δ Ha) 1,15-1,30 (т, 3H), Hb) 1,45 (с, 9H), Hc) и Hd) 4,15-4,30 (м, 4H), He) 4,98 (д, 1H), Hf) 5,75 (дт, 1H), Hg) 5,95 (дд, 1H); 13C ЯМР (125 МГц, CDCl3) δ Ca) 14,1, Cb) 29,2, Cc) 53,8, Cd) 61,8, Ce) 67,0, Ch) 80,1, Cf) 125,0, Cg) 129,2, Ci) 154,0, Cj) 170,2; ИК (чистый) 3458 (ш), 2979 (с), 1786 (с), 1750 (с), 1710 (с), 1448 (м), 1395 (м), 1369 (с), 1318 (с), 1258 (м), 1159 (с), 1896 (м) см-1; МСВР m/z, вычислено для C12H19NO4(M+H): 242,1392; найдено 242,1386.
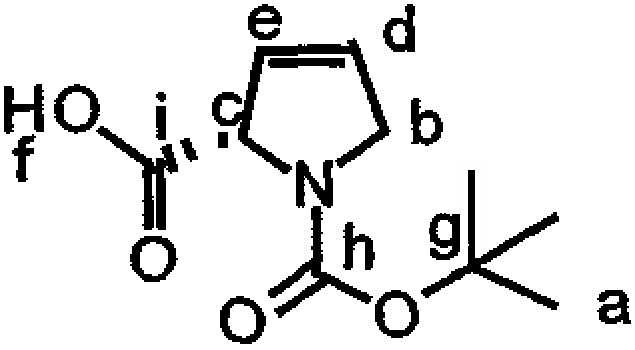
N-Boc-3,4-дегидро-L-пролин (соединение 56)
Сложный этиловый эфир 55 (0,18 грамма; 0,8 миллимоля) растворяют в ТГФ/Н2О (1:1; 10 миллилитров). К полученному раствору добавляют при 0°С LiOH•H2O (0,33 грамма; 8 миллимолей). Реакционную смесь перемешивают в течение примерно 6 часов, отслеживая ход реакции по данным ТСХ. По завершении реакции ТГФ удаляют в вакууме. Затем добавляют насыщенный раствор NaHCO3 и дважды промывают смесь эфиром. Все водные слои объединяют и подкисляют добавлением 1 нормального KHSO4 до рН 4. Используют этилацетат для экстракции подкисленного водного раствора три раза. Экстракты сушат и концентрируют с получением желательной кислоты (соединение 56) с выходом 92%. Соединение 56 характеризуется следующими аналитическими показателями: Rf 0,20 (30% ацетон/гексан); [α]D 25 +8,4 (с=0,2; CHCl3); 1H ЯМР (500 МГц, CDCl3) δ Ha) 1,49 (с, св.м, 9H), Hb) 4,25 (д, 2H), Hc) 5,05 (д, 1H), Hd) 5,80 (дт, 1H), He) 6,01 (дд, 1H), Hf) 8,40 (ш, 1H); 13C ЯМР (125 МГц, CDCl3) δ Ca) 28,9, Сb) 53,9, Cc) 66,2, Cg) 81,8, Cd) 124,2, Ce) 129,9, Ch) 154,5, Ci) 165,3; ИК (чистый) 3000-3400 (ш), 2957 (с), 1736 (с), 1704 (с), 1666 (с), 1400,2 (с), 1367 (м), 1177 (с), 1136 (с) см-1; МСВР m/z, вычислено для C10H15NO4(M+H): 213,1079; найдено 242,1086.
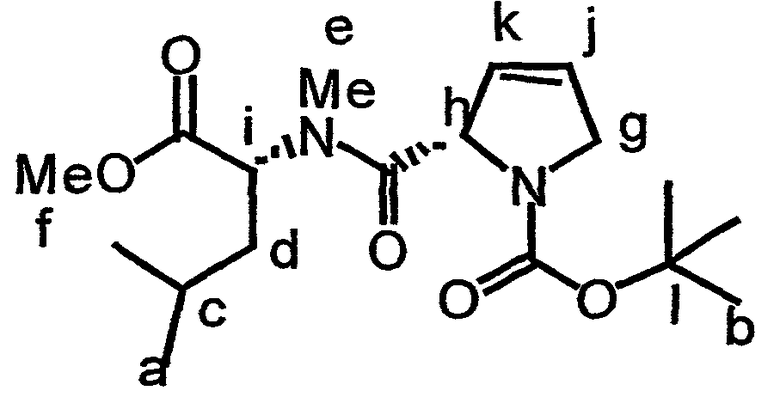
N-Boc-3,4-дегидро-L-пролил-метил-N-метил-лейцинат (соединение 57)
Соединение 56 (0,1 грамма; 0,469 миллимоля) растворяют в CH2Cl2 (5 миллилитров). После этого добавляют при 0°С HATU (0,26 грамма; 0,58 миллимоля) и затем ДИЭА (0,26 миллилитра; 1,88 миллимоля). И, наконец, к смеси добавляют гидрохлоридную соль диметил-D-лейцина (0,09 грамма; 0,469 миллимоля). Реакционную смесь перемешивают в течение 6 часов, отслеживая ход реакции по данным ТСХ. По завершении реакции смесь разбавляют Et2O и органический слой промывают 5% HCl, 5% NaHCO3 и насыщенным раствором соли. Полученный раствор сушат и концентрируют. Неочищенный остаток очищают хроматографией на колонке с получением желательного продукта (соединение 57) с выходом 76%. Соединение 57 характеризуется следующими аналитическими показателями: Rf 0,32 (30% ацетон/гексан); [α]D 25 -22,7 (с=0,4; CHCl3); 1H ЯМР (500 МГц, CDCl3) δ Ha) 0,90-1,05 (д, св.м, 6H), Hb) 1,48 (с, св.м, 9H), Hc) и Hd) 1,65-1,80 (м, 3H), He) 3,05 (с, 3H), Hf) 3,75 (с, 3H), Hg) 4,20-4,35 (м, 2H), Hh) 5,28 (т, 1H), Hi) 5,40 (д, 1H), Hj) 5,70 (дт, 1H), Hk) 6,01 (дд, 1H); 13C ЯМР (125 МГц, CDCl3) δ Ca) 22,0, 23,8, Cc) 25,2, Cb) 29,0, Cd) 37,8, Ce) 52,2, Ch) 53,8, Ci) 65,8, Cl) 80,0, Cj) 124,0, Ck) 129,2, Cm) 159,5, Cn) 171,0, Co) 172,2; ИК (чистый) 2956 (с), 1743 (с), 1705 (с), 1667 (с), 1400 (с), 1366 (м), 1316 (в), 1258 (в), 1177 (м), 1128 (м) см-1; МСВР m/z, вычислено для C18H30N2O5(M+H): 355,2233; найдено 355,2225.
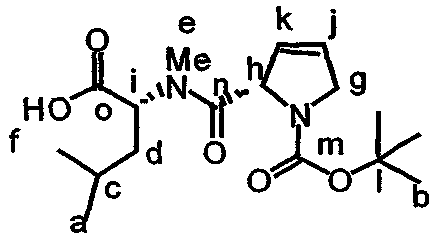
N-Boc-3,4-дегидро-L-пролил-N-метил-лейцин (соединение 57а)
Соединение 57 (0,13 грамма; 0,37 миллимоля) растворяют в ТГФ/Н2О (1:1; 5 миллилитров). К полученному раствору добавляют при 0°С LiOH•H2O (0,15 грамма; 3,7 миллимоля). Реакционную смесь перемешивают в течение примерно 6 часов, отслеживая ход реакции по данным ТСХ. По завершении реакции ТГФ удаляют в вакууме. Затем добавляют насыщенный раствор NaHCO3 и дважды промывают смесь эфиром. Все водные слои объединяют и подкисляют добавлением 1 нормального KHSO4 до рН 4. Проводят три раза экстракцию подкисленного водного раствора этилацетатом. Экстракты сушат и концентрируют с получением желательной кислоты (соединение 57а) с выходом 92%. Соединение 57а характеризуется следующими аналитическими показателями: Rf 0,20 (40% ацетон/гексан); [α]D 25 +52,3 (с=0,2; CHCl3); 1H ЯМР (500 МГц, CDCl3) δ Ha) 0,85-1,05 (д, св.м, 6H), Hb) 1,48 (с, св.м, 9H), Hc) и Hd) 1,65-1,92 (м, 3H), He) 3,12 (с, св.м, 3H), Hf) ш, 1H, Hg) 4,10-4,28 (м, 2H), Hh) 5,15 (т, 1H), Hi) 5,35 (д, 1H), Hj) 5,70 (дт, 1H), Hk) 6,01 (дд, 1H); 13C ЯМР (125 МГц, CDCl3) δ Ca) 23,3, 24,5, Cc) 25,0, Cb) 28,3, Cd) 31,5, Cg) 38,5, Ce) 53,6, Ci) 55,8, Ch) 65,2, Cl) 80,0, Cj) 124,1, Ck) 129,5, Cm) 153,8, Cn) 171,3, Co) 175,3; ИК (чистый) 3300 (ш), 2957 (с), 1731 (м), 1783 (с), 1667 (с), 1612 (м), 1481 (м), 1400 (с), 1367 (м), 1177 (с), 1136,7 (с) см-1; МСВР m/z, вычислено для C17H28N2O5(M+H): 341,2076; найдено 341,2063.
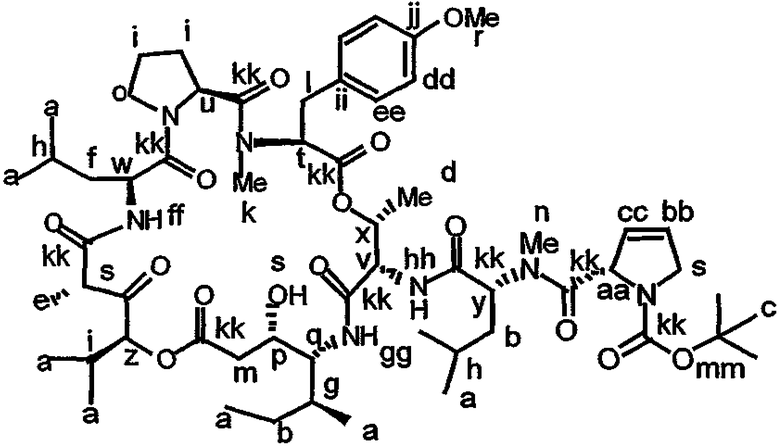
Цикло[N-(N-Вос-3,4-дегидро-L-пролил-N-метил-D-лейцил)-О[[N-[(2S,3S,4S)-4-[(3S,4R,5S)-4-амино-3-гидрокси-5-метилгептаноил]окси-3-оксо-2,5-диметилгексаноил]-L-лейцил]-L-пролил-N,O-диметил-L-тирозил]-L-треонил] (соединение 58)
Неочищенную кислоту 57а (5,0 миллиграмма; 0,012 миллимоля) объединяют при 0°С с HCl-солью макроцикла (14,9 миллиграмма; 0,012 миллимоля) в CH2Cl2 (0,1 миллилитра). Добавляют HATU (48 миллиграммов; 0,012 миллимоля) и ДИЭА (0,048 миллилитра; 0,048 миллимоля). Реакционную смесь перемешивают при 0°С в течение ночи, отслеживая ход реакции по данным ТСХ. По завершении реакции смесь разбавляют диэтиловым эфиром и органический слой промывают 5% HCl, 5% NaHCO3 и насыщенным раствором соли. Полученный раствор сушат и концентрируют. Неочищенный остаток очищают хроматографией на колонке, элюируя смесью 5% MeOH/CH2Cl2 с получением желательного продукта (соединения 58) с выходом 72%. Соединение 58 характеризуется следующими аналитическими показателями: Rf 0,40 (10% MeOH/CH2Cl2); [α]D 25 -83,2 (с=0,3; CHCl3); 1H ЯМР (500 МГц, CDCl3) δ Ha) 0,85-0,97 (м, 24H), Hb) 1,17-1,27 (м, 3H), Hc) 1,45 (с, 9H), Hd) 1,40 (д, 3H), He) 1,43 (д, 3H), Hf) 1,46-1,50 (м, 1H) и 1,61 (т, 1H), Hg) 1,68-1,73 (м, 1H), Hh) 1,74-1,79 (м, 1H), Hi) 1,82-1,88 (м, 2H), 2,02-2,08 (м, 1H) и 2,11-2,17 (м, 2H), Hj) 2,34-2,37 (м, 1H), Hk) 2,57 (с, 3H), Hl) 2,63 (дд, 1H) и 2,95 (д, 1H), Hm) 3,18 и 3,39 (дд, 1H), Hn) 3,23 (с, 3H), Ho) 3,57-3,61 (м, 2H), Hp) 3,33 (д, 1H), Hq) 3,69-3,71 (м, 1H), Hr) 3,80 (с, 3H), Hs) 4,05-4,14 (м, 2H) и 4,36-4,48 (м, 2H), Ht) 4,27 (к, 1H), Hu) 4,56 (дд, 1H), Hv) 4,65 (дд, 1H), Hw) 4,81 (т, 1H), Hx) 5,19 (д, 1H), Hy) 5,35 (дд, 1H), Hz) 5,42 (дд, 1H), Haa) 5,61 (дд, 1H), Hbb) 5,73-5,75 (м, 1H), Hcc) 6,11 (дд, 1H), Hdd) 6,85 (д, 2H), Hee) 7,08 (д, 2H), Hff) 7,20 (д, 1H), Hgg) 7,54 (д, 1H), Hhh) 7,78 (д, 1H); 13C ЯМР (125 МГц, CDCl3) δ Ca) 11,7, 14,7, 15,2, 16,3, 16,9, 18,6, 20,1 и 20,9, Cd) 23,3, Ce) 23,7, Ca) 24,8 и 27,2, Cj) 24,9, 25,0 и 33,9, Cf) 27,9, Cc) 28,6, Cg) 31,2, Ch) 31,3, Cj) 33,9, Cl) 36,2, Cm) 38,7, Ck) 38,8, Cn) 41,3, Co) 46,9, Cq) 49,46, Cs) 49,52, 53,0 и 67,9, Сr) 55,3, Cv) 55,4, Cw) 55,5, Cu) 57,2, Cy) 57,6, Ct) 63,9, Caa) 65,9, Cp) 66,5, Cx) 70,4, Cz) 81,5, Cz) 81,7, Cdd) 114,1, Ccc) 124,0, Cbb) 129,1, Cii) 130,0, Cee) 130,3, Cjj) 158,6, Ckk) 168,6, 169,3, 170,5, 170,6, 171,3, 171,5, 172,4, 173,9, 204,9; ИК (чистый) 3337 (с), 2959 (с), 2870 (м), 1733 (с), 1645 (с), 1640 (с), 1543 (м), 1514 (м), 1454 (м), 1407 (м), 1368 (м), 1302 (в), 1248 (м), 1171 (м) см-1; МСВР m/z, вычислено для C59H91N7O15(M+Na): 1160,6471; найдено 1160,6415.
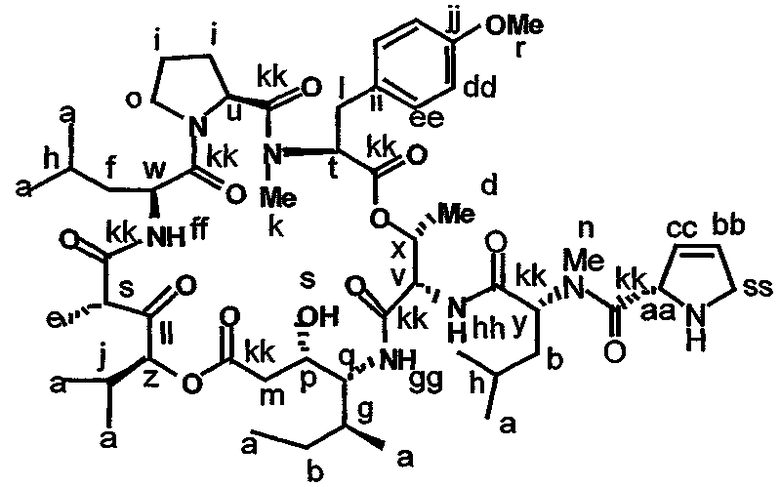
Цикло[N-(N-3,4-дегидро-L-пролил-N-метил-D-лейцил)-О[[N-[(2S,3S,4S)-4-[(3S,4R,5S)-4-амино-3-гидрокси-5-метилгептаноил]окси-3-оксо-2,5-диметилгексаноил]-L-лейцил]-L-пролил-N,O-диметил-L-тирозил]-L-треонил] (соединение 59)
Соединение 58 (4,0 миллиграмма) растворяют в HCl•диоксане (0,5 миллилитра) и перемешивают при комнатной температуре. По завершении реакции растворитель удаляют в вакууме. Дважды добавляют толуол и полученный раствор концентрируют. Остаток сушат в вакууме в течение ночи с получением желательной HCl-соли с выходом 98%. HCl-соль растворяют в EtOAc, промывают насыщенным раствором NaHCO3 и органический слой снова промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют с получением желательного продукта (соединение 59) с выходом 75%. Соединение 59 характеризуется следующими аналитическими показателями: Rf 0,20 (10% MeOH/CH2Cl2); [α]D 25 -242,3 (с=0,2; CHCl3); 1H ЯМР (500 МГц, CDCl3) δ Ha) 0,79-0,97 (м, 24H), Hb) 1,12-1,23 (м, 3H), Hd) 1,32-1,40 (д, 3H), He) 1,43 (д, 3H), Hf) 1,46-1,50 (м, 1H) и 1,61 (т, 1H), Hg) 1,68-1,73 (м, 1H), Hh) 1,74-1,79 (м, 1H), Hi) и Hj) 1,82-1,88 (м, 2H), 2,02-2,08 (м, 1H) и 2,11-2,17 (м, 3H), Hk) 2,25 (с, 3H), Hl) 2,51 (д, 2H), Hm) 3,18 и 3,39 (дд, 1H), Hn) 2,95 (с, 3H), Ho) 3,57-3,61 (м, 2H), Hp) 3,33 (д, 1H), Hq) 3,69-3,71 (м, 1H), Hr) 3,73 (с, 3H), Hs) 3,90-4,18 (м, 2H), Ht) 4,49 (к, 1H), Hu) 4,56 (дд, 1H), Hv) 4,65 (дд, 1H), Hw) 4,81 (т, 1H), Hx) 5,19 (м, 3H), Hbb) и Haa) 5,73-5,75 (м, 3H), Hcc) и Hz) 6,01 (дд, 3H), Hdd) 6,85 (д, 2H), Hee) 7,08 (д, 2H), Hff) 7,20 (д, 1H), Hgg) 7,54 (д, 1H), Hhh) 7,78 (д, 1H); 13C ЯМР (125 МГц, CDCl3) δ Ca) 11,7, 14,7, 15,2, 16,3, 16,9, 18,6, 20,1 и 20,9, Cd) 23,3, Ce) 23,7, Ca) 24,8 и 27,2, Ci) 24,9, 25,0 и 33,9, Cf) 27,9, Cc) 28,6, Cg) 31,2, Сh) 31,3, Сj) 33,9, Cl) 36,2 Cm) 38,7, Ck) 38,8, Cn) 41,3, Co) 46,9, Cq) 49,46, Cs) 49,52, 53,0 и 67,9, Сr) 55,3, Cv) 55,4, Cw) 55,5, Cu) 57,2, Cy) 57,6, Ct) 63,9, Caa) 65,9, Cp) 66,5, Cx) 70,4, Cz) 81,5, Cdd) 114,1, Ccc) 124,0, Cbb) 129,1, Cii) 130,0, Cee) 130,3, Cjj) 158,6, Ckk) 168,6, 169,3, 170,5, 171,3, 171,5, 172,4, 173,9, Cll) 204,9; ИК (чистый) 3337 (с), 2958 (с), 2861 (м), 1734 (с), 1642 (с), 1638 (с), 1547 (м), 1514 (м), 1451 (м), 1385 (в), 1243 (в), 1166 (в) см-1; МСВР m/z, вычислено для C54H83N7O13(M+H): 1038,6127; найдено 1038,6103.
Пример 7
Синтез и биологическая оценка фотоаффинности аналогов дидемнина
Были идентифицированы два белка, которые связываются с дидемнинами, а именно: эукариотический фактор удлинения 1 альфа (EF-1a; Crews et al., 1994, J. Biol. Chem., 269:15411-15414) и пальмитоил-протеин-тиоэстераза 1 (PPT1; Crews et al., 1996, Proc. Natl. Acad. Sci. USA, 93:4316-4319). Однако точное структурное взаимодействие между дидемнином В и двумя указанными белками все еще до конца не выяснено. Описанные в данном примере эксперименты были проведены с целью получения фотореактивных производных дидемнина, которые могли бы быть использованы для изучения связывания соответствующих дидемнинов с ними и с другими клеточными мишенями, а также для целей синтеза аналогичных фотореактивных производных тамандарина.
В данном примере описан синтез аналогов дидемнина, обозначенных как соединения 403, 404, 405 и 406 (см. фиг.51). Указанные соединения имеют структуру формулы XXI, где R2 обозначает заместитель, имеющий структуру формулы III, R3 обозначает метил, R4 обозначает боковую цепь изолейцина, каждый из R5, R6, R8 и R9 обозначает гидридный радикал, R7 обозначает метоксирадикал, R10 обозначает боковую цепь лейцина, Х обозначает -О-, Y обозначает гидридный радикал и R1 имеет структуру, показанную на фиг.47А, 47В, 47С и 47D соответственно.
Каждое из соединений 403, 404, 405 и 406 представляет собой производное дидемнина А, и каждая из указанных молекул включает группу 4-бензоилбензойной кислоты. Такой тип производного бензофенона был выбран в качестве фотореактивной группы в связи с его многочисленными преимуществами в процессе фотоаффинного мечения, как описано в литературе (Dormán et al., 1994, Biochemistry, 33:5661-5673; Fleming, 1995, Tetrahedron, 51:12479-12520). С бензофенонами достаточно легко работать при соответствующем освещении, но они фотоактивируются светом, имеющим длину волны примерно 350 нанометров. Свет, имеющий указанную длину волны, в основном не повреждает белки и используется с целью избежания фотоиндуцированных изменений в целевых белках, использующихся в данных экспериментах. Активированные бирадикалы бензофенонов не вступают в контакт с молекулами растворителей и нуклеофилами и сшиваются преимущественно по неактивным углеродным центрам. Поскольку фотовозбуждение бензофенонов является обратимым процессом, данная молекула аналога, которая не является ближайшей к месту связывания лиганда, может подвергаться нескольким циклам возбуждения-релаксации, в отсутствие отрицательного воздействия на них неспецифических побочных реакций. В результате бензофеноны демонстрируют тенденцию к сшиванию с достижением более высокой сайт-специфичности, чем такие фотофоры, как арилазиды, которые подвергаются реакции необратимого фотолиза.
Части боковых цепей соединений 403, 404, 405 и 406 были синтезированы и затем на конечной стадии процесса связаны с усовершенствованным макролидным промежуточным соединением. На фиг.48 показан синтез D-лейциновой группы, которая является общей для всех четырех аналогов. D-лейцин превращают в его бензилкарбамат (соединение 407) с помощью бензилхлорформиата в NaHCO3 и воде. Соединение 407 подвергают диалкилированию с использованием диметилсульфата в присутствии порошка КОН, ТГФ и Bu4N+HSO4 -. Каталитический гидрогенолиз карбамата над катализатором Pd/C в присутствии водорода и смеси (1:1) этилацетат : метанол с последующим связыванием с HCl в присутствии метанола дает гидрохлоридную соль амина, соединение 409. Как показано на фиг.49, соединение 409 связывают с 4-бензоилбензойной кислотой при проведении защиты кислоты с помощью БОФ-Cl, реагента, который обычно используют для связывания N-метиламинов, в присутствии NMM и ДМФ при 0°С в течение 30 минут, после чего обеспечивают контакт продукта реакции с соединением 409. Удаление метильной группы омылением сложного эфира приводит к получению соединения 412.
Производное бензофенона, обозначенное как соединение 410 (см. фиг.50), подвергают удлинению цепи за счет БОФ-опосредованного связывания с линкером, представляющим собой метиловый эфир глицина, в присутствии БОФ, NMM, ДМФ и гидрохлоридной соли сложного метилового эфира глицина. Омыление сложного эфира соединения 413 в присутствии LiOH, воды, ТГФ и метанола с последующим связыванием с солью амина 409 в присутствии БОФ-Cl, NMM и ДМФ, при последующем омылении в присутствии LiOH, воды, ТГФ и метанола дает соединение 415. Соединение 417 получают аналогичным способом с использованием метилового эфира 6-аминогексаноевой кислоты. Соединение 419 получают при двойном связывании соединения 410 с метиловым эфиром 6-аминогексаноевой кислоты перед связыванием с соединением 409 с последующим омылением.
Соединения 412, 415, 417 и 419 связывают с указанной выше солью макроцикла (полученной, как описано в литературе: Mayer et al., 1994, J. Org. Chem., 59:5192-5205; Mayer et al., 1995, Acta Crystallogr., C51:1609-1614), используя БОФ-связывающий реагент, с получением соединений 403, 404, 405 и 406 соответственно, при выходе 68-81%.
Для оценки пригодности указанных соединений для фотоаффинного мечения белков, связывающих EF-1a, соединения 403, 404, 405 и 406 оценивают по их потенциальной способности ингибировать биосинтез белка. Результаты проведенной оценки даны в таблице 2. Система бесклеточной трансляции соответствует описанным ранее (SirDeshpande et al., 1995, Biochemistry, 34:9177-9184; Ahuja et al., J. Med. Chem., 2000, 43:4212-4218). В данной системе дидемнин В демонстрирует значение половинной максимальной ингибирующей концентрации (ИК50), равное 3 микромолям. Результаты, приведенные в таблице 2, показывают, что способность ингибировать биосинтез белка остается неизменной даже в том случае, когда более крупная бензофеноновая группа включается в структуру дидемнина В. Длина линкера, по всей видимости, оказывает пограничное влияние, при этом две самых коротких боковых цепи (то есть соединения 403 и 404) имеют примерно одинаковый потенциал с дидемнином В. Увеличение длины боковой цепи коррелирует с умеренным снижением ингибирующего потенциала. Указанные результаты совпадают с данными, полученными другими авторами (Sakai et al., 1996, J. Med. Chem., 39:2819-2834; Ahuja et al., J. Med. Chem., 2000, 43:4212-4218), и показывают, что ингибирование биосинтеза белка достаточно толерантно к модификации боковой цепи.
В таблице 3 приведены предварительные результаты, полученные с использованием для скрининга панели опухолевых клеток NCI-60 (описанной Boyd et al., 1995, Drug Dev. Res., 34:91-109). Результаты таблицы 3 указывают на то, что бензофеноновые фотоаффинные аналоги могут использоваться для изучения противоопухолевой активности дидемнинов. Изучение параметра 50% ингибирования роста (РИ50) показывает, что все четыре аналога сохраняют потенциал, сравнимый с потенциалом дидемнина В. В отличие от результатов, полученных для биосинтеза белка in vitro, в данном случае, скорее всего, отсутствует какое-то явное соответствие между длиной линкера и активностью. Однако полное ингибирование роста (ПРИ) четырьмя аналогами требует значительно более высоких концентраций, чем это необходимо в случае дидемнина В. Интересно, что все четыре аналога проявляют от трех до десяти раз меньшую токсичность, определяемую по значению параметра летальной концентрации LC50.
(наномоли)
(микромоли)
(микромоли)
Результаты экспериментов, представленные в данном примере, показывают, что бензофенонсодержащие аналоги дидемнинов могут быть получены в ходе полного синтеза. Биологическая оценка данных аналогов указывает, что включение бензофенона в боковую цепь пептида представляет собой несложную стратегию, подходящую для фотоаффинного мечения молекулярных мишеней дидемнинов.
Описание каждого патента, патентной заявки и публикаций, цитированных в настоящем описании, включено в него полностью в качестве ссылки.
Несмотря на то, что настоящее изобретение раскрывается со ссылкой на конкретные варианты его осуществления, другие варианты и разновидности осуществления настоящего изобретения могут быть рассмотрены специалистами в данной области без отхода от концепции и области настоящего изобретения. Прилагаемая формула изобретения включает такие варианты и соответствующие разновидности.
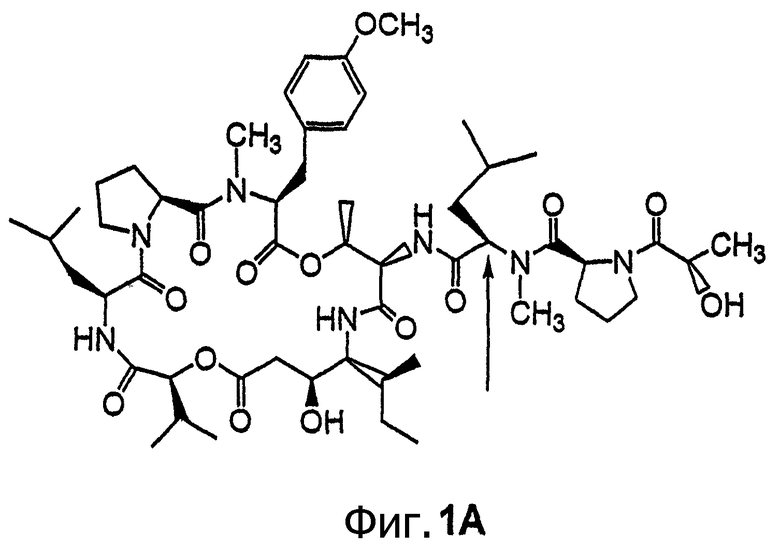
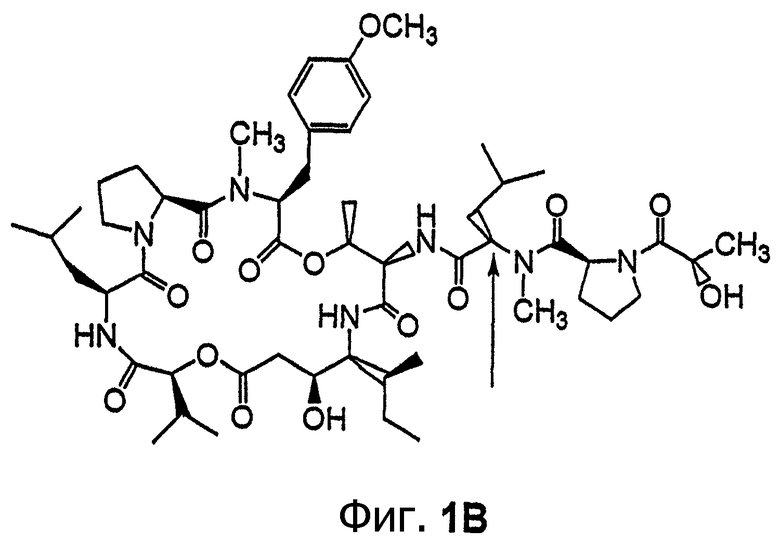
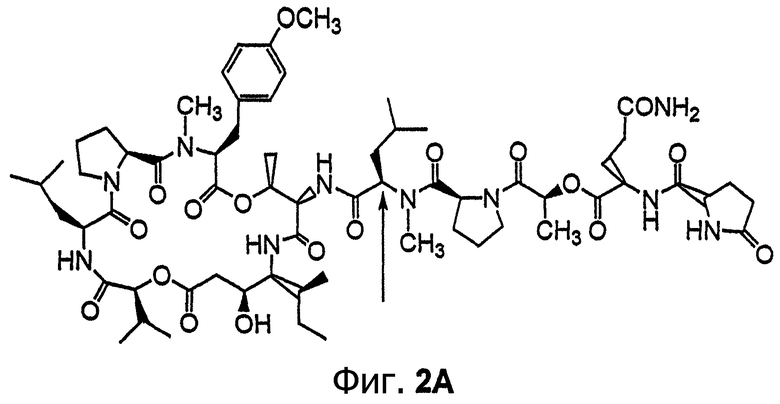
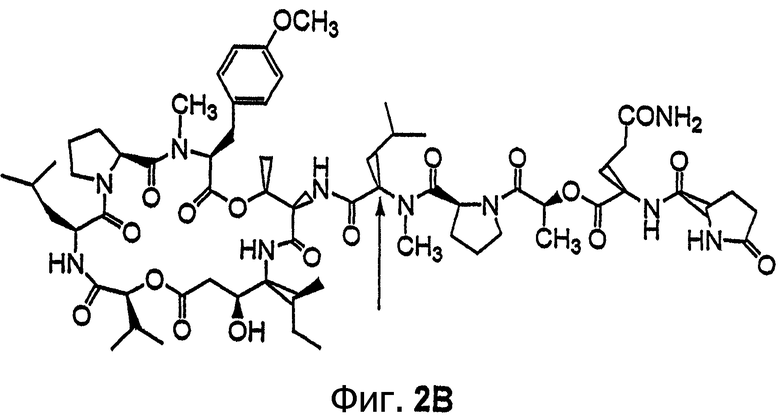
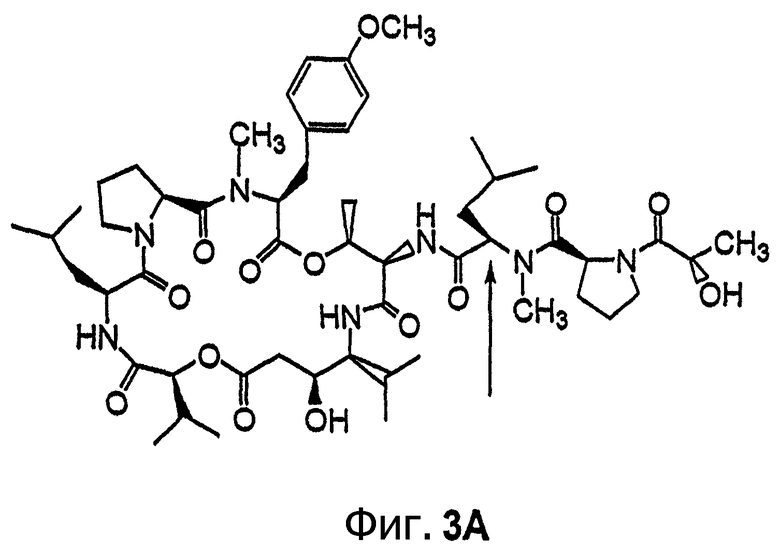
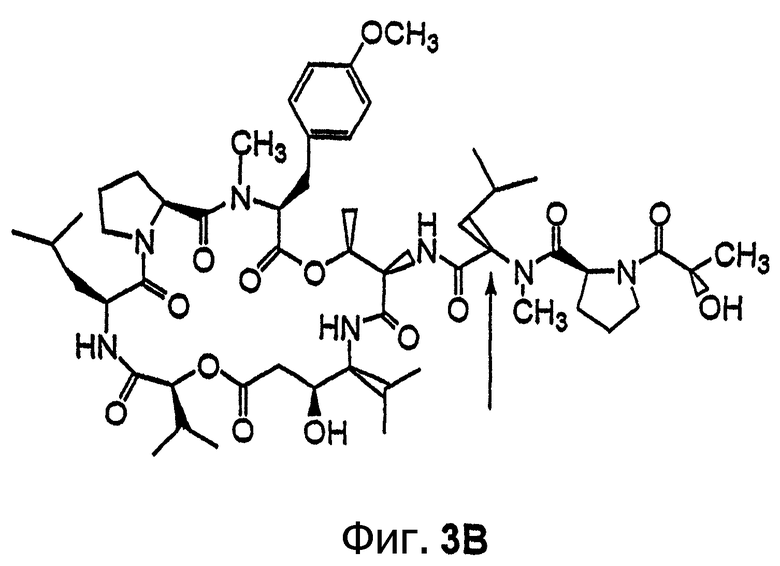
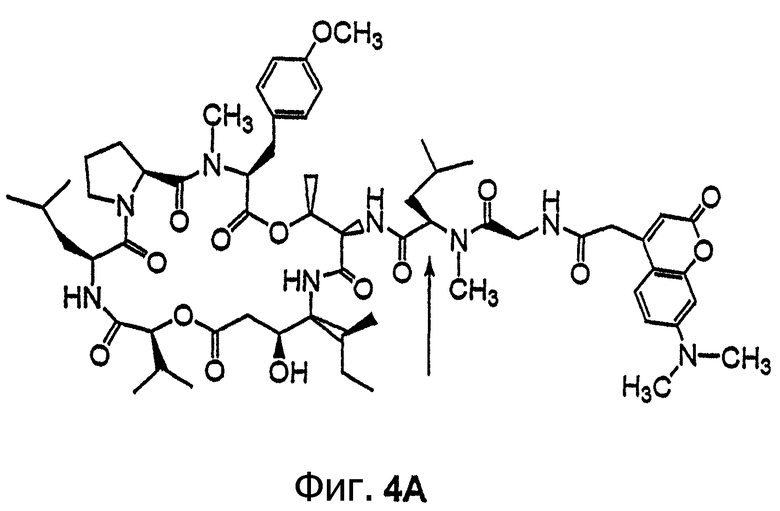
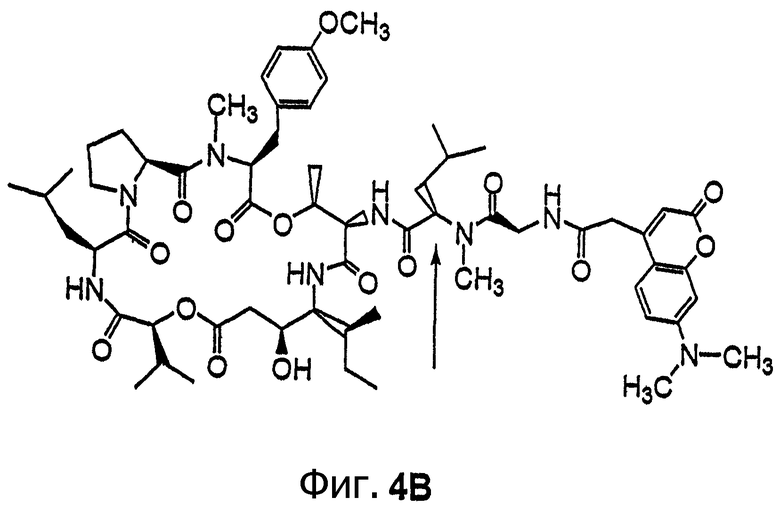
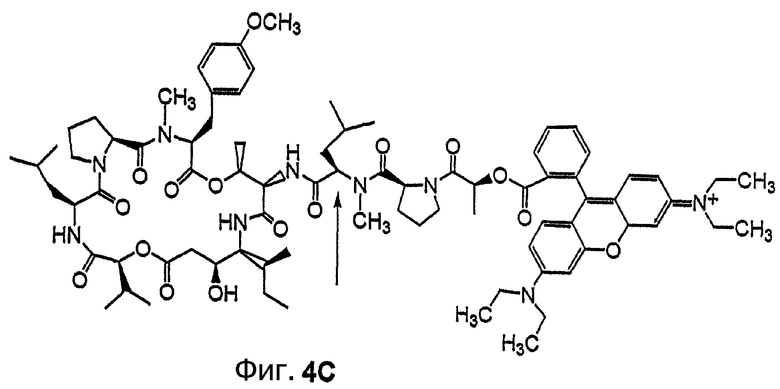
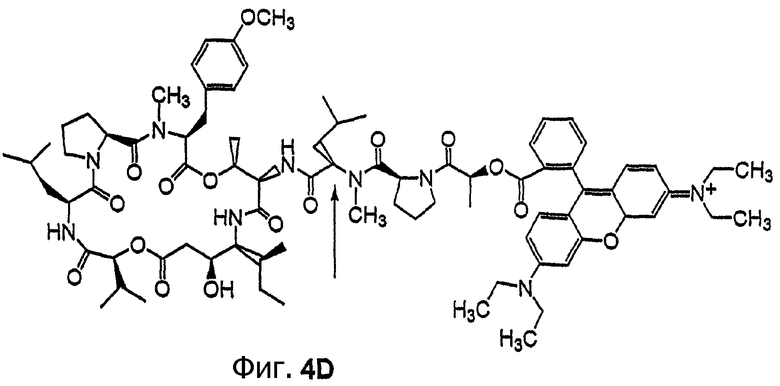
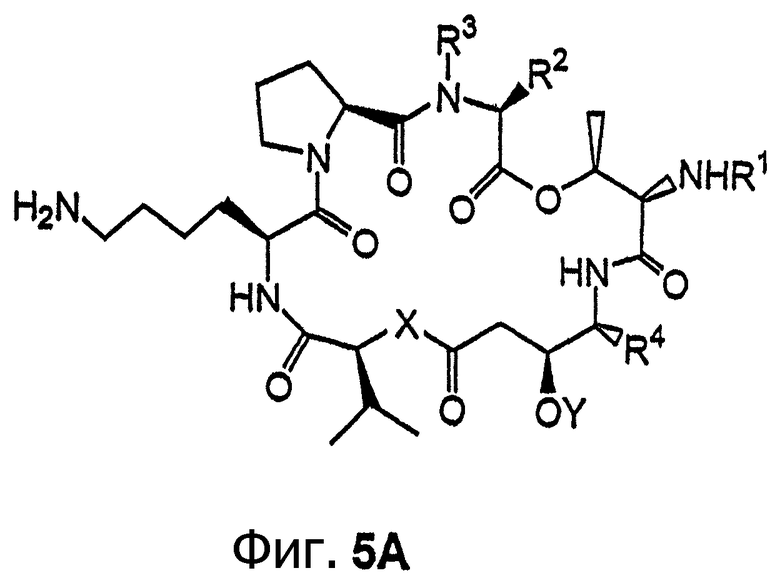
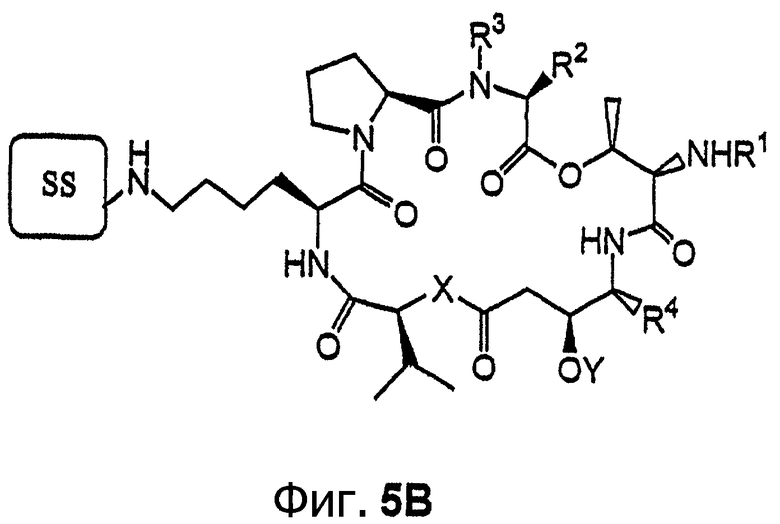
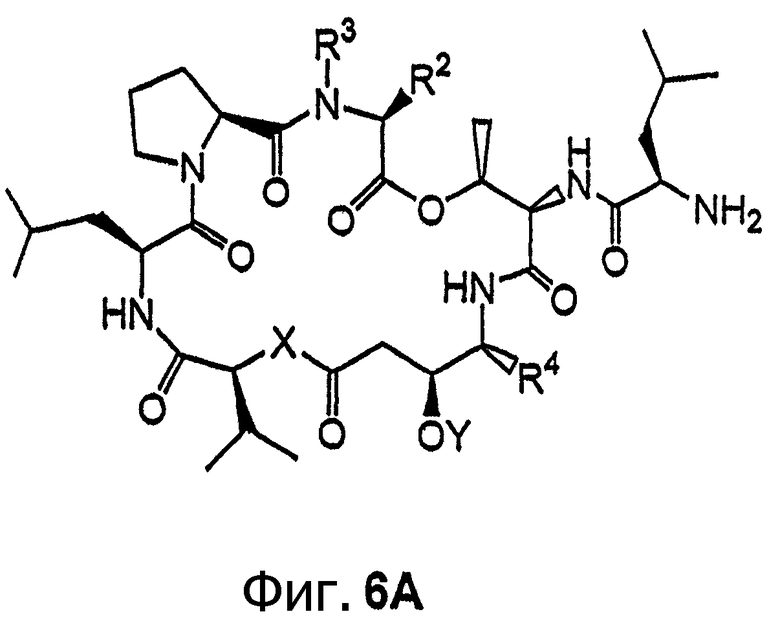
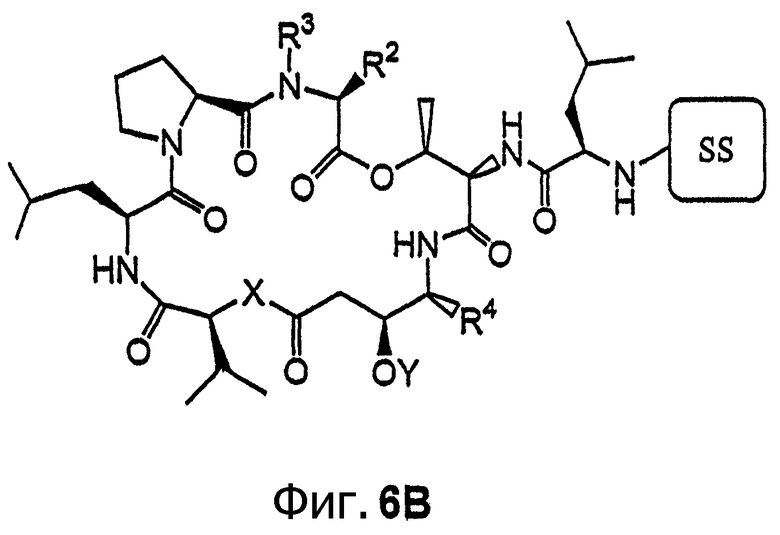
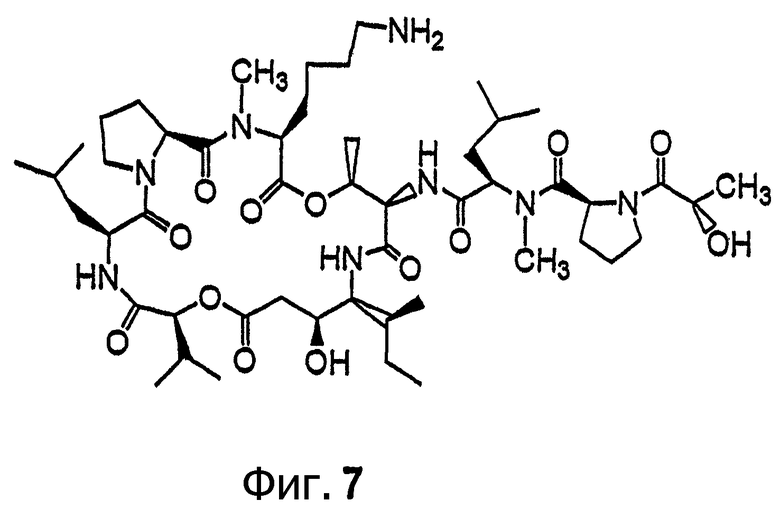
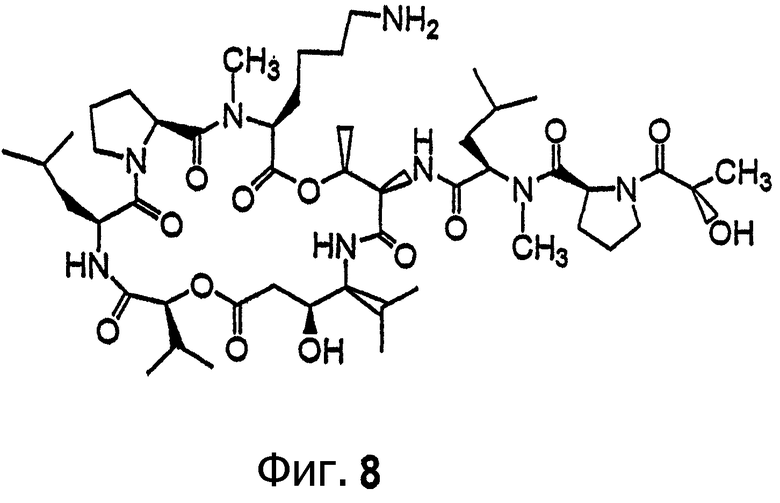
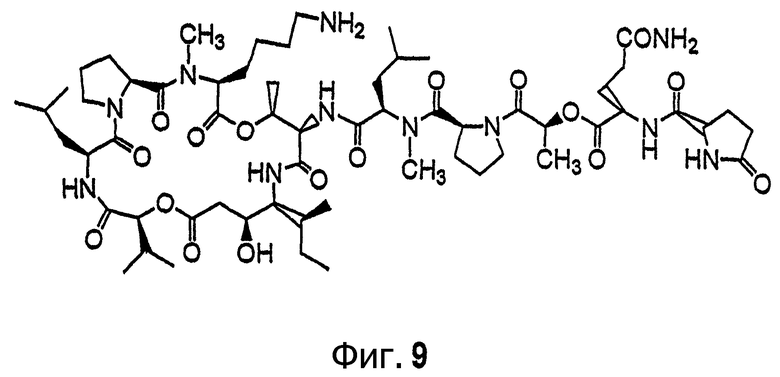
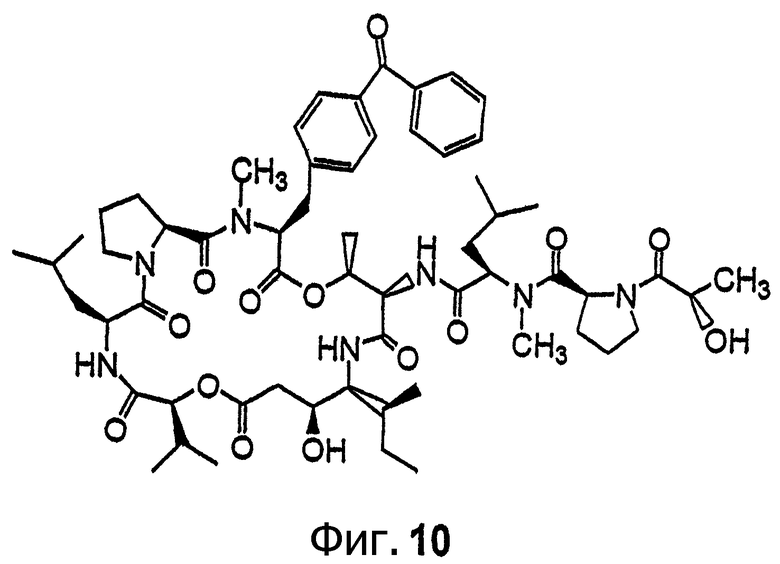
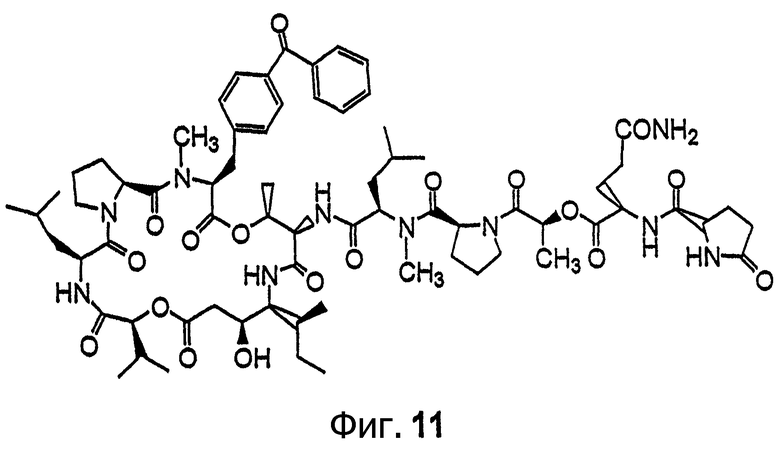
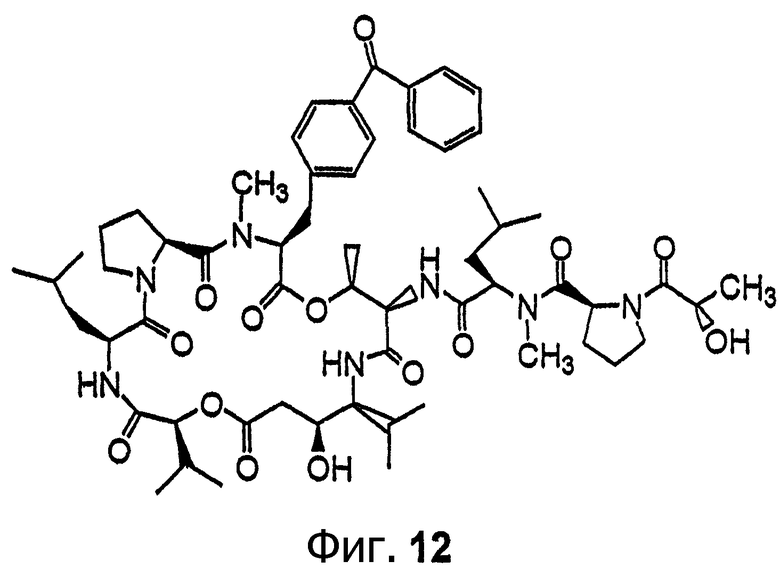
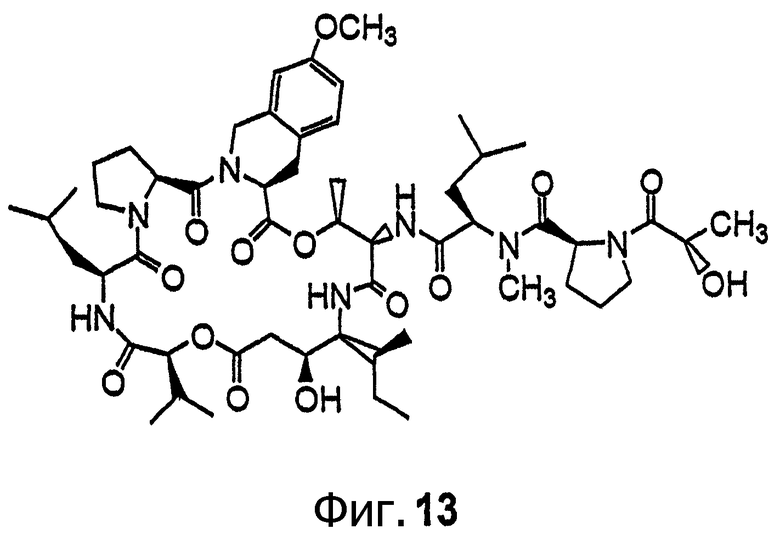
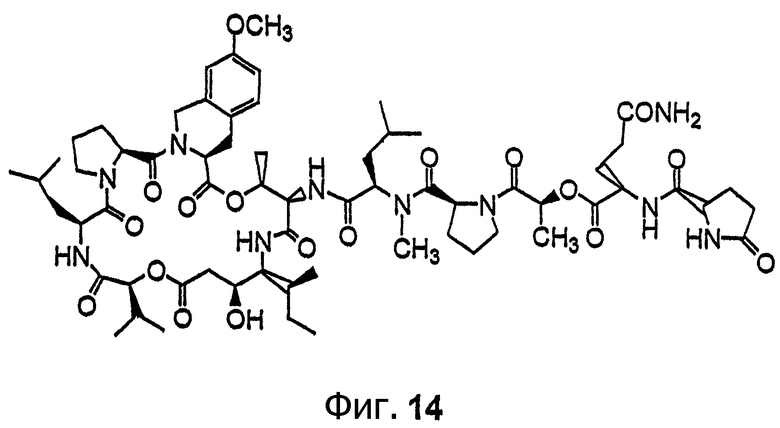
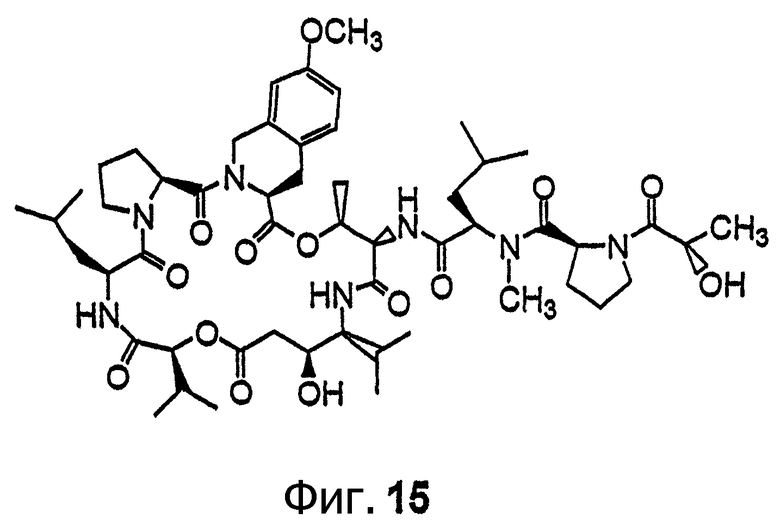
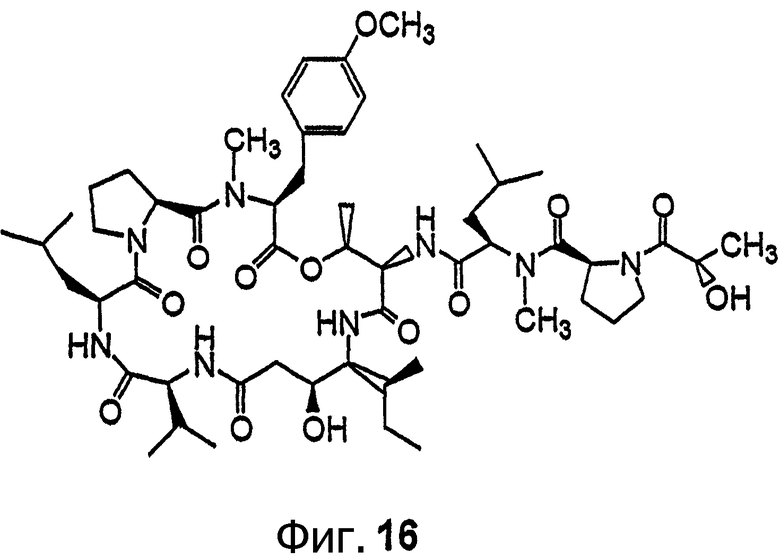
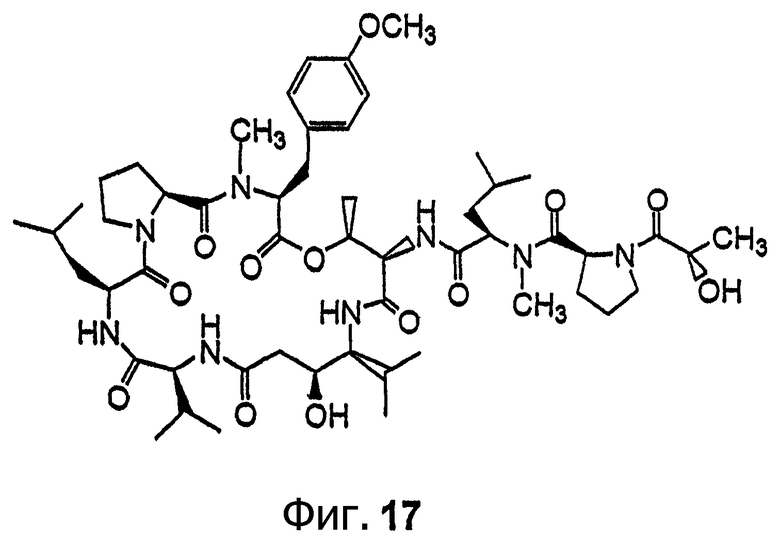
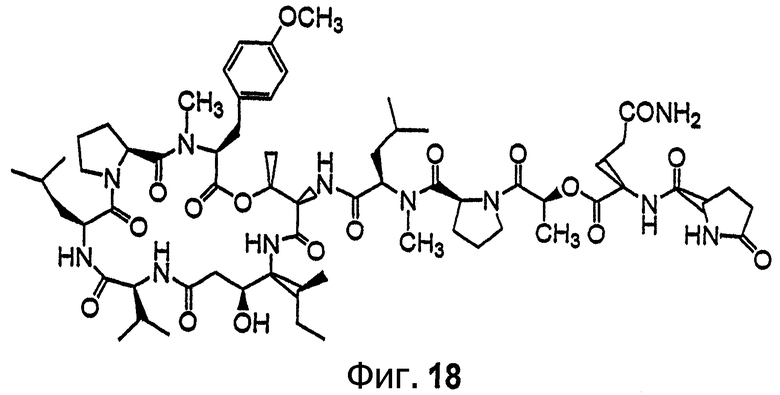
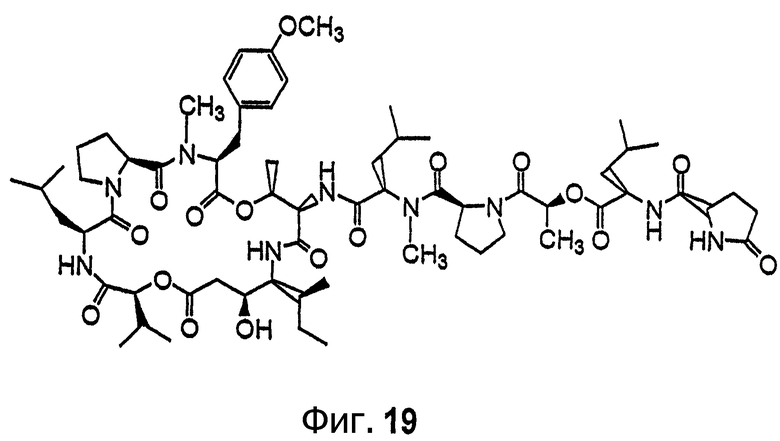
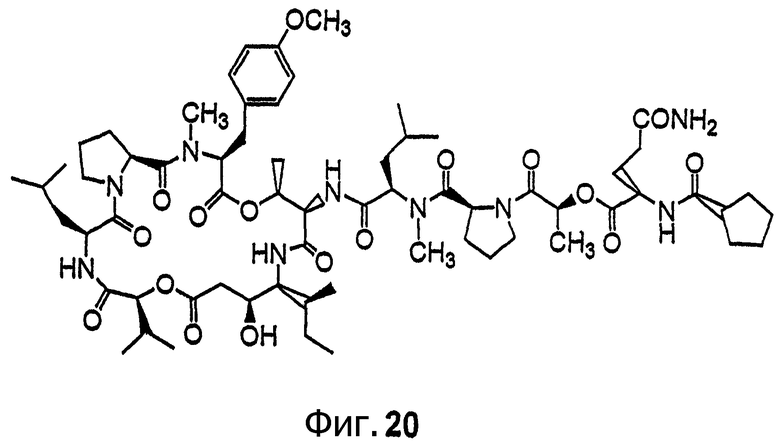
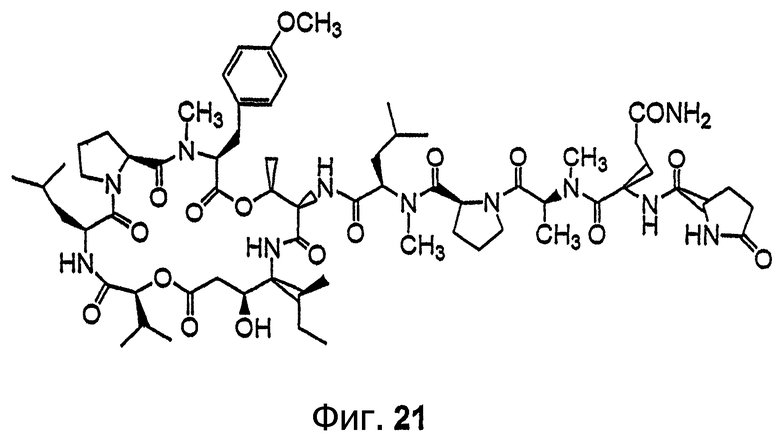
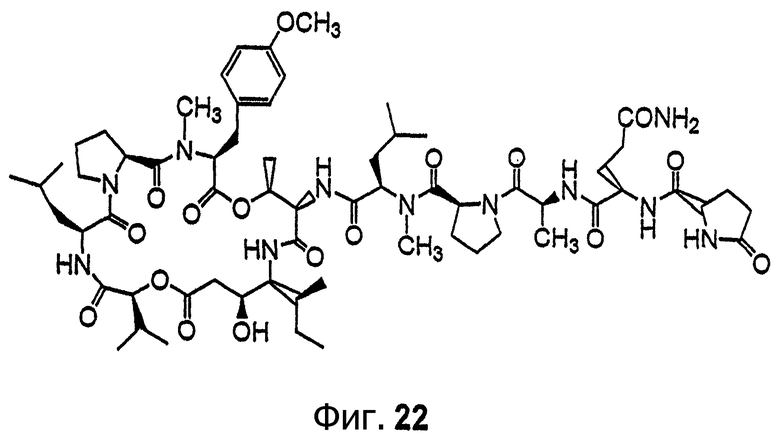
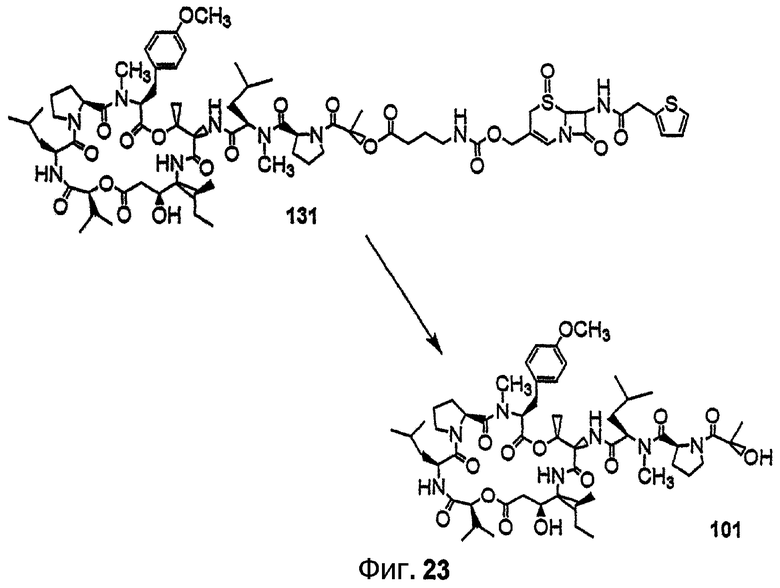
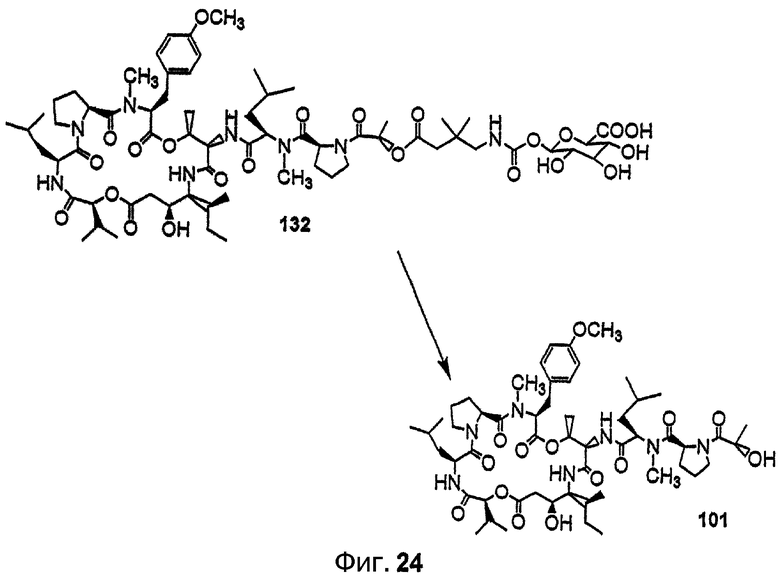
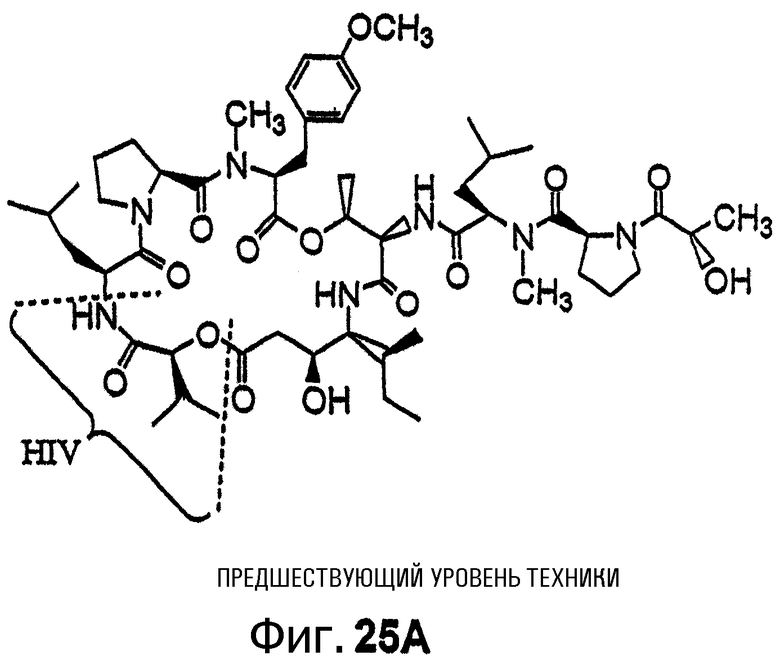

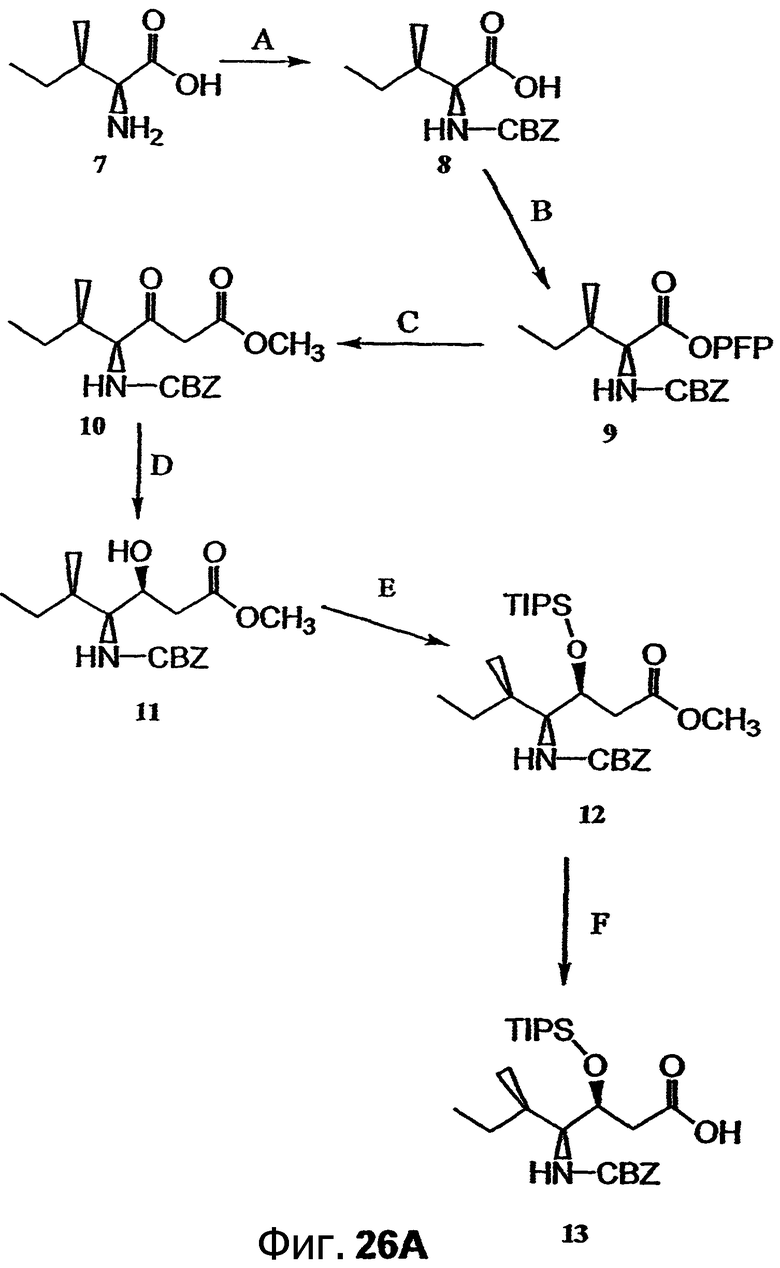
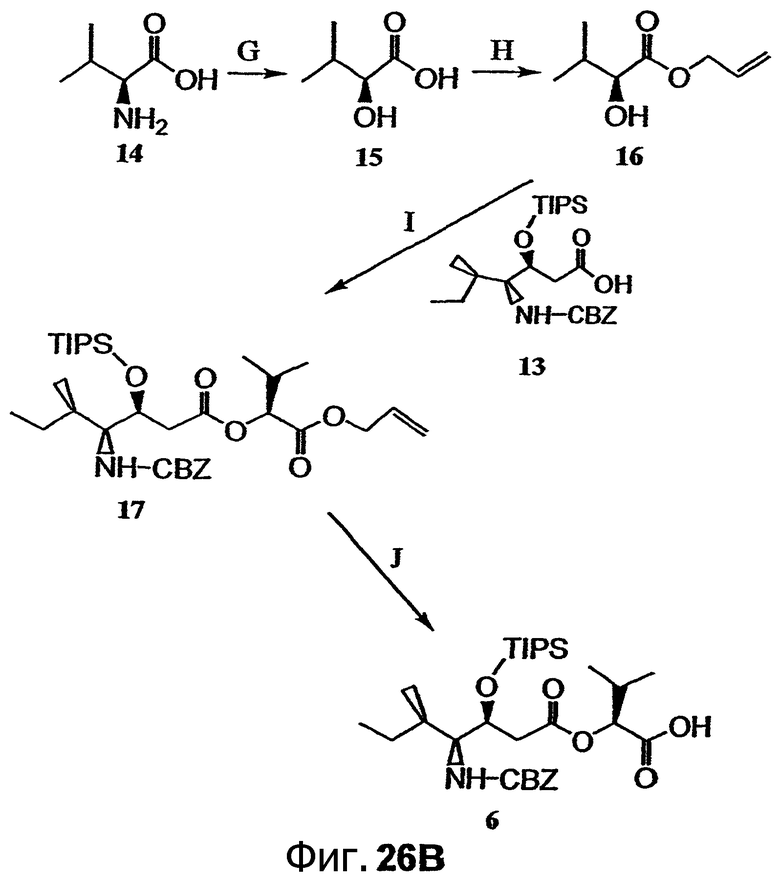
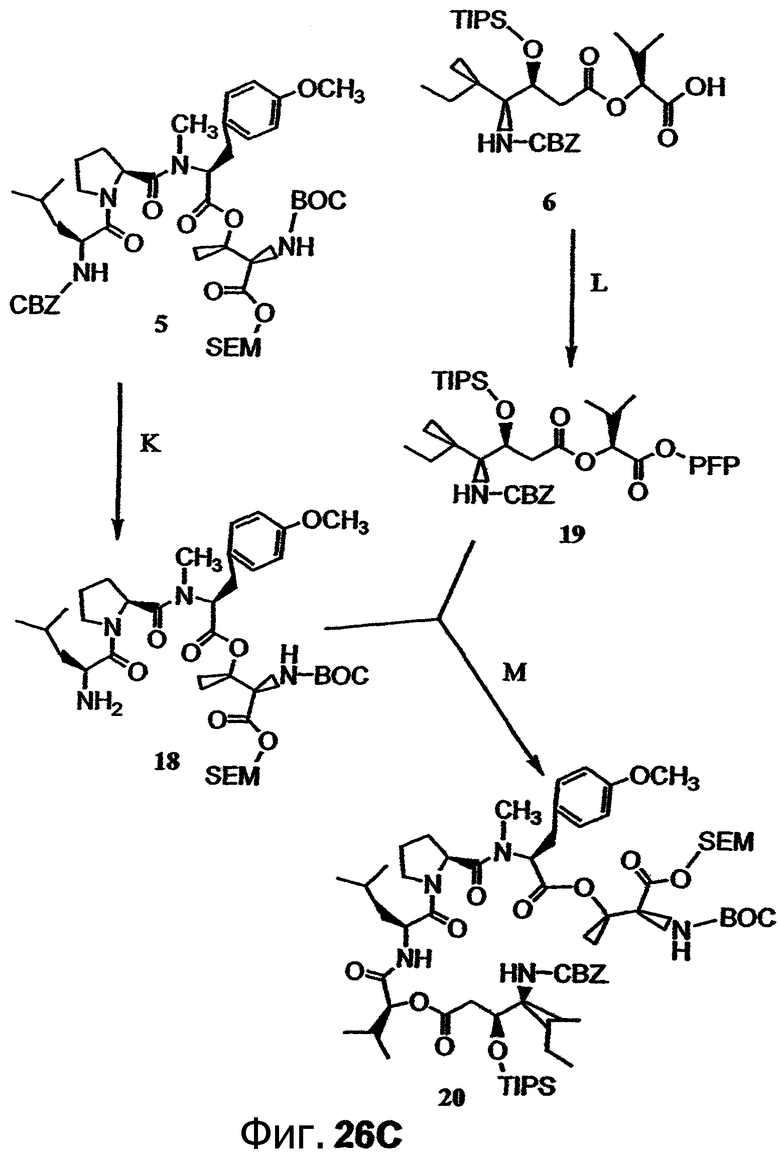

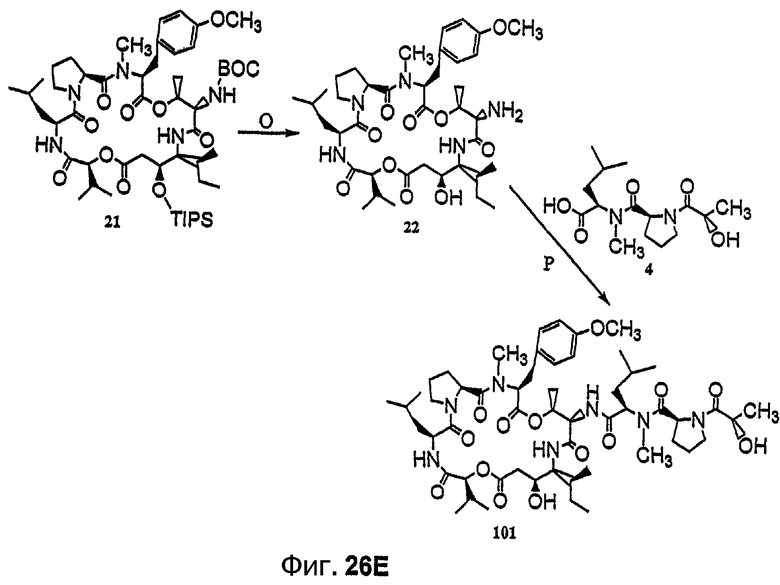
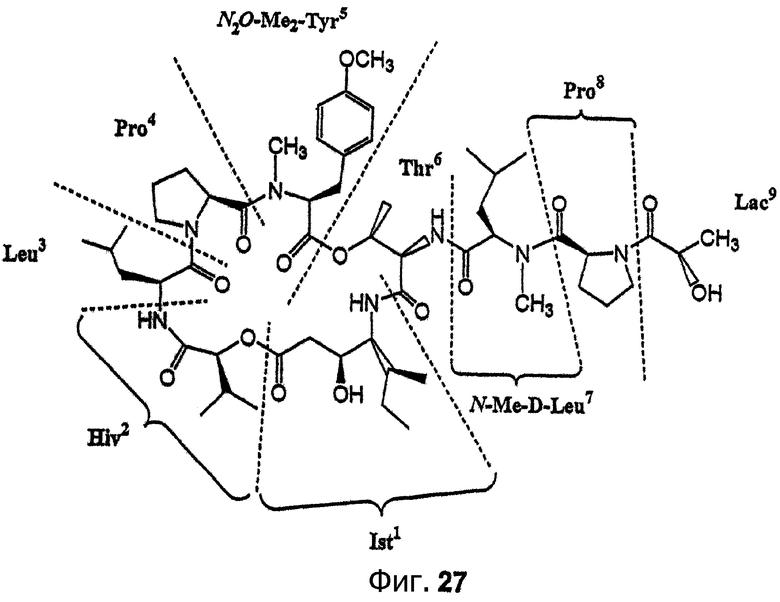
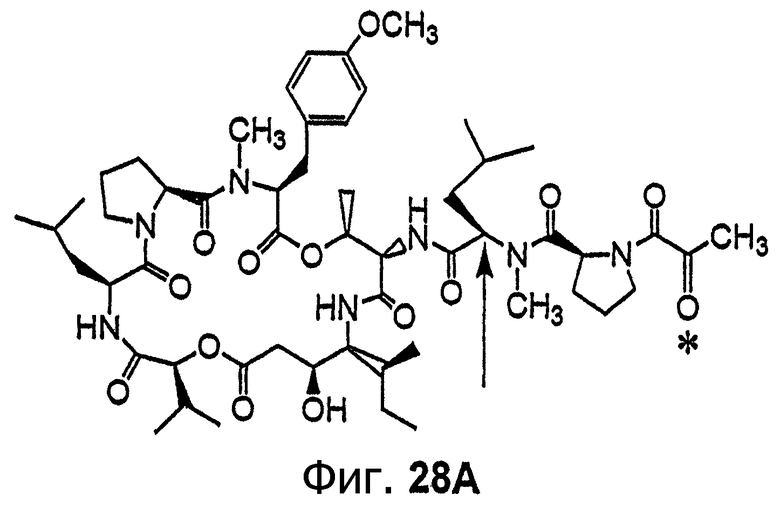
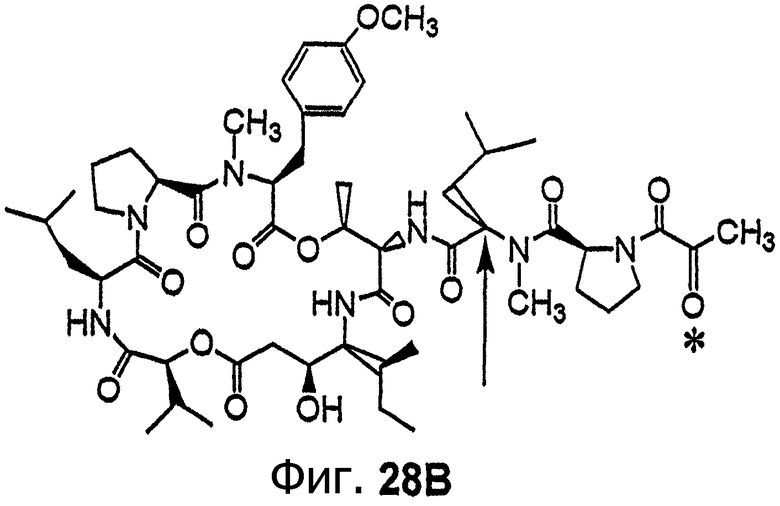
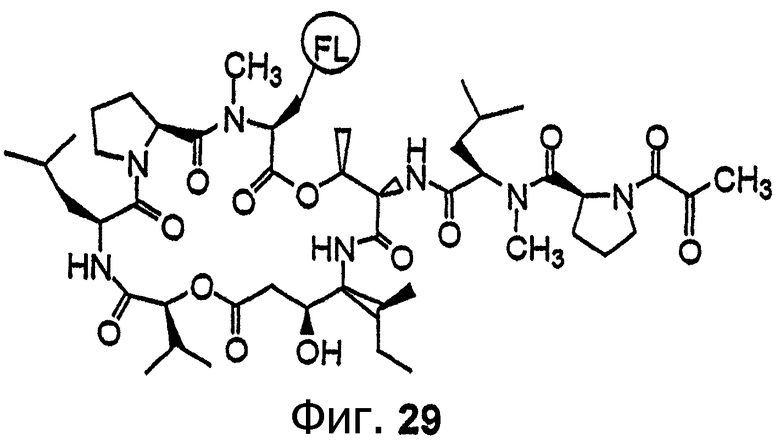
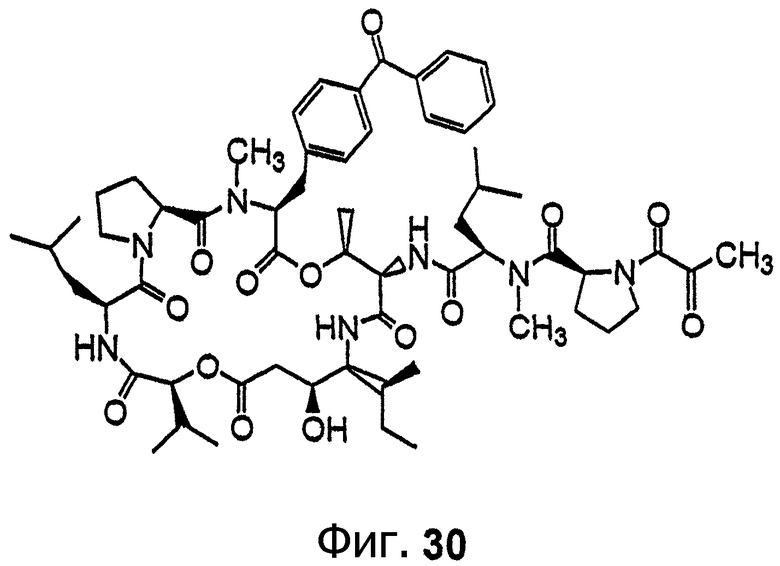
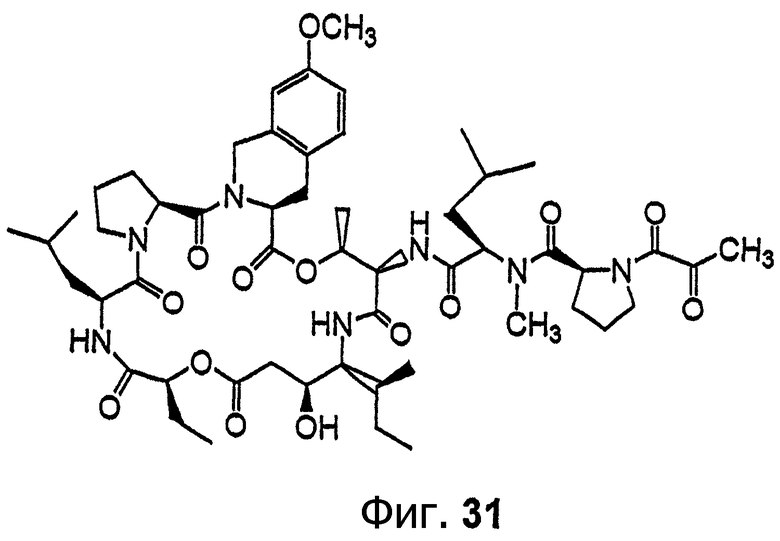
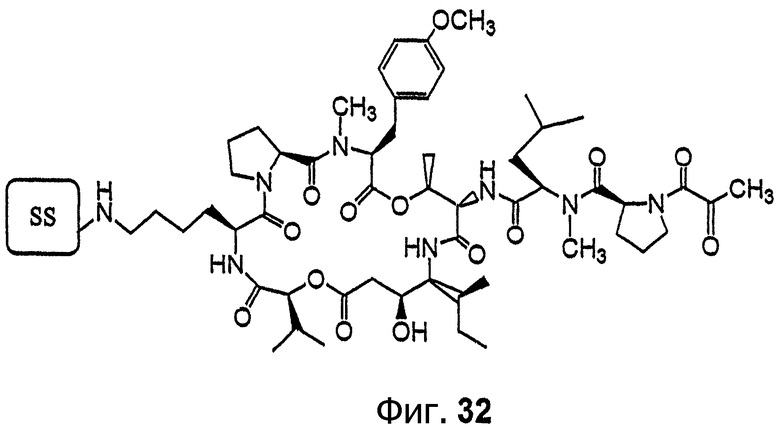
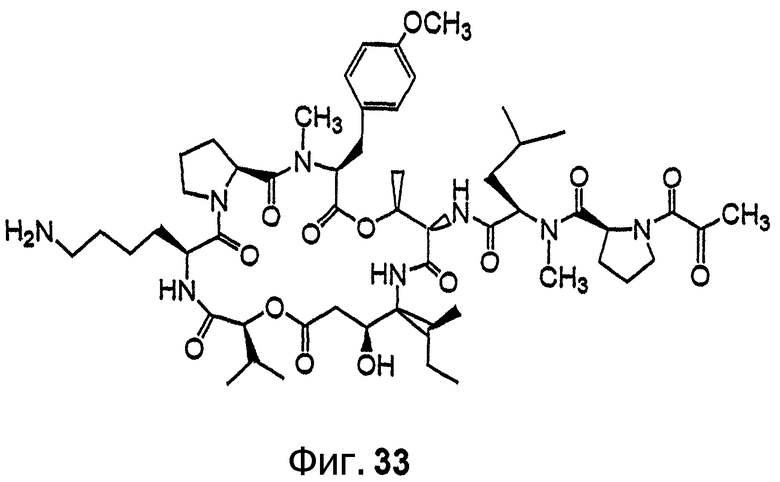
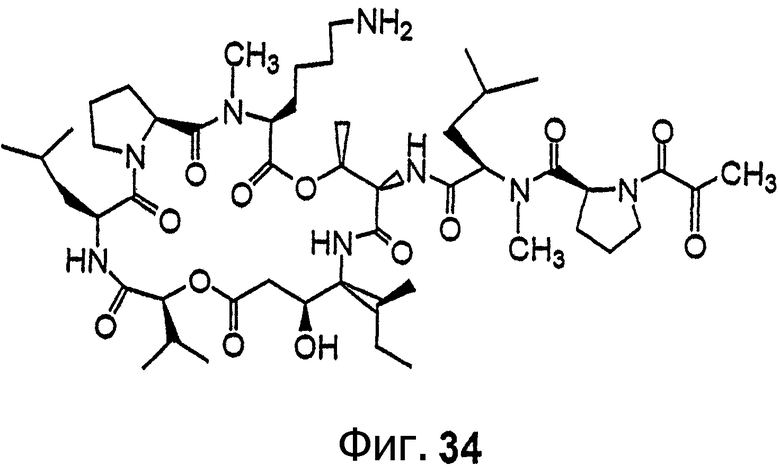
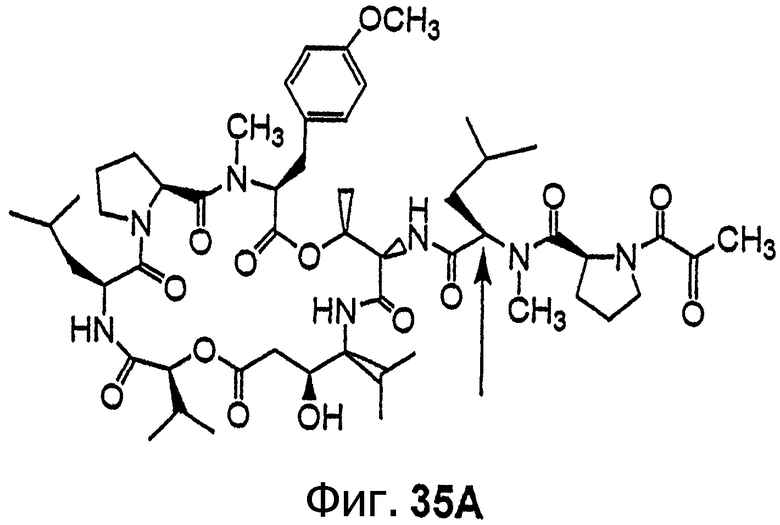
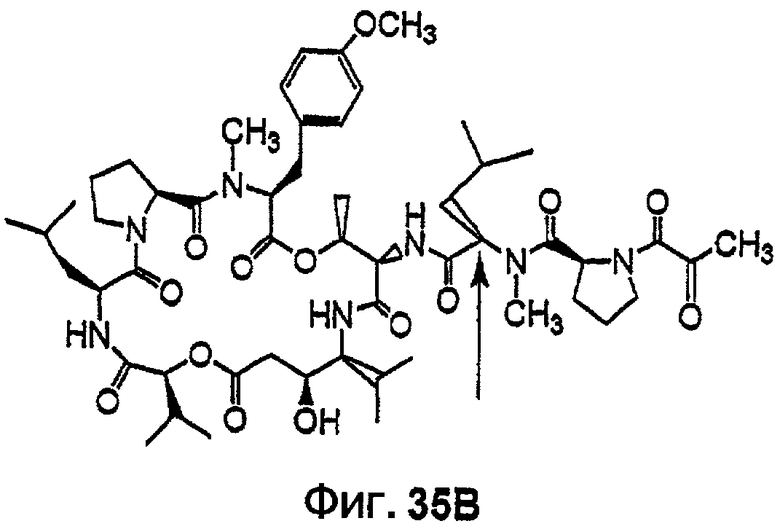
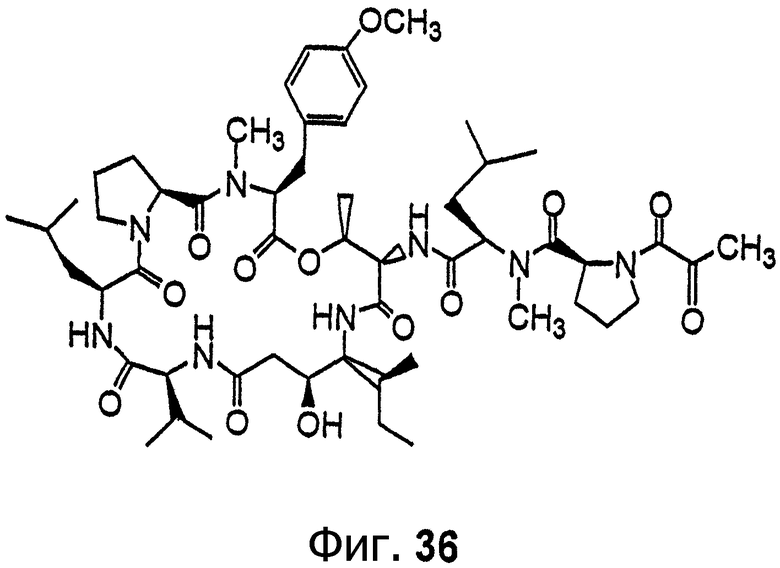
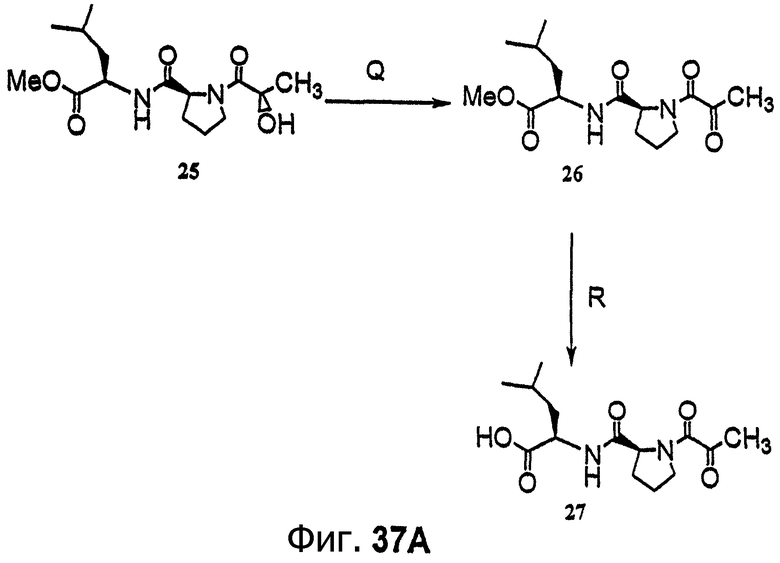
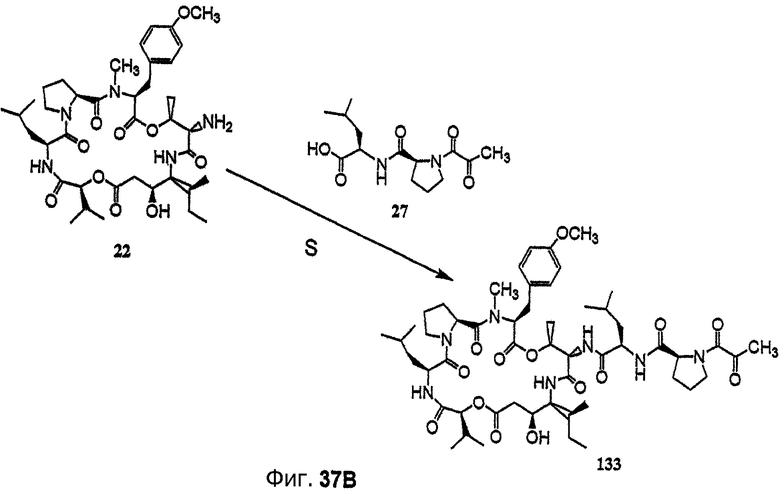
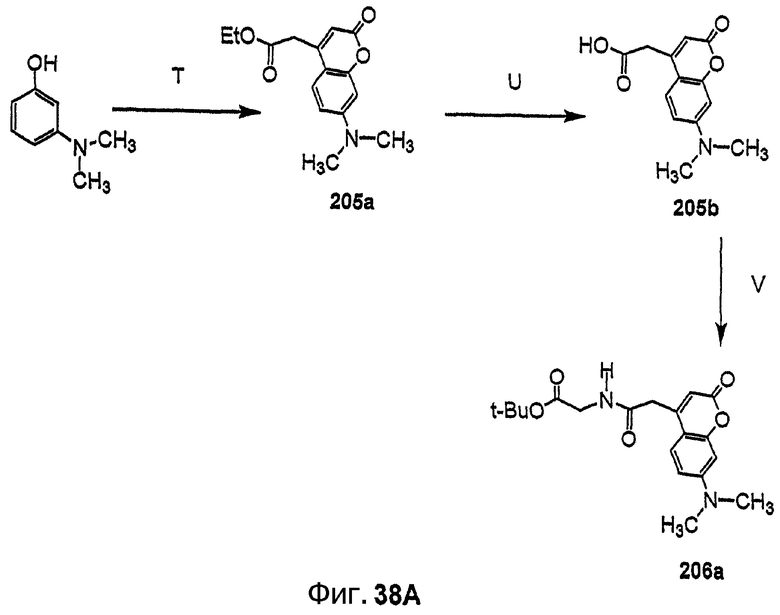
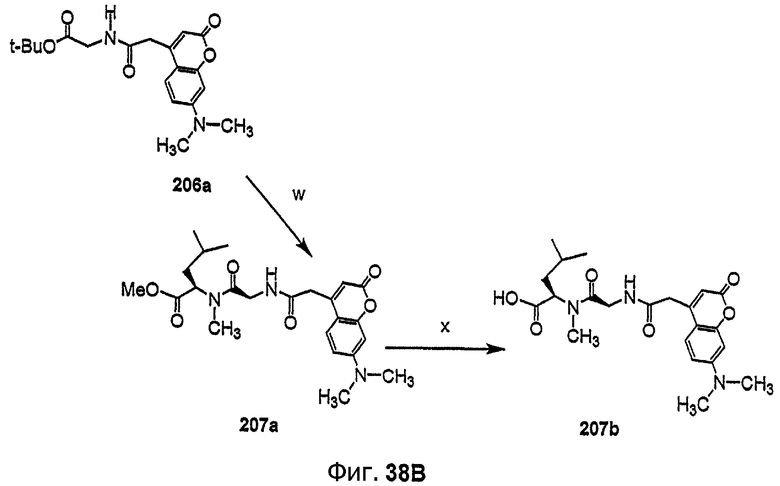
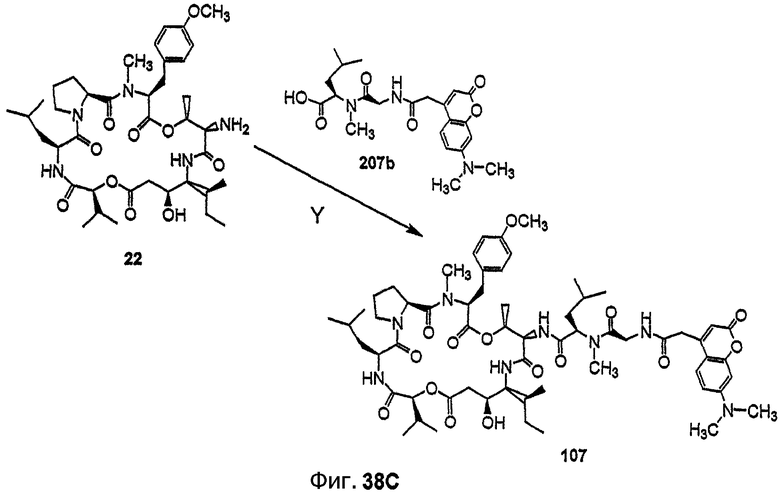
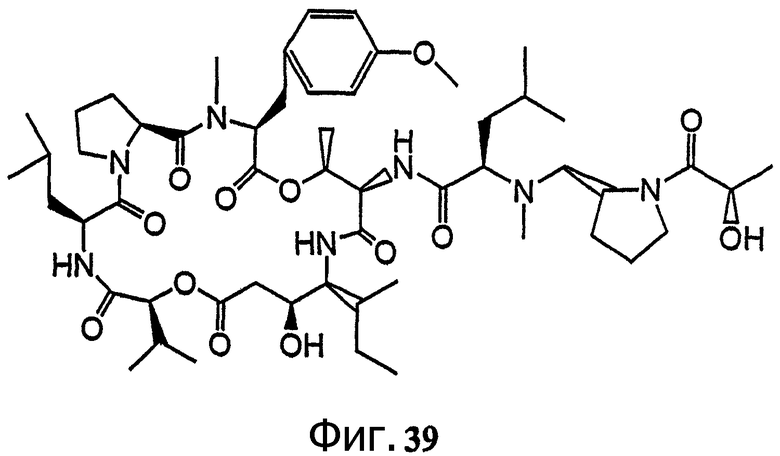
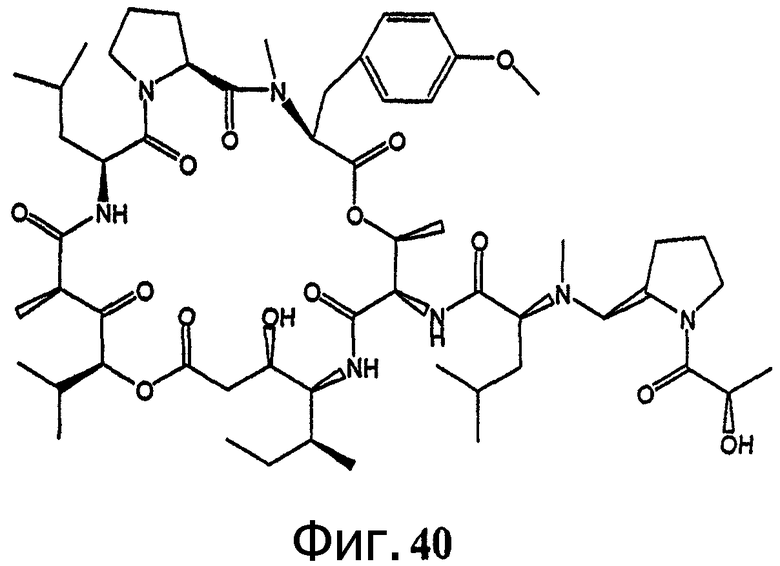
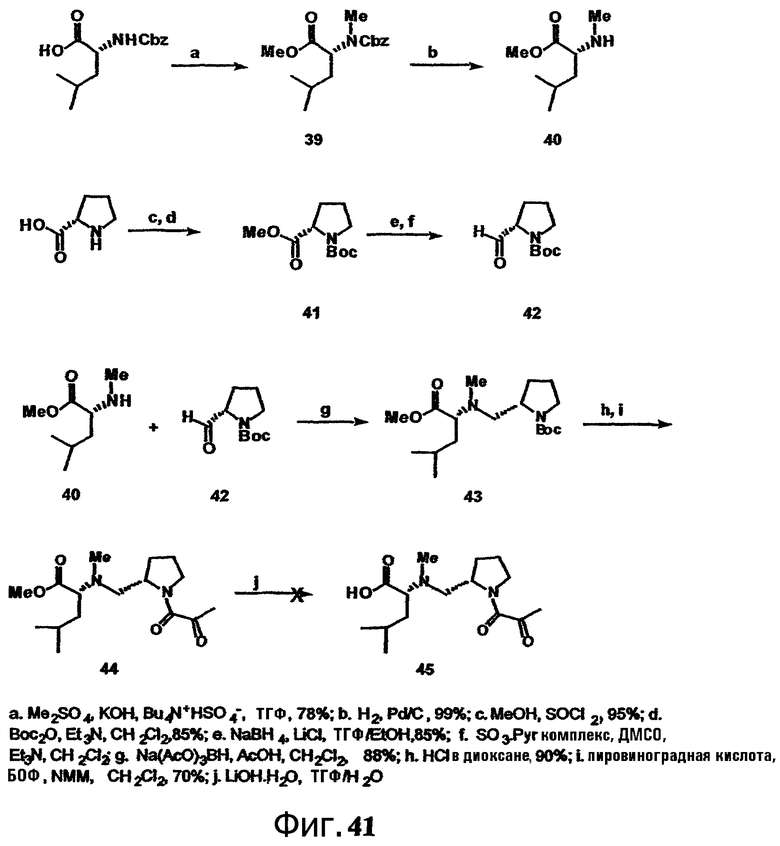
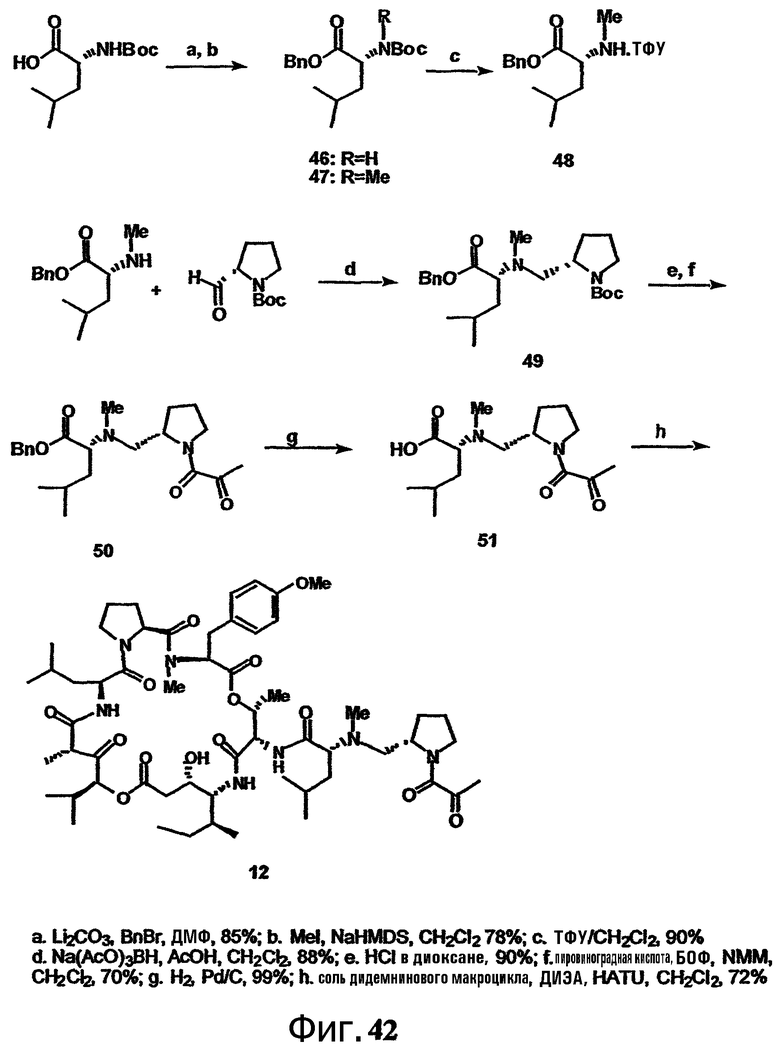
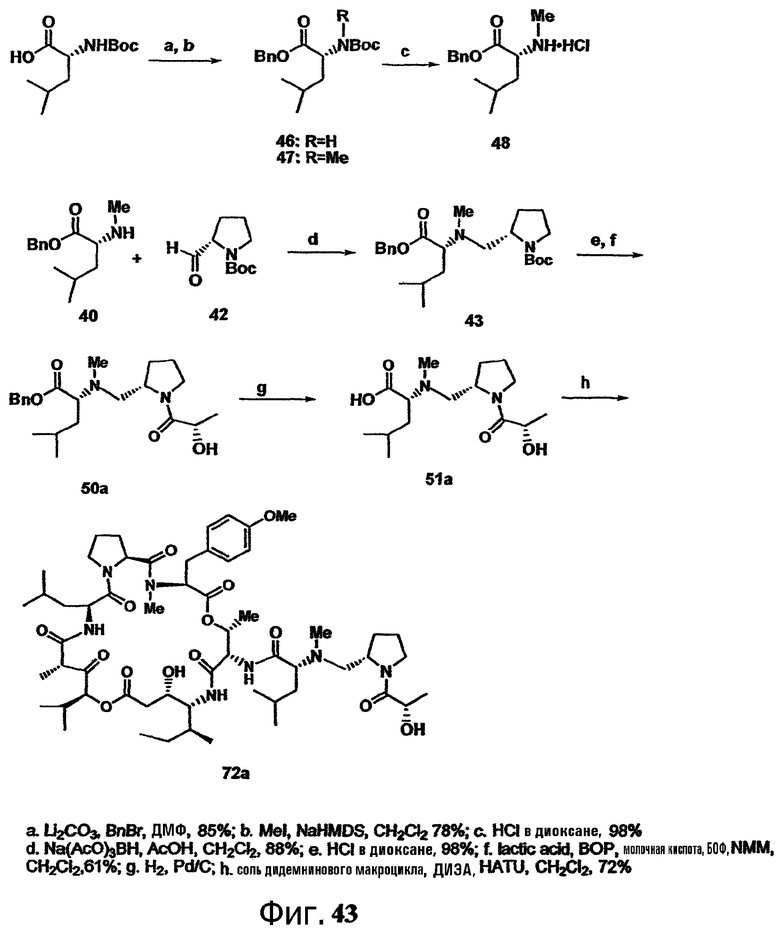
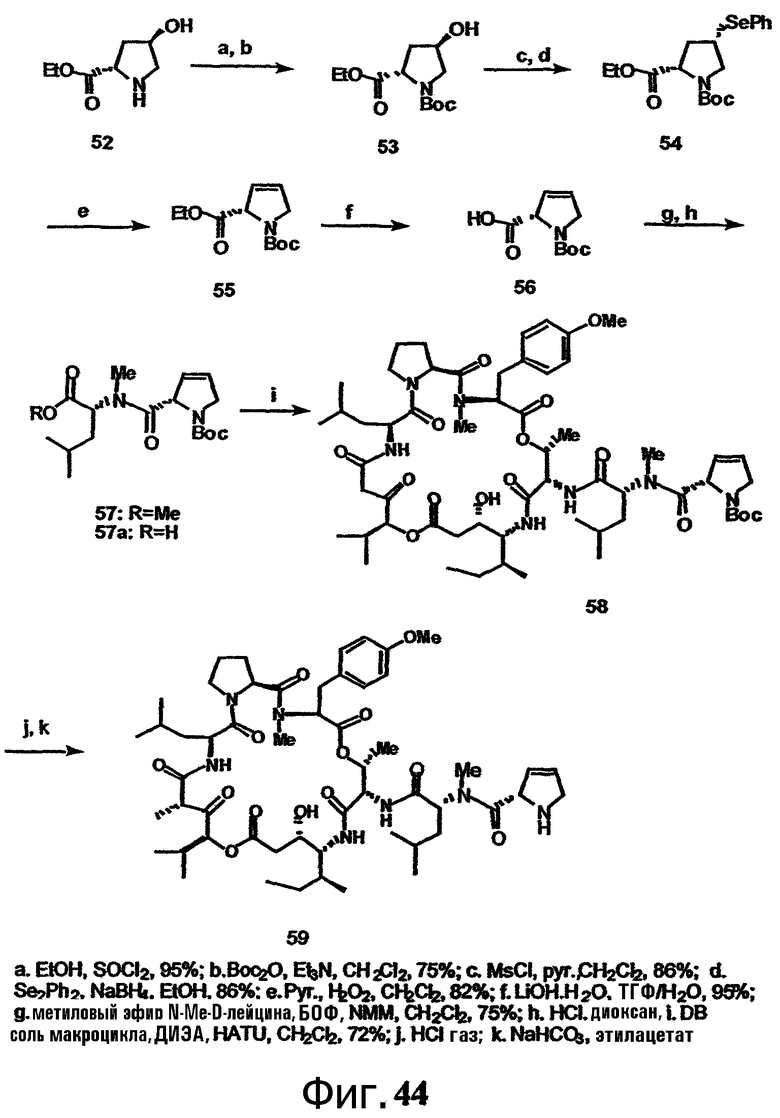
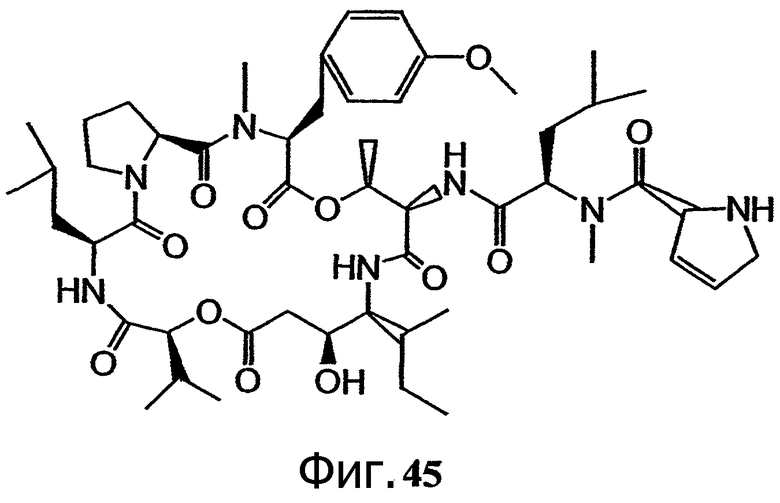
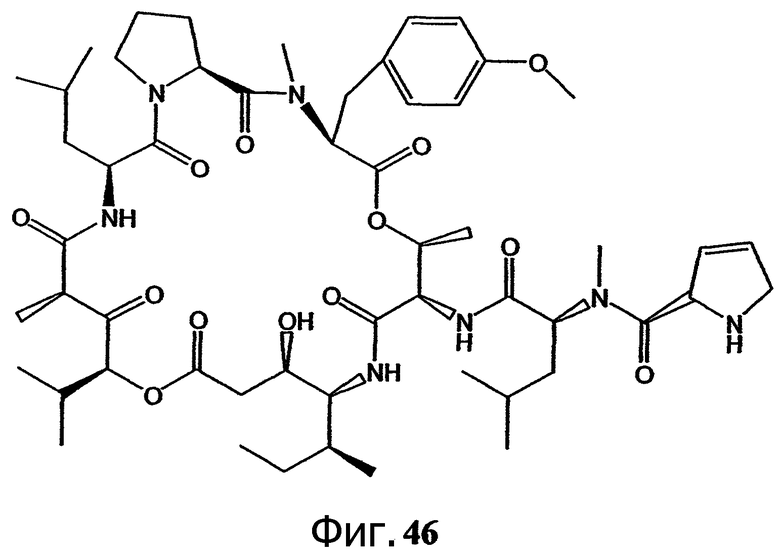
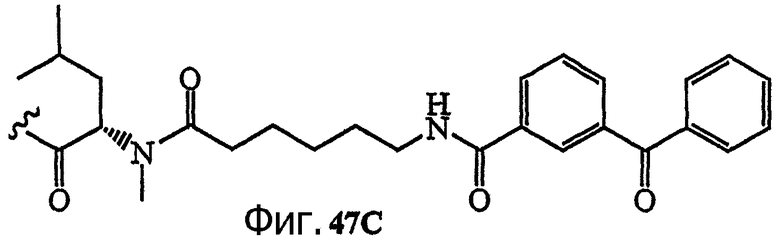
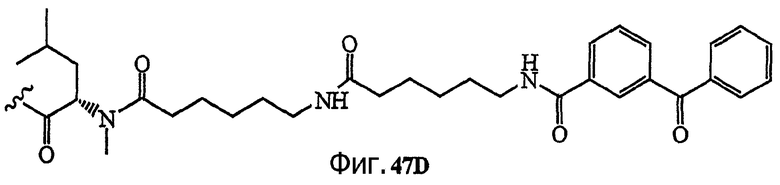
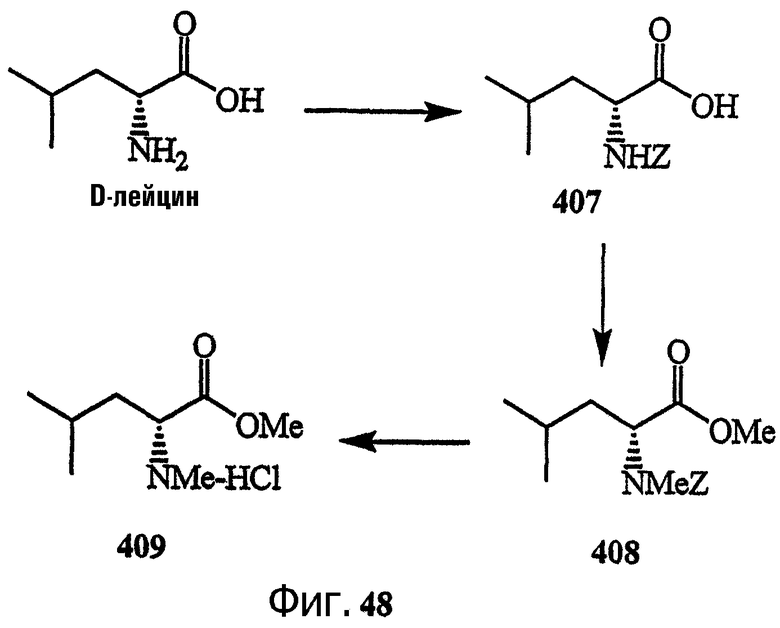
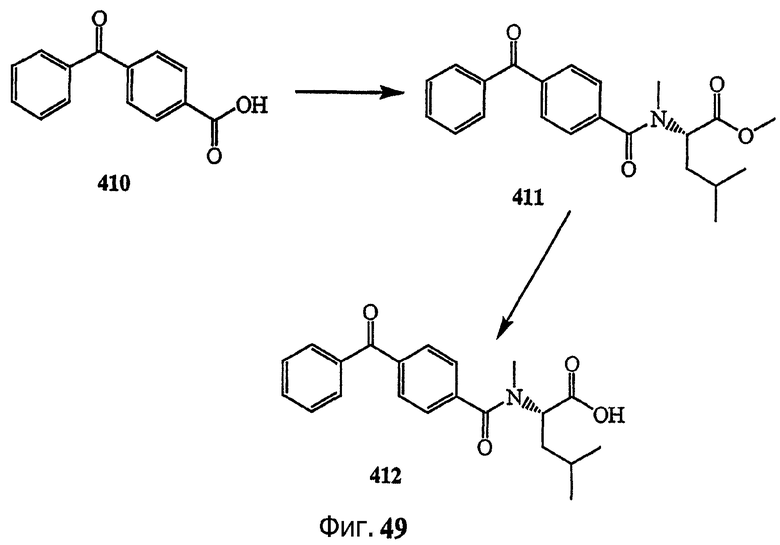
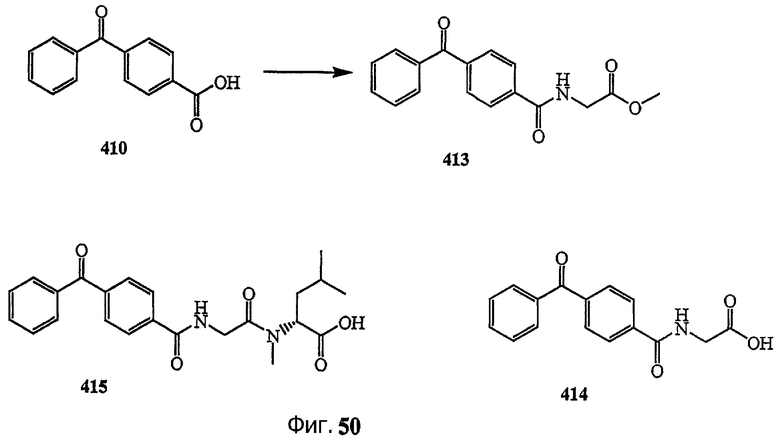
Изобретение относится к области фармакологии и медицины и касается композиции для фотоафинного мечения белков, включающей аналог тамандарина формулы (1), или аналог дидемнина формулы (2), или фрагмент дидемнина формулы (3), способа получения аналогов дидемнина, фрагмента дидемнина, подложки, содержащей аналог тамандарина или дидемнина, способа ингибирования роста или пролиферации клетки и способа ингибирования онкогенеза и апоптоза в клетке. Изобретение обеспечивает снижение токсичности и повышение терапевтического индекса. 15 н. и 52 з.п. ф-лы, 51 ил., 3 табл.
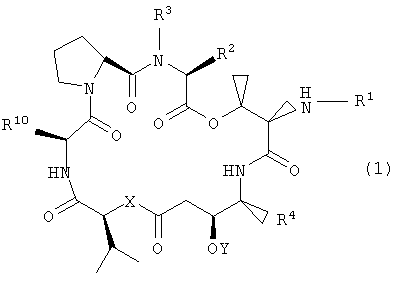
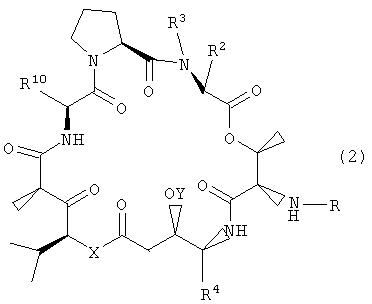
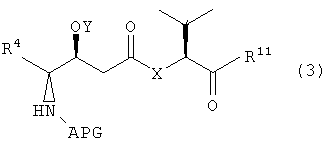
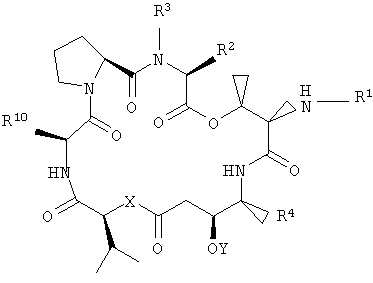
где i) R1 выбирают из группы, состоящей из
Н,
(трет-бутилоксикарбонил) а,
лейцина,
(N-метил)лейцина,
(N-метил)лейцин-(первый флуорофор) а,
(N-метил)лейцин-пролина,
(N-метил)лейцин-пролин-лактата,
(N-метил)лейцин-пролин-пирувата,
(N-метил)лейцин-пролин-лактат-(первый флуорофор) а,
(N-метил)лейцин-пролин-лактат-глутамин-пироглутамата,
(N-метил)лейцин-пролин-лактат-глутамин-циклопентаноата,
(N-метил)лейцин-пролин-аланин-лейцин-пироглутамата,
(N-метил)лейцин-пролин-(N-метил-аланин)-лейцин-пироглутамата,
(N-метил)лейцин-дезоксопролина,
(N-метил)лейцин-дезоксопролин-лактата,
(N-метил)лейцин-дезоксопролин-пирувата,
(N-метил)лейцин-дезоксопролин-лактат-(первый флуорофор) а,
(N-метил)лейцин-дезоксопролин-лактат-глутамин-пироглутамата,
(N-метил)лейцин-дезоксопролин-лактат-глутамин-циклопентаноата,
(N-метил)лейцин-дезоксопролин-аланин-лейцин-пироглутамата,
(N-метил)лейцин-дезоксопролин-(N-метил-аланин)-лейцин-пироглутамата,
(N-метил)лейцин-дегидропролина,
(N-метил)лейцин-дегидропролин-лактата,
(N-метил)лейцин-дегидропролин-пирувата,
(N-метил)лейцин-дегидропролин-лактат-(первый флуорофор) а,
(N-метил)лейцин-дегидропролин-лактат-глутамин-пироглутамата,
(N-метил)лейцин-дегидропролин-лактат-глутамин-циклопентаноата,
(N-метил)лейцин-дегидропролин-аланин-лейцин-пироглутамата и
(N-метил)лейцин-дегидропролин-(N-метил-аланин)-лейцин-пироглутамата;
ii) R2 и R3 является одним из:
(a) R2 выбирают из группы, состоящей из боковой цепи изолейцина, боковой цепи валина, боковой цепи аланина, боковой цепи норлейцина, боковой цепи норвалина, боковой цепи лейцина, боковой цепи гистидина, боковой цепи триптофана, боковой цепи аргинина, боковой цепи лизина, второго флуорофора и заместителя, имеющего структуру:
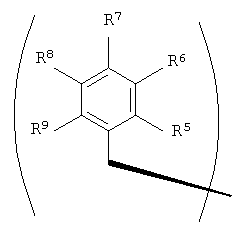 ;
;
и R3 выбирают из группы, состоящей из -СН3 и -Н; или
b) R2 и R3 вместе обозначают заместитель, имеющий структуру
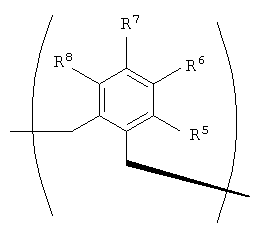 ;
;
iii) каждый из R5, R6, R7, R8 и R9, если они присутствуют, независимо выбирают из группы, состоящей из -Н, -ОН, -ОСН3, -СО(С6Н5), -Br, -I, -F, -Cl, -СН3 и -C2H5;
iv) R4 выбирают из группы, состоящей из боковой цепи изолейцина и боковой цепи валина;
v) X выбирают из группы, состоящей из -О- и -(NH)-;
vi) Y выбирают из группы, состоящей из -Н и защитной группы для гидроксила;
vii) R10 выбирают из группы, состоящей из боковой цепи лейцина и боковой цепи лизина, и
viii) молекула не явлется тамандарином А или тамандарином В.
Н,
(трет-бутилоксикарбонил) а,
лейцина,
(N-метил)лейцина,
(N-метил)лейцин-(первый флуорофор) а,
(N-метил)лейцин-(S)пролина,
(N-метил)лейцин-(S)пролин-(S)лактата,
(N-метил)лейцин-(S)пролин-пирувата,
(N-метил)лейцин-(S)пролин-(S)лактат-(первый флуорофор) а,
(N-метил)лейцин-(S)пролин-(S)лактат-глутамин-пироглутамата,
(N-метил)лейцин-(S)пролин-(S)лактат-глутамин-циклопентаноата,
(N-метил)лейцин-(S)пролин-аланин-лейцин-пироглутамата,
(N-метил)лейцин-(S)пролин-(N-метил-аланин)-лейцин-пироглутамата,
(N-метил)лейцин-дезоксо-(S)пролина,
(N-метил)лейцин-дезоксо-(S)пролин-(S)лактата,
(N-метил)лейцин-дезоксо-(S)пролин-пирувата,
(N-метил)лейцин-дезоксо-(S)пролин-(S)лактат-(первый флуорофор) а,
(N-метил)лейцин-дезоксо-(S)пролин-(S)лактат-глутамин-пироглутамата,
(N-метил)лейцин-дезоксо-(S)пролин-(S)лактат-глутамин-циклопентаноата,
(N-метил)лейцин-дезоксо-(S)пролин-аланин-лейцин-пироглутамата,
(N-метил)лейцин-дезоксо-(S)пролин-(N-метил-аланин)-лейцин-пироглутамата,
(N-метил)лейцин-дегидро-(S)пролина,
(N-метил)лейцин-дегидро-(S)пролин-(S)лактата,
(N-метил)лейцин-дегидро-(S)пролин-пирувата,
(N-метил)лейцин-дегидро-(S)пролин-(S)лактат-(первый флуорофор) а,
(N-метил)лейцин-дегидро-(S)пролин-(S)лактат-глутамин-пироглутамата,
(N-метил)лейцин-дегидро-(S)пролин-(S)лактат-глутамин-циклопентаноата,
(N-метил)лейцин-дегидро-(S)пролин-аланин-лейцин-пироглутамата и
(N-метил)лейцин-дегидро-(S)пролин-(N-метил-аланин)-лейцин-пироглутамата.
Н,
(трет-бутилоксикарбонил) а,
лейцина,
(N-метил)лейцина,
(N-метил)лейцин-(первый флуорофор) а,
(N-метил)лейцин-(S)пролина,
(N-метил)лейцин-(S)пролин-(S)лактата,
(N-метил)лейцин-(S)пролин-пирувата,
(N-метил)лейцин-(S)пролин-(S)лактат-(первый флуорофор) а,
(N-метил)лейцин-(S)пролин-(S)лактат-(S)глутамин-(S)пироглутамата,
(N-метил)лейцин-(S)пролин-(S)лактат-(S)глутамин-(S)циклопентаноата,
(N-метил)лейцин-(S)пролин-(S)аланин-(S)лейцин-(S)пироглутамата,
(N-метил)лейцин-(S)пролин-(N-метил-S-аланин)-(S)лейцин-(S)пироглутамата,
(N-метил)лейцин-дезоксо-(S)пролина,
(N-метил)лейцин-дезоксо-(S)пролин-(S)лактата,
(N-метил)лейцин-дезоксо-(S)пролин-пирувата,
(N-метил)лейцин-дезоксо-(S)пролин-(S)лактат-(первый флуорофор) а,
(N-метил)лейцин-дезоксо-(S)пролин-(S)лактат-(S)глутамин-(S)пироглутамата,
(N-метил)лейцин-дезоксо-(S)пролин-(S)лактат-(S)глутамин-(S)циклопентаноата,
(N-метил)лейцин-дезоксо-(S)пролин-(S)аланин-(S)лейцин-(S)пироглутамата,
(N-метил)лейцин-дезоксо-(S)пролин-(N-метил-S-аланин)-(S)лейцин-(S)пироглутамата,
(N-метил)лейцин-дегидро-(S)пролина,
(N-метил)лейцин-дегидро-(S)пролин-(S)лактата,
(N-метил)лейцин-дегидро-(S)пролин-пирувата,
(N-метил)лейцин-дегидро-(S)пролин-(S)лактат-(первый флуорофор) а,
(N-метил)лейцин-дегидро-(S)пролин-(S)лактат-(S)глутамин-(S)пироглутамата,
(N-метил)лейцин-дегидро-(S)пролин-(S)лактат-(S)глутамин-(S)циклопентаноата,
(N-метил)лейцин-дегидро-(S)пролин-(S)аланин-(S)лейцин-(S)пироглутамата и
(N-метил)лейцин-дегидро-(S)пролин-(N-метил-аланин)-(S)лейцин-(S)пироглутамата.
 ;
;
R3 обозначает метил, R4 обозначает боковую цепь изолейцина, каждый из R5, R6, R8 и R9 обозначает гидридный радикал, R7 обозначает метокси, R10 обозначает боковую цепь лейцина, Х обозначает -О- и Y обозначает гидридный радикал.
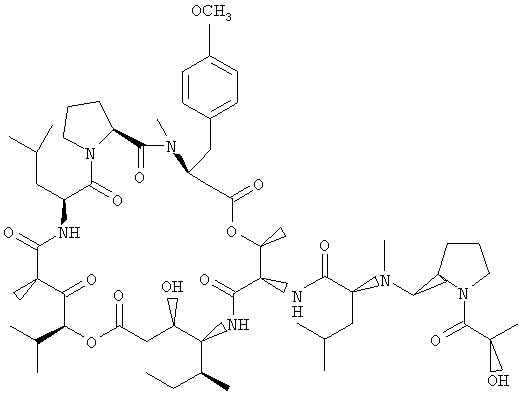 .
.
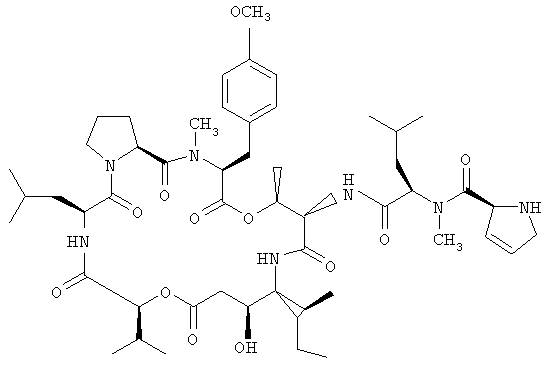 .
.
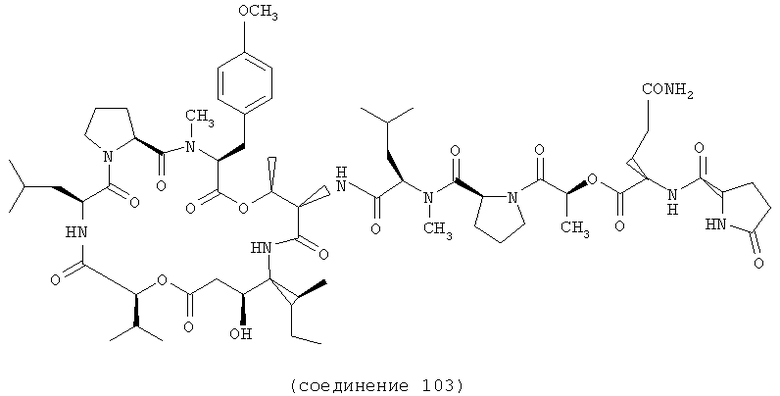
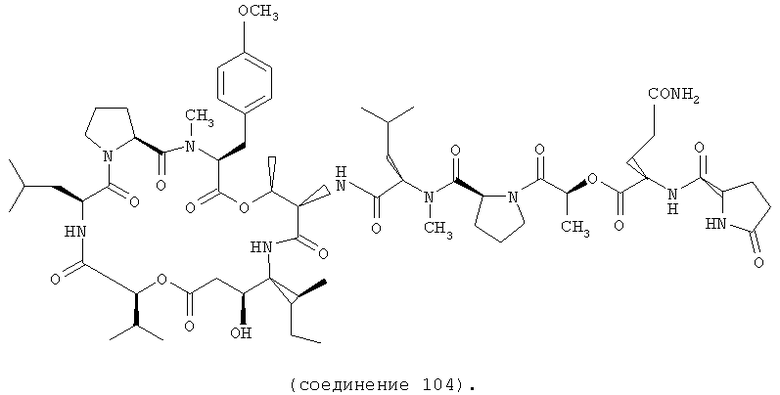
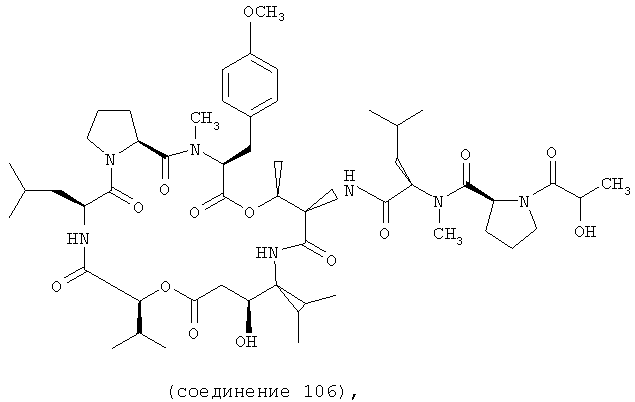
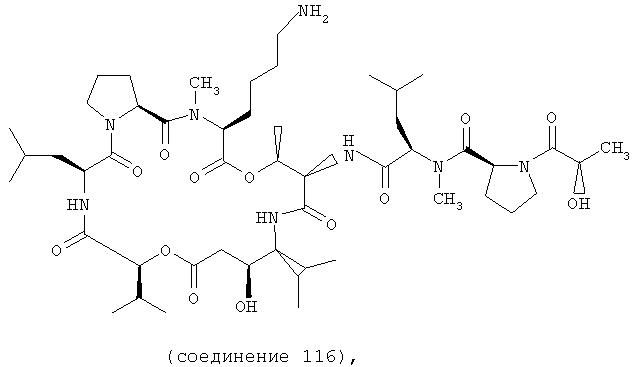
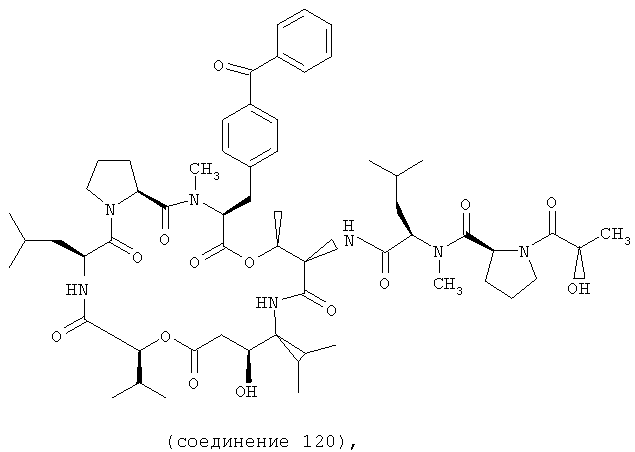
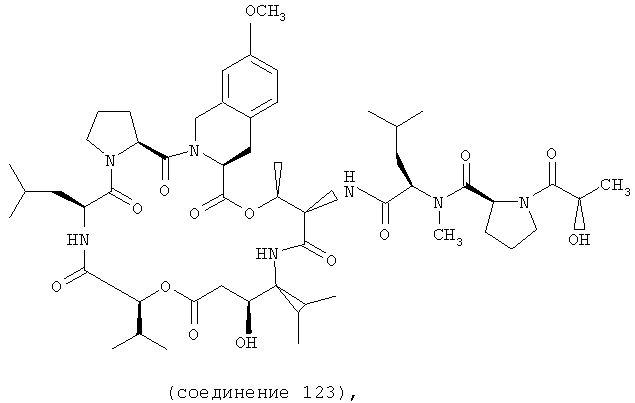
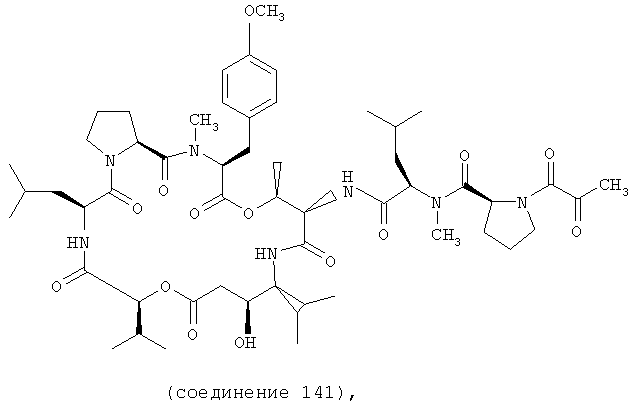
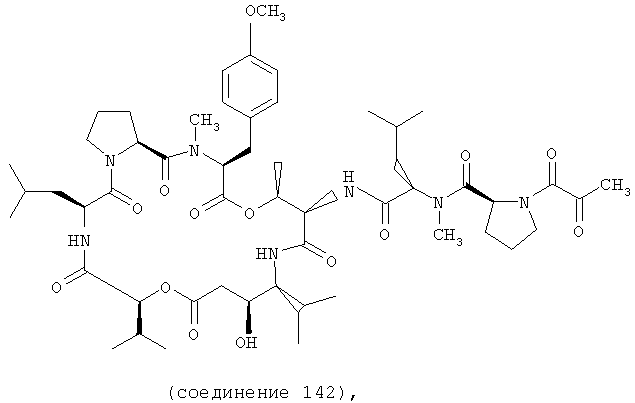
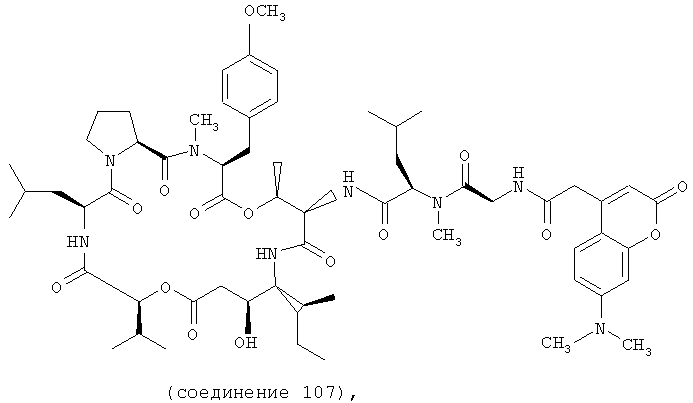
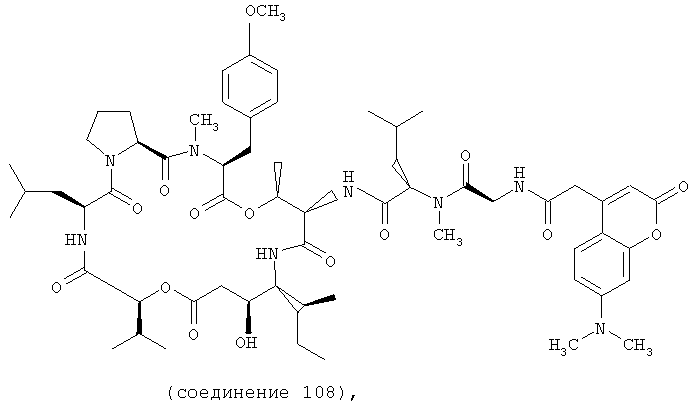
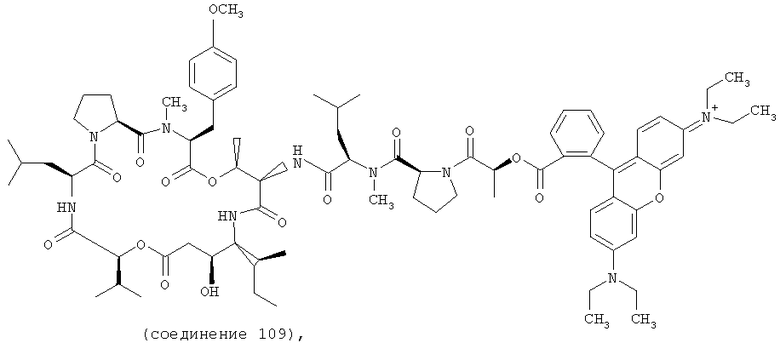
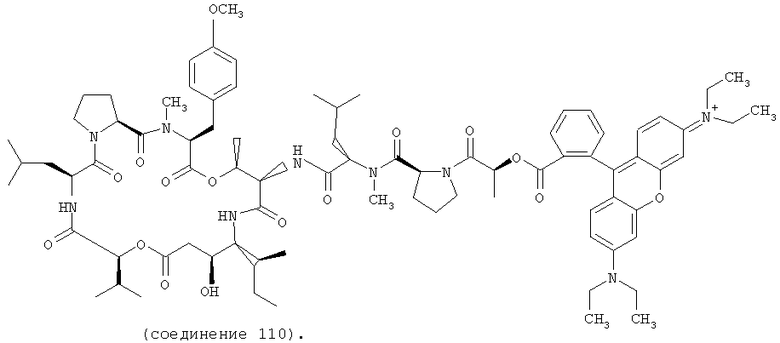
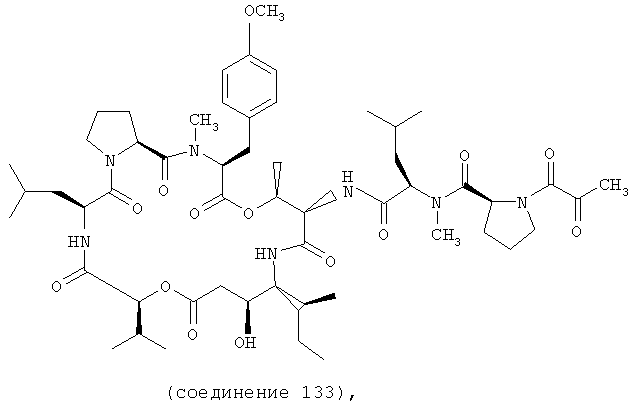
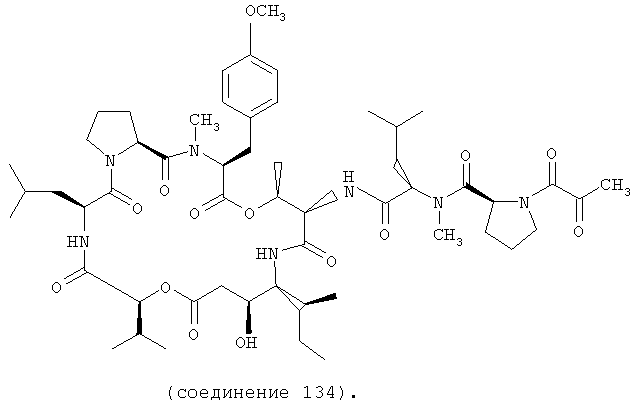
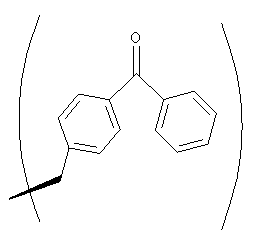
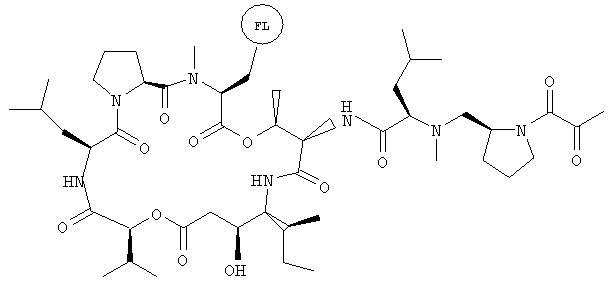 .
.
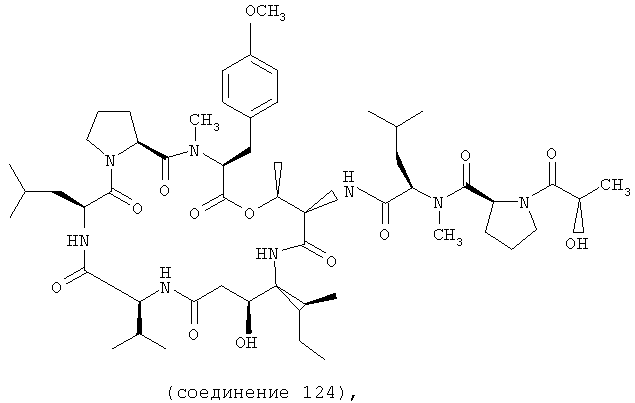
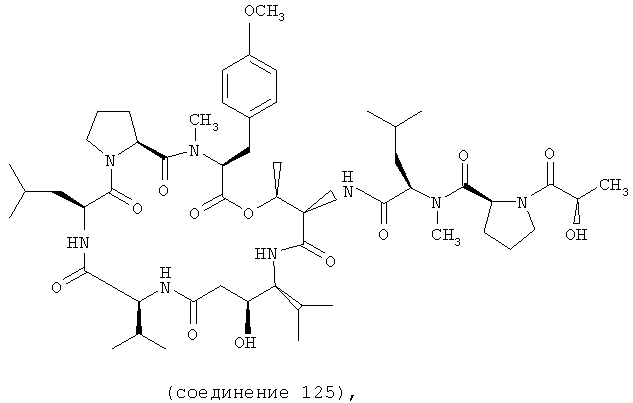
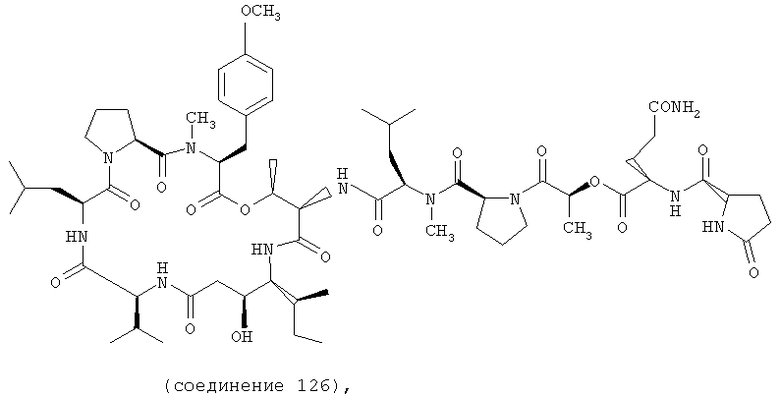
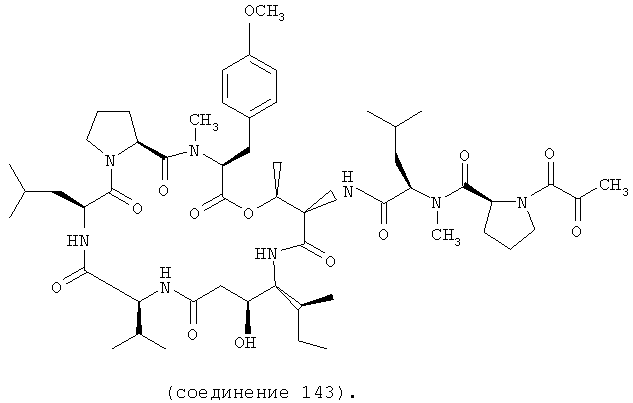
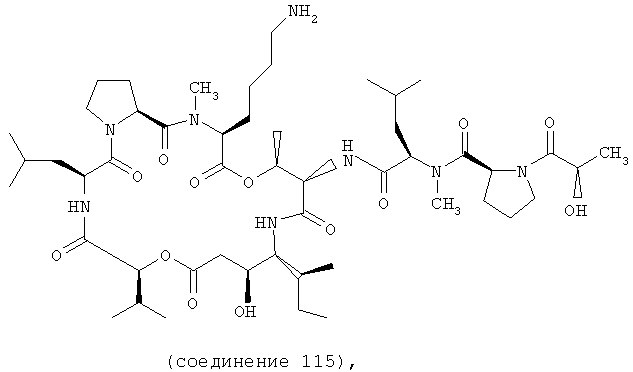
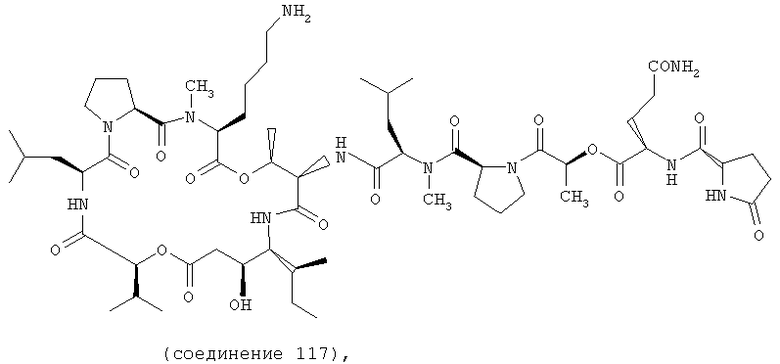
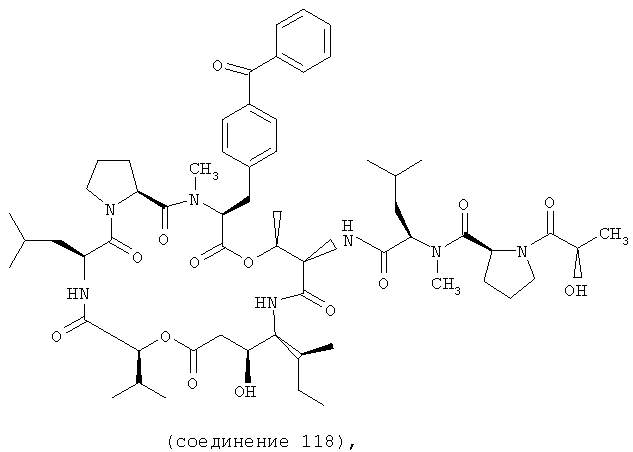
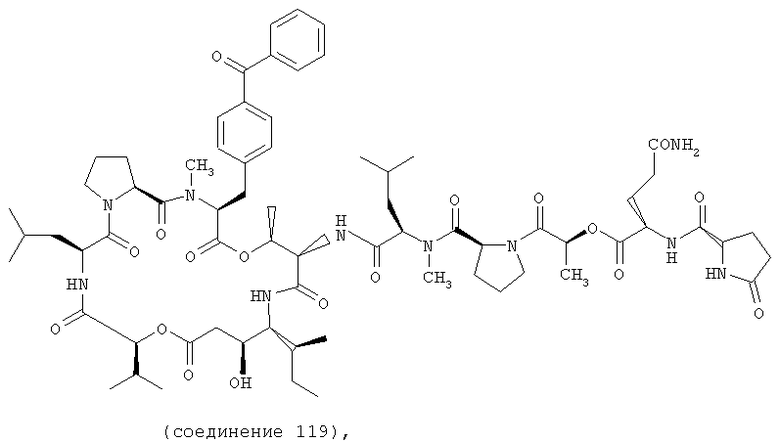
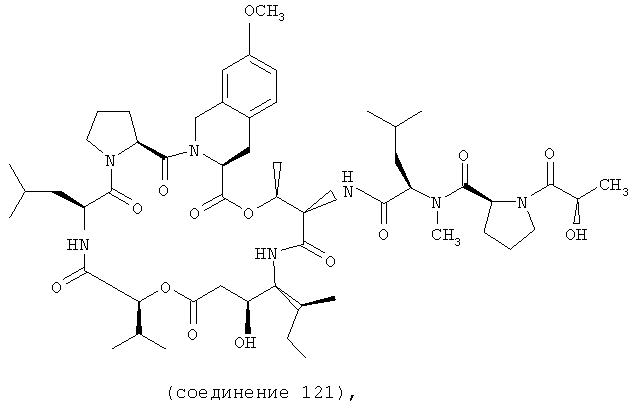
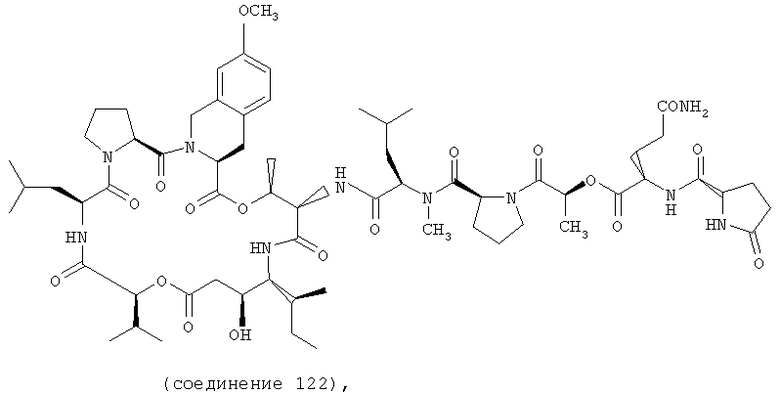
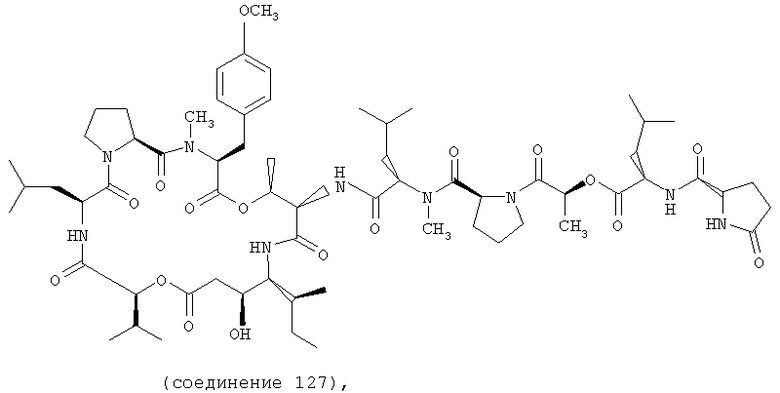
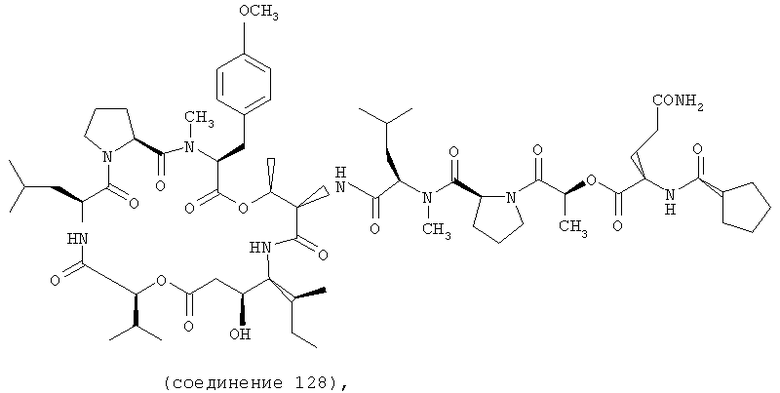
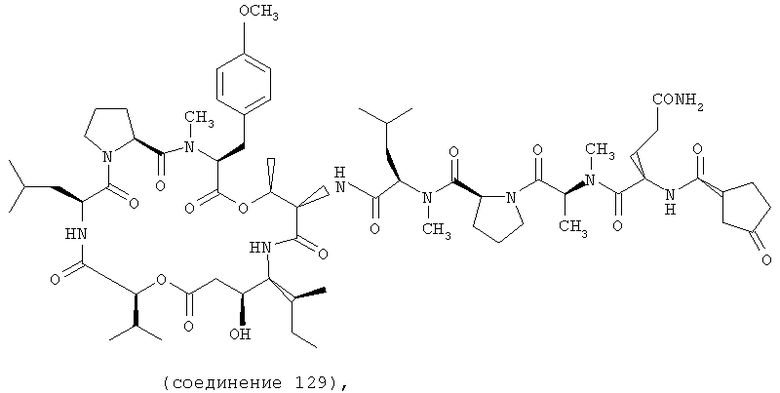
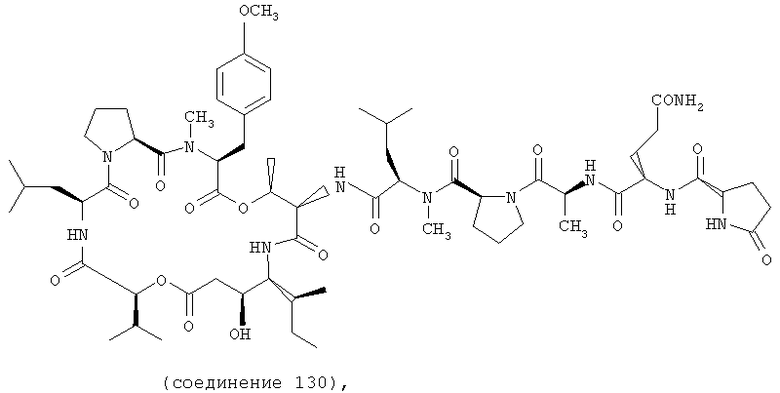
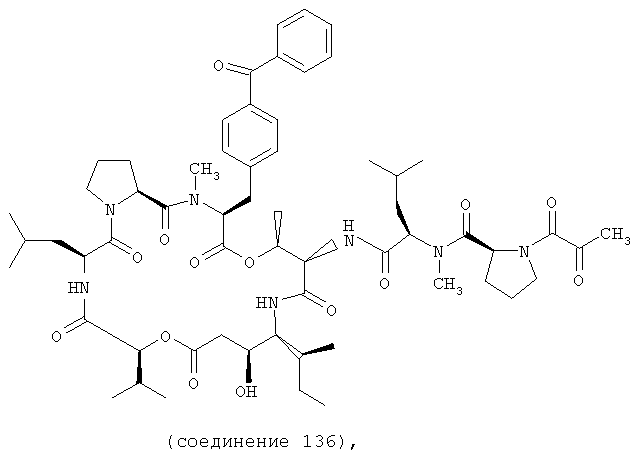
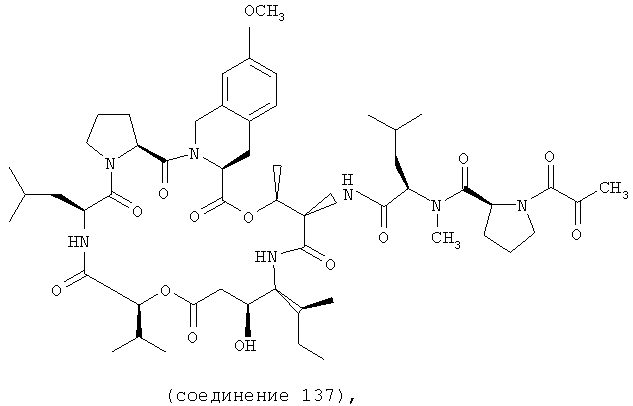
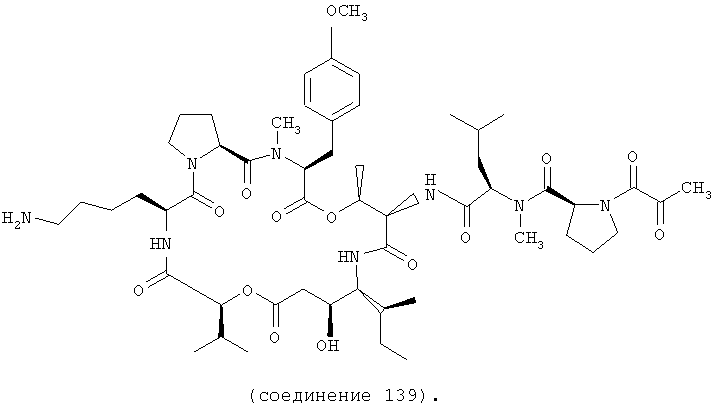
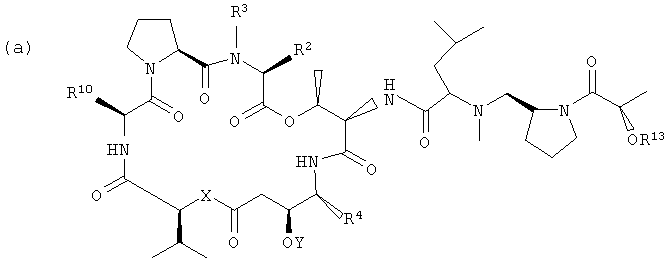 ,
,
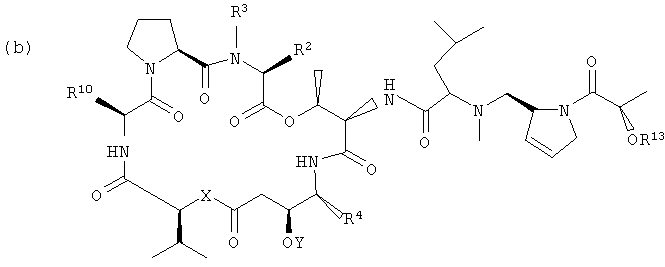 ,
,
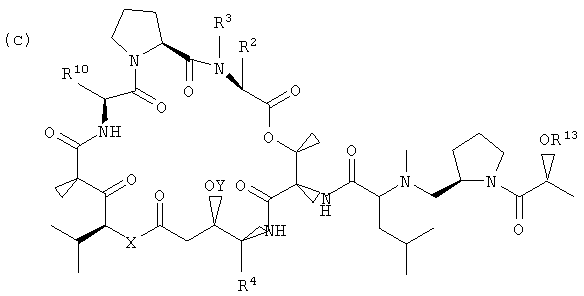 , и
, и
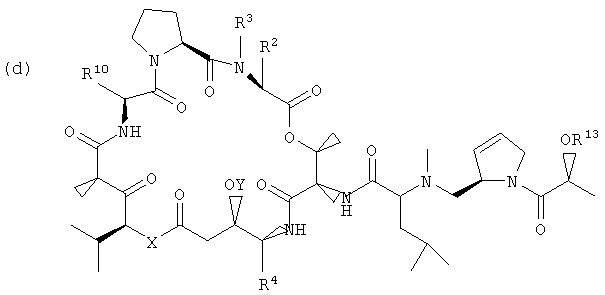 ,
,
где i) R3 выбирают из группы, состоящей из -СН3 и -Н, и R2 выбирают из группы, состоящей из боковой цепи изолейцина, боковой цепи валина, боковой цепи аланина, боковой цепи норлейцина, боковой цепи норвалина, боковой цепи пролина, боковой цепи лейцина, боковой цепи гистидина, боковой цепи триптофана, боковой цепи аргинина, боковой цепи лизина, второго флуорофора и заместителя, имеющего структуру
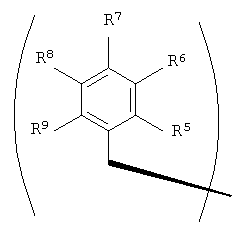 ; или
; или
b) R2 и R3 вместе обозначают заместитель, имеющий структуру
 ;
;
ii) каждый из R5, R6, R7, R8 и R9, если они присутствуют, независимо выбирают из группы, состоящей из -Н, -ОН, -ОСН3, -СО(С6Н5), -Br, -I, -F, -Cl, -СН3 и -C2H5;
iii) R4 выбирают из группы, состоящей из боковой цепи изолейцина и боковой цепи валина;
iv) X выбирают из группы, состоящей из -О- и -(NH)-;
v) Y выбирают из группы, состоящей из -Н и защитной группы для гидроксила;
vi) R10 выбирают из группы, состоящей из боковой цепи лейцина и боковой цепи лизина, и
vii) R13 обозначает ферментативно расщепляемую группу, которая расщепляется ферментом, выбранным из группы, состоящей из карбоксипептидазы, бета-лактамазы, бета-галактозидазы, V-амидазы пенициллина, цитозиндезаминазы, нитроредуктазы, щелочной фосфатазы, бета-глюкуронидазы и каталитического антитела.
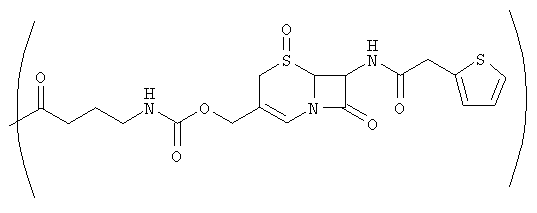 .
.
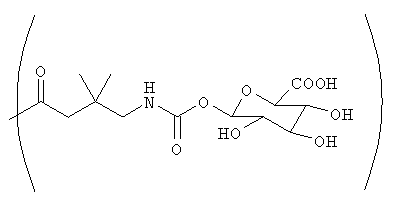 .
.
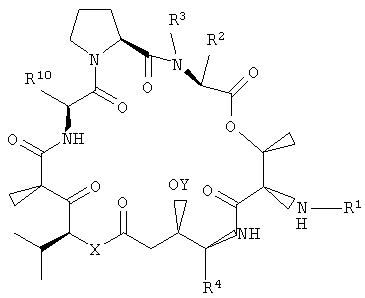
где i) R1 выбирают из группы, состоящей из
(трет-бутилоксикарбонил) а,
лейцина,
(N-метил)лейцин-(первый флуорофор) а,
(N-метил)лейцин-пролина,
(N-метил)лейцин-пролин-лактат-(первый флуорофор) а,
(N-метил)лейцин-пролин-лактат-глутамин-пироглутамата,
(N-метил)лейцин-пролин-лактат-глутамин-циклопентаноата,
(N-метил)лейцин-пролин-аланин-лейцин-пироглутамата,
(N-метил)лейцин-пролин-(N-метил-аланин)-лейцин-пироглутамата,
(N-метил) лейцин-дезоксопролина,
(N-метил)лейцин-дезоксопролин-лактата,
(N-метил)лейцин-дезоксопролин-пирувата,
(N-метил)лейцин-дезоксопролин-лактат-(первый флуорофор) a,
(N-метил)лейцин-дезоксопролин-лактат-глутамин-пироглутамата,
(N-метил)лейцин-дезоксопролин-лактат-глутамин-циклопентаноата,
(N-метил)лейцин-дезоксопролин-аланин-лейцин-пироглутамата,
(N-метил)лейцин-дезоксопролин-(N-метил-аланин)-лейцин-пироглутамата,
(N-метил)лейцин-дегидропролина,
(N-метил)лейцин-дегидропролин-лактата,
(N-метил)лейцин-дегидропролин-пирувата,
(N-метил)лейцин-дегидропролин-лактат-(первый флуорофор) а,
(N-метил)лейцин-дегидропролин-лактат-глутамин-пироглутамата,
(N-метил)лейцин-дегидропролин-лактат-глутамин-циклопентаноата,
(N-метил)лейцин-дегидропролин-аланин-лейцин-пироглутамата и
(N-метил)лейцин-дегидропролин-(N-метил-аланин)-лейцин-пироглутамата;
ii) R2 и R3 является одним из:
(a) R3 выбирают из группы, состоящей из -СН3 и -Н, и R2 выбирают из группы, состоящей из боковой цепи изолейцина, боковой цепи валина, боковой цепи аланина, боковой цепи норлейцина, боковой цепи норвалина, боковой цепи лейцина, боковой цепи гистидина, боковой цепи триптофана, боковой цепи аргинина, боковой цепи лизина, второго флуорофора и заместителя, имеющего структуру
 ; или
; или
b) R2 и R3 вместе обозначают заместитель, имеющий структуру
 ;
;
iii) каждый из R5, R6, R7, R8 и R9, если они присутствуют, независимо выбирают из группы, состоящей из -Н, -ОН, -ОСН3, -СО(С6Н5), -Br, -I, -F, -Cl, -СН3 и -С2Н5;
iv) R4 выбирают из группы, состоящей из боковой цепи изолейцина и боковой цепи валина;
v) X выбирают из группы, состоящей из -О- и -(NH)-;
vi) Y выбирают из группы, состоящей из -Н и защитной группы для гидроксила;
vii) R10 выбирают из группы, состоящей из боковой цепи лейцина и боковой цепи лизина, и
viii) молекула не является тамандарином А.
(трет-бутилоксикарбонил) а,
лейцина,
(N-метил)лейцин-(первый флуорофор) а,
(N-метил)лейцин-(S)пролина,
(N-метил)лейцин-(S)пролин-(S)лактат-(первый флуорофор) а,
(N-метил)лейцин-(S)пролин-(S)лактат-глутамин-пироглутамата,
(N-метил)лейцин-(S)пролин-(S)лактат-глутамин-циклопентаноата,
(N-метил)лейцин-(S)пролин-аланин-лейцин-пироглутамата,
(N-метил)лейцин-(S)пролин-(N-метил-аланин)-лейцин-пироглутамата,
(N-метил)лейцин-дезоксо-(S)пролина,
(N-метил)лейцин-дезоксо-(S)пролин-(S)лактата,
(N-метил)лейцин-дезоксо-(S)пролин-пирувата,
(N-метил)лейцин-дезоксо-(S)пролин-(S)лактат-(первый флуорофор) а,
(N-метил)лейцин-дезоксо-(S)пролин-(S)лактат-глутамин-пироглутамата,
(N-метил)лейцин-дезоксо-(S)пролин-(S)лактат-глутамин-циклопентаноата,
(N-метил)лейцин-дезоксо-(S)пролин-аланин-лейцин-пироглутамата,
(N-метил)лейцин-дезоксо-(S)пролин-(N-метил-аланин)-лейцин-пироглутамата,
(N-метил)лейцин-дегидро-(S)пролина,
(N-метил)лейцин-дегидро-(S)пролин-(S)лактата,
(N-метил)лейцин-дегидро-(S)пролин-пирувата,
(N-метил)лейцин-дегидро-(S)пролин-(S)лактат-(первый флуорофор) а,
(N-метил)лейцин-дегидро-(S)пролин-(S)лактат-глутамин-пироглутамата,
(N-метил)лейцин-дегидро-(S)пролин-(S)лактат-глутамин-циклопентаноата,
(N-метил)лейцин-дегидро-(S)пролин-аланин-лейцин-пироглутамата и
(N-метил)лейцин-дегидро-(S)пролин-(N-метил-аланин)-лейцин-пироглутамата.
(трет-бутилоксикарбонил) а,
лейцина,
(N-метил)лейцин-(первый флуорофор) а,
(N-метил)лейцин-(S)пролина,
(N-метил) лейцин-(S)пролин-(S)лактат-(первый флуорофор) а,
(N-метил)лейцин-(S)пролин-(S)лактат-(S)глутамин-(S)пироглутамата,
(N-метил)лейцин-(S)пролин-(S)лактат-(S)глутамин-(S)циклопентаноата,
(N-метил)лейцин-(S)пролин-(S)аланин-(S)лейцин-(S)пироглутамата,
(N-метил)лейцин-(S)пролин-(N-метил-S-аланин)-(S)лейцин-(S)пироглутамата,
(N-метил)лейцин-дезоксо-(S)пролина,
(N-метил)лейцин-дезоксо-(S)пролин-(S)лактата,
(N-метил)лейцин-дезоксо-(S)пролин-пирувата,
(N-метил)лейцин-дезоксо-(S)пролин-(S)лактат-(первый флуорофор) а,
(N-метил)лейцин-дезоксо-(S)пролин-(S)лактат-(S)глутамин-(S)пироглутамата,
(N-метил)лейцин-дезоксо-(S)пролин-(S)лактат-(S)глутамин-(S)циклопентаноата,
(N-метил)лейцин-дезоксо-(S)пролин-(S)аланин-(S)лейцин-(S)пироглутамата,
(N-метил)лейцин-дезоксо-(S)пролин-(N-метил-S-аланин)-(S)лейцин-(S)пироглутамата,
(N-метил)лейцин-дегидро-(S)пролина,
(N-метил)лейцин-дегидро-(S)пролин-(S)лактата,
(N-метил)лейцин-дегидро-(S)пролин-пирувата,
(N-метил)лейцин-дезоксо-(S)пролин-(S)лактат-(первый флуорофор) а,
(N-метил)лейцин-дезоксо-(S)пролин-(S)лактат-(S)глутамин-(S)пироглутамата,
(N-метил)лейцин-дезоксо-(S)пролин-(S)лактат-(S)глутамин-(S)циклопентаноата,
(N-метил)лейцин-дегидро-(S)пролин-(S)аланин-(S)лейцин-(S)пироглутамата и
(N-метил)лейцин-дезоксо-(S)пролин-(N-метил-S-аланин)-(S)лейцин-(S)пироглутамата.
 ;
;
R3 обозначает метил, R4 обозначает боковую цепь изолейцина, каждый из R5, R6, R8 и R9 обозначает гидридный радикал, R7 обозначает метокси, R10 обозначает боковую цепь лейцина, Х обозначает -О- и Y обозначает гидридный радикал.
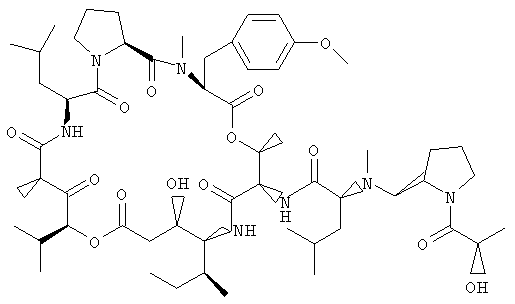 .
.
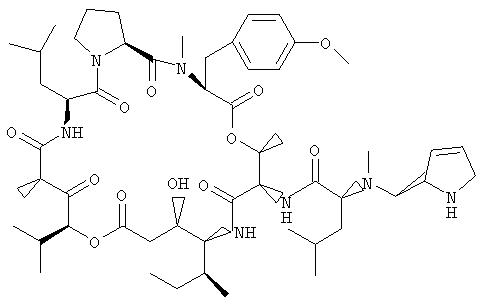

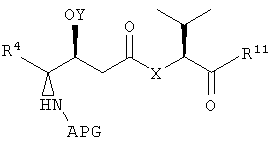
где i) Y выбирают из группы, состоящей из -Н и защитной группы для гидроксила;
ii) X выбирают из группы, состоящей из -О- и -(NH)-;
iii) R4 выбирают из группы, состоящей из боковой цепи изолейцина и боковой цепи валина;
iv) APG обозначает защитную группу для амина и
v) R11 выбирают из группы, состоящей из -ОН, -NH2, -О(аллил), -О(пентафторфенил) и заместителя, имеющего структуру
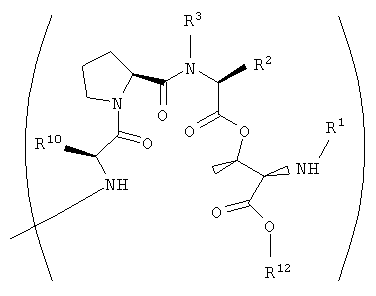
где a) R1 выбирают из группы, состоящей из -Н и защитной группы для амина;
b) или
(I) R3 выбирают из группы, состоящей из -СН3 и -Н и R2 выбирают из группы, состоящей из боковой цепи изолейцина, боковой цепи валина, боковой цепи аланина, боковой цепи норлейцина, боковой цепи норвалина, боковой цепи пролина, боковой цепи лейцина, боковой цепи гистидина, боковой цепи триптофана, боковой цепи аргинина, боковой цепи лизина, второго флуорофора и заместителя, имеющего структуру
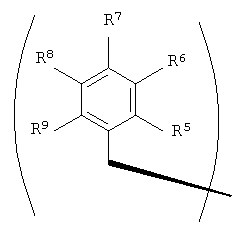 ; или
; или
II) R2 и R3 вместе обозначают заместитель, имеющий структуру
 ;
;
c) каждый из R5, R6, R7, R8 и R9, если они присутствуют, независимо выбирают из группы, состоящей из -Н, -ОН, -ОСН3, -СО(С6Н5), -Br, -I, -F, -Cl, -СН3 и -C2H5;
d) R10 выбирают из группы, состоящей из боковой цепи лейцина, боковой цепи лизина и защищенной боковой цепи лизина и
е) R12 выбирают из группы, состоящей из -Н и -2-(триметилсилил)этоксикарбонила.
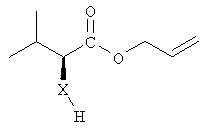
и второго реагента, имеющего структуру
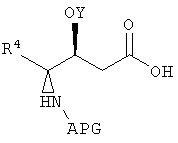
с получением первого фрагмента дидемнина, имеющего структуру
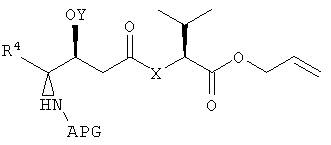
где X выбирают из группы, состоящей из -О- и -(NH)-; APG обозначает защитную группу для амина, Y обозначает защитную группу для гидроксила и R4 выбирают из группы, состоящей из боковой цепи изолейцина и боковой цепи валина.
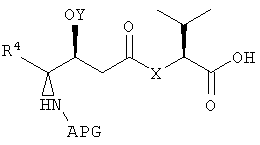 .
.
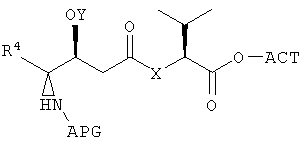 .
.
где -ACT обозначает активатор.
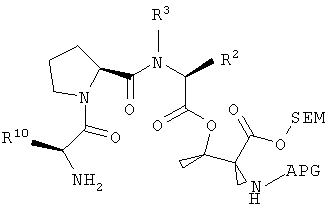
с получением четвертого фрагмента дидемнина, имеющего структуру
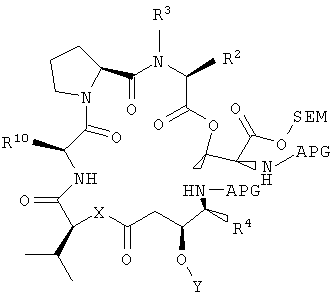
где i) или
(a) R3 выбирают из группы, состоящей из -СН3 и -Н, и R2 выбирают из группы, состоящей из боковой цепи изолейцина, боковой цепи валина, боковой цепи аланина, боковой цепи норлейцина, боковой цепи норвалина, боковой цепи пролина, боковой цепи лейцина, боковой цепи гистидина, боковой цепи триптофана, боковой цепи аргинина, боковой цепи лизина, второго флуорофора и заместителя, имеющего структуру
 ; или
; или
b) R2 и R3 вместе обозначают заместитель, имеющий структуру
 ;
;
ii) каждый из R5, R6, R7, R8 и R9, если они присутствуют, независимо выбирают из группы, состоящей из -Н, -ОН, -ОСН3, -СО(С6Н5), -Br, -I, -F, -Cl, -СН3 и -С2Н5;
iii) APG обозначает защитную группу для амина;
iv) SEM обозначает 2-(триметилсилил)этоксикарбонил;
v) R10 выбирают из группы, состоящей из боковой цепи лейцина и боковой цепи лизина.
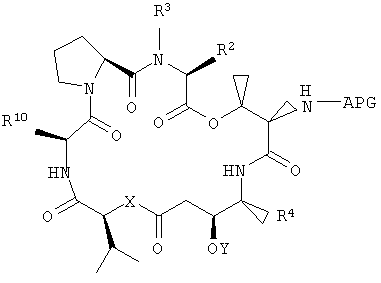 .
.
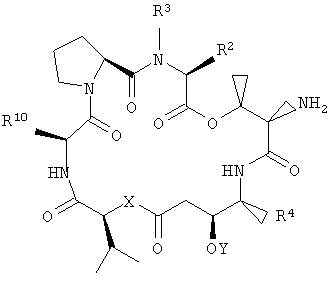 .
.
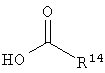
с получением третьего аналога дидемнина, имеющего структуру
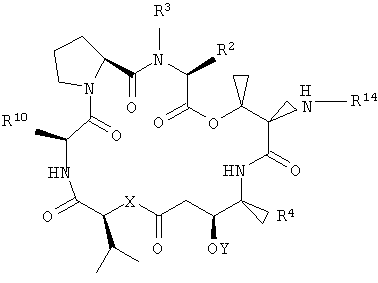
где R14 выбирают из группы, состоящей из
лейцина,
(N-метил)лейцина,
(N-метил)лейцин-(первый флуорофор) а,
(N-метил)лейцин-пролина,
(N-метил)лейцин-пролин-лактата,
(N-метил)лейцин-пролин-пирувата,
(N-метил)лейцин-пролин-лактат-(первый флуорофор) а,
(N-метил)лейцин-пролин-лактат-глутамин-пироглутамата,
(N-метил)лейцин-пролин-лактат-глутамин-циклопентаноата,
(N-метил)лейцин-пролин-аланин-лейцин-пироглутамата,
(N-метил)лейцин-пролин-(N-метил-аланин)-лейцин-пироглутамата,
(N-метил)лейцин-дезоксопролина,
(N-метил)лейцин-дезоксопролин-лактата,
(N-метил)лейцин-дезоксопролин-пирувата,
(N-метил)лейцин-дезоксопролин-лактат-(первый флуорофор) а,
(N-метил)лейцин-дезоксопролин-лактат-глутамин-пироглутамата,
(N-метил)лейцин-дезоксопролин-лактат-глутамин-циклопентаноата,
(N-метил)лейцин-дезоксопролин-аланин-лейцин-пироглутамата,
(N-метил)лейцин-дезоксопролин-(N-метил-аланин)-лейцин-пироглутамата,
(N-метил)лейцин-дегидропролина,
(N-метил)лейцин-дегидропролин-лактата,
(N-метил)лейцин-дегидропролин-пирувата,
(N-метил)лейцин-дегидропролин-лактат-(первый флуорофор) а,
(N-метил)лейцин-дегидропролин-лактат-глутамин-пироглутамата,
(N-метил)лейцин-дегидропролин-лактат-глутамин-циклопентаноата,
(N-метил)лейцин-дегидропролин-аланин-лейцин-пироглутамата и
(N-метил)лейцин-дегидропролин-(N-метил-аланин)-лейцин-пироглутамата, и
одну из указанных групп связывают с ферментативно расщепляемой группой, которая расщепляется ферментом, выбранным из группы, состоящей из карбоксипептидазы, бета-лактамазы, бега-галактозидазы, V-амидазы пенициллина, цитозиндезаминазы, нитроредуктазы, щелочной фосфатазы, бета-глюкуронидазы и каталитического антитела.
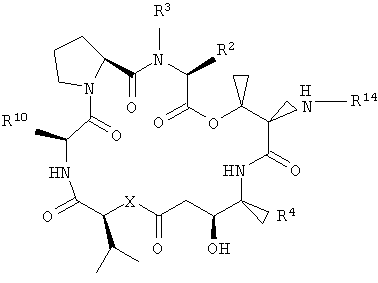
По пп.1-3 в отношении группы R1, содержащей дезоксопролин или дегидропролин, установлен приоритет от 22.01.2001. В отношении остальных групп R1 по пп.1-3 установлен приоритет от 07.04.2000.
По пп.4, 8-18, 20-23 и 61 установлен приоритет от 07.04.2000.
По пп.5-7, 19, 24-38 и 62 установлен приоритет от 22.01.2001.
По пп.39-60 и 63-67 установлен приоритет в соответствии с тем, какая дата приоритета установлена для соединений, упомянутых в данных пунктах.
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| US 5504189 A, 02.04.1996 | |||
| US 4493796 A, 15.01.1985 | |||
| US 4782135 A, 01.11.1988 | |||
| US 5294603 A, 15.03.1994 | |||
| СПОСОБ ПОЛУЧЕНИЯ КОАГУЛЯНТА НА ОСНОВЕ ГИДРОКСИЛХЛОРИДА АЛЮМИНИЯ | 1996 |
|
RU2102322C1 |
Авторы
Даты
2008-04-27—Публикация
2001-04-09—Подача