Изобретение относится к новым 1-//(диалкиламино)алкил/-амино/-4-замещенным тиоаксантен-9-онам, фармацевтическим композициям, содержащим тиоаксантеноны, методам лечения опухолевой тиоаксантенонами и методам лечения рака у млекопитающих композициями, содержащими тиоксантеноны.
Nabin and Elsheikh /J. Pharm. Sci., 54, 1672-1673 /1965/ описывают 1-//2-(диэтиламино)этил/амино/-4-(диэтиламино)- метил/тиоксантен-9-он, однако использование этого соединения не было показано.
В патенте США 3745172 (Colins and Rosi) впервые описан промежуточный продукт синтеза фунгицидов и бактерицидов строения: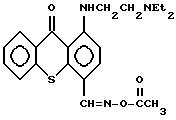
и антигельминтный и антибактериальный агент строения: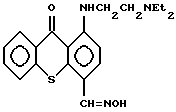
В патенте США 3312598 (Rosi and Perusotti) запатентована 1-//2-(диэтиламино)этил/амино/-9-оксо-9H-тиоксантен-4-карбоновая кислота как побочный продукт ферментации, однако не раскрыто ее применение.
Blans и French /J. Med. Chem 6, 185-191 1963/ раскрывают синтез серии тиоксантенонов, отнесенных к лукантону, и приводят результаты испытаний этих соединений против лейкемии и двух твердых опухолей. Среди описанных соединений представлены соединения строения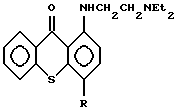
где R-метил, метокси и этокси.
Yarinski и Freele /Journal of Tropical Medicine and Hygiene 73, 23-27 (1970)/ раскрывают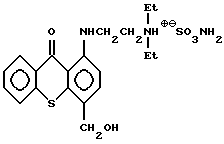
в качестве антишистосомального агента.
N-/2-(диметиламино)этил/-9-оксо-9H-тиоксантен-4-карбоксамид моногидрохлорид, описанный в публикации /Palmer et al., J. Med. Chem. 31, 707-712 (1988)/, был испытан против клеток P388 лейкемии in vitro и против лейкоза морских свинок /L 1210/, и in vivo против клеток лейкемии P388, в результате чего была установлена небольшая вероятность возможности использования его в качестве противоопухолевого агента.
В патенте США 4539412 (Archer) описываются соединения формулы: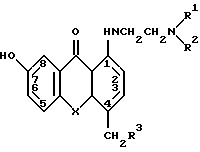
где для X = S:
R1 и R2 - независимо выбираются из низших алкилов, и одновременно выбираются из пирролидинила, пиперидинила, морфолинила, пиперазинила и N-замещенного пиперазинила; и
R3-H или гидроксил.
и где для X = 0:
R1 и R2 - индивидуально выбираются из низших алкилов и одновременно выбираются из пирролидинила, пиперидила, морфолинила, пиперазинила и N -замещенного пиперазинила;
R3-H или гидроксил.
Указанные соединения полезны в качестве противоопухолевых агентов.
Соединения общей формулы: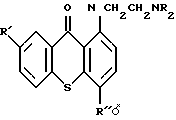
R=C2H5, R' = H, R'' = CH2OH /пример 1/;
R=CH3, R' = OH, R'' = CH2OH /пример 2/;
R=C2H5, R' = H, R'' = CH2OCONHCH3 /пример 4/;
R=CH3, R' = OH, R'' = CH2OCONHCH3 /пример 5/;
R=C2H5, R' = H, R'' = CH2OCONHC6H5 /пример 23/;
R=C2H5, R' = H, R'' = CH2OCONHC3H7 /пример 24/;
R=C2H5, R' = H, R'' = CH2OCONHC4H9 /пример 25/;
R=C2H5, R' = H, R'' = CH2OCOCH3 /пример 26;/
R=C2H5, R' = H, R'' = CH2OCOCH3 /пример 27/ или
R=C2H5, R' = H, R'' = CH2OCOC6H3(NO2)2 /пример 28/
и результаты испытания этих соединений на противоопухолевую и/или антишистосомицидальную активность описаны в публикации Archer и др. /J. Med. Chem/ 31, 254-260 (1988)/.
В соответствии с данным изобретением предлагаются соединения общей формулы I: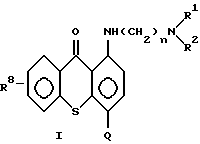
где (I) n = 2 или 3;
R1 и R2 - независимо друг от друга - низший алкил;
Q - остаток, выбранный из группы, состоящей из CH2 NHR3, CH2NHR3, CH2N(R4)SO2R7, CH2NHCHO, CH=N-Ar, C(O)R5R6, CH2N(R4)C (O)R7, CH2N(C2H5)CHO, CH2N(R4) P(O) (O-низший алкил)2, CH2= CH-N(R9)(R10), CH2N(R4)C(O)OR4 7 CH2N(R4)C(O)CF3.
R3 водород или низший алкил;
R4 водород, низший алкил или Ar;
R5 водород, низший алкил или Ar;
R6 водород или низший алкил;
R7 низший алкил или Ar;
R8 гидроксил;
Ar - фенил или фенил, замещенный метилом, метокси, - гидрокси, галоидом или нитрогруппой; и
R9 и R10 - независимо друг от друга - низший алкил; или
(2) Q - остаток, выбранный из группы, состоящей из CH2N(R4)SO2R7, CH= N-Ar, C(O)NR5R6, CH2N(R4)C(O)R7, CH2N(R4)P(O) (O-низший алкил)2, CH2N(R4)C(O)CF3 и CH2N(R4)C(O)OR7; R8 - водород, низший алкил, низший алкокси или гидроксил; Ar - фенил, замещенный гидроксилом; и n R1, R2, R4, R5, R6 и R7 - принимают значения, определенные в части /1/ при условии, что один или более из R4, R5 или R7 - Ar, или
Q - остаток, выбранный из группы, состоящей из CH2 N=CH-N(R9)(R10), CH2N(R4)C(O)CF3 и CH2N(R4)C(O)OR7; R8 водород, низший алкил, низший алкокси или гидроксил; и n, R1, R2, R4, R7, Ar, R9 и R10 - принимают значения, определенные выше в части (1); или их фармацевтически приемлемые кислотно-аддитивные соли или сольваты;
Соединения являются полезными для лечения опухолей у млекопитающих.
Термин "низший алкил", используемый здесь, включает линейные, разветвленные или циклические углеводороды, содержащие четыре или несколько атомов углерода. Термин "галоид" включает бром, хлор и фтор. Термин "низший алкокси" включает линейные или разветвленные алкокси заместители, имеющие от одного до четырех атомов углерода, например, метокси, этокси, пропокси, изо-пропокси, бутокси, фтор-бутокси и т.п.
Предпочтительными соединениями, определенными в рамках части /1/, являются соединения, в которых Q представляет собой остаток, выбранный из группы, состоящей из CH2NHR3, CH2N(R4) SO2R7, CH2NHCHO, CH-N-Ar, C(O)NR5R6,
CH2N(R4)C(O)R7, CH2N(C2H5)CHO и
CH2N(R4)P(O) - (O-низший алкил)2 и R4 - водород или низший алкил, особенно когда Ar - фенил или фенил, замещенный метилом, метокси-, галоидом или нитро-группой. Особенно предпочтительными являются соединения, в которых n равно 2, R1 и R2 оба являются этилом, R3 - водород или метил и R7 - низший алкил, в частности, 1-//2-(диэтиламино)этил/амино/-4-(метиламино)метил)-7- гидрокситиоксантен-9-он и N-//1-(2-(диэтиламино)этил)амино/-7-гидрокси-9-оксотиоксантен-4-ил/метил/ метансульфонамид.
Предпочтительными соединениями, определенными в рамках части /3/, являются соединения, в которых R8 - водород, низший алкил или низший алкокси; R4 - водород и Ar - фенил или фенил, замещенный метилом, метокси-, галоидом или нитрогруппой. Особенно предпочтительными являются соединения, в которых n равно 2 и R1 и R2 оба являются этилом, а R8 - водород или метокси-группа, особенно соединения, в которых R7 - низший алкил. Самыми предпочтительными соединениями являются метил N-//1-//2-(диэтиламино)этил)амино)-9-оксотиоксантен-4-ил/метил/карбамат и метил N-//1-//2-(диэтиламино)этил)амино/-7-метокси-9-оксотиоксантен-4- ил/метил/карбамат.
Изобретение также относится к композиции для лечения опухолей и рака у млекопитающих, которые содержат соединения формулы I и фармацевтически приемлемые наполнители или разбавители.
Изобретение далее относится к способу использования соединения формулы I для лечения опухолей у млекопитающих, который заключается во введении млекопитающему соединения формулы I.
Изобретение относится также к способу использования соединения формулы I для лечения рака у млекопитающих, который заключается во введении млекопитающему композиции соединения формулы I и фармацевтически приемлемых наполнителей или разбавителей.
Синтез соединений данного изобретения может быть в общих чертах представлен так, как показано на схемах А и Б и В (см. в конце описания).
Соединения формулы III /формула I, в которой Q - CH=N-Ar/ могут быть синтезированы нагреванием альдегида формулы II с приблизительно одним эквивалентом соответствующего анилина в инертном азеотропном растворителе, предпочтительно ксилоле или толуоле, до температуры кипения.
Соединения формулы IV могут быть получены из альдегида формулы II нагреванием до 150 - 185oC в присутствии от приблизительно 5 до приблизительно 17 эквивалентов муравьиной кислоты в формамиде, N-алкилформамиде или N-Ar-формамиде, который используется здесь как растворитель. Условия проведения этой реакции Лейкарта хорошо известны. Соединения формулы V получают далее кислотным гидролизом формамида.
Соединения формулы VI /формула I, в которой Q - CH2N(R4)SO2R7/ могут быть синтезированы сульфонилированием амина небольшим избытком низшего алкилсульфонила или арилсульфонилхлоридом в /а/ приемлемом растворителе, предпочтительно пиридине, при температуре от 0oC до 50oC; или /б/ приемлемом растворителе, таком как дихлорметан, в избытке основания, такого как триэтиламин, при температуре от приблизительно 0oC до приблизительно комнатной температуры.
С другой стороны, соединения формулы VI, где R4 - низший алкил, могут быть синтезированы сульфонилированием амина V, в котором R4 - водород, как описано выше, с последующей обработкой образующегося сульфонамида VI, в котором R4 - водород, избытком основания, предпочтительно, гидридом натрия, в соответствующем растворителе, таком как тетрагидрофуран или N,N-диметилформамид, и последующей обработкой избытком подходящего галоидпроизводного низшего алкила при температуре от приблизительно 0oC до температуры, соответствующей температуре кипения используемого растворителя.
Карбоксамиды формулы IX могут быть синтезированы взаимодействием альдегида II с 5 - 6-кратным избытком гидроксиламида гидрохлорида в пиридине, необязательно содержащей сорастворитель, с последующим дегидрированием оксима /VII/ обработкой избытком уксусного ангидрида и нагреванием в инертном высококипящем растворителе, таком как ксилол, и, наконец, частичным гидролизом нитрила /VIII/ в концентрированной серной кислоте. В том случае, когда необходимо, чтобы R5 и R6 были отличны от водорода, амид IX может быть далее гидролизован в соответствующую кислоту в 16%-ном спиртовом KOH, и кислота может быть конденсирована с подходящим амином с использованием хорошо известных методов.
Соединения формулы X /формула I, в которой Q - CH2N(R4)C(O)R7/ может быть синтезировано ацилированием амина V с избытком хлорида кислоты низшего алкила или хлоридом арильной кислоты в подходящем растворителе, предпочтительно, пиридине, необязательно в присутствии сорастворителя, предпочтительно дихлорметана, при температуре от приблизительно 0oC до приблизительно 50oC.
Соединения формулы XII /формула I, в которой Q представляет собой CH2= CHN(R9)(R10)/могут быть синтезированы обработкой амина формулы V избытком диметилацеталя формулы (MeO)2CHN(R9)(R10) при температуре приблизительно 60oC.
Соединения формулы XIII /формула I, в которой Q представляет собой CH2N(R4)-C(O)CF3/ могут быть синтезированы обработкой амина формулы V в подходящем растворителе, предпочтительно дихлорметане, избытком раствора трифторацетилгалогенида формулы CF3C(O)X, в которой X - галоид, предпочтительно трифторацетилхлорида, в подходящем растворителе, предпочтительно толуоле, при температуре около 0oC.
Соединения формулы XIV /формула I, в которой Q представляет собой CH2N(R4)C(O)OR7)/ могут быть синтезированы обработкой амина V избытком подходящего галоидформиата формулы R7OC(O)X, в которой X - галоид, предпочтительно хлор, в избытке основания, предпочтительно триэтиламина, в подходящем растворителе, таком как дихлорметан или хлороформ, при температуре от приблизительно 0oC до приблизительно комнатной температуры.
Альдегид II может быть получен методом, описанным в патенте США 3294803, т. е. окислением MnO2 спирта, полученного методом, приведенным в патенте США 3711512, или методом, описанным ниже в примерах.
Простые химические превращения, общепринятые и хорошо известные квалифицированным специалистам в области химии, могут быть использованы для замены функциональных групп соединений данного изобретения, например, деалкилирование низший-алкил-ариловых эфиров с получением соответствующих фенольных производных.
Соединения формулы I используются как в форме свободного основания, так и в форме кислотно-аддитивных солей, и обе эти формы охватываются данным изобретением. Кислотно-аддитивные соли в некоторых случаях являются более удобной формой для использования, но на практике использование солевой формы по существу равно использованию основной формы. Кислоты, которые могут быть использованы для получения кислотно-аддитивных солей, включают предпочтительно те, которые при присоединении к свободному основанию образуют приемлемые с медицинской точки зрения соли, т.е. соли, анионы которых относительно безвредны для организма животного при применении соли в медицинской дозе, так чтобы полезное действие, присущее свободному основанию, не было искажено побочным действием, приписываемым анионам. Приемлемыми для практического применения солями данного изобретения являются гидрохлориды, фумараты, толуолсульфонаты, метансульфонаты или малеаты. Однако в сфере данного изобретения заключаются и другие приемлемые с медицинской точки зрения соли, образованные другими минеральными или органическими кислотами. Кислотно-аддитивные соли основных соединений получают либо растворением свободного основания в водном спиртовом растворе, содержащем соответствующую кислоту, и выделением соли упариванием раствора, либо взаимодействием свободного основания с кислотой в органическом растворителе, в этом случае соль выделяется немедленно, высаживается вторым растворителем или может быть получена упариванием раствора. Несмотря на то, что соли основных соединений, приемлемые с медицинской точки зрения, являются предпочтительными, область данного изобретения составляют все кислотно-аддитивные соли. Все кислотно-аддитивные соли являются полезными в качестве источников для получения соединения в форме свободного основания, даже если соль как таковая необходима только как промежуточный продукт, как например, когда соль получена только с целью очистки или идентификации или когда она используется в качестве промежуточного продукта для получения соли, приемлемой с медицинской точки зрения, методами ионного обмена.
Строение соединений данного изобретения было определено методом синтеза и одним или более: элементарным анализом, и методами ИК, УФ и ЯМР спектроскопии. Направление реакций и идентичность и однородность продуктов оценивались методом тонкослойной хроматографии /ТСХ/ или методом газожидкостной хроматографии /ГЖХ/. Температуры плавления даны в градусах Цельсия /oC/ и являются нескорректированными. Исходные продукты являются либо коммерчески доступными либо могут быть получены достаточно известными методами.
Далее изобретение будет иллюстрировано следующими примерами, не ограничивающими однако данное изобретение.
Пример 1. 1-//2-(Диэтиламино)этил/амино/-4- (N-фенилформимидоил)тиоксантен-9-он.
(I: R1=R2=C2H5; Q = CH=N-C6H5; R8 = H; n = 2).
Смесь 17,7 г /50 ммолей/ 1-//2-(диэтиламино)этил/амино-9- оксо-тиоксантен-4-карбоксиальдегида и 15,1 г /150 ммолей/ анилина в 100 мл толуола кипятят в течение 8 часов с насадкой Рино-Старка. Анализ методом ТСХ на алюминии с использованием смеси хлороформ/гексан/изопропиламин в соотношении 10 : 10 : 2 показывает, что реакция прошла не полностью. Толуол отгоняют, добавляют 25 мл анилина и смесь кипятят в течение 4 часов. 50 мл ксилола добавляют и реакционную смесь кипятят снова в течение 3 часов. Растворитель и избыток анилина удаляют под вакуумом, остаток перекристаллизовывают из бензола, в результате чего получают 19,9 г технического продукта. В результате перекристаллизации технического продукта из приблизительно 1,5 л гексана получают 15,8 г /86%/ продукта с т. пл. 125 - 126oC.
Пример 2. N-//1-//2-(Диэтиламино)этил/амино/-9-оксотиоксантен-4- ил/метил формамид.
(I: R1=R2=C2H5; Q = CH2NHCHO; R8 = H; n = 2).
Раствор 35,4 г /0,1 моля/ 1-//2-(диэтиламино)этил/амино-9- оксо-тиоксантен-4-карбоксиальдегида, 420 мл формамида и 50 мл /1 моль/ муравьиной кислоты нагревают до 160oC и выдерживают при этой температуре в течение 1 часа. Реакционную смесь охлаждают, выливают в 2 л воды и подщелачивают приблизительно 50 мл гидроокиси натрия /35%/. Смолистый осадок фильтруют и сушат под вакуумом. Высушенный осадок растворяют в приблизительно 1,5 л теплого этилацетата, обрабатывают углем и кристаллизуют охлаждением. Продукт отфильтровывают, промывают этилацетатом и сушат с получением 29,0 /75%/ продукта с т.пл. 154 - 155oC.
Пример 3. N-//1-//2-(Диэтиламино)этил/амино/-9-оксотиоксантен-4- ил/метил-N-метилформамид.
(IV: R1=R2=C2H5; R4 = CH3; R8 = H; n = 2).
Методом, аналогичным описанному в примере 2, получают 24,6 г N-метилформамида из 35,4 г /0,1 моля/ 1-//2-(диэтиламино)этил/амино- 9-оксотиоксантен-4-карбоксальдегида, 394 г N-метилформамида и 50 мл муравьиной кислоты. Продукт перекристаллизовывают из 150 мл ацетона с получением продукта с температурой плавления 127 - 130o.
Пример 4. 4-(Аминометил)-1-//2-(диэтиламино)этил/амино/- тиоксантен-9-он
(I: R1=R2=C2H5; Q = CH2NH2; R8 = H; n = 2).
Раствор 24,4 г /64 ммоля/ формамида примера 2 в 240 мл 2 н. соляной кислоты нагревают на паровой бане в течение 1 часа. Реакционную массу затем охлаждают до комнатной температуры, подщелачивают 35% водным раствором гидроокиси натрия и образующийся осадок желтого цвета выделяют фильтрованием. Продукт растворяют в бензоле, обрабатывают углем, сушат сульфатом магния, фильтруют и азеотропно сушат для удаления следов влаги. Высушенный остаток перекристаллизовывают из метанола и изопропанола добавлением эфирной соляной кислоты. Образующееся твердое вещество перекристаллизовывают из метанола с получением 10,6 г продукта с температурой плавления 270 - 272o в виде гидрохлоридной соли
Пример 5. 1-//2-(Диэтиламино)этил/амино/-4-(метиламино)- метил/тиоксантен-9-он
(I: R1=R2=C2H5; Q = CH2NHCH3; R8 = H; n = 2).
Методом, точно совпадающим с описанным в примере 4, получают 10,5 г метиламина гидрохлорида полугидрата из 14,6 г /37 ммолей/ N-метилформамида примера 3 и 150 мл 2 н. соляной кислоты. Продукт плавится при 241 - 243o.
Пример 6. N-//1-//2-(Диэтиламино)этил/амино/-9- оксотиоксантен-4-ил/метил/метансульфонамид.
(I : R1 = R2=C2H5; Q = CH2NHSO2CH3; R8 = H; n = 2).
Раствор 10,65 г /30 ммолей/ свободного основания амина, полученного в примере 4, в 100 мл пиридина охлаждают на ледяной бане и добавляют к нему в виде одной порции 4 г /35 ммолей/ метансульфонилхорида. Смесь перемешивают в течение 2 часов при комнатной температуре и приливают к 750 мл воды, содержащей 2 г гидроокиси натрия. Темно-желтый осадок собирают, промывают и оставляют сушиться под вакуумом в течение ночи. Вторую порцию получают добавлением избытка гидроокиси натрия к фильтрату и фильтрованием полученного твердого вещества. Осадки соединяют и после высушивания перекристаллизовывают из бензола с получением 6,4 г метансульфонамида с т.пл. 169-170o.
Пример 7. 1-//2'-(Диэтиламино)этил/амино/-9-оксотиоксантен-4- карбоксамид.
([I : R1=R2=C2H5; Q = CONH2; R8 = H; n = 2).
Суспензию 74 г /0,23 моля/ 1-//2-(Диэтиламино)этил/амино/- 9-оксо-тиоксантен-4-карбоксальдегида и 74 г /1,06 моля/ гидроксиламина гидрохлорида в 400 мл пиридина и 400 мл этанола кипятят в течение 0,5 часа, после чего для получения гомогенного раствора добавляют 70 мл воды. Раствор нагревают еще 2 часа и оставляют на 14 часов при комнатной температуре. Образующийся кристаллический оксим фильтруют и получают с количественным выходом продукт с т. пл. 215-218oС.
123 г оксима нагревают быстро на паровой бане в 180 мл уксусного ангидрида до получения раствора. Раствор охлаждают, добавляют 100 мл 1,8 M HCl в эфире и образующуюся суспензию растворяют в 500 мл диэтилового эфира. Суспензию выдерживают при температуре 0o в течение 14 часов и фильтруют. Остаток /123 г, т.пл. 109-112oC/ суспендируют в 250 мл ксилола и кипятят в течение 20 минут. Смесь охлаждают и фильтруют с получением 71,3 г нитрила с т. пл. 265oС.
10 г нитрила перемешивают в 200 мл концентрированной H2SO4 при комнатной температуре в течение 3 дней. Реакционную смесь нейтрализуют концентрированным NH4OH и остаток фильтруют. Остаток смешивают с теплой смесью этилацетата и этилового спирта, фильтруют и кристаллизуют продукт из охлажденного раствора с получением продукта с т.пл. 241-243oС. Его растворяют в этаноле и добавляют один г/эквивалент HCl в этаноле. Получают 6 г амида гидрохлорида с т.пл. 271-272o.
Пример 8. N-//1-//-(Диэтиламино)этил)амино/-9-оксотиоксантен-4-ил/метил/- N-метилметансульфонамид.
(I : R1=R2 = C2H5; Q = CH2N(CH3)SO2CH3; R8 = H; n = 2).
Раствор 1,5 г /3,5 ммоля/ метансульфонамида, полученного в примере 6, в тетрагидрофуране /ТГФ/ /60 мл/ охлаждают до 0oC на ледяной бане и добавляют 0,16 г /4,0 ммоля/ NaH. Реакционную смесь подогревают до комнатной температуры, перемешивают в течение 10 минут, после чего добавляют метилйодид - 0,25 мл /4,0 ммоля/. Реакционную смесь перемешивают при комнатной температуре в течение 24 часов, затем растворитель удаляют под вакуумом. Осадок подвергают очистке методом колоночной хроматографии на двуокиси кремния с элюированием хлороформом /100%/ затем 1% изопропиламин/хлороформом с получением 1,15 г /74%/ N-метилметансульфонамида в виде желтого порошка с т.пл. 175-177oC. Свободное основание также обрабатывают метансульфоновой кислотой в метаноле с получением метансульфонатной соли с т. пл. 194 - 195,5oC /обозначенная далее как пример 8a/.
Пример 9. N-//1-//2-(Диэтиламино)этил/амино/-9- оксотиоксантен-4-ил/метил/фенилсульфонамид.
(I : R1=R2=C2H5; Q = CH2NHSO2C6H5; R8 = H; n = 2).
Методом, аналогичным описанному в примере 6, получают 2,4 г /57%/ фенилсульфонамида в виде соли метансульфоновой кислоты из 2,5 г /7,15 ммоля/ свободного основания амина примера 4, пиридина /50 мл/ и бензолсульфонил хлорида /1,1 мл, 8,62 ммоля/, с последующей обработкой метансульфоновой кислотой в метаноле. Полученный продукт перекристаллизовывают из этанола.
Пример 10. N-//1-//2-(Диэтиламино)этил/амино/-9-оксо-тиоксантен- 4-ил/-метил/ацетамид.
(I : R1=R2 = C2H5; Q = CH2NHC(O)CH3; R8 = H; n = 2).
Методом, аналогичным описанному в примере 2, получают 2,3 г /52%/ ацетамида в виде твердого вещества оранжевого цвета из 4,15 г /11,7 ммоля/ свободного основания амина примера 4, пиридина /60 мл/ и ацетилхлорида /0,82 мл, 11,53 ммоля/. Продукт перекристаллизовывают из ацетона с получением твердого вещества с температурой плавления 182 - 183oC.
Пример 11. N-//1-//2-(Диэтиламино)этил/амино/-9-оксотиоксантен- 4-ил/метил/бензамид.
(I : R1 = R2 = C2H5; Q = CH2NHC(O)C5H6; R8=H; n = 2).
Методом, аналогичным описанному в примере 6, получают 1,02 г /68%/ бензамида в виде желтого порошка из 1,17 г /3,29 ммоля/ свободного основания амина примера 4, пиридина /25 мл/ и бензолхлорида /0,42 мл, 3,62 ммоля/. Продукт подвергают очистке методом колоночной хроматографии на двуокиси кремния, элюируя хлороформом, начиная со 100% хлороформа до 1% изопропиламин/хлороформ, с последующей перекристаллизацией из этилацетата. Продукт плавится при 161 - 163oC.
Пример 12. N-//1-//2-(Диэтиламино)этил/амино/-9-оксотиоксантен- 4-ил/диэтил/фосфоамид.
(I : R1=R2=C2H5; Q = CH2NHP(O)(OC2H5)2; R8 = H; n = 2).
Раствор 2,28 г /6,48 ммоля/ свободного основания амина примера 4, CH2Cl2 /50 мл/ и триэтиламина /2 мл/ при 0oC обрабатывают диэтилфосфорохлоридатом /1,0 мл, 6,9 ммоля/. Реакционную смесь перемешивают в течение 2 часов при 0oC, затем 1 час при комнатной температуре. Растворитель удаляют под вакуумом, остаток подвергают очистке методом колоночной хроматографии на двуокиси кремния, элюируя этилацетатом /100%/, затем 5% метанол/этилацетатом, и, наконец, смесью метанол/изопропиламин/ этилацетат в соотношении 5/5/90 с получением 2,28 г /72%/ диэтилформамида в виде твердого вещества желтого цвета с т.пл. 108 - 110oC после перекристаллизации из этилацетата.
Пример 13. N-//1-//2-(Диэтиламино)этил/амино/-9-оксотиоксантен- 4-ил/метил/-N-этилформамид.
(IV: R1 = R2 = C2H5; R4 = C2H5; R8 = H; n = 2).
Раствор 2,0 г /5,6 ммоля/ 1-//2-(Диэтиламино)этил/амино/- 9-оксотиоксантен-4-карбоксальдегида, N-этилформамида /24 мл/ и муравьиной кислоты /3,0 мл, 79,5 ммоля/ нагревают до 170oC и выдерживают при этой температуре в течение 4 часов. Затем реакционную смесь охлаждают, выливают в воду и подщелачивают 10% гидроокисью натрия. Образующееся твердое вещество собирают фильтрованием и промывают водой. Твердый остаток экстрагируют смесью хлороформ/вода, органический слой отделяют и сушат Na2SO4. Растворитель отгоняют под вакуумом и остаток подвергают очистке методом радиальной хроматографии элюируя смесью изопропиламин/метанол/этилацетат в соотношении 0,1:1:98 с получением 1,32 г /57%/ N-этилформамида в виде твердого вещества оранжевого цвета с т.пл. 75 - 77o.
Пример 14. 1-//2-Диэтиламино этил/амино/-4-(этиламино)метил/тиоксантен-9-он
(I : R1=R2 = C2H5; Q = CH2NHC2H5; R8 = H; n = 2).
Методом, аналогичным описанному в примере 4, получают 1,29 г /92%/ этиламина в форме дигидрохлорида из 1,3 г /3,2 ммоля/ N-этилформамида примера 13 и 10,8 мл 2 н. соляной кислоты. Продукт перекристаллизовывают из смеси этанол/тетрагидрофуран, после чего он имеет температуру плавления 160oC /разл./
Пример 15 1-//2-Диэтиламино/этил/амино/-4- (диметиламинометиленаминометил)тиоксантен-9-он тригидрохлорид.
(I : R1 = R2 = C2H5 = C2H5; Q = CH2N = CHN(CH3)2; R8 = H; n = 2).
N-//1-//2-(Диэтиламино)/этил/амино/-2-оксотиоксантен-4-ил/метил/формамид /3 г/ разбавляют 50 мл 2н. HCl и раствор нагревают на паровой бане в течение 90 минут. Смесь охлаждают, подщелачивают до pH 10 35%-ной водной гидроокисью натрия и экстрагируют в хлороформе. Органический слой отделяют, фильтруют через K2CO3, упаривают в вакууме и полученный технический продукт используют в реакции с диметилформамидиметилацеталем, которая протекает при температуре 60oC в течение ночи. Избыток ДМФ-диметилацеталя удаляют под вакуумом, требуемое заглавное соединение подвергаю очистке методом тонкослойной хроматографии /силикагель; хлороформ: и-C3H7:CH3OH = 98:1:1/. Полученные продукты растворяют в 2,5 M HCl /C2H5OH / 100 мл/, охлаждают на ледяной бане, фильтруют и сушат, в результате чего получают 2,38 г 1-//2-(диэтиламино)-этил/амино/-4- (диметиламинометиленаминометил)-тиоксантен-9-она тригидрохлорида в виде твердого вещества оранжевого цвета, т.пл. 258 - 260oC.
Пример 16. N-//1-//2-Диэтиламино этил/амино/-O-оксотеоксантен- 4-ил/= метил/трифторацетамид.
(I : R1 = R2 = C2H5; Q = CH2NHC(O)CF3; R8 = H; n = 2).
Раствор 2-аминометил-1-//2-(диэтиламино)этил/амино/тиоксантен- 9-она /2,91 г; 8,19 ммоля/ в 80 мл метиленхлорида при температуре 0oC обрабатывают трифторацетилхлоридом /14,75 мл 0,61 М раствор в толуоле; 9,0 ммоля/, реакционную смесь перемешивают в течение 90 минут. Смесь упаривают под вакуумом и остаток подвергают очистке методом тонкослойной хроматографии /селикагель; C2H5OCOCH3 /100%/, затем 2%-ный изопропиламин/этилацетат/, а затем перекристаллизовывают из этилацетата с получением 2,52 г /68%/ продукта в форме свободного основания с т.пл. 189 - 190oC /пример 16/. Свободное основание растворяют в метаноле и обрабатывают метансульфоновой кислотой /0,55 г, 5,72 ммоля/ с получением метансульфоната с т.пл. 152 - 154oC после перекристаллизации из ацетона /пример 16a/.
Пример 17.
(a) Смесь тиосалициловой кислоты /50,14 г, 0,33 моля/ и уксуснокислой меди /5,0 г/ в ДМСО /500 мл доводят до кипения и порциями добавляют карбонат калия /54,3 г/. Затем шприцем вводят в смесь 3-бромхлорбензол /42 мл, 0,36 моля/ и смесь кипятят в течение 3 часов. Реакционную смесь выливают в воду, обрабатывают углем и фильтруют через целит. Фильтрат подкисляют концентрированной HCl и образующийся осадок выделяют фильтрацией, промывают водой и сушат под вакуумом при 60oC с получением 75,01 г /86%/ 2-/(3-хлорфенил)- тио/бензойной кислоты.
(б) К раствору концентрированной H2SO4 при 0oC при перемешивании добавляют 2-/(3-хлорфенил)тио/бензойной кислоты /75,00 г 0,28 моля/ в течение часа. После этого смесь перемешивают еще 2 часа, выливают в концентрированный раствор NH4OH /500 мл/ в воде /2,5 л/, образующийся осадок выделяют фильтрованием, промывают водой и сушат под вакуумом при 60oC с получением 65,9 г /95%/ смеси 1-хлор и 3-хлортиоксантен-9-онов.
(в) Смесь 1-хлор- и 2-хлортиоксантен-9-онов /14,01 г, 56,8 ммоля/, пиридина /20 мл/ и диэтиламинопропиламина /5,13 г, 39,4 ммоля/ кипятят до тех пор, пока реакция не пройдет полностью. Подогрев снимают, растворитель отгоняют под вакуумом, остаток помещают в хлороформ и подвергают очистке методом колоночной хроматографии на двуокиси кремния, с элюированием сначала хлороформом для удаления непрореагировавшего 3-хлоризомера, а затем 5%-ным раствором изопропиламина в хлороформе с получением 5,10 г /54%/ 1-//3-(диэтиламино)пропил/амино/тиоксантен-9-она в виде оранжевого смолистого вещества.
(г) Смесь 1-//3-диэтиламино пропил/амино/тиоксантен-9-она /5,10 г, 15,0 ммоля/, формалина /160 мл/ и 5 н. уксусной кислоты /0,8 мл/ нагревают до 90oC и выдерживают при этой температуре 16 часов, добавляют дополнительное количество уксусной кислоты /0,20 мл/, затем формалин /50 мл/ и смесь нагревают снова до 90oC и выдерживают при этой температуре приблизительно 57 часов. После этого смесь разбавляют водой, подщелачивают 5 н. раствором NaOH и экстрагируют хлороформом. Органический слой сушат Na2SO4 и пропускают через колонку с двуокисью кремния, элюируя сначала 2%-ным раствором метанола в хлороформе, а затем смесью изопропиламин/метанол/хлороформ в соотношении 2/2/96 с получением 3,82 г /69%. 1-//(диэтиламино)пропил/амино/-4-гидроксиметилтиоксантен-9-она в виде оранжево-коричневого смолистого вещества.
(д) 1-//3-Диэтиламино пропил/амино/-9-оксотиоксантен-4-карбоксальдегид.
(II: R1= R2=C2H5; R8=H, n = 3).
Смесь 1-//3-(диэтиламино)пропил/амино/-4-гидроксиметилтиоксантен-9-она /3,82 г/, толуола /60 мл/ и окиси марганца /7,5 г/ кипятят в течение 6,5 часов. Смесь охлаждают до комнатной температуры, фильтруют через целит и фильтрат упаривают под вакуумом с получением 3,3 г /87%/ продукта в виде коричневого масла.
/е/ 1-//-(Диэтиламино)пропил/амино/-4-(метиламинометил)тиоксантен-9-он дигидрохлорид 3/2 гидрат.
(I: R1=R2=C2H5; Q=CH2NHCH3; R8=H; n=3).
Раствор 1-//3-(диэтиламино)пропил/амино/-9-оксатиоксантен-4- карбоксальдегида/ 3,3 г, 8,96 ммоля/ и 3 г муравьиной кислоты в 50 мл N-метилформамида кипятят в течение 2 часов. Смесь подщелачивают 5 мл 5 н. раствора гидроокиси натрия и экстрагируют в хлороформе /3 х 150 мл/. Органический слой сушат сульфатом натрия, упаривают под вакуумом, полученный технический продукт в виде масла растворяют в 3 н. водном растворе соляной кислоты /50 мл/ и нагревают на паровой бане в течение 3 часов. Затем смесь охлаждают, подщелачивают 30 мл водного 35%-ного раствора NaOH, экстрагируют в хлороформе /3х150 мл/, органический слой сушат сульфатом натрия и упаривают под вакуумом с получением коричневого масла, которое подвергают очистке методом тонкослойной хроматографии /селикагель; 5% триэтиламин/диэтиловый эфир, затем 5% (C2H5)3 N/этилацетат, затем триэтиламин:метанол:этилацетат=5:5:90/ с получением 1,1 г 1-//3-(диэтиламино)пропил/амино/-4-(метиламино)/-4-метиламинометил тиоксантен-9-он в виде прозрачного смолистого вещества оранжевого цвета. Этот продукт превращают в соответствующий дигидрохлорид взаимодействием с 6 н.HCl в диэтиловом эфире с получением 1,04 г дигидрохлорида 3/2 гидрата в виде порошка желтого цвета с т.пл. 222 - 224oC.
Пример 18.
(а) Смесь 1-хлор и 3-хлортиоксантен-9-онов /20 г/, пиридина /40 мл/ и N-диметилэтилендиамина /11 мл/ кипятят в течение приблизительно 22 часов, затем растворитель удаляют под вакуумом. Остаток соединяют c техническим продуктом /3,51 г/, полученным в результате трех аналогичных экспериментов, и смесь подвергают очистке методом колоночной хроматографии на двуокиси кремния, элюируя сначала хлороформом, затем 1%-ный раствором изопропиламина в хлороформе с получением 13,4 г 1-//2-(диметиламино)этил/амино/тиоксантен-9-она.
(б) Смесь 1-//2-(диметиламино)/этил/амино/-тиоксантен-9-она /13 г, 0,044 моля/, 37%-ного формалина /390 мл/ и 5 н. уксусной кислоты /6,5 мл/ нагревают до 100oC и выдерживают при этой температуре в течение 8,5 часов, затем оставляют на два дня, после чего снова нагревают до 100oC и выдерживают при этой температуре еще несколько часов. Смесь выливают в ледяную воду, подщелачивают 35%-ным раствором NaOH и экстрагируют хлороформом. Органический слой промывают рассолом, сушат сульфатом натрия и упаривают под вакуумом. Остаток подвергают очистке методом колоночной хроматографии на двуокиси кремния, элюируя последовательно: 25%-ным раствором CHCl3 в гексане; 50%-ным раствором хлороформа в гексане; 75%-ным раствором хлороформа в гексане; 100%-ным хлороформом; 0,5%-ным раствором изопропиламина в хлороформе; 1%-ным раствором изопропиламина в хлороформе; 2%-ным раствором изопропиламина в хлороформе и смесью изопропиламин:метанол:хлороформ в соотношении 2:2:96 с получением 9,2 г /64%/ 1-//2-(диметиламино)этил/амино/-4- гидроксиметил тиоксантен-9-она.
(в) 1-//2-(Диметиламино)этил/амино/-9-оксотиоксантен-4- карбоксальдегид.
(формула II: R1=R2=CH3; R8=H; n=2).
Смесь 1-//2-(диметиламино)этил/амино/-4-(гидроксиметил) тиоксантен -9-она /9,2 г, 0,028 моля/ в толуоле /322 мл/ нагревают до приблизительно 60oC, и затем к смеси добавляют двуокись марганца /MnO2, 16 г/, смесь нагревают до 60oC и выдерживают при этой температуре в течение 1 часа. Смесь фильтруют и фильтрат упаривают под вакуумом с получением 7,9 г /87%/ продукта.
(г) N-//1-//2-(Диметиламино)этил/амино/-9-оксотиоксантен-4-ил/ метил/формамид.
(I: R1=R2=CH3; Q=CHNHCHO; R8=H; n=2).
Смесь 1-//2-диметиламино этил/амино/-9-оксотиоксантен-4- карбоксальдегида /4,75 г/, формамида /66,5 мл/ и муравьиной кислоты /7,6 мл/ нагревают до 170oC и выдерживают при этой температуре в течение 4 часов. Смесь выливают в ледяную воду /250 мл/ подщелачивают 35%-ным раствором NaOH и экстрагируют хлороформом. Органический слой промывают водой /дважды/, затем раствором поваренной соли - один раз, раствор сушат сульфатом натрия и упаривают под вакуумом с получением 6,2 г продукта.
(д) 4-(Аминометил)-1-//2-(диметиламино)этил/амино/-9- оксотиоксантен-9-он дигидрохлорид•1/2 гидрат.
(I: R1=R2=CH3; Q=CH2NH2; R8=H; n=2).
Смесь N-//1-//2-(диметиламино)этил/амино/-9- оксатиоксантен-4-ил/метил/формамида /6,2 г/ и 2 н. HCl /52 мл/ нагревают до 100oC и выдерживают при этой температуре в течение 1,5 - 2 часов. Реакционную смесь выливают в ледяную воду, подщелачивают 35%-ным раствором NaOH и экстрагируют хлороформом. Органический слой промывают водой /дважды/, затем рассолом /один раз/, сушат сульфатом натрия и упаривают под вакуумом. Остаток подвергают очистке методом колоночной хроматографии, элюируя последовательно этилацетатом, 0,5%-ным раствором триэтиламино в этилацетате, 2%-ным раствором триэтиламина в этилацетате, 1 - 2%-ным раствором изопропиламина в этилацетате и, наконец, смесью метанол:изопропиламин: хлороформ в соотношении 2:(1 - 2):(97 - 96) с получением 3,3 г /58%/ продукта в виде свободного основания. Порцию свободного основания растворяют в метаноле и обрабатывают концентрированной HCl /3,3 мл/ в метаноле /6 мл/ с получением 1,2 г продукта в форме дигидрохлорида•1/2 гидрата с т.пл. 213oC /разл./.
(е) N-//1-//2-(Диметиламино)этил/амино/-9-оксотиоксатен-4- ил/метил/метансульфонамид метансульфонат.
([I: R1=R2=CH3; Q=CH2NHSO2CH3; R8=H; n=2).
4-(Аминометил)-1-//2-(диметиламино)/этил/амино/-9- оксотиоксантен-9-он/ 2 г, 6 ммоля/ в 30 мл сухого пиридина перемешивают при комнатной температуре до получения раствора. Раствор охлаждают на ледяной бане, добавляют по каплям раствор 0,52 мл /6,7 ммоля/ метансульфонилхлорида в охлажденном пиридине и смесь перемешивают в течение 1 часа при комнатной температуре. Реакционную смесь выливают в 500 мл воды, содержащий 0,51 г гидрокоокиси натрия, экстрагируют хлороформом, органический слой дважды промывают водой и рассолом, сушат безводным сульфатом натрия. Смесь фильтруют и упаривают под вакуумом. Остаток /2,5 г/ переносят в диэтиловый эфир, фильтруют, сушат с получением 2 г продукта с т.пл. 126 - 127oC. Свободное основание растворяют в метаноле и обрабатывают метансульфоновой кислотой /0,48 г/ с получением 2,0 г /67%/ продукта в форме соли метансульфоновой кислоты с т.пл. 168oC (разл./.
Пример 19.
(а) Методом, аналогичным описанному в примере 17/в/, получают 6,83 г 1-//3-(диметиламино)пропил/амино/тиоксантен-9-она из смеси 1-хлор- и 3-хлортиоксантен-9-онов /15,15 г, 61,4 ммоля/, пиридина /20 мл/ и диметиламинопропиламина /6,01 г, 59,1 ммоля/.
(б) Методом, аналогичным описанному в примере 17/г/, получают 6,74 г /90%/ 1-//3-(диметиламино)пропил/амино/-4-(гидроксиметил)- тиоксантен-9-он из 1-//3-(диметиламино)пропил/амино/тиоксантен-9-она /6,8 г, 21,9 ммоля/, формалина /175 мл/ из ледяной уксусной кислоты /0,75 мл/.
(в) 1-//3-(Диметиламино)пропил/амино/-9-оксотиоксантен-4- карбоксальдегид.
(II: R1=R2=CH3; R8=H; n=3).
Методом, аналогичным описанному в примере 17/д/, получают продукт из 1-//3-диметиламино пропил/амино/-4-гидроксиметилтиоксантен -9-она /6,7 г/, толуола /80 мл/ и двуокиси марганца /12,15 г/. Продукт подвергают очистке методом колоночной хроматографии на двуокиси кремния, элюируя сначала хлороформом /100%/, а затем 1% раствором изопропиламина в хлороформе.
(г) N-//1-//3-диметиламино)пропил/амино/-9-оксотиоксантен-4- ил/метил/-N-метилформамид.
(IV: R1=R2=CH3; R4=CH3; R8=H; n=3/.
Смесь N-метилформамида /50 мл/, муравьиной кислоты /5,2 г/ и 1-//3-диметиламин/пропил/амино/-9-оксотиоксантен-4-карбоксальдегида /4,14 г, 12,16 ммоля/ кипятят в течение 3 часов. Смесь разбавляют водой /250 мл/, подщелачивают 35%-ным раствором NaOH и экстрагируют хлороформом /3х150 мл/. Органический слой сушат сульфатом натрия, пропускают через фильтр с двуокисью кремния, элюируя хлороформом /100%/, затем 2%-ным раствором изопропиламина в хлороформе с получением 3,93 г /84%/ продукта.
(д) 1-//3-Диметиламино)пропил/амино/-4-(метиламинометил) тиоксантен-9-он дигидрохлорид моногидрат.
(I: R1=R2=CH3; Q=CH2NHCH3; R8=H; n=3).
Раствор полученного ранее N-метилформамида /3,83 г, 10 ммоля/ в 40 мл 3 н. HCl выдерживают на паровой бане в течение 3 часов, нейтрализуют 35%-ным раствором NaOH и охлаждают на ледяной бане в течение 1 часа. Жидкий слой декантируют и технический продукт растворяют в хлороформе, фильтруют через силикагель, элюируя сначала хлороформом, затем 1%-ным раствором изопропиламина в хлороформе с получение 2,38 г требуемого амина в виде смолистого вещества оранжевого цвета. Продукт превращают в соответствующую соль соляной кислоты растворением в метаноле и обработкой концентрированной соляной кислотой, в результате чего получают 0,98 г дигидрохлорида моногидрата с т.пл. 228 - 229oC.
Пример 20.
(а) N-//2-(Диметиламино)этил/амино/-9-оксотиоксантен-4-ил/ метил/-N-метилформамид.
(IV: R1=R2=CH3; R4 = CH3; R8 = H; n = 2).
Смесь 1-//2-(диметиламино)этил/амино-9-оксотиоксантен-4- карбоксальдегида /4,75 г, 0,15 моля/, N-метилформамида /48 мл/, муравьиной кислоты нагревают до 170oC в течение 4,5 часов и затем оставляют при комнатной температуре на приблизительно 64 часа. Реакционную смесь выливают в воду /250 мл/, подщелачивают 35%-ным раствором NaOH, экстрагируют хлороформом /три раза/. Органический слой отделяют, промывают водой /два раза/, затем рассолом, и сушат сульфатом натрия. Растворитель отгоняют под вакуумом с получением 5,75 г продукта.
(б) 1-//2-(Диметиламино)этил/амино/-4-/(метиламино)- метил/тиоксантен-9-он дигидрохлорид•5/4 гидрат.
(I: R1=R2=CH3; Q = CH2NHCH3; R8 = H; n = 2).
Методом, аналогичным описанному в примере 19/д/, получают 1,8 г 1-//2-(диметиламино)этил/амино/-4-/(метиламино)метил/тиоксантен-9-он из 5,7 г /15,4 ммоля/ соответствующего N-метилформамида примера 20 (а) и 50 мл 2 н. HCl, после очистки свободного основания методом колоночной тонкослойной хроматографии /силикагель, хлороформ, 0,5%-ный раствор изопропиламина в хлороформе/. Свободное основание переводят в солевую форму дигидрохлорид • 5/4 гидрата обработкой концентрированной соляной кислотой в метаноле с получением 1,8 г /30%/ продукта с т.пл. 177oC /разл./
Пример 21.
(а) N-//1-//3-(Диметиламино)пропил/амино/-9-оксотиоксантен- 4-ил/метилформамид.
(I: R1=R2=CH3; Q = CH2NHCO; R8 = H; n = 3).
Раствор 1-//3-(диметиламино)пропил/амино-9-оксотиоксантен-4- карбоксальдегида /3,6 г; 10,57 ммоля/ в 50 мл формальдегида, содержащем 3,6 г муравьиной кислоты, кипятят в течение 1,5 часов и затем оставляют при комнатной температуре на ночь. Реакционную смесь разбавляют водой /400 мл/, подщелачивают 3 мл 5 н. раствора NaOH, интенсивно перемешивают в течение 30 минут, образующийся осадок фильтруют, промывают водой и сушат, в результате чего получают 3,1 г /79%/ продукта в виде желтого порошка.
(б) 4-Аминометил-1-//3-(диметиламино)пропил/амино/тиоксантен- 9-он.
(I: R1=R2=CH3; Q = CH2NH2; R8 = H; n = 3).
Раствор формамида примера 21 (а) - /2,98 г; 8,07 ммоля/ в 40 мл 3 н. HCl нагревают на паровой баре в течение 4 часов, затем дают охладиться до комнатной температуры, охлаждают на ледяной бане, нейтрализуют до pH 8 5 н. раствором NaOH. Образующуюся гомогенную смесь экстрагируют хлороформом /5 x 100 мл/, органический слой сушат сульфатом натрия и фильтруют через слой силикагеля /элюируя сначала 5%-ным раствором триэтиламина в диэтиловом эфире, затем 1 - 5%-ным раствором изопропанола в хлороформе/ с получением 2,3 г /83%/ продукта в виде масла светло-желтого цвета.
(в) N-//1-//3-(Диметиламино)пропил/амино/-9-оксотиоксантен- 4-ил/метансульфонамид метансульфонат • 1/2 гидрат.
(I: R1=R2=CH3; Q = CH2NHSO2CH3; R8 = H; n = 3).
К холодному раствору амина примера 21 /б/, охлажденному на ледяной бане, /2,2 г, 6,44 ммоля/ в пиридине добавляют метансульфонилхлорид /0,51 мл, 6,59 ммоля/ и образующуюся смесь перемешивают при комнатной температуре в течение ночи. Смесь разбавляют хлороформом, пропускают через толстый слой селикагеля, элюируя 5%-ным раствором триэтиламина в этилацетате, с получением 1,32 г N-//1-//3-(диметиламино)пропил/амино/-9-оксотиоксантен- 4-ил/метансульфонамида в виде желтого порошка. Свободные основание растворяют в метаноле /10 мл/ и обрабатывают метансульфоновой кислотой /0,31 г, 1 эк/ в метаноле, в результате получают 1,38 г соли метансульфонат • 1/2 гидрата в виде твердого вещества оранжевого цвета с т.пл. > 107oC.
Пример 22. N-//1-//2-(Диэтиламино)этил/амино/-9- оксотиоксантен-4-ил/метил/-N-метилэтансульфонамид метансульфонат.
(I: R1=R2=C2H5; Q = CH2N(CH3)SO2C2H5; R8 = H; n = 2).
Раствор 2,03 г /5,49 ммоля/ 1-//2-(диэтиламино)этил/амино/- 4-(метиламино)метил/-тиоксантен-9-она /получен методом, описанным в примере 5/ и триэтиламина в 45 мл метиленхлорида охлаждают до 0oC и обрабатывают этансульфонилхлоридом /0,74 г, 5,76 ммоля/. После выдерживания полученного раствора в течение 15 минут при 0oC, реакционную смесь перемешивают при комнатной температуре в течение 72 часов. Смесь упаривают под вакуумом, остаток растворяют в хлороформе и подвергают очистке, пропуская через слой силикагеля /хлороформ, затем 1%-ный раствор триэтиламина в хлороформе/, в результате получают 2,43 г /96%/ N-//1-//2-(диэтиламино)этил/- амино/-9-оксатиоксантен-4-ил/метил/-N-метилэтансульфонамида. Сульфонамид перекристаллизовывают из этилацетата и обрабатывают метансульфоновой кислотой в изопропаноле с получением продукта в форме соли метансульфоновой кислоты с т.пл. 159 - 161oC.
Пример 23. N-//1-//2-(Диэтиламино)этил/амино/-9- оксотиоксантен-4-ил/метил/(p-метокси)бензолсульфонамид метансульфонат.
(I: R1=R2=C2H5; Q = CH2NHSO2C6H4-p-OCH3; R8 = H; n = 2).
Раствор 1,40 г /3,94 ммоля/ 4-(аминометил)-1-//2- (диэтиламино)этил/амино/тиоксантен-9-она /получен методом, описанным в примере 4/ в 30 мл хлороформа, содержащих 1,5 мл триэтиламина, охлаждают до 0oC и обрабатывают p-метоксибензолсульфонилхлоридом /0,83 г, 4,02 ммоля/. После выдерживания реакционной смеси при 0oC в течение 10 минут, реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Хлороформ отгоняют под вакуумом, остаток растворяют в 100 мл метиленхлорида, содержащих 1 мл триэтиламина, и обрабатывают дополнительным p-метоксибензолсульфонилхлоридом /0,85 г/ при перемешивании при комнатной температуре. Смесь упаривают под вакуумом, остаток подвергают очистке, пропуская через слой силикагеля /1% триэтиламина в хлороформе/, с получением 1,57 г N-//1-//2-диэтиламино этил/амино/-9-оксотиоксантен-4-ил/метил/-p-метоксибензолсульфонамида. Сульфонамид обрабатывают метансульфоновой кислотой /0,3 г/ в смеси изопропанол/изопропанол/метанол с получением 1,07 г соли метансульфоновой кислоты с т.пл. 133 - 137oC.
Пример 24. N-//1-//2-(Диэтиламино)этил/амино/-9-оксотиоксантен- 4-ил/метил/этинсульфонамид метансульфонат.
(I: R1=R2=C2H5; Q = CH2NHSO2C2H5; R8 = H; n = 2).
Раствор 2,5 г 4-(аминометил)-1-//2-(диэтиламино)этил/амино/- тиоксантен-9-она /получен методом, описанным в примере 4/ в 30 мл пиридина охлаждают на ледяной бане, выдерживают 15 минут и быстро по каплям добавляют 0,95 г этансульфонилхлорида в 5 мл пиридина, после чего реакционную смесь перемешивают при комнатной температуре в течение часа. Смесь выливают в 75 мл воды, содержащих 0,75 г NaOH, экстрагируют хлороформом, органический слой промывают водой /дважды/ и рассолом и сушат сульфатом натрия. Смесь упаривают под вакуумом и остаток смешивают с диэтиловым эфиром и сушат /40oC/0,1 мм/ с получением 1,7 г N-//1-//2-(Диэтиламино)этил/амино/-9- оксотиоксантен-4-ил/метил/этансульфонамида с т.пл. 105oC /разл./ Сульфонамид растворяют в метаноле и обрабатывают метансульфоновой кислотой в метаноле, в результате чего получают 1,61 г /42%/ соли метансульфоновой кислоты с т.пл. 135oC /разл./
Пример 25. N-//1-//2-(Диэтиламино)этил/амино/-9- оксотиоксантен-4-ил/метил/-N-этилметансульфонамид.
(I: R1=R2=C2H5; Q = CH2N(C2H5)SO2CH3; R8 = H; n = 2).
Раствор 2,10 г /5,48 ммоля/ 1-//2-(диэтиламино)этил/амино/- 4-/(этиламино)метил/-тиоксантен-9-она /получен методом, описанным в примере 14/ в 30 мл метиленхлорида охлаждают до 0oC, обрабатывают 2 мл триэтиламина и метансульфонилхлорида /0,7 мл/ и реакционную смесь перемешивают при комнатной температуре в течение 6 часов. Растворитель отгоняют под вакуумом, остаток растворяют в хлороформе и раствор очищают, пропуская через слой силикагеля /элюируя хлороформом, а затем 2%-ным раствором триэтиламина в хлороформе/. В результате перекристаллизации из этилацетата с последующей сушкой получают 1,11 г /44%/ продукта в виде порошка желтого цвета с т. пл. 172 - 176oC.
Пример 26. N-//1-//2-(Диэтиламино)этил/амино/-9- оксотиоксантен-4-ил/метил/-3,4-дихлорбензолсульфонамидметансульфонат • 1/2 гидрат
(I: R1=R2=C2H5; Q = CH2NHSO2C6H3 - 3,4-дихлор; R8 = H; n = 2).
К раствору 3,4-дихлорбензолсульфонилхлорида /1,84 г, 7,5 ммоля/ в 35 мл сухого пиридина добавляют 2,5 г /7 ммоля/ 4-аминометил-1-//2-(диэтиламино)этил/амино/тиоксантен-9-она /получен методом, описанным в примере 4/ под атмосферой азота и реакционную смесь перемешивают при комнатной температуре в течение 15 минут, а затем оставляют приблизительно на 72 часа. Реакционную смесь выливают в 75 мл воды, содержащих 0,75 г NaOH и экстрагируют хлороформом. Органический слой промывают дважды водой и рассолом, сушат сульфатом натрия. Хлороформ отгоняют под вакуумом, остаток перекристаллизовывают из этанола с получением 1,24 г N-//1-//2-(Диэтиламино)этил/амино/-9-оксотиоксантен-4-ил/метил/- 3,4-дихлорбензолсульфонамида с т.пл. 95oC /разл./. Свободное основание растворяют в метаноле и обрабатывают метансульфоновой кислотой в метаноле с получением метансульфонат • 1/2 гидрата с т.пл. 55oC /разл./
Пример 27. N-//1-//2-(Диэтиламино)этил/амино/-9- оксотиоксантен-4-ил/метил/-2-фторбензолсульфонамид.
(I: R1=R2=C2H5; Q = CH2NHSO2C6H4-2-F; R8 = H; n = 2).
Раствор 1,36 г /3,83 ммоля/ 4-(аминометил-1-//2- (диэтиламино)этил/амино/тиоксантен-9-она /получен методом, описанным в примере 4/ в 25 мл метиленхлорида, содержащих 1 мл триэтиламина, охлаждают до 0oC и обрабатывают 2-фторбензолсульфонилхлоридом /0,84 г, 4,32 ммоля/, после чего реакционную смесь перемешивают в течение нескольких часов. Растворитель отгоняют под вакуумом, остаток растворяют в хлороформе и подвергают очистке методом тонкослойной хроматографии /силикагель : хлороформ, затем 1%-ный раствор триэтиламина в хлороформе/. Растворитель удаляют под вакуумом и в результате перекристаллизации из этилацетата получают 1,08 г /55%/ продукта в виде порошка оранжевого цвета с т.пл. 125 - 127oC.
Пример 27. N-//1-//2-(Диэтиламино)этил/амино/-9- оксотиоксантен-4-ил/метил/-N-пропилметансульфонамид.
(I: R1=R2=C2H5; Q = CH2N(C3H7)SO2CH3; R8 = H; n = 2).
Масло из 0,2 г 60%-ной дисперсии гидрида натрия в минеральном масле удаляют четырехкратным высаживанием с пентаном. К гидриду натрия при перемешивании под атмосферой азота добавляют сухой диметилформамид /40 мл/, а затем 2 г N-//1-//2-(диэтиламино)этил /амино/-9-оксотиоксантен-4-ил/метил/метансульфонамида /пример 6/, после чего смесь нагревают до температуры 50oC и выдерживают при этой температуре 2 часа. После этого смесь охлаждают на ледяной бане в течение 15 минут и добавляют 0,87 г пропилйодида в небольшом количестве диметилформамида и оставляют смесь при перемешивании на ночь. Затем смесь смешивают с 35 мл воды, фильтруют, остаток промывают водой и сушат /50oC/ 0,1 мм /P2O5/ с получением 2,17 г продукта с т.пл, 142 - 143oC.
Пример 29. N-//1-//2-(Диэтиламино)этил/амино/-9- оксотиоксантен-4-ил/метил/-N-метил-бензолсульфонамид метансульфонат.
(I: R1=R2=C2H5; Q = CH2N(CH3)SO2C6H5; R8 = H; n = 2).
Раствор 5,32 г /14,4 ммоля/ 1-//2-(диэтиламино)этил/амино/- 4-/(метиламино/метил/-оксотиоксантен-9-она /получен методом, описанным в примере 5/ в 100 мл метиленхлорида охлаждают до 0oC и обрабатывают триэтиламином /5 мл/ и бензолсульфонилхлоридом /2 мл, 15,67 ммоль/, после чего смесь перемешивают в течение 2 часов. Смесь упаривают под вакуумом и остаток подвергают очистке, пропуская через слой селикагеля /элюируя сначала хлороформом, а затем 0,5 - 1%-ным раствором изопропиламина в хлороформе/, в результате получают 6,24 г смолистого вещества желтого цвета. Продукт растворяют в этилацетате, растворитель удаляют под вакуумом и получают 6,06 г /83%/ N-//1-//2-(диэтиламино)этил/амино/-9-оксотиоксантен-4- ил/метил/-N-метилбензолсульфонамида. Сульфонамид /2,5 г/ суспендируют в изопропаноле и обрабатывают метансульфоновой кислотой /0,51 г/, в результате чего получают 2,63 г соли метансульфоновой кислоты с т. пл. 171 - 174oC.
Пример 30.
(а) К смеси м-анисовой кислоты /250 г, 1,67 моля/ и уксусной кислоты /1 : 1/ добавляют бром /85 мл/, а затем воду /1 1/. Смесь нагревают до кипения, охлаждают на ледяной бане, образующийся осадок выделяют фильтрованием и промывают водой, в результате получают 305,7 г /79%/ 2-бром-5-метоксибензойной кислоты с т.пл. 154 - 156oC.
(б) К смеси 3-хлортиофенола /20 г, 0,138 моля/, уксуснокислой меди /1,8 г/ и диметилформамида /200 мл/ добавляют K2CO3 /23 г/. Смесь нагревают до 150oC в течение 35 - 20 минут, затем порциями добавляют 2-бром-5-метоксибензойную кислоту /35,8 г, 0,155 моля/. Смесь нагревают и выдерживают при нагревании в течение ночи, затем выливают в воду /600 мл/ фильтруют, обрабатывают фильтрат углем, фильтруют и разбавляют соляной кислотой. Образующийся осадок выделяют фильтрованием, промывают водой, сушат при температуре 50oC под вакуумом над P2O5, в результате чего получают 27,6 г 2-/(3-хлорфенил)тио/-5-метоксибензойной кислоты.
(в) К охлажденной серной кислоте /89 мл/ под атмосферой азота добавляют 2-/(3-хлорфенил)тио/-5-метоксибензойной кислоты /27 г, 0,092 моля,/ порциями в течение 1,5-2 часов. Смесь перемешивают при комнатной температуре в течение ночи, выливают в воду /900 мл/, содержащую конц. NH4OH /218 мл/ и охлаждают. Образующийся осадок выделяют фильтрацией и сушат при 50oC под вакуумом над P2O5, в результате чего получают 21 г /42%/ смеси 1-хлор- и 3-хлор-7-метокси-тиоксантен-9-она.
(г) Смесь 1-хлор- и 3-хлор-7-метокситиоксантен-9-она /20,7 г/, пиридина /69 мл/ и диэтиламиноэтиламина /16,1 г, О,138 моля/ нагревают до 115oC под атмосферой азота и выдерживают при этих условиях в течение 2 часов. Растворитель удаляют под вакуумом и остаток подвергают очистке методом колоночной хроматографии на двуокиси кремния, элюируя сначала хлороформом /100%/, а затем 1%-ным раствором изопропиламина в хлороформе с получением 11,22 г 1-//2-(диэтиламино)этил/амино-7-метокситиоксантен-9-она.
(д) Смесь 1-//2-(диэтиламино)этил/амино/-7-метокситиоксантен-9- она /11,2 г, 0,031 моля,/, 37% формальдегида /277 мл/ и 5 н. уксусной кислоты /4,6 мл/ нагревают до 100oC и выдерживают при этой температуре в течение 3 часов. Реакционную смесь охлаждают, фильтруют, фильтрат выливают в ледяную воду /600 мл/ и подщелачивают 35% NaOH. Смесь экстрагируют хлороформом /три раза/, промывают рассолом и сушат сульфатом натрия. Растворитель удаляют под вакуумом и остаток подвергают очистке методом колоночной хроматографии на двуокиси кремния, элюируя 25%-ным (раствором хлороформа в гексане, затем 0,5%-ным (раствором изопропиламина в хлороформе, в результате чего получают 8,8 г /73%/ 1-//2-диэтиламино этил/амино/-4-гидроксиметил-7-метокситиоксантен-9-она.
(е) 1-//2-(диэтиламино)этил/амино/-7-метокси-9-оксотиоксантен-4- карбоксальдегид.
(II: R1=R2C2H5; R8=7-OCH3; n=2).
Раствор 1-//2-(диэтилaминo)этил/aминo/4-(гидpoксиметил)- -7-метокситиоксантен-9-она /8,8 г, 0,023 моля/ в толуоле /268 мл/ нагревают до 60oC под атмосферой азота, затем добавляют MnO2 /13,2 г/. Смесь выдерживают при нагревании в течение ночи, фильтруют, фильтрат упаривают под вакуумом, в результате чего получают 7,05 г /81%/ продукта.
(ж) N-//1-//2-(диэтиламино)этил/амино/-7-метокси-9-оксотиокcантен- -4-ил/метил/-N-метилформамид.
(IV: R1=R2=C2H5; R4=CH3; R8=7-OCH3; n = 2).
Раствор 1-//2-(диэтиламино)-этил/амино/-7-метокси-9- оксотиоксантен-4-карбоксальдегида /3 г, 7,8 ммоля/ и 1,5 мл муравьиной кислоты в 25,5 мл N-метилформамида нагревают до 170oC и перемешивают при этой температуре под атмосферой азота в течение 8 часов. Реакционную смесь выливают в 160 мл смеси воды со льдом подщелачивают 35%-ным раствором NaOH и экстрагируют трижды хлороформом. Органический слой промывают водой дважды и рассолом, сушат сульфатом натрия, отгоняют растворитель под вакуумом, в результате чего получают 3 г /89,9%/ продукта.
(з) 1-//2-(Диэтиламино)этил/амино/-4-(метиламино)-метил/-7- метокситиоксантен-9-он.
(I: R1=R2=C2H5; Q = CH2NHCH3; R8=7 - OCH3; n = 2).
N-Метилформамид, полученный в примере 30 (ж), /3,0 г/, в 2 н. растворе соляной кислоты в воде /24 мл/ нагревают до 100oC и перемешивают под атмосферой азота в течение двух часов. Затем смесь охлаждают, выливают в 125 мл ледяной воды, подщелачивают 35%-ным (водным раствором NaОН, экстрагируют хлороформом, после чего дважды промывают водой, затем рассолом. Органический слой сушат сульфатом натрия и упаривают под вакуумом, в результате чего получают 3,1 г технического продукта. Продукт обрабатывают диэтиловым эфиром и фильтрат очищают на нескольких тонкослойных хроматографических колонках/селикагель, элюирование: 50% смесью гексана и хлороформа, затем хлороформом и наконец, 0,25 - 0,5%-ным (раствором изопропиламина в хлороформе - колонка 1; хлороформом, затем смесью изопропиламин: метанол: хлороформ в соотношении 1:1:98 - колонка 2; хлороформом, затем 0,5%-ным раствором изопропиламина в хлороформе - колонка 3/ в результате чего получают 0,746 г продукта.
Пример 31.
(а) N-//1-//2/(Диэтиламино)этил/амино/-7-метокси-9-оксо- тиоксантен-4-ил/метил/формамид.
(I: R1=R2=C2H5; Q = CH2NHCHO; R8 = 7 - OCH3; n = 2).
Смесь 1-//2-(диэтиламино)этила/амино/-7-метокси-9-оксотиоксантен- 4-карбоксальдегида /3,6 г, 0,0094 моля/, формамида /48 мл/ и муравьиной кислоты /6 мл/ нагревают до 170oC под атмосферой азота и выдерживают при этих условиях в течение 8 часов. Смесь выливают в ледяную воду, подщелачивают 35%-ным раствором NaOH и экстрагируют хлороформом. Органический слой отделяют, промывают водой дважды, затем рассолом и сушат сульфатом натрия, после чего упаривают под вакуумом с получением 3,88 г продукта.
(б) 4-Аминометил-1-//2-(диэтиламино)этил/амино/7-метокситиоксантен-9-он.
(I: R1=R2=C2H5; Q = CH2NH2; R8 = 7 - OCH3; n = 2).
Смесь формамида, полученного в примере 31/а/, /3,88 г/ и 2 н водной соляной кислоты /32 мл/ нагревают до 100oC и перемешивают при этой температуре в течение 2 часов под атмосферой азота. Затем вышеуказанную смесь охлаждают, выливают в воду, подщелачивают 10%-ным (водным раствором NaOH, экстрагируют хлороформом и промывают сначала водой, затем рассолом. Органический слой сушат сульфатом натрия и упаривают под вакуумом с получением 3,6 г технического продукта. Продукт растворяют в хлороформе и очищают с использованием тонкослойной хроматографии /селикагелъ; элюирование сначала смесью гексан: хлороформ в соотношении 50:50, затем 1%-ным раствором изопропиламина в смеси гексан:хлороформ = 50:50/, с получением 1,75 г требуемого продукта.
(в) N-//1-//2-(Диэтиламино)/этил/амино/-7-метокси-9-оксотиоксантен-4-ил/ метил/метансульфонамид.
(I: R1=R2=C2H5; Q = CH2NHSO2CH3; R8 = 7 - OCH3; n = 2).
К раствору 1,75 г /0,0045 моля/ амина пример 31 /б/ в 22,5 мл пиридина, охлажденному на ледяной бане, под атмосферой азота при перемешивании по каплям добавляют 0,39 мл /0,005 моля,/ метансульфонилхлорида в небольшом количестве пиридина и полученную реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Смесь затем выливают в 275 мл воды, содержащих 0,38 г NaOH, экстрагируют хлороформом и органический слой промывают водой и рассолом. Слой хлороформа сушат сульфатом натрия, растворитель отгоняют под вакуумом, остаток сушат под вакуумом с получением 1,61 г /77%/ продукта с т. пл. 144oC /разл./
Пример 32.
(а) К смеси 3-хлортиофенола /20 г 0,138 моля/, уксуснокислой меди /1,75 г/ и диметилформамида /199 мл/ под атмосферой азота порциями добавляют K2CO3 /23 г/. Смесь нагревают до 150oC, а затем добавляют 2,5-дибромбензойную кислоту /43,5 г/. Смесь оставляют при нагревании на ночь, затем выливают в воду /600 мл/, фильтруют, фильтрат обрабатывают углем и фильтруют снова. Фильтрат подкисляют конц. соляной кислотой, экстрагируют хлороформом, органический слой промывают рассолом и сушат сульфатом натрия. Растворитель отгоняют под вакуумом, в результате чего получают 28,9 г 2-/(3-хлорфенил)тио/-5-бромбензойной кислоты.
(б) Смесь 2-/(3-хлорфенил)тио/-5-бромбензойной кислоты /28,4 г/ и концентрированной серной кислоты /80 мл/ перемешивают сначала при температуре 0oC, а затем при комнатной температуре в течение ночи. Смесь приливают в ледяную воду /850 мл/, содержащую конц. NH4OH /199 мл/ и образующийся в виде осадка продукт фильтруют и сушат при температуре 50oC под вакуумом, в результате чего получают 15,0 г смеси 1-хлор и 3-хлор-7-бромтиоксантен-9-онов.
(в) Смесь 1-хлор и 3-хлор-7-бромтиоксантен-9-онов /13,6 г/ пиридина /108 мл/ и N,N-диэтилэтилендиамина /16,3 мл/ нагревают до 115oC и выдерживают при этой температуре в течение 20 часов. Растворитель удаляют под вакуумом, остаток подвергают очистке методом колоночной хроматографии на двуокиси кремния, элюируя сначала хлороформом /100%/, затем 1%-ным раствором изопропиламина в хлороформе, в результате чего получают 9,3 г 1-//2-(диэтиламино)этил/амино/-7-бромтиоксантен-9-она.
(г) Смесь 1-//2-(диэтилaминo)этил/aминo-7-брoмтиоксантен-9-она /9,3 г, 22,9 ммоля/, 203 мл 37% раствора формальдегида и 3,4 мл 5 н. раствора уксусной кислоты нагревают до 100oC под атмосферой азота и выдерживают при этих условиях в течение ночи. Смесь охлаждают до комнатной температуры и образующийся осадок твердого вещества выделяют фильтрованием. Фильтрат разбавляют водой, подщелачивают 35%-ным (раствором NaOH и экстрагируют хлороформом. Органический слой промывают рассолом, сушат сульфатом натрия, отгоняют растворитель, в результате чего получают 10 г масла. Полученное масло растворяют в метиленхлориде, фильтруют, растворитель отгоняют под вакуумом и технический гидроксиметильный аналог очищают методом тонкослойной хроматографии /селикагель; элюирование: 25%-ным раствором хлороформа в гексане, смесью хлороформ: гексан = 1:1, затем снова 25%-ным раствором хлороформа в гексане, хлороформом /100%/ и затем 0,5-1%-ным раствором изопропиламина в хлороформе/, в результате чего получают 3,2 г 1-//2-(диэтилaминo)этил/aминo/-4-(гидpoксиметил)-7-бромтиоксантен- 9-она.
(е) 1-//2-(Диэтиламино)этил/амино/-7-бром-9-оксотиоксантен-4-карбоксальдегид.
(II: R1=R2=C2H5; R8=7-Br; n = 2).
Смесь 3,2 г /7,34 моля/ спирта примера 32 /г/ и 4,3 г двуокиси марганца в 85 мл толуола нагревают до 60oC и выдерживают при данной температуре под атмосферой азота в течение 1 часа. Смесь фильтруют, промывают хлороформом и соединенные фильтры упаривают под вакуумом, в результате чего получают 3 г твердого вещества желтого цвета. Твердое вещество желтого цвета обрабатывают диэтиловым эфиром, фильтруют и сушат с получением 2,7 г /94,3%/ проекта с т. пл. 145 - 146oC.
(ж) N-//1-//2-(Диэтиламино)этил/амино/-7-бром-9-оксотиоксантен-4-ил/метил/ формамид.
(I: R1=R2=C2H5; Q = CH2NHCHO; R8=7-Br; n = 2).
Смесь 2,7 г /6,2 ммоля/ 1-//2-(диэтиламино)этил/амино/-7- бром-9-оксотиоксантен-4-карбоксальдегида, 31,7 мл формамида и 3,6 мл муравьиной кислоты нагревают до 170oC под атмосферой азота и перемешивают при этой температуре в течение 8 часов. После чего смесь оставляют при комнатной температуре на 72 часа. Смесь выливают в 150 мл ледяной воды, подщелачивают 35%-ным раствором NaOH, образующийся твердый продукт выделяют фильтрованием и промывают водой. Твердый продукт растворяют в хлороформе, промывают рассолом, сушат сульфатом натрия, после чего растворитель отгоняют под вакуумом и получают 2,85 г требуемого формамида в виде твердого вещества желто-оранжевого цвета с т. пл. 132oC /разл/.
(з) 1-//2-(Диэтиламино)этил/амино/-4-(аминометил)-7-бромтиоксантен-9-он.
(I: R1 = R2 = C2H5; Q = CH2NH2: R8 = 7 - Br; n = 2).
Смесь 2,85 г /6,2 ммоля/ вышеуказанного формамида /пример 32/ж/ в 26 мл 2 н. соляной кислоты нагревают до 100oC под атмосферой азота и выдерживают при этой температуре 2 часа, после чего смесь оставляют на ночь при комнатной температуре. Затем смесь выливают в 200 ледяной воды, подщелачивают 35%-ным раствором гидроокиси натрия и экстрагируют хлороформом. Органический слой промывают водой и рассолом, сушат сульфатом натрия и упаривают под вакуумом, в результате чего получают 2,67 г темного масла. Темное масло подвергают очистке методом тонкослойной хроматографии /селикагель; 1250 мл смеси гексан:хлороформ в соотношении 1:1, затем 1% раствором изопропиламина в смеси гексан-хлороформ = 1:1/, в результате чего получают 1,87 г /70%/ продукта с т. пл. 79 - 83oC.
Пример 33. N-//1-//2-(Диэтиламино)этил/амино/-7-бром-9- оксотиоксантен-4-ил/метил/метансульфонамид.
(I: R1 = R2 = C2H5; Q = CH2NHSO2CH3; R8 = 7 - Br; n = 2).
1-//2-(Диэтиламино)этил/амино/-4-(аминометил)-7-бромтиоксантен-9-он /1 г, 2,3 ммоля/ в 11,5 мл сухого пиридина под атмосферой азота перемешивают на ледяной бане в течение 15 минут, затем по каплям добавляют 0,2 мл /2,6 ммоля/ метансульфонилхлорида в охлажденном пиридине и полученную смесь перемешивают при комнатной температуре. Реакционную смесь выливают в 200 мл воды, добавляют 0,19 г гидроокиси натрия в ледяной воде и экстрагируют хлороформом. Органический слой промывают водой дважды и рассолом и сушат безводным сульфатом натрия. Смесь затем фильтруют, упаривают под вакуумом, остаток промывают эфиром, фильтруют, сушат, в результате чего получают 1,02 г продукта с т. пл. 134 - 139oC.
Пример 34. Метил N-//1-//2-(диэтиламино)этил/амино/-9- оксотиоксантен-4-ил/метил/карбамат.
(I: R1 = R2 = C2H5; Q = CH2NHCOOCH3; R8 = H: n = 2).
К раствору 2,94 г /8,27 ммоля/ 4-(аминометил)-1-//2-(диэтиламино)/этил/амино/тиоксантен-9-она /получен методом, описанным в примере 4/ в 50 мл метиленхлорида, содержащих 5 мл триэтиламина, охлажденному до 0oC, добавляют 0,7 мл /9,06 ммоля/ метилхлорформиата, полученную смесь перемешивают в течение 2,5 часов. Растворитель отгоняют под вакуумом, остаток суспендируют в хлороформе и очищают методом тонкослойной хроматографии /селикагель; элюирование хлороформом, затем 1%-ным раствором изопропиламина в хлороформе/, в результате чего получают 2,36 г /69%/ продукта в виде твердого вещества желтого цвета с т. пл. 129 - 131oC.
Пример 35. 1-//2-(Диэтиламино)этил/амино/-4-/(метиламино)метил/- 7-гидрокси-тиоксантен-9-он.
(I: R1 = R2 = C2H5; Q = CH2NHCH3; R8 = 7-OH; n = 2).
Раствор 1,6 г /4 ммоля/ 1-//2-диэтиламино)этил/амино/-4- (метиламино/метил/-7-метокситиоксантен-9-она /получен методом, описанным в примере 30/з// в 10 мл 48%-ного раствора HBr нагревают до 110oC и выдерживают при этой температуре в течение 5 часов. После охлаждения реакционную смесь нейтрализуют насыщенным раствором бикарбоната натрия и экстрагируют хлороформом /3х100 мл/. Смолистое вещество темного окраса, не растворимое в воде или хлороформе растворяют в метаноле и соединяют с раствором хлороформа. Растворитель отгоняют под вакуумом, в результате чего получают 1,67 г твердого вещества темно-оранжевого цвета. Этот продукт подвергают очистке методом тонкослойной хроматографии /силикагель: элюирование смесью изопропиламин: метанол: хлороформ в соотношении 1:1:98 - 1 колонка; двуокись кремния: элюирование смесью изопропиламин:метанол:хлороформ в соотношении 2:2:96 - 2 колонка/, с получением 0,56 г /36%/ продукта с т. пл. 167 - 169oC.
Пример 36. Метил-N-//1-//2-(диэтиламино)/этил/амино/-7-метокси- 9-оксотиоксантен-4-ил/-метил/карбамат.
(I: R1=R2 = C2H5; Q = CH2NHCOOCH3; R8 = 7-OCH3; n = 2).
К раствору 1,55 г 4-аминометил-1-//2-(диэтиламино)этил/амино/-7- метокситиоксантен-9-она /получен методом, описанным в примере 31/б// в 40 мл хлороформа, содержащих 2 мл триэтиламина, охлажденному до 0oC, добавляют 0,45 мл метилхлорформиата, полученную смесь перемешивают при комнатной температуре в течение нескольких часов, остаток подвергают очистке методом тонкослойной хроматографии /селикагель: элюирование хлороформом, затем 1%-ным раствором триэтиламина в смеси хлороформ:гексан в соотношении 1:1/ с получением 1,2 г продукта, перекристаллизация которого из этилацетата приводит к получению 0,79 г твердого вещества ярко-желтого цвета с т. пл. 131 - 132oC.
Пример 37. N-//1-(2-Диэтиламино)этил/амино/-7-гидрокси-9- оксотиоксантен-4-ил/метил/метансульфонамид•3/4 гидрат.
(I: R1 = R2 = C2H5; Q = CH2NHSO2CH3; R8 = 7-OH; n = 2).
К раствору N-//1-(2-диэтиламино)этил/амино/-7-метокси-9- оксотиоксантен-4-ил/метил/метансульфонамида /0,5 г/ / получен методом, описанным в примере 31/в// в хлористом метилене /45 мл/ при -78oC добавляют 1 н. BBr3 в хлористом метилене /1,71 мл/. Смеси дают нагреться до комнатной температуры, перемешивают в течение ночи и затем выливают в ледяную воду /250 мл/, содержащую 35% NaOH /8 мл/. Смесь подкисляют разбавленной соляной кислотой, затем подщелачивают твердым Na2CO3, после чего экстрагируют этилацетатом. Органический слой отделяют, промывают рассолом, сушат сульфатом натрия и упаривают под вакуумом. Осадок подвергают очистке методом колоночной хроматографии на двуокиси кремния, элюируя 5%-ным раствором метанола в этилацетате, в результате чего получают 0,28 г /58%/ продукта с т. пл. 78oC /разл/.
Пример 38. 4-Аминометил-1-//2-диэтиламиноэтил/амино/-6- метилтиоксантен-9-он.
(I: R1=R2 = C2H5; Q = CH2NH2; R8 = 6 - CH3; n = 2).
Предполагают, что методом, аналогичным описанному в примере 30 /части а - е/, но заменяя 4-метилбензойной кислотой 3-метоксибензойную кислоту в части а, может быть получен 1-//2-(диэтиламино)этил/амино/-6-метил-9-оксотиоксантен-4-карбоксальдегид. Далее предполагают, что он может быть превращен в 4-(аминометил)-1-//2-(Диэтиламино)этиламино/-6-метил-тиоксантен-9-он методами, описанными в примере 31 части а-б.
Примеры 39 - 41.
Предполагают, что методом, описанным в примере 34, заменяя, если это необходимо, соответствующий амин формулы V 4-(аминометил)-1-//2-(диэтиламино)этил/амино/тиоксантен-9-он, могут быть получены соединения формулы I (см. в конце описания).
Пример 42. 1-//2-(Диэтиламино)этил/амино/-4-(метиламино метил/-6- метилтиоксантен-9-он.
(I: R1 = R2 = C2H5; Q = CH2NCH3; R = 6 - CH3; n = 2).
Методом, описанным в примере 30 части /ж-з/, заменяя 1-//2-(диэтиламино)этил/амино/-6-метил-9-оксотиоксантен-4-карбоксальдегидом 1-//-(диэтиламино)этил/амино/-7-метокси-9-оксотиоксантен-4-карбоксальдегид, может быть получен вышеуказанный продукт.
Пример 43. N-//1-//2-(Диэтиламино)этил/амино/-6-метил-9- оксотиоксантен-4-ил/метил/метансульфонамид.
(I: R1 = R2 = C2H5; Q = CH2NHSO2CH3; R8 = 6-CH3; n = 2).
Предполагают, что методом, описанным в примере 6, можно получить вышеуказанный продукт из 4-(аминометил)-1-//2-(диэтиламино) этил/амино/-6-метилтиоксантен-9-она, пиридина и метансульфонилхлорида.
Пример 44. N-//1-//2-(Диэтиламино)этил/амино/-7-метокси-9- оксотиоксантен-4-ил/метил/фенилсульфонамид.
(I: R1 = R2 = C2H5; Q = CH2NHSO2C6H5; R8 = 7-CH3O; n = 2).
Предполагают, что методом, аналогичным описанному в примере 31 часть /в/, может быть получен вышеуказанный продукт из 4-(аминометил)-1-//2-(диэтиламино)этил/амино/-7-метокситиоксантен-9-она, пиридина и бензолсульфонилхлорида.
Пример 45.
(а) N-//1-//2-(Диэтиламино)этил/амино/-9-оксотиоксантен-4- ил/метил/-N-фенилформамид.
(IV: R1=R2 = C2H5; R4 = C6H5; R8 = H; n = 2).
Смесь 1-//2-(Диэтиламино)этил/амино/-9-оксотиоксантен-4- карбоксальдегида /3,40 г, 9,59 ммоля/, форманилида /31 г/ и муравьиной кислоты нагревают до 160oC и выдерживают при этой температуре в течение 2 часов. Смесь охлаждают, приливают в воду /200 мл/ и экстрагируют диэтиловым эфиром /3 х 150 мл/. Водный слой подщелачивают 5 н. NaOH, экстрагируют хлороформом /3 х 150 мл/ и соединенные органические экстракты сушат сульфатом натрия и пропускают через флорисил, элюируя сначала хлороформом /100%/, затем 5%-ным раствором изопропиламина в хлороформе. Растворитель отгоняют под вакуумом и остаток подвергают очистке методом колоночной хроматографии на двуокиси кремния, элюируя 0,5 и 1%-ными растворами изопропиламина в хлороформе, и двойной перекристаллизацией из смеси бензол/гексан, в результате чего получают 1,88 г требуемого продукта.
(б) 1-//2-(Диэтиламино)этил/амино/-4-/фениламино метил/тиоксантен-9-он.
(V: R1 = R2 = C2H5; R4 = C6H5; R8 = H; n = 2).
Смесь N-фенилформамида примера 45/а/ /1,70 г, 3,70 ммоля/ и 3 н. HCl /100 мл/ нагревают на паровой бане в течение 1 часа. Затем смесь охлаждают, подщелачивают 5 н. NaOH, экстрагируют хлороформом /3 х 100 мл/, соединенные органические фазы сушат сульфатом натрия и упаривают под вакуумом. Остаток подвергают очистке методом колоночной хроматографии на двуокиси кремния, элюируя диэтиловым эфиром /100%/, затем 5%-ным раствором изопропиламина в эфире; и последующей очисткой на второй колонке с двуокисью кремния, элюируя 1%-ным раствором изопропиламина в эфире, в результате чего получают 0,80 г требуемого продукта с т. пл. 133 - 135oC.
(в) N-//1-//2-(Диэтиламино)этил/амино/-9-оксотиоксантен-4- ил/метил/-N-фенилметансульфонамид.
(1: R1 = R2 = C2H5; Q = CH2N(C6H5)SO2CH3; R8 = H; n = 2).
Предполагают, что вышеуказанный продукт может быть получен методом, аналогичным описанному в примере 22, из 1-//2-(диэтиламино)этил/амино/-4-/(фениламино)метил//тиоксантен-9-она примера 45/б/, метансульфонилхлорида, метиленхлорида и триэтиламина.
Предполагают, что другие соединения общей формулы I могут быть получены методами, аналогичными приведенным в примерах 1 - 14, заменяя подходящими 1-//2-(диалкиламино)этил/амино/- или 1-//3-(диалкиламино)пропил/амино/-9-оксотиоксантен-4-карбоксальдигидом 1-//2-(диалкиламино)этил/амино/-9-оксотиоксантен-4-карбоксальдегид, или методом, аналогичным приведенным в примерах 15 - 45, но используя подходящий 1-//(диалкиламино)алкил/амино/-9-оксотиоксантен-4-карбоксальдегид. Получение многих альдегидов и их прекурсоров описано в патенте США 3294803.
Представительные примеры соединений данного изобретения были испытаны на противоопухолевую активность на мышах в соответствии со следующей методикой.
Животных отбирают и имплантируют им подкожно фрагменты опухолей весом от 30 до 60 мг трокаром 12-го размера и снова отбирают перед неселективным распределением для различных методов лечения и контрольных групп. Для лечения на ранней стадии заболевания химиотерапию начинают в период от 1 до 5 дней после имплантации в то время, когда количество клеток опухоли относительно невелико /от 107 до 108 единиц клеток/. Для лечения заболеваний на поздней стадии химиотерапию откладывают до тех пор, пока опухоль не достигнет относительно большого размера /200 - 300 мг/. Для 90% животных опухоль достигла 2,5 кратного размера. Измерение опухолей кронциркулем проводят еженедельно /или дважды в неделю для более быстро растущих опухолей/. Мышей обезглавливают, когда размер опухолей составляет 1500 мг /т.е. перед тем, как опухоли смогут причинить дискомфорт животному/. Вес опухолей измеряют двухкратным измерением.
Обработанные и контрольные группы исследуют, когда опухоли контрольной группы достигают приблизительно от 700 до 1200 мг /в среднем по группе - медиана группы/. Определяют медиану веса опухолей каждой группы/ включая отсутствие опухолей/. Отношение О/К (вес обработанных опухолей к весу опухолей контрольной группы) в % является показателем противоопухолевой эффективности: О/К, равная или меньшая, чем 42%, рассматривается отделением Оценки Лекарств Отдела Лечения Рака Национального Института рака (Drug Evaluation Branch of Division of Canser Treatment NCI) как значительная противоопухолевая активность. О/К, меньшая 10%, рассматривается как высоко значительная противоопухолевая активность. Самое маленькое значение потери веса тела /среднее значение группы/, превосходящее 20%, или большая, чем 20%-ная смертность от лекарств, рассматривается как исключительно токсическая доза.
Результаты определения приведены в таблице 1 для аденокарциномы протока поджелудочной железы #3 и в таблице 2 для аденокарциномы #38 толстой кишки.
Соединение примера 5 было испытано внутривенным введением против ряда других опухолей, как показано в таблице 3, и было активно в дозе 300 мг/кг при пероральном введении против аденокарциномы толстой кишки 38.
Соединение примера 6 было испытано болюсным внутривенной инъекцией против ряда других опухолей, как показано в таблице 4.
Соединение примера 8 было испытано против ряда опухолей, как представлено в таблице 5.
Соединение примера 36 было испытано против ряда опухолей, как представлено в таблице 6.
Представленные соединения изобретения были испытаны против аденокарциномы молочной железы 16/C/PP, как показано в таблице 7.
Представленные соединения данного изобретения были испытаны против лейкемии P388, устойчивой к действию адриамицина, как показано в таблице 8.
Фармацевтические композиции данного изобретения включают одно или более соединений данного изобретения, введенных в композиции совместно с одним или более нетоксичными физиологически приемлемыми носителями, адъювантами или разбавителями, которые здесь определены совместно как носители, для парентерального введения, для перорального введения в твердой или жидкой форме, для ректального или местного применения и т.п.
Композиции могут вводиться людям и животным перорально, ректально, парентерально /внутривенно, внутримышечно или подкожно/, внутриполостно, интравагинально, интраперитонеально, локально /порошки, мази или капли/ или в виде растворов для опрыскивания полости рта и носа.
Композиции, применимые для парентеральной инъекции, могут содержат физиологически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии и стерильные порошки для получения стерильных растворов или дисперсий для инъекций. Примеры подходящих водных и неводных носителей, разбавителей, растворителей или наполнителей включают воду, этанол, полиспирты /пропиленгликоль, полиэтиленгликоль, глицерин и т.п./, их подходящие смеси, растительные масла /такие как оливковое масло/ и органические эфиры, применяемые для инъекций, такие как этилолеат. Надлежащая текучесть может быть сохранена, например, использованием покрытий /оболочек/ таких, как лецитин, сохранением требуемого размера частиц в случае дисперсий и использованием поверхностно-активных веществ.
Эти композиции могут также содержат адъюванты, такие как консервирующие, смачивающие, эмульгирующие и диспергирующие агенты. Предотвращение действия микроорганизмов может быть достигнуто при помощи различных антибактериальных и противогрибковых агентов, например, парабены, хлорбутанол, фенол, сорбиновая кислота и т.п. Может возникнуть необходимость введения изотонических агентов, например сахаров, хлорида натрия и т.п. Продление абсорбции фармацевтической формы, применяемой для инъекции, может быть достигнуто использованием агентов, замедляющих абсорбцию, например, моностеарат алюминия и желатин.
При необходимости и для обеспечения более эффективного распределения соединения могут быть введены в системе медленного высвобождения или системы с заданным периодом выделения, такие как полимерные матрицы, липосомы и микросферы. Они могут быть стерилизованы, например, фильтрованием через фильтр, задерживающий бактерии, или введением стерилизующих агентов в форму стерильных твердых составов, которые можно растворить в стерильной воде или другой стерильной среде для инъекции непосредственно перед использованием.
Твердые дозированные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых дозированных формах активное соединение смешено с по меньшей мере одним инертным обычным наполнителем /или носителем/, таким как цитрат натрия или двухкальциевых фосфат или с /а/ разбавителями или удлинителями, например, крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, /б/ связующими веществами, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и аравийская камедь, /в/ увлажнителями, например глицерин, /г/ дезинтегрирующими /сыпучими/ агентами, например, агар-агар, карбонат кальция, крахмал из картофеля или тапиоки, альгиновая кислота, некоторые комплексные силикаты и карбонат натрия, /д/ замедлителями /ингибиторы/ растворения, например, парафин, /е/, ускорителями абсорбции, например соединения четвертичного аммония, /ж/ смачивающими агентами, например, цетиловый спирт или глицеролмоностеарат, /з/ абсорбентами, например каолин и бентонит, /и/ смазывающими агентами, например, тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, натрийлаурилсульфат или смесями на их основе. В случае капсул, таблеток, и пилюль дозированные формы могут также содержать буферные агенты.
Процент активного компонента в композиции и метод лечения опухолей или рака может изменяться таким образом, чтобы была получена подходящая доза. Вводимая каждому отдельному пациенту доза изменима в зависимости от клинической оценки с использованием критериев: способа введения, срока лечения, возраста и веса пациента, способности активного компонента, восприимчивости к нему пациента. Эффективная количественная доза активного компонента, таким образом, может быть легко определена клиническим изучением всех критериев с использованием самых лучших результатов в интересах пациента.
Дополнительные примеры.
(A) Таблетка
Ингредиент - мг/табл.
Соединение примера 15 - 50,0
Маннит, USP - 223,75
Натрий кроскармелоза - 6,0
Кукурузный крахмал - 15,0
Гидроксипропилметилцеллюлоза, USP - 2,25
Стеарат магния - 3,0
(B) Капсула
Ингредиент - мг/капс.
Соединение примера 16а - 10,0
Маннит, USP - 488,5
Натрий кроскармелоза - 15,0
Стеарат магния - 1,5
(C) Парентеральное
Ингредиент - мг/мл
Соединение примера 34 - 2,0
Декстроза - 39,5
Стерильная вода для инъекций - До 1 мля
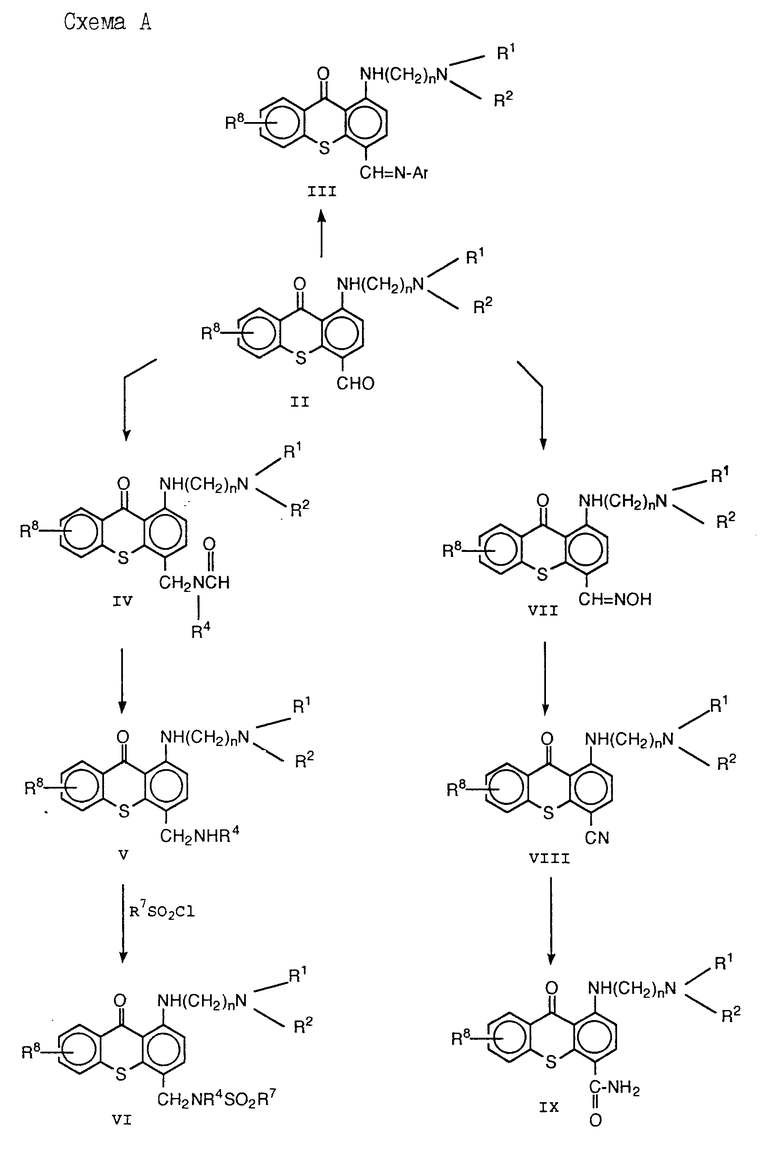
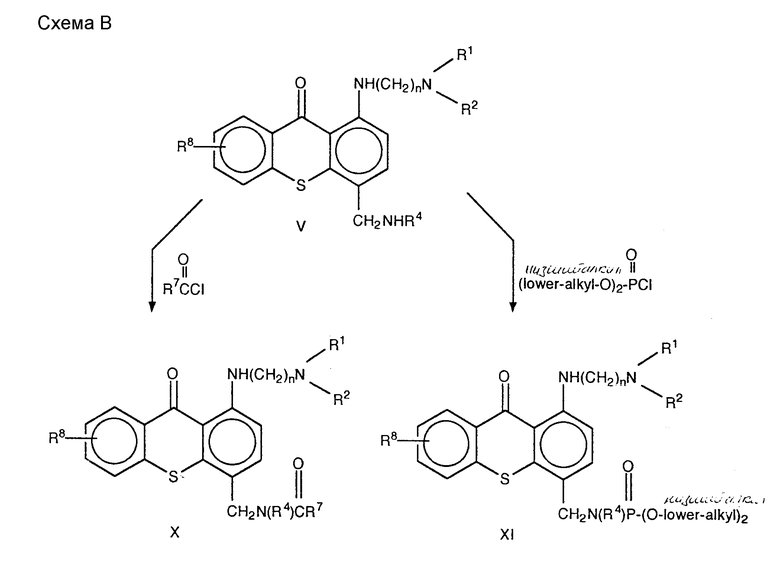
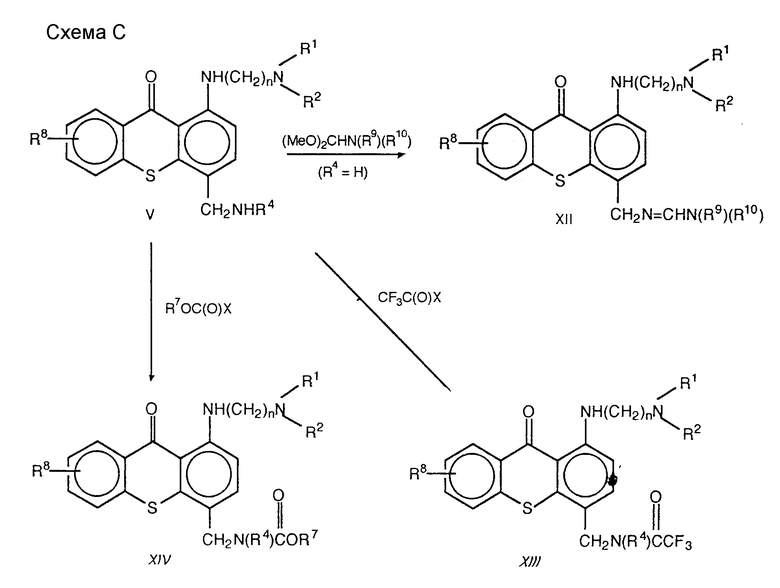

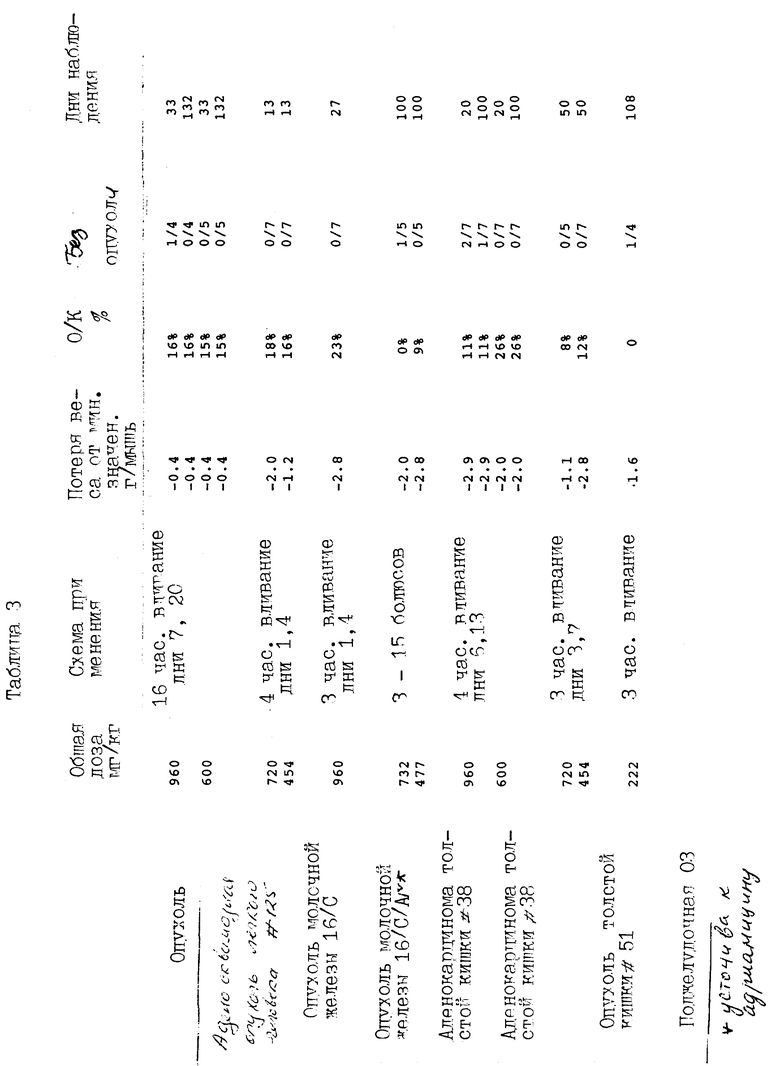

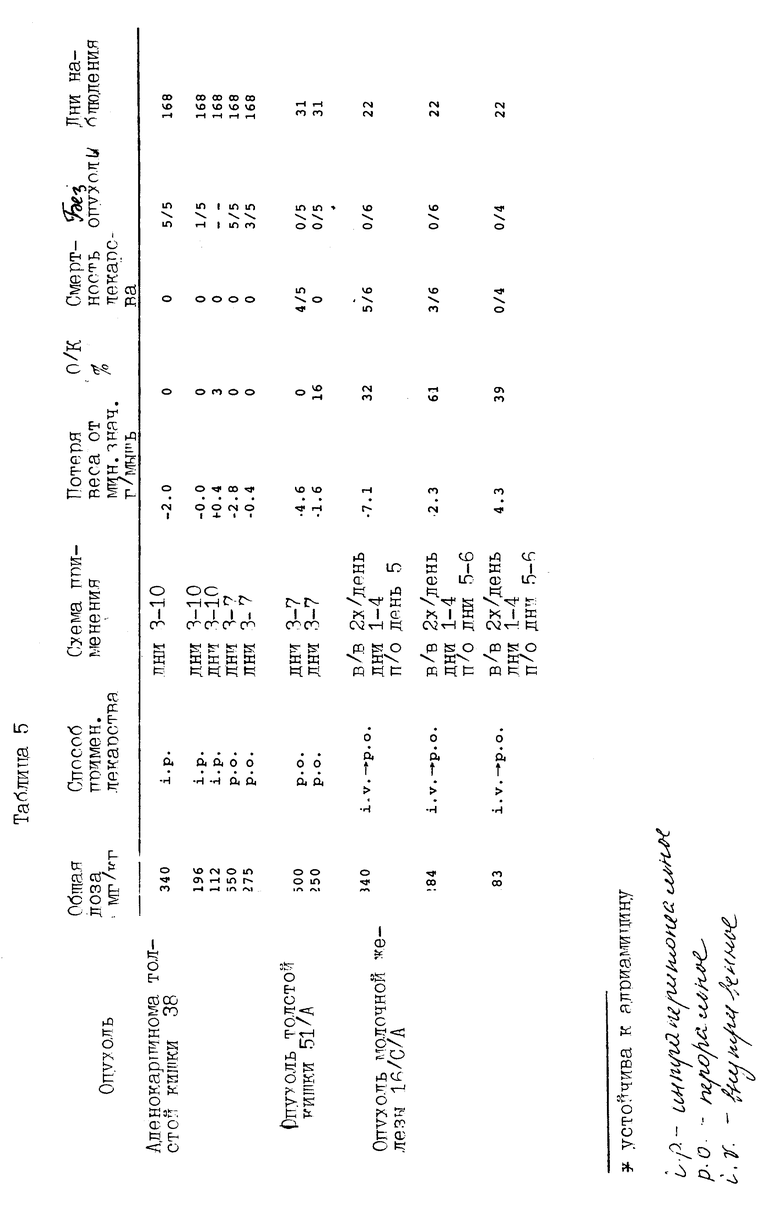
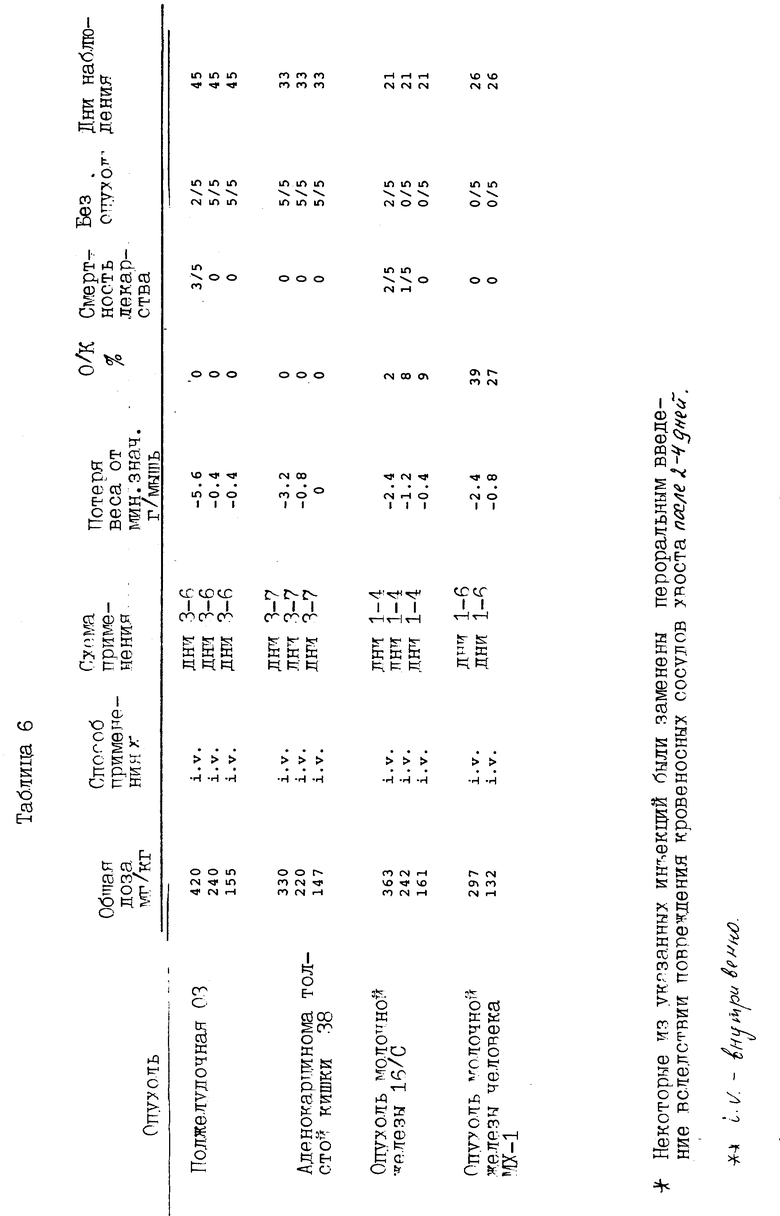
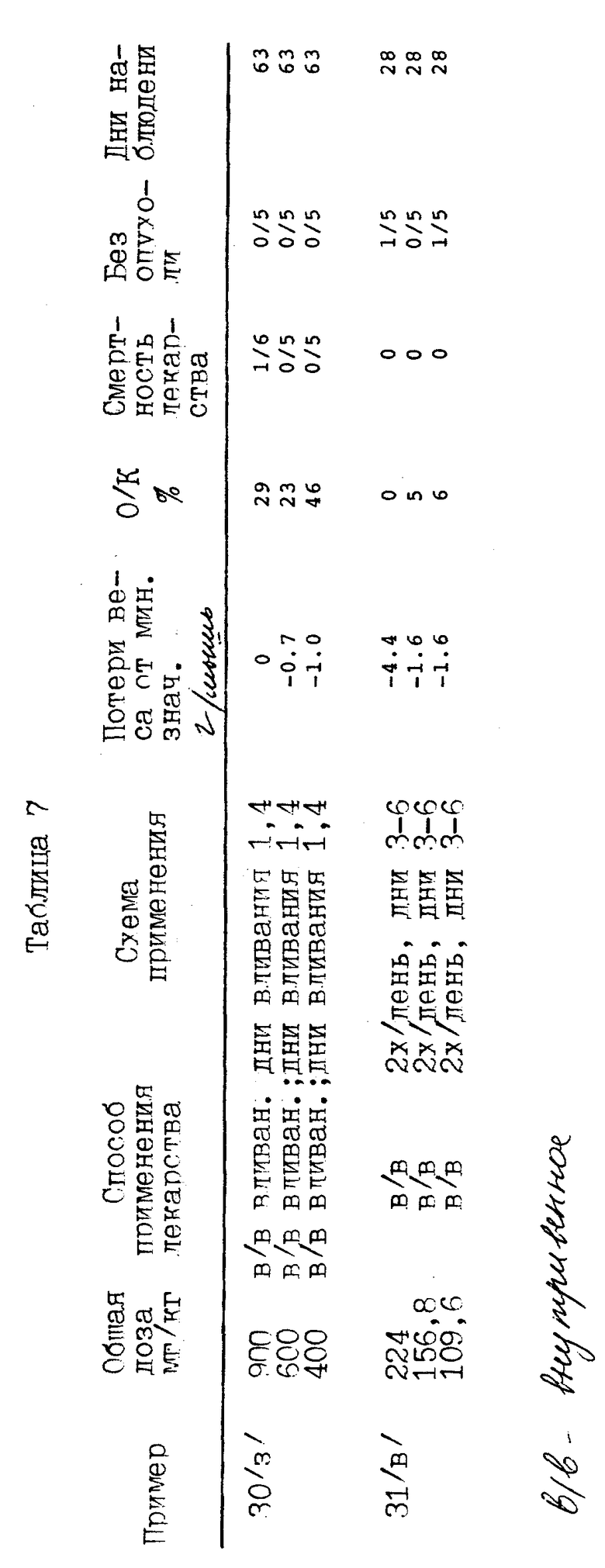

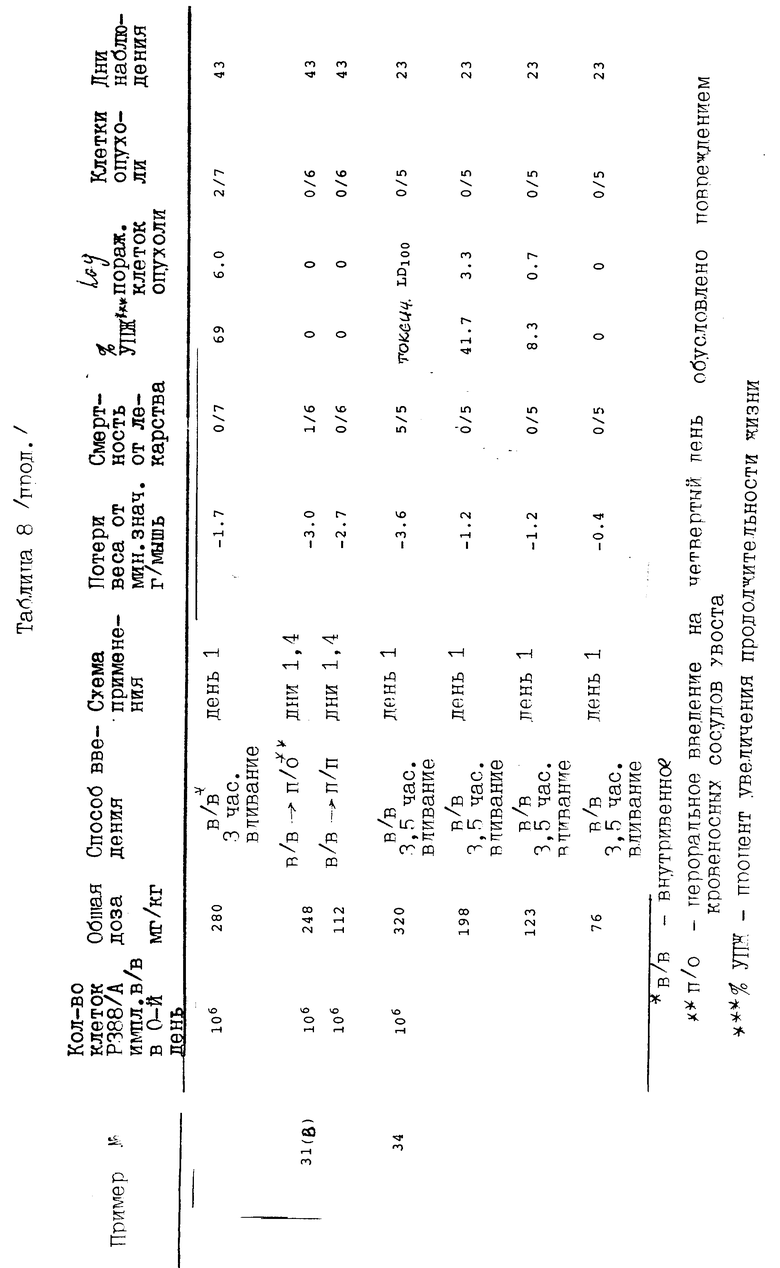

Описываются новые тиоксантеноновые соединения общей Формулы /I/, где значения R1, R2, R8, Q, указаны в п.1 формулы, или их фармацевтически приемлемые соли, кислотно-аддитивные соли или сольваты. Соединения формулы /I/ обладают противоопухолевой активностью. Описывается также композиция на основе вышеуказанных соединений, обладающая противоопухолевой активностью. 5 с. и 16 з.п.ф-лы, 8 табл.
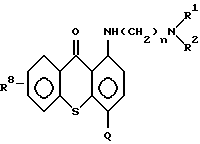
где (1) n = 2 или 3;
R1 и R2 независимо друг от друга - низший алкил;
Q - остаток, выбранный из группы, состоящей из СН2NHR3, СH2N(R4)SO2R7, СН2NHCHO, СН=N-Ar, C(O)NR5R6, СН2N(R4)C(O)R7, CH2N (C2H5)CHO, CH2N(R4)P(O)(O - низший алкил)2, CH2N = СН-N (R9)(R10), CH2N(R4)С(O)СF3 и СН2N(R4)С(O)OR7; R3 - водород или низший алкил;
R4 - водород, низший алкил или Ar;
R5 - водород, низший алкил или Аr;
R6 - водород или низший алкил;
R7 - низший алкил или Аr;
R8 - гидроксил;
Ar - фенил или фенил, замещенный метилом, метокси-, гидроксильной группой, галоидом или нитрогруппой;
R9 и R10 независимо друг от друга - низший алкил; или
(2) Q - остаток, выбранный из группы, состоящей из CH2N(R4)SO2R7, СН = N-Аг, С(O)NR5R6, CH2N(R4)C(O)R7, CH2N(R4)P(O) (O - низший алкил)2, СН2N(R4)С(O)СF3 и CH2N(R4)C(O)OR7;
R8 - водород, низший алкил, низший алкокси или гидроксил; Аr - фенил, замещенный гидроксилом;
n, R1, R2, R4 - R7 принимают значения, определенные выше, при условии, что один или более из R4, R5, R7 - Аr; или
(3) Q - остаток, выбранный из группы, состоящей из CH2N=CHN(R9)(R10), СН2N(R4)С(O)СF3 и CH2N(R4)C(O)OR7;
R8 - водород, низший алкил, низший алкокси или гидроксил;
n, R1, R2, R4, R7, Аr, R9 и R10 принимают значения, определенные в части (1),
или их фармацевтически приемлемые кислотно-аддитивные соли или сольваты.
| ИМПУЛЬСНЫЙ СТАБИЛИЗАТОР НАПРЯЖЕНИЯ | 0 |
|
SU330444A1 |
| Способ получения 3,6-бис(диметиламино)тиоксантен-10,10-диоксида | 1983 |
|
SU1121264A1 |
| US 4571405 A, 1986 | |||
| US 4539412 A, 1985 | |||
| US 4582851 A, 1986. | |||
Авторы
Даты
1999-09-27—Публикация
1994-04-07—Подача