Изобретение относится к новым аналогам витамина D, более конкретно к 1α- гидрокси-аналогам витамина D3, имеющим видоизмененную боковую цепь в 17-положении и проявляющим активность модулирования клеток.
Витамин D3, который имеет формулу: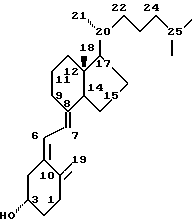
как хорошо известно, играет жизненно важную роль в метаболизме кальция, путем промотирования кишечной абсорбции кальция и фосфора, поддержания адекватных уровней кальция и фосфора в сыворотке и стимулирования мобилизации кальция из лакуны костной жидкости в присутствии паратироидного гормона.
Около 20 лет назад стало известно, что витамины D подвергаются гидроксилированию ин виво, причем гидроксилирование в 25-положении происходит в печени, а гидроксилирование в 1α- положении имеет место в почках, получающийся 1α- 25-дигидрокси-метаболит является биологически активным веществом. Данное открытие привело к синтезу многих аналогов витамина D, оценка которых показала, что гидроксильные группы в 1α- положении и/или в 24R-, или 25-положении являются существенными для соединений или их метаболитов в проявлении существенного влияния на кальциевый метаболизм. Хотя, как указывалось выше, такие гидроксильные группы обычно в конечном счете вводятся ин виво, гидроксилирование в 24R- или 25-положении происходит гораздо более легко, чем в 1α- положении, использование аналогов витамина D, уже гидроксилированных таким образом, оказалось значительно более благоприятным ввиду их повышенных уровней активности и их быстрого действия и последующего выведения из организма. Должно быть понятно, что 1α- гидроксилированные производные витамина D представляют особую ценность (пользу) для пациентов, страдающих от ренальной недостаточности.
Примеры гидроксилированных аналогов витамина D, которые находят применение в настоящее время, включают природный метаболит 1α, 25-дигидрокси-витамин D3 и 1α- гидрокси-витамин D3 (который легко 25-гидроксилируется ин виво). Другие многообещающие соединения, как сообщают, включают 1α, 24R-дигидрокси-витамин D3, D2 аналоги указанных выше соединений и 1α, 25-дигидрокси-аналоги, несущие атомы фтора в 24-, 25- и/или 27-положениях (см. De Luca and Schnoes, Ann. Rev. Biochem. (1983), 52 стр. 411 - 439 и De Luca и др., Top. Curr. Chem. (1979), 83, стр. 1 - 65).
Совсем недавно стало известно, что природный метаболит 1α, 25-дигидрокси-витамин D3 оказывает дополнительное воздействие на клеточный метаболизм. Эти эффекты модулирования клеток включают стимуляцию созревания и дифференциации клеток (Tanaka и др., Biochem. J. (1982), 204, стр. 713 - 719; Amento и др., J. Clin. Invest. (1984), 73, стр. 731 - 739; Colston и др., Endocrinology (1981), 108, стр. 1083 - 1086; Abe и др., Proc. Nat. Acad. Sci. (1981), 78, стр. 4990 - 4994) и иммуноподавляющие или иммуносупрессивные эффекты (например, ингибирование продуцирования интерлейкина П) (Rigby, Immunology Today (1988), 9, стр. 54 - 58). Еще более недавно исследовался иммунопотенциирующий эффект 1α, 25-дигидрокси-витамина D3, было найдено, что данное соединение стимулирует продуцирование бактерицидных кислородных метаболитов и хемотактическую ответную реакцию лейкоцитов (см., например, Cohen и др., J. Immunol. (1986), 136, стр. 1049 - 1053). Хорошо известно, что лейкоциты играют главную роль в защите организма от различных инфекций (см., например, Roitt, Brostoff and Male, "Immunology" 2-е изд. (1989), C.V. Mosby, St. Louis, Sec. 16.10 - 16.13 и 17.4. - 17.5), например, путем приклеивания к поражающим организмам и поглощения их (хемотактическая реакция) и/или продуцирования сверхокисей и/или других токсичных кислородных метаболитов. Известно, что данная ответная реакция может также стимулироваться мутогенами, такими как со-карциногенные форбальные сложные эфиры и Y-интерферон, которые в структурном отношении совершенно отличаются от аналогов витамина D.
В силу этих воздействий на клеточный метаболизм, 1α, 25-дигидрокси-витамин D3 в основном имеет терапевтический потенциал в таких разнообразных областях, как лечение псориаза, воспалительных и аутоиммунных заболеваний, неоплазии и гиперплазии, как вспомогательное средство при хемотерапии инфекционных заболеваний (и бактериальных, и вирусных и грибковых), и в других терапевтических способах воздействия, в которые вовлечены моноядерные фагоципы. 1α, 25-дигидрокси-витамин D3 и 1α- гидрокси-витамин D3 предлагались также для использования при лечении гипертензии (Lind и др., Acto Med., Scand. (1987), 222, стр. 423 - 427) и сахарного диабета (Inomata и др., Bоne Mineral (1986) 1, стр. 187 - 192), и высказывалось предположение, что 1α, 25-дигидрокси-витамин D3 может способствовать росту волос (Lancet, 4 марта 1989, стр. 478) и может быть полезен при лечении акне (фолликулярного дерматита) (Malloy и др., Tricontinental. Meeting for Investigative Dermatology, Вашингтон, 1989). Однако сильное воздействие 1α, 25-дигидрокси-витамина D3 и 1α- 25-гидрокси-витамина D3 на кальциевый метаболизм обычно является помехой к такому использованию, поскольку дозировки на уровне, достаточном для того, чтобы добиться желаемого клеточного модулирования, иммуносупрессивного или иммунопотенциирующего действия, имеют тенденцию вести к неприемлемой гиперкальцемии. Это привело к попыткам синтезировать новые аналоги, имеющие уменьшенное влияние на метаболизм кальция, но которые все же оказывают желаемое воздействие на клеточный метаболизм.
Имеются сообщения о новых аналогах, которые проявляют, по крайней мере, в умеренной степени данное желаемое разделение активности. Так, сообщается, что соединение МC-903, которое представляет собой аналог 22,23-ненасыщенного 1α, 24R-дигидрокси-витамина D3, несущий циклопропильную группу в 24-положении вместо обычной C25-C27 конфигурации холестановой боковой цепи, и которое проходит клинические испытания на лечение псориаза, оказывает действие на клеточное созревание, сравнимое по величине с 1α, 25-дигидрокси-витамином D3, хотя при этом проявляет меньшее гиперкальцемическое действие (Calverley, Tetrahedron (1987), 43, стр. 4609 - 4619, и Holick Arch Dermatol (1989), 125, стр. 1692 - 1696). Аналогичные требования выдвигались в отношении аналогов 1α, 25-дигидрокси-витамина D3, например, 22-окса (Abe и др., Endocrinology (1989), 124, стр. 2645 - 2647), 24- и 26-гомо (Ostrem и др., J. Biol. Chem. (1987), 262, стр. 14164 - 14171). 16-дегидро-23,24-этинил (Zhou и др., Blood (1989), 74, стр. 82 - 93) и 19-нор-10-дигидро (Perlman и др., Tetrahedron Lett (1990), стр. 1823 - 1824).
Из этих сведений нет возможности сделать вывод о том, какие соединения будут проявлять активность модулирования клетки (или об уровне какой-либо такой активности) или определить факторы, которые ведут к разделению активностей, касающихся клеточной модуляции и кальциевого метаболизма. Таким образом, хотя большое количество результатов предполагают, что присутствие гидроксильных групп по направлению к концу боковой цепи холестанового типа или его аналогов необходимо соединениям, чтобы они показывали значительную активность модулирования клеток, находки авторов Ostrem и др. (см. цитированный источник) указывают на то, что аналоги, имеющие только короткую незамещенную в 17-положении боковую цепь (например, изопропил или втор-бутил, как в гомо- или бис-гомо-прегнанах), проявляют вполне значительную активность индуцирования дифференциации и являются более сильными, чем соответствующие соединения с короткой боковой цепью, несущие гидроксильную группу в боковой цепи. Хотя ряд этих соединений, по-видимому, показывают активность модулирования клеток на уровне, аналогичном 1α, 25-дигидрокси-витамину D3, они, видимо, все еще оказывают заметное влияние на кальциевый метаболизм, причем такая активность ослаблена самое большее на два порядка по величине относительно активности 1α, 25-дигидрокси-витамина D3. Это может, следовательно, вызывать связанные с этим проблемы токсичности, если такие соединения используются при длительной терапии, особенно когда требуется систематическое применение, например, для лечения воспалительных и аутоиммунных заболеваний, неоплазии и гиперплазии, или при оральной терапии для лечения псориаза.
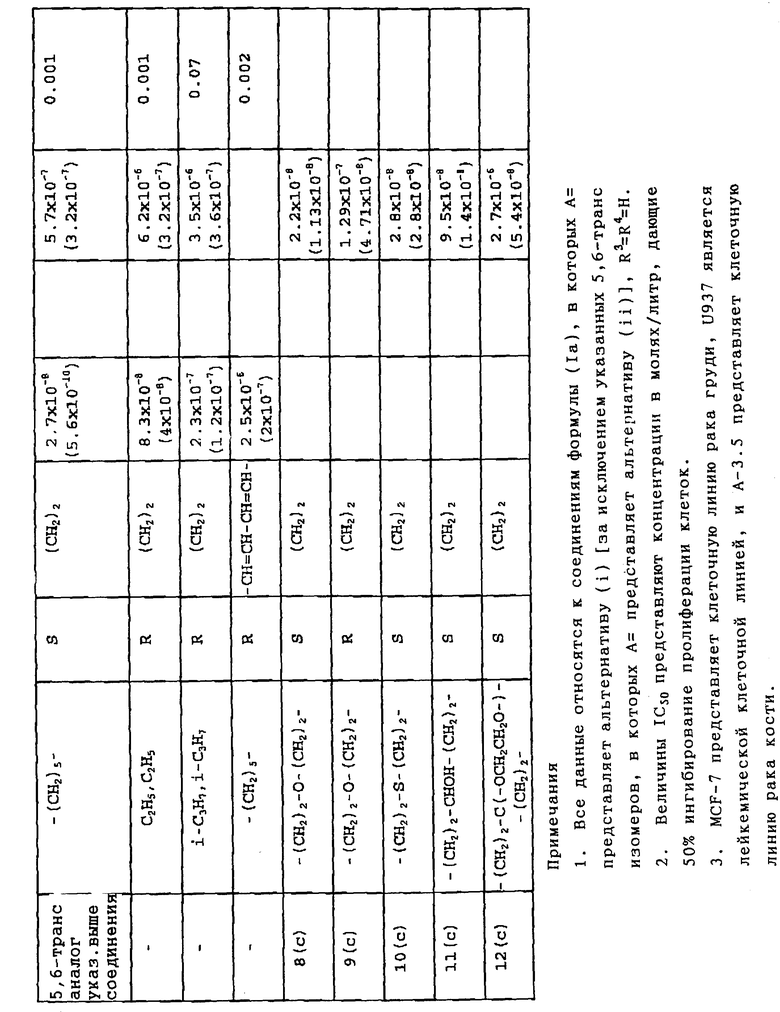
Настоящее изобретение основано на неожиданном обнаружении ряда производных 1α- гидрокси-витамина D и его 20-эпи аналогов, у которых боковая цепь в 17-положении заканчивается необязательно N-замещенной или N,N-дизамещенной карбамоильной группой, при этом указанные производные, проявляя минимальное воздействие на метаболизм кальция, могут оказывать сильное влияние на клеточное модулирование, например, о чем свидетельствует выявление факта клеточной дифференциации и созревания, ингибирования пролиферации и/или активации моноцитов (например, как ) определяется по методу Styrt и др., Blood (1986), 67, стр. 334 - 342). Таким образом, обнаружено, что соединения согласно изобретению оказывают незначительное воздействие на уровни кальция и фосфора в сыворотке у крыс, даже когда назначаются в количествах 100-кратных по сравнению с обычной дозировкой 1α, 25-дигидрокси-витамина D3. Соответственно эти соединения обнаруживают преимущественное терапевтическое соотношение клеточной модуляции и кальцемической активности.
Следующее преимущество соединений изобретения заключается в том, что они имеют очень низкое средство к кишечному рецептору 1α, 25-дигидроксихолекальциферолу.
Изобретение предусматривает соединения формул (I) и (II)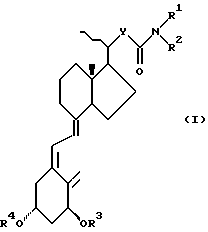
где Y представляет алкиленовую или алкиниленовую группу, содержащую от 4 атомов углерода; R1 и R2, которые могут быть одинаковыми или различными, каждый представляет атом водорода, или низшую алкильную или циклоалкильную группу, или, вместе с атомом азота, к которому они присоединены, образуют гетероциклическую группу; и R3 и R4, которые могут быть одинаковыми или различными, каждый представляет атом водорода или O-защитную группу.
Очевидно, понятно, что формулы (I) и (II) охватывают соединения, имеющие 20R конфигурацию природных производных витамина D,соединения, имеющие 20S конфигурацию производных эпивитамина D, и смеси двух изомеров. Эти формулы также включают активные соединения, в которых R3 и R4 представляют атомы водорода, и их предшественники, в которых R3 и R4 представляют O-защитные группы, хотя такие предшественники сами по себе могут быть активными, когда О-защитная группа или группы являются метаболическими лабильными.
Тот факт, что активные соединения (I) и (II), которые обладают боковыми цепями в 17-положении достаточного размера, аналогичными витамину D, которые не несут 24- или 25-гидроксильной группы и которые во многих случаях не способны гидроксилироваться в этих положениях, проявляют активность модулирования клеток, является неожиданным в свете предшествующих находок в данной области, которые в сильной степени предполагают необходимость такой гидроксильной группы. Наблюдение полезной активности модулирования клеток у активных соединений формул (I) или (II) является еще более удивительным ввиду сообщения о том, что соединения, имеющие аналогичную боковую цепь, но к которой нет 1α- гидроксильной группы, лишены активности, подобной витамину D, и фактически являются полезными в качестве антагонистов витамина D, очевидно вследствие блокирования 25-гидпроксилирования (с. патент США N 4217288).
Отмечалось также (Sorensen и др., Biochemical Pharmacology, (1990), 39, стр. 391-393), что упомянутый выше аналог 1α, 24R-гидрокси-витамина D3 МС-903 окисляется ин виво в соответствующее 24-оксосоединение, и что данный метаболит показывает значительно пониженную активность, что касается влияния на клеточную пролиферацию и дифференциацию, по сравнению с МС-903. Это предполагает, что введение 24-оксогруппы включает стадию дезактивации в отношении активности модулирования клетки, в противоположность нашим находкам, касающимся 14-оксо- и гомологичных соединений настоящего изобретения.
Кроме того по причинам, изложенным выше, наблюдаемое разделение активностей модулирования клетки и кальцемической активности, проявляемое активными соединениями изобретения, не могло быть предсказано на основании известных сведений, относящихся к аналогам витамина D, проявляющим клеточно-модулирущую активность.
Активные 5,6-транс(5E)-изомеры формулы (II) являясь примерно на один порядок по величине менее активными, чем активные 5,6-цис (5Z)- изомеры формулы (I), в отношении клеточно-модулирующей активности, также менее активны в отношении повышения уровней кальция в сыворотке, и таким образом снова проявляют заметное и неожиданное разделение клеточно-модулирующей и кальцемической активностей.
Группа Y в приведенных выше формулах может содержать 0, 1 или 2 двойных связи, и могут, например, иметь формулу -(RA)m-(RB)n-, где RA представляет -CH= CH-, RB представляет -CH2-, m представляет 0, 1 или 2, и n представляет нуль или целое число, такое, чтобы 2m+n =1, 2, 3 или 4. Преимущественно Y может быть C2-4 алкиленовой группой.
Когда R1 и/или R2 в формулах (I) и (II) представляют низкие алкильные группы, ими могут быть, например, (1-6) C алкильные группы, такие как метил, этил, пропил и бутил. Низшие циклоалкильные группы могут, например, содержать 3-8 атомов углерода, как например, в циклопропильной, циклопентильной и циклогексильной группах. Когда группа R1R2N-представляет гетероциклическую группу, она может содержать, например, один или более дополнительных гетероатомов, выбранных из 0, N и S, и может включать одно или более колец, например, каждое из которых имеет 5 или 6 кольцевых членов, как например, в случае N- присоединенной пирролильной, пиразолильной, имидазолильной, индолильной, индазолильной, пуринильной, пирролидинильной, имидазолидильной, пиразолидинильной, пиперидинильной, морфолино, тиазолидинильной или тиаморфолино групп.
Когда R3 и R4 представляет О-защитные группы, ими могут быть, например, способные отщепляться O-защитные группы, такие, как группы, хорошо известные в данной области техники. Подходящие группы включают простые этерифицирующие группы, такие как силильные группы (например, три/низший алкил/силильные группы, такие как триметилсилил, триэтилсилил, триизопролпилсилил или трет-бутилметилсилил, три(арил)силильные группы: такие как трифенилсилил, и смешанные алкил-арилсилильные группы, низшие (например, (1-6/C) алкильные группы, необязательно прерываемые атомом кислорода, такие как метил, метоксиметил или метоксиэтоксиметил, и циклические группы, такие как тетрагидропиранил. Сложные этерифицирующие О-защитные группы включают низшие (например, /1,6/с/ алконоильные группы, такие как ацетил, пропионил, изобутирил или пивалоил, ароильные (например, содержащие 7-15 атомов углерода), такие как бензоил или 4-фенилазобензоил, низшие алкансульфонильные, такие как (необязательно галоидированные) метансульфонил, и ареносульфонильные, такие как п-толуолсульфонил. Такие О-замещенные производные являются полезными в качестве промежуточных продуктов при получении активных 1α,3β- диолов формулы (I) и (II), в которых R3 и R4 представляют атомы водорода, хотя, как указывалось выше, когда О-защитные группы являются метаболически лабильными ин виво, такие простые и сложные эфиры формул (I) и (II) могут непосредственно использоваться в терапии.
Клеточно-модулирующая активность активных соединений согласно изобретению, в сочетании с отсутствием с их стороны существенного проявления кальцемического действия, делает их представляющими интерес (как самих, так и в качестве вспомогательных средств) при оказании помощи в случае неопластических заболеваний, особенно миелогенного лейкоза. Они могут также использоваться или сами по себе, или в качестве вспомогательных средств при хемотерапии инфекционных заболеваний и во всех других случаях терапевтического воздействия, при которых вовлечены моноядерные фагоциты, например, при лечении костных заболеваний (например, остеопороза), аутоиммунных заболеваний, реакции хозяин-трансплантат, отторжения трансплантата и воспалительных заболеваний, неоплазии и гиперплазии, такой как псориаз. Угри или акне, аглопеция (облысение), старение кожи (включая фотостарение), гипертензия, ревматоидный артрит и астма составляют другие соотношения, которые могут подвергаться лечению с помощью активных соединений согласно изобретению, и данное изобретение охватывает использование этих соединений при терапии или профилактики таких состояний и в производстве медикаментов для такого лечения или профилактики.
Мы считаем, что активные 20R изомеры формул (I) и (II) могут быть предпочтительными для лечения инфекционных заболеваний, например, при комбинационной терапии, тогда как активные 20S эпи-изомеры могут предпочитаться для применений, включающих иммуносупрессивный эффект, например при лечении аутоиммунных и воспалительных заболеваний, ревматоидного артрита, астмы и др. Данная точка зрения подкрепляется, например, работой Binderup и др., касающейся аналогов 20-эпи-витамина D3, о которой сообщается в Biochemical Pharmacology (1991), 42/8/, стр. 1569-1575.
Активные соединения согласно изобретению могут преобразовываться в готовые препаративные формы для назначения любым удобным способом, например, орально (включая под язык), парентерально, ректально или путем ингаляции; и фармацевтические композиции, сформированные таким образом, включают один из аспектов данного изобретения.
Композиции, назначаемые для орального применения, могут, если необходимо, содержать один или более физиологически совместимых носителей и/или эксципиентов и могут быть твердыми или жидкими. Композиции могут принимать любую удобную формулу, включая, например, таблетки, таблетки с покрытием, капсулы, лепешки, водные или масляные суспензии, растворы, эмульсии, сиропы, эликсиры и сухие продукты, подходящие для преобразования в другие формы с водой или еще одним подходящим жидким носителем перед использованием. Композиции могут преимущественно приготавливаться в форме дозированных единиц. Таблетки и капсулы в соответствии с изобретением могут при желании содержать общепринятые ингредиенты, такие как связующие, например, сироп, камедь акации, желатин, сорбит, трагакант или поливинил-пирролидон, наполнители, например, лактозу, сахар, кукурузный крахмал, фосфат кальция, сорбит или глицин; смазочные агенты, например, стеарат магния, тальк, полиэтиленгликоль или двуокись кремния; дезинтегрирующие агенты, например, картофельный крахмал; или приемлемые смачивающие агенты, такие как лаурилсульфат натрия. Таблетки могут иметь покрытия, наносимые в соответствии с методами, хорошо известными в технике.
Жидкие композиции могут содержать общепринятые добавки, такие как суспедирующие агенты, например, сироп сорбита, метилцеллюлозу, глюкозно-сахарный сироп, желатин, гидроксиметилцеллюлозу, карбоксиметилцеллюлозу, стеарат-алюминиевый гель или гидрированные съедобные жиры; эмульгируемые агенты, например, лецитин, сорбитанмоноолеат или камедь акации; неводные носители, которые могут включать пищевые или съедобные масла, например, растительные масла, такие как масло арахиса, миндальное масло, фракционированное кокосовое масло, жир из печени рыб, масляные сложные эфиры, такие как полисорбат 80, пропиленгликоль, или этиловый спирт; и консервирующие добавки, например, метил- или пропил-н-гидроксибензоаты или сорбиновую кислоту. Жидкие композиции могут удобным образом инкапсулироваться, например, в желатиновые капсулы, давая продукт в форме дозированных единиц или единичных доз.
Композиции для парентерального назначения могут формироваться с использованием инъецируемого жидкого носителя, такого как стерильная свободная от пирогенов вода, стерильный свободный от перекисей этилолеат, дегидратированный спирт или пропиленгликоль, или смесь дегидратированного спирта и пропиленгликоля, и могут инъецироваться внутривенно, интраперитонально или внутримышечно.
Композиции для ректального назначения могут формироваться с использованием обычной основы для суппозиториев, такой как масло какао или другой глицерид.
Композиции для назначения с помощью ингаляции обычно формируются для личного использования, например, в дозированной форме, например, в виде суспензии в веществе типа ракетного топлива, таком как галоидированный углеводород, заполненный в аэрозольный контейнер, снабженный дозирующим клапаном для выпуска.
Может оказаться целесообразным вводить в композиции изобретения антиоксидант, например, аскорбиновую кислоту, бутилированный гидроксианизол или гидрохинон для увеличения срока их хранения.
Когда любая из указанных выше композиций приготавливается в дозированной форме, они могут содержать, например, 0,05 - 250 мкг, например, 0,1 - 50 мкг, активного соединения согласно изобретению на дозированную единичную форму. Композиции могут включать при желании один или более дополнительных активных ингредиентов.
Подходящую суточную дозу активного соединения согласно изобретению может, например, составлять интервал 0,1 - 500 мкг, например, 0,2 - 100 мкг, в день, в зависимости от таких факторов, как тяжесть заболевания, подвергаемого лечению, и возраст, вес и состояние субъекта.
Соединения согласно изобретению могут быть получены с помощью следующих методов:
А) Соединения формулы (I) могут получаться с помощью изомеризации соответствующего 5,6-транс-соединения формулы (II) с последующим, если необходимо или желательно, удалением O-защитных групп. Изомеризация может проводиться, например, путем обработки иодом, дисульфидом или диселенидом, или с помощью облучения ультрафиолетовыми лучами предпочтительно в присутствии триплетного сенсибилизатора (активатора). 1α -Гидрокси-соединения формулы (II) сами могут получаться с помощью окисления соответствующего 1-незамещенного 5,6-транс-соединения с использованием селенитного сложного эфира или двуокиси селена; или селенистой кислоты в присутствии спирта, например, как описано в GB-A-2038834, содержание которого упомянуто здесь для сведения. 1-незамещенное 5,6-транс-соединение может, при желании, приготавливаться на месте (ин ситу) изомеризацией соответствующего 5,6-цис витаминового производного в окислительных условиях.
B) Соединения формул (I) или (II) могут получаться по реакции соединения формулы (III)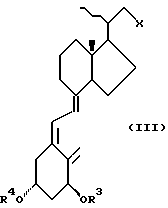
(где R3 и R4 имеют значения, определенные выше, и X представляет оксо или фосфоранилиденовую группу; металлированную силановую или сульфоновую группу; группу -/CH2/aL, где a представляет 0, 1 или 2, и L представляет удаляемую группу, например, группу сульфонатного эфира, такую как низший алкилсульфонилокси, низший фторалкилсульфонилокси или арилсульфонилокси, или, более предпочтительно, атом галогена, такого как хлор, бром или иод; или группу -/CH2/bR5, где b представляет 0, 1, 2 или 3, и R5 представляет цианогруппу или сложноэтерифицированную карбоксильную или тиокарбоксильную группу, такую как алкоксикарбонил, аралкоксикарбонил, арилоксикарбонил, алкалтиокарбонил, аралкилтиорбонил или арилтиокарбонильную группу) или соответствующего 5,6-транс-соединения с одним или более реагентами, служащими для генерирования желаемой амидной группировки в боковой цепи, с последующим, когда это необходимо и/или желательно, удалением любых O-защитных групп. Очевидно, что соединение формулы (II), полученное таким способом, может при желании превращаться в соединение формулы (I) с помощью изомеризации, как описано в способе (A).
Реакции согласно процессу (B), которые могут использоваться для получения соединений формулы (I) или (II), в которой Y представляет алкиленовую группу, включают:
B1) Реакцию соединения (III), в котором X представляет группу -/CH2/aL, определенную выше, или 5,6-транс-изомера его с металлированной или диметаллированной солью амида формулы IV
CH3 • CO • NR1R2, (IV)
(где R1 и R2 имеют значения, определенные выше), например, соли щелочного металла, такой как дитиевая соль, полученной с помощью реакции с основанием, таким как диизопропиламид лития.
B2) Реакцию соединения (III), в котором X представляет группу -/CH2/bR5, определенную ранее, или соответствующего 5,6-транс- изомера для превращения сложного эфира, тиоэфира или цианогруппы R5 в желаемую амидную группу, например, с помощью непосредственного аминолиза сложного эфира или тиоэфира, или косвенно через соответствующую свободную кислоту, полученную с помощью гидролиза сложного эфира, тиоэфира или нитрила, или через галоидангидрид кислоты, полученный из него. Следует понимать, что нитрилы формулы (III) могут частично гидролизоваться непосредственно в соединения (I), в которых R1 и R2 оба представляют атомы водорода.
B3) Реакцию соединения (III), в котором X представляет группу -/CH2/aL, определенную выше, или 5,6-транс-изомера его с реагентом, служащим для введения одно-углеродного фрагмента (например, металлцианидом или металлированным тритианом) и превращение введенной таким образом группы в желаемую - -CONR1R2 группу, например, как описано для процесса (B2).
Реакция согласно процессу (B), которая может использоваться для получения соединений формулы (I) или (II), в которой Y представляет алкиленовую группу, включает
B4) Реакцию соединения (III), в котором X представляет оксогруппу, или 5,6-транс-изомера его по типу реакции Виттига, например, с фосфораном формулы:
/RC/3P = CH-/Y1/p-RD, (V)
(где Y1 представляет алкиленовую или алкениленовую группу, имеющую до 2 атомов углерода; p равно 0 или 1; RC представляет углеводородную группу, например, алкильную или аралкильную группу или арильную группу, такую как фенил; и RD представляет аминокарбонильную группу - -CONR1R2, определенную выше, или группу предшественник, превращаемую в нее, такую как сложноэфирную, тиоэфирную или циногруппу) с последующим, когда это необходимо, превращением для генерирования группы -CONR1R2. Альтернативно, фосфоран (Y) может заменяться металлированным силаном (RC)3Si - CHM-/Y1/p-RD или металлированным сульфоном RCSO2 - CHM-/Y1/p-RD (где RC, RD, Y1 и p имеют значения, указанные выше, и M представляет атом металла, например, щелочного металла, такого как литий или натрий), причем после данной последней реакции следует восстановление промежуточного гидроксисульфона с образованием требуемой двойной связи, например, с использованием натриевой амальгамы. В обратном порядке, эти реакции могут проводиться с использованием соединения формулы (III), в которой X представляет фосфоранилиденовую группировку -P(RC)3, или соответствующего металлированного производного формулы (III), в которой X представляет -Si(RC)3 или -SO2RC, (где RC имеет значения, указанные выше) с альдегидом формулы HCO-/Y1/p-RD (где p, RD и Y1 имеют значения, указанные выше).
Соединения формулы (III), имеющего нормальную в 20-положении конфигурацию природных производных витамина D, т.е. соединения формулы (IIIa)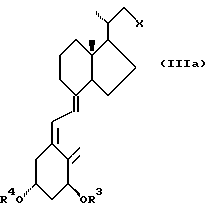
и/или 5,6-транс-изомера и их могут получать из 1α- гидрокси-витамина D2 или его O-защищенного производного с помощью окислительного расщепления 22,23-двойной связи, причем соединение витамина D2 предпочтительно стабилизируется с помощью образования диенофильного аддукта Дильо-Альдера, например, с двухокисью серы или диацилазо соединением, как описано в GB-A-2114570 (содержание которого приведено здесь для сведения). Данным способом может получаться 20S соединение (IIIa), в котором X представляет оксогруппу.
Такие соединения (IIIa) или, более предпочтительно, их диенофильные аддукты могут изомеризоваться, например, путем обработки слабым основанием, например, неорганическим основанием, таким как бикарбонат натрия, или третичным органическим основанием, таким как DABCO (т.е. 1,4-диазабицикло[2.2.2] октаном) или DBU (т.е. 1,8-диазабицикло[5.4.0]ундец-7-еном), давая смесь 20R и 20S изомеров, из которой чистый 20R эпи-изомер, т.е. соединение формулы (IIIb)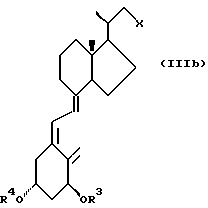
(в которой X представляет оксогруппу) или его диенофильный аддукт может выделяться хроматографическим путем (например, как описано автором Calverley в Tetrahedron (1987), 43, стр. 4609 - 4619). Альтернативно, отделение желаемого эпи-изомера может быть отложено до последней стадии в синтезе, вплоть до нее и включая конечную стадию.
Оксогруппа X в полученных таким образом соединениях (IIIa) и (IIIb) или их смесях может превращаться с помощью восстановления в гидроксильную группу и затем в соединения, в которых X представляет группу -/CH2/aL, где a = 0, и L представляет атом галогена, например, с помощью превращения в сульфонатный эфир (например, тозилат) и нуклеофильным замещением тозилатной группы по реакции с галогенидной солью (например, бромидом щелочного металла). Эти последние соединения (III) и их 5,6-транс-изомеры могут подвергаться реакции, например, с цианидом металла, как описано для процеса B3), давая соединение (III) или его 5,6-транс-изомер, в котором X представляет группу -/CH2/bR5, где b = 0, цианогруппа R5 может впоследствии при желании модифицироваться с помощью гидролиза и сложной этерификации.
Соединения (III) и соответствующие 5,6-транс-изомеры, в которых X представляет группу -/CH2/bR5, где b = 1 или 2, и R5 имеет значения, определенные ранее, могут получаться по реакции соединения (III) или его 5,6-транс-изомера, в котором X представляет группу -/CH2/aL, где a представляет 0 или 1 и L имеет значения, определенные выше, с металлированным производным сложного эфира или тиоэфира уксусной кислоты, с производным, содержащим еще один карбанионный эквивалент уксусной кислоты (например, металлированным производным ацетонитрила), или с металлированным малонатным эфиром. В последнем случае продукт реакции частично гидролизуется, давая моноэфир, который может декарбоксилироваться с помощью нагревания, давая соединение (III), в котором X - группа - /CH2/bR5, где R5 - сложноэфирная группа.
Соединения (III) и соответствующие 5,6-транс-изомеры, в которых X представляет группу -/CH2/aL, в которой a представляет 1 или 2 и L имеет значения, определенные выше, могут получаться из соединений (III) или 5,6- транс-изомеров их, где X представляет группу -/CH2/bR5, в которой b равно 0 или 1 и R5 представляет сложноэфирную группу, с помощью восстановления эфира в спирт, например, с использованием литийалюминийгидрида, и превращения гидроксильной группы в удаляемую группу, например, как описано выше.
1-Незамещенные аналоги соединений формулы (III) и/или их 5,6-транс-изомеры могут также получаться аналогичным образом из витамина D2 и затем вводиться в реакцию такую, чтобы получить желаемую амидную группу боковой цепи, и подвергаться 1α- гидроксилированию, например, как описано в упомянутом выше GB-A-2038834, на соответствующей стадии синтеза.
Обычно на любой стадии может присутствовать или 5,6-цис, или 5,6-транс-геометрия, хотя может быть предпочтительным применять на вышеупомянутой стадии 1α- гидроксилирования и в реакциях окислительного расщепления 22,23-двойной связи 5,6-транс-изомеры. Превращение 5,6-транс-геометрического изомера в 5,6-цис таким образом наиболее успешно проводится после введения 1α- гидроксильной группы.
O-защитные группы, присутствующие в 1α- и/или 3β- положениях, могут удаляться, например, с помощью общепринятых методов, которые хорошо известны и описаны в литературе. Так, сложноэтерифицирующие ацильные группы могут удаляться с помощью основного гидролиза, например, с использованием алкоголята щелочного металла в адканоле. Простые этерифицирующие группы, такие как силильные, могут удаляться с помощью кислотного гидролиза или обработки тетралалкиламмонийфторидами. Использование таких кислотно-лабильных стабильных к основанию защитных групп может представлять преимущество, при реакции соединений формулы (III) и соответствующих 5,6-транс-изомеров и/или 1-незамещенных соединений, ввиду сильно основных условий, обычно применяемых на стадиях гомологизации, используемых для построения желаемой боковой цепи.
Следующие неограничительные примеры служат для иллюстрации изобретения. Все температуры даны в градусах Цельсия.
Пример 1.
a) 1α,3β- Ди/триизопропилсилилокси/-9/10-секо-25-азахолеста/5/E/, 7,10/19/-триен-24-он [формула II - 20R- изомер, R1=R2=CH3, R3=R4=/изо= Rr/3Si, Y = -CH2CH2-]
1α,3β- Ди-/триизопропилсилилокси/-9,10-секо-20-п- толуолсульфонилоксиметилпрегна-5/E/, 7,10/19/-триен [5,6-транс-изомер формулы (IIIa)-R3= R4= /изо-Pr/3Si, X = тозилокси-ЯМР δ 7,5 (2H, д., J = 8, арил), 7,03 (2H, д., J = 8, арил) 6,16 и 5,6 (AB, J = 11, 6H, 7H), 4,8 (2H, с., 19H), 4,46 (1H, т, J = 11, 1H), 4,39-3,5 (3H, м, 3H, 22H'a), 2,36 (3H, с., арил CH3), 0,5 (3H, с, 18H'b) (710 мг) нагревался в условиях дефлегмации в ацетонитриле (8 мл), содержащем избыток бромида лития (620 мг). Через 45 минут смесь охлаждалась, разбавлялась водой и экстрагировалась эфиром. Эфирный экстракт очищался с помощью хроматографии на силикагеле, давая 490 мг соответствующего 20-бромметильного соединения (ЯМР δ 6,25 и 5,66 (ABкв., J = 11, 6,7 H'b), 4,83 (2H, с, 19H'b), 4,66-4,0 (2H, м., 1,3H'a), 3,31 (2H, шир.с. 22H'a), 0,55 (3H, с, 18H'b), УФ νмакс 270 (213000), λмин 229 (4922)). Раствор данного соединения (245 мг) в гексаметилфосфорамиде (0,7 мл) добавлялся при -78oC к раствору) литиевой соли N,N-диметилацетамида (полученной из N,N-диметилацетамида (0,158 мл) и диизопропиламида лития (1,54 ммоля), в тетрагидрофуране (4,6 мл)). Реакционная смесь оставлялась подогреваться до комнатной температуры (30 минут), перемешивалась в течение дальнейших 2 часов, затем обрабатывалась насыщенным водным хлоридом аммония, а затем водой, и продукт экстрагировался простым эфиром. Очистка с помощью хроматографии давала целевое соединение (208 мг). ЯМР δ 6,4 и 5,76 (ABкв., J = 11, 6,7H'b), 4,93 (2H, с. , 19H'b), 4,76-4,01 (2H, м, 1,3H'a), 3,31 и 2,9 (каждый 3H, с, N-CH3), 0,55 (3H, с, 18H'b). ИК νмакс (CDCl3) 1625 см-1 (амид). УФ νмакс 270 (23333), λмин 230 (7337).
b) 1α,3β- Дигидрокси-9,10-секо-25-азахолеста-5/Z/,7,10/19/- триен-24-он [формула (I) - 20R изомер, R1=R2CH3, R3=R4=H, Y = -CH2CH2-].
Продукт стадии (a) выше облучался в течение 45 минут в бензоле (6 мл), содержащем феназин (12 мг). Растворитель затем удалялся, и сырое 5Z соединение обрабатывалось при комнатной температуре в течение 2 часов водным фторидом тетрабутиламмония (0,3 мл 1М) в тетрагидрофуране (1 мл). Разбавление водой, экстрагирование продукта в эфир и очистка с помощью препаративной ТСХ давала целевое соединение (21 мг).
ЯМР δ 6,36 и 5,98 (ABкв., J = 11, 6,7H'b), 5,26 и 4,95 (каждый 1H, с., 19H'b), 4,63-3,9 (2H, м, 1,3H'a), 3,0 и 2,93 (каждый 3H, с., N-CH3), 0,56 (3H, с, 18H'b), ИК νмакс (CDCl3) 3610 и 3410 (OH), 1630 см-1 (амид). УФ λмакс 265 (18, 300), λмин 228 (10166).
Пример 2.
a) 3β- Гидрокси-20-(2-этоксикарбониэтил)-9,10-сексопрегна- 5/E/, 7,10(19)-триен [1-незамещенный аналог 5,6-транс-изомера формулы (IIIa) -R4H, X = CH2CH • O • C2H5].
Аддукт двуокиси серы и 3β- ацетокси-20-гидроксиметил-9,10-секо- прегна-5/E/, 7,10(19)-триена (4,54 г) растворялся в дихлорметане (40 мл), содержащем 1,8-бис/диметиламино/нафталин (3,14 г) и обрабатывался при -30oC трифторметансульфоновым ангидридом (3,812 г). Реакционная смесь перемешивалась непродолжительно, оставлялась подогреваться до комнатной температуры, охлаждалась до -30oC, затем обрабатывалась раствором натрий-диэтилмалоната (полученного из диэтилмалоната (8,32 г) и гидрида натрия (1,248 г)) в тетрагидрофуране (40 мл). Смесь оставлялась подогреваться до комнатной температуры и перемешивалась в течение 15 минут. Добавление насыщенного водного хлорида аммония, затем воды, экстрагирование продукта в эфир и очистка с помощью хроматографии давала аддукт двуокиси серы и 3β- ацетокси-20(2,2-диэтоксикарбонилэтил)-9,10-секопрегна-5/E/, 7,10 (19)триена в виде смеси 6R- и 6S-соединений (4,675 г)
(ЯМР δ 5,1-4,26 (3H, м, 3, 6, 7H'b), 4,0 (4H, кв., J = 7, O-CH2Me), 3,46 (2H, шир.с, 19H'b), 1,93 и 1,90 (всего 3H, каждый с., ацетил H), 0,63 и 0,56 (всего 3H, с, 18H'b).
Раствор данного продукта (4,475 г) в этаноле (15 мл) обрабатывался этанольной гидроокисью калия (20 мл, 1 М) с водой (0,380 мл). Смесь перемешивалась при комнатной температуре в течение 1,5 часов, затем разбавлялась водой и подкислялась, и продукт экстрагировался в эфир. Сырой сложный моноэфир, полученный таким образом, декарбоксилировался (и двуокись серы удалялась для регенерации 5,7,10-(19)-триеновой системы) с помощью нагревания при 125o в диметилсульфоксиде (15 мл), содержащем бикарбонат натрия (5 г) в течение 20 минут. Смесь охлаждалась, затем разбавлялась водой, и продукт экстрагировался в эфир и очищался с помощью хроматографии, давая целевое соединение (2,22 г).
ЯМР δ 6,16 и 5,56 (ABкв., J = 11, 6,7H'b), 4,53 и 4,43 (каждый 1H, с., 19H'b), 3,91 (2H, кв., J = 7, O-CH2Me), 0,56 (3H, с, 18H'b), УФ λмакс 272 (23600), λмин 231 (5645).
b) 1α,3β Ди/триизопропилсилилокси/-20-/2-этоксикарбонилэтил/- 9,10-секопрегна-5/E/, 7,10/19/-триен (5,6-транс-изомер формулы (IIIa)-R3=R4=/изо-Pr/3Si, X = CH2CO • O • C2H5)
Продукт стадии (a) выше (2,563 г) подвергался реакции с триизопропилсилилхлоридом (1,214 г) и имидазолом (1,42 г) в дихлорметане (5 мл) для превращения 3β- гидроксильной группы в триизопропилсилилоксигруппу. Данный продукт в 1,2-дихлорэтане (32 мл) гидроксилировался с помощью обработки двуокисью селена (0,51 г) в ацетонитриле (32 мл) и N-окисью N-метилморфолина (2,47 г) в дихлорметане (32 мл) согласно процессу GB-A-2038834, давая (после очистки с помощью хроматографии) 1α- гидроксисоединение (1,37 г) (ЯМР δ 6,3 и 5,7 (ABкв, J = 11, 6,7 H'b), 4,9 и 4,8 (каждый 1H, с, 19H'b), 4,63-3,7 (2H, м, 1,3H'a), 4,0 (2H, кв, J = 7, O-CH2Me), 0,56 (3H, с, 18H'b). УФ λмакс 270 (23,200), λмин 229 (5068). Данный продукт силилировался, как описано выше, давая целевое соединение (1,575 г). ЯМР δ 6,26 И 5,68 (ABкв, J = 11, 6,7 H'b), 4,86 (2H, с, 19H'b), 4,73-3,73 (2H, м, 1,3H'a), 4,0 (2H, кв, J = 7,0-CH2Me), 0,53 (3H, с, 18H'b). УФ λмакс 270 (23,600), λмин 228 (5053).
c) 1α,3β- Ди/(тризопропилсилилокси)-25,26,27-тринор-9, 10-секохолеста-5(E): 7,10(19)-триен-24-ол (5,6-транс-изомер формулы (IIIa)-R3= R4=(изо-Pr)3Si, X=CH2CH2OH)
Раствор продукта от стадии (b) выше (350 мг) в эфире (1 мл) добавлялся к перемешиваемому раствору литийалюминийгидрида (100 мг) в эфире (5 мл) при 0o. Смесь перемешивалась при комнатной температуре в течение получаса, охлаждалась до 0o, обрабатывалась водным сульфатом натрия, и продукт экстрагировался в эфир. Эфирный экстракт промывался водой, затем солевым раствором и удалялся в вакууме, давая целевое соединение. ЯМР δ (CCl4): 6,21 и 5,62 (ABкв, 6 и 7 H'b), 4,82 (2H, с, 19H'b), 4,66-3,98 (2H, м, 1,3H'a), 3,41 (шир. с. , 2H, 24H'a), 0,55 (с, 3H, 18 Me), УФ (Et2O): λмакс 270 (23,600), λмин 229 (5,714).
d) 1α,3β- Ди(триизопропилсилилокси)-25,26,27-тринор-9,10- секохолеста-5(E),7,10(19)-триен-24-бромид(5,6-транс- изомер
формулы (IIIa) R3=R4=/изо-Pr/3Si, X=CH2CH2Br)
Раствор спирта со стадии (c) выше (330 мг) в дихлорметане (4 мл), содержащем 1,8-бис/диметиламино/нафталин (309 мг), обрабатывался в течение 3 минут при -40o трифторметансульфоновым ангидридом (0,203 г). Смесь затем обрабатывалась раствором бромида натрия (1,03 г) и тетрабутиламмонийбромида (0,01 г) в воде (5 мл) и оставалась подогреваться до комнатной температуры. Спустя 30 минут, реакционная смесь распределялась между дихлорметаном и водой. Органическая фаза отделялась, промывалась разбавленной серной кислотой, концентрировалась, и продукт очищался с помощью хроматографии, давая 0,26 г целевого соединения. ЯМР δ (CCl4): 6,06 и 5,6 (ABкв, 6,7 H'b), 4,71 (с, 2H, 19H'b), 4,63-4,0 (с, 2H, 1,3H'a), 3,21 (т., 2H, 24 H'a), 0,56 (с., 3H, 18 Me). УФ (Et2O): λмакс 270 (23,600). λмин 229 (6098).
e) 1α,3β Ди/триизопропилсилилокси/-22,23-бисгомо-25-аза-9,10- секохолеста-5(E), 7,10(19)триен-24-он (формулы (II) - 20R изомер R1=R2=CH3, R3=R4= /изо-Pr/3Si, Y=-CH2CH2CH2CH2-).
Бромид со стадии (d) выше (0,18 г) в гексаметилфосфорамиде (0,8 мл) обрабатывался литиевой солью N,N-диметилацетамида, как описано в примере 1(a), давая целевое соединение (0,103 г), ЯМР δ (CCl4): 6,26 и 5,66 (ABкв., 6, 7H'b), 4,83 (с, 2H, 19H'b), 4,66-4,01 (м., 2H, 1, 3H'a), 2,93 и 2,91 (2c, каждый 3H, N-Me'a), 0,52 (с., 3H, 18 Me), УФ (Et2O): λмакс 270 (23,600), λмин 229 (5526).
f) 1α,3β -Дигидрокси-23,23-биогомо-25-аза-9,10-секохолеста-5(Z), 7,10(19)-триен-24-он (формулы (I) - 20R изомер, R1=R2=CH3, R3=R4=H, Y=-CH2CH2CH2CH2-).
Амид со стадии (e) выше (0,072 г) облучался в присутствии феназина (0,018 г), а затем десилилировался, как описано в примере 1(b), давая целевое соединение (0,26 г). ЯМР δ (CDCl3): 6,33 и 5,93 (ABкв., 6, 7H'b), 5,26 и 4,93 (2, 1H, 19H'b), 4,66-3,83 (м., 1, 3H'a), 2,96 и 2,9 (2 с., каждый 3H, N-Me'u), 0,53 (с, 3H, 18 Me), УФ (EtOH): λмакс 264 (18,300), λмин 228 (10,892).
Пример 3.
a) 26 этиловый эфир 1α,3β ди/триизопропилсилилокси/-27-нор-9,10- секохолеста-5(E), 7,10(19),22,24-пентаен-26-карбоновой кислоты (5,6-транс-изомер) формулы (IIIa) - X=(=CH-CH=CH-CO2Et). R3=R4=/изо-Pr/3Si.
Смесь 1α,3β- ди/триизопропилсилилокси/-9,10-секопрегна- 5(E),7,10(19)-триен-20-карбоксалтдегида (5,6-транс-изомера формулы (IIIa), R3=R4=/изо-Pr)3Si, X=(O)) (0,452 г) и фосфоран из этилового эфира 4-трифенилфосфоний-бут-2-еновой кислоты (1,2 г) в хлороформе (3 мл) нагревались с обратным холодильником в течение 4 часов, растворитель удалялся в вакууме, и продукт очищался с помощью хроматографии, давая названное в заголовке соединение (0,26 г). ЯМР δ (CCl4): 7,26 - 6,41 (м, 1H, 25H), 6,26 - 5,23 (м., 5H, 6, 7, 22, 23, 24H'a), 4,7 (с., 2H, 19H'b), 4,56-3,66 (м., 4H, 1,3H'a, сложноэфирный CH2), 0,55 (с, 3H, 18 Me), УФ (EtOH): λмакс 264 (39, 695).
b) 1α,3β -Ди/триизопропилсилилокси/-27-нор-9,10-секохолеста- 5(Z), 7,10(19), 22,24-пентаен-26-карбоновая кислота, 26 этиловый эфир (формула (IIIa), X=(=CH-CH=CH-CO2Et), R3=R4=/изо-Pr)3Si).
Сложный эфир со стадии (a) выше (0,06 г) облучался в присутствии феназина (0,015 г), как описано в примере 1(b), давая названное в заголовке соединение (0,053 г). ЯМР δ (CCl4): 7,58-6,66 (м, 1H, 25H), 6,41-5,33 (м., 5H, 6, 7, 22, 23, 24H'a), 5,08 и 4,75 (2 с., 1H приблиз., 19H'b), 4,58 - 3,75 (м, 4H, 1, 3H'a, сложноэфирон. CH2), 0,55 (с., 3H, 18 Me), УФ (EtOH): λмакс 263 (46,938).
c) 26 диметиламид 1α,3β -дигидрокси-27-нор-9,10-)секохолеста- 5(Z), 7,10(19), 22,24-пентаен-26-карбоновой кислоты (формула (I) - 20R изомер, R1= R2=CH3, R3=R4=H, Y=-CH=CH=CHOCH-).
Сложный эфир со стадии (b) выше (0,53 г) растворялся в растворе 1 M этанольной гидроокиси калия (2 мл). После хранения при комнатной температуре на протяжении ночи смесь разбавлялась водой, продукт экстрагировался в дихлорметане, промывался 1% водной серой кислотой, и растворитель удалялся. Неочищенная кислота (0,046 г) растворялась в дихлорметане (1 мл) и обрабатывалась дициклогексилкарбодиимидом (0,016 г), а затем диметиламином (0,3 мл). После 30-минутного перемешивания при комнатной температуре реакционная смесь разбавлялась дихлорметаном, твердые вещества удалялись фильтрованием, фильтрат промывался водой, затем 1% водной серной кислотой, и растворитель удалялся. Хроматография давала 1,3-ди/триизопропилиловый эфир) целевого соединения (0,019 г). ЯМР δ (CHCl3): 7,33-6,6 (м., 1H, 25H), 6,56-5,33 (м., 5H, 6, 7, 22, 23, 24H'a). 5,06 и 4,73 (2 с., 1H приблиз., 19H'b), 4,6 - 3,83 (м. , 2H, 1,3H'a), 2,98 (с., 6H, NME), 0,53 (с, 3H, 18 Me). УФ (EtOH): λмакс 265 (40,671). Удаление силильных групп, как описано в примере 1(b), давало целевое соединение (0,008 г). УФ (EtOH): λмин 266 (36,775).
Пример 4.
a) 1α,3β -Ди/триизопропилсилилокси/-9,10-секохолановая кислота 5(Z), 7,10(19)триен (5,6-цис-изомер формулы (IIIa), R3= R4= (изо-Pr)3Si), X = CH2CO2H).
Сложный этиловый эфир указанного в заголовке соединения (полученный из соединения примера 2(b) с помощью фотоизомеризации, как описано в примере 3(b)-140 мг) в тетрагидрофуране (0,5 мл) обрабатывался 1 норм. этанольной гидроокисью калия (3 мл). После 3 часов хранения при комнатной температуре реакционная смесь доводилась до pH 2 (добавлением 1% водной серной кислоты), и продукт экстрагировался в простой эфир, который в свою очередь промывался водой и солевым раствором. Удаление эфира давало целевое соединение (123 мг). ИК νмакс (CCl4) 3200-2400 (OH карбоксила), 1720 см-1 (карбонил). ЯМР δ (CCl4): 12,33 (1H, шир. , COOH), 6,03, 5,8 (2H, дд., 6,7H'b) 5,05, 4,75 (каждый 1H, с., 19H'b), 5,01-4,0 (2H, м., 1,3H'a), 0,53 (3H, с., 18H'b). УФ (EtOH): λмакс 264 (18,300).
b) N, N-Пентаметилен -1α,3β- дигидрокси-9,10-секохоланамид- 5(Z), 7,10(19)-триен (формула (I) - 20R изомер, R1+R2=-(CH2)5-, R3=R4=H, Y=-(CH2)2-).
Карбоновая кислота со стадии (a) выше (41 мг) растворялась в дихлорметане (0,5 мл) и обрабатывалась дициклогексилкарбодиимидом (1 экв.) и 4-диметиламинопиридином (2 мг), а затем пиперидином (1 экв.). Реакционная схема хранилась на протяжении ночи при комнатной температуре. Получающийся 1,3-дисилированный амид десилилировался (тетрабутиламмонийфторидом), как в примере 1(b), давая указанное в заготовке соединение. ИК νмакс (CDCl3) 3600 (-OH), 1630 см-1 (C=0, т-амид), ЯМР δ (CDCl3): 6,26, 5,86 (2H, дд., 6,7H'b), 5,2, 4,86 (каждый H, с. , 19H'b), 4,56 - 3,76 (2H, м., 1,3H'a), 3,4 (4H, м., NCH2), 0,5 (3Hc. 18H'b). УФ (EtOH): λмакс 264 (18,300).
Пример 5.
N-Циклопропил -1α,3β- дигидрокси-9,10-секохоланамид-5(Z),7,10(19)- триен (формула (I)-20R изомер, R1=H, R2=циклопропил, R3=R4=H, Y=-(CH2)2-).
Указанное в заголовке соединение получалось, как описано в примере 4(b), с использованием циклопропиламина вместо пиперидина. ИК νмакс (CDCl3) 3580 (-OH), 3420 (-NH), 1680 см-1 (C=O, амид). ЯМРδ (CDCl3): 6,26, 5,83 (2H, дд., 6,76H'b), 5,53 (1H, шир.с., NH), 5,16, 4,83 (каждый 1H, с., 19H'b), 4,66 - 3,88 (2H, м., 1,3H'a), 0,5 (3H, с., 18H'b). УФ (EtOH): λмакс 265 (18,404).
Пример 6.
1α,3β- Дигидрокси-9,10-секоходанамид-5(Z),7,10(19)-триен (формула (I) - 20R изомер, R1=R2=R3=R4=H, Y=-(CH2)2-).
Указанное в заголовке соединение получалось, как описано в примере 4(b), с использованием аммиака вместо пиперидина, ИК νмакс (CDCl3) 3600 (-OH), 3525 и 3410 (NH2), 1680 см-1 (C=O, амид). ЯМР δ (CDCl3): 6,33, 5,91 (2H, дд. , 6,7H'b), 5,41 (2H, шир.с., 1,3H'a), 0,53 (3H, с, 18H'b). УФ (EtOH): λмакс 265 (18,300).
Пример 7.
a) N, N-пентаметилен -1α,3β- ди/триизопропилсилилокси/-9,10-секо-20- эпи-холанамид-5(Z), 7,10(19)-триен (формула (II)-20S изомер, R1+R2=-/CH2/5-, R3=R4=(изо-Pr)3Si, Y=-(CH2)2-).
Аддукт двуокиси серы и 20S-формил -3β- триизопропилсилилокси-9,10-секопрегна-5,7,10(19)-триена (5,17 г, полученный из витамина D2, как описано в J. Org. Chem (1986), 51, стр. 4819) превращался в приблиз. 1:1 смесь 20R и 20S изомеров путем хранения при 0o на протяжении ночи в бензоле (50 мл) и метаноле (50 мл), содержащем 1,8-диазабицикло[5.4.0]ундец-7-ен (1 мл). Порция смеси (2,55 г) последовательно восстанавливалась с помощью боргидрида натрия, тозилировалась тозилхлоридом, нагревалась в присутствии бикарбоната натрия для удаления двуокиси серы и регенерации 5,7,10(19)триеновой системы. 1α- гидроксиилировалась с использованием двуокиси селена и метанола, как описано в GB-A-2038834, и силилировалась, как описано в примере 2(b), давая смесь (1,62 г) 20R (эпи) и 20S (норм.) изомеров тозилата формулы (III)-R3= R4= /изо-Pr/3Si-, X= тозилокси. Часть данной смеси (511 мг) растворялась в ацетонитриле (10 мл) и дихлорметане (10 мл), обрабатывалась бромидом лития (488 мг) и 1,8-бис/диметиламино/нафталином (20 мг), нагревалась в условиях дефлегмации в течение 1,5 часов и обрабатывалась, давая бромиды формулы (III), R3=R4=(изо-Pr)3Si-, X=Br, (340 мг).
Раствор N-ацетилпиперидина (546 мг) в тетрагидрофуране 92 мл) добавлялся при -78o к раствору диизопропиламида лития (полученного из 658 мг диизопропиламина и 2 мл 1,55 М н-бутиллития) в тетрагидрофуране (2,5 мл). Реакционная смесь оставлялась подогреваться до комнатной температуры, затем охлаждалась до -78o, обрабатывалась указанными выше бромидами (III) (340 мг), и хранилась на протяжении ночи при комнатной температуре. Обработка и частичная очистка с помощью хроматографии давала R, S смесь целевого соединения (215 мг) и непрореагировавших бромидом (III).
R, S смесь (300 мг), полученная, как описано выше, расщеплялась с помощью хроматографии (20 г силикагель, проявляемый 5% этилацетатом в гексане). Первым появляющимся изомером было 20-эпицелевое соединение (103 мг), ИК (CCl3): νмакс 1645, 1465 см-1 (амид). УФ (Et2O): λмакс 269, 208 нм. λмин 229 нм, ЯМР δ (CCl4) 0,57 (3H, с, 18-H'b), 3-3,5 (4H, м, N-CH2) 4-4,6 (2H, м, 1,3-H'a), 4,73 (2H, шир.с., 19-H'b), 5,3 - 6,4 (2H, Квкв., 6,7 H'b). После данного соединения следовали смесь эпи и нормального изомеров (95 мг), а затем нормальный (20R) изомер (86 мг).
(b) N,N-Пентаметилен -1α,3β- дигидрокси-9,10-секо-20-эпи-холанамид-5(Z), 7,10(19)-триен (формулы (I) - 20S изомер, R1+R2=-(CH2)5-R3=R4=H, Y=-(CH2)2-)
Облучение первой фракции со стадии (a) выше в присутствии феназина с последующим десилилированием, как в примере I(b), давало целевое соединение, ИК (CDCl3): (νмакс 1620, 1445 см-1.
УФ (EtOH) λмакс 207, 263 нм. λмин 227 нм. (ЯМР δ (CDCl3) 0,51 (3H, с, 18-H'b), 3 - 3,6 (4H, м, N-CH2), 3,8 - 4,7 (2H, м., 1,3-H'a) 4,7,5,3, (1H, каждый с. , 19-H'b), 5,6 - 6,5 (2H, Авкв., 6,7-H'b). Аналогичная обработка последующих фракций дала (I) смесь эпи- и нормального изомеров и (II) соединение примера 4(b) соответственно.
Пример 8.
a) N,N-(3-Оксапентаметилен) -1α,3β- ди(триизопропилсилилокси)-9,10- секохоланамид-5(E), 7,10(19)-триен [формула (II) - 20S изомер, R1+R2=-(CH2)2-O-)CH2)2-, R3=R4=(i-Pr)3Si, Y=-(CH2)2-]
В соответствии с процедурой примера 1(a), но при замене N,N- диметилацетамида N-ацетилморфолином, реакция 20-бромметильного соединения (170 мг) давала после выделения исходное вещество (55 мг) и целевое соединение (98 мг): ИК (CCl4) νmax 1655 см-1; ЯМР (CCl4) δ 0,57 (с., 18-H's), 3,2 - 3,8 (шир. м., морфолиновые H's), 3,8 - 4,7 (шир.м., 1,3-H's), 4,7 - 5,0 (шир.с., 19-H's), 5,4 - 6,5 (ABq, 6,7-H's).
b) N, N-(3-Оксапентаметилен) -1α,3β- ди(триизопропилсилилокси)-9,10-секохоланамид-5(Z), 7,10(19)-триен [формула (I) - 20S изомер, R1+R2=-(CH2)2-O-(CH2)2)-, R3=R4=(i-Pr)3Si, Y=-(CH2)2-]
В соответствии с процедурой примера 1(b) (первая стадия), продукт стадии (a), описанной выше, (98 мг) фотоизомеризовался, давая целевое соединение (83 мг после хроматографической очистки): λmax (Et2O) 262, λmin 227 нм; ИК (CCl4) νmax 1660 см-1; ЯМР (CCl4) δ 0,53 (с., 18-H's), 3,1 - 3,7 (шир.м., морфолиновые H's), 3,8 - 4,5 (шир.м., 1,3-H's), 4,5 - 5,2 (еа с., 19-H's), 5,5 - 6,3 (ABq, 6,7-H's).
c) N,N-(3-Оксапентаметилен) -1α,3β- дигидрокси-9,10-секохоланамид- 5(Z), 7,10(19)-триен [формула (I) - 20S изомер, R1+R2=-(CH2)2-O-(CH2)2-, R3=R4=H, Y=-(CH2)2-]
В соответствии с процедурой примера 1(b) (вторая стадия), продукт стадия (b), описанной выше, десилилировался, давая целевое соединение (42 мг после хроматографии): λmax (EtOH) 263, λmin 228 нм; ИК (CCl4) νmax 3300 - 3360, 1635 см-1; ЯМР (CDCl3) δ 0,53 (с., 18-H's), 3,1 - 3,7 (шир. м., морфолиновые H's), 3,7 - 4,5 (шир. м., 1,3-H's), 4,5 - 5,3 (еа с., 19-H's), (5,5 - 6,4 (ABq, 6,7-H's).
Пример 9.
a) N, N-(3-Оксапентаметилен) -1α,3β- ди(триизопропилсилилокси)-9,10-секо-20-эпихоланамид-5(E), 7,10(19)-триен [формула (II) - 20R изомер, R1+R2=-(CH2)2-O-(CH2)2-, R3=R4=(i-Pr)3Si, Y=-(CH2)2-]
В соответствии с процедурой примера 1(a), но при замене N,N- диметилацетамид N-ацетилморфолином реакции 20R-бромметильного соединения (90 мг) давала целевое соединение (60 мг): ИК (CCl4) νmax 1650 см-1; ЯМР (CCl4) δ 0,57 (с., 18-H's), 3,2 - 3,6 (шир. м., морфолиновые H's), 3,8 - 4,7 (шир.м., 1,3- H's), 4,7 - 5,0 (шир.с., 19-H's), 5,4 - 6,4 (ABq, 6,7-H's).
b) N, N-(3-Оксапентаментилен) -1α,3β- ди(триизопропилсилилокси)- 9,10-секо-20-эпихоланамид-5(Z), 7,10(19)-триен [формула (I) - 20R изомер, R1+R2= -(CH2)2-O-(CH2)2-, R3=R4=(i-Pr)3Si, Y=-(CH2)2-]
В соответствии с процедурой примера 1(b) (первая стадия), продукт стадии (a), описанной выше, фотоизомеризовался, давая целевое соединение (80 мг после хроматографической очистки): λmax (Et2O) 262 λmin 227 нм; ИК (CCl4) νmax 1650 см-1; ЯМР (CCl4) δ 0,53 (с., 18-H's), 3,2 - 3,7 (шир.м., морфолиновые H's), 3,9 - 4,8 (шир.м., 1,3-H's), 4,8 - 5,3 (еа с., 19-H's), 5,8 - 6,4 (ABq, 6,7-H's).
c) N, N-(3-Оксапентаметилен) -1α,3β- дигидрокси-9,10-секо-20-эпихоланамид-5(Z), 7,10(19)-триен [формула (I) - 20R изомер, R1 + R2 = -(CH2)2-O-(CH2)2-, R3=R4=H, Y = -(CH2)2-]
В соответствии с процедурой примера 1(b) (вторая стадия), продукт стадии (b), описанной выше, (80 мг) десилилировался, давая целевое соединение (35 мг после хроматографии): λmax (EtOH) 263, λmin 227 нм; ИК (CDCl3) νmax 3200-3620, 1630 см-1; ЯМР (CDCl3) δ 0,53 (с., 18-H's), 3,2-3,8 (шир.м., морфолиновые H's), 3,8-4,5 (шир. м., 1,3-H's), 4,7, 5,4 (ea c., 19-H's), 5,6-6,5 (ABq, 6,7-H's).
Пример 10.
a) N, N-(3-Тиапентаметилен) -1α,3β- ди(триизопропилсилилокси)-9,10-секохоланамид-5(E), 7,10(19)-триен [формула (II) - 20S изомер, R1 + R2 = -(CH2)2-S-(CH2)2-, R3 = R4 = (i-Pr)3Si, Y = -(CH2)2-]
В соответствии с процедурой примера 1(a), но при замене N,N-диметилацетамида N-ацетилтиаморфолином реакции 20-бромметильного соединения (170 мг) давала после выделения исходное вещество (65 мг) и целевое соединение (100 мг): ИК (CCl4) νmax 1655 см-1; ЯМР (CCl4) δ 0.53 (c., 18-H's), 2,2-2,8 (шир. м. , CH-S-CH's), 3,4-3,8 (шир. м., CH-N-CH's), 3,8-4,6 (шир.м., 1,3-H's), 4,6-5,0 (шир.с., 19-H's), 5,4-6,4 (ABq, 6,7-H's).
b) N, N-(3-Тиапентаметилен) -1α,3β- ди(триизопропилсилокси)-9,10-секохоланамид-5(Z), 7,10(19)-триен [формула (I) - 20S изомер, R1 + R2 =-(CH2)2-S(CH2)2-, R3 = R4 = (i-Pr)3Si, Y = -(CH2)2-]
В соответствии с процедурой примера 1 (b) (первая стадия), продукт стадии (a), описанной выше, фотоизомеризовался, давая целевое соединение (50 мг после хроматографической очистки): λmax (Et2O) 261, λmin 226 нм; ИК (CCl4) νmax 1655 см-1; ЯМР (CCl4) δ 0,57 (с., 18-H's), 2,2-2,9 (шир.м., CH-S-CH's), 3,4-3,8 (шир.м., CH-N-CH's), 3,8-4,5 (шир.м., 1,3-H's), 4,5, 5,3 (ea c., 19-H's), 5,4 - 6,4 (ABq, 6,7 - H's).
c) N, N-(3-Тиапентаметилен) -1α,3β- дигидрокси-9,10-секохоланамид-5(Z), 7,10(19)-триен [формула (I) - 20S изомер], R1 + R2 = -(CH2)2-S-(CH2)2-, R3 = R4 = H, Y = -(CH2)2-]
В соответствии с процедурой примера 1 (b) (вторая стадия), продукт стадии (b), описанной выше, (50 мг) десилилировался, давая целевое соединение (22 мг после хроматографии): λmax (EtOH) 263, λmin 227 нм; ИК (CDCl3) νmax 3200 - 3640, 1630 см-1; ЯМР (CDCl3) δ 0,53 (с., 18-H's), 2,2-2,8 (шир. м., CH-S-CH's), 3,4-3,8 (шир.м., CH-N-CH's), 3,8-4,6 (шир.м., 1,3-H's), 4,7, 5,4 (ea c., 19-H's), 5,5-6,5 (ABq, 6,7-H's).
Пример 11.
a) N,N-(3-Триизопропилсилилоксипентаметилен) -1α,3β- ди(триизопропилсилилокси)-9,10-секохоланамид-5(E), 7,10, (19)-триен [формула (II) - 20S изомер, R1] + R2 = -(CH2)2-CHOTips-(CH2)2-, R3 = R4 = (i-Pr)3Si, Y = -(CH2)2-]
В соответствии с процедурой примера 1 (a), но при замене N,N-диметилацетамида N-ацетил-4-триизопропилсилилоксипиперидином, реакция 20-бромметильного соединения (160 мг) давала целевое соединение (150 мг): λmax (Et2O) 269, λmin 229 нм; ИК (CCl4) νmax 1640 см-1; ЯМР (CCl4) δ 0,53 (c., 18-H's), 3,0-3,7 (шир. м. , CH-N-CH's), 3,7-4,6 (шир.м., 1,3-H's, CHOTips, 4,6-5,0 (шир.с., 19-H's), 5,4-6,5 (ABq, 6,7-H's).
b) N,N-(3-Триизопропилсилилоксипентаметилен)-1,3-ди(триизопропилсилокси)-9,10- секохоланамид-5(Z), 7,10(19)-триен [формула (I)-20S изомер, R1] + R2 = -(CH2)2-CHOTips-(CH2)2-, R3 = R4 = (i-Pr)3Si, Y = -(CH2)2-]
В соответствии с процедурой примера 1 (b) (первая стадия), продукт стадии (a), описанной выше, фотоизомеризовался, давая целевое соединение (120 мг после хроматографической очистки): λmax (Et2O) 262, λmin 226 нм; ИК (CDCl3( νmax 1620 см-1.
c) N,N-(3-Гидроксипентаметилен) -1α,3β- дигидрокси-9,10-секохоланамид-5(Z), 7,10(19)-триен [формула (I) - 20S изомер, R1] + R2 = -(CH2)2-CHOH-(CH2)2-, R3 = R4 = H, Y = -(CH2)2-]
В соответствии с процедурой примера 1 (b) (вторая стадия), продукт стадии (b), описанной выше, (120 мг) десилилировался, давая целевое соединение (48 мг после хроматографии): λmax (EtOH) 262, λmin 227 нм; ИК (CDCl3) νmax 3160 - 3660, 1620 см-1, ЯМР (CDCl3) δ 0,5(c., 18-H's), 3,0-4,5 (шир.м., CH-N-CH's, 1,3-H's, OCH кольца), 4,7, 5,3 (ea c., 19-H's), 5,6-6,4 (ABq, 6,7-H's).
Пример 12.
a) N,N-[3,3-Спиро-(1,4-диоксоланил)пентаметилен] -1α,3β- ди(триизопропилсилилокси)-9,10-секохоланамид-5(E), 7,10, (19)-триен [формула (II) - 20S изомер, R1 + R2 = -(CH2)2-C(-OCH2CH2O-)-(CH2)2-, R3 = R4 = (i-Pr)3Si, Y = -(CH2)2-]
В соответствии с процедурой примера 1 (a), но при замене N,N-диметилацетамида N-ацетил-4,4-спиро(1,4-диоксоланил)пиперидином реакции 20-бромметильного соединения (156 мг) давала целевое соединение (140 мг): λmax (Et2O) 268, λmin 228 нм; ИК (CCl4) νmax 1650 см-1; ЯМР (CCl4) δ 0,57 (c., 18-H's), 3,0 - 3,7 (шир.м., CH-N-CH's), 3,83 (c., диоксоланил H's), 3,9-4,7 (шир.м., 1,3-H's), 4,7-5,0 (шир.с., 19-H's), 5,4-6,5 (ABq, 6,7-H's).
b) N,N-[3,3-Спиро-(1,4-диоксоланил)пентаметилен] -1α,3β- ди(триизопропилсилилокси)-9,10-секохоланамид-5(Z), 7,10(19)-триен [формула (I) - 20S изомер, R1 + R2 = -(CH2)2-C(-OCH2CH2O-)-(CH2)2-, R3 = R4 = (i-Pr)3Si, Y = -(CH2)2-]
В соответствии с процедурой примера 1(b) (первая стадия), продукт стадии (a), описанной выше, (93 мг) фотоизомеризовался, давая целевое соединение (72 мг после хроматографической очистки): λmax (Et2O) 261, λmin 226 нм; ИК (CCl4) νmax 1650 см-1; ЯМР (CCl4) δ 0,5 (c., 18-H's), 3,0-3,6 (шир.м., CH-N-CH's), 3,8 (c., диоксоланил H's), 3,8-4,5 (шир.м., 1,3-H's), 4,5-5,2 (шир. с., 19-H's), 5,5-6,2 (ABq, 6,7-H's).
c) N, N-[3,3-спиро-(1,4-диоксоланил)пентаметилен] -1α,3β- дигидрокси-9,10-секохоланамид-5(Z),7,10(19)-триен [формула (I) - 20S изомер, R1] + R2 = -(CH2)2-C(-OCH2CH2O-)-(CH2)2-, R3 = R4 = H, Y = -(CH2)2-]
В соответствии с процедурой примера 1(b) (вторая стадия), продукт стадии (b), описанной выше, (72 мг) десилилировался, давая целевое соединение (37 мг после хроматографии): λmax (EtOH) 263, λmin 227 нм; ИК (CDCl3) νmax 3200-3660, 1630 см-1; ЯМР (CDCl3) δ 0,53 (c., 18-H's), 3,0 - 3,8 (шир. м., CH-N-CH's), 3,93 (c., диоксоланил H's), 3,8 - 4,6 (шир. м., 1,3-H's), 4,7-5,4 (шир. с., 19-H's), 5,6-6,5 (ABq, 6,7-H's).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 22-ТИАВИТАМИНА D, СПОСОБ ИХ ПОЛУЧЕНИЯ, СПОСОБЫ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ, СОЕДИНЕНИЯ | 1995 |
|
RU2142941C1 |
| ПРОИЗВОДНЫЕ ВИТАМИНА-D, СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ТЕРАПЕВТИЧЕСКИЙ АГЕНТ, СПОСОБ ЛЕЧЕНИЯ | 2001 |
|
RU2230738C9 |
| СПОСОБ КАРБОНИЛИРОВАНИЯ | 2001 |
|
RU2323926C2 |
| АНАЛОГИ ВИТАМИНА D, СПОСОБ ИХ ПОЛУЧЕНИЯ, ДИАСТЕРЕОИЗОМЕР, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2163234C2 |
| АНАЛОГ ВИТАМИНА Д | 1991 |
|
RU2037484C1 |
| АНАЛОГИ ВИТАМИНА D, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2136660C1 |
| БИЦИКЛИЧЕСКИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СПИРОСОЕДИНЕНИЯ | 2010 |
|
RU2506266C2 |
| АНАЛОГИ ВИТАМИНА D, КОМПОЗИЦИИ, СОДЕРЖАЩИЕ УКАЗАННЫЕ АНАЛОГИ, И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2320644C2 |
| 9,10-СЕКОПРЕГНАНОВОЕ ПРОИЗВОДНОЕ И ФАРМАЦЕВТИЧЕСКИЕ СРЕДСТВА | 2007 |
|
RU2440980C2 |
| НОВЫЕ СОЕДИНЕНИЯ КАК ПОТЕНЦИАЛЬНЫЕ ИНДУКТОРЫ ТЕРМИНАЛЬНОЙ ДИФФЕРЕНЦИАЦИИ КЛЕТОК ОПУХОЛИ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1992 |
|
RU2128643C1 |
Изобретение относится к новым производным амида витамина D общей формулы Iа, где значения А, Y, R1, R2 указаны в п.1 формулы, обладающим активностью ингибиторов клеточной пролиферации. Описывается также фармкомпозиция на основе соединения формулы Iа, которая ингибирует пролиферацию клеток и пригодна для лечения от неопластических заболеваний. 2 с. и 9 з. п. ф-лы, 1 табл. 
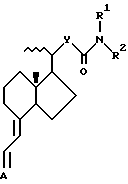
в которой Y представляет С2-4 алкиленовую или алкениленовую группу;
R1 и R2, которые могут быть одинаковыми или различными, каждый представляет атом водорода, низшую алкильную или С3-8 циклоалкильную группу или вместе с атомом азота, к которому они присоединены, образуют гетероциклическую группу, включающую одно или более 5- и/или 6-членных колец, необязательно содержащих один или более дополнительных гетероатомов, выбранных из O, N и S;
А= представляет группу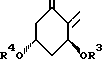
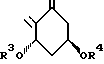
в которой R3 и R4, которые могут быть одинаковыми или различными, каждый представляет атом водорода или О - защитную группу.
Приоритет по пунктам:
06.11.92 по пп.1-5, 10 и 11;
05.05.92 по пп.6 и 9;
07.11.91 по пп.7 и 8.
| 0 |
|
SU301861A1 | |
| Машковский М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, ч.2, 1985, с.34 - 34 | |||
| Biochem | |||
| Pharmacology, 1991, 42(8) | |||
| p, 1569 - 1575. | |||
Авторы
Даты
1999-10-10—Публикация
1992-11-06—Подача