Настоящее изобретение относится к эффективному способу получения промежуточного соединения, используемого при получении новых производных витамина D, которые полезны в качестве лекарственных средств (т.е. терапевтических агентов для лечения кожных заболеваний, таких как псориаз).
А именно, настоящее изобретение относится к способу карбонилирования соединения формулы (2)
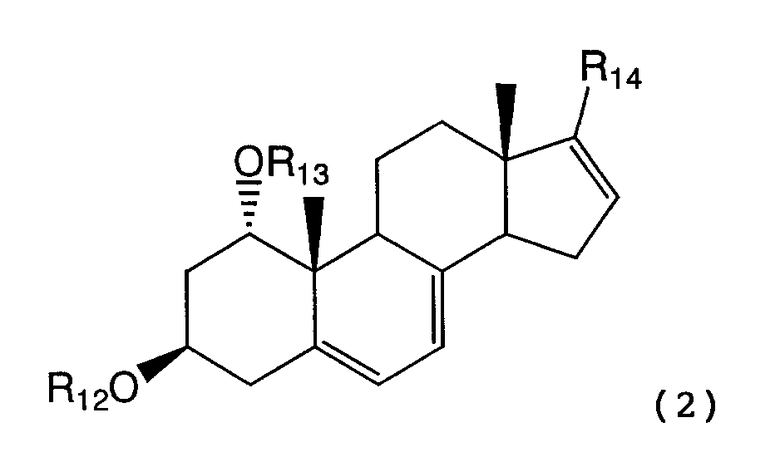
для получения соединения формулы (3):
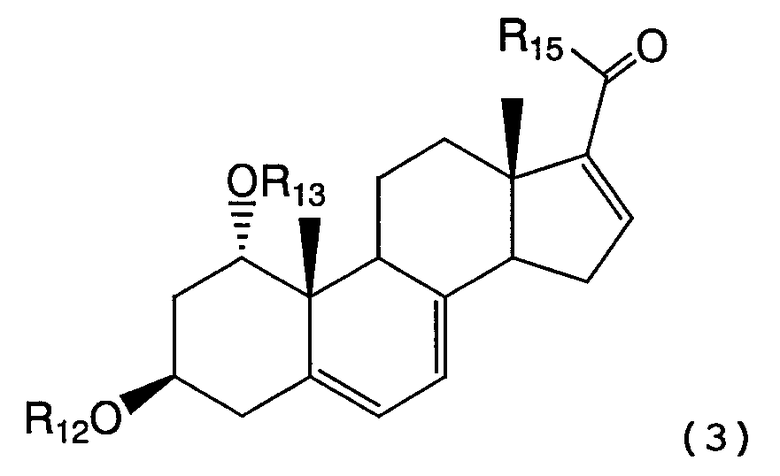 .
.
При получении соединений формулы (3) из соединений формулы (2) в качестве реагентов обычно использовали тетраметилово и диметилцинк. Однако первый реагент требует усовершенствования способа из соображений токсичности и реакционной способности, так как его низкая реакционная способность приводит к побочным реакциям, которые протекают одновременно с нужной реакцией, тогда как последний требует усовершенствования способа из соображений реакционной способности, так его высокая реакционная способность приводит к предпочтительному протеканию побочных реакций по сравнению с нужной реакцией.
Целью настоящего изобретения является разработка эффективного способа получения соединения (3), использующего малотоксичные реагенты, обеспечивающего повышение селективности процесса, приводящего в результате к увеличению выхода продукта реакции.
В результате авторы обнаружили, что нужной цели можно достичь предлагаемым способом карбонилирования соединения формулы (2)

где R12 и R13 каждый представляет защитную группу, и
R14 представляет отщепляемую группу, в растворителе, в присутствии алюминийорганического реагента и палладиевого катализатора в атмосфере окиси углерода, для получения соединения формулы (3):

где R12 и R13 имеют указанные в формуле (2) значения, и R15 представляет алкильную группу, арильную группу, алкенильную группу или алкинильную группу.
В указанном выше способе алюминийорганический реагент предпочтительно имеет формулу (4):
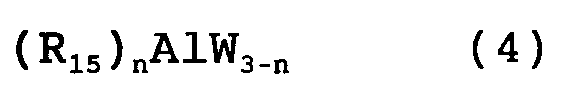
где n представляет целое число от 1 до 3, R15 представляет алкильную группу, арильную группу, алкенильную группу или алкинильную группу, и W представляет атом галогена.
Авторы изобретения нашли, что если для получения соединения (3) по способу карбонилирования настоящего изобретения используют алюминийорганический реагент, этот реагент вызывает мало побочных реакций, что обеспечивает протекание нужной реакции с высокой селективностью, что в результате приводит к увеличению выхода продукта реакции. Кроме того, используемый реагент малотоксичен. Поэтому в настоящем изобретении достигается более эффективное получение соединения формулы (3), по сравнению с известными ранее способами. Это означает, что настоящее изобретение также более эффективно для получения новых производных витамина D формулы (1), нежели получение обычными способами, так как преимущества при получении соединения (3), если его используют для получения соединения (1), приводит к повышенному выходу соединения (1) и к снижению токсичности используемого реагента.
Таким образом, настоящее изобретение обеспечивает эффективное получение соединений, представленных формулой (3), которые можно использовать в качестве промежуточных соединений при получении новых производных витамина D формулы (1):
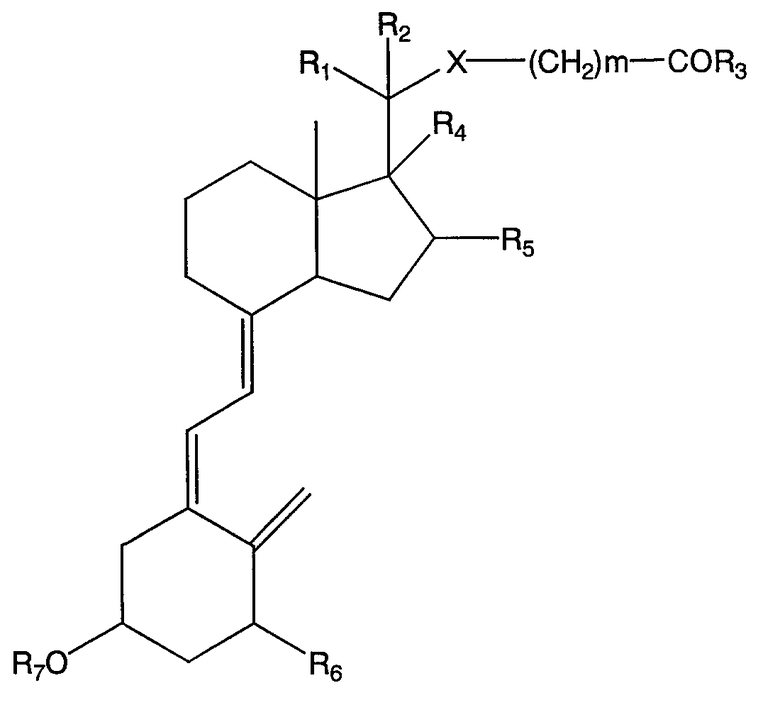
Формула (1)
Где X представляет атом кислорода или атом серы;
m представляет число от 1 до 3;
R1 и R2 каждый представляет атом водорода или алкильную группу;
R4 и R5 каждый представляет атом водорода или гидроксильную группу, или R4 и R5 вместе образуют двойную связь между 16- и 17-положениями;
R3 представляет -YR8 (где Y представляет атом кислорода или атом серы, R8 представляет атом водорода, прямую или разветвленную алкильную группу, которая может быть замещена атомом фтора или циклической алкильной группой, или циклическую алкильную группу, которая может быть замещена атом фтора), или -NR9R10 (где R9 и R10 каждый представляет атом водорода, прямую или разветвленную алкильную группу, которая может быть замещена атомом фтора или циклической алкильной группой, или циклическую алкильную группу, которая может быть замещена атомом фтора, или R9 и R10 могут образовывать кольцо вместе с атомом азота, если R4 и R5 вместе образуют двойную связь между 16- и 17-положениями);
R6 представляет атом водорода или -OR11 (где R11 представляет атом водорода или защитную группу);
и R7 представляет атом водорода или защитную группу.
Новые производные витамина D формулы (1), полученные с использованием соединения формулы (3) в качестве промежуточного соединения, обладают превосходными физиологическими активностями как лекарственные средства, особенно в качестве терапевтических агентов для лечения кожных заболеваний, таких как псориаз, и которые обладают пониженным гиперкальциемическим действием.
Предпочтительный вариант осуществления изобретения
Далее более подробно будут раскрыты варианты воплощения настоящего изобретения. Рассматриваемая заявка заявляет приоритет на основании японской патентной заявки № 2000-375024, содержание которой включено сюда для ссылки во всей полноте.
В том смысле, как здесь использован, термин алькильная группа обычно относится к прямой или разветвленной С1-С15 алкильной группе, или к циклической С3-С15 алкильной группе, если нет других указаний. Алкильные группы, такие как R1 и R2 предпочтительно содержат от 1 до 6 атомов углерода, более предпочтительно от 1 до 4 атомов углерода. Конкретные примеры включают метил, этил, н-бутил, причем метил предпочтителен. Прямые или разветвленные алкильные группы, такие как R8, R9 и R10 предпочтительно содержат от 1 до 10 атомов углерода, более предпочтительно от 1 до 8 атомов углерода. Наиболее предпочтительно, если R8 представляет разветвленную C6-C8 алкильную группу и R9 и R10, каждый представляет прямую или разветвленную С1-С4 алкильную группу. Конкретные примеры включают метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, трет-пентил, 1-этил-1-метилпропил, 1-изопропил-2-метилпропил, 1,1-диэтилпропил, 1,1-диметилбутил, 1,1-диметилгексил, н-гексил, н-гептил, н-октил, нонил и деканоил. Предпочтительны метил, этил, н-пропил, изопропил, изобутил, трет-бутил, трет-пентил, 1-этил-1-метилпропил, 1-изопропил-2-метилпропил, 1,1-диэтилпропил, 1,1-диметилбутил и 1,1-диметилгексил, и более предпочтительны метил, этил, н-пропил, трет-бутил, трет-пентил, 1-этил-1-метилпропил, 1-изопропил-2-метилпропил, 1,1-диметилбутил и 1,1-диметилгексил. Наиболее предпочтительные R8 включают 1-этил-1-метилпропил или 1,1-диметилгексил, R9 представляет метил, и R10 представляет н-пропил.
Примеры циклических алкильных групп обычно включают такие, которые содержат от 3 до 15 атомов углерода, предпочтительно от 3 до 12 атомов углерода, и более предпочтительно от 3 до 8 атомов углерода. В частности, циклическая C3-C6 алкильная группа предпочтительна в качестве заместителя прямой или разветвленной алкильной группы. Конкретные примеры включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклодеканил, циклододеканил и циклопентадеканил.
Прямой или разветвленной алкильной группой, которая может быть замещена атомом фтора или циклической алкильной группой, или циклической алкильной группой, которая может быть замещена атомом фтора, обычно называют прямые, разветвленные или циклические алкильные группы, такие как перечислены выше, в которых, по крайней мере, один из атомов водорода замещен атомом фтора или циклической алкильной группой. Различные типы алкильных групп могут быть замещены различным числом атомов фтора, обычно 3-20 атомами фтора, предпочтительно 3-15 атомами фтора, более предпочтительно 3-12 атомами фтора, и наиболее предпочтительно 3-8 атомами фтора.
Защитные группы, такие как R7, R11, R12 и R13, могут быть одинаковы или различны, и их примеры включают ацильную группу, необязательно замещенную алкильную группу и замещенную силильную группу. Конкретные примеры включают метил, метоксиметил, метилтиометил, трет-бутилтиометил, (фенилдиметилсилил)метокси-метил, бензилоксиметил, п-метоксибензилоксиметил, п-хлорбензил-оксиметил, (4-метоксифенокси)метил, трет-бутоксиметил, 2-метоксиэтоксиметил, 2,2,2-трихлорэтоксиметил, 2-(триметилсилил)-этоксиметил, фенилтиометил, циклопропилметил, тетрагидропиранил, тетрагидротиопиранил, 1-метоксициклогексил, 4-метокситетра-гидропиранил, 4-метокситетрагидротиопиранил, 4-метокситетрагидротиопиранил, S,S-диоксид, 1,4-диоксан-2-ил, тетрагидрофуранил, тетрагидротиофуранил, фенацил, п-бромфенацил, 1-этоксиэтил, метоксиизопропил, 1-(2-хлорэтокси)этил, 1-метил-1-метоксиэтил, 1-метилбензилоксиэтил, 1-метил-1-бензилокси-2-фторэтил, 2,2,2-трихлорэтил, 2-триметилсилилэтил, 2,2-дихлор-1,1-дифторэтил, аллил, трет-бутил, п-хлорфенил, п-метоксифенил, 2,4-динитрофенил, бензил, п-метоксибензил, 3,4-диметоксибензил, o-нитробензил, п-нитробензил, п-хлорбензил, п-бромбензил, 2,6-дихлорбензил, п-цианобензил, п-фенилбензил, 4-(диметиламино-карбонил)бензил, 2-пиколил, 4-пиколил, дифенилметил, п,п'-динитробензгидрил, 5-дибензосуберил, трифенилметил, п-метоксифенилдифенилметил, ди(п-метоксифенил)фенилметил, три(п-метоксифенил)метил, 9-антрил, 1,3-бензодитиолан-2-ил, бензизотиазолил, S,S-диоксид, триметилсилил, триэтилсилил, триизопропилсилил, диметилизопропилсилил, диэтилизопропилсилил, диметилгексилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, трибензилсилил, три-п-ксилилсилил, трифенилсилил, дифенилметилсилил, трет-бутилметоксифенилсилил, формил, ацетил, хлорацетил, дихлорацетил, трихлорацетил, трифторацетил, метоксиацетил, пропионил, бутирил, изобутирил, пивалоил, адамантил, циклогексанкарбонил, бензоил, 4-нитробензоил, 4-хлорбензоил, 4-метоксибензоил, нафтоил, толуоил, 9-флуоренкарбонил, метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил, бензилоксикарбонил, 4-метоксибензил-оксикарбонил, 9-флуоренилметилоксикарбонил, 2,2,2-трихлорэтоксикарбонил, 2-(триметилсилил)этоксикарбонил, 2-(метилтиометокси)-этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, изобутоксикарбонил, винилоксикарбонил, аллилоксикарбонил, п-нитрофенилоксикарбонил, 3,4-диметоксибензилоксикарбонил, o-нитробензилоксикарбонил, п-нитробензилоксикарбонил, бензилтиокарбонил, 4-этокси-1-нафтилоксикарбонил, (метилтио)тиокарбонил, изобутиламинокарбонил и фениламинокарбонил. Предпочтительны замещенные силильные группы, такие как триметилсилил, триэтилсилил, триизопропилсилил, диметилизопропилсилил, диэтилизопропилсилил, диметилгексилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, трибензилсилил, три-п-ксилилсилил, трифенилсилил, дифенилметилсилил и трет-бутилметоксифенилсилил, или ацильные группы, такие как формил, ацетил, хлорацетил, дихлорацетил, трихлорацетил, трифторацетил, метоксиацетил, трифенилметоксиацетил, феноксиацетил, пропионил, бутирил, изобутирил, 4-(метилтиометокси)бутирил, пивалоил, адамантил, циклогексанкарбонил, бензоил, 4-нитробензоил, 4-хлорбензоил, 2-иодобензоил, 4-метоксибензоил, п-фенилбензоил, нафтоил, толуоил и 9-флуоренкарбонил. Более предпочтительны триэтилсилил, триизопропилсилил, диметилизопропилсилил, диэтилизопропилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, трифенилсилил, дифенилметилсилил, ацетил, пивалоил, бензоил и 4-метоксибензоил.
Примеры отщепляемых групп, таких как R14, включают атомы галогенов, таких как атомы хлора, брома и йода, сульфонилоксигруппы, такие как трифторметансульфонилокси, пентафторэтансульфонилокси, нонафторбутансульфонилокси, метансульфонилокси, бензолсульфонилокси и толуолсульфонилокси, или фосфатные сложноэфирные группы, такие как диметилфосфорилокси, диэтилфосфорилокси и дифенилфосфорилокси, причем предпочтительны атомы брома, йода, трифторметансульфонилокси и нонафторбутансульфонилокси.
При получении соединений формулы (3) по способу настоящего изобретения растворитель для использования в процессе карбонилирования можно выбрать соответствующим образом, но предпочтительны органические растворители. Термин органический растворитель используют для обозначения жидкого вещества инертного к субстратам реакции, и примерами могут служить N,N-диметилацетамид, N,N-диметилформамид, 1,3-диметил-2-имидазолидинон, диметилсульфоксид, тетрагидрофуран, 1,2-диметоксиэтан, 1,4-диоксан, трет-бутилметиловый эфир, этиловый эфир, изопропиловый эфир, ацетон, метилэтилкетон, этилацетат, метиленхлорид, 1,2-дихлорэтан, толуол, бензол и хлорбензол. Предпочтительны N,N-диметилацетамид, N,N-диметилформамид и 1,3-диметил-2-имидазолидинон, и предпочтителен N,N-диметилацетамид.
При получении соединения формулы (3) по способу настоящего изобретения термин алюминийорганический реагент относится к соединению формулы (4):
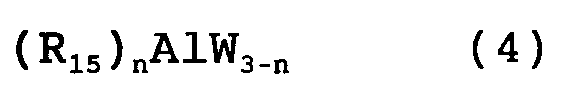
где n представляет целое число 1, 2 или 3;
R15 представляет алкильную группу, арильную группу, алкенильную группу или алкинильную группу, где термин алкильная группа означает прямую или разветвленную С1-С15 алкильную группу или циклическую С3-С15 алкильную группу, термин арильная группа означает фенильную группу, которая может иметь заместители, такие как алкил, галоген или нитро, термин алкенильная группа означает прямой или разветвленный С2-С15 заместитель, содержащий двойную связь, и термин алкинильная группа означает прямой или разветвленный C2-C15 заместитель, содержащий тройную связь; W представляет атом галогена, такой как хлор, бром или йод.
Примеры алюминийорганического реагента включают триметилалюминий, диметилалюминийхлорид, диметилалюминийбромид, диметилалюминиййодид, метилалюминийдихлорид, метилалюминий-дибромид, метилалюминийдийодид, триэтилалюминий, диэтил-алюминийхлорид, диэтилалюминийбромид, диэтилалюминиййодид, этилалюминийдихлорид, этилалюминийдибромид, этилалюминийдийодид, три-н-пропилалюминий, ди-н-пропилалюминийхлорид, ди-н-пропилалюминийбромид, ди-н-пропилалюминиййодид, н-пропил-алюминийдихлорид, н-пропилалюминийдибромид, н-пропилалюминий-дийодид, три-н-бутилалюминий, ди-н-бутилалюминийхлорид, ди-н-бутилалюминийбромид, ди-н-бутилалюминиййодид, н-бутил-алюминийдихлорид, н-бутилалюминийдибромид, н-бутилалюминийдийодид, трифенилалюминий, дифенилалюминийхлорид, дифенилалюминийбромид, дифенилалюминиййодид, фенилалюминийдихлорид, фенилалюминийдибромид и фенилалюминийдийодид. Предпочтительны триметилалюминий, диметилалюминийхлорид, метилалюминийдихлорид, триэтилалюминий, диэтилалюминийхлорид, этилалюминийдихлорид, три-н-пропилалюминий, ди-н-пропилалюминийхлорид, н-пропил-алюминийдихлорид, три-н-бутилалюминий, ди-н-бутил-алюминийхлорид, н-бутилалюминийдихлорид, трифенилалюминий, дифенилалюминийхлорид и фенилалюминийдихлорид. Более предпочтительны диметилалюминийхлорид, диэтилалюминийхлорид, ди-н-пропилалюминийхлорид, ди-н-бутилалюминийхлорид и дифенилалюминийхлорид.
Термин палладиевый катализатор относится к ноль- или двухвалентному соединению палладия, которое может иметь соответствующий лиганд. Примеры включают тетракис (трифенилфосфин)палладий, дихлорбис(трифенилфосфин)палладий, дихлор[1,3-бис(дифенилфосфино)пропан]палладий, дихлор[1,2-бис (дифенилфосфино)этан]палладий, бис(дибензилиденацетон)палладий, и трис(дибензилиденацетон)дипалладий, причем предпочтителен тетракис(трифенилфосфин)палладий.
В соединении формулы (2) предпочтительные примеры защитных групп для R12 и R13 включают ацетильную группу и трет-бутилдиметилсилильную группу. Предпочтительные примеры отщепляемой группы R14 включают атом брома, атом йода, трифторметансульфонилоксигруппу и нонафторбутансульфонил-оксигруппу. Соединение формулы (2) можно получить, например, по способу примера 1(1), представленного далее.
Затем соединение формулы (2) можно карбонилировать, используя окись углерода, в органическом растворителе (например, N,N-диметилформамиде, диметилсульфоксиде, N,N-диметилацетамиде, 1,3-диметил-2-имидазолидиноне, тетрагидрофуране, толуоле) в присутствии алюминийорганического реагента формулы (4), и палладиевого катализатора до получения нужного соединения формулы (3), как описано, например, в примере 1(2).
Предпочтительные примеры алюминийорганических реагентов включают диметилалюминийхлорид, диэтилалюминийхлорид, ди-н-пропилалюминийхлорид, ди-н-бутилалюминийхлорид и дифенилалюминийхлорид.
Предпочтительные примеры палладиевых катализаторов включают тетракис(трифенилфосфин)палладий, дихлорбис(трифенилфосфин)-палладий, дихлор[1,3-бис(дифенилфосфино)пропан]палладий, дихлор[1,2-бис(дифенилфосфино)этан]палладий, бис(дибензилиденацетон)палладий и трис(дибензилиденацетон)дипалладий.
В способе настоящего изобретения эти катализаторы при необходимости можно использовать в комбинации с лигандами, такими, как трифенилфосфин, трибутилфосфин, трициклогексилфосфин или три-трет-бутилфосфин, для достижения более высокой каталитической активности или более высокой селективности реакции.
Реакцию карбонилирования ведут при температуре от 0°C до 150°C в атмосфере окиси углерода при давлении от нормального до повышенного (вплоть до примерно 20 атм) в течение от примерно 10 минут до примерно 12 часов.
Полученное таким образом соединение (3) можно использовать в качестве промежуточного соединения при синтезе нового производного витамина D формулы (1).
Соединение формулы (1) можно получить из соединения формулы (3), например, по способу примера 2, представленного далее.
В формуле (3), R12 и R13 имеют значения, указанные для формулы (2) и R15 представляет алкильные группы, такие как метил, этил, пропил и бутил, арильные группы, такие как фенил, алкенильные группы, такие как винил, или алкинильные группы, такие как этинил.
Полученное таким образом производное витамина D формулы (1) является фармацевтически полезным соединением, обладающим пониженным гиперкальциемическим действием, как показано далее в примерах.
ПРИМЕРЫ
Настоящее изобретение далее описывается следующими примерами, которые предлагаются только с целью иллюстрации, и не должны рассматриваться, как ограничивающие объем изобретения.
В этих примерах каждый из ЯМР спектров получен в указанных в примерах растворителях, и в качестве внутреннего стандарта использованы тетраметиленсилан или хлороформ. Каждый масс-спектр (MC) получен в режиме EI (электронный удар) при напряжении ионизации 70 эВ. Каждый ультрафиолетовый спектр поглощения (UV = УФ) измеряют в этанольном растворе. Хроматографию на колонке и препаративную тонкослойную хроматографию осуществляют, используя силикагель (75-150 мкм или 40-63 мкм) и пластины из силикагеля (толщина: 1 мм, 0,5 мм или 0,25 мм, 20 x 20 см каждая) соответственно.
Пример 1
Синтез (1α,3β)-1,3-бис((трет-бутил)диметил)силил)окси)прегна-5,7,16-триен-20-она
(1) Синтез (1α,3β)-1,3-бис((трет-бутил(диметил)силил)окси) андроста-5,7,16-триен-17-илтрифторметансульфоната
(1α,3β)-1,3-бис((трет-бутил(диметил)силил)окси)андроста-5,7-диен-17-он (21,0 г) растворяют в тетрагидрофуране (140 мл), к этому затем добавляют 2-(N,N-бис(трифторметилсульфонил)-амино)пиридин (19,1 г) при комнатной температуре. После того, как реакционную смесь охлаждают до -78°C, к ней добавляют по каплям 1,0 M тетрагидрофурановый раствор натрий бис(триметилсилил)амида (48,3 мл). Затем перемешивание продолжают при -78°C в течение 30 минут, к реакционной смеси добавляют насыщенный водный бикарбонат натрия, затем экстрагируют смесью гексан/этилацетат = 5/1. Экстрагированный раствор сушат над безводным сульфатом натрия и упаривают при пониженном давлении для удаления растворителя. Полученный остаток промывают ацетонитрилом (100 мл), получая указанное в заголовке соединение (23,3 г, выход 89%).
1H-ЯМР (270 МГц, CDCl3) δ: 5,64-5,58 (м, 2H), 5,43-5,37 (м, 1Н), 4,12-3,98 (м, 1H), 3,74-3,68 (м, 1H), 2,96-2,84 (м, 1Н), 2,48-2,26 (м, 5H), 2,00-1,42 (м, 1H), 0,97 (с, 3H), 0,95 (с, 3H), 0,89 (с, 18H), 0,12 (с, 3H), 0,107 (с, 6H), 0,06 (с, 3Н).
(2) Синтез (1α,3β)-1,3-бис((трет-бутил(диметил)силил)окси) прегна-5,7,16-триен-20-она
(1α,3β)-1,3-бис((трет-бутил(диметил)силил)окси)андроста-5,7,16-триен-17-илтрифторметансульфонат (40,3 г) растворяют в диметилацетамиде (203 мл), с последующим добавлением тетракис (трифенилфосфин)палладия(0) (703 мг). Полученную смесь выдерживают при пониженном давлении и затем помещают в атмосферу окиси углерода. Эту процедуру затем повторяют дважды. К смеси добавляют 0,98 M гексановый раствор диметилалюминийхлорида (74,4 мл) при комнатной температуре и затем перемешивают при комнатной температуре в течение 20 минут. После нагревания до 58°C и перемешивания в течение 2 часов, к реакционной смеси добавляют воду, затем экстрагируют смесью гексан/этилацетат = 1/1. Экстрагированный раствор сушат над безводным сульфатом магния и концентрируют при пониженном давлении, получая указанное в заголовке соединение (34,0 г, выход 100%).
1H-ЯМР (300 МГц, бензол-d6) δ: 6,01 (дд, J=2,5, 2,7 Гц, 1H), 5,72 (д, J=5,8 Гц, 1H), 5,43-5,36 (м, 1H), 4,38-4,23 (м, 1H), 3,58-3,51 (м, 1H), 3,09-2,97 (м, 1H), 2,63-2,53 (м, 2H), 2,41-2,29 (м, 1H), 2,08-1,96 (м, 3H), 1,94 (с, 3H), 1,83-1,67 (м, 2H), 1,05 (с, 9H), 1,04 (с, 3H), 0,95 (с, 9H), 0,86 (с, 3H), 0,19 (с, 3H), 0,17 (с, 3H), 0,11 (с, 3H), 0,02 (с, 3H).
Варьируя использумые согласно настоящему изобретению алюминийорганический реагент, палладиевый катализатор, с аналогичной примеру 1 эффективностью осуществляли карбонилирование соединения формулы (2) с другими, согласно описанию заявки, защитными группами R12 и R13 и отщепляемыми группами R14.
Пример 2
Синтез 1α,3β-дигидрокси-20(S)-(1-этил-1-метилпропокси-карбонилметокси)-9,10-секопрегна-5,7,10(19),16-тетраена
(1) Синтез (1α,3β,20S)-1,3-бис((трет-бутил(диметил)силил)-окси)прегна-5,7,16-триен-20-ола
(1α,3β)-1,3-бис((трет-бутил(диметил)силил)окси)прегна-5,7,16-триен-20-он, синтезированный в примере 1 (45,0 г), растворяют в толуоле (240 мл), и затем охлаждают до -20°C с последующим перемешиванием в течение 30 минут. К полученному раствору добавляют комплекс боран-диметилсульфид (22,9 мл) при -20°C, и перемешивают в течение 5 минут. Затем к раствору добавляют 1M толуольный раствор (R)-2-метил-CBS-оксазаборолидина (22,9 мл) при -20°C и перемешивают в течение 1 часа. К реакционной смеси добавляют метанол, затем экстрагируют этилацетатом. Экстрагированный раствор сушат над безводным сульфатом натрия и упаривают при пониженном давлении для удаления растворителя. Полученный остаток очищают на хроматографической колонке с силикагелем (жидкая фаза: гексан/этилацетат = 9/1), получая указанное в заголовке соединение (23,3 г, выход 89%).
1H-ЯМР (300 МГц, бензол-d6) δ: 5,71 (д, J=4,9 Гц, 1H) 5,49 (шир.с, 2H), 4,40-4,15 (м, 2H), 3,59 (шир.с, 1H), 3,13-3,03 (м, 1H), 2,61 (с, 1H), 2,59 (с, 1H), 2,46-2,37 (м, 1H), 2,20-1,92 (м, 4H), 1,85-1,47 (м, 4H), 1,24 (д, J=6,6 Гц, 3H), 1,06 (с, 9H), 0,99 (с, 3H), 0,95 (с, 9H), 0,91 (с, 3H), 0,20 (с, 3H), 0,18 (с, 3H), 0,06 (с, 3H), 0,05 (с, 3Н).
(2) Синтез 1-этил-1-метилпропил-((((1α,3β,20S)-1,3-бис(трет-бутил(диметил)силил)окси)прегна-5,7,16-триен-20-ил)окси)-ацетата
(1α,3β,20S)-1,3-Бис((трет-бутил(диметил)силил)окси)-прегна-5,7,16-триен-20-ол (210 мг) и 60% гидрид натрия (90 мг) растворяют в тетрагидрофуране (3,7 мл). К полученному раствору добавляют 15-краун-5-эфир (83 мкл) и затем 1-этил-1-метилпропилбромацетат (502 мг) при комнатной температуре с последующим нагреванием до 60°C. После перемешивания при 60°C в течение 12 часов к раствору добавляют метанол, затем экстрагируют трет-бутилметиловым эфиром. Экстрагированный раствор сушат над безводным сульфатом натрия и упаривают при пониженном давлении для удаления растворителя. Полученный остаток очищают на хроматографической колонке с силикагелем (жидкая фаза: гексан:диэтиловый эфир = 10/1) и затем на хроматографической колонке с силикагелем (жидкая фаза: гексан/метиленхлорид = 1/2), получая указанное в заголовке соединение (244 мг, выход 93%).
1H-ЯМР (300 МГц, бензол-d6) δ: 5,70 (д, J=6,9 Гц, 1H), 5,56 (шир.с, 1H), 5,49-5,41 (м, 1H), 4,38-4,25 (м, 1H), 4,21 (кв, J=6,3 Гц, 1H), 3,99 (д, J=16,2 Гц, 1H), 3,92 (д, J=16,2 Гц, 1H), 3,63-3,55 (м, 1H), 3,10-3,00 (м, 1H), 2,64-2,53 (м, 1H), 2,47-2,36 (м, 1H), 2,23-1,44 (м, 12H), 1,41 (д, J=6,3 Гц, 3H), 1,31 (с, 3H), 1,04 (с, 9H), 0,98 (с, 3H), 0,94 (с, 9H), 0,89 (с, 3H), 0,76 (т, J=7,4 Гц, 6H), 0,18 (с, 3H), 0,16 (с, 3H), 0,13 (с, 3H), 0,06 (с, 3H).
(3) Синтез 1-этил-1-метилпропил-(((1α,3β,20S)-1,3-дигидроксипрегна-5,7,16-триен-20-ил)окси)ацетата
1-Этил-1-метилпропил-((((1α,3β,20S)-1,3-бис(трет-бутил-(диметил)силил)окси)прегна-5,7,16-триен-20-ил)окси)ацетат (203 мг) растворяют в 1,0 M тетрагидрофурановом растворе тетрабутиламмонийфторида (3,0 мл) с последующим добавлением уксусной кислоты (75 мкг). Полученный раствор нагревают до 60°C, перемешивают в течение 12 часов и затем экстрагируют этилацетатом. Экстрагированный раствор сушат над безводным сульфатом натрия и упаривают при пониженном давлении для удаления растворителя. Полученный остаток очищают на хроматографической колонке с силикагелем (жидкая фаза: гексан/этилацетат = 2/3), получая указанное в заголовке соединение (132 мг, выход 97%).
1H-ЯМР (300 МГц, ацетон-d6) δ: 5,66-5,59 (м, 2Н), 5,45-5,39 (м, 1H), 4,14 (кв, J=6,6 Гц, 1H), 4,09-3,95 (м, 1H), 3,95 (д, J=16,2 Гц, 1H), 3,86 (д, J=16,2 Гц, 1H), 3,80-3,70 (м, 1,5H), 3,64-3,50 (м, 0,5H), 2,49-2,39 (м, 1H), 2,38-2,17 (м, 4H), 2,12-2,06 (м, 1H), 1,96-1,62 (м, 8H), 1,54-1,42 (м, 1H), 1,37 (с, 3H), 1,30 (д, J=6,6 Гц, 3H), 0,95 (с, 3H), 0,90 (с, 3H), 0,85 (т, J=7,4 Гц, 6H).
(4) Синтез 1α,3β-дигидрокси-20(S)-(1-этил-1-метилпропокси-карбонилметокси)-9,10-секопрегна-5,7,10(19),16-тетраена
1-Этил-1-метилпропил-(((1α,3β,20S)-1,3-дигидроксипрегна-5,7,16-триен-20-ил)окси)ацетат (132 мг) растворяют в тетрагидрофуране (500 мл). Этот раствор охлаждают до 18°C в потоке аргона, и облучают УФ-светом в течение 30 минут, используя 5 кВатт УФ-излучатель с ксенон-ртутной лампой (280-320 нм, USHIO INC.)(японская патентная заявка № 10-188880, WO 00/01477). Далее этот раствор кипятят с обратным холодильником в течение 2 часов и упаривают при пониженном давлении для удаления растворителя. Полученный остаток очищают на хроматографической колонке с силикагелем (жидкая фаза: метиленхлорид:этилацетат = 6/4), получая указанное в заголовке соединение (34,2 мг, выход 26%).
ИК (чистый): 3400, 2973, 2931, 2883, 2850, 1745, 1727, 1459, 1373, 1218, 1122, 1052 см-1. 1Н ЯМР δ: 0,77 (с, 3Н), 0,85 (т, J=7,6 Гц, 6H), 1,36 (д, J=6,6 Гц, 3H), 2,56-2,66 (м, 1H), 2,77-2,87 (м, 1H), 3,84 (д, J=16,5 Гц, 1H), 3,96 (д, J=16,3 Гц, 1H), 4,08 (кв, J=6,4 Гц, 1H), 4,19-4,29 (м, 1H), 4,40-4,49 (м, 1H), 5,01 (шир.с, 1H), 5,34 (шир.с, 1H), 5,59 (шир.с, 1H), 6,11 (д, J=11,4 Гц, 1H), 6,37 (д, J=ll,l Гц, 1H). MC m/z: 472(М+), 85(100%). УФ λмакснм: 263.
Тестовый пример 1
Восьминедельным самцам мышей штамма Balb/c подкожно вводят активный витамин D3 (1α,25(OH)2D3, 125 мкг/мл в этаноле) или соединения 1-5 (производные витамина D, полученные в приведенных выше примерах, 500 мкг/мл в этаноле) или только этанол (в качестве контроля). Эти образцы наносят один раз на кожу в области спины (около 1,5 x 2,0 см2) мыши в объеме 2 мл/кг. Затем каждую из мышей фиксируют с помощью "жесткого" ошейника во избежании слизывания препарата. На следующий день области нанесения очищают и ошейник удаляют. Через два дня после введения у каждой из мышей берут кровь и исследуют уровень содержания ионизированного кальция методом ионоселективных электродов. Анализ осуществляют для групп из 3 мышей. В таблице 1 представлены полученные результаты. Уровни содержания ионизированного кальция в таблице выражены как средние значения.
Тестовый пример 2
Кератиноциты крайней плоти новорожденного младенца (Clonetics) высевают в 96-луночные планшеты (COSTAR 3595) при плотности клеток 2 x 103/лунку. Затем в лунки помещают определенные концентрации активного витамина D3 (1α,25(OH)2D3) или соединений 1-5 с последующим инкубированием в KGM-2 среде при плотности клеток 2 x 103 клеток/200 мкл/лунку в течение 3 дней при температуре 37°C в атмосфере, состоящей из 5% CO2 и 95% воздуха. В каждую лунку добавляют [3H]тимидин (7,4 кБк/лунку), и пластины далее инкубируют в течение 1 дня. Каждую лунку один раз промывают фосфатным буфером, не содержащим кальция и магния (Dulbecco's PBS(-), Nissui, code 05913, pH 7,3-7,65), и обрабатывают 0,25% трипсином для очищения клеток. Включенное в клетки количество [3Н]тимидина определяют с помощью жидкостного сцинтилляционного счетчика (1450 MicroBeta, Wallac). В таблице 1 представлены полученные результаты. Ингибирование роста кератиноцитов выражено в таблице как относительная величина для каждого соединения по сравнению с активным витамином D3: Относительное ингибирование = (ИК50 (моль/л) активного витамина D3)/(ИК50 (моль/л) каждого соединения).
Соединение 1 представляет новое производное витамина D - 20(S)-(трет-бутоксикарбонилметокси)-1α,3β-дигидрокси-9,10-секопрегна-5,7,10(19),16-тетраен, Соединение 2 представляет новое производное витамина D - 1α,3β-дигидрокси-20(S)-(N-трет-бутил-N-метиламинокарбонилметокси)-9,10-секопрегна-5,7,10(19),16-тетраен, Соединение 3 представляет новое производное витамина D - 1α,3β-дигидрокси-20(S)-(трет-бутоксикарбонилэтокси)-9,10-секопрегна-5,7,10(19),16-тетраен, Соединение 4 представляет новое производное витамина D - 1α,3β-дигидрокси-20(S)-(N-трет-бутиламинокарбонилметокси)-9,10-секопрегна-5,7,10(19),16-тетраен и Соединение 5 представляет новое производное витамина D - 1α,3β-дигидрокси-20(S)(изопропоксикарбонилметокси)-9,10-секопрегна-5,7,10(19),16-тетраен.
Тестовый пример 3
Повторяют способ тестового примера 1 для анализа уровней ионизированного кальция в крови мышей, за исключением того, что в качестве производных витамина D используют соединения 6-12. В таблице 2 представлены полученные результаты. Уровни ионизированного кальция в таблице представлены как средние значения.
Тестовый пример 4
Кератиноциты кожи взрослого человека (Clonetics) высевают в 96-луночные планшеты (COSTAR 3595) при плотности клеток 1 x 103/лунку. Затем в лунки добавляют определенные концентрации активного витамина D3 (1α,25(OH)2D3) или соединений 6-12 с последующим инкубированием в KGM-2 среде при плотности клеток 1 x 103 клеток/200 мкл/лунку в течение 3 дней при температуре 37°C в атмосфере, состоящей из 5% CO2 и 95% воздуха. В каждую лунку добавляют [3H]тимидин (7,4 кБк/лунку), и пластины далее инкубируют в течение 1 дня. После удаления среды каждую лунку обрабатывают 0,05% трипсин/0,53 мМ EDTA для очищения клеток. Включенное в клетки количество [3Н]тимидина определяют с помощью жидкостного сцинтилляционного счетчика (1450 MicroBeta, Wallac). В таблице 2 представлены полученные результаты. Ингибирование роста кератиноцитов выражено в таблице как относительная величина для каждого соединения по сравнению с активным витамином D3: Относительное ингибирование = (ИК50 (моль/л) активного витамина D3)/(ИК50 (моль/л) тестируемого соединения).
Соединение 6 представляет новое производное витамина D - 1α,3β-дигидрокси-20(S)-(1-этил-1-метилпропоксикарбонил-метокси)-9,10-секопрегна-5,7,10(19),16-тетраен, Соединение 7 представляет новое производное витамина D - 1α,3β-дигидрокси-20(S)-(1-изопропил-2-метилпропоксикарбонилметокси)-9,10-секопрегна-5,7,10(19),16-тетраен, Соединение 8 представляет новое производное витамина D - 1α,3β-дигидрокси-20(S)-(1,1-диметилбутоксикарбонилметокси)-9,10-секопрегна-5,7,10(19),16-тетраен, Соединение 9 представляет новое производное витамина D -α,3β-дигидрокси-20(S)-(1-этил-1-метилпропоксикарбонил-метокси)-9,10-секопрегна-5,7,10(19)-триен, Соединение 10 представляет новое производное витамина D - 1α,3β-дигидрокси-20(S)-(1,1-диметилгексилоксикарбонилметокси)-9,10-секопрегна-5,7,10(19),16-тетраен, Соединение 11 представляет новое производное витамина D - 1α,3β-дигидрокси-20(S)-{2-(1-этил-1-метилпропоксикарбонил)этокси}-9,10-секопрегна-5,7,10(19),16-тетраен и Соединение 12 представляет новое производное витамина D - {(1α,3β-дигидрокси-9,10-секопрегна-5,7,10(19),16-тетраен-20(S)-ил)окси}-N-(2,2,3,3,3-пентафторпропил)ацетамид.
Новые производные витамина D, полученные с использованием в качестве промежуточного соединения формулы (3), полученного, в свою очередь, эффективным способом карбонилирования соединения формулы (2), не только обладают превосходными физиологическими активностями, но также отличаются пониженным гиперкальциемическим действием по сравнению с обычными производными витамина D. Поэтому новые производные витамина D эффективны при лечении заболеваний, которые допускают лишь ограниченное введение обычных производных витамина D во избежание гиперкальциемии и других проблем.
Таким образом, настоящее изобретение обеспечивает эффективный способ получения соединения (3), использующий малотоксичные реагенты и обеспечивающий высокую селективность процесса и высокий выхода продукта реакции. Это означает, что настоящее изобретение также более эффективно для получения новых производных витамина D формулы (1), так как преимущества при получении промежуточного соединения (3), приводят к повышенному выходу соединения (1) и к снижению токсичности используемого реагента.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ВИТАМИНА-D, СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ТЕРАПЕВТИЧЕСКИЙ АГЕНТ, СПОСОБ ЛЕЧЕНИЯ | 2001 |
|
RU2230738C9 |
| ПРОИЗВОДНЫЕ 22-ТИАВИТАМИНА D, СПОСОБ ИХ ПОЛУЧЕНИЯ, СПОСОБЫ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ, СОЕДИНЕНИЯ | 1995 |
|
RU2142941C1 |
| ПРОИЗВОДНЫЕ АМИДА ВИТАМИНА D И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2139276C1 |
| СТЕРЕОСЕЛЕКТИВНЫЙ СИНТЕЗ АНАЛОГОВ ВИТАМИНА Д | 2005 |
|
RU2380359C2 |
| 9,10-СЕКОПРЕГНАНОВОЕ ПРОИЗВОДНОЕ И ФАРМАЦЕВТИЧЕСКИЕ СРЕДСТВА | 2007 |
|
RU2440980C2 |
| АНАЛОГИ ВИТАМИНА D, КОМПОЗИЦИИ, СОДЕРЖАЩИЕ УКАЗАННЫЕ АНАЛОГИ, И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2320644C2 |
| АНАЛОГИ ВИТАМИНА D, СПОСОБ ИХ ПОЛУЧЕНИЯ, ДИАСТЕРЕОИЗОМЕР, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2163234C2 |
| АНАЛОГИ ВИТАМИНА D, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2126385C1 |
| НОВЫЙ СПОСОБ ПОЛУЧЕНИЯ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ, ПРИМЕНЯЕМЫХ ДЛЯ СИНТЕЗА АНАЛОГОВ ВИТАМИНА D | 2005 |
|
RU2378252C2 |
| АНАЛОГИ ВИТАМИНА D, СПОСОБЫ ИЗ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ | 1993 |
|
RU2128168C1 |
Описывается улучшенный способ карбонилирования для получения промежуточных соединений в синтезе новых производных витамина D. Способ включает карбонилирование соединения формулы (2), где R12, R13 и R14 каждый представляет отщепляемую группу, в растворителе, в присутствии алюминийорганического реагента, предпочтительно диметилалюминийхлорида и палладиевого катализатора, предпочтительно тетракис(трифенилфосфин)палладия в атмосфере окиси углерода для получения соединения формулы (3), где R12 и R13 - указанные выше защитные группы, a R15 - СН3, С2Н5, С3Н7 или С4Н9. 1 з.п. ф-лы, 2 табл.
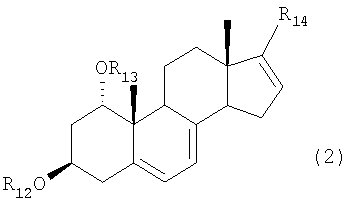
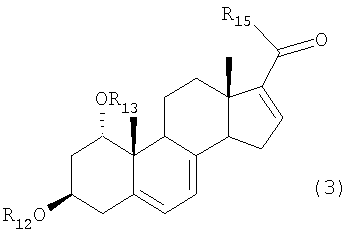
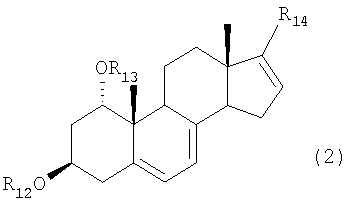
где
R12 и R13 каждый представляет защитную группу, выбранную из группы, включающей триметилсилил, триэтилсилил, триизопропилсилил, диметилизопропилсилил, диэтилизопропилсилил, диметилгексилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, трибензилсилил, три-п-ксилилсилил, трифенилсилил, дифенилметилсилил и трет-бутилметоксифенилсилил, и R14 представляет отщепляемую группу, выбранную из группы, включающей трифторметансульфонилокси, пентафторэтансульфонилокси, нонафторбутансульфонилокси, метансульфонилокси, бензолсульфонилокси и толуолсульфонилокси, в растворителе в присутствии алюминийорганического реагента, выбранного из группы, включающей триметилалюминий, диметилалюминийхлорид, диметилалюминийбромид, диметилалюминиййодид, метилалюминийдихлорид, метилалюминий-дибромид, метилалюминийдийодид, триэтилалюминий, диэтилалюминийхлорид, диэтилалюминийбромид, диэтилалюминиййодид, этилалюминийдихлорид, этилалюминийдибромид, этилалюминийдийодид, три-н-пропилалюминий, ди-н-пропилалюминийхлорид, ди-н-пропилалюминийбромид, ди-н-пропилалюминиййодид, н-пропил-алюминийдихлорид, н-пропилалюминийдибромид, н-пропилалюминий-дийодид, три-н-бутилалюминий, ди-н-бутилалюминийхлорид, ди-н-бутилалюминийбромид, ди-н-бутилалюминиййодид, н-бутилалюминийдихлорид, н-бутилалюминийдибромид и н-бутилалюминий-дийодид, и палладиевого катализатора, выбранного из группы, включающей тетракис(трифенилфосфин)палладий, дихлорбис(трифенилфосфин)палладий, дихлор[1,3-бис(дифенилфосфино)пропан]палладий, дихлор[1,2-бис (дифенилфосфино)этан]палладий, бис(дибензилиденацетон)палладий и трис(дибензилиденацетон)дипалладий, в атмосфере окиси углерода для получения соединения формулы (3)
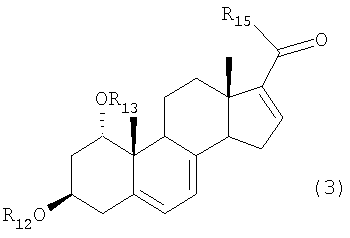
где
R12 и R13 имеют указанные выше значения и R15 представляет метил, этил, пропил или бутил.
| Экономайзер | 0 |
|
SU94A1 |
| Фрикционная муфта | 1980 |
|
SU947504A1 |
| SHIGEO KONDO et al.//Arch | |||
| Dermatol | |||
| Res | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
Авторы
Даты
2008-05-10—Публикация
2001-06-14—Подача