ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к 9,10-секопрегнановому производному (производному витамина D3) и фармацевтической композиции, содержащей его в качестве активного ингредиента.
УРОВЕНЬ ТЕХНИКИ
Псориаз, ихтиозный синдром, кератоз ладони и подошвы, гнойничковое высыпание ладони и подошвы, а также волосяной лишай являются дискератозами в широком смысле, демонстрирующими различные характерные кожные симптомы, такие как эритема, мокнутье, гипертрофия, кератинизация и ороговение. Это заболевание является трудноизлечимой хронической болезнью и вызывает значительные ограничения комфортности повседневной жизни пациентов. В соответствии с его патологической первопричиной данное заболевание, как предполагают, основано на нарушении роста и дифференцировки как клеток воспаления, так и клеток кожи.
Псориаз, который является характерным заболеванием с дискератозом, не представляет собой фатальную болезнь, но является малоизученным и сопровождается предубеждением в отношении его появления, а также душевным страданием. Поэтому в большинстве случаев качество жизни (QOL) значительно нарушается.
Большинство терапевтических способов применялось к вышеупомянутому кератозу, такому как псориаз. Однако не существует радикального лечения, проводилась симптоматическая терапия и уход в течение более длительного периода времени. В качестве основного способа лечения широко приняты наружные аппликации из адренокортикостероидных агентов с достижением отличного терапевтического эффекта. Тем не менее существует также серьезное побочное действие и индукция кожной атрофии и эффект рикошета кожных проявлений, которые, в частности, рассматриваются как проблема.
В последние годы широко используют местное применение производных витамина D3, имеющих скелет 9,10-секопрегнана. По сравнению со стероидами этот пригодный для местного применения агент обладает меньшими побочными действиями и обладает эффектом продления безрецидивного периода (см., например, Непатентную Ссылку 1). Предполагают, что производное витамина D3 эффективно при кератозе, включая псориаз, за счет подавляющего действия на рост эпидермальных клеток (см., например, Непатентные Ссылки 2 и 3), стимулирующего действия на дифференцировку эпидермальных клеток (см., например, Непатентные Ссылки 4 и 6), подавляющего действия на продуцирование цитокинов и подавляющего действия на активацию Т-клеток (см., например, Непатентную Ссылку 7) и т.п.
Что касается производного витамина D3, имеющего скелет 9,10-секопрегнана, то, например, известны различные производные, такие как (1S,3R,20S)-20-(3-гидрокси-3-метилбутилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол (международное непатентованное название: Максакальцитол) (его способ синтеза и фармакологическое действие упомянуты, например, в Непатентных Ссылках 8-10), соединения, упомянутые в Патентной Ссылке 2 или Непатентной Ссылке 11, и т.п.
С другой стороны, хорошо известно, что 1α,25(OH)2D3, который является активной формой витамина D, повышает уровень концентрации кальция в сыворотке вместе с уровнем паратиреоидного гормона в сыворотке, посредством которого гомеостаз кальция поддерживается и контролируется. Наиболее тревожные побочные действия производных витамина D3, которые клинически выявляются в настоящее время: сухость во рту, дискомфорт, вялость, анорексия, рвота, боль в животе и мышечная слабость в результате повышения концентрации кальция в сыворотке (гиперкальциемия). Соответственно существует необходимость в периодическом измерении концентрации кальция в крови не только в случае, когда введение производится пациентам, страдающим от гиперкальциемии, но также пациентам, которые не страдают от данного заболевания. Существует также ограничение в его дозе (см., например, Непатентные Ссылки 12 и 13).
Следовательно, существует актуальная потребность в производном витамина D3, которое по сравнению с традиционными производными витамина D3 обладает относительно малым влиянием на системный метаболизм кальция и способно специфически ослаблять дискератоз эпидермальных клеток в качестве терапевтического агента при кератозе, таком как псориаз.
Патентная Ссылка 1: EP-A 0184112
Патентная Ссылка 2: Japanese Patent 2908566
Патентная Ссылка 3: US 6296997
Патентная Ссылка 4: US 5612325
Патентная Ссылка 5: US Application 2004-0019023
Патентная Ссылка 6: JP-A-Hei-10-231284
Непатентная Ссылка 1: Kobayashi J., et al., Nishinihon-hihuka, 60, 882 (1998)
Непатентная Ссылка 2: Kondo S., et al., Arch. Dermatol. Res., 292, 550 (2000)
Непатентная Ссылка 3: Kobayashi T., et al., J. Eur. Acad. Dermatol. Venereol., 5, 132 (1995)
Непатентная Ссылка 4: Kragballe K., et al., Arch. Dermatol. Res., 282, 164 (1990)
Непатентная Ссылка 5: Matunaga T., et al., J. Dermatol., 17, 135 (1990)
Непатентная Ссылка 6: Takahashi H., et al., J. Dermatol. Sci., 31, 21 (2003)
Непатентная Ссылка 7: Komine M., et al., Arch. Dermatol.
Res., 291, 500 (1999)
Непатентная Ссылка 8: Chem. Pharm. Bull., 39(12), 3221-3224 (1991)
Непатентная Ссылка 9: Chem. Pharm. Bull., 40(6), 1494-1499 (1992)
Непатентная Ссылка 10: Chem. Pharm. Bull., 44(12), 2280-2286 (1996)
Непатентная Ссылка 11: Steroids, 59, 686 (1994)
Непатентная Ссылка 12: Mizutani J., Iyaku Journal, 39, 122 (2003)
Непатентная Ссылка 13: Nakagawa H., Iyaku Journal, 39, 93 (2003)
Непатентная Ссылка 14: Bull. Chem. Soc. Jpn., 52(7), 1989-1993 (1979)
Непатентная Ссылка 15: Chem. Pharm. Bull., 44, 2280 (1996)
Непатентная Ссылка 16: Bioorg. Med. Chem. Lett., 2, 1713 (1992)
Непатентная Ссылка 17: Tetrahedron Lett., 45, 7837 (2004)
Непатентная Ссылка 18: J. Chem. Soc, 115, 1207 (1919)
Непатентная Ссылка 19: J. of Pharmacology и Experimental Therapeutics, 305, 675 (2003)
Непатентная Ссылка 20: J. Chem. Soc. Perkin Trans. 1, 7, 1951 (1990)
Непатентная Ссылка 21: Bull. Chem. Soc. Jpn, 67, 293 (1994)
Непатентная Ссылка 22: J. Org. Chem., 33, 1839 (1968)
Непатентная Ссылка 23: Chem. Pharm. Bull., 34(10), 4410-4413 (1986)
Непатентная Ссылка 24: J. Nutr. Sci. Vitaminol., 26, 545-556 (1980)
Непатентная Ссылка 25: J. Org. Chem., 66(23), 7832-7840 (2001)
Непатентная Ссылка 26: Tetrahedron, 42(11), 2931-2935 (1986)
Непатентная Ссылка 27: Tetrahedron Lett., 33, 41; 6193-6196 (1992)
Непатентная Ссылка 28: Synthesis, 134-135 (1983)
Непатентная Ссылка 29: J. Org. Chem., 68(1), 27-34 (2003)
Непатентная Ссылка 30: Yakugaku Zasshi, 72, 1172 (1952)
Непатентная Ссылка 31: J. Med. Chem., 31(2), 428-32 (1988)
Непатентная Ссылка 32: J. Chem. Soc, 115, 1207 (1919)
Непатентная Ссылка 33: J. Am. Chem. Soc, 80, 4969-4971 (1958)
Непатентная Ссылка 34: Tetrahedron., 42, 11, 2931-2935 (1986)
Непатентная Ссылка 35: Tetrahedron., 42, 11, 2931-2935 (1986)
Непатентная Ссылка 36: Synthesis, 7, 1009-1014 (1998)
Непатентная Ссылка 37: Tetrahedron Lett., 28(15), 1685-1688 (1987)
Непатентная Ссылка 38: J. Chem. Soc, 503-506 (1946)
Непатентная Ссылка 39: Tetrahedron Lett., 2749-2752 (1976)
Непатентная Ссылка 40: Archiv der Phamazie, 316, 339-346 (1983)
Непатентная Ссылка 41: J. Med. Chem., 11, 138-140 (1968)
Непатентная Ссылка 42: J. Med. Chem., 43, 1508-1518 (2000)
Непатентная Ссылка 43: J. Gen. Chem. USSR (Engl. Transl.), 32, 786-788 (1962)
Непатентная Ссылка 44: J. Org. Chem., 52, 4798-4800 (1987)
Непатентная Ссылка 45: Tetrahedron Lett., 42, 1029-1032 (2001)
Непатентная Ссылка 46: J. Am. Chem. Soc, 111, 393-395 (1989)
Непатентная Ссылка 47: J. Org. Chem., 68, 1367-1375 (2003)
Непатентная Ссылка 48: Tetrahedron Lett., 32, 7663 (1991)
Непатентная Ссылка 49: J. Med. Chem., 4662-4674 (1998)
Непатентная Ссылка 50: J. Org. Chem., 51,3098-3108 (1986)
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ЗАДАЧИ, КОТОРЫЕ СТОЯТ ПЕРЕД ИЗОБРЕТЕНИЕМ
Основной задачей изобретения является представление нового и полезного производного витамина D3, которое имеет отличную активность витамина D3 и которое по сравнению с обычными производными витамина D3 имеет относительно небольшое воздействие на системный метаболизм кальция.
СРЕДСТВА ДЛЯ РЕШЕНИЯ ЗАДАЧ
Были проведены различные интенсивные исследования и найдено, что новое 9,10-секопрегнановое производное, которое будет упомянуто ниже, или его фармацевтически приемлемая соль, достигает решений поставленной задачи.
Изобретение может включать 9,10-секопрегнановое производное, представленное следующей общей формулой [1] (в дальнейшем именуемое как соединение по изобретению), или его фармацевтически приемлемую соль. Характерным признаком соединения по изобретению с точки зрения его структуры является то, что карбонилоксигруппа непосредственно связана с атомом углерода по 20-положению, а не через находящуюся между алкиленовую цепь.
[Формула 1]
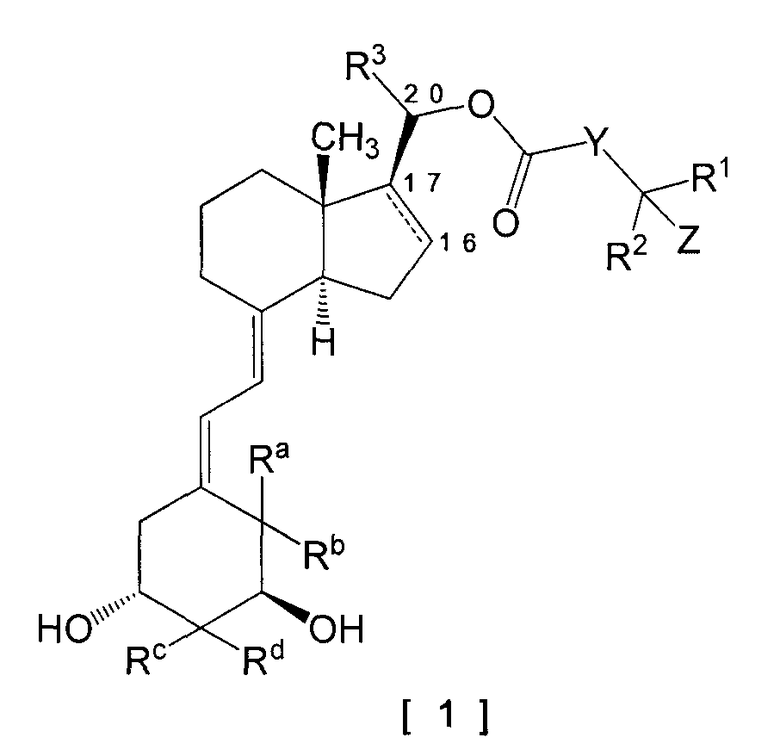
В общей формуле [1]
следующая часть структуры между 16-положением и 17-положением означает простую связь или двойную связь:
[Формула 2]
Y представляет собой (1) простую связь, (2) алкилен, имеющий от 1 до 5 атомов углерода, и необязательно замещенный от 1 до 3 заместителями, выбранными из группы галогена, гидрокси и оксо, (3) алкенилен, имеющий от 2 до 5 атомов углерода или (4) фенилен;
R1 и R2 являются одинаковыми или различными, каждый представляет собой (1) водород, (2) алкил, имеющий от 1 до 6 атомов углерода, и необязательно замещенный от 1 до 3 атомами галогена или (3) циклоалкил, имеющий от 3 до 8 атомов углерода; или R1 и R2, взятые вместе со смежным атомом углерода, образует циклоалкил, имеющий от 3 до 8 атомов углерода;
R3 представляет собой водород или метил;
Z представляет собой водород, гидрокси или -NR11R12; R11 представляет собой водород или алкил, имеющий от 1 до 6 атомов углерода; R12 представляет собой (1) алкил, имеющий от 1 до 6 атомов углерода, и необязательно замещенный гидрокси или (2) алкилсульфонил, имеющий от 1 до 6 атомов углерода;
Ra и Rb оба представляют собой атомы водорода, или Ra и Rb, взятые вместе, образуют метилен;
Rc и Rd являются одинаковыми или различными, каждый представляет собой водород или метил, или Rc и Rd, взятые вместе, образуют метилен.
Однако соединения, где (1) Ra и Rb, взятые вместе, образуют метилен, (2) Rc и Rd представляют собой атомы водорода и (3) частичная структура между 16-положением и 17-положением представляет собой простую связь, исключены.
Изобретение также включает фармацевтическую композицию, содержащую соединение по изобретению или его фармацевтически приемлемую соль в качестве активного ингредиента, или терапевтический агент для лечения дискератоза, включая псориаз, который содержит соединение по изобретению или его фармацевтически приемлемую соль в качестве активного ингредиента.
Из соединений по изобретению, например, предпочтительными являются следующие соединения с (1) по (35):
(1) (1S,3R,20S)-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,10(19),16-тетраен-1,3-диол,
(2) (1R,3R,20S)-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(3) (1R,3R,20S)-2-метилен-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(4) (1R,3R,20S)-19-нор-20-[(2E)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(5) (1R,3R,20S)-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(6) (1R,3R,20S)-2-метилен-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(7) (1R,3R,20S)-2-метилен-19-нор-20-[(2E)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(8) (1R,3R,20S)-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(9) (1R,3R,20S)-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(10) (1R,3R,20S)-19-нор-2-метилен-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(11) (1S,3R,20S)-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,10(19),16-тетраен-1,3-диол,
(12) (1R,2α,3R,20S)-2-метил-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(13) (1R,2β,3R,20S)-2-метил-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(14) (1R,3R,20S)-2-метил-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(15) (1R,3R,20S)-2-метил-19-нор-20-[(2E)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(16) (1R,3R,20S)-19-нор-2-метил-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(17) (1R,3R,20S)-19-нор-2-метилен-20-[(4S)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(18) (1R,3R,20S)-19-нор-2-метилен-20-[(4R)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(19) (1R,3R,20S)-2-метилен-19-нор-20-(5-гидрокси-5-метилгексаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(20) (1R,2α,3R,20S)-2-метил-19-нор-20-(5-гидрокси-5-метилгексаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(21) (1R,2β,3R,20S)-2-метил-19-нор-20-(5-гидрокси-5-метилгексаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(22) (1R,2α,3R,20S)-2-метил-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(23) (1R,2β,3R,20S)-2-метил-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(24) (1R,2α,3R,20S)-19-нор-2-метил-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(25) (1R,2β,3R,20S)-19-нор-2-метил-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(26) (1R,2α,3R,20S)-2-метил-19-нор-20-[(2E)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(27) (1R,2β,3R,20S)-2-метил-19-нор-20-[(2E)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(28) (1R,2α,3R,20S)-2-метил-19-нор-20-[4-этил-4-гидроксигексаноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(29) (1R,2β,3R,20S)-2-метил-19-нор-20-[4-этил-4-гидроксигексаноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(30) (1R,3R,20S)-19-нор-20-[(4S)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(31) (1R,3R,20S)-19-нор-20-[(4R)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(32) (1S,3R,20S)-20-[(4R)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,10(19),16-тетраен-1,3-диол,
(33) (1S,3R,20S)-20-[(4S)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,10(19),16-тетраен-1,3-диол,
(34) (1R,3R,20S)-19-нор-20-[(4S)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(35) (1R,3R,20S)-19-нор-20-[(4R)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол.
Изобретение также включает следующее соединение с (1) по (5) или его фармацевтически приемлемую соль, фармацевтическую композицию, содержащую следующее соединение с (1) по (5), или его фармацевтически приемлемую соль в качестве активного ингредиента, или терапевтический агент для лечения дискератоза, включая псориаз, который содержит следующее соединение с (1) по (5) или его фармацевтически приемлемую соль в качестве активного ингредиента.
(1) (1S,3R,20S)-20-(5-гидрокси-5-этилгептаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол,
(2) (1S,3R,20S)-20-[(4R)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол,
(3) (1S,3R,20S)-20-[(4S)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол,
(4) (1S,3R,20S)-20-(6,6,6-трифтор-5-гидрокси-5-метилгексаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол,
(5) (1S,3R,20S)-20-(5,5,5-трифтор-4-гидрокси-4-метил-3-оксопентаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол.
Изобретение описано подробно ниже.
Термин "галоген" в изобретении включает, например, фтор, хлор, бром, иод.
Термин "алкилен" в изобретении представляет собой линейную или разветвленную цепь, имеющую от 1 до 5 атомов углерода, включая, например, метилен, этилен, триметилен, метилэтилен, тетраметилен, метилтриметилен, этилэтилен, пентаметилен, метилтетраметилен, этилтриметилен. В особенности предпочтительным является линейный алкилен, имеющий от 1 до 3 атомов углерода. Алкилен в изобретении может быть замещен от 1 до 3 заместителями, выбранными из группы, состоящей из галогена, гидрокси и оксо.
Термин "алкенилен" в изобретении представляет собой линейную или разветвленную цепь, имеющую от 2 до 5 атомов углерода. Например, он включает этенилен, пропенилен, бутилен, пентенилен. В особенности предпочтительным является линейный алкенилен, имеющий от 2 до 4 атомов углерода.
Термин "фенилен" в изобретении включает, например, 1,2-фенилен, 1,3-фенилен, 1,4-фенилен.
Термин "алкил" в изобретении представляет собой линейную или разветвленную цепь, имеющую от 1 до 6 атомов углерода, включая, например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, н-гексил, изогексил. В особенности предпочтительными являются метил и этил. Алкил в изобретении может быть замещен от 1 до 3 атомами галогена.
Термин "циклоалкил" в изобретении имеет значение, например, моно-трициклического алкила, имеющего от 3 до 8 атомов углерода, в особенности включая циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклодеканил, адамантил (1-адамантил, 2-адамантил и так далее), 2-бицикло[3.1.1]гептил и 2-бицикло[2.2.1]гептил. В особенности, предпочтительным является монотрициклический алкил, имеющий от 4 до 6 атомов углерода.
Если конкретно не определено, защитная группа для "гидрокси" в изобретении может быть любой гидроксизащитной группой, используемой в реакции, включая, например, 1) триалкилсилил, такой как триэтилсилил, трибутилсилил, трет-бутилдиметисилил, и так далее; 2) (2-триметилсилил)этоксиметил, 3) арилметил, такой как бензил, 4-метоксифенилметил, и так далее; 4) ацил, такой как ацетил, и так далее; и 5) 2-тетрагидропиранил.
НАИЛУЧШИЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Соединение по изобретению может быть получено из известного соединения или из легко синтезируемого промежуточного соединения, например, в соответствии со способом, упомянутым ниже. При получении соединения по изобретению, в случае, когда исходный продукт имеет заместитель, имеющий влияние на ход реакции, как правило, исходный продукт предварительно защищают подходящей защитной группой в соответствии с известным способом и затем проводят реакцию. Защитная группа может быть удалена после реакции в соответствии с известным способом.
[Формула 3]
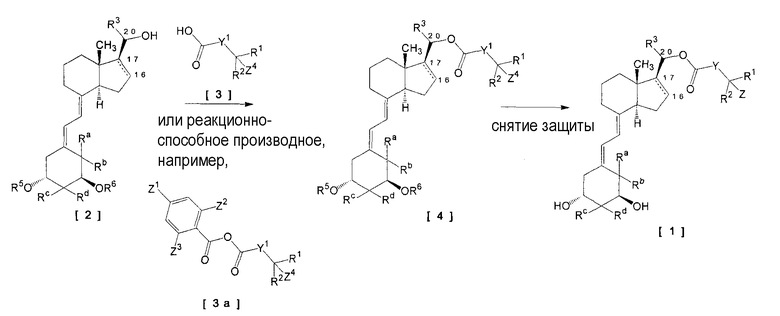
[В формуле Y, Z, R1, R2, R3, Ra, Rb, Rc и Rd имеют те же самые значения, как указано выше. Y1 представляет собой (1) простую связь, (2) алкилен, имеющий от 1 до 5 атомов углерода, и необязательно замещенный от 1 до 3 заместителями, выбранными из группы, состоящей из галогена, защищенной гидроксигруппы и оксо, (3) алкенилен, имеющий от 1 до 5 атомов углерода, или (4) фенилен. R5 и R6 каждый представляет собой защитную группу для гидрокси. Z1, Z2 и Z3 являются одинаковыми или различными, каждый представляет собой галоген, нитро или циано. Z4 представляет собой (1) водород, (2) защищенную гидроксигруппу или (3)-NR13R14. R13 представляет собой водород или алкил, имеющий от 1 до 6 атомов углерода; R14 представляет собой (1) алкил, имеющий от 1 до 6 атомов углерода, и необязательно замещенный защищенной гидроксигруппой или (2) алкилсульфонил, имеющий от 1 до 6 атомов углерода.]
Указанная реакция представляет собой конденсацию соединения (спирт) общей формулы [2] и соединения (карбоновая кислота) общей формулы [3] с последующим снятием защиты, и поэтому она может быть осуществлена в соответствии со способом per se как конденсация и снятие защиты. Например, указанный выше спирт взаимодействует с указанной выше карбоновой кислотой с последующим снятием защиты, что, таким образом, приводит к получению соединения по изобретению.
Первая Стадия (конденсация)
Указанная стадия предназначена для конденсации спирта [2] и карбоновой кислоты [3] при температуре реакции в интервале от -20 до 100ºC в присутствии или отсутствии основания (например, органического основания, такого как триэтиламин, N,N-диизопропил-N-этиламин, N,N-диэтиланилин, пиридин, 4-диметиламинопиридин и 1,8-диазабицикло[5,4.0]ундец-7-ен), используя конденсирующий агент (например, 1,1'-оксалилдиимидазол, 1-этил-3-(3-диметиламинопропил)карбодиимид, дициклогексилкарбодиимид, диэтилцианофосфонат, дифенилфосфорилазид и иодид 2-хлор-1-метилпиридиния). Применим, если конкретно не определено, любой растворитель, не участвующий в реакции, включая, например, простые эфиры, такие как тетрагидрофуран, диэтиловый эфир и так далее; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид, и так далее; нитрилы, такие как ацетонитрил, пропионитрил, и так далее; углеводороды, такие как бензол, толуол, и так далее; галогенуглеводороды, такие как хлороформ, дихлорметан, и так далее; или смешанные растворители. В указанной стадии может быть введена добавка (например, 1-гидроксибензотриазол, N-гидроксисукцинимид, и так далее).
Время реакции меняется в зависимости от типа исходных продуктов и агентов конденсации, температуры реакции и других условий, но в общем оно является подходящим в интервале от 30 минут до 24 часов. Количество указанной выше карбоновой кислоты [3] и соответствующего конденсирующего агента предпочтительно находится в интервале от 1 до 3 молярных единиц относительно спирта [2].
Вместо указанной выше карбоновой кислоты [3] для использования на указанной стадии также применимо ее реакционоспособное производное. Реакционоспособное производное включает такое, которое, как правило, используют при эфирообразующей конденсации, например, галогенангидриды кислоты (например, хлорангидриды и бромангидриды кислоты), смешанные ангидриды кислоты, имидазолиды, активные амиды, и так далее. Когда используют реакционноспособное производное в реакции, указанный выше конденсирующий агент может быть исключен.
Например, в случае, когда используют смешанный ангидрид кислоты в качестве реакционоспособного производного карбоновой кислоты [3], используют пиридиновый растворитель, такой как пиридин, 4-метилпиридин или им подобные, или одно и то же основание и растворитель, как указано выше, и конденсация может быть осуществлена при температуре реакции в интервале от -20 до 100ºC. В качестве добавки может быть введен, например, 4-диметиламинопиридин. Время реакции меняется в зависимости от используемого типа смешанного ангидрида кислоты и температуры реакции, но в общем оно является подходящим в интервале от 30 минут до 24 часов. На стадии использования смешанного ангидрида кислоты смешанный ангидрид кислоты предпочтительно представляет собой смешанный ангидрид кислоты следующей общей формулы [3а] (например, ссылаясь на Непатентную Ссылку 14).
[Формула 4]
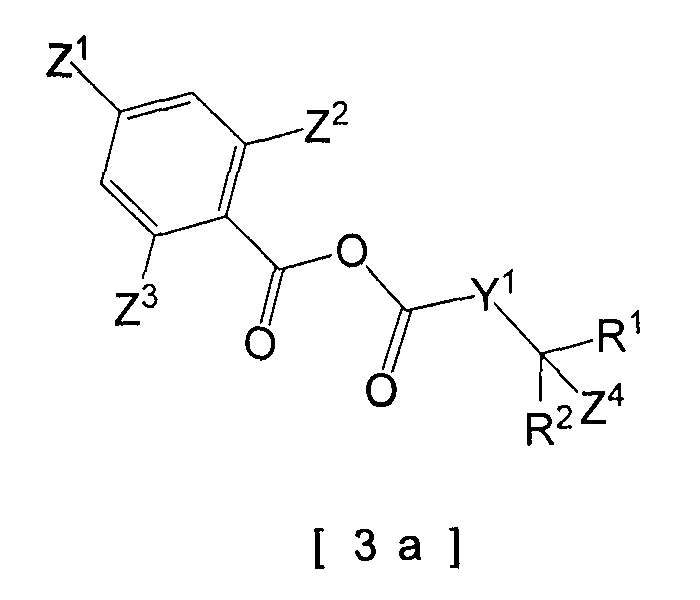
[В формуле Y1, R1, R2, Z1, Z2, Z3 и Z4 имеют те же самые значения, как указано выше.]
R5 и R6 конкретно не определены и могут быть любой гидроксизащитной группой, используемой в реакции. Например, они включают упомянутые выше защитные группы.
Исходное соединение общей формулы [2] может быть получено в соответствии с известным способом (например, ссылаясь на Патентную Ссылку 5 и Непатентные Ссылки с 15 по 17) или аналогичным способом или в соответствии со способом, описанным в Примерах, приведенных ниже.
Исходное соединение общей формулы [3] может быть получено, например, в соответствии с тем же самым способом, как в приведенных Непатентных Ссылках с 18 по 22, или в соответствии со способом, аналогичным способу, описанному в Патентной Ссылке 4 или Непатентных Ссылках с 26 по 41.
Вторая Стадия (снятие защиты)
Указанная стадия представляет собой снятие защиты с гидроксигруппы и может быть осуществлена, как таковая, в соответствии с обычным способом. Конкретно, поскольку варьирование находится в зависимости от типа используемой защитной группы, когда используют трет-бутилдиметилсилил в качестве защитной группы, его можно снять в соответствии с методикой, упомянутой ниже.
Для снятие защиты с соединения общей формулы [4] может быть использован агент снятия защиты (например, фторид тетрабутиламмония, фтористый водород, фтористый водород-пиридин, уксусная кислота и трифторуксусная кислота) и снятие защиты может быть осуществлено при температуре реакции в интервале от от -20 до 100ºC. Может быть использован, если конкретно не определено, любой растворитель, не участвующий в реакции, включая, например, простые эфиры, такие как тетрагидрофуран, диэтиловый эфир, и так далее; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид, и так далее; нитрилы, такие как ацетонитрил, пропионитрил, и так далее; углеводороды, такие как бензол, толуол, и так далее; галогенуглеводороды, такие как хлороформ, дихлорметан, и так далее; или смешанные растворители. Время реакции меняется в зависимости от типа исходного продукт и агента снятия защиты, но в общем оно является подходящим в интервале от 30 минут до 24 часов. Количество используемого агента снятия защиты предпочтительно составляет от 1 до 100 молярных единиц относительно соединения общей формулы [4].
Соединение по изобретению включает соединения, которые имеют асимметричный атом углерода, и изобретение включает не только его оптически активные соединения, но также его рацемические соединения. Для получения таких оптически активных соединений применимым является обычный способ разделения с помощью хиральной колонки; однако они могут также быть получены через асимметричный синтез из исходного соединения [2] (например, они могут быть получены в соответствии с методикой, аналогичной методике асимметричного получения, представленной в Непатентных Ссылках 15 и 16).
В случае, когда соединение по изобретению включает геометрические изомеры или таутомеры, не только любой один из них изомер, но также их смеси входят в объем соединений по изобретению.
Соединение по изобретению может быть использовано в качестве фармацевтического средства непосредственно как оно есть в виде свободного основания, но может быть использовано после перевода в фармацевтически приемлемую соль в соответствии с известным способом. Соль включает соли с неорганической кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота, и так далее; или соли с органической кислотой, такой как уксусная кислота, лимонная кислота, винная кислота, малеиновая кислота, янтарная кислота, фумаровая кислота, п-толуолсульфоновая кислота, бензолсульфоновая кислота, метансульфоновая кислота, и так далее.
Например, гидрохлориды соединения по изобретению могут быть получены путем растворения соединения по изобретению в спиртовом растворе, этилацетном растворе или эфирном растворе хлористого водорода.
Соединение по изобретению является полезным в качестве его фармацевтического средства, как показано в Тестовых Примерах, приведенных ниже, и в особенности является полезным в качестве терапевтического агента для лечения дискератоза, включая псориаз.
В случае, когда соединение по изобретению вводят в качестве его фармацевтического средства, соединение по изобретению может быть введено млекопитающим, включая людей, непосредственно как таковое или в форме фармацевтической композиции, содержащей его в фармацевтически приемлемом и нетоксичном инертном носителе в количестве, например, от 0,0001 до 99,5%, предпочтительно от 0,001 до 90%.
Носителем может быть, по крайней мере, один из твердых, полутвердых или жидких разбавителей, наполнителей и других вспомогательных средств для составления композиций. Фармацевтическую композицию предпочтительно вводят в виде единичной дозы. Способ введения для фармацевтической композиции по изобретению конкретно не определен; но нельзя не сказать о том, что композицию вводят в виде препаративной формы, пригодной для применяемого способа введения. Предпочтительным является местное введение (трансдермальное введение, и так далее).
Дозу терапевтического агента для лечения дискератоза, включая псориаз, предпочтительно определяют с учетом особенности и степени заболевания, состояний пациента, таких как возраст, масса тела и других таких условий и способа введения. В общем, доза, как правило, составляет от 0,01 до 1000 мг/человек/в день, предпочтительно от 0,1 до 500 мг/человек/в день как эффективное количество соединения по изобретению для взрослых пациентов.
Возможно, что доза может быть ниже, чем упомянутая выше, или, напротив, может быть необходима большая доза, чем упомянутая выше. Доза может быть разделена на 2-5 порций, которые могут вводиться в разное время в течение дня.
ПРИМЕРЫ
Изобретение описано более подробно со ссылкой на следующие Ссылочные Примеры, Примеры, Тестовые Примеры и Примеры Композиций, которыми, тем не менее, изобретение не должно быть ограничено.
Ссылочный Пример 1:
3-(трет-бутилдиметилсилилокси)-3-метилмасляная кислота
Стадия 1:
4-Диметиламинопиридин (0,78 г) добавляют к безводному хлористометиленовому раствору 3-гидрокси-3-метилмасляной кислоты (3,76 г) и бензилового спирта (4,13 г) и перемешивают при охлаждении льдом. К полученной реакционной массе добавляют N,N'-дициклогексилкарбодиимид (9,9 г), затем баню со льдом удаляют и реакционную массу перемешивают в течение ночи при комнатной температуре. Высаженное нерастворимое вещество удаляют фильтрованием и маточный раствор концентрируют, что дает остаточное масло (13 г). Его очищают с помощью хроматографии на колонке с силикагелем, что дает бензил-3-гидрокси-3-этилбутират (7,2 г) в виде масла бледно-желтого цвета.
1H-ЯМР (CDCl3) δ: 1,28 (6H, с), 2,55 (2H, с), 5,16 (2H, с), 7,36 (5H, с).
Стадия 2:
2,6-Лутидин (3,6 г) добавляют к безводному хлористометиленовому раствору бензил-3-гидрокси-3-метилбутирата (3,5 г), полученному на стадии 1, и перемешивают при охлаждении льдом. Постепенно к полученной реакционной массе добавляют по каплям трет-бутилдиметилсилилтрифторметансульфонат (3,9 мл) и перемешивают в течение часа при охлаждении льдом и затем в течение 2 часов при комнатной температуре. Реакционную жидкость разбавляют этилацетатом, затем промывают водой, насыщенным водным раствором хлорида аммония и насыщенным водным раствором хлорида натрия, затем сушат над безводным сульфатом магния и концентрируют. 4,5 г остатка очищают с помощью хроматографии на колонке с силикагелем, что дает бензил-3-(трет-бутилдиметилсилилокси)-3-метилбутират (2,62 г) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 0,07 (6H, с), 0,82 (9H, с), 1,36 (6H, с), 2,52 (2H, с), 5,09 (2H, с), 7,35 (5H, с).
Стадия 3:
Бензил-3-(трет-бутилдиметилсилилокси)-3-метилбутират (2,37 г), полученный на стадии 2, растворяют в этилацетате (30 мл) и к полученной реакционной массе добавляют 10% палладий на угле (0,47 г) для гидрогенизации с помощью H2 при атмосферном давлении. Через 40 минут перемешивание прекращают и катализатор удаляют фильтрованием. Маточную жидкость упаривают при пониженном давлении, что дает названное в заголовке соединение (1,70 г) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 0,18 (6H, с), 0,89 (9H, с), 1,40 (6H, с), 2,51 (2H, с).
Ссылочный Пример 2:
(1S,3R,20S)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-20-ол
Через тетрагидрофурановый раствор (500 мл) (1S,3R,20S)-1,3-бис(трет-бутилдиметилсилилокси)-прегна-5,7-диен-20-ола (155 мг) (способ его получения, например, описан в Непатентной Ссылке 23) барботируют аргон при охлаждении льдом в течение 10 минут. Затем в реакционную баню помещают ртутную лампу высокого давления мощностью 500-ватт, при этом охлаждающийся слой циркулирует с раствором фильтрата никель сульфата-сульфата меди (это раскрыто, например, в Непатентной Ссылке 24) и облучение осуществляют в течение 5 минут при охлаждении льдом. Дополнительно реакционную жидкость после этого облучают в течение 2,5 минут и затем переносят в колбу коричневого цвета и нагревают при температуре кипения с обратным холодильником в течение 3 часов. Растворитель упаривают при пониженном давлении и остаток очищают с помощью хроматографии на колонке с силикагелем и препаративной тонкослойной хроматографии, что дает названное в заголовке соединение (30 мг) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 0,06 (12H, с), 0,54 (3H, с), 0,88 (18H, с), 1,23 (3H, д), 2,45 (1H, дд), 2,84 (1H, дд), 3,71 (2H, м), 4,19 (1H, м), 4,38 (1H, дд), 4,86 (1H, д), 5,18 (1H, с), 6,03 (1H, д), 6,23 (1H, д).
Пример 1:
(1S,3R,20S)-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
2,4,6-Трихлорбензоилхлорид (13 мкл) добавляют к тетрагидрофурановому раствору (0,5 мл) 4-триэтилсилилокси-4-метилпентановой кислоты (20 мг), полученной в соответствии со способом, описанным в Непатентной Ссылке 25, и триэтиламину (11,2 мкл) и затем перемешивают при комнатной температуре в течение 30 минут. После отделения кристаллического продукта фильтрованием тетрагидрофуран упаривают и остаток сушат при пониженном давлении. Добавляют безводный бензольный раствор (0,5 мл) (1S,3R,20S)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-20-ола (30 мг), полученный в соответствии с Ссылочным Примером 2, и 4-диметиламинопиридин (30 мг) к остатку в атмосфере газа аргона и затем перемешивают при комнатной температуре в течение 30 минут. Реакционную жидкость разбавляют этилацетатом, затем промывают насыщенным водным раствором гидрокарбоната натрия и насыщенным рассолом в указанном порядке, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем, что дает (1S,3R,20S)-20-(4-триэтилсилилокси-4-метилпентаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен (27 мг) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 0,06 (12H, с), 0,54 (3H, с), 0,57 (6H, кв), 0,87 (18H, с), 0,94 (9H, т), 1,20 (6H, с), 2,36 (2H, т), 2,84 (1H, д), 4,19 (1H, м), 4,37 (1H, дд), 4,85 (1H, д), 4,94 (1H, м), 5,17 (1H, д), 6,02 (1H, д), 6,23 (1H, д).
Стадия 2:
Реагент, полученный путем добавления уксусной кислоты (16 мкл) к 1 M раствору фторида тетра(н-бутил)аммония (0,56 мл), добавляют к безводному тетрагидрофурановому раствору (1 мл) (1S,3R,20S)-20-(4-триэтилсилилокси-4-метилпентаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триена (22 мг), полученному на стадии 1, в атмосфере аргона и затем перемешивают в течение ночи при комнатной температуре. К реакционной жидкости добавляют холодную воду и затем ее подвергают экстракции этилацетатом. Этилацетатный слой промывают насыщенным рассолом, затем сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем и препаративной тонкослойной хроматографии, что дает названное в заголовке соединение (7,1 мг) по изобретению в виде бесцветного порошка.
1H-ЯМР (CDCl3) δ: 0,55 (3H, с), 1,23 (6H, с), 1,23 (3H, д), 1,80 (2H, т), 2,39 (2H, т), 2,60 (1H, дд), 2,83 (1H, м), 4,24 (1H, м), 4,43 (1H, дд), 4,95 (1H, м), 4,99 (1H, дд), 5,33 (1H, ушир.), 6,02 (1H, д), 6,37 (1H, д).
(+) -FABMS m/z 447 [M+H]+
Пример 2:
(1S,3R,20S)-20-(3-гидрокси-3-метилбутаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя 3-(трет-бутилдиметилсилилокси)-3-метилмасляную кислоту (Ссылочный Пример 1) вместо 4-триэтилсилилокси-4-метилпентановой кислоты, получают (1S,3R,20S)-20-[3-(трет-бутилдиметилсилилокси)-3-метилбутаноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
1H-ЯМР (CDCl3) δ: 0,06 (12H, с), 0,08 (6H, с), 0,53 (3H, с), 0,84 (9H, с), 0,87 (18H, с), 1,23 (3H, д), 1,40 (3H, с), 1,36 (3H, с), 2,43 (2H, ушир.с), 2,84 (1H, д), 4,18 (1H, м), 4,36 (1H, дд), 4,85 (1H, д), 4,91 (1H, м), 5,17 (1H, д), 6,02 (1H, д), 6,23 (1H, д).
Стадия 2:
В соответствии со способом, аналогичным способу, представленному на стадии 2 в Примере 1, но используя (1S,3R,20S)-20-[3-(трет-бутилдиметилсилилокси)-3-метилбутаноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученному на стадии 1, вместо (1S,3R,20S)-20-(4-триэтилсилилокси-4-метилпентаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триена получают указанное в заголовке соединение по изобретению.
1H-ЯМР (CDCl3) δ: 0,56 (3H, с), 1,26 (3H, д), 1,27 (6H, с), 2,32 (1H, дд), 2,44 (2H, с), 2,60 (1H, дд), 2,84 (1H, м), 3,74 (1H, ушир.), 4,24 (1H, м), 4,43 (1H, дд), 4,99 (1H, с), 5,01 (1H, м), 5,33 (1H, с), 6,03 (1H, д), 6,37 (1H, д).
ESIMS m/z 455 [M+Na]+
Пример 3:
(1S,3R,20S)-20-(5-гидрокси-5-метилгексаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя 5-триэтилсилилокси-5-метилгексановую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 26, вместо 4-триэтилсилилокси-4-метилпентановой кислоты, получают (1S,3R,20S)-20-(5-триэтилсилилокси-5-метилгексаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-(5-триэтилсилилокси-5-метилгексаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 483,5 [M+Na]+
Пример 4:
(1S,3R,20S)-20-(4,4,4-трифтор-3-гидрокси-3-метилбутаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя 3-(трет-бутилдиметилсилилокси)-4,4,4-трифтор-3-метилмасляную кислоту вместо 4-триэтилсилилокси-4-метилпентановой кислоты, получают (1S,3R,20S)-20-[3-(трет-бутилдиметилсилилокси)-4,4,4-трифтор-3-метилбутаноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-[3-(трет-бутилдиметилсилилокси)-4,4,4-трифтор-3-метилбутаноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 509,3 [M+Na]+
Пример 5:
(1S,3R,20S)-20-(3-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя 3-(трет-бутилдиметилсилилокси)-4-метилпентановую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 27, вместо 4-триэтилсилилокси-4-метилпентановой кислоты, получают (1S,3R,20S)-20-[3-(трет-бутилдиметилсилилокси)-4-метилпентаноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-[3-(трет-бутилдиметилсилилокси)-4-метилпентаноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 469,4 [M+Na]+
Пример 6:
(1S,3R,20S)-20-(4,4,4-трифторбутаноилокси-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя 4,4,4-трифтормасляную кислоту вместо 4-триэтилсилилокси-4-метилпентановой кислоты, получают (1S,3R,20S)-20-(4,4,4-трифторбутаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-(4,4,4-трифторбутаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 479,3 [M+Na]+
Пример 7:
(1S,3R,20S)-20-[4,4,4-трифтор-3-гидрокси-3-(трифторметил)бутаноилокси]-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя 3-(трет-бутилдиметилсилилокси)-4,4,4-трифтор-3-(трифторметил)масляную кислоту вместо 4-триэтилсилилокси-4-метилпентановой кислоты, получают (1S,3R,20S)-20-[3-(трет-бутилдиметилсилилокси)-4,4,4-трифтор-3-(трифторметил)бутаноилокси-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-[3-(трет-бутилдиметилсилилокси)-4,4,4-трифтор-3-(трифторметил)бутаноилокси-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(-) -FABMS m/z 539,2 [M-H]-
Пример 8:
(1S,3R,20S)-20-[(2E)-4-гидрокси-4-метилпент-2-еноилокси]-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя (2E)-4-триэтилсилокси-4-метилпент-2-еновую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 28, вместо 4-триэтилсилилокси-4-метилпентановой кислоты, получают (1S,3R,20S)-20-[(2E)-4-триэтилсилилокси-4-метилпент-2-еноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-[(2E)-4-триэтилсилилокси-4-метилпент-2-еноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 467,3 [M+Na]+
Пример 9:
(1S,3R,20S)-20-(3-циклопропил-3-гидроксипропаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя 3-(трет-бутилдиметилсилилокси)-3-циклопропилпропионовую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 29, вместо 4-триэтилсилилокси-4-метилпентановой кислоты получают (1S,3R,20S)-20-[3-(трет-бутилдиметилсилилокси)-3-циклопропилпропаноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-[3-(трет-бутилдиметилсилилокси)-3-циклопропилпропаноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 467,3 [M+Na]+
Пример 10:
(1S,3R,20S)-20-[(2E)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя (2E)-4-(трет-бутилдиметилсилилокси)-4-этилгекс-2-еновую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 28, вместо 4-триэтилсилилокси-4-метилпентановой кислоты получают (1S,3R,20S)-20-[(2E)-4-(трет-бутилдиметилсилилокси)-4-этилгекс-2-еноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-[(2E)-4-(трет-бутилдиметилсилилокси)-4-этилгекс-2-еноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 495,5 [M+Na]+
Пример 11:
(1S,3R,20S)-20-(5-гидрокси-5-метилгептаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя 5-триэтилсилилокси-5-метилгептановую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 30, вместо 4-триэтилсилилокси-4-метилпентановой кислоты получают (1S,3R,20S)-20-(5-триэтилсилилокси-5-метилгептаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-(5-триэтилсилилокси-5-метилгептаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 475,3 [M+Na]+
Пример 12:
(1S,3R,20S)-20-(3-этил-3-гидроксипентаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя 3-этил-3-триэтилсилилоксипентановую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 31, вместо 4-триэтилсилилокси-4-метилпентановой кислоты получают (1S,3R,20S)-20-(3-этил-3-триэтилсилилоксипентаноилокси)-1,3-бис(трет-
бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-(3-этил-3-триэтилсилилоксипентаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 483,4 [M+Na]+
Пример 13:
(1S,3R,20S)-20-(4-этил-4-гидроксигексаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя 4-этил-4-триэтилсилилоксигексановую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 32, вместо 4-триэтилсилилокси-4-метилпентановой кислоты получают (1S,3R,20S)-20-(4-этил-4-триэтилсилилоксигексаноилокси)-1,3-бис(трет-
бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-(4-этил-4-триэтилсилилоксигексаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 497,5 [M+Na]+
Пример 14:
(1S,3R,20S)-20-[3-(1-гидрокси-1-метилэтил)-бензоилокси]-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя 3-(1-триэтилсилилокси-1-метилэтил)бензойную кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 33, вместо 4-триэтилсилилокси-4-метилпентановой кислоты получают (1S,3R,20S)-20-[3-(1-триэтилсилилокси-1-метилэтил)бензоилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-[3-(1-триэтилсилилокси-1-метилэтил)бензоилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 517,4 [M+Na]+
Пример 15:
(1S,3R,20S)-20-[N-(изопропилсульфонил)-3-аминопропаноилокси]-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя N-(изопропилсульфонил)-β-аланин, полученный в соответствии со способом, описанным в Патентной Ссылке 3, вместо 4-триэтилсилилокси-4-метилпентановой кислоты получают (1S,3R,20S)-20-[N-(изопропилсульфонил)-3-аминопропаноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-[N-(изопропилсульфонил)-3-аминопропаноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 532,4 [M+Na]+
Пример 16:
(1S,3R,20S)-20-(6-гидрокси-6-метилгептаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя 6-триэтилсилилокси-6-метилгептановую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 35, вместо 4-триэтилсилилокси-4-метилпентановой кислоты, получают (1S,3R,20S)-20-(6-триэтилсилилокси-6-метилгептаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-(6-триэтилсилилокси-6-метилгептаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 497,4 [M+Na]+
Пример 17:
(1S,3R,20S)-20-{4-[2,2,2-трифтор-1-гидрокси-1-(трифторметил)этил]бензоилокси}-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя 4-{2,2,2-трифтор-1-трифторметил-1-[2-(триметилсилил)этоксиметилокси]этил}бензойную кислоту вместо 4-триэтилсилилокси-4-метилпентановой кислоты, получают (1S,3R,20S)-20-[4-{2,2,2-трифтор-1-трифторметил-1-[2-(триметилсилил)этоксиметилокси]этил}бензоилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-[4-{2,2,2-трифтор-1-трифторметил-1-[2-(триметилсилил)этоксиметилокси]этил}бензоилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
Пример 18:
(1S,3R,20S)-20-(5,5,5-трифторпентаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя 5,5,5-трифторпентановую кислоту вместо 4-триэтилсилилокси-4-метилпентановой кислоты, получают (1S,3R,20S)-20-(5,5,5-трифторпентаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-(5,5,5-трифторпентаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 493,3 [M+Na]+
Пример 19:
(1S,3R,20S)-20-[N-(2-гидрокси-2-метилпропил)-N-метил-2-аминоацетилокси]-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя N-(2-триэтилсилилокси-2-метилпропил)-N-метил-2-аминоуксусную кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 40, вместо 4-триэтилсилилокси-4-метилпентановой кислоты получают (1S,3R,20S)-20-[N-(2-триэтилсилилокси-2-метилпропил)-N-метил-2-аминоацетилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2 :
(1S,3R,20S)-20-[N-(2-триэтилсилилокси-2-метилпропил)-N-метил-2-аминоацетилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 476,4 [M+1]+
Пример 20:
(1S,3R,20S)-20-[3-(1-гидроксициклопентил)пропаноилокси]-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя 3-(1-триэтилсилилоксициклопентил)пропионовую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 36, вместо 4-триэтилсилилокси-4-метилпентановой кислоты получают (1S,3R,20S)-20-[3-(1-триэтилсилилоксициклопентил)пропаноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-[3-(1-триэтилсилилоксициклопентил)пропаноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 473,5 [M+1]+
Пример 21:
(1S,3R,20S)-20-(3,3-дифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя 4-триэтилсилилокси-3,3-дифтор-4-метилпентановую кислоту, полученную в соответствии со способом, описанным в Патентной Ссылке 4, вместо 4-триэтилсилилокси-4-метилпентановой кислоты получают (1S,3R,20S)-20-(4-триэтилсилилокси-3,3-дифтор-4-метилпентаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-(4-триэтилсилилокси-3,3-дифтор-4-метилпентаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 483,4 [M+1]+
Пример 22:
(1S,3R,20S)-20-[(3S)-3,4-дигидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя (3S)-3,4-бис(триэтилсилилокси)-4-метилпентановую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 37, вместо 4-триэтилсилилокси-4-метилпентановой кислоты, получают (1S,3R,20S)-20-[((3S)-3,4-бис(триэтилсилилокси)-4-метилпентаноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-[(3S)-3,4-бис(триэтилсилилокси)-4-метилпентаноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 485,4 [M+Na]+
Пример 23:
(1S,3R,20S)-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя (4-(трет-бутилдиметилсилилокси)-5,5,5-трифтор-4-метилпентановую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 41, вместо 4-триэтилсилилокси-4-метилпентановой кислоты получают (1S,3R,20S)-20-[4-(трет-бутилдиметилсилилокси)-5,5,5-трифтор-4-метилпентаноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-[4-(трет-бутилдиметилсилилокси)-5,5,5-трифтор-4-метилпентаноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 523,3 [M+Na]+
Пример 24:
(1S,3R, 20R)-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя (1S,3R,20R)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-20-ол, полученный в соответствии со способом, описанным в Непатентной Ссылке 16, вместо (1S,3R,20S)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-20-ола получают (1S,3R,20R)-20-(4-триэтилсилилокси-4-метилпентаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20R)-20-(4-триэтилсилилокси-4-метилпентаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 469,4 [M+Na]+
Пример 25:
(1S,3R,20R)-20-(3-гидрокси-3-метилбутаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 2, но используя (1S,3R,20R)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-20-ол, полученный в соответствии со способом, описанным в Непатентной Ссылке 16, вместо (1S,3R,20S)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-20-ола получают (1S,3R,20R)-20-(3-т-бутилдиметилсилилокси-3-метилбутаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20R)-20-(3-т-бутилдиметилсилилокси-3-метилбутаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -FABMS m/z 432 [M+1]+
Пример 26:
(1S,3R,17β)-17-(4-гидрокси-4-метилпентаноилоксиметил)-9,10-секоандроста-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя (1S,3R,17β)-1,3-бис(трет-бутилдиметилсилилокси)-17-гидроксиметил-9,10-секоандроста-5Z,7E,10(19)-триен, полученный в соответствии со способом, описанным в Непатентной Ссылке 17, вместо (1S,3R,20S)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-20-ола, получают (1S,3R,17β)-17-(4-триэтилсилилокси-4-метилпентаноилоксиметил)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секоандроста-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,17β)-17-(4-триэтилсилилокси-4-метилпентаноилоксиметил)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секоандроста-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 455,3 [M+Na]+
Пример 27:
(1S,3R,20S)-20-(4-гидрокси-4-метил-3-оксо-пентаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя 4-(трет-бутилдиметилсилилокси)-4-метилпент-2-иновую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 38, вместо 4-триэтилсилилокси-4-метилпентановой кислоты получают (1S,3R,20S)-20-[4-(трет-бутилдиметилсилилокси)-4-метилпент-2-иноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
Реагент, полученный путем добавления уксусной кислоты (14 мкл) к 1 M раствору тетра-н-бутиламмонийфторида (0,81 мл), добавляют к безводному тетрагидрофурановому раствору (0,4 мл) (1S,3R,20S)-20-[4-(трет-бутилдиметилсилилокси)-4-метилпент-2-иноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триена (32 мг), полученному на стадии 1, в атмосфере аргона и затем перемешивают в течение ночи при комнатной температуре. К реакционной жидкости добавляют воду и затем реакционную жидкость трижды подвергают экстракции хлороформом. Слой хлороформа затем промывают насыщенным рассолом, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем, что дает названное в заголовке соединение (9,5 мг) по изобретению в виде порошка бледно-коричневого цвета.
(+) -ESIMS m/z 483,3 [M+Na]+
Пример 28:
(1S,3R,20S)-20-(4-этил-4-гидрокси-3-оксо-гексаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя 4-триэтилсилилокси-4-этилгекс-2-иновую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 38, вместо 4-триэтилсилилокси-4-метилпентановой кислоты, получают (1S,3R,20S)-20-[4-(трет-бутилдиметилсилилокси)-4-этилгекс-2-иноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-[4-(трет-бутилдиметилсилилокси)-4-этилгекс-2-иноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 27, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 511,5 [M+Na]+
Пример 29:
(1S,3R,20S)-20-[3-(гидроксиметил)фенилацетилокси]-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя 3-(трет-бутилдиметилсилилоксиметил)фенилуксусную кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 42, вместо 4-триэтилсилилокси-4-метилпентановой кислоты получают (1S,3R,20S)-20-[3-(трет-бутилдиметилсилилоксиметил)фенилацетилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-[3-(трет-бутилдиметилсилилоксиметил)фенилацетилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 503,3 [M+Na]+
Пример 30:
(1S,3R,17β)-17-[(2E)-4-этил-4-гидроксигекс-2-еноилоксиметил]-9,10-секоандроста-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 10, но используя (1R,3R,17β)-1,3-бис(трет-бутилдиметилсилилокси)-17-гидроксиметил-9,10-секоандроста-5Z,7E,10(19)-триен, полученный в соответствии со способом, описанным в Непатентной Ссылке 17, вместо (1S,3R,20S)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрена-5Z,7Z,10(19)-триен-2-ола получают (1S,3R,17β)-17-[(2E)-4-(трет-бутилдиметилсилилокси)-4-этилгекс-2-еноилоксиметил]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секоандроста-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,17β)-17-[(2E)-4-(трет-бутилдиметилсилилокси)-4-этилгекс-2-еноилоксиметил]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секоандроста-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 481,4 [M+Na]+
Пример 31:
(1S,3R,20S)-20-[(3R)-3,4-дигидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя (3R)-3,4-бис(триэтилсилилокси)-4-метилпентановую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 37, вместо 4-триэтилсилилокси-4-метилпентановой кислоты получают (1S,3R,20S)-20-[(3R)-3,4-бис(триэтилсилилокси)-4-метилпентаноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-[(3R)-3,4-бис(триэтилсилилокси)-4-метилпентаноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 485,4 [M+Na]+
Пример 32:
(1S,3R,20S)-20-[5,5,5-трифтор-4-гидрокси-4-(трифторметил)пентаноилокси]-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя 4-(трет-бутилдиметилсилилокси)-5,5,5-трифтор-4-(трифторметил)пентановую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 41, вместо 4-триэтилсилилокси-4-метилпентановой кислоты получают (1S,3R,20S)-20-[4-(трет-бутилдиметилсилилокси)-5,5,5-трифтор-4-(трифторметил)пентаноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-[4-(трет-бутилдиметилсилилокси)-5,5,5-трифтор-4-(трифторметил)пентаноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 577,3 [M+Na]+
Пример 33:
(1S,3R,20S)-20-(3-гидрокси-3-н-пропилгексаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 1, но используя 3-гидрокси-3-н-пропилгексановую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 44, вместо 4-триэтилсилилокси-4-метилпентановой кислоты, получают (1S,3R,20S)-20-(3-гидрокси-3-н-пропилгексаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-(3-гидрокси-3-н-пропилгексаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 511,5 [M+Na]+
Пример 34:
(1S,3R,20S)-20-(5-гидрокси-5-этилгептаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
2,4,6-Трихлорбензоилхлорид (22 мкл) добавляют к тетрагидрофурановому раствору (0,5 мл) 5-триэтилсилилокси-5-этилгептановой кислоты (40 мг), полученной в соответствии со способом, описанным в Непатентной Ссылке 45, и триэтиламину (20 мкл) и затем перемешивают при комнатной температуре в течение 15 часов. После отделения выпавшего кристаллического продукта фильтрованием тетрагидрофуран упаривают и остаток сушат при пониженном давлении. К остатку добавляют безводный толуольный раствор (1 мл) (1S,3R,20S)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-2-ола (26 мг) и 4-диметиламинопиридин (51 мг) в атмосфере аргона и затем перемешивают при комнатной температуре в течение 30 минут. Реакционную жидкость разбавляют этилацетатом, промывают насыщенным водным раствором гидрокарбоната натрия и насыщенным рассолом в указанном порядке, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем, что дает (1S,3R,20S)-20-(5-триэтилсилилокси-5-этилгептаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен (39 мг) в виде бесцветного порошка.
Стадия 2:
Реагент, полученный путем добавления уксусной кислоты (19 мкл) к 1 M раствору тетра(н-бутил)аммонийфторида (0,94 мл), добавляют к безводному тетрагидрофурановому раствору (1 мл) (1S,3R,20S)-20-(5-триэтилсилилокси-5-этилгептаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триена (39 мг), полученному на стадии 1, в атмосфере аргона и затем перемешивают в течение ночи при комнатной температуре. К реакционной жидкости добавляют холодную воду, и затем жидкость подвергают экстракции этилацетатом. Этилацетатный слой промывают насыщенным рассолом, затем сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем и распределительной тонкослойной хроматографии, что дает названное в заголовке соединение (7,1 мг) по изобретению в виде бесцветного порошка.
(+) -ESIMS m/z 511,5 [Mn-Na] +
Пример 35:
(1S,3R,20S)-20-[(4R) или (4S)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 34, но используя 4-(трет-бутилдиметилсилилокси)-5,5,5-трифтор-4-метилпентановую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 41, вместо 5-триэтилсилилокси-5-этилгептановой кислоты получают (1S,3R,20S)-20-[4-(трет-бутилдиметилсилилокси)-5,5,5-трифтор-4-метилпентаноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-[4-(трет-бутилдиметилсилилокси)-5,5,5-трифтор-4-метилпентаноилокси]-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1 и полученный продукт очищают с помощью высокоэффективной жидкостной хроматографии [DAICEL CHIRALPAK AD-RH (4,6×150 мм ID), 55% ацетонитрил-вода, 0,5 мл/мин, 40ºC, УФ 254 нм]. Раствор, содержащий соединение, которое элюировалось первым, концентрируют, что дает названное в заголовке соединение по изобретению.
1H-ЯМР (CDCl3) δ: 0,55 (3H, S), 1,25 (3H, д, J=6,2 Гц), 1,338 (3H, с), 2,51 (2H, т, J=7,2 Гц), 2,85 (1H, т), 4,24 (1H, т), 4,44 (1H, т), 4,98 (1H, т), 4,99 (1H, ушир.с), 5,33 (1H, ушир.с), 6,03 (1H, д, J=11,4 Гц), 6,37 (1H, д, J=11,4 Гц).
Пример 36:
(1S,3R,20S)-20-[(4S) или (4R)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
На стадии фракционирования в высокоэффективной жидкостной хроматографии по методике, указанной в Примере 35, раствор, содержащий соединение, которое элюировалось позже, концентрируют и очищают, что дает названное в заголовке соединение по изобретению. 1H-ЯМР (CDCl3) δ: 0,55 (3H, с), 1,25 (3H, д, J=6,2 Гц), 1,333 (3H, с), 2,51 (2H, т, J=7,2 Гц), 2,85 (1H, т), 4,24 (1H, т), 4,44 (1H, т), 4,98 (1H, т), 4,99 (1H, ушир.с), 5,33 (1H, ушир.с), 6,03 (1H, д, J=11,4 Гц), 6,37 (1H, д, J=11,4 Гц).
Пример 37:
(1S,3R,20S)-20-(6,6,6-трифтор-5-гидрокси-5-метилгексаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 34, но используя 5-триэтилсилилокси-6,6,6-трифтор-5-метилгексановую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 46, вместо 5-триэтилсилилокси-5-этилгептановой кислоты получают (1S,3R,20S)-20-(5-триэтилсилилокси-6,6,6-трифтор-4-метилгексаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
(1S,3R,20S)-20-(5-триэтилсилилокси-6,6,6-трифтор-4-метилгексаноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 34, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 537,4 [M+Na]+
Пример 38:
(1S,3R,20S)-20-(5,5,5-трифтор-4-гидрокси-4-метил-3-оксопентаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 34, но используя 4-триэтилсилилокси-5,5,5-трифтор-4-метилпент-2-иновую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 38, вместо 5-триэтилсилилокси-5-этилгептановой кислоты получают (1S,3R,20S)-20-(4-триэтилсилилокси-5,5,5-трифтор-4-метилпент-2-иноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен.
Стадия 2:
Реагент, полученный путем добавления уксусной кислоты (44,2 мкл) к 1 M раствору фторида тетра(н-бутил)аммония (2,6 мл), добавляют к (1S,3R,20S)-20-(4-триэтилсилилокси-5,5,5-трифтор-4-метилпент-2-иноилокси)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триену (108 мг), полученному на стадии 1, в атмосфере аргона и затем перемешивают в течение 23 часов при комнатной температуре. Затем добавляют реагент, полученный путем добавления уксусной кислоты (22 мкл) к 1 M раствору фторида тетра(н-бутил)аммония (1,25 мл), и перемешивают при комнатной температуре в течение 8,5 часов. После этого реакционную жидкость охлаждают на бане со льдом и добавляют воду. Реакционную жидкость трижды подвергают экстракции хлороформом. Слой хлороформа промывают 1 M водным раствором лимонной кислоты и насыщенным рассолом, затем сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем, что дает названное в заголовке соединение (29 мг) по изобретению в виде порошка белого цвета.
(+) -ESIMS m/z 537,3 [M+Na]+
Пример 39:
(1S,3R,20S)-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,10(19),16-тетраен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 34, но используя 4-триэтилсилилокси-4-метилпентановую кислоту (способ ее получения, например, описан в Непатентной Ссылке 25), вместо 5-триэтилсилилокси-5-этилгептановой кислоты и используя (1S,3R,20S)-1,3-бис(триэтилсилилокси)-20-гидроксипрегна-5,7,16-триен, полученный в соответствии со способом, описанным в Патентной Ссылке 6, вместо (1S,3R,20S)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-20-ола получают (1S,3R,20S)-бис(триэтилсилилокси)-20-(4-триэтилсилилокси-4-метилпентаноилокси)-прегна-5,7,16-триен.
Стадия 2:
(1S,3R,20S)-1,3-бис(триэтилсилилокси)-20-(4-триэтилсилилокси-4-метилпентаноилокси)-прегна-5,7,16-триен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 34, что дает (1S,3R,20S)-1,3-бис(триэтилсилилокси)-20-(4-гидрокси-4-метилпентаноилокси)-прегна-5,7,16-триен.
Стадия 3:
(1S,3R,20S)-1,3-бис(триэтилсилилокси)-20-(4-гидрокси-4-метилпентаноилокси)-прегна-5,7,16-триен, полученный в соответствии с указанной выше стадией 2, обрабатывают, следуя методике, аналогичной методике, представленной в Ссылке 2, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 467,3 [M+Na]+
Пример 40:
(1R,3R,20S)-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 34, но используя 4-триэтилсилилокси-4-метилпентановую кислоту (способ ее получения, например, описан в Непатентной Ссылке 25), вместо 5-триэтилсилилокси-5-этилгептановой кислоты и используя (20S)-дез-A,B-8β-триэтилсилилоксипрегнан-3-ол, полученный в соответствии со способом, описанным в Патентной Ссылке 47, вместо (1S,3R,20S)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-20-ола получают (20S)-дез-A,B-8β-триэтилсилилокси-20-(4-триэтилсилилокси-4-метилпентаноилокси)прегнан.
Стадия 2:
(20S)-дез-A,B-8β-триэтилсилилокси-20-(4-триэтилсилилокси-4-метилпентаноилокси)прегнан, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 34, что дает (20S)-дез-A,B-20-(4-гидрокси-4-метилпентаноилокси)прегнан-8β-ол.
Стадия 3:
В атмосфере аргона дихлорметан (2 мл) добавляют к (20S)-дез-A,B-20-(4-гидрокси-4-метилпентаноилокси)прегнан-8β-олу (42 мг), полученному в соответствии с указанной выше стадией 2, и затем добавляют 4-метилморфолин N-оксид (39 мг) и 4-ангстремовые молекулярные сита (10 мг) и перрутенат тетра-N-пропиламмония (24 мг) и перемешивают в течение 25 минут. Реакционный раствор очищают с помощью хроматографии на колонке с силикагелем, что дает (20S)-дез-A,B-20-(4-гидрокси-4-метилпентаноилокси)прегна-8-он (35 мг) в виде бесцветного масла.
Стадия 4:
В атмосфере аргона триэтиламин (89,8 мкл) и 4-диметиламинопиридин (8 мг) добавляют к дихлорметановому раствору (0,3 мл) (20S)-дез-A,B-20-(4-гидрокси-4-метилпентаноилокси)прегна-8-она (100 мг), полученному в соответствии с указанной выше стадией 3, и затем охлаждают на бане со льдом, к полученной реакционной массе добавляют хлортриэтилсилан (81 мкл) и затем перемешивают при комнатной температуре в течение 20 часов. После охлаждения с помощью бани со льдом к полученной реакционной массе добавляют эфир и воду и раствор трижды подвергают экстракции эфиром. Экстракт сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем, что дает (20S)-дез-A,B-20-(4-триэтилсилилокси-4-метилпентаноилокси)прегнан-8-он (119 мг) в виде бесцветного масла.
(+) -ESIMS m/z 425,4 [M+1]+ 447,4 [M+Na] +
Стадия 5:
В атмосфере аргона безводный тетрагидрофурановый раствор (1,5 мл) оксида {2-[(3'R,5'R)-3',5'-бис(трет-бутилдиметилсилилокси)циклогексилиден]этил}дифенилфосфина (способ его получения, например, описан в Непатентной Ссылке 48) охлаждают на бане со льдом, затем по каплям добавляют гексановый раствор н-бутиллития (1,58 M, 0,06 мл) и перемешивают в течение 30 минут. Затем, после охлаждения до температуры -78ºC, добавляют безводный тетрагидрофурановый раствор (0,3 мл) (20S)-дез-A,B-20-(4-триэтилсилилокси-4-метилпентаноилокси)прегнан-8-она (25 мг), полученного на стадии 4, и перемешивают в течение 3 часов. После нагревания вплоть до температуры 0ºC раствор в дальнейшем перемешивают в течение 19,5 часов. Добавляют насыщенный водный раствор хлорида аммония и полученную реакционную массу трижды подвергают экстракции этилацетатом. Экстракт промывают насыщенным рассолом, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем, что дает (1R,3R,20S)-19-нор-1,3-бис(трет-бутилдиметилсилилокси)-20-(4-триэтилсилилокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен (15 мг) в виде бесцветного масла.
Стадия 6:
(1R,3R,20S)-19-нор-1,3-бис(трет-бутилдиметилсилилокси)-20-(4-триэтилсилилокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен, полученный в соответствии с указанной выше стадией 5, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 34, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 457,4 [M+Na]+
Пример 41:
(1R,3R,20S)-2-метилен-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 5 в Примере 40, но используя {2-[(3'R,5'R)-3',5'-бис(трет-бутилдиметилсилилокси)-4'-
метиленциклогексилиден]этил}дифенилфосфин оксид (способ его получения, например, описан в Непатентной Ссылке 49), вместо {2-[(3'R,5'R)-3',5'-бис(трет-бутилдиметилсилилокси)циклогексилиден]этил}дифенилфосфина оксида получают (1R,3R,20S)-2-метилен-19-нор-1,3-бис(трет-бутилдиметилсилилокси)-20-(4-триэтилсилилокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен.
Стадия 2:
(1R,3R,20S)-2-метилен-19-нор-1,3-бис(трет-бутилдиметилсилилокси)-20-(4-триэтилсилилокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 34, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 469,5 [M+Na]+
Пример 42:
(1R,3R,20S)-19-нор-20-[(2E)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол
Стадия 1:
Пиридин (0,28 мл) и дихлорметан (1 мл) добавляют к (20S)-дез-A,B-8β-триэтилсилилоксипрегнан-20-олу (361 мг), полученному в соответствии со способом, описанным в Патентной Ссылке 47. После охлаждения на бане со льдом к полученной реакционной массе добавляют уксусный ангидрид (0,22 мл) и затем перемешивают при комнатной температуре в течение 21 часа. В дальнейшем добавляют пиридин (0,14 мл) и уксусный ангидрид (0,11 мл) и перемешивают в течение 18 часов. Реакционную жидкость концентрируют при пониженном давлении и остаток очищают с помощью хроматографии на колонке с силикагелем, что дает (20S)-дез-A,B-8β-триэтилсилилокси-20-ацетоксипрегнан (336 мг) в виде бесцветного масла.
Стадия 2:
Тетрагидрофурановый раствор тетра(н-бутил)аммония (1 M, 9,42 мл) добавляют к (20S)-дез-A,B-8β-триэтилсилилокси-20-ацетоксипрегнану (334 мг), полученному в соответствии с указанной выше стадией 1, с охлаждением на бане со льдом, с перемешиванием при комнатной температуре в течение 22 часов и затем вновь охлаждают на бане со льдом. Туда добавляют воду и эфир и полученную реакционную массу подвергают трижды экстракции эфиром. Экстракт промывают 1 M водным раствором лимонной кислоты и насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем, что дает (20S)-дез-A,B-20-ацетоксипрегнан-8β-ол (230 мг) в виде бесцветного масла.
Стадия 3:
В соответствии со способом, аналогичным способу, представленному на стадии 3 в Примере 40, но используя (20S)-дез-A,B-20-ацетоксипрегнан-8β-ол, полученный в соответствии с указанной выше стадией 2, вместо (20S)-дез-A,B-20-(4-гидрокси-4-метилпентаноилокси)прегнан-8β-ола получают (20S)-дез-A,B-20-ацетоксипрегнан-8-он.
Стадия 4:
В соответствии со способом, аналогичным способу, представленному на стадии 5 в Примере 40, но используя (20S)-дез-A,B-20-ацетоксипрегнан-8-он, полученный в соответствии с указанной выше стадией 3, вместо (20S)-дез-A,B-20-(4-триэтилсилилокси-4-метилпентаноилокси)прегнан-8-она получают (1R,3R,20S)-19-нор-1,3-бис(трет-бутилдиметилсилилокси)-20-ацетокси-9,10-секопрегна-5Z,7E-диен.
Стадия 5:
Тетрагидрофуран (1 мл)-метаноловый (1 мл) раствор (1R,3R,20S)-19-нор-1,3-бис(трет-бутилдиметилсилилокси)-20-ацетокси-9,10-секопрегна-5Z,7E-диена (120 мг), полученный в соответствии с указанной выше стадией 4, охлаждают на бане со льдом. К полученной реакционной массе добавляют 10% водный раствор гидроксида калия (0,5 мл) и затем перемешивают при комнатной температуре в течение 14,5 часов. В дальнейшем добавляют 10% водный раствор гидроксида калия (0,25 мл) и перемешивают в течение 4,5 часов. Затем добавляют 10% водный раствор гидроксида калия (0,25 мл) и перемешивают в течение 20 часов. Тетрагидрофуран и метанол удаляют путем концентрирования при пониженном давлении. Затем к полученной массе добавляют воду, и водный раствор трижды подвергают экстракции этилацетатом. После промывания насыщенным водным раствором хлорида натрия реакционную массу сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем, что дает (1R,3R,20S)-19-нор-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E-диен-20-ол (94 мг) в виде порошка белого цвета.
Стадия 6:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 34, но используя (2E)-4-триэтилсилилокси-4-этилгекс-2-еновую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 28, вместо 5-триэтилсилилокси-5-этилгептановой кислоты и используя (1R,3R,20S)-19-нор-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E-диен-20-ол, полученный в соответствии с указанной выше стадией 5, вместо (1R,3R,20S)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-20-ола получают (1R,3R,20S)-19-нор-1,3-бис(трет-бутилдиметилсилилокси)-20[[(2E)-4-этил-4-триэтилсилилоксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен.
Стадия 7:
(1R,3R,20S)-19-нор-1,3-бис(трет-бутилдиметилсилилокси)-20[[(2E)-4-этил-4-триэтилсилилоксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен, полученный в соответствии с указанной выше стадией 6, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 34, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 483,4 [M+Na]+
Пример 43:
(1R,3R,20S)-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 6 в Примере 42, но используя 4-триэтилсилилокси-5,5,5-трифтор-4-метилпентановую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 41, вместо (2E)-4-триэтилсилилокси-4-этилгекс-2-еновой кислоты получают (1R,3R,20S)-19-нор-1,3-бис(трет-бутилдиметилсилилокси)-20-(4-триэтилсилокси-5,5,5-трифтор-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен.
Стадия 2:
(1R,3R,20S)-19-нор-1,3-бис(трет-бутилдиметилсилилокси)-20-(4-триэтилсилокси-5,5,5-трифтор-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 34, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 511,4 [M+Na]+
Пример 44:
(1R,3R,20S)-2-метилен-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 4 в Примере 42, но используя оксид {2-[(3'R,5'R)-3',5'-бис(трет-бутилдиметилсилилокси)-4'-метиленциклогексилиден]этил}дифенилфосфина (способ его получения, например, описан в Непатеной Ссылке 49), вместо оксида {2-[(3'R,5'R)-3',5'-бис(трет-бутилдиметилсилилокси)циклогексилиден]этил}дифенилфосфина получают (1R,3R,20S)-19-нор-2-метилен-1,3-бис(трет-бутилдиметилсилилокси)-20-ацетокси-9,10-секопрегна-5Z,7E-диен.
Стадия 2:
3 M Водный раствор гидроксида натрия (0,2 мл) добавляют к тетрагидрофуран (5 мл)-метаноловому (5 мл) раствору (1R,3R,20S)-19-нор-2-метилен-1,3-бис(трет-бутилдиметилсилилокси)-20-ацетокси-9,10-секопрегна-5Z,7E-диена (140 мг), полученному в соответствии с указанной выше стадией 1, и затем перемешивают при комнатной температуре в течение 3 часов. В дальнейшем добавляют 3 M водный раствор гидроксида натрия (0,2 мл), перемешивают в течение 4 часов, затем нагревают вплоть до 45ºC и перемешивают в течение 13 часов. Тетрагидрофуран и метанол удаляют путем концентрирования при пониженном давлении, затем к полученной реакционной массе добавляют воду и водный раствор дважды подвергают экстракции эфиром. Экстракт промывают водой и насыщенным водным раствором хлорида натрия, затем сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем, что дает (1R,3R,20S)-19-нор-2-метилен-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E-диен-20-ол (93 мг) в виде бесцветного масла.
Стадия 3:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 43, но используя (1R,3R,20S)-19-нор-2-метилен-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E-диен-20-ол, полученный в соответствии с указанной выше стадией 2, вместо (1R,3R,20S)-19-нор-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E-диен-20-ола получают (1R,3R,20S)-19-нор-2-метилен-1,3-бис(трет-бутилдиметилсилилокси)-20-(4-триэтилсилилокси-5,5,5-трифтор-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен.
Стадия 4:
(1R,3R,20S)-19-нор-2-метилен-1,3-бис(трет-бутилдиметилсилилокси)-20-(4-триэтилсилилокси-5,5,5-трифтор-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 34, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 501,6 [M+1]+ 523,4 [M+Na] +
Пример 45:
(1R,3R,20S)-2-метилен-19-нор-20-[(2E)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 3 в Примере 44, но используя (2E)-4-триэтилсилилокси-4-этилгекс-2-еновую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 28, вместо 4-триэтилсилилокси-5,5,5-трифтор-4-метилпентановой кислоты получают (1R,3R,20S)-19-нор-2-метилен-1,3-бис(трет-бутилдиметилсилилокси)-20-[(2E)-4-этил-4-триэтилсилилоксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен.
Стадия 2:
(1R,3R,20S)-19-нор-2-метилен-1,3-бис(трет-бутилдиметилсилилокси)-20-[(2E)-4-этил-4-триэтилсилилоксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 34, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 473,4[M+1]+, 495,6 [M+Na]+
Пример 46:
(1R,3R,20S)-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен-1,3-диол
Стадия 1:
В атмосфере аргона с охлаждением на бане со льдом гидрокарбонат натрия (1,06 г) и m-хлорпербензойную кислоту (65%, 1,04 г) добавляют к безводному дихлорметановому раствору (50 мл) (Z)-дез-A,B-8β-триэтилсилилоксипрегн-17(20)-ена (1,48 г), полученному в соответствии с Непатентной Ссылкой 47. После перемешивания в течение 30 минут раствор очищают с помощью хроматографии на колонке с силикагелем, что дает дез-A,B-8β-триэтилсилилокси-17α,20α-эпоксипрегнан (858 мг) в виде бесцветного масла.
Стадия 2:
В атмосфере аргона с охлаждением на бане со льдом гексановый раствор (24,0 мл) 0,92 M диэтилалюминийхлорид добавляют к безводному толуоловому раствору (14 мл) 2,0 M литий диизопропиламид/гептан-тетрагидрофуранэтилбензольный раствор (16,6 мл). После перемешивания в течение часа к полученной реакционной массе добавляют толуольный раствор (24 мл) дез-A,B-8β-триэтилсилилокси-17α,20α-эпоксипрегнана (858 мг), полученный в соответствии с указанной выше стадией 1. После последующего перемешивания в течение 3,5 часов к полученной реакционной массе добавляют насыщенный водный раствор гидрокарбоната натрия и фильтруют через Целит. Реакционную массу подвергают экстракции этилацетатом, экстракт сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем, что дает (20S)-дез-A,B-8β-триэтилсилилоксипрегн-6-ен-20-ол (644 мг) в виде масла бледно-желтого цвета.
Стадия 3:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 34, но используя 4-триэтилсилилокси-4-метилпентановую кислоту (например, способ ее получения описан в Непатентной Ссылке 25), вместо 5-триэтилсилилокси-5-этилгептановой кислоты и используя (20S)-дез-A,B-8β-триэтилсилилоксипрегн-16-ен-20-ол, полученный в соответствии с указанной выше стадией 2, вместо (1S,3R,20S)-1,3-бис(трет-бутилдиметилсилилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-20-ола получают (20S)-дез-A,B-8β-триэтилсилилокси-20-(4-триэтилсилилокси-4-метилпентаноилокси)прегн-16-ен.
Стадия 4:
(20S)-дез-A,B-8β-триэтилсилилокси-20-(4-триэтилсилилокси-4-метилпентаноилокси)прегн-16-ен, полученный в соответствии с указанной выше стадией 3, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 34, что дает (20S)-дез-A,B-20-(4-гидрокси-4-метилпентаноилокси)прегн-16-ен-8β-ол.
Стадия 5:
В соответствии со способом, аналогичным способу, представленному на стадии 3 в Примере 40, но используя (20S)-дез-A,B-20-(4-гидрокси-4-метилпентаноилокси)прегн-16-ен-8β-ол, полученный в соответствии с указанной выше стадией 4, вместо (20S)-дез-A,B-20-(4-гидрокси-4-метилпентаноилокси)прегнан-8β-ола получают (20S)-дез-A,B-20-(4-гидрокси-4-метилпентаноилокси)прегн-16-ен-8-он.
Стадия 6:
В соответствии со способом, аналогичным способу, представленному на стадии 4 в Примере 40, но используя (20S)-дез-A,B-20-(4-гидрокси-4-метилпентаноилокси)прегн-16-ен-8-он, полученный в соответствии с указанной выше стадией 5, вместо (20S)-дез-A,B-20-(4-гидрокси-4-метилпентаноилокси)прегнан-8-она получают (20S)-дез-A,B-20-(4-триэтилсилилокси-4-метилпентаноилокси)прегн-16-ен-8-он.
Стадия 7:
В соответствии со способом, аналогичным способу, представленному на стадии 5 в Примере 40, но используя (20S)-дез-A,B-20-(4-триэтилсилилокси-4-метилпентаноилокси)прегн-16-ен-8-он, полученный в соответствии с указанной выше стадией 6, вместо (20S)-дез-A,B-20-(4-триэтилсилилокси-4-метилпентаноилокси)прегнан-8-она и используя оксид {2-[(3'R,5'R)-3',5'-бис(4-триэтилсилилокси)циклогексилиден]этил}дифенилфосфина полученный в соответствии с Непатентной Ссылкой 48, вместо оксида {2-[(3'R,5'R)-3',5'-бис(трет-бутилдиметилсилилокси)циклогексилиден]этил}дифенилфосфина, получают (1R,3R,20S)-19-нор-1,3-бис(триэтилсилилокси)-20-(4-триэтилсилилокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен.
Стадия 8:
(1R,3R,20S)-19-нор-1,3-бис(триэтилсилилокси)-20-(4-триэтилсилилокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен, полученный в соответствии с указанной выше стадией 7, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 34, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 455,4 [M+Na]+
Пример 47:
(1R,3R,20S)-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 3 в Примере 46, но используя 4-триэтилсилилокси-5,5,5-трифтор-4-метилпентановую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 41, вместо 4-триэтилсилилокси-4-метилпентановой кислоты, получают (20S)-дез-A,B-8p-(триэтилсилилокси)-20-(4-триэтилсилилокси-5,5,5-трифтор-4-метилпентаноилокси)прегн-16-ен.
Стадия 2:
(20S)-дез-A,B-8β-(триэтилсилилокси)-20-(4-триэтилсилилокси-5,5,5-трифтор-4-метилпентаноилокси)прегн-16-ен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 34, что дает (20S)-дез-A,B-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)прегн-16-ен-8β-ол.
Стадия 3:
В соответствии со способом, аналогичным способу, представленному на стадии 3 в Примере 40, но используя (20S)-дез-A,B-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)прегн-16-ен-8β-ол, полученный в соответствии с указанной выше стадией 2, вместо (20S)-дез-A,B-20-(4-гидрокси-4-метилпентаноилокси)прегнеп-8β-ола получают (20S)-дез-A,B-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)прегн-16-ен-8-он.
Стадия 4:
В соответствии со способом, аналогичным способу, представленному на стадии 4 в Примере 40, но используя (20S)-дез-A,B-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)прегн-16-ен-8-он, полученный в соответствии с указанной выше стадией 3, вместо (20S)-дез-A,B-20-(4-гидрокси-4-гаэтилпентаноилокси)прегнан-8-она и используя хлортриметилсилан вместо хлортриэтилсилана получают (20S)-дез-A,B-20-(5,5,5-трифтор-4-триметилсилилокси-4-метилпентаноилокси)прегн-16-ен-8-он.
Стадия 5:
В соответствии со способом, аналогичным способу, представленному на стадии 5 в Примере 40, но используя (20S)-дез-A,B-20-(5,5,5-трифтор-4-триметилсилилокси-4-метилпентаноилокси)прегн-16-ен-8-он, полученный в соответствии с указанной выше стадией 4, вместо (20S)-дез-A,B-20-(4-триэтилсилилокси-4-метилпентаноилокси)прегнан-8-она и используя оксид {2-[(3'R,5'R)-3',5'-бис(триэтилсилилокси)циклогексилиден]этил}дифенилфосфина, полученному в соответствии с Непатентной Ссылкой 48, вместо оксида {2-[(3'R,5'R)-3',5'-бис(трет-бутилдиметилсилилокси)циклогексилиден]этил}дифенилфосфина получают (1R,3R,20S)-19-нор-1,3-бис(триэтилсилилокси)-20-(5,5,5-трифтор-4-триметилсилилокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен.
Стадия 6:
(1R,3R,20S)-19-нор-1,3-бис(триэтилсилилокси)-20-(5,5,5-трифтор-4-триметилсилилокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен, полученный в соответствии с указанной выше стадией 5, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 1, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 509,4 [M+Na]+
Пример 48:
(1R,3R,20S)-19-нор-2-метилен-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 7 в Примере 46, но используя оксид 2-[(3'R,5'R)-3',5'-бис(триэтилсилилокси)-4'-метиленциклогексилиден]этил]дифенилфосфина, полученный в соответствии с Непатентной Ссылкой 49, вместо оксида 2-[(3'R,5'R)-3',5'-бис(триэтилсилилокси)циклогексилиден]этил}дифенилфосфина получают (1R,3R,20S)-19-нор-2-метилен-1,3-бис(триэтилсилилокси)-20-(4-триэтилсилилокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен.
Стадия 2:
(1R,3R,20S)-19-нор-2-метилен-1,3-бис(триэтилсилилокси)-20-(4-триэтилсилилокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 34, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 445,4[M+1]+, 467,4 [M+Na]+
Пример 49:
(1S,3R,20S)-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,10(19),16-тетраен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 5 в Примере 47, но используя оксид [3'S-(1'Z,3β,5α)]-{2-[3',5'-бис(триэтилсилилокси)-2'-метиленциклогексилиден]этил}дифенилфосфина, полученный в соответствии с Непатентной Ссылкой 50, вместо оксида {2-[(3'R,5'R)-3',5'-бис(триэтилсилилокси)циклогексилиден]этил}дифенилфосфина получают (1S,3R,20S)-1,3-бис(триэтилсилилокси)-20-[5,5,5-трифтор-4-(триметилсилилокси)-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,10(19),16-тетраен.
Стадия 2:
(1S,3R,20S)-1,3-бис(триэтилсилилокси)-20-[5,5,5-трифтор-4-(триметилсилилокси)-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,10(19),16-тетраен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 34, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 521,4 [M+Na]+
Пример 50:
(1R,2α,3R,20S)-2-метил-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол
Безводный бензол (10 мл) насыщают газом водородом, затем добавляют хлорид трис(трифенилфосфин)родия (34 мг) и перемешивают, что дает однородный раствор. Добавляют безводный бензольный раствор (1 мл) (1R,3R,20S)-2-метилен-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диола (8 мг), полученный в Примере 41, перемешивают в течение 1,5 часов, затем продувают аргоном и концентрируют при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем и затем фракционируют с помощью высокоэффективной жидкостной хроматографии [YMC Pack ODS-AM (150×20 мм ID), 50% ацетонитрил-вода, 10 мл/мин, УФ 254 нм]. Раствор, содержащий соединение, которое элюировалось позже, концентрируют и очищают, что дает названное в заголовке соединение (1,9 мг) по изобретению в виде бесцветного порошка.
1H-ЯМР (CDCl3) δ: 0,54 (3H, с), 1,13 (3H, д, J=7,0 Гц), 1,23 (6H, с), 1,23 (3H, д, J=6,2 Гц), 2,39 (2H, т, J=8,0 Гц), 2,60 (1H, дд, J=13,2 Гц, J=4,0 Гц), 2,79 (1H, дд, J=13,2 Гц, J=5,0 Гц), 3,62 (1H, дт, J=9,2 Гц, J=4,4 Гц), 3,97 (1H, ушир.с), 4,95 (1H, квинт, J=6,2 Гц), 5,83 (1H, д, J=11,2 Гц), 6,36 (1H, д, 11,2 Гц)
(+) -ESIMS m/z 449,4 [M+1]+, 471,4 [M+Na]+
Пример 51:
(1R,2β,3R,20S)-2-метил-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол
На стадии фракционирования с помощью высокоэффективной жидкостной хроматографии по методике, указанной в Примере 50, раствор, содержащий соединение, которое элюировалось первым, затем концентрируют и очищают, что дает названное в заголовке соединение (2,1 мг) по изобретению в виде бесцветного порошка. 1H-ЯМР (CDCl3) δ: 0,55 (3H, с), 1,15 (3H, д, J=6,6 Гц), 1,24 (6H, с), 1,24(3H, д, J=6,2 Гц), 2,40 (2H, т, J=7,2 Гц), 2,83 (1H, д, J=10 Гц), 3,08 (1H, дд, J=13,6 Гц, J=4,0 Гц), 3,50 (1H, м), 3,91 (1H, ушир.с), 4,96 (1H, квинт, J=6,2 Гц), 5,88 (1H, д, J=10,9 Гц), 6,25 (1H, д, 10,9 Гц)
(+) -ESIMS m/z 449,4[M+1]+, 471,4 [M+Na]+
Пример 52:
(1R,3R,20S)-2-метил-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол
В соответствии со способом, аналогичным способу получения соединения, представленному в Примере 50, но используя (1R,3R,20S)-2-метилен-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол, полученный в Примере 44, вместо (1R,3R,20S)-2-метилен-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диола, получают указанное в заголовке соединение по изобретению.
(+) -ESIMS m/z 525,4 [M+Na]+
Пример 53:
(1R,3R,20S)-2-метил-19-нор-20-[(2E)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол
В соответствии со способом, аналогичным способу получения соединения, представленному в Примере 50, но используя (1R,3R,20S)-2-метилен-19-нор-20-[(2E)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол, полученный в Примере 45, вместо (1R,3R,20S)-2-метилен-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диола получают указанное в заголовке соединение по изобретению.
EIMS m/z 474 M+
Пример 54:
(1R,3R,20S)-19-нор-2-метил-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен-1,3-диол
В соответствии со способом, аналогичным способу получения соединения, представленному в Примере 50, но используя (1R,3R,20S)-19-нор-2-метилен-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен-1,3-диол, полученный в Примере 48, вместо (1R,3R,20S)-2-метилен-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диола получают указанное в заголовке соединение по изобретению.
(+) -ESIMS 469,4 [M+Na]+
Пример 55:
(1R,3R,20S)-19-нор-2-метилен-20-[(4S)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,16-триен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 1 в Примере 48, но используя (20S)-дез-A,B-20-[5,5,5-трифтор-4-(триметилсилилокси)-4-метилпентаноилокси]прегн-16-ен-8-он, полученный на стадии 4 в Примере 47, вместо (20S)-дез-A,B-20-(4-триэтилсилилокси-4-метилпентаноилокси)прегн-16-ен-8-она получают (1R,3R,20S)-19-нор-2-метилен-1,3-бис(триэтилсилилокси)-20-[5,5,5-трифтор-4-(триметилсилилокси)-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,16-триен.
Стадия 2:
(1R,3R,20S)-19-нор-2-метилен-1,3-бис(триэтилсилилокси)-20-[5,5,5-трифтор-4-(триметилсилилокси)-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,16-триен, полученный на стадии 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 34, и затем фракционируют с помощью высокоэффективной жидкостной хроматографии [DAICEL CHIRALPAK AD (20×250 мм ID), 15% изопропанол-гексан, 8 мл/мин, УФ 254 нм]. Раствор, содержащий соединение, которое элюировалось первым, затем концентрируют и очищают, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 521,4 [M+Na] +
1H-ЯМР (CDCl3) δ: 0,784 (3H, с), 1,333 (3H, с), 1,385(3H, д, J=6,6 Гц), 2,83 (2H, м), 3,23{1H, ушир.с), 4,49 (2H, м), 5,12 (2H, д, J=4,0 Гц), 5,478 (1H, кв., 6,6 Гц), 5,71 (1H, ушир.с), 5,975 (1H,д, J=11,0 Гц), 6,344 (1H, д, J=11,0 Гц).
Пример 56:
(1R,3R,20S)-19-нор-2-метилен-20-[(4R)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,16-триен-1,3-диол
На стадии фракционирования с помощью высокоэффективной жидкостной хроматографии по методике, указанной в Примере 55, раствор, содержащий соединение, которое элюировалось позже, концентрируют и очищают, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 521,4 [M+Na]+
1H-ЯМР (CDCl3) δ: 0,782 (3H, с), 1,335 (3H, с), 1,383 (3H, д, J=6,6 Гц), 2,83 (2H, м), 4,51 (2H, м), 5,11 (2H,д, J=4,0 Гц), 5,475 (1H, кв., 6,6 Гц), 5,71 (1H, ушир.с), 5,976 (1H, д, J=11,4 Гц), 6,345 (1H, д, J=11,4 Гц).
Пример 57:
(1R,3R,20S)-2-метилен-19-нор-20-(5-гидрокси-5-метилгексаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу, представленному на стадии 3 в Примере 44, но используя 5-триэтилсилилокси-5-метилгексановую кислоту, полученную в соответствии со способом, описанным в Непатентной Ссылке 26, вместо 4-триэтилсилилокси-5,5,5-трифтор-4-метилпентановой кислоты получают (1R,3R,20S)-19-нор-2-метилен-1,3-бис(трет-бутилдиметилсилилокси)-20-(5-триэтилсилилокси-5-метилгексаноилокси)-9,10-секопрегна-5Z,7E-диен.
Стадия 2:
(1R,3R,20S)-19-нор-2-метилен-1,3-бис(трет-бутилдиметилсилилокси)-20-(5-триэтилсилилокси-5-метилгексаноилокси)-9,10-секопрегна-5Z,7E-диен, полученный в соответствии с указанной выше стадией 1, обрабатывают, следуя методике, аналогичной методике, представленной на стадии 2 в Примере 34, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 461,4[M+1]+, 483,4 [M+Na]+, 499,5 [M+K] +
Пример 58:
(1R,2α,3R,20S)-2-метил-19-нор-20-(5-гидрокси-5-метилгексаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол
Стадия 1:
В соответствии со способом, аналогичным способу получения соединения, представленному в Примере 50, но используя (1R,3R,20S)-2-метилен-19-нор-20-(5-гидрокси-5-метилгексаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол, полученный в Примере 57, вместо (1R,3R,20S)-2-метилен-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диола, концентрирования и очистки раствора, содержащего соединение, которое элюировалось позже на стадии фракционирования с помощью высокоэффективной жидкостной хроматографии, получают указанное в заголовке соединение по изобретению.
1H-ЯМР (CDCl3) δ: 0,54 (3H, с), 1,13 (3H, д, J=6,6 Гц), 1,23 (3H, д, J=6,2 Гц), 1,23 (6H, с), 2,28 (2H, т, J=7,4 Гц), 2,60 (1H, дд, J=13,0, 4,0 Гц), 2,80 (2H, т), 3,63 (1H, м), 3,97 (1H, ушир.с), 4,95 (1H, квинт, J=6,2 Гц), 5,83 (1H, д, J=11,2 Гц), 6,36 (1H, д, J=11,2 Гц).
(+) -ESIMS m/z 463,4 [M+1]+, 485,4 [M+Na]+, 501,4 [M+K]+
Пример 59:
(1R,2β,3R,20S)-2-метил-19-нор-20-(5-гидрокси-5-метилгексаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол
Стадия 1:
На стадии фракционирования с помощью высокоэффективной жидкостной хроматографии по методике, указанной в Примере 58, раствор, содержащий соединение, которое элюировалось первым, затем концентрируют и очищают, что дает названное в заголовке соединение по изобретению.
1H-ЯМР (CDCl3) δ: 0,55 (3H, с), 1,14 (3H, д, J=6,6 Гц), 1,23 (3H, д, J=6,2 Гц), 1,23 (6H, с), 2,29 (2H, т, J=7,4 Гц), 2,37 (2H, м), 2,81 (1H, м), 3,07 (1H, дд, J=12,6, 4,4 Гц), 3,51 (1H, м), 3,91 (1H, ушир.с), 4,96 (1H, квинт, J=6,2 Гц), 5,88 (1H, д, J=11,2 Гц), 6,25 (1H, д, J=11,2 Гц).
(+) -ESIMS m/z 463,3 [M+1]+, 485,5 [M+Na]+, 501,5 [M+K]+
Пример 60:
(1R,2α,3R,20S)-2-метил-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол
(1R,3R,20S)-2-метил-19-нор-20-(4-гидрокси-5,5,5-трифтор-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол, полученный в Примере 52, очищают с помощью высокоэффективной жидкостной хроматографии [YMC Pack ODS-AM (150×20 мм ID), 55% ацетонитрил-вода, 10 мл/мин, УФ 254 нм] и раствор, содержащий соединение, которое элюировалось позже, концентрируют и очищают, что дает названное в заголовке соединение по изобретению.
1H-ЯМР (CDCl3) δ: 0,54 (3H, с), 1,13 (3H, д, J=7. 0 Гц), 1,25 (3H, д, J=6,0 Гц), 1,335 (3H, с), 2,51 (2H, т, J=7,0 Гц), 2,80 (2H, м), 3,65 (1H, м), 3,97 (1H, ушир.с), 4,98 (1H, квинт, J=6,0 Гц), 5,83 (1H, д, J=11,2 Гц), 6,36 (1H, д, J=11,2 Гц).
Пример 61:
(1R,2β,3R,20S)-2-метил-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол
На стадии фракционирования с помощью высокоэффективной жидкостной хроматографии по методике, указанной в Примере 60, раствор, содержащий соединение, которое элюировалось первым, затем концентрируют и очищают, что дает названное в заголовке соединение по изобретению.
1H-ЯМР (CDCl3) δ: 0,55 (3H, с), 1,15 (3H, д, J=7,0 Гц), 1,25 (3H, д, J=6,0 Гц), 1,338 (3H, с), 2,51 (2H, т, J=7,0 Гц), 2,82 (1H, д, J=12,0 Гц), 3,08 (1H, дд, J=12,0, 4,4 Гц), 3,51 (1H, м), 3,91 (1H, ушир.с), 4,98 (1H, квинт, J=6,0 Гц), 5,88 (1H, д, J=11,2 Гц), 6,25 (1H, д, J=11,2 Гц).
Пример 62:
(1R,2α,3R,20S)-19-нор-2-метил-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен-1,3-диол
(1R,3R,20S)-2-метил-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен-1,3-диол, полученный в Примере 54, очищают с помощью высокоэффективной жидкостной хроматографии в соответствии с методикой, аналогичной методике, представленной в Примере 50, и раствор, содержащий соединение, которое элюировалось позже, концентрируют и очищают, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 469,4 [M+Na]+
1H-ЯМР (CDCl3) δ: 0,77 (3H, с), 1,14 (3H, д, J=6,6 Гц), 1,23 (6H, с), 1,37 (3H, д, J=6,2 Гц), 1,82 (2H, т, J=8,0 Гц), 2,43 (2H, т, J=8,0 Гц), 2,61 (1H, дд, J=12,6, 4,4 Гц), 2,80 (1H, дд, J=14,0, 4,8 Гц), 3,63 (1H, м), 3,97 (1H, м), 5,46 (1H, кв., J=6,2 Гц), 5,70 (1H, ушир.с), 5,91 (1H, д, J=11,2 Гц), 6,36 (1H, д, J=11,2 Гц).
Пример 63:
(1R,2β,3R,20S)-19-нор-2-метил-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен-1,3-диол
На стадии фракционирования с помощью высокоэффективной жидкостной хроматографии по методике, указанной в Примере 62, раствор, содержащий соединение, которое элюировалось первым, затем концентрируют и очищают, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 469,4 [M+Na]+
1H-ЯМР (CDCl3) δ: 0,78 (3H, с), 1,15 (3H, д, J=6,6 Гц), 1,23 (6H, с), 1,37 (3H, д, J=6,2 Гц), 1,82 (2H, т, J=8,0 Гц), 2,44 (2H, т, J=8,0 Гц), 2,79 (1H, ушир. д, J=9,6 Гц), 3,09 (1H, дд, J=12,3, 4,6 Гц), 3,53 (1H, м), 3,91 (1H, ушир.с), 5,47 (1H, кв., J=6,6 Гц), 5,71 (1H, ушир.с), 5,96 (1H, д, J=11,2 Гц), 6,25 (1H, д, J=11,2 Гц).
Пример 64:
(1R,2β,3R,20S)-2-метил-19-нор-20-[(2E)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол
(1R,3R,20S)-2-метил-19-нор-20-[(2E)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол, полученный в Примере 53, очищают с помощью высокоэффективной жидкостной хроматографии [YMC Pack ODS-AM (150×20 мм ID), 55% ацетонитрил-вода, 10 мл/мин, УФ 254 нм]. Раствор, содержащий соединение, которое элюировалось первым, затем концентрируют и затем фракционируют с помощью HPLC [CHIRALPAK AD (20×250 мм ID), Гексан-EtOH=80:20, 10 мл/мин, УФ 254 нм]. Раствор, содержащий соединение, которое элюировалось первым, затем концентрируют и очищают, что дает названное в заголовке соединение (1,8 мг) по изобретению.
(+) -ESIMS m/z 497,4 [MiNa]+, 475,3 [M+1]+
1H-ЯМР (CDCl3) δ: 0,56 (3H, с), 0,88 (6H, т, J=7,2 Гц), 1,15 (3H, д, J=6,6 Гц), 1,28 (3H, д, J=7,0 Гц), 2,38 (2H, м), 2,81 (1H, ушир. д, J=14,0 Гц), 3,09 (1H, дд, J=12,4, 4,6 Гц), 3,52 (1H, тд, J=10,1, 4,4 Гц), 3,91 (1H, ушир.с), 5,02 (1H, квинт, J=6,2 Гц), 5,88 (1H, д, J=11,2 Гц), 6,00 (1H, д, J=15,8 Гц), 6,25 (1H, д, J=11,2 Гц), 6,85 (1H, д, J=15,8 Гц).
Пример 65:
(1R,2α,3R,20S)-2-метил-19-нор-20-[(2E)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол
(1R,3R,20S)-2-метил-19-нор-20-[(2E)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол, полученный в Примере 53, очищают с помощью высокоэффективной жидкостной хроматографии [YMC Pack ODS-AM (150×20 мм ID), 55% ацетонитрил-вода, 10 мл/мин, УФ 254 нм]. Раствор, содержащий соединение, которое элюировалось позже, концентрируют и затем распределяют с помощью HPLC [CHIRALPAK AD (20×250 мм ID), Гексан-EtOH=80:20, 10 мл/мин, УФ 254 нм]. Раствор, содержащий соединение, которое элюировалось первым, концентрируют и очищают, что дает названное в заголовке соединение (2,2 мг) по изобретению.
(+) -ESIMS m/z 497,5 [M+Na]+, 475,3 [M+1]+
1H-ЯМР (CDCl3) δ: 0,55 (3H, S), 0,88 (6H, т, J=7,2 Гц), 1,13 (3H, д, J=6,6 Гц), 1,27 (3H, д, J=7,0 Гц), 2,60 (1H, дд, J=13,2, 4,4 Гц), 2,79 (2H, м), 3,62 (1H, тд, J=9,2, 4,8 Гц), 3,95 (1H, ушир.с), 5,02 (1H, квинт, J=6,2 Гц), 5,84 (1H, д, J=11,2 Гц), 5,99 (1H, д, J=15,2 Гц), 6,36 (1H, д, J=11,2 Гц), 6,85 (1H, д, J=15,2 Гц).
Пример 66:
(1R,2β,3R,20S)-2-метил-19-нор-20-[4-этил-4-гидроксигексаноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол
Безводный бензол (10 мл) насыщают газом водородом, затем добавляют хлорид (трифенилфосфин)родия (39 мг) и затем перемешивают, что дает однородный раствор. Добавляют безводный бензольный раствор (3 мл) (1R,3R,20S)-2-метилен-19-нор-20-[(2E)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диола (10 мг), полученный в Примере 45, перемешивают в течение часа, затем продувают аргоном и концентрируют при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем и затем фракционируют с помощью высокоэффективной жидкостной хроматографии [YMC Pack ODS-AM (150×20 мм ID), 55% ацетонитрил-вода, 10 мл/мин, УФ 254 нм]. Раствор, содержащий соединение, которое элюировалось первым, затем концентрируют и затем фракционируют с помощью HPLC [CHIRALPAK AD (20×250 мм ID), Гексан-EtOH=80:20, 10 мл/мин, УФ 254 нм]. Раствор, содержащий соединение, которое элюировалось позже, концентрируют и очищают, что дает названное в заголовке соединение (0,9 мг) по изобретению в виде бесцветного порошка.
(+) -ESIMS m/z 499,5 [M+Na]+, 477,4 [M+1]+
1H-ЯМР (CDCl3) δ: 0,55 (3H, с), 0,87 (6H, т, J=I,2 Гц), 1,15 (3H, д, J=6,6 Гц), 1,24 (3H, д, J=7,0 Гц), 2,34 (2H, т, J=7,0 Гц), 2,82 (1H, ушир. д, J=11,0 Гц), 3,09 (1H, м), 3,51 (1H, м), 3,92 (1H, ушир.с), 4,95 (1H, квинт, J=6,2 Гц), 5,88 (1H, д, J=11,2 Гц), 6,25 (1H, д, J=11,2 Гц).
Пример 67:
(1R,2α,3R,20S)-2-метил-19-нор-20-[4-этил-4-гидроксигексаноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол
Безводный бензол (10 мл) насыщают газом водородом, затем добавляют хлорид трис(трифенилфосфин)родия (39 мг) и затем перемешивают, что дает однородный раствор. Добавляют безводный бензольный раствор (3 мл) (1R,3R,20S)-2-метилен-19-нор-20-[(2E)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диола (10 мг), полученный в Примере 45, перемешивают в течение часа, затем продувают аргоном и концентрируют при пониженном давлении. Остаток очищают с помощью хроматографии на колонке с силикагелем и затем фракционируют с помощью высокоэффективной жидкостной хроматографии [YMC Pack ODS-AM (150×20 мм ID), 55% ацетонитрил-вода, 10 мл/мин, УФ 254 нм]. Раствор, содержащий соединение, которое элюировалось позже, концентрируют и затем фракционируют с помощью HPLC [CHIRALPAK AD (20×250 мм ID), Гексан-EtOH=80:20, 10 мл/мин, УФ 254 нм]. Раствор, содержащий соединение, которое элюировалось позже, концентрируют и очищают, что дает названное в заголовке соединение (1,0 мг) по изобретению в виде бесцветного порошка.
(+) -ESIMS m/z 499,5 [M+Na]+ 477,4 [M+1]+
1H-ЯМР (CDCl3) δ: 0,54 (3H, с), 0,87 (6H, т, J=7,2 Гц), 1,13 (3H, д, J=6,6 Гц), 1,24 (3H, д, J=7,0 Гц), 2,33 (2H, т, J=7,0 Гц), 2,60 (1H, дд, J=13,2, 4,4 Гц), 2,80 (2H, м), 3,63 (1H, м), 3,97 (1H, ушир.с), 4,95 (1H, квинт, J=6,2 Гц), 5,83 (1H, д, J=11,2 Гц), 6,36 (1H, д, J=11,2 Гц).
Пример 68:
(1R,3R,20S)-19-нор-20-[(4S)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E, 16-триен-1,3-диол
(1R,3R,20S)-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен-1,3-диол, полученный в Примере 47, фракционируют с помощью высокоэффективной жидкостной хроматографии [DAICEL CHIRALPAK AD (20×250 мм ID), 15% изопропанол-гексан, 8 мл/мин, УФ 254 нм]. Раствор, содержащий соединение, которое элюировалось первым, затем концентрируют и очищают, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 509,4 [M+Na]+
1H-ЯМР (CDCl3) δ: 0,78 (3H, с), 1,335 (3H, с), 1,38 (3H, д, J=6,2 Гц), 2,77 (2H, м), 4,12 (2H, м), 5,47 (1H, кв., J=6,2 Гц), 5,71 (1H, ушир.с), 5,94 (1H, д, J=11,2 Гц), 6,30 (1H, д, J=11,2 Гц).
Пример 69:
(1R,3R,20S)-19-нор-20-[(4R)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,16-триен-1,3-диол
На стадии фракционирования с помощью высокоэффективной жидкостной хроматографии по методике, указанной в Примере 68, раствор, содержащий соединение, которое элюировалось позже, концентрируют, что дает названное в заголовке соединение по изобретению.
1H-ЯМР (CDCl3) δ: 0,78 (3H, S), 1,338 (3H, с), 1,38 (3H, д, J=6,2 Гц), 2,77 (2H, м), 4,12 (2H, м), 5,48 (1H, кв., J=6,2 Гц), 5,71 (1H, ушир.с), 5,95 (1H, д, J=11,2 Гц), 6,30 (1H, д, J=11,2 Гц).
Пример 70:
(1S,3R,20S)-20-[(4R) или (4S)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,10(19),16-тетраен-1,3-диол
(1S,3R,20S)-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,10(19),16-тетраен-1,3-диол, полученный в Примере 49, фракционируют с помощью высокоэффективной жидкостной хроматографии [CHIRALPAK AD (20×250 мм ID), Гексан-i-PrOH=90:10, 10 мл/мин, УФ 254 нм]. Раствор, содержащий соединение, которое элюировалось первым, затем концентрируют и очищают, что дает указанное в заголовке соединение (3 мг) по изобретению в виде бесцветного порошка.
(+) -ESIMS m/z 521,4 [M+Na]+
1H-ЯМР (CDCl3) δ: 0,771 (3H, с), 1,33 (3H, с), 1,37 (3H, д, J=6,2 Гц), 2,53 (2H, т, J=6,8 Гц), 2,82 (1H, м), 3,18 (1H, ушир.с), 4,24 (1H, м), 4,42 (1H, м), 5,00 (1H, ушир.с), 5,33 (1H, ушир.с), 5,46 (1H, кв., 6,2 Гц), 5,67 (1H, ушир.с), 6,10 (1H, д, J=11,2 Гц), 6,36 (1H, д, J=11,2 Гц).
Пример 71:
(1S,3R,20S)-20-[(4S) или (4R)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,10(19),16-тетраен-1,3-диол
На стадии фракционирования с помощью высокоэффективной жидкостной хроматографии по методике, указанной в Примере 70, раствор, содержащий соединение, которое элюировалось позже, концентрируют, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 521,4 [M+Na] +
1H-ЯМР (CDCl3) δ: 0,773 (3H, с), 1,34 (3H, с), 1,37 (3H, д, J=6,2 Гц), 2,57 (2H, т, J=7,0 Гц), 2,82 (1H, м), 3,19 (1H, ушир.с), 4,24 (1H, м), 4,42 (1H, м), 5,00 (1H, ушир.с), 5,34 (1H, ушир.с), 5,46 (1H, кв., 6,2 Гц), 5,68 (1H, ушир.с), 6,10 (1H, д, J=11,0 Гц), 6,36 (1H, д, J=11,0 Гц).
Пример 72:
(1R,3R,20S)-19-нор-20-[(4S)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол
(1R,3R,20S)-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол, полученный в Примере 43, фракционируют с помощью высокоэффективной жидкостной хроматографии [DAICEL CHIRALPAK AD (20×250 мм ID), 10% этанол-гексан, 10 мл/мин, УФ 254 нм]. Раствор, содержащий соединение, которое элюировалось первым, затем концентрируют, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 489,3 [M+1]+ 511,3 [M+Na]+
1H-ЯМР (CDCl3) δ: 0,54 (3H, с), 1,24 (3H, д, J=7,0 Гц), 1,33 (3H, с), 2,50 (2H, м), 2,78 (1H, м), 3,30 (1H, ушир.с), 4,05 (2H, м), 4,97 (1H, квинт, 7,0 Гц), 5,86 (1H, д, J=11,6 Гц), 6,30 (1H, д, J=11,6 Гц).
Пример 73:
(1R,3R,20S)-19-нор-20-[(4R)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол
На стадии фракционирования с помощью высокоэффективной жидкостной хроматографии по методике, указанной в Примере 72, раствор, содержащий соединение, которое элюировалось позже, концентрируют, что дает названное в заголовке соединение по изобретению.
(+) -ESIMS m/z 489,4 [M+1]+, 511,4 [M+Na] +
1H-ЯМР (CDCl3) δ: 0,55 (3H, с), 1,24 (3H, д, J=6,6 Гц), 1,34 (3H, с), 2,51 (2H, м), 2,78 (1H, м), 4,07 (2H, м), 4,97 (1H, квинт, 6,6 Гц), 5,81 (1H, д, J=11,0 Гц), 6,30 (1H, д, J=11,0 Гц).
Пример теста 1:
Исследование способности вызывать дифференцировку клеточной линии острого миелолейкоза человека HL-60
Известно, что клеточная линия острого миелолейкоза человека HL-60 дифференцируется в подобные нейтрофилам клетки под действием активного витамина D или ему подобного. Так, клетки после дифференцировки начинают экспрессировать поверхностный маркер, такой как CD11 и CD32, и в то же время они выделяют радикалы кислорода под воздействием форболового эфира или подобного вещества. В этом тесте было использовано вышеупомянутое свойство. В качестве показателя способности индуцировать дифференцировку клеток HL-60 количество радикалов кислорода, образованных под воздействием форболового эфира, было измерено, и соединения по изобретению, упомянутые в Примерах, были сравнены с максакальцитолом по их активности витамина D3. При использовании коммерческих реагентов и наборов, если какие-либо применяются, следуют указаниям, к ним прилагаемым.
(Процесс)
Клетки HL-60 (полученные в ATCC) засевают на 96-луночный планшет в концентрации 5×103 клеток/100 мкл/лунка, и тестируемое соединение в двукратном разведении от 10-7 добавляют в ряды со второго по двенадцатый (максимальная концентрация во втором ряду). Первый ряд используют для контроля. После инкубации в течение 72 часов во влажных условиях в присутствии 5% CO2 при 37°C, используя CO2 инкубатор, 10 мкл PBS, содержащего 50 мМ WST-I (произведенный Takara Bio) и 10 мкМ форбола 12,13-дидеканоата (произведенный SIGMA), добавляют в каждую лунку, после чего инкубируют в течение 4 часов. Поглощение (относительная длина волны: 655 нм) при 450 нм WST-I формазанового красителя, полученного путем превращения из WST-I под воздействием радикалов кислорода, произведенных дифференцированными клетками HL-60, измеряют на микропланшетном считывающем устройстве Benchmark microplate reader (произведено BioRad). Применяют программное обеспечение контроля счетчика поглощения MPM3 (произведено BioRad) и кривую концентрация-поглощение; 50% максимально эффективную концентрацию (здесь и далее обозначаемую как "EC50") в каждом случае определяют с помощью регрессии логистической кривой. Результат показан в Таблице 1.
Как показано в Таблице 1, соединения по изобретению демонстрируют сходную или даже более сильную способность индуцировать дифференцировку клеток по сравнению с максакальцитолом и очевидно, что они проявляют выраженную активность витамина D3.
Пример теста 2:
Исследование действия, повышающего концентрацию кальция в сыворотке
Соединение по изобретению, упомянутое в примере 1, или максакальцитол в этаноле, содержащий 0,3% DMSO, вводят неоднократно посредством чрескожного введения (33 мкг/200 мкл/кг/день) один раз в день в течение 7 дней в спину самцов крыс SD (в возрасте 7 недель). Этанол, содержащий 0,3% DMSO, вводят контрольной группе. Через 24 часа после последнего введения кровь собирают и измеряют концентрацию кальция в сыворотке. Результат показан в Таблице 2.
Как показано в Таблице 2, максакальцитол повышает концентрацию кальция в сыворотке, тогда как соединение настоящего изобретения почти не влияет на концентрацию кальция в сыворотке.
Пример теста 3:
Исследование действия, повышающего выведение с мочой кальция (1)
Соединение по изобретению, упомянутое в Примере 1, 36, 43, 47, 48, 55 или 70 или максакальцитол в этаноле, содержащем 0,5% DMSO, вводят неоднократно посредством чрескожного введения (10 мкг/200 мкл/кг/день) один раз в день в течение 4 дней в спину самцов крыс SD (в возрасте 7 недель). Этанол, содержащий 0,5% DMSO, вводят контрольной группе. Измеряют концентрацию кальция в моче, которую собирают каждые 24 часа, и умножают на количество мочи для подсчета выведения кальция с мочой. Результат показан в Таблице 3. Выведение кальция с мочой, показанное в Таблице 3, указывает суммарное выведение кальция с 0 до 24 часов, с 0 до 48 часов, с 0 до 72 часов и с 0 до 96 часов.
Как показано в Таблице 3, уровень кальция в моче крыс группы, получавшей соединение изобретения, существенно ниже такового в группе получавших максакальцитол.
Пример теста 4:
Исследование действия, повышающего выведение с мочой кальция (2)
Соединение по изобретению, упомянутое в Примерах 42, 61 или 66, или максакальцитол в солевом растворе, содержащем 0,1% Triton×100/5,6% DMSO (22,4 нмоль/кг), вводят внутривенным путем самцам крыс SD (в возрасте 7 недель). Солевой раствор, содержащий 0,1% Triton×100/5,6% DMSO, вводят контрольной группе. Концентрацию кальция в моче, собранную в течение 24 часов после введения, измеряют и подсчитывают выведение кальция с мочой ([концентрация кальция в моче] × [количество мочи]) и пропорцию выведения кальция с мочой по отношению к контрольной группе ([количество в моче при введении тестируемого соединения]/[количество кальция в моче в контрольной группе]). Результат показан в Таблице 4.
(к контролю)
Как показано в Таблице 4, влияние соединения по изобретению на уровень кальция в моче существенно ниже в группе, получавшей соединение по изобретению, по сравнению с группой, получавшей максакальцитол.
Пример теста 5:
Исследование метаболической активности в микросомах печени человека
Соединения по изобретению, упомянутые в Примерах, и максакальцитол сравнивают друг с другом в отношении метаболической активности в микросомах печени человека.
Применяют пул микросом печени человека (HHM-0323), произведенные Tissue Transformation Technologies. 0,25 M калий-фосфатного буфера (pH 7,4) (200 мкл), 5 мкл 250 мкМ раствора каждого тестируемого соединения в DMSO, 50 мкл NADPH-регенерирующей системы (где 20 мг P-NADP+, 70 мг глюкозо-6-фосфата, 40 единиц глюкозо-6-фосфатдегидрогеназы и 20 мг магния хлорида растворяют в 1 мл дистиллированной воды) и 220 мкл дистиллированной воды добавляют в микропробирку и смесь подвергают предварительной инкубации в течение 5 минут при 37°C. Реакцию запускают путем добавления 25 мкл микросом печени человека (конечная концентрация белка: 1 мг/мл). Инкубацию проводят в течение 2, 10, 30 или 60 минут и реакцию останавливают путем добавления 500 мкл ацетонитрила. После центрифугирования при 13,000 об/мин в течение 5 минут каждое из тестируемых соединений в надосадочной фракции (25 мкл) измеряют с помощью метода HPLC (ВЭЖХ) при следующих условиях.
В качестве колонки используют Inertsil ODS-3 (4,6×150 мм; GL Science). В качестве мобильной фазы используют раствор A (ацетонитрил/0,1% водный раствор ацетат аммония = 10/90) и раствор B (ацетонитрил/0,1% водный раствор ацетата аммония = 90/10) в условиях линейного градиента, указанных в Таблицах с 5 по 7. Температура в колонке, скорость потока и длина волны обнаружения были установлены 40°C; 1,0 мл/мин и УФ 250 или 270 нм соответственно.
Соединение, упомянутое в Примере 38, было проанализировано в условиях, приведенных в Таблице 6; соединения, упомянутые в Примерах 55, 56, 68, 69, 72 и 73, находились в условиях, приведенных в Таблице 7; и другие соединения находились в условиях, приведенных в Таблице 5.
Соединения, описанные в Примерах 40, с 43 по 48, 50, 55, 56, 58, 60, 61, 63 и с 65 по 73, были проанализированы в условиях УФ 250 нм; и другие соединения находились в условиях УФ 270 нм.
По результатам вышеуказанного теста HPLC подсчитывают метаболическую активность тестируемого соединения. Результаты показаны в Таблице 8.
Как показано в Таблице 8, очевидно, что соединения по изобретению быстрее метаболизируются в микросомах печени человека, чем максакальцитол.
Пример композиции 1:
Мазь (1 г) получают из 0,25 мг соединения Примера 1, мазевой основы (белый вазелин, триглицерид среднецепочечных жирных кислот, ланолин, парафин или их смешанная основа) и других подходящих вспомогательных веществ посредством размешивания или подобной методики в соответствии с традиционным способом.
Пример композиции 2:
Мазь (1 г) получают из 0,25 мг соединения Примера 2, мазевой основы (белый вазелин, триглицерид среднецепочечных жирных кислот, ланолин, парафин или их смешанная основа) и других подходящих вспомогательных веществ посредством размешивания или подобной методики в соответствии с традиционным способом.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Как описано выше, соединение по изобретению является новым полезным производным витамина D3, которое обладает исключительной активностью витамина D3 по сравнению с обычными производными витамина D3, имеет относительно небольшое влияние на системный метаболизм кальция.
| название | год | авторы | номер документа |
|---|---|---|---|
| СТЕРЕОСЕЛЕКТИВНЫЙ СИНТЕЗ АНАЛОГОВ ВИТАМИНА Д | 2005 |
|
RU2380359C2 |
| НОВЫЙ СПОСОБ ПОЛУЧЕНИЯ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ, ПРИМЕНЯЕМЫХ ДЛЯ СИНТЕЗА АНАЛОГОВ ВИТАМИНА D | 2005 |
|
RU2378252C2 |
| ПРОИЗВОДНЫЕ ВИТАМИНА-D, СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ТЕРАПЕВТИЧЕСКИЙ АГЕНТ, СПОСОБ ЛЕЧЕНИЯ | 2001 |
|
RU2230738C9 |
| НОВЫЕ АКТИВАТОРЫ РЕЦЕПТОРОВ ВИТАМИНА D И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2008 |
|
RU2535448C2 |
| ПРОИЗВОДНЫЕ 22-ТИАВИТАМИНА D, СПОСОБ ИХ ПОЛУЧЕНИЯ, СПОСОБЫ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ, СОЕДИНЕНИЯ | 1995 |
|
RU2142941C1 |
| ПРОИЗВОДНЫЕ АМИДА ВИТАМИНА D И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2139276C1 |
| АНАЛОГИ ВИТАМИНА D, СПОСОБЫ ИЗ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ | 1993 |
|
RU2128168C1 |
| АНАЛОГИ ВИТАМИНА D, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМОПЗИЦИЯ | 1997 |
|
RU2183622C2 |
| АНАЛОГИ ВИТАМИНА D, СПОСОБ ИХ ПОЛУЧЕНИЯ, ДИАСТЕРЕОИЗОМЕР, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2163234C2 |
| ПРОИЗВОДНЫЕ ВИТАМИНА D, СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ | 1997 |
|
RU2223954C2 |
Изобретение описывает новое полезное производное витамина D3, которое имеет отличную активность витамина D3 и по сравнению с обычными производными витамина D3 имеет относительно небольшое воздействие на системный метаболизм кальция. Изобретение включает 9,10-секопрегнановое производное следующей общей формулы [1] и фармацевтическую композицию, содержащую его в качестве активного ингредиента.
[Формула 1]

В общей формуле [1] следующая часть структуры между 16-положением и 17-положением означает простую связь или двойную связь: Y представляет собой простую связь, алкилен, алкенилен или фенилен; R1 и R2 являются одинаковыми или различными, каждый представляет собой водород, алкил или циклоалкил; или R1 и R2, взятые вместе со смежным атомом углерода, образуют циклоалкил; R3 представляет собой водород или метил; Z представляет собой водород, гидрокси или -NR11R12, где R11 и R12 имеют значения, указанные в формуле изобретения. 8 н. и 6 з.п. ф-лы, 8 табл.
1. 9,10-Секопрегнановое производное, представленное следующей общей формулой [1] или его фармацевтически приемлемая соль:
[Формула 1]

в общей формуле [1]
следующая часть структуры между 16-положением и 17-положением  означает простую связь или двойную связь:
означает простую связь или двойную связь:
Y представляет собой (1) простую связь, (2) алкилен, имеющий от 1 до 5 атомов углерода, и необязательно замещенный от 1 до 3 заместителями, выбранными из группы галогена, гидрокси и оксо, (3) алкенилен, имеющий от 2 до 5 атомов углерода или (4) фенилен;
R1 и R2 являются одинаковыми или различными, каждый представляет собой (1) водород, (2) алкил, имеющий от 1 до 6 атомов углерода, и необязательно замещенный от 1 до 3 атомами галогена или (3) циклоалкил, имеющий от 3 до 8 атомов углерода; или R1 и R2, взятые вместе со смежным атомом углерода, образуют циклоалкил, имеющий от 3 до 8 атомов углерода;
R3 представляет собой водород или метил;
Z представляет собой водород, гидрокси или -NR11R12; R11 представляет собой водород или алкил, имеющий от 1 до 6 атомов углерода; R12 представляет собой (1) алкил, имеющий от 1 до 6 атомов углерода, и необязательно замещенный гидрокси или (2) алкилсульфонил, имеющий от 1 до 6 атомов углерода;
Ra и Rb оба представляют собой атомы водорода, или Ra и Rb, взятые вместе, образуют метилен;
Rc и Rd являются одинаковыми или различными, каждый представляет собой водород или метил, или Rc и Rd, взятые вместе, образуют метилен;
однако, соединения, где (1) R1 и R2, взятые вместе, образуют метилен, (2) Rc и Rd представляют собой атомы водорода, и (3) часть структуры между 16-положением и 17-положением представляет собой простую связь, исключены.
2. 9,10-Секопрегнановое производное или его фармацевтически приемлемая соль по п.1, где Z представляет собой гидрокси.
3. 9,10-Секопрегнановое производное или его фармацевтически приемлемая соль по п.1, где Y представляет собой алкилен, имеющий от 1 до 5 атомов углерода, или алкенилен, имеющий от 2 до 5 атомов углерода.
4. 9,10-Секопрегнановое производное или его фармацевтически приемлемая соль по п.1, где R1 и R2 являются одинаковыми или различными, каждый представляет собой алкил, имеющий от 1 до 6 атомов углерода, и необязательно замещенный от 1 до 3 атомами галогена.
5. 9,10-Секопрегнановое производное или его фармацевтически приемлемая соль по п.1, где R3 представляет собой метил.
6. 9,10-Секопрегнановое производное или его фармацевтически приемлемая соль по п.1, где Z представляет собой гидрокси, Y представляет собой этилен или этенилен, R1 и R2 являются одинаковыми или различными, каждый представляет собой метил, трифторметил или этил, и R3 представляет собой метил.
7. 9,10-Секопрегнановое производное или его фармацевтически приемлемая соль по п.1, которое представляет собой следующие соединения с (1) по (26):
(1) (IS,3R,20S)-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,10(19),16-тетраен-1,3-диол,
(2) (1R,3R,20S)-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(3) (1R,3R,20S)-2-метилен-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(4) (1R,3R,20S)-19-нор-20-[(2Е)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(5) (1R,3R,20S)-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(6) (1R,3S,20S)-2-метилен-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(7) (1R,3R,20S)-2-метилен-19-нор-20-[(2Е)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(8) (1R,3R,20S)-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(9) (1R,3R,20S)-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7Е,16-триен-1,3-диол,
(10) (1R,3R,20S)-19-нор-2-метилен-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(11) (1S,3R,20S)-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,10(19),16-тетраен-1,3-диол,
(12) (1R,2α,3R,20S)-2-метил-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7Е-диен-1,3-диол,
(13) (1R,2β,3R,20S)-2-метил-19-нор-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(14) (1R,3R,20S)-2-метил-19-нор-20-(5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7Е-диен-1,3-диол,
(15) (1R,3R,20S)-2-метил-19-нор-20-[(2Е)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(16) (1R,3R,20S)-19-нор-2-метил-20-(4-гидрокси-4-метилпентаноилокси)-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(17) (1R,3R,20S)-19-нор-2-метилен-20-[(4S)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(18) (1R,3R,20S)-19-нор-2-метилен-20-[(4R)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(19) (1R,2β,3R,20S)-2-метил-19-нор-20-[(2Е)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(20) (1R,2α,3R,20S)-2-метил-19-нор-20-[(2Е)-4-этил-4-гидроксигекс-2-еноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(21) (1R,2β,3R,20S)-2-метил-19-нор-20-[4-этил-4-гидроксигексаноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(22) (1R,2α,3R,20S)-2-метил-19-нор-20-[4-этил-4-гидроксигексаноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(23) (1R,3R,20S)-19-10р-20-[(4S)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(24) (1R,3R,20S)-19-нор-20-[(4R)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,16-триен-1,3-диол,
(25) (1R,3R,20S)-19-нор-20-[(4S)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол,
(26) (1R,3R,20S)-19-нор-20-[(4R)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E-диен-1,3-диол.
8. Фармацевтическая композиция для индукции дифференцировки клеток, содержащая в качестве активного ингредиента эффективное количество 9,10-секопрегнанового производного или его фармацевтически приемлемой соли по любому одному из пп.1-7.
9. Терапевтический агент для лечения дискератоза, который содержит в качестве активного ингредиента 9,10-секопрегнановое производное или его фармацевтически приемлемую соль по любому одному из пп.1-7.
10. Терапевтический агент для лечения псориаза, который содержит в качестве активного ингредиента 9,10-секопрегнановое производное или его фармацевтически приемлемую соль по любому одному из пп.1-7.
11. 9,10-Секопрегнановое производное или его фармацевтически приемлемая соль, которое представляет собой следующие соединения с (1) по (5):
(1) (1S,3R,20S)-20-(5-гидрокси-5-этилгептаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол,
(2) (1S,3R,20S)-20-[(4R)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-52,7Е,10(19)-триен-1,3-диол,
(3) (1S,3R,20S)-20-[(4S)-5,5,5-трифтор-4-гидрокси-4-метилпентаноилокси]-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол,
(4) (1S,3R,20S)-20-(6,6,6-трифтор-5-гидрокси-5-метилгексаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол,
(5) (1S,3R,20S)-20-(5,5,5-трифтор-4-гидрокси-4-метил-3-оксопентаноилокси)-9,10-секопрегна-5Z,7E,10(19)-триен-1,3-диол.
12. Фармацевтическая композиция для индукции дифференцировки клеток, содержащая в качестве активного ингредиента эффективное количество 9,10-секопрегнанового производного или его фармацевтически приемлемой соли по п.11.
13. Терапевтический агент для лечения дискератоза, который содержит в качестве активного ингредиента 9,10-секопрегнановое производное или его фармацевтически приемлемую соль по п.11.
14. Терапевтический агент для лечения псориаза, который содержит в качестве активного ингредиента 9,10-секопрегнановое производное или его фармацевтически приемлемую соль по п.11.
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| US 5756733 А, 26.05.1998. | |||
Авторы
Даты
2012-01-27—Публикация
2007-06-01—Подача