Изобретение относится к производным тиазолидинона или их фармакологически приемлемым солям, обладающим превосходным расширяющим коллатеральный сосуд действием и противостенокардическим действием, и к терапевтическому препарату или профилактическому препарату против грудной жабы, содержащему их в качестве активного ингредиента.
Известно, что в качестве терапевтического препарата при сердечно-сосудистых заболеваниях, в частности при грудной жабе, наиболее часто в клинике применяется нитроглицерин. Однако нитроглицерин легко подвержен первому проходящему эффекту и ввиду снижения давления обладает побочными эффектами, такими как головная боль, головокружение, тахикардия. По этой причине при грудной жабе был бы желателен терапевтический препарат, который не подвержен первой проходящей фазе и который дает меньше побочных эффектов.
Известно, например, следующее соединение, производное тиазолидинона, обладающее противостенокардическим действием (Японская нерассмотренная патентная публикация (КОКАI) N Hei 5-213910).
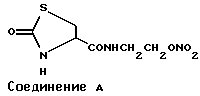
Настоящие заявители в течение многих лет получали ряд производных нитратов и исследовали их фармакологическое действие. В результате настоящие заявители обнаружили, что соединения тиазолидинона, имеющие определенный заместитель, обладают превосходным длительным расслабляющим действием на коллатеральный сосуд и меньшим количеством побочных эффектов, и могут использоваться в качестве лекарственного препарата или профилактического препарата против грудной жабы, что и явилось основанием создания настоящего изобретения.
Производное тиазолидинона по настоящему изобретению имеет общую формулу: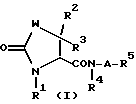
В вышеуказанной формуле W представляет атом серы или атом кислорода, и X представляет группу, имеющую формулу: -N(R1)-; или
X представляет атом серы или атом кислорода, а W представляет группу, имеющую формулу: -N(R1)-;
R1 представляет атом водорода, C1-C6 алкильную группу или C1-C4 алкильную группу, замещенную арилом;
R2 и R3 могут быть одинаковыми или различными и каждый представляют атом водорода, C1-C6 алкильную группу, C1-C4 алкильную группу, замещенную арилом, арильную группу или необязательно замещенную 5- или 6-членную ароматическую гетероциклическую группу, содержащую от 1 до 3 гетероатомов, выбранных из группы, содержащей атомы азота, атомы кислорода и атомы серы (заместителем является C1-C6 алкил, галоген, амино или моно- или ди-C1-C6 алкиламино);
R4 представляет атом водорода, C1-C6 алкильную группу или C1-C4 алкильную группу, замещенную арилом;
R5 представляет замещенную C3-C8 циклоалкильную группу, необязательно содержащую атом азота [указанным заместителем является по существу группа, имеющая формулу: -B-ONO2 (где B представляет одинарную связь или C1-C6 алкиленовую группу) и необязательно C1-C6 алкильная группа];
A представляет одинарную связь или C1-C6 алкиленовую группу; и
указанная арильная группа представляет C6-C10 арильную группу, которая может быть необязательно замещена (заместителем является C1-C6 алкил, C1-C6 алкокси, гидрокси, галоген, амино, моно- или ди-C1-C6 алкиламино или нитро)] .
C1-C6 Алкильные группы для R1, R2, R3, R4 и тому подобное, или алкильные части C1-C6 алкоксигруппы, C1-C6 алкиламино группы и т.д., содержащиеся в арильной или подобной группе, включают, например, группу метил, этил, пропил, изопропил, бутил, втор-бутил, трет-бутил, изобутил, пентил и гексил, и, предпочтительно, C1-C4 алкильную группу, более предпочтительно, C1-C2 алкильную группу и, особенно предпочтительно, метильную группу.
Арильными частями C1-C4 алкильных групп, замещенных арилами, для R1, R2, R3 и R4 (число арильных заместителей, пред почтительно, 1 или 2 и, особенно предпочтительно, 1) являются группы, описанные далее, а алкильными частями являются группы, соответствующие C1-C6 алкильным группам, указанным выше. C1-C4 алкильные группы, замещенные арильной группой, включают, например, группу бензил, фенетил, 2-фенилпропил, 3-фенилпропил, 4-фенилбутил, дифенилметил, 1-нафтилметил и 2-нафтилметил, предпочтительно, группу фенил- (C1-C4 алкил), более предпочтительно, бензильную или фенетильную группу и особенно предпочтительно, бензильную группу.
C6-C10 Арильные группы для R2 и R3 включают, например, фенильную группу и нафтильную группу, и, предпочтительно, фенильную группу.
Галогены в качестве заместителя в C6-C10 арильных группах для R2 и R3 включают, например, атом фтора, атом хлора, атом брома и атом иода, и, предпочтительно, атом фтора или атом хлора.
Между тем заместитель в арильной группе (число заместителей, предпочтительно от 1 до 3, более предпочтительно от 1 до 2, и, особенно предпочтительно, 1) включает, предпочтительно, C1-C4 алкильную группу, C1-C4 алкокси группу, гидроксигруппу, атом галогена, аминогруппу, моно- или ди-C1-C4 алкиламиногруппу или нитрогруппу, более предпочтительно C1-C4 алкильную группу, C1-C4 алкоксигруппу, гидроксигруппу, атом галогена или нитро группу, еще более предпочтительно, метильную группу, метоксигруппу, гидроксигруппу, атом фтора или атом хлора, и, особенно предпочтительно, метильную группу или метоксигруппу.
5- или 6- членное ароматическое гетероциклическое кольцо, содержащее от 1 до 3 гетероатомов, выбранных из группы, включающей атомы азота, атомы кислорода и атомы серы, для R2 и R3 может быть необязательно конденсированно с бензольным кольцом, и может включать, например, фурил, тиенил, пирролил, оксазолил, изоксазолил, тиазолил, изотиазолил, имидазолил, пиразолил, пиридил, пиридазинил, пиримидинил, индолил, хинолил и хиназолинил, предпочтительно, фурил, тиенил, оксазолил, изоксазолил, тиазолил, изотиазолил или пиридил, более предпочтительно, фурил, тиенил или пиридил, и, особенно предпочтительно, тиенил.
Заместитель в 5- или 6-членном ароматическом гетероциклическом кольце может включать, предпочтительно C1-C4 алкильную группу, атом галогена, аминогруппу или моно- или ди-C1-C4 алкиламиногруппу, более предпочтительно C1-C2 алкильную группу, атом фтора или атом хлора, и особенно предпочтительно метильную группу.
Циклоалкильная часть замещенной C3-C8 циклоалкильной группы, которая может необязательно содержать атом азота, для R5 может включать, например, группу циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, азиридинил, азетидинил, пирролидинил, пиперидинил, 2Н-гексагидроазепинил и октагидроазоцинил, предпочтительно, C3-C6 циклоалкильную группу, группу пирролидинил или группу пиперидинил, более предпочтительно, группу циклопропил, циклопентил или циклогексил, еще более предпочтительно, группу циклопентил или группу циклогексил, и, особенно предпочтительно, группу циклогексил.
Замещенная C3-C8 циклоалкильная группа, которая может необязательно содержать атом азота, может обычно включать, например, группу 1- или 2-нитроксиметилциклопропил, группу 1- или 2-(2-нитроксиэтил)циклопропил, группу 1- или 2-(3- нитроксипропил)циклопропил, группу 1- или 2-(3-нитроксибутил)циклопропил, группу 2- или 3-нитроксиметилциклобутил, группу 2- или 3-нитроксициклопентил, группу 2- или 3- нитроксиметилциклопентил, группу 2- или 3-(2-нитроксиэтил)- циклопентил, группу 2- или 3-(3-нитроксипропил) циклопентил, группу 2- или 3-(4-нитроксибутил)циклопентил, группу 2-, 3-или 4- нитроксициклогексил, группу 2-, 3- или 4-нитроксиметилциклогексил, группу 2-, 3- или 4-(2-нитроксиэтил)- циклогексил, группу 2-, 3- или 4-(3-нитроксипропил)циклогексил, группу 2-, 3- или 4-(4-нитроксибутил)цикло-гексил, группу 3-, 4- или 5-нитроксиметилпирролидин-2-ил, группу 3-, 4- или 5- нитроксиметил-1-пирролидин-2-ил, группу 3-, 4- или 5-(2- нитроксиэтил)пирролидин-2-ил, группу 3-, 4-или 5-(3- нитроксипропил)пирролидин-2-ил, группу 3-, 4- или 5-(4- нитроксибутил)пирролидин-2-ил, группу 3-, 4-, 5- или 6- нитроксипиперидин-2-ил, группу 3-, 4-, 5- или 6-нитроксиметилпиперидин-2-ил, группу 3-, 4-, 5- или 6-нитроксиметил-1- метилпиперидин-2-ил, группу 5- или 6-нитроксиметил-пиперидин-3-ил, группу 5- или 6-нитроксиметил-1-метилпиперидин-3-ил, группу 3-, 4-, 5- или 6-(2-нитроксиэтил)- пиперидин-2-ил, группу 3-, 4-, 5- или 6-(3-нитроксипропил)- пиперидин-2-ил, группу 3-, 4-, 5- или 6-(4-нитроксибутил)- пиперидин-2-ил, предпочтительно, группу 2-нитроксиметилциклопропил, группу 2- или 3-нитроксициклопентил, группу 2-или 3- нитроксиметилциклопентил, группу 2- или 3-(2-нитрокси- этил)циклопентил, группу 2- или 3-(3-нитроксипропил)-циклопентил, группу 2- или 3-(4-нитроксибутил)циклопентил, группу 2-, 3- или 4-нитроксициклогексил, группу 2-, 3- или 4- нитроксиметилциклогексил, группу 2-, 3- или 4-(2-нитрокси- этил)циклогексил, группу 2-, 3- или 4-(3-нитроксипропил)- циклогексил, группу 2-, 3- или 4-(4-нитроксибутил)-циклогексил, группу 3-, 4- или 5-нитроксиметилпирролидин-2-ил, группу 3-, 4- или 5-нитроксиметил-1-метилпирролидин-2-ил, группу 3-, 4-, 5- или 6-нитроксиметилпиперидин-2-ил, группу 3-, 4-, 5- или 6- нитроксиметил-1-метилпиперидин-2-ил, группу 5- или 6- нитроксиметилпиперидин-3-ил, группу 5- или 6-нитроксиметил-1- метилпиперидин-3-ил, группу 3-, 4-, 5- или 6-(2-нитроксиэтил) пиперидин-2-ил, группу 3-, 4-, 5- или 6-(3-нитроксипропил) пиперидин-2-ил, группу 3-, 4-, 5- или 6-(4-нитроксибутил) пиперидин-2-ил, более предпочтительно, группу 2- или 3- нитроксиметилциклопентил, группу 2- или 3-(2- нитроксиэтил)циклопентил, группу 2- или 3-(3-нитроксипропил)циклопентил, группу 2- или 3-(4-нитроксибутил)-циклопентил, группу 2-, 3- или 4-нитроксициклогексил, группу 2-, 3- или 4- нитроксиметилциклогексил, группу 2-, 3- или 4-(2- нитроксиэтил)циклогексил, группу 2-, 3- или 4-(3- нитроксипропил)циклогексил, группу 2-, 3- или 4-(4- нитроксибутил)циклогексил, группу 3-, 4-, 5- или 6- нитроксиметилпиперидин-2-ил, или группу 3-, 4-, 5- или 6- нитроксиметил-1-метилпиперидин-2-ил, еще более предпочтительно, группу 2- или 3-нитроксиметилциклогексил, группу 2-, 3- или 4- нитроксициклогексил, группу 2-, 3- или 4-нитроксиметилциклогексил, группу 2-, 3- или 4-(2-нитроксиэтил)- циклогексил, группу 2-, 3- или 4-(3-нитроксипропил)-циклогексил, или группу 2-, 3- или 4(4-нитроксибутил)цикло-гексил, далее, еще более предпочтительно, группу 3-нитроксиметилциклопентил, группу 4-нитроксициклогексил, группу 2-, 3- или 4- нитроксиметилциклогексил, группу 3- или 4-(2- нитроксиэтил)циклогексил, группу 3- или 4-(3-нитроксипропил)циклогексил, или группу 3- или 4-(4-нитроксибутил)- циклогексил, особенно предпочтительно, группу 3- или 4- нитроксиметилциклогексил, группу 4-(2-нитроксиэтил)-циклогексил, группу 4-(3-нитроксипропил)циклогексил или группу 4-(4- нитроксибутил)циклогексил, и, наиболее предпочтительно, группу 4- нитроксиметилциклогексил.
C1-C6 алкиленовые группы A и B могут включать, например, метилен, этилен, пропилен, триметилен, тетраметилен, пентаметилен и гексаметилен, предпочтительно, C1-C4 алкиленовую группу, более предпочтительно, A является метиленовой группой или этиленовой группой и B является метиленовой группой, этиленовой группой, триметиленовой группой или тетраметиленовой группой; и, особенно предпочтительно, A является метиленовой группой и B является метиленовой группой или этиленовой группой (особенно, метиленовой группой).
Те соединения (I), которые содержат кислотную группу, такую как фенольный радикал, могут образовать соли с основаниями. Такие соли могут включать, например, соль со щелочным металлом, таким как литий, натрий или калий, соль со щелочноземельным металлом, таким как барий или кальций, соль с другим металлом, таким как магний или алюминий, соль с органическим амином, таким как дициклогексиламин, и соль с основной аминокислотой, такой как лизин и аргинин и, предпочтительно, соль со щелочным металлом. Между тем соединения (I), содержащие основную группу, такую как радикал амин или алкиламин, могут образовывать соли с кислотами. Такие соли могут включать, например, соль с неорганической кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота и угольная кислота, соль с карбоновой кислотой, такой как уксусная кислота, фумаровая кислота, малеиновая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, лимонная кислота, яблочная кислота и бензойная кислота, соль с сульфоновой кислотой, такой как метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота и толуолсульфоновая кислота, и соль с кислой аминокислотой, такой как глютаминовая кислота и аспарагиновая кислота, предпочтительно, соль с хлористоводородной кислотой или карбоновой кислотой (в особенности, соль с хлористоводородной кислотой).
В соединении (I) атом углерода, к которому присоединены R2 и R3, атом углерода, к которому присоединена группа, имеющая формулу: - CON(R4)-A-R5 (где R4, R5 и A имеют те же значения, что определены выше), и атом углерода, содержащийся в R5, могут быть асимметрическими атомами углерода, и изомеры на основе таких атомов углерода также включены в соединения по настоящему изобретению. Далее стереоизомеры, существующие для группы, имеющей формулу: -A-R5 (где R5 и A имеют те же значения, что определены выше), и каждый изомер или их смесь также включены в соединение по настоящему изобретению (предпочтительна, транс форма) и более того гидрат соединения (I) или его соль также включены в соединение по настоящему изобретению.
Соединение, имеющее вышеуказанную общую формулу (I), может, предпочтительно, включать:
(1) соединение, в котором W является атомом серы или атомом кислорода и X является группой, имеющей формулу: -NR1-; или X является атомом серы и W является группой, имеющей формулу: -NR1-;
(2) соединение, в котором W является атомом серы или атомом кислорода и X является группой, имеющей формулу: -NR1-;
(3) соединение, в котором W является атомом серы и X является группой, имеющей формулу: -NR1-;
(4) соединение, в котором R1 является атомом водорода, C1-C4 алкильной группой, бензильной группой или фенетильной группой;
(5) соединение, в котором R1 является атомом водорода, метильной группой или бензильной группой;
(6) соединение, в котором R1 является атомом водорода;
(7) соединение, в котором R2 и R3 могут быть одинаковыми или различными, и каждый обозначают атом водорода, C1-C4 алкильную группу, C1-C4 алкильную группу, замещенную фенилом (фенильная группа может быть необязательно замещена C1-C4 алкилом, C1-C4 алкокси, гидрокси, галогеном или нитро), нафтилметильную группу, фенильную группу (фенильная группа может быть необязательно замещена C1-C4 алкилом, C1-C4 алкокси, гидрокси, галогеном или нитро), нафтильную группу, или группу фурил, тиенил, пиридил, оксазолил, тиазолил, изоксазолил или изотиазолил, которые могут быть необязательно замещены C1-C2 алкилом, фтором или хлором;
(8) соединение, в котором R2 и R3 могут быть одинаковыми или различными, и, каждый, обозначает атом водорода, метильную группу, этильную группу, бензильную группу, которые могут быть необязательно замещены метилом, метокси, гидрокси, фтором или хлором, фенетильную группу, которая может быть необязательно замещена метилом, метокси, гидрокси, фтором или хлором, фенильную группу, которая может быть необязательно замещена метилом, метокси, гидрокси, фтором или хлором, фурильную группу, тиенильную группу или пиридильную группу;
(9) соединение, в котором R2 является атомом водорода, метильной группой, этильной группой, бензильной группой, которая может быть необязательно замещена метилом, метокси или гидрокси, или фенильной группой, которая может быть необязательно замещена метилом или метокси, или тиенильной группой, и R3 является атомом водорода, или R2 и R3 являются метильной группой;
(10) соединение, в котором R2 является атомом водорода, метильной группой, бензильной группой, которая может быть необязательно замещена метилом или метокси, или фенильной группой, и R3 является атомом водорода, или R2 и R3 являются метильными группами;
(11) соединение, в котором R2 является атомом водорода, метильной группой или бензильной группой, и R3 является атомом водорода;
(12) соединение, в котором R2 является атомом водорода, и R3 является атомом водорода;
(13) соединение, в котором R4 является атомом водорода, C1-C4 алкильной группой, бензильной группой или фенетильной группой;
(14) соединение, в котором R4 является атомом водорода, метильной группой или бензильной группой;
(15) соединение, в котором R4 является атомом водорода;
(16) соединение, в котором R5 является замещенной C3-C6 циклоалкильной группой; пирролидинильной группой или пиперидинильной группой [заместителем, по существу, является группа, имеющая формулу: -B-ONO2 (где B представляет одинарную связь, метиленовую группу, этиленовую группу, триметиленовую группу или тетраметиленовую группу) и, необязательно, метильную группу];
(17) соединение, в котором R5 является замещенной циклопропильной группой, циклопентильной группой или циклогексильной группой [заместителем, по существу, является группа, имеющая формулу: -B-ONO2 (где B представляет метиленовую группу, этиленовую группу, триметиленовую группу или тетраметиленовую группу)];
(18) соединение, в котором R5 является замещенной циклопентильной группой, циклогексильной группой [заместителем является группа, имеющая формулу: -B-ONO2 (где B представляет метиленовую группу, этиленовую группу, триметиленовую группу или тетраметиленовую группу)];
(19) соединение, в котором R5 является группой 2- или 3- нитроксиметилциклопентил, группой 2- или 3-(2- нитроксиэтил)циклопентил, группой 2- или 3-(3- нитроксипропил)циклопентил, группой 2- или 3-(4- нитроксибутил)циклопентил, группой 2, 3- или 4- нитроксициклогексил, группой 2-, 3- или 4- нитроксиметилциклогексил, группой 2-, 3- или 4-(2- нитроксиэтил)циклогексил, группой 2-, 3- или 4-(3- нитроксипропил)циклогексил, группой 2-, 3- или 4-(4- нитроксибутил)циклогексил, группой 3-, 4-, 5- или 6- нитроксиметилпиперидин-2-ил или группой 3-, 4-, 5- или 6- нитроксиметил-1-метилпиперидин-2-ил;
(20) соединение, в котором R5 является группой 2- или 3- нитроксиметилциклопентил, группой 2, 3- или 4- нитроксициклогексил, группой 2-, 3- или 4- нитроксиметилциклогексил, группой 2-, 3- или 4-(2- нитроксиэтил)циклогексил, группой 2-, 3- или 4-(3- нитроксипропил)циклогексил, группой 2-, 3- или 4-(4- нитроксибутил) циклогексил;
(21) соединение, в котором R5 является группой или 3- нитроксиметилциклопентил, группой 4- нитроксициклогексил, группой 2-, 3- или 4- нитроксиметилциклогексил, группой 3- или 4-(2- нитроксиэтил)циклогексил, группой 3- или 4-(3- нитроксипропил)циклогексил, или группой 3- или 4-(4- нитроксибутил) циклогексил;
(22) соединение, в котором R5 является группой 3- или 4- нитроксиметилциклогексил, группой 4-(2- нитроксиэтил) циклогексил, группой 4-(3-нитроксипропил) циклогексил, или группой 4-(4-нитроксибутил)циклогексил;
(23) соединение, в котором R5 является группой 4- нитроксиметилциклогексил;
(24) соединение, в котором A является одинарной связью или C1-C2 алкиленовой группой;
(25) соединение, в котором A является метиленовой группой или этиленовой группой; и
(26) соединение, в котором A является метиленовой группой.
Более того, сочетание соединений, произвольно выбранных из группы, включающей (1)-(3), (4)-(6), (7)-(12), (13)- (15), (16)-(23) и (24)-(26) также является предпочтительным, и включает, например, такие, которые представлены ниже.
(27) соединение, в котором W является атомом серы или атомом кислорода и X является группой, имеющей формулу: -NR1-; или X является атомом серы и W является группой, имеющей формулу -NR1-;
R1 является атомом водорода, C1-C4 алкильной группой, бензильной группой или фенетильной группой;
R2 и R3 могут быть одинаковыми или различными и каждая являются атомом водорода, C1-C4 алкильной группой, C1-C4 алкильной группой, замещенной фенилом (фенил может быть необязательно замещен C1-C4 алкилом, C1-C4 алкокси, гидрокси, галогеном или нитро), нафтилметильной группой, фенильной группой (фенил может быть необязательно замещен C1-C4 алкилом, C1-C4 алкокси, гидрокси, галогеном или нитро), нафтильной группой или группой фурил, тиенил, пиридил, оксазолил, тиазолил, изоксазолил или тиазолил, которая может быть необязательно замешена C1-C2 алкилом, фтором или хлором;
R4 является атомом водорода, C1-C4 алкильной группой, бензильной группой или фенетильной группой;
R5 является замещенной C3-C6 циклоалкильной группой, пирролидинильной группой или пиперидинильной группой [заместителем по существу является группа, имеющая формулу: -B-ONO2 (где B представляет одинарную связь, метиленовую группу, этиленовую группу, триметиленовую группу или тетраметиленовую группу) и, необязательно, метильную группу]; и
A является одинарной связью или C1-C2 алкиленовой группой;
(28) соединение, в котором W является атомом серы или атомом кислорода и X является группой, имеющей формулу: -NR1-;
R1 является атомом водорода, метильной группой или бензильной группой;
R2 и R3 могут быть одинаковыми или различными и каждый являются атомом водорода, метильной группой, этильной группой, бензильной группой, которая может быть необязательно замещена метилом, метокси, гидрокси, фтором или хлором), фенетильной группой, которая может быть необязательно замещена метилом, метокси, гидрокси, фтором или хлором, фенильной группой, которая может быть необязательно замещена метилом, метокси, гидрокси, фтором или хлором, или фурильной группой, тиенильной группой или пиридильной группой;
R4 является атомом водорода, метильной группой или бензильной группой;
R5 является замещенной C3-C6 циклоалкильной группой, пирролидинильной группой или пиперидинильной группой [заместителем по существу является группа, имеющая формулу: -B-ONO2 (где B представляет одинарную связь, метиленовую группу, этиленовую группу, триметиленовую группу или тетраметиленовую группу) и, необязательно, метильная группа]; и
A является одинарной связью или C1-C2 алкиленовой группой;
(29) соединение, в котором W является атомом серы и X является группой, имеющей формулу: -NR1-;
R1 является атомом водорода, метильной группой или бензильной группой;
R2 и R3 могут быть одинаковыми или различными и каждый являются атомом водорода, метильной группой, этильной группой, бензильной группой, которая может быть необязательно замещена метилом, метокси, гидрокси, фтором или хлором, фенэтильной группой, которая может быть необязательно замещена метилом, метокси, гидрокси, фтором или хлором, фенильной группой, которая может быть необязательно замещенна метилом, метокси, гидрокси, фтором или хлором, или фурильной группой, тиенильной группой или пиридильной группой;
R4 является атомом водорода, метильной группой или бензильной группой;
R5 является замещенной C3-C6 циклоалкильной группой, пирролидинильной группой или пиперидинильной группой [заместителем, по существу, является группа, имеющая формулу: -B-ONO2 (где B представляет одинарную связь, метиленовую группу, этиленовую группу, триметиленовую группу или тетраметиленовую группу) и, необязательно, метильная группа]; и
A является одинарной связью или C1-C2 алкиленовой группой;
(30) соединение, в котором W является атомом серы и X является группой, имеющей формулу: -NR1-;
R1 является атомом водорода, метильной группой или бензильной группой;
R2 является атомом водорода, метильной группой, этильной группой, бензильной группой, которая может быть необязательно замещена метилом, метокси или гидроксило или фенильной группой, которая может быть необязательно замещена метилом или метокси или тиенильной группой и R3 является атомом водорода, или R2 и R3 являются метильной группой;
R4 является атомом водорода, метильной группой или бензильной группой;
R5 является замещенной циклопропильной группой, циклопентильной группой или циклогексильной группой [заместителем является группа, имеющая формулу: -B-ONO2 (где B представляет метиленовую группу, этиленовую группу, триметиленовую группу или тетраметиленовую группу)]; и
A является одинарной связью или C1-C2 алкиленовой группой;
(31) соединение, в котором W является атомом серы и X является группой, имеющей формулу: -NR1-;
R1 является атомом водорода, метильной группой или бензильной группой;
R2 является атомом водорода, метильной группой, бензильной группой, которая может быть необязательно замещена метилом или метокси, или фенильной группой и R3 является атомом водорода, или R2 и R3 являются метильной группой;
R4 является атомом водорода, метильной группой или бензильной группой;
R5 является замещенной циклопентильной группой или циклогексильной группой [заместителем является группа, имеющая формулу: -B-ONO2 (где B представляет метиленовую группу, этиленовую группу, триметиленовую группу или тетраметиленовую группу)]; и
A является одинарной связью или C1-C2 алкиленовой группой;
(32) соединение, в котором W является атомом серы и X является группой, имеющей формулу: -NR1-;
R1 является атомом водорода, метильной группой или бензильной группой;
R2 является атомом водорода, метильной группой или бензильной группой;
R3 является атомом водорода;
R4 является атомом водорода, метильной группой или бензильной группой;
R5 является группой 2- или 3-нитроксиметилциклопентил, группой 2- или 3-(2-нитроксиэтил)циклопентил, группой 2- или 3-(3- нитроксипропил)циклопентил, группой 2- или 3-(4- нитроксибутил)циклопентил, группой 2-, 3- или 4-нитрокси- циклогексил, группой 2-, 3- или 4-нитроксиметилциклогексил, группой 2-, 3- или 4-(2-нитроксиэтил)циклогексил, группой 2-, 3- или 4-(3-нитроксипропил)циклогексил, группой 2-, 3-или 4-(4- нитроксибутил)циклогексил, группой 3-, 4-, 5- или 6- нитроксиметилпиперидин-2-ил или группой 3-, 4-, 5- или 6- нитроксиметил-1-метилпиперидин-2-ил; и
A является одинарной связью или C1-C2 алкиленовой группой;
(33) соединение, в котором W является атомом серы и X является группой, имеющей формулу: -NR1-;
R1 является атомом водорода;
R2 является атомом водорода, метильной группой или бензильной группой;
R3 является атомом водорода;
R4 является атомом водорода;
R5 является группой 2- или 3-нитроксиметилциклопентил, 2-, 3- или 4-нитроксициклогексил, группой 2-, 3- или 4- нитроксиметилциклогексил, группой 2-, 3- или 4-(2-нитроксиэтил)циклогексил, группой 2-, 3- или 4-(3-нитроксипропил)- циклогексил, или группой 2-, 3- или 4-(4-нитроксибутил)- циклогексил; и
A является метиленовой группой или этиленовой группой; (34) соединение, в котором W является атомом серы, и X является группой, имеющей формулу: -NR1-;
R1 является атомом водорода;
R2 является атомом водорода, метильной группой или бензильной группой;
R3 является атомом водорода;
R4 является атомом водорода;
R5 является группой 3-нитроксиметилциклопентил, группой 4-нитроксициклогексил, группой 2-, 3- или 4-нитроксиметилциклогексил, группой 2-, 3- или 4-(2-нитроксиэтил)циклогексил, группой 2-, 3- или 4-(3-нитроксипропил)циклогексил или группой 2-, 3- или 4-(4-нитроксибутил)-циклогексил; и
A является метиленовой группой или этиленовой группой;
(35) соединение, в котором W является атомом серы и X является группой, имеющей формулу: -NR1-;
R1 является атомом водорода;
R2 является атомом водорода;
R3 является атомом водорода;
R4 является атомом водорода;
R5 является группой 3- или 4-нитроксиметилциклогексил, группой 4-(2-нитроксиэтил)циклогексил, группой 4-(3- нитроксипропил)циклогексил или группой 4-(4-нитроксибутил)- циклогексил; и
A является метиленовой группой; и
(36) соединение, в котором W является атомом серы и X является группой, имеющей формулу: -NR1-;
R1 является атомом водорода;
R2 является атомом водорода;
R3 является атомом водорода;
R4 является атомом водорода;
R5 является группой 4-нитроксиметилциклогексил; и
A является группой метилен; и
Предпочтительными соединениями, имеющими общую формулу (I), могут быть специально проиллюстрированные в табл. 1 и 2 (см. в конце описания). Соединения, представленные в табл. 1 и 2, имеют структурные формулы (I-1) и (I-2), соответственно.
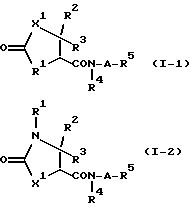
В табл. 1 и 2 сокращения обозначают следующие группы.
Aze ... азетидинил
Azi ... азиридинил
Bu ... бутил
Buc ... циклобутил
Bz ... бензил
Et ... этил
Fur ... фурил
Hxc ... циклогексил
Me ... метил
Np ... нафтил
Ph ... фенил
Pip ... пиперидинил
Pnc ... циклопентил
Prc ... циклопропил
Pyr ... пиридил
Pyrr ... пирролидинил
Then ... тиенил
Thiz ... тиазолил
В табл. 1 и 2 предпочтит. соединениями являются:
Соединение N 1-1, 1-5, 1-6, 1-8, 1-9, 1-14, 1-17, 1-29, 1- 30, 1- 32, 1-36, 1-37, 1-39, 1-40, 1-45, 1-48, 1-59, 1-60, 1-61, 1-64, 1- 65, 1-69, 1-70, 1-72, 1-78, 1-81, 1-92, 1-93, 1-94, 1-96, 1-97, 1- 99, 1-101, 1-103, 1-105, 1-124, 1-128, 1-129, 1-130, 1- 138, 1-169, 1-170, 1-178, 1-189, 1-190, 1-198, 1-207, 1-210, 1- 213, 1-216, 1-219, 1-243, 1-245, 1-247, 1-249, 1-251, 1-282, 1-295, 1-309, 1- 315, 1-346, 1-349, 1-351, 1-353, 1-355, 1-374, 1- 388, 1-419, 1- 439, 1-457, 1-460, 1-463, 1-466, 1-469, 1-493, 1- 495, 1-497, 1- 499, 1-501, 1-513, 1-525, 1-537, 1-549, 1-561, 1- 573, 1-585, 1- 597, 1-609, 1-621, 1-633, 1-645, 1-657, 1-669, 1- 681, 1-693, 1- 705, 1-717, 1-729, 1-741, 1-753, 1-765, 1-777, 1- 789, 1-801, 1- 813, 1-825, 1-837, 1-849, 1-861, 1-873, 1-885, 1- 888, 1-891, 1- 894, 1-897, 1-900, 1-903, 1-906, 1-909, 1-912, 1- 915, 1-921, 1-924, 1-927, 1-930, 1-1224, 2-1, 2-32, 2-36, 2-45, 2-59, 2-60, 2-61, 2-65, 2-96, 2-99, 2-101, 2-105, 2-124, 2-138, 2-169, 2-189, 2-207, 2-210, 2-213, 2-216, 2-243, 2-245, 2-247, 2- 249, 2-251, 2-282, 2-315, 2-346, 2-349, 2-351, 2-353, 2-355, 2-374, 2-388, 2-419, 2-439, 2-457, 2-460, 2-463, 2-466, 2-469, 2-493, 2-495, 2-497, 2-499, 2-501, 2-513, 2-525, 2-537, 2-549, 2-561, 2-573, 2- 585, 2-597, 2-609, 2-621, 2-633, 2-645, 2-657, 2-669, 2-681, 2- 693, 2-705, 2-717, 2-729, 2-741, 2-753, 2-765, 2-777, 2-789, 2- 801, 2-813, 2-825, 2-837, 2-849, 2-861, 2-873, 2-885, 2-888, 2- 891, 2-894, 2-897, 2-900, 2-903, 2-906, 2-909, 2-912, 2-915 and 2- 921.
Более предпочтительными соединениями являются: Соединение N 1-1, 1-5, 1-8, 1-14, 1-29, 1-30, 1-32, 1-36, 1-39, 1- 45, 1-48, 1-59, 1-60, 1-61, 1-64, 1-65, 1-69, 1-70, 1-72. 1- 78, 1-81, 1-92, 1-93, 1-94, 1-96, 1-97, 1-99, 1-101, 1-103, 1-105, 1-124, 1-128, 1-129, 1-130, 1-138, 1-169, 1-170, 1-178, 1-189, 1-190, 1-198, 1-207, 1-210, 1-213, 1-216, 1-219, 1-243, 1-245, 1- 247, 1-249, 1-251, 1-282, 1-295, 1-309, 1-315, 1-346, 1-349, 1- 351, 1-353, 1-419, 1-439, 1-501, 1-513, 1-525, 1-573, 1-585, 1- 621, 1-633, 1-681, 1-729, 1-753, 1-777, 1-900, 1-924, 1-1224, 2-1, 2-32, 2-36, 2-45, 2-59, 2-60, 2-61, 2-65, 2-99 and 2-169.
Особенно предпочтительными соединениями являются:
Соединение N 1-32: N-(4-нитроксиметилциклогексилметил)-2- оксотиазолидин-4-илкарбоксамид,
Соединение N 1-36: N-(4- нитроксиметилциклогексилметил)-5- метил-2-оксотиазолидин-4- илкарбоксамид,
Соединение N 1-39: N-(4- нитроксиметилциклогексилметил)-2-оксо-5-(2-тиенил)тиазолидин-4- илкарбоксамид,
Соединение N 1-45: N-(4- нитроксиметилциклогексилметил)-5-(4-метоксифенил)- 2-оксотиазолидин-4-илкарбоксамид,
Соединение N 1-59: N-(4- нитpoкcимeтилциклoгeкcилмeтил)-5-бензил-2-оксотиазолидин-4- илкарбоксамид,
Соединение N 1-60: N-(4- нитроксиметилциклогексилметил)-5-(4- метилбензил)-2- оксотиазолидин-4-илкарбоксамид,
Соединение N 1-61: N-(4- нитроксиметилциклогексилметил)-5-(4-метоксибензил)-2- оксотиазолидин-4-илкарбоксамид,
Соединение N 1-65: N-[2-(4- нитроксиметилциклогексил)этил)-2-оксотиазолидин-4-илкарбоксамид,
Соединение N 1-69: N-[2-(4-нитроксиметилциклогексил)этил)- 5-метил-2-оксотиазолидин-4-илкарбоксамид,
Соединение N 1-72: N-[2-(4-нитроксиметилциклогексил) этил)]-2-оксо-5-(2-тиенил) тиазолидин-4-илкарбоксамид,
Соединение N 1-78: N-[2-(4- нитроксиметилциклогексил)этил)]-5-(4-метоксифенил)-2- оксотиазолидин-4-илкарбоксамид,
Соединение N 1-92: N-[2-(4- нитроксиметилциклогексил)этил)]- 5-бензил-2-оксотиазолидин-4- илкарбоксамид,
Соединение N 1-93: N-[2-(4- нитроксиметилциклогексил)этил)]-5-(4-метилбензил)-2- оксотиазолидин-4-илкарбоксамид,
Соединение N 1-94: N-[2-(4- нитроксиметилциклогексил)этил)]-5-(4-метоксибензил)-2- оксотиазолидин-4-илкарбоксамид,
Соединение N 1-169: N-[4-(2- нитpoкcиэтил)циклогeкcилмeтил]-2- оксотиазолидин-4-илкарбоксамид,
Соединение N 1-207: N-[2-[4- (3-нитроксипропил)-циклогексил]этил]-2-оксотиазолидин-4- илкарбоксамид,
Соединение N 1-900: N-[4-(3- нитроксипропил)циклогексилметил]-2-оксотиазолидин-4- илкарбоксамид,
Соединение N 1-1224: N-[4-(4-нитроксибутил)циклогексил-метил] -2-оксотиазолидин-4-илкарбоксамид,
Соединение N 2-32: N-(4- нитроксиметилциклогексилметил)-2-оксотиазолидин-5-илкарбоксамид,
Соединение N 2-36: N-(4-нитроксиметилциклогексилметил)-4-метил-2- оксотиазолидин-5-илкарбоксамид,
Соединение N 2-45: N-(4- нитроксиметилциклогексилметил)-4-(4-метоксифенил) -2- оксотиазолидин-5-илкарбоксамид,
Соединение N 2-59: N- (4-нитроксиметилциклогексилметил)-4-бензил-2-оксотиазолидин-5- илкарбоксамид,
Соединение N 2-60: N- (4-нитроксиметилциклогексилметил)-4-(4-метилбензил) -2- оксотиазолидин-5-илкарбоксамид, и
Соединение N 2-61: N-(4- нитроксиметилциклогексилметил)-4-(4-метоксибензил)-2- оксотиазолидин-5-илкарбоксамид.
Соединение, имеющее общую формулу (I) по настоящему изобретению, легко получается, согласно следующим способам.
Способ A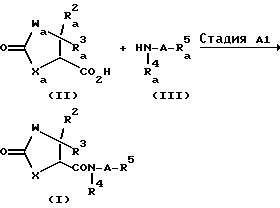
В вышеуказанных формулах W, X, R2, R3, R4, R5 и A имеют значения, указанные выше, и Wa, Ха, R2a, R3a, R4a и R5a, каждый, представляют те же значения, что и W, X, R2, R3, R4 и R5 соответственно, за исключением того, что аминогруппа или иминогруппа (-NH-) в каждой группе может быть необязательно защищена (предпочтительно, защищенная аминогруппа или иминогруппа), и R5b представляет замещенную C3-C6 циклоалкильную группу, необязательно содержащую атом азота [заместителем является, по существу, группа, имеющая формулу: -B-OH (где B имеет те же значения, что указано выше) и желательно C1-C6 алкильную группу (иминогруппа в группе может быть защищена)].
Защитная группа для аминогруппы или иминогруппы не ограничивается особо, поскольку она обычно используется в области синтетической органической химии, и включает, например, трет-бутильную группу, трет-бутоксикарбонильную группу, бензильную группу, которая может быть необязательно защищена C1-C6 алкилом, C1-C6 алкокси или галогеном, такую как бензил, метилбензил, метоксибензил, фторбензил и хлорбензил, бензилоксикарбонильную группу, которая может быть необязательно защищена C1-C6 алкилом, C1-C6 алкокси или галогеном, такую как бензилоксикарбонил, метилбензилоксикарбонил, метоксибензилоксикарбонил, фторбензилоксикарбонил и хлорбензилоксикарбонил или галогеноацетильную группу, такую как хлорацетил, бромацетил и иодацетил, предпочтительно, трет-бутильную группу, трет- бутоксикарбонильную группу, п-метоксибензильную группу, п- метоксибензилоксикарбонильную группу, хлорацетильную группу, бромацетильную группу или иодацетильную группу, более предпочтительно, трет-бутоксикарбонильную группу, п- метоксибензилоксикарбонильную группу и, особенно предпочтительно, трет-бутоксикарбонильную группу.
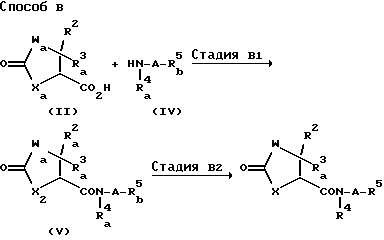
Способ A является способом получения соединения (I).
Стадия A1 является стадией получения соединения, имеющего общую формулу (I), и ее проводят путем взаимодействия соединения, имеющего общую формулу (II) или его реакционно-способного производного (галогенангидриды кислот, смешанные ангидриды кислот или активные сложные эфиры) с соединением, имеющим общую формулу (III), или его кислотно- аддитивной солью (например, соли минеральных кислот, такие как гидрохлориды, нитраты и сульфаты) в инертном растворителе, и удаления защитной группы, такой как аминогруппа и т.д., у образующегося соединения.
Взаимодействие соединения (II) с соединением (III) проводят, например, галогенангидридным методом, смешанно-ангидридным методом, методом с активными сложными эфирами или методом конденсации.
Галогенангидридный метод осуществляют путем взаимодействия соединения (II) с галогенирующим агентом (например, тионилхлоридом, оксалилхлоридом, пентахлоридом фосфора и тому подобное) с получением галогенангидрида кислоты, и затем путем взаимодействия галогенангидрида кислоты с соединением (III), или его кислотно-аддитивной солью в инертном растворителе в присутствии или отсутствие основания.
Используемое здесь основание может включать, например, органические амины, такие как триэтиламин, N-метилморфолин, пиридин и 4-диметиламинопиридин; гидрокарбонаты щелочного металла, такие как гидрокарбонат натрия и гидрокарбонат калия; и карбонаты щелочного металла, такие как карбонат натрия и карбонат калия, и, предпочтительно, органические амины.
Используемый здесь инертный растворитель не ограничивается особо, поскольку он не влияет на реакцию, и может включать, например, углеводороды, такие как гексан, циклогексан, бензол, толуол и ксилол; галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и тетрахлорид углерода; простые эфиры, такие как эфир, тетрагидрофуран и диоксан; кетоны, такие как ацетон; амиды, такие как N,N- диметилформамид, N,N-диметилацетамид, N-мeтил-2-пиppoлидoн и гексаметилфосфорамид; и сульфоксиды, такие как диметилсульфоксид, и, предпочтительно, углеводороды, галогенированные углеводороды, простые эфиры или амиды.
Температура реакции изменяется в зависимости от исходных соединений (II) и (III), типа растворителя и т.п., и температура реакции, как для взаимодействия галогенирующего агента с соединением (II), так и для взаимодействия галогенангидрида кислоты с соединением (III), составляет обычно от -20oC до 150oC. Предпочтительно, температура для первого взаимодействия составляет от -10oC до 50oC, и температура для последнего взаимодействия составляет от 0oC до 100oC. Время реакции изменяется в зависимости от температуры реакции и т. п. , и время реакции для обоих взаимодействий составляет обычно от 15 минут до 24 часов (предпочтительно, от 30 минут до 16 часов).
Метод со смешанным ангидридом кислоты проводят путем взаимодействия C1-C6 алкилгалогенкарбоната, ди-C1-C6 алкил-цианофосфорной кислоты или ди-C5-C10 арилфосфорилазида с соединением (II) с получением смешанного ангидрида кислоты и затем путем взаимодействия смешанного ангидрида кислоты с соединением (III) или его кислотно-аддитивной солью.
Реакцию для получения смешанного ангидрида кислоты проводят путем взаимодействия C1-C6 алкилгалогенкарбоната, такого как метилхлоркарбонат, этилхлоркарбонат, изобутилхлоркарбонат и гексилхлоркарбонат (предпочтительно, этилхлоркарбонат или изобутилхлоркарбонат), ди- C1-C6 алкилцианофосфорной кислоты, такой диметилцианофосфорная кислота, диэтилцианофосфорная кислота и дигексилцианофосфорная кислота (предпочтительно, диэтилцианофосфорная кислота), или ди-C6-C10 арилфосфорилазида, такого как дифенилфосфорилазид, ди(п- нитрофенил)фосфорилазид и динафтилфосфорилазид (предпочтительно, дифенилфосфорилазид), с соединением (II), предпочтительно, в инертном растворителе в присутствии основания.
Используемые здесь основание и инертный растворитель являются подобными тем, которые используются по галогенангидридому методу.
Температура реакции изменяется в зависимости от исходного соединения (II), типа растворителя и т. п. , и составляет обычно от -20oC до 50oC (предпочтительно, от 0oC до 30oC). Время реакции изменяется в зависимости от температуры реакции и т. п. , и обычно составляет от 15 минут до 24 часов (предпочтительно, от 30 минут до 16 часов).
Взаимодействие смешанного ангидрида с соединением (III) или его кислотно-аддитивной солью предпочтительно проводят в инертном растворителе в присутствии или в отсутствие основания. Используемые здесь основание и инертный растворитель подобны тем, которые используются по галогенангидридному методу.
Температура реакции изменяется в зависимости от исходного соединения (III), типа растворителя и т. п. , и составляет обычно от -20oC до 100oC (предпочтительно от -10oC до 50oC). Время реакции изменяется в зависимости от температуры реакции и т.п., и обычно составляет от 15 минут до 24 часов (предпочтительно от 30 минут до 16 часов).
По настоящему способу, в случае, где используются диалкилцианофосфорная кислота или диарилфосфорилазид, соединение (II) и соединение (III) могут быть подвергнуты прямому взаимодействию в присутствии основания.
Метод с активным сложным эфиром проводят путем взаимодействия соединения (II) с активным этерифицирующим агентом (например, N- гидроксипроизводное, такое как N-гидроксисукцинимид, N- гидроксибензотриазол и т.д.) в присутствии конденсирующего агента (например, дициклогексилкарбодиимид и карбонилдиимидазол) с получением активного сложного эфира и путем взаимодействия активного сложного эфира с соединением (III) или его кислотно-аддитивной солью.
Реакция получения активного сложного эфира предпочтительно проводится в инертном растворителе, и используемый здесь инертный растворитель является подобным применяемому по галогенангидридному методу.
Поскольку температура реакции изменяется в зависимости от исходных соединений (II) и (III), типа растворителя и т.д., в реакции активной этерификации она обычно составляет от -20oC до 50oC (предпочтительно от -10 oC до 30 oC), и при взаимодействии активного сложно эфирного производного с соединением (III) она обычно составляет от -20 oC до 50oC (предпочтительно от -10oC до 30oC). Время реакции изменяется в зависимости от температуры реакции и т. д. , и время реакции для обеих реакций составляет обычно от 15 до 24 часов (предпочтительно, от 30 минут до 16 часов).
Конденсационный метод проводят путем взаимодействия соединения (II) и соединения (III), или их кислотно-аддитивных солей непосредственно в присутствии конденсирующего агента (например, дициклогексилкарбодиимид, карбонилдиимидазол и гидрохлорид 1-(N,N-диметиламинопропил)-3-этилкарбодиимид).
Настоящую реакцию осуществляют подобно реакции получения активного сложного эфира.
Защитную группу у аминогруппы или иминогруппы удаляют после завершения вышеуказанной реакции по способу, обычно используемому в области синтетической органической химии.
В случае, когда защитная группа является трет-бутильной группой, трет-бутоксикарбонильной группой, метоксибензильной группой или метоксибензилкарбонильной группой, ее удаляют путем взаимодействия соответствующего соединения с кислотой (например, минеральная кислота, такая как хлористоводородная кислота, серная кислота и азотная кислота, органическая кислота, такая как уксусная кислота, трифторуксусная кислота, метансульфоновая кислота и п-толуолсульфоновая кислота, предпочтительно, хлористоводородная кислота) в инертном растворителе (например, простой эфир, такой как эфир, тетрагидрофуран и диоксан, галогенированный углеводород, такой как дихлорметан и 1,2-дихлорэтан, или ароматический углеводород, такой как бензол, толуол и ксилол, предпочтительно, эфир) при от 0oC до 50oC (предпочтительно при около комнатной температуре) в течение от 30 минут до 5 часов (предпочтительно, от 1 часа до 2 часов).
Между тем, в случае, когда защитная группа является галогенацетильной группой, ее удаляют путем взаимодействия соответствующего соединения с тиомочевиной в инертном растворителе (например, амид, такой как диметилформамид и диметилацетамид, или сульфоксид, такой как диметилсульфоксид, предпочтительно, амид) при от 0oC до 50oC (предпочтительно при комнатной температуре) в течение от 30 минут до 5 часов (предпочтительно, от 1 часа до 2 часов).
Более того, в случае, когда защитная группа является бензильной группой, которая может быть необязательно замещена, или бензилкарбонильной группой, которая может быть необязательно замещена, ее удаляют путем взаимодействия соответствующего соединения с водородом (давление, предпочтительно, от 1 до 3 атм.) в инертном растворителе (например, простой эфир, такой как эфир, тетрагидрофуран и диоксан, в спирте, таком как метанол и этанол (предпочтительно спирт) в присутствии катализатора каталитического восстановления (например, палладий на угле, оксид платины) при от 0oC до 50oC (предпочтительно, при приблизительно комнатной температуре) в течение от 30 минут до 10 часов (предпочтительно, от 1 часа до 5 часов).
После завершения реакции желаемое соединение в каждой реакции выделяют из реакционной смеси путем общепринятых способов, например, путем сбора выпавших кристаллов фильтрацией, после того, как нерастворенные частицы удалены путем фильтрации, если необходимо; или путем удаления нерастворенных частиц путем фильтрации, если необходимо, нейтрализации, если необходимо, отгонки растворителя, добавления воды к реакционной смеси, экстракции несмешивающимся с водой органическим растворителем, таким как этилацетат, высушивания органического слоя и выпаривания экстрагированного растворителя. Если необходимо, полученное таким образом соединение может быть далее очищено обычными методами, например, перекристаллизацией и хроматографией на колонке.
Метод B является способом получения соединения (I).
Стадия B1 является стадией получения соединения, имеющего общую формулу (V) путем взаимодействия соединения (II), или его реакционноспособного производного (галогенангидрид, смешанный ангидрид или активный сложный эфир) с соединением, имеющим общую формулу (IV), или его кислотно-аддитивной солью в инертном растворителе. Настоящую стадию осуществляют, например, галогенангидридным методом, смешанно-ангидридным методом, методом с активным сложным эфиром или конденсационным методом, подобным первой стадии A1 способа A.
Стадия B2 является стадией получения соединения, имеющего общую формулу (I) и ее проводят путем взаимодействия соединения, имеющего общую формулу (V), с нитрующим агентом в отсутствие растворителя, или в инертном растворителе и удаления защитной группы, такой как аминогруппа и т.д., у полученного соединения.
Используемый здесь нитрующий агент может включать, например, дымящую азотную кислоту, тетрафторборид нитроколлодия, тионилхлорид азотная кислота, тионилазотную кислоту и тетрафторборид нитрония, и предпочтительно, дымящую азотную кислоту, тетрафторборид нитроколлодия или тионилхлорид-азотную кислоту.
Используемый здесь инертный растворитель не ограничивается особо, поскольку он не влияет на реакцию, и может включать, например, углеводороды, такие как гексан, циклогексан, бензол, толуол и ксилол, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и тетрахлорид углерода, простые эфиры, такие как эфир, тетрагидрофуран и диоксан, кетоны, такие как ацетон, нитрилы, такие как ацетонитрил, амиды, такие как N,N- диметилформамид, N, N-диметилацетамид, N-метил-2-пирролидон и гексаметилфосфорамид, и сульфоксиды, такие как диметилсульфоксид, предпочтительно, галогенированные углеводороды, простые эфиры, нитрилы или амиды, и особенно предпочтительны, нитрилы.
Температура реакции изменяется в зависимости от исходного соединения (V), типа нитрующего агента и т.д., и обычно составляет от 20oC до 50oC (предпочтительно, около комнатной температуры). Время реакции изменяется в зависимости от реакционной температуры и т.д., и обычно составляет от 30 минут до 24 часов (предпочтительно, от 1 часа до 10 часов).
Защитную группу у амино или иминогруппы удаляют после завершения вышеуказанной реакции тем же образом, что и на последней стадии A1 метода A.
После завершения реакции, желаемое соединение в каждой реакции выделяют из реакционной смеси обычными способами. Например, желаемое соединение может быть получено путем сбора выпавших кристаллов путем фильтрации; или путем нейтрализации, если необходимо, отгонки растворителя, добавления воды к реакционной смеси, экстрагирования несмешивающимся с водой органическим растворителем, таким как этилацетат, высушивания органического слоя и упаривания экстрагирующего растворителя. Если необходимо, полученное таким образом соединение может быть далее очищено обычными методами, например перекристаллизацией и хроматографией на колонке.
Исходное соединение (II) является известным или легко получается в соответствии с известными способами [например, Aust. J. Chem., 21, 1891 (1968), J. Chem. Soc., 4614 (1958), NIHON YAKUGAKU ZASSHI (Japanese Journal of Pharmacy), 73, 949, (1953), Chemische, Berichte, 91, 160 (1958), NIHON KAGAKU ZASSHI (Japanese Journal pf Chemistru), 82, 1075 (1961) или нерассмотренная Японская Патентная публикация N (KOKAI) Hei-5-213910].
Исходные соединения (III) и (IV) являются известными или легко получаются в соответствии с известными способами [например, J. Chem. Soc. Perkin. Trans. , 1, 1770 (1979), Tetrahedron Lett., 4285 (1970), Heterocycles, 34, 739 (1992), Chem. Abst. 66, 62144w (1967) и тому подобное].
Исходные соединения (III) и (IV) также получают в соответствии со следующими способами.
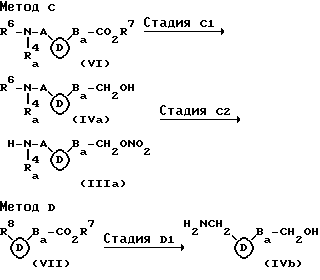
В вышеуказанных формулах R4a, A и B имеют те же значения, что определены выше; R6 представляет атом водорода или аминозащитную группу; R7 представляет атом водорода, C1-C6 алкильную группу или C1-C6 алканоильную группу (например, формил, ацетил, пропионил, бутирил, изобутирил, валерил, изовалерил или группу гексаноил, предпочтительно, группу ацетил, пропионил, бутирил или изобутирил, и, особенно предпочтительно, группу изобутирил); R7а представляет атом водорода или C1-C6 алкильную группу; R8 представляет карбамоильную группу или цианогруппу; R9 представляет цианогруппу или группу, имеющую формулу: - CH(CO2R7a)2 (где R7a имеет то же значение, что определено выше); R10 представляет гидроксизащитную группу (например, 5- или 6- членную циклическую простую эфирную группу, такую как 2- тетрагидрофурил, 2-тетрагидропиранил, 4-метокси-2- тетрагидропиранил и 2-тетрагидротиопиранил, три-C1-C4 алкилсилильную группу, такую как триметилсилил, триэтилсилил и трет-бутилдиметилсилил, бензильную группу, которая может быть необязательно замещена C1-C6 алкилом, C1-C6 алкокси или галогеном, такую как бензил, метилбензил, метоксибензил, фторбензил и хлорбензил, бензилхлоркарбонильную группу, которая может быть необязательно замещена C1-C6 алкилом, C1-C6 алкокси или галогеном, такую как бензилоксикарбонил, метилбензилоксикарбонил, метоксибензилоксикарбонил, фторбензилоксикарбонил и хлорбензилоксикарбонил и, предпочтительно, группу 2-тетрагидропиранил, трет-бутилдиметилсилил или п-метоксибензилоксикарбонил); R11 представляет цианогруппу или азидогруппу; Aa представляет одинарную связь или C1-C5 алкиленовую группу; Ba представляет одинарную связь или C1-C4 алкиленовую группу; группа, имеющая формулу:
представляет C3-C8 циклоалкиленовую группу, содержащую, необязательно, атом азота, который может быть необязательно защищен, и являющуюся необязательно замещенной C1-C6 алкильной группой; Y представляет атом галогена (предпочтительно, атом хлора или атом брома), C1-C6 алкилсульфонилоксигруппу (предпочтительно, метансульфонилоксигруппу или этансульфонилокси группу), или арилсульфонилоксигруппу (предпочтительно, бензолсульфонил группу или толуолсульфонилгруппу); p равно 0 или 1; и q равно 2 или 3.
Метод C является способом получения соединения формулы (IIIa), которое соответствует соединению формулы (III), в котором R5a является замещенной C3-C8 циклоалкильной группой, содержащей, необязательно, атом азота, который, необязательно, может быть защищен (заместителем является, по существу, группа, имеющая формулу: -Ba-CH2ONО2 (где Ba имеет то же значение, что определено выше) и желательно C1-C6 алкильная группа).
Стадия C1 является стадией получения соединения, имеющего общую формулу (IV) и ее проводят путем взаимодействия аминокарбоновой кислоты, имеющей общую формулу (VI), с восстанавливающим агентом (предпочтительно, боргидридное производное, такое как боргидрид натрия и борцианогидрид натрия, и алюмогидридное производное, такое как литий алюминий гидрид) в инертном растворителе (предпочтительно, в простом эфире, таком как эфир и тетрагидрофуран) при от 0oC до 50oC (предпочтительно, при около комнатной температуре) в течение 30 минут до 10 часов (предпочтительно, от 1 часа до 5 часов). Между тем аминогруппа и т.д. в соединении (IV), где R6 является атомом водорода, может быть также защищена путем взаимодействия соединения с трет- бутилхлоридом, трет-бутоксикарбонилхлоридом, трет- бутоксикарбонилбромидом, бензилхлоридом, который может быть необязательно защищен C1-C6 алкилом, C1-C6 алкокси или галогеном, бензилкарбонилхлоридом, который может быть необязательно замещен C1-C6 алкилом, C1-C6 алкокси или галогеном, галогенидом, таким как хлорацетилхлорид, бромацетилбромид и иодацетилхлорид, или дикарбонатом, таким как ди-трет-бутилдикарбонат, дибензилдикарбонат и ди(C1-C6 алкил, C1-C6 алкокси или галогенбензил)дикарбонат в инертном растворителе (предпочтительно, простые эфиры, такие как эфир и тетрагидрофуран, или спирты, такие как метанол и этанол) в присутствии или в отсутствие основания (предпочтительно, аминов, таких как триэтиламин и пиридин) при 0oC до 50oC (предпочтительно, при около комнатной температуре) в течение от 30 минут до 10 часов (предпочтительно, от 1 часа до 5 часов).
Стадия C2 является стадией получения соединения (IlIa) и ее проводят путем нитрования соединения (IVa) и, если необходимо, путем удаления защитной группы, такой как: для аминогруппы и т.д. Настоящую стадию проводят подобно стадии B2 вышеуказанного метода B. Между тем, в реакции удаления защитной группы, такой как для аминогруппы и т.д., защитная группа может быть удалена избирательно путем подбора реакционных условий в зависимости от типа защитной группы.
Метод D является другим способом получения соединения (IVb), которое соответствует соединению (IVa), в котором группа, имеющая формулу: R6-N(R4a)-A- (где R4a, R6 и A имеют те же значения, что определены выше) является аминометильной группой.
Стадия D1 является стадией получения соединения, имеющего общую формулу (IVb) и ее проводят путем взаимодействия соединения, имеющего общую формулу (VII) с восстанавливающим агентом (например, предпочтительно боргидридное производное, такое как боргидрид натрия и борцианоангидрид натрия, или алюминийгидридное производное, такое как литийалюминийгидрид) в инертном растворителе (предпочтительно, простой эфир, такой как эфир и тетрагидрофуран) при от 0oC до 150oC (предпочтительно, от 30oC до 100oC) в течение от 15 минут до 10 часов (предпочтительно, от 30 минут до 5 часов). Между тем, соединение (IVb) может быть получено путем каталитического восстановления продукта со стадии A1 вышеуказанного метода A.
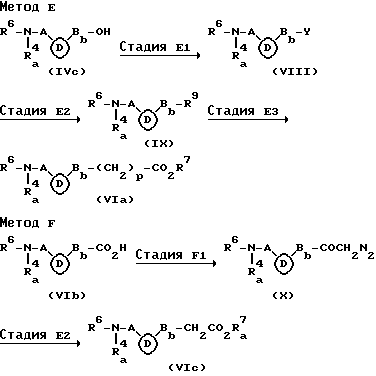
Метод E является способом получения соединения (Via), которое соответствует соединению (VI), в котором группа, имеющая формулу: -Ba-CO2R7Я (где R7 и Ba имеют те же значения, что определены выше) является группой, имеющей формулу: -Bа- (CH2)pCO2R7 (где R7, Ba и p имеют те же значения, что определены выше). Стадия E1 является стадией получения соединения, имеющего общую формулу (VIII), и ее проводят путем взаимодействия соединения формулы (VIc) с галогенидами, такими как тионилхлорид, трихлорид фосфора, трибромхлорид фосфора, оксихлорид фосфора, метансульфонилхлорид, этансульфонилхлорид, бензолсульфонилхлорид, бензолсульфонилбромид и п-толуолсульфонилхлорид или сульфоновыми ангидридами, такими как метансульфоновый ангидрид, этансульфоновый ангидрид, бензолсульфоновый ангидрид и п-толуолсульфоновый ангидрид в инертном растворителе (предпочтительно, простые эфиры, такие как эфир и тетрагидрофуран, или галогенированные углеводороды, такие как метиленхлорид и хлороформ) в присутствии или отсутствие основания (предпочтительно, амины, такие как триэтиламин и пиридин) при от 0oC до 50oC (предпочтительно, при около комнатной температуре) в течение от 30 минут до 10 часов (предпочтительно, от 1 часа до 5 часов). Между тем соответствующий галогенид может быть также получен путем взаимодействия полученного сульфонокси производного с галогенидом щелочного металла, таким как бромид натрия и иодид натрия, в инертном растворителе (предпочтительно, кетоны, такие как ацетон, или амиды, такие как диметилформамид и диметилацетамид) при от 0oC до 50oC (предпочтительно, при около комнатной температуре) в течение от 30 минут до 20 часов (предпочтительно, от 1 часа до 10 часов).
Стадия E3 является стадией получения соединения, имеющего общую формулу (IX), и ее проводят путем взаимодействия соединения (VIII) с цианидом щелочного металла, таким как цианид лития, цианид натрия и цианид калия, или производным малоновой кислоты, имеющим формулу: M+-CH(CO2R7a)2 (где R7a имеет те же значения, что определены выше, и М представляет атом щелочного металла) в инертном растворителе (предпочтительно, простые эфиры, такие как эфир и тетрагидрофуран, или амиды, такие как диметилформамид и диметилацетамид) при от 0oC до 50oC (предпочтительно, при около комнатной температуре) в течение от 30 минут до 10 часов (предпочтительно, от 1 часа до 5 часов).
Между тем, настоящую стадию проводят также, предпочтительно, в присутствии иодида натрия.
Стадия E3 является стадией получения соединения (VIa) и соединения, которое соответствует соединению (VIa), в котором R7 является атомом водорода и p равно 0, получают путем взаимодействия соединения, которое соответствует соединению (IX), в котором R9 является цианогруппой, с кислотой (предпочтительно, минеральной кислотой, такой как соляная кислота, азотная кислота и серная кислота) в водном растворе при от 0oC до 150oC (предпочтительно, от 30oC до 120oC) в течение от 30 минут до 10 часов (предпочтительно, от 1 часа до 5 часов). Между тем, соединение, которое соответствует соединению (VIa), в котором R7 является атомом водорода и p равно 1, получают, если желательно, путем взаимодействия соединения, которое соответствует соединению (IX), в котором R9 является группой, имеющей формулу -CH(CO2R7a)2 (где R7a имеет те же значения, что определены выше) с основанием (предпочтительно, гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия) в инертном растворителе (предпочтительно, водные простые эфиры, такие как водный эфир и водный тетрагидрофуран, или водные спирты, такие как водный метанол и водный этанол) при от 0oC до 50oC (предпочтительно, при около комнатной температуре) в течение от 30 минут до 10 часов (предпочтительно, от 1 часа до 5 часов) для гидролиза, а затем путем нагревания в инертном растворителе (предпочтительно, ароматических углеводородах, таких как бензол, толуол и ксилол) при от 50oC до 200oC (предпочтительно, от 100oC до 150oC) в течение от 30 минут до 10 часов (предпочтительно, от 1 часа до 5 часов).
Более того, соответствующий сложный эфир может быть получен, если желательно, путем взаимодействия полученного таким образом, производного карбоновой кислоты с диазо C1-C6 алкилом, таким как диазометан, диазоэтан и диазогексан, в инертном растворителе (предпочтительно, простые эфиры, такие как эфир и тетрагидрофуран) при от 0oC до 50oC (предпочтительно, при около комнатной температуре) в течение от 5 минут до 2 часов (предпочтительно, от 10 минут до 1 часа), или путем взаимодействия полученного таким образом производного карбоновой кислоты с C1- C6 спиртом, таким как метанол, этанол и гексанол, аналогично стадии A1 вышеуказанного метода A. Соответствующее ацильное производное может быть получено путем взаимодействия производного карбоновой кислоты с C1-C6 алкилгалогенкарбонатом аналогично способу получения смешанного ангидрида на стадии A1 вышеуказанного метода A.
Метод F является способом получения соединения (VIc), которое соответствует соединению (VIa), в котором p равно 1.
Стадия F является стадией получения соединения, имеющего формулу (X) и ее проводят путем взаимодействия исходного соединения с C1-C6 алкилгалогенкарбонатом, таким как метилхлоркарбонат, этилхлоркарбонат, изобутилхлоркарбонат и гексилхлоркарбонат в инертном растворителе (предпочтительно, простые эфиры, такие как эфир и тетрагидрофуран, и галогенированные углеводороды, такие как метиленхлорид и хлороформ) в присутствии или отсутствие основания (предпочтительно, амины, такие как триэтиламин, пиридин и N-метил-морфолин) при от -50oC до 50oC (предпочтительно, от - 20oC до 0oC) в течение от 30 минут до 10 часов (предпочтительно, от 1 часа до 5 часов), и затем путем взаимодействия полученного продукта с диазометаном в инертном растворителе (предпочтительно, простые эфиры, такие как эфир и тетрагидрофуран, и галогенированные углеводороды, такие как метиленхлорид и хлороформ) при от -50oC до 50oC (предпочтительно, от -20oC до 0oC) в течение от 30 минут до 10 часов (предпочтительно, от 1 часа до 5 часов).
Стадия F2 является стадией получения соединения (VIc) и ее проводят путем взаимодействия соединения (X) с избытком воды или C1-C6 спирта, служащих также в качестве инертного растворителя в присутствии производного серебра, такого как карбоксилат серебра, такой как ацетат серебра и бензоат серебра, сульфонат серебра, такой как метансульфонат серебра, бензосульфонат серебра и п-толуолсульфонат, порошок серебра и оксид серебра (предпочтительно, бензоат серебра или оксид серебра), в присутствии или отсутствие органических аминов (например, триэтиламин и пиридин) при от 0oC до 50oC (предпочтительно, при около комнатной температуре) в течение от 30 минут до 10 часов (предпочтительно, от 1 часа до 5 часов). Соединение, которое соответствует соединению (VIс), в котором R7 является атомом водорода, получают взаимодействием соединения (X) с водой, а соединение, которое соответствует соединению (VIc), в котором R7 является C1-C6 алкильной группой, получают путем взаимодействия соединения (X) с C1-C6 спиртом. Полученная таким образом карбоновая кислота может быть этерифицирована или ацилирована аналогично стадии E3 вышеуказанного метода Е.
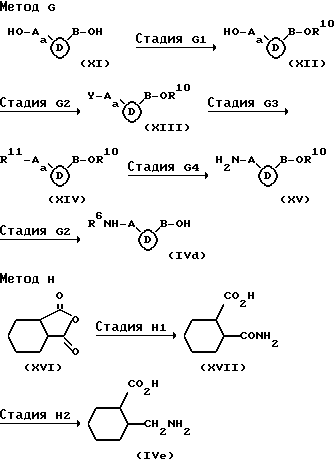
Метод G является методом получения соединения (IVd), которое соответствует соединению (IVa), в котором R4a является атомом водорода.
Стадия GI является стадией получения соединения, имеющего общую формулу (XII), и ее проводят путем защиты гидроксильной группы соединения, имеющего общую формулу (XI). Реакцию защиты гидроксильной группы изменяют в зависимости от типа защитной группы, и ее осуществляют путем взаимодействия, хорошо известным в синтетической органической химии.
В случае, когда защитная группа является 5- или 6-членной циклической эфирной группой, гидроксильная группа может быть защищена путем взаимодействия соответствующего соединения с ненасыщенным простым эфиром, таким как дигидрофуран, дигидропиран, 4-метоксидигидропиран и дигидротиопиран в инертном растворителе (предпочтительно, простые эфиры, такие как эфир и тетрагидрофуран, и галогенированные углеводороды, такие как метиленхлорид и хлороформ) в присутствии кислоты (например, минеральная кислота, такая как соляная кислота, серная кислота и азотная кислота, или органическая кислота, такая как уксусная кислота, трифторуксусная кислота, метансульфоновая кислота и п- толуолсульфоновая кислота, предпочтительно, соляная кислота) при от 0oC до 50oC (предпочтительно, при комнатной температуре) в течение от 30 минут до 5 часов (предпочтительно, от 1 часа до 2 часов). В случае, когда защитная группа является группой три-C1-C4алкилсилильной группой, необязательно замещенной бензильной группой или, необязательно замещенной бензилоксикарбонильной группой, защиту гидроксильной группы проводят путем взаимодействия соответствующего соединения с галогенидом, таким как триметилсилилхлорид, триэтилсилилхлорид, трет-бутилдиметилсилилхлорид, трет-бутилдиметилсилилбромид, бензилхлорид, бензилбромид, метилбензилхлорид, метоксибензилхлорид, фторбензилхлорид, хлорбензилхлорид, бензилоксикарбонилхлорид, метилбензилоксикарбонилхлорид, метоксибензилоксикарбонилхлорид, фторбензилоксикарбонилхлорид и хлорбензилоксикарбонилхлорид, в инертном растворителе (предпочтительно, простые эфиры, такие как эфир и тетрагидрофуран, галогенированные углеводороды, такие как метиленхлорид и хлороформ, амиды, такие как диметилформамид и диметилацетамид, или сульфоксиды,
такие как диметилсульфоксид) в присутствии основания (преимущественно, гидриды щелочного металла, такие как гидрид лития, гидрид натрия и гидрид калия, или амины, такие как триэтиламин, пиридин и N-метилморфолин) при от 0oC до 50oC (предпочтительно при комнатной температуре) в течение от 30 минут до 24 часов (предпочтительно, от 1 часа до 20 часов).
Стадия G2 является стадией получения соединения, имеющего общую формулу (XIII), и ее проводят путем галогенирования или сульфонатирования соединения (XII). Настоящая стадия проводится аналогично стадии E1 вышеуказанного метода E.
Стадия G3 является стадией получения соединения, имеющего общую формулу (XIV), и ее проводят путем взаимодействия соединения (XIII) с цианидами щелочных металлов, такими как цианид лития, цианид натрия и цианид калия, или азидами щелочных металлов, такими как азид лития, азид натрия и азид калия, в инертном растворителе (предпочтительно, простые эфиры, такие как эфир и тетрагидрофуран, амиды, такие как диметилформамид и диметилацетамид, или сульфоксиды, такие как диметилсульфоксид) при от 0oC до 200oC (предпочтительно, от 50oC до 150oC) в течение от 15 минут до 20 часов (предпочтительно, от 30 минут до 10 часов).
Стадия G4 является стадией получения соединения, имеющего общую формулу (XV), и ее проводят путем восстановления соединения (XIV). Настоящую стадию осуществляют аналогично стадии D1 вышеуказанного метода D.
Стадия G5 является стадией получения соединения (IVd) и ее проводят путем удаления гидроксизащитной группы из соединения (XV) и, если желательно, путем защиты аминогруппы.
Гидроксизащитную группу удаляют по способу, обычно используемому в синтетической органической химии.
В случае, когда защитная группа является 5- или 6-членной циклической эфирной группой, метоксибензильной группой или метоксибензилоксикарбонильной группой защитная группа удаляется путем взаимодействия соответствующего соединения с кислотой. Настоящую реакцию проводят аналогично реакции снятия защиты, в которой защитная группа для группы, такой как аминогруппа и т.п., является трет-бутильной группой на стадии A1 вышеуказанного метода A.
В случае, когда защитная группа является тризамещенной силильной группой, защитную группу удаляют путем взаимодействия соответствующего соединения с соединением, которое дает анион фтора, таким как тетрабутиламмоний фторид в инертном растворителе (предпочтительно, простые эфиры, такие как тетрагидрофуран и диоксан) при от -10oC до 50oC (предпочтительно, от 0oC до 30oC) в течение от 2 часов до 24 часов (предпочтительно, от 10 часов до 18 часов).
В случае, когда защитная группа является необязательно замещенной бензильной группой или необязательно замещенной бензилоксикарбонильной группой, защитную группу удаляют, подвергая соответствующее соединение каталитическому восстановлению. Настоящую реакцию проводят аналогично реакции снятия защиты, в котором аминозащитная группа необязательно защищена бензильной группой на стадии A1 вышеуказанного метода A.
Реакцию защиты аминогруппы проводят аналогично стадии C1 вышеуказанного метода C.
Метод H является способом получения соединения, имеющего общую формулу (IVe), включенного в соединение (IVa).
Стадия H1 является стадией получения соединения, имеющего общую формулу (XVII), и ее проводят путем взаимодействия соединения, имеющего общую формулу (XVI) с концентрированным аммиаком при от 0oC до 50oC (предпочтительно, при комнатной температуре) в течение от 30 минут до 20 часов (предпочтительно, от 1 часа до 10 часов).
Стадия H2 является стадией получения соединения (IVe), и ее проводят путем восстановления соединения (XVII). Настоящую стадию проводят аналогично стадии DI вышеуказанного метода D.
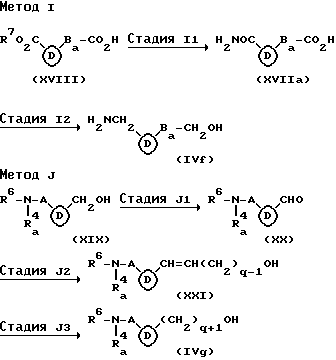
Метод I является способом получения соединения, имеющего общую формулу (IVf), включенного в соединение (IVa).
Стадия I1 является стадией получения соединения, имеющего общую формулу (XVIIa), и ее проводят путем взаимодействия соединения, имеющего общую формулу (XVIII), с концентрированным аммиаком аналогично стадии H1 вышеуказанного метода H.
Стадия I2 является стадией получения соединения (IVf) и ее проводят путем восстановления соединения (XVIIa). Настоящую стадию осуществляют аналогично стадии D1 вышеуказанного метода D.
Метод J является способом получения соединения, имеющего общую формулу (IVg), включенного в соединение (IVa).
Стадия J1 является стадией получения соединения, имеющего общую формулу (XX), и ее проводят путем взаимодействия соединения, имеющего общую формулу (XIX) с окислительным агентом (например, хромовая кислота - пиридин, диметилсульфоксид-оксалилхлорид, диметилсульфоксид-газообразный хлор, диметилсульфоксид-ангидрид трифторуксусной кислоты и сукцинимидодиметилсульфоний хлорид, предпочтительно, диметилсульфоксид-оксалилхлорид) в инертном растворителе (предпочтительно, галогенированные углеводороды, такие как дихлорметан и хлороформ, амиды, такие как диметилформамид и диметилацетамиды, и сульфоксиды, такие как диметилсульфоксид) при от ОoC до 50oC (предпочтительно, при комнатной температуре) в течение от 15 минут до 20 часов (предпочтительно, от 30 минут до 10 часов).
Стадия J2 является стадией получения соединения, имеющего общую формулу (XXI), и ее проводят путем взаимодействия соединения (XX) с соединением, имеющим формулу: (R12)3P+(CH2)qOH Ya- (где q имеет те же значения, что определены выше, R12 представляет C6-C10 арильную группу, и Ya представляет атом галогена) в инертном растворителе (предпочтительно, простые эфиры, такие как эфир и тетрагидрофуран) в присутствии основания (предпочтительно, сильно основные амины, такие как 1,5- диазабицикло[4,3,0] нон-5-ен и 1,8-диазабицикло[5,4,0] ундец-7-ен, и алкиллитий, такой как бутиллитий) при от -20oC до 150oC (предпочтительно, от 0oC до 100oC) в течение от 1 часа до 10 дней (предпочтительно, от 5 часов до 7 дней).
Стадия J3 является стадией получения соединения (IVg) и ее проводят, подвергая соединение (XXI) каталитическому восстановлению аналогично стадии A1 вышеуказанного метода A. Метод К является методом получения соединения, имеющего общую формулу (IVh), включенного в соединение (IVa).
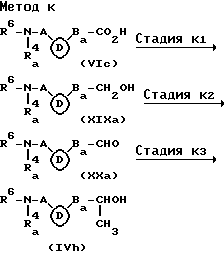
Стадия K1 является стадией получения соединения, имеющего общую формулу (XIXa), и ее проводят путем восстановления соединения, имеющего общую формулу (VIс). Настоящую стадию проводят аналогично стадии D1 вышеуказанного метода D.
Стадия K2 является стадией получения соединения (XXa), и ее проводят путем окисления соединения (XIXa). Настоящую стадию проводят аналогично стадии J1 метода D.
Стадия K3 является стадией получения соединения (IVh), и ее проводят путем взаимодействия соединения (XXa) с реактивом Гриньярда, таким как метилмагнийхлорид и метилмагнийбромид в инертном растворителе (предпочтительно, простые эфиры, такие как эфир и тетрагидрофуран) при от -20oC до 50oC (предпочтительно, от 0oC до 30oC) в течение от 10 минут до 5 часов (предпочтительно, от 15 минут до 2 часов).
После завершения реакции желаемое соединение в каждой реакции выделяют из реакционной смеси обычными способами. Например, желаемое соединение может быть получено путем сбора выпавших кристаллов путем фильтрации; или путем удаления нерастворимых веществ, если необходимо, если реакционная смесь содержит нерастворимые вещества, нейтрализацией реакционного раствора, если необходимо, если реакционный раствор является кислым или щелочным, экстрагированием несмешиваемым с водой органическим растворителем, таким как этилацетат, высушиванием органического слоя и выпариванием экстрагирующего растворителя. Если необходимо, желаемое соединение может быть далее очищено обычными способами, например, перекристаллизацией и колоночной хроматографией.
Исходные соединения (VI), (VII), (XI), (XVI) и (XVIII) известны и легко получаются известными способами (например, Chem. Abst. 64, 3379f (1966), Chemische, Berichte, 67, 1783 (1934), Chemische, Berichte, 71, 759 (1938), J. Am. Chem. Soc., 62, 2891 (1940), J. Am. Chem. Soc., 82, 3257 (1960), J. Am. Chem. Soc., 88, 3522 (1966), Tetrahedron, 21, 2725 (1965), Tetrahedron, 48, 9753 (1992), и т.п.)
Исходное соединение (III) может быть легко получено путем взаимодействия соединения (VI) аналогично стадии B2 метода B.
Соединение, имеющее общую формулу (I), или его фармакологически приемлемая соль по настоящему изобретению проявляют сильное расслабляющее действие на коллатеральные сосуды, не вызывая нежелательных побочных эффектов, таких как головная боль, головокружение, тахикардия, или вредных воздействий на систему пищеварения, печень, кости и т.д., они не являются быстропроходящими по действию. Следовательно, оно может использоваться в качестве терапевтического средства и профилактического средства (предпочтительно, терапевтического средства) при грудной жабе.
B случае, когда соединение (I) по настоящему изобретению и его фармакологически приемлемая соль используются в качестве терапевтического средства или профилактического средства при грудной жабе, соединение или его смесь с фармакологически приемлемым наполнителем или разбавителем может быть введено перорально или парентерально, либо в виде таблетки, капсулы, гранулы, порошка, сиропа либо препарата для инъекции.
Эти препараты получают известными способами, используя добавки, такие как наполнители (например, производные сахара, такие как лактоза, сахароза, глюкоза, маннитол и сорбитол; производные крахмала, такие как кукурузный крахмал, картофельный крахмал, α-крахмал, декстрин и карбоксиметил крахмал; производные целлюлозы, такие как кристаллическая целлюлоза, низший гидроксипропилзамещенная целлюлоза, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза, кальций карбоксиметилцеллюлоза и поперечно сшитая натрий карбоксиметилцеллюлоза; гуммиарабик; декстран; Pullulan; производные силиката, такие как легкий ангидрид кремниевой кислоты, синтетический алюмосиликат и алюминат магний мета- кремниевой кислоты; производные фосфата, такие как фосфат кальция; карбонатные производные, такие как карбонат кальция; и сульфатные производные, такие как сульфат кальция), связывающие вещества (например, вышеуказанные наполнители; желатин; поливинилпирролидон; и Macrogol); разрыхляющие агенты (например, вышеуказанные наполнители; химически модифицированные производные крахмал-целлюлозы, такие как натрий кросскарамелоза, натрий карбоксиметил крахмал и сшитый поливинилпирролидон), смазывающие вещества (например, тальк; стеариновая кислота; и стеараты металлов, такие как стеарат кальция и стеарат магния; коллоидный кремний; воски, такие как пчелиный воск и спермацет; борная кислота; гликоль; карбоновые кислоты, такие как фумаровая кислота и адипиновая кислота; карбоксилат натрия, такой как бензоат натрия; сульфаты, такие как сульфат натрия; лейцин; лаурилсульфаты, такие как лаурилсульфат натрия и лаурилсульфат магния; кремниевые кислоты, такие как ангидрид кремниевой кислоты и гидрат кремниевой кислоты; и производные крахмала среди вышеуказанных наполнителей), стабилизаторы (например, п- гидроксибензоаты, такие как метилпарабен и пролилпарабен; спирты, такие как хлорбутанол, бензиловый спирт и фенетиловый спирт; бензалконий хлорид; фенолы, такие как фенол и крезол, тимерозал; уксусный ангидрид; и сорбитановая кислота); коррегирующие вещества, например обычно используемые подслащивающие агенты, подкисливающие агенты и отдушки), разбавители и растворители для инъекционных агентов (например, вода, этанол и глицерин).
Хотя доза изменяется в зависимости от состояния и возраста лечимого пациента, желательно вводить от 1 до 6 раз в день, в зависимости от состояния: в случае перорального введения нижняя граница составляет 1 мг на каждый прием (предпочтительно, 5 мг), а верхняя граница составляет 1000 мг (предпочтительно, 300 мг) для взрослого; и в случае внутривенного введения нижняя граница составляет 0,1 мг на каждый прием (предпочтительно, 0,5 мг), а верхняя граница составляет 100 мг (предпочтительно, 50 мг) для взрослого.
[Наилучший способ осуществления изобретения]
Настоящее изобретение будет описано более конкретно ниже при помощи примеров, ссылочных примеров, примеров исследования и примеров получения, однако изобретение ими не ограничивается.
Пример 1
N-[Транс-4-нитроксиметилциклогексилметил] -(4R) - 2-оксо-тиазолидин-4-илкарбоксамид (Соединение N 1-32)
В 7 мл сухого бензола суспендировали 0,35 г (4R)-2-оксо-4- тиазолидинкарбоновой кислоты и 0,42 мл оксалилхлорида и при комнатной температуре к ним добавили несколько капель диметилформамида и перемешивали при комнатной температуре в течение 2 часов. Растворитель отгоняли при пониженном давлении с получением хлорангидрида кислоты в виде бледно-желтого масла.
Тем временем, 0,51 г гидрохлорида транс-4-нитроксимет илциклогексилметиламина суспендировали в 10 мл сухого дихлорметана и к нему при перемешивании по каплям добавили 0,95 мл триэтиламина и 5 мл раствора хлорангидрида кислоты в сухом дихлорметане при охлаждении на льду и перемешивали при той же температуре в течение 1 часа. Растворитель отгоняли при пониженном давлении. Остаток подвергали колоночной хроматографии на колонке с силикагелем, используя этилацетат в качестве элюирующего растворителя для отделения и очистки, и кристаллизовали из эфира с получением 0,30 г желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 117-119oC (разложение)
Спектр ЯМР (CDCl3+d6-ДМСО) δ ppm: 0,90-1,15 (4H, м), 1,40-1,60 (1H, м), 1,60-1,95 (5H, м), 3,14 (2H, м), 3,60-3,78 (2H, м), 4,20-4,38 (3H, м), 7,10 (1H, ушир.), 7,67(1H, ушир.)
Пример 2
N-[Цис-4-нитроксиметилциклогексилметил] -(4R)-2- оксотиазолидин-4-илкарбоксамид (Соединение N 1-32)
В 8 мл сухого тетрагидрофурана суспендировали 0,40 г (4R)-2-оксо-4- тиазолидинкарбоновой кислоты и 0,73 г гидрохлорида цис-4- нитроксиметилциклогексилметиламина, и к ним при перемешивании добавляли 1,14 мл триэтиламина и 0,70 мл дифенилфосфоразида при охлаждении на льду, и полученную смесь перемешивали при комнатной температуре в течение 4 часов. Растворитель отгоняли при пониженном давлении и остаток очищали путем хроматографии на колонке с силикагелем (элюирующий растворитель: циклогексан/этилацетат = 2/1). Полученное таким образом желтое масло обрабатывали эфиром с получением 0,69 г бледно-желтого кристаллического продукта. Бледно-желтый кристаллический продукт растворяли в ацетоне, к нему добавляли этилацетат, ацетон отгоняли при пониженном давлении, а остаток оставляли стоять при комнатной температуре с получением 0,44 г желаемого соединения в виде бесцветного волокнистого кристаллического продукта.
Т.пл.: 94-96oC (разложение)
Спектр ЯМР (CDCl3+d6-ДМСО) δ ppm: 1,30-1,65 (8H, м), 1,65-1,83 (1H, м), 1,87-2,05 (1H, м), 3,13-3,35 (2H, м), 3,60- 3,76 (2H, м), 4,23-4,33 (1H, м), 4,38 (2H, J=7 Гц), 7,05-7,20 (1H, ушир.), 7,69 (1H, с).
Пример 3
N-[Транс-4-(2-нитроксиэтил) циклогексилметил]- (4R)-2-оксо-тиазолидин-4-илкарбоксамид (Соединение N 1-169)
В 20 мл безводного тетрагидрофурана суспендировали 191 мг (4R)-2-оксо- 4-тиазолидинкарбоновой кислоты и 294 мг гидрохлорида транс-4- (нитроксиэтил)циклогексилметиламина и при перемешивании к ним добавляли 0,54 мл триэтиламина и 0,28 мл дифенилфосфоразида при охлаждении на льду, полученную смесь перемешивали при комнатной температуре в течение 4 часов. Растворитель отгоняли при пониженном давлении, а остаток очищали путем хроматографии на колонке с силикагелем (элюирующий растворитель: циклогексан/ этилацетат = 1/3) и перекристаллизовывали из дихлорметан- диизопропилэфира с получением 200 мг желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 78-80oC
Спектр ЯМР (CDCl3) δ ppm: 0,82-1,08 (4H, м), 1,25-1,90 (8H, м), 3,05-3,23 (2H, м), 3,66 (1H, дд, J=4,6 Гц, J=11,2 Гц), 3,84 (1H, дд, J=8,6 Гц, J= 11,2 Гц), 4,32-4,40 (1H,м), 4,51 (2H, т, J=6,6 Гц), 6,50-6,70 (2H, м)
Пример 4
N-[Транс-4-(3-нитроксипропил) циклогексилметил] - (4R)-2-оксотиазолидин-4-илкарбоксамид (Соединение N 1-900)
Применяя способ, 1 aнaлoгичный примеру 3, используя 908 мг (4R)-2-оксо-4-тиазолидинкарбоновой кислоты и 1,30 г гидрохлорида транс-4-(3-нитроксипропил) циклогексилметиламина, получали 898 мг желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 110-112oC
Спектр ЯМР (CDCl3) δ ppm: 0,80-1,08 (4H, м), 1,10-1,90 (10H, м), 3,05-3,25 (2H, м), 3,63 (1H, дд, J=4,5 Гц, J=11 Гц), 3,81 (1H, дд, J=8,6 Гц, J=11 Гц), 4,30-4,40 (1H,м), 4,43 (2H, т, J=7,6 Гц), 6,45-6,70 (2H, м)
Пример 5
N-[Транс-4-(1-нитроксиэтил) циклогексилметил] - (4R)-2-оксотиазолидин-4-илкарбоксамид (Соединение N 1-1201)
Применяя способ, аналогичный примеру 3, при использовании 311 мг (4R)-2-оксо-4-тиазолидинкарбоновой кислоты и 421 мг гидрохлорида транс-4-(3-нитроксипропил) циклогексилметиламина, получали 305 мг желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 85-87oC (разложение)
Спектр ЯМР (CDCl3) δ ppm: 0,85-1,25 (5H, м), 1,32 (3H, д, J=5,9 Гц), 1,40-1,67 (2H, м), 1,70-1,97 (4H, м), 3,10-3,28 (2H, м), 3,62 (1H, дд, J=4 Гц, J=11 Гц), 3,82 (1H, дд, J=8,6 Гц, J=11 Гц), 4,32-4,40 (1H,м), 4,86-5,00 (1H, м), 6,26 (1H, с), 6,48 (1H, ушир.)
Пример 6
N-[Транс-1-(4-нитроксиметилциклогексил) этил] - (4R)-2-оксотиазолидин-4-илкарбоксамид (Соединение N 1-1192)
Применяя способ, аналогичный примеру 3, при использовании 300 мг (4R)-2-оксо-4-тиазолидинкарбоновой кислоты и 400 мг гидрохлорида транс-1-(4-нитроксиметилциклогексил)-этиламина получали желаемые соединения, два изомера (основанных на ассиметрическом атоме углерода, с которым связана метильная группа), то есть 110 мг изомера A и 85 мг изомера B соответственно в виде бесцветного кристаллического продукта.
Изомер A
Тонкослойная хроматография: Rf = 0,27 (растворитель для разгонки: циклогексан/этилацетат = 1/2)
Т.пл.: 147-150oC (разложение)
Спектр ЯМР (CDCl3) δ ppm: 0,92-1,20 (4H, м), 1,13 (3H, д, J=6,6 Гц), 1,30-1,95 (6H, м), 3,63 (1H, дд, J=4,6 Гц, J=11 Гц), 3,80 (1H, дд, J=8,6 Гц, J= 11 Гц), 3,89 (1H, дд, J=6,6 Гц, J=16 Гц), 4,27 (2H, д, J=6,6 Гц), 4,30-4,42 (1H, м), 6,23 (1H, д, J=8,6 Гц), 6,54 (1H, с)
Изомер B
Тонкослойная хроматография: Rf = 0,14 (растворитель для разгонки: циклогексан/этилацетат = 1/2)
Т.пл.: 131-133oC (разложение)
Спектр ЯМР (CDCl3) δ ppm: 0,92-1,20 (4H, м), 1,14 (3H, д, J=6,6 Гц), 1,25-1,96 (6H, м), 3,60 (1H, дд, J=4 Гц, J=11 Гц), 3,84 (1H, дд, J=8,6 Гц, J=11 Гц), 3,87-4,00 (1H, м), 4,33 (2H, д, J=6,6 Гц), 4,30-4,40 (1H, м), 6,06 (1H, с), 6,24 (1H, д, J=8,6 Гц)
Пример 7
N-[Транс-4-(1-метил-2-нитроксиэтил) циклогексилметил] -(4R)-2-оксотиазолидин-4-илкарбоксамид (Соединение N 1-1210)
Применяя способ, аналогичный примеру 3, при использовании 76,9 мг (4R)-2-оксо-4-тиазолидинкарбоновой кислоты и 110 мг гидрохлорида транс-4-(1-метил-2-нитроксиэтил)- циклогексилметиламина, получали 91 мг желаемого соединения в виде бесцветного масла.
Спектр ЯМР (d6-ДМСО) δ ppm: 0,78-1,45 (6H, м), 0,89 (3H, д, J=6,9 Гц), 2,94 (2H, т, J=6,2 Гц), 3,25-3,40 (1H, м), 3,65 (1H, дд, J=8,5 Гц, J=11 Гц), 4,22-4,40 (2H,м), 4,45-4,57 (1H, м), 8,00 (1H, т, J=5,6 Гц), 8,25 (1H, с)
Пример 8
N-[Транс-2-(4-нитроксиметилциклогексил) этил] -(4R)-2- оксотиазолидин-4-илкарбоксамид (Соединение N 1-65)
Применяя способ, аналогичный примеру 3, при использовании 152 мг (4R)-2- оксо-4-тиазолидинкарбоновой кислоты и 205 мг гидрохлорида транс-2- (4-нитроксиметилциклогексил)-этиламина, получали 221 мг желаемого соединения в виде бесцветного кристаллического продукта. Т.пл.: 82-84oC
Спектр ЯМР (CDCl3) δ ppm: 0,85-1,55 (5H, м), 1,62- 1,90 (5H, м), 3,20-3,43 (2H, м), 3,64 (1H, д,д, J=4,6 Гц, J=11 Гц), 3,79 (1H, дд, J=8,6 Гц, J= 11 Гц), 4,27 (2H, д, J=6,4 Гц), 4,30-4,40 (1H, м), 6,71 (1H, т, J=5,3 Гц), 7,05 (1H, с)
Пример 9
N-[Транс-2-[4-(3-нитроксипропил) циклогексил] этил]-(4R)-2-оксотиазолидин-4-илкарбоксамид (Соединение N 1- 207)
Применяя способ, аналогичный примеру 3, при использовании 98,6 мг (4R)-2-оксо-4-тиазолидинкарбоновой кислоты и 149 мг гидрохлорида транс-2-[4-(3-нитроксипропил) циклогексил]- этиламина, получали 83 мг желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 101-103oC (разложение)
Спектр ЯМР (d6-DMCO) δ ppm: 0,75-0,98(4H, м), 1,10- 1,38 (6H, м), 1,60-1,80 (6H, м), 3,05-3,17 (2H, м), 3,20- 3,38 (1H,м), 3,64 (1P, дд, J=8,3 Гц, 7=11 Гц), 3,79 (1H, дд, J=8,6 Гц, J=11 Гц), 4,17-4,28 (1H,м), 4,49 (2H, т,J=6,6 Гц), 4,30-4,40 (1H, м), 7,99 (1H, т, J=5,4 Гц), 8,25 (1H, с)
Пример 10
N-(3-Нитроксиметилциклогексил)-(4R)-2- оксотиазолидин-4-илкарбоксамид (Соединение N 1-669)
Применяя способ, аналогичный примеру 3, при использовании 1,05 г (4R)-2- оксо-4-тиазолидинкарбоновой кислоты и 1,67 г гидрохлорида 3- нитроксиметилциклогексиламина получали желаемые соединения, два изомера, а именно 301 мг изомера A и 231 мг изомера B в виде бесцветного кристаллического продукта соответственно.
Изомер A
Тонкослойная хроматография: Rf = 0,52 (растворитель для разгонки: этилацетат)
Т.пл.: 173-177oC (разложение)
Спектр ЯМР (CDCl3+d6-ДМСО) δ ppm: 0,90-1,50 (4H, м), 1,72-2,10 (5H, м), 3,60-3,90 (3H, м), 4,22-4,40 (3H, м), 6,97 (1H, д, J=7,9 Гц), 7,59 (1H, с)
Изомер B
Тонкослойная хроматография: Rf = 0,43 (растворитель для разгонки: этилацетат)
Т.пл.: 141-143oC (разложение)
Спектр ЯМР (CDCl3+d6-ДМСО) δ ppm: 0,88-1,52 (4H, м), 1,70-2,25 (5H, м), 3,60-3,90 (3H, м), 4,22-4,35 (3H, м), 6,92 (1H, д, J=7,6 Гц), 7,50 (1H, с)
Пример 11
N-(4-Нитроксиметилциклогексил)-(4R)-2-оксотиазолидин-4- илкарбоксамид (Соединение N 1-1)
Применяя способ, аналогичный примеру 3, при использовании 486 мг (4R)-2-оксо-4-тиазолидинкарбоновой кислоты и 837 мг гидрохлорида 4- нитроксиметилциклогексиламина, получили 602 мг желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 124-126oC (разложение)
Спектр ЯМР (CDCl3+d6-ДМСО) δ ppm: 1,15-2,00 (9H, м), 3,60-3,77 (2H, м), 3,98-4,13 (1H, м), 4,25-4,35 (1H, м), 4,37 (2H, д, J=6,7 Гц), 6,86 (1H, д, J=6,9 Гц), 7,73 (1H, с)
Пример 12
N-(Транс-2-нитроксиметилциклогексил)-(4R)-2- оксотиазолидин-4-илкарбоксамид (Соединение N 1-633)
Применяя способ, аналогичный примеру 3, при использовании 397 мг (4R)-2- оксо-4-тиазолидинкарбоновой кислоты и 541 мг гидрохлорида транс-2- нитроксиметилциклогексилметиламина, получали 319 мг желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 108-111oC (разложение)
Спектр ЯМР (CDCl3) δ ppm: 1,00-1,35 (4H, м), 1,40- 1,90 (6H, м), 3,22-3,50 (2H, м), 6,63 (1H, дд, J=5,3 Гц, J=10,6 Гц), 3,81 (1H, дд, J=8,6 Гц, J= 10,6 Гц), 4,32-4,60 (3H, м), 6,68 (1H, ушир.), 6,76 (1H, с)
Пример 13
N-(Цис-2-нитроксиметилциклогексилметил)-(4R)-2- оксотиазолидин-4-илкарбоксамид (Соединение N 1-633)
Применяя способ, аналогичный примеру 3, при использовании 480 мг (4R)-2- оксо-4-тиазолидинкарбоновой кислоты и 570 мг гидрохлорида цис-2- нитроксиметилциклогексилметиламина, получали 61 мг желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 74-77oC (разложение)
Спектр ЯМР (CDCl3) δ ppm: 0,80-1,70 (8H, м), 1,88- 2,06 (1H, м), 2,06-2,22 (1H, м), 3,13-3,50 (2H, м), 3,60-3,70 (1H, м), 3,75-3,90 (1H, м), 4,30-4,62 (3H, м), 6,75 (1H, с), 6,84 (1H, с)
Пример 14
N-(3-Нитроксиметилциклогексилметил)-(4R)-2- оксо-тиазолидин-4-илкарбоксамид (Соединение N 1-681)
Применяя способ, аналогичный примеру 3, при использовании 490 мг (4R)-2- оксо-4-тиазолидинкарбоновой кислоты и 890 мг гидрохлорида 3-нитроксиметилциклогексилметиламина получили 850 мг желаемого соединения в виде желтого масла.
Спектр ЯМР (CDCl3+d6-ДМСО) δ ppm: 0,60-1,10 (2H, м), 1,20-1,93 (7,5H, м), 2,05-2,20 (0,5H, м), 3,06-3,40 (2H, м), 3,60-3,72 (1H, м), 3,75-3,87 (1H, м), 4,20-4,45 (3H, м), 6,70- 7,05 (2H, м)
Пример 15
N-(2-Нитроксиметилциклопентил)-(4R)-2- оксотиазолидин-4-илкарбоксамид (Соединение N 1-525)
Применяя способ, аналогичный примеру 3, при использовании 294 мг (4R)-2- оксо-4-тиазолидинкарбоновой кислоты и 471 мг гидрохлорида 2-нитроксиметилциклопентиламина, полученного по ссылочному примеру 79, получали желаемые соединения, два изомера, а именно 153 мг изомера A и 88 мг изомера B в виде бесцветного кристаллического продукта, соответственно.
Изомер A
Тонкослойная хроматография: Rf = 0,57 (растворитель для разгонки: этилацетат)
Т.пл.: 109-111oC
Спектр ЯМР (CDCl3+d6-ДМСО) δ ppm: 1,40-2,10 (6H, м), 2,40- 2,58 (1H, м), 3,69 (2H, д, J=7,3 Гц), 4,23-4,60 (4H, м), 7,04 (1H, д, J=7,9 Гц), 7,82 (1H, с).
Изомер B
Тонкослойная хроматография: Rf = 0,49 (растворитель для разгонки: этилацетат)
Т.пл.: 103-105oC
Спектр ЯМР (CDCl3+D6-ДМСО) δ ppm: 1,40-2,10 (6H, м), 2,40-2,57 (1H, м), 3,70 (2H, д, J=6,6 Гц), 4,20-4,35 (2H, м), 4,25-4,58 (2H, м), 7,05 (1H, д, J=7,9 Гц), 7,67 (1H, с)
Пример 16
N-(2-Нитроксиметилциклопентил)-(4R)-2- оксотиазолидин-4-илкарбоксамид (Соединение N 1-525)
Применяя способ, аналогичный примеру 3, при использовании 444 мг (4R)-2-оксо-4-тиазолидинкарбоновой кислоты и 532 мг гидрохлорида 2-нитроксиметилциклопентиламина, полученного по ссылочному примеру 81, получали желаемые соединения, два изомера, а именно 148 мг изомера A и 209 мг изомера B в виде бесцветного кристаллического продукта соответственно.
Изомер A
Тонкослойная хроматография: Rf = 0,27 (растворитель для разгонки: циклогексан/этилацетат =1/2)
Т.пл.: 96-98oC
Спектр ЯМР (CDCl3+d6-ДМСО) δ ppm: 1,20-2,25 (7H, м), 3,58-3,76 (2H, м), 3,95-4,17 (1H, м), 4,23-4,35 (1H, м), 4,42 (1H, дд, J=7,3 Гц, J=10,6 Гц), 4,55 (1H, дд, J=5,9 Гц, J=10,6 Гц), 7,22 (1H, д, J=7,4 Гц), 7,54 (1H, с)
Изомер B
Тонкослойная хроматография: Rf = 0,18 (растворитель для разгонки: циклогексан/этилацетат = 1/2)
Т.пл.: 118-120oC
Спектр ЯМР (CDCl3+d6-ДМСО) δ ppm: 1,36-2,25 (7H, м), 3,68 (2H, д, J=6,2 Гц), 3,97-4,15 (1H, м), 4,23-4,35 (1H, м), 4,42 (1H, дд, J=7,2 Гц, J=10,5 Гц), 4,44 (1H, дд, J=5,9 Гц, J=10,5 Гц), 7,23 (1H,д, J=7,5 Гц), 7,53 (1H, с)
Пример 17
N-[4-(4-Нитроксибутил) ииклогексилметил] -(4R)- 2-оксотиазолидин-4-илкарбоксамид (Соединение N 1-1224)
Применяя способ, аналогичный примеру 3, при использовании 32,4 мг (4R)-2-оксо-4-тиазолидинкарбоновой кислоты и 49 мг гидрохлорида 4-(2-нитроксибутил)циклогексилметиламина, получали 44 мг желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 90-93oC (разложение)
Спектр ЯМР (CDCl3) δ ppm: 0,80-1,05 (4H, м), 1,05- 2,05 (1 H, м), 3,06-3,30 (2H, м), 3,62 (1H, дд, J=4,5 Гц, J=11,3 Гц), 3,82 (1H, дд, J=8,6 Гц, J= 11,3 Гц), 4,30-4,40 (1H, м), 4,45 (2H, т, J=6,6 Гц), 6,33-6,60 (2H, м), 6,86 (1H, д, J=6,9 Гц), 7,73 (1H, с)
Пример 18
Гидрохлорид N-(5-нитроксиметил-2-пиперидинилметил) -(4R)-2-оксотиазолидин-4-илкарбоксамида (Соединение N 1-1040)
В 40 мл сухого тетрагидрофурана и 20 мл сухого диметилформамида суспендировали 224 мг (4R)-2-оксо-4-тиазолидинкарбоновой кислоты и 350 мг дигидрохлорида 5-нитроксиметил-2-пиперидилметиламина, и к ним при перемешивании добавляли 0,94 мл триэтиламина и 0,188 мл диэтилцианфосфата при охлаждении льдом, и полученную смесь перемешивали при комнатной температуре в течение 5 часов. К реакционной смеси добавляли 0,463 мл ди-трет-бутилдикарбоната и каталитическое количество 4-диметиламинопиридина, полученную смесь перемешивали при комнатной температуре в течение 1 часа. Затем к ней добавляли 2,0 мл ди-трет-бутилдикарбоната и смесь перемешивали при 30oC в течение 1,5 часов. Нерастворимый остаток фильтровали, а растворитель отгоняли при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем (элюирующий растворитель: циклогексан/этилацетат = 2/3-1/6), и фракцию, имеющую Rf 0,14 при тонкослойной хроматографии (растворитель для разгонки: циклогексан/этилацетат = 1/2) собирали путем разделения. Полученную таким образом пену растворяли в 5,0 мл смеси 4 н. соляной кислоты-диоксана, смесь перемешивали при комнатной температуре в течение 30 минут. К смеси добавляли 20 мл эфира, кристаллы собирали путем фильтрации с получением 40 мг желаемого соединения в виде бледно-желтого кристаллического продукта.
Т.пл.: 95-99oC (разложение)
Спектр ЯМР (CDCl3) δ ppm: 1,20-1,50 (2H, м), 1,75-1,95 (2H, м), 2,10-2,30 (1H, м), 2,65-3,20 (2H, м), 3,40- 3,50 (1H, м), 3,60-3,70 (1H, м), 4,28-4,38 (1H, м), 4,40-4,55 (2H, м), 8,30 (1H, с), 8,40 (1H, ушир.)
Ссылочный пример 1
Транс-4-N- бутоксикарбониламинометилциклогексилкарбоновая кислота
В 50 мл воды растворяли 5,0 г транс-4-аминометилциклогексилкарбоновой кислоты, и к ней добавляли 6,6 мл триэтиламина. Затем к смеси добавляли 11,2 мл раствора ди-трет-бутилкарбоната в диоксане (20 мл), полученную смесь перемешивали при комнатной температуре в течение 3 часов. Диоксан отгоняли при пониженном давлении и добавляли раствор лимонной кислоты к конечному водному раствору для доведения pH до 4,0. Смесь экстрагировали этилацетатом, экстракт промывали насыщенным водным раствором хлорида натрия и высушивали над безводным сульфатом магния. Растворитель отгоняли для получения бесцветного кристаллического вещества. К кристаллическому веществу добавляли изопропиловый эфир, кристаллическое вещество собирали фильтрацией и высушивали с получением 7,0 г желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 126-128oC
Спектр ЯМР (CDCl3) δ ppm: 0,85-1,05 (2H, м), 1,30- 1,60 (9H, м), 1,75-1,92 (2H, м), 1,95-2,12 (2H, м), 2,18- 2,35 (1H, м), 2,85-3,05 (2H, м), 4,60 (1H, ушир.)
Ссылочный пример 2
Транс-4-N-трет-бутоксикарбониламинометил- 1-гидроксиметилциклогексан
В безводном тетрагидрофуране (60 мл) растворяли 5,0 г соединения по ссылочному примеру 1 и к нему добавляли по каплям 1 М раствор 22,0 мл литийалюмогидрида в тетрагидрофуране при перемешивании и охлаждении на льду, смесь оставляли перемешиваться при комнатной температуре в течение 2 часов. К реакционной смеси добавляли избыток десятиводного сульфата натрия, нерастворимую часть отфильтровывали, а фильтрат подвергали перегонке при пониженном давлении. Остаток растворяли в дихлорметане и высушивали над безводным сульфатом магния, а растворитель отгоняли. Полученный таким образом остаток очищали путем хроматографии на колонке с силикагелем, используя в качестве элюирующего растворителя циклогексан- этилацетат (2:1) с получением 1,4 г желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 88-89oC
Спектр ЯМР (CDCl3) δ ppm: 0,85-1,05 (4H, м), 1,25-1,52 (11H, м), 1,75-1,90 (4H, м), 2,98 (2H, т, J=6,4 Гц), 3,45 (2H, д, J=6,2 Гц), 4,61 (1H, ушир.)
Ссылочный пример 3
Транс-4-N-трет-бутоксикарбониламинометил-1-нитроксиметил-циклогексан
К 24 мл безводного ацетонитрила при перемешивании и охлаждении на льду добавляли 1,3 г тетрафторборат нитрония и 1,19 г 2,4,6-коллидина, смесь перемешивали при той же температуре в течение 0,5 часа. К реакционной смеси добавляли 1,2 г соединения по ссылочному примеру 2, и полученную смесь перемешивали при комнатной температуре в течение 70 минут. Растворитель отгоняли при пониженном давлении, к остатку добавляли этилацетат, а нерастворимую часть отфильтровывали. Остаток, полученный путем отгонки растворителя при пониженном давлении очищали путем хроматографии на колонке с силикагелем, используя в качестве элюирующего растворителя циклогексан-этилацетат (9: 1) с получением 1,09 г желаемого соединения в виде бледно-желтого кристаллического продукта.
Т.пл.: 65-67oC
Спектр ЯМР (CDCl3) δ ppm: 0,85-1,13 (4H, м), 1,44 (10H, с), 1,60-1,95 (5H, м), 2,98 (2H, т, J=6,4 Гц), 4,27 (2H, д, J=6,4 Гц), 4,59 (1H, ушир.)
Ссылочный пример 4
Гидрохлорид транс-4-нитроксиметилциклогексилметиламина
1,1 г соединения по ссылочному примеру 3 растворяли в 15 мл смеси 4 н. соляной кислоты/диоксана и перемешивали при комнатной температуре в течение 1 часа. Осажденное кристаллическое вещество собирали путем фильтрации и интенсивно промывали диоксаном и эфиром. Затем кристаллическое вещество промывали этанолом и эфиром и высушивали с получением 0,25 г желаемого соединения в виде бесцветного кристаллического вещества, а растворитель отгоняли. Полученный таким образом остаток очищали путем хроматографии на колонке с силикагелем, используя в качестве элюирующего растворителя циклогексан-этилацетат (2:1) с получением 1,4 г желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 166-168oC (разложение)
Спектр ЯМР (d6-ДМСО) δ ppm: 0,85-1,10 (4H, м), 1,45- 1,90 (6H, м), 2,62 (2H, д, J=6,8 Гц), 4,37 (2H, д, J=6,5 Гц), 8,06 (3H, ушир.)
Ссылочный пример 5
Диметил цис-1,4-циклогександикарбоксилат
В 30 мл метанола растворяли 3,0 г цис-1,4-циклогександикарбоновой кислоты и к нему добавили 33,0 мл раствора триметилсилилдиазометана (2 М раствор в гексане). Смесь перемешивали при комнатной температуре в течение ночи. Растворитель отгоняли при пониженном давлении. Остаток растворяли в этилацетате и полученный раствор интенсивно промывали водным раствором бикарбоната натрия и водным раствором хлорида натрия, и высушивали над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении с получением 3,46 г желаемого соединения в виде желтого масла.
Спектр ЯМР (CDCl3) δ ppm: 1,60-1,98 (8H, м), 2,40-2,55 (2H, м), 3,68 (6H, м)
Ссылочный пример 6
Монометил цис-1,4-циклогександикарбоксилат
В 35 мл метанола растворяли 3,46 г диметил цис-1,4- циклогександикарбоксилата и к нему добавляли 17,3 мл 1 н. водного раствора гидроксида натрия, и полученную смесь перемешивали при комнатной температуре в течение 1,5 часа. Растворитель отгоняли при пониженном давлении, а полученный водный раствор промывали этилацетатом. Разбавленной соляной кислотой подводили pH смеси до 1 при охлаждении на льду и смесь экстрагировали этилацетатом. Экстракты промывали водным раствором хлорида натрия и высушивали над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении для получения бесцветного кристаллического вещества. К кристаллическому веществу добавляли изопропиловый эфир и кристаллическое вещество собирали путем фильтрации с получением 1,76 г желаемого соединения в виде бледно-желтого кристаллического продукта.
Т.пл.: 91-93oC
Спектр ЯМР (CDCl3+d6-ДМСО) δ ppm: 1,60-2,00 (8H, м), 2,42-2,52 (2H, м), 3,67 (3H, с)
Ссылочный пример 7
Цис-4-карбомоилциклогексанкарбоновая кислота
В 55 мл концентрированного водного раствора аммиака растворяли 5,29 г монометил цис-1,4-циклогексанкарбоксилата, смесь оставляли при комнатной температуре на 6 дней. Концентрированной соляной кислотой подводили pH смеси до 1 при охлаждении на льду, осажденное кристаллическое вещество собирали путем фильтрации и промывали водой с получением коричневого кристаллического продукта. Кристаллический продукт перекристаллизовывали из этилацетата с получением 2,96 г желаемого соединения в виде бледно-желтого столбчатого кристаллического продукта.
Т.пл.: 209-211oC
Спектр ЯМР (d6-ДМСО) δ ppm: 1,30-1,80 (6H, м), 1,80- 1,96 (2H, м), 2,05-2,22 (1H, м), 2,30-2,40 (1H, м), 6,67 (1H, с), 7,17 (1H, с), 12,09 (1H, с)
Ссылочный пример 8
Цис-4-М-трет-бутоксикарбониламинометил-1- гидроксиметилциклогексан
В 35 мл тетрагидрофурана суспендировали 3,40 г цис-4-карбамоилциклогексанкарбоновой кислоты и к ней добавляли при перемешивании 50,0 мл 1 M литийалюмогидрида при охлаждении льдом. Смесь перемешивали при комнатной температуре в течение 0,5 часа и нагревали с обратным холодильником при перемешивании в течение 1 часа. К полученной смеси добавляли 13,0 г десятиводного сульфата натрия при перемешивании и охлаждении на льду для разложения избытка литийалюмогидрида. Нерастворимые части отделяли путем фильтрации на Целите (Celite), а растворитель отгоняли при пониженном давлении. Остаток растворяли в дихлорметане и высушивали над безводным сульфатом магния, а растворитель отгоняли при пониженном давлении с получением бесцветного масла. Масло растворяли в 30 мл метанола, добавляли 3,0 мл ди-трет- бутилдикарбоната и смесь перемешивали при комнатной температуре в течение 0,5 часа. Растворитель отгоняли при пониженном давлении и, полученный таким образом остаток, очищали путем хроматографии на колонке с силикагелем (элюирующий растворитель: циклогексан/этилацетат = 2/1) с получением бесцветного кристаллического продукта. К кристаллическому продукту добавляли изопропиловый эфир и кристаллическое вещество собирали путем фильтрации с получением 1,69 г желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 93-95oC
Спектр ЯМР (CDCl3) δ ppm: 1,28-1,75 (20H, м), 3,07 (2H, т, J=6,6 Гц), 3,53 (2H, д, J=4,6 Гц), 4,56 (1H, ушир.)
Ссылочный пример 9
Цис-N-трет-бутоксикарбонил-4- нитроксиметилциклогексил-метиламин
Применяя способы, аналогичные ссылочному примеру 3, используя 1,60 г цис-N-трет- бутоксикарбониламинометил-1-гидроксиметилциклогексана и 1,05 г бортетрафторида нитрония, получили 1,40 г желаемого соединения в виде бледно-желтого кристаллического продукта.
Т.пл.: 64-66oC
Спектр ЯМР (CDCl3) δ ppm: 1,25-1,75 (18H, м), 1,88-2,02 (1H, м), 3,08 (2H, т, J=6,6 Гц), 4,36 (2H, д, J=7,3 Гц), 4,54 (1H, ушир.)
Ссылочный пример 10
Гидрохлорид цис-4-нитроксиметилциклогексилметиламина
Применяя способы, аналогичные ссылочному примеру 4, используя 1,40 г цис-N-трет-бутоксикарбонил- 4-нитроксиметил-циклогексилметиламина и 14,0 г 4 н/ смеси соляной кислоты-диоксана, получили 0,94 г желаемого соединения в виде бледно-желтого кристаллического продукта.
Т.пл.: 181-182oC (разложение)
Спектр ЯМР (CDCl3) δ ppm: 1,25-1,75 (18H, м), 1,88- 2,02 (1H, м), 3,08 (2H, т, J=6,6 Гц), 4,36 (2H, д, J=7,3 Гц), 4,54 (1H, ушир.)
Ссылочный пример 11
Транс-N-трет-бутоксикарбонил-4-(2- диазоацетил)-циклогексилметиламин
В 60 мл сухого тетрагидрофурана растворяли 3,00 г транс-4-N-трет- бутоксикарбониламиноэтилциклогексанкарбоновой кислоты, и к ней добавляли 1,28 мл N-метилморфолина и 1, 51 мл изобутилхлорформата при-20oC, полученную смесь перемешивали при-20oC в течение 2 часов. Осадившуюся соль соляной кислоты и N-метилморфолина отделяли фильтрованием, а фильтрат добавляли к 200 мл раствора диазометана в эфире, полученном из 7,0 г N-нитрозометил-мочевины при-20oC. Реакционную смесь перемешивали при-20oC в течение 2 часов и далее перемешивали при комнатной температуре в течение ночи. Растворитель отгоняли при пониженном давлении и остаток очищали путем хроматографии на колонке с силикагелем (элюирующий растворитель: дихлорметан/этилацетат = 8.1) с получением бледно-желтого кристаллического вещества. Кристаллическое вещество перекристаллизовывали из изопропилового эфира с получением 948 мг желаемого соединения в виде бледно-желтого кристаллического продукта.
Т.пл.: 106-107oC
Спектр ЯМР (CDCl3) δ ppm: 0,85-1,07 (2H, м), 1,30 -1,55 (12H, м), 1,78-1,96 (4H, м), 2,05-2,37 (1H, м), 2,98 (2H, т, J=7,4 Гц), 4,59 (1H, ушир.), 5,26 (1H, с)
Ссылочный пример 12
Метил транс-4-N-трет-бутоксикарбониламинметилциклогексилацетат
В 30 мл метанола растворяли 923 мг транс-N-тpeтбутоксикарбонил-4-(2-диазоацетил)циклогексилметиламина, и к нему по каплям добавляли 5,0 мл раствора 128 мг ацетата серебра в триэтиламине при комнатной температуре, полученную смесь перемешивали при комнатной температуре в течение 1 часа и 25 минут. К реакционной смеси добавляли 10 мл насыщенного раствора хлорида натрия, полученную смесь перемешивали при комнатной температуре в течение 5 минут и фильтровали при использовании Целита. Фильтрат отгоняли при пониженном давлении, а остаток растворяли в этилацетате. Полученный раствор интенсивно промывали водным раствором бикарбоната натрия и водным раствором хлорида натрия и высушивали над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении и остаток очищали путем хроматографии на колонке с силикагелем (элюирующий растворитель: циклогексан/этилацетат = 4/1) с получением бесцветного кристаллического вещества. Кристаллическое вещество перекристаллизовывали из изопропилового эфира с получением 796 мг желаемого соединения в виде бесцветного игольчатого кристаллического продукта.
Т.пл.: 53-55oC
Спектр ЯМР (CDCl3) δ ppm: 0,85-1,12 (4H, м), 1,25- 1,58 (1H, м), 1,44 (9H, с), 1,63-1,88 (5H, м), 2,20 (2H, д, J=6,7 Гц), 2,96 (2H, т, J=6,4 Гц), 3,66 (3H, с), 4,65 (1H, ушир.)
Ссылочный пример 13
Транс-N-трет-бутоксикарбонил-4-(2-гидроксиэтил)-циклогексилметиламин
В 10 мл этанола и 7,0 мл тетрагидрофурана растворяли 796 мг метил транс-4-N-трет- бутоксикарбониламинометилциклогексилацетата, к нему добавляли при перемешивании 1,55 г безводного хлорида кальция при охлаждении на льду. Полученную смесь перемешивали при охлаждении на льду в течение 1 часа, к ней добавляли 530 мг боргидрида натрия, смесь перемешивали при той же температуре в течение 30 минут, при комнатной температуре в течение 1 часа и 25 минут, и далее при 40-45oC в течение 4 часов. К реакционной смеси добавляли 5,0 мл ацетона и полученную смесь перемешивали в течение 1 часа и фильтровали при помощи Целита. Фильтрат отгоняли при пониженном давлении, а остаток очищали путем хроматографии на колонке с силикагелем (элюирующий растворитель: циклогексан/этилацетат = 3/1) с получением бесцветного кристаллического продукта. Кристаллический продукт перекристаллизовывали из гексана с получением 619 мг желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 78-80oC
Спектр ЯМР (CDCl3) δ ppm: 0,83-1,05 (4H, м), 1,25-1,55 (4H, м), 1,44 (9H, с), 1,65-1,88 (4H, м), 2,59 (1H, с), 2,95 (2H, т, J=6,3 Гц), 3,66 (2H, т, J=6,7 Гц), 4,84 (1H, ушир.)
Ссылочный пример 14
Транс-N-трет-бутоксикарбонил-4-(2-нитроксиэтил)-циклогексилметиламин
Применяя способы, аналогичные ссылочному примеру 3, используя 574 мг транс-N-трет- бутоксикарбонил-4-(2-гидроксиэтил)циклогексилметиламина и 418 мг бортетрафторида нитрония, получили 437 мг желаемого соединения в виде бесцветного игольчатого кристаллического продукта.
Т.пл.: 60-61oC
Спектр ЯМР (CDCl3) δ ppm: 0,82-1,05 (4H, м), 1,25-1,50 (2H, м), 1,44 (9H, с), 1,62 (2H, кв, J=6,6 Гц, J=13,2 Гц), 1,70-1,88 (2H, м), 2,90-3,00 (2H, м), 4,49 (2H, т, J=7,6 Гц), 4,65-4,85 (1H, ушир.)
Ссылочный пример 15
Гидрохлорид транс-4-(2-нитроксиэтил) циклогексилметиламина
Применяя способы, аналогичные ссылочному примеру 4, используя 437 мг транс-N-трет-бутоксикарбонил-4-(2- нитрокси)-этилциклогексилметиламина и 2,0 мл смеси 4 н. соляной кислоты-диоксана, получили 298 мг желаемого соединения в виде бледно- желтого кристаллического продукта.
Т.пл.: 175-176oC (разложение)
Спектр ЯМР (CDCl3+d6-ДМСО) δ ppm: 0,85-1,12 (4H, м), 1,20-2,02 (8H, м), 2,65-2,88 (2H, м), 4,49 (2H, т, J=7,6 Гц), 8,20- 8,60 (3H, ушир.)
Ссылочный пример 16
Транс-H-трет-бутоксикарбонил- 4-метансульфонилоксиметилциклогексилметиламин
В 500 мл сухого дихлорметана растворяли 10,0 г транс-4-N-трет- бутоксикарбониламинометил-1-гидроксиметил-циклогексана и к нему добавляли 14,3 мл триэтиламина и 14,3 г ангидрида метансульфоновой кислоты при перемешивании и охлаждении на льду, полученную смесь перемешивали при той же температуре в течение 50 минут. Растворитель отгоняли при пониженном давлении и остаток растворяли в этилацетате. Полученный раствор интенсивно промывали водным раствором лимонной кислоты, водным раствором хлорида натрия, водным раствором бикарбоната натрия и водным раствором хлорида натрия и высушивали над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении с получением бесцветного кристаллического вещества. К кристаллическому веществу добавляли изопропиловый эфир и собирали кристаллическое вещество путем фильтрации с получением 13,24 г желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 105-107oC
Спектр ЯМР (CDCl3) δ ppm: 0,83-1,13 (4H, м), 1,30- 1,53 (1H, м), 1,44 (9H, с), 1,60-1,94 (5H, м), 2,88-3,10 (2H, м), 3,00 (3H, с), 4,03 (2H, д, J= 6,6 Гц), 4,59 (1H, ушир.)
Ссылочный пример 17
Транс-N-трет-бутоксикарбонил-4-иодометилциклогексилметиламин
В 130 мл безводного ацетона растворяли 13,24 г транс-N-трет-бутоксикарбонил-4- метансульфонилоксиметилциклогексилметиламина, к нему добавляли 12,32 г иодида натрия, и полученную смесь нагревали с обратным холодильником в течение 3 часов и 45 минут. Растворитель отгоняли при пониженном давлении, а остаток растворяли в этилацетате. Полученный раствор интенсивно промывали водным раствором тиосульфата натрия и водным раствором хлорида натрия, и высушивали над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении и остаток очищали путем хроматографии на колонке с силикагелем (элюирующий растворитель: циклогексан/этилацетат = 4/1) с получением бледно-желтого кристаллического вещества. Кристаллическое вещество перекристаллизовывали из гексана с получением 13,67 г желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 81-83oC
Спектр ЯМР (CDCl3) δ ppm: 0,83-1,10 (4H, м), 1,25- 1,52 (2H, м), 1,44 (9H, с), 1,67-2,02 (4H, м), 2,98 (2H, т, J=6,4 Гц), 3,10 (2H, д, J=6,4 Гц), 4,58 (1H, ушир.)
Ссылочный пример 18
Диэтил транс-4-N-трет-бутоксикарбониламинометилциклогексилметилмалонат
В 10 мл безводного диметилформамида растворяли 0,856 мл диэтилмалоната, к нему добавляли 123,5 мг гидрида натрия при перемешивании на льду, смесь перемешивали при той же температуре в течение 30 минут. К реакционной смеси добавляли 1,0 г транс-N-трет-бутоксикарбонил-4-иодометилциклогексилметиламина, смесь нагревали при перемешивании при внутренней температуре 70oC в течение 1 часа и 30 минут. Затем смесь оставляли отстаиваться, к ней добавляли избыток водного раствора хлорида аммония, а растворитель отгоняли при пониженном давлении. Остаток растворяли в этилацетате, полученный раствор промывали водным раствором хлорида натрия и высушивали над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем (элюирующий растворитель: циклогексан/этилацетат = 4/1) с получением 946 мг желаемого соединения в виде бесцветного масла.
Спектр ЯМР (CDCl3) δ ppm: 0,78-1,08 (4H, м), 1,10-1,60 (8H, м), 1,44 (9H, с), 1,65-1,90 (6H, м), 2,95 (2H, т, J=6,3 Гц), 3,44 (1H, т, J=7,8 Гц), 4,10-4,35 (4H, м), 4,59 (1H, ушир.)
Ссылочный пример 19
Транс-3-(4-N-трет- бутоксикарбониламинометилциклогексил) пропионовая кислота
В 110 мл метанола растворяли 11,64 г диэтил транс-4-N- трет-бутоксикарбониламинометилциклогексилметилмалоната, к нему добавляли 80,0 мл 10% водного раствора гидроксида натрия при перемешивании и комнатной температуре, смесь перемешивали при той же температуре в течение 2 часов и 10 минут. Метанол отгоняли при пониженном давлении, добавляли при перемешивании водный раствор лимонной кислоты при охлаждении на льду для подведения pH смеси до 4 и экстрагировали этилацетатом. Экстракты интенсивно промывали водным раствором хлорида натрия и высушивали над безводным сульфатом магния, а растворитель отгоняли при пониженном давлении. Полученные кристаллы суспендировали в 180 мл ксилола и нагревали с обратным холодильником в течение 1,5 часа. Растворитель отгоняли при пониженном давлении, добавляли смесь раствора гексана и небольшого количества изопропилового эфира для получения кристаллического продукта, кристаллический продукт собирали путем фильтрации с получением 6,88 г желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 90-92oC
Спектр ЯМР (CDCl3) δ ppm: 0,82-1,05 (4H, м), 1,13-2,00 (8H, м), 1,44 (9H, с), 2,36 (2H, т, J=7,6 Гц), 2,96 (2H, т, J=6,3 Гц), 4,60 (1H, ушир.)
Ссылочный пример 20
Транс-3-(4-N-трет-бутоксикарбониламинометилциклогексил) пропанол
В 10 мл сухого тетрагидрофурана растворяли 1,0 г транс-3- (4-N-трет-бутоксикарбониламинометилциклогексил) пропионовой кислоты, к ней добавляли при перемешивании 0,54 мл триэтиламина и 0,15 мл изобутилхлорформата при охлаждении на льду, смесь перемешивали при той же температуре в течение 30 минут. Нерастворимую часть отделяли путем фильтрования при использовании Целита, а фильтрат добавляли при перемешивании по каплям к 5 мл водного раствора 0,40 г боргидрида натрия при охлаждении на льду, смесь перемешивали при той же температуре в течение 1 часа. К реакционной смеси добавляли 10 мл ацетона, и полученную смесь перемешивали при комнатной температуре в течение 10 минут. Растворитель отгоняли при пониженном давлении. К остатку добавляли воду и этилацетат, отделяли слой этилацетата, промывали водным раствором хлорида натрия и высушивали над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении для получения бесцветного кристаллического продукта. Кристаллический продукт перекристаллизовывали из смеси раствора гексана и небольшого количества изопропилового эфира с получением 763 мг желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 76-80oC
Спектр ЯМР (CDCl3) δ ppm: 0,80-1,05 (4H, м), 1,05-1,90 (10H, м), 1,44 (9H, с), 2,96 (2H, т, J=6,3 Гц), 3,63 (2H, т, J=6,5 Гц), 4,59 (1H, ушир.)
Ссылочный пример 21
Транс-N-трет-бутоксикарбонил-4-(3- нитроксипропил)-циклогексилметиламин
Применяя способы, аналогичные ссылочному примеру 3, используя 4,0 г транс-3-(4-N- трет-бутоксикарбониламинометилциклогексил)пропанола и 2,87 г бортетрафторида нитрония, получили 2,20 г желаемого соединения в виде бесцветного игольчатого кристаллического продукта.
Т.пл.: 94-95oC
Спектр ЯМР (CDCl3) δ ppm: 0,78-1,02 (4H, м), 1,07- 1,55 (4H, м), 1,44 (9H, с), 1,65-1,88 (6H, м), 2,97 (2H, т, J=6,4 Гц), 4,43 (2H, д, J=6,8 Гц), 4,58 (1H, ушир.)
Ссылочный пример 22
Гидрохлорид транс-4-(3-нитроксипропил) циклогексилметиламина
Применяя способы, аналогичные ссылочному примеру 4, используя 2,19 г транс-N-трет-бутоксикарбонил-4-(3- нитроксипропил) циклогексилметиламина и 20,0 мл смеси 4 н. соляной кислоты-диоксана, получили 1,57 г желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 174-180oC (разложение)
Спектр ЯМР (d6-ДМСО) δ ppm: 0,75-1,02 (4H, м), 1,05- 1,30 (3H, м), 1,35-1,87 (7H, м), 2,62 (2H, д, J=6,5 Гц), 4,50 (2H, т, J=6,6 Гц), 7,85-8,20 (3H, ушир.)
Ссылочный пример 23
Транс-4-бензилоксиметил-1- гидроксиметилциклогексан
В 10 мл тетрагидрофурана суспендировали 1,51 г гидрида натрия (содержание 55%) и добавляли по каплям при перемешивании раствор 5,0 г транс-1,4- дигидроксиметилциклогексана, растворенного в 20 мл тетрагидрофурана при охлаждении на льду, реакционную смесь перемешивали при комнатной температуре в течение 50 минут. К реакционной смеси при перемешивании и охлаждении на льду добавляли 3,79 мл бензилбромида, и смесь перемешивали при охлаждении на льду в течение 1 часа и затем при комнатной температуре. Нерастворимую часть отделяли путем фильтрации и фильтрат концентрировали при пониженном давлении. Остаток растворяли в этилацетате и раствор интенсивно промывали водным раствором хлорида натрия, 10%-ным водным раствором соляной кислоты, водным раствором хлорида натрия и водным раствором бикарбоната натрия, и высушивали над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем (элюирующий растворитель: циклогексан/этилацетат = 20/1-5/1) с получением 1,75 г желаемого соединения в виде бесцветного масла.
Спектр ЯМР (CDCl3) δ ppm: 0,85-1,08 (4H, м), 1,18-1,30 (1H, м), 1,35-1,68 (2H, м), 1,72-1,95 (4H, м), 3,29 (2H, д, J=6,6 Гц), 3,46 (2H, т, J=5,3 Гц), 4,50 (2H, с), 7,20-7,40 (5H,
Ссылочный пример 24
Транс-4- бензилоксиметилциклогексилальдегид
Раствор 60 мл безводного дихлорметана и 1,33 мл диметилсульфоксида охлаждали в бане с сухим льдом и ацетоном, к ним по каплям добавляли 1,30 мл оксалилхлорида, смесь перемешивали при той же температуре в течение 10 минут. К ней по каплям добавляли раствор 1,75 г транс- 4-бензилоксиметил-1-гидроксиметилциклогексана, растворенного в 10 мл безводного дихлорметана, полученную смесь перемешивали при той же температуре в течение 3 часов и 45 минут. К реакционной смеси добавляли 5,2 мл триэтиламина при той же температуре, баню из сухого льда и ацетона удаляли, температуру смеси постепенно возвращали к 0oC при добавлении к ней избытка водного раствора хлорида аммония. К реакционной смеси добавляли 200 мл этилацетата, полученную смесь интенсивно промывали водным раствором хлорида натрия, 10%-ным водным раствором соляной кислоты, водным раствором бикарбоната натрия и водным раствором хлорида натрия. Смесь высушивали над безводным сульфатом магния, а растворитель отгоняли при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем (растворитель элюции: циклогексан/этилацетат = 40/1-20/1) с получением 1,47 г желаемого соединения в виде бесцветного масла.
Спектр ЯМР (CDCl3) δ ppm: 0,95-1,14 (2H, м), 1,20-1,39 (2H, м), 1,50-1,70 (1H, м), 1,90-2,08 (4H, м), 2,10-2,25 (1H, м), 3,30 (2H, д, J=5,9 Гц), 4,50 (2H, с), 7,20 - 7,40 (5H, м), 9,62 (1H, д, J=1,3 Гц)
Ссылочный пример 25
Транс-4-бензилоксиметил-1-(1- гидроксиэтил) циклогексан
В 50 мл тетрагидрофурана растворяли 1,27 г транс-4-бензилоксиметилциклогексилальдегида и добавляли по каплям 6,7 мл метилмагний бромида (0,9 М раствор в тетрагидрофуране), при охлаждении смеси в бане из сухого льда и ацетона, смесь перемешивали при той же температуре в течение 30 минут. К реакционной смеси добавляли 11,0 мл 10%-ного водного раствора уксусной кислоты, а затем к ней добавляли 200 мл этил-ацетата. Раствор интенсивно промывали водным раствором хлорида натрия, 10%-ным водным раствором соляной кислоты, водным раствором хлорида натрия, водным раствором бикарбоната натрия и водным раствором хлорида натрия и высушивали над без водным сульфатом магния. Растворитель отгоняли при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем (элюирующий растворитель: циклогексан/ этилацетат = 5/1-4/1) с получением 807 мг желаемого соединения в виде бесцветного масла.
Спектр ЯМР (CDCl3) δ ppm: 0,90-1,15 (4H, м), 1,20 (3H, д, J=5,9 Гц), 1,20-2,05 (7H, м), 3,32 (2H, д, J=6,6 Гц), 3,52- 3,68 (1H, м), 4,54 (2H, с), 7,25-7,48 (5H, м)
Ссылочный пример 26
Транс-4-бензилоксиметил-1-(1- третбутилдиметилсилилоксиэтил)-циклогексан
В 50 мл сухого диметилсульфоксида растворяли 2,0 г транс-4-бензилоксиметил-1-(1- гидроксиэтил)циклогексана и добавляли 2,24 мл триэтиламина и 1,88 трет-бутилдиметилсилилхлорида при перемешивании при комнатной температуре, смесь перемешивали при комнатной температуре в течение 2 часов и 50 минут. К реакционной смеси добавляли 200 мл этилацетата. Раствор интенсивно промывали водным раствором лимонной кислоты, водным раствором хлорида натрия, водным раствором бикарбоната натрия и водным раствором хлорида натрия. Смесь высушивали над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем (элюирующий растворитель: циклогексан/этилацетат = 50/1) с получением 2,76 г желаемого соединения в виде бесцветного масла.
Спектр ЯМР (CDCl3) δ ppm: 0,02 (3H,с), 0,03 (3H, с), 0,80-1,30 (4H, м), 0,88 (9H, с), 1,08 (3H, д, J=6,6 Гц), 1,45- 1,90 (6H, м), 3,27 (2H, д, J=6,6 Гц), 3,45-3,60 (1H, м), 4,50 (2H, с), 7,20-7,40 (5H, м)
Ссылочный пример 27
Транс-4-гидроксиметил-1-(1- бутилдиметилсилилоксиэтил)-циклогексан
В 50 мл сухого этанола растворяли 2,7 г транс-4- бензилоксиметил-1-(1-трет-бутилдиметилсилилоксиэтил)- циклогексана, к нему добавляли 2,0 г 10% палладия на угле, полученную смесь нагревали с обратным холодильником в течение 9 часов и 50 минут при перемешивании в струе водорода. Затем к реакционной смеси добавляли 2,0 г 10% палладия на угле, и полученную смесь нагревали с обратным холодильником в течение 4 часов и 15 минут при перемешивании в струе водорода. После окончания реакции палладий на угле отделяли путем фильтрования, а растворитель отгоняли при пониженном давлении с получением 1,85 г желаемого соединения в виде бесцветного масла.
Спектр ЯМР (CDCl3) δ ppm: 0,03 (3H, с), 0,04 (3H, с), 0,70-1,95 (11H, м), 0,88 (9H, с), 1,09 (1,5H, д, J=6 Гц), 1,13 (1,5H, л, J=6 Гц), 3,45 (2H, д, J=6 Гц), 3,50-3,62 (1H, м)
Ссылочный пример 28
Транс-4-(1-трет- бутилдиметилсилилоксиэтил)циклогексилметилметансульфонат
В 50 мл сухого дихлорметана растворяли 1,85 г транс-4-гидроксиметил-1-(1- трет-бутилдиметилсилилоксиэтил) циклогексана 1,89 мл триэтиламина, и к ним при перемешивании добавляли 1,77 г ангидрида метансульфоновой кислоты при охлаждении на льду, смесь перемешивали при той же температуре в течение 35 минут. К реакционной смеси добавляли 200 мл этилацетата, полученную смесь интенсивно промывали водным раствором хлорида натрия, водным раствором лимонной кислоты, водным раствором хлорида натрия, водным раствором бикарбоната натрия и водным раствором хлорида натрия. Смесь высушивали над безводным сульфатом магния, а растворитель отгоняли при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем (элюирующий растворитель: циклогексан/этилацетат = 5/1) с получением 2,01 г желаемого соединения в виде бесцветного масла.
Спектр ЯМР (CDCl3) δ ppm: 0,02 (3H, с), 0,03 (3H, с), 0,88 (9H, с), 0,94-1,30 (5H, м), 1,08 (3H, д, J=6,6 Гц), 1,50- 1,95 (5H, м), 2,99 (3H, с), 3,50-3,62 (1H, м), 4,03 (2H, д, J=6,6 Гц)
Ссылочный пример 29
Транс-4-азидометил-1-(1-трет- бутилдиметилсилилоксиэтил)-циклогексан
В 50 мл сухого диметилформамида суспендировали 2,0 г транс-4-(1-трет- бутилдиметилсилилоксиэтил) циклогексилметилсульфоната и 1,85 г азида натрия, полученную смесь перемешивали при 110oC в течение 45 минут. К реакционной смеси добавляли 200 мл этилацетата, смесь промывали три раза водным раствором хлорида натрия и высушивали над безводным сульфатом магния, а растворитель отгоняли при пониженном давлении с получением 1,7 г желаемого соединения в виде бледно-желтого масла. Это масло использовали для последующей реакции без очистки.
Спектр ЯМР (CDCl3) δ ppm: 0,02 (3H, с), 0,03 (3H, с), 0,88 (9H, с), 0,90-1,28 (5H, м), 1,08 (3H, д, J=6,6 Гц), 1,40- 1,94 (5H, м), 3,12 (2H, д, J=6,6 Гц), 3,48-3,62 (1H, м)
Ссылочный пример 30
Транс-N-трет-бутоксикарбонил-4-(1-трет- бутилдиметилсилилоксиэтил)циклогексилметиламин
В 50 мл сухого этанола растворяли 1,7 г транс-4-азидометил-1-(1-трет- бутилдиметилсилилоксиэтил) циклогексана, 2,57 мл ди-трет- бутилдикарбоната и каталитическое количество 4- диметиламинопиридина, к ним добавляли 1,0 г 10% палладия на угле, смесь перемешивали в струе водорода при комнатной температуре в течение 1 часа. После окончания реакции палладий на угле отделяли путем фильтрования, а растворитель отгоняли при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем (элюирующий растворитель: циклогексан/этилацетат = 50/1-10/1) с получением 1,13 г желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 67-70oC
Спектр ЯМР (CDCl3) δ ppm: 0,02 (3H, с), 0,03 (3H, с), 0,80-1,92 (10H, м), 0,88 (9H, с), 1,07 (3H, д, J=5,9 Гц), 1,44 (9H, с), 2,95 (2H, т, J=6 Гц), 3,45-3,60 (1H, м), 3,56 (1H, ушир.)
Ссылочный пример 31
Транс-H-трет-бутоксикарбонил-4-(1- гидроксиэтилциклогексилметиламин
В 20 мл сухого тетрагидрофурана растворяли 1,3 г транс-N-трет-бутоксикарбонил-4-(1-трет- бутилдиметилсилилоксиэтил)циклогексилметиламина и по каплям при перемешивании добавили 5,25 мл фторида тетрабутиламмония (1,0 М раствор на тетрагидрофуране) при охлаждении на льду, смесь перемешивали при комнатной температуре в течение 55 минут. Затем к ней по каплям добавили 5 мл фторида тетрабутиламмония (1,0 М раствор на тетрагидрофуране) и смесь перемешивали при комнатной температуре в течение ночи и затем при 50oC в течение 9 часов. К реакционной смеси добавили 200 мл этилацетата и смесь интенсивно промывали водным раствором лимонной кислоты, водным раствором хлорида натрия, водным раствором бикарбоната натрия и водным раствором хлорида натрия. Смесь высушивали над безводным сульфатом магния, а растворитель отгоняли при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем (элюирующий растворитель: циклогексан/-этилацетат = 2/1) с получением 701 мг желаемого соединения в виде бесцветного кристаллического продукта. Далее 38 мг желаемого продукта получили из маточной жидкости.
Т.пл.: 75-76oC
Спектр ЯМР (CDCl3) δ ppm: 0,80-1,97 (11H, м), 1,16 (1H, д, J=6,6 Гц), 1,44 (9H, с), 2,97 (2H, т, J=6,6 Гц), 3,48-3,62 (2H, м), 4,57 (1H, ушир.)
Ссылочный пример 32
Транс-N-трет-бутоксикарбонил-4-(1- нитроксиэтил)-циклогексилметиламин
Применяя способы, аналогичные ссылочному примеру 3, используя 739 мг транс-N-трет- бутоксикарбонил-4-(1-гидроксиэтил)циклогексилметиламина и 561 мг бортетрафторида нитрония, получили 533 мг желаемого соединения в виде бесцветного масла.
Спектр ЯМР (CDCl3) δ ppm: 0,84-1,97 (10H, м), 1,31 (3H, д, J=5,9 Гц), 1,44 (9H, с), 2,97 (2H, т, J=6 Гц), 4,56 (1H, ушир.), 4,85-4,98 (1H, м)
Ссылочный пример 33
Гидрохлорид транс-4-(1-нитроксиэтил) циклогексилметиламина
Применяя способы, аналогичные ссылочному примеру 4, используя 533 мг транс-N-трет-бутоксикарбонил-4-1- нитроксиэтил) циклогексилметиламина и 10,0 мл смеси 4 н. соляной кислоты-диоксана получили 427 мг желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 160-163oC (разложение)
Спектр ЯМР (d6-ДМСО) δ ppm: 0,80-1,20 (4H, м), 1,28 (3H, д, J=6,6 Гц), 1,42-1,90 (6H, м), 2,63 (2H, д, J=7,3 Гц), 4,92-5,08 (1H, м), 7,80-8,20 (3H, ушир.)
Ссылочный пример 34
Транс-4-бензилоксиметил-1-(1- метансульфонилоксиэтил)-циклогексан
В 50 мл безводного дихлорметана растворяли 1,50 г транс-4-бензилоксиметил-1-(1- гидроксиэтил) циклогексана и 1,68 мл триэтиламина, и к ним добавляли при перемешивании 1,58 г метансульфоновой кислоты при охлаждении на льду, смесь перемешивали при комнатной температуре в течение 1 часа и 25 минут. Растворитель отгоняли при пониженном давлении, а к остатку добавляли 150 мл этилацетата. Смесь интенсивно промывали водным раствором хлорида натрия, 10%-ным водным раствором соляной кислоты, водным раствором хлорида натрия, водным раствором бикарбоната натрия и водным раствором хлорида натрия, и высушивали над безводным сульфатом магния, а растворитель отгоняли при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем, используя дихлорметан в качестве элюента с получением 1,71 г желаемого соединения в виде бледно-желтого масла.
Спектр ЯМР (CDCl3) δ ppm: 0,85-1,20 (4H, м), 1,39 (3H, д, J=5,9 Гц), 1,45-1,95 (6H, м), 2,99 (3H, с), 3,28 (2H, д, J=6,6 Гц), 4,49 (2H, с), 4,55-4,68 (1H, м), 7,20-7,40 (5H, м)
Ссылочный пример 35
Транс-4-бензилоксиметил-1-(1-азидоэтил) циклогексан
В 50 мл сухого диметилформамида суспендировали 1,70 г транс-4-бензилоксиметил-1-(1-метансульфонилоксиэтил)- циклогексана и 1,69 г азида натрия, и смесь перемешивали при 110oC в течение 30 минут. К реакционной смеси добавляли 200 мл этилацетата и смесь промывали три раза водным раствором хлорида натрия и высушивали над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении с получением 1,48 г желаемого соединения в виде бледно-желтого масла. Это соединение использовали для последующей реакции без очистки.
Спектр ЯМР (CDCl3) δ ppm: 0,85-1,16 (4H, м), 1,20-1,96 (6H, м), 1,24 (3H, д, J=6.6 Гц), 3,20-3,33 (3H, м), 4,49 (2H, с), 7,20-7,40 (5H, м)
Ссылочный пример 36
Транс-4-(1-N-трет- бутоксикарбониламиноэтил)-1-гидроксиметилциклогексан
В 50 мл сухого этанола растворяли 1,48 г транс-4-бензилоксиметил-1-(1- азидоэтил)циклогексана, 1,20 мл ди-трет-бутилдикарбоната и каталитическое количество 4-диметиламинопиридина, и к ним добавляли 1,0 г 10% палладия на угле, полученную смесь перемешивали в атмосфере водорода при давлении 1 атм при комнатной температуре в течение 1 часа, при 50oC в течение 40 минут и далее нагревали с обратным холодильником в течение 1 часа. Затем к ней добавляли 1,0 г 10% палладия на угле и полученную смесь нагревали с обратным холодильником в атмосфере водорода при 1 атм в течение 1 часа и 20 минут. Затем к ним добавили 2,0 г 10% палладия на угле и смесь нагревали с обратным холодильником в атмосфере водорода при давлении 1 атм в течение 3 часов. Кроме того, добавляли 5 капель 10%-ного водного раствора соляной кислоты и смесь нагревали в атмосфере водорода при 1 атм с обратным холодильником в течение 4 часов и 45 минут. После завершения реакции палладий на угле отделяли путем фильтрации, а растворитель отгоняли при пониженном давлении. Остаток растворяли в смеси раствора 10 мл метанола и 10 мл дихлорметана, к которому добавляли 0,72 мл триетиламина, 1,20 мл ди-трет-бутилдикарбоната и каталитическое количество 4-диметиламинопиридина, смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 150 мл этилацетата и смесь интенсивно промывали водным раствором лимонной кислоты, водным раствором хлорида натрия, водным раствором бикарбоната натрия и водным раствором хлорида натрия и высушивали над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем, используя в качестве элюирующего растворителя циклогексан-этилацетат (5:2-2:1) с получением 617 мг желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 93,5-95oC
Спектр ЯМР (CDCl3) δ ppm: 0,83-1,92 (11H, м), 1,08 (3H, д, J=6,6 Гц), 1,44 (9H, с), 3,40-3,62 (3H, м), 4,28-4,45 (1H, м)
Ссылочный пример 37
N-трет-Бутоксикарбонил-1-(транс-4- нитроксиметилциклогексил)этиламин
Применяя способы, аналогичные ссылочному примеру 3, используя 860 мг транс-4-(1-трет- бутоксикарбониламиноэтил)-1-гидроксиметилциклогексана и 555 мг бортетрафторида нитрония, получили 587 мг желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 45-47oC
Спектр ЯМР (CDCl3) δ ppm: 0,92-1,92 (10H, м), 1,08 (3H, д, J=7,3 ), 1,44 (9H, с), 3,40-3,60 (1H, м), 4,25-4,40 (1H, м), 4,26 (2H, д, J=6,6 Гц)
Ссылочный пример 38
Гидрохлорид 1-(транс-4- нитроксиметилциклогексил) этиламина
Применяя способы, аналогичные ссылочному примеру 4, используя 660 мг N-трет-бутоксикарбонил-1- (транс-4-нитроксиметилциклогексил) этиламина и 10 мл смеси 4 н. соляной кислоты-диоксана, получили 502 мг желаемого соединения в виде бледно-желтого кристаллического продукта.
Т.пл.: 168-169oC (разложение)
Спектр ЯМР (d6-ДМСО) δ ppm: 0,90-1,10 (4H, м), 1,13 (3H, д, J=6,6 Гц), 1,35-1,88 (6H, м), 2,92-3,10 (1H, м), 4,37 (2H, д, J=6,6 Гц), 7,75-8,00 (3H, ушир.)
Ссылочный пример 39
Транс-4-N-трет- бутоксикарбониламинометилциклогексилцетонитрил
В 50 мл сухого диметилформамида суспендировали 5,86 г транс-N-трет-бутоксикарбонил-4- метансульфонилоксиметилциклогексилметиламина, 3,28 г иодида натрия и 1,07 г цианида натрия, смесь нагревали при перемешивании при 110oC в течение 40 минут. Реакционную смесь вливали в 100 мл воды со льдом и смесь экстрагировали 150 мл этилацетата. Экстракты интенсивно промывали водным раствором хлорида натрия, водным раствором лимонной кислоты, водным раствором хлорида натрия, водным раствором тиосульфата натрия, водным раствором хлорида натрия, водным раствором бикарбоната натрия и водным раствором хлорида натрия и высушивали над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении, а остаток очищали путем хроматографии на колонке с силикагелем, применяя в качестве элюирующего растворителя циклогексан-этилацетат (10:1-5:1) с получением 3,87 г желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 78-79oC
Спектр ЯМР (CDCl3) δ ppm: 0,85-1,28 (4H, м), 1,30-2,00 (6H, м), 1,48 (9H, с), 2,30 (2H, д, J=6,6 Гц), 3,02 (2H, т, J=6,3 Гц), 4,52- 4,70 (1H, м)
Ссылочный пример 40
Транс-4-N-трет-бутоксикарбониламинометилциклогексил уксусная кислота
В смеси раствора 20 мл конц. соляной кислоты и 10 мл конц. серной кислоты суспендировали 1,02 г транс-4-N-трет- бутоксикарбониламинометилциклогексилацетонитрила, полученную смесь нагревали с обратным холодильником в течение 1 часа и 25 минут. Реакционную смесь вливали в 150 мл воды со льдом и нейтрализовали избытком бикарбоната натрия. Затем к ней добавили 200 мл диоксана и 5,0 мл ди-трет-бутилдикарбоната, и полученную смесь перемешивали при комнатной температуре в течение ночи. Смесь подкисляли водным раствором лимонной кислоты, концентрировали до объема около 100 мл при пониженном давлении и экстрагировали три раза по 300 мл этилацетата. Экстракты промывали водным раствором хлорида натрия и высушивали над безводным сульфатом магния, а растворитель отгоняли при пониженном давлении с получением 0,98 г желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 123-124oC
Спектр ЯМР (CDCl3) δ ppm: 0,85-1,10 (4H, м), 1,30- 1,90 (6H, м), 1,44 (9H, с), 2,23 (2H, д, J=7,0 Гц), 2,97 (2H, т, J=6,3 Гц), 4,50-4,66 (1H, м)
Ссылочный пример 41
Метил 2-(транс-4-N-трет- бутоксикарбониламинометилциклогексил) пропионат
В 20 мл сухого тетрагидрофурана растворяли 0,49 мл диизопириламина и к нему добавляли по каплям 2,19 мл раствора бутиллития (1,6 М раствор в тетрагидрофуране) при охлаждении в бане с сухим льдом и ацетоном. Баню с сухим льдом и ацетоном удаляли, а смесь перемешивали до тех пор, пока температура не станет 0oC. К реакционной смеси снова по каплям добавляли раствор, полученный путем растворения 500 мг метил транс-4-трет- бутоксикарбонил-аминометилциклогексилацетата в 5 мл сухого тетрагидрофурана при охлаждении в бане с сухим льдом и ацетоном. Полученную смесь перемешивали в течение 1 часа и 30 минут, затем к ней добавляли 0,26 мл иодометила, далее смесь перемешивали при той же температуре в течение 2 часов и 15 минут. Температуру реакционной смеси (-73oC) повышали до-40oC в течение 2 часов и добавляли избыток водного раствора хлорида аммония. Реакционную смесь экстрагировали 150 мл этилацетата, экстракты интенсивно промывали водным раствором хлорида натрия, водным раствором лимонной кислоты, водным раствором хлорида натрия, водным раствором тиосульфата натрия, водным раствором хлорида натрия, водным раствором бикарбоната натрия и водным раствором хлорида натрия и высушивали над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении, а остаток очищали путем хроматографии на колонке с силикагелем, применяя в качестве элюирующего растворителя циклогексан-этилацетат (10:1-6:1) с получением 250 мг желаемого соединения в виде бесцветного масла.
Спектр ЯМР (CDCl3) δ ppm: 0,80-1,10 (4H, м), 1,11 (3H, д, J=6,9 Гц), 1,25-1,85 (6H, м), 1,44 (9H, с), 2,16-2,34 (1H, м), 2,96 (2H, т, J=6,3 Гц), 3,66 (3H, с), 4,57 (1H, ушир.)
Ссылочный пример 42
Транс-4-N-трет- бутоксикарбониламинометил-1-(2-гидрокси-1-метилэтил) циклогексан
В 5 мл сухого тетрагидрофурана растворяли 95 мг метил 2-(транс-4- N-трет-бутоксикарбониламинометилциклогексил)-пропионата, к нему по каплям добавляли 0,32 мл раствора литийалюмогидрида (1,0 М раствор в тетрагидрофуране) при охлаждении в бане с сухим льдом и ацетоном, полученную смесь перемешивали в течение 30 минут. К реакционной смеси добавляли 10 мл водного раствора хлорида аммония, и смесь экстрагировали 50 мл этилацетата. Экстракты интенсивно промывали водным раствором хлорида натрия, водным раствором лимонной кислоты, водным раствором хлорида натрия, водным раствором бикарбоната натрия и водным раствором хлорида натрия и высушивали над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении, а остаток очищали путем хроматографии на колонке с силикагелем, применяя в качестве элюирующего растворителя циклогексан-этилацетат (4:1) с получением 80 мг желаемого соединения в виде бесцветного масла.
Спектр ЯМР (CDCl3) δ ppm: 0,80-1,83 (12H, м), 0,89 (3H, д, J=7,l Гц), 1,44 (9H, с), 2,95 (2H, т, J=6,4 Гц), 3,47 (1H, дд, J=7,6 Гц, J=10,5 Гц), 3,61 (1H, дд, J=5,9 Гц, J=10,5 Гц), 4,47-4,65 (1H, м)
Ссылочный пример 43
Транс-4-N-трет- бутоксикарбониламинометил-1-(1-метил-2-нитроксиэтил) циклогексан
Применяя способы, аналогичные ссылочному примеру 3, используя 210 мг транс-4-N-трет-бутоксикарбониламино-метил-1-(2-гидрокси-1- метилэтил)циклогексана и 151 мг бортетрафторида нитрония, получили 150 мг желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 55-57oC
Спектр ЯМР (CDCl3) δ ppm: 0,84-1,86 (11H, м), 0,96 (3H, д, J=6,9 Гц), 1,44 (9H, с), 2,96 (2H, т, J=6,3 Гц), 4,27 (1H, дд, J=7,2 Гц, J=10,4 Гц), 4,44 (1H, дд, J=5,8 Гц, J=10,4 Гц), 4,50-4,64 (1H, м)
Ссылочный пример 44
Гидрохлорид транс-4-(1-метил-2- нитроксиэтил) циклогексил-метиламина
Применяя способы, аналогичные ссылочному примеру 4, используя 150 мг транс-4-N-трет- бутоксикарбониламино-метил-1-(1-метил-1-нитроксиэтил)циклогексана и 10,0 мл смеси 4 н. соляной кислоты-диоксана, получили 111 мг желаемого соединения в виде бледно-желтого кристаллического продукта.
Т.пл.: 114-116oC (разложение)
Спектр ЯМР (CDCl3) δ ppm: 0,80-1,85 (11H, м), 0,90 (3H, д, J=6,8 Гц), 2,57-2,70 (2H, м), 4,36 (1H, дд, J=6,9 Гц, J=10,3 Гц), 4,52 (1H, дд, J=5,8 Гц, J=10,5 Гц), 7,60-7,90 (3H, ушир.)
Ссылочный пример 45
Транс-4-трет-бутилдиметилсилилоксиметил- 1-гидроксиметил-циклогексан
В 250 мл сухого диметилформамида растворили 10,0 г транс-1,4-дигидроксиметилциклогексана и 14,5 мл триэтиламина, и к ним добавили по каплям при перемешивании раствор 10,24 г трет-бутилдиметилсилилхлорида, растворенного в 50 мл сухого диметилформамида при охлаждении на льду, полученную смесь перемешивали при охлаждении на льду в течение 1 часа. К реакционной смеси добавляли 200 мл этилацетата, осажденный гидрохлорид триэтиламина удаляли фильтрованием, а фильтрат концентрировали при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем, применяя в качестве элюирующего растворителя циклогексан-этилацетат (2:1) с получением 11,9 г желаемого соединения в виде бесцветного масла.
Спектр ЯМР (CDCl3) δ ppm: 0,03 (6H, с), 0,85-1,04 (4H, м), 0,89 (9H, с), 1,25-1,90 (7H, м), 3,35-3,50 (4H, м)
Ссылочный пример 46
Транс-4-метансульфонилоксиметил-1- трет-бутилдиметилсилил-оксиметилциклогексан
В 200 мл сухого дихлорметана растворили 11,9 г транс-4-трет- бутилдиметилсилилоксиметил-1-гидроксиметил-циклогексана, к нему добавили при перемешивании 9,63 мл триэтиламина и 9,98 г ангидрида метансульфоновой кислоты при охлаждении на льду, полученную смесь перемешивали при комнатной температуре в течение 30 минут. К реакционной смеси добавили 200 мл этилацетата и смесь промывали водным раствором бикарбоната натрия и водным раствором хлорида натрия, и высушивали над безводным сульфатом магния, а растворитель отгоняли при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем, применяя в качестве элюирующего растворителя циклогексан-этилацетат (8:1-5:1) с получением 12,2 г желаемого соединения в виде бесцветного масла.
Спектр ЯМР (CDCl3) δ ppm: 0,03 (6H, с), 0,82-1,14 (4H, м), 0,89 (9H, с), 1,35-1,92 (6H, м), 3,00 (3H, с), 3,41 (2H, д, J=6,6 Гц), 4,04 (1H, д, J=6,6 Гц)
Ссылочный пример 47
Транс-4-трет- бутилдиметилсилилоксиметилциклогексилацетонитрил
В 100 мл сухого диметилформамида суспендировали 11,0 г транс-4- метансульфонилоксиметил-1-трет-бутилдиметилсилилоксиметилциклогексана, 5,87 г иодида натрия и 1,92 г цианида натрия, смесь перемешивали при 50oC в течение 1 часа и 45 минут, затем при 110oC в течение 45 минут. Реакционную смесь влили в 100 мл воды со льдом и смесь экстрагировали 300 мл эфира. Экстракты промывали водным раствором лимонной кислоты, водным раствором хлорида натрия, водным раствором бикарбоната натрия и водным раствором хлорида натрия и высушивали над безводным сульфатом магния, а растворитель отгоняли при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем, применяя в качестве элюирующего растворителя циклогексан- этилацетат (20: 1-5:1) с получением 7,41 г желаемого соединения в виде бесцветного масла.
Спектр ЯМР (CDCl3) δ ppm: 0,03 (6H, с), 0,82-1,20 (4H, м), 0,89 (9H, с), 1,34-1,95 (6H, м), 2,25 (2H, д, J=6,6 Гц), 3,41 (1H, д, J=5,9 Гц)
Ссылочный пример 48
N-трет-Бутоксикарбонил-2-(транс-4-трет- бутилдиметилсилилоксиметилциклогексил) этиламин
В 20 мл сухого тетрагидрофурана растворили 1,0 г транс-4-трет- бутилдиметилсилилоксиметилциклогексилацетонитрила и к нему по каплям добавляли 3,74 мл литийалюмогидрида (1,0 М раствор в тетрагидрофуране) при охлаждении в бане из сухого льда и ацетона, смесь перемешивали 1 час и затем при 0oC в течение 25 минут. Затем к смеси добавляли 3,74 мл 1 н. водного раствора соляной кислоты и смесь перемешивали в течение 20 минут. К реакционной смеси добавляли 2,06 мл ди-трет-бутилдикарбоната и смесь перемешивали при комнатной температуре в течение 2 часов и 15 минут. К реакционной смеси добавляли 150 мл этилацетата и смесь промывали водным раствором лимонной кислоты, водным раствором хлорида натрия, водным раствором бикарбоната натрия и водным раствором хлорида натрия и высушивали над безводным сульфатом магния, а растворитель отгоняли при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем, применяя в качестве элюирующего раствора циклогексан- этилацетат (40:1-20:1) с получением 1,05 г желаемого соединения в виде бесцветного масла.
Спектр ЯМР (CDCl3) δ ppm: 0,03 (6H, с), 0,82-1,05 (4H, м), 0,89 (9H, с), 1,10-1,90 (8H, м), 1,44 (9H, с), 3,05-3,22 (2H, м), 3,39 (1H, д, J=6,3 Гц), 4,45-4,55 (1H, м)
Ссылочный пример 49
Транс-4-(2-трет- бутоксикарбониламиноэтил)-1-гидроксиметилциклогексан
В 10 мл сухого тетрагидрофурана растворяли 1,05 г N-трет-бутоксикарбонил- 2-(транс-4-трет-бутилдиметилсилилоксиметилциклогексил) этиламина и к нему по каплям добавляли при перемешивании 8,48 мл фторида тетрабутиламмония (1,0 М раствор в тетрагидрофуране) при охлаждении на льду, полученную смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли 150 мл этилацетата, и смесь промывали водным раствором бикарбоната натрия и водным раствором хлорида натрия, и высушивали над безводным сульфатом магния, а растворитель отгоняли при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем, применяя в качестве элюирующего растворителя циклогексан-этилацетат (2:1) с получением 741 мг желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 75-76oC
Спектр ЯМР (CDCl3 δ ppm: 0,85-1,90 (13H, м), 1,44 (9H, с), 3,05-3,28 (2H, м), 3,40-3,58 (2H, м), 4,30-4,60 (1H, м)
Ссылочный пример 50
N-трет-Бутоксикарбонил-2-(транс-4- нитроксиметилциклогексил) этиламин
Применяя способы, аналогичные ссылочному примеру 3, используя 470 мг транс-4-(2-трет- бутоксикарбониламиноэтил)-1-гидроксиметилэтилциклогексана и 357 мг бортетрафторида нитрония, получили 340 мг желаемого соединения в виде бледно-желтого кристаллического продукта.
Спектр ЯМР (CDCl3) δ ppm: 0,85-1,14 (4H, м), 1,20- 1,90 (8H, м), 1,44 (9H, с), 3,05-3,20 (2H, м), 4,26 (2H, д, J=6,5 Гц), 4,35-4,55 (1H, м)
Ссылочный пример 51
Гидрохлорид 2-(транс-4-нитроксиметилциклогексил) этиламина
Применяя способы, аналогичные ссылочному примеру 4, используя 340 мг N-трет-бутоксикарбонил-2- (транс-4-нитроксиметилциклогексил) этиламина и 5,0 мл смеси 4 н. соляной кислоты- диоксана, получили 206 мг желаемого соединения в виде бледно- желтого кристаллического продукта.
Т.пл.: 162-165oC (разложение)
Спектр ЯМР (d6-ДМСО) δ ppm: 0,80-1,12 (4H, м), 1,15-1,53 (3H, м), 1,55-1,80 (5H, м), 2,70-2,88 (2H, м,), 4,36 (2H, д, J=6,l Гц), 7,70-8,10 (3H, ушир.)
Ссылочный пример 52
N-трет-Бутоксикарбонил-2-(транс-4- метансульфонилоксиметилциклогексил) этиламин
В 50 мл сухого дихлорметана растворили 1,0 г транс-4-(2-трет- бутоксикарбониламиноэтил)-1-гидроксиметил-циклогексана, к нему добавили при перемешивании 0,81 мл триэтиламина и 829 мг ангидрида метансульфоновой кислоты при охлаждении на льду, полученную смесь перемешивали при комнатной температуре в течение 40 минут. Затем отгоняли растворитель при пониженном давлении и к остатку добавляли 150 мл этилацетата. Смесь интенсивно промывали водным раствором хлорида натрия, водным раствором бикарбоната натрия и водным раствором хлорида натрия, и высушивали над безводным сульфатом магния, а растворитель отгоняли при пониженном давлении. К полученному кристаллическому продукту добавляли изопропиловый эфир и кристаллический продукт собирали путем фильтрации с получением 1,13 г желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 83-84oC
Спектр ЯМР (CDCl3) δ ppm: 0,85-1,14 (4H, м), 1,16-1,90 (8H, м), 1,44 (9H, с), 3,00 (3H, с), 3,05-3,10 (2H, м), 4,03 (2H, д, J=6,3 Гц), 4,35 - 4,55 (1H, м)
Ссылочный пример 53
Диэтил транс-4-(2-N-трет- бутоксикарбониламиноэтил) циклогексилметилмалонат
В 50 мл сухого диметилформамида растворяли 1,02 мл диэтилмалоната и к нему добавляли при перемешивании 147 мг гидрида натрия (содержание 55%) при охлаждении на льду, и смесь перемешивали в течение 30 минут. К реакционной смеси добавляли 1,13 г N-трет-бутоксикарбонил-2-(транс-4- метансульфонилоксиметилциклогексил)этиламина, смесь нагревали при перемешивании при 110oC в течение 40 минут. Затем к ней добавляли 505 мг иодида натрия и смесь нагревали при перемешивании при 110oC в течение 1 часа и 5 минут. К реакционной смеси добавляли 200 мл этилацетата и смесь интенсивно промывали водным раствором хлорида натрия, водным раствором тиосульфата натрия и водным раствором хлорида натрия, и высушивали над безводным сульфатом магния, а растворитель отгоняли при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем, применяя в качестве элюирующего растворителя циклогексан-этилацетат (10:1-5:1) с получением 895 мг желаемого соединения в виде бесцветного масла.
Спектр ЯМР (CDCl3) δ ppm: 0,80-1,02 (4H, м), 1,10-1,85 (14H, м), 1,44 (9H, с), 3,05-3,20 (2H, м), 3,43 (1H, т, J=7,6 Гц), 4,10-4,28 (6H, м), 4,35- 4,55 (1H, м)
Ссылочный пример 54
Транс-4-(2-N-трет- бутоксикарбониламиноэтил) циклогексилметилмалоновая кислота
В 10 мл этанола растворяли 890 мг диэтил транс-4-(2-N-трет- бутоксикарбониламиноэтил)циклогексилметилмалоната и к нему добавляли при перемешивании 10 мл 2,5 н. гидроксида натрия при охлаждении на льду, смесь перемешивали при комнатной температуре в течение 3,5 часа. Реакционную смесь вливали в 50 мл ледяной воды, подкисляли лимонной кислотой и экстрагировали 200 мл этилацетата. Экстракты промывали водным раствором хлорида натрия, и высушивали над безводным сульфатом магния, а растворитель отгоняли при пониженном давлении. К полученному кристаллическому продукту добавляли изопропиловый эфир и кристаллический продукт собирали путем фильтрации с получением 563 мг желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 152-153oC (разложение)
Спектр ЯМР (d6-ДМСО) δ ppm: 0,72-0,95 (4H, м), 1,05-1,82 (10H, м), 1,37 (9H, с), 2,82-2,98 (2H, м), 3,20-3,35 (1H, м), 6,65-6,80 (1H, м)
Ссылочный пример 55
3-[Транс-4-(2-N-трет- бутоксикарбониламиноэтил)циклогексил] пропионовая кислота
620 мг транс-4-(2-N-трет-бутоксикарбониламиноэтил)- циклогексилметилмалоновой кислоты и 10 мл ксилола нагревали с обратным холодильником в течение 1 часа и 40 минут. Растворитель отгоняли при пониженном давлении и к остатку добавляли гексан, полученный кристаллический продукт собирали путем фильтрации с получением 453 мг желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 107-113oC
Спектр ЯМР (CDCl3) δ ppm: 0,68-0,95 (4H, м), 1,10-1,80 (10H, м), 1,37 (9H, с), 2,19 (2H, т, J=7,5 Гц), 2,85-3,00 (2H, м), 6,65-6,78 (1H, м)
Ссылочный пример 56
Транс-4-(2-N-трет- бутоксикарбониламиноэтил)-1-(3-гидроксипропил)циклогексан
В 10 мл сухого тетрагидрофурана растворяли 450 мг 3-[транс-4-(2-N- трет-бутоксикарбониламиноэтил)циклогексил] -пропионовой кислоты и к ней добавляли при перемешивании 0,42 мл триэтиламина и 0,22 мл изобутилхлорформата при охлаждении на льду, смесь перемешивали при комнатной температуре в течение 3 часов. Нерастворимые частички фильтровали используя Целит, и фильтрат добавляли по каплям при перемешивании к 10 мл водного раствора 171 мг боргидрида натрия при охлаждении на льду. Смесь перемешивали при охлаждении на льду в течение 20 минут, а затем при комнатной температуре в течение 1 часа и 40 минут. Добавляли избыток водного раствора хлорида аммония и смесь экстрагировали 200 мл этилацетата. Экстракты интенсивно промывали водным раствором хлорида натрия, водным раствором бикарбоната натрия и водным раствором хлорида натрия, и высушивали над безводным сульфатом магния, а растворитель отгоняли при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем, применяя в качестве элюирующего растворителя циклогексан-этилацетат (3:1) с получением 284 мг желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 62-64oC
Спектр ЯМР (CDCl3) δ ppm: 0,78-1,05 (4H, м), 1,05-1,85 (13H, м), 1,44 (9H, с), 3,05-3,25 (2H, м), 3,55-3,70 (2H, м), 4,30-4,60 (1H, м)
Ссылочный пример 57
Транс-N-трет-бутоксикарбонил-2-[4-(3- нитроксипропил)-циклогексил] этиламин
Применяя способы, аналогичные ссылочному примеру 3, используя 270 мг транс-4-(2-N- трет-бутоксикарбониламиноэтил)-1-(3-гидроксипропил)циклогексана и 185 мг бортетрафторида нитрония, получили 195 мг желаемого соединения в виде бледно-желтого кристаллического продукта.
Т.пл.: 48-49oC
Спектр ЯМР (CDCl3) δ ppm: 0,80-1,02 (4H, м), 1,10-1,82 (12H, м), 1,44 (9H, с), 3,05-3,20 (2H, м), 4,42 (2H, т, J=6,7 Гц)
Ссылочный пример 58
Гидрохлорид 2-[транс-4-(3- нитроксипропил) циклогексил]-этиламина
Применяя способы, аналогичные ссылочному примеру 4, используя 195 мг транс-N-трет- бутоксикарбонил-2-[4-(3-нитроксипропил)циклогексил]этиламина и 10,0 мл смеси 4 н. соляной кислоты-диоксана, получили 149 мг желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 165-167oC (разложение)
Спектр ЯМР (d6-ДМСО) δ ppm: 0,75-1,00 (4H, м), 1,05- 1,80 (12H, м), 2,78 (2H, т, J=7,7 Гц), 4,50 (2H, т, J=6,6 Гц), 7,65- 7,95 (3H, ушир.)
Ссылочный пример 59
N-трет-Бутоксикарбонил-3- нитроксиметилциклогексиламин
Применяя способы, аналогичные ссылочному примеру 3, используя 3,0 г N-трет-бутоксикарбонил-3- гидроксиметилциклогексиламина и 3,48 г бортетрафторида нитрония, получили 2,65 г желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 68-70oC
Спектр ЯМР (CDCl3) δ ppm: 0,78-1,50 (4H, м), 1,44 (9H, с), 1,70-2,18 (5H, м), 3,35-3,58 (1H, м), 4,29 (2H, д, J=5,9 Гц), 4,30-5,50 (1H, м)
Ссылочный пример 60
Гидрохлорид 3-нитроксиметилциклогексиламина
Применяя способы, аналогичные ссылочному примеру 4, используя 2,65 г N-трет-бутоксикарбонил-3- нитроксиметилциклогексиламина и 27,0 мл смеси 4 н. соляной кислоты-диоксана, получили 1,90 г желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 168-169oC (разложение)
Спектр ЯМР (d6-ДМСО) δ ppm: 0,85-1,40 (4H, м), 1,60- 2,05 (5H, м), 2,90-3,05 (1H, м), 4,35-4,50 (2H, м), 8,00-8,40 (3H, ушир.)
Ссылочный пример 61
N-трет-Бутоксикарбонил-4- нитроксиметилциклогексиламин
Применяя способы, аналогичные ссылочному примеру 3, используя 3,0 г N-трет-бутоксикарбонил-4- гидроксиметилциклогексиламина и 3,48 г бортетрафторида нитрония, получили 2,34 г желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 83-84oC
Спектр ЯМР (CDCl3) δ ppm: 1,05-2,10 (9H, м), 1,45 (9H, с), 3,65-3,85 (1H, м), 4,26 (0,3H, д, J=6,6 Гц), 4,33 (1,7H, д, J=6,6 Гц), 4,45-4,70 (1H, м)
Ссылочный пример 62
Гидрохлорид 4-нитроксиметилциклогексиламина
Применяя способы, аналогичные ссылочному примеру 4, используя 2,32 г N-трет-бутоксикарбонил-4-нитроксиметилциклогексиламина и 23,0 мл смеси 4 н. соляной кислоты-диоксана, получили 1,34 г желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 155-157oC (разложение)
Спектр ЯМР (d6-ДМСО) δ ppm: 1,10-2,05 (9H, м), 2,85- 2,97 (0,14H, м), 3,13-3,25 (0,86H, м), 4,36 (0,28H, д, J=6,5 Гц), 4,44 (1,72H, д, J=6,5 Гц), 8,00-8,40 (3H, ушир.)
Ссылочный пример 63
Транс-2-карбамоилциклогексанкарбоновая кислота
К 40 мл водного конц. аммиака добавляли при перемешивании 10,0 г ангидрида транс-1,2-циклогександикарбоновой кислоты при комнатной температуре, смесь перемешивали при комнатной температуре в течение 4 часов и 15 минут. pH реакционной смеси подводили при перемешивании до 1 конц. соляной кислотой при охлаждении льдом, и осадившийся кристаллический продукт собирали путем фильтрации и промывали водой. Кристаллический продукт перекристаллизовывали из этанола с получением 6,93 г желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 183-186oC
Спектр ЯМР (d6-ДМСО) δ ppm: 1,10-1,35 (4H, м), 1,60- 2,05 (4H, м), 2,20-2,45 (2H, м), 6,65 (1H, с), 7,72 (1H, с), 11,88 (1H, с)
Ссылочный пример 64
Транс-N-трет-бутоксикарбонил-2- гидроксиметилциклогексилметиламин
В 40 мл сухого тетрагидрофурана суспендировали 4,0 г транс-2-карбамоилциклогексанкарбоновой кислоты и по каплям при перемешивании добавляли 54,0 мл раствора литийалюмогидрида в тетрагидрофуране (1,0 М раствор) при охлаждении льдом, полученную смесь перемешивали при комнатной температуре в течение 55 минут и нагревали с обратным холодильником в течение 1 часа. К реакционной смеси при перемешивании и охлаждении на льду добавляли 13,0 г десятиводного сульфата натрия и смесь перемешивали в течение 1 часа и 15 минут. Реакционную смесь фильтровали через Целит и промывали этанолом, фильтрат концентрировали до около 100 мл при пониженном давлении. К концентрату добавляли 6,4 мл ди-трет-бутилдикарбоната при перемешивании и комнатной температуре, смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь концентрировали при пониженном давлении и остаток очищали путем хроматографии на колонке с силикагелем, используя в качестве элюирующего растворителя циклогексан-этилацетат (2:1) с получением 1,47 г желаемого соединения в виде бледного розового масла.
Спектр ЯМР (d6- ДМСО) δ ppm: 0,90-1,90 (10H, м), 1,44 (9H, с), 2,90-3,08 (1H, м), 3,22-3,40 (1H, м), 3,43-3,80 (3H, м), 5,10-5,30 (1H, м)
Ссылочный пример 65
Транс-N-трет-бутоксикарбонил-2- нитроксиметилциклогексилметиламин
Применяя способы, аналогичные ссылочному примеру 3, используя 893 мг транс-N-трет- бутоксикарбонил-2-гидроксиметилциклогексилметиламина и 723 мг бортетрафторида нитрония, получили 885 мг желаемого соединения в виде желтого масла.
Спектр ЯМР (CDCl3) δ ppm: 0,90-1,90 (10H, м), 1,44 (9H, с), 2,95-3,16 (1H, м), 3,16-3,37 (1H, м), 4,40 (1H, дд, J=5,9 Гц, J=10,6 Гц), 4,44-4,70 (2H, м)
Ссылочный пример 66
Гидрохлорид транс-2-нитроксиметилциклогексилметиламина
Применяя способы, аналогичные ссылочному примеру 4, используя 885 мг транс-N-трет- бутоксикарбонил-2-нитроксиметилциклогексилметиламина и 5,0 мл смеси 4 н. соляной кислоты-диоксана, получили 600 мг желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 144-146oC (разложение)
Спектр ЯМР (CDCl3) δ ppm: 1,12-1,45 (4H, м), 1,65- 2,10 (6H, м), 2,85-3,05 (1H, м), 3,13-3,30 (1H, м), 4,53 (2H, д, J=3,3 Гц), 8,10-8,60 (3H, ушир.)
Ссылочный пример 67
Цис-2-карбомоилциклогексанкарбоновая кислота
Применяя способы, аналогичные ссылочному примеру 63, используя 20 мл водный конц. аммиак и 2,50 г ангидрида цис-1,2- циклогександикарбоновой кислоты, получили 2,07 г желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 156-158oC
Спектр ЯМР (CDCl3) δ ppm: 1,30-2,25 (8H, м), 2,60- 2,75 (1H, м), 2,85-2,96 (1H, м), 5,82-6,05 (1H, ушир.), 6,10-6,28 (1H, ушир.)
Ссылочный пример 68
Цис-N-трет-бутоксикарбонил-2- гидроксиметилциклогексилметиламин
Применяя способы, аналогичные ссылочному примеру 64, используя 2,0 г цис-2- карбамоилциклогексанкарбоновой кислоты, 29,0 мл раствора литийалюмогидрида в тетрагидрофуране (1,0 М раствор) и 3,2 мл ди- трет-бутилдикарбоната, получили 0,73 г желаемого соединения в виде бледного розового масла.
Спектр ЯМР (CDCl3) δ ppm: 1,20-1,95 (10H, м), 1,44 (9H, с), 2,30-2,55 (1H, ушир. ), 2,90-3,08 (1H, м), 3,10-3,25 (2H, м), 3,50- 3,80 (2H, м), 4,80-5,00 (1H, ушир.)
Ссылочный пример 69
Цис-N-трет-бутоксикарбонил-2- нитроксиметилциклогексилметиламин
Применяя способы, аналогичные ссылочному примеру 3, используя 2,49 г цис-N-трет- бутоксикарбонил-2-гидроксиметилциклогексилметиламина и 2,0 г бортетрафторида нитрония, получали 1,79 г желаемого соединения в виде желтого масла.
Спектр ЯМР (CDCl3) δ ppm: 1,20-2,20 (10H, м), 1,44 (9H, с), 3,00-3,20 (2H, м), 4,35-4,65 (3H, м)
Ссылочный пример 70
Гидрохлорид цис-2- нитроксиметилциклогексилметиламина
Применяя способы, аналогичные ссылочному примеру 4, используя 1,79 г цис-N-трет-бутоксикарбонил- 2-нитрокси-метилциклогексилметиламина и 10,0 мл раствора 4 н. соляной кислоты-диоксина, получили 1,15 г желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 158-160oC (разложение)
Спектр ЯМР (CDCl3) δ ppm: 1,30-2,30 (10H, м), 2,90-3,10 (2H, м), 4,35-4,60 (2H, м), 8,00-8,50 (3H, ушир.)
Ссылочный пример 71
Диметил 1,3-циклогександикарбоксилат
К раствору диазометана-эфира, полученного согласно методу Arndt'a (Arndt; Synth. Collect Vol. 11, 165) из 40 г N- метилнитрозомочевины добавляли 11,0 г 1,3-циклогександикарбоновой кислоты и смесь перемешивали при комнатной температуре в течение 30 минут. После завершения реакции растворитель отгоняли при пониженном давлении, а остаток растворяли в диэтилацетате и промывали водным раствором бикарбоната натрия и водным раствором хлорида натрия. После высушивания остатка над безводным сульфатом магния, растворитель отгоняли при пониженном давлении с получением 8,33 г желаемого соединения в виде бледно-желтого масла.
Спектр ЯМР (CDCl3) δ ppm: 1,20-2,40 (9,3H, м), 2,62-2,75 (0,7H, м), 3,67 (6H, м)
Ссылочный пример 72
Монометил 1,3-циклогександикарбоксилата
В 85 мл метанола растворили 8,33 г диметил 1,3- циклогександикарбоксилата и к нему добавили 41,6 мл 1 н. водного раствора гидроксида натрия, смесь перемешивали при комнатной температуре в течение 4 часов. Растворитель отгоняли при пониженном давлении и водный раствор промывали этилацетатом. pH раствора подводили до 1 разбавленной соляной кислотой при охлаждении и экстрагировали этилацетатом. Экстракты промывали водным раствором хлорида натрия и высушивали над безводным сульфатом магния, а растворитель отгоняли при пониженном давлении с получением 6,7 г желаемого соединения в виде бесцветного масла.
Спектр ЯМР (CDCl3) δ ppm: 1,20-2,45 (9,3H, м), 2,65-2,80 (0,7H, м), 3,68 (3H, с)
Ссылочный пример 73
3-Карбамоилциклогексанкарбоновая кислота
В 70 мл водного раствора концентрированного аммиака растворяли 6,7 г монометил 1,3-циклогександикарбоксилата, полученную смесь оставляли выдерживаться при комнатной температуре в течение 17 дней. Концентрированной соляной кислотой при охлаждении подводили pH смеси до 1 и смесь экстрагировали этилацетатом. Экстракты промывали водным раствором хлорида натрия и высушивали над безводным раствором сульфата магния, а растворитель отгоняли при пониженном давлении с получением 2,64 г желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 102-128oC
Спектр ЯМР (d6-ДМСО) δ ppm: 1,00-2,70 (10H, м), 6,69 (1H, с), 7,20 (1H, с)
Ссылочный пример 74
3-N-трет-Бутоксикарбониламинометил-1-гидроксиметилциклогексан
Применяя способы, аналогичные ссылочному примеру 8, используя 3,60 г 3-карбамоилциклогексанкарбоновой кислоты и 53,0 г 1 М раствора литийалюмогидрида в тетрагидрофуране и 4,8 мл ди- трет-бутилдикарбоната, получали 1,52 г желаемого соединения в виде бесцветного масла.
Спектр ЯМР (CDCl3) δ ppm: 0,50-1,95 (10H, м), 1,44 (9H, с), 2,88-3,20 (2H, м), 3,40-3,60 (3H, м), 4,60 (1H, ушир.)
Ссылочный пример 75
N-трет-Бутоксикарбонил-3- нитроксиметилциклогексилметиламин
Применяя способы, аналогичные ссылочному примеру 3, используя 1,50 г 3-N-трет- бутоксикарбониламинометил-1-гидроксиметилциклогексана и 1,15 г бортетрафторида нитрония, получали 1,22 г желаемого соединения в виде бледно-желтого масла.
Спектр ЯМР (CDCl3) δ ppm: 0,60-1,90 (10H, м), 1,44 (9H, с), 2,90-3,13 (2H, м), 4,27 (1,5H, д, J=5,9 Гц), 4,35 (0,5H, д, J=6,6 Гц), 4,58 (1H, ушир. )
Ссылочный пример 76
Гидрохлорид 3-нитроксиметилциклогексилметиламина
Применяя способы, аналогичные ссылочному примеру 4, используя 1,22 г N-трет-бутоксикарбонил-3- нитроксиметилциклогексиламина и 13,0 мл раствора 4 н. соляной кислоты-диоксана, получили 0,40 г желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 109-111oC (разложение)
Спектр ЯМР (d6-ДМСО) δ ppm: 0,60-2,15 (10H, м), 2,55-2,80 (2H, м), 4,26-4,45 (2H, м), 7,80- 8,30 (3H, ушир.)
Ссылочный пример 77
N-трет-Бутоксикарбонил-2-гидроксиметилциклопентиламин
В 60 мл метанола растворяли 3,18 г 2-гидроксиметил-циклопентиламина и к нему добавляли 9,72 мл ди-трет- бутилдикарбоната, полученную смесь перемешивали при комнатной температуре в течение 1,5 часа и далее оставляли на ночь при комнатной температуре. Растворитель отгоняли при пониженном давлении и остаток очищали путем хроматографии на колонке с силикагелем, используя в качестве элюирующего растворителя циклогексан-этилацетат (4:1) с получением 0,88 г желаемого соединения, изомер A (соединение, которое имеет низкую полярность) в виде бесцветного кристаллического продукта, и 0,43 г желаемого соединения, изомер B (соединение, которое имеет высокую полярность) в виде бесцветного кристаллического продукта.
Изомер A
Тонкослойная хроматография: Rf = 0,47 (растворитель для разгонки: циклогексан/этилацетат = 2/1)
Т.пл.: 107-108oC
Спектр ЯМР (CDCl3) δ ppm: 1,00-1,75 (6H, м), 1,46 (9H, с), 1,90-2,20 (2H, м), 3,22-3,48 (1H, м), 3,59 (2H, дд, J=4,0 Гц, J=11,9 Гц), 4,05-4,20 (1H, м), 4,49 (1H, д, J=7,9 Гц)
Изомер B
Тонкослойная хроматография: Rf = 0,38 (растворитель для разгонки: циклогексан/этилацетат = 2/1)
Т.пл.: 65-67oC
Спектр ЯМР (CDCl3) δ ppm: 1,20-1,50 (3H, м), 1,45 (9H, с), 1,53-2,10 (5H, м), 3,40-3,77 (3H, м), 4,55-4,75 (1H, ушир.)
Ссылочный пример 78
N-трет-Бутоксикарбонил-2- нитроксиметилциклопентиламин
Применяя способы, аналогичные ссылочному примеру 3, используя 1,43 г изомера A, полученного по ссылочному примеру 77, и 1,76 г бортетрафторида нитрония, получали 0,94 г желаемого соединения в виде желтого масла.
Спектр ЯМР (CDCl3) δ ppm: 1,30-2,10 (6H, м), 1,45 (9H, с), 2,20-2,48 (1H, м), 4,00-4,20 (1H, м), 4,32 (2H, дд, J=6,6 Гц, J=10,6 Гц), 4,30-4,50 (1H, м), 4,61 (2H, дд, J=5,9 Гц, J=10,6 Гц)
Ссылочный пример 79
Гидрохлорид 2-нитроксиметилциклопентиламина
Применяя способы, аналогичные ссылочному примеру 4, используя 0,94 г соединения, полученного по ссылочному примеру 78, и 9,5 мл раствора 4 н. соляной кислоты- диоксана, получили 0,53 г желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 133-135oC (разложение)
Спектр ЯМР (CDCl3) δ ppm: 1,50-1,85 (5H, м), 1,90- 2,02 (1H, м), 2,35-2,45 (1H, м), 3,50-3,60 (1H, м), 4,57 (2H, д, J=7,8 Гц), 8,10-8,40 (1H, ушир.)
Ссылочный пример 80
Т-трет-Бутоксикарбонил-2- нитроксиметилциклопентиламин
Применяя способы, аналогичные ссылочному примеру 3, используя 1,16 г изомера B, полученного по ссылочному примеру 77, и 1,43 г бортетрафторида нитрония, получали 1,08 г желаемого соединения в виде желтого масла.
Спектр ЯМР (CDCl3) δ ppm: 1,30-1,80 (4H, м), 1,45 (9H, с), 1,88-2,15 (3H, м), 3,60-3,80 (1H, м), 4,38 (2H, дд, J=7,3 Гц, J=10,6 Гц), 4,40-4,55 (1H, м), 4,63 (2H, дд, J=5,0 Гц, J=10,6 Гц)
Ссылочный пример 81
Гидрохлорид 2-нитроксиметилциклопентиламина
Применяя способы, аналогичные ссылочному примеру 4, используя 1,08 г соединения, полученного по ссылочному примеру 80, и 11,0 мл раствора 4 н. соляной кислоты- диоксана, получали 0,64 г желаемого соединения в виде бесцветного кристаллического продукта. Т.пл.: 128-132oC (разложение)
Спектр ЯМР (CDCl3) δ ppm: 1,35-2,05 (6H, м), 2,28-2,40 (1H, м), 3,25-3,45 (1H, м), 4,53 (1H, дд, J=6,9 Гц, J=10,3 Гц), 4,69 (1H, дд, J=5,9 Гц, J= 10,3 Гц), 8,15-8,50 (1H, ушир.)
Ссылочный пример 82
Транс-4-N-трет- бутоксикарбониламинометилциклогексилальдегид
К раствору 150 мл сухого дихлорметана и 3,64 мл диметилсульфоксида по каплям добавляли 3,58 мл оксалилхлорида при охлаждении на бане из сухого льда и ацетона, полученную смесь перемешивали при той же температуре в течение 45 минут. К реакционной смеси по каплям добавляли раствор 5,0 г транс-4-N-трет- бутоксикарбониламинометил-1-гидроксиметилциклогексана, растворенного в 25 мл сухого дихлорметана, смесь перемешивали при той же температуре в течение 2 часов. Баню из сухого льда и ацетона удаляли и температуру реакционной смеси постепенно возвращали к 0oC, к ней добавляли 50 мл водного раствора хлорида аммония. К реакционной смеси добавляли 200 мл этилацетата, смесь промывали водным раствором хлорида натрия, 10%-ным водным раствором соляной кислоты, водным раствором бикарбоната натрия и водным раствором хлорида натрия и высушивали над безводным сульфатом магния, а растворитель отгоняли при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем, используя в качестве растворителя циклогексан-этилацетат (5: 1-2: 1) с получением 4,29 г желаемого соединения в виде бесцветного кристаллического продукта.
Т.пл.: 64-66oC
Спектр ЯМР (CDCl3) δ ppm: 0,90-1,10 (2H, м), 1,16-1,55 (3H, м), 1,45 (9H, с), 1,80-2,10 (4H, м), 2,10-2,25 (1H, м), 3,00 (2H, т, J=6,4 Гц), 4,50-4,70 (1H, ушир.), 9,62 (1H, д, J=1,2 Гц)
Ссылочный пример 83
4-(4-N-трет- Бутоксикарбониламинометилциклогексил)-3-бутен-1-ол
В 20 мл сухого диоксана суспендировали 500 мг транс-4-N-трет- бутоксикарбониламинометилциклогексилальдегида и 995 мг (3- гидроксипропил)трифенилфосфоний бромида, и к ним добавили 0,37 мл 1,8-диазобицикло[5,4,0]ундек-7-ена, и смесь нагревали с обратным холодильником в течение 2 дней. Затем к реакционной смеси добавляли 20 мл сухого ацетонитрила и смесь нагревали с обратным холодильником в течение 3 дней. Затем к ней добавляли 995 мг (3- гидроксипропил)трифенилфосфоний бромида и 0,37 мл 1,8- диазобицикло[5,4,0]ундек-7-ена и смесь нагревали с обратным холодильником в течение 2 дней. Кроме того, к ней добавляли 995 мг (3-гидроксипропил)трифенилфосфоний бромида и 0,37 мл 1,8- диазобицикло[5,4,0]ундек-7-ена и смесь нагревали с обратным холодильником в течение 5 дней. Растворитель отгоняли при пониженном давлении, а остаток очищали путем хроматографии на колонке с силикагелем, используя в качестве растворителя циклогексан-этилацетат (4:1) с получением 252 мг желаемого соединения в виде желтого масла.
Спектр ЯМР (CDCl3) δ ppm: 0,85-2,60 (13H, м), 1,44 (9H, с), 2,97 (1,2H, т, J= 6,4 Гц), 3,06 (0,8H, т, J=6,4 Гц), 3,56-3,70 (1,2H, м), 4,00- 4,10 (0,8H, м), 4,47-4,77 (1H, м), 5,20-5,50 (2H, м)
Ссылочный пример 84
4-(4-N-трет- Бутоксикарбониламинометилциклогексил)бутан-1-ол
К 20 мл этанола добавляли 313 мг 4-(4-N-трет- бутоксикарбониламинометилциклогексил)-3-бутен-1-ола и 100 мг 10% палладия на угле, и смесь перемешивали в атмосфере азота при 1 атм при 60oC в течение 4 часов. Нерастворимую часть фильтровали при использовании Целита, а растворитель из фильтрата отгоняли при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем, используя в качестве растворителя циклогексан-этилацетат (4:1) с получением 212 мг желаемого соединения в виде бесцветного масла.
Спектр ЯМР (CDCl3) δ ppm: 0,75-2,00 (17H, м), 1,44 (9H, с), 2,96 (1,4H, т, J= 6,4 Гц), 3,05 (0,7H, т, J=6,4 Гц), 3,64 (2H, т, J=6,6 гц), 4,50-4,70 (1H, м)
Ссылочный пример 85
N-трет-Бутоксикарбонил-4-(4-нитроксибутил) циклогексилметиламин
Применяя способы, аналогичные ссылочному примеру 3, используя 212 мг 4-(4-N-трет-бутоксикарбониламинометилциклогексил) бутан-1-ола и 145 мг бортетрафторида нитрония, получали 95,9 мг желаемого соединения в виде желтого масла.
Спектр ЯМР (CDCl3) δ ppm: 0,75-1,00 (4H, м), 1,05-2,00 (12H, м), 1,44 (9H, с), 2,96 (1,5H, т, J=6,4 Гц), 3,06 (0,5H, т, J=6,5 Гц), 4,44 (2H, т, J= 6,6 Гц), 4,46-4,65 (1H, м)
Ссылочный пример 86
Гидрохлорид 4-(4-нитроксибутил) циклогексилметиламина
Применяя способы, аналогичные ссылочному примеру 4, используя 95,9 мг N-трет-бутоксикарбонил-4-(4- нитроксибутил)циклогексилметиламина и 2,0 мл раствора 4 н. соляной кислоты-диоксана, получили 53,1 мг желаемого соединения в виде бесцветного кристаллического продукта.
Спектр ЯМР (CDCl3) δ ppm: 0,70-2,05 (16H, м), 2,70-3,00 (2H, м), 4,57 (2H, т, J=6,6 Гц), 8,15-8,50 (3H, ушир.)
Ссылочный пример 87
1-Бензил-2-N-трет- бутоксикарбониламинометил-5-гидроксиметилпиперидин
В 100 мл сухого тетрагидрофурана растворяли 3,06 г этил 1-бензил-2-циано-5- пиперидинкарбоксилата и к нему добавляли по каплям 56,2 мл 1 М раствора литийалюмогидрида в тетрагидрофуране при охлаждении на льду, смесь перемешивали при комнатной температуре в течение 20 минут и затем нагревали с обратным холодильником в течение 1,5 часа. Реакционную смесь добавляли по каплям к 300 мл ледяной воды и нерастворимую часть фильтровали чрез Целит. К фильтрату добавляли 3,1 мл ди-трет- бутилдикарбоната и каталитическое количество 4- диметиламинопиридина и смесь перемешивали при комнатной температуре в течение 1 часа и 55 минут. К реакционной смеси добавляли уксусную кислоту для подведения pH смеси до 7, затем к ней добавили 3,1 мл ди-трет-бутилдикарбоната и каталитическое количество 4-диметиламинопиридина, смесь перемешивали при комнатной температуре в течение 2,5 часов. Более того, к смеси добавляли 3,1 мл ди-трет-бутилдикарбоната и каталитическое количество 4-диметиламинопиридина и смесь перемешивали при комнатной температуре в течение 50 минут. Тетрагидрофуран отгоняли при пониженном давлении и остаток экстрагировали этилацетатом, а растворитель отгоняли при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем (элюирующий растворитель: циклогексан/этилацетат = 3/4-1/4) с получением 1,64 г изомера A (соединение, которое имеет низкую полярность) и 0,43 г изомера B (соединение, которое имеет высокую полярность) в виде желтого масла и в виде бледно-красного масла соответственно.
Изомер A
Тонкослойная хроматография: Rf = 0,56 (растворитель для разгонки: дихлорметан/метанол = 9/1)
Спектр ЯМР (CDCl3) δ ppm: 1,44 (9H, с), 1,50-2,00 (5H, м), 2,36-2,75 (3H, м), 3,25-3,40 (2H, м), 3,41 (1H, д, J=13,4 Гц), 3,59 (2H, Abq, J=13 Гц), 3,99 (1H, д, J=13,4 Гц), 4,80 (1H, ушир.), 7,20-7,40 (5H, м)
Изомер B
Тонкослойная хроматография: Rf = 0,48 (растворитель для разгонки: дихлорметан/метанол = 9/1)
Спектр ЯМР (CDCl3) δ ppm: 1,45 (9H, с), 1,50-1,85 (5H, м), 2,25-2,40 (1H, м), 2,94 (1H, д, J=9,3 Гц), 3,16 (1H, д, J= 13,6 Гц), 3,20-3,65 (5H, м), 4,03 (1H, д, J=13,6 Гц), 5,01 (1H, ушир.), 7,18-7,38 (5H, м)
Ссылочный пример 88
1-трет-Бутоксикарбонил-2-N-трет- бутоксикарбониламинометил-5-гидpoкcимeтилпипepидин
В 20 мл этанола растворяли 0,84 г соединения (изомер B) по ссылочному примеру 87 и к нему добавили 200 мг 10% палладия на угле, смесь перемешивали в струе водорода при комнатной температуре в течение 3 часов и 40 минут. Затем к смеси добавляли 200 мг 10% палладия на угле и перемешивали при комнатной температуре в струе водорода в течение 11 часов. К реакционной смеси добавляли 0,69 мл ди-трет- бутилдикарбоната и смесь оставляли стоять при комнатной температуре в течение 8 дней. Реакционную смесь фильтровали и фильтрат отгоняли при пониженном давлении. Остаток очищали путем хроматографии на колонке с силикагелем (элюирующий растворитель: циклогексан/этилацетат = 2/3-1/2) с получением 658 мг желаемого соединения в виде бесцветной пены.
Спектр ЯМР (CDCl3) δ ppm: 1,43 (9H, с), 1,48 (9H, с), 1,55-1,95 (5H, м), 2,90-3,22 (2H, м), 3,35-3,65 (3H, м), 3,98 (1H, д, J=14,6 Гц), 4,13-4,26 (1H, м), 4,75 (1H, ушир.)
Ссылочный пример 89
1-трет-Бутоксикарбонил-2-N-трет- бутоксикарбониламиноэтил-5-нитроксиметилпиперидин
Применяя способы, аналогичные ссылочному примеру 3, используя 658 мг 1-трет- бутоксикарбонил-2-N-трет-бутоксикарбониламинометил-5- гидроксиметилпиперидина и 273 мг бортетрафторида нитрония, получали 523 мг желаемого соединения в виде желтой пены.
Спектр ЯМР (CDCl3) δ ppm: 1,42 (9H, м), 1,45 (9H, м), 1,65-1,95 (4H, м), 2,05-2,18 (1H, м), 3,05-3,16 (2H, м), 3,48-3,63 (1H, м), 3,95 (1H, д, J=14,2 Гц), 4,20-4,40 (2H, м), 4,54 (1H, дд, J=8,6 Гц, J=10,8 Гц), 4,78 (1H, ушир.)
Ссылочный пример 90
Дигидрохлорид 5-нитроксиметил-2- пиперидилметиламина
Применяя способы, аналогичные ссылочному примеру 4, используя 523 мг 1-трет-бутоксикарбонил-2-N-трет- бутоксикарбониламинометил-5-нитроксиметилпиперидина и 20 мл раствора 4 н. соляной кислоты-диоксана, получили 351 мг желаемого соединения в виде бесцветной пены.
Спектр ЯМР (d6-ДМСО) δ ppm: 1,20-1,45 (1H, м), 1,58- 2,05 (4H, м), 2,20-2,40 (1H, м), 2,65-2,90 (1H, м), 2,95- 3,50 (4H, м), 4,48 (2H, д, J=5,8 Гц)
Пример исследования 1
Расслабляющее действие на коллатеральный сосуд при внутривенном введении
Собак породы бигль (самцы), весом от 9 до 13 кг, анестезировали при внутривенном введении пентобарбитала в дозе 30 мг/кг и проводили эксперимент при искусственном дыхании. Для измерения давления в левой сонной артерии ретроградно вводили полиэтиленовую канюлю (внутривенный катетер Atom 2F) в один из боковых сосудов левой щитовидной артерии. Кровоток в левой сонной артерии от данного места измерения давления пережимали на 1 минуту артериальным зажимом и измеряли давление (Р) и снижение периферического давления (ΔP) непосредственно перед окклюзией. В этот момент времени вводили исследуемый образец через другую полиэтиленовую канюлю, введенную в бедренную вену. Левую сонную артерию пережимали на 1 минуту на 5, 15, 30, 45 и 60 минуту, и на каждое время измеряли давление (P) и снижение периферического давления (ΔP) сразу же перед окклюзией. Расслабляющие действие на коллатеральный сосуд (коллатеральный индекс = CI (КИ)) исследуемого образца рассчитывали по следующей формуле:
CI = 100-(ΔP,/P,)×(100/(ΔP/P).
Результат настоящего исследования соединений по примерам 1, 4, 8 и 9 показал их прекрасное действие, CI60 (среднее значение CI от 0 минуты до 60 минуты) при дозе 0,1 мг/кг составляет более чем 15.
Пример исследования 2
Расслабляющее действие на коллатеральный сосуд при введении через воротную вену
Пока приготавливали образцы согласно описанному выше способу животных лапаротомизировали вдоль средней линии брюшины, выводили часть брызжеечной вены и рассекали так, чтобы вводить исследуемый образец в воротную вену. Для вживления в воротную вену, в брызжеечную вену антеретроградно вводили полиэтиленовую канюлю (внутривенный катетер Atom 2F) и тогда через нее вводили исследуемый образец. Для изучения первичного действия исследуемого образца его сначала вводили внутривенно (бедренная вена) и измеряли на 60 минуту его расслабляющее действие на коллатеральный сосуд. Затем через 2 или 3 часа тот же исследуемый образец вводили в воротную вену и измеряли на 60 минуту его расслабляющее действие на коллатеральный сосуд, эти воздействия сравнивали друг с другом.
В результате настоящего исследования соединение по примеру 1 показало отличное действие.
Пример приготовления 1
Капсула
Соединение по примеру 1 - 20,0 мг
Лактоза - 158,7
Кукурузный крахмал - 70,0
Стеарат магния - 1,3 - 250 мг
Составленный подобным образом порошок смешивается и пропускается через сито 60 меш, затем порошок капсулируется в желатиновую капсулу N 3 по 250 мг для получения капсулы.
Пример приготовления 2
Таблетка
Соединение по примеру 1 - 20,0 мг
Лактоза - 154,0
Кукурузный крахмал - 25,0
Стеарат магния - 1,0 - 200 мг
Составленный подобным образом порошок смешивается и при помощи таблетирующей машины приготавливается 200 мг таблетка.
Если необходимо, можно покрыть таблетку сахарным покрытием.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОПТИЧЕСКИ АКТИВНОЕ ПРОИЗВОДНОЕ ТИАЗОЛИДИНОНА, СПОСОБЫ ЕГО ПОЛУЧЕНИЯ, КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ СТЕНОКАРДИИ, СПОСОБ РАСШИРЕНИЯ КОЛЛАТЕРАЛЬНЫХ СОСУДОВ ПРИ ЛЕЧЕНИИ ИЛИ ПРОФИЛАКТИКИ СТЕНОКАРДИИ, СПОСОБ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ ЯЗВЕННОЙ БОЛЕЗНИ | 1996 |
|
RU2141956C1 |
| ПРОИЗВОДНЫЕ АМИДОКАРБОНОВОЙ КИСЛОТЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ СНИЖЕНИЯ ГЛЮКОЗЫ В КРОВИ | 1998 |
|
RU2176999C2 |
| ПРОИЗВОДНЫЕ ФЕНИЛАЛКИЛКАРБОНОВОЙ КИСЛОТЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1997 |
|
RU2169141C2 |
| ПРОИЗВОДНЫЕ 1-БИФЕНИЛМЕТИЛИМИДАЗОЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ГИПЕРТЕНЗИИ | 1992 |
|
RU2128173C1 |
| ЦИКЛОАЛКИЛ-ЗАМЕЩЕННОЕ ПРОИЗВОДНОЕ ИМИДАЗОЛА, ОБЛАДАЮЩЕЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ TAFIa | 2011 |
|
RU2572814C2 |
| ПРОИЗВОДНЫЕ 1-МЕТИЛКАРБАПЕНЕМА | 2001 |
|
RU2247725C2 |
| ПРОИЗВОДНЫЕ НИТРОКСИАЛКИЛАМИДА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1994 |
|
RU2098406C1 |
| ПРОИЗВОДНОЕ АМИНОКИСЛОТЫ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1992 |
|
RU2104265C1 |
| ТРИАЗОЛОВЫЕ СОЕДИНЕНИЯ ИЛИ ИХ ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И ПРОТИВОГРИБКОВАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2146250C1 |
| 5-ГИДРОКСИ-4-(ТРИФТОРМЕТИЛ)ПИРАЗОЛОПИРИДИНОВОЕ ПРОИЗВОДНОЕ | 2014 |
|
RU2673810C1 |










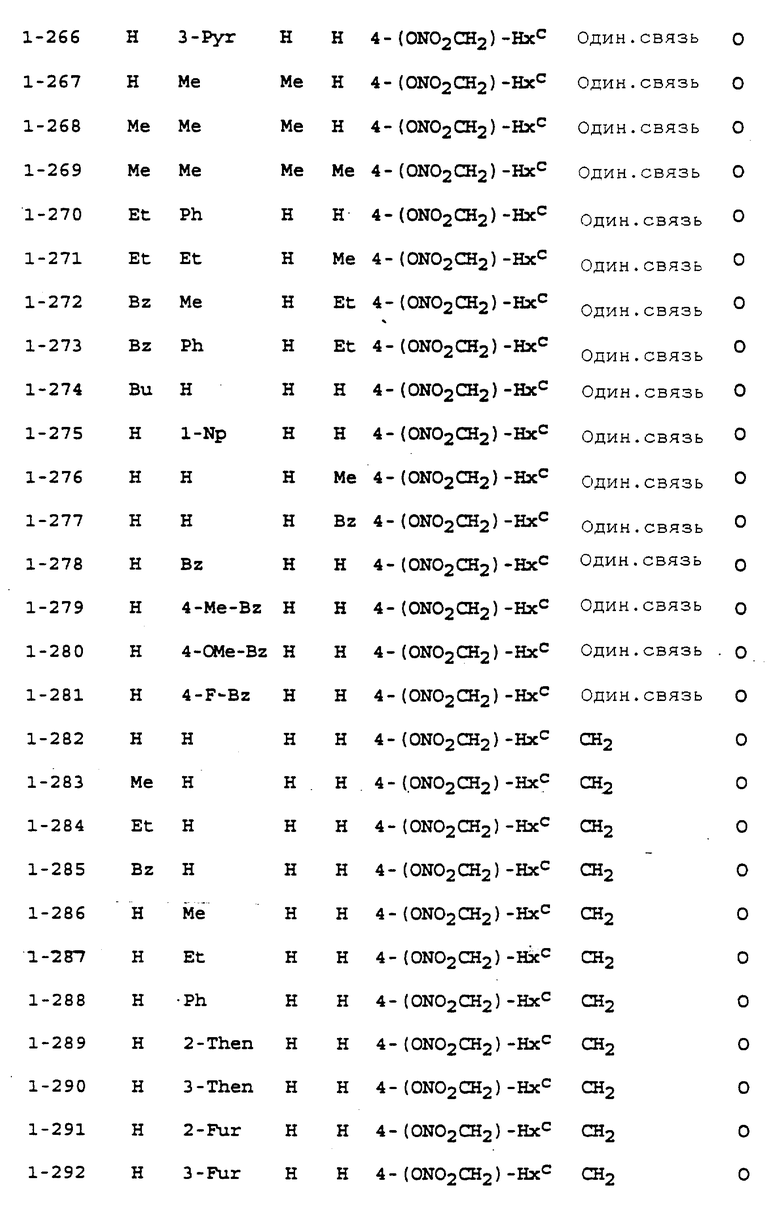





























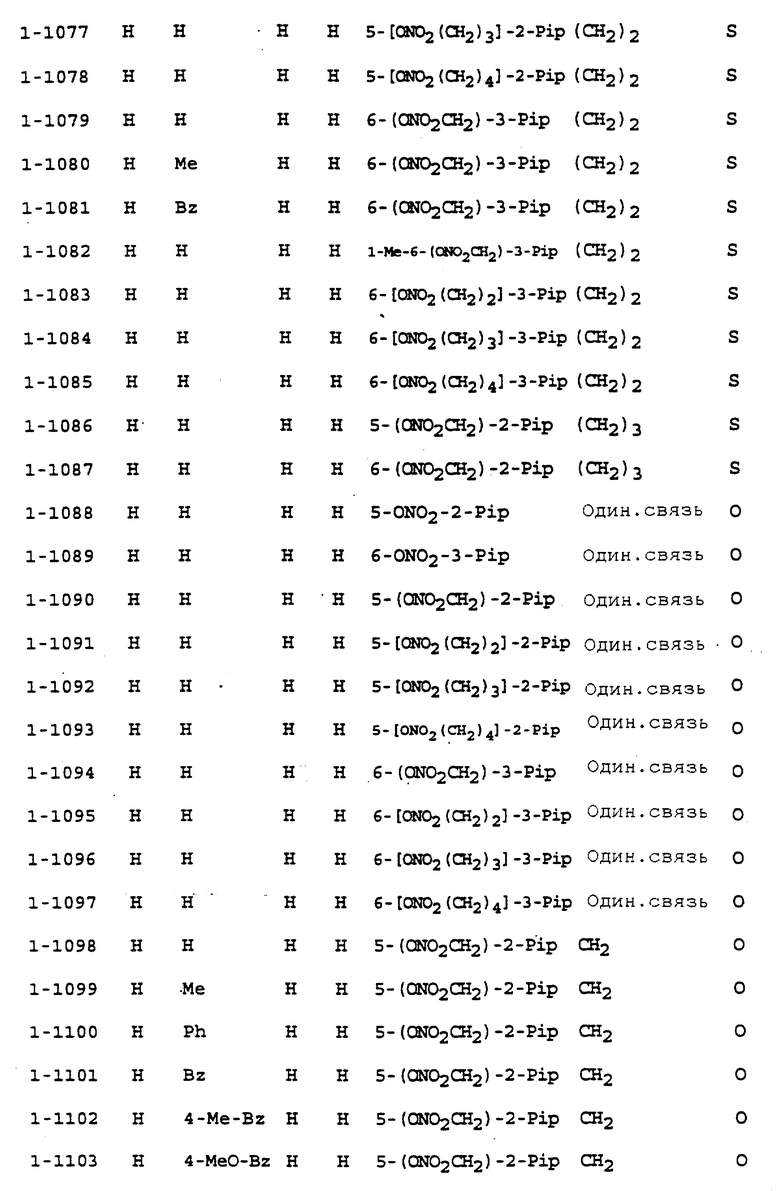
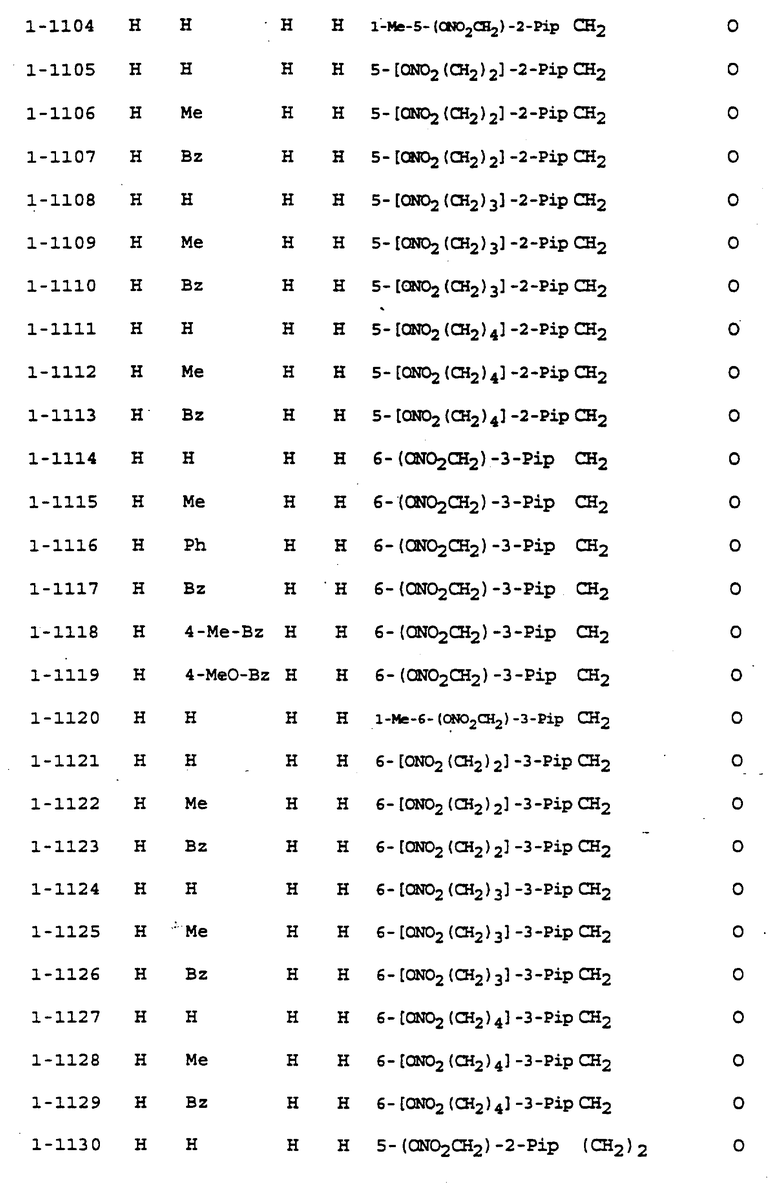










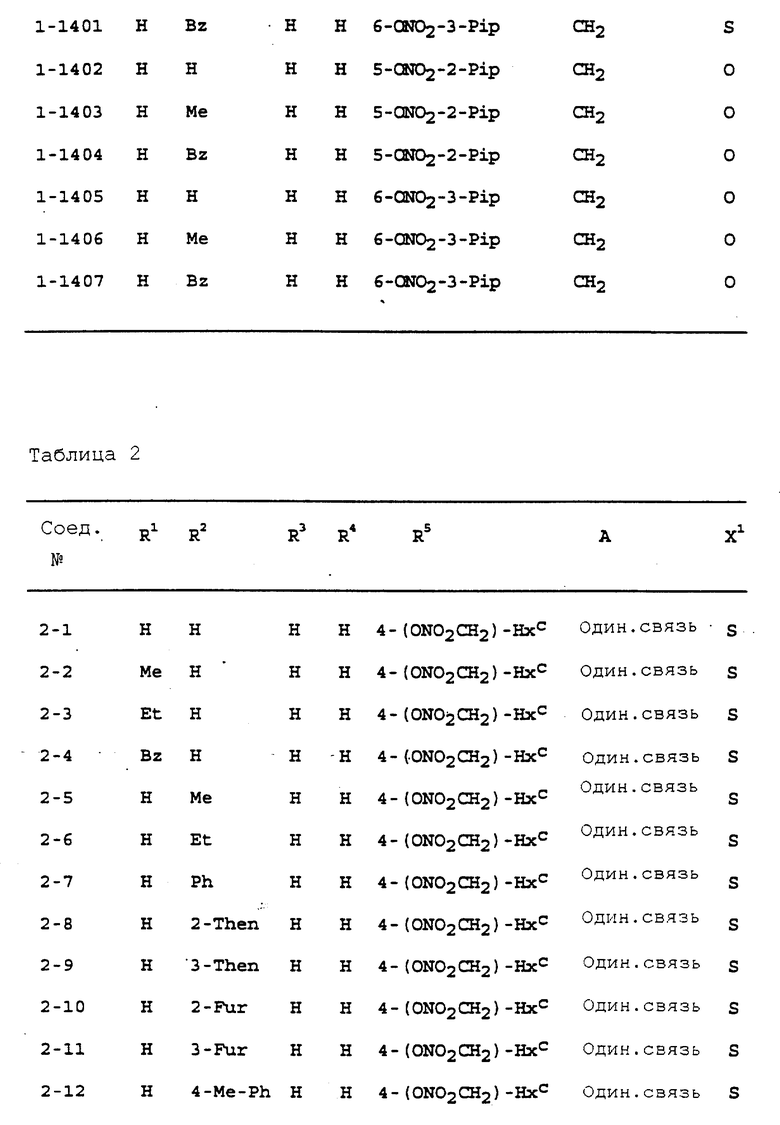









































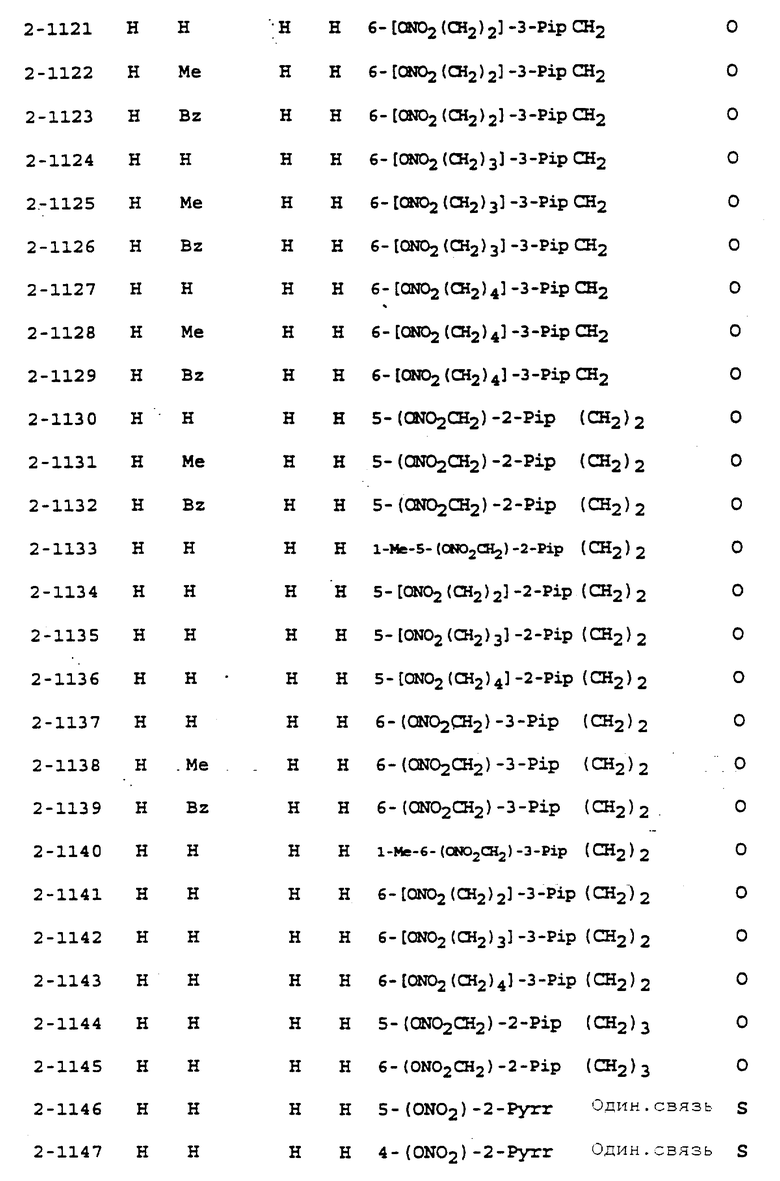

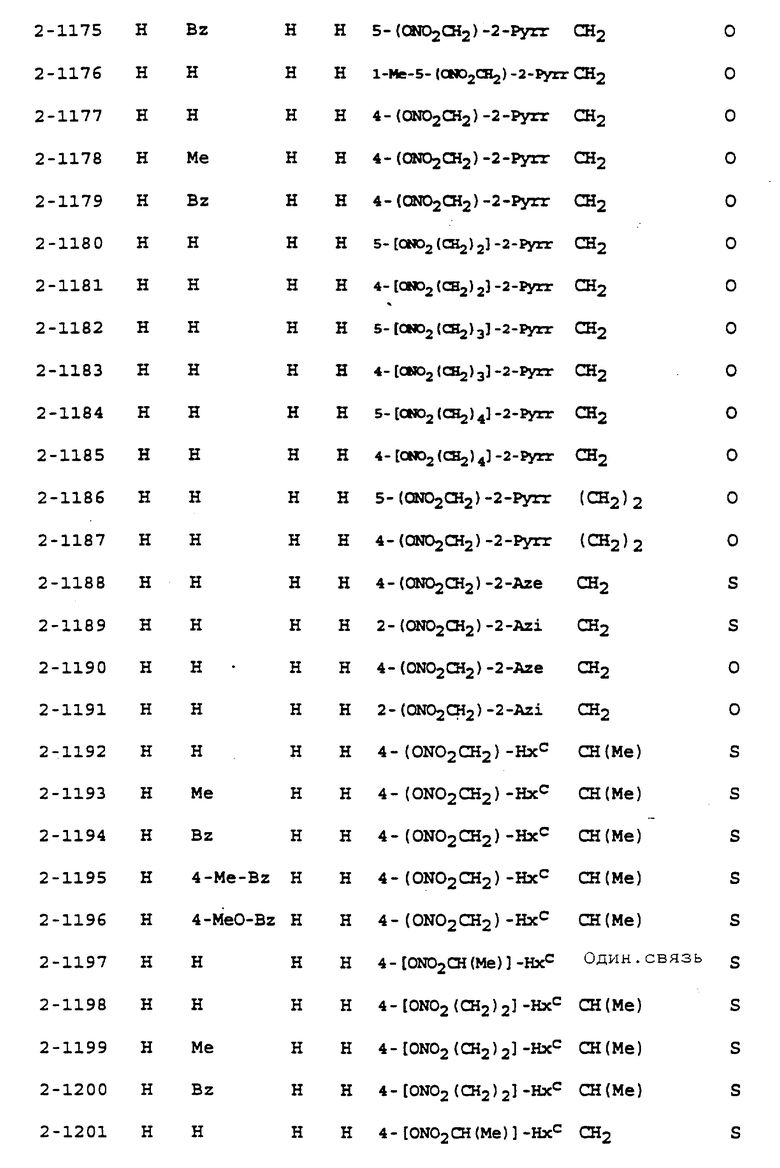



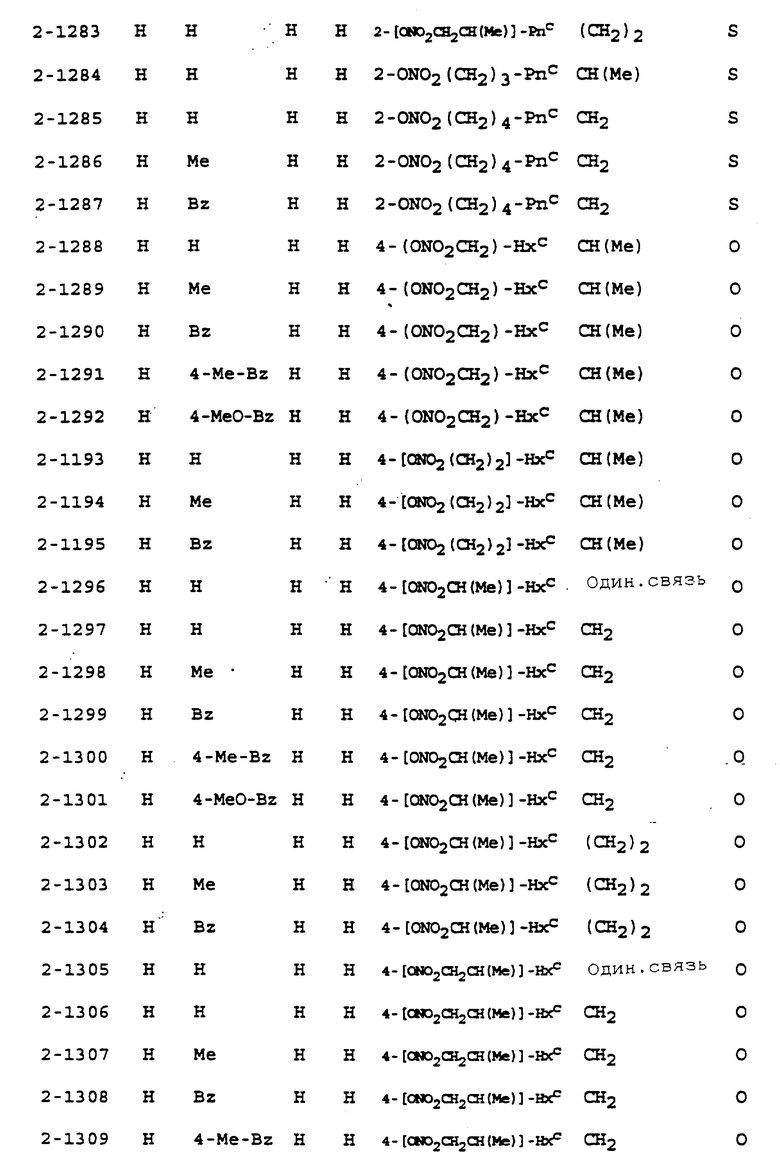
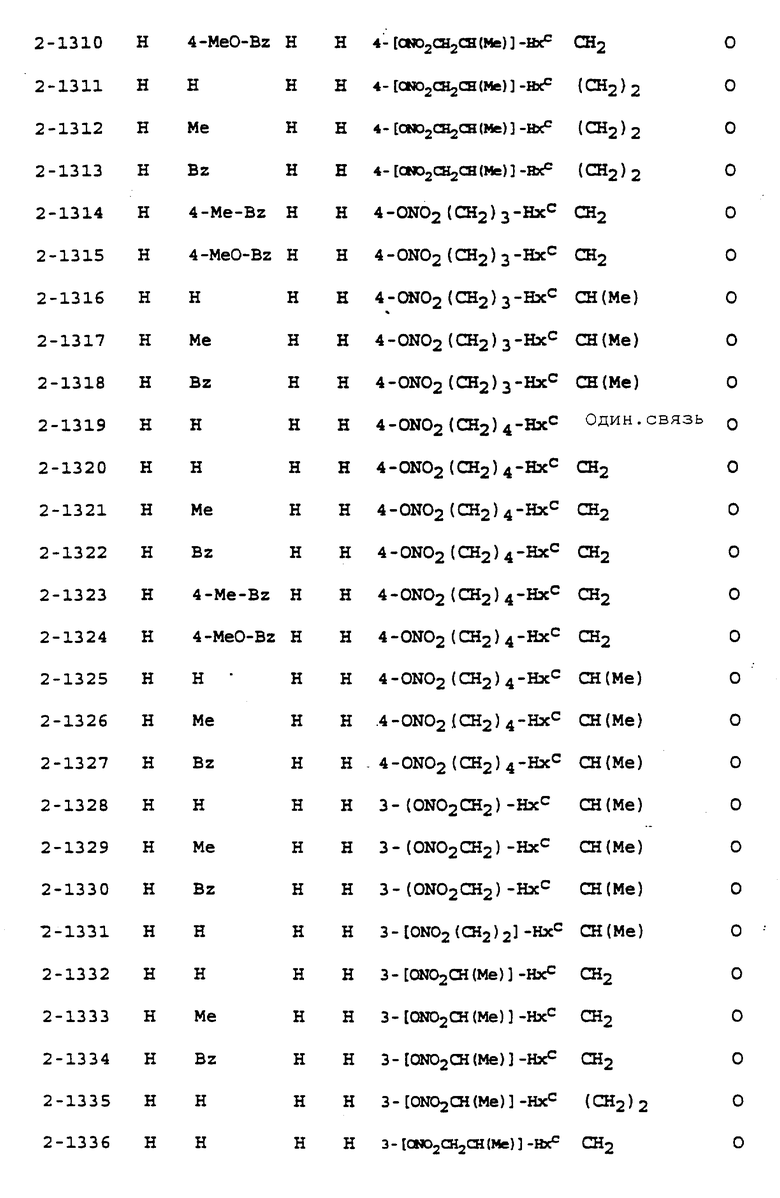



Предложены производные тиазолидинона, имеющие общую формулу I, где W представляет атом серы и Х представляет группу, имеющую формулу -N(R1)-; R1, R2, R3 и R4 представляют, каждый, атом водорода; R5 представляет замещенную циклоалкильную группу, имеющую 3-8 атомов углерода, необязательно содержащую кольцевой атом азота, замещенную группой, имеющей формулу -B-ONO2, и, кроме того, необязательно замещенную алкильной группой, имеющей от 1 до 6 атомов углерода, где B представляет одинарную связь или алкиленовую группу, имеющую от 1 до 6 атомов углерода; А представляет одинарную связь или алкиленовую группу, имеющую от 1 до 6 атомов углерода или их фармакологически приемлемые соли. Предложен также способ получения производных тиазолидинона общей формулы I взаимодействием соединения формулы II с соединением формулы III. Фармацевтическая композиция для лечения или профилактики стенокардии. Производные тиазолидинона обладают сосудорасширяющим действием на коллатеральные сосуды, не подверженные первой проходной фазе, и дают меньше побочных эффектов. 3 с. и 19 з.п.ф-лы, 1 табл.
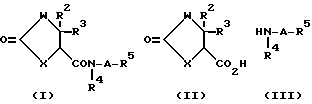
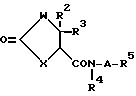
где W представляет собой атом серы и Х представляет группу, имеющую формулу -N(R1)-;
R1 представляет собой атом водорода;
R2 и R3, каждый, представляют собой атом водорода;
R4 представляет собой атом водорода;
R5 представляет собой циклоалкильную группу, имеющую от 3 до 8 атомов углерода, необязательно содержащую кольцевой атом азота, замещенную группой, имеющей формулу -B-ОNO2, и, кроме того, необязательно замещенную алкильной группой, имеющей от 1 до 6 атомов углерода, где В обозначает одинарную связь или алкиленовую группу, имеющую от 1 до 6 атомов углерода;
A обозначает одинарную связь или алкиленовую группу, имеющую от 1 до 6 атомов углерода,
и его фармакологически приемлемые соли.
N-(4-нитроксиметилциклогексилметил)-2-оксотиазолидин-4-илкарбоксамида,
N-[2-(4-нитроксиметилциклогексил)этил] -2-оксотиазолидин-4-илкарбоксамида,
N-[4-(2-нитроксиэтил)циклогексилметил] -2-оксотиазолидин-4-илкарбоксамида,
N-[2-[4-(3-нитроксипропил)циклогексил]этил]-2-оксотиазолидин -4-илкарбоксамида,
N-[4-(3-нитроксипропил)циклогексилметил] -2-оксотиазолидин -4-илкарбоксамид и
N-[4-(4-нитpoкcибутил)циклoгeкcилмeтил] -2-oкcoтиaзoлидин-4-илкарбоксамида, или его фармакологически приемлемая соль.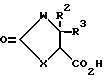
где W, X, R2 и R3 имеют те же значения, что указаны в любом из пп.1-19,
подвергают взаимодействию с соединением, имеющим общую формулу
или с его кислотно-аддитивной солью,
где A, R4 и R5 имеют те же значения, что указаны в любом из пп.1-19.
| Горизонтальная фильтрующая центрифуга | 1973 |
|
SU506434A1 |
| RU 2055073 C1, 27.02.96 | |||
| Машковский М.Д | |||
| Лекарственные средства | |||
| -М.: Медицина, 1985, ч.1, с.412-413. | |||
Авторы
Даты
1999-10-10—Публикация
1995-12-13—Подача