Настоящее изобретение относится к оптически активным производным тиазолидинона, которые оказывают прекрасное расширяющее действие на коллатеральные сосуды и эффективны против стенокардии, к композиции для профилактики или лечения стенокардии, содержащей их в качестве активного ингредиента, применению этих соединений при получении фармацевтического препарата для профилактики или лечения стенокардии, к способу профилактики или лечения стенокардии, который включает назначение их фармакологически эффективного количества млекопитающим, или к способу их получения; или к композиции для профилактики или лечения язвенной болезни, которая содержит в качестве активного ингредиента производные тиа- или оксазолидинонов, их применению при изготовлении фармацевтического препарата для профилактики или лечения язвенной болезни или к способу профилактики или лечения язвенной болезни, который включает назначение фармакологически эффективного количества этих соединений млекопитающему.
Уровень техники
В настоящее время в качестве терапевтического средства при лечении сердечно-сосудистых заболеваний, в частности стенокардии, наиболее часто используется нитроглицерин. Однако нитроглицерин легко дает первоначальный проходящий эффект, и его недостатком является невысокая продолжительность действия. Кроме того, в качестве побочных эффектов проявляются головная боль, головокружение и тахикардия, обусловленные снижением кровяного давления. В связи с этим существует потребность в терапевтическом средстве для лечения стенокардии с продолжительным действием, которое клинически не дает первичного проходящего эффекта.
Заявители настоящего изобретения в качестве средства решения названной проблемы обнаружили соединение, имеющее скелет тиа- или оксазолидинона, например, соединение A следующей формулы: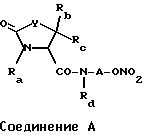
где заместители Ra, Rb, Rc и Rd представляют собой атом водорода и др., и
фрагмент A представляет собой C2-C6-алкиленовую группу,
фрагмент Y представляет собой атом кислорода или атом серы (см., например, японскую нерассмотренную публикацию патента (KOKAI) N Hei 5-213910). Однако о противоязвенном действии этих соединений известно не было.
Описание изобретения
Заявители настоящего изобретения провели дополнительные исследования и установили, что соединения, содержащие оптически активный тиазолидиноновый скелет, обладают прекрасным расширяющим действием на коллатеральные сосуды, которое отличается продолжительностью и сопровождается меньшими побочными эффектами, и эти соединения могут быть использованы в качестве профилактического средства или терапевтического средства при стенокардии (в особенности в качестве терапевтического средства при лечении стенокардии), и эти соединения обладают прекрасной стабильностью, позволяющей реализовать настоящее изобретение. Более того, заявители изучили фармакологическое действие соединений, содержащих тиа- или оксазолидиноновый скелет, и также установили, что эти соединения обладают прекрасным противоязвенным действием и что они могут быть использованы в качестве профилактического средства или терапевтического средства при лечении язвенной болезни (в особенности в качестве терапевтического средства при лечении язвенной болезни).
Настоящее изобретение предлагает оптически активные производные тиазолидинона, содержащую их композицию для профилактики или лечения стенокардии, применение этих соединений при производстве фармацевтического препарата для профилактики или лечения стенокардии, способ профилактики или лечения стенокардии, который включает введение фармакологически эффективного количества этих производных млекопитающему; или способ их получения; или композицию для профилактики или лечения язвенной болезни, которая содержит производные тиа- или оксазолидинона в качестве активного ингредиента, применение их при изготовлении фармацевтического препарата для профилактики или лечения язвенной болезни или способ профилактики или лечения язвенной болезни, который включает введение их фармацевтически эффективного количества млекопитающему.
Сущность изобретения
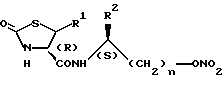
Оптически активные производные тиазолидинона настоящего изобретения имеют общую формулу: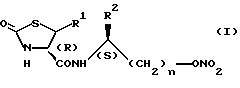
В приведенной выше формуле:
заместитель R1 представляет собой атом водорода,
заместитель R2 представляет собой (C1-C6)- алкильную группу; и
n равно 1.
(C1-C6)-Алкильная группа заместителя R2 может представлять собой, например, метил, этил, пропил, изопропил, бутил, втор-бутил, изобутил, трет-бутил, пентил или гексил, предпочтительно (C1-C4)-алкильную группу, более предпочтительно метильную, этильную, пропильную, изопропильную, бутильную или изобутильную группы, еще более предпочтительно, метильную, пропильную, бутильную или изобутильную группу, и особенно предпочтительно метильную группу.
Настоящее изобретение включает также гидраты соединения (I), и, кроме того, включает рацемическую смесь и оптически активное вещество.
Соединение формулы (I) обладает прекрасной противоязвенной активностью.
Соединение, имеющее общую формулу (I), может включать, предпочтительно:
1) соединение, в котором заместитель R2 представляет собой (C1-C4)-алкильную группу;
2) соединение, в котором заместитель R2 представляет собой метильную, этильную, пропильную, изопропильную, бутильную или изобутильную группу;
3) соединение, в котором заместитель R2 представляет собой метильную, пропильную, бутильную или изобутильную группу;
4) соединение, в котором заместитель R2 представляет собой метильную группу.
Кроме того, для соединения является предпочтительным следующее сочетание заместителей R1 и R2:
1) соединение, в котором заместитель R1 представляет собой атом водорода,
R2 представляет собой (C1-C4)-алкильную группу, и n принимает значение 1;
2) соединение, в котором заместитель R1 представляет собой атом водорода,
заместитель R2 представляет собой метильную группу, этильную группу, пропильную группу, изопропильную группу, бутильную группу или изобутильную группу, и
n принимает значение 1;
3) соединение, в котором заместитель R1 представляет собой атом водорода,
заместитель R2 представляет собой метильную, пропильную, бутильную или изобутильную группу;
n принимает значение 1; и
4) соединение, в котором заместитель R1 представляет собой атом водорода,
заместитель R2 представляет собой метильную группу.
Соединение настоящего изобретения, имеющее общую формулу (I), может быть легко получено в соответствии со следующими способами.
В приведенных выше формулах заместители R1, R2 и n принимают значения, определенные выше, заместитель R7 представляет собой защитную группу для меркапто-группы и заместитель
R8 представляет собой защитную группу для амино-группы.
Защитная группа меркапто-группы не имеет особенных ограничений, поскольку такие группы хорошо известны в данной области органического синтеза. Предпочтительно она представляет собой тризамещенную силильную группу, имеющую заместитель, выбираемый из группы, включающей (C1-C4)-алкильную группу, фенильную группу и фенильную группу, замещенную (C1-C4)-алкилом, (C1-C4)-алкокси-группой или атомом галогена, бензильную группу, бензильную группу, замещенную (C1-C4)-алкилом, (C1-C4)-алкокси-группой или атомом галогена, бензилоксикарбонильную группу, бензилоксикарбонильную группу, замещенную (C1-C4)-алкилом, (C1-C4)-алкокси-группой или атомом галогена, трет-бутильную группу или трет-бутоксикарбонильную группу, более предпочтительно триметилсилильную, триэтилсилильную, трет-бутилдиметилсилильную группу, фенилдиметилсилильную группу, метоксибензильную группу, диметоксибензильную группу, метоксибензилоксикарбонильную группу, диметоксибензилоксикарбонильную группу или трет-бутоксикарбонильную группу, и еще более предпочтительно трет-бутилдиметилсилильную группу, 4-метоксибензильную группу, 4-метоксибензилоксикарбонильную группу или трет-бутоксикарбонильную группу, и особенно предпочтительно трет-бутоксикарбонильную группу.
Защитная группа амино-группы также не имеет особенных ограничений, поскольку такие группы хорошо известны в данной области органического синтеза. Предпочтительно, она представляет собой тризамещенную силильную группу, имеющую заместитель, выбираемый из группы, включающей (C1-C4)-алкильную группу, фенильную группу и фенильную группу, замещенную (C1-C4)-алкилом, (C1-C4)-алкокси-группой или атомом галогена, бензильную группу, бензильную группу, замещенную (C1-C4)-алкилом, (C1-C4)-алкокси-группой или атомом галогена, бензилоксикарбонильную группу, бензилоксикарбонильную группу, замещенную (C1-C4)-алкилом, (C1-C4)-алкокси-группой или атомом галогена, трет-бутильную группу или трет-бутоксикарбонильную группу, более предпочтительно триметилсилильную, триэтилсилильную, трет-бутилдиметилсилильную группу, фенилдиметилсилильную группу, метоксибензильную группу, диметоксибензильную группу, метоксибензилоксикарбонильную группу, диметоксибензилоксикарбонильную группу или трет-бутоксикарбонильную группу, и еще более предпочтительно трет-бутилдиметилсилильную группу, 4-метоксибензильную группу, 4-метоксибензилоксикарбонильную группу или трет-бутоксикарбонильную группу, и особенно предпочтительно трет-бутоксикарбонильную группу.
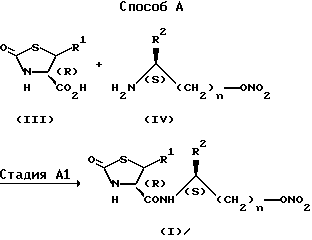
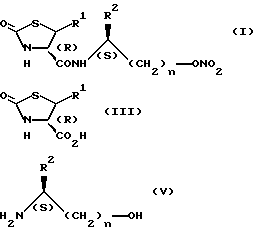
Способ A представляет собой способ получения соединения (I).
Стадия A1 используется для получения соединения, имеющего общую формулу (I), и может быть осуществлена при взаимодействии соединения, имеющего формулу (III), или его реакционноспособного производного (галогенангидрида кислоты, смешанного ангидрида кислоты или активированного сложного эфира) с соединением, имеющим общую формулу (IV), или его кислотно-аддитивной солью (например, солями минеральных кислот, такими как гидрохлориды, нитраты или сульфаты) в инертном растворителе, и может быть проведена, например, галогенангидридным способом, способом смешанного ангидрида, способом активированного сложного эфира или способом конденсации.
Галогенангидридный способ проводят при взаимодействии соединения (III) с галогенирующим агентом (например, с тионилхлоридом, оксалилхлоридом, пентахлоридом фосфора и др.) в инертном растворителе с получением галогенангидрида кислоты, и при взаимодействии полученного галогенангидрида кислоты с соединением формулы (IV) или его кислотно-аддитивной солью в инертном растворителе в присутствии или в отсутствии основания.
В качестве основания можно использовать, например, органические амины, такие как триэтиламин, N-метилморфолин, пиридин или 4-диметиламинопиридин; гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия и гидрокарбонат калия; и карбонаты щелочных металлов, такие как карбонат натрия и карбонат калия; предпочтительно использовать органические амины.
Инертный растворитель, используемый в данном случае, не имеет особенных ограничений, поскольку не влияет на протекание реакции, и он может представлять собой, например, углеводороды, такие как гексан, циклогексан, бензол, толуол и ксилол; галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и четыреххлористый углерод; простые эфиры, такие как эфир, тетрагидрофуран и диоксан; кетоны, такие как ацетон; амиды, такие как N,N-диметилформамид, N, N-диметилацетамид, N-метил-2-пирролидон и гексаметилфосфорамид; и сульфоксиды, такие как диметилсульфоксид; предпочтительны углеводороды, галогенированные углеводороды, простые эфиры или амиды.
Температура реакции меняется в зависимости от исходных соединений (III) и (IV), типа растворителя и т.д., и температура реакции при взаимодействии галогенирующего агента с соединением (III), так и при взаимодействии галогенангидрида с соединением (IV), обычно составляет от -20 до 150oC. Предпочтительно, при проведении первой реакции температура составляет от -10 до 50oC, и в случае последней реакции - от 0 до 100oC. Время реакции меняется в зависимости от температуры реакции и обычно для обеих реакций составляет от 15 минут до 24 часов (предпочтительно от 30 минут до 16 часов).
Способ смешанного ангидрида кислоты проводят путем взаимодействия (C1-C4)-алкилгалогенкарбоната, ди-(C1-C6)-алкилцианофосфорной кислоты или ди-(C6-C10)-арилфосфорилазида с соединением (III) с получением смешанного ангидрида и взаимодействия полученного смешанного ангидрида кислоты с соединением (IV) или его кислотно-аддитивной солью.
Смешанный ангидрид кислоты получают реакцией (C1-C6)-алкилгалогенкарбоната, такого как метилхлоркарбонат, этилхлоркарбонат, изобутилхлоркарбонат и гексилхлоркарбонат (предпочтительно этилхлоркарбонат или изобутилхлоркарбонат), ди-(C1-C6)-алкилцианофосфорной кислоты, такой как диметилцианофосфорная кислота, диэтилцианофосфорная кислота и дигексилцианофосфорная кислота (предпочтительно диэтилцианофосфорная кислота), или ди-(C6-C10)-арилфосфорилазида, такого как дифенилфосфорилазид, ди-(п-нитрофенил)фосфорилазид и ди-нафтилфосфорилазид (предпочтительно дифенилфосфорилазид) с соединением (III), предпочтительно в инертном растворителе в присутствии основания.
Основание и инертный растворитель, которые могут быть использованы в данном случае, аналогичны основанию и растворителю, используемым в галогенангидридном способе.
Температура реакции меняется в зависимости от исходного соединения (III), типа растворителя и т. д. , и обычно составляет от -20 до 50oC (предпочтительно от 0 до 30oC). Время реакции меняется в зависимости от температуры реакции и т. д. и составляет обычно от 15 минут до 24 часов (предпочтительно от 30 минут до 16 часов).
Реакцию смешанного ангидрида кислоты с соединением (IV) или его кислотно-аддитивной солью проводят, предпочтительно, в инертном растворителе в присутствии или в отсутствии основания. Основание и инертный растворитель, которые используют в данном случае, аналогичны основанию и инертному растворителю, используемым в галогенангидридном способе.
Температура реакции меняется в зависимости от исходного соединения (IV), типа растворителя и т.д., и обычно составляет от -20 до 100oC (предпочтительно от -10 до 50oC). Время реакции меняется в зависимости от температуры реакции и т. д. и составляет обычно от 15 минут до 24 часов (предпочтительно от 30 минут до 16 часов).
В случае, когда используется диалкилцианофосфорная кислота или диарилфосфорилазид, настоящий способ осуществляют при взаимодействии непосредственно соединения (III) с соединением (IV) в присутствии основания.
Способ активированного сложного эфира может быть осуществлен при взаимодействии соединения (III) с активным этерифицирующим агентом (например, N-гидроксисоединением, таким как N-гидроксисукцинимид и N-гидроксибензотриазол, и аналогичными соединениями) в присутствии конденсирующего агента (например, дициклогексилкарбодиимида, карбонилдиимидазола и др.), с получением активного сложного эфира, и при взаимодействии активного сложного эфира с соединением (IV) или его кислотно-аддитивной солью.
Реакцию получения активного сложного эфира, предпочтительно, проводят в инертном растворителе. Используемый в этом случае инертный растворитель аналогичен растворителю, используемому в галогенангидридном способе.
Температура реакции меняется в зависимости от исходных соединений (III) и (IV), типа растворителя и т.д., и в случае реакции этерификации составляет обычно от -20 до 50oC (предпочтительно от -10 до 30oC), а при взаимодействии активного сложноэфирного соединения с соединением (IV) температура реакции обычно составляет от -20 до 50oC (предпочтительно от -10 до 30oC). Время реакции меняется в зависимости от температуры реакции и т.д. и обычно для обеих реакций составляет от 15 минут до 24 часов (предпочтительно от 30 минут до 16 часов).
Способ конденсации может быть осуществлен при взаимодействии непосредственно соединения (III) с соединением (IV) или его кислотно-аддитивной солью в присутствии конденсирующего агента (например, дициклогексилкарбодиимида, карбонилдиимидазола, хлоргидрата 1-(N,N-диметиламинопропил)-3-этилкарбодиимида и т.д.). Эту реакцию проводят аналогично реакции получения активированного сложного эфира.
По окончании реакции целевое соединение каждой реакции выделяют из реакционной смеси обычными способами. Например, целевое соединение каждой реакции может быть получено путем отделения нерастворимых компонентов фильтрацией и выделения осажденных кристаллов фильтрацией; или соответствующим отделением нерастворимых компонентов путем фильтрации с последующими нейтрализацией, отгонкой растворителя, добавления воды в реакционную смесь, экстракции смеси несмешивающимся с водой органическим растворителем, таким как этилацетат, сушкой органического слоя и упариванием экстрагирующего растворителя. Если необходимо, то полученное таким образом соединение может быть дополнительно очищено с использованием обычных методик, например, перекристаллизацией, колоночной хроматографией и др.
Исходное соединение (III) Способа A известно или может быть легко получено известными способами или способами, аналогичными способам, описанным, например, в Tetrahedron, 45, 7459 (1989); J.Am.Chem.Soc., 79, 5203 (1957); J.Am.Chem.Soc., 111, 6354 (1989) и т.д.
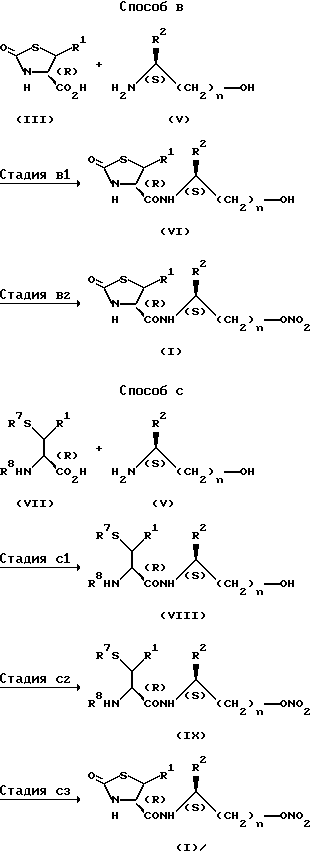
Способ B представляет собой другой способ получения соединения (I).
Стадия B1 предназначена для получения соединения общей формулы (VI) и может быть осуществлена при взаимодействии соединения (III) или его реакционноспособного производного с соединением общей формулы (V) в инертном растворителе. Данная стадия проводится, например, в соответствии с галогенангидридным способом, способом смешанного ангидрида, способом активированного эфира или способом конденсации, аналогично Стадии A1.
Стадия B2 используется для получения соединения общей формулы (I), и ее проводят при взаимодействии соединения общей формулы (VI) с нитрующим агентом в отсутствии или в присутствии инертного растворителя.
Нитрующий агент, используемый на этой стадии, представляет собой, например, дымящуюся азотную кислоту, тетрафторборат нитроколлидиния, тионилхлоридазотную кислоту, тионилазотную кислоту, тетрафторборат нитрония, и предпочтительно дымящуюся азотную кислоту, тетрафторборат нитроколлидиния или тионилхлоридазотную кислоту.
Используемый в данном случае инертный растворитель не имеет особенных ограничений, поскольку не влияет на протекание реакции, и может представлять собой, например, углеводороды, такие как гексан, циклогексан, бензол, толуол и ксилол; галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и четыреххлористый углерод; простые эфиры, такие как эфир, тетрагидрофуран и диоксан; кетоны, такие как ацетон; нитрилы, например, ацетонитрил; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон и гексаметилфосфорамид; и сульфоксиды, такие как диметилсульфоксид; предпочтительны галогенированные углеводороды, простые эфиры или нитрилы. Особенно предпочтительными являются нитрилы.
Температура реакции меняется в зависимости от исходного соединения (VI), типа нитрующего агента и т.д., и обычно составляет от -20 до 50oC, и, предпочтительно, приблизительно температура равна комнатной. Время реакции меняется в зависимости от температуры реакции и др., и обычно составляет от 30 минут до 24 часов (предпочтительно от 1 часа до 10 часов).
Соединение (I) также получают при взаимодействии соединения (VI) с сульфонилирующим агентом например, (C1-C4)-алкансульфонилгалогенидами, такими как метансульфонилхлорид, метансульфонилбромид, этансульфонилхлорид и бутансульфонилхлорид; (C6-C10)-арилсульфонилгалогенидами, такими как бензолсульфонилхлорид, п-толуолсульфонилхлорид, п-толуолсульфонилбромид и нафтилсульфонилхлорид; или (C1-C4-алкансульфоновыми ангидридами, такими как метансульфоновый ангидрид, этансульфоновый ангидрид и бутансульфоновый ангидрид, предпочтительно с метансульфонилхлоридом, этансульфонилхлоридом, бензолсульфонилхлоридом, п-толуолсульфонилхлоридом или метансульфоновым ангидридом, и особенно предпочтительно с метансульфонилхлоридом) при температуре от -20 до 50oC (предпочтительно при комнатной температуре) в течение от 30 минут до 24 часов (предпочтительно в течение от 1 часа до 10 часов), в инертном растворителе (например, в углеводородах, таких как гексан, циклогексан, бензол, толуол и ксилол; галогенированных углеводородах, таких как дихлорметан, 1,2-дихлорэтан и четыреххлористый углерод; или в простых эфирах, таких как эфир, тетрагидрофуран и диоксан; или в нитрилах, таких как ацетонитрил, предпочтительно в нитрилах, и особенно предпочтительно в ацетонитриле), в присутствии или в отсутствии основания (например, органических аминов, таких как триэтиламин, N-метилморфолин, пиридин и 4-диметиламинопиридин, и предпочтительно триэтиламин), с получением сульфонилокси-соединения, и затем при взаимодействии сульфонилокси-соединения с нитратом тетра(C1-C4-алкил) аммония (например, нитратом тетраметиламмония, нитратом тетраэтиламмония или нитратом тетрабутиламмония, и предпочтительно с нитратом тетрабутиламмония), при температуре от 0 до 200oC (предпочтительно от 50 до 150oC) в течение от 30 минут до 24 часов (предпочтительно в течение от 1 часа до 10 часов) в инертном растворителе (например, в ароматических углеводородах, таких как бензол, толуол и ксилол, предпочтительно толуол).
По окончании реакции целевое соединение каждой реакции выделяют из реакционной смеси обычными способами. Например, целевое соединение может быть получено путем отделения фильтрованием осажденных кристаллов; отгонкой растворителя; или отгонкой растворителя, добавления воды в реакционную смесь, экстракции смеси несмешивающимся с водой органическим растворителем, таким как этилацетат, сушкой органического слоя и упариванием экстрагирующего растворителя. Если необходимо, то полученное таким образом соединение может быть дополнительно очищено с использованием обычных методик, например, перекристаллизацией, колоночной хроматографией и др.
Способ C представляет собой другой способ получения соединения (I).
Стадия C1 представляет собой получение соединения общей формулы (VIII), и ее проводят при взаимодействии соединения общей формулы (VII) или его реакционноспособного производного с соединением (V) в инертном растворителе. Эта стадия может быть проведена, например, хлорангидридным способом, способом смешанного ангидрида, способом активного сложного эфира или методом конденсации, аналогично Стадии A1 в описанном выше Способе A.
Стадия C2 представляет собой получение соединения общей формулы (IX), и ее проводят при взаимодействии соединения общей формулы (VIII) с нитрующим агентом в отсутствии или в присутствии инертного растворителя. Эту стадию проводят аналогично Стадии B2 описанного выше Способа B.
Стадия C3 представляет собой получение соединения (I), и ее осуществляют путем снятия защитной группы меркапто-группы и защитной группы амино-группы соединения (IX) и затем реакцией полученного соединения с карбонильными соединениями, такими как карбонилимидазол; производными фосгена, такими как фосген и трифосген; (C1-C4)-алкилгалогенкарбонатами, такими как метилхлоркарбонат, этилхлоркарбонат, этилбромкарбонат, пропилхлоркарбонат и бутилхлоркарбонат; и производными фенилгалогенкарбоната, такими как фенилхлоркарбонат, фенилбромкарбонат, толилхлоркарбонат, метоксифенилхлоркарбонат и хлорфенилхлоркарбонат (предпочтительно с карбонилдиимидазолом, фосгеном, трифосгеном, метилхлоркарбонатом, этилхлоркарбонатом, этилбромкарбонатом или фенилхлоркарбонатом, и особенно предпочтительно с карбонилдиимидазолом).
Снятие защитной группы меркапто-группы и защитной группы амино-группы проводят способами, известными в области органического синтеза. Например, снятие защитной группы меркапто-группы и защитной группы амино-группы может быть осуществлено при взаимодействии соответствующего соединения с кислотой в инертном растворителе.
Кислота, используемая в данном случае, представляет собой, например, минеральную кислоту, такую как соляная кислота, азотная кислота и серная кислота; карбоновую кислоту, такую как уксусная кислота и трифторуксусная кислота; и сульфоновую кислоту, такую как метансульфоновая кислота, бензолсульфоновая кислота и п-толуолсульфокислота, предпочтительно соляную, трифторуксусную или п-толуолсульфокислоту, и особенно предпочтительно соляную кислоту.
Используемый в данном случае инертный растворитель не имеет особенных ограничений, поскольку не влияет на протекание реакции и может представлять собой, например, углеводороды, такие как гексан, циклогексан, бензол, толуол и ксилол; галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и четыреххлористый углерод; простые эфиры, такие как эфир, тетрагидрофуран и диоксан; кетоны, такие как ацетон; и нитрилы, например, ацетонитрил; предпочтительны галогенированные углеводороды или простые эфиры. Особенно предпочтительными являются простые эфиры.
Температура реакции меняется в зависимости от исходного соединения и т. д. и обычно составляет от -20 до 50oC, и предпочтительно является комнатной температурой. Время реакции зависит от температуры реакции и др. и обычно составляет от 30 минут до 24 часов (предпочтительно от 1 часа до 10 часов).
В том случае, когда защитная группа меркапто-группы и/или защитная группа амино-группы представляет собой тризамещенную силильную группу, защитную группу также снимают при взаимодействии соответствующего соединения с реагентом, дающим фтор-анион, таким как тетрабутиламмонийфторид и фторид калия, который используется вместо кислоты.
Защитная группа меркапто-группы и защитная группа амино-группы могут быть сняты последовательно, но предпочтительно одновременно при одинаковых условиях.
Реакцию соединения, полученного при снятии защитной группы меркапто-группы и защитной группы амино-группы, с карбонильным соединением предпочтительно проводят в инертном растворителе.
Используемый в этом случае инертный растворитель не имеет особенных ограничений, поскольку не влияет на протекание реакции и может представлять собой, например, углеводороды, такие как гексан, циклогексан, бензол, толуол и ксилол; галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и четыреххлористый углерод; простые эфиры, такие как эфир, тетрагидрофуран и диоксан; кетоны, такие как ацетон; и нитрилы, например, ацетонитрил; предпочтительны галогенированные углеводороды или простые эфиры. Особенно предпочтительными являются галогенированные углеводороды.
Температура реакции меняется в зависимости от исходного соединения и т. д. и обычно составляет от -20 до 50oC, и предпочтительно является комнатной температурой. Время реакции зависит от температуры реакции и др. и обычно составляет от 10 минут до 10 часов (предпочтительно от 20 минут до 5 часов).
По окончании реакции целевое соединение каждой реакции выделяют из реакционной смеси обычными способами. Например, целевое соединение каждой реакции может быть получено путем отгонки растворителя; или соответствующей отгонкой растворителя, добавления воды в реакционную смесь, экстракции смеси несмешивающимся с водой органическим растворителем, таким как этилацетат, сушкой органического слоя и упариванием экстрагирующего растворителя. Если необходимо, то полученное таким образом соединение может быть дополнительно очищено с использованием обычных методик, например, перекристаллизацией, колоночной хроматографией и др.
Исходное соединение (VII) Способа C известно или может быть легко получено известными способами и способами, аналогичными способам, описанным, например, в Chem. Absts., 74, 100379b (1971).
Соединение общей формулы (I') также обладает прекрасной противоязвенной активностью, и его получают способом, аналогичным описанному выше, с использованием соединения общей формулы (IV') вместо соединения (IV) или соединения общей формулы (V') вместо соединения (V).
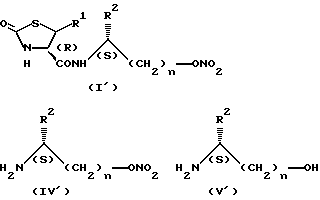
В приведенных выше формулах заместители R1, R2 и n принимают значения, определенные выше.
Активность соединения изобретения
Соединение настоящего изобретения, имеющее приведенную выше общую формулу (I), обладает потенциальным сосудорасширяющим действием для коллатеральных сосудов, невысокой токсичностью и меньшими побочными эффектами, такими как головная боль, головокружение, тахикардия или неблагоприятные воздействия на пищеварительную систему, печень, скелет и т.д., и не дает первоначальный проходящий эффект. Оно может быть использовано в качестве профилактического и терапевтического средства (в особенности в качестве терапевтического средства) при стенокардии.
Соединение (I) отличается тем, что имеет прекрасную стабильность при хранении и удобно в работе.
Промышленное применение
В том случае, когда соединение (I) настоящего изобретения используется в качестве терапевтического средства или профилактического средства при стенокардии, оно может быть введено отдельно или в виде смеси, например, с подходящим фармакологически приемлемым наполнителем, разбавителем или подобными ингредиентами, в форме таблетки, капсулы, гранулы, порошка, сиропа для перорального применения и препаратов для инъекций для парентерального применения.
Эти препараты получают известным способом с использованием добавок, таких как наполнители (например, производные сахаров, такие как лактоза, сахароза, глюкоза, маннит и сорбит; производные крахмалов, такие как кукурузный крахмал, пульпированный картофельный крахмал, а-крахмал, декстрин и карбоксиметилированный крахмал; производные целлюлозы, такие как кристаллическая целлюлоза, гидроксипропилзамещенная целлюлоза с низкой степенью замещения, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза, кальций-карбоксиметилцеллюлоза и натрий-карбоксиметилцеллюлоза, соединенная внутренней мостиковой связью; аравийская камедь; декстран; Пуллулан; силикатные производные, такие как ангидрид легкой кремниевой кислоты, синтетический алюмосиликат и магнийалюминат метакремниевой кислоты; фосфаты, такие как фосфат кальция; карбонаты, такие как карбонат кальция; и сульфаты, такие как сульфат кальция), связующие вещества (например, названные выше наполнители; желатин; поливинилпирролидон; и Macrogol); диспергирующие агенты (например, названные выше наполнители; химически модифицированный крахмал, производные целлюлозы и др. , такие как натрий-кросскармелоза, натрий-карбоксиметилкрахмал и связанный мостиковой связью поливинилпирролидон), смазывающие вещества (например, тальк; стеариновая кислота; и стеараты металлов, такие как стеарат кальция и стеарат магния; коллоидная двуокись кремния; воски, такие как пчелиный воск и спермацет; борная кислота; гликоль; карбоновые кислоты, такие как фумаровая кислота и адипиновая кислота; карбоксилат натрия, такой как бензоат натрия; сульфаты, такие как сульфат натрия; лейцин; лаурилсульфаты, такие как лаурилсульфат натрия и лаурилсульфат магния; кремниевые кислоты, такие как ангидрид кремниевой кислоты и гидрат кремниевой кислоты; и производные крахмала из описанных выше наполнителей), стабилизаторы (например, п-гидроксибензоаты, такие как метилпарабен и пропилпарабен; спирты, такие как хлорбутанол, бензиловый спирт и фенил-этиловый спирт; бензальконийхлорид; фенолы, такие как фенол и крезол; тимеросал; уксусный ангидрид; и сорбиновая кислота); корригирующие добавки (например, подслащивающие добавки, подкисляющие добавки и обычные отдушки), разбавители и растворители для инъекций (например, вода, этанол и глицерин). Доза меняется в зависимости от состояния и возраста пациента, которого необходимо лечить, и в зависимости от состояния средство желательно менять 1-6 раз в день; при пероральном применении низший предел для взрослого составляет по 1 мг за каждый прием (предпочтительно 5 мг) и верхний предел - 1000 мг (предпочтительно 300 мг); в случае внутривенного применения низший предел для взрослого составляет 0,1 мг за каждый прием (предпочтительно 0,5 мг) и верхний предел - 100 мг (предпочтительно 50 мг).
Наилучший вариант практического осуществления изобретения
Настоящее изобретение дополнительно иллюстрируется с помощью Иллюстрирующих примеров, Справочных примеров, Примеров испытаний и Рецептурных примеров, которые не ограничивают изобретение.
ПРИМЕР 1
(4R)-N-[(1S)-1-Meтил-2-нитpoкcиэтил]-2-oкcoтиaзoлидин-4-ил-карбоксамид
В 60 мл сухого тетрагидрофурана суспендируют 2,06 г (4R)-2-оксотиазолидин-4-карбоновой кислоты и 2,00 г гидрохлорида (1S)-1-метил-2-нитроксиэтиламина, к смеси при перемешивании и охлаждении льдом добавляют 4,5 мл триэтиламина и 3,00 мл дифенилфосфорилазида. Смесь перемешивают при комнатной температуре в течение 5 часов. Затем растворитель отгоняют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь циклогексанон-этилацетат (1:4). Получают 3,00 г бесцветных кристаллов. Кристаллы перекристаллизовывают из этилацетата, получают 0,964 г требуемого соединения в виде бесцветных игольчатых кристаллов.
Т.пл. 122-123oC.
Спектр ЯМР (CDCl3+ДМСО-d6) δ, м.д.: 1,27 (3H, д, J=6,6 Гц), 3,67 (2H, д, J=6,6 Гц), 4,10-4,57 (4H, м), 7,57 (1H, уш.с), 7,78 (1H, уш.с).
ПРИМЕР 2
(4R)-N-[(1S)-1-Метил-2-нитроксиэтил]-2-оксотиазолидин-4- ил-карбоксамид
(2a). (4R)-N-[(1S)-1-Метил-2-гидроксиэтил]-2-оксотиазолидин-4- ил- карбоксамид
В 20 мл сухого тетрагидрофурана растворяют 1,0 г (4R)-2-оксотиазолидин-4-карбоновой кислоты и 0,56 г L-аланинола, к смеси при комнатной температуре и охлаждении льдом добавляют 2,8 мл триэтиламина и 1,8 мл дифенилфосфорилазида. Смесь перемешивают при комнатной температуре в течение 3 часов. Затем растворитель отгоняют при пониженном давлении и полученный остаток очищают колоночной хроматографией на силикагеле, в качестве элюента используют этилацетат и дополнительно очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь дихлорметан-метанол (95:5), получают 0,92 г требуемого продукта в виде бесцветных кристаллов.
Т.пл. 160-162oC.
Спектр ЯМР (ДМСО-d6) δ, м.д.: 1,04 (3H, д, J=6,7 Гц), 3,20-3,40 (3H, м), 3,63 (1H, дд, J=8,6 Гц, J=11,2 Гц), 3,70-3,88 (1H, м), 4,16-4,22 (1H, м), 4,73 (1H, т, J=5,6 Гц), 7,83 (1H, д, J=7,9 Гц), 8,24 (1H, уш.с).
(2b). (4R)-N-[(1S)-1-Метил-2-нитроксиэтил]-2-оксотиазолидин-4-ил- карбоксамид
В 10 мл сухого ацетонитрила растворяют 478 мг тетрафторбората нитрония (содержание 85%), при перемешивании и охлаждении льдом добавляют 0,43 мл 2,4,6-коллидина и смесь перемешивают при охлаждении льдом в течение 30 минут. К полученной смеси добавляют 500 мг (4R)-N-[(1S)-1-метил-2-гидроксиэтил] -2- оксотиазолидин-4-ил-карбоксамида и смесь перемешивают при комнатной температуре в течение 1 часа 45 минут. Затем растворитель отгоняют при пониженном давлении и полученный остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь циклогексанэтилацетат (3:7). Получают 178 мг требуемого продукта в виде бесцветных кристаллов.
Т.пл. 119-122oC (разл.).
Спектр ЯМР этого соединения совпадает с таковым соединения примера 1.
ПРИМЕР 3
(4R)-N-[(1S)-1-Метил-2-нитроксиэтил]-2-оксотиазолидин-4- ил-карбоксамид
(3a). N-[(1S)-1-Метил-2-гидроксиэтил] -(2R)-2-трет-бутоксикарбониламино-3- трет-бутоксикарбонилтиопропанамид
В 100 мл сухого тетрагидрофурана растворяют 5,0 г N,S-ди-трет-бутоксикарбонил-L-цистеина и 1,3 г L-аланинола, к смеси при комнатной температуре и охлаждении льдом добавляют 4,4 мл триэтиламина и 4,0 мл дифенилфосфорилазида. Смесь перемешивают при комнатной температуре в течение 4 часов. Затем растворитель отгоняют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь циклогексан-этилацетат (1:1), получают 3,55 г требуемого соединения в виде бесцветных кристаллов.
Т.пл. 70-72oC.
Спектр ЯМР (CDCl3) δ, м.д.: 1,19 (3H, д, J=6,9 Гц), 1,45 (9H, с), 1,51 (9H, с), 2,65-2,90 (1H, уш.с), 3,03-3,30 (2H, м), 3,42-3,58 (1H, м), 3,63-3,78 (1H, м), 3,95-4,04 (1H, м), 4,20-4,35 (1H, м), 5,42-5,68 (1H, уш.с), 6,46 (1H, д, J=7,8 Гц).
(3b). N-[(1S)-1-Метил-2-нитроксиэтил] -(2R)-2-трет- бутоксикарбониламино-3-трет-бутоксикарбонилтиопропанамид
В 25 мл сухого ацетонитрила растворяют 1,24 г тетрафторбората нитрония (содержание 85%), при перемешивании и охлаждении льдом добавляют 1,12 г 2,4,6-коллидина и смесь перемешивают при охлаждении льдом в течение 30 минут. Затем к смеси добавляют раствор, полученный растворением 2,5 г N-[(1S)-1-метил-2-гидроксиэтил] -(2R)-2-трет-бутоксикарбониламино-3- трет-бутоксикарбонилтиопропанамида в 25 мл сухого ацетонитрила. Полученный раствор перемешивают при комнатной температуре в течение 3 часов. Затем растворитель отгоняют при пониженном давлении и полученный остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь циклогексан-этилацетат (4:1). Получают 1,39 г требуемого продукта в виде бледно-желтых кристаллов.
Т.пл. 123-124oC (разл.).
Спектр ЯМР (CDCl3) δ, м.д.: 1,27 (3H, д, J=6,8 Гц), 1,45 (9H, с), 1,51 (9H, с), 3,05-3,28 (2H, м), 4,20-4,55 (4H, м), 5,42 (1H, д, J=6,3 Гц), 6,45-6,65 (1H, уш.с).
(3c). (4R)-N-[(1S)-1-Метил-2-нитроксиэтил]-2-оксотиазолидин-4-ил- карбоксамид
В 10 мл раствора 4H соляной кислоты в диоксане растворяют 1,0 г N-[(1S)-1-метил-2-нитроксиэтил] -(2R)-2-трет-бутоксикарбониламино-3- трет-бутоксикарбонилтиопропанамида и полученный раствор перемешивают при комнатной температуре в течение 2 часов. Растворитель отгоняют при пониженном давлении, к остатку добавляют бензол и раствор упаривают досуха при пониженном давлении. Полученный остаток суспендируют в 10 мл дихлорметана, добавляют 0,46 г карбодиимидазола и смесь перемешивают при комнатной температуре в течение 40 минут. Реакционную смесь очищают колоночной хроматографией на силикагеле, используя в качестве элюента этилацетат, получают 0,45 г бледно-желтых кристаллов. Кристаллы перекристаллизовывают из этилацетата, получают 84 мг требуемого соединения в виде бесцветных кристаллов.
Т.пл. 125-126oC (разл.).
Спектр ЯМР этого соединения совпадает с таковым соединения примера 1.
ПРИМЕР 4
(4R)-N-[(1S)-1-Этил-2-нитроксиэтил]-2-оксотиазолидин-4-ил-карбоксамид
В 10 мл сухого тетрагидрофурана суспендируют 0,50 г (4R)-2-оксотиазолидин-4-карбоновой кислоты и 0,70 г гидрохлорида (1S)-1-этил-2-нитроксиэтиламина, к полученной смеси добавляют 1,40 мл триэтиламина и 0,62 мл диэтилцианофосфорной кислоты. Смесь перемешивают при комнатной температуре в течение 2 часов. Растворитель отгоняют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь циклогексан:этилацетат
(1: 2). Получают бледно-желтое масло. К маслу добавляют изопропиловый эфир, получают бледно-желтый порошок. Порошок растворяют в 10 мл ацетона и добавляют еще 5 мл ацетона. Ацетон отгоняют при пониженном давлении и смесь оставляют при комнатной температуре, получают 0,24 г требуемого соединения в виде бесцветных столбчатых кристаллов.
Т.пл. 106-107oC (разл.).
Спектр ЯМР (ДМСО-d6) δ, м.д.: 0,87 (3H, т, J=7,4 Гц), 1,30-1,68 (2H, м), 3,32 (1H, дд, J=5,0, J=11,2 Гц), 3,68 (1H, дд, J=8,5 Гц, J=11,2 Гц), 3,95-4,10 (1H, м), 4,25-4,35 (1H, м), 4,41 (1H, дд, J=7,5 Гц, J=11,2 Гц), 4,60 (1H, дд, J=4,3 Гц, J=11,2 Гц), 8,09 (1H, д, J=8,5 Гц), 8,27 (1H, уш.с).
ПРИМЕР 5
(4R)-N-[(1S)-1-Пропил-2-нитроксиэтил]-2-оксотиазолидин-4-ил-карбоксамид
Получают 0,84 г требуемого соединения в виде бесцветных кристаллов по методике, аналогичной методике примера 4, используя 0,50 г (4R)-2-оксотиазолидин-4-карбоновой кислоты и 0,75 г гидрохлорида (1S)-1-пропил-2-нитроксиэтиламина.
Т.пл.99-100oC (разл.).
Спектр ЯМР (ДМСО-d6) δ, м.д.: 0,87 (3H, т, J=7,1 Гц), 1,15-1,55 (4H, м), 3,32 (1H, дд, J= 4,8 Гц, J=11,2 Гц), 3,68 (1H, дд, J=8,6 Гц, J=11,2 Гц), 4,03-4,18 (1H, м), 4,23-4,33 (1H, м), 4,39 (1H, дд, J=7,5 Гц, J=11,2 Гц), 4,60 (1H, дд, J=4,2 Гц, J=11,2 Гц), 8,09 (1H, д, J=8,5 Гц), 8,27 (1H, уш.с).
ПРИМЕР 6
(4R)-N-[(1S)-1-Бутил-2-нитроксиэтил]-2-оксотиазолидин-4-ил-карбоксамид
Получают 570 мг требуемого соединения в виде бесцветных кристаллов по методике, аналогичной методике примера 4, используя 441 мг (4R)-2-оксотиазолидин-4-карбоновой кислоты и 500 мг гидрохлорида (1S)-1-бутил-2-нитроксиэтиламина.
Т.пл. 110-112oC (разл.).
Спектр ЯМР (CDCl3) δ, м.д.: 0,91 (3H, т, J=7,2 Гц), 1,20-1,43 (4H, м), 1,45-1,75 (2H, м), 3,16 (1H, дд, J=4,9 Гц, J=11,2 Гц), 3,83 (1H, дд, J=8,6 Гц, J=11,2 Гц), 4,23-4,45 (3H, м), 4,60 (1H, дд, J=3,3 Гц, J=11,2 Гц), 6,65 (1H, уш.с), 6,81 (1H, д, J=8,6 Гц).
ПРИМЕР 7
(4R)-N-[(1S)-1-Изопропил-2-нитроксиэтил]-2-оксотиазолидин-4-ил- карбоксамид
Получают 343 мг требуемого соединения в виде бесцветных кристаллов по методике, аналогичной методике примера 4, используя 333 мг (4R)-2-оксотиазолидин-4-карбоновой кислоты и 500 мг гидрохлорида (1S)-1-изопропил-2-нитроксиэтиламина.
Т.пл. 89-91oC (разл.).
Спектр ЯМР (ДМСО-d6) δ, м.д.: 0,96 (3H, д, J=7,3 Гц), 1,00 (3H, д, J=6,6 Гц), 1,83-2,02 (1H, м), 3,64 (1H, дд, J=4,0 Гц, J=11,2 Гц), 3,84 (1H, дд, J= 8,6 Гц, J=11,2 Гц), 4,05-4,20 (1H, м), 4,35-4,52 (2H, м), 4,65 (1H, дд, J= 4,0 Гц, J=11,2 Гц), 6,80 (1H, уш.с), 6,86 (1H, д, J=9,2 Гц).
ПРИМЕР 8
(4R)-N-[(1S)-1-Изобутил-2-нитроксиэтил]-2-оксотиазолидин-4-ил- карбоксамид
Получают 636 мг требуемого соединения в виде желтого масла по методике, аналогичной методике примера 4, используя 544 мг (4R)-2-оксотиазолидин-4-карбоновой кислоты и 500 мг гидрохлорида (1S)-1-изобутил-2-нитроксиэтиламина.
Спектр ЯМР (ДМСО-d6) δ, м.д.: 0,93 (3H, д, J=6,6 Гц), 0,95 (3H, д, J=7,9 Гц), 1,30-1,80 (3H, м), 3,61 (1H, дд, J=4,0 Гц, J=11,2 Гц), 3,82 (IH, дд, J= 8,6 Гц, J=11,2 Гц), 4,30-4,50 (3H, м), 4,59 (1H, дд, J=3,3 Гц, J=11,2 Гц), 6,69 (1H, уш.с), 6,85 (1H, д, J=7,9 Гц).
СПРАВОЧНЫЙ ПРИМЕР 1
(4R)-N-[(1R)-1-Метил-2-нитроксиэтил]-2-оксотиазолидин-4-ил-карбоксамид
В 100 мл сухого бензола суспендируют 5,64 г (4R)-2-оксотиазолидин-4-карбоновой кислоты, добавляют 6,7 мл оксалилхлорида и несколько капель диметилформамида. Смесь перемешивают при комнатной температуре в течение 3 часов. Затем растворитель отгоняют при пониженном давлении, добавляют еще бензол и суспензию подвергают азеотропной перегонке досуха, получают бледно-желтый хлорангидрид.
В 150 мл сухого дихлорметана суспендируют 5,00 г гидрохлорида (1R)-1-метил-2-нитроксиэтиламина, к смеси при перемешивании и охлаждении льдом добавляют по каплям 14 мл триэтиламина и раствор предварительно полученного хлорангидрида в 70 мл сухого дихлорметана. Смесь перемешивают при охлаждении льдом в течение 1 часа. Затем растворитель отгоняют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь циклогексан-этилацетат (1:4). Получают бледно-желтые кристаллы, которые перекристаллизовывают из этилацетата, получают 2,79 г требуемого соединения в виде бесцветных кристаллов.
Т.пл.101-102oC (разл.).
Спектр ЯМР (CDCl3+ДМСО-d6) δ, м.д.: 1,27 (3H, д, J=6,9 Гц), 3,55-3,75 (2H, м), 4,23-4,58 (4H, м), 7,47 (1H, д, J=7,1 Гц), 7,61 (1H, с).
СПРАВОЧНЫЙ ПРИМЕР 2
(1S)-N-(Трет-бутоксикарбонил)-1-метил-2-нитроксиэтиламин
В 200 мл сухого ацетонитрила суспендируют 17,9 г тетрафторбората нитрония, при температуре от -5oC до 0oC в токе азота добавляют по каплям 17,5 мл 2,4,6-коллидина. Смесь перемешивают при температуре 0oC в течение 30 минут, добавляют 10,7 г N-трет-бутоксикарбонил-L-аланинола и полученную смесь перемешивают при комнатной температуре в течение 1 часа 20 минут. Затем растворитель отгоняют при пониженном давлении и к остатку добавляют этилацетат. Нерастворимые вещества отфильтровывают и фильтрат упаривают досуха при пониженном давлении. Полученное таким образом желтое масло очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь циклогексан-этилацетат (9:1). Получают 7,12 г требуемого продукта в виде бесцветного масла.
Спектр ЯМР (CDCl3) δ, м. д. : 1,23 (3H, д, J=7,3 Гц), 1,45 (9H, с), 3,90-4,15 (1H, м), 4,27-4,75 (3H, м).
СПРАВОЧНЫЙ ПРИМЕР 3
Гидрохлорид (1S)-1-метил-2-нитроксиэтиламина
В 80 мл 4H соляной кислоты в диоксане растворяют 4,52 г (1S)-N-(трет-бутоксикарбонил)-1-метил-2-нитроксиэтиламина и смесь оставляют стоять при комнатной температуре в течение 1 часа и 50 минут. К смеси добавляют 160 мл эфира, кристаллы отфильтровывают и сушат, получают 3,02 г требуемого соединения в виде бесцветных кристаллов.
Т.пл. 134-135oC.
Спектр ЯМР (CDCl3+ДМСО-d6) δ, м.д.: 1,47 (3H, д, J=6,6 Гц), 3,55-3,70 (1H, м), 4,65-4,80 (2H,м).
СПРАВОЧНЫЙ ПРИМЕР 4
(1R)-N-(трет-бутоксикарбонил)-1-метил-2-нитроксиэтиламин
Получают 8,55 г требуемого соединения в виде бесцветного масла по методике, аналогичной методике Справочного примера 2, используя 13,09 тетрафторбората нитрония и 7,72 г N-трет-бутоксикарбонил-D-аланинола.
Спектр ЯМР (CDCl3) δ, м. д. : 1,23 (3H, д, J=7,3 Гц), 1,45 (9H, с), 3,95-4,15 (1H, м), 4,28-4,75 (3H, м).
СПРАВОЧНЫЙ ПРИМЕР 5
Гидрохлорид (1R)-1-метил-2- нитроксиэтиламина
Получают 1,60 г требуемого соединения в виде бесцветных кристаллов по методике, аналогичной методике Справочного примера 3, используя 8,55 г (1R)-N-(трет-бутоксикарбонил)-1-метил-2- нитроксиэтиламина и 90 мл 4H соляной кислоты в диоксане.
Т.пл. 133-135oC.
Спектр ЯМР (CDCl3+ДМСО-d6) δ, м.д.: 1,47 (3H, д, J=6,9 Гц), 3,55-3,70 (1H, м), 4,65-4,78 (2H, м).
СПРАВОЧНЫЙ ПРИМЕР 6
(1S)-N-(трет-бутоксикарбонил)-1-этил-2-нитроксиэтиламин
Получают 3,19 г требуемого соединения в виде бледно-желтого масла по методике, аналогичной методике Справочного примера 2, используя 4,00 г тетрафторбората нитрония и 4,03 г (1S)-N-(трет-бутоксикарбонил)-1-этил-2-гидроксиэтиламина.
Спектр ЯМР (CDCl3) δ, м.д.: 0,98 (3H, т, J=7,3 Гц), 1,40-1,70 (2H, м), 1,45 (9H, с), 3,70-3,95 (1H, м), 4,20-4,70 (3H, м).
СПРАВОЧНЫЙ ПРИМЕР 7
Гидрохлорид (1S)-1-этил-2-нитроксиэтиламина
Получают 2,10 г требуемого соединения в виде бесцветных кристаллов по методике, аналогичной методике Справочного примера 3, используя 3,19 г (1S)-N-(трет-бутоксикарбонил)-1-этил-2- нитроксиэтиламина и 50 мл 4H соляной кислоты в диоксане.
Т.пл.121-123oC (разл.).
Спектр ЯМР (ДМСО-d6) δ, м.д.: 0,96 (3H, т, J=7,2 Гц), 1,50-1,80 (2H, м), 3,35-3,50 (1H, м), 4,66 (1H, дд, J=6,6 Гц, J=11,9 Гц), 4,81 (1H, дд, J=4,0 Гц, 11,9 Гц), 8,49 (3H, уш.с).
СПРАВОЧНЫЙ ПРИМЕР 8
(1S)-N-(Трет-бутоксикарбонил)-1-пропил-2-нитроксиэтиламин
Получают 3,03 г требуемого соединения в виде бесцветных кристаллов по методике, аналогичной методике Справочного примера 2, используя 8,60 г тетрафторбората нитрония и 7,49 г (1S)-N-(трет-бутоксикарбонил)-1-пропил-2-гидроксиэтиламина.
Т.пл. 57 - 58oC.
Спектр ЯМР (CDCl3) δ, м.д.: 0,95 (3H, т, J=7,0 Гц), 1,25-1,70 (4H, м), 1,45 (9H, с), 3,80-4,05 (1H, м), 4,20-4,70 (3H, м).
СПРАВОЧНЫЙ ПРИМЕР 9
Гидрохлорид (1S)-1-пропил-2-нитроксиэтиламина
Получают 2,77 г требуемого соединения в виде бесцветных кристаллов по методике, аналогичной методике Справочного примера 3, используя 4,00 г (1S)-N-(трет-бутоксикарбонил)-1-пропил-2- нитроксиэтиламина и 40 мл 4H соляной кислоты в диоксане.
Т.пл. 157-158oC (разл.).
Спектр ЯМР (ДМСО-d6) δ, м.д.: 0,89 (3H, т, J=7,2 Гц), 1,30-1,70 (4H, м), 3,40-3,55 (1H, м), 4,65 (1H, дд, J=6,8 Гц, J=11,9 Гц), 4,81 (1H, дд, J=3,4 Гц, J=11,9 Гц), 8,51 (3H, уш.с).
СПРАВОЧНЫЙ ПРИМЕР 10
(1S)-N-(Трет-бутоксикарбонил)-1-бутил-2-нитроксиэтиламин
Получают 1,56 г требуемого соединения в виде желтого масла по методике, аналогичной методике Справочного примера 2, используя 1,87 г тетрафторбората нитрония и 2,09 г (1S)-N-(трет-бутоксикарбонил)-1- бутил-2-гидроксиэтиламина.
Спектр ЯМР (CDCl3) δ, м.д.: 0,91 (3H, т, J=7,3 Гц), 1,25-1,65 (6H, м), 1,45 (9H, с), 3,83-3,98 (1H, м), 4,30-4,60 (3H, м).
СПРАВОЧНЫЙ ПРИМЕР 11
Гидрохлорид (1S)-1-бутил-2-нитроксиэтиламина
Получают 702 мг требуемого соединения в виде бесцветных кристаллов по методике, аналогичной методике Справочного примера 3, используя 1,56 г (1S)-N-(трет-бутоксикарбонил)-1-бутил-2- нитроксиэтиламина и 15 мл 4H соляной кислоты в диоксане.
Т.пл. 133-135oC (разл.).
Спектр ЯМР (CDCl3) δ, м.д.: 0,94 (3H, т, J=7,3 Гц), 1,20-2,00 (6H, м), 3,55-3,70 (1H, м), 4,65-4,85 (2H, м).
СПРАВОЧНЫЙ ПРИМЕР 12
(1S)-N-(трет-бутоксикарбонил)-1-изопропил-2-нитроксиэтиламин
Получают 3,07 г требуемого соединения в виде желтого масла по методике, аналогичный методике Справочного примера 2, используя 3,19 г тетрафторбората нитрония и 3,31 г (1S)-N-(трет-бутоксикарбонил)-1-изопропил-2-гидроксиэтиламина.
Спектр ЯМР (CDCl3) δ, м.д.: 0,97 (3H, т, J=5,9 Гц), 0,99 (3H, д, J=6,6 Гц), 1,45 (9H, с), 3,65-3,80 (1H, м), 4,35-4,63 (3H, м).
СПРАВОЧНЫЙ ПРИМЕР 13
Гидрохлорид (1S)-1-изопропил-2-нитроксиэтиламина
Получают 1,97 г требуемого соединения в виде бесцветных кристаллов по методике, аналогичной методике Справочного примера 3, используя 3,07 г (1S)-N-(трет-бутоксикарбонил)-1-изопропил-2- нитроксиэтиламина и 30 мл 4H соляной кислоты в диоксане.
Т.пл. 174-175oC (разл.).
Спектр ЯМР (CDCl3) δ, м.д.: 1,14 (3H, д, J=7,3 Гц), 1,17 (3H, д, J=6,6 Гц), 2,10-2,30 (1H, м), 3,40-3,52 (1H, м), 4,70-4,90 (2H, м).
СПРАВОЧНЫЙ ПРИМЕР 14
(1S)-N-(Трет-бутоксикарбонил)-1-изобутил-2-нитроксиэтиламин
Получают 3,84 г требуемого соединения в виде желтого масла по методике, аналогичной методике Справочного примера 2, используя 3,91 г тетрафторбората нитрония и 4,35 г (1S)-N-(трет-бутоксикарбонил)-1- изобутил-2-гидроксиэтиламина.
Спектр ЯМР (CDCl3) δ, м.д.: 0,93 (3H, д, J=4,6 Гц), 0,95 (3H, д, J=4,6 Гц), 1,20-1,50 (2H, м), 1,45 (9H, с), 1,60-1,80 (1H, м), 3,90-4,10 (1H, м), 4,25-4,65 (3H, м).
СПРАВОЧНЫЙ ПРИМЕР 15
Гидрохлорид (1S)-1-изобутил-2-нитроксиэтиламина
Получают 2,32 г требуемого соединения в виде бесцветных кристаллов по методике, аналогичной методике Справочного примера 3, используя 3,84 г (1S)-N-(трет-бутоксикарбонил)-1-изобутил-2- нитроксиэтиламина и 40 мл 4H соляной кислоты в диоксане.
Т.пл. 174-175oC (разл.).
Спектр ЯМР (CDCl3) δ, м. д. : 0,93-1,10 (6H, м), 1,50-1,70 (1H, м), 1,72-2,00 (2H, м), 3,65-3,82 (1H, м), 4,63-4,85 (2H, м).
ПРИМЕР ИСПЫТАНИЯ 1
Расширение коллатеральных сосудов при внутривенном введении
Гончих собак (самцов), весом от 9 до 13 кг, анестезируют внутривенной инъекцией пентобарбитала в дозе 30 мг/кг и исследуют в условиях искусственного дыхания. Для измерения давления в левой сонной артерии полиэтиленовую канюлю (распыляющий внутривенный катетер 2F) вводят до подъема в одно из ответвлений левой щитовидной артерии. Левую сонную артерию на выходе потока от этого участка измерения давления перекрывают на 1 минуту с помощью артериального зажима и измеряют давление непосредственно перед закупоркой (P) и снижение периферического давления (ΔP). Затем через другую полиэтиленовую канюлю, введенную в паховую вену, вводят испытуемое лекарство. Левую сонную артерию закупоривают на 1 минуту через 5, 15, 30, 45 и 60 минут и каждый раз измеряют давление непосредственно перед закупоркой (Pa) и снижение периферического давления (ΔPa). Расширяющее действие на коллатеральные сосуды (Коллатеральный индекс = КИ) испытуемого лекарства определяют в соответствии со следующим уравнением:
КИ = 100-(ΔPa/Pa)•100/(ΔP/P).
В соответствии с результатами этого испытания соединения примеров 1,5, 6 и 8 проявляют прекрасную активность; КИ (6) при дозе 0,3 мг/кг составляет более 10.
ПРИМЕР ИСПЫТАНИЯ 2
Расширение коллатеральных сосудов при введении в воротную вену
Пока готовят образцы для испытания в соответствии с методикой Примера испытания 1, животное подвергают лапоротомии вдоль срединной брюшной линии и ответвление мезентериальной вены извлекают и надрезают так, чтобы вводить лекарство в воротную вену. Полиэтиленовую канюлю (распыляющий внутривенный катетер 2F) вводят до подъема в эту вену так, чтобы она попала в воротную вену, и затем через нее вводят испытуемое лекарство. Для того, чтобы изучить первичный проходящий эффект лекарства, его вначале вводят внутривенно (паховая вена) для определения расширяющего действия лекарства на коллатеральные сосуды в течение 60 минут. То же самое лекарство вводят затем в воротную вену через 2 или 3 часа после определения сосудорасширяющего действия для коллатеральных сосудов в течение 60 минут и сравнивают два эффекта.
По результатам данного испытания соединение примера 1 проявляет прекрасное расширяющее действие на коллатеральные сосуды.
ПРИМЕР ИСПЫТАНИЯ 3
Ингибирование язвы, обусловленной приемом аспирина
В качестве испытуемых животных используют одну группу самцов крыс линии 10 Donryu, весом 200-250 г каждая. Крыс не кормят перед проведением опыта в течение 24 часов, но они могут свободно пить воду. Испытуемые соединения суспендируют в 0,5%-ном растворе карбоксиметилцеллюлозы (КМЦ). Для контрольной группы используют 0,5%-ный раствор КМЦ.
Испытуемое соединение вводят крысам перорально (0,1 мл/100 г веса тела) и затем через 1 час перорально вводят раствор аспирина (150 мг/мл), суспендирован в 0,5%-ном растворе КМЦ) из расчета 0,1 мл/100 г веса тела. Через 4 часа после введения раствора аспирина крыс умерщвляют с помощью газообразной двуокиси углерода и у каждой крысы извлекают желудок. В желудки наливают по 10 мл 1%-ного раствора формалина и дают желудкам увеличиваться в объеме, помещают в химический стакан с 1%-ным раствором формалина приблизительно на 15-20 минут. Затем каждый желудок разрезают вдоль большей его кривизны и измеряют участок с язвообразованием в слизистой желудка с использованием оборудования для визуализации (Luzex-F, производство Nireko Co., Ltd.). Рассчитывают среднюю величину участка с язвообразованием для каждой группы по величинам участка с язвообразованием каждой крысы из группы и получают скорость ингибирования при сравнении средней величины для испытуемой группы и средней величины для контрольной группы. Полученные результаты представлены в таблице 1.
Согласно этому опыту, соединение примера 1 проявляет прекрасную противоязвенную активность.
ПРИМЕР ИСПЫТАНИЯ 4
Стабильность соединений
Берут точную навеску приблизительно в 2 мг испытуемого соединения и помещают в коричневый флакон. Флакон оставляют в темном месте при комнатной температуре (24-26oC) на 4 недели и измеряют остаточное отношение (%) испытуемого соединения с помощью жидкостной хроматографии (колонка: Inertsil ODS-3, элюент: 10 мМ (pH=7,0) фосфорная кислота (буфер)/ацетонитрил=80/20). Полученные результаты представлены в таблице 2.
В соответствии с этим опытом, соединение примера 1 обладает прекрасной стабильностью при хранении по сравнению со стабильностью при хранении смеси соединения примера 1 и его (4R), (1R)-изомера в соотношении 1:1. Кроме того, соединение примера 1 обладает прекрасной стабильностью при хранении по сравнению с (4R), (1R)-изомером.
РЕЦЕПТУРНЫЙ ПРИМЕР 1
Капсула - Капсула
Соединение примера 1 - 50,0 мг
Лактоза - 128,7 мг
Кукурузный крахмал - 70,0 мг
Стеарат магния - 1,3 мг
Стеарат магния - 250 мг
Полученный таким образом порошок смешивают и пропускают через сито размером 60 меш. и затем порошок загружают в желатиновые капсулы N 3 по 250 мг.
РЕЦЕПТУРНЫЙ ПРИМЕР 2
Таблетка - Таблетка
Соединение примера 1 - 50,0 мг
Лактоза - 124,0 мг
Кукурузный крахмал - 25,0 мг
Стеарат магния - 1,0 мг
Стеарат магния - 200 мг
Полученный таким образом порошок смешивают и с помощью таблетирующей машины готовят таблетку на 200 мг.
Если необходимо, то на таблетку можно нанести покрытие из сахара.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНОЕ ТИАЗОЛИДИНОНА, ОБЛАДАЮЩЕЕ РАСШИРЯЮЩЕЙ КОЛЛАТЕРАЛЬНЫЙ СОСУД АКТИВНОСТЬЮ, СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ СТЕНОКАРДИИ И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННЫХ ПРОИЗВОДНЫХ ТИАЗОЛИДИНОНА | 1995 |
|
RU2139283C1 |
| ПРОИЗВОДНЫЕ НИТРОКСИАЛКИЛАМИДА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1994 |
|
RU2098406C1 |
| АЦИЛИРОВАННЫЕ ГЕТЕРОАЛИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ, ЛЕКАРСТВЕННОЕ СРЕДСТВО, ОБЛАДАЮЩЕЕ СЕЛЕКТИВНОЙ АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ ПРОТИВ NK-РЕЦЕПТОРОВ, СПОСОБ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ | 1998 |
|
RU2174122C1 |
| НОВОЕ ПРОИЗВОДНОЕ ФЕНИЛПИРРОЛА | 2009 |
|
RU2470917C2 |
| ЭФИРНЫЕ ПРОИЗВОДНЫЕ ГЕКСАГИДРОНАФТАЛИНА, ИХ ПОЛУЧЕНИЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1994 |
|
RU2114101C1 |
| ПРОИЗВОДНЫЕ 1-БИФЕНИЛМЕТИЛИМИДАЗОЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ГИПЕРТЕНЗИИ | 1992 |
|
RU2128173C1 |
| ПИРИМИДИН-НУКЛЕОЗИДЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1991 |
|
RU2116306C1 |
| ПРОИЗВОДНЫЕ 1-МЕТИЛКАРБАПЕНЕМА | 2001 |
|
RU2247725C2 |
| ДИСПИРОПИРРОЛИДИНОВЫЕ ПРОИЗВОДНЫЕ | 2012 |
|
RU2612534C2 |
| АМИДНОЕ ПРОИЗВОДНОЕ | 2010 |
|
RU2536409C2 |


Изобретение относится к новому оптически активному производному общей формулы I, где R1 представляет атом водорода, R2 представляет алкильную группу, содержащую от 1 до 6 атомов углерода, и n означает 1. Соединение формулы I получают взаимодействием соединения формулы III или его реакционноспособного производного с амином общей формулы V или его кислотно-аддитивной солью, с последующим нитрованием полученного соединения. Оптически активное производное тиазолидинона предлагаемого изобретения обладает прекрасной активностью против стенокардии и может быть использовано в качестве профилактического или терапевтического средства при стенокардии. 6 с. и 11 з.п.ф-лы, 2 табл.
где R1 представляет атом водорода;
R2 представляет алкильную группу, содержащую от 1 до 6 атомов углерода; и
n означает 1.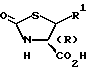
где R1 принимает значения, определенные в п.1,
или его реакционно-способного производного с амином общей формулы IV: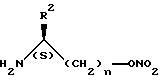
где R2 принимает значения, определенные в п.1,
или его кислотно-аддитивной солью.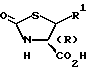
где R1 принимает значения, определенные в п.1,
или его реакционно-способного производного с амином общей формулы V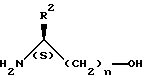
где R2 принимает значения, определенные в п.1, или его кислотно-аддитивной солью, с последующим нитрованием полученного соединения.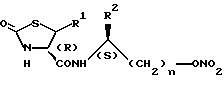
где R1 представляет атом водорода,
R2 представляет алкильную группу, содержащую от 1 до 6 атомов углерода;
n представляет 1.
Приоритет по пунктам и признакам:
02.03.95 по пп.1, 10 и 11 при R1 - атом водорода, n = 1 и R2 - алкил C1 - C4; п.6 - первые три соединения.
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Горизонтальная фильтрующая центрифуга | 1973 |
|
SU506434A1 |
| БИБЛИОТЕКА I | 0 |
|
SU300400A1 |
| Машковский М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, т.1, с.339 - 372. | |||
Авторы
Даты
1999-11-27—Публикация
1996-03-01—Подача