Изобретение относится к медицине, в частности к онкологии, и может найти применение при комбинированном и комплексном лечении больных раком молочной железы (РМЖ).
Актуальность данной проблемы обусловлена тем, что реакция опухоли на облучение - один из факторов, определяющих результаты лечения онкологических больных в отдаленные сроки. Отсутствие достоверных критериев оценки радиочувствительности злокачественных опухолей и невозможность в связи с этим прогнозировать результаты проводимой терапии являются серьезной проблемой современной окнологии (Ю.С.Марадынский и соавт., 1988).
Исследование индивидуальной радиочувствительности позволит не только прогнозировать результаты проводимой терапии, но и будет влиять на тактику врача: выбор методов дальнейшего лечения, обоснованность применения различных радиопротекторов, режим фракционирования дозы.
В настоящее время известны следующие методы прогнозирования чувствительности опухоли к облучению:
1. Клинические методы. Основаны на визуальной (А.А.Габелов, Г.М.Шариков, 1983, Ю. С. Марадынский, В.Г.Андреев, 1988, Denecamp, 1981) или рентгенологической (Г.В.Голдобенко и соавт., 1988, В.А.Куликов, 1988, С.Г. Хачкурузов и соавт., 1981) оценке регрессии опухоли и метастазов. В клинической практике данные методы зачастую являются единственными при оценке эффективности проводимого лечения у конкретного больного. Однако следует признать, что визуальная оценка результатов лучевой терапии (ЛТ) весьма субъективна. Существуют трудности адекватной интерпретации полученных данных: часто имеет место несоответствие клинических и гистологических результатов лечения, затруднена оценка побочного влияния ЛТ на окружающие ткани.
2. Математические методы. Метод Блера-Девидсона-Корогодина, модели F. Ellis, L.Cohen и др. С помощью ЭВМ, по определенным математическим формулам рассчитывают вероятность чувствительности опухоли к облучению. При этом учитываются: гистологическое строение опухоли, стадия процесса, возраст, гормональный фон и другие факторы. Если брать во внимание, что эффективность ЛТ зависит от индивидуальной чувствительности опухоли к облучению и от точности подведения очаговой дозы (по данным ВОЗ отклонение от очаговой дозы на 5% наблюдается у 60% больных, на 10% - у 18% больных, а отклонение от очаговой дозы на 5% приводит к клиническим результатам), что становится ясно, что рассчитать эффективность ЛТ у конкретного больного при помощи математического метода весьма проблематично (О.Н.Денисенко, 1988).
3. Лабораторные методы.
3.1. Методы исследования особенностей опухолевых клеток или изменений в них под воздействием ЛТ.
3.1.1. Метод проточной цитометрии (Г.Г.Автандилов и соавт., 1981, Atcin, Kay, 1979).
3.1.2. Радиометрический метод (Utsumy, 1994).
3.1.3. Иммунофлуоресцентный и радиографический (А.Н.Деденков и соавт., 1987, И.А.Замулаева и соавт., 1988, В.И.Чиссов и соавт., 1991).
3.1.4. Метод клонирования опухолевых клеток ("in vivo", "in vitro" и диффузионных камерах (В.И.Исмаилов, 1986, Selby, Steel, 1981, Yip, 1994, Luo Ying et al, 1995).
3.1.5. Метод ксенографтов или гетеротрансплантатов (Guichard, 1977).
3.1.6. Биохимический метод. Прогнозирование радиочувствительности по уровню циклических нуклеотидов в ткани опухоли (И.Н.Лозинская и соавт., 1987).
Необходимо отметить, что большинство указанных методов достаточно точно прогнозируют радиорезистентные опухоли (70 - 90%). Вероятность предсказания радиочувствительных опухолей намного ниже (50 - 80%). Имеет место недостаточная корреляция между клиническими результатами лечения больных и результатами полученными "in vitro" и "in vivo" (И.И.Пелевина, А.С.Саенко, 1988). Большая продолжительность проведения отдельных методик, необходимость наличия специального оборудования, реактивов, лабораторных животных и т.д., все это, безусловно, ограничивает широкое применение этих методов в клинической практике.
3.2 Методы исследования факторов гомеостаза, влияющих на чувствительность опухоли к облучению и его изменений в ответ на характер лучевых повреждений в опухоли.
На чувствительность опухоли к лучевой терапии могут оказывать влияние: уровень гемоглобина крови (Suit, 1965, Bush et al, 1978), иммунологическая реактивность организма, определяемая в реакциях гиперчувствительности замедленного типа на неопухолевые антигены: ДНХБ, BCG и другие (С.Г.Огородников с соавт., 1986). Однако снижение гемоглобина крови наблюдается у весьма ограниченного контингента больных I - III стадии заболевания, а радиорезистентные опухоли втречаются значительно чаще. Поставка же кожных проб требует как дополнительных манипуляций с больным (пробу желательно ставить дважды: до облучения и в конце ЛТ, так как при радиочувствительных опухолях часто наблюдается смена отрицательных реакций на положительные), так и наличия специальных вакцин или реактивов. Кроме того, более или менее достоверно оценить радиочувствительность опухоли при применении данного метода можно лишь в конце облучения.
В качестве прототипа нами выбран простой и доступный способ прогнозирования радиочувствительности РМЖ по уровню зозинофилов периферической крови (М.А.Сеньчукова, 1994, Патент N 2099703), который заключается в том, что при уровне эозинофилов ≥ 4%, на 15-30 день от начала ЛТ, при уровне лимфоцитов ≥ 0,3 г/л, прогнозируют высокую чувствительность опухоли к облучению (лучевой патоморфоз III - IV степени), а при уровне эозинофидов < 4%, при том же количестве лимфоцитов прогнозируют низкую чувствительность опухоли к облучению (лучевой патоморфоз I - II степени).
Однако предложенный способ содержит целый ряд серьезных недостатков: оценить результаты проводимой терапии можно не ранее чем на 15 день от начала облучения, способ с вероятностью до 50% предсказывает опухоли, чувствительные к ЛТ, нет точных критериев радиорезистентного РМЖ.
Таким образом, проблема прогнозирования радиочувствительности злокачественных опухолей остается весьма актуальной и в наше время.
Новизна данного изобретения заключается в том, что впервые для прогнозирования радиочувствительности РМЖ используется определение показателей гуморальных иммунитета.
Сущность изобретения состоит в том, что до начала облучения у больных в сыворотке крови определяют количество Ig M и Ig G и в тех случаях, где уровень Ig M ≥ 1,7 г/л (независимо от уровня Ig G) или уровень Ig G ≥ 18,5 г/л (независимо от уровня Ig M) прогнозируют радиорезистентный РМЖ. Кровь для иммунологических исследований получают путем пункции локтевой вены. Количество иммуноглобулинов в сыворотке крови определяют общепринятым способом в реакции иммунодиффузии (Mancini et al, 1965).
Новый способ прогнозирования радиочувствительности РМЖ в отличие от прототипа позволяет прогнозировать радиорезистентные опухоли еще до начала облучения. В лучевой терапии прогнозирование именно радиорезистентных опухолей имеет наиболее актуальное значение, что связано с необходимостью коррекции проводимого лечения (назначения радиопротекторов, изменение режима фракционирования дозы). Способ не сложен, не требует дорогостоящей аппаратуры и реакторов и может быть широко использован в клинической практике.
Обследовано 112 больных РМЖ. Средний возраст 56,2 ± 8,3 лет. Всем больным проведен курс предоперационной лучевой терапии методом классического фракционирования дозы. Облучение проводилось на аппаратуре Луч-1 с 5 полей (1-2 поле - на первичную опухоль, 3-4-5 - на регионарные лимфоузлы: подмышечные, подключичные, надключичные, парастернальные). РД = 2 Гр., СД на опухоль молочной железы - 42-46 Гр., на регионарные лимфоузлы - 36-42 Гр. Длительность облучения составила 30-35 дней. На втором этапе, через 20-25 дней от окончания ЛТ больным проводилось оперативное лечение. В основном выполнялись типичные радикальные мастэктомии, в 3 случаях выполнены простые мастэктомии и в 1 - широкая секторальная резекция молочной железы. Эффективность лучевой терапии оценивалась морфологическим способом, по степени лучевого патоморфоза опухоли. Под лучевым патоморфозом (ЛП) понимают типовые изменения опухолевого процесса под влиянием лучевой терапии, имеющие характерные анатомо-клинические проявления (Е.Ф.Лушников, 1988).
I степени ЛП соответствуют слабо выраженные морфологические изменения. Раковые клетки умеренно полиморфные, с очаговыми дистрофическими и некротическими изменениями, особенно в центральных участках. Наличие митозов. Гистологическая структура определяется отчетливо.
При II степени ЛП морфологические изменения выражены умеренно, выявляются в паренхиматозных элементах рака. Усилен полиморфизм раковых клеток, нарастание дистрофических элементов - вакуолизации цитоплазмы и ядер, образование гигантских клеток, наличие некробиотических участков разных размеров в центре и по периферии опухоли. Митозов нет. Гистология сохранена. В строме пролиферация фибробластов, образование коллагеновых волокон.
III степень ЛП характеризуется сильно выраженными морфологическими изменениями. Гистологическую форму установить четко не удается. Морфологические изменения как в паренхиме, так и в строме. Раковые клетки характеризуются резким полиморфизмом. Уменьшение количества опухолевых клеток, отсутствие митозов. В строме склероз, гиалиноз.
При IV степени ЛП элементов опухоли не определяется. Соединительная ткань богатая волокнами, склероз, гиалиноз (Шнукашвили и соавт., 1974).
Опухоли с ЛП I - II степени оценивались как радиорезистентные (1 группа больных - 71 наблюдение), с ЛП III - IV степени - как радиочувствительные (2 группа больных 41 - наблюдение) (В.И.Чиссов и соавт., 1993).
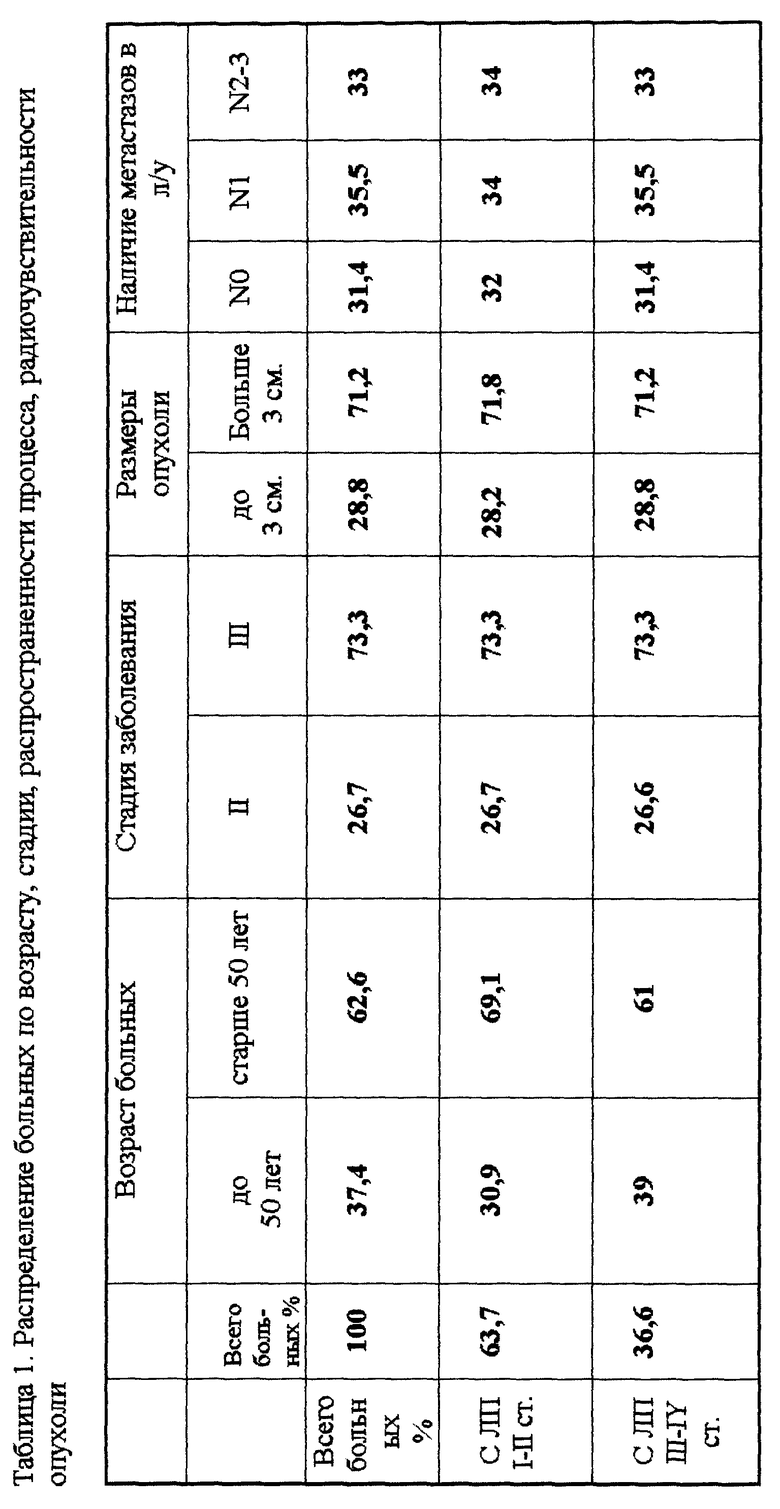
Распределение больных по возрасту, стадии, распространенности процесса, чувствительности опухоли к облучению представлено в табл. 1 - 2. Из этих данных видно, что в исследуемой группе больных преобладали больные старше 50 лет (62,6%), с III стадией РМЖ (73,3%), с размерами опухоли больше 3 см (71,2%). По радиочувствительности преобладали радиорезистентные опухоли с ЛП I - II степени (63,7%). Процент радиочувствительных опухолей был несколько выше в группе больных до 50 лет (42,1% и 33,7% соответственно), с размерами опухоли до 3 см. (40,7% и 35% соответственно), с единичными метастазами в регионарных лимфоузлах (40,4% и 34,2% и 32,4% соответственно).
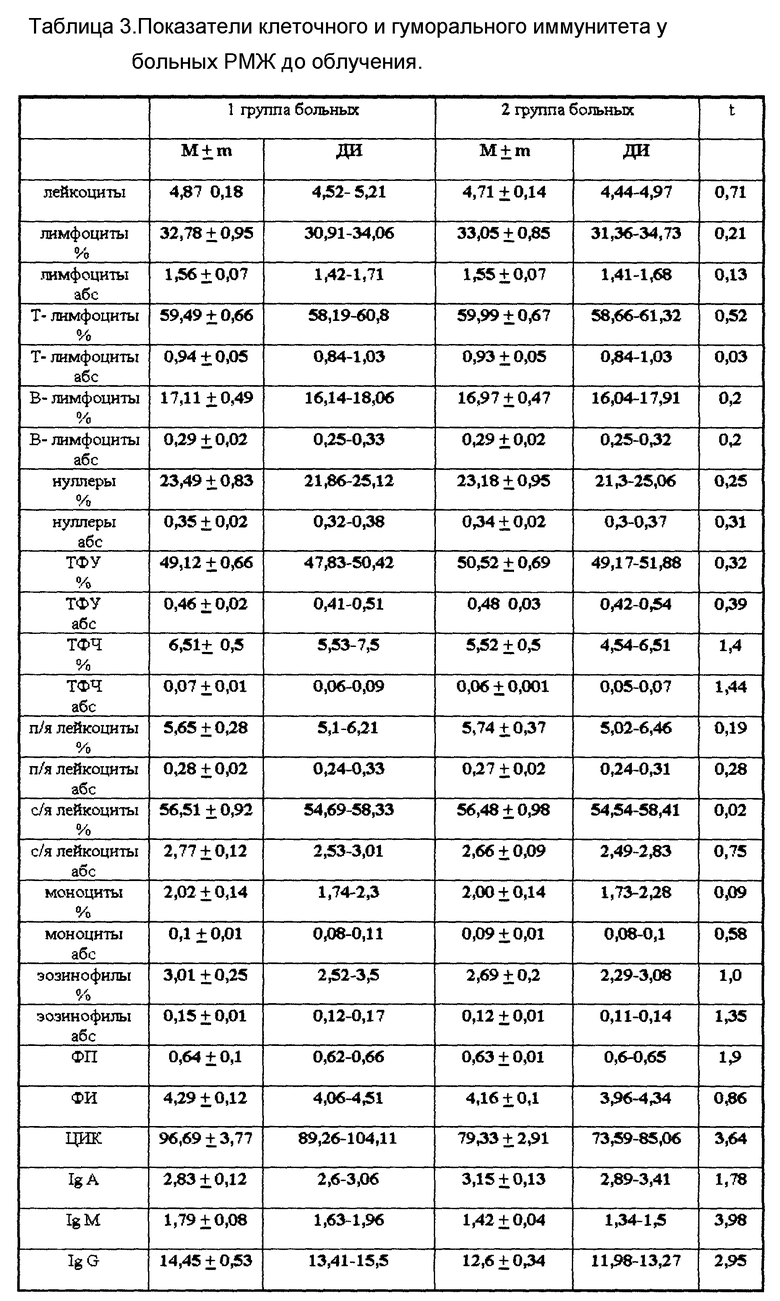
Иммунологические показатели исследовались до начала ЛТ. Изучались показатели клеточного (количество лейкоцитов, относительное и абсолютное число лимфоцитов и их субпопуляций: T- и B-лимфоцитов, нуллеров, теофиллин-устоуйчивых (ТФУ-) и теофиллинрезистентных (ТФЧ-) лимфоцитов, палочкоядерных и сегментоядерных лейкоцитов, моноцитов и эозинофилов, фагоцитарный показатель и фагоцитарный индекс) и гуморального иммунитета (количество Ig A, Ig M, Ig G и ЦИК).
Статическая обработка результатов исследования проводилась с использованием критерия Стьюдента (t). При проверке различий средних рассматривался уровень значимости P = 0,01, t кр = 2,66. Результаты исследования представлены в таблице 3.
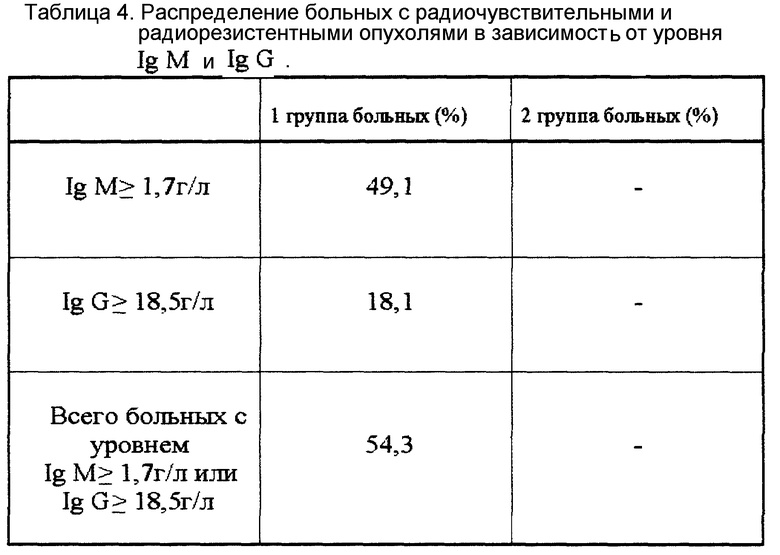
Проведенные исследования позволили установить, что у больных РМЖ с радиочувствительными и радиорезистентными опухолями имеются различия в уровне Ig M и Ig G, определяемых до начала ЛТ. Как видно из таблицы 3, уровень этих показателей у больных 1 группы достоверно выше (P < 0,01), чем у больных 2 группы. Характерным отличием между группами было то, что во 2 группе (таблица 4) не было больных с уровнем Ig M ≥ 1,7 г/л (49,1% больных 1 группы) и уровнем Ig G ≥ 18,5 г/л (18,1% больных 1 группы). Всего больных 1 группы, которые соответствовали бы приведенным выше условиям, было 54,3% от общего числа больных в этой группе. На основании этих данных был разработан новый способ прогнозирования радиорезистентного РМЖ, который позволяет более чем у половины больных прогнозировать опухоли, нечувствительные к ЛТ.
Достоверных различий между 1 и 2 группами больных по показателям клеточного иммунитета не выявлено.
Пример 1: Больная П., 45 лет, 14.01.98 г. Обратилась в ООД г. Оренбурга с жалобами на образование в правой молочной железе. 14.01.98 г. Пункция опухоли. Цитология N 641-43: клетки железистого рака. С 16.01 по 19.02.98 г. Больной проведен курс предоперационной ЛТ. СД на опухоль - 46 Гр., на регионарные лимфоузлы - 36-40 Гр.
16.01.98 иммунологическое обследование: Ig M - 2,62 г/л, Ig G - 13,68 г/л.
12.03.98 г. Больной выполнены операция радикальная мастэктомия по Пейти справа. Гистология N 3482-94: инфильтрирующий рак молочной железы с признаками ЛП II степени. В лимфоузлах метастазов не найдено.
Диагноз: Caglandulae mammae dextrae T3N0M0
Как видно из данного примера: уровень Ig M - 2,62 г/л (> 1,7 г/л), опухоль радиорезистентна.
Пример 2: Больная К., 52 лет, 8.11.97 г. Обратилаcь в ООД г. Оренбурга с жалобами на образование в правой молочной железе. 8.11.97 г. Пункция опухоли. Цитология N 21182-5: клетки солидно железистого рака. С 10.11. по 11.12.97 г. Больной проведен курс предоперационной ЛТ. СД на опухоль - 46 Гр., на регионарные лимфоузлы - 38-40 Гр.
9.11.97 иммунологическое обследование: Ig M - 1,31 г/л, Ig G - 23,36 г/л.
29.12.97 г. Больной выполнена операция радикальная мастэктомия по Холстеду справа. Гистология N 17867-79: инфильтрующий рак молочной железы с признаками ЛП II степени и метастазами в 3 подмышечных лимфоузлах.
Диагноз: Caglandulae mammae dextrae T2N2M0
Как видно из данного примера: уровень Ig G - 23,36 г/л (> 18,5 г/л), опухоль радиорезистентна.
Пример 3: Больная М., 46 лет, 26.11.97 г. Обратилась в ООД г. Оренбурга с жалобами на образование в левой молочной железе. 26.11.97 г. Пункция опухоли. Цитология N 23040: клетки железистого рака. С 28.11. по 24.12.97 г. Больной проведен курс предоперационной ЛТ. СД на опухоль - 46 Гр., на регионарные лимфоузлы - 38-42 Гр. 27.11.97 иммунологическое обследование: Ig M - 1,42 г/л, G - 10,64 г/л. 12.01.98 г. больной выполнена операция радикальная мастэктомия по Пейти справа. Гистология N220-32:Лучевой патоморфоз рака молочной железы III степени. В лимфоузлах метастазов не найдено.
Диагноз: Caglandulae mammae dextrae T2N2M0
Как видно из данного примера: у больной не наблюдалось повышения ни одного из показателей. Опухоль была радиочувствительной.
Таким образом, предложенный способ позволяет еще до начала облучения выявлять более чем половину больных (54,3%) с радиорезистентным РМЖ и вносить коррекцию в проводимое лечение. Способ не сложен, не требует дорогостоящих реактивов и оборудования и может быть широко применен в клинической практике.
Литература
1. Автандилов Г.Г., Сватко Л.Г., Алиметов Х.А. Изменение содержания ДНК в ядрах клеток рака глотки под влиянием лучевой терапии //Вопр. онкологии. - 1982, N4. - С.3-6.
2. Деденков А. Н. , Пелевина И.И., Саенко А.С. Прогнозирование реакции опухоли на лучевую и лекарственную терапию //Москва. - 1987. - С.46-51.
3. Денисенко О.Н. Гарантия качества лучевой терапии //Мед. радиология. - 1988. - N9. - С.36-40.
4. Габелов А.А., Жариков Г.М. Скорость регресса опухолей и эффективность лучевой терапии больных //Вопросы онкологии. - 1983. - N 6. - С.41-45.
5. Голдобенко Г.В., Исаев И.Г. Некоторые прогностические факторы при лучевом лечении больных раком пищевода //. Современные методы оценки эффективности лучевой терапии. - Обнинск, 1988. - С.39-44.
6. Замулаева И. А., Крикунова Л.И., Фурсова Т.И., Подгородниченко В.К. Иммунофлуоресцентное исследование пролиферативной активности опухолевых клеток для прогнозирования эффективности лучевой терапии рака шейки и тела матки // Современные методы оценки эффективности лучевой терапии. - Обнинск, 1988. - С.96-102.
7. Исмаилов В. И. Клональный анализ как способ прогнозирования реакции опухоли на облучение //Мед. радиология. - 1986, N 12. - С.41-47.
8. Лозинская И.Н., Калмыкова И.Я., Якимова Т.П. Состояние иммунитета и системы циклических нуклеотидов при лучевой терапии рака молочной железы // Мед. Радиология. - 1987. - N7. - С. 38-42.
9. Марадынский Ю.С., Андреев В.Г. Прогностическое значение регрессии опухоли в процессе лучевой терапии // Современные методы оценки эффективности лучевой терапии. - Обнинск, 1988. - С.34-39.
10. Огородников С. Г. , Щербань Э.И., Герасимяк В.Г. Прогностическое значение некоторых иммунологических показателей при лучевом лечении больных раком легкого и пищевода // Лабораторное дело. - 1986. - N6. - С. 355-357.
11. Пелевина И.И., Саенко А.С. Радиобиологические предпосылки прогнозирования реакции опухоли на облучение // Мед. радиология.- 1986. - N12. - С. 3-10.
12. Сеньчукова М.А. Способ прогнозирования чувствительности рака молочной железы к лучевой терапии. Патент N 2099703.
13. Хачкурузов С.Г., Черномордникова М.Ф., Савельева О.П. Оценка эффективности лучевого лечения рака молочной железы с помощью маммографии // Мед. радиология. - 1981. - N3. - С.47-51.
14. Чиссов В.И., Сергеева Н.С., Дарьялова С.Л. Пролиферативная активность рака желудка и оценка индивидуальной радиочувствительности. // Мед. радиология. - 1991. - N6. - С.8-14.
15. Atkim N. B., Kay R. Prognostic significance of modal DNA value and other factors in malignant tum ours based on 1465 cases // Brit. J. Cancer. - 1979. - Vol.40. - P.210-221.
16. Buch R.S., Jenkin R.D.T., Alt W.E.C. Definitive evidence of hypoxic cells influencihg cure in cancer therapy // Brit. J. Cancer. -1978. -Vjl.37. P.302-306.
17. Denekamp J. Tumor regression as a guide to prognosis: a study with experimental animals // Brit. J. Cancer. - 1981. - Vol.41, Suppl. 1Y. - P. 56-63.
18. Guichard M., Gosse C., Malaise E.P. Survival curve of human melanoma in nude mice // J. Nat. Cancer Inst. - 1977. - vol. 58. - P. 1665-1669.
19. Mancini G., Carbonara A.O., Hermans J.F. Immunochemical guntitation of antigen by single radial immunodiffision // Immunochemectry. - 1965. - Vol.2. - P.235-254.
20. Selby P.I., Steel G.G. Clonogenic cells survival in cryopserved human tumour cells // Brit. J. Cancer. - 1981. - Vol.43. - P.143.
21. Suit H. D., Lindberg R.D., Fletcher G.H. Prognostic ignificance of exten of tumor regression at completion of radiation therapy // Radiology. - 1965. - Vol.85. - P.100-107.
22. Utsumy H. Human melanoma cells: Relationship between their radiosensitivity and the repair of potentially lethal damage //KURRI Progr. Rept. 1993. - Osaka. - 1994. - P.294-295
23. Yip T.T., Ngan R.K., Lau W.F., Joab I., Cochet C., Cheng A.K. A Possible prognostic role of immunoglobulin-G antibody against recombinant Epstein-Barr virus BZLE-1 transativator protein ZEBRA in patents with nasopharyngeal carcinoma (see comments) //Cancer/ - 1994. - Nov.1, 74 (9). - P. 2397-2398.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЧУВСТВИТЕЛЬНОСТИ ОПУХОЛИ К ЛУЧЕВОЙ ТЕРАПИИ У БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ | 1994 |
|
RU2099703C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЧУВСТВИТЕЛЬНОСТИ ОПУХОЛИ К ЛУЧЕВОЙ ТЕРАПИИ У БОЛЬНЫХ РАКОМ ПРЯМОЙ КИШКИ | 2007 |
|
RU2349916C1 |
| СПОСОБ РАДИКАЛЬНОЙ РЕЗЕКЦИИ ПРИ РАКЕ ВНУТРЕННИХ КВАДРАНТОВ МОЛОЧНОЙ ЖЕЛЕЗЫ | 1996 |
|
RU2125408C1 |
| Способ прогнозирования резистентности к неоадъювантной химиотерапии у больных раком молочной железы | 2022 |
|
RU2802671C1 |
| СПОСОБ ЛЕЧЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 1993 |
|
RU2077268C1 |
| СПОСОБ ЛЕЧЕНИЯ МЕСТНО-РАСПРОСТРАНЕННОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2009 |
|
RU2402985C1 |
| СПОСОБ ПЕРВИЧНОЙ ПЛАСТИКИ МОЛОЧНОЙ ЖЕЛЕЗЫ ПОСЛЕ ЕЕ СУБТОТАЛЬНОЙ РАДИКАЛЬНОЙ РЕЗЕКЦИИ | 1999 |
|
RU2177265C2 |
| СПОСОБ ЛЕЧЕНИЯ МЕСТНЫХ РЕЦИДИВОВ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2004 |
|
RU2286818C2 |
| СПОСОБ ПЕРВИЧНОЙ ПЛАСТИКИ ДЕФЕКТА МОЛОЧНОЙ ЖЕЛЕЗЫ МАЛЫХ РАЗМЕРОВ ПОСЛЕ ЕЕ РАДИКАЛЬНОЙ РЕЗЕКЦИИ | 1998 |
|
RU2127086C1 |
| СПОСОБ КОМБИНИРОВАННОГО ЛЕЧЕНИЯ ОПЕРАБЕЛЬНОГО РАКА ЖЕЛУДКА | 2005 |
|
RU2304989C2 |

Изобретение относится к медицине, в частности к онкологии, и может найти применение при комбинированном и комплексном лечении больных раком молочной железы. До облучения в сыворотке крови определяют количество JgM и JgG. При значениях JgM больших или равных 1,7 г/л или JgG больших или равных 18,5 г/л прогнозируют радиорезистентный рак молочной железы. Способ не сложен, не требует дорогостоящих реактивов и оборудования, позволяет еще до начала облучения выявлять более чем половину больных с радиорезистентным раком молочной железы и вносить коррекцию в лечение. 4 табл.
Способ прогнозирования радиорезистентного рака молочной железы путем исследования показателей крови, отличающийся тем, что до облучения в сыворотке крови больных раком молочной железы определяют количество IgM и IgG и при значениях IgM ≥ 1,7 г/л (независимо от уровня IgG) или IgG ≥ 18,5 г/л (независимо от уровня IgM) прогнозируют радиорезистентный рак молочной железы.
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЧУВСТВИТЕЛЬНОСТИ ОПУХОЛИ К ЛУЧЕВОЙ ТЕРАПИИ У БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ | 1994 |
|
RU2099703C1 |
| Тележка для транспортировки и разгрузки породных кернов | 1959 |
|
SU129669A1 |
| ТРАНСФОРМАТОР С РЕГУЛИРУЕМЫМ КОЭФФИЦИЕНТОМ ТРАНСФОРМАЦИИ, СПОСОБ РЕГУЛИРОВАНИЯ ЕГО КОЭФФИЦИЕНТА ТРАНСФОРМАЦИИ И СПОСОБ КОНТРОЛЯ МОЩНОСТИ, ПОТРЕБЛЯЕМОЙ ИМ ОТ СЕТИ | 1996 |
|
RU2138872C1 |
| JP 62269071 A, 21.11.87 | |||
| US 4219539 A, 26.08.80 | |||
| УСТРОЙСТВО ПОДАЧИ ПРОВОЛОКИ ДЛЯ СВАРОЧНОЙ УСТАНОВКИ | 2015 |
|
RU2697088C2 |
| JP 59178361 A, 29.03.83. | |||
Авторы
Даты
1999-10-20—Публикация
1998-08-10—Подача