Изобретение относится к производным хиноксалиндиона, применяемым в лекарственных средствах, и способу их получения.
Известно, что производные хиноксалина обладают сродством к Quiqualat - рецепторам и на основании этого сродства пригодны в качестве лекарственных средств для лечения заболеваний центральной нервной системы. Предлагаемые согласно изобретению соединения соответствуют формуле (I):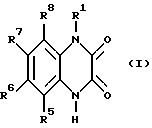
где R1 обозначает -(CH2)n-CR2H- (CH2)m-Z; и
R5, R6, R7, и R8 являются одинаковыми или разными и обозначают водород, (C1-C6)-алкил. CF3, нитро-группу, галоген, NR9R10, циано-группу; SOpR11; SO2NR12R13; SO3H; SO3(C1- C6) - алкил или OR14;
причем
R2 обозначает водород или (CH2)q-R3;
R3 обозначает водород, гидроксил, C1-C6 -алкоксил или HR15R16; "n", "m" и "q" каждый обозначают 0, 1, 2 или 3; Z обозначает POXY, OPOXY, OR17, NR18R19, NH-COR20, NH-SO2-R21, SO2R22, CO2R23, галоген, циано-группу или тетразол;
R11 обозначает H, (C1-C6)-алкил, фенил;
"p" обозначает 0, 1 или 2;
R12, R13, R17 и R23 обозначают водород или (C1-C4)-алкил;
R14 обозначает H или в случае необходимости 1-3-кратно замещенный галогеном (C1-C6)-алкил;
R20 и R21 обозначают (C1-C6) -алкил, в случае необходимости замещенный галогеном фенил или гетероарил;
R22 обозначает гидроксил, (C1-C6)-алкоксил или NR24R25;
X и Y являются одинаковыми или разными и обозначают гидроксил, (C1-C6)-алкоксил, (C1-C4)-алкил или NR18R19;
R9 и R10 являются одинаковыми или разными и обозначают водород, CO-(C1-C6)-алкил, фенил или (C1-C6)-алкил, который в случае необходимости может быть замещен (C1-C4)-алкоксилом или в случае необходимости моно- или дизамещенный (C1-C4)-алкилом амино-группой; или вместе с атомом азота образуют 5-7-членный насыщенный гетероцикл, который может содержать другой N-, S- или О-атом и может быть замещен; или образуют ненасыщенный 5-членный гетероцикл, который может содержать 1-3 N-атомов и может быть замещен;
R15 и R16, R18 и R19 являются одинаковыми или разными и обозначают водород, (C1-C4)-алкил, фенил или вместе с атомом азота образуют 5-7-членный насыщенный гетероцикл, который может содержать другой атом азота, серы или кислорода и может быть замещен, или образуют ненасыщенный 5-членный гетероцикл, который может содержать 1-3 N-атомов и может быть замещен;
R24 и R25 являются одинаковыми или разными и обозначают водород, (C1-C4) -алкил или вместе с атомом азота образуют насыщенный 5-7-членный гетероцикл, который может содержать другой атом кислорода, серы или азота;
а также их изомеры или соли;
причем, в случае, если R2 обозначает водород и Z обозначает POXY или CO2R23, то R5 - R8 не обозначают водород, и в случае, если R2 обозначает водород, Z обозначает POXY или CO2R23 и R5, R6, R7 или R8 обозначают CF3, No2, галоген, NH2 или метил, то имеются дизамещенные соединения формулы (I); и в случае, если R1 обозначает метанфосфоновую кислоту и R6 обозначает циано-группу или замещенный имидазол, то R5, R7 и R8 одновременно не могут обозначать водород; и в случае, если R1 обозначает метанфосфоновую кислоту и R6 обозначает CF3 или NO2 и R7 обозначает имидазол, то R5 и R8 одновременно не могут обозначать водород; и в случае, если R1 обозначает -CH2-COOH и R5 обозначает водород, то R6 и R7 одновременно не могут обозначать галоген или метил.
Соединения общей формулы (I) включают также возможные таутомерные формы и охватывают E- или Z- изомеры, или, если имеется хиральный центр, рацематы или энантиомеры.
Заместители предпочтительно находятся в положении 6 и/или 7.
Под алкилом каждый раз нужно понимать линейный или разветвленный алкильный остаток, как, например, метил, этил, пропил, изопропил, бутил, изобутил, втор. -бутил, пентил, изопентил, гексил, причем предпочтительны C1-C4-алкильные остатки.
Под галогеном каждый раз нужно понимать фтор, хлор, бром и иод, в особенности фтор, хлор и бром.
Если R9 и R10, R15 и R16, R18 и R19, R24 и R25, вместе с атомом азота образуют насыщенный гетероцикл, то он представляет собой, например, пиперидин, пирролидин, морфолин, тиоморфолин, гексагидроазепин или пиперазин. Гетероцикл может быть 1-3-кратно замещен (C1-C4)-алкилом или арилом, как фенил. Например, следует назвать N-метил-пиперазин, 2,6-диметилморфолин, или фенилпиперазин.
Если R9 и R10, R15 и R16; R18 и R19, вместе с атомом азота образуют ненасыщенный гетероцикл, то следует, например, назвать имидазол, пиразол, пиррол и триазол, которые могут быть одно - двукратно замещены циано-группой, C1-C4-алкилом, фенилом или CO2-(C1-C6)-алкилом.
Если соединение формулы I содержит кислотную функцию, то в качестве солей пригодны физиологически приемлемые соли органических и неорганических оснований, как, например, хорошо растворимые соли щелочных и щелочноземельных металлов, а также N-метил-глюкамин, диметилглюкамин, этил-глюкамин, лизин, 1,6-гексадиамин, этаноламин, глюкозамин, саркозин, серинол, три-гидрокси- метиламинометан, аминопропандиол, Sovak-основание, 1-амино- 2,3,4-бутантриол.
Если соединение формулы I содержит основную функцию, то пригодны физиологически приемлемые соли органических и неорганических кислот, как HCl, H2SO4, фосфорная кислота, лимонная кислота, винная кислота и другие.
В качестве гетероарильного остатка R20 и R21 принимают во внимание шестичленные гетероароматические соединения, как пиридин, пиразин, пиримидин и пиридазин.
Предпочтительны соединения с Z= -POXY, -OR17, -CO2R28 NR18R19, SO3H или тетразол, которые в положении 5,6,7 и/или 8 замещены C1-C6-алкилом, CF3, нитро-группой, галогеном, SOpR11, SO2NR12 R13 или NR9R10.
Особенно предпочтительны производные фосфоновой кислоты и карбоновой кислоты, которые могут быть одно - двукратно замещены. В особенности предпочтительные производные фосфоновой кислоты, которые в положении 5-8 двукратно замещены. Предпочтительными заместителями являются в особенности NR9R10 и CF3.
Соединения формулы (I), а также их физиологически приемлемые соли на основании своего сродства к АМРА-рецепторам применимы в качестве лекарственных средств. На основании своего профиля действия предлагаемые согласно изобретению соединения пригодны для лечения заболеваний, которые вызываются гиперактивностью возбуждающих аминокислот, как, например, глутамат или аспартат. Так как новые соединения действуют как антагонисты возбуждающих аминокислот и обладают высоким специфическим сродством к АМРА-рецепторам, тем, что они вытесняют радиоактивно маркированные специфические агонисты (RS)-α-амино-3- гидрокси-5-метил-4-изоксазолпропионата (АМРА) из АМРА-рецепторов, то они в особенности пригодны для лечения таких заболеваний, на которые влияют рецепторы возбуждающих аминокислот, в особенности АМРА-рецепторы.
Согласно изобретению, соединения можно применять для лечения неврологических и психиатрических нарушений, которые возбуждаются сверхстимуляцией АМРА-рецептора. К неврологическим заболеваниям, которые можно лечить функционально и профилактически, относятся, например, невродегенеративные нарушения, как болезнь Паркинсона, болезнь Альцгеймера, хорея Huntington, боковой амиотрофический склероз и оливо-мосто-мозжечковая дегенерация. Согласно изобретению, соединения можно применять для профилактики постишемической гибели клеток (Zelluntergangs), гибели клеток после травм головного мозга; при инсульте, гипоксии, аноксии и гипогликемии и для лечения старческого слабоумия, мультиинфарктной деменции, а также эпилепсии и спазм мышц. К психиатрическим заболеваниям относятся состояния страха, шизофрении, мигрени, болевые состояния, а также лечение расстройств сна и запрещающей симптоматики (Entzugssymptomatik) после злоупотребления лекарствами, как при запрещении употребления спирта, кокаина, бензодиазепина или опиата.
Для применения предлагаемых согласно изобретению соединений в качестве лекарственного средства их можно доводить до формы фармацевтического препарата, который наряду с биологически активным веществом содержит пригодные для кишечного или парентерального введения фармацевтические, органические или неорганические, инертные носители, как, например, вода, желатин, гуммиарабик, молочный сахар, крахмал, стеарат магния, тальк, растительные масла, полиалкиленгликоли и т.д. Фармацевтические препараты могут находиться в твердой форме, например, как таблетки, драже, свечи, капсулы, или в жидкой форме, например, как растворы, суспензии или эмульсии. В случае необходимости они содержат, кроме того, вспомогательные вещества, как консерванты, стабилизаторы, смачиватели или эмульгаторы, соли для изменения осмотического давления или буферы.
Для парентерального применения пригодны в особенности растворы для инъекций или суспензии, в особенности водные растворы активных соединений в полигидроксиэтоксилированном касторовом масле.
В качестве систем-носителей можно применять также поверхностно-активные вспомогательные вещества, как соли галловых кислот или животные или растительные фосфолипиды, однако, также их смеси, а также липосомы или их составные части.
Для орального применения в особенности пригодны таблетки, драже или капсулы, содержащие тальк и/или углеводородные носители или связующие, как, например, лактоза, кукурузный или картофельный крахмалы. Введение также можно осуществлять в жидкой форме, как, например, в виде сока, к которому в случае необходимости добавлено подслащивающее вещество.
Дозу биологически активных веществ можно изменять в зависимости от пути введения, возраста и веса пациента, рода и тяжести излечиваемого заболевания и подобных факторов. Суточная доза составляет 0,5-1000 мг, предпочтительно 50-200 мг, причем дозу можно вводить в виде одноразовой принимаемой дозы или в виде разделенных на 2 или большее количество суточных доз.
Получение предлагаемого согласно изобретению соединения осуществляют с использованием известных приемов. В частности, соединения формулы (I) можно получать тем, что
а) соединение формулы (II):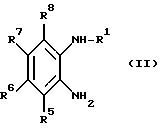
где R1 - R8 имеют вышеуказанное значение, циклизуют с щавелевой кислотой или реакционноспособными производными щавелевой кислоты; или
б) соединение формулы (III):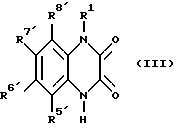
где R1 имеет вышеуказанные значения и один из заместителей R5', R6', R7' или R8' представляет собой отщепляемую группу, нуклеофильно замещают; и, при необходимости, затем омыляют сложноэфирную группу; или этерифицируют до сложноэфирной кислотную группу или амидируют кислотную группу; или восстанавливают нитрогруппу до амино-группы; или алкилируют или ацилируют амино- группу; или амино-группу обменивают на галоген или циано-группу; или вводят нитро-группу или галоген; или осуществляют расщепление простого эфира; или спирт переводят в галогенид; или этот галоген нуклеофильно замещают; или нитрил переводят в тетразол; или разделяют изомеры; или получают соли.
Циклизацию до соединений формулы (I) осуществляют с применением щавелевой кислоты известным образом, одностадийно, в кислой среде, или с применением реакционноспособного производного щавелевой кислоты одностадийно или также в две стадии. Предпочтителен двухстадийный способ, при котором диамин вводят во взаимодействие с производным щавелевой кислоты, как с хлорангидридом неполного сложного эфира щавелевой кислоты, или с реакционноспособными производными имидазолида щавелевой кислоты, в полярных растворителях, как циклические или ациклические простые эфиры или галогенированные углеводороды, например, тетрагидрофуран, диэтиловый эфир или метиленхлорид, в присутствии основания, как органические амины, например, триэтиламин, пиридин, основание хюнига или диметиламинопиридин. Последующую циклизацию можно осуществлять в основной или также в кислой, предпочтительно, однако, в кислой среде, причем в реакционную смесь в качестве агента растворения можно добавлять спирт.
Пригодные основания для двухстадийного способа представляют собой также гидриды щелочных металлов, как NаН; которые используют в инертных растворителях, как углеводороды или простые эфиры.
В качестве отщепляемых групп в варианте способа б), а также при получении исходных соединений формулы (II), пригодны галогены, как фтор, хлор, бром, иод, или О-мезилат, O-тозилат, О-трифлат или О-нонафлат. Нуклеофильное замещение осуществляют по известным из литературы методам в присутствии основания и благоприятствуют ему за счет активирующей электроакцепторной группы, как, например, нитро-группа, циано-группа, трифторметил, предпочтительно в О-положении.
В качестве нуклеофилов пригодны, например, первичные и вторичные амины; N-содержащие, ненасыщенные или насыщенные гетероциклы; цианид; алкоголяты; тиоляты и другие. Взаимодействие можно осуществлять в полярных растворителях, как спирты, галогенированные углеводороды, диметилацетамид, ацетонитрил или вода, или без растворителя. В качестве оснований пригодны неорганические основания, как гидроксиды или карбонаты щелочных или щелочноземельных металлов, или органические основания, как циклические, алициклические и ароматические амины, как ДБУ, основания Хюнига, пиридин или диметиламинопиридин. В качестве основания в случае аминов можно использовать сам нуклеофил в избытке, причем в случае необходимости можно работать без другого растворителя. При слишком низкой температуре кипения амина в случае необходимости можно работать в автоклаве под давлением.
Последующее, в случае необходимости, омыление сложноэфирной группы можно осуществлять основным или кислотным способом, тем, что гидролизуют при повышенной температуре вплоть до температуры кипения реакционной смеси, в присутствии кислот, как высококонцентрированная водная соляная кислота, в случае необходимости в растворителях, как, например, трифторуксусная кислота или спирты. Сложные эфиры фосфоновой кислоты гидролизуют предпочтительно путем нагревания в высококонцентрированных водных кислотах, как, например, концентрированная соляная кислота, в случае необходимости при добавке спирта, или путем обработки с помощью триметилсилилгалогенида в инертных растворителях, как, например, ацетонитрил, и последующей обработки водой.
Этерификацию до сложного эфира карбоновой кислоты или фосфоновой кислоты осуществляют само по себе известным образом с помощью соответствующего спирта при кислом катализе или в присутствии активированного производного кислоты. В качестве активированных производных кислоты принимают во внимание, например, хлорангидрид кислоты, имидазолид кислоты или ангидрид кислоты. В случае фосфоновых кислот этерификации до сложного эфира можно достигать путем взаимодействия со сложными ортоэфирами, в случае необходимости при добавке катализаторов, как п-толуолсульфокислота.
Амидирование осуществляют при использовании свободных кислот или их реакционноспособных производных, как, например, хлорангидриды, смешанные ангидриды, имидазолиды или азиды, путем введения их во взаимодействие с соответствующими аминами при комнатной температуре.
Восстановление нитро-группы до амино-группы осуществляют каталитически в полярных растворителях при комнатной температуре или при повышенной температуре. В качестве катализаторов пригодны металлы, как никель Ренея, или катализаторы на основе благородных металлов, как палладий или платина, в случае необходимости на носителях. Вместо водорода можно использовать известным образом также формиат аммония. Восстановители, как хлорид олова-(II) или хлорид титана-(III), можно применять так же, как комплексные гидриды металлов, возможно в присутствии солей тяжелых металлов. В качестве восстановителя также применимо железо. Реакцию проводят тогда в присутствии кислоты, например, уксусной кислоты, или хлорида аммония, в случае необходимости при добавке растворителя, как вода. Может оказаться предпочтительным введение сложноэфирной группы перед осуществлением реакции. При наличии нескольких нитро-групп в молекуле, желательную, находящуюся в орто-положении нитро-группу можно также обычным образом селективно восстанавливать с помощью Na2S.
Если желательно алкилирование амино-группы, то можно алкилировать обычными методами, например, с помощью алкилгалогенидов или по варианту Mitsonubo путем взаимодействия со спиртом в присутствии трифенилфосфина и сложного эфира азодикарбоновой кислоты, или амин подвергают восстановительному аминированию с помощью альдегидов или кетонов, в случае необходимости последовательно с двумя различными карбонильными соединениями, причем получают смешанные производные (см. литературу, например, Verardo и др., Syntesis 1993, 121; Syntesis 1991, 447; Kawaguchi, syntesis 1985, 701; Micovic и др., Syntesis 1991, 1043.
Ацилирование амино-группы осуществляют обычным образом, например, с помощью галоидангидрида кислоты или ангидрида кислоты, в присутствии основания, как диметиламинопиридин, в растворителях, как метиленхлорид, тетрагидрофуран или пиридин, или по варианту Скоттен-Бауманна в водном растворе при слабощелочном значении pH.
Введение циано-группы можно осуществлять с помощью реакции Зандмейера, например, промежуточно образовавшиеся из амино-соединений с нитрилами соли диазония можно вводить во взаимодействие с цианидами щелочных металлов в присутствии цианида меди-(I).
Введение галогенов, как хлор, бром или иод, через амино-группу можно осуществлять, например, также по Зандмейеру, тем, что промежуточно образующиеся с нитрилами соли диазония вводят во взаимодействие с хлоридом или бромидом меди (I) в присутствии соответствующей кислоты, как соляная кислота или бромоводородная кислота, или с иодидом калия. Когда используют сложный органический эфир азотистой кислоты, то галогены можно вводить, например, путем добавки метилениодида или тетрабромметана, в растворителе, как, например, диметилформамид.
Введение фтора осуществляют, например, путем реакции Balz - Shiemann при использовании тетрафторбората диазония.
Введение NO2-группы осуществляют путем ряда известных способов нитрования. Например, можно нитровать с помощью нитронийтетрафторбората в инертных растворителях, как галогенированные углеводороды, или в сульфолане, ледяной уксусной кислоте или ацетонитриле. Введение NO2-группы также можно осуществлять, например, с помощью нитрующей кислоты в концентрированной серной кислоте в качестве растворителя при температурах в пределах 0-30oC.
Введение галогена осуществляют известными способами галогенирования, как, например, путем электрофильного ароматического замещения.
Например, можно иодировать с использованием иода или йодноватой кислоты по Wirth и др. (Liebigs Ann. Chem., 634, 84, (1960)) или с использованием N-иод-сукцинимида, в растворителях, как тетрагидрофуран, диметилформамид или трифторметансульфокислота.
Расщепление простых эфиров осуществляют обычными способами, например, путем реакции с триметилбромсиланом, в случае необходимости при добавке иодида щелочного металла, в инертном растворителе, как ацетонитрил, при температуре от 0oC до температуры кипения растворителя.
Введение тетразола осуществляют путем взаимодействия соответствующего нитрила с азидом, как, например, триметилсилилазид, азотистоводородная кислота или азид натрия, в случае необходимости при добавке источника протонов, как, например, хлорид аммония или триэтиламмонийхлорид, в полярных растворителях, как диметилформамид, диметилацетамид или N- метилпирролидон, при температурах вплоть до температуры кипения растворителя.
Превращение спирта в галогенид осуществляют с использованием галоидангидридов кислот, как тионилхлорид или трибромид фосфора, с растворителем или без него. В качестве растворителя возможны галогенированные углеводороды, например, метиленхлорид, или простые эфиры.
Смеси изомеров можно разделять обычными методами, как, например, кристаллизация, хроматография или солеобразование, на энантиомеры соответственно, E/Z - изомеры.
Получение солей осуществляют обычным образом, тем, что раствор соединения формулы (I) смешивают с эквивалентным количеством или избытком основания или кислоты, которые в случае необходимости находятся в растворе, и осадок отделяют, или обычным образом обрабатывают раствор.
Если получение исходных соединений не описывается, то они известны или их получают аналогично известным соединениям, например, согласно заявке ВОИС 93/08171 или согласно описанным здесь способам.
Нижеследующие примеры должны пояснить предлагаемый согласно изобретению способ.
Получение исходных соединений
Пример 1. А).
2,05 г моно- трет-бутоксикарбонилэтилендиамина вместе с 1,25 г (0,86 мл) 4- фтор-3-нитро-1-трифторметил-бензола нагревают в течение 30 минут при температуре бани 50oC. При этом масса отверждается. Затем хроматографируют через силикагель с помощью смеси метиленхлорида с этанолом в соотношении 10:1. Получают 2,2 г [1-N-карбо-трет.- бутокси-2-N-(2-нитро-4-трифторметилфенил)] -этилендиамина.
B). N-(2-Нитро-4-трифторметилфенил)этилендиамин
2,2 г 1-N-карбо- трет-бутокси-2-N-(2-нитро-4-трифторметилфенил)-этилендиамина в 60 мл этанола нагревают с 60 мл 1н. соляной кислоты в течение 2-х часов при 110oC. После концентрирования получают 1,77 г N-(2- нитро-4-трифторметилфенил)этилендиамина в виде гидрохлорида.
C). [N-1-(Бензоил)-N-2-(2-нитро-4-трифторметилфенил)] этилендиамин
570 мг N-(2-Нитро-4-трифторметилфенил)этилендиамин-гидрохлорида в 15 мл метиленхлорида смешивают сначала с 424 мг триэтиламина и затем с 295 г бензоилхлорида. После перемешивания в течение 2-х часов при комнатной температуре экстрагируют дважды водой. Органическую фазу сушат, фильтруют и концентрируют. Получают 690 мг [N-1-(бензоил)-N-2-(2-нитро-4- трифторметилфенил)]этилендиамина. Аналогичным образом получают:
[N-1-(метансульфонил)-N-2-(2-нитро-4-трифторметилфенил)] этилендиамин; N-1-(4-хлор-бензоиламино)-N-2-(2-нитро-4- трифторметилфенил)-этилендиамин;
N-1-(никотиноиламино)-N-2-(2-нитро-4-трифторметилфенил)- этилендиамин; N-1-(фенилсульфониламино)-N-2-(2-нитро-4-трифторметилфенил)- этилендиамин.
Пример 2. A).1-(2-Нитро-4-трифторметилфениламино)-2- метоксиэтан
3,75 г 2-Метоксиэтиламина и 10,5 г 4-фтор-3-нитро-1- трифторметилбензола в 200 мл воды вместе с 10 г карбоната натрия нагревают при температуре бани 100oC в течение 2-х часов. При охлаждении осаждается продукт, который можно выделять путем отсасывания (9,8 г). Водный маточный раствор подкисляют с помощью 4н. соляной кислоты и экстрагируют трижды по 100 мл этилацетатом. Объединенные органические экстракты сушат, фильтруют и концентрируют. Получают еще 2,7 г. Общий выход составляет 12,5 г 1-(2-нитро-4-трифторметилфенил)амино-2-метоксиэтана.
Пример 3. A)
1,1 г 2,4-Дифторнитробензола вместе с 2,8 г диэтилового эфира аминометанфосфоновой кислоты нагревают в течение 2-х часов при 40oC. Затем хроматографируют через силикагель с помощью смеси метиленхлорида с этанолом в соотношении 10: 1. Получают 1,6 г диэтилового эфира N-(2-нитро-5- фторфенил)аминометанфосфоновой кислоты.
Аналогичным образом получают: диэтиловый эфир
N-(2-нитро-4-фторфенил)аминометанфосфоновой кислоты;
диэтиловый эфир 1-[N-(2-нитро-4-фторфенил)амино]этанфосфоновой кислоты;
диэтиловый эфир 1-[N-(2-нитро-5-фторфенил)амино]этанфосфоновой кислоты;
диэтиловый эфир 1-(2-нитро-4-трифторметилфениламино)-4- метоксипропанфосфоновой кислоты.
B)
331 мг Диэтилового эфира N- бензофенониминилметанфосфоновой кислоты вводят вместе с 40 мг Aliquat 336 и с 209 мг 2-метокси-1-бромэтана и при 0oC смешивают с 280 мг порошкообразного гидроксида калия, затем перемешивают в течение 3,5 часов при комнатной температуре. Смесь смешивают с метиленхлоридом и 180 мг силикагеля, кратковременно перемешивают и отсасывают. Концентрированный фильтрат хроматографируют через силикагель с помощью смеси циклогексана с этил-ацетатом в соотношении 1:1. Получают 180 мг диэтилового эфира 2-(N- бензофенониминил)-4-метокси-пропанфосфоновой кислоты.
C).
2,0 г Диэтилового эфира 2-(N-бензофенониминил)-4-меток-сипропанфосфоновой кислоты в 30 мл 1н. HCl и 30 мл диэтилового эфира перемешивают 3 часа при комнатной температуре. Органическую фазу отделяют, а водную фазу еще раз экстрагируют диэтиловым эфиром. Органическая фаза содержит бензофенон, и ее отбрасывают. Водную фазу концентрируют досуха, обрабатывают 15 мл насыщенного раствора хлорида натрия, нейтрализуют с помощью Na2CO3 и экстрагируют трижды по 50 мл метиленхлорида. Органическую фазу сушат, фильтруют и концентрируют, получая 800 мг диэтилового эфира 2-амино-4-метокси- пропанфосфоновой кислоты.
Пример 4. А).
790 мг Диэтилового эфира N-(2-нитро-5-фторфенил)амино-метанфосфоновой кислоты в 50 мл этанола смешивают с 2,5 г никеля Ренея и гидрируют при нормальном давлении водорода при комнатной температуре в течение 2-х часов. После отсасывания катализатора фильтрат концентрируют. Получают 660 мг диэтилового эфира N-(2-амино-5-фторфенил)аминометанфосфоновой кислоты.
Аналогичным образом получают:
диэтиловый эфир N-(2-амино-4-фторфенил)аминометанфосфоновой кислоты; диэтиловый эфир 1-[(2-амино-4-трифторметил-фенил) амино]-4-метоксипропанфосфоновой кислоты;
диэтиловый эфир 1-[N-(2-амино-4-фторфенил)амино]этанфосфоновой кислоты;
диэтиловый эфир 1-[N-(2-амино-5-фторфенил)амино]этанфосфоновой кислоты;
1-(2-амино-5-трифторметилфенил)амино-2-метокси-этан;
N-1-(метансульфонил)-N-2-(2-амино-4-трифторметилфенил) этилендиамин;
N-1-(бензоиламино)-N-2-(2-амино-4-трифторметилфенил)этилендиамин;
N-1-(4-хлор-бензоиламино)-N-2-(2-амино-4-трифторметилфенил)этилендиамин;
N-1-(никотиноиламино)-N-2-(2-амино-4-трифторметилфенил)этилендиамин;
N-1-(фенилсульфониламино)-N-2-(2-амино-4-трифторметилфенил) этилендиамин.
Получение целевых соединений
Пример 5: Диэтиловый эфир (7-фтор-1,2,3,4-тетрагидро-2,3- диоксо-хиноксалин-1-ил)-метанфосфоновой кислоты
660 мг Диэтилового эфира N-(2-амино-5- фторфенил)-аминометанфосфоновой кислоты в 70 мл абсолютного тетрагидрофурана смешивают с 509 мг триэтиламина. К этому раствору медленно прикапывают раствор 685 мг хлорангидрида этилового эфира щавелевой кислоты в 30 мл тетрагидрофурана. Смесь перемешивают в течение 4-х часов при комнатной температуре. После отсасывания осадившихся солей, фильтрат концентрируют, затем в смеси из 23 мл этанола с 23 мл 1н. соляной кислоты кипятят в течение 2-х часов при температуре бани 110oC. Концентрируют досуха и остаток хроматографируют через силикагель с помощью смеси метиленхлорида с этанолом в соотношении 10:1. Получают 561 мг диэтилового эфира (7-фтор-1,2,3,4-тетрагидро-2,3- диоксо-хиноксалин-1-ил) метанфосфоновой кислоты.
Аналогичным образом получают: диэтиловый эфир (6-фтор-1,2,3,4- тетрагидро-2,3-диоксо-хиноксалин-1-ил) метанфосфоновой кислоты;
диэтиловый эфир 1-[(7-фтор-1,2,3,4-тетрагидро-2,3-диоксо-хиноксалин- 1-ил)]этанфосфоновой кислоты;
диэтиловый эфир 1-[(6-фтор-1,2,3,4-тетрагидро-2,3- диоксо-хиноксалин-1-ил]этанфосфоновой кислоты.
В принципе, аналогичным образом получают:
6-трифторметил-1-(1-метоксиэт-ил-2-)-1,2,3,4-тетрагидро-2,3- диоксо-хиноксалин; т.пл. = 244,4oC,
6-трифторметил-1-(1-N-бензоиламино-эт-ил-2)-1,2,3,4-тетрагидро- 2,3-диоксо-хиноксалин; т.пл. = 275oC,
6-трифторметил-1-(1-N-метансульфониламиноэт-ил-2)-1,2,3,4-тетрагидро- 2,3-диоксо-хиноксалин; т.пл. = 287,5oC,
диэтиловый эфир 1-(6-трифторметил-1,2,3,4-тетрагидро-2, 3-диоксо-хиноксалин-1-ил)-3-метокси-пропанфосфоновой кислоты;
6-трифторметил-1-(1-N-фенилсульфониламиноэт-ил-2)-1,2,3,4-тетрагидро- 2,3-диоксо-хиноксалин; т.пл. > 250oC,
6-трифторметил-1-(1-N-никoтинoилaминоэтил-2)-1,2,3,4- тетрагидро-2,3-диоксо-хиноксалин; т.пл. 269,8oC,
6-трифторметил-1-(1-N-4-хлор-бензоиламиноэт-ил-2)-1,2,3,4- тетрагидро-2,3-диоксо-хиноксалин, т.пл. > 300oC.
Пример 6
1 г 6-Трифторметил-1-(1-метоксиэт-ил-2)-1,2,3,4-тетрагидро-2,3- диоксо-хиноксалина в 20 мл абсолютного ацетонитрила смешивают с 3,15 мл триметилбромсилана и 1,4 г иодида натрия и нагревают в течение 1 часа при температуре бани 80oC. После добавки 25 мл воды экстрагируют этилацетатом. Органическую фазу отделяют, концентрируют и хроматографируют через силикагель с помощью смеси толуола с ледяной уксусной кислотой и водой в соотношении 10: 10: 1. После концентрирования соответствующих фракций и перемешивания с этанолом получают 330 мг 6-трифторметил-1-(1-гидрокси-эт-ил-2)-1,2, 3,4-тетрагидро-2,3-диоксо-хиноксалиндиона.
Пример 7
615 мг Диэтилового эфира (7-фтор-1,2,3,4-тетрагидро-2,3-диоксо- хиноксалин-1-ил)метанфосфоновой кислоты в 60 мл метиленхлорида смешивают с 743 мг нитронийтетрафторбората. Смесь перемешивают 2 часа при комнатной температуре. Смешивают с 50 мл воды и после отделения органической фазы трижды экстрагируют метиленхлоридом. Объединенную органическую фазу сушат, фильтруют и концентрируют. Остаток хроматографируют через силикагель с помощью смеси метиленхлорида с этанолом в соотношении 10:1. Получают 350 мг диэтилового эфира (6-нитро-7-фтор-1,2,3,4-тетрагидро-2,3- диоксо-хиноксалин-1-ил)метанфосфоновой кислоты, т.пл. 147,7oC.
В принципе аналогичным образом получают:
диэтиловый эфир (6-фтор-7-нитро-1,2,3,4-1,2,3,4-тетрагидро-2,3- диоксо-хиноксалин-1-ил)метанфосфоновой кислоты; т.пл., 218,9oC;
диэтиловый эфир 1-[(6-фтор-7-нитро-1,2,3,4-тетрагидро-2,3- диоксо-хиноксалин-1-ил)]этанфосфоновой кислоты;
диэтиловый эфир 1-[(7-фтор-6-нитро-1,2,3,4-тетрагидро-2, 3-диоксо-хиноксалин-1-ил)]этанфосфоновой кислоты;
диэтиловый эфир 1-[(6-трифторметил-7-нитро-1,2,3,4- тетрагидро-2,3-диоксо-хиноксалин-1-ил)]этанфосфоновой кислоты;
диэтиловый эфир N-[(6-трифторметил-7-нитро-1,2,3,4-гетрагидро- 2,3-диоксо-хиноксалин-1-ил)]метанфосфоновой кислоты;
N-[(6-трифторметил-7-нитро-1,2,3,4-тетрагидро-2, 3-диоксо-хиноксалин-1-ил)]ацетонитрил.
Пример 8
140 мг Диэтилового эфира (6-нитро-7-фтор- 1,2,3,4-тетрагидро-2,3-диоксо-хиноксалин-1-ил) метанфосфоновой кислоты вместе со 129 мг морфолина нагревают 1,5 часа при температуре бани 120oC. После концентрирования в вакууме остаток хроматографируют через силикагель с помощью смеси толуола с ледяной уксусной кислотой и водой в соотношении 10:10:1. После концентрирования соответствующих фракций получают 300 мг диэтилового эфира (7-морфолино-6-нитро-1,2,3,4-тетрагидро-2,3- диоксо-хиноксалин-1-ил) метанфосфоновой кислоты.
Аналогичным образом получают:
диэтиловый эфир [6-(N-имидазолил)-7-нитро-1,2,3,4-тетрагидро- 2,3-диоксо-хиноксалин-1-ил]метанфосфоновой кислоты;
диэтиловый эфир 1-[6-(N-имидазолил)-7-нитро-1,2,3,4- тетрагидро-2,3-диоксо-хиноксалин-1-ил]этанфосфоновой кислоты;
диэтиловый эфир 1-[7-(N-имидазолил)-6-нитро-1,2,3,4-тетрагидро- 2,3-диоксо-хиноксалин-1-ил]этанфосфоновой кислоты;
диэтиловый эфир (6-морфолино-7-нитро-1,2,3,4-тетрагидро-2,3- диоксо-хиноксалин-1-ил)-метанфосфоновой кислоты;
диэтиловый эфир 1-[(6-мopфoлинo-7-нитpo-1,2,3,4-тетрагидро-2,3- диоксо-хиноксалин-1-ил)]этанфосфоновой кислоты;
диэтиловый эфир 1-[7-морфолино-6-нитро-1,2,3,4-тетрагидро-2,3- диоксо-хиноксалин-1-ил)]этанфосфоновой кислоты;
диэтиловый эфир 1-[7-(2-метоксиэтиламино-6-нитро-1,2,3,4-тетрагидро- 2,3-диоксо-хиноксалин-1-ил)]метанфосфоновой кислоты;
диэтиловый эфир 1-[(7-N-мeтилпипepaзинил-6-нитpo-1,2, 3,4-тетрагидро-2,3-диоксо-хиноксалин-1-ил)]метанфосфоновой кислоты; т.пл. 300oC,
диэтиловый эфир 1-[7-(4-метилимидазол-1-ил)-6-нитро-1,2,3,4- тетрагидро-2,3-диоксо-хиноксалин-1-ил]метанфосфоновой кислоты;
диэтиловый эфир 1-[7-(2-метилимидазол-1-ил)-6-нитро-1,2,3,4- тетрагидро-2,3-диоксо-хиноксалин-1-ил]метанфосфоновой кислоты;
диэтиловый эфир 1-[7-(2,4-диметилимидазол-1-ил)-6-нитро-1,2, 3,4-тетрагидро-2,3-диоксо-хиноксалин-1-ил]метанфосфоновой кислоты;
диэтиловый эфир (7-тиоморфолино-6-нитро-1,2,3,4-тетрагидро-2,3- диоксо-хиноксалин-1-ил)метанфосфоновой кислоты;
диэтиловый эфир (7-N,N-дипропиламино-6-нитро-1,2,3,4-тетрагидро-2,3- диоксо-хиноксалин-1-ил)метанфосфоновой кислоты;
диэтиловый эфир (7-N,N-дипропиламино-6-нитро-1,2,3,4- тетрагидро-2,3-диоксо-хиноксалин-1-ил) этанфосфоновой кислоты;
диэтиловый эфир (7-N-метил-N-пропиламино-6-нитро-1,2,3,4-тетрагидро- 2,3-диоксо-хиноксалин-1-ил)метанфосфоновой кислоты;
диэтиловый эфир N-[7-(1,2,4-тpиaзoл-1-ил)-6-нитpo-1,2,3,4- тетрагидро-2,3-диоксо-хиноксалин-1-ил]метанфосфоновой кислоты.
Пример 9
375 мг диэтилового эфира (7-фтор-6-нитро-1,2,3,4- тетрагидро-2,3-диоксо-хиноксалин-1-ил)метанфосфоновой кислоты добавляют к раствору, который приготовлен из 200 мг трифторэтанола, 60 мг гидрида натрия (80%-ного) и 20 мл абсолютного тетрагидрофурана. Затем нагревают 4,5 часа при температуре 70oC. Смесь концентрируют, обрабатывают остаток с помощью 50 мл воды, подкисляют 1н. соляной кислоты и экстрагируют трижды этилацетатом. Органическую фазу сушат, фильтруют и концентрируют. Остаток хроматографируют через силикагель смесью толуола с ледяной уксусной кислотой и водой в соотношении 10: 10: 1. После концентрирования и перемешивания с этанолом получают 19 мг диэтилового эфира (6-нитро-7-трифторэтокси-1,2,3,4-тетрагидро- 2,3-диоксо-хиноксалин-1-ил)метанфосфоновой кислоты.
1H-ЯМР (ДМСО):
1,2(t, 7,5 Гц, 6H), 4,05(p, 7,5 Гц, 4H), 4,8(d, 10 Гц, 2H), 4,85(q, 7,5 Гц, 2H), 7,3(s, 1H), 7,7(s, 1H).
Пример 10
259 г диэтилового эфира (6-нитро-7-морфолино-1,2,3,4-тетрагидро- 2,3-диоксо-хиноксалин-1-ил)метанфосфоновой кислоты в 10 мл абсолютного ацетонитрила смешивают с 628 мг триметилбромсилана и перемешивают 1 час при комнатной температуре. Добавляют воду и концентрируют. Остаток хроматографируют через силанизированный силикагель метанолом. Получают 60 мг (6-нитро-7-морфолино-1,2,3,4- тетрагидро-2,3-диоксо-хиноксалин-1-ил)метанфосфоновой кислоты.
Аналогичным образом получают:
1-(6-трифторметил-1,2,3,4-тетрагидро-2,3-диоксо-хиноксалин- 1-ил)-3-метоксипропан-фосфоновую кислоту;
(6-морфолино-7-нитро-1,2,3,4-тетрагидро-2,3-диоксо-хиноксалин-1- ил)-метанфосфоновую кислоту; т.пл. 240oC,
1-[(6-мopфoлинo-7-нитpo-1,2,3,4-тетрагидро-2,3-диоксо-хиноксалин-1- ил)] этанфосфоновую кислоту;
1-[(7-морфолино-6-нитро-1,2,3,4-тетрагидро-2,3-диоксо-хиноксалин-1- ил)] этанфосфоновую кислоту;
1-[7-(2-метоксиэтиламино-6-нитро-1,2,3,4-тетрагидро-2,3- диоксо-хиноксалин-1-ил)]метанфосфоновую кислоту; т.пл. > 300oC,
1-[(7-N-метилпиперазинил-6-нитро-1,2,3,4-тетрагидро-2,3- диоксо-хиноксалин-1-ил)]метанфосфоновую кислоту; т.пл. > 250oC;
(7-тиоморфолино-7-нитро-1,2,3,4-тетрагидро-2,3-диоксо-хиноксалин- 1-ил)метанфосфоновую кислоту; т.пл. > 300oC,
[(6-трифторметил-7-морфолино-хиноксалин-2,3-дион)-1- ил]метанфосфоновую кислоту; т.пл. > 300oC;
1H-ЯМР-спектр в ДМСО, δ , м.д. (миллионных долей):7,9 (с., 1H); 7,4 (с., 1H); 4,6 (д., J= 11 Гц, 2H); 3,7 (т., J= 5 Гц, 2H); 2,9 (т., 7 = 5 Гц, 2H).
Аналогичным образом получают:
[(6-тpифтopмeтил-7-[пипepидин-1-ил] xинoкcaлин-2,3-дион)-1- ил] метанфосфоновую кислоту; т.пл. > 300oC;
[(6-трифторметил-7-[2,6-диметил-(морфолин-1-ил)] хиноксалин-2,3- дион)-1-ил]-метанфосфоновую кислоту; т.пл. > 300oC,
[(6-трифторметил-7-(гексагидроазепин-1-ил)хиноксалин-2,3-дион)- 1-ил]-метанфосфоновую кислоту; т.пл. > 300oC,
[(6-тpифтopмeтил-7-[(4-фeнилпипepaзин-1-ил)хиноксалин-2,3-дион)- 1-ил] -метанфосфоновую кислоту; т.пл. > 300oC,
1-[(6-трифторметил-7-[морфолин-1-ил] хиноксалин-2,3- дион)-1-ил] -этанфосфоновую кислоту, т.пл. > 300oC,
Пример 11
250 мг Диэтилового эфира [(6-N-имидaзoлил)-7- нитpo-1,2,3,4-тетрагидро-2,3-диоксо-хиноксалин-1- ил]метанфосфоновой кислоты нагревают в 3 мл концентрированной соляной кислоты в течение 2,5 часов при температуре бани 110oC. После концентрирования, остаток обрабатывают водой и осадившийся продукт отсасывают. Получают 100 мг [6-(N-имидазолил)-7-нитро- 1,2,3,4-тетрагидро-2,3-диоксо-хиноксалин-1-ил]метанфосфоновой кислоты, т.пл. > 300oC.
Аналогичным образом получают:
(6-нитро-7-фтор-1,2,3,4-тетрагидро-2,3-диоксо-хиноксалин-1-ил)- метанфосфоновую кислоту; т.пл. 193 - 195oC.
(7-нитро-6-фтор-1,2,3,4-тетрагидро-2,3-диоксо-хиноксалин-1-ил) метанфосфоновую кислоту;
1-[6-(N-имидазолил)-7-нитро-1,2,3,4-тетрагидро-2,3-диоксо- хиноксалин-1-ил]-этанфосфоновую кислоту;
1-[7-(N-имидазолил)-6-нитро-1,2,3,4-тетрагидро-2,3-диоксо-хиноксалин- 1-ил]этанфосфоновую кислоту;
1-[(6-фтор-7-нитро-1,2,3,4-тетрагидро-2,3-диоксо-хиноксалин-1-ил)] этанфосфоновую кислоту;
1-[(7-фтор-6-нитро-1,2,3,4-тетрагидро-2,3-диоксо-хиноксалин-1- ил)] -этанфосфоновую кислоту;
1-[7-(2-метилимидазол-1-ил)-6-нитро-1,2,3,4-тетрагидро-2,3- диоксо-хиноксалин-1-ил]метанфосфоновую кислоту;
1-[7-(4-метилимидазол-1-ил)-6-нитро-1,2,3,4-тетрагидро-2,3- диоксо-хиноксалин-1-ил]метанфосфоновую кислоту;
1-[7-(2,4-диметилимидазол-1-ил)-6-нитро-1,2,3,4-тетрагидро-2,3- диоксо-хиноксалин-1-ил]метанфосфоновую кислоту; т.пл. > 300oC;
(7-N, N-дипропиламино-6-нитро-1,2,3,4-тетрагидро-2,3-диоксо- хиноксалин-1-ил)метанфосфоновую кислоту;
(7-N, N-дипропиламино-6-нитро-1,2,3,4-тетрагидро-2,3-диоксо- хиноксалин-1-ил)-этанфосфоновую кислоту;
(7-N-метил-N-пропиламино-6-нитро-1,2,3,4-тетрагидро-2,3-диоксо- хиноксалин-1-ил)метанфосфоновую кислоту;
1-[(6-тpифтopмeтил-7-имидaзoлил-xинoкcaлин-2,3-дион)-1-ил] этанфосфоновую кислоту;
1-[(6-трифторметил-7-(4-метилимидазол-1-ил-хиноксалин-2,3-дион)- 1-ил] -метанфосфоновую кислоту;
N-(6-трифторметил-7-амино-1,2,3,4-тетрагидро-2,3-диоксо-хиноксалин- 1-ил)-метанфосфоновую кислоту;
1-(6-трифторметил-7-амино-1,2,3,4-тетрагидро-2,3-диоксо-хиноксалин- 1-ил)этанфосфоновую кислоту;
1-[(6-трифторметил-7-(пиперидин-1-ил)хиноксалин-2,3-дион)-1- ил]этанфосфоновую кислоту;
1-[(6-тpифтopмeтил-7-[пипepидин-1-ил]xинoкcaлин-2,3-дион)-1- ил]-уксусную кислоту;
N-[6-трифторметил-7-амино-1,2,3,4-тетрагидро-2,3-диоксо-хиноксалин- 1-ил]-уксусную кислоту;
1-[6-трифторметил-7-пропиламино-1,2,3,4-тетрагидро-2,3-диоксо- хиноксалин-1-ил]этан-1-фосфоновую кислоту;
1-[6-трифторметил-7-гексиламино-1,2,3,4-тетрагидро-2,3- диоксо-хиноксалин-1-ил]этан-1-фосфоновую кислоту;
N-[(6-тpифтopмeтил-7-[гeкcилaминo-1]xинoкcaлин-2,3-дион)-1-ил]- метанфосфоновую кислоту;
N-[(6-тpифтopмeтил-7-[пeнтил-1-aминo]xинoкcaлин-2,3-дион)-1- ил]-метанфосфоновую кислоту;
N-[(6-тpифтopмeтил-7-(гексил-2-амино)-хиноксалин-2,3-дион)-1- ил] -метанфосфоновую кислоту;
N-[7-(1,2,4-триазол-1-ил)-6-нитро-1,2,3,4-тетрагидро-2,3-зиноксалин- 1-ил]метанфосфоновую кислоту.
Пример 12: Диэтиловый эфир N-(6-трифторметил-7-морфолино- хиноксалин-2,3-дион-1-ил)метанфосфоновой кислоты
A.
3,3 г (30 ммоль) Аминометанфосфоновой кислоты в 120 мл воды и 120 мл этанола объединяют вместе с 3,37 г (31,8 ммоль) карбоната натрия и смешивают с 7,8 г (97%-ного, 30 ммоль) 3- трифторметил-4,6-дихлорметил-4,6-дихлорнитробензола и перемешивают в течение 4-х часов с обратным холодильником при температуре бани 120oC. После удаления этанола на ротационном испарителе, экстрагируют трижды по 100 мл этилацетатом. Органическую фазу промывают небольшим количеством воды. Она содержит исходный материал, и ее отбрасывают. Объединенную водную фазу подкисляют до pH 1 с помощью 4н. соляной кислоты и экстрагируют трижды по 100 мл этилацетатом. Органическую фазу промывают водой, сушат, фильтруют и концентрируют. Получают 6,85 г (68 % от теории) N-(2-нитро-4-трифторметил-6-хлор-фенил) аминометанфосфоновой кислоты с т.пл. 207,3oC.
Аналогичным образом получают:
1-[(2-нитро-4-трифторметил-5-хлор-фенил)амино]этанфосфоновую кислоту.
B.C.
6,85 г (20,5 ммоль) N-(2-нитро-4-трифторметил-5-хлор- фенил)аминометанфосфоновой кислоты в 20 мл морфолина перемешивают 3,5 часа при температуре бани 120oC. Выпаривают на ротационном испарителе досуха и остаток вместе со 100 мл триэтилового эфира ортомуравьиной кислоты и 779 мг (41 ммоль) п-толуолсульфокислоты нагревают 3,8 часа при температуре бани 150oC. После концентрирования на ротационном испарителе досуха остаток обрабатывают 100 мл воды, смешивают с NaCl и трижды экстрагируют по 100 мл этилацетата. Объединенную этилацетатную фазу промывают разбавленным раствором хлорида натрия, сушат, фильтруют и концентрируют. Выход диэтилового эфира N-(2-нитро-4-трифторметил- 5-морфолино-фенил)аминометанфосфоновой кислоты составляет 10,6 г (> 100% от теории; содержит еще морфолингидрохлорид).
D.
10,6 г (примерно 20 ммоль) Диэтилового эфира N-(2-нитро-4- трифторметил-5-морфолино-фенил)аминометанфосфоновой кислоты в 250 мл этанола гидрируют в присутствии 4,5 г палладия- на-угле (10%-ного) при нормальном давлении водорода при комнатной температуре в течение 3,5 часов. После отсасывания катализатора через силикагель и концентрирования фильтрата получают 9,2 г (>100% от теории; содержит еще морфолингидрохлорид) диэтилового эфира N-(2-амино-4-трифторметил-5-морфолино-фенил) аминометанфосфоновой кислоты.
Аналогичным образом, согласно B.C.D., получают:
диэтиловый эфир N-(2-амино-4-трифторметил-5-пиперидино-фенил) аминометанфосфоновой кислоты;
диэтиловый эфир N-(2-амино-4-трифторметил-5-/2,6-диметил- морфолино/-фенил) аминометанфосфоновой кислоты;
диэтиловый эфир N-(2-амино-4-трифторметил-5-гексагидроазепино- фенил)-аминометанфосфоновой кислоты;
диэтиловый эфир N-(2-амино-4-трифторметил-5-фенилпиперазинил- фенил)-аминометанфосфоновой кислоты;
диэтиловый эфир 1-[(2-амино-4-трифторметил-5-морфолинофенил)амино] этанфосфоновой кислоты;
диэтиловый эфир N-[(2-амино-4-трифторметил-5-гекс-1-ил-аминофенил) амино]метанфорной кислоты;
диэтиловый эфир N-[(2-амино-4-трифторметил-5-пент-1-ил- аминофенил)-амино]метанфосфорной кислоты;
диэтиловый эфир N-[(2-амино-4-трифторметил-5-гекс-2-ил-аминофенил)- амино]метанфосфоновой кислоты.
Е.
1,26 г (2,7 ммоль) Диэтилового эфира N-(2-амино-4-трифторметил-5-морфолино-фенил) аминометанфосфоновой кислоты в 60 мл абсолютного тетрагидрофурана объединяют вместе с 0,79 мл (5,7 ммоль) триэтиламина. Смесь смешивают по каплям с раствором 0,63 мл (5,7 ммоль) хлорангидрида сложного этилового эфира щавелевой кислоты в 20 мл тетрагидрофурана. Затем перемешивают при комнатной температуре в течение 3-х часов. Смесь отсасывают и фильтрат концентрируют. Остаток после концентирования фильтрата обрабатывают в 20 мл этанола и 20 мл 1н. соляной кислоты и перемешивают 2 часа при температуре бани 110oC. После удаления этанола в вакууме, остаток разбавляют водой до 30 мл и встряхивают трижды по 30 мл с этилацетатом. Объединенную этилацетатную фазу промывают один раз с помощью 30 мл воды сушат, фильтруют и концентрируют. Получают 1,13 г (89,7% от теории) диэтилового эфира [(6-тpифтopмeтил-7-мopфoлинохиноксалин- 2,3-дион)-1-ил]метанфосфоновой кислоты с т. пл.= 192,6oC.
Аналогичным образом получают:
диэтиловый эфир [(6-тpифтopмeтил-7-[пипepидин-1-ил]xиноксалин- 2,3-дион)-1-ил]метанфосфоновой кислоты; т.пл. 221,8oC,
диэтиловый эфир [(6-трифторметил-7-[2,6-диметил-(морфолин-1- ил)]-хиноксалин-2,3-дион)-1-ил]метанфосфоновой кислоты;
диэтиловый эфир [(6-тpифтopмeтил-7-(гeкcaгидpoaзeпин-1-ил) хиноксалин-2,3-дион)-1-ил]метанфосфоновой кислоты;
диэтиловый эфир [(6-трифторметил-7-фенил-пиперазин-1-ил) хиноксалин]-2,3-дион-1-ил]метанфосфоновой кислоты; т.пл.>300oC,
диэтиловый эфир 1-[(6-трифторметил-7-[морфолин-1-ил]хиноксалин- 2,3-дион)-1-ид]этанфосфоновой кислоты; т.пл. 213,1oC,
диэтиловый эфир N-[(6-тpифтopмeтил-7-(гeкcил-1- аминo]хиноксалин-2,3-дион)-1-ил]метанфосфоновой кислоты;
диэтиловый эфир N-[(6-тpифтopмeтил-7-[пeнтил-1-aмино] хиноксалин-2,3-дион)-1-ил]метанфосфоновой кислоты;
диэтиловый эфир N-[(6-тpифтopмeтил-7-[гeкc-2-ил-aминo] хиноксалин-2,3-дион)-1-ил]метанфосфоновой кислоты.
Пример 13: Диэтиловый эфир 1-(6-трифторметил-7-имидазолил- хиноксалин-2,3-дион-1-ил) этанфосфоновой кислоты
A.
1,67 г (5 ммоль) 1-[(2-нитро-4-трифторметил-5-хлор-фенил) амино]этанфосфоновой кислоты (согласно примеру 8, A.) вместе с 1,70 г имидазола перемешивают 4 часа при температуре бани 160oC. Обрабатывают водой в количестве 100 мл и перемешивают трижды с ионообменником 1R 120 (сильно кислая форма, амберлит, 20- 50 меш.) и отсасывают. После этого концентрируют на ротационном испарителе досуха и остаток вместе с 24 мл триэтилового эфира ортомуравьиной кислоты и 156 мг (0,82 ммоль) п-толуолсульфокислоты нагревают 10 часов при температуре бани 150oC. После концентрирования досуха на ротационном испарителе хроматографируют через силикагель с помощью смеси метиленхлорида с этанолом в соотношении 10: 1. Получают 222 мг (17% от теории) диэтилового эфира 1-[(2-нитро-4-трифторметил-5-имидазолил-фенил)амино] этан- фосфоновой кислоты.
Аналогичным образом получают:
диэтиловый эфир 1-[(2-нитpo-4-тpифтopмeтил-5-(4-мeтил-имидазол-1- ил)-фенил)-амино]метанфосфоновой кислоты.
B.
572 мг (1,4 ммоль) Диэтилового эфира 1-[(2-нитро-4- трифторметил-5-имидазолил-фенил)амино] этанфосфоновой кислоты в 60 мл этанола гидрируют в присутствии 300 мг палладия- на-угле (10%-ного) при нормальном давлении водорода в течение 1,5 часов при комнатной температуре. После отсасывания катализатора через силикагель и концентрирования фильтрата получают 531 мг (99,6 % от теории) диэтилового эфира 1-[(2-aминo-4- тpифтopмeтил-5-имидaзoлилфeнил)амино]этан-фосфоновой кислоты.
Аналогичным образом получают:
диэтиловый эфир 1-[(2-амино-4-трифторметил-5-(4-метилимидазол-1- ил)-фенил)амино]метанфосфоновой кислоты.
C.
531 мг (1,4 ммоль) Диэтилового эфира 1-[(2-амино-4- три-фторметил-5-имидазолил-фенил)амино]этанфосфоновой кислоты в 35 мл абсолютного тетрагидрофурана объединяют с 0,4 мл (2,9 ммоль) триэтиламина. Смесь по каплям смешивают с раствором 0,32 мл (2,9 ммоль) хлорангидридэтилового эфира щавелевой кислоты в 10 мл тетрагидрофурана. Затем перемешивают 3 часа при комнатной температуре. Смесь отсасывают и фильтрат концентрируют. Остаток после концентрирования фильтрата обрабатывают 15 мл этанола и 15 мл 1н. соляной кислоты и перемешивают 2 часа при температуре бани 110oC. После удаления этанола в вакууме остаток разбавляют водой до 30 мл и трижды встряхивают с этилацетатом с использованием каждый раз по 25 мл этилацетата. Объединенную этилацетатную фазу промывают один раз водой в количестве 30 мл, сушат, фильтруют и концентрируют. Получают диэтиловый эфир 1-[(6-трифторметил-7- имидазолил-хиноксалин-2,3-дион)-1-ил]этан-фосфоновой кислоты.
Аналогичным образом получают:
диэтиловый эфир 1-[(6-трифторметил-7-(4-метилимидазол-1-ил- хиноксалин-2,3-дион)-1-ил]метанфосфоновой кислоты.
Пример 14: 2-[(6-Трифторметил-хиноксалин-2,3-дион-1-ил) пропионитрил]
A.
6 г (28,7 ммоль) 4-Фтор-3-нитробензотрифторида в 120 мл воды смешивают с 4,08 г (28,7 ммоль) 3-аминопропионитрила (в форме фумарата) и 0,36 г (60 ммоль) карбоната натрия и нагревают 3 часа при температуре бани 110oC. Выделившееся твердое вещество отсасывают. Получают 5,1 г (68,5% от теории) 2-N-[(2-нитро-4-трифторметил-фенил)амино]-пропионитрила.
B.
2 г (7,7 ммоль) 2-N-[(2-тpифтopмeтил- фeнил)aминo]пpoпиoнитрила в 200 мл этанола гидрируют в присутствии 500 мг палладия-на-активном угле (10%-ного) при комнатной температуре в течение часа при нормальном давлении водорода. После отфильтровывания от катализатора и концентрирования фильтрата получают 1,5 г (88,4% от теории) 2-N- [(2-амино-4-трифторметилфенил)амино]пропионитрила.
C.
1,5 г (6,5 ммоль) 2-N-[(2-амино-4-трифторметил-фенил)амино] пропионитрила объединяют с 0,8 мл (7,3 ммоль) триэтиламина в 90 мл тетрагидрофурана и при 0oC по каплям смешивают с раствором 0,75 мл (7,3 ммоль) хлорангидрида этилового эфира щавелевой кислоты в 20 мл тетрагидрофурана. После перемешивания в течение 2-х часов при комнатной температуре отсасывают от солей и фильтрат концентрируют. Остаток в 100 мл 1н. соляной кислоты вместе со 100 мл этанола в течение 2-х часов кипятят с обратным холодильником. После концентрирования остаток распределяют в смеси этилацетата с водой, органическую фазу концентрируют и остаток перемешивают с этилацетатом. Получают 510 мг (44,8% от теории) 3-(6-трифторметил-хиноксалин-2,3-дион-1-ил)пропионитрила, т.пл. 246,6oC.
Аналогичным образом получают:
2-[(6-трифторметил-хиноксалин-2,3-дион-1-ил)ацетонитрил]; т.пл. 300oC,
2-[(6-тpифтopмeтил-xинoкcaлин-2,3-дион-1-ил)этил]сульфокислоту.
Пример 15: 2-[(6-Tpифтopмeтил-xинoкcaлин-2,3-диoн-1-ил) этил]тетразол
345 мг (1,2 ммоль) 3-[(6-Трифторметил-хиноксалин-2,3- дион-1-ил)пропионитрила] вместе с 407 мг (6,3 ммоль) азида натрия и 333 мг (6,3 ммоль) хлорида аммония в 13 мл диметилформамида нагревают 3 часа при температуре бани 120oC. После добавки еще раз 203 мг (3,2 ммоль) азида натрия и 160 мг (3,1 ммоль) хлорида аммония, еще раз нагревают при температуре бани 120oC в течение 5 часов. После разбавления водой и установления pH 2, экстрагируют этилацетатом. При встряхивании с насыщенным раствором хлорида натрия из органической фазы осаждается целевое соединение. Путем концентрирования органической фазы и перемешивания в этилацетате получают дальнейшую фракцию. В целом получают 150 мг (37,8% от теории) 2-[(6-трифторметил-хиноксалин-2,3-дион-1-ил-этил]- тетразола с т.пл. 279,8oC.
Аналогичным образом получают:
[(6-трифторметил-хиноксалин-2,3-дион-1-ил)метил]тетразол.
Пример 16: 2-[(6-Трифторметил-хиноксалин-2,3-дион-1- ил)этил]хлорид
1,3 г (4,7 ммоль) 2-(6-трифторметил-хиноксалин- 2,3-дион-1-ил)-этилового спирта в 20 мл тионилхлорида перемешивают 4 часа при комнатной температуре. После концентрирования и последующей перегонки с толуолом получают 1,34 г (97% от теории) 2-[(6-трифторметил-хиноксалин-2,3-дион-1-ил)этил]хлорида, т. пл. 221,3oC.
Пример 17: N-[(6-Tpифтopмeтил-xинoкcaлин-2,3-дион-1- ил)этил]имидазол
392 мг (1 ммоль) 2-[(6-Трифторметил-хиноксалин-2,3-дион-1- ил)этил]-хлорида вместе со 150 мг (2,2 ммоль) имидазола в течение 3-х часов нагревают при температуре бани 150oC. При распределении в смеси из 10 мл этилацетата и 10 мл воды, органическую фазу концентрируют и остаток хроматографируют через силикагель с помощью смеси метанола с бутанолом, водой и аммиаком в соотношении 75: 25:17:3 в качестве элюирующего средства. Получают 54 мг (17% от теории) 2-[(6-трифторметил-хиноксалин-2,3-дион-1-ил) этил]имидазола с т.пл. > 250oC.
Аналогичным образом получают:
2-[(6-Трифторметил-хиноксалин-2,3-дион-1-ил)этил]морфолин (в виде смолы)
Пример 18: 6-Трифторметил-7-нитро-1-(1-метокси-этил- 2)-1,2,3,4-тетрагидро-2,3-диоксо-хиноксалин
100 мг 6-Трифторметил-1-(1-метокси-)т-2-ил)-1,2,3,4-тетрагидро- 2,3-диоксо-хиноксалина суспендируют в 1 мл концентрированной серной кислоты, при 4oC смешивают с 0,1 мл смеси из концентрированной серной кислоты с концентрированной азотной кислотой в соотношении 1:1 и перемешивают 1 час при 4oC. После этого все переходит в раствор. Затем раствор выливают на лед и отсасывают выпавший осадок. Получают 59 мг (50% от теории) 6-трифторметил-7-нитро-1-(1-метокси- эт-2-ил)-1,2,3,4-тетрагидро-2,3-диоксо-хиноксалина, т. пл. > 300oC.
Пример 19: 6-Трифторметил-7-иод-1-(1-метокси-этил-2)-1,2, 3,4-тетрагидро-2,3-диоксо-хиноксалин
288 мг 6-Трифторметил-1-(1-метокси-этил-2-)-1,2,3,4- тетрагидро-2,3-диоксо-хиноксалина в 5 мл ледяной уксусной кислоты смешивают с 0,05 мл воды, 0,012 мл концентрированной серной кислоты, 34,4 мг иодноватой кислоты и 88,4 мг иода и нагревают в течение 4-х часов при 80oC. После концентрирования, остаток обрабатывают водой, подщелачивают и экстрагируют метиленхлоридом. Органическую фазу сушат, фильтруют и концентрируют и остаток хроматографируют через силикагель с помощью смеси толуола с ледяной уксусной кислотой и водой в соотношении 10:10:1 в качестве элюирующего средства. Получают 40 г 6-трифторметил-7-иод-1-(1- метокси-эт-2-ил-1,2,3,4-тетрагидро-2,3-диоксо-хиноксалина. Остаток представляет собой исходное вещество, которое еще раз можно использовать в реакции, т.пл. 265,9oC.
Пример 20: Диэтиловый эфир N-[(6-Циaнo-xинoкcaлин-2,3-дион)- 1-ил]-этанфосфоновой кислоты
A
2,77 г (15,24 ммоль) 4-Хлор-3-нитро- бензонитрила вместе с 10,5 г (38 ммоль) диэтилового эфира аминоэтанфосфоновой кислоты перемешивают 16 часов при 30oC. Реакционную смесь затем хроматографируют через силикагель с помощью смеси метиленхлорида с этанолом в соотношении 95:5 в качестве элюирующего средства. Получают 3,86 г (80% от теории) диэтилового эфира 1-[N-(2-нитро-4-цианофенил)амино]этанфосфоновой кислоты.
В.
3,1 г Диэтилового эфира N-(2-нитро-4-цианофенил)аминоэтанфосфоновой кислоты растворяют в 55 мл тетрагидрофурана с 3 мл триэтиламина и при 0oC по каплям смешивают с раствором 2,35 мл хлорангидрида этилового эфира щавелевой кислоты в 16 мл тетрагидрофурана. После перемешивания в течение 3-х дней при комнатной температуре, разбавляют с помощью 300 мл этилацетата и промывают последовательно водой и концентрированным раствором хлорида натрия. Органическую фазу сушат, фильтруют и концентрируют. Получают 5,43 г сырого амида неполного сложного этилового эфира N- (диэтилфосфонил-этил-1)-N-(2-нитро-4-цианофенил) щавелевой кислоты, который вводят во взаимодействие далее без очистки.
C.
1,25 г Амида неполного сложного этилового эфира N-(ди этилофосфонил-эт-1-ил)-N-(2-нитро-4-цианофенил)щавелевой кислоты в 60 мл ледяной уксусной кислоты смешивают с 12,9 г (230 ммоль) порошка железа и нагревают 60 минут при 90oC. После удаления путем декантации от непревращенного железа и фильтрации через кизельгур, фильтрат концентрируют, растворяют в этилацетате и многократно промывают водой. Органическую фазу сушат, фильтруют и концентрируют. Остаток хроматографируют через силикагель с помощью смеси толуола с этанолом в соотношении 8:2 в качестве элюирующего средства. Получают 1,43 г (32,9% от теории) диэтилового эфира N-[(6-циано-хиноксалин-2,3-дион)-1- ил] этанфосфоновой кислоты.
Пример 21: N-[(6-Циано-хиноксалин-2,3-дио)-1-ил]этанфосфоновая кислота
600 мг Диэтилового эфира N-[6-циано-хиноксалин-2,3-дион)-1- ил]этанфосфоновой кислоты растворяют в 20 мл метиленхлорида и медленно по каплям смешивают с 2 мл (13,4 ммоль) триметилсилилиодида. После перемешивания в течение 4-х часов при комнатной температуре образуется коричневого цвета раствор. Его встряхивают с водой и отсасывают образующиеся при этом осадки. Объединенные кристаллизаты перекристаллизуют из смеси этанола с водой. Получают 300 мг (83% от теории) N-[(6-циано-хиноксалин-2, 3-дион)-1-ил]этанфосфоновой кислоты с т.пл. = 280oC.
Пример 22: Диэтиловый эфир-N-[6-трифторметил-7-амино-1,2,3, 4-тетрагидро-2,3-диоксо-хиноксалин-1-ил]метанфосфоновой кислоты
600 мг Диэтилового эфира N-[6-трифторметил-7-нитро-1,2,3,4- тетрагидро-2,3-диоксо-хиноксалин-1-ил] метанфосфоновой кислоты растворяют в 30 мл этанола и вместе со 100 мг Pd/C (10%) гидрируют в течение 1 часа при нормальном давлении водорода и при комнатной температуре. После отсасывания катализатора, катализатор еще раз кипятят с этанолом: объединенный фильтрат концентрируют и получают 590 мг диэтилового эфира N-(6-трифторметил-7-амино-1,2, 3,4-тетрагидро-2,3-диоксо-хиноксалин-1-ил)этанфосфоновой кислоты.
Аналогичным образом получают:
диэтиловый эфир N-(6-трифторметил-7-амино-1,2,3,4-тетрагидро- 2,3-диоксо-хиноксалин-1-ил) метанфосфоновой кислоты;
этиловый эфир N-(6-трифторметил-7-амино-1,2,3,4-тетрагидро- 2,3-диоксо-хиноксалин-1-ил)уксусной кислоты;
6-трифторметил-7-амино-1-(1-метокси-этил-2)-1,2,3,4-тетрагидро- 2,3-диоксо-хиноксалин, т.пл. 221,3oC.
Пример 23: Этиловый эфир N-[6-трифторметил-7-нитро-1,2,3,4- тетрагидро-2,3-диоксо-хиноксалин-1-ил]уксусной кислоты
А.
(1,1 ммоль) 2-Трифторметилхиноксалин-2,3-дион-1-ил)ацетонитрила в 10 мл концентрированной соляной кислоты кипятят с обратным холодильником в течение 4-х часов. Осадившийся продукт отсасывают. Получают 188 мг 2-[(6-трифторметил-хиноксалин-2,3-дион)-1-ил]уксусной кислоты.
В.
150 мг (0,52 ммоль) 2-[(6-трифторметил-хиноксалин- 2,3-дион)-1-ил]уксусной кислоты в 7 мл этанольного раствора хлороводорода кипятят с обратным холодильником в течение 2-х часов. Затем концентрируют, остаток растворяют в 4 мл метиленхлорида и 1 мл ацетонитрила, смешивают со 120 мг нитронийтетрафторбората и перемешивают 2 часа при комнатной температуре. После этого встряхивают с водой, органическую фазу сушат, фильтруют и концентрируют. Получают этиловый эфир N-(6-трифторметил-7-нитро- 1,2,3,4-тетрагидро-2,3-диоксо-хиноксалин-1-ил)-уксусной кислоты.
Пример 24: 6-Трифторметил-7-иод-1-(1-метокси-этил-2)-1, 2,3,4-тетрагидро-2,3-диоксо-хиноксалин
90 мг 6-трифторметил-7-амино-1-(1-метокси-этил-2)-1,2,3,4- тетрагидро-2,3-диоксо-хиноксалина обрабатывают в 8 мл этанольного раствора хлороводорода, концентрируют и гидрохлорид растворяют в 6 мл диметилформамида и 3 мл метилениодида и при температуре бани 80oC смешивают с 0,08 мл изоамилнитрита. После перемешивания в течение 3-х часов при этой температуре, смесь концентрируют в вакууме. Получают 105 мг 6- трифторметил-7-иод-1-(1-метокси-эт-2-ил)-1,2,3,4-тетрагидро-2,3- диоксо-хиноксалина, т.пл. 265oC.
Аналогичным образом получают:
диэтиловый эфир N-(6-трифторметил-7-иод-1,2,3,4-тетрагидро-2, 3-диоксо-хиноксалин-1-ил)-метанфосфоновой кислоты;
этиловый эфир N-(6-трифторметил-7-иод-1,2,3,4-тетрагидро-2,3- диоксо-хиноксалин-1-ил)-уксусной кислоты.
Пример 25: Диэтиловый эфир 1-[(6-Трифторметил-7-[пиперидин-1-ил]- хиноксалин-2,3-дион)-1-ил]этанфосфоновой кислоты
При 0oC к суспензии 100 мг диэтилового эфира [(6-трифторметил- 7-амино-хиноксалин-2,3-дион)-1-ил] -метанфосфоновой кислоты и 30 мг кусочков таблеток боргидрида натрия в 3 мл тетрагидрофурана прикапывают раствор 0,15 мл 25%-ного водного раствора диальдегида глутаровой кислоты и 0,45 мл 3 М серной кислоты в 3 мл смеси тетрагидрофурана с метанолом в соотношении 2:3. После затухания реакции, еще раз вводят 30 мг кусочков таблеток боргидрида натрия и после этого перемешивают 1 час при комнатной температуре. Затем устанавливают нейтральную реакцию с помощью раствора гидроксида натрия и встряхивают с этилацетатом. Этилацетатную фазу сушат, фильтруют и концентрируют. После хроматографии на силикагеле с помощью смеси толуола с ледяной уксусной кислотой и водой в соотношении 10:10:1 получают 60 мг диэтилового эфира 1-[6- трифторметил-7-[пиперидин-1-ил] хиноксалин-2,3-дион)-1- ил] этанфосфоновой кислоты.
Аналогичным образом получают:
этиловый эфир 1-[(6-трифторметил-7-(пиперидин-1-ил)хиноксалин-2,3- дион)-1-ил]уксусной кислоты.
Пример 26: Диэтиловый эфир 1-[(6-трифторметил-7-пропиламино- хиноксалин-2,3-дион)-1-ил]этанфосфоновой кислоты
При 4oC, к суспензии 80 мг диэтилового эфира [(6- трифторметил-7-аминохиноксалин-2,3-дион)-1-ил] метанфосфоновой кислоты в 3 мл тетрагидрофурана прикапывают раствор 0,02 мл перегнанного пропанола и 0,2 мл 3 М серной кислоты в 2 мл тетрагидрофурана. К этой перемешиваемой смеси добавляют 20 мг кусочков таблеток боргидрида натрия. После затухания реакции, еще раз добавляют 10 мг кусочков таблеток боргидрида натрия и после этого перемешивают 1 час при комнатной температуре. После этого устанавливают нейтральную реакцию с помощью раствора гидроксида натрия и встряхивают с этилацетатом. Этилацетатную фазу сушат, фильтруют и концентрируют. После хроматографии через силикагель с помощью смеси толуола с ледяной уксусной кислотой и водой в соотношении 10: 10: 1, получают 40 мг диэтилового эфира [(6- трифторметил-7-пропиламино-хиноксалин-2,3-дион)-1- ил]этанфосфоновой кислоты.
Пример 27: Диэтиловый эфир 1-[(6-трифторметил-7-ацетиламино- хиноксалин-2,3-дион)-1-ил]-этанфосфоновой кислоты
80 мг Диэтилового эфира 1-[(6-тpифтopмeтил-7-aминoxинoксалин- 2,3-дион)-1-ил] этанфосфоновой кислоты растворяют в 8 мл уксусной кислоты и смешивают со 150 мг ацетангидрида и перемешивают 3 часа при комнатной температуре. После концентрирования получают 50 мг диэтилового эфира 1-[(6- трифторметил-7-ацетиламино-хиноксалин-2,3-дион)-1- ил]этанфосфоновой кислоты.
Пример 28
N-[6-Трифторметил-7-нитро-1,2,3,4-тетрагидро-2,3-диоксо-хиноксалин- 1-ил]уксусная кислота.
Получают вышеназванное соединение с температурой плавления более 300oC.
Пример 29
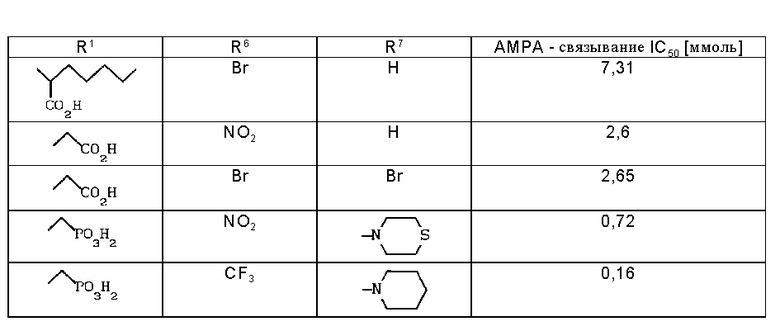
Данные, характеризующие сродство соединений к АМРА-рецепторам, приведены в таблице.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ХИНОКСАЛИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И СРЕДСТВО С КВИСКВАЛАТ-АНТАГОНИСТИЧЕСКИМ ДЕЙСТВИЕМ НА ИХ ОСНОВЕ | 1992 |
|
RU2117663C1 |
| ПРОИЗВОДНЫЕ БЕНЗО(F)ХИНОКСАЛИНДИОНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1994 |
|
RU2140421C1 |
| ПРОИЗВОДНЫЕ ПИРИДО(1,2,3-DE)ХИНОКСАЛИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1994 |
|
RU2140924C1 |
| ПРОИЗВОДНЫЕ АМИНОФОСФОНОВЫХ И -ФОСФИНОВЫХ КИСЛОТ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ НА ИХ ОСНОВЕ | 1997 |
|
RU2181362C2 |
| ТРИЦИКЛИЧЕСКИЕ ДИКАРБОНИЛЬНЫЕ ПРОИЗВОДНЫЕ И ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ НА ИХ ОСНОВЕ | 1995 |
|
RU2145606C1 |
| 19,11-ПЕРЕКРЫТЫЕ МОСТИКАМИ 4-ЭСТРЕНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1993 |
|
RU2157814C2 |
| ЗАМЕЩЕННЫЕ ПИРАЗОЛИЛПИРАЗОЛЫ, 3-ГИДРАЗИНОПИРАЗОЛЫ, ГЕРБИЦИДНАЯ КОМПОЗИЦИЯ И СПОСОБ БОРЬБЫ С СОРНЯКАМИ | 1992 |
|
RU2094433C1 |
| АМИДОЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ КСАНТИНА, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩИМ ДЕЙСТВИЕМ ФОСФОЕНОЛПИРУВАТКАРБОКСИКИНАЗЫ (ФЕПКК), СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2003 |
|
RU2295525C2 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА | 2005 |
|
RU2414468C2 |
| ТРИЦИКЛИЧЕСКИЕ АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ И ПРОИЗВОДНЫЕ ТЕТРАГИДРОХИНОЛИНА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1991 |
|
RU2023712C1 |
Описываются новые производные хиноксалиндиона формулы I, где значения R1, R5 - R8 указаны в 1 пункте формулы, обладающие сродством к АМРА - рецепторам. Описывается также способ их получения, а также фармацевтическое средство на их основе. 4 с. и 2 з.п. ф-лы, 1 табл.
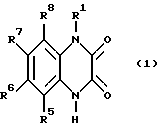

где R1 обозначает - (CH2)n-CR2H-(CH2)m-Z;
R5, R6, R7 и R8 являются одинаковыми или разными и обозначают водород, CF3, нитрогруппу, галоген, NR9R10, цианогруппу или OR14, причем R2 обозначает водород, n, m каждый обозначает 0, 1, 2 или 3; z обозначает POXY, OR17, NR18R19, NHCOR20, NHSO2R21, CO2R23, галоген, цианогруппу или тетразол, R17 обозначает C1-C4-алкил, R14 обозначает, в случае необходимости, 1 - 3 кратно замещенный галогеном (C1-C6)-алкил, R20 и R21 обозначают (C1-C6)-алкил, в случае необходимости замещенный галогеном фенил или пиридил, X и Y являются одинаковым и обозначают гидроксил или (C1-C6) алкоксил, R9 и R10 являются одинаковыми или разными и обозначают водород или (C1-C6) алкил, который в случае необходимости может быть замещен (C1-C4) алкоксилом или вместе с атомом азота образуют 6 - 7-членный насыщенный гетероцикл, который может содержать другой N -, S -, или O-атом и может быть замещен (C1-C4)алкилом или фенилом, или образует ненасыщенный 5-членный гетероцикл, который может содержать 1-3 N-атомов и может быть замещен (C1-C4)алкилом; R18 и R19 вместе с атомом азота образуют ненасыщенный 5-членный гетероцикл, который может содержать 1 - 3 N-атомов, R23-водород,
или их изомеры или соли;
при условии, что:
а) R5, R6, R7 и R8 не являются одновременно водородом, б) в случае, если Z обозначает CO2R23, NR18R19 или OR17, два различных заместителя обозначают R5, R6, R7 и R8, при этом: 1) NR9R10 не обозначает имидазол или триазол, 2) R6 и R7 независимо друг от друга каждый обозначает NO2, галоген, CN или CF3, и с) в случае, если Z обозначает OPXY, два различных заместителя обозначают R5, R6, R7 и R8, при этом R7 не обозначает имидазол, если R1 является метанфосфоновой кислотой и R6 обозначает CF3 или NO2.
4. Способ получения производных хиноксалиндиона формулы I, отличающийся тем, что соединение формулы II
где R1 - R8 имеют указанные в п.1 значения, подвергают циклизации с щавелевой кислотой или реакционноспособными производными щавелевой кислоты.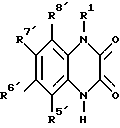
где R1 имеет значения, указанные в п.1 и один из заместителей R5', R6', R7' или R8' обозначают отщепляемую группу, а другие соответствуют значениям R5, R6, R7 или R8, указанным в п.1, подвергают нуклеофильному замещению, и при необходимости затем омыляют сложноэфирную группу; или нитро-группу восстанавливают до амино-группы; или амино-группу алкилируют; или амино-группу обменивают на галоген, или вводят нитро-группу или галоген; или спирт переводят в галогенид; или этот галоген нуклеофильно замещают; или нитрил переводят в теразол; или разделяют изомеры; или получают соли.
Приоритет по признакам:
28.04.93 - все соединения, кроме Z - галоген, циано, R20 и R21 - в случае необходимости замещенный галогеном фенил, R9 и R10 вместе с атомом азота образуют 7-членный насыщенный гетероцикл, или 5-членный гетероцикл, замещенный (C1-C4) алкилом;
21.12.93 - по признакам, уточняющим признаки по первому приоритету.
| УСТРОЙСТВО ДЛЯ снятия ВНУТРЕННЕГОВ ТРУБАХГРАТА | 0 |
|
SU344943A1 |
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| Способ получения замещенных хиноксалиндионов или их солей | 1974 |
|
SU584771A3 |
| Огнетушитель | 0 |
|
SU91A1 |
| US 4948794 A, 1980. | |||
Авторы
Даты
1999-10-27—Публикация
1994-04-28—Подача