Изобретение относится к трициклическим азотсодержащим соединениям, гетероциклическим аминам, обладающим активностью в отношении центральной нервной системы. Эти новые соединения могут использоваться для лечения шизофрении, болезни Паркинсона, состояний тревоги или в качестве соединений, понижающих кровяное давление.
Известен ряд дигидрофениленов - замещенных трициклических аминов - и родственных соединений, обладающих активностью в отношении центральной нервной системы. Главное отличие этих соединений от предлагаемых состоит в том, что последние содержат в своей трициклической структуре по меньшей мере один атом азота, являющийся общим для двух ядер. Как правило, предлагаемые соединения проявляют антипсихотическую активностью и лучшую оральную биологическую доступность.
Известны трициклические структуры, обладающие активностью в отношении центральной нервной системы (РСТ Int.Pub.No W 087/04153 и РСТ Int.Pub No W 088/04292).
В патенте США N 4110339 раскрываются 4-(ди-н-пропил)амино-1,3,4,5-тетрагидробенз(с d)индолы, используемые как ингибиторы пролактина и для лечения болезни Паркинсона.
В европейском патенте N 153083 и патенте ФРГ N 3346573 описываются метоксизамещенные 4-(ди-н-пропил)амино-1,3,4,5-тетрагидробенз(с d)индолы. В этих источниках раскрываются азотсодержащие трициклические структуры, но в них азот не является общим для каких-либо двух ядер.
Известны азотсодержащие трициклические структуры, в которых азот обобществлен двумя ядрами, но которые дополнительно содержат другие заместители, не характерные для заявляемых соединений (Эванс Д.Д., Петерс Д. Дж., I.Chem.Soc., Perkin Trans.I, 1974, с.285-88).
Предлагаемое изобретение заключается в том, что оно относится к трициклическим азотсодержащим соединениям формулы I (все формулы даны как иллюстративный материал), обладающим активностью в отношении центральной нервной системы, и к их фармацевтически приемлемым солям; R1,R2 и R3 независимо - атом водорода, С1-6-алкильная, С3-5-алкенильная или С3-5-алкинильная группа, С3-7-циклоалкильная или С4-10-циклоалкил- или фенилзамещенная алкильная группа, или R1 и R2 соединены и образуют С3-7-циклическую аминогруппу, которая может содержать дополнительные гетероатомы и/или ненасыщенность; Х - атом водорода, С1-6-алкильная группа, атом галогена, гидроксильная группа, алкоксигруппа, цианогруппа, карбоксамидная группа, карбоксильная группа или карбоалкоксигруппа, A - SO2,N,CH,CH2,CHCH3,C= O,C=S,C-SCH3, C=NH,C-NH2, C-NHCH3,C-NHCOOCH3 или C-NHCN; B - CH2,CH,C=O,N,NH или N-CH3; n - значения 0 или 1; D - CH,CH2,C=O,O,N,NH или N-CH3.
Эти новые соединения могут использоваться для лечения шизофрении, болезни Паркинсона, состояния тревоги, деприессии или для понижения кровяного давления.
Настоящее изобретение относится к новому соединению, имеющему структурную формулу XXXW', где W - O или H2; R1 и R2 независимо - атом водорода или С1-4-алкильную группу. Это соединение используется в качестве интермедиата при получении соединений формулы I. Предпочтительными являются соединения, в которых W представляет собой Н2, а R1 и R2 являются одинаковыми, например, группами СН3 или С3Н2.
Еще одна отличительная особенность настоящего изобретения состоит в том, что оно относится к способу лечения расстройств центральной нервной системы (ЦНС), таких как состояние тревоги, депрессия, гипертензия и связанное с ней высокое кровяное давление, болезнь Паркинсона и шизофрения у людей или животных, путем введения реципиентам фармацевтически эффективного количества соединений формулы I, включая его фармацевтически приемлемые соли. Возможны другие применения этих соединений при приступах паники, расстройствах аппетита, навязчиво-компульсивных расстройствах, наблюдаемых при слабоумии. Кроме того, считается, что активация центрального 5-НТ рецептора принимает участие в определении сексуального поведения. Эти соединения могут быть полезными для стимулирования сексуальной активности и для ослабления импотенции.
В данном изобретении описаны соединения, обладающие активностью в отношении центральной нервной системы. Эти соединения определяются наличием в них трициклической структуры с обобществленным двумя ядрами атомом азота, к которой присоединен аминный заместитель (NR1R2); структура этих соединений поясняется формулой I (все формулы даны как иллюстративный материал).
В общем случае эти структуры включают разнообразные конденсированные трициклические органические соединения. Систематические названия этих циклических систем могут быть найдены в справочнике по циклическим системам. Эти названия образуют, комбинируя названия бензола или моноциклического гетероцикла с бициклическим гетероциклом, которые являются общими для конденсированных ядер, чтобы отличить соединение от изомерных систем со сходными названиями.
Изобретение включает в себя 5-аминоимидазо-(4,5,1-ij)-хинолины и 5-аминоимидазо-(4,5,1-ij)-хинолинолы, отвечающие формуле I (соединения 6-71); более простые названия этих соединений - имидазохинолины и имидазохинолиноны или 5-аминоимидазохинолины и 5-аминоимидазохинолиноны.
Активность этих конкретных соединений в отношении центральной нервной системы была установлена с помощью различных тестов, таких как тесты на гипотермию и гипоксический стресс; кроме того, было найдено, что эти соединения являются антагонистами допамина и серотонина, например, в пробе на связывание с рецепторами 5НТА.
Заявляемые соединения, как правило, изображаются формулой I, где R1,R2 и R3 независимо - атом водорода, С1-6-алкильная, С3-5-алкенильная, С3-5-алкильная, С3-7-циклоалкильная, или С4-10-циклоалкил- или фенилзамещенная алкильная группа, или R1 и R2 соединены и образуют С3-7-циклическую аминогруппу, которая может содержать дополнительные гетероатомы и/или ненасыщенность; Х - атом водорода, С1-6-алкильная группа, алкоксигруппа, цианогруппа, карбоксамидная группа, карбоксильная группа или карбококсигруппа; n - значения O или I; A - SO2,N,CH,CH2,CH-галоген, CHCH3, C=O,C=S,C-SCH3, C=NH, C-NH2,C-NHCH3, C-NHCOOCH3, или C-NHCN; B - CH2,CH,CH-галоген, O,C=O,N, NH или N-CH3; n - значения O или I; D - CH, CH2,CH-галоген, C= O,O,N,NH или N-CH3.
Примерами С1-6-алкильных групп являются метильная, этильная, пропильная, бутильная, пентильная, гексильная группы и их изомерные формы.
Примерами алкенильных групп являются углеводороды с числом атомов углерода 3-5, имеющие неразветвленную или разветвленную цепь и являющиеся ненасыщенными, содержащими как минимум одну двойную связь, например пропенильная или бутенильная группы.
Примерами алкинильных групп являются ненасыщенные углеводороды с числом атомов углерода 3-5, имеющие неразветвленную или разветвленную цепь и содержащие как минимум одну тройную связь, например пропенильная или бутинильная группы.
Примерами С3-7-циклоалкильных групп являются циклопропильная, циклобутильная, циклопентильная, циклогексильная и циклогептильная группы. Примеры циклоалкилзамещенных алкильных групп включают (циклопропил) метильную и (циклобутил)метильную группы. Примеры фенилзамещенных алкильных групп включают фенилметил (бензильную), 1-(фенил) этильную, 2-(фенил)этильную и 4-(фенил) бутильную группу.
Выражение С3-7-циклическая аминогруппа означает, что группы R1и R2 соединены и образуют ядро, содержащее соединенный с этими группами атом азота; примерами являются азетидин, пирролидин, пиперидин, 2-метилпирролидин. Это ядро может содержать дополнительные гетероатомы, которые представляют собой атомы азота, кислорода и серы и/или ненасыщенность, например пиперазин, N-метилпиперазин, морфолин, имидазол.
Атом галогена определяется как F,Cl,Br,I.
Алкоксигруппа - С1-6-алкильная группа, соединенная с атомом кислорода, например метокси-, этокси-, изопропоксигруппа.
Карбоксамидная группа - группа -CONH2.
Карбоалкоксигруппа - группа -COOR, где R - низшая алкильная группа, например карбометоксигруппа, карбоэтоксигруппа.
Тиокарбонильная группа - группа C=S, т.е. представляет собой карбонильную группу, в которой атом кислорода заменен атомом серы.
Сульфонильная группа - группа SO2, в которой атом серы соединен с соседними атомами кольца.
Фармацевтически приемлемые соли - хлориды, бромиды, иодиды, сульфаты, фосфаты, ацетаты, пропионаты, лактаты, малеаты, соли яблочной кислоты, сукцинаты, тартраты, циклогексансульфаматы, метансульфонаты, этансульфонаты, бензолсульфонаты, толуолсульфонаты и другие соли, содержащие фармацевтически приемлемые противоионы для аминов. Кроме того, соединения настоящего изобретения могут вводиться реципиентам в виде гидратов.
Соединения формулы I могут быть получены из метилзамещенных гетероциклов формулы II и замещенных 3-аминотетрагидрохинолинов формулы III (все формулы даны как иллюстративный материал).
В формуле IIm принимает значения O или I, если m равно O, N связан с A двойной связью. В формуле III W - O или H2, а D' может представлять собой нитрогруппу, остальные группы в формулах II и III такие же, как и в формуле I.
Некоторые из метилзамещенных гетероциклических интермедиатов, требуемых для проведения синтезов, известны. Известны и методики синтеза 3-аминотетрагидрохинолинов, которые могут быть использованы для получения 8-замещенных соединений формулы III, требуемых для данной работы; соединения формулы III, в которых D' - нитрогруппа, аминогруппа, гидроксильная группа или алкоксигруппа, являются новыми соединениями.
Для получения соединения формулы III и для превращения соединений формулы II в формулу I требуются интермедиаты формул VI и VII , представляющие собой производные малоновой кислоты (малоновые интермедиаты).
Для получения этих соединений диэфир малоновой кислоты IV, предпочтительно диметиловый, диэтиловый или метилбензиловый диэфир, реагируют с бромом в среде четыреххлористого углерода, в результате чего получают диэфир броммалоновой кислоты V . Это соединение далее реагирует в среде подходящего растворителя, такого как хлористый метилен, эфир или тетрагидрофуран, с соответствующим амином. После отделения побочного продукта - бромистоводородной соли амина - и удаления избытка амина замещенный аминомалонат формулы VI может быть использован без дополнительной очистки или может быть очищен хроматографически перед дальнейшим использованием. Использованные в этой реакции амины включают диметиламин, пирролидин, пиперидин, морфолин, имидазол, 4-метилпиперазин, пропиламин и (R)- и (S)- α -метилбензиламин, что приводит к получению интермедиатов формулы VI, представленных в табл.1. Особенно предпочтительными из приведенных в табл.1 эфиров являются смешанные эфиры (соединения VIi-VIq), так как карбобензилоксигруппа может быть удалена каталитическим гидрированием. Интермедиаты VId-h дают третичные амины, которые могут быть дебензилированы каталитическим гидрированием с получением соответствующих вторичных аминов.
При реакции первичного амина с соединением формулы V образуется первичный продукт VI, который может реагировать с хлорангидридом кислоты, алкил- или бензилхлороформиатом или с ди-трет-бутил-дикарбонатом с образованием амидов и карбаматов формулы VII. В формуле VII RI' представляет собой атом водорода, алкильную, алкоксикарбонильнуыю или бензилоксикарбонильную группу; таким образом из соединения VIс были получены соединения VIIe-VIIf (табл.2).
Другие аминомалонаты формулы VII могут быть получены из диалкиламиномалонатов, например из диэтиламиномалоната VIII. Соединение VIII реагирует с ди-трет-бутил-дикарбонатом с образованием карбамата VIIc - интермедиата, в котором аминная функция защищена лабильной (легко отщепляющейся в виде кислоты) трет-бутоксикарбонильной группой. Восстановительное алкилирование VIII пропионовым альдегидом с использованием цианоборгидрида натрия можно провести так, чтобы получить вторичный амин VIс или третичный амин VIb в качестве основного продукта. Соединение VIc может быть ацилировано пропионилхлоридом с образованием VIIe или превращено в трет-бутоксикарбонильное производное VIIf.
2,3,6,7-Тетрагидро-1Н-5Н-бензо(ij)хи-нолизин-2-амины, т. е. соединения формулы I, в которых A,B и D - СН2, могут быть по- лучены согласно схеме 1 (все схемы даны как иллюстративный материал) для получения соединений 1-5.
Бромирование 8-метилхинолина (IX) N-бромсукцинимидом дает 8-(бромметил) хинолин (Х), который, реагируя с диэтил (формиламино) малонатом (VIIa), дает XIa (R1' = H). Это соединение гидрируют на платиновом катализаторе, получая XIIa, гидролиз которого дает XIIIa. Это соединение гидролизуют до XIV, метилируют в XV и восстанавливают, получая соединение 1. Кроме того, соединение XIIIa восстанавливают литийалюминийгидридом, получая смесь соединений 2 и 3. Пропиламиновые аналоги, т.е. соединения 4 и 5, получают по схеме 1 из 8-(бромметил) хинолина и диэтил-(1-оксопропил)малоната (VII).
При замене в указанной последовательности реакций амиломалонатов VIIa и VIId на аминомалонаты VIi-VIq могут быть получены соответствующие аналоги.
5,6-Дигидро-N,N-дипропил-4Н-имидазо (4,5,1-ij)хинолин-5-амины настоящего изобретения, т. е. соединения формулы I, в которых D - азот; A - СН; n равно O; D и A соединены двойной связью, могут быть получены по схеме 2 для получения соединения 6. Каталитическое гидрирование 2-метил-6-нитроанилина (XVI) с использованием палладиевого катализатора дает 3-метил-1,2-бензолдиамин (XVII), который нагревают с муравьиной кислотой, получая 4-метилбензимидазол (XVIII). Это соединение нагревают в диоксане с ди-трет-бутилдикарбонатом, полученный в результате трет-бутил-4-метилбензимидазол-1-карбоксилат [XIXa, R = OC(CH3)3] бромируют N-бромсукцинимидом в среде четыреххлористого углерода, получая трет-бутил-4-(бромметил) бензимидазол-1-карбоксилат (XXa). Алкилирование XXa калиевой солью диэтил (дипропиламино) малоната (VIb) в среде ТГФ при кипячении с обратным холодильником дает XXIa, который гидролизуют до XXII, используя этилат натрия в среде слегка обводненного этанола. Соединение XXII восстанавливают в спирт XXIII, используя литийалюминийгидрид. При обработке XXIII четырехбромистым углеродом и трифенилфосфином в среде хлористого метилена сразу получают соединение 6.
В эту последовательность реакций могут быть внесены некоторые изменения. Гидролиз XXIa в XXII можно осуществлять в две стадии; в мягких условиях гидролиза этил-α-(дипропиламино)-1Н-бензимида- зол-4-пропанат, образующийся при отщеплении трет-бутоксикарбонильной группы, может быть получен в качестве единственного продукта реакции и этот продукт может быть далее гидролизован до XXII. Реакция соединения XVIII с метилхлороформиатом дает XIXb (R = OCH3), которое с высоким выходом превращают в XXII, как показано в схеме 2. Ацетилирование XVIII дает XIXc (R = CH3), которое также превращают в XXII, хотя в этой реакции выход не так высок, как в случае использования в качестве защитных групп трет-бутоксикарбонильной или карбометоксигрупп.
Последовательность реакций схемы 2 может быть использована для получения аналогов с модифицированным дипропиламинным заместителем. При использовании вместо диэтил (дипропиламино)-малоната (VIb) малонатов VIi-VIq получают соединения 7-12. При получении этих соединений продукт, образующийся при реакции малоната с XXa, превращают в метил- α-(замещенный амино)-1Н-бензимидазол-4-пропанат с помощью гидрогенолиза, как описано в примере 19.
Эту последовательность можно также использовать для получения соединений формулы I, имеющих в бензольном кольце заместитель Х. Например, соединения 14-18 были получены при использовании вместо 4-метилбензимидазола (XXIII) таких замещенных бензимидазолов, как 5-метокси-4-метилбензимидазол, 6-метокси-5-метилбензимидазол, 4-метокси-6-метилбензимидазол и 5-хлор-4-метилбензимидазол. При обработке соединений 14-16 бромистоводородной кислотой образуются соответствующие фенолы 19-21.
Альтернативный синтез 5,6-дигидро-N, N-дипропил-4Н-имидазо (4,5,1-ij) хинолин-5-аминов из 3-аминохинолина (XXIV) показан в схеме 3 . Соединение XXIV формилируют, получая XXV, которое гидрируют, используя в качестве катализатора оксид платины, и формилируют, получая XXVI с хорошим выходом. Бромирование XXVI дает содержащее в положении 6 бром соединение XXVII, которое нитруют, получая XXVIII. Гидрирование XXIX в присутствии палладия на древесном угле дает триамин ХХХ, который обрабатывают муравьиной кислотой, получая соединение 22.
Реакция первичного амина с пропионовым альдегидом и цианоборгидридом натрия дает моно- и дипропиламинопроизводные - соединения 23 и 6 соответственно. Каталитическое восстановление соединения 22 в присутствии формальдегида дает описанный диэтиламиновый аналог (соединение 7).
Последовательность реакций схемы 3 может быть также использована для получения соединений формулы I, имеющих в бензольном кольце заместитель Х. Например, соединение 24 было получено при использовании 3-амино-6-метилхинолина вместо 3-аминохинолина; 3-амино-6-метилхинолиновый интермедиат получают из паратолуидина и натриевой соли нитромалонового альдегида, используя известные методики. Этим методом можно получить и другие аналоги, содержащие в кольце заместитель.
5-амино-5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-2-оны настоящего изобретения, т.е. соединения в которых A - карбонильная группа; n равно 0; D - NH или N-(низший алкил), можно получить по схеме 4. Нитрохинолин XXIX, полученный по схеме 3, защищают, восстанавливают и циклизуют, используя фосген с получением трет-бутоксикарбонилзащищенного имидазохинолинона XXXIII. Это соединение гидролизуют до амина (соединение 26), который алкилируют, получая диметиламиновый аналог (соединение 27) и пропиламиновые аналоги (соединения 28 и 29). Дальнейшее алкилирование соединения 27 и 29 с использованием системы гидрид калия - иодистый метил дает соединения 30 и 31 соответственно.
6-Бром-1,2,3,4-тетрагидро-3-хинолинамин (соединение XXIX) алкилируют иодистым пропилом, получая XXIVa, которое восстанавливают до 1,2,3,4-тетрагидро-N3, N3-дипропил-3,8-хинолиндиамина формулы XXXVa, где R1 и R2 - С3Н7. Алкилирование XXIX системой формальдегид-муравьиная кислота с последующим каталитическим восстановлением дает соответствующее диметиламинопроизводное формулы XXXVb, где R1 и R2 - СН3. Соединение XXXVa было также получено из 2-нитробензилхлорида в примере 67.
Интермедиаты XXXII,XXXVa и XXXVb могут быть использованы для получения 5-амино-5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолинов и 5-амино-5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-2-онов настоящего изобретения, а также при получении ряда новых гетероциклических аналогов, в которых соседние атомы азота соединены с образованием пяти- или шестичленного гетероциклического ядра, как это показано для соединения XXXVa в схеме 5. Реакция соединения XXXVa с тиофосгеном или с ди-(2-пиридил) тиокарбонатом дает 5-(дипропиламино)-5,6-дигидро-4Н-имидазо (4,5,1-ij)-хинолин-2-тион (соединение 33), которое далее алкилируют, получая 5,6-дигидро-2-метилтио-N,N-дипропил-4Н-имидазо (4,5,1-ij)-хинолин-5-амин (соединение 34). Соединение XXXVa реагирует с цианогенбромидом с образованием соединения 35, которое алкилируют иодистым метилом, получая соединение 36. Реакция соединения XXXVa с дифенилцианокарбонимидатом дает соединение 37, а с сульфамидом - соединение 38.
Соединения с шестичленным гетероциклическим ядром получают реакцией соединения XXXVa: с этилбромацетатом с образованием соединения 39, с хлоруксусным ангидридом с получением соединения 40, с бутилглиоксилатом с получением соединения 41, с этилоксалилхлоридом или с оксалилхлоридом с получением соединения 42, с этилбромпропионатом с получением соединения 84 и с α -хлорпропионилхлоридом с получением соединения 85.
Аналогичный ряд соединений (соединения 43-50) получают из 1,2,3,4-тетрагидро-N3, N3-диметил-3,8-хинолиндиамином; при использовании в этих реакциях соединения XXXII могут быть получены другие продукты.
5-Амино-5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-2-оны настоящего изобретения могут быть также получены согласно схеме 6. Реакция 3-метил-1,2-бензолдиамина с карбонилдиимидазолом или фосгеном дает 4-метилбензимидазолон (XXXVI). Это соединение кипятят с обратным холодильником с оксихлоридом фосфора, получая XXXVII, которое защищают и бромируют N-бромсукцинимидом, получая соединение XXXIX. Это соединение сдваивают с VIIb и полученный аддукт XL гидролизуют в XLI. Восстановление этого соединения литийалюминийгидридом дает спирт XLII, который обрабатывают системой четырехбромистый углерод - трифенилфосфин, получая соединение 51. Соединение 51 кипятят с обратным холодильником в уксусной кислоте, превращая его в соединение 6.
Следуя схеме 6, можно получить аналоги соединений 51 и 6. Соединения 52-57 были получены при использовании малонатов VIk-q или VIq вместо VIIс.
Эта последовательность реакций может быть также использована для получения соединений формулы I, имеющих в бензольном кольце заместитель Х. Например, соединения 58-63 были получены при использовании вместо 2-хлор-4-метилбензимидазола (XVIII) следующих замещенных бензимидазолов: 2,5-дихлор-4-метилбензимидазол, 2-хлор-5-метокси-4-метилбензимидазол, 2-хлор-6-метокси-4-метилбензимидазол и 2-хлор-4-метокси-6-метилбензимидазол. Эти соединения были также получены из содержащих в кольце заместитель 1,2,3,4-тетрагидро-3,8-хинолиндиаминов, как описано в примерах 82-87.
Соединения с метильным заместителем в положении 6 в имидазохинолиновом или имидазохинолиноновом ядре были получены из 4-этилбензимидазола по методике, представленной в схеме 2 (см.пример 88), и путем превращения 2-этиланилина в 1,2,3,4-тетрагидро-4-метил-N3,N3-диметил -3,8-хинолиндиамин по методикам, представленным на схемах 7 и 4. Соединения с алкильным заместителем в положении 4 в имидазохинолиновом или имидазохинолиноновом ядре были получены из интермедиата XXIII и родственных первичных спиртов путем окисления в альдегид, реакции этого альдегида с алкилмагнийбромидом и циклизации полученного спирта (см.пример 92). По этим методикам были получены соединения 64-71.
5-Амино-5,6-дигидро-4Н-оксазоло (5,4,1-ij) хинолин-2-оны настоящего изобретения, т.е. соединения, в которых A - карбонильная группа; n равно O; D - O, могут быть получены по схеме 7 для получения соединения 72. 3-Метил-2-нитроанизол (XLII) восстанавливают в XLIV, это соединение кипятят с уксусным ангидриидом, получая XLV. Этот продукт бромируют и сдваивают с VIl b, получая XLVII. Соединение XLVII кипятят с этилатом натрия в среде этанола, получая XLVII, которое превращают в фенол XLIX и восстанавливают литийалюминийгидридом в L. Соединение L обрабатывают карбонилдиимидазолом, получая соединение 72.
Родственные соединения 73-79 получают по методике схемы 7 из соединения XLVI и соответствующего малоната формулы VI или VII. Соединения 80 и 82 получают реакцией фенольного интермедиата L с тиофосгеном или этилбромацетатом.
Соединения 86-93 получают из 4-метилированного гетероцикла формулы II по методикам, описанным в схемах 2 и 6.
Соединения 95-97 получают из 5-(пропиламино)-5,6-дигидро-4Н-пирроло (3,2,1-i, j) хинолин-2,3-диона (соединение 94), которое получают по примеру 118.
6-(Дипропиламино)-2,3,6,7-тетрагидро- 5Н-пиридо (3,2,1-i, j) хиназолин-3-он (соединение 98) получили девятистадийным синтезом из 3-метил-2-нитробензойной кислоты, как описано в примере 122. Соединения 99-105 получили из того же исходного вещества, используя методики, описанные в примерах 123-129.
Альтернативная методика синтеза соединений настоящего изобретения иллюстрируется схемой 8. Трет-бутил-1,2,3,4-тетрагидро-5-(дипропи-ламино) хинолин-1-карбоксилат, полученный, как описано в примере 130, превращают в анион LI, который далее реагирует, как это показано в схеме 8, давая соединения 87,92,95,97 и 102. Соединения настоящего изобретения могут быть разделены на R- и S-изомеры известными способами; изобретение охватывает как рацемические, так и оптически чистые продукты. Разделение может быть осуществлено с помощью разделяющих агентов, таких как оптически активные дибензоилвинная кислота, камфорсульфоновая кислота, бис-о-толуоилвинная кислота, винная кислота и диацетилвинная кислота.
Другая методика, используемая для разделения первичных и вторичных аминов формулы I, включает в себя их превращение в диастереомерные амины с использованием оптически активной кислоты. Диастереомерные амиды разделяют, расцепляют амидную связь и получают оптически чистые соединения формулы I. Эта методика проиллюстрирована примерами 49 и 50 для получения оптических изомеров соединения 29 с использованием в качестве разделяющего агента трет-бутоксикарбонил-L-фенилаланина. Для разделения рацемическое соединение 26 сдваивают с трет-бутоксикарбонил-L-фенилаланином, полученные диастереомерные амиды хроматографически делят на (+)- и (-)-формы: каждый изомер затем обрабатывают так, как это подробно описано ниже для (-)-изомера. Проводят реакцию (-)-изомера стрифторуксусной кислотой, получая (-) N-[5,6-дигидро-2-оксо-4Н-имидазо (4,5,1-i, j)хинолин-5-ил]-L-фенилаланинамид. Разложение этого соединения по Эдману реакцией с фенилизотиоцианатом и затем с трифторуксусной кислотой позволяет удалить остаток фенилаланина и получить (-)-форму соединения 26. Дальнейшая реакция этого соединения с пропионовым альдегидом и цианоборгидридом натрия дает (-)-форму соединения 29, которое является более активным изомером.
Соединения, в которых заместитель R3 представляет собой алкильную группу, существуют в виде диастереомеров, в которых алкильная группа и аминный заместитель (NR1R2) могут находиться в цис- или транс-положении друг к другу. Изобретение включает в себя использование этих соединений в виде смесей изомеров (RR,RS,SR,SS), рацемических диастереомеров (R,R и S,S, или R, S и S,R) и оптически чистых диастереомеров. Смесь диастереомеров может быть разделена известными способами, например хроматографированием на силикагеле. Полученные при этом рацемические диастереомеры могут быть разделены на оптически чистые соединения с использованием указанных методик.
Тестирование нижеперечисленных соединений показало, что они могут обладать полезными антипсихотическими свойствами; об этом свидетельствуют данные по ЦНС-активности (величины ED50 менее 50 мг/кг) этих соединений, полученные в известных тестах на гипотермию и/или гипоксический стресс. Некоторые из соединений, кроме того, продемонстрировали наличие у них аналгезирующей (болеутоляющей) активности. В этих тестах группам из 4 самцов мышей CF-1 внутрибрюшинно (подкожно в тестах на гипоксический стресс и на вызванные HCl болевые судороги) вводили дозы тестируемых соединений в виде суспензий или растворов в 0,25%-й водной метилцеллюлозе. Начальная доза исследуемого соединения составляла 100 мг/кг. Эту дозу уменьшали с логарифмическим шагом 0,3 до тех пор, пока не прекращалось наблюдение действия соединения у всех животных. Для расчета значений ED50 95%-ных доверительных интервалов использовали известную методику.
В гипотермическом тесте температуру брюшка измеряли через 45 мин. Гипотермическими считались те мыши, у которых температура была более чем на 2 стандартных отклонения ниже средней. Этот тест используется для идентификации соединений, которые могут использоваться как антипсихотические агенты или как агенты, понижающие давление.
В тесте на гипоксический стресс мыши через 30 мин после введения соединения поодиночке помещали в герметизируемые колбы Эрленмейера объемом 125 мл. Фиксировали время выживания в этих условиях. Считалось, что действие препарата наблюдается у тех мышей, для которых время выживания было больше, чем среднее + 2 стандартных отклонения, полученные в параллельных контрольных группах. Этот тест используется для идентификации соединений, которые могут использоваться как анксиолитики.
Для определения болеутоляющего действия мышам через 30 мин после введения тестируемого соединения внутрибрюшинно вводили 10 мл/кг 0,15%-го раствора HCl. Затем мышей помещали в пластмассовые ящики и наблюдали за ними в течение 15 мин, определяя количество животных, у которых не наблюдались болевые судороги. Если как минимум у трех мышей, которым было введено тестируемое соединение, не наблюдалось судорог, тест для данного соединения повторяли при меньшей дозе.
Тесты на гипотермию и на гипоксический стресс показали, что соединения предлагаемого изобретения более эффективны, чем родственные соединения, и характеризуют значения ED50 на уровне 0,05 мг/кг. Кроме того, в гипотермическом тесте соединения продемонстрировали хорошую активность и в случае их введения животным оральным путем.
Дозировки для лечения пациентов с применением данных соединений должны выбираться в соответствии с рядом факторов, включая тип, возраст, пол, вес и состояние здоровья пациента, степень психоза, способы введения соединения и то, какое конкретно соединение используется. Для обладающего стандартными знаниями и опытом врача или психиатра не составит труда определить и прописать эффективное количество соединения, позволяющее предотвратить или остановить прогрессирование болезни. При этом врач или психиатр может вначале использовать относительно небольшие дозы, в дальнейшем увеличивая дозу до тех пор, пока не будет получен максимальный эффект.
Обычно начальные дозы соединений составляют от не менее 10 до около 1200 мг в день при оральном введении; это количество можно давать одной дозой или дробно несколькими дозами. При использовании других форм введения даются эквивалентные дозы. При использовании доз более 600 мг следует принимать меры предосторожности и следить за тем, чтобы каждая последующая доза не оказывала токсического действия.
Соединения настоящего изобретения могут вводиться в виде дискретных дозировочных форм для орального введения, таких как таблетки, капсулы, пилюли, порошки или гранулы. Их можно также вводить парэнтерально (например, подкожно, внутривенно, или внутримышечно), используя известные в фармацевтике формы. Их также можно применять ректально или вагинально в таких формах, как суппозитории или палочки. Как правило, предпочтительным способом введения является оральный.
Соединения настоящего изобретения могут также применяться в виде фармацевтически или терапевтически приемлемых солей, таких как соли, образованные со следующими кислотами: соляная, бромистоводородная, йодистоводородная, серная, фосфорная, уксусная, пропионовая, молочная, малеиновая, яблочная, янтарная, винная, циклогексансульфоновая, метансульфоновая, этансульфоновая, бензолсульфоновая, толуолсульфоновая и т.п. Кроме того, соединения настоящего изобретения могут применяться в форме гидратов.
П р и м е р 1. Бензилметилмалонат.
Смесь диметилмалоната (100 г, 0,75 моль) и бензилового спирта (108 г, 1 моль) нагревают в течение 2 ч при 180оС с дистилляционной насадкой для удаления образующегося при реакции метанола. Затем продукт перегоняют при пониженном давлении, получая 55 г предгона (смесь диметилмалоната и бензилового спирта) и 63 г (40%) бензилметилмалоната, т.кип.105-115оС/0,2 мм рт.ст. (чистота 98% согласно данным газовой хроматографии). Кубовый остаток представляет собой 71 г (33%) дибензилмалоната (чистота 90% по данным ГХ).
П р и м е р 2. Бензилметилброммалонат.
К перемешиваемому раствору бензилметилмалоната (20,8 г, 0,10 моль) в четыреххлористом углероде добавляют бром (17,6 г, 0,10 моль). Через 30 мин при пониженном давлении удаляют растворитель и получают 28 г продукта (чистота 85% по ГХ, содержит 7% бензилметилмалоната), который используют без дальнейшей очистки.
П р и м е р 3. Диэтил (дипропиламино)малонат (соединение VIb).
К перемешиваемому раствору диэтилброммалоната (47,8 г, 0,20 моль) в ТГФ (400 мл) добавляют дипропиламин (22,3 г, 0,22 моль). Раствор перемешивают 18 ч при комнатной температуре. Осадок гидробромида дипропиламида отфильтровывают и промывают ТГФ. Фазу ТГФ упаривают, маслообразный остаток делят между этилацетатом (200 мл) и раствором гидроокиси натрия (10 мл, 4 н.). Фазу этилацетата отделяют, промывают водой (дважды по 10 мл) и при пониженном давлении удаляют растворитель. Маслообразный остаток растворяют в равном количестве (по объему) гексана и пропускают через колонку с силикагелем (420 г), которую вначале элюируют смесью этилацетата: гексан (1: 20). Концентрацию этилацетата в элюенте медленно увеличивают до тех пор, пока из колонки не элюируется весь диэтил (дипропиламино) малонат. Собирают те фракции, которые по данным ТСХ и ГХ содержат целевое соединение, и удаляют растворитель, получая диэтил (дипроипиламино) малонат в виде масла с выходом 80-90%.
По этой методике, заменяя дипропиламин на диметиламин, пропиламин, N-метилбензиламин, N-пропилбензиламин, бензиламин, α-метилбензиламин и (R)- α -метилбензиламин, получают соединения VIa и VIc-VIh.
По этой методике, заменяя диэтилбромммалонат на бензилметилброммалонат и используя в качестве аминного компонента диметиламин, дипропиламин, пирролидин, пиперидин, морфолин, 4-метилпиперазин и имидазол, получают соединения VIi-VIp.
П р и м е р 4. Диэтил [N-(1,1-диметилэтоксикарбонил)пропиламино]-малонат (соединение VIIf).
Диэтиламиномалонат (21,1 г, 0,1 моль) растворяют в этаноле и добавляют раствор этилата натрия в этаноле (50 мл, 1М). К перемешиваемому раствору добавляют пропионовый альдегид (6,6 г, 0,11 моль) и цианоборгидрид натрия (3,6 г, 0,058 моль). Через 30 мин для завершения реакции добавляют дополнительные количества пропионового альдегида (6,0 г) и цианоборгидрида натрия (2,6 г). Раствор упаривают, остаток разделяют между этилацетатом и водой. После выпаривания этилацетата получают 25,1 г диэтил (пропиламино)малоната. Его смешивают с ди-трет-бутилдикарбонатом (34 г, 0,156 моль) и полученную смесь нагревают при 100оС, 1ч. Неочищенный продукт хроматографируют на силикагеле, используя в качестве смесь этилацетат: гексан, и получают 21,2 г диэтил [N-(1,1-диметилэтоксикарбонил)пропиламино] малоната в виде масла.
По такой же методике, заменяя ди-третбутилдикарбонат на пропионилхлорид, получают соединение VIIe.
П р и м е р 5. Диэтил (1-оксопропил)малонат (соединение VIId).
К раствору солянокислого диэтиламиномалоната (20,40 г, 0,096 моль) в ТГФ (300 мл) добавляют триэтиламин (20 г, 0,2 моль) и пропионовый ангидриид (12,54 г, 0,096 моль). Полученную реакционную смесь перемешивают при комнатной температуре в течение 45 мин. При пониженном давлении удаляют растворитель, а неочищенный продукт разделяют между этилацетатом и водой. Фазу этилацетата отделяют и упаривают, получая 34,64 г твердого вещества белого цвета. Его растворяют в горячем этилацетате (60 мл), добавляют 60 мл гексана и фильтруют раствор для отделения нерастворимого вещества. Раствор охлаждают до - 10оС и фильтруют, получая 17,63 г (72%) диэтил (1-оксопропил)малоната, т.пл. 89-93оС.
По такой же методике, заменяя пропионовый ангидрид на ди-трет-бутилдикарбонат, получают соединение VIIc.
П р и м е р 6. 8-(Бромметил)хинолин (соединение X).
Смесь 8-метилхинолина (45 г, 0,314 моль), N-бромсукцинимида (55 г, 0,309 моль) и перекиси бензоила (1,5 г) в четыреххлористом углероде (250 мл) кипятят с обратным холодильником в течение 7 ч. Реакционную смесь фильтруют, упаривают и неочищенный продукт кристаллизуют из метанола (70 мл), получая 37,7 г продукта. Маточные растворы хроматографируют на силикагеле в среде хлороформа, получая 17 г вещества, которое кристаллизуют из смеси этилацетат:гексан, получая еще 12 г продукта.
П р и м е р 7. Диэтил (формиламино)(8-хинолинилметил)пропандиоат (соединение XIa).
К перемешиваемому раствору этилата натрия в этаноле (приготовлен из 2,4 г натрия и 250 мл этанола, 0,10 моль) добавляют диэтил формиламино-малонат (22,0 г, 0,108 моль), спустя 5 мин добавляют 8-(бромметил)хинолин (22,0 г, 0,10 моль) и полученный раствор перемешивают еще 15 мин. При пониженном давлении удаляют растворитель и продукт разделяют между этилацетатом и водой. Этилацетат удаляют, полученный маслообразный остаток кристаллизуют из эфира, получая 19,9 г (58%) диэтил (формиламино)(8-хинолинилметил)пропандиоата, т.пл. 120-122оС.
Анализ для формулы C18H20N2O5:
Вычислено: C 62,78; H 5,85; N 8,14
Найдено: С 62,53; H 6,03; N 8,07
П р и м е р 8. N-[2,3,6,7-тетрагидро-3-оксо-1Н, 5Н-бензо(i, j)хинолизин-2-ил]-формамид (соединение XIIIa).
Часть А. Этил-2,3,6,7-тетрагидро-3-оксо-2-(формиламино)-1Н, 5Н-бензо(i, j)хинолизин-2-карбоксилат (соединение XIIa).
Смесь диэтил (формиламино)(8-хинолинилметил)малоната (9,2 г, 26,7 ммоль) и оксида платины (0,7 г) в ледяной уксусной кислоте (150 мл) гидрируют (начальное давление 3,5 атм) в течение 15 мин (поглощение водорода составляет примерно 2 эквивалента). Смесь фильтруют через целит, растворитель удаляют при пониженном давлении. Продукт разделяют между этилацетатом и раствором гидроокиси натрия. Этилацетатную фазу промывают водой, выпаривают этилацетат и полученный продукт кристаллизуют из эфира, получая 7,8 г (97%) этил-2,3,6,7-тетрагидро-3-оксо-2-(формила- мино)-1Н, 5Н-бензо(i, j)хинолизин-2-карбоксилата, т.пл. 103-106оС.
Анализ для формулы C16H18N2O4:
Вычислено: C 63,56; H 6,00; N 9,27.
Найдено: C 63,51; H 6,09; N 9,18.
Часть Б. N-[2,3,6,7-тетрагидро-3-оксо-1Н, 5Н-бензо(i,j)хинолизин-2-ил] формамид (соединение XIIIа).
К раствору этил-2,3,6,7-тетрагидро-3-оксо-2-(формиламино)-1Н, 5Н-бензо(i,j)хинолизин-2-карбоксилата (3,04 г, 10 ммоль) в метаноле (25 мл) медленно добавляют раствор гидроокиси натрия (5,0 мл, 4 н. раствора, 20 ммоль). После перемешивания при комнатной температуре в течение 30 мин добавляют соляную кислоту (5,0 мл, 4,0) осадок отфильтровывают, промывают водой и сушат на воздухе, получая 2,4 г N-[2,3,6,7-тетрагидро-3-оксо-1Н, 5Н-бензо(i,j)хинолизин-2-ил]формамида, т.пл. 149-152оС. Часть этого продукта перекристаллизовывают из этилацетата для анализа. т.пл. 140-143оС.
Анализ для формулы C13H14N2O2:
Вычислено: C 67,81; H 6,13; N 12,17.
Найдено: C 67,67; H 6,07; N 11,94.
П р и м е р 9. 2,3,6,7-Тетрагидро-N,N-диметил-1Н, 5Н-бензо(i, j)хинолизин-2-амин (соединение I).
Часть А. 2,3,6,7-Тетрагидро-3-оксо-1Н, 5Н-бензо(i,j)хинолизин-2-амин (соединение XIV).
Раствор N-[2,3,6,7-тетрагидро-3-оксо-1Н, 5Н-бензо(i,j)-хинолизин-2-ил] формамида (0,8 г, 3,4 ммоль) в этанольном растворе хлористого водорода (10 мл, 4,2 М) нагревают при 50оС в течение 2 ч. Этанол охлаждают, добавляют равный объем эфира, получая 0,78 г солянокислого 2,3,6,7-тетрагидро-3-оксо-1Н, 5Н-бензо(i, j)хинолизин-2-амина, т.пл. 216-221оС. Продукт был перекристаллизован для анализа, т.пл. 219-222оС.
Анализ для формулы C12H14N2O ˙HCl:
Вычислено: C 60,37; H 6,33; Cl 14,85, N 11,74.
Найдено: C 59,89; H 6,42; Cl 15,41; N 11,68.
Часть Б. 2,3,6,7-Тетрагидро-N,N-диметил-1Н, 5Н-бензо(i,j)хинолизин-2-амин (соединение I).
Смесь 2,3,6,7-тетрагидро-3-оксо-1Н, 5Н-бензо(i,j)хинолизин-2-амина (2 г), 30% -ный раствор формальдегида (1 мл) и катализатор - 10% палладия на угле (0,5 г) в этаноле (150 мл) гидрируют (начальное давление водорода 3,5 атм) до полного поглощения водорода (2 ч). Для удаления катализатора раствор фильтруют, затем упаривают, неочищенный продукт растворяют в эфире (300 мл) и добавляют литийалюминийгидрид (1,5 г). Спустя час добавляют этилацетат, при пониженном давлении удаляют растворители и разделяют продукт между этилацетатом и водой. После выпаривания этилацетата получают масло, которое очищают хроматографированием на силикагеле, получая 1,03 г 2,3,6,7-тетрагидро-N,N-диметил-1Н, 5Н-бензо(i,j)хинолизин-2-амин.
Большую часть продукта превращают в соль малеиновой кислоты, т.пл. 135-137оС. Образец перекристаллизовывают для анализа из смеси метанол:эфир.
Анализ для формулы: C14H20N2C4H4O4:
Вычислено: C 65,04; H 7,28; N 8,43.
Найдено: C 64,72; H 7,43; N 8,20.
П р и м е р 10. 2,3,6,7-Тетрагидро-N-метил-1Н, 5Н-бензо(i, j)хинолизин-2-амин и N-этил-2,3,6,7-тетрагидро-N-метил-1Н, 5Н-бензо(i, j)хинолизин-2-амин (соединение 2 и 3).
N-[2,3,6,7-тетрагидро-3-оксо-1Н, 5Н-бензо(i,j)хинолизин-ил]формамид (4 г, 0,017 моль) аликвотами по 0,5 г с интервалами 10 мин добавляют к перемешиваемому раствору литийалюминийгидрида (2,77 г, 0,073 моль) в безводном эфире (500 мл). После перемешивания в течение ночи при комнатной температуре реакционную смесь кипятят с обратным холодильником в течение 3 ч, охлаждают на льду и обрабатывают этилацетатом и метанолом. Растворитель выпаривают при пониженном давлении, неочищенный продукт разделяют между этилацетатом (800 мл) и водой (40 мл). Этилацетатный слой отделяют, промывают водой и выпаривают этилацетат, получая 3,64 г неочищенного продукта. Его хроматографируют на силикагеле в среде хлороформа, получая 1,4 г N-этил-2,3,6,7-тетрагидро-N-метил-1Н, 5Н-бензо(i, j)хинолизин-2-амина, который вымывается из колонки первым. Это соединение превращают в соль малеиновой кислоты, т. пл. 90-100оС, в смеси метанол:эфир. Для анализа продукт перекристаллизовывают; т.пл. 94-98оС.
Анализ для формулы C15H22N2C4H4O4:
Вычислено: C 65,87; H 7,57; N 8,09.
Найдено: C 65,53; H 7,81; N 8,08.
При дальнейшем элюировании колонки получают 1,3 г 2,3,6,7-тетрагидро-N-метил-1Н, 5Н-бензо(i, j)хинолизин-2-амина, который превращают в соль малеиновой кислоты, т.пл. 151-155оС, из смеси метанол:эфир.
Анализ для формулы C13H18N2C4H4O4:
Вычислено: C 64,13; H 6,97; N 8,80.
Найдено: C 63,79; H 7,16; N 8,62.
П р и м е р 11. Диэтил-[(1-оксопропил)амино](8-хинолинилметил)пропандиоат (соединение XI).
Диэтил-(1-оксопропил)малонат (15,14 г, 0,065 моль) добавляют к перемешиваемому раствору этилата натрия в этаноле (165 мл, 0,4 М раствора, 0,066 моль). Спустя 5 мин добавляют 8-(бромметил)хинолин (13,15 г, 0,059 моль) и раствор перемешивают еще 15 мин. Растворитель удаляют при пониженном давлении, продукт растворяют в этилацетате (300 мл), промытом водой (3 раза по 10 мл). Этилацетат удаляют, твердый остаток (27,3 г) кристаллизуют из смеси этилацетат: гексан, получая 21,6 г желто-коричневых кристаллов с т.пл. 80-100оС. Перекристаллизация аликвоты (4 г) из смеси этилацетат:гексан дает 2,87 г желто-коричневых кристаллов, т.пл. 104-106оС.
Анализ для формулы C20H24N2O5:
Вычислено: C 64,50; H 6,50; N 7,52.
Найдено: C 64,25; H 6,51; N 7,51.
П р и м е р 12. Этил-2,3,6,7-тетрагидро-3-оксо-2-[(1-оксопропил)-амино] -1Н, 5Н-бензо(i,j)хинолизин-2-карбоксилат (соединение XIIb).
Смесь диэтил-[(1-оксопропил)амино] (8-хинолинилметил)-пропандиоата (17,47 г, 0,047 моль) и оксида платины (0,72 г) в среде ледяной уксусной кислоты (150 мл) гидрируют (начальное давление водорода 3,5 атм) до тех пор, пока не прекратится поглощение водорода (1,8 эквивалентов). Смесь фильтруют через целит, растворитель удаляют при пониженном давлении. Продукт кристаллизуют из этилацетата, получая 12,08 г кристаллов с т.пл. 136-140оС. Для анализа образец перекристаллизовывают из этилацетата; т.пл. 137-141оС.
Анализ для формулы C18H22N2O4:
Вычислено: C 65,44; H 6,71; N 8,48.
Найдено: C 65,66; H 6,64; N 8,43.
П р и м е р 13. N-[2,3,6,7-тетрагидро-3-оксо-1Н, 5Н-бензо(i, j)хинолизин-2-ил]-пропанамид (соединение XIIIb).
К раствору этил-2,3,6,7-тетрагидро-3-оксо-2-[(1-оксопропил)амино]-1Н, 5Н-бензо(i, j)хинолизин-2-карбоксилата (3,33 г, 0,010 моль) в метаноле (50 мл) медленно добавляют раствор гидроокиси натрия (10 мл 4,0 н. раствора, 0,04 моль). После перемешивания в течение 30 мин при комнатной температуре при пониженном давлении удаляют растворитель. Полученное твердое вещество растворяют в воде (20 мл) и метаноле (следовые количества), нейтрализуют 4 н. соляной кислотой (10 мл, 0,04 моль), охлаждают до - 10оС, осадок отфильтровывают и сушат на воздухе, получая 2,86 г 2,3,6,7-тетрагидро-3-оксо-2-[(1-оксопропил) амино]-1Н, 5Н-бензо(i,j)хинолизин-2-карбоновой кислоты. Этот продукт в течение 20 мин кипятят с обратным холодильником в среде этанола для осуществления декарбоксилирования. Этанол удаляют при пониженном давлении, твердый продукт перекристаллизовывают из смеси этилацетат:гексан, получая 1,85 г N-[2,3,6,7-тетрагидро-3-оксо-1Н, 5Н-бензо(i,j)хинолизин-2-ил] пропанамида, т.пл. 149-152оС. Образец перекристаллизовывают для анализа; т. пл. 152-154оС.
Анализ для формулы C15H18N2O2:
Вычислено: C 69,74; H 7,02; N 10,85.
Найдено: C 69,33; H 7,33; N 10,68.
П р и м е р 14. 2,3,6,7-Тетрагидро-N-пропил-1Н, 5Н-бензо(i, j)хинолизин-2-амин (соединение 4).
N-[2,3,6,7-тетрагидро-3-оксо-1Н, 5Н-бензо(i,j)хинолизин-2-ил]пропанамид (2,5 г, 0,01 моль) растворяют в безводном эфире (500 мл). Раствор охлаждают до 0оС, добавляют литийалюминийгидрид (1,46 г, 0,038 моль) и кипятят реакционную смесь с обратным холодильником в течение 4 ч. Реакционную смесь "гасят" этилацетатом и метанолом, при пониженном давлении удаляют растворители и полученный продукт разделяют между этилацетатом (400 мл) и водой (50 мл). После упаривания этилацетатной фазы получают 2,35 г желтого масла. Этот продукт очищают хроматографированием на силикагеле. Элюирование смесями метанол: хлороформ с содержанием метанола 1 и 2,5% дает 2,07 г 2,3,6,7-тетрагидро-N-пропил-1Н, 5Н-бензо(i,j)изохинолизин-2-амина.
Этот продукт превращают в гидрофумарат, который перекристаллизовывают из смеси метанол:эфир, т.пл. 190-194оС.
Анализ для формулы C15H22N2 ˙1/2C4H4O4:
Вычислено: C 70,80; H 8,39; N 9,71.
Найдено: C 70,37; H 8,26; N 9,65.
П р и м е р 15. 2,3,6,7-Тетрагидро-N, N-дипропил-1Н, 5Н-бензо(i, j)хинолизин-2-амин (соединение 5).
Смесь 2,3,6,7-тетрагидро-N-пропил-1Н, 5Н-бензо(i, j)хинолизин-2-амина (2,33 г, 0,01 моль), иодистого пропила (5,16 г, 0,03 моль) и безводного карбоната калия (3 г, 0,02 моль) в диметилформамиде (75 мл) перемешивают 5 ч при 90оС. После этого добавляют дополнительные количества йодистого пропила (1,72 г, 0,01 моль) и карбоната калия (0,5 г, 0,0036 моль) и ведут реакцию еще 2 ч. Реакционную смесь охлаждают, фильтруют для удаления неорганических соединений и при пониженном давлении удаляют растворитель. Полученный продукт разделяют между этилацетатом (800 мл) и 4 н. раствором гидроокиси натрия (20 мл, 0,08 моль), органический слой концентрируют, фильтруют и хроматографируют на силикагеле в смеси 5-30% этилацетата:гексана, получая 2,19 г 2,3,6,7-тетрагидро-N,N-дипропил-1Н, 5Н-бензо(i,j)хинолизин-2-амина.
Часть этого продукта превращают в соль фумаровой кислоты с т.пл. 112,5-116оС. Перекристаллизация из смеси метанол:эфир дает легкие коричневые кристаллы с т.пл. 112-116оС.
Анализ для формулы C18H28N2C4H4O4:
Вычислено: C 68,01; H 8,30; N 7,21.
Найдено: C 67,73; H 8,47; N 7,14.
П р и м е р 16. 4-Метил-1Н-бензимидазол (соединение XVIII).
Часть А. 3-Метил-1,2-бензолдиамин (соединение XVII).
2-Метил-6-нитроаналин (15,2 г, 0,1 моль) растворяют при нагревании в этаноле (150 мл). Раствор охлаждают, добавляют катализатор - 10% палладия на угле - и проводят гидрирование (начальное давление водорода 3,5 атм) до тех пор, пока не прекратится поглощение водорода (1 ч). Катализатор отфильтровывают, при пониженном давлении удаляют этанол и получают 11,9 г (98%) 3-метил-1,2-бензолдиамина, который используют без дополнительной очистки.
Часть Б. 4-Метил-1Н-бензимидазол (соединение XVIII).
Смесь 3-метил-1,2-бензолдиамина (11,9 г) и муравьиной кислоты (150 мл) нагревают при 70оС в течение 15 мин. Растворитель удаляют при пониженном давлении, а маслообразный остаток перемешивают с водой (100 мл), добавляя раствор гидроокиси натрия (65 мл, 4,0 н.) до тех пор, пока раствор не станет щелочным. Осадок отфильтровывают, промывают водой и сушат на воздухе, получая 11,6 г (90%) 4-метил-1Н-бензимидазола, т.пл. 141-145оС.
П р и м е р 17. Трет-бутил-4-(бромметил)-1Н-бензимидазол-1-карбоксилат (соединение XXa).
Часть А. Трет-бутил-4-метил-1Н-бензимидазол-1-карбоксилат (соединение XIXa).
Смесь 4-метил-1Н-бензимидазола (11,6 г, 0,088 моль) и ди-трет-бутил-дикарбоната (21,1 г, 0,097 моль) в диоксане (200 мл) нагревают при 80оС в течение 1 ч. Растворитель удаляют при пониженном давлении, а маслообразный остаток хроматографируют на силикагеле, используя в качестве элюента смесь этилацетат: гексан. Получают 18,7 г (92%) трет-бутил-4-метил-1Н-бензимидазол-1-карбоксилата в виде масла.
Часть Б. Трет-бутил-4-(бромметил)-1Н-бензимидазол-1-карбоксилат (соединение XXa).
Смесь трет-бутил-4-метил-1Н-бензимидазол-1-карбоксилата (11,6 г, 0,05 моль), N-бромсукцинимида (8,9 г, 0,05 моль) и перекиси бензоила (0,25 г) в четыреххлористом углероде (100 мл) перемешивают и кипятят с обратным холодильником в течение 1 ч. Раствор охлаждают и фильтруют, удаляя сукцинимидные побочные продукты, после чего удаляют растворитель. Неочищенный продукт хроматографируют на силикагеле, используя в качестве исходного элюента смесь этилацетат:гексан (1:20). В качестве первого основного продукта, элюируемого из колонки, получают 1,6 г трет-бутил-4-(дибромметил)-1Н-бензимидазол-1-карбок- силата; перекристаллизация из гексана дает 1,04 г продукта с т.пл. 101-104оС.
Анализ для формулы C13H14Br2N2O2:
Вычислено: C 40,03; H 3,62; Br 40,92; N 7,18.
Найдено: C 39,87; H 3,83; Br 41,18; N 7,19.
При дальнейшем элюировании колонки получают 10,4 г трет-бутил-4-(бромметил)-1Н-бензимидазол-1-карбоксилата. Это соединение перекристаллизовывают из гексана, получая 9,6 г продукта с т.пл. 87-89оС.
Анализ для формулы C13H15BrN2O2:
Вычислено: C 50,18; H 5,04; Br 25,71; N 9,11.
Продолжение элюирования позволяет выделить еще 0,95 г трет-бутил-4-(бромметил)-1Н-бензимидазол-1-карбоксилата.
По методике примера 17 (часть Б), используя метил-4-метил-1Н-бензимидазол-1-карбоксилат вместо трет-бутил-4-метил-1Н-бензимидазол-1-карбоксилата, получают метил-4-(бромметил)-1Н-бензимидазол-1-карбоксилат (соединение ХХ).
По методике примера 17 (часть Б), используя 1-ацетил-4-метил-1Н-бензимидазол вместо трет-бутил-4-метил-1Н-бензимидазол-1-карбоксилата, получают 1-ацетил-4-(бромметил)-бензимидазол (соединение ХХс), т.пл. 109-112оС.
Анализ для формулы C10H10BrN2O:
Вычислено: C 47,45; H 3,58; Br 31,58; N 11,07.
Найдено: C 47,47; H 3,82; Br 29,17; N 11,21.
П р и м е р 18. 5,6-Дигидро-N,N-дипропил-4Н-имидазо(4,5,1-i, j)хинолин-5-амин (соединение 6).
Часть А. Диэтил-D{[(1,1-диметилэтоксикарбонил)-1Н-бензимидазол-4-ил]метил}- (дипропиламино)пропандиоат (соединение XXIa).
К перемешиваемому раствору диэтил-(дипропиламино)малоната (10,2 г, 0,039 моль) в сухом ТГФ (100 мл) добавляют гидрид калия (3,3 г 40%-ной суспензии в масле, промыта эфиром для удаления масла, 0,03 моль). Через 5 мин добавляют трет-бутил-4-(бромметил)-1Н-бензимидазол-1-карбокси- лат (6,22 г, 0,02 моль) и кипятят раствор с обратным холодильником в течение 6 ч. Растворитель удаляют при пониженном давлении, а маслообразный остаток разделяют между этилацетатом и водой. После выпаривания этилацетата неочищенный продукт хроматографируют на силикагеле, элюируя смесью этилацетат:гексан. Получают 7,9 г диэтил-{[(1,1-диметилэтоксикарбонил)-1Н-бензимидазол-4-ил]метил}- (дипропиламино)-проипандиоат в виде масла.
Часть Б. Этил- α-(дипропиламино)-1Н-бензимилазол-4-пропаноат (соединение XXII).
Диэтил-{ [(1,1-диметилэтоксикарбонил)- 1Н-бензимилазол-4-ил] метил} - (дипропиламино)пропанодиоат (3,4 г, 6,9 ммоль) растворяют в этаноле (50 мл), обрабатывают этилатом натрия в этаноле (35 мл 0,8 М раствора, 4 эквивалента) и водой (1 мл). Полученную реакционную смесь кипятят с обратным холодильником в течение 4 ч. Затем раствор охлаждают, нейтрализуют добавлением 15 мл 2,2 н. HCl в этаноле, фильтруют для удаления хлорида натрия и удаляют растворитель при пониженном давлении. Продукт разделяют между этилацетатом и водой, удаляют этилацетат и хроматографируют неочищенный продукт на силикагеле, используя хлороформ в качестве начального элюента. Элюирование смесью 5% метанола:хлороформа дает 1,60 г этил-α -(дипропиламино)-1Н-бензимидазол-4-пропаноата. Продукт кристаллизуют из смеси этилацетат:гексан; т.пл. 78-80оС.
Анализ для формулы C18H27N3O2:
Вычислено: C 68,11; H 8,57; N 13,24.
Найдено: C 68,41; H 8,51; N 13,22.
Часть В. β -(Дипропиламино)-1Н-бензимидазол-4-пропанол (соединение XXIII).
К перемешиваемому раствору этил-α-(дипропиламино)-1Н-бензимидазол-4-про-паноата (1,5 г, 4,7 ммоль) в сухом ТГФ (50 мл) при 0оС добавляют литийалюминийгидрид (250 мг, 6,6 ммоль) и дают раствору нагреться до комнатной температуры. ТСХ в среде смеси 10% метанола - хлороформ показывает, что реакция проходит до конца за 15 мин. Добавляют этанол (5 мл) и при пониженном давлении удаляют растворитель. Остаток разделяют между этилацетатом и водой. После выпаривания этилацетата получают 1,3 г β-(дипропиламино)-1Н-бензимидазол-4-пропанола, который используют без дополнительной очистки.
Часть Г. 5,6-Дигидро-N, N-дипропил-4Н-имидазо(4,5,1-ij)хинолин-5-амин (соединение 6).
К перемешиваемому раствору β-(дипропиламино)-1Н-бензимидазол-4-пропанола (600 мг, 2,18 ммоль) в хлористом метилене (12 мл) добавляют трифенилфосфин (625 мг, 2,4 ммоль). По окончании растворения добавляют четырехбромистый углерод (940 мг, 2,8 ммоль) и перемешивают раствор 30 мин. Добавляют хлористый метилен (20 мл) и экстрагируют раствор 25 мл 1,0 н. соляной кислоты. Отделяют хлористый метилен, повторно экстрагируют 10 мл 1,0 н. соляной кислоты, соединенные водные экстракты подщелачивают (20 мл 4,0 н. едкого натра) и экстрагируют этилацетатом. После удаления этилацетата продукт хроматографируют на силикагеле, используя в качестве начального растворителя хлороформ; получают 380 мг продукта. Образец для анализа кристаллизуют из гексана; т.пл. 95-98оС.
Анализ для формулы С16H23N3:
Вычислено: C 74,66; H 9,01; N 16,33.
Найдено: C 74,28; H 9,25; N 16,36.
П р и м е р 19. 5,6-Дигидро-N,N-диметил-4Н-имидазо(4,5,1-i,j)хинолин-5-амин (соединение 7).
Часть А. Метилбензиловый диэфир (диметиламино)-{[(1,1-диметилэтоксикарбонил)- 1Н-бензимидазол-4-ил] метил}пропандионовой кислоты.
Это соединение получают по методике примера 18 (часть А), используя вместо диэтил(дипропиламино)малоната метилбензило- вый диэфир(диметиламино)пропандионовой кислоты (соединение VIi).
Часть Б. Метил-α-(диметиламино)-1Н-бензимидазол-4-пропаноат.
Смесь метилбензилового диэфира (диметиламино)-{[(1,1-диметилэтоксикарбонил)- 1Н-бензимидазол-4-ил] метил}-пропандионовой кислоты (6,0 г) и 10% палладия на древесном угле (1 г) в этаноле (150 мл) гидрируют до прекращения поглощения водорода. Раствор фильтруют и упаривают, получая 4,1 г метил-α-(диметиламино)-1Н-бензимидазол-4-пропаноата в виде масла.
Часть В. β-(Диметиламино)-1Н-бензимидазол-4-пропанол.
Это соединение получают по методике примера 18 (часть В), используя вместо этил-α-(дипропиламино)-1Н-бензимидазол -4- пропаноата метил-α-(диметиламино)-1Н-бензимидазол-4-пропаноат.
Часть Г. 5,6-Дигидро-N,N-диметил-4Н-имидазо(4,5,1-ij)хинолин-5-амин.
Это соединение получают по методике примера 18 (часть Г), используя β -(диметиламино)-1Н-бензимидазол-4-пропанол вместо β-(дипропиламино)-1Н-бензимидазол-4-пропанола.
Полученный продукт превращают в солянокислую соль с т.пл. 264-265оС из смеси метанол:эфир.
Анализ для формулы C12H15N3 ˙2HCl:
Вычислено: C 52,56; H 6,25; Сl 25,86; N 15,33.
Найдено: C 52,44; H 6,53; Cl 25,64; N 15,18.
П р и м е р 20. 1-[5,6-Дигидро-4Н-имидазо(4,5,1-i,j)хинолин-5-ил]-пирролидин (соединение 8).
Это соединение получают по методике примера 19, используя метилбензиловый диэфир (1-пирролидинил) пропандионовой кислоты (соединение VIk) вместо метилбензилового диэфира (диметиламино)пропандионовой кислоты (соединение VIi). Полученный продукт превращают в дигидрохлорид с т.пл. 291-294оС.
П р и м е р 21. 2-[5,6-Дигидро-4Н-имидазо(4,5,1-i,j)хинолин-5-ил]-пиперидин (соединение 9).
Это соединение получают по методике примера 19, используя метилбензиловый диэфир (1-пиперидинил)пропандионовой кислоты (соединение VIm) вместо метилбензилового диэфира диметиламинопропандионовой кислоты (соединение VIi). Полученный продукт превращают в дигидрохлорид с т.пл. 287-290оС.
П р и м е р 22. 4-[5,6-Дигидро-4Н-имидазо(4,5,1-i,j)хинолин-5-ил]-морфолин (соединение 10).
Это соединение получают по методике примера 19, используя метилбензиловый диэфир (4-морфолинил)пропандионовой кислоты (соединение VIn) вместо метилбензилового диэфириа (диметиламино)пропандионовой кислоты (соединение VIi). Полученный продукт превращают в дигидрохлорид с т.пл. 290-292оС.
П р и м е р 23. 1-[5,6-Дигидро-4Н-имидазо(4,5,1-i,j)хинолин-5-ил]-имидазол (соединение II).
Это соединение получают по методике примера 19, используя метилбензиловый диэфир (1-имидазолил) пропандионовой кислоты (соединение VIp) вместо метилбензилового диэфира (диметиламино)пропандионовой кислоты (соединение VIi). Полученный продукт превращают в моногидробромид с т.пл. 239-242оС.
П р и м е р 24. 1-[5,6-Дигидро-4Н-имидазо(4,5,1-i,j)хинолин-5-ил]-4-метилпипера- зин (соединение 12).
Это соединение получают по методике примера 19, используя метилбензиловый диэфир 4-метил-1-пиперазинил пропандионовой кислоты (соединение VIq) вместо метилбензилового диэфира (диметиламино)пропандионовой кислоты (соединение VIi).
П р и м е р 25. N-(1-фенилэтил)-5,6-дигидро-4Н-имидазо(4,5,1-i,j)-хинолин-5-амин (соединение 13).
Это соединение получают по методике примера 18, используя диэтил(1-фенилэтиламино)малонат (соединение VIg) вместо диэтил(дипропиламино)малоната (соединение VIb).
П р и м е р 26. Трет-бутил-4-(бромметил)-5-метокси-1Н-бензимидазол-1-карбок- силат.
Часть А. 3-Хлор-2-метил-6-нитробензоламин.
Суспензию 2,6-дихлор-4-нитротолуола (6,0 г, 29 ммоль) в 50%-ом метанольном растворе аммиака (60 мл) перемешивают при 130оС (давление 24 атм) в течение 18 ч. Охлаждают автоклав до - 30оС, открывают его, отфильтровывают осадок и промывают его метанолом, получая 4,14 г (76%) 3-хлор-2-метил-6-нитробензоламина.
Часть Б. 3-Метокси-2-метил-6-нитробензоламин.
К перемешиваемой суспензии 3-хлор-2-метил-6-нитробензоламина (4,0 г, 23,5 ммоль) в метаноле (250 мл) добавляют раствор метилата натрия в метаноле (110 мл, 25%-й раствор, 0,49 моль, 20 эквивалентов), полученную смесь перемешивают и кипятят с обратным холодильником в течение 18 ч. Раствор охлаждают, нейтрализуют метанольным раствором хлористого водорода, фильтруют для удаления хлорида натрия и удаляют растворитель при пониженном давлении. Твердый остаток разделяют между этилацетатом и водой. После выпаривания этилацетата получают 3,7 г (86%) 3-метокси-2-метил-6-нитробензоламина.
Часть В. 4-Метокси-3-метил-1,2-бензолдиамин.
Смесь 3-метокси-2-метил-4-нитробензоламина (3,5 г, 19,0 ммоль) и 10% палладия на угле (1,0 г) гидрируют (начальное давление водорода 3,5 атм) в среде абсолютного этанола (150 мл) до тех пор, пока не прекратится поглощение водорода (30 мин). Раствор фильтруют через целит и удаляют этанол, получая 2,84 г (98%) 4-метокси-3-метил-1,2-бензолдиамина.
Часть Г. 5-Метокси-4-метил-1Н-бензимидазол.
Смесь 4-метокси-3-метил-1,2-бензолдиамина (2,8 г, 18,4 ммоль) и муравьиной кислоты (30 мл) нагревают при 60оС в течение 30 мин. При пониженном давлении удаляют муравьиную кислоту, разделяют продукт между хлороформом и водой, содержащей достаточное количество гидроокиси натрия для того, чтобы подщелочить раствор. После выпаривания растворителя неочищенный продукт хроматографируют (метанол: хлороформ), получая 2,55 г (84%) 5-метокси-4-метил-1Н-бензимидазола.
Часть Д. Трет-бутил-5-метокси-4-метил-1Н-бензимидазол-1-карбоксилат.
Смесь 5-метокси-4-метил-1Н-бензимидазола (2,5 г, 15,4 ммоль) и ди-трет-бутилдикарбоната (4,2 г, 19,3 ммоль) в диоксане (70 мл) нагревают при 100оС в течение 1 ч. После выпаривания растворителя остаток хроматографируют на силикагеле, получая 3,75 г (93%) трет-бутил-5-метокси-4-метил-1Н-бензимидазол-1-карбоксилата.
Часть Е. Трет-бутил-4-(бромметил)-5-метокси-1Н-бензимидазол-1-карбоксилат.
Смесь N-бромсукцинимида (2,66 г, 15 ммоль), перекиси бензоила (0,35 г) и трет-бутил-5-метокси-4-метил-1Н-бензимидазол-1- карбоксилата (3,70 г, 14,1 ммоль) в четыреххлористом углероде (70 мл) кипятят с обратным холодильником в течение 1 ч. Раствор охлаждают, фильтруют для удаления сукцинимидных побочных продуктов, упаривают, остаток растворяют в этилацетате и хроматографируют на силикагеле, элюируя смесью этилацетат:гексан; получают 4,8 г продукта. Этот продукт кристаллизуют из смеси этилацетат:гексан, получая 3,6 г (75%) трет-бутил-4-(бромметил)-5-метокси-1Н-бен- зимидазол-1-карбоксилата, т.пл. 127-129оС.
Анализ для формулы C14H17BrN2O3:
Вычислено: C 49,28; H 5,02; Br 23,42; N 8,21.
Найдено: C 49,27; H 4,98; Br 26,81; N 7,71.
П р и м е р 27. 5,6-Дигидро-7-метокси-N,N-дипропил-4Н-имидазо (4,5,1-ij) хинолин-5-амин (соединение 14).
Это соединение получают по методике примера 18, используя трет-бутил-4-(бромметил)-5-метокси-1Н-бензимидазол-1-кар-боксилат вместо трет-бутил-4-(бромметил)-1Н-бензимидазол-1-карбоксилата. Полученный продукт перекристаллизовывают из пентана; т.пл.46-49оС.
Анализ для формулы C17H25N3O:
Вычислено: C 71,04 H 8,77 N 14,62
Найдено: C 70,80 H 8,89 N 14,80
Продукт превращают в дигидрохлорид.
П р и м е р 28. 5,6-Дигидро-8-метокси-N,N-дипропил-4Н-имидазо-(4,5,1-ij) хинолин-5-амин (соединение 15).
Это соединение получают по методике примера 18, используя трет-бутил-4-(бромметил)-6-метокси-1Н-бензимидазол-1-кар-боксилат вместо трет-бутил-4-(бромметил)-1Н-бензимидазол-1-карбоксилата.
П р и м е р 29. 5,6-Дигидро-9-метокси-N,N-дипропил-4Н-имидазо-(4,5,1-ij) хинолин-5-амин (соединение 16).
Это соединение получают по методике примера 18, используя трет-бутил-4-(бромметил)-7-метокси-1Н-бензимидазол-1-кар-боксилат вместо трет-бутил-4-(бромметил)-1Н-бензимидазол-1-карбоксилата.
П р и м е р 30. 5,6-Дигидро-7-метокси-N,N-диметил-4Н-имидазо (4,5,1-ij) хинолин-5-амин (соединение 17).
Это соединение получают по методике примера 18, используя трет-бутил-4-(бромметил)-5-метокси-1Н-бензимидазол-1-кар-боксилат вместо трет-бутил-4-(бромметил)-1Н-бензимидазол-1-карбоксилата и диэтил (диметиламино) малонат вместо диэтил (дипропиламино) малоната.
П р и м е р 31. 7-Хлор-5,6-дигидро-N,N-дипропил-4Н-имидазо (4,5,1-ij) хинолин-5-амин (соединение 18).
Это соединение получают по методике примера 18, используя трет-бутил-5-хлор-4-(бромметил)-1Н-бензимидазол-1-карбокси- лат вместо трет-бутил-4-(бромметил)-1Н-бензимидазол-1-карбоксилата.
П р и м е р 32. 5-(Дипропиламино)-5,6-дигидро-4Н-имидазо-4,5,1-ij) хинолин-7-ол (соединение 19).
5,6-Дигидро-7-метокси-N,N-дипропил-4Н-имидазо (4,5,1-ij) хинолин-5-амин (1 г) нагревают при 130оС в течение 2 ч в среде 48%-ной бромистоводородной кислоты. Раствор охлаждают, после чего упаривают при пониженном давлении. Полученный твердый продукт кристаллизуют из смеси метанол: эфир, т.пл. 270оС.
П р и м е р 33. 5,6-Дигидро-5-(дипропиламино)-4Н-имидазо (4,5,1-ij) хинолин-8-ол (соединение 20).
Это соединение получают по методике примера 32, используя 5,6-дигидро- 8-метокси-N,N-дипропил-4Н-имидазо (4,5,1-ij)хинолин-5-амин вместо 5,6-дигидро-7-метокси-N,N-дипропил-4Н-имидазо- (4,5,1-ij) хинолин-5-амина.
П р и м е р 34. 5,6-Дигидро-5-(дипропиламино)-4Н-имидазо (4,5,1-ij) хинолин-9-ол (соединение 20).
Это соединение получают по методике примера 32, используя 5,6-дигидро-9-метокси-N, N-дипропил-4Н-имидазо (4,5,1-ij) хинолин-5-амин вместо 5,6-дигидро-7-метокси-N,N-дипропил-4Н-имидазо-(4,5,1-ij) хинолин-5-амина.
П р и м е р 35. N-(3-Хинолин) формамид (соединение XXV).
Раствор уксусно-муравьиного ангидрида получают медленно добавляя 95-97% -ную муравьиную кислоту (20,80 г, 17,05 мл, 0,45 моль) к уксусному ангидриду (40,84 г, 37,7 мл, 0,40 моль) при 0оС. Полученный раствор перемешивают при комнатной температуре в течение 2 ч, после чего добавляют его к перемешиваемому раствору 3-аминохинолина (28,84 г, 0,20 моль) в сухом тетрагидрофуране (300 мл). Спустя 15 мин раствор упаривают, добавляют метанол (50 мл) и полученный раствор перемешивают 30 мин. Раствор упаривают при пониженном давлении, а маслообразный остаток растирают с эфиром. Полученное твердое вещество белого цвета отфильтровывают, получая 28,7 г (84%) продукта с т.пл.157-160оС.
Анализ для формулы C10H8N2O:
Вычислено: C 69,75 H 4,68 N 16,27
Найдено: C 69,45 H 4,78 N 16,31
П р и м е р 36. N-(1-Формил-1,2,3,4-тетрагидро-3-хинолин) формамид (соединение XXXVI).
Смесь N-(3-хинолин) формамида (30 г, 0,175 моль), оксида платины (2 г) и уксусной кислоты (300 мл) гидрируют (начальное давление водорода 3,5 атм) до поглощения двух эквивалентов водорода (время реакции 3 ч). Смесь фильтруют через целит и удаляют уксусную кислоту при пониженном давлении. Остаток растворяют в этилацетате и промывают раствором едкого натра и водой. После выпаривания этилацетата получают 29,4 г неочищенного вещества. Это вещество растворяют в 200 мл ТГФ. При 0оС добавляют к полученному раствору муравьиный ангидрид (получен из муравьиной кислоты, 27,2 г, 0,59 моль) и уксусный ангидрид (53,5 г, 0,52 моль). Через 15 мин раствору дают нагреться до комнатной температуры, а еще через 15 мин добавляют метанол (60 мл). Раствор упаривают и полученное масло разделяют между этилацетатом и 4 н. раствором гидроокиси натрия. Раствор гидроокиси натрия повторно экстрагируют этилацетатом. Соединенные этилацетатные экстракты упаривают, полученный неочищенный продукт очищают хроматографированием на силикагеле, используя в качестве элюента смесь 2,5% метанола: хлороформа. Получают 22,55 г (69%) продукта. Образец для анализа кристаллизуют из смеси метанол:эфир (1:3); т. пл.125-128оС.
Анализ для формулы C11H18N2O2:
Вычислено: C 64,69 H 5,92 N 13,72
Найдено: C 64,60 H 5,97 N 13,66
П р и м е р 37. N-(1-Формил-6-бром-1,2,3,4-тетрагидро-3-хинолил)-формамид (соединение XXVII).
К перемешиваемому раствору N-(1-формил-1,2,3,4-тетрагидро-3-хинолил)формами- да (14 г, 0,065 моль) в уксусной кислоте (70 мл), содержащему безводный ацетат натрия (10,2 г, 0,12 моль), добавляют бром (10,2 г, 0,064 моль). Раствор перемешивают 30 мин и добавляют воду (500 мл). Осадок отфильтровывают и сушат на воздухе, получая 15,8 г (86%) N-(1-формил-6-бром-1,2,3,4-тетрагидро-3- хинолил) формамида с т.пл.174-178оС. Образец для анализа был перекристаллизован из этанола; т.пл.178-181оС.
П р и м е р 38. 6-Бром-1,2,3,4-тетрагидро-8-нитро-3-хинолинамин (соединение XXIX).
Смесь N-(1-формил-6-бром-1,2,3,4-тетрагидро-3-хинолил)-формамида (12,8 г, 45,2 ммоль) и нитрата натрия (12,8 г, 150 ммоль) в трифторуксусной кислоте (100 мл) перемешивают при комнатной температуре в течение 18 ч. Основную массу растворителя удаляют при пониженном давлении, а остаток разделяют между этилацетатом и водой. Этилацетат промывают гидроокисью натрия и водой и удаляют этилацетат, получая 14,2 г N-(1-формил-6-бром-1,2,3,4-тетрагидро-8-нитро-3-хинолил) формамида (соединение XXVIII) в виде твердого вещества. Это вещество растворяют в этанольном растворе хлористого водорода (100 мл, 4,0 н. ), смесь кипятят с обратным холодильником 1 ч, добавляют эфир (200 мл), осадок отфильтровывают, промывают эфиром и сушат, получая 12,8 г (82%) 8-бром-1,2,3,4-тетрагидро-8-нитро-3-хинолинамина дигидрохлорида, т.пл. > 300оС.
П р и м е р 39. Дигидрохлорид 5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-5-амина (соединение 22).
Смесь дигидрохлорида 6-бром-1,2,3,4-тетрагидро-8-нитро-3-хинолинамина (10,69 г, 0,031 моль) и 10% палладия на угле (1 г) гидрируют (начальное давление водорода 3,5 атм) в среде абсолютного этанола (175 мл) до прекращения поглощения водорода (время реакции 1,5 ч). Смесь фильтруют через целит, растворитель удаляют при пониженном давлении. Пенообразный остаток разделяют между этилацетатом и 1 н. раствором гидроокиси натрия. После выпаривания этилацетата получают 5,41 г 3,8-диамино-1,2,3,4-тетрагидрохинолина (соединение ХХХ) в виде масла коричневого цвета.
Это масло растворяют в муравьиной кислоте (60 мл) и перемешивают при 55оС в течение 5 ч. Затем в высоком вакууме удаляют муравьиную кислоту. Полученное масло разделяют между этилацетатом (400 мл) и 4 н. раствором гидроокиси натрия (60 мл). Водную фазу 5 раз экстрагируют этилацетатом; соединенные этилацетатные экстракты промывают водой (2 раза по 25 мл). Выпаривают этилацетат, получая 5,5 г вещества, которое представляет собой смесь целевого продукта (80%) и его N-формильного производного (20%). Неочищенный продукт растворяют в метанольном растворе HCl (150 мл) для того, чтобы гидролизовать N-формильное производное. Через 1,5 ч стояния при комнатной температуре образовавшийся осадок отфильтровывают и промывают смесью метанол: эфир (1: 3), получая 6,33 г (82%) дигидрохлорида 5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-5-амина, т.пл. > 300оС.
Анализ для формулы C10H11N3 ˙2HCl:
Вычислено: C 44,80 H 5,32 Cl 28,81 N 17,07
Найдено: C 48,68 H 5,44 Cl 28,60 N 16,92
П р и м е р 40. 5,6-Дигидро-N-пропил-4Н-имидазо (4,5,1-ij) хинолин-5-амин (соединение 23).
К перемешиваемому при 0оС раствору дигидрохлорида 5,6-дигидро-1Н-имидазо (4,5,1-ij) хинолин-5-амина (3 г, 0,012 моль) в метаноле (250 мл) добавляют пропионовый альдегид (11 г, 0,19 моль) и цианоборгидрид натрия (0,85 г, 0,014 моль). Через 20 мин добавляют метанольный раствор аммиака (10 мл), раствор концентрируют, получая масло, которое разделяют между этилацетатом и раствором гидроокиси натрия. Этилацетатную фазу промывают водой, упаривают, растворяют в хлороформе и хроматографируют на силикагеле, используя в качестве элюента смесь 5% метанола: хлороформ; первым продуктом, элюируемым из колонки, является 5,6-дигидро-N,N-липропил-4Н-имидазо (4,5,1-ij)-хинолин-5-амин (0,9 г, 32%).
Продолжение элюирования дает 1,65 г (64%) монопропиламинопроизводного. Его растворяют в метаноле и эфирном растворе HCl и добавляют эфир. Выпавший осадок отфильтровывают и дважды перекристаллизовывают из смеси метанол: эфир, получая 1,32 г сесквигидрохлорида 5,6-дигидро-N-пропил-4Н-имидазо (4,5,1-ij) хинолин-5-амина, т.пл.294-297оС (разл.).
Анализ для формулы C13H17N3C˙l,5HCl:
Вычислено: C 57,83 H 6,91 Cl 19,70 N 15,56
Найдено: C 57,84 H 76,04 Cl 19,46 N 15,26
П р и м е р 41. 5,6-Дигидро-8-метил-N,N-дипропил-4Н-имидазо (4,5,1-ij) хинолин-5-амин (соединение 24).
Это соединение получают по методике примера 40, используя дигидрохлорид 5,6-дигидро-5-метил-4Н-имидазо (4,5,1-ij) хинолин-5-амина вместо дигидрохлорида 5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-5-амина. Соединение кристаллизуют из гексана; т.пл.91-94оС.
Анализ для формулы C17H25N3O:
Вычислено: C 75,23 H 9,28 N 15,48
Найдено: C 75,08 H 8,88 N 15,67
П р и м е р 42. 5,6-Дигидро-2-метил-N,N-дипропил-4Н-имидазо (4,5,1-ij) хинолин-5-амин (соединение 25).
Трет-бутил-(8-амино-1,2,3,4-тетрагидро- 3-хинолил) карбамат (2,72 г) в течение 2,5 ч обрабатывают уксусным ангидридом (1,16 г) в среде ТГФ (150 мл). Реакционную смесь упаривают, а неочищенный продукт растворяют в метанольном растворе хлористого водорода. Через 5 ч удаляют растворитель и получают 3,1 г дигидриохлорида 5,6-дигидро-2-метил-4Н-имидазо (4,5,1-ij) хинолин-5-амина.
Это соединение по методике примера 40 превращают в 5,6-дигидро-2-метил-N, N-дипропил-4Н-имидазо (4,5,1-ij) хинолин-5-амин. Этот продукт превращают в дигидрохлорид, т.пл.202-205оС.
Анализ для формулы C13H17N3 ˙2HCL:
Вычислено: C 59,28 H 7,91 Cl 20,59 N 12,20
Найдено: C 58,81 H 8,02 Cl 21,90 N 11,41
П р и м е р 43. Трет-бутил-(6-бром-1,2,3,4-тетрагидро-8-нитро-3-хинолинил) карбамат (соединение XXXI).
Смесь 6-бром-1,2,3,4-тетрагидро-8-нитро-3-хинолинамина (3,45 г, 0,01 моль), ди-трет-бутилдикарбоната (3 г, 0,014 моль) и триэтиламина (2 г, 0,02 моль) в ДМФА (50 мл) перемешивают при комнатной температуре в течение 1 ч. К перемешиваемому раствору медленно добавляют воду (7 мл). Выпавший осадок отфильтровывают, промывают водой и сушат, получая 3,7 г ярко-оранжевого твердого вещества с т.пл.193-195оС.
Анализ для формулы C14H18BrN3O4:
Вычислено: C 45,17 H 4,87 Br 21,47 N 11,29
Найдено: C 45,25 H 4,97 Br 21,34 N 11,38.
П р и м е р 44. Трет-бутил-[1,2,5,6-тетрагидро-2-оксо-4Н-имидазо (4,5,1-ij) хинолин-5-ил] карбамат (соединение XXXIII).
Часть А. Трет-бутил-(8-амино-1,2,3,4-тетрагидро-3-хинолинил)-карбамат.
Смесь трет-бутил-(6-бром-1,2,3,4-тетрагидро-8-нитро-3-хинолинил)карбамата (3,72 г, 0,01 моль), абсолютного этанола (150 мл) и 10% палладия на угле (0,60 г) гидрируют (давление водорода 3,5 атм) в течение 18 ч. Смесь фильтруют через целит и удаляют растворитель. Пенообразный остаток разделяют между этилацетатом и 1 н. раствором гидроокиси натрия, фазу этилацетата упаривают при пониженном давлении, получая 2,72 г трет-бутил-(8-амино-1,2,3,4-тетрагидро-3-хинолил) карбамата (соединение XXXII) в виде масла.
Часть Б. Трет-бутил-[1,2,5,6-тетрагидро-2-оксо-4Н-имидазо-(4,5,1-ij) хинолин-5-ил]-карбамат (соединение XXXIII).
Трет-бутил-(8-амино-1,2,3,4-тетрагидро - 3-хинолил) карбамат (2,7 г) растворяют в ТГФ (100 мл). При перемешивании добавляют к полученному раствору раствор фосгена в ТГФ (20,7 мл, 0,40 М, 0,093 моль). Через 5 мин добавляют триэтиламин (2,08 г, 0,020 моль) и перемешивают раствор еще 10 мин. При пониженном давлении удаляют ТГФ и полученный остаток разделяют между хлороформом (250 мл) и водой (20 мл). Фазу хлороформа промывают 4 н. раствором гидроокиси натрия (5 мл) и упаривают. Неочищенный материал соединяют с материалом, полученным в предыдущей реакции (по 0,002 моль) и очищают хроматографированием на силикагеле, элюируя смесью 1% метанола: хлороформ; получают 2,28 г продукта. Кристаллизация из смеси метанол: эфир (1:1) дает 1,60 г (54%) твердого вещества белого цвета с т.пл.235-236оС.
Анализ для C15H19N3O3:
Вычислено: C 62,26 H 6,62 N 14,52
Найдено: C 61,65 H 6,94 N 14,23
П р и м е р 45. 5-Амино-5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-2(1Н)-он (соединение 26).
Трет-бутил-[1,2,5,6-тетрагидро-2-оксо-4Н-имидазо (4,5,1-ij)хинолин-5-ил]карбамат (1,65 г, 0,0057 моль) растворяют в метанольном растворе HCl (85 мл) и перемешивают при комнатной температуре 1 ч. Растворитель удаляют при пониженном давлении, получая 1,29 г неочищенного продукта. Образец для анализа перекристаллизовывают из метанола и эфира, получая твердое вещество розового цвета с т.пл. > 300оС.
Анализ для формулы C10H11N3O˙ ˙HCl˙1/2H2O:
Вычислено: C 51,58 H 5,58 Cl 15,11 N 17,90
Найдено: C 51,04 HB 5,47 Cl 15,10 N 17,86
П р и м е р 46. Гидрохлорид 5-(диметиламино)-5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-2(1Н)-она (соединение 27).
5-Амино-5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-2-(1Н)-он (0,73 г, 3,2 ммоль) растворяют в 1 н. растворе гидроокиси натрия (3,2 мл). К этому раствору добавляют абсолютный этанол (100 мл), 37%-ный раствор формальдегида (1,3 мл) и 10% палладия на угле (0,65 г). Полученную смесь гидрируют (начальное давление водорода 3,5 атм) до прекращения поглощения водорода (время реакции 5 ч). Смесь фильтруют через целит, растворитель удаляют при пониженном давлении и получают прозрачное масло. Этот неочищенный материал соединяют с материалом, полученным в предыдущей реакции (2,5 ммоль), растворяют в хлороформе и фильтруют под действием силы тяготения, удаляя параформальдегид. Соединение очищают хроматографированием на силикагеле, элюируя смесью 10% метанола:хлороформа; получают 0,88 г (71%) 5-(диметиламино)-5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-2-(1Н)-он в виде масла.
П р и м е р 47. 5-(Пропиламино)-5,6-дигидро-4Н-имидазо (4,5,1-ij)хинолин-2(1Н)-он (соединение 28).
К перемешиваемому раствору 1,90 г (8,4 ммоль) 5-амино-5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-2(1Н)-она, 0,85 мл метилата натрия и 1,5 г пропионового альдегида в метаноле (175 мл) маленькими порциями в течение 5 ч добавляют цианоборгидрид натрия (0,17 г). Добавляют метанольный раствор аммиака и через 30 мин выпаривают растворитель. Маслообразный остаток разделяют между этилацетатом и водой, а неочищенный продукт, полученный после выпаривания этилацетата, растворяют в хлороформе и хроматографируют на силикагеле, элюируя смесью 2,5% метанола:хлороформа; получают 1,24 г (64%) 5,6-дигидро-5-(пропиламино)-4Н-имидазо (4,5,1-ij) хинолин-2 (1Н)-она.
Этот продукт превращают в гидрохлорид с т.пл. > 300оС из смеси метанол: эфир.
Анализ для формулы C13H17N3O ˙HCl:
Вычислено: C 58,31 H 6,77 Cl 13,24 N 15,69
Найдено: C 58,16 H 6,92 Cl 13,17 N 15,18
П р и м е р 48. 5-(Дипропиламино)-5,6-дигидро-4Н-имидазо (4,5,1-ij)хинолин-2-(1Н)-он (соединение 29).
К перемешиваемому при 0оС раствору 5-амино-5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-2(1Н)-она (2,70 г, 0,012 моль) и метилата натрия (1 мл, 3,8 М раствора) в метаноле (250 мл) добавляют пропионовый альдегид (12,7 г, 0,21 моль) и цианоборгидрид натрия (2,22 г, 0,035 моль). Раствору дают нагреться до комнатной температуры и спустя 1 ч добавляют метанольный раствор аммиака (10 мл). Раствор перемешивают еще 30 мин и растворитель удаляют при пониженном давлении. Смесь растворяют в этилацетате (500 мл), промывают 4 н. раствором гидроокиси натрия (15 мл) и водой (2 раза по 10 мл) и упаривают. Неочищенный продукт растворяют в смеси хлороформ:метанол (2: 1) и хроматографируют на силикагеле, элюируя хлороформом. Полученное твердое вещество растирают со смесью эфир: гексан (1:1, 40 мл) и фильтруют, получая 2,12 г (65% ) продукта с т.пл.155-157оС. Образец для анализа перекристаллизовывают из смеси этилацетат:гексан; т.пл.155-158оС.
Анализ для формулы C16H23N3O:
Вычислено: C 70,29 H 8,48 N 15,37
Найдено: C 70,36 H 8,78 N 15,30
Этот продукт превращают в гидрохлорид с т.пл.221-224оС (разл.).
Анализ для формулы C16H23N3O˙HCl:
Вычислено: C 62,02 H 7,81 Cl 11,44 N 13,56
Найдено: C 61,88 H 7,79 Cl 11,50 N 13,48
П р и м е р 49. (-)-5-(Дипропиламино)-5,6-дигидро-4Н-имидазо (4,5,1-ij)хинолин-2(1Н)-он (-) [форма соединения 29].
Часть А. (+) и (-) Трет-Бутоксикарбонил-N-[1,2,5,6-тетра-гидро-2-оксо-4Н-имидазо (4,5,1-ij) хинолин-5-ил]-L-фенилаланинамид.
Смесь трет-бутоксикарбонил-L-фенилаланина (2,9 г, 11 ммоль) гидрохлорида 5-амино-5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-2-(1Н)-она (2,25 г, 10 ммоль), 1-гидроксибензотриазола (1,65 г, 11 ммоль), триэтиламина (1,1 г, 11 ммоль) и ди- циклогексилкарбодиимида (3,09 г, 15 ммоль) в диметилформамиде (50 мл) перемешивают при комнатной температуре в течение 2 ч. Раствор фильтруют для удаления дициклогексилмочевины, упаривают и хроматографируют; первым продуктом, элюируемым из колонки, является (+) трет-бутоксикарбонил-N-[1,2,5,6-тетрагидро-2-оксо-4Н-имидазо (4,5,1-ij) хинолин-5-ил]-L-фенилаланинамид (1,8 г). Этот продукт кристаллизуют из метанола; т.пл.215-217оС; ( α)DMeOH +26оС.
Анализ для формулы C24H28N4O4:
Вычислено: C 66,03 H 6,47 N 12,84
Найдено: C 66,01 H 6,54 N 13,01
Дальнейшее элюирование дает 1,9 г (-) трет-бутоксикарбонил-N-[1,2,5,6-тетрагид- ро-2-оксо-4Н-имидазо (4,5,1-ij)хинолин-5-ил]-L-фенилаланинамида.
Часть Б. (-) 5-Амино-5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-2(1Н)-он.
(-) Трет-бутоксикарбонил-N-[1,2,5,6-тетрагидро-2-оксо-4Н-имидазо (4,5,1-ij) хинолин-5-ил] -L-фенилаланинамид (1,8 г) перемешивают с этанольным раствором хлористого водорода (50 мл, 4,0 н. раствора) 1 ч. Растворитель удаляют и маслообразный остаток разделяют между хлороформом и раствором гидроокиси натрия. После выпаривания хлороформа получают 1,4 г (-) N-[1,2,5,6-тетрагидро-2-оксо-4Н-имидазо (4,5,1-ij) хинолин-5-ил] фенилаланинамида. Этот продукт растворяют в смеси ацетонитрил: ТГФ (30 мл, 1:1) и добавляют фенилизотиоцианат (675 мг, 5 ммоль). Через 1 ч удаляют растворитель и маслообразный остаток хроматографируют на силикагеле, используя хлороформ в качестве начального элюента.
Элюирование смесью 5% метанола: хлороформа дает 1,8 г (-) N-[(фениламино) тиокарбонил]-N-[1,2,5,6-тетрагидро-2-оксо-4Н-имидазо)4,5,1-ij) хинолин-5-ил] фенилаланинамида. Этот продукт растворяют в трифторуксусной кислоте (25 мл). Через 1 ч растворитель удаляют и растворяют остаток в метаноле (5 мл). Добавляют эфир (50 мл), охлаждают раствор до -10оС, осадок отфильтровывают, промывают эфиром и сушат на воздухе, получая 1,2 г трифторацетата (-) 5-амино-5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-2(1Н)-она, т.пл.247оС (разл.), ( α)DMeOH -18оС.
Анализ для формулы C10H11N3O˙ ˙C2HF3O2:
Вычислено: C 47,53 H 3,99 F 18,80 N 13,97
Найдено: C 47,31 H 4,26 F 17,37 N 13,48
Часть В. (-) 5-(Дипропиламино)-5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-2(1Н)-он.
Это соединение получают по методике примера 47, используя трифторацетат (-) 5-амино-5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-2(1Н)-она вместо 5-амино-5,6-дигидро-4Н-имидазо (4,5,1)хинолин-2(1Н)-она. Солянокислая соль этого продукта кристаллизуется из смеси метанол: эфир в виде полугидрата (содержание воды 2,89%) с неопределенной температурой плавления: ( α)DMeOH - 16,5о.
Анализ для формулы C16H23N3O˙HCl ˙ ˙1/2H2O:
Вычислено: C 62,02 H 7,81 N 13,56 Cl 11,44
Найдено: C 61,88 H 7,79 N 13,48 Cl 11,50
Соединение было также превращено в гидробромид, который получили из смеси метанол:эфир в виде моногидрата, т.пл.190-192оС.
П р и м е р 50. (+) 5-(Дипропиламино)-5,6-дигидро-4Н-имидазо (4,5,1-ij)хинолин-2(1Н)-она гидрохлорид.
Это соединение получают из (+) трет-бутоксикарбонил-N-[1,2,5,6-тетрагидро-2-ок-со-4Н-имидазо (4,5,1-ij) хинолин-5-ил)-L-фенилаланинамида по методике примера 49 (части Б и В). Солянокислую соль продукта кристаллизуют из смеси метанол:эфир в форме гидрата (содержание воды 0,98%) с неопределенной температурой плавления: ( α)DMeOH +16,5оС.
Анализ для формулы C16H23N3O ˙HCl ˙ 1/4H2O:
Вычислено: C 61,13 H 8,01 Cl 11,28 N 13,37
Найдено: C 61,17 H 8,08 Cl 11,12 N 13,35
П р и м е р 51. 5-(Дипропиламино)-5,6-дигидро-1-метил-4Н-имидазо-(4,5,1-ij) хинолин-2(1Н)-он (соединение 30).
К перемешиваемому раствору 5-(дипропиламино)-5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-2(1Н)-она (0,60 г, 2,2 ммоль) в сухом ТГФ (25 мл) добавляют гидрид калия (0,28 г 35%-й дисперсии в минеральном масле, промыта эфиром для удаления масла, 2,7 ммоль) в сухом ТГФ. Затем вводят йодистый метил (0,31 г, 2,2 ммоль) в сухом ТГФ. После перемешивания полученного раствора в течение 18 ч при комнатной температуре к нему добавляют метанол. После этого при пониженном давлении удаляют растворитель, материал растворяют в смеси метанол: хлороформ (1:1) и хроматографируют на силикагеле, элюируя хлороформом; получают 0,50 г (выход 79%) твердого вещества желтого цвета. Этот продукт дважды перекристаллизовывают из гексана, получая 0,28 г (44% ) 5-(дипропиламино)-5,6-дигидро-1-метил-4Н-имидазо (4,5,1-ij) хинолин-2(1Н)-она, т.пл.83-85оС.
Анализ для формулы C17H25N3O:
Вычислено: C 71,04 H 8,77 N 14,62
Найдено: C 71,25 H 8,91 N 14,74
П р и м е р 52. 5-(Диметиламино)-5,6-дигидро-1-метил-4Н-имидазо-(4,5,1-ij) хинолин-2(1Н)-он (соединение 31).
Это соединение получают по методике примера 51, используя 5- (диметиламино)-5,6-дигидро-4Н-имидазо (4,5,1-ij)хинолин-2(1Н)-он вместо 5-(дипропиламино)-5,6-дигидро-4Н-имидазо (4,5,1-ij)-хинолин-2(1Н)-она.
Продукт превращают в гидрохлорид, который кристаллизуют из смеси метанол: эфир, т.пл.268-271оС.
Анализ для формулы C13H17N3O˙HCl:
Вычислено: C 58,31 H 6,77 Cl 13,24 N 15,69
Найдено: C 58,40 H 6,92 Cl 13,05 N 15,33
П р и м е р 53. 5-(Диметиламино)-5,6-дигидро-8-метил-4Н-имидазо-(4,5,1-ij) хинолин-2(1Н)-он (соединение 32).
Это соединение получают по методике примера 46, используя 5-амино-5,6-дигидро-6-метил-4Н-имидазо (4,5,1-ij)хинолин-2(1Н)-он вместо 5-амино-5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-2-(1Н)-она.
Продукт превращают в гидрохлорид, который кристаллизуют из смеси метанол: эфир, т.пл.281-284оС.
Анализ для формулы C13H17N3O ˙HCl:
Вычислено: C 58,31 H 6,77 Cl 13,24 N 15,69
Найдено: C 58,00 H 7,03 Cl 12,94 N 15,44
П р и м е р 54. 6-Бром-1,2,3,4-тетрагидро-8-нитро-N,N-дипропил-3-хинолинамин (соединение XXXIa).
Смесь дигидрохлорида 6-бром-1,2,3,4-тетрагидро-8-нитро-3-хинолинамина (11,5 г, 0,033 моль), иодистого пропила (21 г, 0,12 моль) и безводного карбоната натрия (20 г, 0,19 моль) в диметилформамиде (100 мл) в течение 5 ч перемешивают при 100оС. Затем раствор упаривают, остаток разделяют между этилацетатом и водой и выпаривают этилацетат, получая масло красного цвета. Это масло хроматографируют на силикагеле, получая 8,2 г 6-бром-1,2,3,4-тетрагидро-8-нитро-N, N-дипропил-3-хинолинамина. Продукт кристаллизуют из смеси этилацетат:гексан, получая 7,6 г продукта, т.пл.79-81оС.
Анализ для формулы C15H22BrN3O2:
Вычислено: C 50,57 H 6,23 Br 22,43 N 11,79
Найдено: C 50,59 H 6,27 Br 22,53 N 11,69.
При дальнейшем элировании получают 1,5 г 6-бром-1,2,3,4-тетрагидро-8-нитро-N-пропил-3-хинолинамин в виде масла.
П р и м е р 55. 6-Бром-1,2,3,4-тетрагидро-N,N-диметил-8-нитро-3-хинолинамин (соединение XXXIb).
Смесь 6-бром-1,2,3,4-тетрагидро-8-нитро-3-хинолинамина (1,5 г, 5,5 ммоль), 37%-го водного раствора формальдегида (1,8 мл) и муравьиной кислоты (10 мл) нагревают в течение 1 ч при 100оС. Затем раствор упаривают, разделяют остаток между этилацетатом (200 мл) и 4 н. раствором гидроокиси натрия (10 мл) и выпаривают этилацетат, получая масло красного цвета. Это масло хроматографируют на силикагеле, получая 1,58 г 6-бром-1,2,3,4-тетрагидро-N, N-диметил-8-нитро-3-хинолинамина.
Продукт кристаллизуют из смеси этилацетат: гексан, т.пл.88-91оС.
Анализ для формулы C11H14BrN3O2:
Вычислено: C 44,01 H 4,70 Br 26,62 N 14,00
Найдено: C 44,04 H 4,89i Br 26,62 N 13,97
П р и м е р 56. 5-(Дипропиламино)-5,6-дигидро-4Н-имидазо (4,5,1-ij)хинолин-2-(1Н)-тион (соединение 33).
Часть А. 1,2,3,4-Тетрагидро-N3,N3-дипропил-3,8-хинолиндиамин (соединение XXXVb).
Смесь 6-бром-1,2,3,4-тетрагидро-8-нитро-N, N-дипропил-3-хинолинамина (2,7 г) и 10% палладия на древесном угле (0,5 г) в среде этанола (150 мл) гидрируют в течение 18 ч. Раствор фильтруют, этанол выпаривают и получают 1,9 г 1,2,3,4-N3,N3-дипропил-3,8-хинолиндиамина в виде масла.
Часть Б. 5-(Дипропиламино)-5,6-дигидрио-4Н-имидазо (4,5,1-ij)-хинолин-2(1Н)-тион.
К перемешиваемому раствору 1,2,3,4-тетрагидро-N3,N3-дипропил-3,8-хинолин-диамина (1,6 г, 6,7 ммоль) в ТГФ (50 мл) добавляют ди(2-пиридил)тиокарбонат (1,6 г, 7,2 ммоль). Раствор перемешивают в течение 1 ч, упаривают и разделяют остаток между хлороформом и водой. Фазу хлороформа упаривают и остаток хроматографируют на силикагеле, используя в качестве начального элюента смесь этилацетат: гексан (1:9); получают 1,6 г продукта. Кристаллизация из гексана дает 1,3 г (67%) 5-(дипропиламино)-5,6-дигидро-4Н-имида-зо (4,5,1-ij)-хинолин-2(1Н)-тиона, т.пл.150-151оС.
Анализ для формулы C16H23N3S:
Вычислено: C 66,39 H 8,01 N 14,52 S 11,08
Найдено: C 66,50 H 8,18 N 14,56 S 11,02
П р и м е р 57. 5,6-Дигидро-2-метилтио-N, N-дипропил-4Н-имидазо (4,5,1-ij)хинолин-5-амин (соединение 34).
Это соединение получают по методике примера 51, используя 5-(дипропиламино)-5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-2-(1Н)-тион вместо 5-(дипроипиламино)-5,6-дигидро-4Н-имидазо-(4,5,1-ij) хинолин-2-(1Н)-она. Продукт кристаллизуют из пентана. т.пл.49-52оС.
Анализ для формулы C17H25N3S:
Вычислено: C 67,28 H 8,30 N 13,85 S 10,57
Найдено: C 67,57 H 7,28; N 14,00 S 10,44
П р и м е р 58. 5,6-Дигидро-N5,N5-дипропил-4Н-имидазо (4,5,1-ij)-хинолин-2,5-диамин (соединение 35).
Это соединение получают по методике примера 56 (часть Б), используя цианогенбромид вместо ди (2-пиридил)тиокарбоната. Продукт очищают хроматографическим методом и растирают с эфиром, т.пл.160-170оС.
Анализ для формулы C16H24N4:
Вычислено: C 70,55 H 8,88 N 20,57
Найдено: C 68,96 H 9,03 N 20,57
П р и м е р 59. 5,6-Дигидро-N2-метил-N5, N5-дипропил-4Н-имидазо (4,5,1-ij)хинолин-2,5-диамин (соединение 36).
Это соединение получают по методике примера 51, используя 5,6-дигидро-N5, N5-дипропил-4Н-имидазо (4,5,1-ij) хинолин-2,5-диамин вместо 5-(дипропиламино)-5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-2(1Н)-она. Продукт отделяют от сопутствующего 5,6-дигидро-1-метил-N5,N5-дипропил-4Н-имидазо (4,5,1-ij)хинолин-2,5-диамина с помощью хроматографии.
П р и м е р 60. 6-(Дипропиламино)-5,6-дигидро-4Н-имидазо (4,5,1-ij)хинолин-2-ил)цианамид (соединение 37).
Это соединение получают по методике примера 56 (часть Б), используя дифенилцианокарбонимидат вместо ди (2-пиридил)тиокарбоната.
П р и м е р 61. 5,6-Дигидро-N,N-дипропил-1Н,4Н-тиадиазоло (4,3,2-ij)хинолин-5-амина 2,2-диоксид (соединение 38).
Это соединение получают по методике примера 56 (часть Б), используя сульфамид вместо ди (2-пиридил)тиокарбоната и проводя реакцию при 150оС в отсутствие растворителя.
П р и м е р 62. 1,2,6,7-Тетрагидро-6-(дипропиламино)-3Н,5Н-пииридо-(1,2,3-de) хиноксалин-3-он (соединение 39).
Это соединение получают по методике примера 56, используя этилбромацетат вместо ди (2-пиридил) тиокарбоната и проводя реакцию при температуре кипения растворителя. Неочищенный продукт хроматографируют, получая основной продукт - 1,2,6,7-тетрагидро-6-(дипропиламино)-3Н,5Н-пиридо (1,2,3-de)-хиноксалин-3-он, который вымывается из колонки первым. Этот продукт кристаллизуют из смеси этилацетат: гексан, т.пл.97-99оС.
Анализ для формулы C17H25N3O:
Вычислено: C 71,04 H 8,77 N 14,62
Найдено: C 71,20 H 8,90 N 14,85
Дальнейшее элюирование дает небольшое количество 1,2,6,7-тетрагидро-6-(дипропиламино)-3Н,5Н-пиридо (1,2,3-de)хиноксалин-2-она.
П р и м е р 63. 1,2,6,7-Тетрагидро-6-(дипропиламино)-3Н,5Н-пиридо(1,2,3-de) хиноксалин-2-он (соединение 40).
Это соединение получают по методике примера 56, используя ангидрид хлоруксусной кислоты вместо ди(2-пиридил)тиокарбоната. Образующийся вначале N8-(хлорацетил)-1,2,3,4-тетрагидро-N3, N3-дипропил-3,8-хинолиндиамин нагревают при 150оС в ДМФА, в результате чего происходит циклизация в 1,2,6,7-тетрагидрио-6-(дипропиламино)-3Н, 5Н-пиридо (1,2,3-de) хиноксалин-2-он, который получают в форме солянокислой соли, кристаллизующейся из смеси метанол:эфир, т.пл.250-255оС (разл.).
Анализ для формулы C17H25N3O ˙HCl:
Вычислено: C 63,04 H 8,09 Cl 10,95 N 12,98
Найдено: C 62,39 H 8,34 Cl 10,85 N 12,84
П р и м е р 64. 6,7-Дигидро-6-(дипропиламино)-3Н,5Н-пиридо (1,2,3-de)хиноксалин-3-он (соединение 41).
Это соединение получают по методике примера 56, используя бутилглиоксилат вместо ди (2-пиридил)тиокарбоната и проводя реакцию при температуре кипения растворителя.
Продукт превращают в п-толуолсульфонат, т.пл.188-190оС из смеси метанол: эфир.
П р и м е р 65. 6,7-Дигидрио-6-(дипропиламино)-1Н,5Н-пиридо (1,2,3-de)хиноксалин-2,3-дион (соединение 42).
Это соединение получают по методике примера 56, используя этилоксалилхлорид вместо ди (2-пиридил) тиокарбоната и проводят реакцию при температуре кипения растворителя. Продукт кристаллизуют из смеси этилацетат:гексан, т.пл.166-168оС.
Анализ для C17H23N3O2:
Вычислено: C 67,75 H 7,69 N 13,94
Найдено: C 67,66 H 7,96 N 13,80.
Продукт превращают в солянокислую соль, которую кристаллизуют из смеси метанол: эфир; т.пл.250-255оС (разл.).
П р и м е р 66. 5-(Диметиламино)-5,6-дигидро-4Н-имидазо (4,5,1-ij)-хинолин-2(1Н)-тион (соединение 43).
Часть А. 1,2,3,4-Тетрагидро-N3,N3-диметил-3,8-хинолиндиамин (соединение XXXVb).
Смесь 6-бром-1,2,3,4-тетрагидро-8-нитро-N, N-диметил-3-хинолинамина (1,15 г, 3,8 ммоль) и 10% палладия на древесном угле (0,5 г) в этаноле (150 мл) гидрируют в течение 18 ч. Раствор фильтруют, этанол выпаривают и получают 0,73 г 1,2,3,4-тетрагидро-N3,N3-диметил-3,8-хинолиндиамина в виде масла.
Часть Б. 5-(Диметиламино)-5,6-дигидро-4Н-имидазо (4,5,1-ij)-хинолин-2(1Н)-тион.
К перемешиваемому раствору 1,2,3,4-тетрагидро-N3,N3-диметил-3,8-хинолиндиамина (0,73 г, 3,8 ммоль) в ТГФ (50 мл) добавляют ди (2-пиридил) тиокарбонат (0,92 г, 4,0 ммоль). Раствор перемешивают 1 ч, упаривают и остаток разделяют между хлороформом и водой. Фазу хлороформа упаривают и остаток хроматографируют на силикагеле, используя в качестве начального элюента смесь этилацетат: гексан (1:9); получают 0,68 г продукта. Кристаллизация из циклогексана дает 0,60 г 5-(диметиламино)-5,6-дигидро-4Н-имида- зо (4,5,1-ij) хинолин-2(1Н)-тиона, т.пл.203-205оС.
Анализ для формулы C12H15N3S:
Вычислено: C 61,77 H 6,48 N 18,01 S 13,74
Найдено: C 61,77 H 6,53 N 17,73
П р и м е р 67. Альтернативный синтез 1,2,3,4-тетрагидро-N3, N3-диметил-3,8-хи-нолиндиамина (соединение XXXVb).
Часть А. Диэтил-(формиламино) [(2-нитрофенил)метил] пропандиоат.
К перемешиваемому раствору этилата натрия (250 мл 0,4 М раствора) добавляют диэтил (формиламино) малонат (20,3 г, 0,1 моль). Добавляют 2-нитробензилхлорид (17,2 г, 0,1 моль), смесь кипятят с обратным холодильником в течение 2 ч и удаляют растворитель при пониженном давлении. Остаток разделяют между этилацетатом и водой, отделяют фазу этилацетата и упаривают ее, получая 40,3 г неочищенного продукта. Полученное соединение кристаллизуют из смеси этилацетат: гексан, получая 25,5 г диэтил-(формиламино) [(2-нитрофенил)метил] пропандиотата, т.пл.129-132оС.
Часть Б. Этил-3-(формиламино)-1,2,3,4-тетрагидро-2-оксо-3-хинолинкарбоксилат.
Смесь диэтил-(формиламино) [(2-нитрофенил)метил] пропандиоата (8,54 г, 0,025 моль) и 10% палладия на угле (2,0 г) в абсолютном этаноле (200 мл) гидрируют (начальное давление водорода 3,5 атм) до прекращения поглощения водорода. Смесь фильтруют через целит и кипятят с обратным холодильником в течение 2 ч, чтобы осуществить циклизацию. При пониженном давлении удаляют растворитель, получая 6,6 г продукта, который кристаллизуют из метанола, получая 5,0 г белых кристаллов, т.пл.187-190оС.
Анализ для формулы C13H14N2O4:
Вычислено: C 59,53 H 5,38 N 10,68
Найдено: C 59,77 H 5,36 N 10,75.
Часть В. 3-(Формиламино)-3,4-дигидро-2(1Н) хинолинон.
К перемешиваемому раствору этил-3-(форимиламино)-1,2,3,4-тетрагидро-2-оксо -3-хинолинкарбоксилата (11,3 г, 0,043 моль) в метаноле (250 мл) добавляют гидроокись натрия (50 мл 4,0 н. раствора, 0,20 моль). Через 30 мин появляется осадок белого цвета, а через 45 мин к реакционной смеси добавляют воду (50 мл). После кипячения с обратным холодильником в течение ночи добавляют соляную кислоту (50 мл, 4,0 н. раствора, 0,20 моль) и при пониженном давлении удаляют растворители. Твердый остаток кипятят с обратным холодильником в этаноле (200 мл) в течение 1 ч, фильтруют для удаления соли и охлаждают, получая 6,8 г продукта, т.пл.197-200оС.
Анализ для формулы C10H10N2O2:
Вычислено: C 63,15 H 5,30 N 14,73
Найдено: C 63,03 H 5,37 N 14,71
Часть Г. 3-(Формиламино)-6-бром-3,4-дигидро-8-нитро-2(1Н)хинолинон.
К перемешиваемому раствору 3-(формиламино)-3,4-дигидро-2(1Н)хинолинона (19,0 г, 0,1 моль) и безводного ацетата натрия (12,7 г, 0,2 моль) в уксусной кислоте (500 мл) добавляют бром (16,0 г, 0,1 моль). Через 1 ч вводят воду (1,5 л), образовавшийся осадок отфильтровывают и сушат на воздухе, получая 17,8 г 3-(формиламино)-6-бром-3,4-дигидро-2-(1Н) хинолинона, т.пл. 275-282оС (разл. ). Этот продукт растворяют в трифторуксусной кислоте (300 мл), к полученному раствору при перемешивании добавляют нитрат натрия (9,0 г). Спустя 1 ч добавляют воду, осадок отфильтровывают и сушат на воздухе, получая 18,2 г 3-(формиламино)-6-бром-3,4-дигидро-8-нитро-2(1Н)хинолинона, т.пл. 232-235оС.
Часть Д. 3-(Амино)-6-бром-3,4-дигидро-8-нитро-2(1Н)хинолинон.
Это соединение получают по методике примера 9 (часть А), используя 3-(формиламино)-6-бром-3,4-дигидро-8-нитро-2(1Н)-хи- нолинон вместо N-[2,3,6,7-тетрагидро-3-оксо-1Н, 5Н-бензо(ij)-хинолизин-2-ил]формамида.
Часть Е. 3-(Диметиламино)-6-бром-3,4-дигидро-8-нитро-2(1Н)хинолинон.
Это соединение получают по методике примера 55, используя 3-(формиламино)-6-бром-3,4-дигидро-8-нитро-2-(1Н)-хинолин-он вместо 6-бром-1,2,3,4-тетрагидро-8-нитро-3-хинолинамина. Продукт кристаллизуют из этилацетата, т.пл.162-165оС.
Часть Ж. 3,8-Диамино-3,4-дигидро-N3,N3-диметил-2(1Н)хинолинон.
Это соединение получают по методике примера 56 (часть А), используя 3-(диметиламино)-6-бром-3,4-дигидро-8-нитро-2(1Н)-хи- нолинон вместо 6-бром-1,2,3,4-тетрагидро-8-нитро-N,N-дипропил-3-хинолинамина.
Часть И. 1,2,3,4-Тетрагидро-N3,N3-диметил-3,8-хинолиндиамин.
Это соединение получают по методике примера 14, используя 3,8-диамино-3,4-дигидро-N3, N3-диметил-2(1Н)-хинолинон вместо N-[2,3,6,7-тетрагидро-3-оксо-1Н, 5Н-бензо(ij)хинолизин-2-ил]пропанамида.
П р и м е р 68. 5,6-Дигидро-N,N-диметил-2-метилтио-4Н-имидазо-(4,5,1-ij)хино-лин- 5-амин (соединение 44).
Это соединение получают по методике примера 51, используя 5-(диметиламино)-5,6-дигидро-4Н-имидазо(4,5,1-ij)хинолин-2(1Н)-тион вместо 5-(дипропиламино)-5,6-дигидро-4Н-имидазо-(4,5,1-ij)хинолин-2(1Н)- она. Продукт кристаллизуют из смеси этилацетат:гексан, т.пл. 84-86оС.
Анализ для формулы C13H17N3S:
Вычислено: C 63,12 H 6,93 N 16,99 S 12,96
Найдено: C 63,08 H 7,02 N 16,97 S 12,82
П р и м е р 69. 5,6-Дигидро-N5,N5-диметил-4Н-имидазо(4,5,1-ij)хинолинон-2,5- диамин (соединение 45).
Это соединение получают по методике примера 66, используя цианогенбромид вместо ди-(2-пиридил)тиокарбоната.
П р и м е р 70. 5,6-Дигидро-N,N-диметил-4Н-тиадиазоло(4,3,2-ij)хинолин-5-амина 2,2-диоксид (соединение 46).
Это соединение получают по методике примера 66, используя сульфамид вместо ди-(2-пиридил)тиокарбоната и проводя реакцию при 150оС в отсутствие растворителя.
П р и м е р 71. 1,2,6,7-Тетрагидро-6-(ди-метиламино)-3Н, 5Н-пиридо-(1,2,3-de)хиноксалин-3-он (соединение 47).
Это соединение получают по методике примера 66, используя этилбромацетат вместо ди-(2-пиридил)тиокарбоната и проводя реакцию при температуре кипения растворителя.
П р и м е р 72. 1,2,6,7-Тетрагидро-6-(диметиламино)-3Н, 5Н-пиридо-(1,2,3-de)хиноксалин-2-он (соединение 48).
Это соединение получают по методике примера 66, используя ангидрид хлоруксусной кислоты вместо ди-(2-пиридил)тиокарбоната и циклизуя образующийся вначале N8-(хлорацетил)-1,2,3,4-тетрагидро-N3, N3-диметил-3,8-хинолиндиамин
нагреванием при 150оС в ДМФА.
П р и м е р 73. 6,7-Дигидро-6-(диметиламино)-3Н, 5Н-пиридо-(1,2,3-de)-хиноксалин-3-он (соединение 49).
Это соединение получают по методике примера 66, используя бутилглиоксилат вместо ди-(2-пиридил)тиокарбоната и проводя реакцию при температуре кипения растворителя.
П р и м е р 74. 6,7-Дигидро-6-(диметиламино)-1Н, 5Н-пиридо(1,2,3-de)-хиноксалин-2,3-дион (соединение 50).
Это соединение получают по методике примера 66, используя этилоксалилхлорид вместо ди-(2-пиридил)тиокарбоната и проводя реакцию при температуре кипения растворителя.
П р и м е р 75. Альтернативный синтез 5-(дипропиламино)-5,6-дигидро-4Н-имида-зо(4,5,1-ij)хинолин-2(1Н)-она (соединение 29).
Часть А. 4-Метил-1Н-бензимидазолидинон.
К перемешиваемому раствору 3-метил-1,2-бензолдиамина (22,98 г, 0,19 моль) в диметилформамиде (200 мл) при охлаждении добавляют 1,1-карбонилдиимидазол (30,5 г, 0,19 моль). Полученную смесь нагревают при 100оС в течение 1 ч. При пониженном давлении удаляют растворитель до тех пор, пока не начнет образовываться твердый осадок. Для осаждения целевого продукта медленно при перемешивании добавляют воду (200 мл). Осадок отфильтровывают и сушат на воздухе, получая 26,28 г коричневого твердого вещества, т.пл. > 280оС, которое используют без дополнительной очистки.
Часть Б. 2-Хлор-4-метил-1Н-бензимидазол.
Через перемешиваемую суспензию 4-метил-1Н-бензимидазолидинона (5 г, 0,034 моль) в оксихлориде фосфора (50 мл) в течение 1 ч при 120оС барботируют газообразный хлористый водород. Затем удаляют растворитель и полученное твердое вещество растворяют в воде (50 мл). Осторожно добавляют гидроокись аммония (20 мл) до тех пор, пока смесь не приобретет щелочную реакцию. Затем водную фазу экстрагируют хлороформом, фильтруют через целит и упаривают, получая 5,2 г масла коричневого цвета. Этот продукт хроматографируют на силикагеле в хлороформе, элюируя смесью 1% метанола:хлороформа, получают 3,96 г масла коричневого цвета. Кристаллизация из смеси этилацетат:гексан дает 2,72 г коричневых кристаллов, т.пл. 137,5-139,5оС.
Часть В. Метил-2-хлор-4-метил-1Н-бензимидазол-1-карбоксилат.
К перемешиваемому раствору 2-хлор-4-метил-1-бензимидазола (1,23 г, 7,4 ммоль) в ТГФ (25 мл) добавляют гидрид калия (0,85 г 35%-й суспензии в масле, промыта эфиром для удаления масла, 7,4 ммоль). Добавляют метилхлороформиат (0,7 г, 7,4 ммоль) и перемешивают реакционную смесь в течение 10 мин. Растворитель удаляют и полученный материал разделяют между этилацетатом и водой. Упариванием органического слоя получают 1,68 г твердого вещества белого цвета. Кристаллизацией из гексана получают 1,42 г белых кристаллов, т. пл. 90-91оС.
Анализ для формулы C10H9ClN2O2:
Вычислено: C 53,47 H 4,04 Cl 15,78 N 12,47
Найдено: C 53,63 H 4,11 Cl 15,81 N 12,45
Часть Г. Метил-4-(бромметил)-2-хлор-1Н-бензимидазол-1-карбоксилат.
Смесь метил-4-метил-2-хлор-1Н-бензимидазол-1-карбоксилата (17,5 г, 0,078 моль), N-бромсукцинимида (13,9 г, 0,078 моль) и перекиси бензоила (2,0 г) в четыреххлористом углероде (175 мл) кипятят с обратным холодильником при перемешивании в течкение 2 ч. Раствор охлаждают, фильтруют для удаления сукцинимидных побочных продуктов, упаривают и кристаллизуют из смеси этилацетат: гексан, получая 17,1 г метил-4-(бромметил)-2-хлор-1Н-бензимидазол-1-карбоксилата в виде бледно-желтого твердого вещества.
Часть Д. 2-Хлор-5,6-дигидро-N, N-дипропил-4Н-имидазо(4,5,1-ij)-хинолин-5- амин (соединение 51).
Это соединение получают по методике примера 18, используя метил-4-(бромметил)-2-хлор-1Н-бензимидазол-1-карбоксил- ат вместо метил-4-(бромметил)-1Н-бензимидазол-1-карбоксилата. Полученный продукт превращают в дигидрохлорид, т.пл. 165-170оС.
Часть Е. 5-(Дипропиламино)-5,6-дигидро-4Н-имидазо(4,5,1-ij)-хинолин- 2(1Н)-он (соединение 29).
2-Хлор-5,6-дигидро-N, N-дипропил-4Н-имидазо(4,5,1-ij)хинолин-5-амин кипятят с обратным холодильником в уксусной кислоте в течение 1 ч. Растворитель удаляют, а остаток разделяют между этилацетатом и раствором гидроокиси натрия. Упариванием этилацетата получают 5-(дипропиламино)-5,6-дигидро-4Н-имидазо(4,5,1-ij)хино- лин-2(1Н)-он.
П р и м е р 76. 1-[1,2,5,6-Тетрагидро-2-оксо-4Н-имидазо(4,5,1-ij)-хинолин-5-ил] пирролидин (соединение 52).
Это соединение получают по методике примера 44 (часть Б), используя 1-(8-амино-1,2,3,4-тетрагидро-3-хинолил)пирролидин вместо третбутил-(8-амино-1,2,3,4-тетрагидро-3-хинолил)карбамата.
П р и м е р 77. 1-[1,2,5,6-Тетрагидро-2-оксо-4Н-имидазо(4,5,1-ij)-хинолин-5-ил] пиперидин (соединение 53).
Это соединение получают по методике примера 44 (часть Б), используя 4-(8-амино-1,2,3,4-тетрагидро-3-хинолил)пиперидин вместо третбутил-(8-амино-1,2,3,4-тетрагидро-3-хинолил)карбамата.
П р и м е р 78. 4-[1,2,5,6-Тетрагидро-2-оксо-4Н-имидазо(4,5,1-ij)-хинолин-5-ил] морфолин (соединение 54).
Это соединение получают по методике примера 44 (часть Б), используя 1-(8-амино-1,2,3,4-тетрагидро-3-хинолил)морфолин вместо третбутил-(8-амино-1,2,3,4-тетрагидро-3-хинолил)карбамата.
П р и м е р 79. 1-[1,2,5,6-Тетрагидро-2-оксо-4Н-имидазо(4,5,1-ij)-хинолин-5-ил] имидазол (соединение 55).
Это соединение получают по методике примера 44 (часть Б), используя 1-(8-амино-1,2,3,4-тетрагидро-3-хинолил)имидазол вместо третбутил-(8-амино-1,2,3,4-тетрагидро-3-хинолил)карбамата.
П р и м е р 80. 1-[1,2,5,6-Тетрагидро-2-оксо-4Н-имидазо(4,5,1-ij)-хинолин-5-ил]-4- метилпиперазин (соединение 56).
Это соединение получают по методике примера 44 (часть Б), используя 1-(8-амино-1,2,3,4-тетрагидро-3-хинолил)-4-метил-пи-перазин вместо третбутил-(8-амино-1,2,3,4-тетрагидро-3-хинолил)карбамата.
П р и м е р 81. 5-[(Фенилметил)метиламино]-5,6-дигидро-4Н-имидазо-(4,5,1-ij)хи-нолин- 2(1Н)-он (соединение 57).
Это соединение получают по методике примера 44 (часть Б), используя 1,2,3,4-тетрагидро-N3-метил-N3-(фенилметил)хино- лин-3,8- диамин вместо третбутил-(8-амино-1,2,3,4-тетрагидро-3-хинолил)карбама- та. Продукт превращают в гидрохлорид, т.пл. 145-149оС, из смеси метанол:эфир.
П р и м е р 82. 5-(Дипропиламино)-7-хлор-5,6-дигидро-4Н-имидазо-(4,5,1-ij)хино- лин- 2(1Н)-он (соединение 58).
Это соединение получают по методике примера 44 (часть Б), используя 5-хлор-1,2,3,4-тетрагидро-N3, N3-дипропил-3,8-хи- нолин-диамин вместо третбутил-(8-амино-1,2,3,4-тетрагидро-3-хинолил)карбамата.
П р и м е р 83. 5-(Дипропиламино)-5,6-дигидро-7-метокси-4Н-имидазо-(4,5,1-ij) хинолин-2(1Н)-он (соединение 59).
Это соединение получают по методике примера 44 (часть Б), используя 1,2,3,4-тетрагидро-5,5-метокси-N3, N3-дипропил-3,8- хинолиндиамин вместо третбутил-(8-амино-1,2,3,4-тетрагидро-3-хинолил)карбамата.
П р и м е р 84. 5-(Дипропиламино)-5,6-дигидрио-8-метокси-4Н-имидазо-(4,5,1-ij) хинолин-2(1Н)-он (соединение 60).
Это соединение получают по методике примера 44 (часть Б), используя 1,2,3,4-тетрагидро-6-метокси-N3, N3-дипропил-3,8- хинолиндиамин вместо третбутил-(8-амино-1,2,3,4-тетрагидро-3-хинолил)карбама- та.
П р и м е р 85. 5-(Дипропиламино)-5,6-дигидро-9-метокси-4Н-имидазо-(4,5,1-ij) хинолин-2(1Н)-он (соединение 61).
Это соединение получают по методике примера 44 (часть Б), используя 1,2,3,4-тетрагидро-7-метокси-N3, N3-дипропил-3,8- хинолиндиамин вместо третбутил-(8-амино-1,2,3,4-тетрагидро-3-хинолил)карбамата.
П р и м е р 86. 5-(Диметиламино)-5,6-дигидро-8-метокси-4Н-имидазо-(4,5,1-ij) хинолин-2(1Н)-он (соединение 62).
Это соединение получают по методике примера 44 (часть Б), используя 1,2,3,4-тетрагидро-6-метокси-N3, N3-диметил-3,8-хи- нолиндиамин вместо третбутил-(8-амино-1,2,3,4-тетрагидро-3-хинолил)карбамата.
П р и м е р 87. 5-(Диметиламино)-5,6-дигидро-4Н-имидазо(4,5,1-ij)-хинолин-8-ол (соединение 63).
Это соединение получают по методике примера 32, используя 5-(диметиламино)-5,6-дигидро-8-метокси-4Н-имидазо(4,5,1-ij) хинолин- 2(1Н)-он вместо 5,6-дигидро-7-метокси-N, N-дипропил-4Н-имидазо(4,5,1-ij ) хинолин-5-амина.
П р и м е р 88. 5,6-Дигидро-6-метил-N,N-диметил-4Н-имидазо(4,5,1-ij)хинолин-5- амин (соединение 64).
Часть А. 4-Этил-1Н-бензимидазол.
Это соединение получают по методике примера 17, используя 4-бром-2-этил-6-нитроанилин вместо 2-метил-6-нитроанилина.
Часть Б. Третбутил-4-(1-бромэтил)-1Н-бензимидазол-1-карбоксилат.
Это соединение получают по методике примера 17, используя 4-этил-1Н-бензимидазол вместо 4-метил-1Н-бензимидазола.
Часть В. 5,6-Дигидро-6-метил-N, N-диметил-4Н-имидазо(4,5,1-ij)- хинолин-5-амин.
Это соединение в виде смеси диастереомеров получают по методике примера 19, используя третбутил-4-(1-бромэтил)-1Н-бензимидазол-1-карбоксилат вместо третбутил-4-(1-бромэтил)-1Н-бензимидазол-1-карбоксилата.
П р и м е р 89. 5,6-Дигидро-6-метил-N,N-дипропил-4Н-имидазо(4,5,1-ij)хинолин-5- амин (соединение 65).
Это соединение в виде смеси диастереомеров получают по методике примера 88 (часть В), используя метилбензил(дипропиламино)малонат вместо метилбензил(диметиламино)малоната. Продукт кристаллизуют из гексана, т.пл. 78-84оС.
Анализ для формулы C17H23N3O:
Вычислено: C 75,23 HB 9,28 N 15,43
Найдено: C 75,00 H 9,47 N 15,54
П р и м е р 90. 5-(Диметиламино)-5,6-дигидро-6-метил-4Н-имидазо-(4,5,1-ij)хинолин - 2(Н1)-она гидрохлорид (соединение 66).
Это соединение в виде смеси диастереомеров получают по методике примера 44 (часть Б), используя 1,2,3,4-тетрагидро-4-метил-N3,N3-диметил-3,8-хинолиндиамин вместо третбутил(8-амино-1,2,3,4-тетрагидро-3- хинолил)карбамата.
П р и м е р 91. 5-(Дипропиламино)-5,6-дигидро-6-метил-4Н-имидазо(4,5,1-ij) хинолин-2(1Н)-она гидрохлорид (соединение 67).
Это соединение в виде смеси диастереомеров получают по методике примера 44 (часть Б), используя 1,2,3,4-тетрагидро-4-метил-N3,N3-дипропил-3,8-хинолиндиамин вместо третбутил-(8-амино-1,2,3,4-тетрагидро-3-хинолил)карбамата.
П р и м е р 92. 5,6-Дигидро-4-метил-N,N-дипропил-4Н-имидазо(4,5,1-ij)хинолин- 5- амин (соединение 68).
Часть А. β-(дипропиламино)-1Н-бензимидазол-4-пропаналь.
К хлористому метилену (20 мл) при перемешивании при - 78оС добавляют оксалилхлорид (1,2 мл, 0,014 моль). Через 10 мин после этого к полученной смеси добавляют ДМСО (2 мл) и продолжают перемешивать еще 10 мин. Вводят β-(дипропиламино)-1Н-бензимидазол-4-пропанол (2,1 г, 7,5 ммоль) в хлористом метилене и спустя 30 мин дают раствору нагреться до комнатной температуры. Добавляют воду, отделяют и выпаривают хлористый метилен и полученный остаток хроматографируют на силикагеле, получая β -(дипропиламино)-1Н-бензимидазол-4-пропаналь в виде масла.
Часть Б. β -(дипропиламино)- α-метил-1Н-бензимидазол-4-пропанол.
К перемешиваемому раствору β-(дипропиламино)-1Н-бензимидазол-4-пропанола (1,45 г, 5 ммоль) в ТГФ (25 мл) добавляют метилмагнийбромид (3,3 мл, 3,0 М раствора в эфире, 6 ммоль). Раствор перемешивают в течение 1 ч, упаривают и разделяют остаток между этилацетатом и водой. Этилацетат выпаривают и хроматографируют остаток на силикагеле, получая β -(дипропиламино)- α-метил-1Н-бензимидазол-4-пропанол в виде масла.
Часть В. 5,6-Дигидро-4-метил-N,N-дипропил-4Н-имидазо(4,5,1-ij)хинолин-5- амин.
Это соединение в виде смеси диастереомеров получают по методике примера 18 (часть Г), используя β -(дипропиламино)-α -метил-1Н-бензимидазол-4-пропанол вместо β-(дипропиламино)-1Н-бензимидазол-4-4- про- панола.
П р и м е р 93. 5,6-Дигидро-4-метил-N,N-диметил-4Н-имидазо(4,5,1-ij)хинолин-5- амин (соединение 69).
Это соединение в виде смеси диастереомеров получают по методике примера 18 (часть Г), используя β-(диметиламино)- α-метил-1Н-бензимидазол-4-пропанол вместо β-(дипропиламино)-1Н-бензимидазол-4-про-панола.
П р и м е р 94. 5-(Дипропиламино)-5,6-дигидро-4-метил-4Н-имидазо-(4,5,1-ij) хинолин-2(1Н)-она гидрохлорид (соединение 70).
Это соединение в виде смеси диастереомериов получают по методике примера 44 (часть Б), используя 1,2,3,4-тетрагидро-2- метил-N3,N3-дипропил-3,8-хинолиндиамин вместо третбутил-(8-амино-1,2,3,4-тетрагидро-3-хинолил)карбамата.
П р и м е р 95. 5-(Диметиламино)-5,6-дигидро-4-метил-4Н-имидазо-(4,5,1-ij) хинолин-2(1Н)-она гидрохлорид (соединение 71).
Это соединение в виде смеси диастереомеров получают по методике примера 44 (часть Б), используя 1,2,3,4-тетрагидро-2-метил-N3,N3-диметил-3,8-хинолиндиамин вместо третбутил-(8-амино-1,2,3,4-тетрагидро-3- хинолил)карбамата.
П р и м е р 96. 5-(Дипропиламино)-5,6-дигидро-2Н, 4Н-оксазоло(5,4,3-ij)хинолин-2-он (соединение 72).
Часть А. N-ацетил-N-(2-метокси-6-метилфенил)ацетамид (соединение XLV).
К раствору 3-метил-2-нитроанизола (16,8 г, 0,1 моль) в этаноле (150 мл) добавляют палладий на древесном угле (1,0 г, 10% палладия) и полученную смесь гидрируют (начальное давление водорода 3,5 атм) до прекращения поглощения водорода (2 ч). Раствор фильтруют и упаривают, получая 13,8 г 2-метокси-6-метилбензоламина (соединение XLIV) в виде масла. Этот продукт растворяют в уксусном ангидриде (100 мл) и полученный раствор кипятят с обратным холодильником в течение 1 ч. Часть растворителя (50 мл) медленно удаляют в течение 1 ч, после чего раствор охлаждают и оставшийся растворитель удаляют при пониженном давлении. Маслообразный остаток кристаллизуют из смеси этилацетат:гексан (200 мл, 1:2), получая 20,5 г N-ацетил-N-(2-метокси-6-метилфенил)ацетамида, т.пл. 116-119оС.
Анализ для формулы C12H15NO3:
Вычислено: C 65,14 H 6,83 N 6,33
Найдено: C 65,44 H 7,04 N 6,39
Часть Б. N-Ацетил-N-[2-(бромметил)-6-метоксифенил]ацетамид (соединение XLVI).
Смесь N-ацетил-N-(2-метокси-6-метилфенил)ацетамида (25 г, 0,11 моль), N-бромсукцинимида (20,1 г, 0,11 моль) и перекиси бензоила (4,5 г, 0,019 моль) в четыреххлористом углероде (300 мл) кипятят с обратным холодильником при перемешивании в течение 3 ч. Раствор охлаждают, фильтруют, упаривают и твердый остаток кристаллизуют из смеси этилацетат:гексан, получая 21,0 г N-ацетил-N-[2-(бромметил)-6-метоксифенил] ацетамида, чистоты 95% (по данным ГХ-анализа).
Часть В. Диэтил-(дипропиламино){[2-(диацетиламино)-3-метоксифенил]-метил} пропандиоат (соединение XLVII).
К перемешиваемому раствору диэтил(дипропиламино)малоната (34,6 г, 133 ммоль) в ТГФ (200 мл) добавляют гидрид калия (13,4 г 35%-й дисперсии, 117 ммоль). Добавляют N-ацетил-N-[2-(бромметил)-6-метоксифенил]ацетамид (10,0 г, 33 ммоль) и раствор кипятят с обратным холодильником в течение 1 ч. Затем раствор упаривают и маслообразный остаток разделяют между этилацетатом и водой. После выпаривания этилацетата остаток хроматографируют на силикагеле, элюируя смесью этилацетат: гексан (1:10); получают 9,2 г диэтил-(дипропиламино){ [2-(диацетиламино)-3-метокси- фенил] метил} пропандиоат. Кристаллизация из смеси этилацетат:гексан дает 8,4 г продукта, т.пл. 72-75оС.
Анализ для формулы C25H38N2O7:
Вычислено: C 62,74 H 8,00 N 5,85
Найдено: C 62,59 H 8,00 N 5,87
Часть Г. 3-(Дипропиламино)-3,4-дигидрио-8-метокси-2(1Н)-хинолинон (соединение XLVIII).
Диэтил-(дипропиламино){ [2-(диацетил- амино)-3-метоксифенил] метил} пропандиоат (6,34 г) растворяют в растворе этилата натрия в этаноле (150 мл 1,4 М раствора). Через 20 мин раствор начинают кипятить с обратным холодильником в течение 15 ч. К реакционной смеси периодически добавляют воду: 1 мл после 1 ч, 2 мл после 3 ч, 5 мл после 4 ч и 15 мл после 5 ч кипячения. Раствор фильтруют для удаления осадка неорганического вещества, при пониженном давлении удаляют растворитель и разделяют остаток между этилацетатом и водой. Масло, полученное после выпаривания этилацетата, хроматографируют на силикагеле, получая 3,3 г 3-(дипропиламино)-3,4-дигидро-8-метокси-2(1Н)-хинолинона. Продукт кристаллизуют из пентана, получая 2,0 г продукта, т.пл. 50-54оС.
Анализ для формулы C16H24N2O2:
Вычислено: C 69,53 H 8,75 N 10,14
Найдено: C 69,56 H 8,98 N 10,24
Часть Д. 1,2,3,4-Тетрагидро-8-метокси-N, N-дипропил-3-хинолинамин (соединение XLIX).
К перемешиваемому раствору 3-(дипропиламино)-3,4-дигидро-8-метокси-2(1Н)-хи- нолинона (1,05 г, 3,8 ммоль) в ТГФ (50 мл) добавляют литийалюминийгидрид (1,08 г, 27,7 ммоль) и полученный раствор нагревают при 50оС в течение 1 ч. После охлаждения к раствору для разрушения избытка гидрида добавляют сначала этилацетат, затем метанол и выпаривают растворитель. Остаток разделяют между этилацетатом и водой. После выпаривания этилацетата получают 0,98 г 1,2,3,4-тетрагидро-8-метокси-N,N-дипропил- 3-хинолинамин в виде масла.
Часть Е. 1,2,3,4-Тетрагидро-8-гидрокси-N, N-дипропил-3-хинолинамин (соединение L).
Раствор 1,2,3,4-тетрагидро-8-метокси-N,N-дипропил-3-хинолинамина (0,98 г) в бромистоводородной кислоте (20 мл, конц. 48%) нагревают при 155оС в течение 6 ч. Раствор охлаждают, упаривают и остаток разделяют между этилацетатом и насыщенным раствором бикарбоната натрия. Водную фазу повторно экстрагируют этилацетатом и соединенные органические экстракты упаривают, получая 0,88 г 1,2,3,4-тетрагидро-8-гидрокси-N, N-дипро-пил-3-хинолинамина в виде масла.
Часть Ж. 5-(Дипропиламино)-5,6-дигидро-2Н, 4Н-оксазоло(5,4,3-ij)хинолин-2-он (соединение 72).
К перемешиваемому раствору 1,2,3,4-тетрагидро-8-гидрокси-N,N-дипропил-3-хи- нолинамина (0,59 г, 2,4 ммоль) в ТГФ (10 мл) добавляют карбонилдиимидазол (0,46 г, 2,8 ммоль). Через 5 мин удаляют растворитель, остаток растворяют в этилацетате и хроматографируют на силикагеле, используя в качестве начального элюента смесь 5% этилацетата:гексана, получают 0,57 г 5-(дипропиламино)-5,6-дигидро-2Н, 4Н-оксазоло(5,4,3-ij)хинолин-2-она в виде масла.
Продукт превращают в п-толуолсульфонат, т.пл. 192-194оС, из смеси метанол:эфир.
Анализ для формулы C16H22N2O2˙C7H8O3S:
Вычислено: C 61,86 H 6,77 N 6,28 S 7,18
Найдено: C 61,90 H 6,97 N 6,28 S 7,18
П р и м е р 97. 5-(Пропиламино)-5,6-дигидро-2Н, 4Н-оксазоло(5,4,3-ij)хинолин-2-он (соединение 73).
Часть А. 5-[N-(фенилметил)пропиламино)-5,6-дигидро-2Н, 4Н-оксазоло(5,4,3-ij)хинолин-2-он.
Это соединение получают по методике примера 96, используя диэтил-[N-(фенилметил)пропиламино]малонат вместо диэтилдипропиламиномалоната.
Часть Б. 5-(Пропиламино)-5,6-дигидро-2Н, 4Н-оксазоло(5,4,3-ij)хинолин-2-он.
Это соединение получают по методике примера 66 (часть А), используя 5-[N-(фенилметил)пропиламино]-5,6-дигидро-2Н, 4Н-оксазоло(5,4,3-ij)хинолин-2-он вместо 6-бром-1,2,3,4-тетрагидро-8-нитро-N,N-ди- метил-3-хинолинамина.
П р и м е р 98. 5-(диметиламино)-5,6-дигидро-2Н, 4Н-оксазоло(5,4,3-ij)хинолин-2-он (соединение 74).
Это соединение получают по методике примера 96, используя диэтил (диметиламино) малонат вместо диэтил (дипропиламино) малоната.
П р и м е р 99. 5-[N-метил-1-(фенил) этиламино]-5,6-дигидро-2Н, 4Н-оксазоло (5,4,3-ij) хинолин-2-он (соединение 75).
Это соединение получают по методике примера 96, используя диэтил-[N-метил-2-(фенил) этиламино) малонат вместо диэтилдипропиламино малоната.
П р и м е р 100. 1-[5,6-Дигидро-2-оксо-2Н, 4Н-оксазоло (5,4,3-ij)-хинолин-5-ил) пирролидин (соединение 76).
Это соединение получают по методике примера 96, используя метилбензиловый диэфир (1-пирролидинил) пропандионовой кислоты (соединение VIk) вместо диэтил (дипропиламино) малоната.
П р и м е р 101. 1-[5,6-Дигидро-2-оксо-2Н, 4Н-оксазоло(5,4,3-ij)-хинолин-5-ил]пиперидин (соединение 77).
Это соединение получают по методике примера 96, используя метилбензиловый диэфир (1-пиперидинил) пропандионовой кислоты (соединение VIm) вместо диэтил (дипропиламино) малоната.
П р и м е р 102. [4-(5,6-Дигидро-2-оксо-2Н, 4Н-оксазоло[5,4,3-ij)хинолин-5-ил] морфолин (соединение 78).
Это соединение получают по методике примера 96, используя метилбензиловый диэфир (4-морфолинил) пропандионовой кислоты (соединение VIn) вместо диэтил (дипропиламино) малоната.
П р и м е р 103. 1-[5,6-Дигидро-2-оксо-2Н, 4Н-оксазоло (5,4,3-ij)хинолин-5-ил]имидазол (соединение 79).
Это соединение получают по методике примера 96, используя метилбензиловый диэфир (1-имидазолил) пропандионовой кислоты (соединение VIp) вместо диэтил (дипропиламино) малоната.
П р и м е р 104. 5-(Дипропиламино)-5,6-дигидро-2Н, 4Н-оксазоло (5,4,3-ij)хинолин-2-тион (соединение 80).
Это соединение получают по методике примера 56 (часть Б), используя 1,2,3,4-тетрагидро-8-гидрокси-N, N-дипропил-3-хино-линамин вместо 1,2,3,4-тетрагидро-N3,N3-дипропил-3,8-хинолиндиамина.
П р и м е р 105. 5-(Диметиламино)-5,6-дигидро-2Н, 4Н-оксазоло-(5,4,3-ij) хинолин-2-тион (соединение 81).
Это соединение получают по методике примера 56 (часть Б), используя этилбромацетат вместо ди(2-пиридил) тиокарбоната и натриевую соль 1,2,3,4-тетрагидро-8-гидрокси-N, N-дипропил-3-хинолинамина вместо 1,2,3,4-тетрагидро-N3, N3-дипропил-3,8-хино- линдиамина. Продукт превращают в малеат, т.пл. 124-127оС.
П р и м е р 107. 6-(Диметиламино)-6,7-дигидро-5Н-пиридо (1,2,3-de)-1,4-бензоксазин-3(2Н)-он (соединение 83).
Это соединение получают по методике примера 56 (часть Б), используя этилбромацетат вместо ди(2-пиридил)тиокарбоната и натриевую соль 1,2,3,4-тетрагидро-8-гидрокси-N, N-диметил-3-хинолинамина вместо 1,2,3,4-тетрагидро-N3,N3-дипропил-3,8-хино- линдиамина.
П р и м е р 108. 1,2,6,7-Тетрагидро-6-(дипропиламино)-2-метил-3Н, 5Н-пиридо (1,2,3-de) хиноксалин-3-он (соединение 84).
Это соединение получают по методике примера 56, используя этил- α - бромпропионат вместо ди (2-пиридил) тиокарбоната и проводя реакцию при температуре кипения растворителя. Неочищенный продукт хроматографируют, получая основной продукт - 1,2,6,7-тетрагидро-6-(дипропиламино)-2-ме- тил-3Н, 5Н-пиридо-(1,2,3-de) хиноксалин-3-он, который вымывается из колонки первым.
П р и м е р 109. 1,2,6,7-Тетрагидро-6-(дипропиламино)-3-метил-3Н, 5Н-пиридо (1,2,3-de) хиноксалин-2-он (соединение 85).
Это соединение получают по методике примера 56, используя хлорпропионилхлорид вместо ди (2-пиридил) тиокарбоната. Образующийся вначале N8-( α-хлорпропионил)-1,2,3,4-тетрагидро-N3, N3-дипропил- 3,8-хинолиндиамин нагревают при 150оС в ТГФ, в результате чего происходит его циклизация с образованием 1,2,6,7-тетрагидро-6-(дипропиламино)-3-метил-3Н, 5Н-пиридо-(1,2,3-de) хиноксалин-2-он.
П р и м е р 110. 5,6-Дигидро-N,N-дипропил-4Н-пирроло (3,2,1-ij) хинолин-5-амин (соединение 86).
Это соединение получают по методике примера 18, используя метил-7-(бромметил)-1Н-индол-1-карбоксилат вместо третбутил-4-(бромметил)-1Н-бензимидазол-1- карбоксилата.
П р и м е р 111. 5,6-Дигидро-N,N-диметил-4Н-пирроло (3,2,1-ij) хинолин-5-амин (соединение 87).
Это соединение получают по методике примера 18, используя метил-7-(бромметил)-1Н-индол-1-карбоксилат вместо третбутил-4-(бромметил)-1Н-бензимидазол-1- карбоксилата и диэтил (диметиламино) малонат вместо диэтил (дипропиламино) малоната. Продукт превращают в малеат, т.пл. 114-115оС, из смеси ТГФ:эфир.
П р и м е р 112. 5,6-Дигидро-N,N-дипропил-4Н-пиразоло (4,3,2-ij) хинолин-5-амин (соединение 88).
Это соединение получают по методике примера 18, используя метил-7-(бромметил)-1Н-индазол-1-карбоксилат вместо третбутил-4-(бромметил)-1Н-бензимидазол-1-карбоксилата.
П р и м е р 113. 5,6-Дигидро-N,N-диметил-4Н-пиразоло (4,3,2-ij)-хинолин-5-амин (соединение 89).
Это соединение получают по методике примера 18, используя метил-7-(бромметил)-1Н-индазол-1-карбоксилат вместо третбутил-4-(бромметил)-1Н-бензимидазол-1-карбоксилата и диэтил (диметиламино) малонат вместо диэтил (дипропиламино) малоната.
П р и м е р 114. 5,6-Дигидро-N,N-дипропил-4Н-триазоло (4,5,1-ij) хинолин-5-амин (соединение 90).
Это соединение получают по методике примера 18, используя метил-4-(бромметил)-1Н-бензотриазол-1-карбоксилат вместо третбутил-4-(бромметил)-1Н-бензимидазол-1-кар - боксилата.
П р и м е р 115. 5,6-Дигидро-N,N-диметил-4Н-триазоло (4,5,1-ij) хинолин-5-амин (соединение 91).
Это соединение получают по методике примера 18, используя метил-4-(бромметил)-1Н-бензотриазол-1-карбокси- лат вместо третбутил-4-(бромметил)-1Н-бензимидазол-1-карбоксилата и диэтил (диметиламино) малонат вместо диэтил (дипропиламино) малоната.
П р и м е р 116. 1,2,5,6-Тетрагидро-N,N-дипропил-4Н-пирроло (3,2,1-ij) хинолин-5-амин (соединение 92).
Это соединение получают по методике примера 18, используя третбутил-2,3-дигидро-7-(бромметил)-1Н-индол-1-карбоксилат вместо третбутил-4-(бромметил)-1Н-бензимидазол-1-карбоксилата. Продукт превращают в малеат, т. пл. 139-140оС, из смеси ТГФ:эфир.
П р и м е р 117. 1,2,5,6-Тетрагидро-N,N-диметил-4Н-пирроло (3,2,1-ij)хинолин-5-амин (соединение 93).
Это соединение получают по методике примера 18, используя третбутил-2,3-дигидро-7-(бромметил)-1Н-индол-1-карбоксилат вместо третбутил-4-(бромметил)-1Н-бензимидазол-1-карбоксилата и диэтил(диметиламино) малонат вместо диэтил (дипропиламино) малоната.
П р и м е р 118. 5-(Пропиламино)-5,6-дигидро-4Н-пирроло (3,2,1-ij)-хинолин-2,3-дион (соединение 94).
Часть А. N-пропил-N-(6-бром-1,2,3,4-тетрагидро-8-нитрохинолин-3-ил) формамид.
Это соединение получают по методике примера 35, используя 6-бром-1,2,3,4-тетрагидро-8-нитро-N-пропил-3-хинолинамин вместо 3-аминохинолина.
Часть Б. N-пропил-N-(8-амино-1,2,3,4-тетрагидро-3-хинолил)-формамид.
Это соединение получают по методике примера 56 (часть А), используя N-пропил-N-(6-бром-1,2,3,4-тетрагидро-8-нитро-3-хино- лил) формамид вместо 6-бром-1,2,3,4-тетрагидро-8-нитро-N,N-дипропил-3-хинолина-мина.
Часть В. N-пропил-N-[5,6-дигидро-2,3-диоксо-4Н-пирроло (3,2,1-ij) хинолин-5-ил]формамид.
К перемешиваемому раствору N-пропил-N-(6-бром-1,2,3,4-тетрагидро-8-нитро-хинолин-3-ил) формамида (3,14 г, 0,01 моль) в эфире (100 мл) добавляют оксалилхлорид (1,26 г, 0,01 моль). Через 30 мин эфир удаляют, а остаток нагревают при 100оС в течение 4 ч, осуществляя циклизацию. Неочищенный продукт разделяют между этилацетатом и водой, фазу этилацетата упаривают и остаток хроматографируют на силикагеле, получая N-пропил-N-[5,6-дигидро-2,3-диоксо-4Н-пирроло (3,2,1-ij) хинолин-5-ил] формамид.
Часть Г. 5-(Пропиламино)-5,6-дигидро-4Н-пирроло (3,2,1-ij) хинолин-2,3-дион (соединение 94).
N-пропил-N-[5,6-дигидро-2,3-диоксо-4Н-пирроло (3,2,1-ij)-хинолин-5-ил] формамид кипятят в течение 1 ч с обратным холодильником с этанольным раствором хлористого водорода, получая солянокислую соль 5-(пропиламино)-5,6-дигидро-4Н-пирроло-(3,2,1-ij) хинолин-2,3-диона.
П р и м е р 119. 5-(Дипропиламино)-5,6-дигидро-4Н-пирроло (3,2,1-ij) хинолин-1,3-дион (соединение 95).
Это соединение получают по методике примера 54, используя 5-(пропиламино)-5,6-дигидро-4Н-пирроло (3,2,1-ij) хинолин- 2,3-диона гидрохлорид вместо 6-бром-1,2,3,4-тетрагидро-8-нитро-3-хино-линамина дигидрохлорида.
П р и м е р 120. 5-(Пропиламино)-5,6-дигидро-4Н-пиирроло (3,2,1-ij)-хинолин-2(1Н)-он (соединение 96).
Это соединение получают по методике примера 36, используя 5-(пропиламино)-5,6-дигидро-4Н-пирроло (3,2,1-ij) хинолин-2,3-дион вместо N-(3-хинолил)формамида.
П р и м е р 121. 5-(Дипропиламино)-5,6-дигидро-4Н-пирроло (3,2,1-ij)хинолин-2(1Н)-он (соединение 97).
Это соединение получают по методике примера 36, используя 5-(дипропиламино)-5,6-дигидро-4Н-пирроло (3,2,1-ij) хинолин-2,3-дион вместо N-(3-хинолил) формамида. Продукт кристаллизуют из гексана, т.пл. 86-88оС.
П р и м е р 122. 6-(Дипропиламино)-2,3,6,7-тетрагидро-5Н-пиридо-(3,2,1-ij) хиназолин-3-он (соединение 98).
Часть А. Метил-3-метил-2-нитробензоат.
3-метил-2-нитробензойную кислоту (15,0 г) перемешивают в течение ночи с метанольным раствором хлористого водорода (150 мл, 2,2 н.). Затем реакционную смесь кипятят 3 ч с обратным холодильником, охлаждают и фильтруют, получая 9,0 г метил-3-метил-2-нитробензоата, т.пл. 72-75оС. Маточные растворы, полученные в результате фильтрования, содержат исходную кислоту и сложный эфир.
Часть Б. Метил-3-(бромметил)-2-нитробензоат.
Этот продукт получают по методике примера 6, используя метил-3-метил-3-нитробензоат вместо 8-метилхинолина. Продукт очищают хроматографированием на силикагеле и кристаллизуют из смеси этилацетат:гексан; т.пл. 91-95оС.
Часть В. Метилбензиловый диэфир (дипропиламино)[(3-карбометокси-3-нитро- фенил)метил] пропандиовой кислоты.
Этот продукт получают по методике примера 19 (часть А), используя метил-3-(бромметил)-2-нитробензоат вместо третбутил-(бромметил)-1Н-бензимидазол-1-кар- боксилата и метилбензиловый диэфир (дипропиламино) пропандиовой кислоты вместо диэтил (дипропиламино) малоната.
Часть Г. Метил-3-(дипропиламино)-1,2,3,4-тетрагидро-2-оксо-8-хинолинкарбок- силат.
Смесь метилбензилового диэфира (дипропиламино) [(3-карбометокси-2-нитрофенил)метил] пропандиовой кислоты (5,0 г), 10% палладия на древесном угле (0,5 г) в метаноле (150 мл) гидрируют до тех пор, пока не прекратится поглощение водорода. Реакционную смесь фильтруют и удаляют растворитель, получая 3 г метил- α -(дипропиламино)-(2-амино-3-карбометоксифенил) пропаноат в виде масла. Это масло кипятят с обратным холодильником в среде ДМФА в течение 18 ч, осуществляя циклизацию. Растворитель удаляют и маслообразный остаток хроматографируют на силикагеле, получая 2,4 г метил-3-(дипропиламино)-1,2,3,4-тетрагидро-2-оксо-8- хинолинкарбоксилата.
Часть Д. 3-(Дипропиламино)-1,2,3,4-тетрагидро-2-оксо-8-хинолинкарбоновая кислота.
Смесь метил-(3-дипропиламино)-1,2,3,4-тетрагидро-2-оксо-8- хинолинкарбоксилата (1,0 г), метанола (15 мл) и 4,0 н. раствора гидроокиси натрия (3,3 мл) перемешивают при комнатной температуре в течение 30 мин. Метанол удаляют, осадок переносят в воду и нейтрализуют добавлением 4,0 н. раствора соляной кислоты (3,3 мл). Осадок отфильтровывают, промывают водой и сушат на воздухе, получая 0,67 г 3-(дипропиламино)-1,2,3,4-тетрагидро-2-оксо-8-хинолинкарбоновой кислоты, т.пл. 214-217оС.
Анализ для формулы C16H22N2O3:
Вычислено: C 66,18 H 7,64 N 9,65
Найдено: C 65,99 H 7,67 N 9,62
Часть Е. 3-(дипропиламино)-1,2,3,4-тетрагидро-2-оксо-8-хинолинкарбоксамид.
Смесь 3-(дипропиламино)-1,2,3,4-тетрагидро-2-оксо-8-хинолинкарбоновой кислоты (1,0 г), 1-гидроксибензотриазола (1,65 г, 11 ммоль) и дициклогексилкарбодиимида (3,09 г, 15 ммоль) в диметилформамиде (25 мл) перемешивают при комнатной температуре в течение 15 мин. Затем через раствор начинают барботировать аммиак, спустя 15 мин раствор фильтруют, упаривают и остаток разделяют между этилацетатом и раствором гидроокиси натрия. Этилацетат выпаривают, твердый остаток очищают хроматографированием на силикагеле, элюируя этилацетатом; получают 0,98 г продукта. Этот продукт кристаллизуют из метанола, получая 0,78 г 3-(дипропиламино)-1,2,3,4-тетрагидро-2-оксо-8-хинолинкарбоксами- да, т.пл. 214-217оС.
Анализ для формулы C16H23N3O2:
Вычислено: C 66,41 H 8,01 N 14,52
Найдено: C 66,46 H 8,30 N 14,69
Часть Ж. 1,2,3,4-Тетрагидро-8-(аминометил)-N,N-дипропил-3-хинолинамин.
К перемешиваемому раствору 3-(дипропиламино)-1,2,3,4-тетрагидро-2-оксо-8-хи-нолинкарбоксамида (0,25 г) в ТГФ (125 мл) добавляют литийалюминийгидрид (1,5 г) и раствор кипятят с обратным холодильником в течение 2 сут. Раствор охлаждают, разлагают избыток гидрида добавлением метанола (20 мл) и при пониженном давлении удаляют растворители. Остаток разделяют между этилацетатом (400 мл) и водой (15 мл). Декантируют этилацетат с неорганического твердого вещества и удаляют растворитель при пониженном давлении. Маслообразный остаток растворяют в хлороформе и хроматографируют на силикагеле. Элюирование смесью 5% метанола: хлороформа дает 0,40 г 1,2,3,4-тетрагидро-8-(аминометил)-N,N-ди-пропил-3-хинолинамина.
Часть И. 6-(Дипропиламино)-2,3,6,7-тетрагидро-5Н-пиридо-(3,2,1-ij) хиназолин-3-он (соединение 98).
Это соединение получают по методике примера 96 (часть Ж), используя 1,2,3,4-тетрагидро-8-(аминометил)-N, N-дипропил-3- хинолинамин вместо 1,2,3,4-тетрагидро-8-гидрокси-N, N-дипропил-3-хинолинамина. Продукт кристаллизуют из гексана; т.пл. 116-119оС.
П р и м е р 123. 6-(Диметиламино)-2,3,6,7-тетрагидро-5Н-пиридо-(3,2,1-ij) хиназолин-3-он (соединение 99)
Это соединение получают по методике примера 122, используя метилбензиловый диэфир диметиламино пропандиовой кислоты на стадии, соответствующей последовательности реакций.
П р и м е р 124. 6-(Дипропиламино)-6,7-дигидро-1Н, 5Н-пиридо (3,2,1-de)-2,4-бензоксазин-3-он (соединение 100).
Часть А. 1,2,3,4-Тетрагидро-8-(гидроксиметил)-N,N-дипропил-3-хинолинамин.
Это соединение получают по методике примера 122 (часть Ж), используя метил-3-(дипропиламино)-1,2,3,4-тетрагидро-2-оксо- 8- хинолинкарбоксилат вместо 3-(дипропиламино)-1,2,3,4-тетрагидро-2-оксо-8-хино-линоксамида.
Часть Б. 6-(Дипропиламино)-6,7-дигидро-1Н, 5Н-пиридо (3,2,1-de)-2,4-бензоксазин-3-он (соединение 100).
Это соединение получают по методике примера 44 (часть Б), используя 1,2,3,4-тетрагидро-8-(гидроксиметил)-N, N-дипропил-3-хинолинамин вместо третбутил-(8-амино-1,2,3,4-тетрагидро-3-хинолил) карбамата. Продукт превращают в гидрохлорид, т.пл. 192-195оС.
П р и м е р 125. 6-(Диметиламино)-6,7-дигидро-1Н, 5Н-пиридо (3,2,1-de)-2,4-бензоксазин-3-он (соединение 101).
Это соединение получают по методике примера 124, используя метил-3-(диметиламино)-1,2,3,4-тетрагидро-2-оксо-8- хинолинкарбоксилат вместо метил-3-(дипропиламино)-1,2,3,4-тетрагидро-2-оксо- 8- хинолинкарбоксилата.
П р и м е р 126. 6-(Дипропиламино)-6,7-дигидро-3Н, 5Н-бензо (ij)-хинолизин-3-он (соединение 102).
Часть А. 5-(Дипропиламино)-1,2,3,4-тетрагидро-8-хинолинкарбоксальдегид.
Это соединение получают по методике примера 92 (часть А), используя 1,2,3,4-тетрагидро-8-(гидроксиметил)-N, N-дипропил-3-хинолинамин вместо N-(дипропиламино)-1Н-бензимидазол-4-пропанола.
Часть Б. 6-(Дипропиламино)-6,7-дигидро-3Н, 5Н-бензо (ij) хинолизин-3-он (соединение 102).
Смесь 5-(дипропиламино)-1,2,3,4-тетрагидро-8-хинолинкарбоксальдегида (2,60 г, 0,01 моль), диэтилмалоната (1,76 г, 0,011 моль), пиперидина (0,3 г) и уксусной кислоты (0,1 мл) в этаноле (20 мл) кипятят с обратным холодильником в течение 6 ч. Растворители удаляют, остаток переносят в ДМФА и кипятят с обратным холодильником в течение 3 ч. ДМФА удаляют, остаток хроматографируют, получая 6-(дипропиламино)-6,7-дигидро-3-оксо-3Н, 5Н-бензо (ij)хинолизин-2-карбоксилат. Этот продукт растворяют в этаноле (50 мл) и обрабатывают раствором гидроокиси натрия (10 мл, 4 н.) в течение 1 ч. Раствор нейтрализуют соляной кислотой, получая 6-(дипропиламино)-6,7-дигидро-3Н, 5Н-бензо (ij) хинолизин-3-он. Продукт кристаллизуют из гексана, т. пл. 82-84оС.
П р и м е р 127. 6-(Диметиламино)-6,7-дигидро-3Н, 5Н-бензо (ij)-хинолизин-3-он (соединение 103).
Это соединение получают по методике примера 126, используя 1,2,3,4-тетрагидро-8-(гидроксиметил)-N,N-диметил-3-хинолин- амин вместо 1,2,3,4-тетрагидро-8-(гидроксиметил)-N,N-дипропил-3-хинолинамина.
П р и м е р 128. 6-(Дипропиламино)-2,3,6,7-тетрагидро-3Н, 5Н-бензо(ij) хинолизин-3-он (соединение 104).
Этот продукт получают по методике примера 36, используя 6-(дипропиламино)-6,7-дигидро-3Н, 5Н-бензо (ij) хинолизин-3-он вместо N-(3-хинолизил) формамида. Продукт кристаллизуют из пентана, т.пл. 44-46оС.
П р и м е р 129. 6-(Диметиламино)-2,3,6,7-тетрагидро-3Н, 5Н-бензо(ij) хинолизин-3-он (соединение 105).
Это соединение получают по методике примера 36, используя 6-(дипропиламино)-6,7-дигидро-3Н, 5Н-бензо (ij) хинолизин-3-он вместо N-(3-хинолил) формамида.
П р и м е р 130. Третбутил-1,2,3,4-тетрагидро-5-(дипропиламино)-хинолин-1- карбоксилат.
Смесь 1,2,3,4-тетрагидро-N3,N3-дипропилхинолина (31,4 г, 0,135 моль) и ди-третбутилдикарбоната (32,5 г, 0,149 моль) нагревают при 100оС в течение 1 ч. Продукт хроматографируют на силикагеле, элюируя смесью этилацетат гексан; получают 42,6 г третбутил-1,2,3,4-тетрагидро-5-(дипропила- мино)-хинолин-1-карбоксилата, т.пл. 40-42оС.
Часть полученного продукта превращают в гидрохлорид, т.пл. 168оС (разл. ), из смеси метанол: эфир.
П р и м е р 131. Третбутил-1,2,3,4-тетрагидро-8-метил-5-(дипропиламино)-хинолин-1- карбоксилат (соединение 11).
К перемешиваемому раствору третбутиил-1,2,3,4-тетрагидро-5-(дипропиламино) хинолин-1- карбоксилата (10 г, 0,030 моль) в ТГФ (200 мл) при - 78оС добавляют втор-бутиллитий (17,7 мл 1,3 М раствора в гексане, 0,045 моль). Через 15 мин добавляют йодистый метил (17,1 г, 0,13 моль) и дают раствору нагреться до комнатной температуры. При пониженном давлении удаляют ТГФ и маслообразный остаток разделяют между этилацетатом и водой. Этилацетат выпаривают, полученное масло хроматографируют на силикагеле, получая 10,65 г третбутил-1,2,3,4-тетрагидро-8-метил-5-(дипропила-мино) хинолин-1-карбоксилат в виде масла.
П р и м е р 132. 5-(Дипропиламино)-5,6-дигидро-4Н-пирроло (3,2,1-ij) хинолин-2(1Н)-он (соединение 97).
По методике примера 131, используя третбутил-1,2,3,4-тетрагидро-8-метил-5- (дипропиламино) хинолин-1-карбоксилат вместо третбутил-1,2,3,4-тетрагидро-5-(дипропиламино)-хинолин-1- карбоксилата и двуокись углерода вместо йодистого метила, получают 1,2,3,4-тетрагидро-1-(третбутоксикарбонил)-5-(дипропиламино) хинолин-8-пропионовую кислоту. Этот продукт обрабатывают трифторуксусной кисло- той, удаляя третбутоксикарбонильную группу и осуществляя циклизацию с образованием 5-(дипропиламино)-5,6-дигидро-4Н-пирроло (3,2,1-ij) хинолин-2 (1Н)-он, т.пл. 84-86оС.
П р и м е р 133. Восстановление 5-(дипропиламино)-5,6-дигидро-4Н-пирроло (3,2,1-ij) хинолин-2(1Н)-она (соединение 97) литийалюминийгидридом.
Смесь 5-(дипропиламино)-5,6-дигидро-4Н-пирроло (3,2,1-ij)хинолин-2(1Н)-она (0,75 г) и литийалюминийгидрида (0,21 г) перемешивают в среде эфира (20 мл в течение 45 мин. Реакцию прекращают добавлением метанола, растворитель выпаривают, а остаток разделяют между этилацетатом и водой. После выпаривания этилацетата получают масло, которое хроматографируют на силикагеле, элюируя смесью этилацетат:гексан (1:20); получают 0,27 г 5,6-дигидро-N,N-дипропил-4Н-пирроло (3,2,1-ij) хинолин-5-амина (соединение 87), который вымывается из колонки первым. При последующем элюировании получают 0,34 г 1,2,5,6-тетрагидро-N,N-дипропил-4Н-пирроло (3,2,1-ij) хинолин-5-амина (соединение 92).
П р и м е р 134. 5,6-Дигидро-5-(дипропиламино)-4Н-пирроло (3,2,1-ij) хинолин-2,3-дион (соединение 93).
По методике примера 131, используя этилоксалат вместо йодистого метила, получают 1,2,3,4-тетрагидро-1-(третбутоксикарбонил)- α-оксо-5-(дипропиламино) хинолин-8-пропионовую кислоту (соединение LIII). Этот продукт обрабатывают трифторуксусной кислотой, осуществляя циклизацию с образованием 5,6-дигидро- 5-(дипропиламино)-4Н-пирроло (3,2,1-ij) хинолин-2,3-диона (соединение 95).
П р и м е р 135. 6-(Дипропиламино)-6,7-дигидро-3Н, 5Н-бензо (ij) хинолизин-3-он (соединение 102).
По методике примера 131, используя этилформиат вместо йодистого метила, получают третбутил-8-формил-1,2,3,4-тетрагидро-5-(дипропиламино)-хинолин-1- карбоксилат (соединение LIV) в виде масла. Этот продукт (3,6 г) добавляют к перемешиваемому раствору триметилфосфоноацетата (3,64 г) и гидрида натрия (0,96 г) в ацетонитриле (75 мл).
Раствор упаривают, хроматографируют, получая 3,6 г метил-1,2,3,4-тетрагидро-1-(третбутоксикарбонил)-α -оксо-5-(дипропиламино) хинолин-8-бутеноата (соединение LV) в виде масла. Этот продукт обрабатывают трифторуксусной кислотой, удаляя третбутоксикарбонильную защитную группу, и кипятят с обратным холодильником в этаноле, осуществляя циклизацию в 6-(дипропиламино)-6,7-дигидро-3Н, 5Н-бензо (ij) хинолизин-3-он (соединение 102).
П р и м е р 136. Аллилирование 5-(амино)-5,6-дигидро-4Н-имидазо-(4,5,1-ij) хинолин-2 (1Н)-она.
По методике примера 54, используя бромистый аллил вместо йодистого пропила и 5-(амино)-5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-2 (1Н)-он вместо 6-бром-1,2,3,4-тетрагидро-8-нитро-3-хинолинамина дигидрохлорида, получают 5-(диаллиламино)-5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-2(1Н)-он, т. пл. 150-152оС, из этилацетата и 5-(аллиламино)-5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-2(1Н)-он. Последнее соединение превращают в гидрохлорид, т.пл. 260оС, из смеси метанол: эфир.
П р и м е р 137. Реакция 5-(амино)-5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-2(1Н)-она с циклопропилметилбромидом.
По методике примера 54, используя циклопропилметилбромид вместо йодистого пропила и 5-(амино)-5,6-дигидрио-4Н-имидазо-(4,5,1-ij) хинолин-2(1Н)-он вместо дигидрохлорида 6-бром-1,2,3-тетрагидро-8-нитро-3-хинолинамина, получают 5-[бис(циклопропилметил)амино] -5,6-дигидро -4Н-имидазо (4,5,1-ij) хинолин-(1Н)-он, т.пл. 152-154оС из смеси этилацетат: гексан и 5-(циклопропилметиламино)-5,6-дигидро-4Н-имидазо (4,5,1-ij) хинолин-2 (1Н)-он. Последнее соединение превращают в гидрохлорид, т.пл. 309оС (разл. ), из смеси метанол: эфир.
В нижеприведенных схемах реакций использованы следующие аббревиатуры: КДИ - карбонилдиимидазол; БОК - третбутилоксикарбонил, БСИ - N-бромсукцинимид.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТАБЛЕТКИ С ПРОЛОНГИРОВАННЫМ ВЫДЕЛЕНИЕМ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 1998 |
|
RU2205007C2 |
| АЛКИЛЗАМЕЩЕННЫЕ ЦИКЛИЧЕСКИЕ АМИНЫ В КАЧЕСТВЕ СЕЛЕКТИВНЫХ ЛИГАНДОВ D3-ДОПАМИНА | 1997 |
|
RU2185372C2 |
| ПРОИЗВОДНЫЕ 1,2,3,4-ТЕТРАГИДРО-2-НАФТИЛАМИНА | 1990 |
|
RU2086535C1 |
| БИЦИКЛИЧЕСКИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ АМИНЫ И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, БИЦИКЛИЧЕСКИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ АМИНЫ И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ В КАЧЕСТВЕ ИНГИБИТОРА РЕАКЦИОННОСПОСОБНОГО КИСЛОРОДА | 1993 |
|
RU2103272C1 |
| ЗАМЕЩЕННЫЕ ПИРИМИДИНТИОАЛКИЛЬНЫЕ ИЛИ АЛКИЛЭФИРНЫЕ СОЕДИНЕНИЯ И СПОСОБ ИНГИБИРОВАНИЯ ОБРАТНОЙ ТРАНСКРИПТАЗЫ ВИРУСОВ | 1996 |
|
RU2167155C2 |
| ТРОПОНЗАМЕЩЕННЫЙ ФЕНИЛОКСАЗОЛИДИНОН ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ ИЛИ ГИДРАТЫ | 1993 |
|
RU2119484C1 |
| 4-ГИДРОКСИПИРАН-2-ОНЫ, ЦИКЛООКТИЛ-ИЛИ БЕНЗОПИРАН-2-ОНЫ, 4-ГИДРОКСИ-2Н-ПИРАН-2-ОНЫ И 4-ГИДРОКСИ-ЦИКЛООКТАПИРАН-2-ОНЫ | 1995 |
|
RU2139284C1 |
| Способ получения моно-окса-бензоацетамидных или -бензамидных соединений,или метансульфонатной соли моно-окса-бензоацетамидных соединений | 1982 |
|
SU1338784A3 |
| ДИАРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ | 1992 |
|
RU2099335C1 |
| СПОСОБ ПОЛУЧЕНИЯ АМИДОВ ИМИДАЗО(4,5-B)ХИНОЛИНИЛОКСИАЛКАНОВЫХ КИСЛОТ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИМЕНЯЕМЫХ СОЛЕЙ | 1990 |
|
RU2041210C1 |
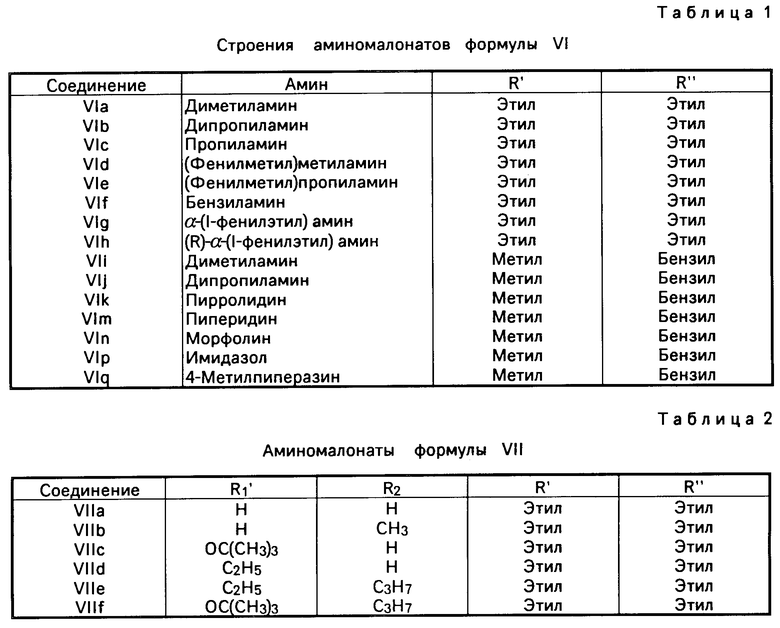
Использование: в качестве препаратов, обладающих активностью в отношении центральной нервной системы. Сущность изобретения: трициклические азотсодержащие соединения ф-лы 1, указанной в описании, где R1-R3-H, C1-C6 - алкильная, C3-C5 - алкенильная, C3-C5 - алкинильная, C3-C7 - циклоалкильная, C4-C10 - циклоалкил или фенилзамещенная C1-C6 - алкильная группа; 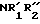 - остаток C3-C7 - циклического амина; X - H, C1-C6 - алкил, галоген, OH, C1-C6 CN, карбоксиамид, карбоксил, C1-C6 A-CH, CH2 CH-галоген, CHCH3, C=O, C=S, C-SCH3, C= NH, C-NH2, C-NHCH3, C-NHCOOCH3, C-NHCN, SO2, N, B-CH2, CH, CH-галоген, C=O, N, NH или N-CH3, O, n=0-1; D-CH, CH2 - галоген, C=O, O, N, NH, N-CH3. 15 з.п.ф-лы, 2 табл.
- остаток C3-C7 - циклического амина; X - H, C1-C6 - алкил, галоген, OH, C1-C6 CN, карбоксиамид, карбоксил, C1-C6 A-CH, CH2 CH-галоген, CHCH3, C=O, C=S, C-SCH3, C= NH, C-NH2, C-NHCH3, C-NHCOOCH3, C-NHCN, SO2, N, B-CH2, CH, CH-галоген, C=O, N, NH или N-CH3, O, n=0-1; D-CH, CH2 - галоген, C=O, O, N, NH, N-CH3. 15 з.п.ф-лы, 2 табл.
X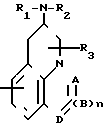
или их фармацевтически приемлемые соли,
где R1, R2 и R3 - независимые водород, C1 - C6-алкильная, C3 - C5-алкенильная, C3 - C5-алкинильная, C3 - C7-циклоалкильная, или C4 - C10-циклоалкил, или фенилзамещенная C1 - C6-алкильная группа; NR1R2 - остаток C3 - C7-циклического амина, который может содержать дополнительные гетероатомы, выбираемые из атомов азота, кислорода и серы, или/и ненасыщенность;
X-водород, C1 - C6-алкильная группа, галоген, гидроксильная группа, C1 - C6-алкоксигруппа, цианогруппа, карбоксиамидная группа, карбоксильная группа или (C1 - C6-алкокси)карбонильная группа;
A - CH, CH2, CH - галоген, CHCH3, C=O, C=S, C - SCH3, C=NH, C - NH2, C - NHCH3, C - NHCOOCH3, или C - NHCN SO2 или N,
B - CH2CH, CH-галоген или С=О, или N, NH или N - CH3, O;
n = 0 или 1;
D - CH, CH2, CH - галоген или C=O, O, N, NH или N-CH3.
гидрохлорид 5-(диметиламино)-5,6-дигидро-4H-имидазо- (4,5,1-ij) хинолин-2(IH)-он;
5-(пропиламино)-5,6-дигидро-4H-имидазо (4,5,1-ij)-хинолин-2 (IH)-он; 5-(дипропиламино)-5,6-дигидро-4H-имидазо(4,5,1-ij)хинолин-2(IH)-он;
(-)-5-(дипропиламино/-5,6-дигидро-4H-имидазо(4,5,1-ij)хинолин 2(IH)-он;
5,6-дигидро-N,N-дипропил-4H-имидазо(4,5,1-ij)хинолин-5-амин;
5,6-дигидро-N-пропил-4H-имидазо(4,5,1-ij)хинолин-5-амин;
5,6-динидро-5-(дипропиламино)-4H-имидазо(4,5,1-ij)хинолин-8-ол;
6. Соединение по п.1, где D - N, n = 1.
1,2,6,7-тетрагидро-6-(дипропиламино)-3H, 5H-пиридо(1,2,3-de)-хиноксалин-2-он;
6,7-дигидро-6-(дипропиламино)-3H, 5H-пиридо(1,2,3-de)хиноксалин-3-он;
6,7-дигидро-6-(дипропиламино)-3H, 5H-пиридо(1,2,3-de)хиноксалин-2,3-дион;
8. Соединение по п.1, где D = O, n представляет собой O и A представляет собой CH, CH2, CHCH3, C = O, C = S, C - SCH3, C = NH, C - NH2, C - NH CH3, C - NHCOOCH3 или C - NH CN.
5-(дипропиламино)-5,6-дигидро-2H, 4H-оксазоло (5,4,3-ij)хинолин-2-он,
5-(пропиламино)-5,6-дигидро-2H, 4H-оксазоло(5,4,3-ij)хинолин-2-он;
5-(диметиламино)-5,6-дигидро-2H, 4H-оксазоло (5,4,3-ij)хинолин-2-он;
11. Соединение по п.1, в котором D представляет собой CH, CH2 или C = O и n равно нулю.
5,6-дигидро-N,N-дипропил-4H-пирроло(3,2,1-ij)хинолин-5-амин;
5,6-дигидро-N,N-диметил-4H-пирроло(3,2,1-ij)хинолин-5-амин;
5,6-дигидро-N,N-дипропил-4H-пиразоло(4,3,2-ij)хинолин-5-амин;
5,6-дигидро-N,N-диметил-4H-пиразоло (4,3,2-ij)хинолин-5-амин; 1,2,5,6-тетрагидро-N,N-дипропил-4H-пирроло(3,2,1-ij)хинолин-5-амин;
1,2,5,6-тетрагидро-N,N-диметил-4H-пирроло (3,2,1-ij)хинолин-5-амин;
5-(пропиламино)-5,6-дигидро-4H-пирроло(3,2,1-ij)хинолин-2,3-дион; 5-(дипропиламино)-5,6-дигидро-4H-пирроло(3,2,1-ij)хинолин-2,3-дион;
5-(пропиламино)-5,6-дигидро-4H-пирроло(3,2,1-ij)хинолин-2 (IH)-он; 5-(дипропиламино)-5,6-дигидро-4H-пирроло(3,2,1-ij)хинолин-2(IH)-он;
13. Соединения по п.1, где D представляет собой CH, CH2 или C = O и n = 1.
2,3,6,7-тетрагидро-N,N-диметил-1H, 5H-бензо(ij)хинолизин-2-амин;
2,3,6,7-тетрагидро-N-метил-1H, 5H-бензо(ij)хинолизин-2-амин;
N-этил-2,3,6,7-тетрагидро-N-метил-1H, 5H-бензо (ij)хинолизин-2-амин:
2,3,6,7-тетрагидро-N-пропил-1H, 5H-бензо-(ij)хинолизин-2-амин;
2,3,6,7-тетрагидро-N,N-дипропил-1H, 5H-бензо(ij)хинолизин-2-амин;
6-(дипропиламино)-2,3,6,7-тетрагидро-5H-пиридо (3,2,1-ij)хинозолин-3-он; 6-(диметиламино)-2,3,6,7-тетрагидро-5H-пиридо(3,2,1-(ij)-хиназолин-3-он;
6-дипропиламино)-6,7-дигидро-1H 5 H-пиридо(1,2,3-de)-2,4-бензоксазин-3-он;
6-(диметиламино)-6,7-дигидро-1H, 5H-пиридо(1,2,3-de)-2,4-бензоксазин-3-он;
6-(дипропиламино)-6,7-дигидро-3H, 5H-бензо(ij)хинолизин-3-он;
6-(диметиламино)-6,7-дигидро-3H, 5H-бензо(ij)хинолизин-3-он;
6-(дипропиламино)-2,3,6,7-тетрагидро-3H, 5H-бензо(ij)хинолизин-3-он;
6-(диметиламино)-2,3,6,7-тетрагидро-3H, 5H-бензо(ij)хинолизин-3-он;
6-(диметиламино)-2,3,6,7-тетрагидро-3H, 5H-бензо(ij)хинолизин-3-он;
15. Производные тетрагидрохинолина общей формулы

где W - O или H2;
R′1 и R2 - независимые водород или C1 - C4-алкильная группа.
1,2,3,4-тетрагидро-N3, N3-диметил-3,8-хинолиндиамин;
1,2,3,4-тетрагидро-N3, N3-дипропил-3,8-хинолиндиамин;
трет-бутил(8-амино-1,2,3,4-тетрагидро-3-хинолил)-карбамат;
N-пропил-N-(8-амино-1,2,3,4-тетрагидро-3-хинолил)-формамид.
| J of Med | |||
| Chem, 1992, N35. |
Авторы
Даты
1994-11-30—Публикация
1991-12-06—Подача