Изобретение относится к биотехнологии и касается получения моноклональных антител для печеночной трематоде Opisthorchis felineus, которые могут найти применение в медицине, иммунологии и биотехнологии с целью усовершенствования методов идентификации и диагностики, а также для стандартизации антигена в иммунодиагностикумах.
Известны коллекции мышиных моноклональных антител (МКА) к печеночной трематоде Opisthorchis viverrini, полученные за рубежом [1, 3]. Сведения об аналогах подобных моноклональных антител для печеночной трематоды Opisthorchis felineus в доступных источниках информации не обнаружены.
Технической задачей изобретения является получение гибридомы мышиного происхождения, секретирующей МКА к иммуногену 105 кДа экскреторно-секреторного антигена (Э-С) печеночной трематоды Opisthorchis felineus, которые можно эффективно использовать для индикации антигена печеночной трематоды Opisthorchis felineus в физиологических жидкостях или специфических иммуноглобулинов в сыворотке крови больных описторхозом, вызываемым печеночной трематодой Opisthorchis felineus, что делает препараты данных антител перспективными реагентами для усовершенствования имеющихся и для конструирования принципиально новых диагностических тест-систем на печеночную трематоду человека Opisthorchis felineus.
Задача решается слиянием клеток мышиной P3/NS1/1-Ag4.l (NSI) миеломы с клетками селезенки самок мыши BALB/c массой 15-20 г (ГНЦ ВБ "Вектор), иммунизированных очищенным суммарным препаратом антигенов трематоды Opisthorchis felineus, которые получены при культивировании Opisthorchis felineus в течение 2-х недель на минимальной поддерживающей среде Игла.
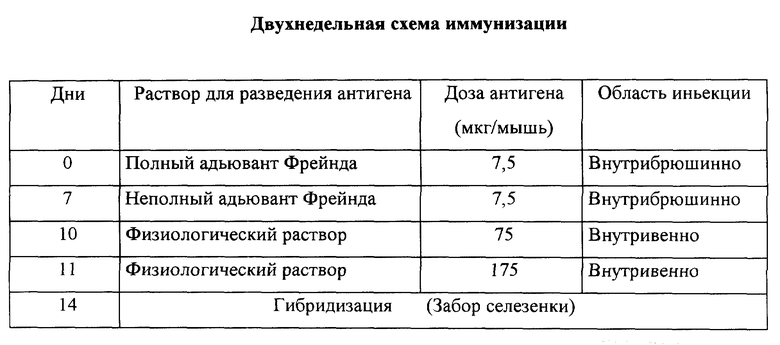
Используют схему иммунизации, представленную в таблице.
Для слияния используют 150 млн. селезеночных клеток и 50 млн. клеток NSI. Смесь клеток центрифугируют, супернатант тщательно удаляют и к клеточному осадку добавляют 0.4 мл 50% раствора полиэтиленгликоля (ПЭГ) с молекулярной массой 2000. Смесь центрифугируют 15 мин при 600 g. После 3-5 мин паузы слой ПЭГ медленно разбавляют раствором версена, после чего осадок ресуспендируют и центрифугируют. Клетки распределяют в пять культуральных 96-луночных микроплат по 100 мкл в лунку. Селекцию гибридных клеток проводят в среде НАТ, состоящей из питательной среды ДМЕМ(М), в которую добавлены 15% фетальной сыворотки коров, 0.1 мМ гипоксантина, 0.04 мМ тимидина и 0.01 мМ аминоптерина.
Отбор специфических гибридов проводят методом иммуноферментного анализа (ИФА). В лунки полистироловых микроплат ("Dynatech", Швейцария) в качестве антигена вносят 10 нг очищенного препарата трематоды Opisthorchis felineus и после подсушивания на воздухе антиген фиксируют в течение 10 мин холодным этанолом. Места неспецифического связывания насыщают 0.5% раствором казеина. Затем в лунки переносят по 50 мкл культуральной среды исследуемых гибридом и инкубируют в течение часа при 37oC. После инкубации лунки промывают 3-5 раз дистиллированной водой. Далее в планшеты вносят по 50 мкл антивидового коъюгата (иммуноглобулины кролика, меченные пероксидазой против lgG мыши) и сорбируют 45 мин при 37oC. Планшеты промывают и проводят ферментативную реакцию. Результаты анализа определяют на спектрофотометре при длине волны 492 нм. Положительными считают клоны, антитела которых дают сигнал превышения над контролем в 3 раза.
Гибридный штамм 1А1/В2 клонировали дважды методом предельных разведений, перевели в массовую культуру и заморозили в жидком азоте.
Штамм характеризуется следующими признаками:
Морфологические признаки. Культура состоит из крупных округлых клеток, сходных по морфологии и размерам с исходной родительской миеломой NSI. Овальное ядро расположено эксцентрично и занимает значительную часть цитоплазмы.
Культуральные свойства. Среда для культивирования - среда Игла MEM в модификации Дульбекко, содержащая увеличенные количества аргинина до 200 мг/л, фолиевой кислоты до 12 мг/л, аспарагина до 36 мг/л, а также 0.05 мМ 2-меркаптоэтанола и 20 мМ HEPES, 4 мМ L-глутамина. Содержание фетальной сыворотки в ростовой среде - 10%. В среду также добавляют 80 мкг/мл сульфата гентамицина. Гибридома 1А1/В2 растет в виде монослойно-суспензионной культуры. Посевная доза 100-200 тыс. клеток в миллилитре, кратность рассева - 1:5-1:6 через 3-4 дня. Культивирование проводят при 37oC в термостате с 5% углекислоты, в атмосфере 95% влажности или в герметических флаконах без подачи CO2.
Культивирование гибридомы в организме животного. Самок мышей BALB/c (ГНЦ ВБ "Вектор") сенсибилизируют внутрибрюшинным введением 5 мл вазелинового масла. Через 2-4 недели животным вводят 10 млн. гибридных клеток. Через 10-12 дней формируется асцитная опухоль. От одного животного можно получить 20-50 мл асцитической жидкости. Гибридома прививается в 100% случаев.
Характеристика полезного продукта. Гибридный клон 1А1/В2 обеспечивает получение мышиных иммуноглобулинов класса lgG в количестве 10-20 мг антител из миллилитра асцитической жидкости и 1-5 мкг из миллилитра культуральной среды. Они специфически взаимодействуют с белками 105 и 160 кДа реплики препарата экскреторно-секреторного антигена Opisthorchis felineus в реакции иммуноблотинга. Стабильная продукция МКА сохраняется на протяжении не менее 30 пассажей in vitro.
Криоконсервирование. Среда для замораживания - среда ДМЕМ(М) - 50%, фетальная сыворотка - 40%, диметилсульфоксид - 10%. 0.5 мл клеточной суспензии переносят в пластиковые криопробирки и помещают в пенопластовый контейнер с толщиной стенок 1.5 см. Контейнер вносят в пары жидкого азота. Через сутки пробирки переносят в жидкий азот. Размораживание проводят, опуская пробирки в воду с температурой 41oC. Клетки разводят средой ДМЕМ(М) и центрифугируют при 600 g. Осадок ресуспендируют в ростовой среде в концентрации 200-300 тысяч клеток в миллилитре и переносят в культуральные флаконы. Жизнеспособность после размораживания составляет 60-80% (окраска 0,25% трипановым синим).
Изобретение иллюстрируется данными иммуноблотинга (см. чертеж):
Связывание моноклональных антител, продуцируемых гибридомой 1A1/B2, в иммуноблотинге с экскреторно-секреторным антигеном Opisthorchis felineus.
Пример 1. Культивирование штамма 1A1/B2, секретирующего моноклональные антитела к трематоде Opisthorchis felineus в организме животных, мышей BALB/c.
Вариант 1. Культивируемые клетки штамма 1A1/B2, находящиеся в логарифмической фазе роста, стерильно центрифугируют 5-10 мин при 1000 об/мин на центрифуге ОПН-3. Надосадок удаляют, а осадок суспензируют в стерильном растворе Эрла или Хенкса. Самкам мышей BALB/c (ГНЦ ВБ "Вектор") весом 15-20 г внутрибрюшинно инъецируют каждой по 3-5 мл клеточной суспензии, содержащей 15-20 млн. гибридных клеток. Через 7-10 дней животных усыпляют и из брюшной полости извлекают 10-12 мл асцитной жидкости. Клетки из асцитной жидкости отделяют центрифугированием и используют для дальнейшего перевивания гибридомы, а в надосадочной жидкости определяют титр антител с помощью иммуноферментного анализа, как описано выше.
Вариант 2. Предварительно мышам BALB/c (ГНЦ ВБ "Вектор") весом 15-20 г не менее, чем за 10 дней до прививки гибридомных клеток вводят внутрибрюшинно по 5 мл вазелинового масла. Суспензию культивируемых клеток штамма 1A1/B2, приготовленную как описано выше, прививают животным внутрибрюшинно. Каждая инъекция содержит 10 млн. клеток в 1-3 мл бес сывороточной среды или раствора Эрла. Через 10-14 дней после прививки гибридомных клеток образуется 15-30 мл асцитной жидкости, которая используется для получения препаратов моноклональных антител, как описано далее.
Пример 2. Выделение очищенных моноклональных антител, продуцируемых штаммом гибридных культивируемых клеток 1A1/B2, из асцитической жидкости и культуральной среды.
Вариант 1. К выбранному объему асцитической жидкости или культуральной среды, содержащих МКА и предварительно отцентрифугированных при 5000 g 20 мин, добавляют равный объем насыщенного раствора сульфата аммония. Полученную суспензию после инкубирования в течение 30 мин при +4oC еще раз центрифугируют 20 мин при 5000 g. Осадок, содержащий обогащенную фракцию иммуноглобулинов, растворяют в 0.01 М растворе фосфатного буфера, при pH 7,2. Остаток сульфата аммония удаляют путем гельфильтрации. С этой целью используется колонка 3х30 см, заполненная сефадексом G-25 и уравновешенная 0.01 М фосфатным буфером, pH 7,2.
Дальнейшее выделение МКА проводится хроматографией на ДЭАЭ-сефадекс-А-50. На колонку размером 2.5х20 см, заполненную ДЭАЭ-сефадекс-А-50, суспендированным в 0.02 М фосфатном буфере (ФБ), pH 6.3. наносятся выделенные иммуноглобулины (на 1 мг геля 1 мг белка). Элюирование иммуноглобулинов проводят ФБ, pH 6,3. Фракция специфических lgG выходит в первом пике. После гельфильтрации и элюирования можно сконцентрировать фракцию, содержащую МКА, при помощи ПЭГ-20000.
Вариант 2. Один объем асцитической жидкости или культуральной среды, содержащих МКА, разводят 4 объемами 0.6 М ацетатного буфера (0.04 М лимонной кислоты, 0.2 М натрия ацетата), pH 4,0 и доводят pH до 4,5 с помощью 0.1 N раствора едкого натра. К разведенному образцу добавляют по каплям, с постоянным перемешиванием, каприловую кислоту из расчета 25 мкл на 1 мл раствора и инкубируют 30 мин при +4oC. Затем центрифугируют 30 мин при 8000 g и осадок удаляют, а супернатант смешивают с 10-кратным фосфатно-солевым буфером (ФСБ) и устанавливают pH 7,4 раствором 1,0 N едкого натра (супернатант при необходимости фильтруют). Добавляют равный объем насыщенного раствора сульфата аммония (V:V), встряхивают и выдерживают ночь при +4 С или 30 мин при +20-25oC. Центрифугируют 15 мин при 5000 g. Супернатант сливают, а осадок ресуспендируют в ФСБ, pH 7,4. Остатки сульфата аммония удаляют путем диализа против 50-100 объемов ФСБ, pH 7,4.
Пример 3. Определение специфического взаимодействия МКА 1A1/B2 с экскреторно-секреторным антигеном печеночной трематоды Opisthorchis felineus методом ИФА.
Вариант 1. ИФА проводят на полистироловых планшетах; антиген наносят в объеме 15 мкл/лунку на планшеты и после подсушивания на воздухе фиксируют этанолом. Места неспецифического связывания насыщают 0,5% раствором казеина в буфере ТСБ-Твин (0.145 М хлористого натрия, 20 mM Трис-HCl, 5 mM PMSF (Sigma-USA), 0.1% Tween-20 (Serva), pH-7.4) при 37oC 45 минут.
Затем инкубируют с моноклональными антителами 1A1/B2 45 минут при 37oC. Специфическое связывание выявляют антивидовыми меченными пероксидазой антителами против lgG. Хромоген - 0,1% о-фенилендиамин в цитратно-фосфатном буфере (0.2 М лимонной кислоты, 0.5 М Na2HPO3, pH 5.0) с 0.03% перекиси водорода). Останавливают реакцию добавлением 100 мкл на лунку I N HCl и измеряют оптическую плотность образцов на спектрофотометре "Uniscan" (Финляндия) с использованием светофильтра с максимумом пропускания 492 нм. В качестве контроля используют гомологичные нормальную и гипериммунную сыворотки.
Вариант 2. ИФА проводят с репликой препарата экскреторно-секреторного антигена, подвергнутого электрофорезу и переносу на нитроцеллюлозную мембрану в блоте [2, 4, 5]. Места неспецифического связывания насыщают 0,5% раствором казеина в буфере ТСБ-Твин (0.145 М хлористого натрия, 20 mM Трис-HCI, 5 mM PMSF (Sigma-USA), 0.1% Tween-20 (Serva), pH 7.4) при 37oC 45 минут.
Затем инкубируют с моноклональными антителами 1A1/B2 45 минут при 37oC. Специфическое связывание выявляют антивидовыми меченными пероксидазой хрена антителами против lgG. Хромоген - 0.1% 4-хлор-1-нафтол в ЗФР (50 mM трис-HCl. 0.145 mM NaCl pH 7.4 и 10% этанола) с 0.03% перекиси водорода. В качестве контроля используют среду от родительской миеломы NSI.
Клеточная линия 1A1/B2 обеспечивает получение мышиных иммуноглобулинов класса lgG (субкласса lgG2a) в количестве 5-10 мг очищенных антител из миллилитра асцитической жидкости и 0.5-2 мкг из миллилитра культуральной среды. МКА 1A1/B2 обладают высокой специфичностью к экскреторно-секреторному антигену Opisthorchis felineus, при связывании в ИФА с Э-С-антигеном методом предельных разведений титр культуральной жидкости 1/64.000 и титр асцита 1/1.280.000, сигнал в ИФА при связывании с 15 нг Э-С-антигена на лунку - ОП492: 2.00. В иммуноблотинге моноклональные антитела связываются с белком - иммуногеном 105 кДа печеночной трематоды человека Opisthorchis felineus.
Вышеприведенные свойства штамма гибридных клеток 1А1/2 позволяют заключить, что впервые на основе мышиной миеломы получена гибридома-продуцент МКА к белку 105 кДа экскреторно- секреторного антигена печеночной трематоды Opisthorchis felineus, которая позволяет получать мышиные моноклональные иммуноглобулины для широкого использования в научно-исследовательских и производственных целях.
Вышеуказанные свойства штамма 1A1/B2 отличают его от всех описанных ранее гибридом, продуцирующих МКА к печеночным трематодам рода Opisthorchis.
Список используемой литературы
1. Billings P. В. , Utsakhit N. @ Sirisinha S. Monoclonal antibodies against Opisthorchis viverrini antigens. Parasite Immunology, - 1990, - vol. 12, - p. 545-557
2. Laemmli U.K. // Nature, - 1970, - vol. 227, - p. 680-685.
3. Sirisinha S. , Chawengkirttikul R., Tayapiwatana C., Naiyanetr C., Waikagul J. , Radomyos P. and Podoprigora G.I. Specific and cross- reactivemonoclonal antibodies to the 89-kDa antigen of Opisthorchis viverrini. Southeast Asean J. Trop. Med. Public Health, - 1992, - vol. 23, - N 3, - p. 489-490.
4. Towbin H., Gordon J. // J. Immunol. Methods, - 1984, - vol. 72, - p. 313-340.
5. Towbin H. Staehelin Т., Gordon. // Proc. Nat. Acad. Sci. USA, - 1979, - vol. 76, - p. 4350-4354.
Сущность изобретения: штамм гибридных перевиваемых клеток ИМБ 649 был получен слиянием клеток мышиной миеломы P3/NS1/1-Ag4.1 с клетками сингенных мышей BALB/c, иммунизированных очищенным препаратом суммарного антигена печеночной трематоды Opisthorchis felineus. Штамм гибридных перевиваемых клеток ИМБ 649 секретирует моноклональные антитела lgG2a, специфически взаимодействующие с белком 105 кДа экскреторно-секреторного антигена Opisthorchis felineus в иммуноблотинге. Моноклональные антитела данного изобретения используют в качестве реагентов для новых тест-систем на печеночную трематоду человека Opisthorchis felineus. 1 ил., 1 табл.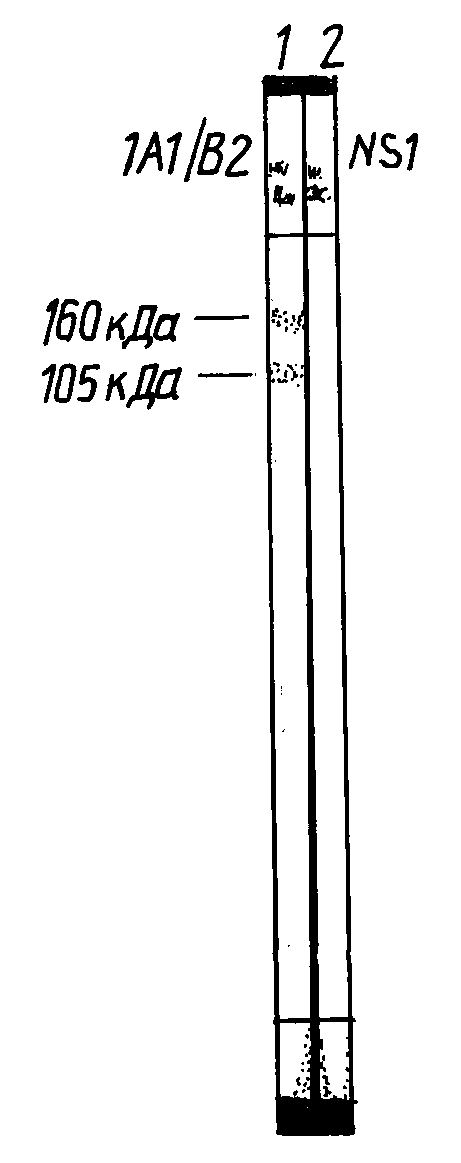
Штамм гибридных культивируемых клеток животных Mus musculus L. ИМБ 649, используемый для получения моноклональных антител к белку 105 кДа экскреторно-секреторного антигена печеночной трематоды человека Opisthorchis felineus.
| Production and characterization of monoclonae antifodies against the excretorysecretory antigen of the liver fluke Opisthorchis viverrihi | |||
| J | |||
| Parasitoe., 1991, 21,4, p.421-428 | |||
| Monoclonal, antifodies against opisthorchis viverrihi antigens, Parasite Immunology, 1990, vol | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
Авторы
Даты
1999-12-27—Публикация
1997-06-03—Подача