Изобретение относится к области биотехнологии и медицины, конкретно к диагностике описторхоза.
Известно несколько методов диагностирования описторхоза, вызываемого печеночной трематодой Opisthorchis felineus. В медицинской практике достаточно широко применяются иммунохимические методы обнаружения специфических антител (AT) в сыворотке крови человека, основанные на их специфическом связывании с антигенами (АГ) Opisthorchis felineus. Иммунодиагностика описторхоза особенно удобна при массовых обследованиях населения. Известны различные методы иммунодиагностики, такие как метод тонкослойного иммунного анализа, реакция непрямой гемагглютинации, иммуноферментный анализ (ИФА). В настоящее время для иммунодиагностики описторхоза наиболее широко используются способы, основанные на методе ИФА. Ряд ИФА-наборов в настоящее время выпускается коммерческим способом и активно используется в медицинской иммунодиагностике описторхоза. Известно, что с использованием иммунодиагностики регистрируется ежегодно около 40000 случаев описторхоза на территории России. К сожалению, современные ИФА-наборы для определения антител к антигенам описторхоза обладают существенными недостатками. Это, прежде всего, низкая чувствительность и специфичность ИФА при хронических формах глистной инвазии из-за использования малоспецифичных фракций антигена.
Суть основных способов иммуноанализа в приложении к выявлению специфических антител при описторхозе заключается в следующем:
1) Способ тонкослойного иммунного анализа для тестирования специфических IgG антител [1].
Для анализа используют полистироловые чашки с 1% агаром. После застывания агара в нем пробивают 3 лунки диаметром 3 мм. В каждую лунку вносят сыворотку крови исследуемого пациента. Затем лунки отмывают водой, после чего в одну лунку добавляют описторхозный антиген (сухой антиген из тел гельминтов), в другую копрофильтрат, в третью изотонический раствор хлорида натрия (контроль). После этого агар удаляют и чашки трехкратно отмывают фосфатно-солевым буфером с добавлением Твина-20. Далее в чашки вносят сыворотку против иммуноглобулинов G человека, меченную пероксидазой хрена. После отмывки проточной водой в них добавляют субстратную смесь (10 мг ортофенилендиамина, 0,35 мл 3% перекиси водорода и 50 мл 1% агара, приготовленного на цитратном буфере рН 6,0). Реакцию проводят в темноте при комнатной температуре. Остановку реакции производят добавлением 50 мкл 1 N раствора серной кислоты. Появление фиолетового окрашивания в местах первой и второй лунок указывает на образование комплексов АГ-АТ. Специфичность и чувствительность около 87,5%.
Недостатки способа: недостаточно высокие специфичность и чувствительность метода, высокий расход исходных компонентов, регистрация неспецифических реакций, связанных с присутствием в сыворотки крови пациентов высокого уровня аутоантител к копрофильтратам.
2) Способ реакции непрямой гемагглютинации для выявления специфических антител [2].
В качестве антигена используют цельный экстракт гомогената половозрелых Opisthorchis felineus с содержанием белка 1 мг/мл. Для получения эритроцитарного диагностикума применяют взвесь в изотоническом растворе (0,9% раствор NaCl) 20% эритроцитов, предварительно формализованных по Weinbach, описторхозный соматический антиген и 0,44% водный раствор амидола в соотношении 2:1:1. Сенсибилизированные эритроциты отмывают 0,9% раствором хлорида натрия и суспендируют до 1% концентрации (по плотному осадку) в среде, состоящей из сахарозы (3%), желатина (1%), мертиолата натрия в конечной концентрации 1: 10000. Реакцию непрямой геммаглютинации (РНГА) ставят общепринятым методом.
Недостатки способа: недостаточная специфичность и очень низкая чувствительность метода определения антител, нестандартность эритроцитов и проблемы, связанные с большими трудностями по их хранению.
3) ИФА-тест для обнаружения специфических IgM антител [3].
Используют непрямой вариант ИФА, заключающийся в обнаружении иммунных комплексов, образованных сывороточными антителами больных описторхозом с иммобилизованным на твердой фазе описторхозным антигеном, с помощью класс-специфического иммуноферментного конъюгата, выявляющего IgM человека. Постановку ИФА осуществляют в полистироловых планшетах для микроанализа. В качестве АГ для активации твердой фазы применяют вытяжку из цельного гомогената марит описторхисов, выделенных из желчных протоков печени спонтанно инвазированных кошек. Эта ИФА-система для определения IgM-антител к антигенам Opisthorchis felineus в сыворотке крови человека служит объективным показателем острой фазы инвазии, дифференцировать которую достаточно сложно.
Схема реакции.
Разведение реагентов и промывание планшетов на всех этапах реакции проводят 0,01 М фосфатным буферным раствором рН 7,2-7,4 с добавлением 0,15 М хлорида натрия и 0,05% Твина-20. При отработке всех параметров ИФА параллельно с сывороткой больного исследуют сыворотку донора, не имеющего в анамнезе описторхоза (отрицательный контроль), в одинаковых разведениях с опытной. Для получения иммуноферментного конъюгата используют коммерческие моноспецифические сыворотки к IgM человека, дополнительно очищенные от перекрестно реагирующих AT на иммуносорбентах с иммуноглобулинами G и А, а также Fab-фрагментами IgG человека; AT конъюгируют с модифицированной периодатом натрия пероксидазой хрена. Субстратом служит смесь ортофенилендиамина (0,04%-ный раствор) и перекиси водорода (0,005%). Оптическую плотность продуктов ферментативной реакции измеряют на фотометре с вертикальным ходом луча при длине волны 492 нм.
Недостатки способа: метод специфичен только для острых форм описторхоза и обладает нулевой ценностью при диагностике хронических форм заболевания. Тест-система неприменима для диагностики хронических форм описторхоза, которые преобладают у населения эндемичных районов.
Наиболее близким к заявляемому является способ-прототип непрямого ИФА, адаптированный для O.felineus [4]. Постановку ИФА осуществляют на полистироловых планшетах для микроанализа. В качестве антигена используют растворимую фракцию гомогената марит O. felineus. Антиген наносят в объеме 100 мкл/лунку в полистироловых планшетах и сорбируют в 0,1 М NaKББ, pH 9,6 ночь при 4oС. Места неспецифического связывания насыщают 1% раствором яичного альбумина в TBS pH 7,4. Разведение реагентов и промывание планшетов на всех этапах реакции проводят в TBS (буферным раствором 25 мМ Трис-НСl pH 7,2-7,4 с добавлением 0,145 М хлорида натрия). Плашки промывают в буфере TBS-Твин (0,145 М хлористого натрия, 20 мМ Трис-HCl, 0,1% Твин-20 (Serva), pH-7,4) при комнатной температуре 9 минут. Специфическое связывание выявляют с помощью класс-специфического иммуноферментного конъюгата с пероксидазой хрена выявляющего IgG человека. Хромоген - 0,1% О-фенилендиамин в цитратно-фосфатном буфере (0,2М лимонной кислоты, 0,5 М Na2HPО3, pH 5,0) с 0,03% перекиси водорода. Останавливают реакцию добавлением 100 мкл на лунку 1 N HC1. Оптическую плотность образцов измеряют на спектрофотометре типа "Multiscan" (Финляндия) с использованием светофильтра с максимумом пропускания 492 нм.
Основной недостаток всех вышерассмотренных методов анализа заключается в недостаточной специфичности и чувствительности этих методов из-за использования малоспецифических фракций АГ, типа соматических экстрактов, для диагностики описторхоза. Важнейшими критериями при разработке любых иммунодиагностических систем являются их чувствительность и специфичность, повышение которых невозможно без использования более специфичных и стандартных составляющих. Неадекватность и нестандартность АГ, используемого для диагностики, не позволяет повысить чувствительность и специфичность иммунохимических тестов. Наиболее важным звеном при совершенствовании иммунодиагностических систем на O.felineus является повышение специфичности АГ.
Технической задачей изобретения является повышение специфичности ИФА для выявления специфических антител в сыворотках людей при описторхозе, вызываемом O.felineus.
Поставленная задача решается путем выделения высокоспецифичной фракции АГ O.felineus за счет его аффинной очистки с использованием МКА. Специфичная подложка аффинно формируется на начальной стадии ИФА из сорбированных к пластиковой поверхности планшет смеси высокоспецифичных к O.felineus МКА и аффинно-обогащенного на поверхности твердой фазы основного р105 антигена O. felineus [5] . Оригинальный способ очистки антигена на стадии ИФА позволяет получать стандартный высокоспецифичный антиген O.felineus. Специфический комплекс МКА-АГ полностью сохраняет способность взаимодействия с антиописторхозными антителами сыворотки крови человека и надежно фиксируется на твердой фазе сорбированными МКА. Для формирования подложки используются мышиные МКА к экскреторно-секреторному (ЭС) АГ O.felineus [4, 6, 7, 8]. Использованные для модификации МКА в иммуноблоттинге, также как и иммунные сыворотки человека, реагируют с основным иммуногенным белком в районе 105 кДа ЭС и соматическим антигеном O.felineus [5, 9].
Таким образом, специфическая подложка МКА-АГ представляет собой комплекс из сорбированной к пластиковой поверхности планшет смеси МКА и аффинно-захваченной иммуноспецифической фракции АГ O.felineus. Это позволяет качественно повысить удельную концентрацию основного 105 кДа антигена O.felineus на поверхности твердой фазы пластиковых планшет, что в конечном итоге приводит к повышению чувствительности и специфичности иммуноферментного теста, а также уменьшению времени анализа сыворотки.
Заявляемый способ обнаружения антител человека против р105 антигена O. felineus с использованием подложки из смеси очищенных МКА включает следующие основные стадии:
1. Сорбция МКА. Смесь МКА против основного 105 кДа антигена O.felineus используется для сорбции на пластиковую поверхность лунок 96-луночных планшетов в 0,1 M NaKББ при рН 9,6.
2. Забивка мест неспецифического связывания. Осуществляется за счет инкубирования с 1% яичного альбумина в буферном растворе -25 мМ Трис-НСl рH 7,2 - 7,4 с добавлением 0,145 М хлорида натрия (TBS).
3. Связывание с АГ и отмывка. В лунки планшет вносят 100 мкл АГ в концентрации 5 мкг/мл, представляющего вытяжку цельного гомогената марит O.felineus. После инкубации планшет в течение 1 часа при 37oС планшеты промывают и используют для проведения анализа. Для разведения иммунореагентов используют 1% яичный альбумин в TBS. Отмывка на всех стадиях осуществляется TBS-твин (0,145 М хлористого натрия, 20 мМ Трис-HCl, 0,1% Твин-20 (Serva), рН-7,4).
4. Тестирование сывороток. 100 мкл исследуемой сыворотки человека в разведении 1:100 вносят в ячейку и инкубируют в течение 3-5 минут при 37oС.
5. Выявление иммунного комплекса. После трехкратной промывки иммунный комплекс выявляется добавлением 100 мкл на лунку моноклонального антивидового конъюгата с пероксидазой хрена в предварительно выбранном рабочем разведении.
6. Окрашивание субстратом. В качестве субстрата для пероксидазы используется 0,1% О-фенилендиамин в цитратно-фосфатном буфере (0,2 М лимонной кислоты, 0,5 М Nа2НРО3, рH 5,0) с 0,03% перекиси водорода.
7. Остановка реакции. Реакция останавливается добавлением 100 мкл 1 N HCl.
8. Учет и обработка результатов. Оптическую плотность образцов измеряют на спектрофотометре "Multiscan" (Финляндия) с использованием светофильтра с максимумом пропускания 492 нм.
Сущность изобретения заключается в том, что предлагается стандартная специфическая подложка для иммуноферментного анализа из специфического комплекса МКА-АГ и способ иммуноферментного тестирования специфических антител к O.felineus, при котором основная специфическая составляющая диагностической системы формируется на начальной стадии процесса ИФА.
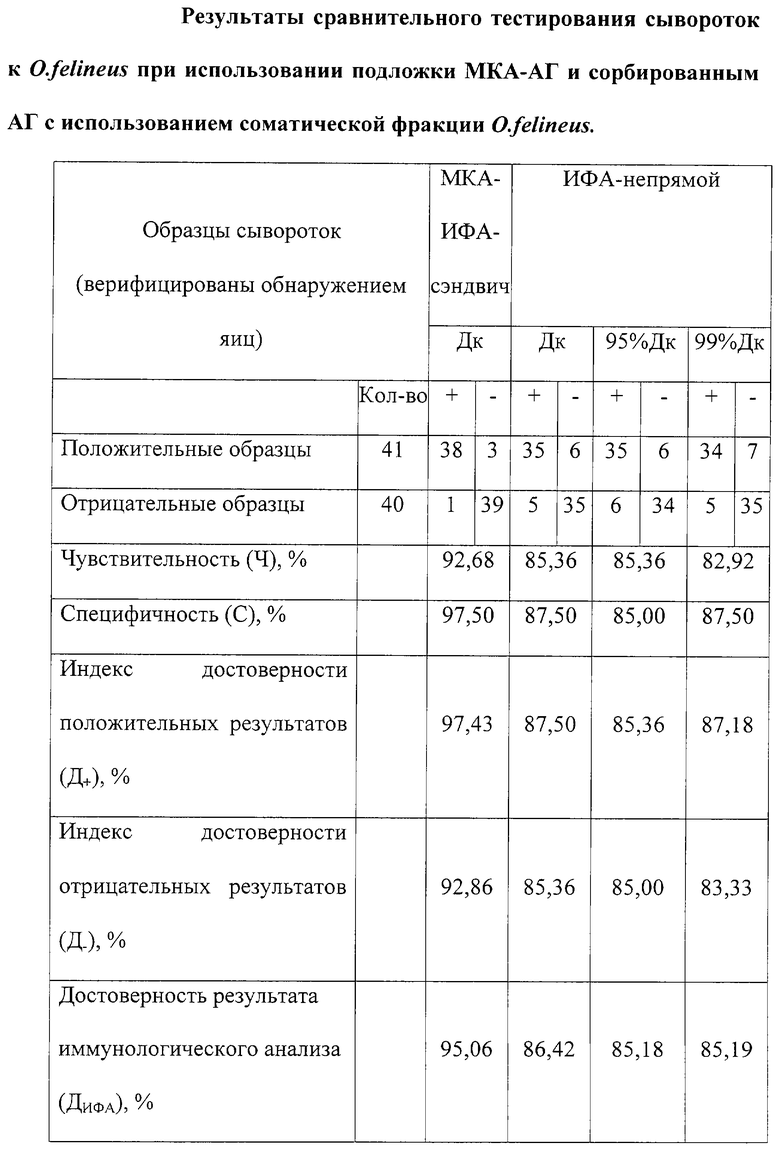
Модификация системы ИФА подложкой из специфического комплекса МКА-АГ при тестировании специфических антител при описторхозе позволяет увеличить чувствительность до 92,68% при 97,50% специфичности (таблица). Базовая иммуноферментная система-прототип без подложки с этой же панелью образцов имеет максимальную чувствительность 85,36% и специфичность 87,50%.
Повышение специфичности системы за счет использования подложки МКА-АГ позволяет максимально сократить время фазы выявления специфических антител. Период инкубации сывороток сокращается с 1 часа до 3-5 минут при использовании специфической подложки. В этом случае время анализа сыворотки существенно сокращается (чертеж).
Перечень графических материалов:
Чертеж. Сравнение сигнала ОП скрининга в ИФА с подложкой МКА-АГ и сорбированным АГ иммунной сыворотки в разведении 1/100.
Для лучшего понимания сущности заявляемого изобретения ниже следуют примеры его осуществления.
Пример 1. Формирование подложки.
Специфическая подложка формируется на стадии ИФА последовательной сорбцией на пластиковую поверхность планшет смеси МКА, насыщением мест неспецифического связывания забивкой и специфическим связыванием на МКА иммуноспецифической фракцией АГ O. felineus. Комплекс подложки сохраняет специфическое свойство АГ, обеспечиваемое поливалентностью, и удерживается на твердой фазе за счет сорбированных МКА.
Пример 2. Определение чувствительности и специфичности предлагаемого способа в сравнении со способом-прототипом.
Наличие антител против антигенов описторхоза тестировалось одновременно в двух панелях сывороток, содержащих заведомо положительные и отрицательные образцы сывороток человека. Положительные сыворотки были собраны от больных описторхозом людей, у которых диагноз был подтвержден обнаружением яиц O.felineus в кале или желчи. Отрицательные сыворотки были получены от здоровых людей после клинического обследования, исключившего заболевание описторхозом.
Как видно из полученных результатов (таблица), по всем диагностическим критериям сэндвич-ИФА, модифицированный специфическим комплексом МКА-АГ, превосходит прототип непрямой-ИФА. При тестировании специфических антител чувствительность системы, модифицированной подложкой из комплекса МКА-АГ, составила 92,68% при 97,50% специфичности (таблица). Базовая иммуноферментная система-прототип без подложки с этой же панелью образцов имеет максимальную чувствительность 85,36% и специфичность 87,50%. Полученные результаты были обработаны статистически при помощи диагностического критерия, основанного на сравнении полученного результата ОП с его максимальным показателем ОП в группе здоровых лиц при 95% (95% Дк), 99% (99% Дк) вероятности [10, 11] , а также с учетом реагирования на специфическую и неспецифическую фракцию (Дк).
Результаты обработки показали более высокие индексы достоверности положительных и отрицательных результатов и достоверности самого иммунологического анализа, что позволило сделать заключение о более высокой специфичности и чувствительности предлагаемого способа.
Таким образом, предлагаемый способ диагностики описторхоза обладает существенно более высокой диагностической достоверностью, чем способ-прототип. Модификация подложкой из высоко специфического комплекса МКА-АГ на основной иммуноген O. felineus повышает специфичность системы и увеличивает чувствительность. Способ использования специфических МКА для увеличения специфичности системы ИФА позволяет использовать нестандартизованные препараты АГ O. felineus. Это особенно важно, так как препараты антигенов печеночной трематоды получают из природных источников, что обусловлено невозможностью лабораторного культивирования O.felineus. Введение аффинной очистки основного антигена р105 O.felineus при помощи МКА на первой стадии проведения ИФА позволяет стандартизовать проведение анализа путем селекции основного р105 антигена O. felineus. Специфическая подложка из МКА-АГ является высоко стандартным составляющим, что позволяет стандартизировать наиболее важное звено иммунодиагностической системы. МКА могут быть произведены в строго контролируемых лабораторных условиях в неограниченных количествах. За счет высокоспецифического свойства подложки существенно сокращается время тестирования образцов сывороток, что особенно важно при массовых обследованиях.
Все это позволяет сделать вывод, что предлагаемый способ с использованием модифицированной подложки из специфического комплекса МКА-АГ может быть использован для клинической диагностики и серо-эпидемиологических исследовании при описторхозе и обладает повышенной чувствительностью и специфичностью по сравнению со способом-прототипом.
Источники информации
1. Прокудина И.И. Модифицированный метод тонкослойного иммунного анализа для диагностики описторхоза. // Медицинская паразитология и паразитарные болезни. N 1, 1994, стр. 59-60.
2. Клебановская И.А. Реакция непрямой гемагглютинации в диагностике ранней фазы описторхоза. // Медицинская паразитология и паразитарные болезни. N 5, 1985, стр. 25-26.
3. Менявцева Т.А., Ратнер Г.М., Стручкова С.В., Колмакова М.В., Степанова Т.Н., Лепехин А.В., Майер В.А., Постникова Т.Ф. Иммуноферментный анализ в диагностике описторхоза. Сообщение 1. Разработка иммуноферментного метода определения IgM - антител к описторхозному антигену. // Медицинская паразитология и паразитарные болезни. N 1, 1996, стр. 41-43.
4. Котелкин А.Т., Локтев В.Б. Сравнительное биохимическое и иммунологическое изучение соматического и метаболического антигенов Opisthorchis felineus. // Медицинская паразитология и паразитарные болезни. N 2, 1996, стр. 18-23.
5. Патент РФ 2143488, кл. 6 C 12 N 5/00, опубл. БИ 36 от 27.12.99.
6. Котелкин А. Т., Покровская И.В., Локтев В.Б. Сравнительное изучение соматического, экскреторно-секреторного и яичного антигенов Opisthorchis felineus. // Медицинская паразитология и паразитарные болезни. N 1, 1997, стр. 12-16.
7. Котелкин А.Т., Локтев В.Б. Полипептидный состав основных антигенов и выявление доминирующих иммуногенных белков Opisthorchis felineus. // Вестник РАМН. N 4, 1998, стр. 29-33.
8. Котелкин А.Т., Локтев В.Б. Сравнительное биохимическое и иммунологическое изучение соматического и метаболического антигенов Opisthorchis felineus. // Медицинская паразитология и паразитарные болезни. N 2, 1996, стр. 18-23.
9. Котелкин А.Т., Локтев В.Б. Получение и характеризация мышиных гибридом, секретирующих специфические моноклональные антитела к основному растворимому антигену Opisthorchis felineus. // Медицинская паразитология и паразитарные болезни. N 3, 1999, стр. 6-10.
10. Вербов В.Н., Золотухин В.А., Шутова О.В., Сушков В.И., Артюхов А.И., Чистякова И.В. Модификация иммуноферментной тест-системы для серодиагностики описторхоза. // Медицинская паразитология и паразитарные болезни. N 2, 1990, стр. 9-11.
11. Гицу Г.А., Нгуен Тхи Хой, Баллад Н.Е., Ха Вьет Вьен, Киеу Тунг Лэм, Иващенко Е.А. Эффективность иммуноферментного теста с гомологичным и гетерологичным антигенами при клонорхозе. // Медицинская паразитология и паразитарные болезни. N 4, 1991, стр. 20-23.

Изобретение относится к области биотехнологии и медицины, конкретно к диагностике описторхоза. Предложен специфический реагент, который представляет собой комплекс из сорбированных на пластиковой поверхности планшеты МКА и афинно-захваченной иммуноспецифической фракции АГ О. felineus. Также предложен способ иммуноферментного тестирования специфических антител при описторхозе с использованием специфического реагента. Использование реагента и применение способа тестирования позволяет повысить специфичность и чувствительность теста и уменьшить время анализа сыворотки. 2 с.п. ф-лы, 1 ил., 1 табл.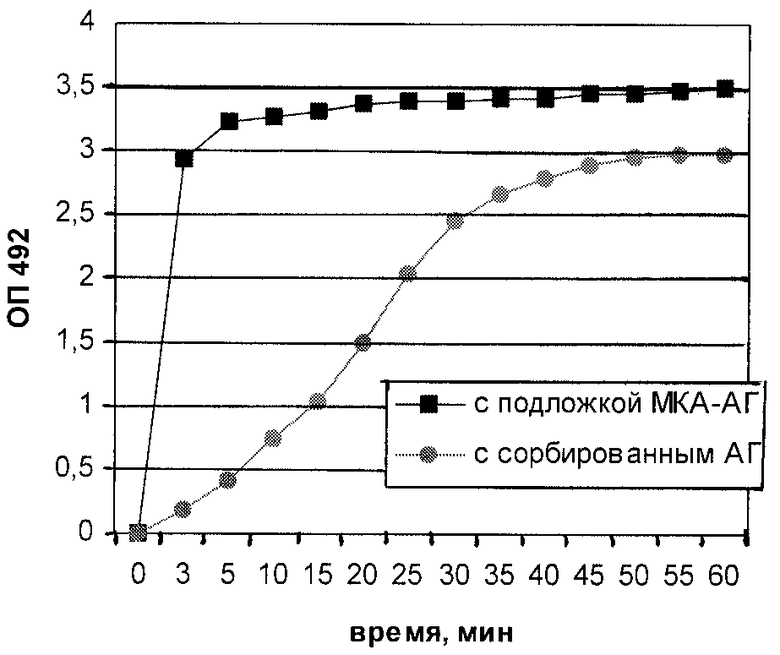
| КОТЕЛКИН А.Т | |||
| и др | |||
| Сравнительное биохимическое и иммунологическое изучение соматического и метаболического антигенов Opisthorchis felineus | |||
| - Медицинская паразитология и паразитарные болезни, № 2, 1996, с | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS L., ИСПОЛЬЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К БЕЛКУ 105 КДА ЭКСКРЕТОРНО-СЕКРЕТОРНОГО АНТИГЕНА ПЕЧЕНОЧНОЙ ТРЕМАТОДЫ ЧЕЛОВЕКА OPISTHORCHIS FELINEUS | 1997 |
|
RU2143488C1 |
| СПОСОБ ДИАГНОСТИКИ ОПИСТОРХОЗА И СРЕДСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1998 |
|
RU2143838C1 |
| СПОСОБ ДИАГНОСТИКИ ОПИСТОРХОЗНОГО ПОРАЖЕНИЯ ПЕЧЕНИ | 1998 |
|
RU2136216C1 |
| US 5863775, 26.01.1999. | |||
Авторы
Даты
2003-01-27—Публикация
2001-05-08—Подача