Изобретение относится к биотехнологии, в частности к медицинской вирусологии и иммунологии, может быть использовано для проведения иммунодиагностики цитомегаловируса человека (ЦМВ).
Цитомегалия - широко распространенное заболевание. Подавляющее большинство случаев инфекции асимптомны. Активные формы инфекции бывают у беременных и новорожденных, а также у людей с иммунными дефектами, у больных СПИД и у иммуносупрессивных пациентов после трансплантации органов. Входными воротами цитомегаловирусной инфекции (ЦМВИ) могут быть эпителий мочеполового тракта, верхних отделов пищевого или дыхательного тракта [1, 2]. Среди известных внутриутробных инфекций именно ЦМВИ является ведущей причиной поражения головного мозга и потери слуха у новорожденных [3, 4]. Не менее важным является раннее выявление цитомегаловирусной природы бесплодия у мужчин [5]. Нижний матриксный фосфопротеин рр65 (65-68 кДа, мажорный и высокоспецифичный белок ЦМВ) [6]) используют для быстрого диагноза заболевания ЦМВИ и его присутствие на мембранах периферических лейкоцитов в настоящее время принято считать одним из основных критериев острой ЦМВИ. Показано, что количество рр65 антигена и вирусной ДНК в крови коррелирует с риском и тяжестью ЦМВИ у иммуносупрессированных больных. Присутствие антигена рр65 в крови выявляют чаще всего с помощью коммерческих моноклональных антител (CINAKit Rapid Antigenemia, Argene) к этому белку на поверхности периферических лейкоцитов методами иммунофлуоресценции или иммунопероксидазным [7, 8, 9].
Известны гибридомы - продуценты моноклональных антител для выявления цитомегаловирусов (патент Японии №4211364, МПК А61К 39/395, опубл. 03.08.1992 г.).
Известны гибридомы, продуцирующие мышиные моноклональные антитела (МКА) к нативному раннему нуклеарному белку р72 (72 кДа) ЦМВ [10, 11, 12]. Первое сообщение о получении МКА к матриксному нативному белку рр65 описано в работе [13] при сравнении их свойств с коммерческими МКА (Clonab CMV, Biotest Diagnostic Corporetion) и второе о рекомбинантном Fab - фрагменте МКА к белку рр65, полученном технологией фагового дисплея из лейкоцитов больного человека [14]. Описано свойство поликлональных кроличьих антител к рекомбинантному белку рр65 выявлять продуктивную форму ЦМВИ в тканях сердца пациентов, которым была проведена операция аортокоронарного шунтирования [15]. В России в настоящее время для лабораторной диагностики ЦМВИ у новорожденных детей используют МКА к нативному сверхраннему белку р72 и коммерческие МКА к белку рр65 [16, 17].
Однако известные зарубежные штаммы гибридных клеток Mus museums L. - продуценты МКА, которые можно использовать для выявления белка рр65 цитомегаловируса человека недоступны для получения МКА и производства отечественных диагностических тест-систем.
Техническим результатом является расширение спектра штаммов гибридных клеток Mus museums L. - продуцентов МКА, которые можно использовать для выявления белка рр65 цитомегаловируса человека.
Указанный технический результат достигается путем получения штамма гибридных клеток животного Mus museums L. 5F10, депонированного в Коллекции клеточных культур ФГУН ГНЦ ВБ "Вектор" Роспотребнадзора, используемого как продуцент моноклональных антител для выявления белка рр65 цитомегаловируса человека.
Штамм получен путем слияния клеток мышиной p3-X63/Ag8.653 (NS/1) миеломы с клетками селезенок мышей BALB/c, иммунизированных аффинно-очищенным рекомбинантным белком рр65 [18], полученным в результате биосинтеза в клетках Е.соli на основе плазмидной конструкции, включающей фрагмент гена UL83, кодирующий иммунодоминантную область белка [19].
Заявляемый штамм гибридных клеток получен в Государственном научном центре вирусологии и биотехнологии "Вектор" Роспотребнадзора Российской Федерации и депонирован в Коллекции клеточных культур ГНЦ ВБ "Вектор". Авторское название гибридомной клеточной линии - 5F10.
Родословная штамма. Гибридный штамм клеток получен путем слияния клеток мышиной p3-X63/Ag8.653 (NS/1) миеломы с клетками селезенок мышей BALB/c, иммунизированных аффинно-очищенным рекомбинантным белком рр65 цитомегаловируса человека. В качестве сливающего агента использовали 45% раствор полиэтиленгликоля фирмы "Sigma" с молекулярным весом 1300-1600 кДа по методу [20]. Клетки после слияния выращивали в селективной среде ГАТ в 96-луночных культуральных планшетах. В качестве фидерных клеток использовали перитонеальные макрофаги беспородных мышей. Гибридомы, стабильно продуцирующие специфические МКА, клонировали 3 раза. Выход позитивных клонов в последнем клонировании составил 100%. Число пассажей к моменту депонирования: 7-10 пассажей.
Маркерные признаки и методы их оценки. Штамм секретирует мышиные иммуноглобулины субкласса IgG (имеющие тяжелую 55 кДа и легкую 25 кДа цепи), специфически взаимодействующие с рекомбинантным белком рр65 и нативным вирусным белком рр65 ЦМВ. Анализ мышиных иммуноглобулинов проводят методом ИФА, используя в качестве антигена рекомбинантный белок рр65 или вирусо-ассоциированный белок рр65 в лизате инфицированных клеток. Контаминация бактериями и грибами не обнаружена.
Культуральные свойства. Среда для культивирования DMEM/F12 с глутамином, пиридоксином, Hepes (ФГУН ГНЦ ВБ "Вектор" Роспотребнадзора). Содержание фетальной сыворотки, оптимизированной для гибридом (HyClone, USA) в ростовой среде - 10%. В среду также добавляют 80-160 мкг/мл сульфата гентамицина.
Штамм является монослойно-суспензионной культурой, в которой до 20% клеток находится в суспензии, не прикрепляясь к поверхности посуды для культивирования. Клетки с поверхности культуральной посуды удаляются раствором трипсина/версена=1/1 (объем/объем). Посевная доза 200 тысяч кл./мл. Частота пассирования через 3-4 суток. Индекс пролиферации - не менее 5.
Культивирование штамма Mus musculus L. ГНЦ ВБ "Вектор" 5F10 в организме животного. Самкам мышей BALB/c (виварий ГНЦВБ "Вектор") предварительно вводят внутрибрюшинно 0,3-0,5 мл пристана (Sigma). Через 2-4 недели животным прививают внутрибрюшинно 10 млн гибридных клеток. Асцитическая опухоль формируется на 7-10 день. Гибридома прививается в 100% случаев. От одного животного можно получить 3-5 мл асцитической жидкости, содержащей МКА.
Характеристика полезного продукта. Типирование гибридомных иммуноглобулинов проведено методом твердофазного ИФА с использованием моноспецифических мышиных антител («Sigma», США). МКА относятся к субклассу IgGl. Они специфически взаимодействуют с рекомбинантным рр65 и вирусо-ассоциированным белками рр65 (65-68 кДа) в лизате инфицированных клеток в реакции иммуноблота. В ИФА титр МКА в асците составляет 1:2187000 и 1:25600 на рекомбинантном антигене и лизате инфицированных клеток Vero, соответственно. Стабильная продукция МКА сохраняется на протяжении не менее 10 пассажей in vitro при непрерывном культивировании. Из одного миллилитра асцитической жидкости можно получить 3-5 мг очищенных моноклональных антител. Криоконсервирование. Среда для замораживания - среда ДМЕМ(М) - 50%, фетальная сыворотка - 40%, диметилсульфоксид - 10%. 1-1,5 мл клеточной суспензии переносят в пластиковые криопробирки и помещают в пенопластовый контейнер с толщиной стенок 1 см. Контейнер вносят в пары жидкого азота и через 18-24 часа пробирки переносят в жидкий азот. Размораживание проводят, опуская пробирки в воду с температурой 37-41°С. Клетки разводят средой ДМЕМ(М) и центрифугируют при 1000 об/мин. Осадок ресуспендируют в ростовой среде и клетки переносят в культуральные флаконы в концентрации 200-300 тысяч в миллилитре. Жизнеспособность клеток после размораживания составляет 60-80% (по результатам окрашивания 0,25% трипановым синим). Каждая ампула содержит не менее 10 млн/мл клеток.
Изобретение поясняется чертежами.
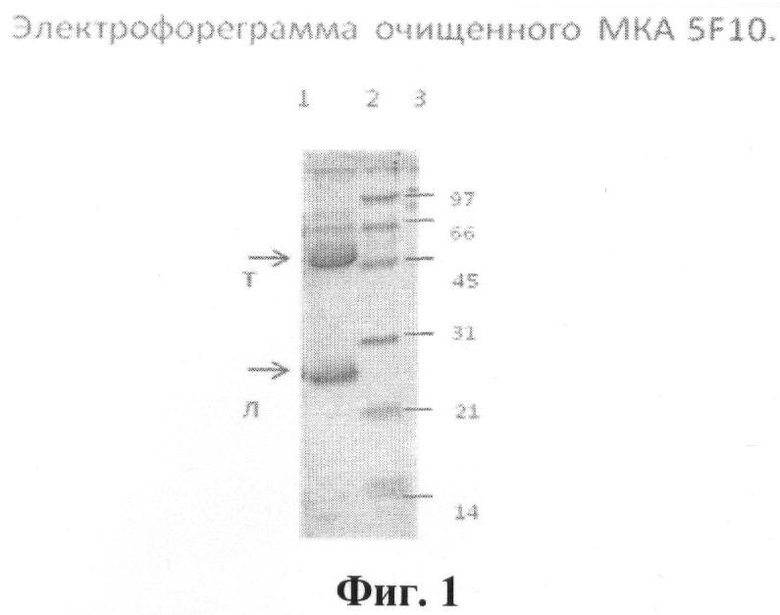
На фиг.1 представлена электрофореграмма очищенных МКА 5F10, где:
1 - препарат очищенного МКА 5F10, стрелками обозначены цепи иммуноглобулина:
т - тяжелая цепь (55 кДа); л - легкая цепь (25 кДа);
2 - белковые маркеры молекулярного веса (Bio-Rad);
3 - значения молекулярного веса белковых маркеров.
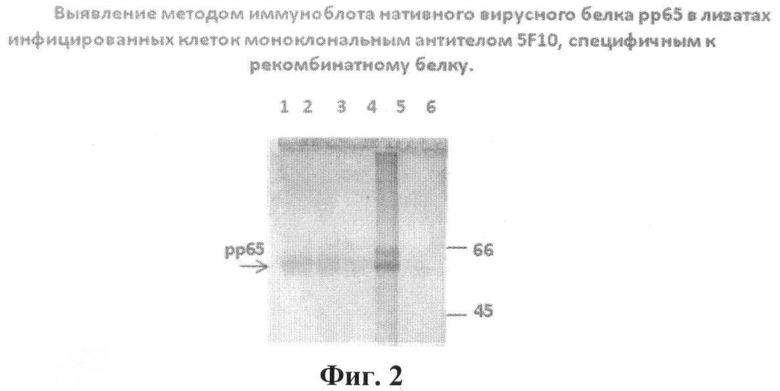
На фиг.2 приведен иммуноблот нативного вирусного белка рр65: цельная нитроцеллюлозная мембрана, с перенесенными в результате электрофореза белками, обработана очищенным препаратом МКА 5F10 в разведении 1:500;
1, 2, 3 - лизаты инфицированных ЦМВ клеток Vero, RH, L68 (по 10 мкл на дорожку);
4 - очищенный рекомбинантный белок рр65 (10 мкл) (положительный контроль);
5 - лизат клеток Vero, инфицированных вирусом простого герпеса 2 типа (отрицательный контроль);
6 - значения молекулярного веса белковых маркеров.
Методика получения заявляемого штамма.
Штамм гибридных клеток Mus musculus L. ГНЦ ВБ "Вектор" - 5F10 получают следующим образом. Самок мышей BALB/c (виварий ГНЦВБ "Вектор") массой 15-20 г иммунизируют по схеме, которая приведена ниже в таблице.
Для слияния используют соотношение 3/1 селезеночных клеток мышей и клеток мышиной миеломы NS/1. Смесь клеток центрифугируют, супернатант тщательно удаляют и к клеточному осадку добавляют 0,4 мл 45% раствора полиэтиленгликоля (ПЭГ) с молекулярной массой 1300-1600. Смесь центрифугируют 15 мин при 1000 об/мин. После 3 мин паузы слой ПЭГ медленно разбавляют 5 мл раствора версена, после чего осадок ресуспендируют. Затем клетки снова осаждают (10 мин при 1000 об/мин) и осадок растворяют в ростовой среде. Клетки распределяют в пять 96-луночных микроплат (Costar) по 100 мкл в лунку. Селекцию гибридных клеток проводят в среде ГАТ, состоящей из питательной среды ДМЕМ(М), в которую добавлены 10% фетальной сыворотки коров (Gipco), 0,1 мМ гипоксантина, 0,04 мМ тимидина и 0,01 мМ аминоптерина.
Отбор специфических гибридов проводят методом иммуноферментного анализа (ИФА). В лунки микроплат (ВНИИМедПолимер) в качестве антигена сорбируют 100-200 нг аффинно-очищенного рекомбинантного белка рр65. Места неспецифического связывания насыщают 0,5% раствором казеина (ICN). Затем в лунки переносят по 100 мкл культуральной среды исследуемых гибридом и инкубируют 45 мин при 37°С. После инкубации лунки промывают 3-5 раз физиологическим раствором, содержащим 0,05% твин-20 (Sigma). Далее в планшеты вносят по 100 мкл антивидового конъюгата (иммуноглобулины кролика против IgG мыши, меченные пероксидазой хрена) и выдерживают 45 мин при 37°С. Планшеты промывают и проводят ферментативную реакцию. Результаты анализа определяют на спектрофотометре "Multiscan" (Финляндия).
Полученный гибридный штамм дважды клонируют методом предельных разведений, переводят в массовую культуру и замораживают в жидком азоте.
Приведенные ниже примеры подробно раскрывают полезные свойства объектов изобретения.
Пример 1. Культивирование гибридных клеток штаммом Mus musculus L. ГНЦ ВБ "Вектор" - 5F10, продуцирующих МКА к рекомбинантному белку рр65 ЦМВ в организме животных, мышей BALB/c.
Мышам BALB/c (виварий ГНЦВБ "Вектор") весом 20-22 г не менее чем за 10 дней до прививки гибридомных клеток вводят внутрибрюшинно по 0,3-0,5 мл вазелинового масла или пристана. Культивируемые клетки штаммов, находящиеся в логарифмической фазе роста, стерильно центрифугируют 5-10 мин при 1000 об/мин на центрифуге ОПН-3. Надосадок удаляют, а осадок клеток суспензируют в стерильном растворе Эрла или Хенкса. Самкам мышей BALB/c (виварий ГНЦВБ "Вектор") весом 20-22 г. внутрибрюшинно вводят каждой по 1 мл клеточной суспензии, содержащей не менее 10 млн гибридомных клеток. Через 7-10 дней животных усыпляют и из брюшной полости извлекают 3-5 мл асцитической жидкости. Клетки из асцитической жидкости отделяют центрифугированием, а в надосадочной жидкости определяют титр МКА с помощью иммуноферментного анализа, как описано выше.
Пример 2. Выделение очищенных моноклональных антител, продуцируемых гибридными культивируемыми клетками штамма Mus musculus L. ГНЦ ВБ "Вектор"-5F10.
Один объем асцитической жидкости, содержащей МКА, разводят 4 объемами 0,6 М ацетатного буфера (0,04 М лимонной кислоты, 0,2 М натрия ацетата), рН 4,0 и доводят рН до 4,5 с помощью 0,1 N раствора едкого натра. К разведенному образцу добавляют по каплям, с постоянным перемешиванием, каприловую кислоту из расчета 25 мкл на 1 мл раствора и инкубируют ночь при +4°С. Затем центрифугируют 30 мин при 8000 g и осадок удаляют, а надосадок смешивают с 10-кратным фосфатно-солевым буфером (ФСБ) и устанавливают рН 7,4 раствором 1,0 N едкого натра. Равный объем насыщенного раствора сульфата аммония добавляют (V:V) к этому раствору, встряхивают и выдерживают ночь при +4°С или 30 мин при +20-25°С. Центрифугируют 15 мин при 5000 g. Надосадок сливают, а осадок растворяют в ФСБ, рН 7,4. Остатки сульфата аммония удаляют путем диализа против 50-100 объемов ФСБ, рН 7,4. Электрофорез очищенного препарата МКА проводили по методу, описанному в работе [21] в прерывистой буферной системе с использованием 12-15% полиакриламидного геля с 0,1% додецилсульфата натрия в трис-глициновом буфере. Разделяющий гель содержал 0, 0625 М трис-НСl (рН 8,8), 0,1% SDS, 10(15)% акриламид, 1% N,N- метиленбисакриламид. Препарат МКА (1 мкл) наносили на дорожку в объеме 30 мкл буфера, содержащем 0, 0625 М трис-НСl (рН 6,8), 2% SDS, 5% 2-меркаптоэтанол, 10% глицерин, 0,01% бромфеноловый синий. Перед нанесением буфер, содержащий МКА, прогревали 3 мин при 95°С. Электрофорез вели в режиме 10 В/см. Окраску геля проводили при помощи Кумасси G-250. Очищенный препарат МКА 5F10 в виде электрофореграммы представлен на фиг.1.
Пример 3. Культивирование цитомегаловируса человека. Цитомегаловирус человека, штамм AD-169, полученный из Американской Коллекции Типовых Культур (АТСС) в виде инфицированной культуры клеток фибробластов человека (Л-68), хранится в жидком азоте в среде L-15 с 7% ДМСО и 20% фетальной сыворотки. Вирус культивировали в монослое клеток Л-68 в среде DMEM с 10% эмбриональной сывороткой. Адсорбцию вируса проводили при температуре 37°С в течение 1-1,5 часов. После адсорбции клетки отмывали средой Игла-МЕМ и покрывали средой для культивирования. На 7-8 сутки после заражения клетки разрушали 2-кратным замораживанием/оттаиванием. Клеточный дебрис, осажденный центрифугированием при 1000g в течение 10 минут (центрифуга BECMAN J2-21), в небольшом объеме супернатанта обрабатывали ультразвуком при 50 ватт в течение 30 секунд на тающем льду. Супернатант освобождали от клеточных мембран центрифугированием при 1000g в течение 10 минут и использовали для выделения вирусной ДНК, дальнейшего культивирования на культурах клеток L-68 (диплоидные клетки легкого эмбриона человека), Vero (клетки почки африканской зеленой мартышки) и RH (клетки почки эмбриона человека) и как антиген для ИФА и иммуноблота.
Пример 4. Определение методом ИФА специфического взаимодействия МКА, продуцируемых гибридными клетками штамма Mus musculus L. ГНЦ ВБ "Вектор" - 5F10 с рекомбинантным белком рр65 или нативным ЦМВ в лизате инфицированных клеток L-68, Vero, RH.
ИФА проводили на полистироловых планшетах; антиген (рекомбинантный белок рр65 или лизат инфицированных клеток L-68, Vero, RH) сорбировали в 0,5 М карбонатном буфере, рН 9,0 в объеме 100 мкл/лунку на планшеты. Места неспецифического связывания насыщали при 37°С 45 минут 0,5% раствором казеина в буфере ТСБ-Твин (0.145 М хлористого натрия, 20 мM Трис-HCl, 5 мM PMSF (Sigma), 0,1% Tween-20 (Serva), pH-7,4) и затем инкубировали с МКА 45 минут при 37°С. Специфическое связывание МКА с антигеном выявляли антивидовыми меченными пероксидазой антителами против IgG мыши. Далее добавляли хромоген, 0,1% O-фенилендиамин, в цитратно-фосфатном буфере (0,2 М лимонной кислоты, 0,5 М Na2HPO3, pH 5,0) с 0,03% перекиси водорода). Останавливали реакцию добавлением 100 мкл на лунку 1 N НСl и измеряли оптическую плотность образцов на спектрофотометре "Multiscan" с использованием светофильтра с максимумом пропускания 492 нм. В качестве отрицательного и положительного контроля использовали гомологичные нормальную (неиммунную) и гипериммунную сыворотки соответственно.
Пример 5. Выявление в иммуноблоте взаимодействия МКА, продуцируемых гибридными клетками штамма Mus musculus L. ГНЦ ВБ "Вектор" - 5F10 с рекомбинантным белком рр65 и нативным ЦМВ в лизате инфицированных клеток L-68, Vero, RH.
Вирусные белки в лизатах клеток L-68, Vero, RH, инфицированных ЦМВ и рекомбинантный белок рр65 после 12% ПААГ-электрофореза были перенесены на нитроцеллюлозную мембрану (Millipore, США). Места неспецифичсского связывания насыщали 0,5% раствором казеина в буфере ТСБ-Твин (0,145 М хлористого натрия, 20 мM Трис-HCl, 5 мM PMSF (Sigma), 0.1% Tween-20 (Serva), pH-7,4) при 37°С 2 часа. Затем целую мембрану инкубировали с МКА 4 часа при 20-22°С. Специфическое связывание антител, взаимодействующих с вирусными и рекомбинантным белками, выявляли с помощью конъюгата антивидовых антител против IgG мыши, меченных пероксидазой хрена. В качестве отрицательного контроля использовали лизат клеток Vero, инфицированных вирусом простого герпеса 2 типа [22]. Результаты представлены на фиг.2.
Вышеприведенные свойства штамма гибридных клеток Mus musculus L. ГНЦ ВБ "Вектор" - 5F10 (авторское название клеточной линии 5F10) позволяют заключить, что впервые на основе мышиной миеломы получена гибридома Mus musculus L. ГНЦ ВБ "Вектор" 5F10 - продуцент МКА к рекомбинантному белку рр65 цитомегаловируса человека. Штамм гибридных клеток обеспечивает получение мышиных моноклональных иммуноглобулинов класса IgGl в количестве 3-5 мг очищенных антител из миллилитра асцитической жидкости. Очищенные МКА специфично реагировали в ИФА с рекомбинантным белком и нативным в лизате инфицированных клеток Vero (титр МКА составлял 1:2187000 и 1:25600 соответственно), а также выявляли в иммуноблоте рекомбинантный белок рр65, полученный в результате биосинтеза в клетках E.coli на основе плазмидной конструкции, включающей фрагмент гена UL83 (кодирующий иммунодоминантную область белка) и вирус-ассоциированный белок рр65 в лизатах инфицированных клеток L-68, Vero, RH, что позволяет эффективно использовать продуцируемые штаммом МКА для выявления цитомегалии. Вышеуказанные свойства штамма Mus museums L. ГНЦ ВБ "Вектор" - 5F10 (авторское название клеточной линии 5F10) отличают их от всех описанных ранее гибридом, продуцирующих МКА к белкам цитомегаловируса.
Источники информации
1. Mcgavran MH, Smith MG. / Ultrastructural, cytochemical and microchemical observations on cytomegalovirus (salivary gland virus) infection of human cells in tissue culture. // Exp Mol Pathol 1965; 4:1-10.
2. Sinzger С, Jahn G. / Human cytomegalovirus cell tropism and pathogenesis. // Intervirology 1996; 39:302-319.
3. Barbi M, Binda S, Caroppo S, et al. / A wider role of congenital cytomegalovirus infection in sensorineural hearing loss. // Pediatr. Infect. dis 2003. Vol.22, pp.39-42.
4. Malinger G, Lev D, Zahalka N, et al. / Fetal cytomegalovirus infection of the brain: the spectrum of sonographic findings. // Am.J. Neuroradiol 2003. Vol.24, pp.28-32.
5. Shen C, Chang S, Yang S, Wu C, Yang Y, Ho H.N., and Huang E. / Cytomegalovirus is present in semen from a population of men seeking fertility evaluation. // The Journal of Infectious Diseases., 1994; 169:222-3.
6. Craighead JE, Kanich RE, Almeida JD. / Nonviral microbodies with viral antigenicity produced in cytomegalovirus-infected cells. // J Virol 1972; 10:766-775.
7. Jahan M, Nabassum S, Islam MN. /Comparison of CMV рр65 antigen and IgM antibody detection for early recognition of CMV primary infection and reactivation. // MymensingMed J 2008. 17(1):28-31.
8. Gentile G, Picardi A, Capobianchi A, et al. / A prospective study comparing quantitative Cytomegalovirus (CMV) polymerase chain reaction in plasma and рр65 antigenemia assay in monitoring patients after allogeneic stem cell transplantation. // BMC Infect Dis 2006. 21;6:167.
9. Ksouri H, Eljed H, Greco A. / Analysis of cytomegalovirus (CMV) viremia using the pp65 antigenemia assay, the amplicor CMV test, and a semi-quantitative polymerase chain reaction test after allogeneic marrow transplantation. // Transpl Infect Dis 2007. 9(1): 16-21.
10. Stirk PR, Griffiths PD. / Use of monoclonal antibodies for the diagnosis of cytomegalovirus infection by the detection of early antigen fluorescent foci (DEAFF) in cell culture. // J Med Virol 1987. 21(4):329-37.
11. Zweygberg Wirgart D, Landqvist M, Hokeberg I, et al. / Early detection of cytomegalovirus in cell culture by a new monoclonal antibody, CCH2. // J Virol Methods 1990. 27(2):211-9.
12. Макарова Н.Е., Кущ А.А., Иванова Л.А., Мартынова В.Н., Баринский И.Ф., Pustowoit В. / Получение моноклональных антител к сверхранним белкам цитомегаловируса человека и их применение для выявления инфицированных клеток. // Журнал "Вопросы вирусологии" 1996. №1, с.28-32.
13. Gerna G, Revello MG, Percivalle E, Morini F. / Comparison of different immunostaining techniques and monoclonal antibodies to the lower matrix phosphoprotein (pp65) for optimal quantitation of human cytomegalovirus antigemia. // J Clin Microbiol 1992. 30(5):1232-7.
14. Williamson RA, Lazzorotto T, Sanna PP, et al. / Use recombinant human antibody fragments for detection of cytomegalovirus antigenemia. // Clin Microbiol 1997. 35(8):2047-50.
15. Суслопаров М.А., Суслопаров И.М., Махова Н.М., Омигов В.В., Литасова Е.Е., Леган М.В., Слайковская Л.Е., Мироненко С.П., Чернявский A.M., Лукьянчикова Н.Л. / Исследование маркеров герпесвирусных инфекций при ишемической болезни сердца. // Мол. генетика и вирусология 2005. №4, с.36-40.
16. Алямовская Г.А., Кешищан Е.С., Адуева С.М., Меджидова М.Г., Федорова Н.Е., Pustowoit D, Малахова М.В., Ильина Е.Н., Говорун В.М., Кущ А.А. / Выявление прямых маркеров цитомегаловируса и противовирусных антител у детей раннего возраста. // Журнал "Вопросы вирусологии" 2005, №1, с.14-19.
17. Федорова Н.Е., Меджидова М.Г., Воронцова О.Н., Дегтярев Д.Н., Pustowoit D, Асади Мобархан, Саматова М.М., Кущ А.А., Володин Н.Н. / Количественные лабораторные методы для диагностики цитомегаловирусной инфекции у недоношенных новорожденных детей. / Журнал "Вопросы вирусологии" 2005, №1, с.9-14.
18. Суслопаров И.М., Суслопаров М.А., Ивченко С.Н., Гришаев М.П., Смердова М.А., Косова Е.Ю., Блинов В.М., Сараев Д.В., Махова Н.М., Носкова Н.В. / Конструирование рекомбинантного антигена рр65 цитомегаловируса человека и исследование его иммунохимических свойств. // Молекулярная генетика, микробиология и вирусология 2005. 4:36-40.
19. Суслопаров М.А., Суслопаров И.М. / Рекомбинантная плазмидная ДНК pUL83HCMV, обеспечивающая экспрессию в клетках бактерий E.coli рекомбинантного белка, содержащего иммунодоминантную часть фосфопротеина рр65 HCMV и фрагмент бета-галактозидазы. // Патент РФ №2218408, БИ №34, 10.12.2003.
20. Gefter ML, Margulies DH, Scharff MD. / A simple method for polyethylene glycol promoted hybridization of mouse myeloma cells. // Somat. Cell Genet. 1977. V.3, p.231-236.
21. Остерман А.А. / Методы исследования белков и нуклеиновых кислот. Электрофорез и ультрацентрифугирование. // Москва, 1981. С.37-64.
22. Суслопаров М.А., Махова Н.М., Носкова Н.В., Плясунов И.В., Суслопаров И.М., Сергеев А.Н., Шерстобоев Е.Ю.
Изобретение относится к биотехнологии и может быть использовано для проведения иммунодиагностики цитомегаловируса человека (ЦМВ). Штамм гибридных клеток животного Mus musculus L. 5F10 получен путем слияния клеток мышиной p3-X63/Ag8.653 (NS/1) миеломы с клетками селезенок мышей BALBc, иммунизированных аффинно-очищенным рекомбинантным белком рр65. Штамм гибридомы депонирован в Коллекции клеточных культур ФГУН ГНЦ ВБ "Вектор" Роспотребнадзора и используется как продуцент моноклональных антител для выявления белка рр65 цитомегаловируса человека. Изобретение позволяет расширить спектр штаммов гибридных клеток Mus musculus L. - продуцентов МКА для выявления белка рр65 цитомегаловируса человека и создать производство отечественных диагностических тест-систем для выявления цитомегалии. 1 табл., 2 ил.
Штамм гибридных клеток животного Mus musculus L. 5F10, депонированный в Коллекции клеточных культур ФГУН ГНЦ ВБ "Вектор" Роспотребнадзора, используемый как продуцент моноклональных антител для выявления белка рр65 цитомегаловируса человека.
| WO 2008120203 А2, 09.10.2008 | |||
| CN 101261272 A, 10.09.2008 | |||
| JP 4211364 A, 03.08.1992 | |||
| СПОСОБ ПОЛУЧЕНИЯ СЛИТКА | 0 |
|
SU248909A1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pUL83HCMV, ОБЕСПЕЧИВАЮЩАЯ ЭКСПРЕССИЮ В КЛЕТКАХ БАКТЕРИИ Escherichia coli РЕКОМБИНАНТНОГО БЕЛКА, СОДЕРЖАЩЕГО ИММУНОДОМИНАНТНУЮ ЧАСТЬ ФОСФОПРОТЕИНА pp65 HCMV И ФРАГМЕНТ β-ГАЛАКТОЗИДАЗЫ | 2001 |
|
RU2218408C2 |
Авторы
Даты
2010-06-27—Публикация
2008-12-15—Подача