Изобретение относится к области медицины, в частности к генетической токсикологии, и касается способа воздействия на организм с использованием вещества, обладающего антимутагенными свойствами.
В настоящее время глобальный характер приобретает проблема загрязнения окружающей среды и последствия этого воздействия на генетический аппарат клетки. Мутагены - физические, химические и биологические факторы, способные вызывать наследственные изменения, т. е. мутации в живой клетке. Действие мутагенов универсально для всех живых организмов. Биологические эффекты мутагенов подразделяются на эффекты в соматических клетках, которые приводят к возникновению синдромов поражения отдельных органов и тканей, и эффекты в зародышевых клетках, в результате чего повреждается хромосомный аппарат клетки, возникают несущие мутацию гаметы, что приводит к возникновению различных наследственных патологий [1].
Мутагены широко распространены в среде обитания человека. Они содержатся в продуктах питания, воде и воздухе. С повреждающим действием мутагенов на генетические структуры связывают возникновение врожденных пороков развития, злокачественных опухолей, а также преждевременное старение и бесплодие. В связи с невозможностью изоляции человека от воздействия внешней среды встает вопрос о защите генома человека и других организмов от вредных последствий антропогенного загрязнения окружающей среды, необходимости поиска путей снижения давления мутационного груза в популяции. Существуют различные механизмы, противодействующие возникновению мутаций в клетке. Появилось много работ, в которых установлены антимутагенные эффекты ряда соединений [2,3,4].
В настоящее время принято подразделять вещества, подавляющие или снижающие мутагенную активность химических соединений, на десмутагены и антимутагены. В первом случае подразумеваются вещества, инактивирующие мутагены вне клетки, во втором - вещества, снижающие мутагенный эффект путем модификации различных этапов индуцированного мутагенеза [10].
Антимутагены - соединения, способные снижать повреждающее действие мутагенов на генетические структуры. Для профилактики мутагенных воздействий возможно применение фармакологических средств защиты генома, а также некоторых антиоксидантов.
Существует положительный опыт применения в качестве антимутагенов некоторых фармакологических средств, таких как сарколизин, 2-меркаптобензимидазол, бензодиазепиновые транквилизаторы; растительных масел, таких как пасленовое и физалисное, некоторых бактериальных и ферментных препаратов, ингибиторов ферментов, витаминов, таких как A, C, E и других биологически активных веществ [5,6,7,9].
В настоящее время известны также способы антимутагенного воздействия на клетку, в которых используют препараты белкового происхождения, например интерферон, и его производные [8], микробную рибонуклеазу [9].
В тоже время, накопленный опыт показывает, что многочисленные положительные эффекты действия витаминов (в том числе антимутагенные) проявляются преимущественно на фоне соответствующих гипо- и авитаминозов, а применение фармакологических средств для защиты генома затруднено невозможностью их назначения широким континентам населения [4].
Настоящее изобретение посвящено разработке способа антимутагенного воздействия на организм с помощью использования аспартама - дипептида, молекула которого состоит из остатков двух аминокислот: аспарагиновой и фенилаланина. Препарат используется как пищевая добавка, обладающая сладким вкусом.
Аспартам и целый ряд его химических производных известны как вещества со значительным подслащивающим эффектом; его используют в медицине, пищевой, фармацевтической и парфюмерно-косметической промышленности, а также ветеринарии (RU 2043419 C1, 10.09.95, FR 2719590, 10.11.95, FR 2719592, 23.06.95). В частности, в разработке, описанной в патенте US 5728863, 17.03.98, указано, что метиловый эфир α-L-аспартил-L-фенилаланина обладает низкой калорийностью и при этом слаще в 200 раз по сравнению с сахаром.
В патентах RU 2043419, 10.09.95 и RU 2098425, 10.12.97, RU 2083585, 10.07.97 приведены сведения о производных аспартама, обладающих значительным подслащивающим эффектом. В медицинской практике аспартам используют для питания больных диабетом и ожирением.
В доступной научно-технической и патентной литературе мы не обнаружили сведений о возможных антимутагенных свойствах аспартама и его производных.
Задачей настоящего изобретения является создание способа антимутагенного воздействия на организм, в котором дипептид аспарагиновой кислоты и фенилаланина, например аспартам, используют как средство, снижающее кластогенное действие мутагенов.
Поставленная задача решается тем, что разработан способ антимутагенного воздействия на организм, включающий введение дипептида аспарагиновой кислоты и фенилаланина или его фармацевтически приемлемых производных (например, аспартам, его метиловый эфир и др.) в качестве вещества, снижающего кластогенное действие мутагенных средств, таких как алкилирующие агенты, например циклофосфамид, или прооксидантов, например диоксидин.
В качестве индукторов мутагенеза выбраны соединения, наиболее полно отражающие картину мутагенного воздействия на организм. Один - из группы алкилирующих агентов, второй - из группы прооксидантов - активаторов свободнорадикального окисления.
Высокой мутагенной активностью обладают соединения, способные переносить на молекулу ДНК алкильные группировки (метиловые, этиловые, пропиловые). Однако, обладая высокой реакционной способностью, эти соединения легко реагируют с внеклеточными компонентами и поэтому внутрь клетки попадает небольшое их количество по сравнению с содержанием этих алкилирующих агентов во внеклеточной среде. В молекуле ДНК, кроме азотистых оснований, могут также алкилироваться фосфатные группы рибонуклеотидов, вызывая тем самым разрывы (кластогенный эффект) хромосом и их структурные перестройки. По характеру генетического эффекта алкилирующие соединения относят к радиомиметикам, т.е. к соединениям, чей мутагенный эффект напоминает мутагенный эффект ионизирующего излучения.
В качестве алкилирующего агента, обладающего кластогенным действием, выбран один из наиболее распространенных средовых мутагенов - циклофосфамид [1,4].
Мутагенная активность прооксидантов определяется концентрацией в среде свободных радикалов: -OH*, -O2 -HO2 *. Мутагенный эффект прооксидантов может быть усилен действием облучения светом видимой части спектра, УФ-облучением, кислородом, что способствует появлению в окружающей среде свободных радикалов.
В качестве прооксиданта, также обладающего кластогенным действием, в экспериментах использовали известный генератор свободных радикалов - диоксидин [4]. Следует напомнить, что одним из важнейших последствий воздействия мутагенов на организм является активация процесса свободнорадикального перекисного окисления липидов (СПОЛ).
Исследования последних лет показали, что чрезмерная интенсификация свободно-радикальных и перекисных реакций является одним из главных факторов повреждения мембран и ферментов клеток [2,3,4]. Ведущее значение при этом имеют следующие процессы: изменение физико-химических свойств липидов мембран, уменьшение содержания в них фосфолипидов, холестерина, жирных кислот. Это обуславливает нарушение конформации их липопротеидных комплексов и в связи с этим снижение активности белков и ферментных систем, обеспечивающих рецепцию гуморальных воздействий, трансмембранный перенос ионов и молекул, структурную целостность мембран; изменение физико-химических свойств белковых мицелл, выполняющих структурную и ферментные функции в клетке; образование структурных дефектов в мембране, так называемых кластеров, вследствие внедрения в них продуктов СПОЛ. В частности, накопление в мембране липидных гидроперекисей приводит к их объединению в мицеллы, создающие трансмембранные каналы проницаемости, по которым возможен неконтролируемый ток катионов и других молекул органических и неорганических соединений в клетку и из нее. Увеличение образования продуктов СПОЛ и параллельно с этим кластеров может привести к фрагментации мембран и к гибели клетки. Указанные процессы в свою очередь обуславливают нарушение важных для жизнедеятельности клеток процессов - возбудимости, генерации и проведения нервного импульса, обмена веществ, восприятия и реализации регулирующих воздействий, межклеточного взаимодействия и др. Таким образом, в качестве второго мутагенного агента, обладающего кластогенным действием, выбран активатор перекисного окисления липидов, в частности диоксидин.
Исследования проводились в экспериментах на мышах линии C57 В 1/6 массой 18-20 г (питомник "Светлые горы" Российской Академии Медицинских Наук). Были испытаны дозы аспартама в диапазоне от 4.0 до 40 мг/кг.
Было проведено 4 серии экспериментов. Во всех экспериментах оценивали количество клеток костного мозга с хромосомными повреждениями (кластогенный эффект) путем микроскопического анализа цитогенетических препаратов, приготовленных по общепринятой методике.
В первой серии экспериментов аспартам вводили перорально одновременно с внутрибрюшинной инъекцией диоксидина (100 мг/кг) на срок 24 часа (острый эксперимент).
Во второй серии эксперимента аспартам вводили перорально, ежедневно в течение 5 дней, последнее введение аспартама сочетали с внутрибрюшинной инъекцией диоксидина (100 мг/кг) на срок 24 часа (предобработка).
В третьей серии экспериментов аспартам вводили перорально одновременно с внутрибрюшинной инъекцией циклофосфамида (20 мг/кг) на срок 24 часа (острый эксперимент).
В четвертой серии эксперимента аспартам вводили перорально, ежедневно в течение 5 дней, последнее введение аспартама сочетали с внутрибрюшинной инъекцией циклофосфамида (20 мг/кг) на срок 24 часа (предобработка).
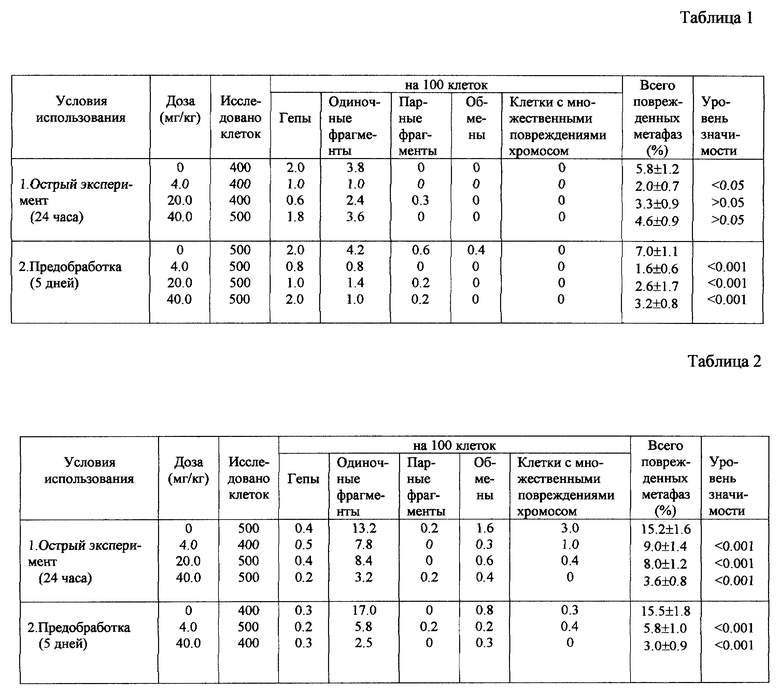
Полученные результаты представлены в виде таблиц 1 и 2. В таблице 1 можно проследить влияние аспартама на цитогенетические эффекты диоксидина в дозе 100 мг/кг. В таблице представлены статистически обработанные данные по уровню хромосомных повреждений в остром эксперименте и при условии предварительного введения в организм аспартама (предобработка). Результаты, представленные в таблице 1, демонстрируют, что отдельно взятый диоксидин (в остром эксперименте) индуцирует хромосомные повреждения в 5.8-7.0% исследованных клеток.
Аспартам в дозе 4.0 мг/кг, вводимый на срок 24 часа совместно с диоксидином, статистически достоверно, в 2.9 раза снижает кластогенное действие мутагена на клетки костного мозга. Однако не влияет на эффект мутагена при использовании из расчета 20 и 40 мг/кг (табл. 1).
Антимутагенное действие аспартама в значительно большей степени выражено при его предварительном пятидневном введении перед инъекцией диоксидина. В этом случае аспартам в дозе 4 мг/кг полностью подавляет кластогенную активность диоксидина (1.6% поврежденных клеток против 1.4% поврежденных клеток у интактных животных в контроле). А в дозах 20 и 40 мг/кг статистически значимо снижает кластогенный эффект мутагена в 2.7 и 2.2 раза соответственно (табл. 1).
В таблице 2 представлено влияние аспартама на цитогенетические эффекты циклофосфамида в дозе 100 мг/кг.
В этой таблице представлены результаты, демонстрирующие, что отдельно взятый циклофосфамид (в остром эксперименте) индуцирует хромосомные повреждения в 15.2-15.5% исследованных клеток.
Аспартам, вводимый перорально в дозах 4, 20 и 40 мг/кг, вызывает статистически достоверное снижение кластогенного эффекта циклофосфамида соответственно в 1.7, 1.9 и 4.2 раза при 24-часовой экспозиции препаратов в организме животных (табл. 2).
На фоне предварительного пятидневного введения аспартама в дозах 4 и 40 мг/кг кластогенный эффект циклофосфамида был статистически достоверно снижен в 2.7 и 5.2 раза соответственно.
Таким образом, полученные результаты позволяют заключить, что пероральное потребление аспартама в дозах от 4.0 до 40 мг/кг снижает кластогенное действие алкилирующих и прооксидантных мутагенов. Данное наблюдение позволяет сделать вывод о наличии у аспартама антимутагенных свойств.
Пример 1. Мышам линии C 57 B 1/6 перорально в течение 5-ти дней, ежедневно вводили аспартам в дозе 4 мг/кг. Одновременно с последним введением аспартама мышам инъецировали диоксидин в дозе 100 мг/кг. Забой животных производили через 24 часа после последнего введения. Приготовленные цитогенетические препараты клеток спинного мозга анализировали с целью выявления метафазных пластинок, имеющих хромосомные повреждения.
Анализ 500 клеток позволил выявить 1.6 ± 0.6% клеток с хромосомными повреждениями. В спектре повреждений были представлены ахроматические пробелы хромосом (гепы) в количестве 0.8 на каждые 100 исследованных метафаз и одиночные фрагменты хромосом (0.8 на 100 исследованных метафаз).
Установленный результат не отличается от данных, зарегистрированных у интактных животных 1.4 ± 0.5% клеток с хромосомными повреждениями, и статистически значимо ниже (в 4.2 раза) результата, характеризующего кластогенный эффект мутагена, установленного у животных, получавших только диоксидин без аспартама.
Пример 2. Аспартам в дозе 40 мг/кг вводили мышам линии C 57 B 1/6 перорально однократно одновременно с инъекцией циклофосфамида в дозе 20 мг/кг. Забой животных производили через 24 часа после введения соединений. Готовили цитогенетические препараты клеток костного мозга, которые анализировали с целью выявления метафазных пластинок, имеющих хромосомные повреждения.
Анализ 500 метафазных пластинок клеток костного мозга мышей позволил выявить 3.6 ± 0.8% клеток с хромосомными повреждениями. Спектр хромосомных повреждений был представлен гепами (0.2/100 клеток), одиночными фрагментами (3.2/100 клеток), парными фрагментами (0.2/100 клеток) и обменами (0.4/100 клеток).
У животных, получавших только циклофосфамид (20 мг/кг), было установлено 15.2 ± 1.6% поврежденных метафаз. Спектр хромосомных повреждений был представлен гепами (0.4/100 клеток), одиночными фрагментами (13.2/100 клеток), парными фрагментами (0.2/100 клеток) и обменами (1.6/100 клеток), а также клетками с множественными повреждениями хромосом (3.0/100 клеток).
Сравнение описанных результатов показало, что у мышей, получавших циклофосфамид в сочетании с аспартамом, уровень клеток с повреждениями хромосом статистически значимо в 5.2 раза ниже аналогичного показателя, зарегистрированного у животных, обработанных циклофосфамидом.
Таким образом, представленные материалы свидетельствуют о том, что дипептид аспарагиновой кислоты и фенилаланина (например, аспартам) обладает выраженным эффектом снижения кластогенного действия мутагенов алкилирующего и прооксидантного происхождения. Проведенные эксперименты на животных позволяют сделать вывод о том, что названный дипептид (в частности аспартам) может быть использован в качестве антимутагенного средства для защиты генома млекопитающих от вредного воздействия окружающей среды.
СПИСОК ЛИТЕРАТУРЫ:
1. Дубинин Н.П., Пашин Ю.В. Мутагенез и окружающая среда. -М.: 1978.
2. Еремина А.Н. Совершенствование системы Salmonella (микросомы для качественной и количественной оценки мутагенного и антимутагенного действия химических веществ). автореф. канд. дис. -Челябинск: 1988.
3. Дурнев А.Д., Середенин С.Б. Фармакологические проблемы поиска и применения антимутагенов. Вестник РАМН. 1993, N 1, c. 19 - 26.
4. Середенин С. Б. , Дурнев А.Д. Фармакологическая защита генома. -М.: 1992.
5. Дурнев А. Д. Антимутагенные свойства диазепиновых транквилизаторов. Химико-фармацевтический журнал. 1989, 23, N7, с. 784-786.
6. Умнова Н.В. Антимутагенное действие ингибиторов микросомных монооксигеназ. Вестник РАМН. -1993, N 1, с. 19 - 26.
7. Пентюк А.А, Дурнев А.Д. Витамин A и ферментные системы метаболической активации генотоксических соединений. Вестник РАМН, -1995, N1, c.3-9.
8. Генгель Ф.И. Антимутагенное действие препарата видоспецифического интерферона. Вестник РАМН. 1993, N4, с 613-617.
9. Иванченко О. Б. Антимутагенная активность ферментного препарата "биназа...". Микробиология, -1995, 64, N2, с.234- 238.
10. Kada T. Jn: Environ. Mutag. and Carcinog,- Tokyo: N.-Y., 1982, p. 355-359.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ АНТИМУТАГЕННОГО ВОЗДЕЙСТВИЯ НА ОРГАНИЗМ | 2003 |
|
RU2261704C2 |
| ПИЩЕВАЯ ЭМУЛЬСИЯ И СПОСОБ ЕЕ ПРИГОТОВЛЕНИЯ | 2000 |
|
RU2192762C2 |
| БЕЛКОВО-ЖИРОВОЙ КРЕМ "ЛИМОН" И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 2000 |
|
RU2204907C2 |
| ПИЩЕВАЯ ЭМУЛЬСИЯ И СПОСОБ ЕЕ ПРИГОТОВЛЕНИЯ | 2000 |
|
RU2192763C2 |
| СРЕДСТВО С АНТИМУТАГЕННОЙ АКТИВНОСТЬЮ | 2004 |
|
RU2277417C1 |
| БЕЛКОВО-ЖИРОВОЙ КРЕМ "АПЕЛЬСИН" И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 2000 |
|
RU2204912C2 |
| АНТИМУТАГЕН | 2004 |
|
RU2266128C1 |
| СПОСОБ АНТИМУТАГЕННОГО ВОЗДЕЙСТВИЯ НА ОРГАНИЗМ В ЭКСПЕРИМЕНТЕ | 2010 |
|
RU2440135C1 |
| СПОСОБ ПРОФИЛАКТИКИ И КОРРЕКЦИИ ЦИТОГЕНЕТИЧЕСКИХ НАРУШЕНИЙ | 2012 |
|
RU2504392C1 |
| КОМПОЗИЦИЯ ДЛЯ ПОЛУЧЕНИЯ МОЛОЧНО-БЕЛКОВОЙ МАССЫ "СОЛНЫШКО" | 2000 |
|
RU2192752C2 |
Изобретение относится к области медицинской экологии, в частности к способу защиты от мутагенного действия химических агентов окружающей среды. Сущность изобретения состоит в том, что разработан способ антимутагенного воздействия, включающий введение дипептида аспарагиновой кислоты и фенилаланина или фармацевтически приемлемых производных (например, аспартам, его метиловый эфир и др.) в качестве вещества, снижающего кластогенное действие мутагенных агентов, таких как алкилирующие агенты, например циклофосфамид, или прооксиданты, например диоксидин. Изобретение расширяет арсенал способов защиты живого организма от мутагенного воздействия окружающей среды. 5 з. п. ф-лы, 2 табл.
| СПОСОБ ПОЛУЧЕНИЯ АНТАГОНИСТОВ АНДРОГЕННОГО РЕЦЕПТОРА И ИХ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ | 2016 |
|
RU2719590C2 |
| КОМПОЗИЦИЯ ДЛЯ ГЕЛЕВОЙ САЛФЕТКИ, СОДЕРЖАЩЕЙ СУПЕРАБСОРБИРУЮЩЕЕ ГЕЛЕВОЕ ВОЛОКНО | 2016 |
|
RU2719591C2 |
Авторы
Даты
2000-02-27—Публикация
1999-04-30—Подача