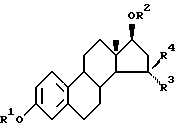
Настоящее изобретение касается новых 15,15-диалкилзамещенных производных эстрадиола общей формулы I:
в которой R1 и R2, независимо друг от друга, являются каждый атомом водорода, неразветвленной алканоильной группой, содержащей от 1 до 10 атомов углерода, разветвленной алканоильной группой, содержащей от 3 до 10 атомов углерода, алканоильной группой из 3 - 10 атомов углерода, содержащей циклоалифатическую структуру в виде 3-6-членного кольца углеродных атомов, или бензоильной группой, и
R3 и R4, независимо друг от друга, являются каждый неразветвленной алкильной группой, содержащей от 1 до 10 атомов углерода, или разветвленной алкильной группой, содержащей от 3 до 10 атомов углерода.
Радикалы R1 и R2 могут быть одинаковыми либо различными.
Радикалы R1 и/или R2 предпочтительно обозначают атом водорода.
В качестве ацильных групп R1 и R2 подходящими являются радикалы органических карбоновых кислот, содержащие от 1 до 10 атомов углерода. Такие радикалы являются производными от алифатических, циклоалифатических, алифатически-циклоалифатических и ароматических монокарбоновых кислот. Число атомов углерода в циклических структурах может изменяться от 3 до 6. В качестве R1 и R2 предпочтительны ацильные группы уксусной кислоты, пропионовой кислоты, масляной кислоты, изомасляной кислоты, пивалиновой кислоты, капроновой кислоты, гептановой кислоты, каприловой кислоты, пеларгоновой кислоты, декановой кислоты, 3-циклопентилпропионовой кислоты и бензойной кислоты.
В качестве радикалов R3 и R4 предпочтительны группы: метил, этил, пропил, изопропил, бутил, изобутил и трет-бутил. Однако высшие, гомологические неразветвленные и разветвленные алкильные группы вплоть до децильного радикала также являются подходящими.
Радикалы R3 и R4 могут быть одинаковыми либо различными.
В частности, углеродный атом 15 предпочтительно является замещенным двумя метильными группами. В качестве особенно предпочтительного соединения согласно изобретению может быть упомянут 15,15-диметилэстра-1,3,5(10)-триен 3,17β-диол.
Соединения общей формулы I согласно изобретению проявляют сильное сродство к рецептору эстрогена, а также, в особенности, обладают высокой эстрогенной эффективностью при пероральном введении.
В качестве соединений с высокой эстрогенной эффективностью известны, например, эстрогены естественного происхождения эстрадиол и эстриол (E. Schroeder, C. Rufer and R. Schmiechen, Pharmazeutische Chemie [Pharmaceutical Chemistry], 1982, Georg Thiеme Verlag, Stuttgart - New York, p. 568 ff).
Однако они метаболически нестабильны и после перорального введения катаболизируются путем окисления 17-гидроксильной группы до соответствующего, менее эффективного производного эстрона. Исходя из такой быстрой метаболической инактивации, они вряд ли пригодны для перорального применения.
Путем введения, например, этинильной группы в положение 17 (этинилэстрадиол, Poc. cit., p. 574), окисление 17-гидроксильной группы может быть предотвращено, и, следовательно, соответствующие производные обладают высокой эстрогенной эффективностью при пероральном введении.
Лишь недавно стало возможным получать эстрогенные соединения с высокой пероральной активностью не с помощью изменения заместителей в стероидном скелете, а путем модификации самого стероидного скелета. Так, связывание атомов углерода в позициях 14 и 17 этеновым или этановым мостиком блокирует окисление 17β-гидроксильной группы (J. Chem. Commun., 1986, 451 - 453 или International Patent Application PCT/DE 87/00361).
Производные эстрадиола, которые содержат 14,15-метиленовые группы, также представляют собой соединения с высокой эстрогенной эффективностью при пероральном введении (US-A, 4 231 946).
При пероральном введении эстрогенное действие соединений общей формулы I согласно изобретению сравнимо с таковым стандартного 17α-этинилэстрадиола. В соединениях согласно изобретению атака стероид-17β-гидрогеназы блокируется путем введения двух алкильных групп в C-15-положение и, таким образом, тормозится метаболическое окисление 17-гидроксильной группы несмотря на присутствие атома водорода при атоме C-17.
Краткое описание чертежа
Полнее оценить и лучше понять различные другие цели, характеристики и сопутствующие преимущества настоящего изобретения можно при рассмотрении вместе с сопровождающим чертежом, где представлен график, демонстрирующий устойчивость эстрадиола и 15,15-диметилэстра-1,3,5(10)-триен-3,17β-диола по отношению к 17β- гидроксистероид-гидрогенезе.
Подобное описание
Для определения устойчивости собственно эстрадиола (A), а также соединения согласно изобретению, т.е. 15,15-диметилэстра-1,3,5(10)-триен-3,17β-диола (B) к 17β- гидроксистероид-гидрогенезе из плаценты человека, испытуемые вещества выдерживали с микросомами плаценты в присутствии NADP (никотинамид-адениндинуклеотидфосфаты; 0,5 ммоль).
Стероиды (исходный субстрат и продукт) экстрагировали и разделяли при помощи HPLC (жидкостной хроматографии высокого разрешения). Для проведения оценки находили отношение полученных электронным интегрированием площадей пиков соответствующего продукта реакции (а именно, предполагаемого 17-кетосоединения) и исходного вещества и строили график его зависимости от времени выдержки (см. чертеж). В то время как эстрадиол (A) под воздействием 17β-гидроксистероидгидрогеназы в значительной степени превращается в эстрон, соединение согласно изобретению 15,15-диметилэстра-1,3,5(10)-триен -3,17β-диол (B) служит субстратом для 17β-гидроксистероид-гидрогеназы лишь в умеренной степени.
Это может объяснить эффективность при пероральном введении вновь описанных веществ.
Эстрогенная активность соединений согласно изобретению может быть продемонстрирована результатами теста на связывание рецептора эстрогена. В этом тесте, проводимом in vitro, готовят препарат ткани матки крысы и в качестве эталонного вещества используют меченый 3H-эстрадиол. Соединение согласно изобретению 15,15-диметилэстра-1,3,5(10)-триен-3,17β-диол соответственно имеет коэффициент конкуренции, равный 1,5.
Изобретение также касается использования соединений общей формулы I для получения фармацевтических агентов.
Соединения согласно изобретению могут вводиться в составы и применяться таким же образом, как и этинилэстрадиол, который является наиболее используемым эстрогеном. Они перерабатываются в обычные формы фармацевтических агентов с добавками, носителями и/или ароматизирующими веществами, обычно применяемыми в галеновой фармацевтике, в соответствии с известными в отрасли методами. Для перорального введения особенно подходящими являются таблетки, таблетки с покрытием, капсулы, гранулы, суспензии или растворы. Для парентерального введения особенно пригодны масляные растворы, такие как, например, растворы в сезамовом (кунжутном) масле или касторовом масле, которые могут не обязательно содержать дополнительно разбавитель, такой, как, например, бензилбензоат или бензиловый спирт.
Концентрация активного ингредиента в фармацевтических составах зависит от способа введения и области применения. Так, например, капсулы или таблетки для лечения симптомов дефицита эстрогена могут содержать около 0,001 - 0,05 мг активного ингредиента, масляные растворы для внутримышечных инъекций могут содержать около 0,01 - 0,1 мг активного ингредиента на 1 мл, а вагинальные мази могут содержать около 0,1 - 10 мг на 100 мл мази. Для средства женской контрацепции эстрогены согласно изобретению могут использоваться в комбинации с гестагенами, обычно применяемыми в гормональных контрацептивах или предлагаемыми для применения в таких препаратах, например, такими, как прогестерон, медроксипрогестерона ацетат, гестонорона капроат, хлормадинона ацетат, линэстренол, гидроксипрогестерона капроат, норэтиндрон и его эфиры (например, ацетат), норгестрел, левоноргестрел, ципротерона ацетат, дезогестрел, норгестимат, дигидроспироренон и гестоден. Таблетки или таблетки с покрытием для ежедневного приема предпочтительно содержат около 0,003 - 0,05 мг эстрогена в соответствии с изобретением и предпочтительно около 0,05 - 0,5 мг гестагена.
Соединения согласно изобретению могут быть использованы в случае симптомов дефицита эстрогена у женщин, таких как, например, аменоррея, дисменоррея, бесплодие, эндометриты, кольпиты и климактерические симптомы (гормонально-заместительная терапия) и предотвращения остеопороза. Далее, эти соединения могут быть использованы как эстрогенные компоненты гормональных контрацептивов (однофазные и многофазные, и многостадийные препараты). Сверх того, они являются подходящими, в сочетании с другими активными ингредиентами, для использования в гормоносодержащих внутриматочных пессариях, носителях имплантируемых активных ингредиентов, а также в системах, предназначенных для трансдермального введения. Возможными областями применения соединений общей формулы I согласно изобретению в таких трансдермальных системах являются средства контроля над рождаемостью для женщин и гормонально-заместительная терапия (HRT).
Повышенная растворимость в жире, в сравнении с эстрадиолом и 17α- этинилэстрадиолом, обусловленная липофильными алкильными группами в положении 15, делает соединения согласно изобретению особенно подходящими для использования в таких депо-составах.
Новые соединения общей формулы I:
в которой R1 и R2, независимо друг от друга, являются каждый атомом водорода, неразветвленной алканоильной группой, содержащей от 1 до 10 атомов углерода, разветвленной алканоильной группой, содержащей от 3 до 10 атомов углерода, алканоильной группой из 3 - 10 атомов углерода, содержащей циклоалифатическую структуру в виде 3-6-членного кольца углеродных атомов, или бензоильной группой, и
R3 и R4, независимо друг от друга, являются каждый неразветвленной алкильной группой, содержащей от 1 до 10 атомов углерода, или разветвленной алкильной группой, содержащей от 3 до 10 атомов углерода, получают способом, в котором 3-алкилэфир соединения общей формулы II:
в которой R1' является неразветвленной алкильной группой, содержащей от 1 до 10 атомов углерода или разветвленной алкильной группой, содержащей от 3 до 10 атомов углерода, и
R3 и R4 имеют значения, указанные в формуле I, расщепляют в соответствии со стандартными способами 3-гидроксигруппу, необязательно этерифицируют, а затем, впоследствии, необязательно этерифицируют 17-гидроксигруппу. Альтернативно, 3- и 17-гидроксильные группы необязательно этерифицируются одновременно, и полученное 3,17-диацилоксисоединение избирательно омыляют до 3-гидрокси-17-ацилоксисоединения.
Алкильные группы R1' с числом атомов углерода до 10 представляют собой, например, метил, этил, пропил, изопропил, бутил, изобутил или трет-бутил, либо иные высшие гомологи вышеупомянутых групп. Предпочтительной является метильная группа.
Расщепление 3-алкилового эфира проводят стандартными способами расщепления стероидных эфиров. Так, расщепление 3-алкиловых эфиров может быть проведено при нагревании до кипения, например, кислотой Льюиса в инертном растворителе. В качестве кислот Льюиса используют, например, эфират трифторида бора или гидрид диизобутилалюминия (DIBAH). В качестве растворителей пригодны бензол, толуол, тетрагидрофуран, диоксан и другие.
Для последующей необязательной этерификации фенольной и третичной гидроксильной группы могут быть использованы известные способы, используемые для этерификации в химии стероидов.
Этерификацию проводят, например, посредством взаимодействия с галогенангидридом (хлоридом или бромидом) соответствующей карбоновой кислоты или ангидридом карбоновой кислоты (с числом атомов углерода в зависимости от желаемых R1 и/или R2 в конечном продукте) в присутствии основания, такого как, например, 4-диметиламинпиридин при температуре предпочтительно около 20 - 80oC. Если в качестве третичных аминов используются одновременно пиридин и 4-диметиламинпиридин, этерификация может быть проведена радикалами низших карбоновых кислот, предпочтительно при комнатной температуре, и высшими карбоновыми кислотами, предпочтительно при приблизительно 40 - 80oC. В качестве примера может быть также упомянута реакция с уксусной кислотой или уксусным ангидридом в присутствии сильных кислот, таких как, например, трифторуксусная кислота, перхлорная кислота или п-толуолсульфоновая кислота, при комнатной или несколько повышенной температуре.
Синтезы двух возможных полуэфиров происходят путем частичной этерификации или частичного омыления:
a) Исходя из 3,17β-дигидроксисоединений, 3-ацилокси 17β- гидроксисоединения могут быть получены избирательной этерификацией фенольной гидроксигруппы. Это достигается путем взаимодействия с ангидридом соответствующей кислоты в присутствии гетероциклического азотсодержащего ароматического соединения, предпочтительно пиридина. Подходящими температурами реакции являются, например, температуры от комнатной до температуры кипения реакционной смеси. Избирательная этерификация 3-гидроксильной группы может также регулироваться количеством введенного этерифицирующего реагента.
b) Исходя из 3,17β-диацилоксисоединений, 3-гидрокси 17α- ацилоксисоединения могут быть получены избирательным омылением фенольной ацилоксигруппы. Синтез осуществляется путем взаимодействия с карбонатом щелочного металла или щелочноземельного металла, предпочтительно карбонатом калия или карбонатом кальция, в водно-метанольном растворе. Температура реакции может, например, иметь значения от комнатной температуры до температуры кипения реакционной смеси.
Получение соединений согласно изобретению представлено на нижеследующей диаграмме, из которой можно также видеть изменения стереохимии атома углерода в положении 15.
С этой целью описанный способ получения 3-метокси-15β -метил-эстра-1,3,5(10)-триен-17-она (R. V. Cumbs, U. S. Patent 3 766 224; Chem. Abstr. 1974, 80, 27436к) был модифицирован. См. следующую схему реакции.
Енолят, полученный добавлением диалкилкупрата лития LiCuR2 3 или соответствующего алкилмагнийгалогенида (алкил = R3, галогенид = Br, I) в присутствии содержащего медь (I) катализатора (например, CuI, CuCN) к 3-метокси-эстра-1,3,5(10),15-тетраен-17-ону (соединение I), превращается in situ путем добавления триметилхлорсилана в соответствующий силиленоловый эфир, который взаимодействует необязательно, без дальнейшей очистки с ацетатом палладия в процессе дегидрирования по Цуи (J. Tsuji et al., Chem. Letters 1133, 1984) с образованием 3-метокси-15-алкилэстра-1,3,5(10),15-тетраена (см. соединения 3, 7 или 10). Путем повторного добавления диалкилкупрата лития LiCuR2 3 или соответствующего алкилмагнийгалогенида (алкил = R4, галогенид = Br, I) в присутствии содержащего медь (I) катализатора (например, CuI, CuCN) к ненасыщенному кетону (см. соединения 3, 7 или 10), получают 15,15-диалкилзамещенное соединение, которое превращают путем восстановления C-17-карбонильной группы в соответствии со стандартными способами, в 17β-гидроксисоединение (см. соединения 12, 13, 14, или 15), являющееся исходным соединением общей формулы II.
Радикалы R3 и R4 могут варьироваться желательным образом в рамках общей формулы I при использовании соответствующих диалкилкупратов лития для получения аналогичным путем соединений 12, 13, 14 или 15. При этом исходные соединения общей формулы II, требуемые для синтеза всех соединений общей формулы I, являются вполне доступными.
В то время как в приведенном выше рассмотрении описывается получение 3-метоксисоединений формулы II, при использовании соответствующих высших 3-алкоксигомологов соединения I как исходного материала могут быть получены другие 3-алкоксисоединения формулы II. См. US 3766224.
Если R3 и R4 должны различаться, стереохимия на атоме углерода 15 может задаваться с помощью последовательности стадий алкилирования. Группа R3, первая из двух групп, вводимых в положение C-15, располагается в окончательном продукте в α-положении.


4 R3, R4Me 12 16
5 R3Me, R4Et 13 17
8 R3Et, R4Me 14 18
11 R3Pr, R4Me 15 19
17β-Гидроксисоединения общей формулы II и 17-кетосоединения, через которые проходит их синтез, являются новыми и, взятые совместно как исходные вещества общей формулы IIa, также относятся к предмету данного изобретения.

где
R1' является алкильной группой - неразветвленной, имеющей 1-10 атомов углерода, или разветвленной, имеющей 3-10 атомов углерода;
R3 и R4 независимо друг от друга представляет собой каждый неразветвленный алкил, имеющий 1-10 атомов углерода, или разветвленный алкил, имеющий 3-10 атомов углерода; и
Z представляет собой α-атом водорода и β- гидроксильную группу или атом кето-кислорода.
Предполагается, что без дальнейшей углубленной разработки специалисты, используя предыдущее описание, смогут применить настоящее изобретение в наиболее полной степени. Поэтому следующие отдельные предпочтительные варианты осуществления необходимо рассматривать только как иллюстративные, а не ограничивающие каким бы то ни было образом содержание данного открытия (изобретения) в остальной его части.
В предшествующих и последующих примерах все температуры неизменно указываются в градусах Цельсия, и, если не указано иначе, все доли и проценты являются весовыми.
Полное содержание всех заявок, патентов и публикаций, цитированных выше, и соответствующей заявки Германии P 4326240.6, зарегистрированной 2 августа 1993 года, включено здесь посредством ссылок.
Примеры
Следующие примеры использованы для более подробного объяснения изобретения.
Пример 1
3-Метокси-15β-метилэстра-1,3,5(10)-триен-17-он (2)
Диметилкупрат лития (0,63 ммоль) в безводном диэтиловом эфире (1 мл) [получен из иодида меди (I) (120 мг; 0,63 ммоль) и метиллития (0,75 мл; 1,6 М; 1,20 ммоль)] охлаждают до -78oC. Добавляют триэтиламин (0,1 мл; 0,8 ммоль) и хлортриметилсилан (0,1 мл; 0,78 ммоль), а затем добавляют Δ15-17-кетон (1) (84 мг; 0,30 ммоль) в безводном тетрагидрофуране (4 мл). Спустя 5 минут добавляют насыщенный водный раствор хлорида аммония и 1 М соляную кислоту. Реакционную смесь перемешивают при 20oC в течение 15 минут. Остаток после обработки (этилацетатом) (72 мг) хроматографируют на силикагеле (6 г), и элюирование смесью этилацетат-толуол (1:4) дает 3-метокси-15β- метилэстра-1,3,5(10)-триен-17-он (2) (65 мг; 92%), т.пл. 127 - 129oC (из смеси ацетон-метанол) (лит. , т.пл. 122-124oC); [α]D +74oC (с, 1,0); νmax 1725 см-1 (CO); δH 1,07 (3H, c, 13β-Me ); 1,16 (3H, д, J 7,4 Гц 15β-Me ), 2,91 (2H м, 6-H2), 3,79 (3H, c, 3-OMe), 6,69 (1H, д, J 2,7 Гц, 4-H), 6,73 (1H, дд, J 8,6 и 2,7 Гц, 2-H), и 7,21 (1H, д, J 8,6 Гц, 1-H); δ C 17,0 (15-Me), 17,9 (C-18), 25,6 (C-15), 26,8 (C-11), 27,7 (C-7), 29,5 (C-8), 34,1 (C-16), 35,9 (C-12), 44,5 (C-6), 44,8 (C-9), 47,5 (C-13), 55,2 (3-OMe), 111,4 (C-2), 113,9 (C-4), 126,0 (C-1), 132,5 (C-10), 137,8 (C-5), 157,7 (C-3), и 221,3 (C-17).
(Найдено: C, 80,7; H, 8,6%; M+, 298. Расчетные значения для C20H26O2: C, 80,5; H, 8,8%; M, 298).
3-Метокси-15-метилэстра-1,3,5(10)-тетраен-17-он (3)
(а) Раствор диизопропиламида лития (5,28 ммоль) в безводном тетрагидрофуране (4 мл) [получен при 0oC из диизопропиламина (1,5 мл; 10,58 ммоль) в безводном тетрагидрофуране (4 мл) и бутиллития (3,3 мл; 1,6 М; 5,28 ммоль)] охлаждают до -78oC и медленно добавляют 15β- метил-17-кетон (2) (315 мг; 1,05 ммоль) в безводном тетрагидрофуране (5 мл). Смесь перемешивают при -78oC в течение 30 минут. Добавляют хлортриметилсилан (1,4 мл; 11,0 ммоль) и дают смеси нагреться до 20oC. Через 15 минут колбу вновь охлаждают до 0oC и добавляют насыщенный водный раствор хлорида аммония. Остаток после обработки (этилацетатом) (385 мг) растворяют в ацетонитриле (10 мл). Добавляют ацетат палладия (11) (233 мг; 1,04 ммоль) и смесь перемешивают при температуре кипения в течение 15 минут. Реакционную смесь охлаждают до 20oC, фильтруют и упаривают с получением темного кристаллического продукта (484 мг). Хроматографирование на силикагеле (24 г), со смесью этилацетат-толуол (1:19) в качестве элюента дает 3-метокси-15-метилэстра-1,3,5(10)-тетраен-17-он (3) (267 мг; 86% от 2), т.пл. 156-158oC (из смеси этилацетат-метанол);
[α]D-17° (с 1,0); νmax 1688 см-1 (CO); δH 1,11 (3H, c, 13β-Me ); 2,25 (3H, c, 15-Me), 2,94 (2H, м, 6-H2), 3,79 (3H, c, 3-OMe), 5,77 широкий (1H, c, 16-H), 6,69 (1H, д, J 2,5 Гц, 4-H), 6,75 (1H, дд, J 8,6 и 2,5 Гц, 2-H), и 7,23 (1H, д, J 8,6 Гц, 1-H); δ C 20,9 (C-18), 21,5 (15-Me), 25,6 (C-11), 27,7 (C-7), 29,2 (C-9), 29,3 (C-8), 36,8 (C-12), 45,2 (C-6), 52,6 (C-13), 55,2 (3-OMe), 57,3 (C-14), 111,5 (C-2), 113,6 (C-4), 126,1 (C-1), 128,7 (C-16), 132,0 (C-10), 137,3 (C-5), 157,7 (C-3), 175,2 (C-15), и 212,1 (C-17). (Найдено: C, 81,3; H, 8,15%; M+, 296. Расчетные значения для C20H24O2; C, 81,0; H, 8,2%; M, 296).
(b) Диметилкупрат лития (0,79 ммоль) в безводном диэтиловом эфире (1 мл) получают как описано ранее. Реагент охлаждают до -78oC, добавляют триэтиламин (0,1 мл; 0,8 ммоль) и хлортриметилсилан (0,1 мл; 0,78 ммоль), а затем добавляют Δ15-17-кетон (1) (106 мг; 0,37 ммоль) в сухом тетрагидрофуране (4 мл). Спустя 5 минут добавляют насыщенный водный раствор хлорида аммония. Остаток после обработки (этилацетатом) представляет собой бесцветное масло (109 мг).
Указанный продукт бы обработан в условиях дегидросилилирования, аналогичных описанным выше [66 мг ацетата палладия (II) в 5 мл ацетонитрила], с получением 15-метил Δ15-17-кетона (3) (93 мг; 85% от 1).
3-Метокси-15,15-диметилэстра-1,3,5(10)-триен-17-он (4)
К раствору диметилкупрата лития (0,79 ммоль) в безводном диэтиловом эфире (2 мл) [полученному стандартным образом при 0oC из иодида меди (I) (150 мг; 0,79 ммоль) и метиллития (1,3 мл; 1,6 М; 2,08 ммоль)] при -78oC добавляют комплекс трифторида бора с диэтиловым эфиром (0,1 мл; 0,80 ммоль), а затем добавляют 15-метил -Δ15-17-кетон (3) (163 мг; 0,55 ммоль) в безводном тетрагидрофуране (2 мл). Через 30 минут добавляют насыщенный водный раствор хлорида аммония. Стандартная обработка (этилацетат) дает кристаллический остаток, хроматографирование которого на силикагеле (5 г) с элюированием смесью этилацетаттолуол (1:19) дает 15,15-диметилкетон (4) (146 мг 70%), т. пл. 145-148oC (из смеси этилацетат-метанол); [α]D+75° (с 1,0); νmax 1727 см-1 (CO); δH1,10 (3H, c, 13β-Me ); 1,28 и 1,29 (каждый 3H, c, 15α- и 15β-Me ), 1,84 (1H, д, J 10,9 Гц, 14α-H ), 2,09 и 2,61 (каждый 1H, д, J 19,4 Гц, 16α- и 16β-H ), 2,93 (2H, м, 6-H2), 3,78 (3H, с, 3-ОМе), 6,63 (1H, д, J 2,7 Гц, 4-H), 6,70 (1H, дд, J 8,6 и 2,7 Гц, 2-H), 7,21 (1H, д, J 8,6 Гц, 1-H); δC17,8 (C-18), 24,5 (15-Me), 26,0 ((C-11), 28,2 (C-7), 29,8 (C-6), 34,2 (C-12), 34,6 (15-Mе), 35,5 (C-15), 37,5 (C-8), 44,9 (C-9), 50,2 (C-13), 53,6 (C-16), 55,2 (3-OMe), 58,4 (C-14), 111,6 (C-2), 113,6 (C-4), 126,4 (C-1), 132,2 (C-10), 137,4 (C-5), 157,6 (C-3) и 221,4 (C-17) (Найдено: C, 80,5; H, 8,8%; M+, 312. Расчетные значения для C21H28O2: C, 80,7; H, 9,0%; M, 312).
15β- Этил-3-метокси -15α- метилэстра-1,3,5(10)-триен-17-он (5)
Раствор этилмагнийиодида (2,5 ммоль) в безводном диэтиловом эфире (2 мл) [полученного при 20oC из магния (60 мг; 2,5 ммоль) и этилиодида (иодистого этила) (0,2 мл; 2,5 ммоль)] охлаждают до 0oC, добавляют иодид меди (I) (47 мг, 0,25 ммоль) и смесь перемешивают в течение 5 минут. Добавляют 15-метил Δ15-17-кетон (3) (148 мг; 0,5 ммоль) в безводном тетрагидрофуране (2 мл). Реакционную смесь перемешивают при 20oC в течение 15 минут. Добавляют насыщенный водный раствор хлорида аммония и нашатырный спирт, и остаток после обработки (этилацетат) (150 мг; 92%) кристаллизуют из диизопропилового эфира с получением 15β- этил-3-метокси -15α- метилэстра-1,3,5(10)-триен-17-она (5) (135 мг), т.пл. 104-107oC (из смеси диизопропиловый эфир-метанол); [α]D+90° (с 1,0); νmax 1724 см-1 (CO); δH0,94 (3H, т, J 7,6 Гц, 15β-CH2CH3 ), 1,09 (3H, с, 13β-Me ); 1,22 (3H, с, 15α-Me ); 1,63 и 1,76 (каждый 1H, вырожденный дкв, J 15,2 и 3 х 7,6 Гц, 15β-CH2CH3 ), 1,87 и 2,80 (каждый 1H, д, J 19,3 Гц, 16α- и 16β-H), 2,91 (2H, м, 6-H2), 3,78 (3H, с, 3-ОМе), 6,64 (1H, д, J 2,8 Гц, 4-H), 6,71 (1H, дд, J 8,7 и 2,8 Гц, 2-H), и 7,21 (1H, д, J 8,7 Гц, 1-H); δC9,0 (C-152), 18,3 (C-18), 25,9 (C-151), 27,4 (C-11), 28,6 (C-7), 29,8 (C-6), 30,3 (C-12), 34,4 ( 15α-Me ), 37,3 (C-8), 39,4 (C-15), 45,1 (C-9), 48,9 (C-16), 49,8 (C-13), 55,2 (3-ОМе), 59,8 (C-14), 111,6 (C-2), 113,6 (C-4), 126,4 (C-1), 132,3 (C-10), 137,4 (C-5), 157,6 (C-3), и 220,3 (C-17) (Найдено: C 80,9; H, 9,6%; М+, 326. Расчетные значения для C22H30O2: C 80,9; H, 9,3; M 326).
15β- Этил-3-метоксиэстера-1,3,5(10)-триен-17-он (6)
Раствор этилмагнийиодида (3,8 ммоль) в безводном диэтиловом эфире (1 мл) [полученного из магния (91 мг, 3,8 ммоль) и этилиодида (0,3 мл; 3,8 ммоль)] охлаждают до 0oC. Добавляют иодид меди (I) (71 мг, 0,37 ммоль). Медленно добавляют раствор енона (1) (200 мг; 0,68 ммоль) в безводном тетрагидрофуране (5 мл) и проводят перемешивание при 20oC в течение 10 минут. Смесь охлаждают до 0oC и добавляют насыщенный водный раствор хлорида аммония. Остаток после обработки (этилацетат) (207 мг; 93%) не рекристаллизируют с получением 15β- этил-3-метоксиэстра-1,3,5(10)-триент-17-она (6) (198 мг), т.пл. 125-129oC (из смеси хлороформ-метанол); [α]D+85° (с, 0,95); νmax 1727 см-1 (CO); δH 0,95 (3H, т, J 7,5 Гц, 15β- CH2CH3), 1,02 (3H, с, 13β-Me ); 1,34 и 1,65 (каждый 2H, м, 15β-CH2CH3 ), 1,90 (1H, дд, J 9,3 и 2,7 Гц, 14α-H , 2,39 (2H, м, 16α- и 16β-H ), 2,92 (2H, м, 6-H2), 3,79 (3H, с 3-ОМе), 6,66 (1H, д, J 2,9 Гц, 4-H), 6,72 (1H, дд, J 8,4 и 2,9 Гц, 2-H), т 7,20 (1H, д, J 8,4 Гц, 1-H); δC 13,9 (C-152), 17,8 (C-18), 23,8 (C-151), 25,6 (C-11), 26,8 (C-7), 29,5 (C-6), 34,0 (C-12), 36,0 (C-8), 36,5 (C-15), 42,2 (C-9), 44,6 (C-16), 47,1 (C-13), 52,9 (C-14), 55,2 (3-ОМе), 111,4 (C-2), 113,9 (C-4), 126,0 (C-1), 132,4 (C-10), 137,8 (C-5), 157,7 (C-3), и 221,4 (C-17) (Найдено: C, 80,6; H, 8,9%; M+, 312. Расчетные значения для C21H28O2; C, 80,7; H, 9,0%; M, 312).
15-Этил-3-метоксиэстра-1,3,5(10)-тетраен-17-он (7)
Раствор диизопропиламида лития (7,8 ммоль) в безводном тетрагидрофуране (3 мл) [получен при 0oC из диизопропиламина (2,2 мл; 15,8 ммоль) в тетрагидрофуране (3 мл) и бутиллития (4,9 мл; 1,6 М; 7,8 ммоль)] охлаждают до - 78oC. Медленно добавляют раствор 15β- этилкетона (6) (495 мг; 1,58 ммоль) в безводном тетрагидрофуране (12 мл). Через 30 минут выдержки при - 78oC добавляют хлортриметилсилан (2,5 мл; 19,7 ммоль) и перемешивают при 0oC в течение 15 минут. Добавляют насыщенный водный раствор хлорида аммония. Остаток после обработки (этилацетат) (577 мг) растворяют в ацетонитриле (20 мл). Добавляют ацетат палладия (II) (340 мг; 1,51 ммоль) и смесь нагревают до температуры кипения в течение 20 минут. Раствор охлаждают до 20oC, фильтруют и упаривают. Хроматографирование остатка (470 мг) на силикагеле (25 г) и элюирование этилацетатом (1: 19) дает 3-метокси-15-метилэстра-1,3,5(10)- тетраен-17-он (7) (419 мг; 85% от 6), т.пл. 103-106oC (из смеси хлороформ-метанол); [α]D-14° (с 0,9); νmax 1689 см-1 (CO); δH 1,11 (3H, с, 13β-Me ); 1,20 (3H, т, J 7,6 Гц, 15-CH2CH3), 2,40 (2H, м, 15-CH2CH3), 3,78 (3H, с, 3-ОМе), 5,79 широкий (1H, с, 16-H), 6,64 (1H, д, J 2,8 Гц, 4-H), 6,73 (1H, дд, J 8,3 и 2,8 Гц, 2-H), и 7,22 (1H, д, J 8,3 Гц, 1-H); δC 11,6 (C-152), 21,5 (C-18), 25,6 (C-11), 27,3 (C-7), 28,0 (C-12), 29,2 (C-151), 29,4 (C-6), 37,0 (C-8), 45,3 (C-9) 52,6 (C-13), 55,2 (3-ОМе), 57,2 (C-12), 111,6 (C-2), 113,6 (C-4), 125,7 (C-16), 126,2 (C-1), 132,1 (C-10), 137,3 (C-5), 157,5 (C-3), 181,1 (C-15), и 212,2 (C-17). (Найдено: C, 81,1; H, 8,5%; M+, 310. Расчетные значения для C21H26O2:C, 81,25; H, 8,4%; M, 310).
15α-(тил-3-метокси-15β- метилэстра-1,3,5(10)-триен-17-он (8)
Раствор метилмагнийиодида (2,5 ммоль) в безводном диэтиловом эфире (2,5 мл) [полученного при 20oC из магния (60 мг; 2,5 ммоль) и метилиодида (0,16 мл; 2,5 ммоль)] охлаждают до 0oC. Добавляют иодид меди (I) (46 мг, 0,24 ммоль). Спустя 5 минут при 0oC добавляют раствор 15-этил -Δ15- 17-кетона (7) (150 мг; 0,48 ммоль) в безводном тетрагидрофуране (3 мл). Смесь перемешивают при 20oC в течение 15 минут. Добавляют насыщенный водный раствор хлорида аммония и нашатырный спирт, и остаток после обработки (этилацетат) (150 мг; 96%) кристаллизуют из хлороформа с получением 15α- этил-3-метокси -15β- метилэстра-1,3,5(10)-триен-17-она (8) (127 мг; 81%), т.пл. 110-113oC (из смеси хлороформ-метанол); [α]D+90° (с 1,0); νmax 1724 см-1 (CO); δH 0,89 (3H, т, J 7,4 Гц, 15α-CH2CH3 ), 1,12 (3H, с, 13β-Me ); 1,25 (3H, с, 15β-Me ); 1,36 и 1,76 (каждый 2H, вырожденный дкв, J 14,8 и 3 х 7,4 Гц, 15α-CH2CH3 ); 2,18 и 2,44 (каждый 1H, д, J 19,4Гц, 16α- и 16β-H ), 2,88 (2H, м, 6-H2), 3,77 (3H с, 3-ОМе), 6,62 (1H, д, J 2,9 Гц, 4-H), 6,71 (1H, дд, J 8,6 и 2,9 Гц, 2-H), и 7,20 (1H, д, J 8,6 Гц, 1-H), δC 9,4 (C-152), 18,2 (C-18), 21,8 (C-151), 26,1 (C-11), 28,3 (C-7), 29,9 (C-6), 34,2 (C-12), 37,5 (C-8), 38,1 (15β-Me) , 38,9 (C-15), 44,9 (C-9), 49,8 (C-16), 50,0 (C-13), 55,2 (3-OMe), 56,6 (C-14), 111,6 (C-2), 113,6 (C-4), 126,5 (C-1), 132,2 (C-10), 137,4 (C-5), 157,6 (C-3), и 220,4 (C-17) (Найдено: C, 81,2; H, 9,5%; M+, 326. Расчетные значения для C22H30O2: C, 80,9; H, 9,3%; M, 326).
15β- Изопропил-3-метоксиэстра-1,3,5(10)-триен-17-он (9)
Комплекс иодида меди (I) с диметилсульфидом (107 мг; 0,42 ммоль) и гексаметилфосфотриамид (1,1 мл; 3,6 ммоль) добавляют к раствору изопропилмагнийбромида (4,25 ммоль) [полученного при 0oC из магния (102 мг; 4,25 ммоль) и изопропилбромида (0,4 мл; 4,26 ммоль)] в безводном диэтиловом эфире (5 мл) при 0oC. Через 5 минут выдерживания при этой температуре медленно добавляют раствор енона (1) (200 мг, 0,71 ммоль) и хлортриметилсилана (0,8 мл; 6,30 ммоль) в безводном тетрагидрофуране. Смесь перемешивают при 0oC в течение 20 минут. Добавляют насыщенный водный раствор хлорида аммония и нашатырный спирт. Остаток после обработки (этилацетат) (205 мг) хроматографируют на силикагеле (20 г), и элюирование смесью этилацетат-толуол (1:49) дает 15β- изопропил-3-метоксиэстра-1,3,5(10)-триен-17-он (9) (201 мг; 87%), т.пл. 104-108oC (из диизопропилового эфира); [α]D + 106o (с, 1,0); νmax 1724 см-1 (CO); δH 0,96 и 1,10 (каждый 3H, д, J 6,4 Гц, 15β- CHMe2), 1,08 (3H, с, 13β-Me ); 1,92 (1H, дд, J 9,6 и 3,0 Гц, 14α-H ), 2,41 (2H, м, 16-H2), 2,89 (2H, м, 6-H2), 3,79 (3H, с, 3-ОМе), 6,66 (1H, д, J 2,8 Гц, 4-H), 6,73 (1H, дд, J 8,4 и 2,8 Гц, 2-H), и 7,20 (1H, д, J 8,4 Гц, 1-H); δC 17,4 (C-18), 21,8 и 24,3 ( 15β- CHMe2), 25,4 (C-11), 28,2 (C-7); 29,5 (C-6), 32,3 (C-8), 34,8 (C-12), 38,0 (C-15), 42,4 (C-9), 45,0 (C-16), 45,5 (C-14), 46,5 (C-13), 55,2 (3-OMe), 55,4 ( 15β- CHMe2), 111,4 (C-2), 113,9 (C-4), 126,6 (C-1), 132,4 (C-10), 137,9 (C-5), 157,7 (C-3), и 222,8 (C-17) (Найдено: C, 80,5; H, 9,3%; M+, 326. Расчетные значения для C22H30O2: C, 80,9; H, 9,3%; M, 326.
15-Изопропил-3-метоксиэстра-1,3,5(10), 15-тетраен-17-он (10)
Раствор 15β- изопропилкетона (9) (210 мг; 0,64 ммоль) в безводном тетрагидрофуране (10 мл) добавляют к раствору диизопропиламина лития (3,2 ммоль) [получен при 0oC из диизопропиламина (0,9 мл; 6,35 ммоль) в тетрагидрофуране (2 мл) и бутиллития (1,9 мл; 3,04 ммоль)] при - 78oC. После 30 минут выдерживания при этой температуре добавляют хлортриметилсилан (1 мл; 7,88 ммоль). Смеси дают нагреться до 0oC в течение 20 минут. Добавляют насыщенный водный раствор хлорида аммония и остаток после обработки (этилацетат) (242 мг) растворяют в безводном ацетонитриле (20 мл). Добавляют ацетат палладия (II) (140 мг; 0,62 ммоль) и смесь нагревают до температуры кипения в течение 20 минут. Раствор охлаждают до 20oC, фильтруют и упаривают. Остаток хроматографируют на силикагеле (23 г), и элюирование смесью этилацетат-толуол (1: 19) дает 15-изопропил-3-метоксиэстра-1,3,5(10), 15-тетраен-17-он (10) (170 мг; 81% от 9), т.пл. 113 - 116oC (из смеси хлороформ-метанол); [α]D-18° (с, 1,0); νmax 1690 см-1 (CO); δH 1,10 (3H, с, 13β-Me ); 1,16 и 1,22 (каждый 3H, J 6,6 Гц, 15 - CHMe2), 2,57 (1H, дд, J 11,2 и 2,7 Гц, 14α-H), 2,92 (2H, м, 6-H2), 3,79 (3H, с, 3-OMe), 5,80 (1H, дд, J 2,7 и 1,2 Гц, 16-H), 6,65 (1H, д, J 2,7 Гц, 4-H), 6,74 (1H, дд, J 8,6 и 2,7 Гц, 2-H), и 7,24 (1Н, J 8,6 Гц, 1-H); δC 21,1 (C-18), 21,6 и 21,7 (15-CHMe2), 25,6 (C-11), 28,1 (C-7), 29,1 (C-6), 29,7 (C-8), 30,8 (15-CHMe2), 37,4 (C-12), 45,4 (C-9), 52,6 (C-13), 55,2 (3-OMe), 56,3 (C-14), 111,6 (C-2), 113,6 (С-3) 123,9 (C-16) 126,3 (C-1), 132,2 (C-10), 137,2 (C-5), 157,7 (C-3), 185,7 (C-15), и 212,4 (C-17) (Найдено: C, 81,6; H, 8,9%; M+, 324. Расчетные значения для C22H28O2: C, 81,4; H 8,7%; M, 324).
15α-Изопропил-3-метокси-15β- метилэстра-1,3,5(10)-триен-17-он (11)
Раствор диметилкупрата лития (0,61 ммоль) в безводном диэтиловом эфире (1,5 мл) [получен при 0oC из иодида меди (I) (118 мг; 0,61 ммоль) и метиллития (0,8 мл; 1,6 М; 1,28 ммоль)] охлаждают до -78oC. Последовательно добавляют триэтиламин (0,1 мл; 0,72 ммоль) и хлортриметилсилан (0,1 мл; 0,79 ммоль). В течение 5 минут проводят перемешивание при -78oC, после чего по каплям добавляют раствор изопропилзамещенного енона (10) (100 мг; 0,31 ммоль) в безводном тетрагидрофуране (3 мл). Реакционную смесь перемешивают в течение дальнейших 30 минут при 0oC. Добавляют насыщенный водный раствор хлорида аммония и разбавленную соляную кислоту. Чтобы дать полностью гидролизоваться енол-силильному эфиру, смесь перемешивают при 20oC в течение 15 минут. Остаток после обработки (этилацетат) (97 мг) хроматографируют на силикагеле (10 г), и элюирование смесью этилацетаттолуол (1:49) дает 15α-изопропил-3-метокси-15β- метилэстра-1,3,5(10)-триен-17-он (11) (92 мг; 86%), т.пл. 113-115oC (из диизопропилового эфира); [α]D +87oC (с 0,9); νmax 1724 см-1 (CO); δH (C6D6), 0,68 (6H, д, J 6,0 Гц), 15α- CHMe2), 0,87 (3H, с, 15β-Me ), 0,98 (3H, с, 13β-Me ), 1,62 нечеткий (1H, кв, J 6,0 Гц, 15α- CHMe2), 1,95 и 2,15 (каждый 1H, д, J 19,1 Гц, 16α- и 16β-H ), 2,68 (2H, м, 6-H2), 3,44 (3H, с, 3-OMe), 6,70 (1H, д, J 2,6 Гц, 4-H), 6,79 (1H, дд, J 8,8 и 2,6 Гц, 2-H), и 7,09 (1H, д, J 8,8 Гц, 1-H); δH (CDCl3), 0,87 и 0,89 (каждый 3H, д, J 6,7 Гц, 15α-CHMe2 ), 1,13 (3H, с, 13β-Ме), 1,32 (3H, с, 15β-Me ), 2,23 нечеткий (2H, д, J 18,7 Гц, 16α и 16β-H ), 2,87 (2H, м, 6-H2), 3,77 (3H, с, 3-OMe), 6,68 (1H, д, J 2,8 Гц, 4-H), 6,75 (1H, дд, J 8,8 и 2,8 Гц, 2-H), и 7,20 (1H, д, J 8,8 Гц, 1-H); δC 17,8 (C-18), 18,4 и 18,8 (15α-CHMe2), 23,0 (C-11), 26,1 (C-7), 27,8 ( 15β-Me ), 30,0 (C-8), 34,5 (C-12), 36,9 ( 15α- CHMe2), 37,7 (C-6), 41,5 (C-15), 44,6 (C-9), 45,0 (C-16), 49,9 (c-13), 55,2 (3-OMe), 111,6 (C-2), 113,6 (C-4), 126,5 (C-1), 132,2 (C-10), 137,4 (C-5), 157,6 (C-3), и 220,3 (C-17) (Найдено: C, 81,2; H, 9,6%; M+, 340. Расчетные значения для C23H32O2; C, 81,1; H, 9,5%; M, 340).
3-Метокси-15,15-диметилэстра-1,3,5(10)-триен -17β-ол (12)
Алюмогидрид лития (30 мл; 0,79 ммоль) добавляют к раствору диметилзамещенного кетона (4) (50 мг, 0,16 ммоль) в безводном тетрагидрофуране (2 мл) при 0oC. Смесь перемешивают при 0oC в течение 5 минут. Добавляют насыщенный водный раствор гидрокарбоната натрия и фильтруют смесью. Обработка фильтрата (этилацетатом) дает 3-метокси-15,15-диметилэстра-1,3,5-(10)-триен -17β-ол (12), (43 мг; 85%), т.пл. 87 - 91oC (из смеси хлороформ-гексан); [α]D+75° (с 1,1); νmax 3606 см-1 (OH); δH 0,92 (3H, с, 13β-Me); 1,06 (1H, д, J 11,2 Гц, 14α-H), 1,11 и 1,14 (каждый 3H, с, 15α- и 15β-Me), 1,61 и 1,90 (каждый 1H, дд, J 13,0 и 10,2, и 13,0 и 7,9 Гц, 16α- и 16β-H), 2,86 (2H, м, 6-H2), 3,71 (1H, дд, J 10,2 и 7,9 Гц, 17α-H), 3,77 (3H, с, 3-OMe), 6,62 (1H, д, J 2,7 Гц, 4-H), 6,71 (1H, дд, J 8,6 и 2,7 Гц, 2-H), и 7,21 (1H, д, J 8,6 Гц, 1-H), δC 13,5 (C-18), 25,6 (15-Me), 26,1 (C-11), 28,5 (C-7), 29,9 (C-6), 35,0 (C-12), 36,2 (C-15), 37,1 (C-8), 38,8 (15-Me), 44,9 (C-9), 45,6 (C-13), 50,1 (C-16), 55,2 (3-OMe), 58,1 (C-14), 79,8 (C-17), 111,4 (C-2), 113,6 (C-4), 126,3 (C-1), 132,9 (C-10), 137,7 (C-5), и 157,5 (C-3) (Найдено: C, 80,0; H, 9,5%; M+, 314. Расчетные значения для C21H30O2: C, 80,2; H 9,6%; M, 314).
15β- Этил-3-метокси -15α- метилэстра-1,3,5(10)-триен -17β-ол (13)
Алюмогидрит лития (58 мг; 0,31 ммоль) добавляют к раствору 15β-этил-15α- метилзамещенного кетона (5) (100 мг, 0,31 ммоль) в безводном тетрагидрофуране (2 мл) при 0oC. Смесь перемешивают при 0oC в течение 5 минут. Добавляют насыщенный водный раствор хлорида аммония и фильтруют смесь. Стандартная обработка фильтрата (этилацетат) дает 15β- этил-3-метокси -15α- метилэстра-1,3,5(10)-триен -17β-ол (13) (92 мг; 90%), в виде масла, [α]D+70° (с, 1,1); νmax 3604 см-1 (OH); δH 0,88 (3Н, т, J 7,2 Гц, 15β- CH2CH3), 0,90 (3H, с, 15α-Me), 1,10 (3H, с, 13β- Me), 1,51 нечеткий (2H, м, 15β- CH2CH3), 1,73 нечеткий (2H, м, 16α- и 16β-H), 2,84 (2H, м, 6-H2), 3,74 (1H, дд, J 9,9 и 8,2 Гц, 17α-H ), 3,78 (3H, с, 3-OMe), 6,63 (1H, д, J 2,8 Гц, 4-H), 6,71 (1H, дд, J 8,4 и 2,8 Гц, 2-H), и 7,21 (1Н, д, J 8,4 Гц, 1-H); δC 8,6 (C-152), 13,9 (C-18), 25,9 (C-151), 28,6 (C-11), 29,0 (С-7), 29,9 (C-6), 30,3 (C-12), 36,8 (C-8), 39,0 ( 15α-Me), 40,0 (C-15), 45,2 (C-9), 45,5 (C-14), 55,2 (3-OMe), 59,6 (C-13), 79,5 (C-16), 80,0 (C-17), 111,4 (C-2), 113,6 (C-4), 126,2 (C-1), 133,0 (C-10), 137,7 (C-5) и 157,5 (C-3).
15α- Этил-3-метокси -15β- метилэстра-1,3,5(10)-триен -17β- ол (14)
Алюмогидрид лития (48 мг; 1,26 ммоль) добавляют к раствору 15α-этил-15β- метилзамещенного кетона (8) (80 мг; 0,25 ммоль) в безводном тетрагидрофуране при 0oC. Проводят перемешивание при низкой температуре в течение 5 минут. Добавляют насыщенный водный раствор гидрокарбоната натрия и фильтруют смесь. Стандартная обработка фильтрата (этилацетат) дает 15α- этил-3-метокси -15β- метилэстра-1,3,5(10)-триен 17β-ол (14) (75 мг; 89%). т.пл. 133 - 136oC (их смеси хлороформ-метанол); [α]D+67° (с 0,9); νmax 3604 см-1 (OH); δH 0,88 (3Н, т, J 7,2 Гц, 15α- CH2CH3), 0,93 (3, с, 15β-Me), 1,06 (3H, с, 13β-Me ), 1,10 (1H, д, J 11,1 Гц, 14α-H ), 1,32 нечеткий (2H, м, 15α- CH2CH3), 1,39 и 2,04 (каждый 1H, дд, J 13,2 и 10,0, и 13,2 и 7,9 Гц, 16α- и 16β-H), 2,84 (2H, м, 6-H2), 3,60 (1H, дд, J 10,0 и 7,9 Гц, 17α-H ), 3,77 (3H, с, 3-OMe), 6,61 (1H, д, J 2,9 Гц, 4-H), 6,70 (1H, дд, J 8,6 и 2,9 Гц, 2-H), и 7,20 (1H, д, J 8,6 Гц, 1-H); δC 9,4 (C-152), 13,9 (C-18), 23,7 (C-151), 26,1 (C-11), 28,6 (C-7), 29,9 (C-6), 37,1 (C-12), 37,7 (C-8), 38,9 15β-Me , 39,7 (C-15), 45,0 (C-9), 45,6 (C-14), 55,2 (3-OMe), 55,6 (C-13), 79,3 (C-16), 80,2 (C-17), 111,4 (C-2), 113,6 (C-4), 126,3 (C-1), 133,0 (C-10), 137,7 (C-5), и 157,5 (C-3) (Найдено: C, 80,0; H, 9,7%; M+, 328. Расчетные значения для C22H32O2: C, 80,4; H, 9,8%; M, 328).
15α- Изопропил-3-метокси -15β- метилэстра-1,3,5(10)-триен -17β- ол (15)
Алюмогидрид лития (35 мг; 0,92 ммоль) добавляют к раствору 15α- изопропил -15β- метилзамещенного кетона (11) (63 мг; 0,19 ммоль) в безводном тетрагидрофуране ( 4 мл) при 0oC. После выдерживания при этой температуре в течение 10 минут, добавляют насыщенный водный раствор гидрокарбоната натрия. Смесь фильтруют и прозрачный раствор подвергают стандартной обработке (этилацетат) с получением 15α- изопропил-3-метокси -15β- метилэстра-1,3,5(10)-триен -17β-ола (15) (60 мг; 95%), [α]D+54° (с 1,3); νmax 3604 см-1 (OH); δH (200 МГц), 0,88 и 0,92 (каждый 3H, д, J 6,8 Гц, 15α- CHMe2), 0,96 (3H, с, 13β-Me ), 1,13 (3H, с, 15β-Me), 1,73 (1H, дд, J 13,4 и 10,2 Гц, 16-H), 2,13 (1H, дд, J 13,4 и 7,9 Гц, 16-H), 3,54 (1H, дд, J 10,2 и 7,9 Гц, 17α-H), 3,78 (3H, с, 3-OMe), 6,64 (1H, дд, J 2,7 Гц, 4-H), 6,71 (1H, дд, J 8,5 и 2,7 Гц, 2-H), и 7,22 (1H, д, J 8,5 Гц, 1-Н); δC 14,1 (C-18), 18,2 и 18,6 ( 15α- CHMe2), 23,6 (C-11), 26,2 (C-7), 28,5 ( 15β- Me), 29,9 (C-8), 36,6 (C-12), 37,3 ( 15α- CHMe2), 39,3 (C-6), 40,7 (C-15), 42,7 (C-13), 44,7 (C-9), 46,0 (C-16), 51,8 (C-14), 55,2 (3-OMe), 80,8 (C-17), 111,4 (C-2), 113,6 (C-4), 126,3 (C-1), 133,0 (C-10), 137,6 (C-5), и 157,7 (C-3) (Найдено: C, 80,4; H 9,9%; M+, 342). Расчетные значения для C23H34O2: C, 80,65; H, 10,0%; M, 342.
Примеры 2 - 5
3-Деметилирование 15,15-диалкил -17β- спиртов (12 - 15)
Пример 2
Характерная методика: Гидрид диизобутилалюминия (0,5 мл; 1,5 М; 0,75 ммоль) добавляют к раствору 15,15-диметил -17β- спирта (12) в безводном толуоле (5 мл). Раствор нагревают при температуре кипения в течение 24 часов. Смесь охлаждают до 0oC, добавляют насыщенный водный раствор хлорида аммония, и водную фазу далее подкисляют разбавленной HCl. Стандартная обработка (этилацетат) дает 15,15-диметилэстра-1,3,5(10)-триен -3,17β- диол (16) (43 мг; 90%), т. пл. 167 - 170 (из этилацетата); [α]D+49° (с 1,1 этанол) (Найдено: C, 79,6; H, 9,3%; M+, 300. Расчетные значения для C20H28O2: C, 80,0; H, 9,4%; M, 300).
Пример 3
15β-Этил-15α- метилэстра-1,3,5(10)-триен -3,17β- диол (17)
Т. пл. 132-136oC (из этилацетата); [α]D+54° (с 1,0 в этаноле) (Найдено: C, 80,4; H, 9,5%; M+, 314. Расчетные значения для C21H30O2: C, 80,2; H, 9,6%; M, 314).
Пример 4
15α-Этил-15β- метилэстра-1,3,5(10)-триен -3,17β- диол (18)
Получен в виде пены: [α]D+59° (с 1,0 в этаноле) (Найдено: C, 79,8; H, 9,5%, M+, 314. Расчетные значения для C21H30O2: C, 80,2; H, 9,6%; M, 314).
Пример 5
15α-изо-Пропил-15β- метилэстра-1,3,5(10)-триен 3,17β- диол (19)
Т. пл. 201 - 205oC (из этилацетата); [α]D+71° (с 1,0 в тетрагидрофуране) (Найдено: C, 80,7; H, 9,8%; M+, 328. Расчетные значения для C22H32O2: C, 80,4; H, 9,8%; M, 328).
Предыдущие примеры могут быть успешно воспроизведены при замене использованных в предыдущих примерах реагентов и/или условий проведения реакций на в целом или конкретно описанные реагенты и/или условия проведения реакций согласно настоящему изобретению.
Из предшествующего описания квалифицированные специалисты могут легко установить существенные характеристики настоящего изобретения и, без отступления от сути изобретения и выхода за рамки его объема, внести в изобретение различные изменения и модификации, с тем чтобы приспособить его для различных условий и возможностей применения.
| название | год | авторы | номер документа |
|---|---|---|---|
| НЕНАСЫЩЕННЫЕ 14,15-ЦИКЛОПРОПАНОАНДРОСТАНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2000 |
|
RU2244718C2 |
| 14,17-C-МОСТИКОВЫЕ СТЕРОИДЫ И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 1995 |
|
RU2169153C2 |
| ЭСТРАТРИЕНЫ, СОДЕРЖАЩИЕ МОСТИК | 1990 |
|
RU2087479C1 |
| 19,11-ПЕРЕКРЫТЫЕ МОСТИКАМИ 4-ЭСТРЕНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1993 |
|
RU2157814C2 |
| ПРОИЗВОДНЫЕ ЭСТРА-1,3,5(10)-ТРИЕНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2139885C1 |
| 17α-АКИЛ-17β-ОКСИЭСТРАТРИЕНЫ, ИХ ПРИМЕНЕНИЕ И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 2002 |
|
RU2285009C2 |
| СПОСОБ ПОЛУЧЕНИЯ (15α,16α,17β)-ЭСТРА-1,3,5(10)-ТРИЕН-3,15,16,17-ТЕТРОЛА (ЭСТЕТРОЛА) И ИНТЕРМЕДИАТЫ В ЭТОМ СПОСОБЕ | 2020 |
|
RU2818561C1 |
| 17 БЕТА-ОКСИЭСТРАТРИЕНЫ | 2002 |
|
RU2339643C2 |
| 15β-ЗАМЕЩЕННЫЕ СТЕРОИДЫ С ИЗБИРАТЕЛЬНОЙ ЭСТРОГЕННОЙ АКТИВНОСТЬЮ | 2005 |
|
RU2386637C2 |
| СОЕДИНЕНИЯ, НАБОР, АНДРОГЕННАЯ КОМПОЗИЦИЯ | 2000 |
|
RU2242479C2 |
Описываются новые 15,15-диалкилстероидные соединения формулы I, где R1 и R2 независимо друг от друга являются каждый водородом, R3 и R4 независимо друг от друга являются неразветвленным алкилом, содержащим 1 - 10 атомов углерода, или разветвленным алкилом, содержащим 3 - 10 атомов углерода. Соединения обладают высокой эстрогенной эффективностью при пероральном введении. Описывается также способ их получения и исходные вещества для проведения этого способа и способ их получения. 4 с. и 4 з.п. ф-лы, 1 ил.
 (I)
(I)
где R1 и R2 независимо друг от друга являются каждый водородом;
R3 и R4 независимо друг от друга являются неразветвленным алкилом, содержащим 1 - 10 атомов углерода, или разветвленным алкилом, содержащим 3 - 10 атомов углерода.
где R1 является неразветвленным алкилом, содержащим 1 - 10 атомов углерода;
R3 и R4 независимо друг от друга являются каждый неразветвленным алкилом, содержащим 1 - 10 атомов углерода, или разветвленным алкилом, содержащим 3 - 10 атомов углерода,
подвергают расщеплению 3-алкилэфирной группы.
где R1' является неразветвленным алкилом, содержащим 1 - 10 атомов углерода;
R3 и R4 независимо друг от друга являются каждый неразветвленным алкилом, содержащим 1 - 10 атомов углерода, или разветвленным алкилом, содержащим 3 - 10 атомов углерода;
Z представляет атом кето-кислорода.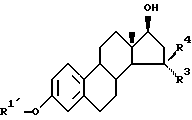
где R1' является неразветвленным алкилом, содержащим 1 - 10 атомов углерода;
R3 и R4 независимо друг от друга являются каждый неразветвленным алкилом, содержащим 1 - 10 атомов углерода, или разветвленным алкилом, содержащим 3 - 10 атомов углерода,
отличающийся тем, что он включает взаимодействие 3-R1' 0-эстра-1,3,5(10), 15-тетраен-17-онового соединения с LiCuR2 3 или алкилмагнийгалогенидом, где алкил представляет собой R3, а галогенид - Br или I, в присутствии содержащего медь (I) катализатора с получением 3-R1' 0-15β-R3-эстра-1,3,5(10)-триен-17-она; химическое превращение его in situ путем добавления хлортриметилсилана и последующего добавления ацетата палладия (II) с получением 3-R1' 0-15β-R3-эстра-1,3,5(10), 15-тетраен-17-она; взаимодействие его с LiCuR2 4 или алкилмагнийгалогенидом, где алкил представляет собой R4, а галогенид - Br или I, в присутствии содержащего медь (I) катализатора с получением 3-R1' 0-15α-R3-15β-R4-эстра-1,3,5(10)-триен-17-она; восстановление C-17-карбонила его с получением упомянутого соединения формулы II, R1', R2, R3 имеют значения, указанные в п.1.
| US 3766224, 1973 | |||
| Ф.П.ТРИНУС | |||
| Фармакотерапевтический справочник | |||
| - Киев: Здоровье, 1989, с.266 | |||
| D.Poirier et al | |||
| TETRAHEDRON, 47, N 37, 1991, p.7751. |
Авторы
Даты
2000-04-10—Публикация
1994-08-01—Подача