Изобретение относится к способу получения антикоагулянтной композиции, а также к композиции, полученной таким образом. Настоящее изобретение относится также к устройству, содержащему названную композицию, предназначенному для сбора крови, и к способу отбора образцов крови.
Анализ цельной крови требует применения антикоагулянта, обычно в устройстве для сбора крови, с целью предотвратить свертывание взятого образца крови до его анализа. Известно использование гепарина как в сухом, так и в жидком виде в связи с его способностью связывать определенную часть электролитов во взятом образце крови (например, ионов натрия, калия и/или кальция). Это связывание электролитов является нежелательным, поскольку оно существенно препятствует точному определению концентрации электролитов в крови, в частности, концентрации натрия, калия и кальция. Определение концентрации ионов кальция в последнее время привлекло к себе пристальное внимание в области кардиологии ввиду чувствительности сердечной мышцы к концентрации ионов кальция и последней разработки приборов для определения газов крови для контроля их концентрации.
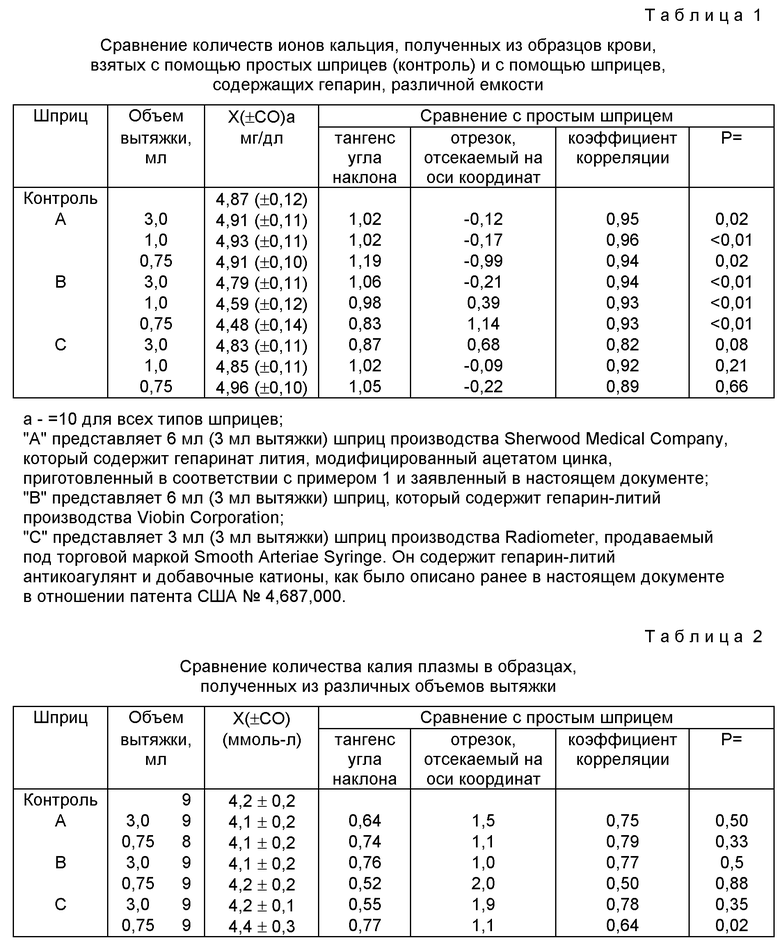
Имеющиеся в продаже устройства для сбора крови содержат гепарин в количестве в пределах диапазона от 8 до 150 МЕ/мл объема крови, который предполагается собрать. Чем выше величина, тем больше снижение концентрации ионов кальция в результате хелатообразования (связывание кальция гепарином) и поэтому больше неточность измерения концентрации ионов кальция. Имеющиеся в продаже устройства для сбора крови предполагалось использовать для измерения, наряду с другими ионами, концентрации ионов кальция, и поэтому они были предназначены для приема в качестве образца только заданного объема крови. Частичное заполнение устройства не соответствовало требованиям, потому что оно приводило к неточности измерения (см. приведенные ниже результаты в табл. 1 кас. шприца B). Преимуществом изобретения является гибкость в варьировании объема крови, который можно собирать (см. результаты для шприца A в той же табл.).
До настоящего времени предлагались различные решения проблем, касающихся связывания этих электролитов гепарином. Например, Radiometer A/S, Копенгаген, предлагали антикоагулянтные композиции для использования вместе с аппаратом для отбора образцов крови, представляющим капиллярные трубочки, покрытые изнутри сухим гепаринатом натрия. Эти композиции содержат определенное количество хлорида кальция, призванное компенсировать те катионы кальция крови, которые свяжутся в растворе с гепаринатом. Применение этой композиции, таким образом, не обеспечивает полного разрушения вышеупомянутой проблемы, поскольку она вводит дополнительное количество ионов натрия и хлора в образец крови, мешая таким образом точному определению концентраций ионов натрия и хлора в образце крови. Помимо этого добавленные ионы кальция представляют только приблизительную замену того их количества, которое, как ожидается, будет связано гепариновым компонентом. Следовательно, подобный анализ концентрации ионов кальция во взятом образце крови, хотя и является усовершенствованным, однако не может считаться вполне точным.
Патент США N 4687000 (выданный Radiometer A/S) раскрывает способ обработки образца крови антикоагулянтом, а также устройство для отбора образцов крови. Раскрытый способ включает контактирование взятого образца крови с (а) антикоагулянтом, способным связывать некоторые виды катионов в крови, и (b) добавочным веществом, включающим некоторые выборочные виды катионов в количествах, компенсирующих ту часть этих видов катионов, которая связывается с антикоагулянтом.
Однако упомянутый способ по-прежнему не предлагает истинное решение упомянутых выше проблем, поскольку виды катионов, присутствующие в консерванте, представляют собой скорее только показатели содержания катионов, которые, как ожидается, связаны, чем истинные и точные количества.
Устройства для сбора крови патента США N 4687000 предназначены только для использования с определенным заданным объемом крови. Таким образом, частичное заполнение устройства может привести к неточности измерения концентрации ионов металлов (см. результаты для шприца C в табл. 2). Кроме того, использование такого устройства приводит к неточности измерения общей концентрации кальция (см. результаты для шприца C в табл. 3). Устройство для сбора крови изобретения позволяет избежать эти недостатки (см. результаты для шприца A в той же табл.).
Поэтому задачей настоящего изобретения является обеспечение антикоагулянтной композиции и способа его получения.
Еще одной целью настоящего изобретения является создание способа обработки образца крови антикоагулянтом, который позволяет выполнять точный анализ присутствующих в нем ионов натрия, калия и кальция.
Еще одной целью настоящего изобретения является создание устройства, которое одновременно является контейнером для названного антикоагулянта и применяется в заявленном способе.
Таким образом, настоящее изобретение включает способ получения антикоагулянта, а также сам антикоагулянт, приготовленный согласно названному способу.
Настоящее изобретение включает также устройство для взятия образцов крови, включающее:
(a) принимающую часть, ограничивающую пространство для приема образца крови;
(b) входную часть для помещения образца крови в пространство для приема образца крови; и
(c) антикоагулянт, находящийся в пространстве для приема образца крови, который включает продукт процесса, заявленного в пункте 1 формулы изобретения.
Настоящее изобретение включает также способ отбора образцов крови, использующий заявленную композицию.
Как указывалось выше, настоящее изобретение относится к новой антикоагулянтной композиции и способу ее получения. Изобретение относится также к улучшенному способу отбора образцов крови и к устройству, предназначенному для этой цели.
Антикоагулянтная композиция настоящего изобретения является гепаринатом лития, модифицированным солью тяжелого металла, например, ацетатом цинка. Приготавливают эту композицию посредством методики, описанной ниже.
Определенное количество гепарин-натрия растворяют в воде до консистенции, оптимальной для прохождения через слой ионообменной смолы. Гепарин-натрий получают из различных источников, таких как легкие крупного рогатого охота и/или слизистые оболочки крупного рогатого скота, слизистые оболочки свиньи и цельный кишечник свиньи. Помимо этого существует коммерческий препарат, производимый, например, фирмой Viobin Corporation, Waunakee, Wisconsin.
Полученный раствор предпочтительно имеет концентрацию приблизительно 30000-50000 ЕД/см3.
Этот раствор затем пропускают через колонку из кислой ионообменной смолы. Смола может включать любую кислую ионообменную смолу или их смеси. Такие смолы включают IR-120 (смолу от Rohm and Haas Company, имеющую матрикс из дивинилбензола (8%) и функциональность сульфоновой кислоты). Предпочтительно использование смолы IR-120. Особенно предпочтительно использование смолы IR-120 в водородной форме. Вытекающую из ионообменной колонки жидкость собирают и исследуют на содержание гепарина, например с помощью толуидинового синего. Эта жидкость в дальнейшем должна иметь pH 3 или менее. Кислую реакцию вытекающей жидкости можно поддерживать, подбирая адекватное время прохождения раствора через ионообменную колонку.
Кислый гепарин затем превращают в соль тяжелого металла гепарина посредством контакта с соединением, содержащим тяжелый металл. Предпочтительно превращение в соль цинка, бария или меди. Эти соли включают ацетат цинка дигидрат, а также хлориды и сульфаты цинка, бария и меди. Предпочтительно использование дигидрата ацетата цинка. В случае использования дигидрата ацетата цинка его добавляют к кислой жидкости, вышедшей из ионообменной колонки, в количестве, варьируемом от приблизительно 2 до приблизительно 7 граммов на каждые 15 граммов гепарин-натрия, первоначально введенного в ионообменную колонку. Использование других вышеназванных соединений, содержащих тяжелые металлы, предусматривает сходные молярные количества. pH растворимость раствора в дальнейшем контролируют, чтобы гарантировать уровень pH, не превышающий приблизительно 3.
К соли тяжелого металла гепарина, полученной на предшествующем этапе, добавляют затем водный раствор солей лития, таких как ацетат лития, гидроксид лития или карбонат лития, таким образом, чтобы pH полученного раствора находился в пределах приблизительно от 6 до 7. Предпочтительно использование гидроксида лития. Особенно предпочтительно использование 10% водного раствора гидроксида лития. Этот раствор перемешивают обычно в течение примерно от 4 до 24 часов, предпочтительно по меньшей мере в течение 8 часов, для того чтобы произошли хелирование лития и стабилизация pH раствора. Разумеется, можно добавлять дополнительные количества этого раствора для коррекции отклонений pH. Раствор со стабилизировавшимся pH затем можно профильтровать с помощью фильтра, способного удалить любое бактериальное загрязнение и/или нерастворимые вещества, полученные на предыдущих этапах. Предпочтительно использование фильтров с размером пор около 0,22 микрометра. Профильтрованный раствор затем можно высушить при помощи соответствующего оборудования, такого как Lyophilizer производства Hull или Virtiz.
Время сушки и температуру подбирают таким образом, чтобы избежать разложения гепарината. После высушивания гепариновая композиция затем предпочтительно хранится при низкой влажности, поскольку этот материал гигроскопичен.
Заявленная композиция согласно данным атомно-абсорбционной спектроскопии содержит около 6-8% (вес.) цинка. Если используются иные тяжелые металлы, заявленная композиция содержит эквивалентные молярные количества таких металлов.
Количество гепариновой композиции, используемой для одного образца крови, должно быть достаточным для предотвращения свертывания названного образца. Однако следует избегать и применения излишнего количества этой композиции, дабы свести к минимуму возможные помехи при анализе взятого образца крови. Таким образом, предпочтительным является использование самого малого количества антикоагулянтной композиции, способного адекватным образом предотвратить свертывание образца крови. Обнаружено, что в практике заявленного способа оптимальным является использование приблизительно от 8 до 150 международных единиц (ME) композиции на миллилитр образца крови. Предпочтительно использовать приблизительно от 20 до 80 МЕ/мл. Наиболее предпочтительно использовать приблизительно 50 МЕ/мл. Вышеназванные пределы концентрации антикоагулянта, адекватные для предотвращения свертывания крови, являются концентрациями, применимыми в устройствах для взятия крови, и, разумеется, присутствуют в продуктах, коммерчески доступных в настоящее время. Эти пределы, однако, не относятся к использованию шприцов Sherwood ABG, описанных в настоящей заявке.
Следует, однако, отметить, что в настоящее время все чаще используются и рекомендуются более низкие концентрации антикоагулянтов. Например, предлагаемые руководства, выпущенные в сентябре 1992 года подкомитетом Электролитов NCCZS (документ C31-P), рекомендуют использование гепарината в количестве приблизительно 15 МЕ/мл. Сообщалось также об эффективности еще более низких концентраций (например, менее 10 МЕ/мл). В самом деле, шприцы Sherwood Medical ABG обычно содержат 12 (+/-2) МЕ/мл гепарината. Использование таких низких уровней антикоагулянта также находится в рамках настоящего изобретения.
Заявленную антикоагулянтную композицию можно предварительно растворять перед ее контактом с образцом крови или, более предпочтительно, использовать ее в сухом виде для растворения при контакте с образцом крови. Наиболее предпочтительным является присутствие композиции в сухом виде в устройстве для взятия крови, например в капиллярной трубке, шприце или вакуумном контейнере. Таким образом, композиция является доступной для немедленного контакта со взятым образцом крови. Сухая форма заявленной композиции может присутствовать в устройстве для взятия крови в виде сухого твердого вещества (т. е. порошка) или в виде пленки или покрытия на стенках или других внутренних частях устройства для взятия крови. Например, композиция может располагаться на или внутри инертного носителя, такого, например, который раскрывается в патенте США N 4687000, включенном в настоящий документ в качестве ссылки.
Настоящее изобретение раскрывается далее посредством иллюстрирующих примеров. Эти примеры не являются и не должны истолковываться как ограничение рамок настоящего изобретения.
Пример 1. Приблизительно 1 кг гепарина (производства Viobin Corporation) растворяют для получения водного раствора с концентрацией от 30000 до 50000 ЕД/см3.
Подготавливают колонку с приблизительно 9 л ионообменной смолы IR-120 в водородной форме и отмывают достаточным количеством воды. Затем в колонку помещают раствор гепарина и контролируют pH вытекающей из колонки жидкости с помощью толуидинового синего. Кислотность вытекающей жидкости поддерживают на уровне 3 или менее. Вытекающую жидкость собирают. К собранной жидкости добавляют ацетат цинка дигидрат в количестве приблизительно от 3 до 7 г соли цинка на каждые 15 г исходного количества гепарин-натрия. Затем добавляют достаточное количество 10% водного раствора гидроксида лития так, чтобы полученный раствор имел pH приблизительно от 0,6 до 6,5. Затем раствор оставляют отстаиваться в течение ночи. На следующее утро раствор фильтруют через фильтр с размерами пор 0,22 мкм. Раствор затем высушивают с помощью Hull Lyophilizer и полученный продукт хранят при низкой влажности воздуха.
Пример 2. Основной раствор гепариновой композиции, полученной в примере 1, приготавливают путем растворения приблизительно 1440000 единиц фармакопеи США приблизительно в 1000 мл деионизированной воды. Полученный раствор содержит около 1440 единиц фармакопеи США/мл. 0,025 мл раствора гепарина с помощью пипетки помещают в шприц (марки ABG производства Sherwood Medical) со складками в его цилиндре в 45o. Затем раствор высушивают лиофилизацией. Сухие частицы гепарината в шприце содержат около 36±6 единиц фармакопеи США гепарината. Конечная концентрация гепарина в отобранных образцах крови в шприцах составляет, таким образом, приблизительно 12±2 единиц фармакопеи США/мл.
Эти шприцы затем используют для взятия крови. Шприцы заполняют полностью и/или частично кровью и образцы затем анализируют на содержание электролитов. Такие же количества крови собирают также в шприцы, содержащие гепарин, производства Radiometer A/S (типа Smooth-E Arterial Blood Sampler) и Sherwood Medical (типа ABG), а также в шприцы, не содержащие гепарината (контроль). Результаты испытаний и данные статистической обработки представлены в таблицах 1 - 3.
Вышеприведенные данные показывают, что образцы, взятые шприцом A, демонстрировали хорошие коэффициенты корреляции в отношении ионов кальция во всех образцах крови и приемлемые тангенсы угла наклона и отрезки, отсекаемые на оси координат. Таким образом, помехи, обусловленные гепарином, при определении концентрации ионизированного кальция, даже если доля гепарина существенно увеличивалась при частичном заполнении шприца кровью, уменьшались. Сходные результаты продемонстрировал шприц C. Как и ожидалось, шприцы, содержащие простой гепарин-литий (шприц B), демонстрировали значительно более низкие количества ионизированного кальция по сравнению с контролем, возможно благодаря связыванию ионов кальция гепарином.
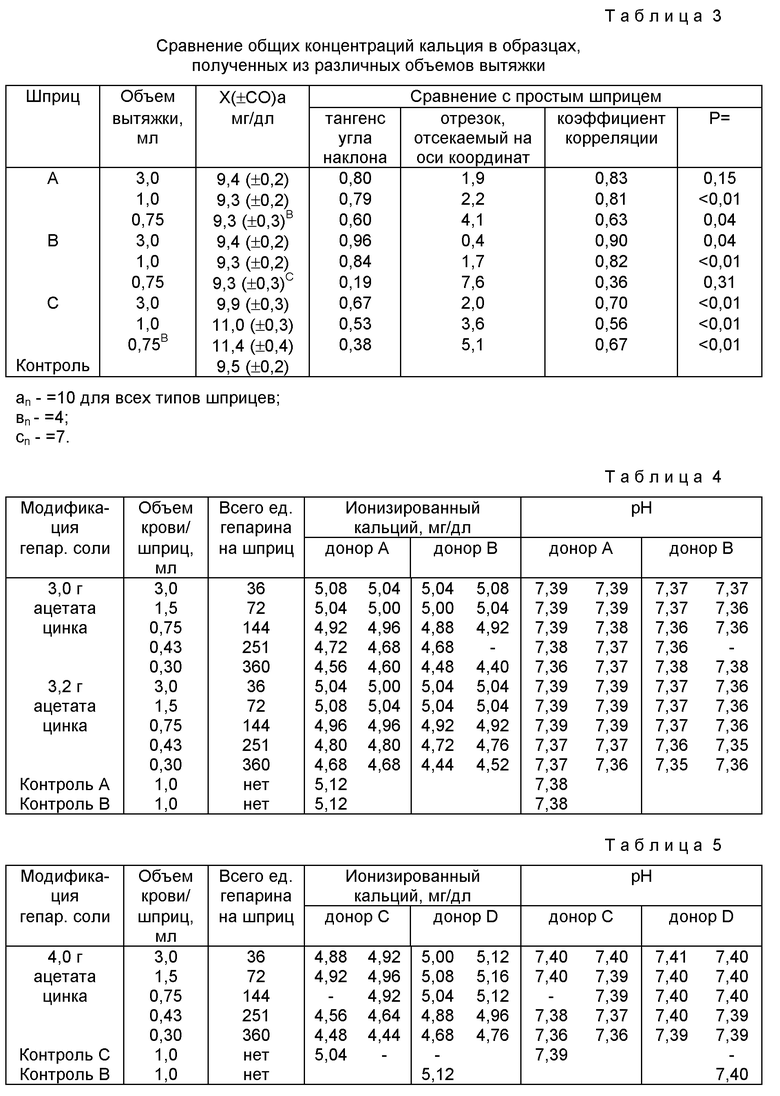
Пример 3. Процедура примера 2 была повторена за исключением того, что образцы анализировали скорее на содержание калия, нежели на содержание ионизированного кальция. Результаты примера 3 представлены в таблице 2.
Из средних значений, приведенных в таблице 2, можно видеть, что шприц A и шприц B демонстрировали удовлетворительные результаты по сравнению с контрольным шприцом как в образцах объемом в полную вытяжку, так и объемом в сокращенную вытяжку. Напротив, образцы, отобранные шприцом C, демонстрировали значительно более высокие концентрации ионов калия в образцах объемом в сокращенную вытяжку.
Пример 4. Процедура примера 2 была повторена за исключением того, что образцы исследовали скорее на общую концентрацию калия, чем на концентрацию ионизированного кальция. Результаты примера 4 представлены в таблице 3.
Как можно видеть из данных, приведенных в таблице 3, средние значения для шприцов A и B находились в пределах 0,2 мг/дл по сравнению со шприцом, даже при сокращенных объемах вытяжки. Напротив, использование шприца C дало результаты, которые были умеренно более высокими при полных объемах вытяжки и значительно более высокими при сокращенных объемах вытяжки. Это свидетельствует об искусственном увеличении значений общего кальция, связанном с использованием шприца C при сокращенном объеме вытяжки крови в качестве образца.
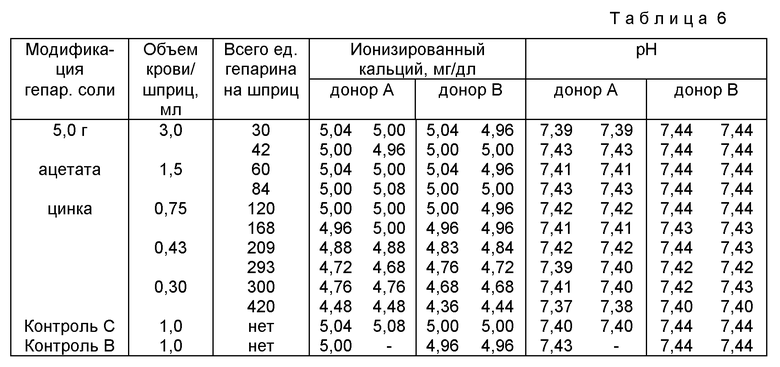
Пример 5. С помощью процедуры примера 1 были приготовлены четыре (4) отдельные партии гепариновой композиции, заявленной в настоящем документе. Партии отличались друг от друга только количеством добавленного ацетата цинка. Были использованы 3.0, 3.2, 4.0 и 5.0 г ацетата цинка на 15 г исходного гепарин-натрия.
Полученные гепариновые композиции затем поместили в 6 мл (3 мл вытяжки крови) шприцы для процедуры, описанной в примере 2. Затем набирали образцы цельной крови в разных количествах, указанных в таблицах 4 - 6. Названные образцы исследовали на концентрацию ионизированного кальция и pH. Результаты названных исследований также представлены в таблицах 4 - 6.
Результаты, представленные в таблицах 4-6, показывают, что эффективность заявленного антикоагулянта не снижает чрезмерным образом концентрации ионизированного кальция в образцах цельной крови. Как можно видеть, наилучшие результаты были получены при использовании наиболее предпочтительной композиции, т. е. той, которую приготавливали с использованием 5 г ацетата цинка на 15 г исходного гепарина.
Изобретение может использоваться в медицине и касается способа получения антикоагулянтной композиции, позволяющей проводить более точный анализ концентраций электролитов крови. Описываются также антикоагулянтная композиция, полученная по данному способу, и устройство, содержащее названную композицию, предназначенное для отбора образцов, а также для сбора крови. 3 с. и 7 з.п. ф-лы, 6 табл.
| US 4687000 A, 18.08.87 | |||
| Шланговое соединение | 0 |
|
SU88A1 |
| Линейная микроминиатюрная катушка индуктивности | 1973 |
|
SU454593A1 |
| RU 94015595 A1, 27.09.96. | |||
Авторы
Даты
2000-05-10—Публикация
1994-01-25—Подача