Данное изобретение относится к новым соединениям, обладающим противогипергликемической активностью. В частности, данное изобретение относится к новым 5-[3-арилпроп-2-инил] -5-(арилсульфонил) тиазолидин-2,4-дионам и 5-[3-арилпроп-2-инил] -5-(арилсульфанил)тиазолидин-2,4-дионам и их производным для понижения уровня глюкозы в крови у гипергликемических млекопитающих, которые используются при лечении инсулин-независимого (тип 2) сахарного диабета, предпочтительно у людей.
Предпосылки изобретения
Лечение инсулин-независимого сахарного диабета (тип 2 диабета) обычно состоит из лечебной схемы питания и физической нагрузки, приема оральных гипергликемических средств и, в более серьезных случаях, инсулина. Обычно используемыми оральными средствами являются сульфонилмочевины и бигуаниды. Хотя сульфонилмочевины являются ценными для лечения диабета типа 2, они могут вызывать приступы гипогликемии и демонстрируют другие токсические проявления, которые ограничивают их применение. Они также имеют склонность к высокой частоте первичных и вторичных нарушений эффективности их действия (срывы компенсации). Аналогично, использование бигуанидов снижается из-за их ассоциации с инцидентами токсического молочнокислого ацидоза. Непрерывная потребность в новых гипогликемических средствах, которые могли быть менее токсичными и более эффективными, совершенно очевидна.
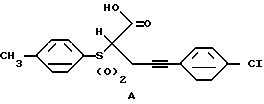
5-[1 и 2-нафталинил)сульфонил]-2,4-тиазолидиндионы (Zask and Jirkovsky патент США 4997948, 1991), 5-[1 и 2-нафталинил)тио]-2,4-тиазолидиндионы (Zask and Jirkovsky патент США 5068342, 1991) и 5-[арилсульфонил]-2,4-тиазолидиндионы (Zask et al, J.Med.Chem. 1990, 33, 1418-1423) были ранее описаны как противодиабетические средства. Соединения по данному изобретению (1) отличаются тем, что они также содержат 5-[3-арилпроп-2-инил] группу. Эта последняя часть повышает противодиабетическую эффективность 5-арилсульфонил-2,4-тиазолидиндионов. 2-[(4-Метилфенил)сульфонил]-5-фенилпент-4-иновая кислота (BM13907), (A) (Wolff, et al, патент США 4933367, 1990; Freund, et al. Arch. Pharmacol. 1989, 340 (suppl R40) Abstract 117; Obermaier-Kusser Biochem. J. 1989, 261, 699) была также описана как противодиабетическое средство. Соединения по данному изобретению (1) отличаются тем, что они содержат 2,4-тиазолидиндионовое кольцо вместо карбоксильной группы A.
В других публикациях заявляются соединения, которые содержат 2,4-тиазолидиндионовое кольцо и которые также проявляют противодиабетическую активность. К ним относятся циглитазон (ciglitazone) (патент США N 4461902; Sohda, et al, Chem.Pharm.Bull. 1982, 30, 3580) и ряд более сильнодействующих аналогов: пиоглитазон (Sohda, et al, Arzneim. Forsch. Drug.Res. 1990, 40, 37), энглитазон (Stevenson, et al, Metabolism 1991, 40, 1268); CS-045 (Metabolism 1991, 40, 1213) и другие (Hulin, et al, J.Med.Chem. 1992, 35, 1853; Sohda, et al, J.Med.Chem. 1992, 35, 2671). Ни одно из 2,4-тиазолидиндионсодержащих соединений из вышеуказанных публикаций не содержит 5-(арилсульфонил), 5-(арилсульфанил) или 5-[3-арилпроп-2-инил] группы, которые есть у соединения по данному изобретению.
Соединения, в которых сера присоединена по 5-положению 2,4-тиазолидиндионового кольца, были описаны (Japan Kokai 7840, 770; Japan Kokai 7846, 973; Микробиол. Ж. (Киев) 1970, 32, 518-520 (Укр.); Ger.Offen.DE 3045059), но они отличаются от соединений по данному изобретению тем, что азот 2,4-тиазолидиндионового кольца замещен или сера находится в виде сульфоновой кислоты. Помимо того, эти соединения не являются сульфонами и не содержат нафталинового кольца. Кроме того, эти соединения заявляются как имеющие только противогнилостные свойства или как являющиеся антибиотиками.
Описание изобретения
Это изобретение относится к новым 5-[3-арилпроп-2-инил]-5- (арилсульфонил)тиазолидин-2,4-дионам и 5-[3-арилпроп-2-инил]-5- (арилсульфанил)тиазолидин-2,4-дионам формулы (I). Эти соединения обладают противогипергликемической активностью, которая была продемонстрирована по их способности понижать уровни глюкозы в плазме у db/db (C57BLC/KsJ) мыши и понижать уровни глюкозы в плазме и уровни инсулина у ob/ob (C57Bl/6J) мыши. Обе являются моделями инсулин-независимого (тип 2) сахарного диабета.
Соединения по данному изобретению характеризуются общей формулой (I), представленной ниже, где Ar обозначает фенил, 2-нафтил, алкилзамещенный фенил, алкоксизамещенный фенил, галогензамещенный фенил, 2-пиридинил, замещенный 2-пиридинил, 3-пиридинил, 4-пиридинил, 2-хинолинил, 2-пиримидинил, 2-бензоксазолил, 2-бензтиазолил, 2-бензимидазолил, 2-фуранил, 2-бензо[b]фуранил, 2-тиенил, 2-бензо[b]тиенил, n равен 0 или 2; Ar' представляет фенил, алкилзамещенный фенил, перфторалкилзамещенный фенил, галогензамещенный фенил, алкоксизамещенный фенил, перфторалкоксизаметенный фенил и алкилтиозамещенный фенил.
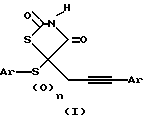
Предпочтительные соединения данного изобретения включают соединения формулы (I), где Ar обозначает фенил, алкилзамещенный фенил, галогензамещенный фенил или 2-пиридинил, n равен 2; и Ar' обозначает фенил, галогензамещенный фенил и перфторалкоксизамещенный фенил.
К наиболее предпочтительным соединениям данного изобретения относятся:
5-[3-(4-Хлорфенил)проп-2-инил] -5-(пиридин-2-сульфонил)тиазолидин- 2,4-дион;
5-[3-(4-Фторфенил)проп-2-инил] -5-(пиридин-2-сульфонил)тиазолидин- 2,4-дион;
5-[3-(4-Хлорфенил)проп-2-инил] -5-(4-фторбензолсульфонил)тиазолидин- 2,4-дион;
5-(4-Фторбензолсульфонил)-5-[3-(4-Фторфенил)проп-2-инил] тиазолидин- 2,4-дион;
5-Бензолсульфонил-5-[3-(4-хлорфенил)проп-2-инил]тиазолидин- 2,4-дион;
5-Бензолсульфонил-5-[3-(3,5-бис-трифторметилфенил)проп- 2-инил]тиазолидин-2,4-дион;
5-[3-(4-Хлорфенил)проп-2-инил] -5-(4-хлорбензолсульфонил)тиазолидин- 2,4-дион;
5-[3-(4-Бромфенил)проп-2-инил]-5-(толуол-4-сульфонил)тиазолидин- 2,4-дион;
5-[3-Фенил-проп-2-инил]-5-(толуол-4-сульфонил)тиазолидин-2,4-дион;
Соединения по данному изобретению могут быть получены по способам, описываемым в общих чертах схемами с 1 по V, первая из которых представлена ниже:
Схема I
В схеме I соответствующий коммерчески доступный арилтиол формулы (II) подвергают взаимодействию с основанием и последующий комплекс подвергают взаимодействию с одним или более эквивалентами 5-бромтиазолидин-2,4-диона (Zask et al. , J.Med.Chem., 1990, 33, 1418-1423), получая 5-арилсульфанилтиазолидин- 2,4-дион формулы (III). Реакцию обычно осуществляют в апротонном растворителе, таком как ТГФ или гексан, используя 2 или более эквивалентов сильного основания амида металла, такого как литийдиизопропиламид или литийбис(триметилсилил)амид, при низких температурах (например, от 0 до -78oC) с последующим нагреванием до температуры окружающей среды или более высокой температуры в течение от 1 до 10 часов. Альтернативно, соединение формулы (III) можно получить в протонном растворителе, таком как вода или низкомолекулярный спиртовой растворитель. В тех случаях, когда реакцию проводят таким способом, арилтиол формулы (I) подвергают взаимодействию с 2 или более эквивалентами карбоната или бикарбоната щелочного металла, такого как карбонат натрия или бикарбонат калия, при 0oC до комнатной температуры. Добавляют один или более эквивалентов 5-бромтиазолидин-2,4-диона и продолжительность реакции варьируют от 1 до 2 дней.
Соединение формулы (III) затем может быть окислено, чтобы получить 5-арилсульфонилтиазолидин-2,4-дион формулы (V). Следуя методике Zask et al., (J. Med.Chem. 1990, 33, 1418-1423), это окисление обычно проводят, используя избыток (от 2 до 20 эквивалентов) водного пероксида водорода в уксусной кислоте, при температуре реакции от температуры окружающей среды или выше (от 30o до 80oC) в течение от 1 до 10 часов. Альтернативно, необходимое окисление можно эффективно осуществить при помощи пероксимоносульфата калия. Пероксимоносульфат калия (KHSO5) поставляется коммерчески в виде 2:1:1 комплекса с инертными ингредиентами, калий кислый сульфат (KHSO4) и калий сульфат (K2SO4). Этот комплекс поставляют под торговым названием оксон. Соединение формулы (III) растворяют в низкомолекулярном спиртовом растворителе, таком как метанол, и добавляют к водному раствору оксона, который содержит 2 или более эквивалента активного ингредиента KHSO5. Температуру реакции можно варьировать от 0oC до 50oC и продолжительность реакции можно варьировать от 30 мин. До 2 дней. Другая альтернатива, для превращения соединения формулы (III) в соединение формулы (V) можно использовать реагент надбензойную кислоту, такую как метахлориднадбензойная кислота. Два или более эквивалента надбензойной кислоты используют, предпочтительно в галогенуглеводородном растворителе, таком как хлороформ, при температуре окружающей среды в течение периода времени от 1 часа до нескольких дней.
Соединение формулы (V) можно также получить путем взаимодействия одного или более эквивалентов арилсульфината щелочного металла формулы (IV) с 5-бромтиазолидин-2,4-дионом. Подходящими растворителями для этого превращения являются полярные апротонные растворители, такие как ДМФ, ТГФ и протонные растворители, такие как низкомолекулярные спирты или вода. Альтернативно, арилсульфинаты щелочного металла формулы (IV) могут быть подвергнуты взаимодействию с 5-бромтиазолидин-2,4-дионом, используя межфазный катализатор Aliquat 336 (хлорид трикаприлилметиламмония) по способу G.Baum, et al. (Synthesis 1987, 56-59).
Сульфинат щелочного металла формулы (IV) может быть получен путем окисления арилтиола формулы (II) 2 эквивалентами водного пероксида водорода в присутствии гидроксида щелочного металла, такого как гидроксид натрия, в воде или в водном низкомолекулярном спиртовом растворителе. Арилсульфинат щелочного металла формулы (IV) можно получить путем восстановления арилсульфонилхлорида формулы (XI). Это превращение наиболее удобно проводить, используя способ Chew Lee and Lamar Field (Synthesis 1990, 391-397), согласно которому сульфонилхлорид формулы (XI) подвергают взаимодействию с двумя эквивалентами п-тиокрезола и двумя эквивалентами триэтиламина в дихлорметане при от -78oC до комнатной температуры. Арилсульфиновую кислоту, полученную при обработке водной кислотой, подвергают затем обработке гидроксидом щелочного металла с получением арилсульфината щелочного металла формулы (IV).
Соединения формулы (V) имеют два основных участка, которые могут быть алкилированы алкилирующими агентами в присутствии основания. Этими участками являются C-5 углеродный атом тиазолидиндиона и атом азота тиазолидиндиона. Требуемым участком алкилирования для соединений данного изобретения является C-5 атом углерода соединения (V). Для того чтобы предотвратить потенциальную конкуренцию алкилирования при атоме азота соединения (V), атом азота можно защитить подходящей защищающей алкилирование группой. Тритил(трифенилметан)группа выполняет такую функцию. Тритилгруппу вводят путем взаимодействия соединения формулы (V) с одним молярным эквивалентом хлорида трифенилметана в присутствии одного молярного эквивалента третичного аминового основания, такого как триэтиламин, предпочтительно в галогенуглеродном растворителе при 0oC или при температуре окружающей среды.
Схема II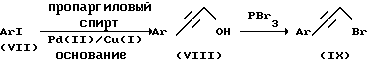
В схеме II (3-арилпроп-2-инил) бромиды формулы (IX) можно получить при помощи двустадийного способа из коммерчески доступных арилйодидов формулы (VII). На первой стадии соединение формулы (VIII) получают путем взаимодействия соединения формулы (VII) с одним или более эквивалентами пропаргилового спирта в присутствии каталитического количества палладиевого (II) реагента, такого как дихлорбис(трифенилфосфин) палладий (II) и каталитического количества реагента меди (I), такого как йодид меди (I). Эту реакцию проводят также в присутствии одного или более эквивалентов вторичного или третичного амина, такого как диэтиламин или триэтиламин. Вторичный или третичный амин может быть использован в качестве растворителя или может быть использован галогенуглеродный растворитель, такой как хлороформ. Обычно используют температуры реакции в области от температуры окружающей среды вплоть до 80oC; и времена реакции варьируют от 1 часа до 2 дней. Соединение формулы (IX) наиболее удобно получать из соединения формулы (VIII) путем взаимодействия (VIII) с 0,5 до одного молярного эквивалента трехбромистого фосфора в сухом эфирном растворителе, содержащем пиридин. Эту реакцию наиболее удобно проводить при температуре в диапазоне от 0oC до комнатной в течение периода времени от 1 часа до 30 часов.
Соединения формулы (I) затем получают путем алкилирования соединений формулы (III), (V) или (VI) с помощью соединений формулы (IX).
Что касается схемы (III):
Схема III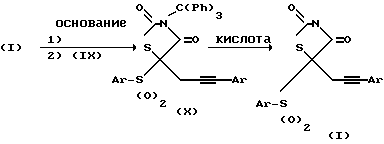
Тиазолидиндионовый C-5 водород соединения (VI) удаляют путем действия одного или более эквивалентов основания. Обычно используемые основания включают гидриды щелочного металла, такой как гидрид натрия, алкилы щелочного металла, такой как бутил лития или амиды щелочного металла, такой как литийдиизопропиламид. Подходящие растворители включают ТГФ или ДМФ, причем температуры варьируют в диапазоне от -78oC до комнатной температуры. После депротонизации соединения формулы (VI) вводят бромид формулы (IX) и реакционную смесь обычно перемешивают при 0oC или комнатной температуре в течение от 1 до 48 часов, получая соединение формулы (X). Затем соединение формулы (X) обрабатывают кислотой, чтобы удалить трифенилметановую защитную группу. Типичные кислоты включают один или более эквивалентов трифторуксусной кислоты или муравьиной кислоты. Эту кислоту можно использовать в качестве растворителя или обычно применяют галогенуглеродный растворитель, такой как дихлорметан. Эту реакцию удобно проводить при 0oC или комнатной температуре в течение периодов времени от 10 мин до 2 часов.
Что качается схемы IV
Схема IV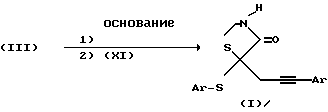
5-[3-арилпроп-2-инил] -5-(арилсульфанил)тиазолидин-2,4-дионы можно получить путем взаимодействия соответствующих 5-(арилсульфанил)тиазолидин-2,4-дионов формулы (III) с 2 или более эквивалентами основания. Два эквивалента основания вызывают депротонирование как атома азота тиазолидиндиона, так и при C-5 положении с образованием дианиона. К обычным основаниям, которые осуществляют это депротонирование, относятся гидриды щелочного металла, такие как гидрид натрия, алкилы щелочного металла, такие как бутил лития или основания амидов щелочного металла, такие как литий диизопропиламид или литий бис(триметилсилил)амид. К удобным растворителям относятся ТГФ для основания амидов щелочного металла и ТГФ или ДМФ для оснований гидридов щелочного металла. Температуры реакции варьируют в диапазоне от -78oC до комнатной температуры. Спустя 2 минуты до 1 часа после введения основания в реакционную смесь добавляют один или более эквивалентов соответствующего (3-арилпроп-2-инил) бромида формулы (IX) и реакционную смесь перемешивают при 0oC или комнатной температуре в течение периода времени от 1 часа до 3 дней. Алкилирование происходит исключительно по C-5 атому углерода тиазолидиндиона с получением 5-[3-арилпроп-2-инил] -5-(арилсульфанил)тиазолидин-2,4-диона формулы (I).
Что качается схемы V:
Схема V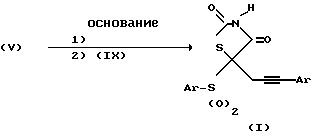
5-[3-арилпроп-2-инил] -5-(арилсульфонил)тиазолидин-2,4-дионы можно получить путем взаимодействия соответствующих 5-(арилсульфонил)тиазолидин-2,4-дионов формулы (V) с 2 или более эквивалентами основания. Два эквивалента основания вызывают депротонирование как атома азота тиазолидиндиона, так и C-5 положения тиазолидиндиона с образованием дианиона. Обычными основаниями, которые выполняют это депротонирование, являются гидриды щелочного металла, такие как гидрид натрия, алкилы щелочного металла, такие как бутил лития или основания амидов щелочного металла, такие как литий диизопропиламид или литийбис(триметилсилил)амид. К удобным растворителям относятся ТГФ для основания амидов щелочного металла и ТГФ или ДМФ для оснований гидридов щелочного металла. Температуры реакции варьируют в диапазоне от -78oC до комнатной температуры. От 2 до 1 часа после введения основания в реакционную смесь добавляют один или более эквивалентов соответствующего (3-арилпроп-2-инил)бромида формулы (IX) и реакционную смесь перемешивают при 0oC или комнатной температуре в течение периода времени от 1 часа до 3 дней. Алкилирование происходит исключительно по C-5 атому углерода тиазолидиндиона с получением 5-[З-арилпроп-2-инил]-5- (арил-сульфонил)тиазолидин-2,4-диона формулы (I).
Соединения по данному изобретению можно получить по способу, который включает взаимодействие соединения, имеющего формулу B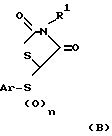
где Ar и n такие, как определено выше, и R1 обозначает водород или удаляемую защитную группу, с соединением, имеющим формулу C
R2-CH2-C≡CAr1 (С)
где Ar такой, как определен выше, и R2 обозначает отщепляемую группу в присутствии основания, так, чтобы ввести заместитель 3-арилпроп-2-инил по C-5 атому углерода тиазолидиндиона и когда целесообразно удаление указанной удаляемой защитной группы, и когда требуется извлечение соединения, имеющего формулу I в виде его фармацевтически приемлемой соли. В случае, когда R1 является водородом, способ может быть выполнен, как описано ниже в схеме IV или V. В этом случае следует отметить, что используемое основание должно быть сильным основанием, т.е. достаточно сильным, чтобы вызывать депротонирование в С-5 положении тиазолидиндионового кольца, а также при атоме азота тиазолидиндионового кольца. Другой метод осуществления способа изобретения включает взаимодействие соединения формулы B, где R1 обозначает защитную группу, с соединением, имеющим формулу C. Это может быть выполнено по способу, описанному здесь ниже, ссылаясь на схему III. Получение 5-(арилсульфонил)- 3-(трифенилметил)тиазолидин-2,4-дионов (VI), используемых как описано в схеме III, может быть выполнено как описано в схеме I. Если конечное соединение должно иметь формулу I, где n равно 0, то способ может быть осуществлен, используя соединение, имеющее формулу (III) вместо соединения, имеющего формулу (V), в реакции с трифенилметанхлоридом в присутствии одного молярного эквивалента основания и используя полученный 5-(арилсульфенил)-3-тритилтиазолидин-2,4-дион вместо соединения формулы (VI).
Данное изобретение также включает способ понижения уровня глюкозы в крови у гипергликемического млекопитающего, включающий введение такому млекопитающему эффективного количества одного или более соединений, описанных здесь в качестве эффективных для снижения глюкозы в крови. Этот способ может рассматриваться как способ лечения гипергликемии у млекопитающего, который включает введение такому млекопитающему эффективного количества одного или более соединений, описанных здесь в качестве эффективных для снижения глюкозы в крови. Млекопитающим, которых лечат таким образом, предпочтительно является человек. Соединения по данному изобретению могут также использоваться в качестве средств для лечения гиперлипидемии и осложнений диабета (например, невропатия, нефропатия, ритинопатия, катаракты). Соединения по данному изобретению, чтобы повысить эффективность, могут быть использованы также в сочетании с инсулином, сульфонилмочевинами, бигуанидами, ингибиторами альдоредуктазы и гиполипидемическими средствами.
Дозы соединений, представленных здесь, будут зависеть от конкретного выбранного соединения и формы введения. Кроме того, она будет зависеть от конкретного хозяина, подлежащего лечению. Обычно соединения по данному изобретению вводятся при уровне концентраций, которые дают защитное действие без каких-либо вредных побочных воздействий. Например, эффективное количество соединения можно обычно варьировать от около 10 до около 250 мг/кг веса тела в день, назначенное один раз в день или разделенное на два-четыре приема в неделю. Оптимальная доза для индивидуального субъекта, подлежащего лечению, должна определяться лицом, ответственным за лечение, причем обычно сначала назначают более маленькие дозы, а в последующем увеличения в дозировке делаются с целью определения наиболее подходящей дозировки.
Данное изобретение охватывает также фармацевтические композиции, используемые для понижения уровня глюкозы в крови. Среди них - композиции, содержащие смесь одного или более описанных здесь соединений или фармацевтически приемлемых солей, и фармацевтически приемлемый носитель, композиции могут применяться путем тех же самых способов введения, как и сами соединения.
Соединения по данному изобретению могут образовывать соли с подходящими терапевтически приемлемыми неорганическими и органическими основаниями. Эти полученные соли обладают той же самой активностью, что и родственная кислота, и они включены в объем данного изобретения. К подходящим неорганическим основаниям, которые образуют соли, относятся, например, гидроксиды, карбонаты или бикарбонаты терапевтически приемлемых щелочных металлов и щелочноземельных металлов, таких как литий, натрий, калий, магний, кальций и т. п. К подходящим органическим основаниям относятся первичные вторичные амины, такие как метиламин, бензатин (N,N'-дибензилэтилендиамин), холин, диэтаноламин, этилендиамин, меглумин (N-метилглукамин), бенетамин (N-бензилфенэтиламин), диэтиламин, пиперазин, трометамин (2-амино-2-гидроксиметил-1,3-пропандиол), прокаин и т.д. Кроме того, можно упомянуть четвертичные соли, например, тетраалкил (например, тетраметил), алкилалканол (например, метилтриэтанол) и циклические (например, N,N'-диметилморфолин) соли аммония. В принципе, однако, могут быть использованы все аммонийные соли, если они физиологически совместимы.
Преобразования в соответствующие соли легко осуществляются путем взаимодействия кислотной формы соединений с соответствующим основанием, обычно один эквивалент, в сорастворителе. Соль выделяют путем концентрирования досуха или путем добавления не растворителя. Например, в случае неорганических солей, предпочтительно растворять кислоту или соединение в воде, содержащей гидроксид, карбонат или бикарбонат, соответствующий требуемой неорганической соли. Выпаривание раствора или добавление смешивающегося с водой растворителя более умеренной полярности, например, низшего спирта, такого как бутанол, или низшего алканона, такого как этилметилкетон, приводит к получению твердой неорганической соли. В случае соли амина предпочтительно использовать сорастворитель умеренной или низкой полярности, такой как этанол, этилацетат или бензол. Выпаривание растворителя или добавление смешивающегося растворителя более низкой полярности, такого как бензол или н-гексан, приводит к получению твердой соли. Четвертичные аммонийные соли можно получить путем смешения кислоты соединения с четвертичным аммониевым гидроксидом в водном растворе с последующим выпариванием воды.
Соединения по данному изобретению могут клинически вводиться млекопитающим, включая человека, либо оральным, либо парентеральным путем. При оральном введении возможно либо введение соединения одного, либо в сочетании с твердым или жидким фармацевтически приемлемым носителем или разбавителем, таким как крахмал, молоко, сахар, некоторые типы глины, вода, растительное или минеральные масла и так далее, в виде таблеток, капсул, порошков, сиропов, растворов, суспензий и т.п. Для парентерального введения активное соединение можно использовать в сочетании с водной или органической средами, с образованием инъецируемых растворов или суспензий. Например, растворы в кунжутном масле или масле земляного ореха, водные растворы воды и растворимых фармацевтически приемлемых солей соединений. Инъецируемые растворы, полученные таким способом, могут вводиться внутривенно, внутрибрюшинно, подкожно или внутримышечно. Соединения по данному изобретению могут вводиться также в виде суппозиториев. Нижеследующие не ограничивающие примеры более подробно иллюстрируют данное изобретение.
Пример 1
5-(Толуол-4-сульфанил)тиазолидин-2,4-дион, (III)
К раствору 5-бромтиазолидин-2,4-диона (5,0 г, 25,5 ммоль, Zask et al., J.Med.Chem. 1990, 33, 1418-1423) и п-тиокрезола [(II), 3,17 г, 25,5 ммоль] в сухом ТГФ (200 мл) при -78oC добавляют по каплям литийбис(триметилсилил)амид (1,0 М в гексане, 56 мл, 56 ммоль). После 30 мин реакционную смесь нагревают до комнатной температуры. Спустя еще час добавляют 2н HCl до pH 1. Слои разделяют, и водную фазу экстрагируют этилацетатом (3 х 300 мл). Объединенную органическую фазу сушат (MgSO4), концентрируют и подвергают флэш-хроматографии (3:2 петролейный эфир:этилацетат), получая названное соединение в виде белого твердого вещества (4,4 г, 72%): т.пл. 124-126oC; ЯМР (CDCl3): δ 8,08 (с, 1H,  7,48 (д, J = 8,7 Гц, 2Н,
7,48 (д, J = 8,7 Гц, 2Н, 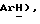 7,18 (д, J = 8,7 Гц, 2H,
7,18 (д, J = 8,7 Гц, 2H, 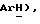 5,32 (с, 1H,
5,32 (с, 1H,  МС (ЭИ): 239 (MI, 90%), 196 (18%), 123 (100%).
МС (ЭИ): 239 (MI, 90%), 196 (18%), 123 (100%).
Пример 2
5-(Пиридин-2-сульфанил)тиазолидин-2,4-дион, (III)
К раствору 5-бромтиазолидин-2,4-диона (28,24 т, 0,144 моль) и 2-меркаптопиридина [(II), 16,00 г, 0,144 моль] в сухом ТГФ (200 мл) при -78oC добавляют по каплям литийбис(триметилсилил)амид (1,0 М в гексане, 317 мл, 0,317 моль) в течение периода около 40 мин. После 30 мин реакционную смесь нагревают до комнатной температуры. Еще через 3 часа добавляют 10% HCl до pH 1. Слои разделяют, и водную фазу экстрагируют этилацетатом (2 х 500 мл). Объединенную органическую фазу промывают водой (500 мл), солевым раствором (500 мл), сушат (MgSO4) и концентрируют, получая названное соединение в виде зеленого твердого вещества (30,45 г, 93%): т.пл. 118-120oC; ЯМР (ДМСО, d6): δ 12,35 (с, 1H, 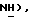 8,39 (д, J = 5,3 Гц, 1H,
8,39 (д, J = 5,3 Гц, 1H, 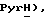 7,69 (дд, J = 7,3, 8,3 Гц, 1H,
7,69 (дд, J = 7,3, 8,3 Гц, 1H, 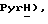 7,42 (д, J = 8,3 Гц, 1H,
7,42 (д, J = 8,3 Гц, 1H, 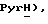 7,19 (дд, J = 5,3, 7,3 Гц, 1H,
7,19 (дд, J = 5,3, 7,3 Гц, 1H, 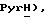 6,31 (с, 1H,
6,31 (с, 1H,  МС (ЭИ): 226 (MI, 12%), 155 (10%), 79 (100%); Анал. (C8H6N2O2S2): C, H, N.
МС (ЭИ): 226 (MI, 12%), 155 (10%), 79 (100%); Анал. (C8H6N2O2S2): C, H, N.
Используя методику, описанную в примере 1, соединения формулы (III), примеры 3 и 4, получают из соответствующего арилмеркаптана формулы (II) и 5-бромтиазолидин-2,4-диона.
Пример 3
5-(Хинолин-2-сульфанил)тиазолидин-2,4-дион, (III)
Из 2-хинолинтиола: т.пл. 227-229oC.
Пример 4
5-(Нафталин-2-сульфанил)тиазолидин-2,4-дион, (III) (Известно: Zask et al., J.Med.Chem. 1990, 33, 1418-1423).
Пример 5
5-(4-Фторфенилсульфанил)тиазолидин-2,4-дион, (III)
5-(Бромтиазолидин-2,4-дион (15,0 г, 76,5 ммоль) добавляют при 0oC к механически перемешиваемому раствору 4-фтортиофенола [(II), 9,8 г, 76,5 ммоль] , карбоната натрия (27,75 г, 262 ммоль) и воды (120 мл). После 16 часов реакционную смесь разбавляют водой (500 мл), подкисляют конц. HCl до pH 1 и фильтруют. Полученное твердое вещество промывают водой и петролейным эфиром и сушат в вакууме, получая названное соединение в виде белого твердого вещества (14,05 г, 75%): т.пл. 99-100oC; ЯМР (ДМСО, В6): δ 12,14 (с, 1H, 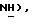 7,66 (т, J = 8,0 Гц, 2H,
7,66 (т, J = 8,0 Гц, 2H, 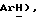 7,29 (т, J = 8,5 Гц, 2H,
7,29 (т, J = 8,5 Гц, 2H, 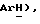 6,05 (с, 1H,
6,05 (с, 1H,  МС (ЭИ): 243 (MI, 100%), 200 (30%), 128 (60%), 127 (50%); Анал. (C9H6FNO2S2): C, H, N.
МС (ЭИ): 243 (MI, 100%), 200 (30%), 128 (60%), 127 (50%); Анал. (C9H6FNO2S2): C, H, N.
Используя методику, описанную в примере 5, соединения формулы (III), примеры 6-10, получают из соответствующего арилмеркаптана формулы (II) и 5-бромтиазолидин-2,4-диона.
Пример 6
5-(Бензолсульфанил)тиазолидин-2,4-дион, (III)
Из тиофенола: т.пл. 103-107,5oC.
Пример 7
5-(4-Хлорфенилсульфанил)тиазолидин-2,4-дион, (III)
Из 4-хлортиофенола: т.пл. 109-110oC.
Пример 8
5-(4-Бромфенилсульфанил)тиазолидин-2,4-дион, (III)
Из 4-бромтиофенола: т.пл. 115-117oC.
Пример 9
5-(4-Метоксифенилсульфанил)тиазолидин-2,4-дион, (III)
Из 4-метокситиофенола: т.пл. 89-91oC.
Пример 10
5-(Толуол-3-сульфанил)тиазолидин-2,4-дион, (III)
Из м-тиокрезола: т.пл. 61,5-64oC.
Пример 11
5-(4-Фторфенилсульфанил)тиазолидин-2,4-дион, (V)
30% пероксид водорода (50,4 мл, 0,489 моль) добавляют по каплям в течение 1 час 20 мин к механически перемешиваемому раствору 5-(4-Фторфенилсульфанил)тиазолидин-2,4-диона [(III), из примера 5, 11,9 г, 48,9 ммоль] в ледяной уксусной кислоте (457 мл) при 60oC. Спустя 3 часа реакционную смесь охлаждают до температуры окружающей среды и концентрируют. Остаток распределяют между водой и этилацетатом. Слой этилацетата сушат (MgSO4) и концентрируют, получая названное соединение в виде белого твердого вещества (10,9 г, 81%): т.пл. 190- 196oC; ЯМР (ДМСО, d6): δ 12,78 (ш.с, 1H, 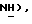 8,00 (м, 2H,
8,00 (м, 2H,  7,58 (т, J = 8,9 Гц, 2H,
7,58 (т, J = 8,9 Гц, 2H, 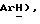 6,70 (с, 1H,
6,70 (с, 1H, 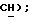 МС (СИ): 276 (М+Н, 100%); Анал. (C9H6FNO4S2): C, H, N.
МС (СИ): 276 (М+Н, 100%); Анал. (C9H6FNO4S2): C, H, N.
По методике, описанной в примере 11, соединения формулы (V), примеры 12-14, получают из соответствующего 5-(арилсульфанил)тиазолидин-2,4-диона формулы (III).
Пример 12
5-(Толуол-4-сульфонил)тиазолидин-2,4-дион, (V)
Получен из 5-(толуол-4- сульфанил)тиазолидин-2,4-диона, (III) примера 1: т.пл. 73-75oC.
Пример 13
5-(Нафталин-2-сульфонил)тиазолидин-2,4-дион, (V)
(Известен: Zask et al., J.Med.Chem. 1990, 33, 1418-1423).
Пример 14
5-(4-Хлорфенилсульфонил)тиазолидин-2,4-дион, (V)
Получен из 5-(4-хлорфенилсульфанил)тиазолидин-2,4-диона, (III) примера 7: т.пл. 143-144,5oC.
Пример 15
5-(Бензолсульфонил)тиазолидин-2,4-дион, (V)
Раствор 5-(бензолсульфанил)тиазолидин-2,4-диона, [(III), пример 6, 10,0 г, 41,8 ммоль] в метаноле (105 мл) добавляют к механически перемешиваемой суспензии оксона (51,4 г, 83,6 ммоль) в воде (210 мл) при 0oC. Суспензию сразу нагревают до комнатной температуры. Спустя 3,5 часа реакционную смесь разбавляют водой (1,5 л) и твердое вещество отфильтровывают. Твердое вещество промывают водой и сушат в вакууме, получая названное соединение в виде белого твердого вещества (8,31 г, 73%); т.пл. 130-133oC; ЯМР (CDCl3): δ 8,07 (с, 1H, 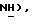 7,98 (д, J = 7,2 Гц, 2H,
7,98 (д, J = 7,2 Гц, 2H, 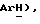 7,78 (т, J = 7,5 Гц, 1H,
7,78 (т, J = 7,5 Гц, 1H, 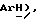 7,67 (т, J = 8,1 Гц, 2H,
7,67 (т, J = 8,1 Гц, 2H, 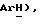 5,44 (с, 1H,
5,44 (с, 1H, 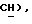 МС (ЭИ): 225 (MI, 24%), 182 (18%), 153 (12%), 110 (100).
МС (ЭИ): 225 (MI, 24%), 182 (18%), 153 (12%), 110 (100).
По методике, описанной в примере 15, соединения формулы (V), примеры 16-18, получают из соответствующего 5-(арилсульфанил)тиазолидин-2,4-диона формулы (III).
Пример 16
5-(4-Бромфенилсульфонил)тиазолидин-2,4-дион, (V)
Получен из 5-(4-бромфенилсульфанил)тиазолидин-2,4-диона, (III) примера 8: т.пл. 156-158oC.
Пример 17
5-(4-Метоксифенилсульфонил)тиазолидин-2,4-дион, (V)
Получен из 5-(4-метоксифенилсульфонил)тиазолидин-2,4-диона, (III) примера 9: т.пл. 93-95oC.
Пример 18
5-(Толуол-3-сульфонил)тиазолидин-2,4-дион, (V)
Получен из 5-(толуол)-3-сульфанил)тиазолидин-2,4-диона, (III) примера 10: т.пл. 96-100oC.
Пример 19
5-(Пиридин-2-сульфонил)тиазолидин-2,4-дион, (V)
м-Хлорнадбензойную кислоту (25,7 г, 146 ммоль) добавляют частями в течение 30 мин к перемешиваемой суспензии 5-(пиридин-2-сульфанил)тиазолидин-2,4-диона [(III), пример 2, 15,0 г, 66,3 ммоль] в хлороформе (600 мл) при комнатной температуре. Через 18 часов добавляют еще м-хлорнадбензойную кислоту (4,65 т, 26,4 ммоль) и реакционную смесь перемешивают дополнительно в течение 6 ч. Реакционную смесь охлаждают в бане со льдом и полученное твердое вещество (18,7 г) отфильтровывают. 10 т, часть полученного твердого вещества, очищают с помощью флэш-хроматографии (9:1 CH2Cl2:ацетонитрил), получая названное соединение в виде белого твердого вещества (4,18 г, 46%): т. пл. 129-131oC; ЯМР (ДМСО, d6): δ 12,00 (ш.с, 1H,  8,85 (д, J = 4,0 Гц, 1H,
8,85 (д, J = 4,0 Гц, 1H, 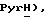 8,23 (дд, J = 6,1, 7,9 Гц, 1H,
8,23 (дд, J = 6,1, 7,9 Гц, 1H, 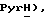 8,12 (д, J = 7,9 Гц, 1H,
8,12 (д, J = 7,9 Гц, 1H, 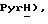 7,85 (дд, J = 4,0, 6,1 Гц, 1H,
7,85 (дд, J = 4,0, 6,1 Гц, 1H, 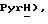 6,79 (с, 1H,
6,79 (с, 1H, 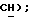 МС (ЗИ): 258 (MI, 8%) 215 (55%), 123 (22%), 78 (100%).
МС (ЗИ): 258 (MI, 8%) 215 (55%), 123 (22%), 78 (100%).
Пример 20
5-(Хинолин-2-сульфонил)тиазолидин-2,4-дион, (V)
30% водный пероксид водорода (10,7 мл, 104 ммоль) добавляют по каплям к перемешиваемому раствору 2-хинолинтиола [(II), 8,0 г, 49,6 ммоль] в 2,5% водном NaOН (229 мл) и этаноле (229 мл). Спустя 1 час реакционную смесь концентрируют, получая белое, твердое вещество (8,34 г), которое содержит, в основном, натрий-2-нафталинсульфинат (формула IV). 7,0 г, часть этого соединения (≤32,5 ммоль), добавляют к раствору 5-бромтиазолидин-2,4-диона (6,38 г, 32,5 ммоль) в сухом ДМФ (53 мл) и полученный раствор перемешивают при комнатной температуре в течение 4 часов. ДМФ удаляют в вакууме и к остатку добавляют воду (400 мл). Водную фазу экстрагируют этилацетатом (2 х 400 мл) и объединенную этилацетатную фазу сушат (солевой раствор) и концентрируют. Неочищенный продукт подвергают флэш-хроматографии (градиент: 98:2 CH2Cl2: изопропанол), получая названное соединение в виде желтого твердого вещества (1,1 г, 9%): т.пл. 168-169oC; ЯМР (ДМСО, d6): δ 12,9 (ш.с, 1H, 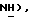 8,85 (д, J = 8,8 Гц, 1H,
8,85 (д, J = 8,8 Гц, 1H, 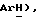 8,24 (д, J = 8,1 Гц, 1H,
8,24 (д, J = 8,1 Гц, 1H, 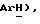 8,16 (д, J = 8,7 Гц, 2H,
8,16 (д, J = 8,7 Гц, 2H, 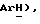 8,02 (дд, J = 6,9, 8,3 Гц, 1H,
8,02 (дд, J = 6,9, 8,3 Гц, 1H, 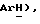 7,89 (дд, J = 6,9, 8,1 Гц, 1H,
7,89 (дд, J = 6,9, 8,1 Гц, 1H, 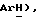 6,95 (с, 1H,
6,95 (с, 1H, 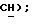 МС (ЭИ): 308 (MI, 10%) 265 (8%), 145 (18%), 129 (100%), 128 (75%); Анал. C12H8N2O4S2: C, H, N.
МС (ЭИ): 308 (MI, 10%) 265 (8%), 145 (18%), 129 (100%), 128 (75%); Анал. C12H8N2O4S2: C, H, N.
Пример 21
[3-(4-хлорфенил)проп-2-инил]бромид, (IX)
Суспензию п-йодхлорбензола [формула (VII), 7,15 г, 30,0 ммоль], пропаргилового спирта (1,75 мл, 30 ммоль), дихлорбис(трифенилфосфин) палладия (II) (0,21 г, 0,3 ммоль), йодида меди (I) (29 мг, 0,15 ммоль) и диэтиламина (50 мл) перемешивают в атмосфере N2 при комнатной температуре, и растворение происходит в течение 20 мин. Через 5 часов, диэтиламин удаляют и неочищенный продукт распределяется между водой и эфиром. Эфирную фазу сушат (солевой раствор), концентрируют и подвергают флэш-хроматографии (4:1 петролейный эфир:этилацетат), получая 3-(4-хлорфенил)проп-2-инол (соединение формулы VIII, 4,09 г 82%). Это соединение формулы (VIII) (3,47 г, 20,83 ммоль) суспендируют в сухом эфире (12 мл) и добавляют пиридин (0,42 мл). Реакционную смесь охлаждают в бане со льдом и по каплям в течение 15 мин добавляют раствор трехбромистого фосфора (1,0 мл, 10,42 ммоль) в сухом эфире (6 мл). Реакционную смесь затем перемешивают при комнатной температуре в течение 2,5 часов, охлаждают на бане со льдом и добавляют колотый лед. Реакционную смесь выливают в воду (200 мл) и экстрагируют эфиром (200 мл). Эфирную фазу промывают водой, насыщенным водным раствором NaHCO3 и солевым раствором. Экстракт концентрируют и подвергают флеш-хроматографии (9:1 петролейный эфир: этилацетат), получая продукт в виде белого твердого вещества (3,38 г, 86%): т.пл. 41-43oC; ЯМР (CDCl3); 7,37 (д, J = 8,7 Гц, 2H,  7,27 (д, J = 8,7 Гц, 2H,
7,27 (д, J = 8,7 Гц, 2H,  4,16 (с, 2H, CH2).
4,16 (с, 2H, CH2).
По методике, описанной в примере 21, соединения формулы (IХ), примеры 22-23, получают из соответствующего коммерчески доступного арилйодида формулы (VII) или коммерчески доступного З-арилпроп-2-инола формулы (VIII).
Пример 22
[3-Бензолпроп-2-инил]бромид, (IX)
Получен из З-бензолпроп-2-инола, (VIII): масло, ЯМР (CDCl3): δ 7,43 (м, 2H, 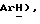 7,33 (м, 3H,
7,33 (м, 3H, 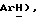 4,16 (с, 3H, CH2).
4,16 (с, 3H, CH2).
Пример 23 [3-[4-(Фторфенил)]проп-2-инил]бромид, (IX)
Получен из п-фторйодбензола, (VII): масло, МС (ЭИ): 2,12 (MI, 8%), 214 (MI, 8%), 133 (100%).
Пример 24
[3-[4-(Метилфенил)]проп-2-инил]бромид, (IX)
Получен из п-метилйодбензола, (VII): масло, МС (ЭИ): 208 (MI, 8%), 210 (MI, 8%), 129 (100%).
Пример 25
[3-[4-(Трифторметилфенил)]проп-2-инил]бромид, (IX)
Получен из п-йод(трифторметил)бензола, (VII): масло; ЯМР (CDCl3): δ 7,57 (д, J = 8,6 Гц, 2H, 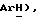 7,52 (д, J = 8,6 Гц, 2H,
7,52 (д, J = 8,6 Гц, 2H, 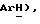 4,13 (с, 3H,
4,13 (с, 3H, 
Пример 26
[3-[4-(Бромфенил)]проп-2-инил]бромид, (IX)
Получен из п-бромйодбензола, (VII): т.пл. 50-51oC.
Пример 27
[3-[4-(Метоксифенил)]проп-2-инил]бромид, (IX)
Получен из п-йоданизола (VII): масло; ЯМР (CDCl3): δ 7,37 (д, J = 8,8 Гц, 2H, 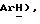 6,83 (д, J = 8,8 Гц, 2H,
6,83 (д, J = 8,8 Гц, 2H, 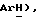 4,16 (с, 3H,
4,16 (с, 3H, 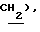 3,80 (с, 3H,
3,80 (с, 3H, 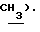
Пример 28
[3-[4-(трифторметоксифенил)]проп-2-инил]бромид, (IX)
Получен из п-трифторметоксийодбензола, (VII): масло; ЯМР (ДМСО d6): δ 7,58 (д, J = 8,8 Гц, 2H, 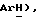 7,37 (д, J = 8,8 Гц, 2H,
7,37 (д, J = 8,8 Гц, 2H, 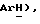 4,49 (с, 3H,
4,49 (с, 3H, 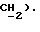
Пример 29
[3-[3-(Хлорфенил)]проп-2-инил]бромид, (IX)
Получен из м-хлорйодбензола, (VII): масло; ЯМР (CDCl3): δ 7,44 (с, 1H, 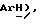 7,32 (м, 2H,
7,32 (м, 2H, 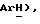 7,28 (м, 2H,
7,28 (м, 2H, 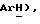 4,14 (с, 2H,
4,14 (с, 2H, 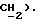
Пример 30. [3-[2-(Хлорфенил)]проп-2-инил]бромид, (IX)
Получен из о-хлорйодбензола, (VII): масло; ЯМР (CDCl3): δ 7,48 (дд, J = 1,9, 7,3 Гц, 1H, 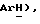 7,40 (дд, J = 1,5, 8,1 Гц, 1H,
7,40 (дд, J = 1,5, 8,1 Гц, 1H,  7,25 (м, 2H,
7,25 (м, 2H, 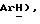 4,21 (c, 2H,
4,21 (c, 2H, 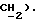
Пример 31 [3-(3,5-Бис(трифторметил)фенил)проп-2-инил]бромид, (IX)
Получен из 3-(3,5-бис(трифторметил)фенил)проп-2-инола, (VIII): т.пл. 30-31oC.
Пример 32
[3-[4- (Метилфенил)проп-2-инил]бромид, (IX)
Получен из п-йодтиоанизола, (VII): масло; ЯМР (ДМСО d6): δ 7,36 (д, J = 8,3 Гц, 2H, 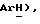 7,22 (д, J = 8,3 Гц, 2H,
7,22 (д, J = 8,3 Гц, 2H, 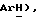 4,48 (с, 2H,
4,48 (с, 2H, 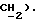
Пример 33
[3-(3,5-Бис(фтор)фенил)проп-2-инил]бромид, (IX)
Получен из 3,4-дифторйодбензола, (VII): масло; МС (ЭИ): 231 (MI, 16%), 233 (MI, 16%), 151 (100%).
Пример 34
N-(Трифенилметил)-5-(толуол-4-сульфонил)тиазолидин-2,4-дион, (VI)
Трифенилметилхлорид (2,67 г, 9,58 ммоль) добавляют к перемешиваемому при комнатной температуре раствору 5-(толуол-4-сульфонил)тиазолидин-2,4-диона [(V), из примера 12, 1,30 г, 4,79 ммоль], триэтиламина (0,67 мл, 4,79 ммоль) и дихлорметана (6,5 мл). Спустя 1 час добавляют воду (300 мл) и органическое вещество экстрагируют этилацетатом (2 х 200 мл). Объединенные экстракты сушат (солевой раствор, MgSO4), концентрируют и очищают при помощи флэш-хроматографии (4: 1 петролейный эфир:этилацетат), получая названное соединение в виде белого твердого вещества (1,1 г, 45%): т.пл. 105-110oC; ЯМР (CDCl3): δ 7,85 (д, J = 8,3 Гц, 2H, 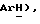 7,48 (д, J = 8,1 Гц, 6H,
7,48 (д, J = 8,1 Гц, 6H,  7,38 (д, J = 8,3 Гц, 2H,
7,38 (д, J = 8,3 Гц, 2H, 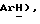 7,23 (м, 9H,
7,23 (м, 9H, 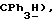 5,13 (с, 1H,
5,13 (с, 1H, 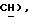 2,46 (с, 3H,
2,46 (с, 3H, 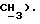
Пример 35
N-(Трифенилметил)-5-[3-(4-хлорфенил)проп-2-инил] -5-(толуол-4- сульфонил)тиазолидин-2,4-дион, (X)
Гидрид натрия (80% дисперсия в минеральном масле, 93 мг, 3,10 ммоль) добавляют к раствору N-(трифенилметил)-5-(толуол-4- сульфонил)тиазолидин-2,4-диона [(VI), из примера 34, 1,06 г, 2,07 ммоль] в сухом ДМФ (9 мл) при 0oC в атмосфере сухого N2. Через 20 мин добавляют [3-(4-хлорфенил)проп-2-инил] бромид [(IX), из примера 21, 0,52 г, 2,27 ммоль] и реакционную смесь перемешивают еще 20 мин при 0oC. Добавляют насыщенный NH4Cl (60 мл), а затем воду (60 мл). После перемешивания в течение 10 мин твердое вещество отфильтровывают, промывают водой и растирают в порошок с петролейным эфиром, получая названное соединение в виде сухого серого твердого вещества (1,16 г, 90%): т. пл. 221-223oC; ЯМР (CDCl3): δ 7,80 (д, J = 8,2 Гц, 2H, 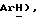 7,45 (д, J = 7,5 Гц, 6H,
7,45 (д, J = 7,5 Гц, 6H,  7,35(д, J = 8,2 Гц, 2H,
7,35(д, J = 8,2 Гц, 2H, 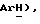 7,14 (м, 11H,
7,14 (м, 11H, 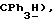 6,98 (д, J = 8,5 Гц, 2H,
6,98 (д, J = 8,5 Гц, 2H, 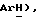 3,29 (д, J = 16,7 Гц, 1H,
3,29 (д, J = 16,7 Гц, 1H, 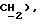 3,12 (д, J = 16,7 Гц, 1H,
3,12 (д, J = 16,7 Гц, 1H,  2,46 (с, 3H,
2,46 (с, 3H, 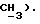
Пример 36
5-[3-(4-Хлорфенил)проп-2-инил] -5-(толуол-4-сульфонил)тиазолидин- 2,4-дион, (I)
Трифторуксусную кислоту (0,32 мл, 4,07 ммоль) добавляют при комнатной температуре к перемешиваемой суспензии N-(трифенилметил)-5-[3-(4-хлорфенил)проп-2-инил]-5-(толуол- 4-сульфонил)тиазолидин-2,4-диона [(X), из примера 35, 1,29 г, 1,94 ммоль] в CH2Cl2 (2 мл). Растворение происходит мгновенно. Спустя 1 час реакционную смесь добавляют в воду (200 мл) и экстрагируют этилацетатом (200 мл). Этилацетатную фазу промывают водой и солевым раствором и затем концентрируют. Неочищенный продукт очищают при помощи флэш-хроматографии (95: 5 CH2Cl2:изопропанол) и затем растирают в порошок в петролейном эфире, получая названное соединение в виде не совсем белого твердого вещества (0,52 г, 64%): т.пл. 172-174oC; ЯМР (CDCl3): δ 8,00 (с, 1H, 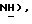 7,85 (д, J = 8,3 Гц, 2H,
7,85 (д, J = 8,3 Гц, 2H, 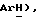 7,41 (д, J = 8,3 Гц, 2H,
7,41 (д, J = 8,3 Гц, 2H, 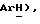 7,26 (с, 4H,
7,26 (с, 4H, 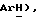 3,65 (д, J = 17,1 Гц, 1H,
3,65 (д, J = 17,1 Гц, 1H,  3,33 (д, J = 17,1 Гц, 1H,
3,33 (д, J = 17,1 Гц, 1H, 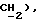 2,49 (с, ЗH,
2,49 (с, ЗH, 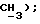 МС (CI); 420 (M+H, 58%), 422 (M+H, 24%), 265 (40%), 267 (26%), 157 (100%);
МС (CI); 420 (M+H, 58%), 422 (M+H, 24%), 265 (40%), 267 (26%), 157 (100%);
Анал. Расч. Для C19H14ClNO4S2: C, 54,35; H, 3,36; N, 3,36;
Найдено: C, 54,74; H, 3,54; N, 2,98.
Пример 37
5-[3-(4-Хлорфенил)проп-2-инил] -5-(толуол-4-сульфанил)-тиазолидин- 2,4-дион, (I)
Гидрид натрия (80% дисперсия в минеральном масле, 0,63 г, 21,1 ммоль) добавляют к раствору 5-(толуол-4-сульфанил)тиазолидин- 2,4-диона [(III), из примера 1, 1,75 г, 8,44 ммоль] в сухом ТГФ (9 мл) при 0oC в атмосфере сухого N2. Через 20 мин добавляют раствор [3-(4-хлорфенил)проп-2-инил]бромида [(IX), из примера 21, 1,94 г, 8,44 ммоль] в сухом ТГФ в течение 30 мин. Через 2,5 часа реакционную смесь концентрируют и добавляют разбавленную водную HCl (85 мл). Органику экстрагируют этилацетатом (2 х 85 мл) и экстракты сушат (солевой раствор), концентрируют, очищают при помощи флэш-хроматографии (98: 2 CH2Cl2: изопропанол и растирают в порошок в петролейном эфире, получая названное соединение (1,25 г, 38%): т.пл. 108-109oC; ЯМР (ДМСО, d6): δ 12,27 (c, 1H, 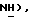 7,46 (д, J = 8,5 Гц, 2H,
7,46 (д, J = 8,5 Гц, 2H, 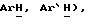 7,39 (д, J = 8,7 Гц, 1H,
7,39 (д, J = 8,7 Гц, 1H, 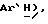 7,27 (д, J = 7,9 Гц, 1H,
7,27 (д, J = 7,9 Гц, 1H, 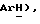 3,48 (д, J = 17,3 Гц, 1H,
3,48 (д, J = 17,3 Гц, 1H, 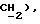 3,32 (д, J = 17,3 Гц, 1H,
3,32 (д, J = 17,3 Гц, 1H, 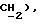 2,34 (с, 3H,
2,34 (с, 3H,  МС (ЭИ); 387 (MI, 5%), 389 (2%), 124 (85%), 91 (100%);
МС (ЭИ); 387 (MI, 5%), 389 (2%), 124 (85%), 91 (100%);
Анал. Расч. для C19H14ClNO2S2: C, 58,21; H, 3,53; N, 3,77;
Найдено: C, 58,02; H, 3,58; N, 3,52.
Используя методику, описанную в примере 37, соединения формулы (I), примеры 38-41, получают из соответствующего 5-арилсульфанилтиазолидин-2,4-диона формулы (III) и соответствующего (З-арилпроп-2-инил)бромида формулы (IX).
Пример 38
5-[3-(4-Хлорфенил)проп-2-инил] -5-бензолсульфанилтиазолидин- 2,4-дион, (I)
Пучен из 5-(бензолсульфанил)тиазолидин-2,4-диона формулы (III), пример 6 и [3-(4-хлорфенил)проп-2-инил] бромида формулы (IX), из примера 21: т.пл. 87-88oC;
Анал. Расч. для C18H12ClNO2S2: C, 57,83; H, 3,24; N, 3,75;
Найдено: C, 58,05; H, 3,07; N, 3,62.
Пример 39
5-[3-(4-Хлорфенил)проп-2-инил] -5-(4-фторфенилсульфанил)тиазолидин- 2,4-дион, (I)
Пучен из 5-(фторфенилсульфанил)тиазолидин-2,4-диона формулы (III), пример 5 и [3-(4-хлорфенил)проп-2-инил]бромида формулы (IX), из примера 21: т. пл. 116-117oC;
Анал. Расч. для C18H11ClFNO2S2: C, 55,17; H, 2,83; N, 3,57;
Найдено: C, 54,58; H, 2,65; N, 3,39.
Пример 40
5-[3-(4-Хлорфенил)проп-2-инил] -5-(пиридин-2- сульфанил)тиазолидин-2,4-дион, (I)
Пучен из 5-(пиридин-2-сульфанил)тиазолидин-2,4-диона (III), пример 2 и [3-(4-хлорфенил)проп-2-инил] бромида формулы (IX), из примера 21: т.пл. 124-125oC;
Анал. Расч. для C17H11ClNO2S2: C, 54,47; H, 2,96; N, 7,47;
Найдено: C, 54,49; H, 2,86; N, 7,14.
Пример 41
5-[3-(4-Хлорфенил)проп-2-инил] -5-(хинолин-2-сульфанил)тиазолидин- 2,4-дион, (I)
Пучен из 5-(хинолин-2-сульфанил)тиазолидин-2,4-диона (III), пример 3 и [3-(4- хлорфенил)проп-2-инил] бромида формулы (IX), из примера 21: т.пл. 163-165oC;
Анал. Расч. для C21H13ClN2O2S2: C, 58,04; H, 3,06; N, 6,40;
Найдено: C, 57,98; H, 2,84; N, 6,15.
Пример 42
5-[3-(4-Хлорфенил)проп-2-инил] -5-(4-фторбензолсульфонил)тиазолидин- 2,4-дион, (I)
Гидрид натрия (80% дисперсия в минеральном масле, 0,55 г, 18,2 ммоль) добавляют к раствору 5-(4-фторфенилсульфонил)тиазолидин-2,4-диона [(V), из примера 11, 2,0 г, 7,27 ммоль] в сухом ТГФ (12 мл) при 0oC в атмосфере сухого N2. Через 1,5 часа, раствор [3-(4-хлорфенил)проп-2-инил]бромида [(IX), из примера 21, 1,67 г, 7,27 ммоль] в сухом ТГФ (12 мл) добавляют в течение 25 минут. Через 20 часов, реакционную смесь концентрируют и добавляют разбавленный раствор HCl (100 мл). Органику экстрагируют этилацетатом (3 х 100 мл) и экстракты сушат (солевой раствор), концентрируют, очищают при помощи флэш-хроматографии (97: 3 CH2Cl2:метанол) и растирают в порошок с петролейным эфиром, получая названное соединение в виде белого твердого вещества (0,99 г, 32%): т. пл. 176-177oC; ЯМР (ДМСО, d6): δ 13,0 (ш. с, 1H, 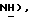 8,02 (м, 1H, ArH 7,59 (т, J = 8,9 Гц, 1H,
8,02 (м, 1H, ArH 7,59 (т, J = 8,9 Гц, 1H, 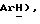 7,45 (д, J = 8,5 Гц, 1H,
7,45 (д, J = 8,5 Гц, 1H, 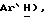 7,35 (д, J = 8,5 Гц, 1H,
7,35 (д, J = 8,5 Гц, 1H, 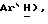 3,66 (д, J = 17,5 Гц, 1H,
3,66 (д, J = 17,5 Гц, 1H, 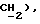 3,50 (д, J = 17,3 Гц, 1H,
3,50 (д, J = 17,3 Гц, 1H, 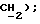 МС (-DCl); 422 (M-I, 22%), 424 (M-H, 16%), 263 (100%), 265 (40%);
МС (-DCl); 422 (M-I, 22%), 424 (M-H, 16%), 263 (100%), 265 (40%);
Анал. Расч. для C18H11ClFNO4S2: C, 51,01; H, 2,62; N, 3,30;
Найдено: C, 51,08; H, 2,55; N, 2,97.
Пример 43
5-[3-(4-Хлорфенил)проп-2-инил] -5-(пиридин-2-сульфонил)тиазолидин- 2,4-дион, (I)
Гидрид натрия (80% дисперсия в минеральном масле, 0,32 г, 10,8 ммоль) добавляют к раствору 5-(пиридин-2-сульфонил)тиазолидин-2,4-диона [(V), из примера 19, 1,1 г, 4,30 ммоль] в сухом ТГФ (7,5 мл) при 0oC в атмосфере сухого N2. Через 10 мин добавляют раствор [3-(4-хлорфенил)проп-2-инил]бромида [(IX), из примера 21, 0,99 г, 4,30 ммоль] в сухом ТГФ (7,5 мл) в течение 30 мин. Спустя 27 часов при комнатной температуре, реакционную смесь гасят насыщенным водным NH4Cl (20 мл), добавляют воду (120 мл) и органику экстрагируют этилацетатом (2 х 150 мл). Экстракты сушат (солевой раствор), концентрируют и очищают при помощи флэш-хроматографии (градиент: 97:3 до 88: 12 CH2Cl2:метанол), получая названное соединение в виде желтого твердого вещества (0,63 г, 36%): т.пл. 140-141oC; ЯМР (ДМСО, d6): δ 13,2 (ш.с, 1H, 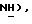 8,82 (дд, J = 0,6, 4,0 Гц, 1H, PyrH), 8,23 (тд, J = l,6, 7,8 Гц, 1H,
8,82 (дд, J = 0,6, 4,0 Гц, 1H, PyrH), 8,23 (тд, J = l,6, 7,8 Гц, 1H,  8,15 (д, J = 7,9 Гц, 1H,
8,15 (д, J = 7,9 Гц, 1H, 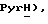 7,87 (ддд, J = 1,1, 5,3, 7,7 Гц, 1H,
7,87 (ддд, J = 1,1, 5,3, 7,7 Гц, 1H, 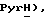 7,45 (д, J = 8,5 Гц, 1H, Ar'H 7,35 (д, J = 8,5 Гц, 1H, Ar'H 3,88 (д, J = 17,2 Гц, 1H,
7,45 (д, J = 8,5 Гц, 1H, Ar'H 7,35 (д, J = 8,5 Гц, 1H, Ar'H 3,88 (д, J = 17,2 Гц, 1H, 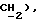 3,74 (д, J = 17,2 Гц, 1H,
3,74 (д, J = 17,2 Гц, 1H, 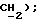 MC (+DCI); 407 (M+H, 50%), 409 (M+H, 24%), 264 (80%), 266 (36%), 144 (100%);
MC (+DCI); 407 (M+H, 50%), 409 (M+H, 24%), 264 (80%), 266 (36%), 144 (100%);
Анал. Расч. для C17H11ClN2O4S2: C, 50,18; H, 2,72; N, 6,88;
Найдено: C, 50,07; H, 2,67; N, 6,57.
По методике, описанной в примере 43, соединения формулы (I), примеры 44-85, получают из соответствующего 5-арилсульфонилтиазолидин-2,4-диона формулы (V) и соответствующего (3-арилпроп-2-инил)бромида формулы (IX) (см. табл. 1).
Пример 86
5-(6-Метилпиридин-2-сульфания)тиазолидин-2,4-дион, (III)
Это соединение получают из 5-бромтиазолидин-2,4-диона и 2-метил-6-меркаптопиридина (A. D.Dunn, R.Norrie, J.L'Hostis, and S.Marjot J.Prak Chem.-Chem. Zt. 1992, 334, 119-125) по методике, описанной в примере 1: т.пл. 114-115oC.
Пример 87
5-(Пиримидин-2-сульфанил)тиазолидин-2,4-дион, (III)
Это соединение получают из 5-бромтиазолидин-2,4-диона и 2-меркаптопиримидина по методике, описанной в примере 1: МС (ЭИ): 227 (MI, 5%), 184 (15%), 80 (100%).
Пример 88
5-(5-Хлорбензотиазол-2-илсульфанил)тиазолидин-2,4-дион, (III)
Это соединение получают из 5-бромтиазолидин-2,4-диона и 5-хлор-2-меркаптобензотиазола по методике, описанной в примере 5: т.пл. 253-255 (разл.).
Пример 89
5-(Бензоксазол-2-илсульфанил)тиазолидин-2,4-дион, (III)
Это соединение получают из 5-бромтиазолидин-2,4-диона и 2- меркаптобензоксазола по методике, описанной в примере 5: т.пл. 241-243 (разл.).
Пример 90
5-(6-Метилпиридин-2-сульфонил)тиазолидин-2,4-дион, (V)
Это соединение получают из 5-бромтиазолидин-2,4-диона и 2-метил-меркаптопиридина (A. D.Dunn, R.Norrie, J.L'Hostis, and S.Marjot J.Prak Chem.-Chem. Zt. 1992, 334, 119-125) по методике, описанной в примере 20: т.пл. 129-130 (разл.).
Пример 91
5-[3-(4-Хлорфенил проп-2-инил] -5-(4-хлорфенилсульфанил)тиазолидин- 2,4-дион, (I)
N-Бутиллитий (2,5 М в гексане, 12,3 мл, 30,8 ммоль) добавляют к раствору 5-(4-хлорфенилсульфанил)тиазолидин-2,4-диона [(III), из примера 7, 4,0 г, 15,4 ммоль] в сухом ТГФ (195 мл) при 78oC в атмосфере сухого N2 в течение 40 минут. Спустя 30 мин, раствор [3-(4-хлорфенил)проп-2-инил]бромида [(IX), из примера 21, 3,53 г, 15,5 ммоль] в сухом ТГФ (65 мл) добавляют в течение 12 мин. Спустя 10 мин, реакционной смеси дают возможность нагреться до комнатной температуры. Спустя 2 часа, реакционную смесь переносят в насыщенный водный хлорид аммония (1 л) и экстрагируют этилацетатом (800 мл). Экстракты сушат (солевой раствор), концентрируют и очищают при помощи флэш-хроматографии (4:1 петролейный эфир:этилацетат), получая названное соединение в виде белого твердого вещества (2,58 г, 41%): т.пл. 144-146oC; ЯМР (ДМСО, d6): δ 12,37 (с, 1H, 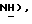 7,59 (д, J = 8,5 Гц 2H, ArH), 7,56 (д, J = 8,7 Гц, 2H,
7,59 (д, J = 8,5 Гц 2H, ArH), 7,56 (д, J = 8,7 Гц, 2H,  7,46 (д, J = 8,5 Гц, 2H,
7,46 (д, J = 8,5 Гц, 2H, 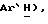 7,40 (д, J = 8,3 Гц, 2H,
7,40 (д, J = 8,3 Гц, 2H, 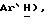 3,52 (д, J = l7,3 Гц, 1H,
3,52 (д, J = l7,3 Гц, 1H, 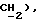 3,35 (д, J = 17,3 Гц, 1H,
3,35 (д, J = 17,3 Гц, 1H, 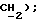 МС (ЭИ): 407, 409, 411 (MI, 5%), 364, 366 (8%), 264 (30%), 193 (40%), 149 (100%), 143 (20%);
МС (ЭИ): 407, 409, 411 (MI, 5%), 364, 366 (8%), 264 (30%), 193 (40%), 149 (100%), 143 (20%);
Анал. Расч. для C18H11Cl2NO2S2: C, 52,95; H, 2,72; N, 3,43;
Найдено: C, 52,95; H, 2,87; N, 3,29.
Используя методику, описанную в примере 91, соединения формулы (I), примеры 92-95, получают из соответствующего 5-арилсульфанилтиазолидин-2,4-диона формулы (III) и [3-(4-хлорфенил)проп-2-инил]бромида формулы (IX), примера 21.
Пример 92
5-(5-Хлорбензотиазол-2-илсульфанил)-5-[3-(4-хлорфенил)проп-2- инил]тиазолидин-2,4-дион, (I)
Получен из 5-(5-хлорбензотиазол-2-илсульфанил)тиазолидин-2,4-диона, (III), пример 88, и [3-(4-хлорфенил)проп-2-инил]бромида формулы (IX), пример 21: т.пл. 187-188oC;
Анал. Расч. для C19H10Cl2N2 O2S3: C, 49,04; H, 2,17; N, 6,02;
Найдено: C, 48,94; H, 2,31; N, 6,21.
Пример 93
5-(Бензоксазол-2-илсульфанил)-5-[3-(4-хлорфенил)проп-2-инил] тиазолидин- 2,4-дион, (I)
Получен из 5-(бензоксазол-2-илсульфанил)тиазолидин-2,4-диона, (III), пример 89, и [3-(4-хлорфенил)проп-2-инил]бромида формулы (IX), пример 21: т. пл. 137-139oC;
Анал. Расч. для C19H11ClN2O3S2: C, 55,80; H, 2,67; N, 6,75;
Найдено: C, 54,92; H, 2,76; N, 6,82.
Пример 94
5-[3-(4-Хлорфенил)проп-2-инил]-5-(6-метил-пиридин-2- сульфанил)тиазолидин-2,4-дион, (I)
Получен из 5-(6-метил-пиридин-2-сульфанил)тиазолидин-2,4-дион, (III), пример 86, и [3-(4-хлорфенил)проп-2-инил]бромида формулы (IX), пример 21: т. пл. 147-148oC;
Анал. Расч. для C18H13ClN2O2S2: C, 55,59; H, 3,37; N, 7,20;
Найдено: C, 55,52; H, 3,31; N, 7,02.
Пример 95
5-[3-(4-Хлорфенил)проп-2-инил] -5-(пиримидин-2-сульфанил)тиазолидин- 2,4-дион, (I)
Получен из 5-(пиримидин-2-сульфанил)тиазолидин-2,4-дион, (III), пример 87, и [3-(4-хлорфенил)проп-2-инил] бромида формулы (IX), пример 21: т.пл. 118-120oC;
Анал. Расч. для C16H10ClN3O2S2: C, 51,13; H, 2,68; N, 11,18;
Найдено: C, 51,27; H, 2,93; N, 10,82.
Пример 96
5-[3-(4-Хлорфенил)проп-2-инил]-5-(6-метил-пиридин-2- сульфонил)тиазолидин-2,4-дион, (I)
N-Бутиллитий (2,5 М в гексане, 2,77 мл, 6,93 ммоль) добавляют к раствору 5-(6-метил-пиридин-сульфонил)тиазолидин-2,4-диона [(V), из примера 90, 0,92 г, 3,38 ммоль] в сухом ТГФ (30 мл) при 78oC в атмосфере сухого N2 в течение двадцати минут. Раствор [3-(4-хлорфенил)проп-2-инил]бромида [(IX), из примера 21, 3,53 г, 15,4 ммоль] в сухом ТГФ (10 мл) добавляют в течение 20 минут. Реакционной смеси дают возможность нагреться до комнатной температуры. Спустя 16 часов, реакционную смесь переносят в насыщенный водный хлорид аммония (80 мл) и экстрагируют этилацетатом (2 х 300 мл). Экстракты промывают водой, сушат (солевой раствор), концентрируют, очищают при помощи флэш-хроматографии (градиент: 97:3 до 93:7 CH2Cl2:изопропанол), получая клейкое твердое вещество, которое перетирают с петролейным эфиром (990 мл):бензол (2 мл), получая названное соединение в виде не совсем белого твердого вещества (0,55 г, 39%): т.пл. 104-106oC; ЯМР (ДМСО, d6): δ 13,1 (ш.с, 1H, 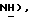 8,10 (т, J = 7,8 Гц, 1H, pyH), 7,95 (д, J = 7,7 Гц, 1H,
8,10 (т, J = 7,8 Гц, 1H, pyH), 7,95 (д, J = 7,7 Гц, 1H, 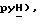 7,71 (д, J = 7,7 Гц, 1H,
7,71 (д, J = 7,7 Гц, 1H, 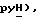 7,45 (д, J = 8,8 Гц, 2H,
7,45 (д, J = 8,8 Гц, 2H, 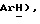 7,35 (д, J = 8,7 Гц, 2H,
7,35 (д, J = 8,7 Гц, 2H, 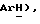 3,86 (д, J = 17,4 Гц, 1H,
3,86 (д, J = 17,4 Гц, 1H, 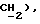 3,72 (д, J = 17,4 Гц, 1H,
3,72 (д, J = 17,4 Гц, 1H,  2,57 (с, 3H,
2,57 (с, 3H, 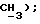 МС (ЭИ): 420 (MI, 3%), 265 (12%), 263 (38%), 194 (25%), 192 (70%), 149 (40%), 93 (100%);
МС (ЭИ): 420 (MI, 3%), 265 (12%), 263 (38%), 194 (25%), 192 (70%), 149 (40%), 93 (100%);
Анал. Расч. для C18H13ClN2O4S2: C, 51,37; H, 3,11; N, 6,66;
Найдено: C, 50,99; H, 3,05; N, 6,58.
Пример 97
5-[3-(3,5-Бис(трифторметил)фенил)проп-2-инил] -5-(пиридин-2- сульфонил)тиазолидин-2,4-дион, (I)
По методике, описанной в примере 43, это соединение получают из 5-(пиридин-2-сульфонил)тиазолидин-2,4-дион формулы (V), пример 19, и [3-(3,5-бис(трифторметил)фенилпроп-2-инил] бромида формулы (IX), пример 31: т. пл. 150-152oC: ЯМР (ДМСО, d6): δ 8,79 (д, J = 4,4 Гц 1H, pyH), 8,16 (дт, J = 1,6, 7,9 Гц, 1H, 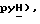 8,11 (с, 1H,
8,11 (с, 1H, 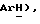 8,05 (д, J = 7,9 Гц, 1H,
8,05 (д, J = 7,9 Гц, 1H, 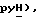 7,94 (с, 2H,
7,94 (с, 2H, 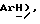 7,9 (дд, J = 4,9, 7,3 Гц, 1H,
7,9 (дд, J = 4,9, 7,3 Гц, 1H, 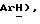 3,87 (д, J = 17,2 Гц, 1H,
3,87 (д, J = 17,2 Гц, 1H, 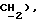 3,71 (д, J = 17,2 Гц, 1H,
3,71 (д, J = 17,2 Гц, 1H, 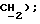 МС (CI): 509 (MI+1, 100%) 367 (32%), 366 (352%), 287 (35%), 194 (25%), 194 (20%);
МС (CI): 509 (MI+1, 100%) 367 (32%), 366 (352%), 287 (35%), 194 (25%), 194 (20%);
Анал. Расч. для C19H10F6M2 O4S2: C, 44,98; H, 1,98; N, 5,51;
Найдено: C, 42,80; H, 2,09; N, 5,77.
Пример 98
5-(2,3-Дихлортиофен-5-сульфонил)тиазолидин-2,4-дион, (V)
Раствор п-тиокрезола (4,94 г, 39,8 ммоль), триэтиламина (5,55 мл, 39,8 ммоль) в дихлорметане (30 мл) добавляют по каплям в течение 12 минут к раствору 2,3-дихлортиофен-5-сульфонил хлорида (5,0 г, 19,9 ммоль) в дихлорметане (50 мл) при -78oC в атмосфере сухого азота. Добавляют еще 10 мл дихлорметана и реакционную смесь перемешивают при -78oC в течение 2 часов и затем нагревают до комнатной температуры в течение 20 минут. Реакционную смесь выливают в воду (400 мл) и слои разделяют. Дихлорметановую фазу промывают водой (2 х 200 мл) и объединенную фазу подкисляют концентрированной HCl. Твердый NaCl добавляют к водной фазе, которую затем экстрагируют простым эфиром (4 х 200 мл). Экстракты объединяют и сушат (Na2SO4) и концентрируют, получая 2,3-дихлортиофен-5-сульфиновую кислоту в виде белого твердого вещества (2,89 г, 67%): ЯМР (ДМСО, d6): δ 9,1 (ш.с, 1H, 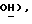 7,54 (с, 1H, тиофен
7,54 (с, 1H, тиофен 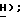 МС (ЭИ): 216, 218, 220, (70, 50, 10%, MI), 199, 201, 203 (60, 50, 10%, -ОН), 169 (50%), 167 (70%), 154 (70%), 152 (100%). Эту сульфиновую кислоту (2,33 г, 10,73 ммоль) растворяют в растворе гидроксида натрия (0,42 г, 10,73 ммоль) в метаноле (25 мл) при комнатной температуре. Метанол удаляют и остаточную воду удаляют путем ее отгонки в виде азеотропа с бензолом, получая 2,3-дихлортиофен-5-сульфиновую кислоту, натриевую соль формулы (IV) в виде белого твердого вещества (2,57 г, 100%): ЯМР (ДМСО, d6): δ 6,89 (с, 1H, тиофен
МС (ЭИ): 216, 218, 220, (70, 50, 10%, MI), 199, 201, 203 (60, 50, 10%, -ОН), 169 (50%), 167 (70%), 154 (70%), 152 (100%). Эту сульфиновую кислоту (2,33 г, 10,73 ммоль) растворяют в растворе гидроксида натрия (0,42 г, 10,73 ммоль) в метаноле (25 мл) при комнатной температуре. Метанол удаляют и остаточную воду удаляют путем ее отгонки в виде азеотропа с бензолом, получая 2,3-дихлортиофен-5-сульфиновую кислоту, натриевую соль формулы (IV) в виде белого твердого вещества (2,57 г, 100%): ЯМР (ДМСО, d6): δ 6,89 (с, 1H, тиофен 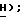 Анал. Расч. для C4HCl2O2S2: C, 20,09; H, 0,41; Найдено: C, 19,80; H, 0,52. Эту сульфиновую кислоту, натриевую соль формулы (IV) (2,12 г, 8,87 ммоль) смешивают с 5-бром-тиазолидин-2,4-дионом (1,58 г, 8,06 ммоль) и Aliquat 336 (хлорид трикаприлилметиламмония, 0,45 мл) и выдерживают в течение ночи. Добавляют разбавленную водную HCl (100 мл) и водную реакционную смесь экстрагируют этилацетатом (2 х 100 мл). Объединенные экстракты промывают соляным раствором и концентрируют. Неочищенный продукт очищают при помощи флэш-хроматографии, используя промытый кислотой (2% H3PO4 в метаноле) силикагель и в качестве элюента смесь 82:18 этилацетат:петролейный эфир, получая названное соединение формулы (V) в виде белого твердого вещества: т. пл. 176-177oC: ЯМР (ДМСО, d6): δ 13,0 (ш.с, 1H,
Анал. Расч. для C4HCl2O2S2: C, 20,09; H, 0,41; Найдено: C, 19,80; H, 0,52. Эту сульфиновую кислоту, натриевую соль формулы (IV) (2,12 г, 8,87 ммоль) смешивают с 5-бром-тиазолидин-2,4-дионом (1,58 г, 8,06 ммоль) и Aliquat 336 (хлорид трикаприлилметиламмония, 0,45 мл) и выдерживают в течение ночи. Добавляют разбавленную водную HCl (100 мл) и водную реакционную смесь экстрагируют этилацетатом (2 х 100 мл). Объединенные экстракты промывают соляным раствором и концентрируют. Неочищенный продукт очищают при помощи флэш-хроматографии, используя промытый кислотой (2% H3PO4 в метаноле) силикагель и в качестве элюента смесь 82:18 этилацетат:петролейный эфир, получая названное соединение формулы (V) в виде белого твердого вещества: т. пл. 176-177oC: ЯМР (ДМСО, d6): δ 13,0 (ш.с, 1H, 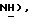 8,10 (с, 1H, тиофен
8,10 (с, 1H, тиофен 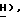 6,85 (с, 1H,
6,85 (с, 1H, 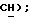 МС (ЭИ): 331, 333, 335, (30, 20, 5%, MI), 215, 217, 219 (100, 70, 15%).
МС (ЭИ): 331, 333, 335, (30, 20, 5%, MI), 215, 217, 219 (100, 70, 15%).
Анал. Расч. для C7H3Cl2NO4S3: C, 23,51; H, 0,91, N, 4,22;
Найдено: C, 25,83; H, 1,00, N, 4,23.
Пример 99
5-[3-(4-Хлорфенил)проп-2-инил]-5-(2,3-дихлортиофен-5- сульфонил)тиазолидин-2,4-дион, (I)
По методике, описанной в примере 96, это соединение получают из 5-(2,3-дихлортиофен-5-сульфонил)тиазолидин-2,4-диона формулы (V), пример 98, и 3-(4-хлорфенил)проп-2-инил] бромида формулы (IX), из примера 21: т.пл. 160-161oC: ЯМР (ДМСО, d6): δ 8,03 (с, 1H, тиофен 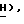 7,44 (д, J = 8,4 Гц, 2H,
7,44 (д, J = 8,4 Гц, 2H, 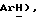 7,33 (д, J = 8,3 Гц, 2H,
7,33 (д, J = 8,3 Гц, 2H, 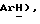 3,69 (д, J = 17,4 Гц, 1H,
3,69 (д, J = 17,4 Гц, 1H, 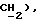 3,52 (д, J = 17,4 Гц, 1H,
3,52 (д, J = 17,4 Гц, 1H, 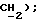 МС (-FAB): 478, 480 (10%, 10%, M-H, 297 (30%), 148 (100%);
МС (-FAB): 478, 480 (10%, 10%, M-H, 297 (30%), 148 (100%);
Анал. Расч. для C16H8Cl3NO4S3: C, 39,97; H, 1,68; N, 2,91;
Найдено: C, 40,30; H, 1,97; N, 2,95.
ФАРМАКОЛОГИЯ
Активность соединений данного изобретения в понижении уровня глюкозы в крови демонстрируется в экспериментах, используя диабетических (db/db) мышей.
db/db (C57BL/KsJ) мышь демонстрирует многие метаболитические аномалии, которые ассоциируются с инсулин-независимым сахарным диабетом (тип II) у людей. Животные страдают ожирением, интолерантны к глюкозе и имеют гипергликемию при голодании, которая иногда сопровождается парадоксальной гиперинсулинемией. Кроме того, у db/db мыши могут развиваться некоторые из отдаленных осложнений, которые ассоциированы с сахарным диабетом. [Смотри Coleman Diabetes, 31 (Suppl. l), 1 (1992)]. Несмотря на эти общности (commonalities), экстренное введение сульфонилмочевин (даже в экстремально высоких дозах) не может понизить гипергликемию у db/db мыши [см. Tutwiler et al, Diabetes 27, 856, (1978). Способность некоторых других гипергликемических средств быть эффективными для этого вида подтверждает, что эти другие средства имеют механизмы действия, отличные от механизма действия сульфонилмочевин [там же; Lee et al. , Diabetes 31:12 (1982); Chang et al. Diabetes 32, 830 (1985); Hosokawa et al. Diabetes 34, 267 (1985)]. Такие соединения поэтому, вероятно, должны быть более эффективными в популяции диабетических пациентов типа II, которые не отвечают на терапию сульфонилмочевиной. Ниже следуют эксперименты, являющиеся иллюстрацией вышесказанного, после проведения следующей общей методики, имеющей отношение к этим экспериментам. На утро дня 1 35 мышей [самцы db/db (C57BL/KsJ), Jackson Laboratories, возраста от 2 до 7 месяцев и весом от 35 до 60 г] подвергали голоданию в течение 4 часов, взвешивали и отбирали базовую пробу крови из кончика хвоста каждой мыши без анестезии, помещали непосредственно в фторидсодержащую пробирку, смешивали и помещали на лед. Затем мышь кормили. Плазму отделяли и определяли уровни глюкозы в плазме при помощи Abbott VP Анализатора. Из-за непостоянства уровней глюкозы в плазме у db/db мышей, 5 мышей, имеющих небольшие экстремумы (т. е. наибольший или наименьший) уровни глюкозы в плазме, исключали и оставшихся 30 мышей произвольно разбивали на 7 групп по эквивалентным средним уровням глюкозы в плазме:
Группа A - наполнитель-контроль - N=6
Группа B - положительный контроль (циглитазон) - N = 4
Группа C - 1-ое испытываемое лекарственное средство - N=4
Группа D - 2-ое испытываемое лекарственное средство - N=4
Группа E - 7 3-е испытываемое лекарственное средство - N=4
Группа F - 4-ое испытываемое лекарственное средство - N=4
Группа H - 5-ое испытываемое лекарственное средство - N=4
После полудня дней 1, 2 и 3, наполнитель или испытываемые лекарственные средства вводили (п.о.. р.о.) откормленным, по желанию (ad libitum), мышам. Положительный контроль, циглитазон [(±)-5-[4-[(1-метилциклогексил]метокси] бензил] тиазолидин-2,4-дион] смотри Fujita et al. Diabetes, 32, 804 (1983), вводили через желудочный зонд при дозе 100 мг/кг/день. Испытываемые соединения вводили через желудочный зонд при дозе 100 мг/кг/день, если не оговорено особо в таблице.
На утро дня 4 мышей взвешивали и подвергали голоданию, но вода была доступна по желанию (ad libitum). Спустя три часа, отбирали пробу крови и затем мышей подвергали четвертому введению лекарственного средства или наполнителя. У неанестизированных мышей снова отбирали пробы крови через 2 или 4 часа после введения лекарственного средства. Отделяли плазму и определяли уровни глюкозы в плазме при помощи Abbott VP Анализатора.
Для каждой мыши процентное изменение в уровне глюкозы в плазме на день 4 (среднее из проб на 2- и 4-часа) от его соответствующего уровня перед введением лекарственного средства (базовая проба на день 1) определяли следующим образом: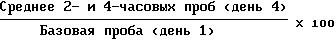
Анализ дисперсии, следуя многократному сравнению (одностороннему) Дуннете (Dunnett's multiple comparison (one-side)), используют для установления степени статического значения различия между группой наполнитель-контроль и группами, подвергнутыми лечению индивидуальным лекарственным средством. Лекарственное средство считают активным, при введенной конкретной дозе, если различие в уровне глюкозы в плазме составляет p<0,05.
Представленные в табл. 2 результаты демонстрируют, что 5-[3-арилпроп-2-инил] -5-(арилсульфонил)тиазолидин-2,4-дионы и что 5-[3-арилпроп-2-инил]-5-(арилсульфанил)тиазолидин-2,4-дионы данного изобретения проявляют свойство, заключающееся в том, что они понижают уровни глюкозы в крови, возникающие после приема пищи, у постпрандиальных (postprandial) диабетических db/db мышей. Фактическое различие между средним процентным изменением группы - наполнитель и группой, подвергнутой лечению лекарственным средством, представлено в табл. 2.
Анализ результатов, представленных в табл. 2, показывает, что соединения данного изобретения пригодны в качестве противогипергликемических средств, поскольку они понижают уровни глюкозы в крови у диабетических мышей. Например, соединения примеров 42, 43 и 81 при дозе только 20 мг/кг дают результаты, сравнимые или превосходящие циглитазон при 100 мг/кг.
Активность соединений данного изобретения в понижении глюкозы в крови демонстрируется также в испытаниях на диабетических (ob/ob) мышах.
Инсулин-независимый диабетический (NIDDM) синдром обычно может быть характеризован ожирением, гипергликемией, аномальной секрецией инсулина, гиперинсулинемией и инсулинорезистентностью. У генетически тучной-гипергликемической ob/ob мыши могут проявляться многие из этих метаболитических аномалий и, как полагают, такая мышь является полезной моделью для исследования гипогликемических средств, которыми лечат NIDDM. [Coleman, D.: Diabetologia 14: 141-148, 1978]. Ниже следуют эксперименты, являющиеся иллюстрацией вышесказанного, после приведения следующей общей методики, имеющей отношение к этим экспериментам.
В каждом исследовании мышей [самцов или самок ob/ob (C57BI/6J) мышей и их lean litermates (ob/+ или +/+, Jackson Laboratories), возраста от 2 до 5 месяцев (от 10 до 65 г)] аналогичного возраста статистически распределяют по весу тела на 4 группы по 10 мышей. Мышей помещают в клетку по 5 штук и выдерживают при нормальном рационе для грызунов с водой по желанию (ad libitum). Мыши получают ежедневно через желудочный зонд соединение (суспендированное в 0,5 мл 0,5% метилцеллюлозы); растворенное в питьевой воде; или примешанное к пище. Доза даваемых соединений колебалась от 2,5 до 200 мг/кг веса тела/день. Дозу рассчитывают с учетом откормленного еженедельно веса тела и выражают как активную часть. Положительный контроль, циглитазон (5-(4-(1-метилциклогексил-метокси)бензил-2,4-дион, смотри Chang, A. , Wyse, В. , Gilchrist, В. , Peyerson, Т., and Diani, A. Diabetes 32: 830-838, 1983) давали при дозе 100 мг/кг/день, что приводит к существенному понижению глюкозы в плазме. Контрольные мыши получают только наполнитель.
На утро дня 4, 7 или 14 отбирают две капли крови (приблизительно 50 мкл (ul) в содержащие фторид натрия пробирки либо из хвостовой вены, либо после декапитации. В этих исследованиях, в которых соединение вводят ежедневно при помощи желудочного зонда, пробы крови отбирают спустя два часа после введения соединения.
Плазму отделяют центрифугированием и концентрацию глюкозы определяют ферментативно на Abbott VP Анализаторе.
Для каждой мыши, процентное изменение глюкозы в плазме на дни 4, 7 или 14 рассчитывали относительно среднего значения глюкозы в плазме мышей, подвергнутых обработке наполнителем. Анализ дисперсии, следуя тесту сравнения (одно-хвостовому) Дуннета (Dunett's Comparison Test (one-tailed), использовали для установления значимого (существенного) различия между значениями плазменной глюкозы для контрольной группы и групп, подвергнутых лечению индивидуальным соединением (CMS SAS Realease 5.18). Соединение следует рассматривать активным, если разница составляет p<0,05.
Анализ результатов, представленных в табл. 3, указывает на то, что соединения данного изобретения являются пригодными в качестве противогипергликемических средств, так как они понижают уровни глюкозы в крови у диабетических мышей. Например, соединения примеров 49, 51 и 81 при дозе только 50 мг/кг дают результаты, сравнимые или превосходящие циглитазон при 100 мг/кг.
Соединения по изобретению можно успешно вводить животным в виде простой композиции на основе 2% Твин 80 (полисорбат 80) в физиологическом растворе.
Соединения по изобретению могут вводиться в виде обычных таблеток, капсул, сиропа и т.п.
Стандартные таблетки 300 мг могут быть получены следующим образом.
Ингредиенты - на таблетку
Активное соединение - 300 мг
Поливинилпирролидон - 22,5 мг
Лактоза - 61,75 мг
Спирт 3D3A - 200 градусов - 4,5 мл
Стеариновая кислота - 9 мг
Тальк - 13,5 мг
Кукурузный крахмал - 43,25 мг
Данные таблетки получают смешиванием активного соединения, поливинилпирролидона и лактозы и растиранием через сито в 40 меш. Затем добавляют спирт и смесь месят до тех пор, пока влажная масса не будет проходить через сито в 4 меш. Влажную массу высушивают и высушенные гранулы растирают через сито в 20 меш. Стеариновую кислоту, тальк и кукурузный крахмал растирают через сито в 60 меш и тщательно смешивают с гранулятом. Конечную смесь прессуют в таблетки, применяя стандартный вогнутый пуансон с давлением 7/16 фунтов.
Аналогично можно использовать для введения и обычные сиропы для перорального применения на основе соединений по настоящему изобретению. Например, сироп какао может быть получен с использованием следующих ингредиентов.
Ингредиенты - на 1000 мл
Какао - 180 г
Сахароза - 600 г
Жидкая глюкоза - 180 г
Глицерин - 50 мл
Хлорид натрия - 2 г
Ванилин - 0,2 г
Бензоат натрия - 1 г
Очищенная вода - до 1000 мл
Данный сироп получают смешиванием сахарозы и какао и постепенным прибавлением к смеси раствора жидкой глюкозы, глицерина, хлорида натрия, ванилина и бензоата натрия в 325 мл горячей очищенной воды. Всю смесь кипятят 3 минуты, дают остыть до комнатной температуры и перемешивают с водой, взятой в количестве, необходимом для достижения объема сиропа в 1000 мл. В этот базовый сироп может быть внесено активное соединение в желаемой концентрации.
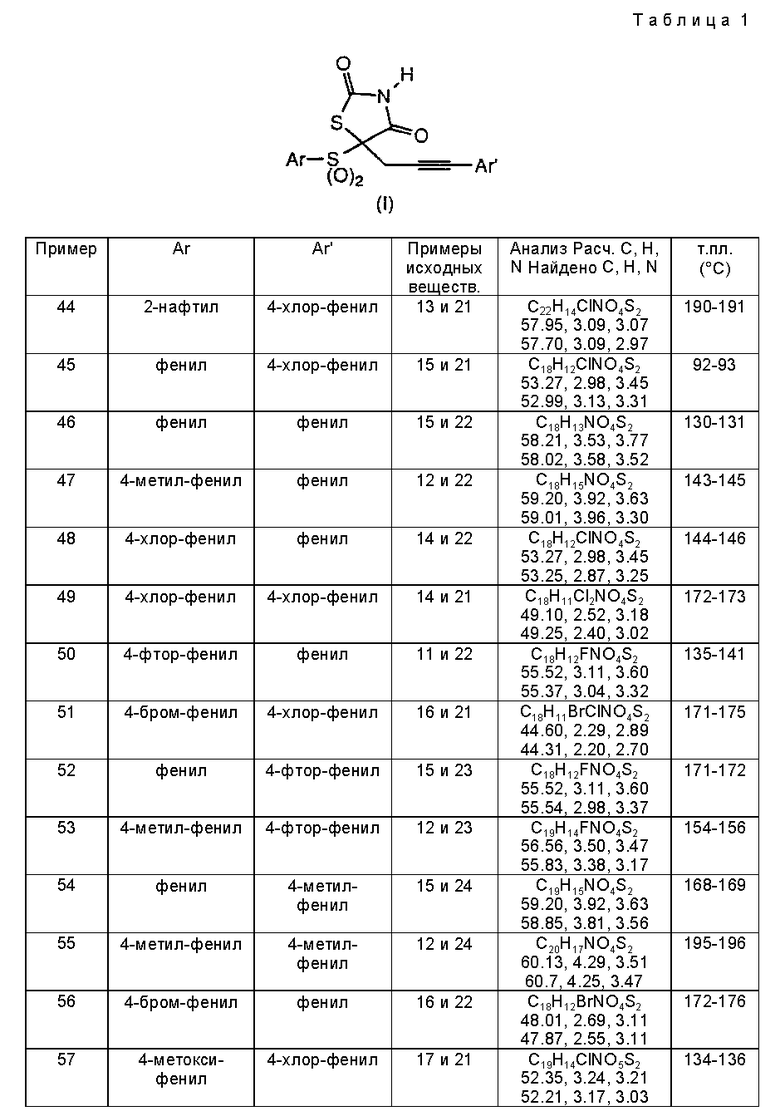



Производные тиазолидиндиона общей формулы I, где Аr - фенил, 2-нафтил, алкилзамещенный фенил, алкоксизамещенный фенил, галозамещенный фенил, 2-пиридинил, метилзамещенный 2-пиридинил, 2-хинолинил, 2-пиридинил, 2-бензоксазолил, галогензамещенный 2-бензатиазолил; n = 0 или 2; Аr' - фенил, алкилзамещенный фенил, перфторалкилзамещенный фенил, галогензамещенный фенил, алкоксизамещеный фенил, перфторалкоксизамещенный фенил или алкилтиозамещенный фенил; или их фармацевтически приемлемые соли обладают противогипергликемической активностью. Соединения по данному изобретению могут использоваться в качестве средств для лечения гиперлипидемии и осложнений диабета. 3 с. и 20 з.п. ф-лы, 3 табл. 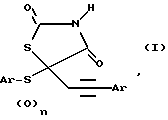
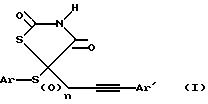
где Ar - фенил, 2-нафтил, алкилзамещенный фенил, алкоксизамещенный фенил, галогензамещенный фенил, 2-пиридинил, метилзамещенный 2-пиридинил, 2-хинолинил, 2-пиримидинил, 2-бензоксазоил, галогензамещенный 2-бензатиазолил, 2-бензтиазолил;
n = 0 или 2;
Ar' - фенил, алкилзамещенный фенил, перфторалкилзамещенный фенил, галогензамещенный фенил, алкоксизамещенный фенил, перфторалкоксизамещенный фенил или алкилтиозамещенный фенил;
или их фармацевтически приемлемые соли.
где Ar представляет фенил, алкилзамещенный фенил, галогензамещенный фенил или 2-пиридинил;
n = 2;
Ar' представляет фенил, галогензамещенный фенил или перфторалкоксизамещенный фенил;
или его фармацевтически приемлемая соль.
где Ar - фенил, 2-нафтил, алкилзамещенный фенил, алкоксизамещенный фенил, галогензамещенный фенил, 2-пиридинил, метилзамещенный 2-пиридинил, 2-хинолинил, 2-пиримидинил, 2-бензоксазолил, 2-бензтиазолил;
n = 0 или 2;
Ar' - фенил, алкилзамещенный фенил, перфторалкилзамещенный фенил, галогензамещенный фенил, алкоксизамещенный фенил, перфторалкоксизамещенный фенил или алкилтиозамещенный фенил;
или его фармацевтически приемлемой соли.
где Ar представляет фенил, алкилзамещенный фенил, галогензамещенный фенил или 2-пиридинил;
n = 2;
Ar' представляет фенил, галогензамещенный фенил или перфторалкоксизамещенный фенил;
или его фармацевтически приемлемой соли.
Авторы
Даты
1999-02-20—Публикация
1995-02-08—Подача