Изобретение относится к способу лечения in vivo неопластических заболеваний, включая лейкемию и твердые опухоли путем последовательного введения 2- β -D-рибофуранозилтиазол-4-карбоксамида и 1- β -D-рибофуранозил-1,2,4-триазол-3-карбоксамида или их фармацевтически приемлемых солей.
Хотя арсенал химиотерапевтических агентов для лечения неопластических заболеваний включает целый ряд клинически полезных соединений, борьба с раковыми опухолями у теплокровных все еще оставляет много пространства для поиска.
Раковые клетки характеризуются высоким уровнем активности инозинмонофосфатдегидрогеназы (ИМФДГ). ИМФДГ представляет собой скоростьопределяющий фермент биосинтеза гуанозинтрифосфата (ГТФ) и поэтому является чувствительной мишенью при химиотерапии: Weber G., Dehydrogenase and GTR as Targets in Human Leukemia Treatment, Adv. Exp. Med. Biol., 3098:287-292, (1991). Было показано, что 2-β-D-рибофуранозилтиазол-4-карбоксамид (тиазофурин), синтетический аналог C-нуклеозида селективно блокирует ИМФДГ и истощает гуаниннуклеотидный пул, форсируя тем самым переход ракового заболевания в состояние ремиссии: Weber G., Critical Issues in Chemotherapy with Tiazofurin, Adv. Enzym. Regul., 29:75-95 (1989).
Механизм послетиазофуринового ингибирования ИМФДГ хорошо известен. Тиазофурин превращается в свой активный метаболит, тиазол-4-карбоксамид-аденин-динуклеотид (ТАД), который, в свою очередь, ингибирует фермент на сайте НАД-НАДН (NAD-NADH) инозинмонофосфатдегидрогеназы (ИМФДГ): Yamada Y. et al., IMP De-hydrogenase. Inhibition by the Antileukemic Drug, Tiazofurin, Leuk. Res. 13(2):179-184 (1989). Сродство ТАД к ферменту выше, чем природного метаболита.
Для рибавирина, применяемого главным образом в качестве сильного антивирусного препарата широкого спектра действия, показано, что он также способен ингибировать ИМФДГ: Yamada Y. et al. Action of Active Metabolites of Tiazofurin and Ribavarin on Purified IMP Dehydrogenase, Biochem. 27:2193-2196 (1988). Ингибирование протекает по иному механизму, чем для тиазофурина, действуя на другом сайте на молекуле фермента. Он также превращается в свой активный метаболит, рибавирин-монофосфат (РМФ), который ингибирует фермент на сайте ИМФ-КМФ (IMP-ХМР) инозинмонофосфатдегидрогеназы (ИМФДГ). Как и в случае тиазофурина, сродство активной формы к ферменту выше, чем природного метаболита.
В тех случаях, когда назначают только рибавирин, то при низких дозах он менее эффективен, чем тиазофурин (см. фиг. 1 и 2). В некоторых случаях рибавирин проявляет незначительный или вовсе не проявляет противоопухолевого эффекта: BeKesi J.G. et al. Treatment of Spontaneous Leukemia in AKR Mice with Chemotherapy, Immunotherapy, or interferon, Cancer Research 36:631-639 (1976).
Национальный Институт Онкологии определяет ремиссию при наличии пациента с гематологией, соответствующей менее 5% бластных клеток в костном мозге. Это грубо соответствует величине активности ИМФДГ менее 10% и содержания ГТФ менее 20%. Хотя были получены положительные результаты при испытании тиазофурина для лечения онкологических больных, исследователи все еще не достигли продолжительной ремиссии у пациентов или конечной дифференциации раковых клеток при использовании этого соединения: Tricot et al., Tiazofurin. Biological Effects and Clinical Uses, Int'l J.Cell Clon. 8:161-170 (1990). В пределах 1-3 недель после вливания тиазофурина параметры ремиссии возвращались к своим первоначальным значениям, отмечаемым до лечения. Следовательно, ежедневные вливания соединения являются обязательными.
В то же время ежедневные вливания тиазофурина могут привести к проблемам, связанным с токсическим действием или развитием устойчивости к лекарственному средству.
Таким образом, чтобы увеличить продолжительность ремиссии и поддержать пациента в состоянии хронической фазы болезни, было установлено, что тиазофурин, возможно, следует назначать в комбинации со вторым соединением: Weber G. , Critical Issues ion Chemotherapy with Tiazofurin Adv. Enzyme Reg., 29: 75-95 (1989). Исследователи потратили огромные усилия, чтобы найти соединение, которое бы обладало необходимыми фармакологическими свойствами для "капитализации" улучшения состояния пациента, достигнутого в результате применения тиазофурина, и поддержать его в состоянии хроники или ремиссии. Этот процесс включает проведение обширного исследования и испытаний, чтобы осветить такие показатели, как эффективность, токсичность и дать правильный протокол обследования.
Заявленное изобретение обеспечивает метод достижения тех преимуществ, которые до сих пор ускользали от исследователей. Оно раскрывает метод сохранения консолидированного результата при достижении ремиссии, вызванной применением тиазофурина, но без необходимости непрерывного вливания последнего. В результате пациенты освобождаются от стресса и затрат на длительную госпитализацию, а также риска, связанного с повторными вливаниями тиазофурина. Вместо этого они возвращаются домой и наслаждаются жизнью.
Изобретение обеспечивает уникальный индивидуальный план лечения, который сводит до минимума побочные эффекты путем подбора и корректировки дозировок для биохимических потребностей пациента. Биохимические показатели подвергают тщательному мониторингу в отношении величины концентрации ГТФ, уровня активности ИМФДГ и изменения количества бластных клеток. Это позволяет осуществить точную и тонкую регулировку величины дозы для пациента с целью поддержания его в хронической фазе при хорошей жизнедеятельности.
Ввиду неспособности современной противораковой химиотерапии успешно бороться со всеми неопластическими заболеваниями, очевидно, что существует потребность в новых и дополнительных химиотерапевтических агентах и методах их применения.
Настоящее изобретение относится к способу лечения неопластических заболеваний, включая лейкемию и твердые опухоли, у теплокровных животных с применением последовательного введения тиазофурина и рибавирина. Тиазофурин может быть назначен сначала в высокой дозе с тем, чтобы индуцировать резкое снижение уровня активности ИМФДГ и содержания ГТФ. Полученные результаты затем консолидируют путем ежедневной инфузии тиазофурина до достижения состояния стабильной ремиссии. Как только пациент приходит в состояние ремиссии, начинают вводить рибавирин в постоянно снижающихся дозировках до тех пор, пока не будет достигнута минимальная доза рибавирина, сохраняющая благотворный эффект от введения тиазофурина. Минимальная возможная доза определяется непрерывным мониторингом активности ИМФДГ, концентрации ГТФ или гематологическими данными, получаемыми в процессе лечения.
Для иллюстрации настоящего изобретения 2- β -D-рибофуранозил- тиазол-4-карбоксамид и его фармацевтически приемлемые соли будут далее называться на равных, либо как а) тиазофурин (незапатентованное название, принятое специальным Государственным Советом США), либо б) под указанным выше его химическим названием. Аналогично, 1- β -D-рибофуранозил-1,2,4-триазол-3-карбоксамид или его фармацевтически приемлемые соли будут далее называться на равных, либо как а) рибавирин (незапатентованное название, принятое специальным Государственным Советом США), либо б) под указанным выше его химическим названием.
А. Получение тиазофурина и рибавирина
Тиазофурин получают по методике, описанной в патентах США 4 680 285 или 4 451 648, приводимые здесь в качестве ссылок. Рибавирин получают по методике, описанной в патентах США 4 138 547 или 3 991 078, приводимые здесь в качестве ссылок. Рибавирин, кроме того, известен под торговым названием "Виразол" и выпускается фирмой Виратек Инк.
Б. Методы введения тиазофурина
Тиазофурин вводят путем инъекции или, что предпочтительно, путем вливания. Инъекции могут быть внутривенными, внутримышечными, интрацеребральными, подкожными или внутрибрюшинными. Вливание осуществляют путем хирургической имплантации катетера пациенту. Имплантированный катетер обеспечивает постоянное введение тиазофурина. Вливание проводят предпочтительно в течение 60 мин, как это описано в статье: Jayaram Н. et al. Clinical Pharmokinetic Study of Tiazofurin Administered as One Hour Infusion, Int.J.Cancer 51 (2):182-188 (1992), которая приводится здесь в качестве ссылки.
Для инъекции или вливания применяют тиазофурин в форме раствора или суспензии. Соединение может быть растворено или суспендировано в физиологически совместимом растворе таким образом, чтобы оно присутствовало в концентрации по крайней мере 0,1 вес.% от общего веса композиции. Предпочтительно его присутствие в фармацевтическом носителе в концентрации от 10 до 90 вес.% от общего веса композиции.
В. Методы введения рибавирина
Рибавирин вводят путем инъекции или, что предпочтительно, перорально. В зависимости от метода введения соединение вместе с соответствующими разбавителями и носителями может быть переведено в лекарственную форму и применяться в виде мазей, кремов, пен и растворов, содержащих от 0,01 до 15 вес.%, предпочтительно от 1 до 10 вес.% указанного соединения.
Для инъекций применяют рибавирин в форме раствора или суспензии, при этом соединение растворяют или суспендируют в физиологически совместимом растворе в количестве от 10 до 1500 мг/мл. Инъекции могут быть внутривенными, внутримышечными, интрацеребральными, подкожными или внутрибрюшинными.
Для орального введения применяют рибавирин в форме капсул, таблеток, суспензий для перорального применения или сиропа. Таблетки или капсулы обычно содержат от 100 до 500 мг рибавирина. Предпочтительно, чтобы они содержали около 300 мг рибавирина. Капсульная форма представляет собой обычные желатиновые капсулы, которые содержат помимо рибавирина, взятого в указанных выше концентрациях, небольшое количество (менее 5 вес.%) стеарата магния или другого наполнителя. Как правило, таблетки содержат вышеуказанное количество соединения и связующее в виде раствора желатина, водокрахмальной пасты, поливинилпирролидона, водного раствора поливинилового спирта и др. с обычной сахаросодержащей оболочкой.
Сироп обычно содержит от 50 до 200 мг рибавирина на 5 мл сиропа.
Г. Способ лечения
Лечение делится на три четкие фазы. "Фаза индукции" относится к периоду, в течение которого активность ИМФДГ у пациента резко снижается благодаря введению высокой дозы тиазофурина. "Фаза консолидации" относится к периоду, в течение которого результаты, полученные на фазе индукции, консолидируются и полностью достигаются все параметры ремиссии. "Фаза поддержания" относится к периоду, в течение которого пациента поддерживают в состоянии ремиссии. Собственно "ремиссия" определяется уровнем ИМФДГ (мене 10%), уровнем ГТФ (менее 20%) или гематологическими данными (менее 5% бластных клеток в костном мозге).
Фаза индукции характеризуется первоначально высокой дозой тиазофурина, установленной для того, чтобы резко снизить активность ИМФДГ. Это достигается введением более 4400 мг/м2 соединения. Предпочтительно, чтобы эта доза составляла 4400 мг/м2.
Такую высокую дозу тиазофурина вводят до тех пор, пока уровень активности ИМФДГ не снизится до интервала значений 0-10%, предпочтительно до 0-5%. Величину активности предпочтительно подвергают мониторингу по методике, предложенной в статье: Ikegami T. et al. Direct Assay Method for Inosine 5'-monophosphate Dehydrogenase Activity, Anal. Biochem., 150:155-160 (1985). Хотя доза и период времени могут меняться, указанный предпочтительный интервал активности может быть достигнут приблизительно за 2 суток при ежедневной вводимой дозе в 4400 мг/м2.
По достижении желаемого уровня активности ИМФДГ лечение переходит в фазу консолидации. Эта фаза характеризуется более низкими дозами введения тиазофурина до тех пор, пока организм пациента не стабилизируется в состоянии ремиссии. Хотя период времени может изменяться, оно может быть достигнуто в пределах 5-12 дней.
Эффективное количество тиазофурина в фазе консолидации обычно колеблется от 1100 до 3300 мг/м2; предпочтительно, чтобы эта доза составляла около 2200 мг/м2. В любом случае фактическая доза должна быть достаточной для того, чтобы обеспечить эффективное количество агента для консолидации результатов, достигнутых в фазе индукции, в том виде, как они представлены гематологическими данными или данными по активности ИМФДГ; при этом определение и оценка всех этих данных будет без труда находиться в пределах умения специалистов в этой области и при условии раскрытия их в описании.
После фазы консолидации лечение входит в свою третью и окончательную стадию, а именно в фазу поддержания. Эта фаза стратегически планируется таким образом, чтобы поддержать пациента в состоянии ремиссии с помощью рибавирина. Рибавирин первоначально назначается в высоких дозах, как правило, в интервале от 1100 до 3300 мг/м2. Предпочтительно она должна составлять около 2200 мг/м2. Эту дозу затем постепенно снижают до тех пор, пока пораженное животное не будет потреблять наименьшую возможную дозу, необходимую для поддержания ремиссии. Как правило, эту дозу точно регулируют методом 100 миллиграммовых инкрементов.
Положительный результат от предложенной дозировки может быть отслежен путем тщательного определения уровня активности ИМФДГ, концентрации ГТФ или методом подсчета бластных клеток. Хотя эта доза будет четко изменяться в зависимости от индивидуальных условий, ее наименьшая величина, необходимая для существования ремиссии, будет достигнута приблизительно при 900 мг/м2. В любом случае фактическое количество должно быть достаточным для того, чтобы поддержать уровень ИМФДГ в интервале от 1 до 20%. Предпочтительным в этом случае является интервал 1-10% или число бластных клеток, составляющее менее 5%. Все это будет без труда находиться в пределах умения специалистов оценить эти данные и при условии раскрытия их в описании.
Пример 1.
В этом примере крысам ACN/N с подкожной трансплантированной гепатомой 3924A ежедневно вводят внутрибрюшинно инъекции в количестве 150 мг/кг тиазофурина (торговое название "Тиазол" фирмы Вератек Инк.) в течение двух дней. Затем крыс делят на две группы: одна получает ежедневно внутрибрюшинно инъекции солевого раствора, другая - 100 мг/кг рибавирина (торговое название "Виразол" фирмы Виратек Инк.) в течение дополнительных двух дней. Тиазофурин снижает активность ИМФДГ до 10%, а рибавирин поддерживает ингибирование активности ИМФДГ в интервале 20-30% от контрольных величин. Активность ИМФДГ у крыс с введенным солевым раствором возвращается к своим первоначальным значениям (см. фиг. 1-5).
Пример 2.
Пациентов с гранулоцитарной лейкемией в период бластокриза лечат с помощью двух ежедневных вливаний 4400 мг/м2 тиазофурина (торговое название "Тиазол" фирмы Вератек Инк.) в течение двух дней с последующей ежедневной дозой в 2200 мг/м2 тиазофурина в течение 12-13 дней. После такого лечения следует назначение ежедневной снижающейся дозы рибавирина (торговое название "Виразол" фирмы Виратек Инк.), начиная с 2200 мг/м2 и заканчивая дозой 900 мг/м2. Для контроля содержания мочевой кислоты пациенту вводят аллопуринол в 6-8 доз, общим количеством 800 мг, в течение 24 ч. Эта процедура должна также служить для увеличения гипоксантина в плазме. Постоянный мониторинг ИМФДГ в бластных клетках позволяет лечащему врачу снижать дозу рибавирина и поддерживать пациента в состоянии ремиссии.
Пример 3.
Пациентов с яичниковой карциномой лечат с помощью двух ежедневных вливаний 4400 мг/м2 тиазофурина (торговое название "Тиазол" фирмы Вератек Инк.) в течение двух дней с последующей ежедневной дозой в 2200 мг/м2 тиазофурина в течение 12-13 дней. После такого лечения следует назначение ежедневной снижающейся дозы рибавирина (торговое название "Виразол" фирмы Виратек Инк. ), начиная с 2200 мг/м2 и заканчивая дозой 900 мг/м2. Для контроля содержания мочевой кислоты пациенту вводят аллопуринол в 6-8 доз, общим количеством 800 мг, в течение 24 ч. Эта процедура должна также служить для увеличения гипоксантина в плазме. Постоянный мониторинг ИМФДГ и ГТФ позволяет лечащему врачу снижать дозу рибавирина и поддерживать пациента в состоянии ремиссии.
Следует отметить, что описанные выше примеры являются исключительно иллюстративными и какие-либо модификации со стороны специалистов в этой области вполне возможны. Соответственно, настоящее изобретение не может быть ограничено приведенными примерами, но должно находиться в объеме прилагаемой формулы.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЗДОРОВЛЕНИЯ ГЛАЗНОГО НЕРВА И СЕТЧАТКИ ГЛАЗА | 1996 |
|
RU2181045C2 |
| СОЕДИНЕНИЯ И СПОСОБЫ ЛЕЧЕНИЯ ЛЕЙКЕМИИ | 2013 |
|
RU2672553C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ПРИМЕНЕНИЯ ФОРБОЛОВЫХ ЭФИРОВ | 2008 |
|
RU2472511C2 |
| ПРИМЕНЕНИЕ ВИРУСА МИКСОМЫ ДЛЯ ТЕРАПЕВТИЧЕСКОГО ЛЕЧЕНИЯ РАКА И ХРОНИЧЕСКОЙ ВИРУСНОЙ ИНФЕКЦИИ | 2004 |
|
RU2362584C2 |
| СПОСОБ ИНДУКЦИИ КОНЕЧНОЙ ДИФФЕРЕНЦИРОВКИ | 2003 |
|
RU2320331C2 |
| КОМБИНАЦИИ, ВКЛЮЧАЮЩИЕ ПРОИЗВОДНЫЕ ЭПОТИЛОНА И АЛКИЛИРУЮЩИЕ АГЕНТЫ | 2003 |
|
RU2341260C2 |
| КОМПОЗИЦИИ ФОРБОЛОВЫХ ЭФИРОВ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ИЛИ УМЕНЬШЕНИЯ ПРОДОЛЖИТЕЛЬНОСТИ ЦИТОПЕНИИ | 2015 |
|
RU2730998C2 |
| ФЛАВОНОИДНОЕ СОЕДИНЕНИЕ, ОБЛАДАЮЩЕЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ | 2006 |
|
RU2398595C2 |
| ПРИМЕНЕНИЕ КОМБИНАЦИИ ВИРУСА МИКСОМЫ И РАПАМИЦИНА ДЛЯ ТЕРАПЕВТИЧЕСКОГО ЛЕЧЕНИЯ | 2006 |
|
RU2461630C2 |
| СПОСОБЫ ИНДУКЦИИ КОНЕЧНОЙ ДИФФЕРЕНЦИРОВКИ | 2010 |
|
RU2530648C2 |
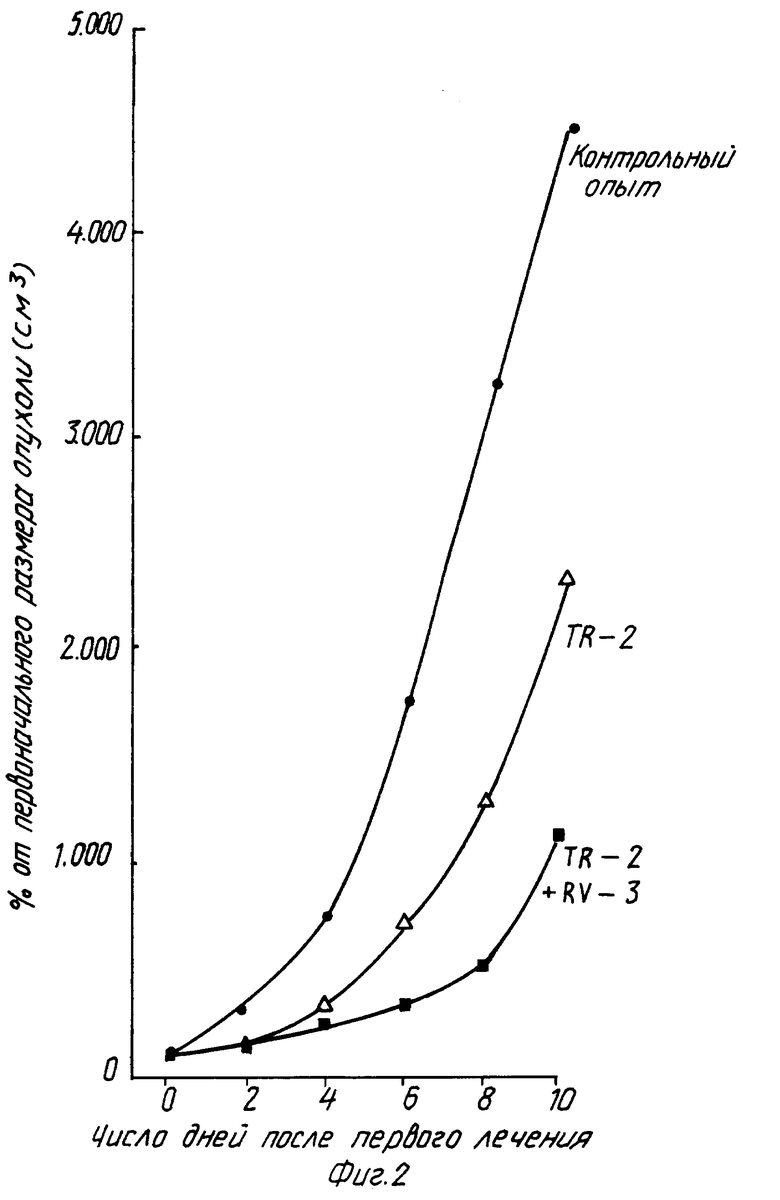
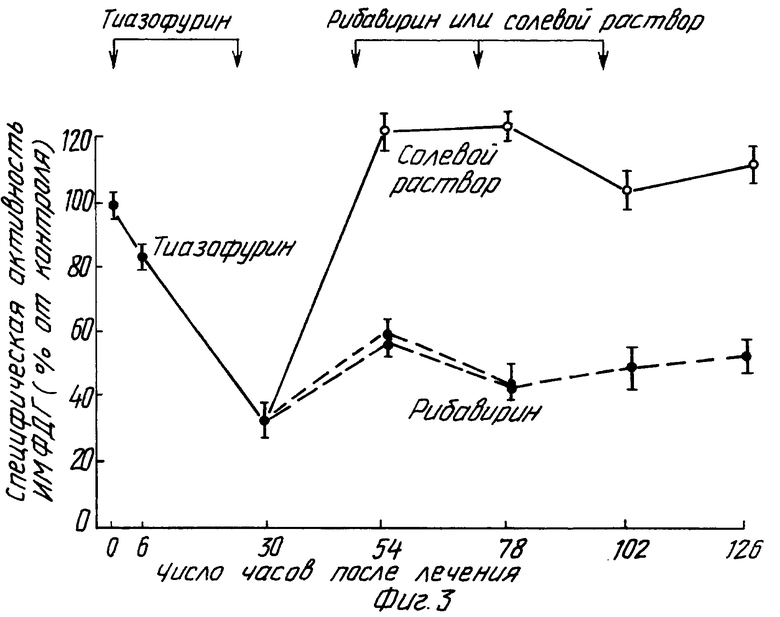
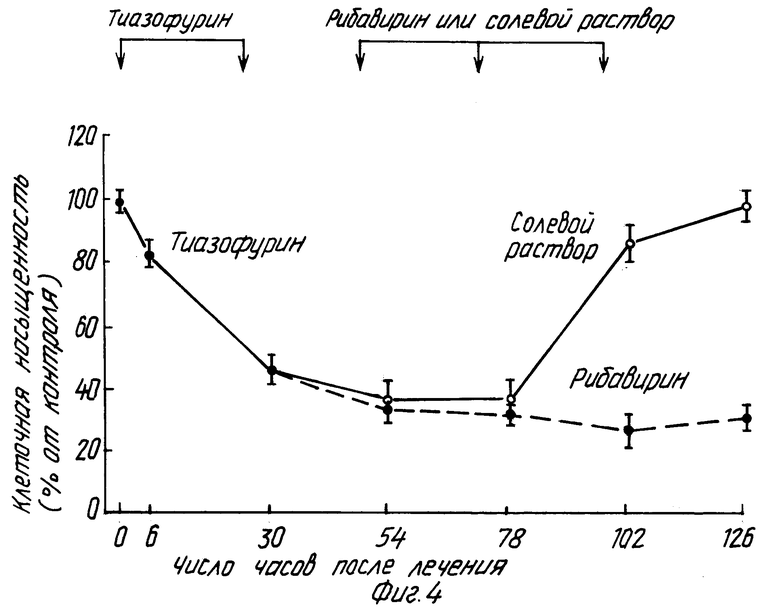
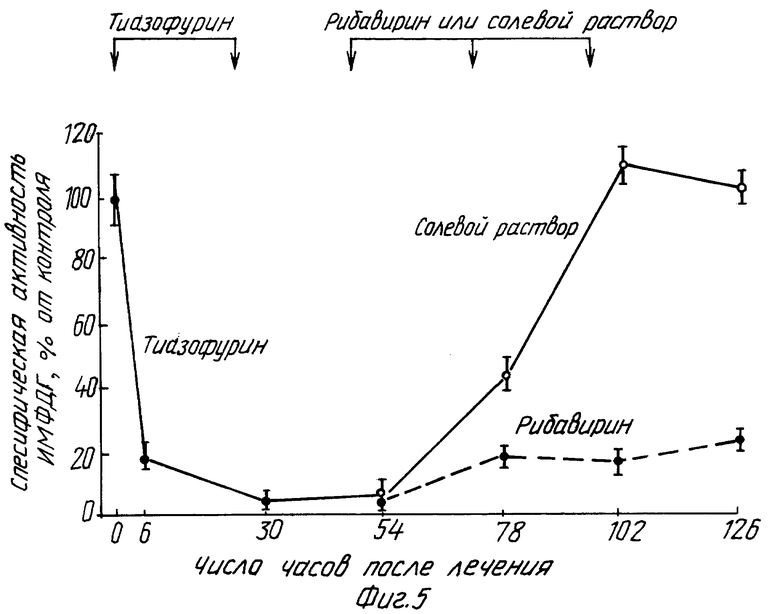
Изобретение относится к медицине и касается лечения неопластических заболеваний у теплокровных. Предлагается вводить тиазофурин сначала в высокой дозе с тем, чтобы стимулировать резкое снижение активности ИМФДГ. Полученные результаты поддерживают путем беспрерывного введения тиазофурина в более низкой дозе до достижения стабилизации гематологических данных и состояния стабильной ремиссии. После этого начинают вводить рибавирин в постоянно снижающихся дозировках до тех пор, пока не будет достигнута минимальная доза последнего, сохраняющая по крайней мере один из показателей: уровень активности ИМФДГ менее 10%, концентрацию ГТФ менее 20%, бластные клетки в костном мозге менее 5%. Способ приводит к увеличению продолжительности ремиссии заболевания. 3 с. и 21 з.п. ф-лы, 5 ил.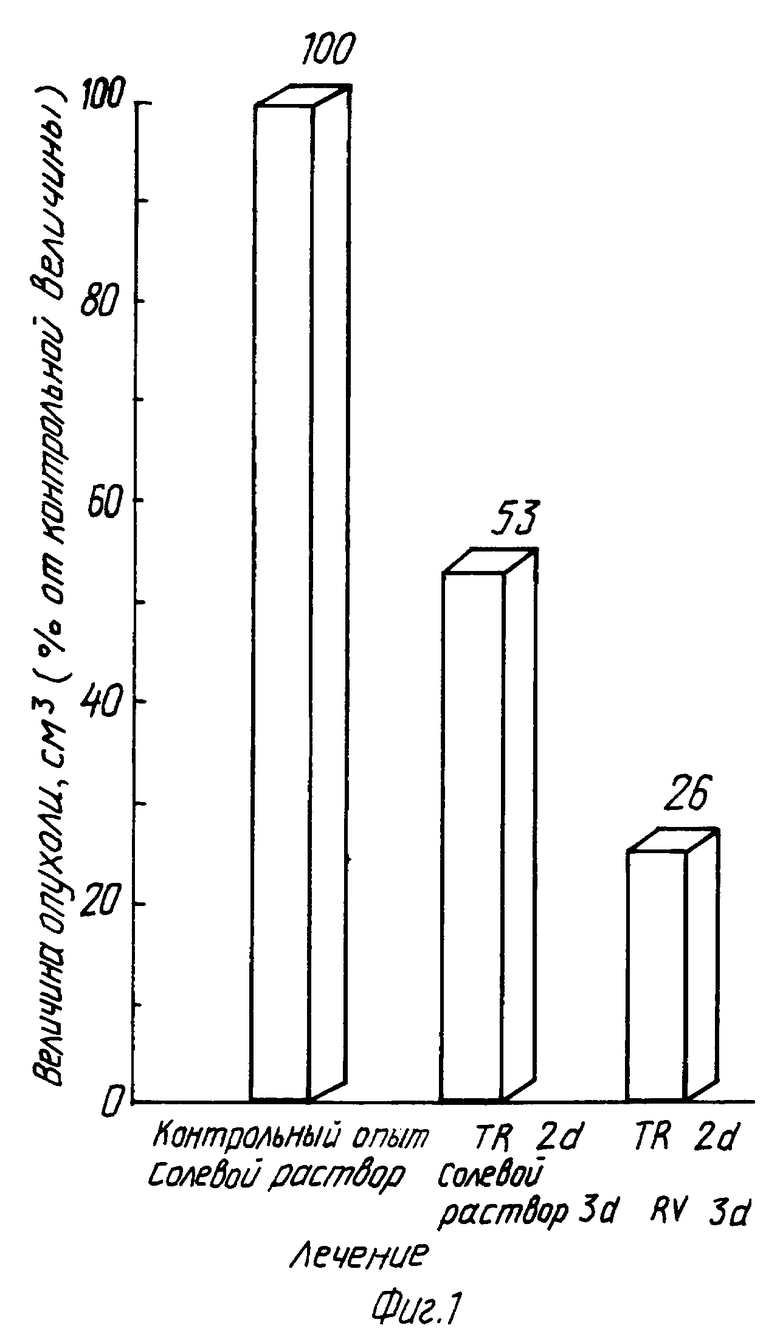
| Natsumeda et al-in Biochem and Biophys | |||
| Research., 1988, v.153, N 1, p.321-327. |
Авторы
Даты
2000-05-20—Публикация
1994-05-05—Подача